JP2005529603A - 糖尿病を予防、治療、および診断するための組成物および方法 - Google Patents
糖尿病を予防、治療、および診断するための組成物および方法 Download PDFInfo
- Publication number
- JP2005529603A JP2005529603A JP2004512780A JP2004512780A JP2005529603A JP 2005529603 A JP2005529603 A JP 2005529603A JP 2004512780 A JP2004512780 A JP 2004512780A JP 2004512780 A JP2004512780 A JP 2004512780A JP 2005529603 A JP2005529603 A JP 2005529603A
- Authority
- JP
- Japan
- Prior art keywords
- seq
- smap
- polypeptide
- agent
- nucleic acid
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 238000000034 method Methods 0.000 title claims abstract description 141
- 206010012601 diabetes mellitus Diseases 0.000 title claims abstract description 76
- 239000000203 mixture Substances 0.000 title abstract description 36
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 139
- 210000004027 cell Anatomy 0.000 claims description 128
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 122
- 229920001184 polypeptide Polymers 0.000 claims description 114
- 150000007523 nucleic acids Chemical class 0.000 claims description 112
- 102000039446 nucleic acids Human genes 0.000 claims description 99
- 108020004707 nucleic acids Proteins 0.000 claims description 99
- 230000014509 gene expression Effects 0.000 claims description 90
- 239000003795 chemical substances by application Substances 0.000 claims description 81
- 230000000694 effects Effects 0.000 claims description 79
- 239000002157 polynucleotide Substances 0.000 claims description 71
- 108091033319 polynucleotide Proteins 0.000 claims description 71
- 102000040430 polynucleotide Human genes 0.000 claims description 71
- 150000001413 amino acids Chemical group 0.000 claims description 59
- 238000012360 testing method Methods 0.000 claims description 49
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 38
- 210000001519 tissue Anatomy 0.000 claims description 34
- 241001465754 Metazoa Species 0.000 claims description 32
- 241000282414 Homo sapiens Species 0.000 claims description 25
- -1 SEQ ID NO: 2 amino acids Chemical class 0.000 claims description 25
- 239000003814 drug Substances 0.000 claims description 24
- 108020004999 messenger RNA Proteins 0.000 claims description 24
- 102000058061 Glucose Transporter Type 4 Human genes 0.000 claims description 22
- 108091006300 SLC2A4 Proteins 0.000 claims description 22
- 206010022489 Insulin Resistance Diseases 0.000 claims description 21
- 206010018429 Glucose tolerance impaired Diseases 0.000 claims description 20
- 210000001789 adipocyte Anatomy 0.000 claims description 20
- 230000000692 anti-sense effect Effects 0.000 claims description 19
- 229940079593 drug Drugs 0.000 claims description 18
- 210000004369 blood Anatomy 0.000 claims description 17
- 239000008280 blood Substances 0.000 claims description 17
- 238000003752 polymerase chain reaction Methods 0.000 claims description 17
- 208000001072 type 2 diabetes mellitus Diseases 0.000 claims description 17
- 230000005945 translocation Effects 0.000 claims description 15
- 230000004190 glucose uptake Effects 0.000 claims description 13
- 230000007423 decrease Effects 0.000 claims description 12
- 210000002700 urine Anatomy 0.000 claims description 9
- 241000894006 Bacteria Species 0.000 claims description 7
- 210000005260 human cell Anatomy 0.000 claims description 6
- 238000000338 in vitro Methods 0.000 claims description 5
- 201000009104 prediabetes syndrome Diseases 0.000 claims description 5
- 208000001280 Prediabetic State Diseases 0.000 claims description 4
- 108700008625 Reporter Genes Proteins 0.000 claims description 4
- 210000002064 heart cell Anatomy 0.000 claims description 4
- 210000000663 muscle cell Anatomy 0.000 claims description 3
- 230000008727 cellular glucose uptake Effects 0.000 claims description 2
- 230000002441 reversible effect Effects 0.000 claims description 2
- 210000002363 skeletal muscle cell Anatomy 0.000 claims description 2
- 108090000623 proteins and genes Proteins 0.000 description 177
- 102000004169 proteins and genes Human genes 0.000 description 151
- 235000018102 proteins Nutrition 0.000 description 142
- 239000000523 sample Substances 0.000 description 87
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 64
- 238000003556 assay Methods 0.000 description 60
- 235000001014 amino acid Nutrition 0.000 description 57
- 229940024606 amino acid Drugs 0.000 description 56
- 150000001875 compounds Chemical class 0.000 description 41
- 239000003607 modifier Substances 0.000 description 41
- 239000002773 nucleotide Substances 0.000 description 40
- 125000003729 nucleotide group Chemical group 0.000 description 40
- 238000009396 hybridization Methods 0.000 description 39
- 102000035195 Peptidases Human genes 0.000 description 34
- 108091005804 Peptidases Proteins 0.000 description 34
- 239000004365 Protease Substances 0.000 description 34
- 102000004877 Insulin Human genes 0.000 description 32
- 108090001061 Insulin Proteins 0.000 description 32
- 229940125396 insulin Drugs 0.000 description 32
- 230000027455 binding Effects 0.000 description 31
- 238000009739 binding Methods 0.000 description 31
- 239000000126 substance Substances 0.000 description 30
- 238000003018 immunoassay Methods 0.000 description 26
- 238000001514 detection method Methods 0.000 description 25
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 23
- 239000008103 glucose Substances 0.000 description 23
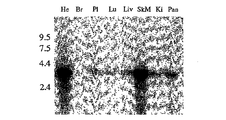
- 210000002027 skeletal muscle Anatomy 0.000 description 23
- 239000003112 inhibitor Substances 0.000 description 22
- 102000004190 Enzymes Human genes 0.000 description 20
- 108090000790 Enzymes Proteins 0.000 description 20
- 229940088598 enzyme Drugs 0.000 description 20
- 239000007787 solid Substances 0.000 description 19
- 101000708790 Homo sapiens SPARC-related modular calcium-binding protein 2 Proteins 0.000 description 18
- 235000019419 proteases Nutrition 0.000 description 18
- 239000000758 substrate Substances 0.000 description 18
- 239000013598 vector Substances 0.000 description 18
- 108020004414 DNA Proteins 0.000 description 17
- 102100032724 SPARC-related modular calcium-binding protein 2 Human genes 0.000 description 17
- 239000005557 antagonist Substances 0.000 description 17
- 239000003446 ligand Substances 0.000 description 17
- 239000013615 primer Substances 0.000 description 16
- 125000003275 alpha amino acid group Chemical group 0.000 description 15
- 239000011230 binding agent Substances 0.000 description 15
- 230000002163 immunogen Effects 0.000 description 15
- 238000012216 screening Methods 0.000 description 15
- 108020004705 Codon Proteins 0.000 description 14
- 239000000556 agonist Substances 0.000 description 14
- 238000004422 calculation algorithm Methods 0.000 description 14
- 238000002372 labelling Methods 0.000 description 14
- 230000000295 complement effect Effects 0.000 description 13
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 13
- 101000615384 Homo sapiens Stromal membrane-associated protein 2 Proteins 0.000 description 12
- 241000699666 Mus <mouse, genus> Species 0.000 description 12
- 239000012190 activator Substances 0.000 description 12
- 239000012491 analyte Substances 0.000 description 12
- 201000010099 disease Diseases 0.000 description 12
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 11
- 241000699670 Mus sp. Species 0.000 description 11
- 108091028043 Nucleic acid sequence Proteins 0.000 description 11
- 239000002585 base Substances 0.000 description 11
- 239000012634 fragment Substances 0.000 description 11
- 230000005764 inhibitory process Effects 0.000 description 11
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 10
- 239000000427 antigen Substances 0.000 description 10
- 108091007433 antigens Proteins 0.000 description 10
- 102000036639 antigens Human genes 0.000 description 10
- 239000003153 chemical reaction reagent Substances 0.000 description 10
- 239000002299 complementary DNA Substances 0.000 description 10
- 238000000159 protein binding assay Methods 0.000 description 10
- 238000006467 substitution reaction Methods 0.000 description 10
- 108091034117 Oligonucleotide Proteins 0.000 description 9
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 9
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 9
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 9
- 238000006243 chemical reaction Methods 0.000 description 9
- 230000002401 inhibitory effect Effects 0.000 description 9
- 238000002493 microarray Methods 0.000 description 9
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 9
- 230000004044 response Effects 0.000 description 9
- ZHNUHDYFZUAESO-UHFFFAOYSA-N Formamide Chemical compound NC=O ZHNUHDYFZUAESO-UHFFFAOYSA-N 0.000 description 8
- 108060001084 Luciferase Proteins 0.000 description 8
- 239000005089 Luciferase Substances 0.000 description 8
- 108091005461 Nucleic proteins Proteins 0.000 description 8
- 239000000872 buffer Substances 0.000 description 8
- 238000009472 formulation Methods 0.000 description 8
- 230000006870 function Effects 0.000 description 8
- 102000055258 human SMOC2 Human genes 0.000 description 8
- 230000001900 immune effect Effects 0.000 description 8
- 210000003000 inclusion body Anatomy 0.000 description 8
- 238000011534 incubation Methods 0.000 description 8
- 238000004519 manufacturing process Methods 0.000 description 8
- 230000035945 sensitivity Effects 0.000 description 8
- 101710202247 SPARC-related modular calcium-binding protein 2 Proteins 0.000 description 7
- BFNBIHQBYMNNAN-UHFFFAOYSA-N ammonium sulfate Chemical compound N.N.OS(O)(=O)=O BFNBIHQBYMNNAN-UHFFFAOYSA-N 0.000 description 7
- 238000004458 analytical method Methods 0.000 description 7
- 230000015572 biosynthetic process Effects 0.000 description 7
- 210000002216 heart Anatomy 0.000 description 7
- 230000001965 increasing effect Effects 0.000 description 7
- 230000004048 modification Effects 0.000 description 7
- 238000012986 modification Methods 0.000 description 7
- 238000000746 purification Methods 0.000 description 7
- 239000000243 solution Substances 0.000 description 7
- 241000894007 species Species 0.000 description 7
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 6
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 6
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 description 6
- 230000004913 activation Effects 0.000 description 6
- 125000000539 amino acid group Chemical group 0.000 description 6
- 229910052921 ammonium sulfate Inorganic materials 0.000 description 6
- 235000011130 ammonium sulphate Nutrition 0.000 description 6
- 238000003491 array Methods 0.000 description 6
- 230000000875 corresponding effect Effects 0.000 description 6
- 230000009260 cross reactivity Effects 0.000 description 6
- 238000003745 diagnosis Methods 0.000 description 6
- 229940042399 direct acting antivirals protease inhibitors Drugs 0.000 description 6
- 230000002068 genetic effect Effects 0.000 description 6
- 230000007246 mechanism Effects 0.000 description 6
- 239000012528 membrane Substances 0.000 description 6
- 210000004379 membrane Anatomy 0.000 description 6
- 229920000642 polymer Polymers 0.000 description 6
- 239000000047 product Substances 0.000 description 6
- 230000001105 regulatory effect Effects 0.000 description 6
- 238000000926 separation method Methods 0.000 description 6
- 230000003827 upregulation Effects 0.000 description 6
- 238000005406 washing Methods 0.000 description 6
- 108700028369 Alleles Proteins 0.000 description 5
- 102000015833 Cystatin Human genes 0.000 description 5
- 102000005927 Cysteine Proteases Human genes 0.000 description 5
- 108010005843 Cysteine Proteases Proteins 0.000 description 5
- 108060003951 Immunoglobulin Proteins 0.000 description 5
- 238000000636 Northern blotting Methods 0.000 description 5
- 238000007792 addition Methods 0.000 description 5
- 230000003321 amplification Effects 0.000 description 5
- 238000002820 assay format Methods 0.000 description 5
- 230000001580 bacterial effect Effects 0.000 description 5
- 235000020958 biotin Nutrition 0.000 description 5
- 229960002685 biotin Drugs 0.000 description 5
- 239000011616 biotin Substances 0.000 description 5
- 230000001186 cumulative effect Effects 0.000 description 5
- 108050004038 cystatin Proteins 0.000 description 5
- 238000012217 deletion Methods 0.000 description 5
- 230000037430 deletion Effects 0.000 description 5
- 210000003527 eukaryotic cell Anatomy 0.000 description 5
- 102000018358 immunoglobulin Human genes 0.000 description 5
- 238000005259 measurement Methods 0.000 description 5
- 238000003199 nucleic acid amplification method Methods 0.000 description 5
- 238000007899 nucleic acid hybridization Methods 0.000 description 5
- 230000002018 overexpression Effects 0.000 description 5
- 239000008194 pharmaceutical composition Substances 0.000 description 5
- 230000002797 proteolythic effect Effects 0.000 description 5
- 238000003753 real-time PCR Methods 0.000 description 5
- 238000012552 review Methods 0.000 description 5
- 239000002904 solvent Substances 0.000 description 5
- 239000006228 supernatant Substances 0.000 description 5
- 238000003786 synthesis reaction Methods 0.000 description 5
- 238000013518 transcription Methods 0.000 description 5
- 230000035897 transcription Effects 0.000 description 5
- 238000012546 transfer Methods 0.000 description 5
- 238000011282 treatment Methods 0.000 description 5
- 241000701161 unidentified adenovirus Species 0.000 description 5
- 102100026189 Beta-galactosidase Human genes 0.000 description 4
- 102000005701 Calcium-Binding Proteins Human genes 0.000 description 4
- 108010045403 Calcium-Binding Proteins Proteins 0.000 description 4
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 4
- 241000700159 Rattus Species 0.000 description 4
- 102000012479 Serine Proteases Human genes 0.000 description 4
- 108010022999 Serine Proteases Proteins 0.000 description 4
- 108010090804 Streptavidin Proteins 0.000 description 4
- 239000011324 bead Substances 0.000 description 4
- 229940049706 benzodiazepine Drugs 0.000 description 4
- 125000003310 benzodiazepinyl group Chemical class N1N=C(C=CC2=C1C=CC=C2)* 0.000 description 4
- 108010005774 beta-Galactosidase Proteins 0.000 description 4
- 239000012472 biological sample Substances 0.000 description 4
- 210000000170 cell membrane Anatomy 0.000 description 4
- 230000001413 cellular effect Effects 0.000 description 4
- 238000002648 combination therapy Methods 0.000 description 4
- 230000029087 digestion Effects 0.000 description 4
- 239000007850 fluorescent dye Substances 0.000 description 4
- 239000011521 glass Substances 0.000 description 4
- 238000012203 high throughput assay Methods 0.000 description 4
- 238000013537 high throughput screening Methods 0.000 description 4
- 238000000099 in vitro assay Methods 0.000 description 4
- 230000003993 interaction Effects 0.000 description 4
- 125000005647 linker group Chemical group 0.000 description 4
- 210000003712 lysosome Anatomy 0.000 description 4
- 230000001868 lysosomic effect Effects 0.000 description 4
- 239000003550 marker Substances 0.000 description 4
- 239000011159 matrix material Substances 0.000 description 4
- 229930182817 methionine Natural products 0.000 description 4
- 230000000051 modifying effect Effects 0.000 description 4
- 239000008188 pellet Substances 0.000 description 4
- 239000000816 peptidomimetic Substances 0.000 description 4
- 239000013641 positive control Substances 0.000 description 4
- 239000002244 precipitate Substances 0.000 description 4
- 238000002360 preparation method Methods 0.000 description 4
- 230000002285 radioactive effect Effects 0.000 description 4
- 150000003839 salts Chemical class 0.000 description 4
- 230000028327 secretion Effects 0.000 description 4
- 239000003001 serine protease inhibitor Substances 0.000 description 4
- 210000002966 serum Anatomy 0.000 description 4
- 239000007790 solid phase Substances 0.000 description 4
- 230000009870 specific binding Effects 0.000 description 4
- 229940124597 therapeutic agent Drugs 0.000 description 4
- 238000013519 translation Methods 0.000 description 4
- 208000035408 type 1 diabetes mellitus 1 Diseases 0.000 description 4
- 238000000108 ultra-filtration Methods 0.000 description 4
- 241000701447 unidentified baculovirus Species 0.000 description 4
- 238000011144 upstream manufacturing Methods 0.000 description 4
- 238000011179 visual inspection Methods 0.000 description 4
- 101100297347 Caenorhabditis elegans pgl-3 gene Proteins 0.000 description 3
- 108090000426 Caspase-1 Proteins 0.000 description 3
- 102000053642 Catalytic RNA Human genes 0.000 description 3
- 108090000994 Catalytic RNA Proteins 0.000 description 3
- 108091026890 Coding region Proteins 0.000 description 3
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 3
- 241000238631 Hexapoda Species 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 3
- 102000005741 Metalloproteases Human genes 0.000 description 3
- 108010006035 Metalloproteases Proteins 0.000 description 3
- 239000004677 Nylon Substances 0.000 description 3
- 208000008589 Obesity Diseases 0.000 description 3
- 108700026244 Open Reading Frames Proteins 0.000 description 3
- 108090000526 Papain Proteins 0.000 description 3
- 108091093037 Peptide nucleic acid Proteins 0.000 description 3
- 241000276498 Pollachius virens Species 0.000 description 3
- 229940124158 Protease/peptidase inhibitor Drugs 0.000 description 3
- 108010076504 Protein Sorting Signals Proteins 0.000 description 3
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 3
- 102000018968 Salivary Cystatins Human genes 0.000 description 3
- 108010026774 Salivary Cystatins Proteins 0.000 description 3
- 108090000631 Trypsin Proteins 0.000 description 3
- 102000004142 Trypsin Human genes 0.000 description 3
- 241000700605 Viruses Species 0.000 description 3
- 239000002671 adjuvant Substances 0.000 description 3
- 235000004279 alanine Nutrition 0.000 description 3
- 230000000890 antigenic effect Effects 0.000 description 3
- 238000013459 approach Methods 0.000 description 3
- 229920001222 biopolymer Polymers 0.000 description 3
- 230000003197 catalytic effect Effects 0.000 description 3
- 239000006285 cell suspension Substances 0.000 description 3
- 238000010367 cloning Methods 0.000 description 3
- 238000012875 competitive assay Methods 0.000 description 3
- 230000009137 competitive binding Effects 0.000 description 3
- 230000009918 complex formation Effects 0.000 description 3
- 235000018417 cysteine Nutrition 0.000 description 3
- 238000000502 dialysis Methods 0.000 description 3
- 239000013604 expression vector Substances 0.000 description 3
- 102000037865 fusion proteins Human genes 0.000 description 3
- 108020001507 fusion proteins Proteins 0.000 description 3
- 239000000499 gel Substances 0.000 description 3
- 238000001502 gel electrophoresis Methods 0.000 description 3
- 238000007446 glucose tolerance test Methods 0.000 description 3
- 102000056879 human SMAP2 Human genes 0.000 description 3
- 238000003119 immunoblot Methods 0.000 description 3
- 238000005462 in vivo assay Methods 0.000 description 3
- 238000007834 ligase chain reaction Methods 0.000 description 3
- 210000004072 lung Anatomy 0.000 description 3
- 238000012544 monitoring process Methods 0.000 description 3
- 230000036963 noncompetitive effect Effects 0.000 description 3
- 229920001778 nylon Polymers 0.000 description 3
- 235000020824 obesity Nutrition 0.000 description 3
- 230000003287 optical effect Effects 0.000 description 3
- 210000001322 periplasm Anatomy 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 230000000750 progressive effect Effects 0.000 description 3
- 230000017854 proteolysis Effects 0.000 description 3
- 102000005962 receptors Human genes 0.000 description 3
- 108020003175 receptors Proteins 0.000 description 3
- 108091092562 ribozyme Proteins 0.000 description 3
- 238000012163 sequencing technique Methods 0.000 description 3
- 230000019491 signal transduction Effects 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 230000003381 solubilizing effect Effects 0.000 description 3
- 238000010561 standard procedure Methods 0.000 description 3
- 230000007704 transition Effects 0.000 description 3
- 239000012588 trypsin Substances 0.000 description 3
- 238000001262 western blot Methods 0.000 description 3
- VRYALKFFQXWPIH-PBXRRBTRSA-N (3r,4s,5r)-3,4,5,6-tetrahydroxyhexanal Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)CC=O VRYALKFFQXWPIH-PBXRRBTRSA-N 0.000 description 2
- HRPVXLWXLXDGHG-UHFFFAOYSA-N Acrylamide Chemical compound NC(=O)C=C HRPVXLWXLXDGHG-UHFFFAOYSA-N 0.000 description 2
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 2
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 2
- 102100033312 Alpha-2-macroglobulin Human genes 0.000 description 2
- 108091093088 Amplicon Proteins 0.000 description 2
- 102000035101 Aspartic proteases Human genes 0.000 description 2
- 108091005502 Aspartic proteases Proteins 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 102100035904 Caspase-1 Human genes 0.000 description 2
- 102000003902 Cathepsin C Human genes 0.000 description 2
- 108090000267 Cathepsin C Proteins 0.000 description 2
- 108090000317 Chymotrypsin Proteins 0.000 description 2
- 241000557626 Corvus corax Species 0.000 description 2
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 2
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 2
- 102000005720 Glutathione transferase Human genes 0.000 description 2
- 108010070675 Glutathione transferase Proteins 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 101710154606 Hemagglutinin Proteins 0.000 description 2
- 108010058683 Immobilized Proteins Proteins 0.000 description 2
- 102000009786 Immunoglobulin Constant Regions Human genes 0.000 description 2
- 108010009817 Immunoglobulin Constant Regions Proteins 0.000 description 2
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 2
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 2
- 108700005091 Immunoglobulin Genes Proteins 0.000 description 2
- 108091092195 Intron Proteins 0.000 description 2
- 108010041872 Islet Amyloid Polypeptide Proteins 0.000 description 2
- 102000036770 Islet Amyloid Polypeptide Human genes 0.000 description 2
- 108010077861 Kininogens Proteins 0.000 description 2
- 102000010631 Kininogens Human genes 0.000 description 2
- LRQKBLKVPFOOQJ-YFKPBYRVSA-N L-norleucine Chemical compound CCCC[C@H]([NH3+])C([O-])=O LRQKBLKVPFOOQJ-YFKPBYRVSA-N 0.000 description 2
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 2
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- 101100203415 Mus musculus Smap2 gene Proteins 0.000 description 2
- 108090000590 Neurotransmitter Receptors Proteins 0.000 description 2
- 101710093908 Outer capsid protein VP4 Proteins 0.000 description 2
- 101710135467 Outer capsid protein sigma-1 Proteins 0.000 description 2
- 108010067372 Pancreatic elastase Proteins 0.000 description 2
- 102000016387 Pancreatic elastase Human genes 0.000 description 2
- 108090000284 Pepsin A Proteins 0.000 description 2
- 102000057297 Pepsin A Human genes 0.000 description 2
- 108010015078 Pregnancy-Associated alpha 2-Macroglobulins Proteins 0.000 description 2
- ATUOYWHBWRKTHZ-UHFFFAOYSA-N Propane Chemical compound CCC ATUOYWHBWRKTHZ-UHFFFAOYSA-N 0.000 description 2
- 101710176177 Protein A56 Proteins 0.000 description 2
- 108020004511 Recombinant DNA Proteins 0.000 description 2
- YASAKCUCGLMORW-UHFFFAOYSA-N Rosiglitazone Chemical compound C=1C=CC=NC=1N(C)CCOC(C=C1)=CC=C1CC1SC(=O)NC1=O YASAKCUCGLMORW-UHFFFAOYSA-N 0.000 description 2
- 108050000761 Serpin Proteins 0.000 description 2
- 102000008847 Serpin Human genes 0.000 description 2
- FKNQFGJONOIPTF-UHFFFAOYSA-N Sodium cation Chemical compound [Na+] FKNQFGJONOIPTF-UHFFFAOYSA-N 0.000 description 2
- 238000002105 Southern blotting Methods 0.000 description 2
- 108091081024 Start codon Proteins 0.000 description 2
- 238000000692 Student's t-test Methods 0.000 description 2
- 229940100389 Sulfonylurea Drugs 0.000 description 2
- 229940123464 Thiazolidinedione Drugs 0.000 description 2
- 101710120037 Toxin CcdB Proteins 0.000 description 2
- 108091023040 Transcription factor Proteins 0.000 description 2
- 102000040945 Transcription factor Human genes 0.000 description 2
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 2
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- 230000003213 activating effect Effects 0.000 description 2
- 239000000443 aerosol Substances 0.000 description 2
- 230000032683 aging Effects 0.000 description 2
- PMMURAAUARKVCB-UHFFFAOYSA-N alpha-D-ara-dHexp Natural products OCC1OC(O)CC(O)C1O PMMURAAUARKVCB-UHFFFAOYSA-N 0.000 description 2
- 125000003277 amino group Chemical group 0.000 description 2
- 238000010171 animal model Methods 0.000 description 2
- 230000003178 anti-diabetic effect Effects 0.000 description 2
- 239000003472 antidiabetic agent Substances 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 238000000376 autoradiography Methods 0.000 description 2
- 210000000227 basophil cell of anterior lobe of hypophysis Anatomy 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 2
- 230000033228 biological regulation Effects 0.000 description 2
- 230000023555 blood coagulation Effects 0.000 description 2
- 210000004556 brain Anatomy 0.000 description 2
- 150000001720 carbohydrates Chemical class 0.000 description 2
- 235000014633 carbohydrates Nutrition 0.000 description 2
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 2
- 230000015556 catabolic process Effects 0.000 description 2
- 238000000423 cell based assay Methods 0.000 description 2
- 239000013592 cell lysate Substances 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 239000007795 chemical reaction product Substances 0.000 description 2
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 2
- 238000004587 chromatography analysis Methods 0.000 description 2
- 229960002376 chymotrypsin Drugs 0.000 description 2
- 238000004440 column chromatography Methods 0.000 description 2
- 230000002860 competitive effect Effects 0.000 description 2
- 238000004590 computer program Methods 0.000 description 2
- 230000021615 conjugation Effects 0.000 description 2
- 239000000470 constituent Substances 0.000 description 2
- 238000010276 construction Methods 0.000 description 2
- 239000013068 control sample Substances 0.000 description 2
- 230000001276 controlling effect Effects 0.000 description 2
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 2
- 238000013500 data storage Methods 0.000 description 2
- 238000006731 degradation reaction Methods 0.000 description 2
- FMGSKLZLMKYGDP-USOAJAOKSA-N dehydroepiandrosterone Chemical compound C1[C@@H](O)CC[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CC=C21 FMGSKLZLMKYGDP-USOAJAOKSA-N 0.000 description 2
- 235000005911 diet Nutrition 0.000 description 2
- 239000000539 dimer Substances 0.000 description 2
- 238000006073 displacement reaction Methods 0.000 description 2
- 150000002019 disulfides Chemical class 0.000 description 2
- 239000003937 drug carrier Substances 0.000 description 2
- 238000001962 electrophoresis Methods 0.000 description 2
- 238000004520 electroporation Methods 0.000 description 2
- 201000010063 epididymitis Diseases 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 210000002744 extracellular matrix Anatomy 0.000 description 2
- 230000020764 fibrinolysis Effects 0.000 description 2
- 239000000706 filtrate Substances 0.000 description 2
- 230000004927 fusion Effects 0.000 description 2
- 230000006377 glucose transport Effects 0.000 description 2
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 2
- 239000005090 green fluorescent protein Substances 0.000 description 2
- 229960000789 guanidine hydrochloride Drugs 0.000 description 2
- PJJJBBJSCAKJQF-UHFFFAOYSA-N guanidinium chloride Chemical compound [Cl-].NC(N)=[NH2+] PJJJBBJSCAKJQF-UHFFFAOYSA-N 0.000 description 2
- 239000000185 hemagglutinin Substances 0.000 description 2
- 239000005556 hormone Substances 0.000 description 2
- 229940088597 hormone Drugs 0.000 description 2
- 239000001257 hydrogen Substances 0.000 description 2
- 229910052739 hydrogen Inorganic materials 0.000 description 2
- 230000002209 hydrophobic effect Effects 0.000 description 2
- 230000028993 immune response Effects 0.000 description 2
- 230000000984 immunochemical effect Effects 0.000 description 2
- 238000007901 in situ hybridization Methods 0.000 description 2
- 238000012296 in situ hybridization assay Methods 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- 102000028416 insulin-like growth factor binding Human genes 0.000 description 2
- 108091022911 insulin-like growth factor binding Proteins 0.000 description 2
- 210000003734 kidney Anatomy 0.000 description 2
- 150000002611 lead compounds Chemical class 0.000 description 2
- 239000002502 liposome Substances 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 210000004185 liver Anatomy 0.000 description 2
- 230000004807 localization Effects 0.000 description 2
- 210000004962 mammalian cell Anatomy 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- XZWYZXLIPXDOLR-UHFFFAOYSA-N metformin Chemical compound CN(C)C(=N)NC(N)=N XZWYZXLIPXDOLR-UHFFFAOYSA-N 0.000 description 2
- 229960003105 metformin Drugs 0.000 description 2
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 2
- YACKEPLHDIMKIO-UHFFFAOYSA-N methylphosphonic acid Chemical class CP(O)(O)=O YACKEPLHDIMKIO-UHFFFAOYSA-N 0.000 description 2
- 238000013508 migration Methods 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 239000000178 monomer Substances 0.000 description 2
- 125000004573 morpholin-4-yl group Chemical group N1(CCOCC1)* 0.000 description 2
- 230000035772 mutation Effects 0.000 description 2
- 239000002736 nonionic surfactant Substances 0.000 description 2
- 238000001216 nucleic acid method Methods 0.000 description 2
- 210000000496 pancreas Anatomy 0.000 description 2
- 235000019834 papain Nutrition 0.000 description 2
- 229940055729 papain Drugs 0.000 description 2
- 230000007170 pathology Effects 0.000 description 2
- 229940111202 pepsin Drugs 0.000 description 2
- 230000002093 peripheral effect Effects 0.000 description 2
- 150000004713 phosphodiesters Chemical class 0.000 description 2
- HYAFETHFCAUJAY-UHFFFAOYSA-N pioglitazone Chemical compound N1=CC(CC)=CC=C1CCOC(C=C1)=CC=C1CC1C(=O)NC(=O)S1 HYAFETHFCAUJAY-UHFFFAOYSA-N 0.000 description 2
- 239000013612 plasmid Substances 0.000 description 2
- 239000004417 polycarbonate Substances 0.000 description 2
- 239000011148 porous material Substances 0.000 description 2
- 239000002987 primer (paints) Substances 0.000 description 2
- 210000001236 prokaryotic cell Anatomy 0.000 description 2
- 235000019833 protease Nutrition 0.000 description 2
- 238000001742 protein purification Methods 0.000 description 2
- 230000009257 reactivity Effects 0.000 description 2
- 238000010188 recombinant method Methods 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 238000007894 restriction fragment length polymorphism technique Methods 0.000 description 2
- 230000000717 retained effect Effects 0.000 description 2
- 230000003248 secreting effect Effects 0.000 description 2
- 150000003384 small molecules Chemical class 0.000 description 2
- 229910001415 sodium ion Inorganic materials 0.000 description 2
- 238000002764 solid phase assay Methods 0.000 description 2
- 150000003431 steroids Chemical class 0.000 description 2
- 230000000638 stimulation Effects 0.000 description 2
- 238000007920 subcutaneous administration Methods 0.000 description 2
- 235000000346 sugar Nutrition 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- 230000009466 transformation Effects 0.000 description 2
- UFTFJSFQGQCHQW-UHFFFAOYSA-N triformin Chemical compound O=COCC(OC=O)COC=O UFTFJSFQGQCHQW-UHFFFAOYSA-N 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- XUFXOAAUWZOOIT-SXARVLRPSA-N (2R,3R,4R,5S,6R)-5-[[(2R,3R,4R,5S,6R)-5-[[(2R,3R,4S,5S,6R)-3,4-dihydroxy-6-methyl-5-[[(1S,4R,5S,6S)-4,5,6-trihydroxy-3-(hydroxymethyl)-1-cyclohex-2-enyl]amino]-2-oxanyl]oxy]-3,4-dihydroxy-6-(hydroxymethyl)-2-oxanyl]oxy]-6-(hydroxymethyl)oxane-2,3,4-triol Chemical compound O([C@H]1O[C@H](CO)[C@H]([C@@H]([C@H]1O)O)O[C@H]1O[C@@H]([C@H]([C@H](O)[C@H]1O)N[C@@H]1[C@@H]([C@@H](O)[C@H](O)C(CO)=C1)O)C)[C@@H]1[C@@H](CO)O[C@@H](O)[C@H](O)[C@H]1O XUFXOAAUWZOOIT-SXARVLRPSA-N 0.000 description 1
- 102000040650 (ribonucleotides)n+m Human genes 0.000 description 1
- UKAUYVFTDYCKQA-UHFFFAOYSA-N -2-Amino-4-hydroxybutanoic acid Natural products OC(=O)C(N)CCO UKAUYVFTDYCKQA-UHFFFAOYSA-N 0.000 description 1
- ZOBPZXTWZATXDG-UHFFFAOYSA-N 1,3-thiazolidine-2,4-dione Chemical compound O=C1CSC(=O)N1 ZOBPZXTWZATXDG-UHFFFAOYSA-N 0.000 description 1
- BOVGTQGAOIONJV-BETUJISGSA-N 1-[(3ar,6as)-3,3a,4,5,6,6a-hexahydro-1h-cyclopenta[c]pyrrol-2-yl]-3-(4-methylphenyl)sulfonylurea Chemical compound C1=CC(C)=CC=C1S(=O)(=O)NC(=O)NN1C[C@H]2CCC[C@H]2C1 BOVGTQGAOIONJV-BETUJISGSA-N 0.000 description 1
- LLJFMFZYVVLQKT-UHFFFAOYSA-N 1-cyclohexyl-3-[4-[2-(7-methoxy-4,4-dimethyl-1,3-dioxo-2-isoquinolinyl)ethyl]phenyl]sulfonylurea Chemical compound C=1C(OC)=CC=C(C(C2=O)(C)C)C=1C(=O)N2CCC(C=C1)=CC=C1S(=O)(=O)NC(=O)NC1CCCCC1 LLJFMFZYVVLQKT-UHFFFAOYSA-N 0.000 description 1
- VGONTNSXDCQUGY-RRKCRQDMSA-N 2'-deoxyinosine Chemical group C1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CNC2=O)=C2N=C1 VGONTNSXDCQUGY-RRKCRQDMSA-N 0.000 description 1
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 1
- PMMURAAUARKVCB-CERMHHMHSA-N 2-deoxy-D-glucopyranose Chemical compound OC[C@H]1OC(O)C[C@@H](O)[C@@H]1O PMMURAAUARKVCB-CERMHHMHSA-N 0.000 description 1
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 1
- QCVGEOXPDFCNHA-UHFFFAOYSA-N 5,5-dimethyl-2,4-dioxo-1,3-oxazolidine-3-carboxamide Chemical compound CC1(C)OC(=O)N(C(N)=O)C1=O QCVGEOXPDFCNHA-UHFFFAOYSA-N 0.000 description 1
- ZKRFOXLVOKTUTA-KQYNXXCUSA-N 9-(5-phosphoribofuranosyl)-6-mercaptopurine Chemical compound O[C@@H]1[C@H](O)[C@@H](COP(O)(O)=O)O[C@H]1N1C(NC=NC2=S)=C2N=C1 ZKRFOXLVOKTUTA-KQYNXXCUSA-N 0.000 description 1
- 229920000936 Agarose Polymers 0.000 description 1
- 229940077274 Alpha glucosidase inhibitor Drugs 0.000 description 1
- 244000105975 Antidesma platyphyllum Species 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- 208000023275 Autoimmune disease Diseases 0.000 description 1
- 241000271566 Aves Species 0.000 description 1
- 108090001008 Avidin Proteins 0.000 description 1
- 210000002237 B-cell of pancreatic islet Anatomy 0.000 description 1
- 108010077805 Bacterial Proteins Proteins 0.000 description 1
- 229940123208 Biguanide Drugs 0.000 description 1
- 102000015081 Blood Coagulation Factors Human genes 0.000 description 1
- 108010039209 Blood Coagulation Factors Proteins 0.000 description 1
- 102000004506 Blood Proteins Human genes 0.000 description 1
- 108010017384 Blood Proteins Proteins 0.000 description 1
- 241000208199 Buxus sempervirens Species 0.000 description 1
- 102000000905 Cadherin Human genes 0.000 description 1
- 108050007957 Cadherin Proteins 0.000 description 1
- 102000029728 Calcium binding protein 2 Human genes 0.000 description 1
- 108091016526 Calcium binding protein 2 Proteins 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 240000006432 Carica papaya Species 0.000 description 1
- 235000009467 Carica papaya Nutrition 0.000 description 1
- 102000014914 Carrier Proteins Human genes 0.000 description 1
- 108010078791 Carrier Proteins Proteins 0.000 description 1
- 108090000712 Cathepsin B Proteins 0.000 description 1
- 102000004225 Cathepsin B Human genes 0.000 description 1
- 102000003908 Cathepsin D Human genes 0.000 description 1
- 108090000258 Cathepsin D Proteins 0.000 description 1
- 108090000619 Cathepsin H Proteins 0.000 description 1
- 102000004175 Cathepsin H Human genes 0.000 description 1
- 108090000624 Cathepsin L Proteins 0.000 description 1
- 102000004172 Cathepsin L Human genes 0.000 description 1
- 102000005600 Cathepsins Human genes 0.000 description 1
- 108010084457 Cathepsins Proteins 0.000 description 1
- 102000009410 Chemokine receptor Human genes 0.000 description 1
- 108050000299 Chemokine receptor Proteins 0.000 description 1
- 108010035563 Chloramphenicol O-acetyltransferase Proteins 0.000 description 1
- RKWGIWYCVPQPMF-UHFFFAOYSA-N Chloropropamide Chemical compound CCCNC(=O)NS(=O)(=O)C1=CC=C(Cl)C=C1 RKWGIWYCVPQPMF-UHFFFAOYSA-N 0.000 description 1
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 1
- 206010053567 Coagulopathies Diseases 0.000 description 1
- 108700010070 Codon Usage Proteins 0.000 description 1
- 102000008186 Collagen Human genes 0.000 description 1
- 108010035532 Collagen Proteins 0.000 description 1
- 108060005980 Collagenase Proteins 0.000 description 1
- 102000029816 Collagenase Human genes 0.000 description 1
- 108091035707 Consensus sequence Proteins 0.000 description 1
- 108010061641 Cystatin A Proteins 0.000 description 1
- 108010061635 Cystatin B Proteins 0.000 description 1
- 108010061642 Cystatin C Proteins 0.000 description 1
- 102100031237 Cystatin-A Human genes 0.000 description 1
- 102100026891 Cystatin-B Human genes 0.000 description 1
- 102100026897 Cystatin-C Human genes 0.000 description 1
- 102100028182 Cystatin-D Human genes 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- 238000000018 DNA microarray Methods 0.000 description 1
- 239000003155 DNA primer Substances 0.000 description 1
- 238000001712 DNA sequencing Methods 0.000 description 1
- FMGSKLZLMKYGDP-UHFFFAOYSA-N Dehydroepiandrosterone Natural products C1C(O)CCC2(C)C3CCC(C)(C(CC4)=O)C4C3CC=C21 FMGSKLZLMKYGDP-UHFFFAOYSA-N 0.000 description 1
- 108091027757 Deoxyribozyme Proteins 0.000 description 1
- 239000004338 Dichlorodifluoromethane Substances 0.000 description 1
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 1
- 108010016626 Dipeptides Proteins 0.000 description 1
- 108010065556 Drug Receptors Proteins 0.000 description 1
- 102000013138 Drug Receptors Human genes 0.000 description 1
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 102000016675 EF-hand domains Human genes 0.000 description 1
- 108050006297 EF-hand domains Proteins 0.000 description 1
- 238000002965 ELISA Methods 0.000 description 1
- 108010000912 Egg Proteins Proteins 0.000 description 1
- 102000002322 Egg Proteins Human genes 0.000 description 1
- 108010014258 Elastin Proteins 0.000 description 1
- 102000016942 Elastin Human genes 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 108010013369 Enteropeptidase Proteins 0.000 description 1
- 102100029727 Enteropeptidase Human genes 0.000 description 1
- 108010062466 Enzyme Precursors Proteins 0.000 description 1
- 102000010911 Enzyme Precursors Human genes 0.000 description 1
- 241000701959 Escherichia virus Lambda Species 0.000 description 1
- 241000206602 Eukaryota Species 0.000 description 1
- 108700024394 Exon Proteins 0.000 description 1
- 102000016359 Fibronectins Human genes 0.000 description 1
- 108010067306 Fibronectins Proteins 0.000 description 1
- 238000012413 Fluorescence activated cell sorting analysis Methods 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 108010026132 Gelatinases Proteins 0.000 description 1
- 102000013382 Gelatinases Human genes 0.000 description 1
- HEMJJKBWTPKOJG-UHFFFAOYSA-N Gemfibrozil Chemical compound CC1=CC=C(C)C(OCCCC(C)(C)C(O)=O)=C1 HEMJJKBWTPKOJG-UHFFFAOYSA-N 0.000 description 1
- 108700039691 Genetic Promoter Regions Proteins 0.000 description 1
- FAEKWTJYAYMJKF-QHCPKHFHSA-N GlucoNorm Chemical compound C1=C(C(O)=O)C(OCC)=CC(CC(=O)N[C@@H](CC(C)C)C=2C(=CC=CC=2)N2CCCCC2)=C1 FAEKWTJYAYMJKF-QHCPKHFHSA-N 0.000 description 1
- 208000002705 Glucose Intolerance Diseases 0.000 description 1
- 102000053187 Glucuronidase Human genes 0.000 description 1
- 108010060309 Glucuronidase Proteins 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 108010043121 Green Fluorescent Proteins Proteins 0.000 description 1
- 102000004144 Green Fluorescent Proteins Human genes 0.000 description 1
- 108091027305 Heteroduplex Proteins 0.000 description 1
- 108010093488 His-His-His-His-His-His Proteins 0.000 description 1
- 101000916687 Homo sapiens Cystatin-D Proteins 0.000 description 1
- 101000669513 Homo sapiens Metalloproteinase inhibitor 1 Proteins 0.000 description 1
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 1
- 241000701044 Human gammaherpesvirus 4 Species 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- 102000004157 Hydrolases Human genes 0.000 description 1
- 108090000604 Hydrolases Proteins 0.000 description 1
- PMMYEEVYMWASQN-DMTCNVIQSA-N Hydroxyproline Chemical compound O[C@H]1CN[C@H](C(O)=O)C1 PMMYEEVYMWASQN-DMTCNVIQSA-N 0.000 description 1
- 206010020772 Hypertension Diseases 0.000 description 1
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 1
- 208000026350 Inborn Genetic disease Diseases 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 102000003746 Insulin Receptor Human genes 0.000 description 1
- 108010001127 Insulin Receptor Proteins 0.000 description 1
- 229940122199 Insulin secretagogue Drugs 0.000 description 1
- 102000004369 Insulin-like growth factor-binding protein 4 Human genes 0.000 description 1
- 108090000969 Insulin-like growth factor-binding protein 4 Proteins 0.000 description 1
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- UKAUYVFTDYCKQA-VKHMYHEASA-N L-homoserine Chemical compound OC(=O)[C@@H](N)CCO UKAUYVFTDYCKQA-VKHMYHEASA-N 0.000 description 1
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- QEFRNWWLZKMPFJ-ZXPFJRLXSA-N L-methionine (R)-S-oxide Chemical compound C[S@@](=O)CC[C@H]([NH3+])C([O-])=O QEFRNWWLZKMPFJ-ZXPFJRLXSA-N 0.000 description 1
- QEFRNWWLZKMPFJ-UHFFFAOYSA-N L-methionine sulphoxide Natural products CS(=O)CCC(N)C(O)=O QEFRNWWLZKMPFJ-UHFFFAOYSA-N 0.000 description 1
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- 102000007547 Laminin Human genes 0.000 description 1
- 108010085895 Laminin Proteins 0.000 description 1
- 108090001090 Lectins Proteins 0.000 description 1
- 102000004856 Lectins Human genes 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 102000004318 Matrilysin Human genes 0.000 description 1
- 108090000855 Matrilysin Proteins 0.000 description 1
- 102000000422 Matrix Metalloproteinase 3 Human genes 0.000 description 1
- 102000002274 Matrix Metalloproteinases Human genes 0.000 description 1
- 108010000684 Matrix Metalloproteinases Proteins 0.000 description 1
- 102100039364 Metalloproteinase inhibitor 1 Human genes 0.000 description 1
- IBAQFPQHRJAVAV-ULAWRXDQSA-N Miglitol Chemical compound OCCN1C[C@H](O)[C@@H](O)[C@H](O)[C@H]1CO IBAQFPQHRJAVAV-ULAWRXDQSA-N 0.000 description 1
- 101001129925 Mus musculus Leptin receptor Proteins 0.000 description 1
- 101100096027 Mus musculus Smoc2 gene Proteins 0.000 description 1
- 102000004108 Neurotransmitter Receptors Human genes 0.000 description 1
- 239000000020 Nitrocellulose Substances 0.000 description 1
- 101710163270 Nuclease Proteins 0.000 description 1
- 108020004711 Nucleic Acid Probes Proteins 0.000 description 1
- 108020005187 Oligonucleotide Probes Proteins 0.000 description 1
- 102000043276 Oncogene Human genes 0.000 description 1
- 108700020796 Oncogene Proteins 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 206010033307 Overweight Diseases 0.000 description 1
- 102000023984 PPAR alpha Human genes 0.000 description 1
- 108010016731 PPAR gamma Proteins 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 108010067902 Peptide Library Proteins 0.000 description 1
- 108010043958 Peptoids Proteins 0.000 description 1
- 102100038825 Peroxisome proliferator-activated receptor gamma Human genes 0.000 description 1
- 108090000316 Pitrilysin Proteins 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- 239000004952 Polyamide Substances 0.000 description 1
- 229920002873 Polyethylenimine Polymers 0.000 description 1
- 239000004642 Polyimide Substances 0.000 description 1
- 239000004743 Polypropylene Substances 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- 229920002396 Polyurea Polymers 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- 241001415846 Procellariidae Species 0.000 description 1
- 102000016611 Proteoglycans Human genes 0.000 description 1
- 108010067787 Proteoglycans Proteins 0.000 description 1
- 102000016971 Proto-Oncogene Proteins c-kit Human genes 0.000 description 1
- 108010014608 Proto-Oncogene Proteins c-kit Proteins 0.000 description 1
- 108010066717 Q beta Replicase Proteins 0.000 description 1
- 108020005093 RNA Precursors Proteins 0.000 description 1
- 108090000783 Renin Proteins 0.000 description 1
- 102100028255 Renin Human genes 0.000 description 1
- 108091028664 Ribonucleotide Proteins 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 101710101799 Sarcocystatin-A Proteins 0.000 description 1
- 102000003800 Selectins Human genes 0.000 description 1
- 108090000184 Selectins Proteins 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- 108090000787 Subtilisin Proteins 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- RYYWUUFWQRZTIU-UHFFFAOYSA-N Thiophosphoric acid Chemical class OP(O)(S)=O RYYWUUFWQRZTIU-UHFFFAOYSA-N 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- JLRGJRBPOGGCBT-UHFFFAOYSA-N Tolbutamide Chemical compound CCCCNC(=O)NS(=O)(=O)C1=CC=C(C)C=C1 JLRGJRBPOGGCBT-UHFFFAOYSA-N 0.000 description 1
- 108700009124 Transcription Initiation Site Proteins 0.000 description 1
- 108700029229 Transcriptional Regulatory Elements Proteins 0.000 description 1
- 102000004338 Transferrin Human genes 0.000 description 1
- 108090000901 Transferrin Proteins 0.000 description 1
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- 108020005202 Viral DNA Proteins 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- 108070000030 Viral receptors Proteins 0.000 description 1
- 229930003316 Vitamin D Natural products 0.000 description 1
- QYSXJUFSXHHAJI-XFEUOLMDSA-N Vitamin D3 Natural products C1(/[C@@H]2CC[C@@H]([C@]2(CCC1)C)[C@H](C)CCCC(C)C)=C/C=C1\C[C@@H](O)CCC1=C QYSXJUFSXHHAJI-XFEUOLMDSA-N 0.000 description 1
- FZNCGRZWXLXZSZ-CIQUZCHMSA-N Voglibose Chemical compound OCC(CO)N[C@H]1C[C@](O)(CO)[C@@H](O)[C@H](O)[C@H]1O FZNCGRZWXLXZSZ-CIQUZCHMSA-N 0.000 description 1
- 229960002632 acarbose Drugs 0.000 description 1
- XUFXOAAUWZOOIT-UHFFFAOYSA-N acarviostatin I01 Natural products OC1C(O)C(NC2C(C(O)C(O)C(CO)=C2)O)C(C)OC1OC(C(C1O)O)C(CO)OC1OC1C(CO)OC(O)C(O)C1O XUFXOAAUWZOOIT-UHFFFAOYSA-N 0.000 description 1
- 229960001466 acetohexamide Drugs 0.000 description 1
- VGZSUPCWNCWDAN-UHFFFAOYSA-N acetohexamide Chemical compound C1=CC(C(=O)C)=CC=C1S(=O)(=O)NC(=O)NC1CCCCC1 VGZSUPCWNCWDAN-UHFFFAOYSA-N 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 210000000577 adipose tissue Anatomy 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 239000011543 agarose gel Substances 0.000 description 1
- 238000007818 agglutination assay Methods 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- 239000003888 alpha glucosidase inhibitor Substances 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- 239000003708 ampul Substances 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- 238000005571 anion exchange chromatography Methods 0.000 description 1
- 238000000137 annealing Methods 0.000 description 1
- 230000009830 antibody antigen interaction Effects 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 238000003782 apoptosis assay Methods 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 210000003719 b-lymphocyte Anatomy 0.000 description 1
- 239000000022 bacteriostatic agent Substances 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 229960000516 bezafibrate Drugs 0.000 description 1
- IIBYAHWJQTYFKB-UHFFFAOYSA-N bezafibrate Chemical compound C1=CC(OC(C)(C)C(O)=O)=CC=C1CCNC(=O)C1=CC=C(Cl)C=C1 IIBYAHWJQTYFKB-UHFFFAOYSA-N 0.000 description 1
- 150000004283 biguanides Chemical class 0.000 description 1
- 238000003766 bioinformatics method Methods 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 239000012620 biological material Substances 0.000 description 1
- 239000003114 blood coagulation factor Substances 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 235000019577 caloric intake Nutrition 0.000 description 1
- 101150039352 can gene Proteins 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 239000004202 carbamide Substances 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 210000002421 cell wall Anatomy 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 210000001638 cerebellum Anatomy 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- 238000009614 chemical analysis method Methods 0.000 description 1
- 230000002925 chemical effect Effects 0.000 description 1
- 125000003636 chemical group Chemical group 0.000 description 1
- 238000006757 chemical reactions by type Methods 0.000 description 1
- 229960001761 chlorpropamide Drugs 0.000 description 1
- 235000012000 cholesterol Nutrition 0.000 description 1
- 210000000349 chromosome Anatomy 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- YZFWTZACSRHJQD-UHFFFAOYSA-N ciglitazone Chemical compound C=1C=C(CC2C(NC(=O)S2)=O)C=CC=1OCC1(C)CCCCC1 YZFWTZACSRHJQD-UHFFFAOYSA-N 0.000 description 1
- 229950009226 ciglitazone Drugs 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 208000035850 clinical syndrome Diseases 0.000 description 1
- 230000035602 clotting Effects 0.000 description 1
- 238000000975 co-precipitation Methods 0.000 description 1
- 229920001436 collagen Polymers 0.000 description 1
- 229960002424 collagenase Drugs 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 230000004154 complement system Effects 0.000 description 1
- 239000002131 composite material Substances 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 238000012790 confirmation Methods 0.000 description 1
- 210000002808 connective tissue Anatomy 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 239000012228 culture supernatant Substances 0.000 description 1
- 238000011461 current therapy Methods 0.000 description 1
- 229920005565 cyclic polymer Polymers 0.000 description 1
- 125000000753 cycloalkyl group Chemical group 0.000 description 1
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 1
- 150000001945 cysteines Chemical class 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 238000001446 dark-field microscopy Methods 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000008260 defense mechanism Effects 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 230000000593 degrading effect Effects 0.000 description 1
- 230000001934 delay Effects 0.000 description 1
- 238000004925 denaturation Methods 0.000 description 1
- 230000036425 denaturation Effects 0.000 description 1
- 239000005547 deoxyribonucleotide Substances 0.000 description 1
- 125000002637 deoxyribonucleotide group Chemical group 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 230000000368 destabilizing effect Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 238000011026 diafiltration Methods 0.000 description 1
- BGLAPYTXCULTEW-UHFFFAOYSA-A dialuminum;octasodium;hydrogen phosphate;tetraphosphate Chemical compound [Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Na+].[Al+3].[Al+3].OP([O-])([O-])=O.OP([O-])([O-])=O.[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O BGLAPYTXCULTEW-UHFFFAOYSA-A 0.000 description 1
- PXBRQCKWGAHEHS-UHFFFAOYSA-N dichlorodifluoromethane Chemical compound FC(F)(Cl)Cl PXBRQCKWGAHEHS-UHFFFAOYSA-N 0.000 description 1
- 235000019404 dichlorodifluoromethane Nutrition 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- 230000000378 dietary effect Effects 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- NAGJZTKCGNOGPW-UHFFFAOYSA-K dioxido-sulfanylidene-sulfido-$l^{5}-phosphane Chemical compound [O-]P([O-])([S-])=S NAGJZTKCGNOGPW-UHFFFAOYSA-K 0.000 description 1
- BFMYDTVEBKDAKJ-UHFFFAOYSA-L disodium;(2',7'-dibromo-3',6'-dioxido-3-oxospiro[2-benzofuran-1,9'-xanthene]-4'-yl)mercury;hydrate Chemical compound O.[Na+].[Na+].O1C(=O)C2=CC=CC=C2C21C1=CC(Br)=C([O-])C([Hg])=C1OC1=C2C=C(Br)C([O-])=C1 BFMYDTVEBKDAKJ-UHFFFAOYSA-L 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- PMMYEEVYMWASQN-UHFFFAOYSA-N dl-hydroxyproline Natural products OC1C[NH2+]C(C([O-])=O)C1 PMMYEEVYMWASQN-UHFFFAOYSA-N 0.000 description 1
- 229940000406 drug candidate Drugs 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 230000004064 dysfunction Effects 0.000 description 1
- 235000006694 eating habits Nutrition 0.000 description 1
- 235000014103 egg white Nutrition 0.000 description 1
- 210000000969 egg white Anatomy 0.000 description 1
- 229920002549 elastin Polymers 0.000 description 1
- 230000013020 embryo development Effects 0.000 description 1
- 238000000295 emission spectrum Methods 0.000 description 1
- 230000002121 endocytic effect Effects 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 230000006862 enzymatic digestion Effects 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 238000012869 ethanol precipitation Methods 0.000 description 1
- 239000000284 extract Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 229960002297 fenofibrate Drugs 0.000 description 1
- YMTINGFKWWXKFG-UHFFFAOYSA-N fenofibrate Chemical compound C1=CC(OC(C)(C)C(=O)OC(C)C)=CC=C1C(=O)C1=CC=C(Cl)C=C1 YMTINGFKWWXKFG-UHFFFAOYSA-N 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 238000000684 flow cytometry Methods 0.000 description 1
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 description 1
- 238000000799 fluorescence microscopy Methods 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 230000009246 food effect Effects 0.000 description 1
- 235000019253 formic acid Nutrition 0.000 description 1
- 238000002825 functional assay Methods 0.000 description 1
- UHBYWPGGCSDKFX-VKHMYHEASA-N gamma-carboxy-L-glutamic acid Chemical compound OC(=O)[C@@H](N)CC(C(O)=O)C(O)=O UHBYWPGGCSDKFX-VKHMYHEASA-N 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 229960003627 gemfibrozil Drugs 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- 230000007274 generation of a signal involved in cell-cell signaling Effects 0.000 description 1
- 208000016361 genetic disease Diseases 0.000 description 1
- 208000004104 gestational diabetes Diseases 0.000 description 1
- 229960004580 glibenclamide Drugs 0.000 description 1
- 229960000346 gliclazide Drugs 0.000 description 1
- 229960004346 glimepiride Drugs 0.000 description 1
- WIGIZIANZCJQQY-RUCARUNLSA-N glimepiride Chemical compound O=C1C(CC)=C(C)CN1C(=O)NCCC1=CC=C(S(=O)(=O)NC(=O)N[C@@H]2CC[C@@H](C)CC2)C=C1 WIGIZIANZCJQQY-RUCARUNLSA-N 0.000 description 1
- 229960003468 gliquidone Drugs 0.000 description 1
- 230000004153 glucose metabolism Effects 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- ZNNLBTZKUZBEKO-UHFFFAOYSA-N glyburide Chemical compound COC1=CC=C(Cl)C=C1C(=O)NCCC1=CC=C(S(=O)(=O)NC(=O)NC2CCCCC2)C=C1 ZNNLBTZKUZBEKO-UHFFFAOYSA-N 0.000 description 1
- 239000010931 gold Substances 0.000 description 1
- 229910052737 gold Inorganic materials 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 210000004349 growth plate Anatomy 0.000 description 1
- 235000009424 haa Nutrition 0.000 description 1
- 230000002650 habitual effect Effects 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 210000003494 hepatocyte Anatomy 0.000 description 1
- 125000005842 heteroatom Chemical group 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- 235000009200 high fat diet Nutrition 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 210000001320 hippocampus Anatomy 0.000 description 1
- 230000006801 homologous recombination Effects 0.000 description 1
- 238000002744 homologous recombination Methods 0.000 description 1
- 108091008039 hormone receptors Proteins 0.000 description 1
- 150000001469 hydantoins Chemical class 0.000 description 1
- 150000002431 hydrogen Chemical group 0.000 description 1
- 239000000852 hydrogen donor Substances 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 229960002591 hydroxyproline Drugs 0.000 description 1
- 201000001421 hyperglycemia Diseases 0.000 description 1
- 230000036737 immune function Effects 0.000 description 1
- 230000003053 immunization Effects 0.000 description 1
- 238000002649 immunization Methods 0.000 description 1
- 238000003365 immunocytochemistry Methods 0.000 description 1
- 229940072221 immunoglobulins Drugs 0.000 description 1
- 238000003364 immunohistochemistry Methods 0.000 description 1
- 238000010324 immunological assay Methods 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 230000002779 inactivation Effects 0.000 description 1
- 239000000411 inducer Substances 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 102000006495 integrins Human genes 0.000 description 1
- 108010044426 integrins Proteins 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 102000027411 intracellular receptors Human genes 0.000 description 1
- 108091008582 intracellular receptors Proteins 0.000 description 1
- 230000004068 intracellular signaling Effects 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 230000002427 irreversible effect Effects 0.000 description 1
- 210000004153 islets of langerhan Anatomy 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 229960000310 isoleucine Drugs 0.000 description 1
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 1
- 150000002540 isothiocyanates Chemical class 0.000 description 1
- 239000007951 isotonicity adjuster Substances 0.000 description 1
- 238000011005 laboratory method Methods 0.000 description 1
- 229920000126 latex Polymers 0.000 description 1
- 239000004816 latex Substances 0.000 description 1
- 239000002523 lectin Substances 0.000 description 1
- TWNIBLMWSKIRAT-VFUOTHLCSA-N levoglucosan Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@H]2CO[C@@H]1O2 TWNIBLMWSKIRAT-VFUOTHLCSA-N 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 230000037356 lipid metabolism Effects 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 238000004020 luminiscence type Methods 0.000 description 1
- 230000002132 lysosomal effect Effects 0.000 description 1
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 1
- 235000019341 magnesium sulphate Nutrition 0.000 description 1
- ADKOXSOCTOWDOP-UHFFFAOYSA-L magnesium;aluminum;dihydroxide;trihydrate Chemical compound O.O.O.[OH-].[OH-].[Mg+2].[Al] ADKOXSOCTOWDOP-UHFFFAOYSA-L 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 235000012054 meals Nutrition 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 102000006240 membrane receptors Human genes 0.000 description 1
- 108020004084 membrane receptors Proteins 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- MYWUZJCMWCOHBA-VIFPVBQESA-N methamphetamine Chemical compound CN[C@@H](C)CC1=CC=CC=C1 MYWUZJCMWCOHBA-VIFPVBQESA-N 0.000 description 1
- 125000000325 methylidene group Chemical group [H]C([H])=* 0.000 description 1
- LSDPWZHWYPCBBB-UHFFFAOYSA-O methylsulfide anion Chemical compound [SH2+]C LSDPWZHWYPCBBB-UHFFFAOYSA-O 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 229960001110 miglitol Drugs 0.000 description 1
- 108091005601 modified peptides Proteins 0.000 description 1
- 230000010070 molecular adhesion Effects 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 230000004001 molecular interaction Effects 0.000 description 1
- 239000003068 molecular probe Substances 0.000 description 1
- XTGGILXPEMRCFM-UHFFFAOYSA-N morpholin-4-yl carbamate Chemical compound NC(=O)ON1CCOCC1 XTGGILXPEMRCFM-UHFFFAOYSA-N 0.000 description 1
- 108091020120 mouse SMOC-2 protein Proteins 0.000 description 1
- 210000000214 mouth Anatomy 0.000 description 1
- 238000002887 multiple sequence alignment Methods 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 201000000050 myeloid neoplasm Diseases 0.000 description 1
- 210000004165 myocardium Anatomy 0.000 description 1
- 229960000698 nateglinide Drugs 0.000 description 1
- OELFLUMRDSZNSF-BRWVUGGUSA-N nateglinide Chemical compound C1C[C@@H](C(C)C)CC[C@@H]1C(=O)N[C@@H](C(O)=O)CC1=CC=CC=C1 OELFLUMRDSZNSF-BRWVUGGUSA-N 0.000 description 1
- 230000001338 necrotic effect Effects 0.000 description 1
- 239000013642 negative control Substances 0.000 description 1
- 239000002858 neurotransmitter agent Substances 0.000 description 1
- 108010087904 neutravidin Proteins 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- 229920001220 nitrocellulos Polymers 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 239000012457 nonaqueous media Substances 0.000 description 1
- 238000010606 normalization Methods 0.000 description 1
- 238000007826 nucleic acid assay Methods 0.000 description 1
- 239000002853 nucleic acid probe Substances 0.000 description 1
- 229920002113 octoxynol Polymers 0.000 description 1
- 238000002966 oligonucleotide array Methods 0.000 description 1
- 239000002751 oligonucleotide probe Substances 0.000 description 1
- 229920001542 oligosaccharide Polymers 0.000 description 1
- 150000002482 oligosaccharides Chemical class 0.000 description 1
- 210000002747 omentum Anatomy 0.000 description 1
- 229940127240 opiate Drugs 0.000 description 1
- 238000007410 oral glucose tolerance test Methods 0.000 description 1
- 229940126701 oral medication Drugs 0.000 description 1
- 230000016087 ovulation Effects 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 108091008725 peroxisome proliferator-activated receptors alpha Proteins 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- PTMHPRAIXMAOOB-UHFFFAOYSA-L phosphoramidate Chemical compound NP([O-])([O-])=O PTMHPRAIXMAOOB-UHFFFAOYSA-L 0.000 description 1
- 150000008298 phosphoramidates Chemical class 0.000 description 1
- BZQFBWGGLXLEPQ-REOHCLBHSA-N phosphoserine Chemical compound OC(=O)[C@@H](N)COP(O)(O)=O BZQFBWGGLXLEPQ-REOHCLBHSA-N 0.000 description 1
- 230000037081 physical activity Effects 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 229960005095 pioglitazone Drugs 0.000 description 1
- 210000002826 placenta Anatomy 0.000 description 1
- 230000036470 plasma concentration Effects 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 229920002401 polyacrylamide Polymers 0.000 description 1
- 238000002264 polyacrylamide gel electrophoresis Methods 0.000 description 1
- 229920002647 polyamide Polymers 0.000 description 1
- 229920000515 polycarbonate Polymers 0.000 description 1
- 201000010065 polycystic ovary syndrome Diseases 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 229920000570 polyether Polymers 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 230000003234 polygenic effect Effects 0.000 description 1
- 229920001721 polyimide Polymers 0.000 description 1
- 229920001155 polypropylene Polymers 0.000 description 1
- 229920001296 polysiloxane Polymers 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 229920002635 polyurethane Polymers 0.000 description 1
- 239000004814 polyurethane Substances 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 229960003611 pramlintide Drugs 0.000 description 1
- TZIRZGBAFTZREM-MKAGXXMWSA-N pramlintide Chemical compound C([C@@H](C(=O)NCC(=O)N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H]1NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)CCCCN)CSSC1)[C@@H](C)O)C(C)C)C1=CC=CC=C1 TZIRZGBAFTZREM-MKAGXXMWSA-N 0.000 description 1
- 108010029667 pramlintide Proteins 0.000 description 1
- 229960002847 prasterone Drugs 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 230000005522 programmed cell death Effects 0.000 description 1
- AAEVYOVXGOFMJO-UHFFFAOYSA-N prometryn Chemical compound CSC1=NC(NC(C)C)=NC(NC(C)C)=N1 AAEVYOVXGOFMJO-UHFFFAOYSA-N 0.000 description 1
- 239000001294 propane Substances 0.000 description 1
- 239000003380 propellant Substances 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 230000004853 protein function Effects 0.000 description 1
- 229940121649 protein inhibitor Drugs 0.000 description 1
- 239000012268 protein inhibitor Substances 0.000 description 1
- 230000006916 protein interaction Effects 0.000 description 1
- 239000012460 protein solution Substances 0.000 description 1
- 230000004850 protein–protein interaction Effects 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 239000000018 receptor agonist Substances 0.000 description 1
- 229940044601 receptor agonist Drugs 0.000 description 1
- 239000002464 receptor antagonist Substances 0.000 description 1
- 229940044551 receptor antagonist Drugs 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 230000008929 regeneration Effects 0.000 description 1
- 238000011069 regeneration method Methods 0.000 description 1
- 102000037983 regulatory factors Human genes 0.000 description 1
- 108091008025 regulatory factors Proteins 0.000 description 1
- 238000007634 remodeling Methods 0.000 description 1
- 230000008521 reorganization Effects 0.000 description 1
- 229960002354 repaglinide Drugs 0.000 description 1
- 238000003571 reporter gene assay Methods 0.000 description 1
- 108091008146 restriction endonucleases Proteins 0.000 description 1
- PYWVYCXTNDRMGF-UHFFFAOYSA-N rhodamine B Chemical compound [Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=CC=C1C(O)=O PYWVYCXTNDRMGF-UHFFFAOYSA-N 0.000 description 1
- 239000002336 ribonucleotide Substances 0.000 description 1
- 125000002652 ribonucleotide group Chemical group 0.000 description 1
- 229960004586 rosiglitazone Drugs 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 230000000276 sedentary effect Effects 0.000 description 1
- 238000010008 shearing Methods 0.000 description 1
- 230000035939 shock Effects 0.000 description 1
- 239000013605 shuttle vector Substances 0.000 description 1
- 210000000813 small intestine Anatomy 0.000 description 1
- 210000002460 smooth muscle Anatomy 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 229910000162 sodium phosphate Inorganic materials 0.000 description 1
- 238000003746 solid phase reaction Methods 0.000 description 1
- 238000010532 solid phase synthesis reaction Methods 0.000 description 1
- 238000010671 solid-state reaction Methods 0.000 description 1
- 230000007928 solubilization Effects 0.000 description 1
- 238000005063 solubilization Methods 0.000 description 1
- 210000004988 splenocyte Anatomy 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 239000008174 sterile solution Substances 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 108091007196 stromelysin Proteins 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- IIACRCGMVDHOTQ-UHFFFAOYSA-M sulfamate Chemical compound NS([O-])(=O)=O IIACRCGMVDHOTQ-UHFFFAOYSA-M 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 229920001059 synthetic polymer Polymers 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 238000002626 targeted therapy Methods 0.000 description 1
- 150000003505 terpenes Chemical class 0.000 description 1
- MPLHNVLQVRSVEE-UHFFFAOYSA-N texas red Chemical compound [O-]S(=O)(=O)C1=CC(S(Cl)(=O)=O)=CC=C1C(C1=CC=2CCCN3CCCC(C=23)=C1O1)=C2C1=C(CCC1)C3=[N+]1CCCC3=C2 MPLHNVLQVRSVEE-UHFFFAOYSA-N 0.000 description 1
- 229940124598 therapeutic candidate Drugs 0.000 description 1
- 150000001467 thiazolidinediones Chemical class 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 125000003396 thiol group Chemical group [H]S* 0.000 description 1
- RYYWUUFWQRZTIU-UHFFFAOYSA-K thiophosphate Chemical compound [O-]P([O-])([O-])=S RYYWUUFWQRZTIU-UHFFFAOYSA-K 0.000 description 1
- 210000001541 thymus gland Anatomy 0.000 description 1
- 239000005495 thyroid hormone Substances 0.000 description 1
- 229940036555 thyroid hormone Drugs 0.000 description 1
- 230000000451 tissue damage Effects 0.000 description 1
- 231100000827 tissue damage Toxicity 0.000 description 1
- 230000007838 tissue remodeling Effects 0.000 description 1
- 230000008427 tissue turnover Effects 0.000 description 1
- 229960002277 tolazamide Drugs 0.000 description 1
- OUDSBRTVNLOZBN-UHFFFAOYSA-N tolazamide Chemical compound C1=CC(C)=CC=C1S(=O)(=O)NC(=O)NN1CCCCCC1 OUDSBRTVNLOZBN-UHFFFAOYSA-N 0.000 description 1
- 229960005371 tolbutamide Drugs 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 108700012359 toxins Proteins 0.000 description 1
- FGMPLJWBKKVCDB-UHFFFAOYSA-N trans-L-hydroxy-proline Natural products ON1CCCC1C(O)=O FGMPLJWBKKVCDB-UHFFFAOYSA-N 0.000 description 1
- 238000010361 transduction Methods 0.000 description 1
- 230000026683 transduction Effects 0.000 description 1
- 238000001890 transfection Methods 0.000 description 1
- 239000012581 transferrin Substances 0.000 description 1
- 230000009261 transgenic effect Effects 0.000 description 1
- 230000014621 translational initiation Effects 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- 230000017105 transposition Effects 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- GXPHKUHSUJUWKP-UHFFFAOYSA-N troglitazone Chemical compound C1CC=2C(C)=C(O)C(C)=C(C)C=2OC1(C)COC(C=C1)=CC=C1CC1SC(=O)NC1=O GXPHKUHSUJUWKP-UHFFFAOYSA-N 0.000 description 1
- 229960001641 troglitazone Drugs 0.000 description 1
- GXPHKUHSUJUWKP-NTKDMRAZSA-N troglitazone Natural products C([C@@]1(OC=2C(C)=C(C(=C(C)C=2CC1)O)C)C)OC(C=C1)=CC=C1C[C@H]1SC(=O)NC1=O GXPHKUHSUJUWKP-NTKDMRAZSA-N 0.000 description 1
- 239000002753 trypsin inhibitor Substances 0.000 description 1
- 229940046728 tumor necrosis factor alpha inhibitor Drugs 0.000 description 1
- 239000002452 tumor necrosis factor alpha inhibitor Substances 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 238000009281 ultraviolet germicidal irradiation Methods 0.000 description 1
- 241001430294 unidentified retrovirus Species 0.000 description 1
- 238000010200 validation analysis Methods 0.000 description 1
- 239000004474 valine Substances 0.000 description 1
- 231100000611 venom Toxicity 0.000 description 1
- 239000002435 venom Substances 0.000 description 1
- 210000001048 venom Anatomy 0.000 description 1
- 125000002348 vinylic group Chemical group 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 235000019166 vitamin D Nutrition 0.000 description 1
- 239000011710 vitamin D Substances 0.000 description 1
- 150000003710 vitamin D derivatives Chemical class 0.000 description 1
- 229940046008 vitamin d Drugs 0.000 description 1
- 229960001729 voglibose Drugs 0.000 description 1
- 230000029663 wound healing Effects 0.000 description 1
- 238000001086 yeast two-hybrid system Methods 0.000 description 1
- 238000013293 zucker diabetic fatty rat Methods 0.000 description 1
- 238000011680 zucker rat Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- C07K14/4701—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals not used
- C07K14/4716—Muscle proteins, e.g. myosin, actin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A61K48/005—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'active' part of the composition delivered, i.e. the nucleic acid delivered
- A61K48/0058—Nucleic acids adapted for tissue specific expression, e.g. having tissue specific promoters as part of a contruct
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6893—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids related to diseases not provided for elsewhere
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/705—Assays involving receptors, cell surface antigens or cell surface determinants
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/81—Protease inhibitors
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2500/00—Screening for compounds of potential therapeutic value
- G01N2500/02—Screening involving studying the effect of compounds C on the interaction between interacting molecules A and B (e.g. A = enzyme and B = substrate for A, or A = receptor and B = ligand for the receptor)
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/04—Endocrine or metabolic disorders
- G01N2800/042—Disorders of carbohydrate metabolism, e.g. diabetes, glucose metabolism
Abstract
Description
本願は、2002年6月13日に出願された米国仮特許出願番号60/388716号(これはすべての目的のために参照として組み入れられる)に対する優先権の利益を主張する。
本発明は、糖尿病を予防、治療、および診断するための方法および組成物に関する。
タンパク質分解は、タンパク質の機能および運命を調節するために細胞が利用する遍在性のメカニズムである。従って、同定されたプロテアーゼの数は多い。プロテアーゼが広範な生理学的プロセスにおいて果たす機能についての認識は大きくなりつつある。プロテアーゼは、組織損傷および感染に対して保護する防御メカニズムにおいて役割を果たすこと(例えば、血液凝固のタンパク質分解性カスケード、フィブリン溶解、および補体系)、プロホルモンおよびチモーゲンのタンパク質分解性活性化を通して調節エレメントとして作用すること、細胞外マトリックスの破壊を誘導すること、組織のターンオーバーおよび再組織化を制御すること、ならびに、リソソームにおいてタンパク質分解を可能にすることが見い出されてきた。
本発明は、平滑筋結合タンパク質-2(SMAP-2)に関連する組成物および方法を提供する。例えば、本発明は、糖尿病または前糖尿病の個体を治療するための薬剤を同定するための方法を提供する。いくつかの実施態様において、この方法は以下の工程を含む:(i)配列番号:2、配列番号:4、配列番号:6、または配列番号:9をコードする核酸にストリンジェントな条件下でハイブリダイズする核酸によってコードされるポリペプチドを含む溶液と薬剤を接触させる工程;(ii)上記ポリペプチドの発現もしくは活性を減少させる薬剤または上記ポリペプチドに結合する薬剤を選択する工程;および(iii)細胞中でのインスリン感受性を調節する能力について該選択された薬剤を試験し、それによって細胞中でのインスリン感受性を調節することができる薬剤を同定する工程。
「インスリン感受性」とは、細胞におけるグルコースの取り込みに対するインスリンの効果をいう。感受性は、生物体レベル、組織レベル、または細胞レベルで決定され得る。例えば、グルコース抵抗性試験後の血液または尿のグルコースレベルはインスリン感受性を示す。インスリン感受性を測定する他の方法には、例えば、グルコースの取り込みの測定(例えば、Garcia de Herreros, A.およびBirnbaum, M.J.、 J. Biol. Chem., 264, 19994-19999 (1989); Klip, A.、Li, G.、およびLogan, W.J.、Am. J. Physiol. 247, E291-296 (1984)を参照されたい)、組織(例えば骨格筋)へのグルコース注入速度(GINF)の測定(例えば、Ludvikら、J. Clin. Invest. 100:2354 (1997); Friasら、Diabates Care 23:64, (2000)を参照されたい)、およびインスリンに応答したGLUT4移行(例えば、本明細書中に記載されるようなもの)の感受性の測定が挙げられる。
1)アラニン(A)、グリシン(G);
2)アスパラギン酸(D)、グルタミン酸(E);
3)アスパラギン(N)、グルタミン(Q);
4)アルギニン(R)、リジン(K);
5)イソロイシン(I)、ロイシン(L)、メチオニン(M)、バリン(V);
6)フェニルアラニン(F)、チロシン(Y)、トリプトファン(W);
7)セリン(S)、トレオニン(T);および
8)システイン(C)、メチオニン(M)
(例えば、Creighton、「タンパク質(Proteins)」(1984)を参照されたい)。
1. 緒言
本発明は、驚くべきことに、SMAP-2と呼ばれるプロテアーゼ阻害物質が糖尿病患者中でアップレギュレートされるということを実証する。SMAP-2は、糖尿病の細胞および組織(例えば、脂肪細胞および骨格筋を含む)においてインスリン感受性を調節する。少なくとも4種のヒトSMAP-2の改変体が本明細書中で提供される(配列番号:2、4、および6、ならびに配列番号:7によってコードされるポリペプチド)。さらに、SMOC-2と名付けられたマウスオルトログが配列番号:9として提供される。
本発明の多数の実施態様において、関心対象のSMAP-2をコードする核酸が組換え方法を使用して単離およびクローニングされる。このような実施態様は、例えば、タンパク質発現のため、またはSMAP-2ポリペプチド(例えば、配列番号:2、配列番号:4、配列番号:6、配列番号:9、および、配列番号:7によってコードされるポリペプチド)に由来する改変体、誘導体、発現カセット、もしくは他の配列の生成の間に、SMAP-2ポリヌクレオチド(例えば、配列番号:1、配列番号:3、配列番号:5、配列番号:7、および配列番号:8)を単離するために、遺伝子発現をモニターするために、異なる種におけるSMAP-2配列の単離もしくは検出のため、患者における診断目的のため、例えば、SMAP-2における変異を検出するため、または核酸の発現レベルもしくはポリペプチドを検出するために使用される。いくつかの実施態様において、本発明のポリペプチドをコードする配列は、異種プロモーターに作動可能に連結される。1つの実施態様において、本発明の核酸は、例えば、ヒト、マウス、ラットなどを含む任意の動物からである。
本発明は、組換え遺伝学の分野におけるルーチン的な技術に依拠している。本発明における一般的な使用方法を開示している基本的なテキストには、Sambrookら、「Molecular Cloning、Laboratory Manual」(第3版、2001);Kriegler、「Gene Transfer and Expression:A Laboratory Manual」(1990);および「Current Protocols in Molecular Biology」(Ausubelら編、1994)が含まれる。
一般に、主題タンパク質をコードする核酸は、cDNAまたはゲノムDNAをコードするように作製されたDNA配列ライブラリーからクローニングされる。特定の配列の位置はオリゴヌクレオチドプローブとハイブリダイズさせることによって決定可能であり、後者の配列は本明細書に開示された配列から導くことができる。本明細書に開示された配列はまた、PCRプライマー用の基準となる上に、SMAP-2特異的プローブを単離するのに適した領域を規定する。または、配列を発現ライブラリー中にクローニングする場合には、発現された組換えタンパク質を、目的のポリペプチド(本明細書に開示されたものを含む)に対して作製された抗血清または精製抗体を用いて免疫学的に検出することもできる。
天然に存在するかまたは組換えのいずれかのSMAP-2が機能アッセイにおける使用のために精製され得る。天然に存在するSMAP-2は、例えば、心臓、大網組織、またはSMAP-2オルトログの任意の他の供給源から精製され得る。組換えポリペプチドは、任意の適切な発現系から精製され得る。
組換えタンパク質を形質転換細菌によって大量に発現させる場合に(通常はプロモーター誘導による、ただし発現は構成性でもよい)、タンパク質が不溶性凝集物を形成することがある。タンパク質封入体の精製に適したプロトコールがいくつかある。例えば、凝集タンパク質(本明細書では以後、封入体と称する)の精製には一般に、通常は約100〜150μg/mlリソソームおよび0.1%ノニデットP-40(非イオン性界面活性剤)を含む緩衝液中でのインキュベーションによる(ただし、これには限定されない)細菌細胞の破壊により、封入体の抽出、分離および/または精製が行われる。細胞浮遊液はPolytronグラインダー(Brinkman Instruments, Westbury, NY)を用いて破砕することができる。または、細胞を氷上で超音波処理することもできる。細菌を可溶化する代替的な方法は、Sambrookら、前記およびAusubelら、前記に記載されており、当業者には明らかであると考えられる。
タンパク質を、例えばFernandezおよびHoeffler、「Gene Expression Systems」(1999)に記載されたような真核生物遺伝子発現系から精製することもできる。いくつかの態様において、バキュロウイルス発現系は本発明のタンパク質を単離するために用いられる。組換えバキュロウイルスは一般に、バキュロウイルスのポリへドロンコード配列を、発現させようとする遺伝子(例えば、SMAP-2ポリヌクレオチド)で置き換えることによって作製される。ポリへドロン遺伝子を欠くウイルスは特有のプラーク形態を有しているため、認識が容易である。いくつかの態様において、組換えバキュロウイルスは目的のポリヌクレオチドを、ポリヌクレオチドがポリへドロンプロモーターと機能的に結合するように、導入ベクター(例えば、pUCをベースとするベクター)中にまずクローニングすることによって作製される。導入ベクターを野生型DNAとともに昆虫細胞(例えば、Sf9細胞、Sf21細胞またはBT1-TN-5B1-4細胞)にトランスフェクトして、野生型ウイルスDNA中のポリへドロン遺伝子と目的のポリヌクレオチドとの相同組換えおよび置換を生じさせる。続いてウイルスを生じさせ、プラークを精製することができる。昆虫細胞のウイルス感染によってタンパク質発現が起こる。発現されたタンパク質は、分泌される場合には細胞上清から収集でき、細胞内にある場合には細胞可溶化物から収集できる。例えば、Ausubelら、およびFernandezおよびHoeffler、前記を参照されたい。
1.溶解性による分別
しばしば最初の工程として、さらにタンパク質混合物が複合体である場合には、最初に塩分別を行うことにより、不要な宿主細胞タンパク質(または細胞培養液に由来するタンパク質)の多くを目的の組換えタンパク質から分離することができる。好ましい塩は、例えば硫酸アンモニウムでありうる。硫酸アンモニウムは、タンパク質混合物中の水の量を効果的に減らすことによってタンパク質を沈殿させる。そこでタンパク質は溶解性の点から沈殿する。タンパク質の疎水性が高いほど、より低い硫酸アンモニウム濃度で沈殿する可能性が高い。典型的なプロトコールでは、タンパク質溶液に硫酸アンモニウム飽和溶液を添加し、その結果、硫酸アンモニウム濃度が20〜30%となるようにする。これによって最も疎水性の高いタンパク質が沈殿すると考えられる。次に沈殿物を廃棄し(目的のタンパク質が疎水性でない場合)、硫酸アンモニウムを上清に添加し、目的のタンパク質が沈殿することが知られた濃度にする。続いて、沈殿物を緩衝液に溶解し、必要であれば過剰な塩を透析または透析濾過によって除去する。低温エタノール沈殿法などの、タンパク質の溶解性に依拠するその他の方法も当業者に知られており、複合タンパク質混合物の分別に用いることができる。
算出された分子量に基づき、種々の孔径の膜(例えば、Amicon社またはMillipore社の膜)を通過させる限外濾過を用いて、それよりもサイズが大きいまたは小さいタンパク質を単離することができる。第1の工程として、分子量カットオフ値が目的のタンパク質の分子量よりも低い孔径の膜を通してタンパク質混合物の限外濾過を行う。続いて、限外濾過後の保持物質に、分子量カットオフ値が目的のタンパク質の分子量よりも高い膜に対する限外濾過を行う。組換えタンパク質はこの膜を通過して濾液に入ると考えられる。続いて、以下に述べるように濾液のクロマトグラフィーを行うことができる。
目的のタンパク質を、そのサイズ、正味の表面電荷、疎水性および異種分子に対する親和性に基づいて他のタンパク質から分離することもできる。さらに、タンパク質に対して産生された抗体をカラム基質に結合させて、タンパク質の免疫精製を行うこともできる。これらの方法はすべて当技術分野で周知である。
当業者は、SMAP-2ポリヌクレオチドの発現の検出には多くの用途があることを認識すると考えられる。例えば、本明細書で考察するように、患者におけるSMAP-2レベルの検出は、糖尿病を、または糖尿病の病的な影響の少なくともいくつかに対する素因を診断するために有用である。さらに、遺伝子発現の検出はSMAP-2発現の修飾物質を同定するのに有用である。
核酸ハイブリダイゼーション技術を用いたSMAP-2遺伝子および遺伝子発現の検出のほかに、イムノアッセイ法を用いてSMAP-2ポリペプチドを検出することも可能である。イムノアッセイ法を用いて、SMAP-2を定性的または定量的に分析することができる。適用可能な技術に関する一般的な概要は、HarlowおよびLane、「Antibodies: A Laboratory Manual」(1988)に記載がある。当業者は、検出目的に有用な抗体が治療薬としても有用であること(すなわち、SMAP-2アンタゴニスト)を認識すると考えられる。
目的のタンパク質または他の免疫原と特異的に反応するポリクローナル抗体およびモノクローナル抗体の作製のための方法は当業者に知られている(例えば、Coligan、前記;HarlowおよびLane、前記;Stitesら、前記およびそれに引用された参考文献;Goding、前記;ならびにKohlerおよびMilstein、Nature, 256: 495-497 (1975)を参照されたい)。このような技術には、ファージベクターまたは類似のベクターにおける組換え抗体のライブラリーからの抗体の選択による抗体の調製が含まれる(例えば、Huseら、前記;およびWardら、前記を参照のこと)。例えば、イムノアッセイ法に用いるための抗血清を作製するためには、本明細書の記載のように、目的のタンパク質またはその抗原性断片を単離する。例えば、組換えタンパク質を形質転換細胞系において産生させる。マウスまたはウサギの近交系に対して、フロイントアジュバントなどの標準的アジュバントおよび標準的な免疫処置プロトコールを用いてタンパク質の免疫処置を行う。または、本明細書に開示するSMAP-2配列に由来する合成ペプチドは、担体タンパク質と結合させ、かつ免疫原として用いられる。
いくつかの態様において、目的のタンパク質は、よく知られたさまざまな免疫学的結合アッセイ法のうち任意のものを用いて検出および/または定量化される(例えば、米国特許第4,366,241号;第4,376,110号;第4,517,288号;および第4,837,168号を参照)。一般的なイムノアッセイ法の概説については、Asai,「Methods in Cell Biology Volume 37: Antibodies in Cell Biology」、Academic Press, Inc. NY (1993);Stites、前記を参照されたい。免疫学的結合アッセイ法(またはイムノアッセイ法)には一般に、分析物(SMAP-2、またはその抗原性部分配列)と特異的に結合し、しばしばそれを固定化する「捕捉剤(capture agent)」が用いられる。捕捉剤は分析物と特異的に結合する部分(moiety)である。好ましい態様において、捕捉剤は、例えば、本発明のSMAP-2ポリペプチドと特異的に結合する抗体である。抗体(例えば、抗SMAP-2抗体)を、当業者に周知の数多くの手段および上記の手段のうち任意のものを用いて作製してもよい。
組織試料から目的のタンパク質または分析物を検出するためのイムノアッセイ法は競合的でも非競合的でもよい。非競合イムノアッセイ法は、捕捉されたタンパク質または分析物の量を直接測定するアッセイ法である。例えば、1つの好ましい「サンドイッチ」アッセイ法では、捕捉剤(例えば、SMAP-2抗体)を、それを固定化するための固体基質に対して直接結合させることができる。続いて、これらの固定化された抗体は、被験試料中に存在するSMAP-2を捕捉する。このようにして固定化されたSMAP-2に対して、次に、標識を有する第2の抗SMAP-2抗体などの標識剤を結合させる。または、第2の抗体には標識がなく、その代わりに、第2の抗体の由来となった種の抗体に対して特異的な第3の抗体をそれと結合させてもよい。第2の抗体は、酵素標識ストレプトアビジンなどの第3の標識分子が特異的に結合しうる、ビオチンなどの標識可能な部分によって修飾することができる。
競合アッセイ法では、試料中に存在するタンパク質または分析物によって特異的捕捉剤(例えば、SMAP-2に対する抗体)から解離した(競合に敗れた)、添加した(外因性の)タンパク質または分析物(すなわち、目的のSMAP-2)の量を測定することにより、試料中に存在するタンパク質または分析物の量を間接的に測定する。抗体と結合したSMAP-2の量は、試料中に存在する免疫原の濃度と反比例する。1つの特に好ましい態様では、抗体を固体基質上に固定化する。分析物の量は、標識された分析対象分子を用意することによって検出しうる。標識に、例えば放射性標識のほかに、抗体などの検出試薬によって認識されうるペプチドまたはその他のタグ標識も含まれうることは、認識されている。
特に好ましい態様においては、ウエスタンブロット(イムノブロット)分析が、試料中の本発明のSMAP-2の存在を検出および定量化するために用いられる。この技術は一般に、試料のタンパク質を分子量に基づいてゲル電気泳動によって分離し、分離されたタンパク質を適した固体支持体(ニトロセルロースフィルター、ナイロンフィルターまたは誘導体化ナイロンフィルターなど)に移行させた上で、目的のタンパク質と特異的に結合する抗体とともに試料をインキュベートすることを含む。例えば、抗SMAP-2抗体は、固体支持体上のSMAP-2と特異的に結合する。これらの抗体を直接標識してもよく、または、目的のタンパク質と特異的に結合する標識抗体(例えば、標識したヒツジ抗マウス抗体)を用いて後に検出してもよい。
アッセイ法に用いる特定の標識または検出可能基は、アッセイ法に用いる抗体の特異的結合に大きな妨げとならない限り、本発明の特に重要な面ではない。検出可能基は、検出可能な物理的または化学的特性を有する任意の物質でありうる。このような検出可能な標識はイムノアッセイ法の分野では十分に開発されており、通常、このような方法に有用なほとんどすべての標識を本発明に適用することができる。すなわち、標識は、分光学的、光化学的、生化学的、免疫化学的、電子的、工学的または化学的な手段によって検出可能な任意の組成物である。本発明において有用な標識には、磁気ビーズ(例えば、Dynabeads(商標))、蛍光色素(例えば、フルオレセイン、イソチオシアネート、テキサスレッド、ローダミンなど)、放射性標識(例えば、3H、125I、35S、14Cまたは32P)、酵素(例えば、西洋ワサビペルオキシダーゼ、アルカリホスファターゼ、およびELISAに一般に用いられる他のもの)、およびコロイド金または着色ガラスまたはプラスチックビーズ(例えば、ポリスチレン、ポリプロピレン、ラテックスなど)などの比色定量用標識が含まれる。
SMAP-2の修飾物質、すなわちSMAP-2活性、またはSMAP-2ポリペプチドもしくはポリヌクレオチドの発現に対するアゴニストまたはアンタゴニストは、糖尿病を含むさまざまなヒト疾患の治療に有用である。例えば、SMAP-2アンタゴニストの投与は、糖尿病の患者またはインスリン抵抗性のある個体を治療し、糖尿病の進行を防ぎ、それによって糖尿病に関連する症状を防ぐために用いうる。
SMAP-2の修飾物質としての試験を行う作用物質は、ポリペプチド、糖、核酸または脂質などの任意の低分子化合物または生物的実体でよい。一般に、被験化合物は低分子化合物およびペプチドであると考えられる。本質的にはあらゆる化合物を、本発明のアッセイ法における修飾物質またはリガンドの候補として用いることができるが、水性溶液または有機溶液(特にDMSOをベースとするもの)中に溶解しうる化合物を用いることが最も多い。アッセイ法は、アッセイ法の工程を自動化し、任意の好都合な源から化合物をアッセイ法に提供し、一般にはそれを平行して稼働させることにより(例えば、自動化アッセイ法でのマイクロタイタープレート上でのマイクロタイター形式による)、大規模化学ライブラリーをスクリーニングするように設計する。修飾物質には、SMAP-2mRNAのレベルを低下させるように設計された作用物質(例えば、アンチセンス分子、リボザイム、DNAザイム(DNAzyme)、短鎖抑制性RNA(small inhibitory RNA)など)またはmRNAからの翻訳のレベルを低下させるように設計された作用物質(例えば、mRNA分子上の翻訳開始配列または他の配列に対して相補的なアンチセンス分子などの翻訳遮断物質)も含まれる。化合物の供給元が、Sigma社(St. Louis, MO)、Aldrich社(St. Louis, MO)、Sigma-Aldrich社(St. Louis, MO)、Fluka Chemika-Biochemica Analytika社(Buchs, Switzerland)などを含め、数多くあることは知られているであろう。
多数の異なるスクリーニングプロトコールが、細胞(ヒト細胞のような哺乳動物細胞を含む)中のSMAP-2の発現または活性のレベルを調節する薬剤を同定するために使用され得る。一般的な用語において、スクリーニング方法は、例えば、SMAP-2ポリペプチドに結合すること、SMAP-2がプロテアーゼに結合することを妨害すること、SMAP-2との阻害物質もしくは活性化物質の結合を増加させること、またはSMAP-2の発現を活性化もしくは阻害することによって、SMAP-2の活性を調節する薬剤を同定するために、複数の薬剤をスクリーニングする工程を含む。
そのようにして同定された薬剤の少なくともいくつかがおそらくSMAP-2の修飾物質であるので、SMAP-2に結合し得る薬剤の能力についてのスクリーニングによって予備的なスクリーニングが行われ得る。例えば、SMAP-2と相互作用する内因性タンパク質を同定するための結合アッセイもまた有用である。例えば、抗体、レセプター、プロテアーゼ、またはSMAP-2を結合する他の分子が結合アッセイにおいて同定され得る。
SMAP-2およびその対立遺伝子および多型バリアントはプロテアーゼ阻害物質である。SMAP-2ポリペプチドの活性は、機能的効果、化学的効果、および物理的効果を決定するための種々のインビトロアッセイおよびインビボアッセイを使用して(例えば、プロテアーゼ活性を阻害するSMAP-2の能力を測定して、またはSMAP-2の調節もしくはインスリン感受性の効果を測定することによって)、評価され得る。例えば、候補SMAP-2修飾物質は、インスリンに応答してグルコースを取り込むことができるSMAP-2発現細胞を含む混合物に加えられ得る。このようなアッセイは、SMAP-2の阻害物質および活性化物質について試験するために使用され得る。このような導入活性の修飾物質は、細胞内シグナル伝達を制御するためおよび糖尿病を治療するために有用である。
SMAP-2の発現を調節する化合物のスクリーニングも提供される。スクリーニング法は、被験化合物がSMAP-2を発現する1つまたは複数の細胞と接触させた後に、SMAP-2の発現の増加または減少(転写物もしくは翻訳産物のどちらか)を検出する細胞を用いたアッセイ法を行うことを含む。アッセイ法は、SMAP-2を発現する任意の細胞を用いて行うことができる。。
前記のスクリーニング方法のいずれかによって最初に同定される薬剤は、見かけの活性を確証するためにさらに試験され得る。好ましくは、このような研究は、適切な動物モデルを用いて行われる。このような方法の基本的形式には、最初のスクリーニングの間に同定されたリード化合物を、ヒトの代わりのモデルとして働く動物に投与する工程、次いで、SMAP-2が実際に調節されるか否かを決定する工程が包含される。化合物の効果は、正常な動物、糖尿病動物または食餌で誘導されたインスリン抵抗性動物において評価され得る。候補SMAP-2修飾物質の投与に応答した血液グルコースおよびインスリンレベルが決定され得る。確証研究において利用される動物モデルは一般的に任意の種の哺乳動物である。適切な動物の特定の例には、霊長類、マウス、およびラットが含まれるがこれらに限定されない。例えば、糖尿病の一遺伝子性モデル(例えば、ob/obマウスおよびdb/dbマウス、ZuckerラットおよびZucker糖尿病脂肪性ラットなど)または糖尿病の多遺伝子性モデル(例えば、OLETFラット、GKラット、NSYマウス、およびKKマウス)が、糖尿病動物またはインスリン抵抗性動物におけるSMAP-2調節を確証するために有用であり得る。さらに、ヒトSMAP-2を発現するトランスジェニック動物が、薬物候補をさらに確証するために使用され得る。
本発明のハイスループットアッセイ法では、最大で数千種もの異なる修飾物質またはリガンドを1日でスクリーニングすることが可能である。詳細には、マイクロタイタープレートの各ウェルを、選択した修飾物質の候補に対して別々のアッセイ法を実行するために用い、または、濃度もしくはインキュベーション時間の影響を観察しようとする場合には、単一の修飾物質を試験するためにウェルを5〜10個ずつ用いることができる。このため、1枚の標準的なマイクロタイタープレートで、約100種(例えば、96種)の修飾物質をアッセイすることが可能である。1536穴のウェルプレートを用いれば、1枚のプレートで約100〜約1500種の異なる化合物をアッセイすることができる。1日当たり数枚の異なるプレートをアッセイできれば、本発明の統合システムを用いて最大で約6,000〜20,000種類またはそれ以上の異なる化合物をアッセイ法でスクリーニングすることが可能である。さらに、試薬操作のためのマイクロ流体(microfluidic)アプローチを用いることができる。
本発明は、本発明のSMAP-2ポリペプチドをコードする核酸、またはSMAP-2タンパク質、抗SMAP-2抗体などを用いて本明細書に記載したアッセイ法を実施するための組成物、キットおよび統合システムを提供する。
SMAP-2の修飾物質(例えば、アンタゴニスト(SMAP-2特異的抗体を含む)、またはアゴニスト)は、インビボでのSMAP-2活性の修飾のために、哺乳動物対象に対して直接投与することができる。投与は、修飾性化合物を導入して、治療しようとする組織に最終的に接触させるために通常用いられる任意の経路によるもので、当技術分野において周知である。個々の化合物の投与には複数の経路を用いることができるが、ある特定の経路によって別の経路よりも即時的かつより効果的な反応が得られることがしばしばである。
本発明はまた、糖尿病または少なくともいくつかの糖尿病の病理の素因を診断する方法を提供する。診断は、個体の遺伝子型の決定(例えば、SNPを有する)、および糖尿病または他のSMAP-2に関連する疾患の発生と関連を有することが知られている対立遺伝子を有する遺伝子型の比較を含み得る。代替的には、診断はまた、患者においてSMAP-2(タンパク質または転写物)のレベルを決定する工程、ならびに、次いでベースラインまたは範囲に対してそのレベルを比較する工程を含む。代表的には、ベースラインの値は、健常(例えば、痩せた)人におけるSMAP-2を表す。痩せた個体におけるポリペプチドのレベルは単一の個体からの読み取りであり得るが、代表的には、痩せた個体の群からの統計的な関連した平均値である。痩せた個体におけるポリペプチドのレベルは、例えば、コンピュータプログラムにおける値によって表され得る。
以下の実施例は、例証のために提供されるものであって、特許請求の範囲を限定するものではない。
Genechipアレイに、骨格筋、心臓、大網脂肪および皮下(SubQ)脂肪、脳、腎臓、肝臓、肺、小腸(Sm.I)、胸腺、および膵臓を含む種々のヒト組織から調製されるcRNAをハイブリダイズさせた。図1は、これらの組織におけるSMAP-2について得られた平均差スコアを示す。SMAP-2は、Affymetrixソフトウェアによって、骨格筋、心臓、大網、およびSubQ組織に存在し、他のすべての組織には存在しないと判定された。各々の組織についての平均差スコアは:骨格筋-32、心臓-652、大網脂肪-762、および皮下脂肪-171であった。
種々のヒト組織に由来する複数の組織のノーザンブロットをSMAP2プローブでハイブリダイズさせた。これらの組織には、心臓(He)、脳(Br)、胎盤(Pl)、肺(Lu)、肝臓(Liv)、骨格筋(SkM)、腎臓(Ki)、および膵臓(Pan)が含まれる。図2は、SMAP-2が、最も高いレベルが心臓および骨格筋において観察された、制限されたヒト組織発現パターンを有することを実証する。
Genechipアレイに、一晩絶食後(基礎レベル)または5時間高インスリン性-正常血糖クランプ(クランプ)後に得られた、痩せ(n=17)、肥満(n=16)、および糖尿病(n=19)の骨格筋から調製されたcRNAでハイブリダイズさせた。図3に示されるように、SMAP-2遺伝子発現は、糖尿病被験体(糖尿病)において4.15倍アップレギュレートされ、痩せの正常値(痩せ)と比較した場合に統計学的に有意であった(スチューデントt-検定、p値<0.028)。平均差スコア±標準誤差は:痩せ基礎レベル117.8±48.7;痩せクランプ108.8±41.1;肥満基礎レベル85.7±43.8;肥満クランプ122.1±51.3;糖尿病基礎レベル488.5±149.7および糖尿病クランプ167.3±54.1であった。従って、SMAP-2はヒト糖尿病骨格筋においてアップレギュレートされる遺伝子であるようである。
ヒト糖尿病骨格筋におけるSMAP-2のアップレギュレーションを、定量的PCRを用いて再確認した。PCRプライマーおよびTaqmanプローブをPerkin ElmerのPrimer Expressソフトウェア(バージョン1.5)を使用して設計した。手短に述べると、プライマーを80-120ヌクレオチド長のアンプリコンを産生するように選択する。ヒトSMAP-2にのみハイブリダイズするプライマーおよびプローブを使用することによって特異性を得る。
SMOC2の発現レベルをdb/dbマウスにおいて決定した。PCRプライマーをPerkin ElmerのPrimer Expressソフトウェア(バージョン1.5)を使用して設計した。手短に述べると、プライマーを80-120ヌクレオチド長のアンプリコンを産生するように選択する。マウスSMOC-2にのみハイブリダイズするプライマーを使用することによって特異性を得る。
マウス3T3-L1脂肪細胞からのSMAP-2の分泌もまた分析した。3T3-L1脂肪細胞(分化後5-8日)を、トリプシンを用いてプレートから取り外し、PBSで2回洗浄し、そして20×106細胞/mlの濃度でPBS中に再懸濁した。細胞を、300μgの対照LacZ、または野生型SMAP-2プラスミドDNAおよびeGFP-GLUT4をコードするDNA 50μgのいずれかを用いてエレクトロポレーションした。エレクトロポレーション後、細胞を、24ウェルプレートまたはカバーガラスのいずれかの上に再配置し、10%FBSを含むDMEM中で36時間インキュベートした。36時間後、培養上清を細胞から分離した。図6を参照されたい。1mlの上清(M)または100μgの全細胞抽出物(C)を免疫沈殿させ、エピトープタグ抗V5抗体を用いてイムノブロットした。標準分子量マーカー(KDa)を図6の左に示す。「++」標識は、イムノブロット上でポジティブ対照として使用した組換えSMAP-2のアリコートを示す。
SMAP-2発現に応答するGLUT4移行もまた分析した。マウス3T3-L1脂肪細胞を上記のようにエレクトロポレーションした。図7は、3T3-L1脂肪細胞における、対照(基礎レベル)、または1nMもしくは10nMインスリン刺激後の代表的なGLUT4.eGFP移行を示す。3回の別々の実験を示し、GLUT4.eGFP発現細胞の%として表現して、これはインスリンに応答した原形質膜へのGLUT4.eGFPの移行を示し、およびV5エピトープタグ化SMAP-2を同時染色した。GLUT4.eGFPの%±SEは、LacZでは4±2(基礎レベル)、53±10(1nMインスリン)、および67±5(10nMインスリン)、ならびに野生型SMAP-2を発現する細胞においては4±2(基礎レベル)、10±1(1nMインスリン、pv<0.046)、および20±6(10nMインスリン、pv<0.0003)であった。
3T3-L1脂肪細胞に、対照eGFPアデノウイルス(eGFP)または野生型SMAP-2アデノウイルス(SMAP-2)のいずれかを、100または200のいずれかの感染多重度(MOI)で感染させた。一晩のインキュベーション後、細胞を、基礎レベル、0.1nM、1nM、または10nMで30分間インスリンで刺激した(INS)。脂肪細胞を、[3H]2-デオキシ-グルコース(2-DOG)の取り込みの測定によってグルコース輸送活性について正確にアッセイした。各アッセイを3連で行った。結果を図8および表1(下記)に示す。データは、100に設定されたeGFP基礎レベルと比較した場合の、2-DOGの取り込みにおける倍数変化として提示される(n=3)。
SMAP2の発現を調節し得る化合物についてスクリーニングするための高スループットアッセイの例を確立した。第6染色体上の220kbを含むヒトSMAP2ゲノム配列のバイオインフォマティックス分析は、転写開始部位が開始コドンの約320bp上流である可能性が高いことを示唆した。SMAP2プロモーターの開始コドンの1.2kbゲノム領域上流に焦点を当てると、ヒトとマウス間で55%の配列同一性が存在し、この領域がプロモーターとして機能する本質的な転写調節エレメントを有し得ることを示唆する。本発明者らは、pGL3ルシフェラーゼレポーターベクターの上流にこの1.2kbヒトSMAP2プロモーター領域をクローニングし、従って、細胞に基づくアッセイにおいてSMAP2プロモーターの影響下でルシフェラーゼの発現をさせた。
配列番号:1-SMAP-2オープンリーディングフレーム
配列番号:2-SMAP-2ポリペプチド
配列番号:3
AB014730 SMAP-2のホモサピエンス(Homo sapiens)mRNA、完全cds
配列番号:4 AB014730ポリペプチド
配列番号:5
AB014737 SMAP-2BのホモサピエンスmRNA、完全cds
配列番号:6 AB014737ポリペプチド
配列番号:7
AX073674.1|AX073674 PCT 国際公開公報第0104264号からの配列8
配列番号:8
AJ249901.1|MMU249901 分泌型モジュラーカルシウム結合タンパク質2(smoc2遺伝子)のマウス(Mus musclus)mRNA
配列番号:9
マウスSMOC2のアミノ酸配列
配列番号:10
1.2kb SMAP-2ヒトプロモーター
配列番号:11
マウスSMAP2プロモーター
Claims (55)
- 糖尿病または前糖尿病の個体を治療するための薬剤を同定するための方法であって、以下の工程を含む方法:
(i)配列番号:2、配列番号:4、配列番号:6、または配列番号:9をコードする核酸にストリンジェントな条件下でハイブリダイズする核酸によってコードされるポリペプチドを含む溶液と薬剤を接触させる工程;
(ii)ポリペプチドの発現もしくは活性を減少させる薬剤または該ポリペプチドに結合する薬剤を選択する工程;および
(iii)選択された薬剤を、細胞中でのインスリン感受性を調節する能力について試験し、それによって細胞中でのインスリン感受性を調節することができる薬剤を同定する工程。 - ポリペプチドの発現を減少させる薬剤を選択する工程を含む、請求項1記載の方法。
- ポリペプチドの活性を減少させる薬剤を選択する工程を含む、請求項1記載の方法。
- ポリペプチドに結合する薬剤を選択する工程を含む、請求項1記載の方法。
- 接触させる工程がインビトロで実行される、請求項1記載の方法。
- 試験する工程が、動物に薬剤を投与する工程、およびインスリン感受性の調節について動物を試験する工程を含む、請求項1記載の方法。
- 動物が投与の前にインスリン抵抗性を示す、請求項6記載の方法。
- 試験する工程が、ポリペプチドを発現する細胞を薬剤と接触させる工程、およびインスリン感受性の調節について細胞を試験する工程を含む、請求項1記載の方法。
- 試験する工程が、薬剤と接触させていない細胞と比較して、細胞中のグルコースの取り込みを増加させる薬剤を選択する工程を含む、請求項8記載の方法。
- 試験する工程が、薬剤と接触させていない細胞と比較して、細胞中のGLUT4移行を増加させる薬剤を選択する工程を含む、請求項8記載の方法。
- 細胞が脂肪細胞、心臓細胞、または骨格筋細胞である、請求項1記載の方法。
- 細胞がヒト細胞である、請求項1記載の方法。
- アミノ酸配列が配列番号:2を含む、請求項1記載の方法。
- アミノ酸配列が配列番号:4を含む、請求項1記載の方法。
- アミノ酸配列が配列番号:6を含む、請求項1記載の方法。
- アミノ酸配列が配列番号:9を含む、請求項1記載の方法。
- 薬剤が抗体である、請求項1記載の方法。
- 抗体がモノクローナル抗体である、請求項17記載の方法。
- 薬剤がアンチセンスポリヌクレオチドである、請求項1記載の方法。
- 試験する工程が細胞のグルコースの取り込みを試験する工程を含む、請求項1記載の方法。
- 試験する工程が細胞中のGLUT4移行を試験する工程を含む、請求項1記載の方法。
- 請求項1記載の方法によって同定された薬剤の治療的有効量を動物に投与する工程を含む、糖尿病または前糖尿病の動物を治療する方法。
- 薬剤が抗体である、請求項22記載の方法。
- 抗体がモノクローナル抗体である、請求項23記載の方法。
- 薬剤がアンチセンスポリヌクレオチドである、請求項22記載の方法。
- 動物がヒトである、請求項23記載の方法。
- 配列番号:2に特異的に結合する薬剤の治療的有効量を動物に投与する工程を含む、糖尿病または前糖尿病の動物を治療する方法。
- 薬剤がポリペプチドである、請求項27記載の方法。
- 薬剤が抗体である、請求項27記載の方法。
- 抗体がモノクローナル抗体である、請求項29記載の方法。
- 薬剤がアンチセンスポリヌクレオチドである、請求項27記載の方法。
- 動物がヒトである、請求項27記載の方法。
- 配列番号:2をコードする核酸にストリンジェントな条件下でハイブリダイズする核酸によってコードされるポリペプチドのレベルを、個体からの試料中で検出する工程を含む、糖尿病または前糖尿病の個体を診断する方法であって、
痩せた人におけるポリペプチドのレベル、または個体からの以前の試料におけるポリペプチドのレベルと比較して、試料中のポリペプチドのレベルが増加すれば、個体が糖尿病または前糖尿病であることを示す、方法。 - 個体が2型糖尿病を有する、請求項27記載の方法。
- 個体が前糖尿病である、請求項27記載の方法。
- 試料が血液試料、尿試料、または組織試料である、請求項33記載の方法。
- 検出する工程が、試料をポリペプチドに特異的に結合する抗体に接触させる工程を含む、請求項33記載の方法。
- 配列番号:2をコードする核酸にストリンジェントな条件下でハイブリダイズするポリヌクレオチドのレベルを、個体からの試料中で検出する工程を含む、2型糖尿病を有するか、または前糖尿病である個体を診断する方法であって、
痩せた人におけるポリヌクレオチドのレベル、または個体からの以前の試料のポリヌクレオチドのレベルと比較して、試料中のポリヌクレオチドのレベルが増加すれば、個体が糖尿病または前糖尿病であることを示す、方法。 - 検出する段階が、配列番号:2をコードする核酸にストリンジェントな条件下でハイブリダイズするmRNAを定量する工程を含む、請求項38記載の方法。
- mRNAが逆転写され、かつポリメラーゼ連鎖反応で増幅される、請求項39記載の方法。
- 試料が血液試料、尿試料、または組織試料である、請求項38記載の方法。
- 配列番号:2のアミノ酸351〜379位
配列番号:2のアミノ酸388〜416位
配列番号:2のアミノ酸40〜84位
配列番号:2のアミノ酸90〜153位;および/または
配列番号:2のアミノ酸216〜281位
を含むポリペプチドをコードするポリヌクレオチドを含む、単離された核酸。 - ポリペプチドが配列番号:2を含む、請求項42記載の核酸。
- ポリヌクレオチドが配列番号:1である、請求項42記載の核酸。
- 請求項42記載の核酸に作動可能に連結された異種プロモーターを含む発現カセット。
- 請求項42記載の核酸でトランスフェクトされた宿主細胞。
- ヒト細胞である、請求項46記載の宿主細胞。
- 細菌である、請求項46記載の宿主細胞。
- 配列番号:2のアミノ酸351〜379位
配列番号:2のアミノ酸388〜416位
配列番号:2のアミノ酸40〜84位
配列番号:2のアミノ酸90〜153位;および/または
配列番号:2のアミノ酸216〜281位
を含む、単離されたポリペプチド。 - 配列番号:2を含む、請求項49記載のポリペプチド。
- 異種ポリヌクレオチドに作動可能に連結されたプロモーターを含む発現カセットであって、プロモーターが配列番号:10または配列番号:11を含む、発現カセット。
- ポリヌクレオチドがポリペプチドをコードする、請求項51記載の発現カセット。
- ポリペプチドがレポーター遺伝子産物である、請求項51記載の発現カセット。
- 請求項51記載の発現カセットを含む細胞。
- 異種ポリヌクレオチドに作動可能に連結されたプロモーターを含む発現カセットを導入する工程を含む、筋肉細胞中でポリヌクレオチドを発現する方法であって、プロモーターが配列番号:10または配列番号:11を含む、方法。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US38871602P | 2002-06-13 | 2002-06-13 | |
| PCT/US2003/018976 WO2003105879A1 (en) | 2002-06-13 | 2003-06-13 | Compositions and methods for preventing, treating and diagnosing diabetes |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2005529603A true JP2005529603A (ja) | 2005-10-06 |
| JP2005529603A5 JP2005529603A5 (ja) | 2006-07-27 |
Family
ID=29736528
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004512780A Pending JP2005529603A (ja) | 2002-06-13 | 2003-06-13 | 糖尿病を予防、治療、および診断するための組成物および方法 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US20060210974A1 (ja) |
| EP (1) | EP1511506A4 (ja) |
| JP (1) | JP2005529603A (ja) |
| AU (1) | AU2003238232A1 (ja) |
| WO (1) | WO2003105879A1 (ja) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2007063225A (ja) | 2005-09-01 | 2007-03-15 | Takeda Chem Ind Ltd | イミダゾピリジン化合物 |
| WO2007104034A2 (en) | 2006-03-08 | 2007-09-13 | Takeda San Diego, Inc. | Glucokinase activators |
| US8008332B2 (en) | 2006-05-31 | 2011-08-30 | Takeda San Diego, Inc. | Substituted indazoles as glucokinase activators |
| JP5419706B2 (ja) | 2006-12-20 | 2014-02-19 | タケダ カリフォルニア インコーポレイテッド | グルコキナーゼアクチベーター |
| US8173645B2 (en) | 2007-03-21 | 2012-05-08 | Takeda San Diego, Inc. | Glucokinase activators |
| US20090136465A1 (en) | 2007-09-28 | 2009-05-28 | Intrexon Corporation | Therapeutic Gene-Switch Constructs and Bioreactors for the Expression of Biotherapeutic Molecules, and Uses Thereof |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2000069885A2 (en) * | 1999-05-14 | 2000-11-23 | Millennium Pharmaceuticals, Inc. | Secreted proteins and uses thereof |
| AU2001239742A1 (en) * | 2000-03-06 | 2001-09-17 | Eli Lilly And Company | Nucleic acids, encoding human crsp1 and uses thereof |
-
2003
- 2003-06-13 EP EP03737127A patent/EP1511506A4/en not_active Withdrawn
- 2003-06-13 JP JP2004512780A patent/JP2005529603A/ja active Pending
- 2003-06-13 AU AU2003238232A patent/AU2003238232A1/en not_active Abandoned
- 2003-06-13 US US10/515,892 patent/US20060210974A1/en not_active Abandoned
- 2003-06-13 WO PCT/US2003/018976 patent/WO2003105879A1/en active Application Filing
Also Published As
| Publication number | Publication date |
|---|---|
| EP1511506A1 (en) | 2005-03-09 |
| WO2003105879A1 (en) | 2003-12-24 |
| US20060210974A1 (en) | 2006-09-21 |
| EP1511506A4 (en) | 2006-12-06 |
| AU2003238232A1 (en) | 2003-12-31 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20080064857A1 (en) | Methods and Reagents for Diagnosis and Treatment of Diabetes | |
| US7491533B2 (en) | Polynucleotides encoding an isolated β-islet cell two-pore domain potassium channel | |
| JP2008506949A (ja) | 肥満、糖尿病およびインスリン抵抗性の診断および治療の方法 | |
| JP2008503212A (ja) | 肥満、糖尿病およびインスリン抵抗性の診断および治療の方法 | |
| JP2005535302A (ja) | 糖尿病およびインスリン抵抗性の診断および治療のための方法 | |
| US20060228706A1 (en) | Methods of diagnosing and treating diabetes and insulin resistance | |
| JP2005529603A (ja) | 糖尿病を予防、治療、および診断するための組成物および方法 | |
| US7294698B2 (en) | Methods and reagents for diagnosis and treatment of diabetes | |
| JP2006503265A (ja) | 糖尿病およびインスリン抵抗性の診断および治療の方法 | |
| JP2005528921A (ja) | Cx3cr1修飾物質を用いる糖尿病の治療および診断の方法 | |
| US20080318312A1 (en) | Pancreatic islet transcription factor and uses thereof | |
| US20060234292A1 (en) | Methods of diagnosing and treating diabetes and insulin resistance | |
| US7510851B2 (en) | Compositions and methods for diagnosing and treating diabetes, insulin resistance and dyslipidemia | |
| JP2006507799A (ja) | 糖尿病およびインスリン抵抗性の診断および治療の方法 | |
| JP2008505648A (ja) | 糖尿病およびインスリン抵抗性の診断および治療の方法 | |
| JP2008502909A (ja) | 糖尿病およびインスリン抵抗性の診断および治療の方法 | |
| US20050208516A1 (en) | Methods and reagents for diagnosis and treatment of diabetes | |
| AU2004304917A1 (en) | Genes commonly regulated by different classes of antidepressants |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20060607 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20060607 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20090224 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20090617 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20091112 |