JP2005506340A - Methods and compositions for targeting underglycosylated proteins across the blood brain barrier - Google Patents
Methods and compositions for targeting underglycosylated proteins across the blood brain barrier Download PDFInfo
- Publication number
- JP2005506340A JP2005506340A JP2003535542A JP2003535542A JP2005506340A JP 2005506340 A JP2005506340 A JP 2005506340A JP 2003535542 A JP2003535542 A JP 2003535542A JP 2003535542 A JP2003535542 A JP 2003535542A JP 2005506340 A JP2005506340 A JP 2005506340A
- Authority
- JP
- Japan
- Prior art keywords
- igf
- therapeutic
- protein
- fusion protein
- targeting
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/62—DNA sequences coding for fusion proteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
- A61K38/30—Insulin-like growth factors (Somatomedins), e.g. IGF-1, IGF-2
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
- A61K47/64—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent
- A61K47/642—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent the peptide or protein in the drug conjugate being a cytokine, e.g. IL2, chemokine, growth factors or interferons being the inactive part of the conjugate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
- A61K47/64—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent
- A61K47/6425—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent the peptide or protein in the drug conjugate being a receptor, e.g. CD4, a cell surface antigen, i.e. not a peptide ligand targeting the antigen, or a cell surface determinant, i.e. a part of the surface of a cell
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/575—Hormones
- C07K14/65—Insulin-like growth factors (Somatomedins), e.g. IGF-1, IGF-2
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/02—Fusion polypeptide containing a localisation/targetting motif containing a signal sequence
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/06—Fusion polypeptide containing a localisation/targetting motif containing a lysosomal/endosomal localisation signal
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/20—Fusion polypeptide containing a tag with affinity for a non-protein ligand
- C07K2319/21—Fusion polypeptide containing a tag with affinity for a non-protein ligand containing a His-tag
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/50—Fusion polypeptide containing protease site
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/61—Fusion polypeptide containing an enzyme fusion for detection (lacZ, luciferase)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/70—Fusion polypeptide containing domain for protein-protein interaction
- C07K2319/74—Fusion polypeptide containing domain for protein-protein interaction containing a fusion for binding to a cell surface receptor
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/70—Fusion polypeptide containing domain for protein-protein interaction
- C07K2319/74—Fusion polypeptide containing domain for protein-protein interaction containing a fusion for binding to a cell surface receptor
- C07K2319/75—Fusion polypeptide containing domain for protein-protein interaction containing a fusion for binding to a cell surface receptor containing a fusion for activation of a cell surface receptor, e.g. thrombopoeitin, NPY and other peptide hormones
Abstract
脳へ組成物を標的化するための方法および組成物が開示される。本発明の方法および組成物は、治療タンパク質を脳へ標的化するために、IGF部分をその治療タンパク質と結合する工程を包含する。IGF標的化部分を含む可溶性融合タンパク質は、血流から脳内の神経組織に輸送される。本発明の方法および組成物は、リソソーム貯蔵疾患を処置するための治療的用途を包含する。本発明はまた、IGF融合タンパク質を発現するための核酸および細胞を提供する。Disclosed are methods and compositions for targeting a composition to the brain. The methods and compositions of the invention include the step of combining an IGF moiety with a therapeutic protein in order to target the therapeutic protein to the brain. A soluble fusion protein comprising an IGF targeting moiety is transported from the bloodstream to neural tissue in the brain. The methods and compositions of the present invention encompass therapeutic uses for treating lysosomal storage diseases. The invention also provides nucleic acids and cells for expressing IGF fusion proteins.
Description
【技術分野】
【0001】
(関連出願)
本願は、以下の利益を主張する:米国特許第60/329,650号(2001年10月16日出願);同第10/136,639号(2002年4月30日出願);同第10/136,841号(2002年4月30日出願);同第60/384,452号(2002年5月29日出願)、同第60/386,019号(2002年6月5日出願)ならびに同第60/408,816号(2002年9月6日出願)(これらの開示の全体は、本明細書中で参考として援用される)。
【0002】
(発明の分野)
本発明は、脳にタンパク質を特異的に送達するための手段を提供する。脳に対してタンパク質を標的化する能力は、神経学的疾患の処置において大変有用である。本発明の方法および組成物は、血液脳関門をわたって細胞に対してタンパク質を標的化するのに有用であり、特に、CNS中の細胞(ニューロン細胞、マクロファージ細胞、および他の細胞型)のリソソームにタンパク質を標的化するのに有用である。従って、本発明は、治療的に有用であるタンパク質を送達して、CNSに影響を与えるリソソーム貯蔵疾患(「LSD」)を処置する方法および組成物を提供する。
【背景技術】
【0003】
(背景)
血液脳関門は、中枢神経系(CNS)における恒常的な環境を維持する。血液を脳に供給するこれらの毛細管は、毛細管内皮膜を介して殆どの分子の通過をブロックする緊密な接合点である。これらの膜は脂溶性物質の通過を可能にするが、水溶性物質(例えば、グルコース、タンパク質、およびアミノ酸)は、血液脳関門を通過しない。グルコースおよび必須アミノ酸を、血液脳関門をわたって輸送するための媒介輸送機構が、存在する。能動輸送機構は、過剰となった、カリウムのような分子を脳から取り除く。しかし、血液脳関門は、薬物のCNSへの送達を妨げる。
【発明の開示】
【発明が解決しようとする課題】
【0004】
多くの神経学的疾患が、CNSにおける細胞性の欠陥から生じる。具体的には、多くのリソソーム貯蔵疾患は、CNSの細胞に影響を与え、そして、中程度の神経学的症状から重篤な神経学的症状を生じる。従って、CNSに治療組成物を送達する能力は、多くの疾患(リソソーム貯蔵疾患を含む)に対する効果的な処置の重要な局面である。
【0005】
必要な薬物をCNSに送達する方法(例えば、くも膜下送達によるCNS内への直接送達)が設計されてきた。しかし、血液脳関門を介して血液からCNSへ薬物および特にタンパク質ベースの薬物を効果的に送達する方法は、当該分野で利用可能ではない。
【0006】
従って、血液脳関門のCNS側における脳実質にタンパク質を送達する方法、特に、CNSにおける細胞のリソソームにタンパク質を送達する方法における、必要性が当該分野に存在する。
【課題を解決するための手段】
【0007】
(発明の要旨)
本発明は、血流から脳またはCNSへ組成物を標的化するため普遍的な方法および組成物を提供する。本発明に従って、IGF部分は、血液脳関門の他の側面における脳実質に対する血流からの分子の標的化するのに使用される。好ましい分子は、治療ポリペプチドである。
【0008】
従って、本発明は、1局面において、インスリン様増殖因子(IGF)部分またはタグに結合した治療因子を含むタンパク質に関する。1実施形態において、タンパク質は、IGFタグと共に融合タンパク質として発現される。1実施形態において、IGFタグは、IGF−IIまたはその一部分を含まない。別の実施形態において、融合タンパク質はまた、IGF−IIの2倍は十分にあるリソソーム標的化部分を含み、その結果、その標的化部分は、カチオン非依存性マンノース−6−リン酸/IGF−IIレセプターに結合して、リソソームによる取り込みを媒介する。別の実施形態において、融合タンパク質はまた、そのタンパク質をリソソームに標的化するためにマンノース−6−リン酸を踏む。
【0009】
好ましいIGF部分またはタグは、IGF−IタグまたはIGF−IIタグである。最も好ましいIGFタグは、IGF−Iタグである。1局面において、そのIGFタグは、インタクトなIGF−Iタンパク質またはIGI−IIタンパク質である。あるいは、IGFタグは、血液脳関門をわたって標的化するのに十分であるIGF−Iタンパク質またはIGI−IIタンパク質の一部分である。好ましい部分は、IGF−IまたはIGF−IIのいずれかのAドメイン、Bドメイン、Cドメイン、もしくはDドメインまたはC末端領域あるいはそれらの部分のうちの少なくとも1つを含む。1つの実施形態において、IGFタグは、AドメインまたはBドメインを含む。本発明に従って、そのAドメインおよびBドメインは、好ましいIGF部分の中心となるコア構造特徴を提供する。AドメインおよびBドメインは、リンカーペプチドによって結合され得る。あるいは、そのAドメインおよびBドメインは、二量体形成してIGFタグを形成する別個のペプチドを提供する。好ましくは、同一IGFタンパク質からのAドメインおよびBドメインが使用され得る。しかし、IGF−IからのAドメインは、IGF−IIからのBドメインと結合され得る。同様に、IGF−IIからのAドメインは、IGF−IからのBドメインと結合され得る。従って、本発明の組成物は、キメラIGF−I/IGF−II分子を含む。例えば、あるIGFタンパク質に由来するAドメインは、別のIGFタンパク質のCドメインおよびBドメインと連結され得る。Aドメイン、Bドメイン、およびCドメインの代替的な組み合わせもまた、有用である。さらなる実施形態において、あるIGFのAドメインは、例えば、2アミノ酸架橋のようなアミノ酸架橋を使用することによって別のIGFタンパク質のドメインに直接的に連結され得る。
【0010】
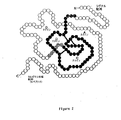
最も好ましいIGF部分は、以下からなる群より選択されるIGF−I部分を含む:図1に示される、IGF−I配列における、およそ残基1〜およそ残基25からのIGF−Iフラグメント、およそ残基25〜およそ残基40からのIGF−Iフラグメント、およそ残基40〜およそ残基65からのIGF−Iフラグメント、ならびに、およそ残基65〜およそ残基70からのIGF−Iフラグメント。IGI−IおよびIGI−IIの好ましい代替的な領域は、ヒトIGF−IおよびヒトIGF−IIのついて図1において示される領域のようなIGF−IとIGF−IIとの間の相同性領域を含む。この図1に示される配列は、成熟IGF−Iタンパク質および成熟IGF−IIタンパク質に関する。本明細書に記載される具体的なIGF改変体は、図1に示される成熟アミノ酸配列番号を参照する。さらなる実施形態において、IGFタグは、IGFタンパク質のC末端フラグメント、例えば、図2に示されるC末端からDドメインの領域を含む。好ましいIGFタグは、IGF−I C末端フラグメントを含む。さらに、本発明に従って、IGFタグは、血液脳関門をわたって脳実質へ本発明の組成物を有効に標的化するのに十分な、本明細書中に記載のIGFタグの2倍はある配列を有するペプチドタグを含む。いくつかの実施形態において、IGFタグは、IGF−Iタンパク質から少なくとも1つのペプチド配列、IGF−IIタンパク質から少なくとも1つのペプチド配列を含む。
【0011】
最も好ましいIGFタグは、ヒトIGFタンパク質に基づく。しかし、他の哺乳動物(例えば、マウス、ラビット、サル、およびブタのIGFタンパク質)に由来する、IGFタンパク質に基づくIGFタグもまた、本発明に従う有用なものである。好ましいIGFタグ(例えば、本明細書に記載の、IGFフラグメント、IGFペプチド、またはIGFドメイン)は、1〜100のアミノ酸長であり、より好ましくは、10〜50のアミノ酸長であり、そしてさらに好ましくは、25アミノ酸長であり、そして、脳に結合するペプチドを標的化するのに十分である。好ましいIGFフラグメント、IGFペプチド、またはIGFドメインは、成熟IGF−I配列および成熟IGF−II配列に基づく。
【0012】
本発明のIGFタグは、治療ペプチドの、N末端、C末端、その本体の中、またはこれらの組み合わせにおいて治療ペプチドと融合し得る。IGF部分が、治療タンパク質のN末端に融合されるとき、IGFシグナルペプチドが好ましくはその発現構築物中に含まれる。しかし、IGFシグナルペプチドはまた、IGF標的化部分がC末端または治療タンパク質の本体の中に位置付けられる場合、N末端に含まれ得る。好ましい実施形態において、IGFタグは、ペプチドのC末端に融合される。1実施形態において、IGFタグの第1ドメインは、治療ペプチドに融合され、そして、IGFタグの第2ドメインが、第1のドメインと二量体化して、脳に対して標的化されるタンパク質が標的化される形態で提供される。例えば、その治療ペプチドは、IGFタンパク質のAドメインに融合され得、そして、別個に提供されたBドメインと二量体化され得る。あるいは、治療ペプチドは、IGFタンパク質のBドメインに融合され得、そして別個に提供されるAドメインと二量体化され得る。
【0013】
本発明はまた、血流から神経組織に到達し得るIGFベースペプチドフラグメントを同定するための方法に関し、そして、この方法は、結合タンパク質を脳またはCNSに対して標的化するのに有用である。本発明に従って、IGFベースのタグの有効性は、本明細書に記載の方法(例えば、放射性標識または組織化学染色に基づく局所アッセイ)を使用して評価され得る。
【0014】
本発明はまた、IGFタグまたはIGFタグに融合したタンパク質をコードする核酸(例えば、DNA分子)、およびこのような核酸を含む細胞(例えば、CHO細胞培養物のような哺乳動物細胞培養物、および/または単細胞生物体(E,coilまたはLeishmania)を含むインビトロ培養細胞)に関する。
【0015】
別の局面において、本発明は、血液脳関門をわたって、特に、CNSの細胞のリソソームに標的化するため治療剤を生成するための方法に関する。この薬剤は、血液脳関門を介してタンパク質を標的化するのに有効な、治療剤およびIGFタグの両方を含むタンパク質をコードする核酸を発現する細胞を培養することによって生成される。次いで、このタンパク質は、(例えば、その細胞の周辺の環境から、またはその細胞を溶解することによって)収集される。本発明はまた、本明細書に記載のタンパク質組成物に関連する。
【0016】
従って、本発明は、一局面において、標的化部分と、治療的に活性でありかつ好ましくは哺乳動物リソソームにおいて活性である治療剤とを含む標的化治療剤に関する。「治療的に活性」は、本明細書中で使用される場合、その活性を欠損している細胞またはその区画に、酵素活性を与える、少なくともポリペプチドまたは他の分子を包含する。「治療的に活性」はまた、細胞における生化学的欠損を改善するかまたは補うことを意図されるほかのポリペプチドまたは他の分子を包含するが、化学療法剤のように、主として細胞傷害性または細胞増殖抑制性である分子は包含しない。
【0017】
一実施形態において、標的化部分は、レセプターが標的細胞の形質膜に存在する場合に、ヒトカチオン非依存性M6Pレセプターの細胞外ドメインに、M6P非依存性の様式で結合するための手段(例えば、分子)である。別の実施形態において、この標的化部分は、ヒトカチオン非依存性M6Pレセプターの細胞外ドメインに結合する非グリコシル化リソソーム標的化ドメインである。いずれの実施形態においても、この標的化部分としては、例えば以下が挙げられ得る:IGF−II;レチノイン酸またはその誘導体;ウロキナーゼ型プラスミノゲン活性化因子レセプターのドメインに対して少なくとも70%同一なアミノ酸配列を有するタンパク質;レセプターを認識する抗体可変ドメイン;またはこれらの改変体。いくつかの実施形態において、この標的化部分は、pH7.4(またはおよそ7.4)においてμM以下の解離定数(例えば、10−8M未満、10−9M未満、10−10M未満、または10−7Mと10−11Mとの間)で、およびpH5.5(またはおよそ5.5)において少なくとも10−6Mの解離定数で、そしてpH7.4(またはおよそ7.4)における解離定数の少なくとも10倍で、IGFレセプター(例えば、IGF−IレセプターまたはIGF−IIレセプター)に結合する。特定の実施形態において、結合のための手段は、レセプターの細胞外ドメインに、pH7.4(またはおよそ7.4)よりもpH5.5(またはおよそ5.5)において少なくとも10倍少ない親和性(avidly)で(すなわち、少なくとも10倍大きい解離定数で)結合する;一実施形態において、pH5.5(またはおよそ5.5)における解離定数は、少なくとも10−6Mである。さらなる実施形態において、結合のための手段との標的化治療剤の結合は、pH7.4(またはおよそ7.4)からpH5.5(またはおよそ5.5)へのpH変化により不安定化される。好ましい実施形態において、標的化部分は、IGF−IIレセプターに対してIGF−II様の結合親和性を保持するが、IGF−Iレセプターに対して減少した結合親和性を有する(例えば、10−5Mまたは10−6Mより大きい解離定数)。
【0018】
本発明はまた、例えば、哺乳動物CNSにおいて有効な治療剤およびこのタンパク質をCNSに対して標的化するためのIGFタグを含むタンパク質を投与することにより、患者(例えば、CNSにおける障害を有する患者、および好ましくはリソソーム貯蔵障害から生じるCNS障害を有する患者)を処置する方法に関する。好ましくは、このタンパク質はまた、リソソーム標的化部分(例えば、以下に記載されるもの:米国特許出願番号10/136,841(2002年4月30日出願);代理人事件番号SYM−007CP、表題「Targeted Therapeutic Proteins」(2002年10月16日出願);および代理人事件番号SYM−009、表題「Targeted Therapeutic Proteins」(2002年10月16日出願))、またはこのタンパク質を、CNSにおける欠損細胞のリソソームに対して標的化するためのマンノース−6−ホスフェートを含む。同様に、本発明は、このようなタンパク質をコードする核酸を投与することにより、および/またはこのようなタンパク質をコードする核酸を含む細胞(例えば、ヒト細胞、Leishmaniaのような生物)を投与することにより、患者を処置する方法に関する。
【0019】
本発明はまた、リソソームに標的化され、かつ/または血液脳関門を横切る治療的タンパク質、ならびに哺乳動物における循環において延長された半減期を有する治療的タンパク質を産生するための方法を提供する。この方法は、グリコシル化不全治療的タンパク質を産生することを包含する。本明細書中で使用される場合、「グリコシル化不全(の)(underglycosylated)」とは、そのタンパク質が、哺乳動物細胞(例えば、CHO細胞)において産生された場合に通常は存在する1つ以上の炭水化物構造が省略されるか、除去されるか、改変されるか、またはマスクされ、それにより哺乳動物におけるそのタンパク質の半減期が延びるタンパク質をいう。従って、タンパク質は、実際には、1つ以上の炭水化物構造が存在しないことに起因してグリコシル化不全であり得るか、または循環からのクリアランスを促進する1つ以上の炭水化物構造の改変またはマスキングにより機能的にグリコシル化不全であり得る。例えば、構造は、(i)マンノースレセプターまたはアシアロ糖タンパク質レセプターによる構造の認識を妨害する1つ以上のさらなる部分(例えば、炭水化物基、ホスフェート基、アルキル基など)の付加により、(ii)インビボでこれらのレセプターへの結合を妨害する、結合部分(例えば、レクチンあるいはマンノースレセプターまたはアシアロ糖タンパク質レセプターの細胞外部分)との糖タンパク質の共有結合または非共有結合により、あるいは(iii)炭水化物構造の全てまたは一部の存在をマスクすることにより、血液からのそのクリアランスを減少させるための、糖タンパク質のポリペプチド部分または炭水化物部分に対する任意の他の改変、によりマスクされ得る。
【0020】
一実施形態において、治療的タンパク質は、従来の哺乳動物細胞(例えば、チャイニーズハムスター卵巣(CHO)細胞)がグリコシル化するようにはタンパク質をグリコシル化しない宿主(例えば、細菌または酵母)において産生される、ペプチド標的化部分(例えば、IGF−I、IGF−II、または標的レセプターに結合するのに有効なその部分)を含む。例えば、この宿主細胞により産生されたタンパク質は、末端マンノース残基、フコース残基、および/またはN−アセチルグルコサミン残基(これらは、マンノースレセプターにより認識される)を欠損し得るか、または完全にグリコシル化不全であり得る。別の実施形態において、治療的タンパク質(哺乳動物細胞で産生されても他の宿主で産生されてもよい)は、1つ以上の炭水化物残基(例えば、1つ以上のマンノース残基、フコース残基、および/またはN−アセチルグルコサミン残基)を除去するためか、あるいは1つ以上の炭化水素残基を改変するかまたはマスクするために化学的または酵素的に処理される。このような改変またはマスキングは、肝性マンノースレセプターおよび/またはアシアロ糖タンパク質レセプターに対する治療的タンパク質の結合を減少し得る。別の実施形態において、1つ以上の可能性のあるグリコシル化部位は、標的化治療タンパク質をコードする核酸を変異させ、それにより哺乳動物細胞またはタンパク質をグリコシル化する他の細胞において合成される場合に、このタンパク質のグリコシル化を低減することにより除去される。
【0021】
(発明の詳細な説明)
(CNS標的化部分)
本発明によれば、IGF部分は、血液脳関門を横切って、組成物(好ましくは、タンパク質組成物)をCNSに対して標的化するために有用である。好ましくは、IGFタグは、組成物を脳実質に標的化するために使用される。本発明によれば、組成物は、血液脳関門(BBB)を直接的に横切るか、または血液脳脊髄液関門(BCB)を間接的に横切るかのいずれかでCNSまたは脳脊髄に進入し得る。BBBは、毛細管内皮細胞により形成され、そしてBCBは、脈絡叢の上皮細胞により形成される。いずれかの関門を横切る輸送は、代表的にトランスサイトーシスを含む。本発明によれば、BCBを横切ってCSFに標的化された組成物は、続いて、脳実質に到達し得る。CSFおよび脳実質は、上衣により隔てられており、そして拡散または大部分の流れが、これら2つの区画の間に物質を輸送し得る。
【0022】
本発明は、[125I]IGF−IおよびIGF−IIが、頸動脈中に注入された場合に脳において検出され得るという認識、ならびに皮下投与されたIGF−Iおよびアナログが、脳脊髄液において見出され得るという認識を、一部利用する。本発明によれば、このことは、両方ともBBBまたはBCBを横断し得るということを示唆する。本発明によれば、輸送プロセスの観察された飽和は、このプロセスが、キャリアにより媒介されることを示唆している。しかし、一連のIGF−Iアナログを使用した実験的分析は、IGF−Iレセプター、IGF−IIレセプター、およびIGF結合タンパク質−1、IGF結合タンパク質−3、IGF結合タンパク質−4、またはIGF結合タンパク質−5が、血液脳関門輸送において役割を果たさないことを示唆する。
【0023】
本発明の一局面によれば、好ましい治療組成物は、IGFタグに融合された治療的ペプチドを含む。一実施形態において、このIGFタグは、IGF−IIもその部分も含まない。好ましい治療組成物は、IGF−Iタグが融合されているLSD(リソソーム貯蔵疾患)タンパク質を、血液脳関門を横切るように指向するIGF−Iタグを含む。この場合、このタグは、かならずしも、複数の細胞型のリソソームにタンパク質を指向させない。しかし、このような融合タンパク質を哺乳動物細胞培養系で発現することにより、本発明は、リソソーム局在化に関して内因性M6Pシグナルを利用し、そして血液脳関門を横断するためにIGF−Iタグを使用する。本発明の好ましい実施形態において、ヒトIGF−Iタグが使用される。代替の実施形態において、本発明の方法および組成物は、IGF−Iタグの対立遺伝子改変体、種改変体または他の配列改変体の使用を含む。好ましい配列改変体は、IGF−Iレセプターおよび/またはIGF結合タンパク質へのIGFタグの結合を低下させる変異を含む(例えば、IGF−Iレセプターへの減少した結合を有するLeu60−IGF−IもしくはLeu24IGF−I、またはIGF結合タンパク質への減少した結合を有するΔ1−3 IGF−I)。さらなる有用な配列改変体としては、Arg55およびArg56のアミノ酸置換を有するIGF−Iが挙げられる。類似の特性を有する他の変異体IGFタンパク質タグもまた有用である。
【0024】
IGF−IIベースのタグはまた、脳にタンパク質を標的化するのに有用である。IGF−IIは、トランスサイトーシスにより血液脳関門を横切って輸送されることが報告されている(Bickelら(2001)Adv.Drug.Deliv.Rev.46(1−3):247−79)。本発明によれば、好ましいIGF−IIベースのタグは、脳にタンパク質を標的化し、そしてまた、リソソーム貯蔵疾患に関連した神経学的症状を処置するためにレセプター結合を介してリソソームにタンパク質を標的化する。IGF−IIの好ましい改変体は、Leu24にアミノ酸置換を有する。
【0025】
本発明の別の局面において、各タンパク質の好ましい機能的特性を付与する、IGF−IおよびIGF−IIのフラグメントを含むキメラタグが使用される。一実施形態において、IGF−IIの保持される部分は、IGF−II M6Pレセプターへの結合に重要であることが公知であるIGF−IIの領域を含み、一方でIGF−IIの残りの部分は、IGF−Iの対応する領域と置き換えられる。この実施形態は、IGF−Iが、血液脳関門を横断するためのタグとしてより活性である場合に特に有用である。この実施形態において、タグは、脳標的化に加えてリソソーム標的化に関して最適化された活性を有する。この実施形態の組換え形態は、任意の発現系で作製され得る。
【0026】
本発明のさらなる局面において、有用な組換えLSDタンパク質は、以下に記載される異なるIGFベースのリソソーム標的化タグのいずれか1つを含む:米国特許出願番号10/136,841(2002年4月30日出願);代理人事件番号SYM−007CP、表題「Targeted Therapuetic Proteins」(2002年10月16日出願);および代理人事件番号SYM−009、表題「Targeted Therapeutic Proteins」(2002年10月16日出願)。
【0027】
好ましい実施形態において、IGF−IIタグを含む本発明の組換えタンパク質は、哺乳動物発現系(例えば、CHO細胞発現系)において発現される。本発明によれば、哺乳動物細胞培養に加えられる内因性M6Pシグナルは、IGF−IIタグにより与えられ得るリソソーム標的化を増強する。
【0028】
本発明に従って、有用な最小IGFタグおよび改変体IGFタグは、既知のIGF−I配列およびIGF−II配列に基づいて、本明細書中に記載されるようなCNS局在化アッセイにおいて最小IGFフラグメントまたは改変体IGFフラグメントを試験することによって同定され得る。
【0029】
好ましいIGFタグは、脳に対して標的化されるよう、IGF−Iと十分に重複しているが、IGF−Iレセプターに対して減少した結合親和性を有し、それによって、IGF−Iの有糸分裂特性を除去する。しかし、好ましいIGFタグは、リソソームに標的化されるように、IGF−IIレセプターに結合しない。従って、1つの実施形態において、IGFタグは、IGF−I配列に基づくが、54位および55位に2つの疎水性IGF−II残基を、IGF−Iのこれらの位置のアルギニン残基の代わりに含む。
【0030】
(IGF−IIの構造)
IGF−IIのNMR構造は、2つのグループにより解明された(例えば、Protein Data Bank記録 1IGLを参照のこと)。IGF−II構造の一般的特徴は、IGF−Iおよびインシュリンと類似する。IGF−IIのAドメインおよびBドメインは、インシュリンのAドメインおよびBドメインに対応する。二次構造の特徴は、残基22〜25の逆ターンによって残基26〜28の短いβストランドに連結されたB領域の残基11〜21由来のαヘリックスを含む。残基25〜27は、小さい逆平行βシートを形成するようであり;残基59〜61および残基26〜28もまた、分子間βシート形成に関与し得る。IGF−IIのAドメインにおいて、αヘリックスがまたがる残基42〜49および53〜59は、Bドメインヘリックスと垂直な逆平行構成で配置される。3つのジスルフィド架橋のうちの2つおよび保存された疎水性残基により形成される疎水性クラスターは、これらの二次構造の特徴を安定化する。N末端およびC末端は、残基31〜40の間の領域のように、ほとんど不明確なままである。
【0031】
IGF−IIは、IGF−II/M6PレセプターおよびIGF−Iレセプターに、比較的高い親和性で結合し、そしてより低い親和性でインスリンレセプターに結合する。IGF−IIはまた、多数の血清IGFBPと相互作用する。
【0032】
好ましい実施形態において、リソソーム標的化部分は、タンパク質、ペプチド、またはマンノース−6−リン酸非依存的な様式で、カチオン非依存的M6P/IGF−IIレセプターに結合する他の部分である。有利には、この実施形態は、LSDタンパク質の取り込みのための正常な生物学的機構を模倣し、なおマンノース−6−リン酸非依存的な様式でこれを行う。
【0033】
例えば、成熟IGF−IIポリペプチドをコードするDNAを、LSD遺伝子カセットの3’末端に融合することによって、種々の細胞型によって取り込まれ得、そしてリソソームに輸送され得る融合タンパク質が作製される。あるいは、前駆体IGF−IIポリペプチドをコードするDNAが、LSD遺伝子カセットの3’末端に融合され得る;この前駆体は、哺乳動物細胞において切断されて成熟IGF−IIポリペプチドを生じるカルボキシ末端部分を含むが、IGF−IIシグナルペプチドは、好ましくは除外される(またはLSD遺伝子カセットの5’末端に移動される)。タンパク質が一旦単離されると、さらなる改変がなされる必要がないので、この方法は、グリコシル化を含む方法を超える多数の利点(単純さおよび費用効率を含む)を有する。
【0034】
(IGF−II/M6Pレセプターへの結合)
IGF−IIの残基48〜50(Phe Arg Ser)の、インスリン由来の対応する残基(Thr Ser Ile)による置換、またはIGF−IIの残基54〜55(Ala Leu)の、IGF−I由来の対応する残基(Arg Arg)による置換は、IGF−II/M6Pレセプターへの結合の喪失を生じるが、IGF−Iおよびインスリンレセプターへの結合の保持を生じる。
【0035】
IGF−IおよびIGF−IIは、残基48〜50の領域において、同一の配列および構造を共有するが、IGF−IIレセプターに対する親和性においては、1000倍の差異を有する。NMR構造は、IGF−IIの残基53〜58(IGF−Iの残基54〜59)の領域におけるIGF−IとIGF−IIとの間の構造的差異を明らかにする:αヘリックスは、IGF−IよりもIGF−IIにおいてより良好に規定され、そしてIGF−Iとは異なり、残基53および54の周りの骨格において屈曲が存在しない。この構造的差異は、IGF−II中のAla54およびLeu55の、IGF−I中のArg55およびArg56による置換と相関する。IGF−IIレセプターへの結合が、この領域中の荷電した残基の存在によって直接破壊されるか、または荷電した残基によって生じた構造中の変化が、IGF−IIレセプターへの結合の変化を生じるかのいずれかの可能性がある。いずれの場合にも、IGF−I中の2つのArg残基への、非荷電残基の置換は、IGF−IIレセプターに対するより高い親和性を生じる。従って、これらの位置における正に荷電した残基の存在は、IGF−IIレセプターへの結合の喪失と相関する。
【0036】
IGF−IIは、カチオン非依存性M6Pレセプターのリピート11に結合する。実際、リピート11のみがカチオン非依存性M6Pレセプターの膜貫通ドメインおよび細胞質ドメインに融合したミニレセプター(minireceptor)は、(全長レセプターの親和性の約10分の1の親和性で)IGF−IIに結合し得、そしてIGF−IIの内在化およびリソソームへのその送達を媒介し得る(Grimmeら(2000)J.Biol.Chem.275(43):33697−33703)。M6Pレセプターのドメイン11の構造は、既知である(Protein Data Baseエントリー1GP0および1GP3;Brownら(2002)EMBO J.21(5):1054−1062)。推定IGF−II結合部位は、IGF−IIの疎水性アミノ酸と相互作用すると考えられる疎水性ポケットである;IGF−IIの候補アミノ酸としては、ロイシン8、フェニルアラニン48、アラニン54およびロイシン55が挙げられる。リピート11が、IGF−II結合に十分であるが、カチオン非依存性M6Pレセプターのより大きい部分(例えば、リピート10〜13または1〜15)を含む構築物は、一般に、より高い親和性および増大したpH依存性で、IGF−IIに結合する(例えば、Linnellら(2001)J.Biol.Chem.276(26):23986−23991を参照のこと)。
【0037】
(IGF−Iレセプターへの結合)
IGF−IIの残基Tyr27のLeuでの置換、Leu43のValでの置換、またはSer26のPheでの置換は、IGF−Iレセプターに対するIGF−IIの親和性を、それぞれ、1/94、1/56または1/4に減少させる。ヒトIGF−IIの残基1〜7の欠失は、ヒトIGF−Iレセプターに対する親和性を1/30に減少させ、そしてラットIGF−IIレセプターに対する親和性を同時に12倍増大させる。IGF−IIのNMR構造は、Thr7が、残基48Pheおよび50Serの近傍、ならびに9Cys−47Cysのジスルフィド結合の近傍に位置することを示す。これらの残基とThr7との相互作用は、IGF−Iレセプター結合に必要とされる、柔軟なN末端ヘキサペプチドを安定化し得ると考えられる。同時に、この相互作用は、IGF−IIレセプターへの結合を調節し得る。IGF−IIのC末端の短縮(残基62〜67)もまた、IGF−Iレセプターに対するIGF−IIの親和性を、1/5に低下させるようである。
【0038】
(IGF−IIの欠失変異体)
IGF−Iおよびカチオン非依存性M6Pレセプターについての結合表面は、IGF−IIの別個の面上にある。構造的データおよび変異データに基づき、ヒトIGF−IIよりも実質的に小さい機能的カチオン非依存性M6P結合ドメインが構築され得る。例えば、アミノ末端のアミノ酸1〜7および/またはカルボキシ末端のアミノ酸62〜67は、欠失または置換され得る。さらに、アミノ酸29〜40は、おそらく、このポリペプチドの残りの部分の折り畳みも、カチオン非依存性M6Pレセプターへの結合も変更することなく、除外または置換され得る。従って、アミノ酸8〜28および41〜61を含む標的化部分が、構築され得る。アミノ酸のこれらのストレッチは、おそらく、直接連結され得るか、またはリンカーによって分離され得る。あるいは、アミノ酸8〜28および41〜61は、別個のポリペプチド鎖上に提供され得る。IGF−IIに相同でありかつIGF−IIの構造に密接に関連する3次構造を有する、インスリンの匹敵するドメインは、例え別個のポリペプチド鎖中に存在するとしても、適切な3次構造への適切な再折り畳みを可能にするのに十分な構造的情報を有する(Wangら(1991)Trends Biochem.Sci.279−281)。従って、例えば、アミノ酸8〜28またはその保存的置換改変体は、治療剤に融合され得る;得られた融合タンパク質は、アミノ酸41〜61またはその保存的置換改変体と混合されて、患者に投与され得る。本発明によれば、IGF−Iの類似のフラグメントが、治療剤との融合において有用である。
【0039】
(IGF結合タンパク質への結合)
IGF−IIおよび関連構築物は、IGFBPに対する親和性を減少するように改変され、それによって、タグ化タンパク質のバイオアベイラビリティを増大させ得る。
【0040】
IGF−IIの残基フェニルアラニン26の、セリン残基による置換は、IGFBP1〜5への結合を1/5〜1/75に減少させる。IGF−IIの残基48〜50の、スレオニン−セリン−イソロイシンによる置換は、ほとんどのIGFBPへの結合を、1/100未満に減少させる。しかし、これらの残基はまた、カチオン非依存性マンノース−6−リン酸レセプターへの結合に重要である。IGF−Iレセプターへの結合を破壊するY27L置換は、IGFBP3および酸不安定性サブユニットとの3要素複合体の形成を妨害する;この3要素複合体は、循環中のIGF−IIのほとんどを占める。IGF−IIの最初の6残基の欠失もまた、IGFBP結合を妨害する。
【0041】
IGFBPとのIGF−Iの相互作用についての研究は、さらに、フェニルアラニン16のセリンによる置換は、2次構造には影響しないが、IGFBP結合を、1/40と1/300との間に減少させることを明らかにした。グルタミン酸9をリジンに変化させることもまた、IGFBP結合における有意な減少を生じた。さらに、リジン9/セリン16の二重変異体は、IFGBPに対する最も低い親和性を示した。これらの変異は、IGF−IIにおいて以前に試験されていなかったが、IGF−Iのこの領域とIGF−IIのこの領域との間の配列保存は、類似の変異(グルタミン酸12リジン/フェニルアラニン19セリン)がIGF−II中に作製される場合、類似の影響が観察されることを示唆する。
【0042】
(IGFホモログ)
ヒトIGF−I、IGF−IIまたは脳への輸送に影響を与えるそれらの一部のアミノ酸配列は、参照配列として使用されて、候補配列が、本発明の方法における合理的な成功予測を有するのに十分なアミノ酸配列類似性を有するか否かを決定し得る。好ましくは、改変体配列は、ヒトIGF−IまたはヒトIGF−IIに対して、少なくとも70%類似または60%同一、より好ましくは少なくとも75%類似または65%同一、そして最も好ましくは80%類似または70%同一である。
【0043】
候補ペプチド領域が、ヒトIGF−IまたはヒトIGF−IIに対して、必要な%類似性または%同一性を有するか否かを決定するために、SmithおよびWaterman(1981)J.Mol.Biol.147:195−197に記載される動的プログラミングアルゴリズムを、HenikoffおよびHenikoff(1992)PNAS 89:10915−10919の図2に記載されるBLOSUM62置換マトリクスと合わせて使用して、候補アミノ酸配列およびヒトIGF−IまたはヒトIGF−IIを、最初に整列する。本発明について、ギャップ挿入ペナルティの適切な値は、−12であり、そしてギャップ伸長ペナルティの適切な値は、−4である。Smith−WatermanおよびBLOSUM62マトリクスのアルゴリズムを使用して整列を実行するコンピュータプログラム(例えば、GCGプログラムパッケージソフト(Oxford Molecular Group、Oxford、England))は、市販され、そして当業者に広く使用されている。
【0044】
候補配列と参照配列との間の整列が一旦行われると、%類似性スコアが算出され得る。各配列の個々のアミノ酸は、それらの類似性に従って、互いに連続して比較される。2つの整列されたアミノ酸に対応する、BLOSUM62マトリクスにおける値が0または負の数である場合、ペアの類似性スコアは0であり;そうでなければ、ペアの類似性スコアは1.0である。生の類似性スコアは、整列されたアミノ酸の対の類似性スコアの合計である。次いで、生のスコアを、候補配列または参照配列のより小さい方のアミノ酸の数で除算することによって、正規化する。正規化した生のスコアが、%類似性である。あるいは、%同一性を算出するために、各配列の整列されたアミノ酸は、再び連続して比較される。アミノ酸が同一でない場合、ペアの同一性スコアは0であり;そうでなければ、ペアの同一性スコアは、1.0である。生の同一性スコアは、同一の整列されたアミノ酸の合計である。次いで、生のスコアを、候補配列または参照配列のより小さい方のアミノ酸の数で除算することによって、正規化する。正規化した生のスコアが、%同一性である。挿入および欠失は、%類似性および%同一性を算出する目的のために、無視される。従って、ギャップペナルティは、この算出においては使用されないが、最初の整列には使用される。
【0045】
(IGFの構造的アナログ)
ヒトIGFタンパク質の公知の構造により、コンピュータ支援設計原理(例えば、米国特許第6,226,603号および同第6,273,598号において考察される)を使用した、IGFアナログの設計が可能である。例えば、IGF−IIの公知の原子座標は、従来のコンピュータモデリングプログラム(例えば、INSIGHTII、DISCOVERまたはDELPHI(Biosym,Technologies,Inc.から市販される)、あるいはQUANTAまたはCHARMM(Molecular Simulations,Inc.から市販される))を備えたコンピュータに提供され得る。これらおよび他のソフトウェアプログラムは、分子構造の分析、ならびに構造および分子間相互作用に対する分子変化の影響を予測するシミュレーションを可能にする。例えば、このソフトウェアは、さらなる分子間水素結合もしくはイオン結合を形成する能力を有する改変アナログを同定して、標的レセプターに対するアナログの親和性を改善するために使用され得る。
【0046】
このソフトウェアはまた、CNSを標的化するのに十分なIGF表面の少なくとも一部上に提示される同じ特徴を模倣する構造的特徴および化学的特徴を有する、ペプチドおよび有機分子の設計を可能にする。本発明の好ましい実施形態は、フレームワークを有する合成有機分子を設計および生成することに関し、このフレームワークは、本明細書中に記載されるようなCNS標的化に関連するとして同定されたアミノ酸側鎖上に配置された化学的部分の空間的関係を模倣する空間的関係で、化学的に相互作用する部分を保有する。
【0047】
例えば、適切な化学的基の同定の際に、従来のコンピュータプログラムを使用する当業者は、適切なキャリアフレームワーク上に配置された適切な化学的部分を有する低分子を設計し得る。有用なコンピュータプログラムは、例えば、以下に記載される:Dixon(1992)Tibtech 10:357−363;Tschinkeら(1993)J.Med.Chem.36:3863−3870;およびEisenら(1994)Proteins:Structure,Function,and Genetics 19:199−221(これらの開示は、参考として本明細書中で援用される)。
【0048】
1つの特定のコンピュータプログラム、表題「CAVEAT」は、データベース(例えば、所望の空間的配向の化学的部分を有する構造について、Cambridge Structural Database)を検索する(Bartlettら(1989)、「Molecular Recognition:Chemical and Biological Problems」(Roberts,S.M.編)pp182−196)。CAVEATプログラムは、テンダミスタット(tendamistat)の3次元構造中の、選択されたアミノ酸側鎖の配向に基づいて、テンダミスタット(α−アミラーゼの74残基のインヒビター)のアナログを設計するために使用される(Bartlettら(1989)前出)。
【0049】
あるいは、CNSへの輸送を標的化する一連のアナログの同定の際に、当業者は、当業者を支援して、定量的構造活性関係(QSAR)を開発し、さらなるアナログの新規設計においてさらに支援する、種々のコンピュータプログラムを使用し得る。他の有用なコンピュータプログラムは、例えば、Connolly−Martin(1991)Methods in Enzymology 203:587−613;Dixon(1992)前出;およびWaszkowyczら(1994)J.Med.Chenm.37:3994−4002に記載される。
(治療剤)
本発明の方法および組成物は、任意の治療剤を生成し、そしてCNSに送達するのに有用であるが、本発明は、リソソーム貯蔵疾患に関連する酵素欠損を克服する遺伝子産物について特に有用である。
【0050】
好ましいLSD遺伝子は、表1に示される。好ましい実施形態において、野生型LSD遺伝子産物は、同様のLSD遺伝子における欠損に罹患する患者に送達される。代替の実施形態において、LSD遺伝子の機能的配列または機能的種が、使用される。さらなる実施形態において、LSD遺伝子欠損を補助し得る異なる酵素をコードする遺伝子が、本発明に従って使用される。
【0051】
【表1】
【0052】
【表2】
【0053】
【表3】
1つの実施形態において、治療剤は、グルコセレブロシダーゼであり、これは、ゴーシェ病のための有効な酵素置換治療剤としてGenzymeによって現在製造されている。現在、この酵素は、曝されたマンノース残基により調製され、これは、タンパク質をマクロファージ結合の細胞に特に標的化させる。1型ゴーシェ病患者における主要な病理学は、グルコセレブロシダーゼを集積するマクロファージに起因するが、他の細胞型にグルコセレブロシダーゼを送達することの治療上の利点が存在し得る。本発明を用いるリソソームへのグルコセレブロシダーゼの標的化は、薬剤を複数の細胞型に標的化させ、そして他の調合品と比較して治療上の利点を有し得る。
【0054】
(標的化部分と治療部分との間の会合)
本発明の組成物の治療部分および標的化部分は、必然的に、直接的にまたは間接的に会合する。1つの実施形態において、治療部分および標的化部分は、非共有結合的に会合する。例えば、標的化部分は、ビオチン化され得、そして治療部分に会合するアビジン部分を結合する。あるいは、標的化部分および治療部分は、多量体タンパク質の異なるサブユニットに各々会合(例えば、融合タンパク質)され得る。別の実施形態において、標的化部分および治療部分は、互いに架橋される(化学的架橋剤を用いて)。
【0055】
好ましい実施形態において、治療部分は、融合タンパク質として標的化部分に融合される。標的化部分は、融合タンパク質のアミノ末端、カルボキシ末端であり得るか、または標的化位置の存在が、治療部分の治療剤活性に過度に干渉しない位置における治療部分の配列内に挿入され得る。
【0056】
治療上の活性部分は、ヘテロメリックタンパク質であり、このサブユニットの1つ以上は、標的化部分と会合し得る。ヒキソサミニダーゼA(例えば、テイ−サックス病に影響されるリソソームタンパク質)は、αサブユニットおよびβサブユニットを含む。αサブユニット、またはβサブユニット、またはその両方のいずれかは、本発明に従って標的化部分に会合し得る。例えば、αサブユニットが、標的化部分に会合し、そしてβサブユニットとともに同時発現される場合に、活性な複合体が、形成され、そしてリソソームへと標的化される。
【0057】
(発現方法)
本発明の方法および組成物は、多くの異なる発現系の状況において有用である。例えば、本発明のタンパク質は、CNSに標的化され得、そして好ましくは、リソソームによって取り込まれ、それは、Leishmania、バキュロウイルス、酵母、細菌、哺乳動物または他の発現系から発現および単離されるかのいずれかである。従って、本発明は、タンパク質産生において多大な適応性を可能にする。例えば、産生されるタンパク質が、1つ以上のジスルフィド結合を含む場合、適切な発現系が、選択および改変され得、これが適切な場合は、適切に折り畳まれたタンパク質の収率をさらに改善する。例えば、1つの有用なIGF標的化部分は、3つの分子内ジスルフィド結合を有する。E.coliにおいて発現される本発明の融合タンパク質が構築され、タンパク質をペリプラズム間隙に指向させ得る。IGFタグは、別のタンパク質のC末端に融合される場合、E.coliのペリプラズムにおいて活性な形態で分泌され得る(Wadensten、Ekebackeら、1991)。IGF部分の最適な折り畳みを促進するために、適切な濃度の還元および酸化されたグルタチオンが、好ましくは、細胞環境に加えられ、ジスルフィド結合形成を促進する。ジスルフィド結合を有する融合タンパク質が、完全に溶解しない場合、任意の不溶性物質は、好ましくは、カオトロピック剤(例えば、尿素)により処理され、変性タンパク質を可溶化し、そして適切な濃度の還元および酸化されたグルタチオン、または他の酸化剤および還元剤を有する緩衝液中で再折り畳みされ、適切なジスルフィド結合の形成を促進する(Smith、Cookら、1989)。例えば、IGF−Iは、IGF−IIの変性および還元のために、6M グアニジン−HClおよび0.1M tris(2−カルボキシエチル)ホスフィン還元剤を用いて再折り畳みされる(Yang,Wuら、1999)。タンパク質の再折り畳みは、1mM 酸化グルタチオン、10mM 還元グルタチオン、0.2M KClおよび1mM EDTAを含む0.1M Tris−HCl緩衝液(pH8.7)中で達成された。
【0058】
本発明の方法はまた、精製工程を必要とすることなく、タンパク質を哺乳動物のCNSに直接的に標的化させるのに有用である。1つの実施形態において、IGF融合タンパク質は、宿主に対して投与される共生生物または寄生生物において発現される。発現されたIGF融合タンパク質は、その生物によって血流に分泌され、そして血液脳関門を横切って送達される。
【0059】
本発明の幾つかの実施形態において、CNS標的化タンパク質は、感染されたマクロファージのリソソームにタンパク質を分泌する生存Leishmaniaを介して、インサイチュで送達される。この小器官から、このタンパク質は細胞を離れ、血液脳関門を横切って送達され得る。従って、IGFタグおよび治療剤は、このタンパク質が、マクロファージリソソームに存在する場合、必然的にインタクトのままである。従って、CNSにおけるリソソームへの送達のために設計されたタンパク質が、インサイチュで発現される場合、それらは、好ましくは、リソソーム環境との適合性を保証するために改変される。代替の実施形態において、本発明の治療剤は、BCBを透通し得るT.bruceiにおける発現によって送達され得る。
【0060】
(核酸および発現系)
本発明のキメラ融合タンパク質は、種々の発現系(インビトロの翻訳系およびインタクトな細胞を含む)において発現され得る。M6P改変は、標的化についての必須条件でないので、種々の発現系(酵母、バキュロウイルスを含む)およびタンパク質をグリコシル化しない原核生物系(例えば、E.coli)でさえ、標的化された治療剤タンパク質の発現について適切である。実際に、非グリコシル化タンパク質は、一般的に、改善されたバイオアベイラビリティを有する。なぜなら、グリコシル化タンパク質は、肝洞様毛細血管内皮におけるマンノースレセプターへの結合を介して、循環から迅速に取り除かれるためである。
【0061】
あるいは、哺乳動物細胞発現系におけるキメラ標的化リソソーム酵素の産生は、カチオン非依存性M6Pレセプターについての複数の結合決定因子を有するタンパク質を産生する。2つ以上のカチオン非依存性M6Pレセプターリガンド間(例えば、M6PとIGF−II、またはM6Pとレチン酸)の共同作用が、利用され得る:多価リガンドは、レセプター架橋によってレセプターへの結合を増強することが実証されている。
【0062】
一般的に、キメラ治療剤タンパク質をコードする遺伝子カセットは、特定の発現系について適合させられ、最適な発現に必要な配列(例えば、プロモーター、リボソーム結合部位、イントロン、またはコード配列中の変更)を組み込み得、コドン利用を最適化し得る。タンパク質は、好ましくは、産生細胞から分泌されるので、発現系に適合する、シグナルペプチドをコードするDNAは、内因性シグナルペプチドについて置換され得る。例えば、LeishmaniaにおけるIGF−IまたはIGF−IIによりタグ化されたβ−グルクロニダーゼおよびα−ガラクトシダーゼAの発現について、Leishmaniaシグナルペプチド(GP63またはSAP)をコードするDNAカセットが、内因性シグナルペプチドをコードするDNAカセットの位置に挿入され、最適な発現を達成する。哺乳動物発現系において、内因性シグナルペプチドが使用されるが、IGF−IタグまたはIGF−IIタグが、コード配列の5’末端において融合される場合、IGF−IシグナルペプチドまたはIGF−IIシグナルペプチドを使用することが望ましい。
【0063】
CHO細胞は、治療剤タンパク質の産生について好ましい哺乳動物宿主である。CHO細胞からの高収率の発現を達成するための古典的な方法は、ジヒドロ葉酸レダクターゼ(DHFR)を欠損するCHO細胞株(例えば、CHO細胞株DUKX(O’Dellら(1998)Int.J.Biochem.Cell Biol.30(7):767〜71))を使用することである。CHO細胞のこの系統は、増殖のためにヒポキサンチンおよびチミジンを必要とする。別個のプラスミドまたは単一のプラスミド上での、DHFR遺伝子カセットにより過剰発現される遺伝子の同時トランスフェクションは、DHFR遺伝子についての選択を可能にし、そして、一般的に、選択される組換えタンパク質をまた発現するクローンの単離を可能にする。例えば、プラスミドpcDNA3は、サイトメガロウイルス(CMV)初期領域調節領域プロモーターを使用し、目的の遺伝子およびpSV2DHFRの発現を推進し、DHFR発現を促進する。濃度が増加する葉酸アナログメトトレキサートに組換え遺伝子カセットを係留させる細胞の次の曝露は、DHFR遺伝子の遺伝子コピー数および同時トランスフェクトされた遺伝子の遺伝子コピー数の両方の増幅をもたらす。
【0064】
この系における真核生物発現のための好ましいプラスミドは、CMVのような強力なプロモーターの下流に配置される目的の遺伝子を含む。イントロンが、遺伝子カセットの3’側に近接して配置され得る。DHFRカセットは、同じプラスミド由来または別のプラスミド由来の第2のプロモーターによって駆動され得る。さらに、プラスミド内に、さらなる選択マーカー(例えば、ネオマイシンホスホトランスフェラーゼ(G418に対する耐性を与える))を組み込むことが有用であり得る。
【0065】
別のCHO発現系(Ulmasovら、(2000)PNAS97(26):14212−14217)は、上記のDHFR/メトトレキセート系の代わりに、G418を使用する、目的の遺伝子の増幅に依存する。弱いプロモーターによって駆動されるわずかに欠損性のネオマイシンホスホトランスフェラーゼを有するpCXNベクター(例えば、Niwaら(1991)Gene108:193−200を参照のこと)は、単一工程で高いコピー数(>300)を有するトランスフェクタントについて選択することを可能にする。
【0066】
あるいは、組換えタンパク質は、エプスタイン−バーウイルス(EBV)複製系に基づいて、発現系を使用してヒトHEK293細胞株において産生され得る。これは、EBV複製起点oriPおよびEBV ori結合タンパク質、EBNA−1からなる。EBNA−1のoriPへの結合は、染色体外プラミスドの複製および引き続く増幅を開始する。次いで、この増幅は、プラスミド内に収容される遺伝子カセットの高レベルの発現を生じる。oriPを含むプラスミドは、EBNA−1形質転換HEK293細胞(Invitrogenから市販される)にトランスフェクトされ得るか、あるいはpCEP4(Invitrogenから市販される)のようなプラスミド(EBNA−1の発現を駆動し、そしてEBV oriPを含む)が使用され得る。
【0067】
E.coliにおいて、治療タンパク質は、好ましくは、細胞周辺腔内に分泌される。これは、LSDタンパク質の内因性シグナルペプチドをコードするDNAの代わりに、細菌シグナルペプチド(例えば、ompAシグナル配列)をコードする核酸カセットを使用することによって達成され得る。発現は、多数の強力な誘導性プロモーター(例えば、lacプロモーター、trpプロモーター、またはtacプロモーター)のいずれかによって駆動され得る。1つの適切なベクターは、pBAD/gIII(Invitrogenから市販される)であり、これは、Gene IIIシグナルペプチドおよびaraBADプロモーターを使用する。
【0068】
(インビボ発現)
治療タンパク質(好ましくは、分泌治療タンパク質)をコードする核酸は、有利に、疾患に苦しむ患者に直接的に提供され得るか、またはエキソビボで細胞に提供され、続いて、患者に生きた細胞が投与され得る。当該分野において公知のインビボ遺伝子治療法は、精製DNA(例えば、プラスミド中として)を提供する工程、ウイルスベクター中でDNAを提供する工程、またはリポソームまたは他のベシクル中でDNAを提供する工程を包含する(例えば、遺伝子治療において使用するための脂質キャリアを開示する米国特許第5,827,703号、および遺伝子治療において有用なアデノウイルスベクターを提供する米国特許第6,281,010号を参照のこと)。
【0069】
組換えタンパク質を発現するように改変された細胞を移植することによって疾患を処置するための方法もまた、周知である。例えば、ヒトに導入するための1次ヒト細胞内に核酸を導入するための方法を開示する、米国特許第5,399,346号を参照のこと。エキソビボ治療のためのヒト細胞の使用は、いくつかの実施形態において好ましいが、他の細胞(例えば、細菌細胞)は、患者の脈管系に移植され得、治療剤を連続的に放出する。例えば、米国特許第4,309,776号および同第5,704,910号を参照のこと。
【0070】
本発明の方法は、精製工程を必要とすることなしに、タンパク質を亜細胞(subcellular)成分に直接標的化するために特に有用である。1つの実施形態において、IGF−II融合タンパク質は、宿主に投与される共生寄生生物または減弱化寄生生物において発現される。発現されるIGF−II融合タンパク質は、その生物によって分泌され、宿主細胞によって摂取され、そしてそれらのリソソームに標的化される。
【0071】
本発明のいくつかの実施形態において、IGF融合タンパク質(例えば、GILTタンパク質)は、感染されたマクロファージのリソソーム内に、タンパク質を分泌する生きたLeishmaniaを介して、インサイチュで送達される。この細胞小器官から、これは、細胞を放出し、マクロファージ系統ではない隣接細胞によって摂取される。従って、IGFタグおよび治療剤は、必ずインタクトなままであるが、一方、タンパク質は、マクロファージリソソーム内にある。従って、GILTタンパク質がインサイチュで発現される場合、これらは、好ましくは、リソソーム環境との適合性を保証するために改変される。ヒトβ−グルクロニダーゼ(ヒト「GUS」)(例示的な治療タンパク質)は、通常、リソソーム中において、またはリソソームへの輸送の間のいずれかにおいて、C末端ペプチド切断を受ける(例えば、GUSの残基633と634との間)。従って、GUS−GILT構築物がマクロファージリソソームにおいてLeishmaniaによって発現される実施形態において、ヒトGUSは、好ましくは、そのタンパク質を切断に対して耐性にするために改変されるか、または残基633に続く残基が、好ましくは、GILT融合タンパク質から単純に省かれる。同様に、本発明の任意のIGFタグは、好ましくは、タンパク質分解に対するその耐性を増加するように改変されるか、または最小結合ペプチド(例えば、ファージディスプレーまたは酵母ツーハイブリッドによって同定される)は、野生型IGF部分の代わりに使用される。
【0072】
(過小グリコシル化)
標的治療タンパク質は、好ましくは、過小グリコシル化される:タンパク質が哺乳動物細胞において産生される場合に通常存在する1つ以上の炭水化物構造が、好ましくは、省かれるか、除去されるか、改変されるか、またはマスクされ、哺乳動物におけるタンパク質の半減期を延長する。過小グリコシル化は、多くの方法で達成され得、これらのいくつかは、図5に図示される。図5に示されるように、タンパク質は、実際に過小グリコシル化され得るか、1つ以上の炭水化物構造を実際に欠失し得るか、あるいは1つ以上の炭水化物構造の改変またはマスキングによって機能的に過小グリコシル化され得る。タンパク質は、実施例12において議論されるように、合成される場合に、実際に過小グリコシル化され得、そして完全に非グリコシル化され得る(E.coliにおいて合成される場合)か、部分的に非グリコシル化され得る(部位特異的変異誘発によって1つ以上のグリコシル化部位を破壊した後の哺乳動物系において合成される場合)か、または非哺乳動物グリコシル化パターンを有し得る。実際の非グリコシル化はまた、合成後のタンパク質の脱グリコシル化によって達成され得る。実施例12において議論されるように、脱グリコシル化は、化学的処理または酵素的処理によってであり得、そして完全に脱グリコシル化され得るか、または炭水化物構造の一部のみが除去される場合、部分的に脱グリコシル化される。
【0073】
(投与)
本発明に従って産生される標的治療剤は、任意の経路によって哺乳動物宿主に投与され得る。従って、適切な場合、投与は、経口または非経口(静脈内および腹腔内の投与経路を含む)であり得る。さらに、投与は、ボーラスの治療剤の周期的注射によってであり得るか、または外部であるレザバ(例えば、i.v.バッグ)からの静脈内投与または腹腔内投与によってより連続的になされ得る。特定の実施形態において、本発明の治療剤は、薬学的グレードであり得る。すなわち、特定の実施形態は、ヒトへの投与に必要とされる純度および品質管理の基準に適合する。獣医学的適用もまた、本明細書中で使用される意図される意味の中にある。
【0074】
本発明に従う治療剤の処方物(獣医学的使用およびヒト医療使用の両方のため)は、代表的に、このような治療剤を、それらに対する薬学的に受容可能なキャリアおよび任意の他の成分とともに含む。キャリアは、処方物の他の成分と適合性であり、そのレシピエントに対して有害でないという意味で、「受容可能」であり得る。これに関して、薬学的に受容可能なキャリアは、薬学的投与に適合性の、任意の全ての溶媒、分散媒体、コーティング、抗菌剤、抗真菌剤、等張剤、および吸収遅延剤などを含むことが意図される。薬学的に活性な物質に対するこのような媒体および薬剤の使用は、当該分野において公知である。任意の従来の媒体または薬剤が活性化合物と不適合である場合を除いて、組成物におけるその使用が、企図される。補助的な活性化合物(本発明に従って同定され、そして/または当該分野において公知である)もまた、組成物中に組み込まれ得る。処方物は、簡便には、投薬単位形態で存在し得、そして薬理学/微生物学の分野で周知のいずれかの方法によって調製され得る。一般的に、いくつかの処方物は、治療剤を、液体キャリアもしくは微細に分割された固体キャリアまたはその両方と関連させ、次いで、必要な場合、その生成物を所望の処方物に成形することによって調製される。
【0075】
本発明の薬学的組成物は、その意図される投与経路と適合性であるように処方される。投与経路の例としては、経口または非経口(例えば、静脈内投与、皮内投与、吸入投与、経皮(局所)投与、経粘膜投与、および直腸投与)が挙げられる。非経口適用、皮内適用、または皮下適用のために使用される溶液または懸濁液は、以下の成分を含み得る:滅菌希釈剤(例えば、注入のための水、生理食塩水、不揮発性油、ポリエチレングリコール、グリセリン、プロピレングリコールまたは他の合成溶媒);抗菌剤(例えば、ベンジルアルコールまたはメチルパラベン);抗酸化剤(例えば、アスコルビン酸または重亜硫酸ナトリウム);キレート剤(例えば、エチレンジアミン四酢酸);緩衝液(例えば、アセテート、シトレート、またはホスフェート)および張性の調節のための薬剤(例えば、塩化ナトリウムまたはデキストロール)。Phは、酸または塩基(例えば、塩酸または水酸化ナトリウム)によって調節され得る。
【0076】
経口投与または非経口投与のために有用な溶液は、例えば、Remington’s Pharmaceutical Sciences,(Gennaro,A編)、Mack Pub.,1990に記載される、薬学分野において周知の方法のいずれかによって調製され得る。非経口投与のための処方物はまた、頬投与のためのグリココレート、直腸投与のためのメトキシサリチレート、または膣投与のためのクツル酸(cutric acid)を含み得る。非経口調製物は、ガラスまたはプラスチックから作製されるアンプル、使い捨て可能シリンジまたは複数用量のバイアル内に封入され得る。直腸投与のための坐剤はまた、ココアバター、他のグリセリドまたは室温において固体であり、体温において液体である他の組成物のような非刺激性の賦形剤とその薬物を混合することによって調製され得る。処方物はまた、例えば、ポリアルキレングリコール(例えば、ポリエチレングリコール)、植物由来の油、水素化ナフタレンなどを含み得る。直接的投与のための処方物は、グリセロールおよび高い粘度の他の組成物を含み得る。これらの治療剤のための他の潜在的に有用な非経口キャリアとしては、エチレン−ビニルアセテートコポリマー粒子、浸透圧ポンプ、移植可能注入システム、およびリポソームを含み得る。吸入投与のための処方物は、賦形剤(例えば、ラクトース)を含み得るか、または例えば、ポリオキシエチレン−9−ラウリルエーテル、グリココレートおよびデオキシコレートを含む水溶液、または点鼻薬の形態での投与のための油状溶液、または経鼻的に適用されるゲルとしてであり得る。保持浣腸(retention enemas)はまた、直腸送達のために使用され得る。
【0077】
経口投与のために適切な本発明の処方物は、別個の単位の形態(例えば、カプセル、ゼラチンカプセル、サシェ剤(sachet)、錠剤、トローチ剤、またはロゼンジ)(各々が、所定量の薬物を含有する);粉末または顆粒の形態;水性液体または非水性液体の溶液または懸濁液の形態;あるいはo/wエマルジョンまたはw/oエマルジョンの形態であり得る。治療剤はまた、ボーラス、舐剤またはペーストの形態で投与され得る。錠剤は、必要に応じて、1つ以上の補助成分とともに、薬物を圧縮または調節することによって作製され得る。圧縮錠剤は、適切な機械において、薬物を自由流動形態(例えば、粉末または顆粒)で、必要に応じて、結合剤、潤滑剤、不活性希釈剤、界面活性剤または分散剤によって混合して、圧縮することによって調製され得る。成形された錠剤は、適切な機械において、粉末化薬物および不活性液体希釈剤で湿らされた適切なキャリアの混合物を成形することによって作製され得る。
【0078】
経口組成物は、一般的に、不活性希釈剤または食用キャリアを含む。経口治療投与のために、活性化合物は、賦形剤とともに組み込まれ得る。マウスウオッシュとしての使用のための流体キャリアを使用して調製された経口組成物は、流体キャリア中の化合物を含み、そして経口適用され、すすがれ(swished)、吐き出されるかまたは嚥下される。薬学的に適合性の結合剤、および/またはアジュバント物質は、組成物の一部として含まれ得る。錠剤、丸剤、カプセル剤、トローチ剤などは、以下の成分または類似の性質の化合物のいずれかを含み得る:結合剤(例えば、微結晶セルロース、トラガカントガムまたはゼラチン);賦形剤(例えば、スターチまたはラクトース);崩壊剤(例えば、アルギン酸、Primogel、またはコーンスターチ);潤滑剤(例えば、ステアリン酸マグネシウムまたはSterotes);滑り剤(glidant)(例えば、コロイド状二酸化ケイ素);甘味剤(例えば、スクロースまたはサッカリン);または矯味矯臭剤(例えば、ペパーミント、サリチル酸メチル、またはオレンジ矯味矯臭薬)。
【0079】
注射可能使用に適切な薬学的組成物は、滅菌水溶液(水溶性である場合)または分散液および滅菌注射可能溶液または分散液の即時の調製のための滅菌粉末を含む。静脈内投与のために、適切なキャリアとしては、生理学的生理食塩水、静菌水、Cremophor ELTM(BSAF,Parsippany,NJ)またはリン酸緩衝化生理食塩水(PBS)が挙げられる。全ての場合において、組成物は、滅菌であり得、そして容易な注射可能性が存在する程度に流体であり得る。これは、製造および保存の条件下で安定であり得、そして細菌および真菌のような微生物の混入作用に対して保護され得る。キャリアは、溶媒または分散媒体であり得、これには、例えば、水、エタノール、ポリオール(例えば、グリセロール、プロピレングリコール、および液体ポリエチレングリコールなど)、およびそれらの適切な混合物が挙げられる。適切な流動性は、例えば、コーティング(例えば、レシチン)の使用によって、分散液の場合、必要とされる粒子サイズの維持によって、そして界面活性剤の使用によって、維持され得る。微生物の作用の予防は、種々の抗菌剤および抗真菌剤(例えば、パラベン、クロロブタノール、フェノール、アスコルビン酸、チメロサールなど)によって達成され得る。多くの場合において、等張性剤(例えば、糖、ポリアルコール(例えば、マンニトール(manitol)、ソルビトール、および塩化ナトリウム))を組成物中に含むことが好ましい。注射可能組成物の長期吸収は、組成物中に、吸収を遅延させる薬剤(例えば、モノステアリン酸アルミニウムおよびゼラチン)を含むことによってもたらされ得る。
【0080】
滅菌注射可能溶液は、活性化合物を、上記に列挙された成分の一種またはその組み合わせを有する、適切な溶媒中に必要とされる量で取り込み、必要とされる場合、その後滅菌濾過することによって調製され得る。一般的には、分散物は、活性化合物を滅菌ビヒクル中に取り込むことによって調製され、この滅菌ビヒクルは、基本的な分散媒体および上記に列挙された成分からの必要とされる他の成分を含む。滅菌注射可能溶液の調製用の滅菌粉末の場合において、調製の方法としては、真空乾燥および凍結乾燥が挙げられ、この凍結乾燥は、活性成分と事前に滅菌濾過されたその溶液からの任意のさらなる所望成分との粉末を生じる。
【0081】
関節内投与に適切な処方物は、治療剤の滅菌水性調製物の形態であり得、これは、微結晶形態(例えば、水性微結晶懸濁液の形態)であり得る。リポソーム処方物または静分解ポリマー系はまた、関節内投与および眼動脈投与の両方のための治療剤(therapeutic)を提供するために使用され得る。
【0082】
局所投与に適切な処方物としては、液体または半液体の調製物(例えば、リニメント、ローション、ゲル、塗布剤(applicant))、クリーム、軟膏もしくはペーストのような水中油系エマルジョンもしくは油中水系エマルジョン;または点眼薬(drop)のような溶液もしくは懸濁液を含む、眼の治療薬(treatment)が挙げられる。皮膚表面への局所投与用の処方物は、治療剤を皮膚科学的に受容可能なキャリア(例えば、ローション、クリーム、軟膏または石鹸)を用いて分散させることによって調製され得る。いくつかの実施形態において、皮膚の上にフィルムまたは層を形成し得、塗布を局部に制限しそして除去を防止するキャリアが有用である。組織表面への付着が所望される場合、この組成物は、フィブリノゲン−トロンビン組成物または他の生物接着剤(bioadhesive)中に分散された治療剤が挙げられ得る。次いで、この治療剤は、着色され、噴霧されるかまたはそうでなければ所望の組織表面に塗布され得る。内部組織表面への局所投与のために、この薬剤は、液体組織接着剤または組織表面への吸着を増強することが公知の他の物質中に分散され得る。例えば、ヒドロキシプロピルセルロースまたはフィブリノゲン/トロンビン溶液が有利なように使用され得る。あるいは、組織コーティング溶液(例えば、ペクチン含有処方物)が使用され得る。
【0083】
吸入処置(例えば、喘息用)のために、噴霧缶、噴霧器、またはアトマイザーで投薬された粉末(自己推進処方物または噴霧処方物)の吸入が使用され得る。このような処方物は、粉末吸入デバイスからの肺投与のために微細に細分された散剤形態であり得るかまたは自己推進散剤投薬処方物であり得る。自己推進溶液および噴霧処方物の場合において、この効果は、所望の噴霧特性(すなわち、所望の粒子サイズを有する噴霧を生成し得る)を有する値の選択によってかまたは制御された粒子サイズの懸濁された粉末として活性成分を取り込むことによってかのいずれかで達成され得る。吸入による投与のために、治療剤はまた、圧力容器またはディスペンサーからのエアロゾル噴霧の形態で送達され得、この容器またはディスペンサーは、適切な推進剤(例えば、二酸化炭素のような気体)、または噴霧器を備える、点鼻薬(nasal drop)もまた、使用され得る。
【0084】
全身投与はまた、経粘膜手段または経皮手段によってであり得る。経粘膜投与または経皮投与のために、浸透されるべき関門に適切な浸透剤が、処方物中で使用され得る。このような浸透剤は、一般的には当該分野で公知であり、例えば、経粘膜投与用には洗浄剤、胆汁酸塩誘導体、およびフィルシディック酸(filsidic acid)誘導体が挙げられる。経粘膜投与は、鼻スプレーまたは坐剤の使用によって達成され得る。経皮投与のために、治療剤は、代表的には、一般的には当該分野で公知のような軟膏(ointment)、軟膏(salve)、ゲルまたはクリーム中に処方される。
【0085】
1つの実施形態において、治療剤は、キャリアと共に調製され、このキャリアは、身体からの迅速な排出に対して保護し、移植物およびマイクロカプセル化送達系を含む、制御された放出処方物のようなものである。生分解性で生体適合性のポリマー(例えば、酢酸エチレンビニル、ポリ無水物、ポリグリコール酸、コラーゲン、ポリオルトエステル、およびポリ乳酸)が使用され得る。このような処方物の調製のための方法は、当業者に明らかである。材料もまた、Alza CoporationおよびNova Pharmaceuticals Inc.から市販入手され得る。リポソーム懸濁物もまた、薬学的に受容可能なキャリアとして使用され得る。これらは、当業者に公知の方法(例えば、米国特許第4,522,811号に記載されるような方法)に従って調製され得る。ミクロソームおよびミクロ粒子もまた、使用され得る。
【0086】
経口組成物または非経口組成物は、投与の容易さおよび投薬の均一性のために、投薬単位形態で処方され得る。投薬単位形態とは、処置されるべき被験体のための単位投薬として適した、物理的に別々の単位のことをいう。各単位は、所望の治療効果をもたらすために計算された、所定の量の活性化合物を、必要とされる薬学的キャリアと結合させて含んでいる。本発明の投薬単位形態についての詳細は、活性化合物の特有の特性、達成されるべき特定の治療効果、個々の処置のための活性化合物のような化合物合成の分野に固有の制限存在によって決められ、そしてこれら直接依存する。
【0087】
一般的には、本発明に従って同定される治療剤は、ヒトまたは他の哺乳動物に、非経口投与または経口投与するために、例えば、治療有効量(例えば、所望の効果を誘導するのに十分な時間、標的組織に対して適切な濃度の薬物を提供する量)で処方され得る。さらに、本発明の治療剤は、単独でかまたは特定の疾患または目的の適応症に対して有益な効果を有することが知られている他の分子と組み合わせて投与され得る。例示のみの目的として、有用な補因子としては、症状緩和補因子(防腐薬、抗生物質、抗ウイルス薬、抗真菌薬および鎮痛薬および麻酔薬を含む)が挙げられる。
【0088】
治療剤組成物中に送達される、本発明に従って同定される治療剤の有効濃度は、因子(投与される薬物の最終的な所望投薬量および投与経路を含む)の数に依存して変化する。投与される好ましい投薬量はまた、疾患の型および程度または処置されるべき適応症、特定の患者の全体的な健康状態、送達される治療剤の相対生物学的効率、治療剤の処方、処方物中の賦形剤の存在およびその型、ならびに投与経路のような変数に依存するようである。いくつかの実施形態において、本発明の治療剤は、非ヒト霊長類およびゲッ歯類を使用する、前に記載した哺乳動物研究から推測された代表的な投薬単位を使用して、個体に提供され得る。上記のように、投薬単位とは、まとまっている(すなわち、患者に投与され得、そして容易に扱われて詰められ、治療剤それ自体または固体もしくは液体の薬学的希釈剤もしくはキャリアとの混合物のいずれかを含む、物理的にかつ生理学的に安定な単位用量のままである単用量)といわれる。
【0089】
特定の実施形態において、生物は、本発明に従って同定される治療剤を生成するために操作される。これらの生物は、採取のために治療剤を放出し得るか、または患者に直接導入され得る。別の一連の実施形態において、細胞は、本発明に従って同定される治療剤のキャリアとして作用するために利用され得る。
【0090】
本発明の治療剤はまた、「プロドラッグ」誘導体を含む。プロドラッグという用語は、親分子の薬理学的に不活性な(または部分的に不活性な)誘導体をいい、これは、活性成分を放出または活性化させるために、生物内で自発的または酵素的のいずれかで生体内変化を必要とする。プロドラッグは、本発明の治療剤の改変体または誘導体であって、これは、代謝条件下で切断可能な基を有している。プロドラッグは、本発明の治療剤となり、これは、これらが生理学的条件下で加溶媒分解を引き起こすかまたは酵素分解を引き起こす場合、インビボで薬学的に活性である。本発明のプロドラッグは、生物内の活性薬物成分を放出または活性化するのに必要な生体内変化段階の数に依存してシングル、ダブル、トリプルなどと呼ばれ得、これは、前駆体型形態で存在する官能基の数を示している。プロドラッグ形態は、しばしば、可溶性、組織適合性、または哺乳動物生物中で遅れた放出の利益を供与する(Bundgard,Design of Prodrugs,pp.7−9,21−24,Elsevier,Amsterdam 1985およびSilverman,The Organic Chemistry of Drug Design and Drug Action,pp.352−401,Academic Press,San Diego,Calif.,1992を参照のこと)。さらに、本発明に従うプロドラッグ誘導体は、他の特徴とあわされてバイオアベイラビリティーを増強し得る。
【実施例】
【0091】
(実施例1.構築物を発現する融合タンパク質)
本発明の治療用タンパク質融合物を発現するための核酸構築物は、当該分野で公知の方法に従って組み換え的に作製され得る。例えば、本明細書中に記載される、異なる成分をコードする遺伝子に相補的なオリゴヌクレオチドを使用して、合成遺伝子が作製され得るかまたは天然遺伝子および構築物遺伝子融合物を増幅し得る。好ましい実施形態において、本発明のタンパク質は、シグナル配列を含む組換え遺伝子から発現される。有用な核酸の例としては、本発明の部分を標的化するIGFをコードする核酸が挙げられる。このような核酸は、図3に示されるIGF−1の配列に基づき得る。
【0092】
(実施例2.発現方法および精製方法)
発現産物はまた、他のLeishmania種を含む他の原生動物亜界を使用して、血漿を含まない培地から単離され得る。一般的には、発現株は、血漿を含む培地中で増殖され、血漿を含まない培地中に希釈され、そしていくつかの世代(好ましくは2〜5世代)成長させて、その後発現産物を単離する。例えば、分泌された組換えLSDタンパク質生成物は、Leishmania mexicanaプロマスティゴートから単離され得、これは、27℃にて、75cm2のフラスコ中の1×M199培地(50mL)中でまず培養される。細胞密度が1〜3×107/mLに達すると、この培養物を使用して1.2LのM199培地を播種する。この培養物の密度が約5×l06/mLに達すると、細胞を遠心分離によって収集し、180mLの上清中に再懸濁し、そしてこれを使用して、16Lのスピナーフラスコ中の12Lの「Zima」培地を播種した。この培養物の最初の細胞密度は、代表的には、約5×105/mLである。この培養物を、約1.0〜1.7×10e7細胞/mLの密度まで増殖する。この細胞密度が達成されると、細胞を遠心分離によって培養培地から分離し、そして上清を0.2μのフィルターを介して4℃で濾過し、残りのプロマスティゴートを除去する。濾過した培地を、タンジェンシャル流濾過デバイス(MILLIPORE Prep/Scale−TFFカートリッジ)を使用して、12.0L〜500mLまで濃縮した。
【0093】
この方法に好ましい増殖培地は、M199および「Zima」増殖培地である。しかし、他の血清含有培地および血清を含まない培地も有用である。M199増殖培地は、以下のとおりである:(1Lバッチ)=200mLの5×M199(フェノールpH指示薬を含む)(5倍で混合される)+637mLのH2O、50.0mLのFBS、50.0mLのEF、20.0mLの50g/mL SAT、2.0mLの50%トリエタノールアミン中の0.25%ヘミン、50mMのHepes(pH7.5)中の10mMアデニン(10mL)、40.0mLの1M Hepes(pH7.5)、1mLの95%エタノール中の0.1%ビオチン、10.0mLのペニシリン/ストレプトマイシン。使用される全ての血清は、熱によって不活性化される。最終容積は1Lであり、滅菌濾過される。「Zima」改変M199培地は、以下の通りである:(20.0Lバッチ)=217.8gのM199粉末(−)フェノールレッド+7.0gの炭酸水素ナトリウム、50mMのHepes(pH7.5)中の200.0mLの10mMアデニン、800.0mLのHepesを含まない酸(pH7.5)、20.0mLの95%エタノール中の0.1%ビオチン、200.0mLのペニシリン/ストレプトマイシン、2780.0mLのH2O。最終濃度は20.0Lであり、滅菌濾過される。
【0094】
本発明の1つの局面に従って、Leishmaniaから分泌され、末端マンノース残基を有する炭水化物を含有するLSDタンパク質は、以下のように精製され得る。例えば、プラスミドpXSAP0−GUSを含有する、Leishmania mexican由来の組換えβ−グルクロニダーゼは、少量の血清タンパク質を含むM199培養培地中で増殖された。この培養物が>1.0×107プロマスティゴート/mLの密度に達すると、L.mexicanを遠心分離(10分間、500×g)によって除去した。採取された培養培地を0.2μmのフィルターを通過させ、微粒子を除去し、その後コントロールカナバリンA(ConA)−アガロースカラム(4%架橋されたビーズのアガロース、Sigma)上に直接充填した。このConA−アガロースカラムを、1MのNaCl、20mMのTris(pH7.4)、CaCl2、MgCl2およびMnCl2(各5mM)で予め処理し、その後、5容量のカラム緩衝液(20mMのTris(pH7.4)、1mMのCaCl2、および1mMのMnCl2)で平衡化した。培養培地中の(2L中の)GUS活性の全ての179,800単位(nmol/時間)を、22mLのConAアガロースカラム上に充填した。フロースルーまたは洗浄中に、活性は検出されなかった。このGUS活性を、200mMのメチルマンノピラノシドを含有するカラム緩衝液で溶出した。活性ピークを含む溶出された画分をプールし、そして濃縮した:143900単位のGUS活性を、カラムから回収した(カラムに負荷された活性の80%を回収)。このことは、L.mexicanaから分泌される組換えβ−GUSが、末端マンノース残基を有する炭水化物を保有し、そしてさらに親和性精製工程のための基礎として、マンノースのConAとの相互作用を使用するための可能性を指摘することを示す。従って、高いマンノース炭水化物の存在は、レクチンアフィニティークロマトグラフィーを使用する組換えLSDタンパク質の精製におけるアフィニティー工程の基礎として作用し得る。
【0095】
(実施例3.血液脳関門を通過するアッセイ)
本発明に従って、IGFタグで誘発されたタンパク質(特に、LSDタンパク質)が、血液脳関門を通過するかどうかを決定するために有用なモデル系は、MPSVIIマウスモデルである(WolfeおよびSands(1996)Protocols for Gene Transfer in Neuroscience:Towards Gene Therapy of Neurological Disorders Chapter 20:263−273)。例えば、IGFタグに融合された組換えヒトβグルクロニダーゼは、任意の都合の良い発現系(例えば、Leishmania、酵母、哺乳動物、バキュロウイルスおよび他の発現系)において産生され得る。β−GUSを発現し、分泌するL.mexicanaは、100mlの標準的プロマスティゴート培地(40mM HEPES(pH7.5)、0.1mMアデニン、0.0005%ヘミン、0.0001%ビオチン、5%ウシ胎仔血清、5%胎芽液(embryonic fluid)、50単位/mlペニシリン、50μg/mlストレプトマイシンおよび50μg/ml ノーセオトリシン(nourseothricin)を含むM199)において26℃で増殖される。約5×106 プロマスティゴート/mlの密度に到達した後、プロマスティゴートを、室温にて1000×gで、10分間遠心分離することによって回収し;これらのプロマスティゴートを、室温で1Lの低タンパク質培地(0.1mMアデニン、0.0001%ビオチン、50単位/mlペニシリンおよび50μg/mlストレプトマイシンを補充したM199)に播種するために使用した。1L培地を、滅菌攪拌子を含む2Lの蓋付きフラスコに入れ、それによって、穏やかに攪拌しながら26℃でインキュベートし得る。1Lの培養物を、層流フード移動させ、蓋を取り外し、そして蓋を交換する前に、勢いよくかき混ぜることによって1日に2回通気する。培養が、2〜3×107プロマスティゴート/mlの密度に達する場合、培養物を、プロマスティゴートペレットを捨て、培地を滅菌フラスコに注いだ以外は、上記されるように遠心分離する。1L当たり434gの(NH4)2SO4の添加によって、培地から活性GUSタンパク質を沈殿させ;塩析培地を、4℃で一晩保存する。沈殿したタンパク質を、10,500×gで30分の遠心分離またはGelman Supor−800膜を通しての濾過のいずれかによって回収し;タンパク質を、10mM Tris(pH8)、1mM CaCl2中に再懸濁し、透析まで−80℃で保存する。数Lの培地からの粗調製物を、解凍し、プールし、透析チューブ(Spectra/Por−7、MWCO 25,000)中に配置し、そして重炭酸塩を含むDMEM(Dulbecco改変Eagle培地)の1L容量の2つに対して、一晩透析する。硫酸アンモニウム画分を、ConAカラム上でさらに精製する。
【0096】
B6.C−H−2bml/ByBIR−gusmps/+マウスの異型交配によって作製されたGUSマイナスマウスを、酵素置換治療におけるGUS−IGF融合タンパク質または誘導体の効果を評価するために使用する。2つの形式を使用する。1つの形式において、3〜4匹の動物に、100μlの酵素希釈緩衝液(150mM NaCl、10mM Tris(pH7.5))中の20,000Uの酵素の単回注射を与える。マウスを、72〜96時間後に殺傷し、治療の効力を評価する。第2の形式において、マウスに、3〜4週間にわたって毎週、20,000単位の注射を与え、そして最終注射の1週間後に、このマウスを殺傷する。肝臓、脾臓および脳の組織化学的分析および組織病理学的分析を、刊行された方法によって実施する。治療の非存在下において、GUSマイナスマウスの細胞(例えば、マクロファージおよびKupffer細胞)は、リソソーム中の老廃物の蓄積に由来する大きな細胞内蓄積区画を作り出す。本発明のGUS融合構築物で処置されたマウス中の細胞において、光学顕微鏡でもはや可視ではないまで、これらの区画のサイズは、視覚的に減少されるか、または区画が縮小されることが予想される。
【0097】
本発明に従うと、新生マウスは、完全な血液脳関門を保有しない。しかし、15日目までに、血液脳関門は、β−グルクロニダーゼが、脳においてもはや検出され得ない点まで形成される。従って、上記実験は、好ましくは、15日目以上であるマウスに対して実施される。
【0098】
本発明の1つの実施形態に従って、実験は、まず、完全なIGF−IタグおよびIGF−IIタグの血液脳関門を超えてタンパク質を指向する能力を評価する。次に、レセプターまたはIGF結合タンパク質の結合を破壊するタンパク質の特異的変異バージョンを、アッセイする。ドメイン交換について、IGF−II(成熟タンパク質の残基1〜28)のBドメインは、血液脳関門G11およびT16を超えて輸送を変更することが考えられ得るIGF−Iとほんの2つの差異を含む。IGF−IIにおいてこれらの残基を変更することは、本質的にドメインBの交換である。IGF−IIの残基28および41とIGF−Iの対応する領域との間の領域の別の交換もまた、試験され得る。これは、2つのタンパク質の最も分岐した領域を含む、2つのタンパク質のCドメインを本質的に交換する。代替的交換は、C末端の15残基をIGF−Iの対応する領域と切り替える。これらの3つのキメラは、IGF−IとIGF−IIとの間の血液脳関門を超える取り込みの差異が、2つのタンパク質の間の配列の差異/構造の差異とどのように相関するかの本質的に完全な図を提供する。
【0099】
(実施例4.脳またはCNS中のタンパク質の蓄積についてのアッセイ)
放射性アッセイは、タンパク質産物の脳中での蓄積をモニターするために使用され得る。例えば、脳実質中の放射標識されたタンパク質の取り込みおよび蓄積を、ReinhardtおよびBondy(1994)Endocrinology 135:1753−1761に開示されるようにアッセイし得る。
【0100】
酵素アッセイを、脳中のタンパク質産物の蓄積をモニターするためにまた使用し得る。酵素アッセイは、治療タンパク部分が、組織化学染色に適用可能なアッセイのための酵素である場合、特に有用である。リソソーム蓄積疾患タンパク質に対して有用な酵素アッセイは、Slyら、(2001)P.N.A.S.98(5):2205−2210およびWolfeおよびSands(1996)Protocols for Gene Transfer in Neuroscience:Towards Gene Therapy of Neurological Disorders Chapter 20:263−273に開示されるアッセイが挙げられる。
【0101】
(実施例5.インビボ療法)
B6.C−H−2bml/ByBIR−gusmps/+マウスの異型交配によって作製されたGUSマイナスマウス(Birkenmeier,Davissonら、1989)を、酵素置換治療における本発明の組成物の有効性を評価するために使用する。2つの形式を使用する。1つの形式において、3〜4匹の動物に、100μlの酵素希釈緩衝液(150mM NaCl、10mM Tris(pH7.5))中の20,000Uの酵素の単回注射を与える。マウスを、72〜96時間後に殺傷し、治療の効力を評価する。第2の形式において、マウスに、3〜4週間にわたって毎週、20,000単位の注射を与え、最後の注射の1週間後、このマウスを殺傷する。肝臓、脾臓および脳の組織化学的分析および組織病理学的分析を、刊行された方法(Birkenmeier,Barkerら、1991;Sands,Voglerら、1994;Daly,Voglerら、1999)によって実施する。治療の非存在下において、GUSマイナスマウスの細胞(例えば、マクロファージおよびKupffer細胞)は、リソソーム中の老廃物の蓄積に由来する大きな細胞内蓄積区画を作り出す。本発明の組成物で処置されたマウス中の細胞において、光学顕微鏡でもはや可視ではないまで、これらの区画のサイズは、視覚的に減少されるか、または区画が縮小されることが予想される。
【0102】
同様に、リソソーム蓄積性疾患を有するヒトは、彼らのCNSに対して(特に、CNS内のリソソームに対して)適切な治療部分を標的化する構築物を使用して処置される。いくつかの例において、処置は、本発明の融合タンパク質の規則的な注射形態(例えば、1週間に1回)をとる。他の例において、処置は、融合タンパク質を持続的にインビボ発現させるために核酸を投与することによってか、または患者において融合タンパク質を発現する細胞(例えば、ヒト細胞、または単細胞生物)の投与によって、達成される。例えば、本発明のタンパク質は、2000年2月1日に発行された米国特許第6,020,144号および2001年11月30日に出願されたPCTシリアル番号PCT/US01/44935に記載されるようにLeishmaniaベクターを使用して、インサイチュで発現され得る。
【0103】
(実施例6.酵素アッセイ)
GUS活性に対するアッセイを、実施例3に記載されるように、および/または下記されるように実施する。
【0104】
ガラスアッセイチューブを、3連で番号付けし、100μLの2×GUS反応混合液を、各チューブに添加する。2×GUS反応混合液を、100mgの4−メチルウンベリフェリル−β−Dグルクロニドを14.2mLの200mM酢酸ナトリウムに添加し、酢酸を用いてpHを4.8に調整することによって調製する。100μLまでのサンプルを、各チューブに添加し;水を、200μLの最終反応容量に添加する。反応チューブを、パラフィルムで覆い、37℃の水浴で1〜2時間インキュベートする。反応を、1.8mLの停止緩衝液(10.6gのNa2CO3および12.01gのグリシンを、最終容量500mLの水に溶解し、pHを10.5に調整し、そして反復ディスペンサー中に濾過滅菌することによって調製する)の添加によって停止する。次いで、蛍光光度計を、ブランクとして2mLの停止溶液を使用して較正し、蛍光を、残りのサンプルから読み取る。標準曲線を、2mLの最終容量の停止緩衝液中、1、2、5、10、および20μLの166μMの4−メチルウンベリフェロン標準を使用して調製する。
【0105】
4−メチルウンベリフェロン標準溶液を、2.5mgの4−メチルウンベリフェロンを1mLのエタノール中に溶解し、99mLの滅菌水を添加することによって調製し、約200nmol/mLの濃度を得る。正確な濃度を、分光光度的に決定する。360nmでの吸光係数は、19,000cm−1M−1である。例えば、100μLを、900μLの停止緩衝液に添加し、360nmの吸光度を読み取る。読み取りが、0.337である場合、標準溶液の濃度は、0.337×10(希釈)/19,000=177μMであり、次いで、これを、適切な量の滅菌水の添加によって166μMに希釈し得る。
【0106】
(実施例7.哺乳動物細胞におけるタンパク質産生)
(CHO細胞)
1つの例において、GUS−GILTΔ1−7(N末端7アミノ酸の欠失を有するIGF−II標的化部分)およびGUSΔC18−GILTΔ1−7(GUSΔC18が、GILTΔ1−7のN末端に融合された融合タンパク質)を、Ulmasovら、(2000)PNAS 97(26):14212−14217の系を使用してCHO細胞中で発現した。適切な遺伝子カセットを、pCXNベクターのEcoRI部位に挿入し、これを、0.4cmキュベット中、50μFおよび1,200VでCHO細胞中にエレクトロポレートした。コロニーの選択および増幅を、2〜3週間、400μg/mLのG418によって媒介した。CHO細胞を、15% FBS、1.2mM グルタミン、50μg/mL プロリン、および1mM ピルビン酸を補充したMEM培地中に伝播した。酵素産生のために、細胞を、多層フラスコにおいてMEM中にプレートした。一旦、細胞がコンフルエンスに達すると、回収培地(2% FBS、1.2mM グルタミンおよび1mM ピルビン酸を補充したWeymouth培地)を細胞に適用した。分泌された組換え酵素を含む培地を、24〜72時間ごとに回収した。GUS−GILTΔ1−7細胞株に対する代表的な分泌レベルは、4000〜5000単位/mL/24時間であった。
【0107】
多くのGUSΔC18−GILTΔ1−7 CHO株を、産生された分泌酵素の量についてアッセイした。6つの最大産生体は、8600と14900単位/mL/24時間との間で分泌した。この最大産生株を、タンパク質の回収のために選択した。
【0108】
(HEK 293細胞)
GUS−GILTカセットを、HEK 293細胞中での発現のためにpCEP4(Invitrogen)にクローン化した。使用されたカセットは、野生型GUS−GILT;GUS−GILTΔ1−7;GUS−GILTY27L;GUSΔC18−GILTΔ1−7;GILTY27L、およびGUS−GILTF19S/E12Kを含んだ。
【0109】
HEK 293細胞を、4mM グルタミンおよび10% FBSを含むDMEM培地を含む12ウェルプレート中で、50〜80%のコンフルエンシーまで培養した。細胞を、製造業者によって記載されるようにFuGENE6(Roche)を使用して、pCEP−GUS−GILT DNAプラスミドでトランスフェクトした。1ウェル当たり、0.5μg DNAおよび2μLのFuGENE 6を、添加した。細胞を、トランスフェクションから2〜3日後、トリプシンを使用してウェルから除去し、次いで、100μg/mL ハイグロマイシンを含む上記DMEM培地を含むT25cm2の培養フラスコ中で培養し、トランスフェクトされた細胞の安定な集団を選択した。ハイグロマイシンを含有する培地を、2〜3日毎に交換した。この培養物を、1〜2週間以内にT75cm2培養フラスコに拡大した。酵素産生について、細胞を、多層フラスコにおいて、DMEM中にプレートした。一旦、細胞がコンフルエンスに達すると、回収培地(2% FBS、1.2mM グルタミンおよび1mM ピルビン酸を補充したWeymouth培地)を細胞に適用した。この培地を、CHO細胞について最適化したが、293細胞について最適化しなかった。従って、HEK 293株を用いた分泌レベルは、代替の培地において有意により高いことが示され得る。
【0110】
分泌された酵素のレベルを、表2に示す。
【0111】
(表2)
【0112】
【表4】
(実施例8.GUS融合タンパク質の精製)
クロマトグラフィー(従来のクロマトグラフィーおよびアフィニティークロマトグラフィーを含む)を、使用し、GUS融合タンパク質(例えば、GUS−GILT融合タンパク質および本発明の他の融合タンパク質)を精製し得る。
【0113】
(従来のクロマトグラフィー)
Leishmaniaにおいて産生されるGUS融合タンパク質を精製するための1つの手順を、実施例2に記載する。代替的手順を、以下のパラグラフに記載する。
【0114】
GUS−GILT融合物を発現するLeishmania mexicana細胞株由来の培養上清を、収集し、遠心分離し、そして0.2μのフィルターを通過させて、細胞細片を取り除いた。この上清を、100,000分子量のカットオフを有する接線限外濾過を使用して濃縮し、−80℃にて保存した。濃縮した上清を、ビーズ状アガロースに固定化されたConcanavalin A(ConA)を含むカラムに直接充填した。このカラムを、ConAカラム緩衝液(50mM Tris(pH7.4)、1mM CaCl2、1mM MnCl2)で洗浄し、その後、ConAカラム緩衝液中、マンノシル化されたタンパク質(GUS−GILT融合物を含む)を、0〜0.2Mメチル−α−D−ピラノシドの勾配を使用して溶出した。グルクロニダーゼ活性を含む画分をプールし、濃縮し、そしてその緩衝液を、次のカラムのための調製において、SPカラム緩衝液(25mMリン酸ナトリウム(pH6)、20mM NaCl、1mM EDTA)に交換した。濃縮した画分を、同じ緩衝液で平衡化されたSP高速カラムに充填し、そしてこのカラムを、さらなるSPカラム緩衝液で洗浄した。そのGUS−GILT融合物を、以下の2工程でこのカラムから溶出した:1)0〜0.15Mグルクロン酸の勾配(25mMリン酸ナトリウム(pH6)および10%グリセロール中)、続いて、0.2Mグルクロン酸の勾配(25mMリン酸ナトリウム(pH6)、10%グルセロール)。グルクロニダーゼ活性を含む画分をプールし、そしてその緩衝液を、20mMリン酸カリウム(pH7.4)に交換した。これらのプールした画分を、同じ緩衝液で平衡化したHA過剰ゲル(ultrogel)カラムに充填した。そのGUS−GILT融合タンパク質を、リン酸緩衝液の漸増勾配(145〜340mMリン酸カリウム(pH7.4))で溶出した。グルクロニダーゼ活性を含む画分をプールし、濃縮し、そして25%グリセロールを含む20mM Tris(pH8)中で−80℃にて保存した。
【0115】
哺乳動物細胞中で産生されるGUS−GILT融合タンパク質を精製するための簡便なクロマトグラフィー方法は、以下のパラグラフにおいて記載される。
【0116】
GUS−GILT融合タンパク質を過剰発現する哺乳動物細胞を、Nunc Triple Flasks中でコンフルーエンシーになるまで増殖させ、次いで、2%ウシ胎仔血清を補充した無血清培地(Waymouth MB 752/1)を供給して、精製のための酵素を収集する。この培地を収集し、そしてフラスコに、24時間間隔で再供給する。数個のフラスコからの培地をプールし、そして5000×gにて20分間、4℃にて遠心分離し、分離された細胞などを取り除く。この上清を取り除き、そしてアリコートを、β−GUSアッセイ用に採取する。ここで、この培地を、精製のために直接使用し得るかまたは後の使用のために−20℃にて凍結させ得る。
【0117】
1Lの分泌培地を、37℃にて解凍し(凍結している場合)、0.2μフィルターを通して濾過し、そして4Lのビーカーに移す。この培地の容量を、3Lのdd水を加えることによって4倍に希釈し、塩濃度を低下させる;この希釈培地のpHを、1M Tris塩基を使用して9.0に調整する。10mM Tris(pH9.0)で予め平衡化された50mLのDEAE−Sephacelをこの希釈培地に加え、そして4℃にて2時間、大きい撹拌棒を用いてゆっくりと攪拌する(小さいアリコートを取り除き、微量遠心し(microfuge)、そしてその上清をアッセイして、結合をモニタリングする)。結合が完了した際に、その樹脂を、フリットガラス漏斗によって収集し、そしていくつかのバッチにおいて、750mLの10mM Tris(pH9.0)で洗浄する。この樹脂を、2.5cmカラムに移し、そして120mL/時間の流速にて、さらに750mLの同じ緩衝液で洗浄する。そのDEAEカラムを、0〜0.4M NaCl(10mM Tris(pH9.0)中)の線形勾配で溶出する。そのGUS−GILT融合タンパク質を含む画分を、4−メチルウンベリフェリル−β−D(4−methylumbelliferyl−β−D)グルクロニドアッセイによって検出し、プールし、そして25mM Tris(pH8)、1mM β−グリセロールホスフェート、0.15M塩化ナトリウムで平衡化されたSephacryl S−200の600mLカラムに充填し、そして同じ緩衝液で溶出する。
【0118】
そのGUS−GILT融合タンパク質を含む画分をプールし、そして3×4Lの25mM酢酸ナトリウム(pH5.5)、1mM β−グリセロールホスフェート、0.025%アジ化ナトリウムで透析する。透析した酵素を、36mL/時間の流速にて、25mM酢酸ナトリウム(pH5.5)、1mM β−グルセロールホスフェート、0.025%アジ化ナトリウムで平衡化されたCM−Sepharoseの15mLカラムに充填する。次いで、このカラムを、10カラム容量のこの同じ緩衝液で洗浄する。このCMカラムを、平衡緩衝液中、0〜0.3M塩化ナトリウムの線形勾配で希釈する。そのGUS−GILT融合タンパク質を含む画分をプールし、そして48mL/時間の流速にて、10mM Tris(pH7.5)、1mM β−クリセロールホスフェート、0.15M NaClで平衡化されたSephacryl S−300の2.4×70cm(ベッド容量=317mL)カラムに充填する。その融合タンパク質を含む画分をプールし;そのプールを、GUS活性およびタンパク質濃度についてアッセイして、比活性を決定する。アリコートにSDS−PAGEを行い、その後、クマシー染色または銀染色を行って、純度を確認する。より高濃度の酵素が必要とされる場合、XM−50膜(50,000分子量カットオフ)またはCentricon C−30ユニット(30,000分子量カットオフ)を備えるAmicon Ultrafiltration Unitsを使用して、その融合タンパク質を濃縮し得る。この融合タンパク質を、10mM Tris(pH7.5)、1mM β−グルセロールホスフェートナトリウム、0.15M NaCl緩衝液中、−80℃にて保存する。
【0119】
(アフィニティークロマトグラフィー)
アフィニティークロマトグラフィー条件は、本質的に、Islamら(1993)J.Biol.Chem.268(30):22627−22633に記載される通りである。GUS−GILT融合タンパク質を過剰発現する哺乳動物細胞由来の馴化培地(従来型のクロマトグラフィーについて上記されるように、収集および遠心分離される)を、0.22μフィルターを通して濾過する。塩化ナトリウム(結晶性)を、0.5Mの最終濃度になるまで加え、そして1/400容量の10%ストック溶液を加えることによって、アジ化ナトリウムを0.025%の最終濃度になるまで加える。この培地を、抗ヒトβ−グルクロニダーゼ−Affigel 10(Antibody Sepharose Wash Buffer:10mM Tris(pH7.5)、10mMリン酸カリウム、0.5M NaCl、0.025%アジ化ナトリウムで予め平衡化されている)の5mLカラムに、25mL/時間の速度で4℃にて適用する。画分を収集し、そしてフロースルーで、任意のGUS活性についてモニタリングする。このカラムを、36mL/時間にて、10〜20カラム容量のAntibody Sepharose Wash Bufferで洗浄する。画分を収集し、そしてGUS活性についてモニタリングする。このカラムを、36mL/時間にて、10mMリン酸ナトリウム(pH5.0)+3.5M MgCl2(50mL)で溶出する。4mLの画分を収集し、そしてGUS活性についてアッセイする。融合タンパク質を含む画分をプールし、等容量のP6緩衝液(25mM Tris(pH7.5)、1mM β−グリセロールホスフェート、0.15mM NaCl、0.025%アジ化ナトリウム)で希釈し、そしてBioGel P6カラム(P6緩衝液で予め平衡化されている)に通して脱塩して、MgCl2を取り除き、この緩衝液を、保存用のP6緩衝液に交換する。その融合タンパク質を、P6緩衝液で溶出し、GUS活性を含む画分をプールし、そしてこのプールした画分を、GUSアッセイおよびタンパク質についてアッセイする。クマシーブルー染色または銀染色によって染色されたSDS−PAGEゲルを使用して、純度を確認する。この融合タンパク質を、長期間の安定性のために、P6緩衝液中で−80℃にて凍結して保存する。
【0120】
(実施例9.哺乳動物産生タンパク質に対する取り込み実験)
GUS構築物またはGUS−GILT構築物を産生するHEK293細胞株またはCHO細胞株由来の培養物上清を、0.2μmフィルターを通して収集して、細胞を取り除いた。GM 4668線維芽細胞を、5% CO2中37℃にて15%(v/v)ウシ胎仔血清を補充したDMEM中、12ウェルの組織培養プレートで培養した。細胞を、取り込み培地(DMEM+2% BSA(Sigma A−7030))で、37℃にて1回洗浄した。次いで、線維芽細胞を、取り込み培地1mLあたり1000〜4000単位の酵素とともに培養した(3〜21時間)。数回の実験において、取り込みのための競合物(competitor)を加えた。マンノース−6−ホスフェート(Calbiochem 444100)を、2〜8mMの濃度にていくつかの培地に加え、そして純粋な組換えIGF−II(Cell Sciences OU100)を、2.86mMの濃度にて、いくつかの培地に加えた。これは、投入酵素の量に依存して、10〜100倍のモル過剰を表した。取り込みを、代表的に、三重のウェルで測定した。
【0121】
インキュベーション後、この培地をウェルから取り出し、そしてGUS活性について、二重でアッセイした。ウェルを、1mLの37℃リン酸緩衝化生理食塩水で5回洗浄し、次いで、0.2mLの溶解緩衝液(10mM Tris(pH7.5)、100mM NaCl、5mM EDTA、および1% NP−40)中、室温にて15分間インキュベートした。細胞溶解物を、微量遠心管に移し、そして13,000rpmにて5分間回転させて、細胞細片を取り除いた。標準的な蛍光比色アッセイを使用して、溶解物の10μLの2つのアリコートを、GUS活性についてアッセイした。溶解物の、10μLの3つのアリコートを、タンパク質濃度についてアッセイした(Pierce Micro BCAタンパク質アッセイ、Pierce,IL)。
【0122】
初期実験は、CHO産生GUS−GILTΔ1−7の取り込みを、CHO産生GUSΔC18−GILTΔ1−7の取り込みと比較した。表3に示されるように、このGUSΔC18−GILTΔ1−7タンパク質(これは、潜在的なプロテアーゼ切断部位を排除するように操作された)は、IGF−IIおよびM6Pによって阻害され得る取り込みレベルよりも、有意に高い取り込みレベルを有する。対照的に、IGF−IIタグを欠損した、哺乳動物細胞において産生される組換えGUSの取り込みは、過剰なIGF−11の存在によって影響を受けなかったが、過剰なM6Pによって完全に無効にされた。この実験において、取り込みを18時間行った。
【0123】
(表3)
【0124】
【表5】
引き続く実験は、MPSVII患者由来のヒト線維芽細胞によるCHO産生酵素およびHEK293産生酵素の取り込みを評価した。この実験において、取り込みは21時間であった。
【0125】
(表4)
【0126】
【表6】
さらなる実験は、IGF−II、8mM M6P、または両方のインヒビターの存在下での選択された酵素の取り込みを評価した。取り込みを22.5時間の期間にわたって測定した。
【0127】
(表5)
【0128】
【表7】
上記の実験は、CHO産生系およびHEK293産生系が、機能的な組換えタンパク質を分泌する能力において、本質的に等しいことを示している。この実験はまた、過剰なIGF−IIの存在が、タグ化タンパク質の取り込みを70〜90+%減少させるが、非タグ化タンパク質(4.5%)の取り込みに顕著に影響を与えないことを示している。これは、哺乳動物産生タンパク質の特異的なIGF−II媒介取り込みを示している。Leishmania産生タンパク質とは異なり、哺乳動物細胞において産生される酵素は、M6Pを含むと予測される。M6P/IGF−IIレセプターを介して取り込みを指向する能力を有するこれらのタンパク質上の2つのリガンドの存在は、過剰なIGF−IIも過剰なM6Pのいずれもが完全に取り込みを無効にするはずがないことを意味する。さらに、これら2つのリガンドは、そのレセプター上の別々の位置に結合するので、1つのリガンドを介するこのレセプターへの結合は、過剰な他の競合物の存在によって顕著に影響を受けるはずがない。
【0129】
線維芽細胞上での、M6P/IGF−IIレセプターへのGUS−GILTタンパク質の結合を測定し、そしてその取り込み速度を、公開された方法(Yorkら(1999)J.Biol.Chem.274(2):1164−71)と同様に評価する。上記のように、12ウェルの培養皿で培養したGM4668線維芽細胞を、血清を含まない氷冷培地(1% BSAを含む)中で洗浄する。リガンド(GUS、GUS−GILTもしくはGUS−ΔGILT、またはコントロールタンパク質のいずれか)を、血清を含まない冷培地(+1% BSA)中、細胞に加える。リガンドの添加の際に、このプレートを、30分間氷上でインキュベートする。30分後、リガンドを取り除き、そして細胞を、氷冷培地で、迅速に5回洗浄する。0時点のウェルに、1mlの氷冷ストリッピング(stripping)緩衝液(0.2M酢酸(pH3.5)、0.5M NaCl)を入れる。次いで、このプレートを、37℃の水浴中で浮遊させ、そして0.5mlの予熱培地を加えて、取り込みを開始する。停止点毎に、1mlのストリッピング緩衝液を加える。実験が終了した際に、このストリッピング緩衝液のアリコートを、実施例3に記載されるように、β−グルクロニダーゼ活性の蛍光比色アッセイのために保存する。次いで、細胞を上記のように溶解し、そしてこの溶解物を、β−グルクロニダーゼ活性についてアッセイする、あるいは、免疫学的方法を使用して、標的化された治療タンパク質の存在についてこの溶解物を試験し得る。
【0130】
GUS−GILTは、一旦温度が37℃にシフトすると、数分足らずで線維芽細胞によって迅速に取り込まれ(Yorkら(1999)J.Biol.Chem.274(2):1164−71)、そしてその酵素活性は、長時間にわたってこの細胞内で持続すると、予測される。
【0131】
(実施例10.インビボ治療)
最初に、GUSを含まないマウスを使用して、酵素置換療法におけるGUS−GILTおよびそれらの誘導体の有効性を評価し得る。GUSを含まないマウスを、Birkenmeierら(1989)J.Clin.Invest83(4):1258−6によって記載されるように、B6.C−H−2bml/ByBIR−gusmps/+マウスのヘテロ接合性交配によって作製する。好ましくは、このマウスは、ヒトβ−GUSに対して耐性である。このマウスは、ヒトβ−GUSの欠損コピーを有するトランスジーンを保有し、ヒトタンパク質に対する免疫耐性を誘導し得る(Slyら(2001)PNAS 98:2205−2210)。あるいは、ヒトβ−GUS(例えば、GUS−GILTタンパク質)を新生マウスに投与して、免疫耐性を誘導し得る。しかし、血液脳関門はマウスにおいて約15日目まで見出されないので、15日齢より上のマウスにおいて注射を開始した場合、GILT−GUSが血液脳関門を通過するか否かを決定することは、より簡単である;従って、トランスジェニックマウスが好ましい。
【0132】
最初の実験は、標的化された治療用タンパク質の組織分布を決定することである。少なくとも3匹のマウスに、CHO産生GILTタグ化β−GUSタンパク質(本明細書中でGUSΔC18−GILTΔ1−7と呼ばれ、ここで、GUSΔ18(タンパク質の最後の18のアミノ酸を欠失しているβ−GUSタンパク質)は、Δ1−7GILT(成熟タンパク質の最初の7のアミノ酸を欠くIGF−IIタンパク質)のN末端に融合している)を投与する。他のマウスに、β−GUS、緩衝液コントロール、または実施例12に記載されるようにして過ヨウ素酸塩および水素化ホウ素ナトリウムで処理したGUSΔC18−GILTΔ1−7タンパク質のいずれかを投与する。一般に、好ましい用量は、0.5〜7mg/kg体重の範囲である。1つの例において、酵素用量は、1mg/kg体重で静脈内投与され、そして酵素濃度は、約1〜3mg/mLである。さらに、少なくとも3匹のマウスに、5mg/kg体重のGUSΔC18−GILTΔ1−7タンパク質(過ヨウ素酸塩および水素化ホウ素ナトリウムで処理した)を投与する。24時間後、これらのマウスを、屠殺し、そして以下の器官および組織を単離する:肝臓、脾臓、腎臓、脳、肺、筋肉、心臓、骨および血液。各組織の部分を、ホモジナイズし、そしてタンパク質1mgあたりのβ−GUS酵素活性を、Slyら(2001)PNAS 98:2205−2210に記載されるようにして決定する。組織の部分を、公開された方法により実施される組織化学および/または組織病理学のために調製する(例えば、Voglerら(1990Am J.Pathol.136:207−217を参照のこと)。
【0133】
さらなる実験は、多重注射プロトコールを包含し、ここでマウスに、1mg/kg体重の用量で、週毎に注射する。さらに、過ヨウ素酸塩改変酵素の半減期の測定を、実施例12に記載されるようにして、未処理の酵素と比較して決定する。
【0134】
2つの他のアッセイ様式が使用され得る。一方の様式において、3〜4匹の動物に、100μlの酵素希釈緩衝液(150mM NaCl、10mM Tris、pH7.5)中の20,000Uの酵素を一回注射する。72〜96時間後に、マウスを殺傷し、治療の効果について評価する。第2の様式において、マウスに、3〜4週間かけて、20,000単位で、週毎に注射し、そして最後の注射の1週間後に屠殺する。肝臓、脾臓および脳の組織化学分析および組織生理学分析を、公開された方法(Birkenmeierら(1991)Blood 78(11):3081−92;Sandsら(1994)J.Clin.Invest 93(6):2324−31;Dalyら(1999)Proc.Natl.Acad.Sci.USA 96(5):2296−300)によって実施する。治療しない場合、GUSを有さないマウスの細胞(例えば、マクロファージおよびKupffer細胞)は、リソソームにおける排出生成物の構築から生じる大きな細胞内貯蔵成分を発生する。GUS−GILT構築物で処置したマウスにおける細胞において、これらの成分の大きさは、目に見えるほど減少し、またはこれらの成分は、もはや光学顕微鏡では見えなくなるまで、収縮することが理解される。
【0135】
同様に、リソソーム貯蔵疾患を有するヒトは、そのリソソームに適切な治療的部分を標的化する構築物を使用して処置される。いくつかの場合において、処置は、GILTタンパク質の定期的な(例えば、毎週)の注射の形態をとる。他の場合において、処置は、GILTタンパク質の持続的なインビボ発現を可能にする核酸の投与によって、または患者においてGILTタンパク質を発現する細胞(例えば、ヒト細胞または単細胞生物)の投与によって、達成される。例えば、GILTタンパク質は、米国特許第6,020,144号(2000年2月1日発行);米国仮出願60/250,446(2001年11月30日出願);米国仮出願60/290,281(2001年5月11日出願);およびPCT番号第PCT/US01/44935号(2001年11月30日出願)に記載されるような、Leishmaniaベクターを使用して、インサイチュで発現され得る。
【0136】
本発明の標的化治療用タンパク質もまた、投与され得、そしてその効果が、GUSと共に使用するために以前に記載された方法(酵素アッセイ、組織化学アッセイ、神経学的アッセイ、生存アッセイ、生殖アッセイなど)を使用して、モニタリングされる。例えば、Voglerら(1993)Pediatric Res.34(6):837−840;Sandsら(1994)J.Clin.Invest.93:2324−2331;Sandsら(1997)J.Clin.Invest.99:1596−1605;O’Connorら(1998)J.Clin.Invest.101:1394−1400;およびSoperら(1999)45(2):180−186を参照のこと。
【0137】
(実施例11)
これらの実験の目的は、ファブリー疾患のための酵素置換治療としての、GILT改変α−ガラクトシダーゼA(α−GAL A)の効果を評価することである。
【0138】
ファブリー病は、α−GAL A(GL−3および他の天然のスピンゴリピドからの末端ガラクトースの除去を担う酵素)の不十分な活性から生じるリソソーム貯蔵疾患である。減少した酵素活性は、x連鎖遺伝子における種々のミスセンス変異およびナンセンス変異に起因して生じる。GL−3の蓄積は、心臓、肝臓、腎臓、皮膚および脳の血管上皮細胞のリソソームにおいて最も多く存在するが、他の細胞および組織においても存在する。血管上皮細胞におけるGL−3構築は、最終的に、心臓疾患および腎不全に至る。
【0139】
酵素置換治療は、ファブリー病のための効果的な処置であり、そしてその成功は、GL−3が蓄積する細胞のリソソームによって取り込まれる治療用酵素の能力に依存する。Genzyme産物のFabrazymeは、DUKX B11 CHO細胞において産生される組換えα−GAL Aであり、これはその証明された効力に起因して、欧州におけるファブリー病患者の処置のために承認されている。
【0140】
Fabrazymeが細胞によって取り込まれ、そしてリソソームに輸送される能力は、N結合炭水化物上のマンノース6−ホスフェート(M6P)の存在に起因する。Fabrazymeは、ほとんどの細胞型の細胞表面上に存在する、マンノース−6−ホスフェート/IGF−IIレセプター(M6P/Igf−Iir)への結合、およびその後のレセプター媒介性エンドサイトーシスによって、リソソームに送達される。Fabrazymeは、報告によれば、ASN残基108、161および184において、3個のN結合グリコシル化部位を有する。これらの位置における優勢な炭水化物は、それぞれ、フコシル化された二触角二シアリル化複合体、モノホスホリル化マンノース−7オリゴマンノース、およびビスホスホリル化マンノース−7オリゴマンノースである。
【0141】
本発明のグリコシル化非依存的リソソーム標的化(GILT)技術は、M6P/IGF−Iirとの異なる相互作用を介して、治療用タンパク質をリソソームに直接標的化する。標的化リガンドは、成熟ヒトIGF−II由来であり、これもまた、M6P/IGF−Iirに、高い親和性で結合する。現在の用途において、IGF−IIタグは、治療用タンパク質へのc末端融合物として提供されるが、架橋を含む他の構成が可能である。細胞への取込みのためのGILT改変酵素の能力が、GILT改変βグルクロニダーゼを使用して達成されており、このGILT改変β−グルクロニダーゼは、過剰のIGF−IIと競合するプロセスにおいて、線維芽細胞によって効率的に取り込まれる。GILT改変の利点は、M6P/IGF−IIレセプターへの結合の増加、標的細胞のリソソームへの取込みの増加、薬物動態学の変更もしくは改善、および組織分布の範囲の拡大、変更もしくは改善である。組織分布の改善された範囲は、血液脳関門を横切るGILT改変α−GAL Aの送達を含み得る。なぜなら、IGFタンパク質は、血液脳関門を明らかに横切るからである。
【0142】
GILT系の別の利点は、M6P改変が生じない非哺乳動物発現系における取込み能力のあるタンパク質(uptake−competent protein)を生成する能力である。特定の実施形態において、GILT改変タンパク質は、CHO細胞において主に産生される。特定の他の実施形態において、GILTタグは、α−GAL Aのc末端に配置されるが、本発明はこのように限定されない。
【0143】
(実施例12.過小グリコシル化(underglycosylated)治療用タンパク質)
標的治療剤の効力を、この標的治療剤の血清半減期を伸ばすことによって、増大させ得る。肝臓マンノースレセプターおよびアシアロ糖タンパク質レセプターは、特定の炭水化物構造を認識することによって、循環から糖タンパク質を排除する(Leeら(2002)Science 295(5561):1898−1901;Ishibashiら(1994)J.Biol.Chem.269(45)27803−6)。いくつかの実施形態において、本発明は、炭水化物に依存せず、ポリペプチドまたはそのアナログに依存する様式で、リソソームへのおよび/または血液脳関門を横切る治療剤の標的化を可能にする。これらのタンパク質の実際の過小グリコシル化は、マンノースおよびアシアロ糖タンパク質レセプターによる循環からのそれらの除去を最小にすることによって、循環におけるその半減期を大きく増加させることが予測される。同様に、機能的脱グリコシル化(例えば、治療用タンパク質上の炭水化物残基を、例えば、過ヨウ素酸塩/水素化ホウ素ナトリウムの処理によって、改変することによって)は、1つ以上のクリアランス経路により炭水化物の認識を妨害することによって、類似の効果を達成する。それにもかかわらず、タンパク質の標的化は、ほとんどの実施形態において、炭水化物−レセプター相互作用ではなく、タンパク質−レセプター相互作用に依存するので、グリコシル化の改変または排除は、リソソームへのおよび/または血液脳関門を横切るタンパク質の標的化に悪影響を与えないはずである。
【0144】
本発明の任意の融合タンパク質(例えば、任意のIGF−Iタグ化タンパク質)、またはペプチド標的化シグナルを使用する任意のリソソーム酵素(例えば、IGF−II)は、化学的または酵素的に脱グリコシル化されるかまたは改変されて、特定のリソソーム標的化の所望の特性および長い血清半減期を有する治療剤を生成し得る。マンノースレセプターを介してマクロファージまたは関連の細胞型に治療剤を送達することが重要であり得るいくつかのリソソーム貯蔵疾患の場合、十分にグリコシル化された治療剤が、過小グリコシル化標的治療剤と組み合わせて使用されて、多種多様な細胞型の標的化を達成し得る。
【0145】
(合成された場合に過小グリコシル化されるタンパク質)
いくつかの場合において、十分にグリコシル化されたタンパク質を産生しない系において、最初に標的化治療用タンパク質を生成することが好ましい。例えば、標的化治療用タンパク質は、E.coliにおいて産生され得、それにより、完全にはグリコシル化されていないタンパク質を生成する。あるいは、グリコシル化されていないタンパク質は、ツニカマイシン(Do1−PP−GlcNAc形成のインヒビター)で処理した哺乳動物細胞において産生される。しかし、特定の標的化治療剤が、グリコシル化の非存在下で、正確に折り畳まれない場合、これは好ましくは、最初に、グリコシル化タンパク質として産生され、そして引き続いて脱グリコシル化されるか、または機能的に過小グリコシル化にされる。
【0146】
過小グリコシル化標的治療用タンパク質はまた、標的治療用タンパク質をコードする遺伝子を操作することによって調製され得、その結果、通常はグリコシル化のためのアクセプターとして働くアミノ酸が、異なるアミノ酸に変化する。例えば、N結合グリコシル化のためのアクセプターとして働くアスパラギン残基は、グルタミン残基、またはグリコシル化アクセプターではない別の残基に変化し得る。この保存的変化は、この部位におけるグリコシル化を排除しつつ、酵素構造に対する最小の影響を有する可能性が最も高い。あるいは、グリコシル化アクセプター付近の他のアミノ酸が改変され得、通常はグリコシル化されているアミノ酸を変化させる必要なく、グリコシル化酵素に対する認識モチーフを破壊する。
【0147】
GUSの場合、4個の潜在的なグリコシル化部位の任意の1つの除去が、大きな酵素活性を保持しつつグリコシル化の量を減少させる(Shipleyら(1993)J.Biol.Chem.268(16):12193−8)。2つのグリコシル化部位のいくつかのセットの、GUSからの除去はなお、有意な酵素活性を許容する。4つ全てのグリコシル化部位の除去は、ツニカマイシンでの細胞の処理と同様に、酵素活性を排除するが、精製された酵素の脱グリコシル化は、酵素的な活性な物質を生じる。従って、グリコシル化部位の除去に伴う活性の損失は、酵素の不正確な折り畳みに起因するようである。
【0148】
しかし、他の酵素は、グリコシル化がない場合でさえ、正確に折り畳む。例えば、細菌β−グルクロニダーゼは、天然ではグリコシル化されておらず、そして本発明の標的化部分を使用して、哺乳動物リソソームに、および/または血液脳関門を横切って標的化され得る。このような酵素は、例えば、この酵素をグリコシル化タンパク質として合成し、そしてこれを引き続いて脱グリコシル化するのではなく、グリコシル化されていない状態で合成され得る。
【0149】
(脱グリコシル化)
標的治療剤が、哺乳動物細胞培養系で生成される場合、これは好ましくは増殖培地に分泌され、収集され、標的治療剤の引き続く精製(例えば、クロマトグラフィー精製プロトコール(例えば、イオン交換を含むクロマトグラフィー精製プロトコール)、ゲル濾過、疎水性クロマトグラフィー、ConAクロマトグラフィー、アフィニティクロマトグラフィーまたはイムノアフィニティクロマトグラフィーによって)を可能にする。
【0150】
糖タンパク質の化学的脱グリコシル化は、多数の方法(トリフルオロメタンスルホン酸(TFMS)での処理、またはフッ化水素(HF)での処理を含む)で達成され得る。
【0151】
TFMSによる化学的脱グリコシル化(Sojarら(1989)J.Biol.Chem.264(5):2552−9;Sojarら(1987)Methods Enzymol.138:341−50):1mgのGILT−GUSを、減圧下で一晩乾燥させる。この乾燥したタンパク質を、時折振盪しながら、窒素下で、0.5〜2時間、0℃で、150μlのTFMSで処理する。この反応混合物を、ドライアイス−エタノール浴中で、−20℃より下に冷却し、そしてこの反応物を、予め冷却した(−20℃)、水中60%のピリジンの溶液を徐々に添加することによって、中性にする。次いで、この中性の反応混合物を、4℃で、NH4HCO3(pH7.0)(数回交換する)に対して、透析する。TFMSを用いる化学的脱グリコシル化は、処理されたタンパク質に対する改変(メチル化、スクシンイミド形成およびアスパラギン酸残基の異性化を含む)を生じ得る(Douglassら(2001)J.Protein Chem.20(7):571−6)。
【0152】
HFによる化学的脱グリコシル(Sojarら(1987)Methods Enzymol.138:341−50):この反応を、閉鎖反応系(例えば、Peninsula Laboratories,Inc.から得られ得るようなもの)で実施する。10mgのGILT−GUSを減圧乾燥し、そして反応容器に入れ、次いで、この容器を、HF装置に接続する。HFの全ラインが排気された後に、10mLの無水HFを、反応容器を撹拌しながらレザバから留去する。この反応を、0℃で1〜2時間継続する。その後、水流吸引器でHFを15〜30分間除去する。残った微量のHFを、高真空下で除去する。この反応混合物を、2mLの0.2M NaOHに溶解して、残りの全てのHFを中和し、そして冷0.2M HClでpHを7.5に調整する。
【0153】
酵素脱グリコシル化(Thotakuraら(1987)Methods Enzymol.138:350−9):N結合炭水化物を、タンパク質N−グリコシダーゼ(PNGase)Aまたはタンパク質N−グリコシダーゼFを使用して、糖タンパク質から完全に除去し得る。1つの実施形態において、糖タンパク質は、グリコシダーゼでの処理の前に変性されて、糖タンパク質に対する酵素の活性を促進する;その後、この糖タンパク質は、上記「インビトロリフォールディング」の節において議論されたように、リフォールディングされる。別の実施形態において、過剰のグリコシダーゼが、ネイティブの糖タンパク質を処理して効果的な脱グリコシル化を促進するために使用される。
【0154】
実際に脱グリコシル化されない標的の治療タンパク質の場合には、減少したグリコシル化が、標的治療タンパク質におけるプロテアーゼ感受性部位(これは、このタンパク質の半減期を短縮する)を露出させることが可能である。N結合グリコシル化は、リソソーム酵素のサブセットをタンパク質分解から保護することが公知である(Kundraら(1999)J.Biol.Chem.274(43):31039−46)。このようなプロテアーゼ感受性部位は、好ましくは、タンパク質から(例えば、部位特異的変異誘発によって)操作される。以下に議論されるように、プロテアーゼ感受性部位または潜在的なエピトープを露出させる危険性は、脱グリコシル化を組み込むこと、または炭水化物を全く省略するよりむしろ炭水化物構造を改変することによって、最小化され得る。
【0155】
(炭水化物構造の改変または部分的な脱グリコシル化)
1つの実施形態において、治療タンパク質は、部分的に脱グリコシル化される。例えば、治療タンパク質は、エンドグリコシダーゼ(例えば、エンドグリコシダーゼH)で処理され得、これは、N結合した高マンノース炭水化物を切断するが、複雑な型の炭水化物を切断せず、アスパラギンに結合した単一のGlcNAc残基を残す。この様式で処理された治療タンパク質は、高マンノース炭水化物を欠き、肝マンノースレセプターとの相互作用を減少する。このレセプターは、末端GlcNAcを認識するが、タンパク質表面上の単一のGlcNAcとの増殖性相互作用の可能性は、インタクトな高マンノース構造との相互作業の可能性ほど大きくない。治療タンパク質が哺乳動物細胞中で産生される場合、このタンパク質上に存在する任意の複雑な炭水化物は、endoH処理によって影響を受けないままであり、そして末端をシアリル化され得、これによって、肝炭化水素認識応答との相互作用を低下させ得る。従って、このようなタンパク質は、増加した半減期を有する用である。同時に、残っている炭水化物による立体障害は、タンパク質表面上の潜在的エピトープを免疫系から遮断し、そしてタンパク質表面へのプロテアーゼの接近を低下させ得る(例えば、プロテアーゼリッチなリソソーム環境内で)。
【0156】
他の実施形態において、治療タンパク質のグリコシル化は、例えば、酸化、還元、脱水、置換、エステル化、アルキル化、シアリル化、炭素−炭素結合の切断などによって改変されて、血液からの治療タンパク質のクリアランスを減少させる。いくつかの好ましい実施形態において、治療タンパク質は、シアリル化されていない。例えば、過ヨウ化物および水素化ホウ素ナトリウムでの処理は、大部分の糖タンパク質の炭水化物構造を改変するために効果的である。過ヨウ化物での処理は、ビシナルジオールを酸化し、炭素−炭素結合を切断し、そしてヒドロキシル基をアルデヒド基で置き換える;ホウ素化水素は、これらのアルデヒドをヒドロキシルに還元する。多くの糖残基は、ビシナルジオールを含み、従って、この処理によって切断される。図4Aに示されるように、タンパク質は、アスパラギン残基の近くにN−アセチルグルコサミン残基およびこの構造の他の箇所にマンノース残基を含む高マンノース炭水化物で、アスパラギン残基でグリコシル化され得る。図4Bに示されるように、末端マンノース残基は、ヒドロキシル基を有する3つの連続する炭素を有する;関与する両方の炭素−炭素結合は、過ヨウ化物処理によって切断される。いくつかの非末端マンノース残基はまた、ビシナルジオールを含み、これらは、同様に切断される。それにもかかわらず、この処理は、環状炭水化物を直鎖炭水化物に切断する一方で、これは、この炭水化物を完全には除去せず、潜在的にプロテアーゼ感受性な部位または抗原性ポリペプチド部位の露出の危険性を最小にする。
【0157】
リソソーム酵素β−グルクロニダーゼの半減期は、過ヨウ化物およびホウ素化水素ナトリウムでの連続的な処理の後に、10倍より大きく増加することが公知である(Houbaら(1996)Bioconjug.Chem.7(5):606−11;Stahlら(1976)PNAS 73:4045−4049;Achordら(1977)Pediat.Res.11:816−822;Achordら(1978)Cell 15(1):269−78)。同様に、リシンは、可溶化物とシアノホウ素化水素ナトリウムの混合物で処理された(Thorpeら(1985)Eur.J.Biochem.147:197)。ラットへの注射後、肝臓によって吸収されたリシンの割合は、化学処理と共に注射された用量の40%(未処理リシン)から20%(修飾リシン)まで減少した。対照的に、血液中のリシンの量は、20%(未処理リシン)から45%(処理したリシン)まで増加した。従って、処理されたリシンは、より広い組織分布および循環におけるより長い半減期を享受する。
【0158】
本発明の標的化部分と結合された、β−グルクロニダーゼ構築物(または他の糖タンパク質)は、過ヨウ化物およびホウ素化水素ナトリウムでの連続的な処理によって脱グリコシル化または修飾されると、半減期の類似の(例えば、2倍より大きいか、4倍より大きいか、または10倍より大きい)増加を享受するが、カチオン依存性M6Pレセプターに対する高い親和性は保持するままであり、このレセプターを有する全ての細胞型のリソソームに、この構築物を標的化させる。この構築物はまた、血液脳関門を効率的に横切ることが予測される。対照的に、リソソーム標的化のためにM6Pに依存するβ−グルクロニダーゼ調製物は、過ヨウ化物およびホウ素化水素ナトリウムで脱グリコシル化または処理され、これは、上昇した血清半減期を享受するが、リソソームを標的化し得ない。なぜなら、M6P標的化シグナルがこの処理によって改変されたからである。
【0159】
過ヨウ化物およびホウ素化水素ナトリウムでの連続的な処理による、炭水化物の修飾は、以下のように実施され得る:精製されたGILT−GUSが、50mM酢酸ナトリウム(pH4.5)中40mMのNaIO4と共に、4℃で2時間インキュベートされる。この反応は、過剰のエチレングリコールの添加によって停止され、そして未反応試薬が、この反応マトリックスを、PBS(pH7.5)と平衡化したSephadex G−25Mに通すことによって除去される。この処理に続いて、PBS(pH7.5)中40mMのNaBH4と共に、37℃で3時間インキュベートされ、次いで、4℃で1時間インキュベートされる。この反応混合物をPBS(pH7.5)で溶出するSephadex G−25Mカラムに通し、この反応を終結させる。
【0160】
過ヨウ化物およびホウ素化水素ナトリウムでの処理のための別のプロトコルは、Hickmanら(1974)BBRC 57:55−61に記載されている。精製されたタンパク質が、0.01Mのリン酸ナトリウム(pH6.0)、0.15MのNaCl中に透析される。過ヨウ素酸ナトリウムが、最終濃度0.01Mまで添加され、そしてこの反応は、4℃、暗所で少なくとも6時間進行する。β−ヘキソサミニダーゼの、これらの条件下での過ヨウ化物での処理は、線維芽細胞によるタンパク質の取り込みを防止するために十分である;取り込みは、通常、M6Pレセプターを線維芽細胞表面に有するβ−ヘキソサミニダーゼのM6P部分に依存する。従って、過ヨウ化物での酸化は、M6Pを、M6Pレセプターと相互作用するその能力を廃止するために十分に改変する。
【0161】
あるいは、炭水化物は、Thorpeら(1985)Eur.J.Biochem.147:197−206に開示されるように、過ヨウ化物およびシアノボロヒドリドでの、1工程反応の処理によって修飾され得る。
【0162】
部分的に脱グリコシル化したタンパク質または修飾されたグリコシル化パターンを有するタンパク質における、炭水化物の存在は、グリコシル化の完全な非存在によっておそらくカバーされない、潜在的なポリペプチドエピトープを遮蔽するはずである。治療タンパク質が免疫応答を実際に刺激する場合、免疫抑制治療剤が、治療タンパク質と組み合わせて使用され得る(Brooks(1999)Molecular Genetics and Metabolism 68:268−275)。例えば、アルグルセラーゼで処置されたゴシェ病患者の約15%が、免疫応答を発生させたことが報告された(Beutlerら,The Metabolic and Molecular Bases of Inherited Disease,第8版(2001),Scriverら編,3635−3668頁)。運良く、アルグルセラーゼに対する抗体を産生した患者の多く(82/142)は、通常の処置レジメンによって許容化された(Rosenbergら(1999)Blood 93:2081−2088)。従って、免疫応答を発生させ得る少数の患者の役に立つために、治療タンパク質を受けている患者はまた、本発明のいくつかの実施形態において、免疫抑制治療を受ける。
【0163】
(試験)
タンパク質が過少にグリコシル化されていることを確認するために、ConAに曝露することによって試験され得る。過少グリコシル化タンパク質は、対応する完全にグリコシル化したタンパク質と比較される場合に、ConA−セファロースに対する減少した結合を示すと予測される。
【0164】
実際に過少グリコシル化されたタンパク質はまた、SDS−PAGEによって分解され得、そして対応する完全にグリコシル化したタンパク質と比較され得る。例えば、化学的に脱グリコシル化されたGUS−GILTは、未処理の(グリコシル化)GUS−GILTおよびPNGase Aで処理された酵素的に脱グリコシル化されたGUS−GILTと比較され得る。過少グリコシル化タンパク質は、完全にグリコシル化されたタンパク質と比較される場合、SDS−PAGEにおけるより大きい移動能を有すると予測される。
【0165】
過少グリコシル化された標的化治療タンパク質は、標的化ドメインに依存する取り込みを示す。過少グリコシル化タンパク質は、マンノースまたはM6Pに依存する、減少した取り込みを示す(そして好ましくは、実質的に取り込みを示さない)はずである。これらの特性は、細胞取り込み実験において、実験的に確認され得る。
【0166】
例えば、哺乳動物細胞中で合成され、引き続いて過ヨウ化物およびボロヒドリドで処理された、GUS−GILTタンパク質は、M6P依存性取り込みおよびマンノース依存性取り込みを試験することによって、機能的脱グリコシル化に対して試験され得る。M6P依存性取り込みが減少したことを示すために、取り込みアッセイが、GM4668線維芽細胞を使用して実施される。競合物質の非存在下では、処理された酵素および未処理の酵素は、各々、有意な取り込みを示す。過剰のIGF−IIの存在は、処理された酵素および未処理の酵素の取り込みをかなり減少させるが、未処理の酵素は、M6P依存性の経路を介する残余の取り込みを保持する。過剰のM6Pは、未処理の酵素の取り込みを減少させるが、機能的に脱グリコシル化されたタンパク質の取り込みの減少においては、さほど効果的ではない。処理された酵素および未処理の酵素について、両方の競合物質の同時の存在は、実質的に取り込みを廃止するはずである。
【0167】
マンノース依存性の取り込みを評価するための取り込みアッセイは、J774−E細胞(マンノースレセプターを有するが、M6Pレセプターを存在するならば少数有する、マウスマクロファージ様細胞株)を使用して実施される(Dimentら(1987)J.Leukocyte Biol.42:485−490)。これらの細胞は、低グルコースのDMEM(10%FBS、4mMグルタミン、および抗生物質、抗真菌溶液を補充された)(Sigma,A−5955)中で培養される。これらの細胞を用いる取り込みアッセイは、線維芽細胞を用いて実施されるアッセイと同一の様式で実施される。過剰のM6PおよびIgF−IIの存在下(これは、任意の残余のM6P/IGF−IIレセプターに起因して、取り込みを排除する)で、完全にグリコシル化された酵素は、マンノースレセプターとの相互作用に起因して、かなりの取り込みを示す。過少グリコシル化酵素は、これらの条件下では、かなり減少した取り込みを示すと予測される。完全にグリコシル化された酵素の、マンノースレセプター依存性の取り込みは、過剰の(100μg/mL)マンナンの添加によって競合され得る。
【0168】
脱グリコシル化GUS−GILTの薬物速度論は、1時点あたり、20,000酵素単位の静脈内注射を、3匹のMPSVIIマウスの群に与えることによって、決定され得る。各時点について、50μLの血液を、酵素活性について評価する。
【0169】
(均等物)
本発明は、本発明の精神または本質的な特徴から逸脱することなく、他の特定の形態で実施され得る。従って、上記実施形態は、全ての局面において、本明細書中に記載される本発明の限定ではなく例示であるとみなされるべきである。従って、本発明の範囲は、上記記載によってではなく、添付の特許請求の範囲によって示され、そしてこの特許請求の範囲の意味および均等の範囲内に入る全ての変化は、本発明に含まれることが意図される。
【0170】
(参考としての援用)
本明細書中に開示される特許文献および科学刊行物、ならびにU.S.S.N.60/250,446(2000年11月30日出願);U.S.S.N.60/250,444(2000年11月30日出願);U.S.S.N.60/290,281(2001年5月11日出願);U.S.S.N.60/287,531(2001年4月30日出願);U.S.S.N.60/304,609(2001年7月10日出願);U.S.S.N.60/329,461(2001年10月15日出願)、U.S.S.N.60/351,276(2002年1月23日出願);U.S.S.N.10/136,841(2002年4月30日出願);代理人文書番号SYM−007CP、発明の名称「Targeted Therapuetic Proteins」(2002年10月16日出願);代理人文書番号SYM−009、発明の名称「Targeted Therapeutic Proteins」(2002年10月16日出願);およびPCT出願番号PCT/US01/44935(2001年11月30日出願)の各々の開示は、その全体が、本願に参考として援用される。
【図面の簡単な説明】
【0171】
【図1】図1は、成熟ヒトIGF−I(配列番号1)およびIGF−II(配列番号2)の配列アラインメントを示し、相同領域ならびにAドメイン、Bドメイン、CドメインおよびDドメインを示す。
【図2】図2は、IGFタンパク質の2次元表示であり、シグナル配列、Aドメイン、Bドメイン、CドメインおよびDドメイン、ならびにC末端配列を示す。
【図3】図3は、ヒトIGF−ImRNAについてのタンパク質(図3A、配列番号3)配列および核酸(図3B、配列番号4)配列を示す。
【図4A】図4Aは、アスパラギン残基を介して糖タンパク質に連結された、リン酸化高マンノース炭水化物構造の一形態を示し、そしてマンノースおよびN−アセチルグルコサミン(GlcNAc)の構造も示す。
【図4B】図4Bは、より高レベルに詳細な高マンノース炭水化物構造の一部を示し、そして過ヨウ素酸塩処理による切断を受けやすい位置を示す。この炭水化物構造内の糖残基の位置は、丸で囲んだ大文字A〜Hで表示し;リン酸基は、丸で囲んだ大文字Pで示される。
【図5】図5は、グリコシル化不全のいくつかの型を示す。【Technical field】
[0001]
(Related application)
This application claims the following benefits: US Patent No. 60 / 329,650 (filed Oct. 16, 2001); No. 10 / 136,639 (filed Apr. 30, 2002); No. 136,841 (filed on Apr. 30, 2002); No. 60 / 384,452 (filed May 29, 2002), No. 60 / 386,019 (filed Jun. 5, 2002) No. 60 / 408,816 (filed Sep. 6, 2002), the entire disclosures of which are incorporated herein by reference.
[0002]
(Field of Invention)
The present invention provides a means for specifically delivering proteins to the brain. The ability to target proteins to the brain is very useful in the treatment of neurological diseases. The methods and compositions of the present invention are useful for targeting proteins to cells across the blood brain barrier, particularly for cells in the CNS (neuronal cells, macrophage cells, and other cell types). Useful for targeting proteins to lysosomes. Accordingly, the present invention provides methods and compositions for the delivery of therapeutically useful proteins to treat lysosomal storage diseases (“LSDs”) that affect the CNS.
[Background]
[0003]
(background)
The blood brain barrier maintains a constant environment in the central nervous system (CNS). These capillaries that supply blood to the brain are tight junctions that block the passage of most molecules through the intracapillary membrane. While these membranes allow the passage of fat-soluble substances, water-soluble substances (eg, glucose, proteins, and amino acids) do not cross the blood brain barrier. There is a mediated transport mechanism for transporting glucose and essential amino acids across the blood brain barrier. The active transport mechanism removes excess molecules such as potassium from the brain. However, the blood brain barrier prevents delivery of drugs to the CNS.
DISCLOSURE OF THE INVENTION
[Problems to be solved by the invention]
[0004]
Many neurological diseases arise from cellular defects in the CNS. Specifically, many lysosomal storage diseases affect the cells of the CNS and result in moderate to severe neurological symptoms. Thus, the ability to deliver therapeutic compositions to the CNS is an important aspect of effective treatment for many diseases, including lysosomal storage diseases.
[0005]
Methods have been designed to deliver the required drugs to the CNS (eg, direct delivery into the CNS by subarachnoid delivery). However, methods for effectively delivering drugs and particularly protein-based drugs from the blood to the CNS via the blood brain barrier are not available in the art.
[0006]
Accordingly, there is a need in the art for methods of delivering proteins to the brain parenchyma on the CNS side of the blood brain barrier, particularly for methods of delivering proteins to the lysosomes of cells in the CNS.
[Means for Solving the Problems]
[0007]
(Summary of the Invention)
The present invention provides universal methods and compositions for targeting a composition from the bloodstream to the brain or CNS. In accordance with the present invention, the IGF moiety is used to target molecules from the bloodstream to the brain parenchyma at other aspects of the blood brain barrier. A preferred molecule is a therapeutic polypeptide.
[0008]
Accordingly, the present invention in one aspect relates to a protein comprising a therapeutic factor linked to an insulin-like growth factor (IGF) moiety or tag. In one embodiment, the protein is expressed as a fusion protein with an IGF tag. In one embodiment, the IGF tag does not include IGF-II or a portion thereof. In another embodiment, the fusion protein also includes a lysosomal targeting moiety that is twice as large as IGF-II so that the targeting moiety is a cation-independent mannose-6-phosphate / IGF- It binds to the II receptor and mediates uptake by lysosomes. In another embodiment, the fusion protein also steps on mannose-6-phosphate to target the protein to lysosomes.
[0009]
Preferred IGF moieties or tags are IGF-I tags or IGF-II tags. The most preferred IGF tag is the IGF-I tag. In one aspect, the IGF tag is an intact IGF-I protein or an IGI-II protein. Alternatively, the IGF tag is a portion of an IGF-I protein or IGI-II protein that is sufficient to target across the blood brain barrier. Preferred portions comprise at least one of the A domain, B domain, C domain, or D domain or C-terminal region of either IGF-I or IGF-II or portions thereof. In one embodiment, the IGF tag comprises an A domain or a B domain. In accordance with the present invention, the A and B domains provide core structural features that are central to the preferred IGF moiety. The A domain and B domain can be joined by a linker peptide. Alternatively, the A and B domains provide separate peptides that dimerize to form an IGF tag. Preferably, A and B domains from the same IGF protein can be used. However, the A domain from IGF-I can be combined with the B domain from IGF-II. Similarly, the A domain from IGF-II can be combined with the B domain from IGF-I. Accordingly, the composition of the present invention comprises a chimeric IGF-I / IGF-II molecule. For example, an A domain from one IGF protein can be linked to the C domain and B domain of another IGF protein. Alternative combinations of A domain, B domain, and C domain are also useful. In further embodiments, the A domain of one IGF can be directly linked to the domain of another IGF protein, for example by using an amino acid bridge, such as a two amino acid bridge.
[0010]
The most preferred IGF moiety comprises an IGF-I moiety selected from the group consisting of: an IGF-I fragment from approximately
[0011]
The most preferred IGF tag is based on the human IGF protein. However, IGF tags based on IGF proteins derived from other mammals (eg, mouse, rabbit, monkey, and porcine IGF proteins) are also useful according to the present invention. Preferred IGF tags (eg, IGF fragments, IGF peptides, or IGF domains described herein) are 1 to 100 amino acids long, more preferably 10 to 50 amino acids long, and even more preferred Is 25 amino acids long and is sufficient to target peptides that bind to the brain. Preferred IGF fragments, IGF peptides, or IGF domains are based on mature IGF-I and mature IGF-II sequences.
[0012]
The IGF tag of the present invention can be fused to the therapeutic peptide at the N-terminus, C-terminus, in its body, or a combination thereof at the therapeutic peptide. When the IGF moiety is fused to the N-terminus of a therapeutic protein, an IGF signal peptide is preferably included in the expression construct. However, an IGF signal peptide can also be included at the N-terminus if the IGF targeting moiety is located within the C-terminus or the body of the therapeutic protein. In a preferred embodiment, the IGF tag is fused to the C-terminus of the peptide. In one embodiment, the first domain of the IGF tag is fused to a therapeutic peptide, and the second domain of the IGF tag dimerizes with the first domain to provide a protein targeted to the brain. Provided in a targeted form. For example, the therapeutic peptide can be fused to the A domain of the IGF protein and dimerized with a separately provided B domain. Alternatively, the therapeutic peptide can be fused to the B domain of the IGF protein and dimerized with the separately provided A domain.
[0013]
The present invention also relates to a method for identifying IGF-based peptide fragments that can reach neural tissue from the bloodstream, and this method is useful for targeting binding proteins to the brain or CNS. In accordance with the present invention, the efficacy of IGF-based tags can be assessed using the methods described herein (eg, local assays based on radiolabeling or histochemical staining).
[0014]
The present invention also includes nucleic acids (eg, DNA molecules) encoding IGF tags or proteins fused to IGF tags, and cells containing such nucleic acids (eg, mammalian cell cultures such as CHO cell cultures, and And / or unicellular organisms (in vitro cultured cells containing E, coil or Leishmania).
[0015]
In another aspect, the present invention relates to a method for generating a therapeutic agent for targeting the lysosomes of CNS cells across the blood brain barrier. This agent is produced by culturing cells that express a nucleic acid encoding a protein, including both a therapeutic agent and an IGF tag, that are effective to target the protein through the blood brain barrier. The protein is then collected (eg, from the environment surrounding the cell or by lysing the cell). The present invention also relates to the protein compositions described herein.
[0016]
Accordingly, the present invention in one aspect relates to a targeted therapeutic agent comprising a targeting moiety and a therapeutic agent that is therapeutically active and preferably active in mammalian lysosomes. “Therapeutically active” as used herein includes at least a polypeptide or other molecule that confers enzymatic activity on a cell or compartment thereof that is deficient in that activity. “Therapeutically active” also encompasses other polypeptides or other molecules intended to ameliorate or compensate for biochemical defects in the cell, but, like chemotherapeutic agents, are primarily cytotoxic. Or molecules that are cytostatic are not included.
[0017]
In one embodiment, the targeting moiety is a means for binding in an M6P-independent manner to the extracellular domain of a human cation-independent M6P receptor when the receptor is present in the plasma membrane of the target cell (eg, , Molecule). In another embodiment, the targeting moiety is a non-glycosylated lysosomal targeting domain that binds to the extracellular domain of the human cation-independent M6P receptor. In any embodiment, the targeting moiety may include, for example: IGF-II; retinoic acid or a derivative thereof; amino acid sequence at least 70% identical to the domain of urokinase-type plasminogen activator receptor An antibody variable domain that recognizes the receptor; or a variant thereof. In some embodiments, the targeting moiety has a dissociation constant (eg, 10 μM or less at pH 7.4 (or approximately 7.4)). -8 Less than M, 10 -9 Less than M, 10 -10 Less than M or 10 -7 M and 10 -11 M), and at pH 5.5 (or approximately 5.5) at least 10 -6 It binds to an IGF receptor (eg, IGF-I receptor or IGF-II receptor) at a dissociation constant of M and at least 10 times the dissociation constant at pH 7.4 (or approximately 7.4). In certain embodiments, the means for binding is at least 10-fold less affinity for the extracellular domain of the receptor at pH 5.5 (or approximately 5.5) than at pH 7.4 (or approximately 7.4). avidly) (ie, with a dissociation constant that is at least 10 times greater); in one embodiment, the dissociation constant at pH 5.5 (or approximately 5.5) is at least 10 -6 M. In further embodiments, the binding of the targeted therapeutic agent to the means for binding is destabilized by a pH change from pH 7.4 (or approximately 7.4) to pH 5.5 (or approximately 5.5). The In preferred embodiments, the targeting moiety retains an IGF-II-like binding affinity for the IGF-II receptor, but has a reduced binding affinity for the IGF-I receptor (eg, 10 -5 M or 10 -6 Dissociation constant greater than M).
[0018]
The present invention also provides a patient (eg, a patient having a disorder in the CNS, eg, by administering a therapeutic agent effective in a mammalian CNS and a protein comprising an IGF tag for targeting the protein to the CNS. And preferably relates to a method of treating patients with CNS disorders resulting from lysosomal storage disorders. Preferably, the protein also has a lysosomal targeting moiety (eg, as described below: US Patent Application No. 10 / 136,841 (filed April 30, 2002); agent case number SYM-007CP, title "Targeted Therapeutic Proteins" (filed Oct. 16, 2002); and agent case number SYM-009, titled "Targeted Therapeutic Proteins" (filed Oct. 16, 2002)), or a protein deficient in the CNS Mannose-6-phosphate for targeting to the lysosomes. Similarly, the invention administers a nucleic acid encoding such a protein and / or administering a cell (eg, a human cell, an organism such as Leishmania) that contains a nucleic acid encoding such a protein. In particular, it relates to a method of treating a patient.
[0019]
The present invention also provides methods for producing therapeutic proteins targeted to lysosomes and / or across the blood brain barrier, as well as having therapeutic half-lives in circulation in mammals. This method involves producing a glycosylation-deficient therapeutic protein. As used herein, “underglycosylated” is one or more that is normally present when the protein is produced in mammalian cells (eg, CHO cells). A carbohydrate structure that is omitted, removed, modified or masked, thereby extending the half-life of the protein in mammals. Thus, a protein may actually be glycosylated due to the absence of one or more carbohydrate structures, or by modification or masking of one or more carbohydrate structures that facilitate clearance from the circulation. It may be functionally glycosylated. For example, the structure may be (ii) added in vivo by addition of one or more additional moieties (eg, carbohydrate groups, phosphate groups, alkyl groups, etc.) that interfere with structure recognition by the mannose receptor or asialoglycoprotein receptor. By covalent or non-covalent attachment of glycoproteins to binding moieties (eg, lectins or extracellular portions of mannose receptors or asialoglycoprotein receptors) that interfere with binding to these receptors, or (iii) all carbohydrate structures Or by masking the presence of some, it can be masked by any other modification to the polypeptide or carbohydrate portion of the glycoprotein to reduce its clearance from the blood.
[0020]
In one embodiment, the therapeutic protein is produced in a host (eg, a bacterium or yeast) that does not glycosylate the protein such that traditional mammalian cells (eg, Chinese hamster ovary (CHO) cells) are glycosylated. A peptide targeting moiety (eg, IGF-I, IGF-II, or that moiety effective to bind to a target receptor). For example, the protein produced by the host cell may lack terminal mannose residues, fucose residues, and / or N-acetylglucosamine residues (which are recognized by the mannose receptor) or may be completely It may be glycosylation deficient. In another embodiment, the therapeutic protein (which may be produced in mammalian cells or in other hosts) has one or more carbohydrate residues (eg, one or more mannose residues, fucose residues). Groups, and / or N-acetylglucosamine residues) or chemically or enzymatically to modify or mask one or more hydrocarbon residues. Such modification or masking may reduce the binding of the therapeutic protein to the hepatic mannose receptor and / or asialoglycoprotein receptor. In another embodiment, one or more potential glycosylation sites are synthesized in a nucleic acid encoding the targeted therapeutic protein, thereby synthesizing in a mammalian cell or other cell that glycosylates the protein. In addition, it is removed by reducing glycosylation of the protein.
[0021]
(Detailed description of the invention)
(CNS targeting moiety)
According to the present invention, the IGF moiety is useful for targeting a composition (preferably a protein composition) to the CNS across the blood brain barrier. Preferably, an IGF tag is used to target the composition to the brain parenchyma. According to the present invention, the composition may enter the CNS or cerebrospinal cord either directly across the blood brain barrier (BBB) or indirectly across the blood cerebrospinal fluid barrier (BCB). . BBB is formed by capillary endothelial cells and BCB is formed by choroid plexus epithelial cells. Transport across either barrier typically involves transcytosis. According to the present invention, a composition targeted to CSF across the BCB can subsequently reach the brain parenchyma. The CSF and brain parenchyma are separated by the upper garment, and diffusion or most flow can transport material between these two compartments.
[0022]
The present invention recognizes that [125I] IGF-I and IGF-II can be detected in the brain when injected into the carotid artery, and that subcutaneously administered IGF-I and analogs are found in cerebrospinal fluid. Part of the recognition that it can be issued. According to the present invention, this suggests that both can cross the BBB or BCB. According to the present invention, the observed saturation of the transport process suggests that this process is mediated by a carrier. However, experimental analysis using a series of IGF-I analogs is IGF-I receptor, IGF-II receptor, and IGF binding protein-1, IGF binding protein-3, IGF binding protein-4, or IGF binding protein— 5 suggests that it does not play a role in blood brain barrier transport.
[0023]
According to one aspect of the invention, a preferred therapeutic composition comprises a therapeutic peptide fused to an IGF tag. In one embodiment, the IGF tag does not include IGF-II or a portion thereof. A preferred therapeutic composition comprises an IGF-I tag that directs an LSD (lysosomal storage disease) protein fused with an IGF-I tag across the blood brain barrier. In this case, this tag does not necessarily direct the protein to multiple cell types of lysosomes. However, by expressing such fusion proteins in mammalian cell culture systems, the present invention utilizes the endogenous M6P signal for lysosomal localization and uses an IGF-I tag to cross the blood brain barrier. use. In a preferred embodiment of the invention, a human IGF-I tag is used. In an alternative embodiment, the methods and compositions of the invention include the use of allelic variants, species variants or other sequence variants of the IGF-I tag. Preferred sequence variants include mutations that reduce binding of the IGF tag to the IGF-I receptor and / or IGF binding protein (eg, Leu with reduced binding to the IGF-I receptor). 60 -IGF-I or Leu 24 IGF-I, or Δ1-3 IGF-I with reduced binding to IGF binding protein). Further useful sequence variants include Arg 55 And Arg 56 IGF-I having the following amino acid substitution. Other mutant IGF protein tags with similar properties are also useful.
[0024]
IGF-II based tags are also useful for targeting proteins to the brain. IGF-II has been reported to be transported across the blood brain barrier by transcytosis (Bickel et al. (2001) Adv. Drug. Deliv. Rev. 46 (1-3): 247-79). According to the present invention, preferred IGF-II based tags target proteins to the brain and also target proteins to lysosomes via receptor binding to treat neurological symptoms associated with lysosomal storage diseases Turn into. A preferred variant of IGF-II is Leu. 24 Have amino acid substitutions.
[0025]
In another aspect of the invention, chimeric tags comprising fragments of IGF-I and IGF-II are used that confer preferred functional properties of each protein. In one embodiment, the retained portion of IGF-II comprises a region of IGF-II that is known to be important for binding to the IGF-II M6P receptor, while the remaining portion of IGF-II is , Replaced with the corresponding region of IGF-I. This embodiment is particularly useful when IGF-I is more active as a tag for crossing the blood brain barrier. In this embodiment, the tag has activity optimized for lysosomal targeting in addition to brain targeting. The recombinant form of this embodiment can be made in any expression system.
[0026]
In a further aspect of the invention, useful recombinant LSD proteins comprise any one of the different IGF-based lysosomal targeting tags described below: US Patent Application No. 10 / 136,841 (April 2002) Attorney Case Number SYM-007CP, Title “Targeted Therapeutic Proteins” (filed Oct. 16, 2002); and Attorney Case Number SYM-009, Title “Targeted Therapeutic Proteins” (October 16, 2002) Application).
[0027]
In preferred embodiments, a recombinant protein of the invention comprising an IGF-II tag is expressed in a mammalian expression system (eg, a CHO cell expression system). According to the present invention, the endogenous M6P signal added to mammalian cell culture enhances lysosomal targeting that can be conferred by the IGF-II tag.
[0028]
In accordance with the present invention, useful minimal and variant IGF tags are based on known IGF-I and IGF-II sequences and are minimal IGF fragments in a CNS localization assay as described herein. Alternatively, it can be identified by testing variant IGF fragments.
[0029]
Preferred IGF tags overlap sufficiently with IGF-I to be targeted to the brain, but have reduced binding affinity for the IGF-I receptor, thereby Remove mitotic properties. However, preferred IGF tags do not bind to the IGF-II receptor, as targeted to lysosomes. Thus, in one embodiment, the IGF tag is based on the IGF-I sequence, but replaces two hydrophobic IGF-II residues at positions 54 and 55 with arginine residues at these positions of IGF-I. Included.
[0030]
(Structure of IGF-II)
The NMR structure of IGF-II has been elucidated by two groups (see, eg, Protein Data Bank Record 1IGL). The general characteristics of the IGF-II structure are similar to IGF-I and insulin. The A and B domains of IGF-II correspond to the A and B domains of insulin. Secondary structure features include an alpha helix from residues 11-21 of the B region linked to a short beta strand of residues 26-28 by a reverse turn of residues 22-25. Residues 25-27 appear to form a small antiparallel β sheet; residues 59-61 and residues 26-28 may also be involved in intermolecular β sheet formation. In the A domain of IGF-II, residues 42-49 and 53-59, which span the α helix, are placed in an antiparallel configuration perpendicular to the B domain helix. Hydrophobic clusters formed by two of the three disulfide bridges and conserved hydrophobic residues stabilize these secondary structural features. The N-terminus and C-terminus remain almost unclear, as is the region between residues 31-40.
[0031]
IGF-II binds to the IGF-II / M6P receptor and IGF-I receptor with relatively high affinity and to the insulin receptor with lower affinity. IGF-II also interacts with a number of serum IGFBPs.
[0032]
In preferred embodiments, the lysosome targeting moiety is a protein, peptide, or other moiety that binds to the cation-independent M6P / IGF-II receptor in a mannose-6-phosphate independent manner. Advantageously, this embodiment mimics the normal biological mechanism for LSD protein uptake and does this in a mannose-6-phosphate independent manner.
[0033]
For example, by fusing DNA encoding the mature IGF-II polypeptide to the 3 ′ end of the LSD gene cassette, a fusion protein is created that can be taken up by various cell types and transported to the lysosome. Alternatively, DNA encoding the precursor IGF-II polypeptide can be fused to the 3 ′ end of the LSD gene cassette; this precursor is cleaved in mammalian cells to yield the mature IGF-II polypeptide. However, the IGF-II signal peptide is preferably excluded (or moved to the 5 ′ end of the LSD gene cassette). This method has a number of advantages (including simplicity and cost efficiency) over methods involving glycosylation since once the protein is isolated, no further modifications need to be made.
[0034]
(Binding to IGF-II / M6P receptor)
Replacing residues 48-50 of IGF-II (Phe Arg Ser) with the corresponding residue from insulin (Thr Ser Ile), or IGF-I of residues 54-55 of IGF-II (Ala Leu) Substitution with the corresponding residue from origin (Arg Arg) results in loss of binding to the IGF-II / M6P receptor, but retains binding to IGF-I and the insulin receptor.
[0035]
IGF-I and IGF-II share the same sequence and structure in the region of residues 48-50, but have a 1000-fold difference in affinity for the IGF-II receptor. The NMR structure reveals a structural difference between IGF-I and IGF-II in the region of residues 53-58 of IGF-II (residues 54-59 of IGF-I): It is better defined in IGF-II than IGF-I, and unlike IGF-I, there is no bending in the skeleton around residues 53 and 54. This structural difference correlates with the replacement of Ala54 and Leu55 in IGF-II by Arg55 and Arg56 in IGF-I. Binding to the IGF-II receptor is either directly disrupted by the presence of charged residues in this region, or changes in structure caused by charged residues cause changes in binding to the IGF-II receptor. It may either occur. In either case, substitution of uncharged residues for two Arg residues in IGF-I results in higher affinity for the IGF-II receptor. Thus, the presence of positively charged residues at these positions correlates with loss of binding to the IGF-II receptor.
[0036]
IGF-II binds to repeat 11 of the cation-independent M6P receptor. Indeed, a minireceptor in which only repeat 11 is fused to the transmembrane and cytoplasmic domains of the cation-independent M6P receptor (with an affinity of about one-tenth that of the full-length receptor) to IGF-II. It can bind and mediate the internalization of IGF-II and its delivery to lysosomes (Grimme et al. (2000) J. Biol. Chem. 275 (43): 33697-33703). The structure of domain 11 of the M6P receptor is known (Protein Data Base entries 1GP0 and 1GP3; Brown et al. (2002) EMBO J. 21 (5): 1054-1062). The putative IGF-II binding site is a hydrophobic pocket believed to interact with the hydrophobic amino acids of IGF-II; candidate amino acids of IGF-II include leucine 8, phenylalanine 48, alanine 54 and leucine 55 . Constructs with repeat 11 sufficient for IGF-II binding but containing a larger portion of the cation-independent M6P receptor (eg, repeats 10-13 or 1-15) generally have higher affinity and increased It binds to IGF-II in a pH-dependent manner (see, eg, Linnell et al. (2001) J. Biol. Chem. 276 (26): 23986-23991).
[0037]
(Binding to IGF-I receptor)
Substitution of IGF-II residue Tyr27 with Leu, substitution of Leu43 with Val, or substitution of Ser26 with Phe increases the affinity of IGF-II for the IGF-I receptor by 1/94, 1 /, respectively. Reduce to 56 or 1/4. Deletion of residues 1-7 of human IGF-II reduces the affinity for human IGF-I receptor by 1/30 and simultaneously increases the affinity for rat IGF-II receptor by a factor of 12. The NMR structure of IGF-II shows that Thr7 is located in the vicinity of residues 48Phe and 50Ser, and in the vicinity of the 9Cys-47Cys disulfide bond. It is believed that the interaction of these residues with Thr7 can stabilize the flexible N-terminal hexapeptide required for IGF-I receptor binding. At the same time, this interaction can regulate binding to the IGF-II receptor. A shortening of the C-terminus of IGF-II (residues 62-67) also appears to reduce the affinity of IGF-II for the IGF-I receptor by 1/5.
[0038]
(Deletion mutant of IGF-II)
The binding surface for IGF-I and the cation-independent M6P receptor is on a separate surface of IGF-II. Based on structural and mutational data, a functional cation-independent M6P binding domain can be constructed that is substantially smaller than human IGF-II. For example, amino-terminal amino acids 1-7 and / or carboxy-terminal amino acids 62-67 can be deleted or substituted. In addition, amino acids 29-40 can possibly be omitted or substituted without altering the rest of the polypeptide or binding to the cation-independent M6P receptor. Thus, a targeting moiety comprising amino acids 8-28 and 41-61 can be constructed. These stretches of amino acids can probably be linked directly or separated by a linker. Alternatively, amino acids 8-28 and 41-61 can be provided on separate polypeptide chains. Comparable domains of insulin that have a tertiary structure that is homologous to IGF-II and closely related to the structure of IGF-II, even if present in separate polypeptide chains, are suitable for proper tertiary structure. With sufficient structural information to allow proper refolding (Wang et al. (1991) Trends Biochem. Sci. 279-281). Thus, for example, amino acids 8-28 or a conservative substitution variant thereof can be fused to a therapeutic agent; the resulting fusion protein can be mixed with amino acids 41-61 or a conservative substitution variant thereof and administered to a patient. Can be done. According to the present invention, similar fragments of IGF-I are useful in fusion with therapeutic agents.
[0039]
(Binding to IGF binding protein)
IGF-II and related constructs can be modified to reduce affinity for IGFBP, thereby increasing the bioavailability of the tagged protein.
[0040]
Replacement of IGF-II residue phenylalanine 26 with a serine residue reduces binding to IGFBP 1-5 by 1/5 to 1/75. Substitution of residues 48-50 of IGF-II with threonine-serine-isoleucine reduces binding to most IGFBP by less than 1/100. However, these residues are also important for binding to the cation-independent mannose-6-phosphate receptor. A Y27L substitution that disrupts binding to the IGF-I receptor prevents the formation of a ternary complex with IGFBP3 and an acid labile subunit; this ternary complex accounts for most of the circulating IGF-II . Deletion of the first 6 residues of IGF-II also prevents IGFBP binding.
[0041]
Studies on the interaction of IGF-I with IGFBP further show that substitution of phenylalanine 16 with serine does not affect secondary structure, but reduces IGFBP binding between 1/40 and 1/300. It revealed that. Changing glutamate 9 to lysine also resulted in a significant decrease in IGFBP binding. In addition, the lysine 9 / serine 16 double mutant showed the lowest affinity for IFGBP. Although these mutations have not been previously tested in IGF-II, sequence conservation between this region of IGF-I and this region of IGF-II is similar to that of a similar mutation (
[0042]
(IGF homolog)
The human IGF-I, IGF-II or some of those amino acid sequences that affect transport to the brain are used as reference sequences so that the candidate sequence has a reasonable prediction of success in the method of the invention. Can be determined whether they have sufficient amino acid sequence similarity. Preferably, the variant sequence is at least 70% similar or 60% identical to human IGF-I or human IGF-II, more preferably at least 75% similar or 65% identical, and most preferably 80% similar or 70% identical.
[0043]
To determine whether a candidate peptide region has the required% similarity or% identity to human IGF-I or human IGF-II, Smith and Waterman (1981) J. MoI. Mol. Biol. The dynamic programming algorithm described in 147: 195-197 is used in conjunction with the BLOSUM62 substitution matrix described in FIG. 2 of Henikoff and Henikoff (1992) PNAS 89: 10915-10919 to generate candidate amino acid sequences and human IGFs. -I or human IGF-II are aligned first. For the present invention, a suitable value for the gap insertion penalty is -12 and a suitable value for the gap extension penalty is -4. Computer programs that perform alignment using the Smith-Waterman and BLOSUM62 matrix algorithms (eg, GCG program package software (Oxford Molecular Group, Oxford, England)) are commercially available and widely used by those skilled in the art.
[0044]
Once the alignment between the candidate sequence and the reference sequence is made, a% similarity score can be calculated. The individual amino acids of each sequence are compared sequentially with each other according to their similarity. If the value in the BLOSUM62 matrix corresponding to two aligned amino acids is 0 or a negative number, the pair similarity score is 0; otherwise, the pair similarity score is 1.0 . The raw similarity score is the sum of the similarity scores of aligned amino acid pairs. The raw score is then normalized by dividing by the number of smaller amino acids in the candidate or reference sequence. The normalized raw score is the% similarity. Alternatively, the aligned amino acids of each sequence are again compared sequentially to calculate% identity. If the amino acids are not identical, the pair's identity score is 0; otherwise, the pair's identity score is 1.0. The raw identity score is the sum of the same aligned amino acids. The raw score is then normalized by dividing by the number of smaller amino acids in the candidate or reference sequence. The normalized raw score is% identity. Insertions and deletions are ignored for purposes of calculating% similarity and% identity. Therefore, gap penalties are not used in this calculation, but are used for the initial alignment.
[0045]
(Structural analog of IGF)
The known structure of the human IGF protein allows the design of IGF analogs using computer-aided design principles (eg, discussed in US Pat. Nos. 6,226,603 and 6,273,598). is there. For example, known atomic coordinates for IGF-II can be obtained from conventional computer modeling programs (eg, INSIGHT II, DISCOVER or DELPHI (commercially available from Biosym, Technologies, Inc.) or QUANTA or CHARMM (commercially available from Molecular Simulations, Inc.). To be provided on a computer equipped with). These and other software programs allow analysis of molecular structures and simulations that predict the impact of molecular changes on structure and intermolecular interactions. For example, the software can be used to identify modified analogs that have the ability to form additional intermolecular hydrogen bonds or ionic bonds to improve the affinity of the analog for the target receptor.
[0046]
This software also allows the design of peptides and organic molecules that have structural and chemical features that mimic the same features presented on at least a portion of the IGF surface sufficient to target the CNS . Preferred embodiments of the present invention relate to designing and generating synthetic organic molecules having a framework, the amino acid side identified as being associated with CNS targeting as described herein. It possesses a chemically interacting moiety in a spatial relationship that mimics the spatial relationship of chemical moieties placed on a chain.
[0047]
For example, one skilled in the art using conventional computer programs in identifying appropriate chemical groups can design small molecules with the appropriate chemical moieties placed on an appropriate carrier framework. Useful computer programs are described, for example, in: Dixon (1992) Tibtech 10: 357-363; Tschinke et al. Med. Chem. 36: 3863-3870; and Eisen et al. (1994) Proteins: Structure, Function, and Genetics 19: 199-221, the disclosures of which are incorporated herein by reference.
[0048]
One specific computer program, the title “CAVEAT”, searches a database (eg, Cambridge Structural Database for structures with chemical moieties of the desired spatial orientation) (Bartlett et al. (1989), “Molecular Recognition: Chemical”. and Biological Problems "(Roberts, S.M.) pp 182-196). The CAVEAT program is designed to design analogs of tendamistat (a 74-residue inhibitor of α-amylase) based on the orientation of selected amino acid side chains in the three-dimensional structure of tendamistat. Used (Bartlett et al. (1989) supra).
[0049]
Alternatively, in identifying a series of analogs that target transport to the CNS, one of skill in the art will assist the skilled artisan to develop a quantitative structure-activity relationship (QSAR) and further assist in the design of additional analogs. Various computer programs can be used. Other useful computer programs are described in, for example, Connolly-Martin (1991) Methods in Enzymology 203: 587-613; Dixon (1992) supra; and Waszkowyz et al. Med. Chemm. 37: 3994-4002.
(Therapeutic agent)
While the methods and compositions of the present invention are useful for generating and delivering any therapeutic agent to the CNS, the present invention is particularly useful for gene products that overcome enzyme deficiencies associated with lysosomal storage diseases. is there.
[0050]
Preferred LSD genes are shown in Table 1. In a preferred embodiment, the wild type LSD gene product is delivered to a patient suffering from a defect in a similar LSD gene. In an alternative embodiment, a functional sequence or functional species of the LSD gene is used. In a further embodiment, genes encoding different enzymes that can aid in LSD gene deletion are used according to the present invention.
[0051]
[Table 1]
[0052]
[Table 2]
[0053]
[Table 3]
In one embodiment, the therapeutic agent is glucocerebrosidase, which is currently manufactured by Genzyme as an effective enzyme replacement therapeutic for Gaucher disease. Currently, this enzyme is prepared with exposed mannose residues, which specifically target the protein to macrophage-bound cells. The primary pathology in patients with
[0054]
(Meeting between targeting and treatment)
The therapeutic and targeting moieties of the compositions of the present invention necessarily associate directly or indirectly. In one embodiment, the therapeutic moiety and targeting moiety associate non-covalently. For example, the targeting moiety can be biotinylated and bind an avidin moiety that is associated with the therapeutic moiety. Alternatively, the targeting moiety and the therapeutic moiety can each be associated (eg, a fusion protein) with different subunits of the multimeric protein. In another embodiment, the targeting moiety and the therapeutic moiety are crosslinked to each other (using a chemical crosslinking agent).
[0055]
In preferred embodiments, the therapeutic moiety is fused to the targeting moiety as a fusion protein. The targeting moiety can be the amino terminus, carboxy terminus of the fusion protein, or can be inserted within the sequence of the therapeutic moiety at a position where the presence of the targeting position does not unduly interfere with the therapeutic activity of the therapeutic moiety.
[0056]
The therapeutically active moiety is a heteromeric protein and one or more of the subunits can be associated with a targeting moiety. Hixosaminidase A (eg, a lysosomal protein affected by Tay-Sachs disease) contains an α subunit and a β subunit. Either the α subunit, or the β subunit, or both can be associated with the targeting moiety according to the present invention. For example, when the α subunit associates with the targeting moiety and is co-expressed with the β subunit, an active complex is formed and targeted to the lysosome.
[0057]
(Expression method)
The methods and compositions of the present invention are useful in the context of many different expression systems. For example, a protein of the invention can be targeted to the CNS and is preferably taken up by lysosomes, whether it is expressed and isolated from Leishmania, baculovirus, yeast, bacteria, mammals or other expression systems. Either. The present invention thus allows great flexibility in protein production. For example, if the protein to be produced contains one or more disulfide bonds, an appropriate expression system can be selected and modified, which, if appropriate, further improves the yield of a properly folded protein. For example, one useful IGF targeting moiety has three intramolecular disulfide bonds. E. The fusion protein of the invention expressed in E. coli can be constructed and directed to the periplasmic space. When the IGF tag is fused to the C-terminus of another protein, It can be secreted in an active form in the periplasm of E. coli (Wadensten, Ekebacke et al., 1991). In order to promote optimal folding of the IGF moiety, an appropriate concentration of reduced and oxidized glutathione is preferably added to the cellular environment to promote disulfide bond formation. If the fusion protein having a disulfide bond does not completely dissolve, any insoluble material is preferably treated with a chaotropic agent (eg, urea) to solubilize the denatured protein and be reduced and oxidized at the appropriate concentration. Glutathione, or refolded in a buffer with other oxidizing and reducing agents, to promote proper disulfide bond formation (Smith, Cook et al., 1989). For example, IGF-I is refolded with 6M guanidine-HCl and 0.1M tris (2-carboxyethyl) phosphine reducing agent for the denaturation and reduction of IGF-II (Yang, Wu et al., 1999). ). Protein refolding was achieved in 0.1 M Tris-HCl buffer (pH 8.7) containing 1 mM oxidized glutathione, 10 mM reduced glutathione, 0.2 M KCl and 1 mM EDTA.
[0058]
The methods of the invention are also useful for targeting proteins directly to the mammalian CNS without the need for purification steps. In one embodiment, the IGF fusion protein is expressed in a symbiont or parasite administered to the host. The expressed IGF fusion protein is secreted into the bloodstream by the organism and delivered across the blood brain barrier.
[0059]
In some embodiments of the invention, the CNS targeting protein is delivered in situ via viable Leishmania that secretes the protein into the lysosomes of infected macrophages. From this organelle, the protein can leave the cell and be delivered across the blood brain barrier. Thus, IGF tags and therapeutic agents necessarily remain intact when this protein is present in macrophage lysosomes. Thus, when proteins designed for delivery to lysosomes in the CNS are expressed in situ, they are preferably modified to ensure compatibility with the lysosomal environment. In an alternative embodiment, the therapeutic agent of the present invention is a T.B. It can be delivered by expression in brucei.
[0060]
(Nucleic acids and expression systems)
The chimeric fusion proteins of the invention can be expressed in a variety of expression systems, including in vitro translation systems and intact cells. Because M6P modifications are not a prerequisite for targeting, targeted therapeutic agents, even in various expression systems (including yeast, baculovirus) and prokaryotic systems that do not glycosylate proteins (eg, E. coli) Appropriate for protein expression. Indeed, non-glycosylated proteins generally have improved bioavailability. This is because glycosylated proteins are rapidly cleared from the circulation through binding to the mannose receptor in the hepatic sinusoidal capillary endothelium.
[0061]
Alternatively, production of a chimeric targeted lysosomal enzyme in a mammalian cell expression system produces a protein having multiple binding determinants for the cation-independent M6P receptor. Co-action between two or more cation-independent M6P receptor ligands (eg, M6P and IGF-II, or M6P and retinoic acid) can be utilized: multivalent ligands enhance receptor binding by receptor cross-linking It has been demonstrated that
[0062]
In general, a gene cassette encoding a chimeric therapeutic protein is adapted for a particular expression system and contains sequences necessary for optimal expression (eg, promoters, ribosome binding sites, introns, or alterations in the coding sequence). Can be incorporated and codon usage can be optimized. Since the protein is preferably secreted from the producer cell, the DNA encoding the signal peptide that is compatible with the expression system can be substituted for the endogenous signal peptide. For example, for expression of β-glucuronidase and α-galactosidase A tagged with IGF-I or IGF-II in Leishmania, the DNA cassette encoding the Leishmania signal peptide (GP63 or SAP) encodes the endogenous signal peptide. Inserted at the position of the DNA cassette to achieve optimal expression. In mammalian expression systems, an endogenous signal peptide is used, but if an IGF-I tag or IGF-II tag is fused at the 5 ′ end of the coding sequence, the IGF-I signal peptide or IGF-II signal peptide It is desirable to use
[0063]
CHO cells are the preferred mammalian host for production of therapeutic protein. Classical methods for achieving high yield expression from CHO cells are CHO cell lines deficient in dihydrofolate reductase (DHFR) (eg, CHO cell line DUKX (O'Dell et al. (1998) Int. J). Biochem.Cell Biol.30 (7): 767-71)). This line of CHO cells requires hypoxanthine and thymidine for growth. Co-transfection of genes overexpressed by the DHFR gene cassette on separate plasmids or a single plasmid allows selection for the DHFR gene, and generally the selected recombinant protein is also Allows isolation of expressing clones. For example, plasmid pcDNA3 uses a cytomegalovirus (CMV) early region regulatory region promoter to drive expression of the gene of interest and pSV2DHFR and promote DHFR expression. Subsequent exposure of cells tethering the recombinant gene cassette to increasing concentrations of the folate analog methotrexate results in amplification of both the gene copy number of the DHFR gene and the gene copy number of the co-transfected gene.
[0064]
A preferred plasmid for eukaryotic expression in this system contains the gene of interest placed downstream of a strong promoter such as CMV. An intron can be placed in close proximity to the 3 ′ side of the gene cassette. The DHFR cassette can be driven by a second promoter from the same plasmid or from another plasmid. In addition, it may be useful to incorporate additional selectable markers within the plasmid, such as neomycin phosphotransferase (confers resistance to G418).
[0065]
Another CHO expression system (Ulmasov et al. (2000) PNAS97 (26): 14212-14217) relies on amplification of the gene of interest using G418 instead of the DHFR / methotrexate system described above. The pCXN vector with a slightly defective neomycin phosphotransferase driven by a weak promoter (see, eg, Niwa et al. (1991) Gene 108: 193-200) has a high copy number (> 300) in a single step. Allows selection of transfectants with.
[0066]
Alternatively, the recombinant protein can be produced in the human HEK293 cell line using an expression system based on the Epstein-Barr virus (EBV) replication system. It consists of the EBV origin of replication oriP and the EBV ori binding protein, EBNA-1. Binding of EBNA-1 to oriP initiates replication and subsequent amplification of extrachromosomal plasmids. This amplification then results in a high level of expression of the gene cassette housed in the plasmid. A plasmid containing oriP can be transfected into EBNA-1 transformed HEK293 cells (commercially available from Invitrogen) or a plasmid such as pCEP4 (commercially available from Invitrogen) (which drives the expression of EBNA-1, And EBV oriP) can be used.
[0067]
E. In E. coli, the therapeutic protein is preferably secreted into the periplasmic space. This can be accomplished by using a nucleic acid cassette encoding a bacterial signal peptide (eg, an ompA signal sequence) instead of DNA encoding the endogenous signal peptide of the LSD protein. Expression can be driven by any of a number of strong inducible promoters (eg, lac promoter, trp promoter, or tac promoter). One suitable vector is pBAD / gIII (commercially available from Invitrogen), which uses the Gene III signal peptide and the araBAD promoter.
[0068]
(In vivo expression)
A nucleic acid encoding a therapeutic protein (preferably a secreted therapeutic protein) can be advantageously provided directly to a patient suffering from a disease or provided to a cell ex vivo, followed by administration of a living cell to the patient. Can be done. In vivo gene therapy methods known in the art include providing purified DNA (eg, in a plasmid), providing DNA in a viral vector, or providing DNA in a liposome or other vesicle. (See, eg, US Pat. No. 5,827,703, which discloses lipid carriers for use in gene therapy, and US Pat. No. 6,281,010, which provides adenoviral vectors useful in gene therapy. about).
[0069]
Methods for treating diseases by transplanting cells that have been modified to express recombinant proteins are also well known. See, eg, US Pat. No. 5,399,346, which discloses methods for introducing nucleic acids into primary human cells for introduction into humans. Although the use of human cells for ex vivo therapy is preferred in some embodiments, other cells (eg, bacterial cells) can be transplanted into the patient's vasculature and release the therapeutic agent continuously. See, for example, U.S. Pat. Nos. 4,309,776 and 5,704,910.
[0070]
The methods of the invention are particularly useful for targeting proteins directly to subcellular components without the need for purification steps. In one embodiment, the IGF-II fusion protein is expressed in a symbiotic or attenuated parasite administered to the host. Expressed IGF-II fusion proteins are secreted by the organism, taken up by host cells, and targeted to their lysosomes.
[0071]
In some embodiments of the invention, an IGF fusion protein (eg, a GILT protein) is delivered in situ, via live Leishmania that secretes the protein, into the lysosomes of infected macrophages. From this organelle it releases cells and is taken up by neighboring cells that are not macrophage lineages. Thus, the IGF tag and the therapeutic agent remain intact while the protein is in the macrophage lysosome. Thus, when GILT proteins are expressed in situ, they are preferably modified to ensure compatibility with the lysosomal environment. Human β-glucuronidase (human “GUS”) (an exemplary therapeutic protein) typically undergoes C-terminal peptide cleavage either in lysosomes or during transport to lysosomes (eg, residues of GUS Between 633 and 634). Thus, in embodiments where the GUS-GILT construct is expressed by Leishmania in macrophage lysosomes, the human GUS is preferably modified to make the protein resistant to cleavage or the residue following residue 633. The group is preferably simply omitted from the GILT fusion protein. Similarly, any IGF tag of the present invention is preferably modified to increase its resistance to proteolysis, or a minimal binding peptide (eg, identified by phage display or yeast two-hybrid) is Used in place of the wild type IGF moiety.
[0072]
(Underglycosylation)
The target therapeutic protein is preferably underglycosylated: one or more carbohydrate structures normally present when the protein is produced in mammalian cells are preferably omitted, removed or modified. Or masked to increase the half-life of the protein in the mammal. Underglycosylation can be achieved in a number of ways, some of which are illustrated in FIG. As shown in FIG. 5, a protein can actually be underglycosylated, can actually lack one or more carbohydrate structures, or can be functionally modified or masked by one or more carbohydrate structures. Can be underglycosylated. The protein may actually be under-glycosylated and, when synthesized, fully aglycosylated (as synthesized in E. coli) or partially as discussed in Example 12. It can be non-glycosylated (when synthesized in a mammalian system after destroying one or more glycosylation sites by site-directed mutagenesis) or have a non-mammalian glycosylation pattern. Actual non-glycosylation can also be achieved by deglycosylation of the protein after synthesis. As discussed in Example 12, deglycosylation can be by chemical or enzymatic treatment and can be fully deglycosylated or if only a portion of the carbohydrate structure is removed. Partially deglycosylated.
[0073]
(Administration)
The targeted therapeutic agent produced according to the present invention can be administered to the mammalian host by any route. Thus, where appropriate, administration can be oral or parenteral (including intravenous and intraperitoneal routes of administration). Furthermore, administration can be by periodic injection of a bolus therapeutic agent or can be made more continuous by intravenous or intraperitoneal administration from an external reservoir (eg, an iv bag). In certain embodiments, the therapeutic agents of the present invention can be pharmaceutical grade. That is, certain embodiments meet the purity and quality control standards required for human administration. Veterinary applications are also within the intended meaning used herein.
[0074]
Formulations of therapeutic agents according to the present invention (for both veterinary use and human medical use) typically include such therapeutic agents, pharmaceutically acceptable carriers and any other ingredients for them. Include with. A carrier can be “acceptable” in the sense of being compatible with the other ingredients of the formulation and not injurious to the recipient thereof. In this regard, pharmaceutically acceptable carriers include any and all solvents, dispersion media, coatings, antibacterial and antifungal agents, isotonic and absorption delaying agents and the like that are compatible with pharmaceutical administration. Is intended. The use of such media and agents for pharmaceutically active substances is known in the art. Except insofar as any conventional media or agent is incompatible with the active compound, its use in the composition is contemplated. Supplementary active compounds (identified according to the invention and / or known in the art) can also be incorporated into the compositions. The formulations may conveniently be present in dosage unit form and may be prepared by any method well known in the pharmacology / microbiology art. In general, some formulations involve associating the therapeutic agent with a liquid carrier or a finely divided solid carrier or both and then, if necessary, shaping the product into the desired formulation. Prepared by
[0075]
A pharmaceutical composition of the invention is formulated to be compatible with its intended route of administration. Examples of routes of administration include oral or parenteral (eg, intravenous administration, intradermal administration, inhalation administration, transdermal (topical) administration, transmucosal administration, and rectal administration). Solutions or suspensions used for parenteral, intradermal or subcutaneous application may contain the following components: sterile diluent (eg, water for injection, saline, fixed oil) , Polyethylene glycol, glycerin, propylene glycol or other synthetic solvents); antibacterial agents (eg benzyl alcohol or methyl paraben); antioxidants (eg ascorbic acid or sodium bisulfite); chelating agents (eg ethylenediaminetetraacetic acid); Buffers (eg acetate, citrate, or phosphate) and agents for modulation of tonicity (eg sodium chloride or dextrol). Ph can be adjusted with acids or bases, such as hydrochloric acid or sodium hydroxide.
[0076]
Solutions useful for oral or parenteral administration are described, for example, in Remington's Pharmaceutical Sciences, (Gennaro, A), Mack Pub. , 1990, and can be prepared by any of the methods well known in the pharmaceutical arts. Formulations for parenteral administration may also include glycocholate for buccal administration, methoxysalicylate for rectal administration, or tricric acid for vaginal administration. The parenteral preparation can be enclosed in ampoules, disposable syringes or multiple dose vials made of glass or plastic. Suppositories for rectal administration are also obtained by mixing the drug with nonirritating excipients such as cocoa butter, other glycerides or other compositions that are solid at room temperature and liquid at body temperature. Can be prepared. Formulations can also include, for example, polyalkylene glycols (eg, polyethylene glycol), plant-derived oils, hydrogenated naphthalene, and the like. Formulations for direct administration can include glycerol and other compositions of high viscosity. Other potentially useful parenteral carriers for these therapeutic agents may include ethylene-vinyl acetate copolymer particles, osmotic pumps, implantable infusion systems, and liposomes. Formulations for inhalation administration may include excipients (eg, lactose) or, for example, in the form of aqueous solutions containing polyoxyethylene-9-lauryl ether, glycocholate and deoxycholate, or nasal drops It can be as an oily solution for administration or as a gel applied nasally. Retention enemas can also be used for rectal delivery.
[0077]
Formulations of the present invention suitable for oral administration are in discrete unit forms (eg, capsules, gelatin capsules, sachets, tablets, troches, or lozenges) each containing a predetermined amount of drug. Contained); in the form of a powder or granules; in the form of an aqueous or non-aqueous liquid solution or suspension; or in the form of an o / w emulsion or w / o emulsion. The therapeutic agent can also be administered in the form of a bolus, electuary or paste. A tablet may be made by compressing or adjusting the drug, optionally with one or more accessory ingredients. Compressed tablets are mixed in a suitable machine in a free-flowing form (e.g., powder or granules), optionally mixed with a binder, lubricant, inert diluent, surfactant or dispersant, It can be prepared by compression. Molded tablets can be made by molding in a suitable machine a mixture of a suitable carrier moistened with a powdered drug and an inert liquid diluent.
[0078]
Oral compositions generally include an inert diluent or an edible carrier. For the purpose of oral therapeutic administration, the active compound can be incorporated with excipients. An oral composition prepared using a fluid carrier for use as a mouthwash contains the compound in a fluid carrier and is orally applied, swished, exhaled or swallowed. Pharmaceutically compatible binding agents, and / or adjuvant materials can be included as part of the composition. Tablets, pills, capsules, troches and the like may contain any of the following ingredients or compounds of similar nature: binders (eg, microcrystalline cellulose, gum tragacanth or gelatin); excipients (eg, starch) Or lactose); disintegrants (eg, alginic acid, primogel, or corn starch); lubricants (eg, magnesium stearate or Sterotes); glidants (eg, colloidal silicon dioxide); sweeteners (eg, sucrose or Saccharin); or a flavoring agent (eg, peppermint, methyl salicylate, or orange flavoring).
[0079]
Pharmaceutical compositions suitable for injectable use include sterile aqueous solutions (where water soluble) or dispersions and sterile powders for the extemporaneous preparation of sterile injectable solutions or dispersion. For intravenous administration, suitable carriers include physiological saline, bacteriostatic water, Cremophor EL ™ (BSAF, Parsippany, NJ) or phosphate buffered saline (PBS). In all cases, the composition can be sterile and can be fluid to the extent that easy syringability exists. It can be stable under the conditions of manufacture and storage and can be preserved against the contaminating action of microorganisms such as bacteria and fungi. The carrier can be a solvent or dispersion medium including, for example, water, ethanol, polyol (for example, glycerol, propylene glycol, and liquid polyethylene glycol, and the like), and suitable mixtures thereof. The proper fluidity can be maintained, for example, by the use of a coating, such as lecithin, by the maintenance of the required particle size in the case of dispersion and by the use of surfactants. Prevention of the action of microorganisms can be achieved by various antibacterial and antifungal agents (eg, parabens, chlorobutanol, phenol, ascorbic acid, thimerosal, etc.). In many cases, it will be preferable to include isotonic agents, for example, sugars, polyalcohols such as mannitol, sorbitol, and sodium chloride in the composition. Prolonged absorption of injectable compositions can be brought about by including in the composition an agent that delays absorption, for example, aluminum monostearate and gelatin.
[0080]
Sterile injectable solutions are prepared by incorporating the active compound in the required amount in a suitable solvent having one or a combination of the ingredients listed above and then, if required, sterile filtering. Can be done. Generally, dispersions are prepared by incorporating the active compound into a sterile vehicle that contains the basic dispersion medium and the required other ingredients from those enumerated above. . In the case of sterile powders for the preparation of sterile injectable solutions, methods of preparation include vacuum drying and lyophilization, which can be any additional treatment from the active ingredient and its pre-sterilized filtered solution. This produces a powder with the desired ingredients.
[0081]
Formulations suitable for intra-articular administration can be in the form of a sterile aqueous preparation of the therapeutic agent, which can be in microcrystalline form (eg, in the form of an aqueous microcrystalline suspension). Liposomal formulations or static degrading polymer systems can also be used to provide therapeutics for both intra-articular and ophthalmic arterial administration.
[0082]
Formulations suitable for topical administration include oil-in-water or water-in-oil emulsions such as liquid or semi-liquid preparations (eg, liniments, lotions, gels, applicants), creams, ointments or pastes. Or ophthalmic treatments, including solutions or suspensions such as eye drops. Formulations for topical administration to the skin surface can be prepared by dispersing the therapeutic agent with a dermatologically acceptable carrier such as a lotion, cream, ointment or soap. In some embodiments, a carrier that can form a film or layer on the skin, restricts application locally and prevents removal is useful. Where attachment to a tissue surface is desired, the composition may include a therapeutic agent dispersed in a fibrinogen-thrombin composition or other bioadhesive. The therapeutic agent can then be colored and sprayed or otherwise applied to the desired tissue surface. For topical administration to the internal tissue surface, the agent can be dispersed in a liquid tissue adhesive or other material known to enhance adsorption to the tissue surface. For example, hydroxypropylcellulose or fibrinogen / thrombin solutions can be used to advantage. Alternatively, a tissue coating solution (eg, a pectin-containing formulation) can be used.
[0083]
For inhalation treatments (eg for asthma), inhalation of powders (self-propelled or spray formulations) dispensed with a spray can, nebulizer or atomizer can be used. Such formulations can be in finely divided powder form for pulmonary administration from powder inhalation devices or can be self-propelled powder dosage formulations. In the case of self-propelling solutions and spray formulations, this effect can be achieved by the choice of values having the desired spray characteristics (ie that can produce a spray having the desired particle size) or controlled particle size suspension. Can be achieved either by incorporating the active ingredient as a finished powder. For administration by inhalation, the therapeutic agent can also be delivered in the form of an aerosol spray from a pressure container or dispenser, which can be a suitable propellant (eg, a gas such as carbon dioxide), or a nebulizer. Nasal drops comprising: can also be used.
[0084]
Systemic administration can also be by transmucosal or transdermal means. For transmucosal or transdermal administration, penetrants appropriate to the barrier to be permeated can be used in the formulation. Such penetrants are generally known in the art and include, for example, for transmucosal administration, detergents, bile salt derivatives, and filsidic acid derivatives. Transmucosal administration can be accomplished through the use of nasal sprays or suppositories. For transdermal administration, the therapeutic agent is typically formulated in an ointment, salve, gel or cream, as generally known in the art.
[0085]
In one embodiment, the therapeutic agent is prepared with a carrier that protects against rapid elimination from the body, such as a controlled release formulation, including implants and microencapsulated delivery systems. It is a thing. Biodegradable and biocompatible polymers can be used, such as ethylene vinyl acetate, polyanhydrides, polyglycolic acid, collagen, polyorthoesters, and polylactic acid. Methods for the preparation of such formulations will be apparent to those skilled in the art. Materials are also available from Alza Corporation and Nova Pharmaceuticals Inc. Commercially available. Liposomal suspensions can also be used as pharmaceutically acceptable carriers. These can be prepared according to methods known to those skilled in the art, for example, as described in US Pat. No. 4,522,811. Microsomes and microparticles can also be used.
[0086]
Oral or parenteral compositions can be formulated in dosage unit form for ease of administration and uniformity of dosage. Dosage unit form refers to physically discrete units suitable as unit dosages for the subject to be treated. Each unit contains a predetermined quantity of active compound calculated to produce the desired therapeutic effect in association with the required pharmaceutical carrier. The details of the dosage unit form of the invention are determined by the specific properties of the active compound, the particular therapeutic effect to be achieved, the presence of limitations inherent in the field of compound synthesis such as the active compound for individual treatments. , And these depend directly.
[0087]
In general, a therapeutic agent identified in accordance with the present invention will be administered to a human or other mammal for parenteral or oral administration, eg, a therapeutically effective amount (eg, sufficient to induce a desired effect). For a period of time, in an amount that provides the appropriate concentration of drug to the target tissue). Furthermore, the therapeutic agents of the present invention can be administered alone or in combination with other molecules known to have beneficial effects against a particular disease or intended indication. For illustrative purposes only, useful cofactors include symptom relief cofactors (including antiseptics, antibiotics, antivirals, antifungals and analgesics and anesthetics).
[0088]
The effective concentration of the therapeutic agent identified in accordance with the present invention delivered in the therapeutic agent composition will vary depending on the number of factors, including the final desired dosage and route of administration of the drug being administered. . The preferred dosage administered is also the type and extent of the disease or indication to be treated, the overall health of the particular patient, the relative biological efficiency of the therapeutic agent delivered, the formulation of the therapeutic agent, the formulation It appears to depend on variables such as the presence and type of excipients in the product and the route of administration. In some embodiments, the therapeutics of the invention are provided to an individual using a representative dosage unit inferred from previously described mammalian studies using non-human primates and rodents. Can be done. As noted above, a dosage unit is a cohesive (ie, that can be administered to a patient and is easily handled and packed, with the therapeutic agent itself or a mixture with a solid or liquid pharmaceutical diluent or carrier. A single dose that remains a physically and physiologically stable unit dose).
[0089]
In certain embodiments, the organism is engineered to produce a therapeutic agent identified according to the present invention. These organisms can release therapeutic agents for collection or can be introduced directly into the patient. In another series of embodiments, the cells can be utilized to act as carriers for therapeutic agents identified in accordance with the present invention.
[0090]
The therapeutic agents of the present invention also include “prodrug” derivatives. The term prodrug refers to a pharmacologically inactive (or partially inactive) derivative of a parent molecule, which is spontaneous or enzymatic in the organism to release or activate the active ingredient. Requires biotransformation at any point. Prodrugs are variants or derivatives of the therapeutic agents of the invention that have groups that are cleavable under metabolic conditions. Prodrugs become the therapeutic agents of the present invention, which are pharmaceutically active in vivo when they cause solvolysis or physiological degradation under physiological conditions. The prodrugs of the present invention may be referred to as single, double, triple, etc. depending on the number of biotransformation steps required to release or activate the active drug component in the organism, which is a precursor form Indicates the number of functional groups present. Prodrug forms often provide the benefits of solubility, histocompatibility, or delayed release in mammalian organisms (Bundgard, Design of Prodrugs, pp. 7-9, 21-24, Elsevier, Amsterdam 1985 and Silverman). , The Organic Chemistry of Drug Design and Drug Action, pp.352-401, Academic Press, San Diego, Calif., 1992). Furthermore, the prodrug derivatives according to the present invention can be combined with other features to enhance bioavailability.
【Example】
[0091]
(Example 1. Fusion protein expressing construct)
Nucleic acid constructs for expressing therapeutic protein fusions of the invention can be made recombinantly according to methods known in the art. For example, oligonucleotides complementary to genes encoding different components described herein can be used to create synthetic genes or to amplify natural gene and construct gene fusions. In a preferred embodiment, the protein of the invention is expressed from a recombinant gene comprising a signal sequence. Examples of useful nucleic acids include nucleic acids encoding IGF that target portions of the invention. Such nucleic acids can be based on the sequence of IGF-1 shown in FIG.
[0092]
(Example 2. Expression method and purification method)
Expression products can also be isolated from plasma-free media using other protozoan subgenuses containing other Leishmania species. In general, expression strains are grown in medium containing plasma, diluted in medium without plasma, and grown for several generations (preferably 2-5 generations), after which the expression product is simply isolated. Release. For example, the secreted recombinant LSD protein product can be isolated from Leishmania mexicana promastigote, which is 75 cm at 27 ° C. 2 In 1 × M199 medium (50 mL) in a flask. Cell density is 1-3x10 7 / Ml is used to inoculate 1.2 L of M199 medium. The density of this culture is about 5 × 10 6 When / ml was reached, the cells were collected by centrifugation, resuspended in 180 mL supernatant and used to seed 12 L of “Zima” medium in a 16 L spinner flask. The initial cell density of this culture is typically about 5 × 10 5 / ML. This culture is about 1.0-1.7 × 10e. 7 Grow to a density of cells / mL. Once this cell density is achieved, the cells are separated from the culture medium by centrifugation, and the supernatant is filtered through a 0.2μ filter at 4 ° C. to remove the remaining promastigotes. The filtered media was concentrated to 12.0 L-500 mL using a tangential flow filtration device (MILLIPORE Prep / Scale-TFF cartridge).
[0093]
Preferred growth media for this method are M199 and “Zima” growth media. However, other serum-containing media and media without serum are also useful. The M199 growth medium is as follows: (1 L batch) = 200 mL 5 × M199 (with phenol pH indicator) (mixed 5 times) +637 mL H 2 O, 50.0 mL FBS, 50.0 mL EF, 20.0 mL 50 g / mL SAT, 2.0 mL 0.25% hemin in 50% triethanolamine, 50 mM Hepes (pH 7.5). 10 mM adenine (10 mL), 40.0 mL 1 M Hepes (pH 7.5), 0.1 mL biotin in 1 mL 95% ethanol, 10.0 mL penicillin / streptomycin. All sera used are inactivated by heat. The final volume is 1 L and is sterile filtered. The “Zima” modified M199 medium is as follows: (20.0 L batch) = 217.8 g M199 powder (−) phenol red + 7.0 g sodium bicarbonate, 50 mM Hepes (pH 7.5) 200.0
[0094]
In accordance with one aspect of the present invention, an LSD protein secreted from Leishmania and containing a carbohydrate having a terminal mannose residue can be purified as follows. For example, a recombinant β-glucuronidase from Leishmania mexican containing the plasmid pXSAP0-GUS was grown in M199 culture medium containing a small amount of serum protein. This culture is> 1.0 × 10 7 When a density of promastigote / mL is reached, L. The mexican was removed by centrifugation (10 min, 500 × g). The collected culture medium was passed through a 0.2 μm filter to remove particulates and then loaded directly onto a control canavalin A (Con A) -agarose column (4% cross-linked bead agarose, Sigma). This ConA-Agarose column was loaded with 1 M NaCl, 20 mM Tris (pH 7.4), CaCl 2 MgCl 2 And MnCl 2 (5 mM each) and then 5 volumes of column buffer (20 mM Tris pH 7.4), 1 mM CaCl 2 And 1 mM MnCl 2 ). All 179,800 units (nmol / hour) of GUS activity (in 2 L) in culture medium were loaded onto a 22 mL ConA agarose column. No activity was detected during flow-through or washing. This GUS activity was eluted with a column buffer containing 200 mM methylmannopyranoside. The eluted fractions containing the activity peak were pooled and concentrated: 143900 units of GUS activity were recovered from the column (recovering 80% of the activity loaded on the column). This is because L.A. Recombinant β-GUS secreted from mexicana possesses a carbohydrate with a terminal mannose residue, and further uses the interaction of mannose with ConA as a basis for the affinity purification process. Indicates what to point out. Thus, the presence of high mannose carbohydrates can serve as the basis for the affinity process in the purification of recombinant LSD protein using lectin affinity chromatography.
[0095]
Example 3. Assay crossing the blood brain barrier
In accordance with the present invention, a model system useful for determining whether IGF-tagged proteins (especially LSD proteins) cross the blood brain barrier is the MPSVII mouse model (Wolfe and Sands (1996). Protocols for Gene Transfer in Neuroscience: Towers Gene Therapy of Neurological Disorders Chapter 20: 263-273). For example, recombinant human β-glucuronidase fused to an IGF tag can be produced in any convenient expression system (eg, Leishmania, yeast, mammal, baculovirus and other expression systems). L. expresses and secretes β-GUS. mexicana is 100 ml of standard promastigote medium (40 mM HEPES (pH 7.5), 0.1 mM adenine, 0.0005% hemin, 0.0001% biotin, 5% fetal calf serum, 5% embryonic fluid. ), M199 with 50 units / ml penicillin, 50 μg / ml streptomycin and 50 μg / ml noosethricin) at 26 ° C. About 5 × 10 6 After reaching a density of promastigotes / ml, the promastigotes are recovered by centrifuging at 1000 × g for 10 minutes at room temperature; these promastigotes are recovered in 1 L low protein medium ( M199 supplemented with 0.1 mM adenine, 0.0001% biotin, 50 units / ml penicillin and 50 μg / ml streptomycin). 1 L medium can be placed in a 2 L capped flask containing a sterile stir bar and thereby incubated at 26 ° C. with gentle agitation. The 1 L culture is aerated twice a day by moving the laminar flow hood, removing the lid, and shaking vigorously before replacing the lid. The culture is 2-3 × 10 7 When a density of promastigote / ml is reached, the culture is centrifuged as described above except that the promastigote pellet is discarded and the medium is poured into a sterile flask. 434 g of (NH 4 ) 2 SO 4 Precipitate the active GUS protein from the medium; store the salting-out medium at 4 ° C. overnight. The precipitated protein is recovered by either centrifugation at 10,500 × g for 30 minutes or filtration through a Gelman Super-800 membrane; the protein is recovered in 10 mM Tris (pH 8), 1 mM CaCl 2 Resuspend in and store at −80 ° C. until dialysis. Crude preparations from several liters of medium are thawed, pooled, placed in dialysis tubes (Spectra / Por-7, MWCO 25,000) and in DMEM (Dulbeco modified Eagle medium) containing bicarbonate. Dialyze overnight against two 1 L volumes. The ammonium sulfate fraction is further purified on a ConA column.
[0096]
B6. C-H-2 bml / ByBIR-gus mps GUS minus mice generated by // mice heterozygous use are used to evaluate the effect of GUS-IGF fusion proteins or derivatives in enzyme replacement therapy. Two formats are used. In one format, 3-4 animals are given a single injection of 20,000 U of enzyme in 100 μl of enzyme dilution buffer (150 mM NaCl, 10 mM Tris pH 7.5). Mice are killed 72-96 hours later and the efficacy of treatment is evaluated. In the second format, the mice are given weekly injections of 20,000 units for 3-4 weeks and the mice are sacrificed 1 week after the final injection. Histochemical and histopathological analyzes of the liver, spleen and brain are performed by published methods. In the absence of treatment, GUS minus mouse cells (eg, macrophages and Kupffer cells) create large intracellular accumulation compartments derived from the accumulation of waste products in lysosomes. In cells in mice treated with the GUS fusion constructs of the invention, the size of these compartments is expected to be visually reduced or the compartments reduced until they are no longer visible with light microscopy. The
[0097]
In accordance with the present invention, newborn mice do not possess a complete blood brain barrier. However, by day 15, the blood brain barrier is formed to the point where β-glucuronidase can no longer be detected in the brain. Therefore, the above experiment is preferably performed on mice that are 15 days or longer.
[0098]
In accordance with one embodiment of the invention, the experiment first assesses the ability of the full IGF-I tag and IGF-II tag to direct proteins across the blood brain barrier. Next, a specific mutant version of the protein that disrupts the binding of the receptor or IGF binding protein is assayed. For domain exchange, the B domain of IGF-II (residues 1-28 of the mature protein) contains only two differences from IGF-I, which may be thought to alter transport across the blood brain barrier G11 and T16. . Changing these residues in IGF-II is essentially a domain B exchange. Another exchange of regions between residues 28 and 41 of IGF-II and the corresponding region of IGF-I can also be tested. This essentially exchanges the C domains of the two proteins, including the most branched regions of the two proteins. An alternative exchange switches the C-terminal 15 residues with the corresponding region of IGF-I. These three chimeras are the essence of how the difference in uptake across the blood brain barrier between IGF-I and IGF-II correlates with the sequence / structure differences between the two proteins. Provide a complete picture.
[0099]
Example 4. Assay for protein accumulation in brain or CNS
A radioactive assay can be used to monitor the accumulation of protein products in the brain. For example, uptake and accumulation of radiolabeled protein in the brain parenchyma can be assayed as disclosed in Reinhardt and Bondy (1994) Endocrinology 135: 1753-1176.
[0100]
Enzymatic assays can also be used to monitor the accumulation of protein products in the brain. Enzymatic assays are particularly useful when the therapeutic protein moiety is an enzyme for an assay applicable to histochemical staining. Useful enzyme assays for lysosomal storage disease proteins are described in Sly et al. (2001) P.M. N. A. S. 98 (5): 2205-2210 and Wolfe and Sands (1996) Protocols for Gene Transfer in Neuroscience: Worlds Gene Therapy of Neurological Chapters Disclosure 20: 263-27.
[0101]
Example 5. In vivo therapy
B6. C-H-2 bml / ByBIR-gus mps GUS minus mice (Birkenmeier, Davison et al., 1989) generated by // mice atypical mating are used to evaluate the effectiveness of the compositions of the invention in enzyme replacement therapy. Two formats are used. In one format, 3-4 animals are given a single injection of 20,000 U of enzyme in 100 μl of enzyme dilution buffer (150 mM NaCl, 10 mM Tris pH 7.5). Mice are killed 72-96 hours later and the efficacy of treatment is evaluated. In the second format, mice are given 20,000 unit injections every week for 3-4 weeks, and the mice are sacrificed one week after the last injection. Histochemical and histopathological analysis of the liver, spleen and brain are performed by published methods (Birkenmeier, Barker et al., 1991; Sands, Vogler et al., 1994; Dary, Vogler et al., 1999). In the absence of treatment, GUS minus mouse cells (eg, macrophages and Kupffer cells) create large intracellular accumulation compartments derived from the accumulation of waste products in lysosomes. In cells in mice treated with the composition of the invention, the size of these compartments is visually reduced or expected to shrink until they are no longer visible with light microscopy. .
[0102]
Similarly, humans with lysosomal storage diseases are treated using constructs that target appropriate therapeutic moieties to their CNS, particularly to lysosomes within the CNS. In some examples, the treatment takes a regular injection form (eg, once a week) of the fusion protein of the invention. In other examples, treatment is by administering a nucleic acid to continuously express the fusion protein in vivo, or by administration of a cell that expresses the fusion protein in a patient (e.g., a human cell, or a unicellular organism). Achieved. For example, the proteins of the present invention are described in US Pat. No. 6,020,144 issued on Feb. 1, 2000 and PCT serial number PCT / US01 / 44935 filed on Nov. 30, 2001. As such, it can be expressed in situ using the Leishmania vector.
[0103]
(Example 6. Enzyme assay)
Assays for GUS activity are performed as described in Example 3 and / or as described below.
[0104]
Glass assay tubes are numbered in triplicate and 100 μL of 2 × GUS reaction mixture is added to each tube. A 2 × GUS reaction mixture is prepared by adding 100 mg of 4-methylumbelliferyl-β-D glucuronide to 14.2 mL of 200 mM sodium acetate and adjusting the pH to 4.8 with acetic acid. Up to 100 μL of sample is added to each tube; water is added to a final reaction volume of 200 μL. The reaction tube is covered with parafilm and incubated in a 37 ° C. water bath for 1-2 hours. The reaction was run with 1.8 mL stop buffer (10.6 g Na 2 CO 3 And 12.01 g glycine is dissolved in a final volume of 500 mL water, adjusted to pH 10.5 and prepared by filter sterilization in a repeat dispenser). The fluorometer is then calibrated using 2 mL of stop solution as a blank and fluorescence is read from the remaining sample. A standard curve is prepared using 1, 2, 5, 10, and 20 μL of 166 μM 4-methylumbelliferone standard in 2 mL final volume of stop buffer.
[0105]
A 4-methylumbelliferone standard solution is prepared by dissolving 2.5 mg of 4-methylumbelliferone in 1 mL of ethanol and adding 99 mL of sterile water to obtain a concentration of approximately 200 nmol / mL. The exact concentration is determined spectrophotometrically. The extinction coefficient at 360 nm is 19,000 cm. -1 M -1 It is. For example, 100 μL is added to 900 μL of stop buffer and the absorbance at 360 nm is read. If the reading is 0.337, the concentration of the standard solution is 0.337 × 10 (diluted) / 19,000 = 177 μM, which is then diluted to 166 μM by adding an appropriate amount of sterile water Can do.
[0106]
(Example 7. Protein production in mammalian cells)
(CHO cells)
In one example, GUS-GILTΔ1-7 (IGF-II targeting moiety with deletion of N-terminal 7 amino acids) and GUSΔC18-GILTΔ1-7 (fusion protein in which GUSΔC18 is fused to the N-terminus of GILTΔ1-7) Was expressed in CHO cells using the system of Ulmasov et al. (2000) PNAS 97 (26): 14212-14217. The appropriate gene cassette was inserted into the EcoRI site of the pCXN vector, which was electroporated into CHO cells at 50 μF and 1,200 V in a 0.4 cm cuvette. Colony selection and amplification was mediated by 400 μg / mL G418 for 2-3 weeks. CHO cells were propagated in MEM medium supplemented with 15% FBS, 1.2 mM glutamine, 50 μg / mL proline, and 1 mM pyruvate. Cells were plated in MEM in multi-layer flasks for enzyme production. Once the cells reached confluence, collection medium (Weymouth medium supplemented with 2% FBS, 1.2 mM glutamine and 1 mM pyruvate) was applied to the cells. Medium containing secreted recombinant enzyme was collected every 24-72 hours. Typical secretion levels for the GUS-GILTΔ1-7 cell line were 4000-5000 units / mL / 24 hours.
[0107]
A number of GUSΔC18-GILTΔ1-7 CHO strains were assayed for the amount of secreted enzyme produced. The six largest producers were secreted between 8600 and 14900 units / mL / 24 hours. This largest producer was selected for protein recovery.
[0108]
(HEK 293 cells)
The GUS-GILT cassette was cloned into pCEP4 (Invitrogen) for expression in HEK 293 cells. The cassettes used included wild type GUS-GILT; GUS-GILTΔ1-7; GUS-GILTY27L; GUSΔC18-GILTΔ1-7; GILTY27L, and GUS-GILTF19S / E12K.
[0109]
HEK 293 cells were cultured to 50-80% confluency in 12 well plates containing DMEM medium containing 4 mM glutamine and 10% FBS. Cells were transfected with the pCEP-GUS-GILT DNA plasmid using FuGENE6 (Roche) as described by the manufacturer. 0.5 μg DNA and 2 μL FuGENE 6 were added per well. Cells are removed from the wells using trypsin 2-3 days after transfection and then T25 cm containing the above DMEM medium containing 100 μg / mL hygromycin. 2 A stable population of transfected cells was selected in culture flasks. The medium containing hygromycin was changed every 2-3 days. This culture should be T75 cm within 1-2 weeks. 2 Expanded to culture flask. For enzyme production, cells were plated in DMEM in multilayer flasks. Once the cells reached confluence, collection medium (Weymouth medium supplemented with 2% FBS, 1.2 mM glutamine and 1 mM pyruvate) was applied to the cells. This medium was optimized for CHO cells but not for 293 cells. Thus, it can be shown that the level of secretion using HEK 293 strain is significantly higher in the alternative medium.
[0110]
The levels of secreted enzyme are shown in Table 2.
[0111]
(Table 2)
[0112]
[Table 4]
(Example 8. Purification of GUS fusion protein)
Chromatography (including conventional chromatography and affinity chromatography) can be used to purify GUS fusion proteins (eg, GUS-GILT fusion proteins and other fusion proteins of the invention).
[0113]
(Conventional chromatography)
One procedure for purifying the GUS fusion protein produced in Leishmania is described in Example 2. An alternative procedure is described in the following paragraph.
[0114]
Culture supernatants from Leishmania mexicana cell lines expressing the GUS-GILT fusion were collected, centrifuged, and passed through a 0.2μ filter to remove cell debris. The supernatant was concentrated using tangential ultrafiltration with a 100,000 molecular weight cut-off and stored at -80 ° C. The concentrated supernatant was loaded directly onto a column containing Concanavalin A (ConA) immobilized on beaded agarose. This column was prepared using ConA column buffer (50 mM Tris (pH 7.4), 1 mM CaCl. 2 1 mM MnCl 2 ) Followed by elution of mannosylated proteins (including GUS-GILT fusion) in ConA column buffer using a gradient of 0-0.2 M methyl-α-D-pyranoside. Fractions containing glucuronidase activity were pooled, concentrated, and the buffer was replaced with SP column buffer (25 mM sodium phosphate (pH 6), 20 mM NaCl, 1 mM EDTA) in preparation for the next column. . The concentrated fraction was loaded onto an SP high speed column equilibrated with the same buffer, and the column was washed with additional SP column buffer. The GUS-GILT fusion was eluted from the column in the following two steps: 1) A gradient from 0 to 0.15 M glucuronic acid (in 25 mM sodium phosphate (pH 6) and 10% glycerol) followed by 0. 2M glucuronic acid gradient (25 mM sodium phosphate (pH 6), 10% glycerol). Fractions containing glucuronidase activity were pooled and the buffer was replaced with 20 mM potassium phosphate (pH 7.4). These pooled fractions were loaded onto an HA overgel column equilibrated with the same buffer. The GUS-GILT fusion protein was eluted with an increasing gradient of phosphate buffer (145-340 mM potassium phosphate (pH 7.4)). Fractions containing glucuronidase activity were pooled, concentrated and stored at −80 ° C. in 20 mM Tris (pH 8) containing 25% glycerol.
[0115]
A simple chromatographic method for purifying the GUS-GILT fusion protein produced in mammalian cells is described in the following paragraphs.
[0116]
Mammalian cells overexpressing the GUS-GILT fusion protein are grown to confluency in Nunc Triple Flasks and then supplied with serum-free medium (Waymouth MB 752/1) supplemented with 2% fetal calf serum And collect the enzyme for purification. This medium is collected and re-fed to the flask at 24 hour intervals. Pool media from several flasks and centrifuge at 5000 × g for 20 minutes at 4 ° C. to remove separated cells and the like. The supernatant is removed and an aliquot is taken for β-GUS assay. Here, the medium can be used directly for purification or frozen at -20 ° C for later use.
[0117]
1 L of secretion medium is thawed at 37 ° C. (if frozen), filtered through a 0.2 μ filter and transferred to a 4 L beaker. The volume of the medium is diluted 4-fold by adding 3 L of dd water to reduce the salt concentration; the pH of the diluted medium is adjusted to 9.0 using 1M Tris base. 50 mL of DEAE-Sephacel pre-equilibrated with 10 mM Tris (pH 9.0) is added to the diluted medium and stirred gently using a large stir bar for 2 hours at 4 ° C. (remove small aliquots, trace amounts) Centrifuge (microfuge) and assay the supernatant to monitor binding). When binding is complete, the resin is collected by a fritted glass funnel and washed in several batches with 750 mL of 10 mM Tris, pH 9.0. The resin is transferred to a 2.5 cm column and washed with an additional 750 mL of the same buffer at a flow rate of 120 mL / hour. The DEAE column is eluted with a linear gradient of 0-0.4 M NaCl in 10 mM Tris (pH 9.0). Fractions containing the GUS-GILT fusion protein were detected by 4-methylumbelliferyl-β-D (4-methylumbelliferyl-β-D) glucuronide assay, pooled, and 25 mM Tris (pH 8), 1 mM β- Load onto a 600 mL column of Sephacryl S-200 equilibrated with glycerol phosphate, 0.15 M sodium chloride and elute with the same buffer.
[0118]
Fractions containing the GUS-GILT fusion protein are pooled and dialyzed against 3 × 4 L of 25 mM sodium acetate (pH 5.5), 1 mM β-glycerol phosphate, 0.025% sodium azide. The dialyzed enzyme is loaded onto a 15 mL column of CM-Sepharose equilibrated with 25 mM sodium acetate (pH 5.5), 1 mM β-glucose phosphate, 0.025% sodium azide at a flow rate of 36 mL / hr. To do. The column is then washed with 10 column volumes of this same buffer. The CM column is diluted with a linear gradient of 0-0.3M sodium chloride in equilibration buffer. The fractions containing the GUS-GILT fusion protein are pooled and separated by Sephacryl S- equilibrated with 10 mM Tris (pH 7.5), 1 mM β-chrycerol phosphate, 0.15 M NaCl at a flow rate of 48 mL / hr. Pack 300 300 x 2.4 cm (bed capacity = 317 mL) column. Fractions containing the fusion protein are pooled; the pool is assayed for GUS activity and protein concentration to determine specific activity. An aliquot is subjected to SDS-PAGE followed by Coomassie staining or silver staining to confirm purity. If higher concentrations of enzyme are needed, the fusion using XM-50 membrane (50,000 molecular weight cutoff) or Amicon Ultrafiltration Units with Centricon C-30 unit (30,000 molecular weight cutoff) The protein can be concentrated. This fusion protein is stored at −80 ° C. in 10 mM Tris (pH 7.5), 1 mM β-glycerol sodium phosphate, 0.15 M NaCl buffer.
[0119]
(Affinity chromatography)
Affinity chromatography conditions are essentially as described by Islam et al. Biol. Chem. 268 (30): 22627-22633. Conditioned media from mammalian cells overexpressing the GUS-GILT fusion protein (collected and centrifuged as described above for conventional chromatography) is filtered through a 0.22μ filter. Sodium chloride (crystalline) is added to a final concentration of 0.5M and sodium azide is added to a final concentration of 0.025% by adding 1/400 volume of 10% stock solution. This medium has been pre-equilibrated with anti-human β-glucuronidase-Affigel 10 (Antibody Sepharose Wash Buffer: 10 mM Tris (pH 7.5), 10 mM potassium phosphate, 0.5 M NaCl, 0.025% sodium azide. ) At 4 ° C. at a rate of 25 mL / hr. Fractions are collected and monitored for any GUS activity at flow-through. The column is washed with 10-20 column volume of Anti-Sepharose Wash Buffer at 36 mL / hour. Fractions are collected and monitored for GUS activity. This column was loaded with 10 mM sodium phosphate (pH 5.0) +3.5 M MgCl at 36 mL / hour. 2 Elute with (50 mL). 4 mL fractions are collected and assayed for GUS activity. Fractions containing the fusion protein are pooled, diluted with an equal volume of P6 buffer (25 mM Tris (pH 7.5), 1 mM β-glycerol phosphate, 0.15 mM NaCl, 0.025% sodium azide) and BioGel Desalted through a P6 column (pre-equilibrated with P6 buffer), MgCl 2 And replace this buffer with a P6 buffer for storage. The fusion protein is eluted with P6 buffer, fractions containing GUS activity are pooled, and the pooled fractions are assayed for GUS assay and protein. Purity is confirmed using SDS-PAGE gels stained by Coomassie blue or silver staining. The fusion protein is stored frozen at −80 ° C. in P6 buffer for long-term stability.
[0120]
(Example 9. Uptake experiment for mammalian protein)
Culture supernatants from HEK293 or CHO cell lines producing GUS constructs or GUS-GILT constructs were collected through 0.2 μm filters to remove cells. GM 4668 fibroblasts with 5% CO 2 Cultured in 12-well tissue culture plates in DMEM supplemented with 15% (v / v) fetal calf serum at 37 ° C. Cells were washed once at 37 ° C. with uptake medium (DMEM + 2% BSA (Sigma A-7030)). The fibroblasts were then cultured with 1000-4000 units of enzyme per mL of uptake medium (3-21 hours). In several experiments, a competitor for uptake was added. Mannose-6-phosphate (Calbiochem 444100) is added to some media at a concentration of 2-8 mM, and pure recombinant IGF-II (Cell Sciences OU100) is added at a concentration of 2.86 mM. Added to the medium. This represented a 10-100 fold molar excess depending on the amount of enzyme input. Incorporation was typically measured in triplicate wells.
[0121]
After incubation, the medium was removed from the wells and assayed in duplicate for GUS activity. Wells were washed 5 times with 1
[0122]
Initial experiments compared the uptake of CHO produced GUS-GILTΔ1-7 with the uptake of CHO produced GUSΔC18-GILTΔ1-7. As shown in Table 3, this GUSΔC18-GILTΔ1-7 protein, which was engineered to eliminate potential protease cleavage sites, is more than uptake levels that can be inhibited by IGF-II and M6P. Has a significantly higher uptake level. In contrast, uptake of recombinant GUS produced in mammalian cells lacking the IGF-II tag was not affected by the presence of excess IGF-11, but was completely abolished by excess M6P. It was. In this experiment, uptake was carried out for 18 hours.
[0123]
(Table 3)
[0124]
[Table 5]
Subsequent experiments evaluated the uptake of CHO and HEK293 producing enzymes by human fibroblasts from MPSVII patients. In this experiment, uptake was 21 hours.
[0125]
(Table 4)
[0126]
[Table 6]
Further experiments evaluated uptake of selected enzymes in the presence of IGF-II, 8 mM M6P, or both inhibitors. Uptake was measured over a period of 22.5 hours.
[0127]
(Table 5)
[0128]
[Table 7]
The above experiments show that the CHO production system and the HEK293 production system are essentially equal in their ability to secrete functional recombinant proteins. This experiment also shows that the presence of excess IGF-II reduces the uptake of tagged protein by 70-90 +% but does not significantly affect the uptake of untagged protein (4.5%). ing. This indicates specific IGF-II-mediated uptake of mammalian-produced proteins. Unlike Leishmania-producing proteins, enzymes produced in mammalian cells are predicted to contain M6P. The presence of two ligands on these proteins that have the ability to direct uptake through the M6P / IGF-II receptor should result in both excess IGF-II and excess M6P completely abolishing uptake. Means no. Furthermore, since these two ligands bind to different locations on the receptor, binding to this receptor via one ligand should not be significantly affected by the presence of excess other competitors.
[0129]
The binding of the GUS-GILT protein to the M6P / IGF-II receptor on fibroblasts was measured and its uptake rate was determined by published methods (York et al. (1999) J. Biol. Chem. 274 (2 ): Evaluated in the same manner as 1164-71). As described above, GM4668 fibroblasts cultured in a 12-well culture dish are washed in ice-cold medium without serum (containing 1% BSA). Ligand (either GUS, GUS-GILT or GUS-ΔGILT, or control protein) is added to the cells in cold medium without serum (+ 1% BSA). The plate is incubated on ice for 30 minutes upon addition of ligand. After 30 minutes, the ligand is removed and the cells are quickly washed 5 times with ice cold medium.
[0130]
GUS-GILT is rapidly taken up by fibroblasts in less than a few minutes (York et al. (1999) J. Biol. Chem. 274 (2): 1164-71) once the temperature has shifted to 37 ° C. Enzymatic activity is expected to persist in this cell for a long time.
[0131]
Example 10 In Vivo Treatment
Initially, mice without GUS can be used to assess the effectiveness of GUS-GILT and their derivatives in enzyme replacement therapy. Mice without GUS were isolated from Birkenmeier et al. (1989) J. MoI. Clin. Invest 83 (4): 1258-6, as described by B6. C-H-2 bml / ByBIR-gus mps / + Made by heterozygous mating of mice. Preferably, the mouse is resistant to human β-GUS. This mouse carries a transgene with a defective copy of human β-GUS and can induce immune resistance to human proteins (Sly et al. (2001) PNAS 98: 2205-2210). Alternatively, human β-GUS (eg, GUS-GILT protein) can be administered to newborn mice to induce immune tolerance. However, since the blood brain barrier is not found in mice until about day 15, it is possible to determine whether GILT-GUS crosses the blood brain barrier when injection is initiated in mice older than 15 days of age. Therefore, transgenic mice are preferred.
[0132]
The first experiment is to determine the tissue distribution of the targeted therapeutic protein. At least three mice have CHO-producing GILT-tagged β-GUS protein (referred to herein as GUSΔC18-GILTΔ1-7, where GUSΔ18 (β lacking the last 18 amino acids of the protein). -GUS protein) is administered at the N-terminus of Δ1-7GILT (an IGF-II protein lacking the first 7 amino acids of the mature protein)). Other mice are administered either β-GUS, buffer control, or GUSΔC18-GILTΔ1-7 protein treated with periodate and sodium borohydride as described in Example 12. In general, the preferred dose is in the range of 0.5-7 mg / kg body weight. In one example, the enzyme dose is administered intravenously at 1 mg / kg body weight and the enzyme concentration is about 1-3 mg / mL. In addition, at least 3 mice are administered 5 mg / kg body weight of GUSΔC18-GILTΔ1-7 protein (treated with periodate and sodium borohydride). After 24 hours, these mice are sacrificed and the following organs and tissues are isolated: liver, spleen, kidney, brain, lung, muscle, heart, bone and blood. A portion of each tissue is homogenized and β-GUS enzyme activity per mg protein is determined as described in Sly et al. (2001) PNAS 98: 2205-2210. Tissue portions are prepared for histochemistry and / or histopathology performed by published methods (see, eg, Vogler et al. (1990 Am J. Pathol. 136: 207-217).
[0133]
Further experiments include a multiple injection protocol, where mice are injected weekly at a dose of 1 mg / kg body weight. Furthermore, the measurement of the half-life of periodate-modifying enzyme is determined as described in Example 12 compared to untreated enzyme.
[0134]
Two other assay formats can be used. In one mode, 3-4 animals are injected once with 20,000 U of enzyme in 100 μl of enzyme dilution buffer (150 mM NaCl, 10 mM Tris, pH 7.5). After 72-96 hours, the mice are killed and evaluated for therapeutic efficacy. In the second mode, mice are injected weekly at 20,000 units over 3-4 weeks and sacrificed one week after the last injection. Histochemical and histophysiological analysis of the liver, spleen and brain were performed using published methods (Birkenmeier et al. (1991) Blood 78 (11): 3081-92; Sands et al. (1994) J. Clin. Invest 93 (6): 2324-31; Daly et al. (1999) Proc. Natl. Acad. Sci. USA 96 (5): 2296-300). Without treatment, mouse cells that do not have GUS (eg, macrophages and Kupffer cells) generate large intracellular storage components that result from the assembly of excretion products in lysosomes. It is understood that in cells in mice treated with the GUS-GILT construct, the size of these components decreases visibly, or these components contract until they are no longer visible in the light microscope.
[0135]
Similarly, a human having a lysosomal storage disease is treated using a construct that targets a therapeutic moiety appropriate for that lysosome. In some cases, treatment takes the form of regular (eg, weekly) injections of GILT protein. In other cases, treatment is achieved by administration of a nucleic acid that allows sustained in vivo expression of the GILT protein, or by administration of cells that express the GILT protein in a patient (eg, human cells or unicellular organisms). . For example, GILT protein is disclosed in US Pat. No. 6,020,144 (issued February 1, 2000);
[0136]
The targeted therapeutic proteins of the present invention can also be administered and the effects of which have been previously described for use with GUS (enzyme assay, histochemical assay, neurological assay, survival assay, reproductive assay). Etc.) to be monitored. See, for example, Vogler et al. (1993) Pediatric Res. 34 (6): 837-840; Sands et al. (1994) J. MoI. Clin. Invest. 93: 2324-2331; Sands et al. (1997) J. MoI. Clin. Invest. 99: 1596-1605; O'Connor et al. (1998) J. MoI. Clin. Invest. 101: 1394-1400; and Super et al. (1999) 45 (2): 180-186.
[0137]
(Example 11)
The purpose of these experiments is to evaluate the effect of GILT-modified α-galactosidase A (α-GAL A) as an enzyme replacement therapy for Fabry disease.
[0138]
Fabry disease is a lysosomal storage disease that results from insufficient activity of α-GAL A, an enzyme responsible for the removal of terminal galactose from GL-3 and other natural spingolipids. Reduced enzyme activity occurs due to various missense and nonsense mutations in the x-linked genes. GL-3 accumulation is most abundant in lysosomes of heart, liver, kidney, skin and brain vascular epithelial cells, but is also present in other cells and tissues. GL-3 assembly in vascular epithelial cells ultimately leads to heart disease and renal failure.
[0139]
Enzyme replacement therapy is an effective treatment for Fabry disease, and its success depends on the ability of the therapeutic enzyme to be taken up by lysosomes in cells where GL-3 accumulates. The Genzyme product Fabrazyme is recombinant α-GAL A produced in DUKX B11 CHO cells, which is approved for the treatment of Fabry disease patients in Europe due to its proven efficacy.
[0140]
The ability of Fabrazyme to be taken up by cells and transported to lysosomes is due to the presence of mannose 6-phosphate (M6P) on N-linked carbohydrate. Fabrazyme is delivered to lysosomes by binding to mannose-6-phosphate / IGF-II receptor (M6P / Igf-Iir) and subsequent receptor-mediated endocytosis present on the cell surface of most cell types Is done. Fabrazyme reportedly has three N-linked glycosylation sites at ASN residues 108, 161 and 184. The predominant carbohydrates at these positions are the fucosylated di antennal disialylated complex, monophosphorylated mannose-7 oligomannose, and bisphosphorylated mannose-7 oligomannose, respectively.
[0141]
The glycosylation-independent lysosome targeting (GILT) technology of the present invention targets therapeutic proteins directly to lysosomes through different interactions with M6P / IGF-Iir. The targeting ligand is derived from mature human IGF-II, which also binds to M6P / IGF-Iir with high affinity. In current applications, the IGF-II tag is provided as a c-terminal fusion to a therapeutic protein, although other configurations involving cross-linking are possible. The ability of GILT-modified β-glucuronidase for uptake into cells has been achieved using GILT-modified β-glucuronidase, which is processed by fibroblasts in a process that competes with excess IGF-II. It is taken in efficiently. The benefits of GILT modification are increased binding to the M6P / IGF-II receptor, increased uptake of target cells into the lysosome, altered or improved pharmacokinetics, and expanded, altered or improved range of tissue distribution. An improved range of tissue distribution may include delivery of GILT-modified α-GAL A across the blood brain barrier. This is because IGF protein clearly crosses the blood brain barrier.
[0142]
Another advantage of the GILT system is the ability to generate uptake-competent proteins in non-mammalian expression systems that do not undergo M6P modification. In certain embodiments, GILT variant proteins are produced primarily in CHO cells. In certain other embodiments, the GILT tag is placed at the c-terminus of α-GAL A, although the invention is not so limited.
[0143]
Example 12. Underglycosylated therapeutic protein
The efficacy of the targeted therapeutic agent can be increased by increasing the serum half-life of the targeted therapeutic agent. Liver mannose receptors and asialoglycoprotein receptors eliminate glycoproteins from the circulation by recognizing specific carbohydrate structures (Lee et al. (2002) Science 295 (5561): 1898-1901; Ishibashi et al. (1994) J. MoI. Biol.Chem.269 (45) 27803-6). In some embodiments, the present invention allows targeting of therapeutic agents to lysosomes and / or across the blood brain barrier in a manner that is not dependent on carbohydrates, but on polypeptides or analogs thereof. The actual underglycosylation of these proteins is expected to greatly increase their half-life in the circulation by minimizing their removal from the circulation by mannose and asialoglycoprotein receptors. Similarly, functional deglycosylation (eg, by modifying carbohydrate residues on a therapeutic protein, eg, by treatment with periodate / sodium borohydride) via one or more clearance pathways A similar effect is achieved by interfering with carbohydrate recognition. Nevertheless, since protein targeting depends in most embodiments on protein-receptor interactions rather than carbohydrate-receptor interactions, glycosylation modification or elimination may be directed to lysosomes and / or blood. Should not adversely affect protein targeting across the brain barrier.
[0144]
Any fusion protein of the invention (eg, any IGF-I tagged protein) or any lysosomal enzyme (eg, IGF-II) that uses a peptide targeting signal may be chemically or enzymatically deglycosylated. Or modified to produce therapeutic agents with the desired properties of specific lysosomal targeting and long serum half-lives. For some lysosomal storage diseases where it may be important to deliver the therapeutic agent to macrophages or related cell types via the mannose receptor, a fully glycosylated therapeutic agent is combined with an underglycosylated targeted therapeutic agent Can be used to achieve targeting of a wide variety of cell types.
[0145]
(Proteins that are under-glycosylated when synthesized)
In some cases, it is preferred to first generate a targeted therapeutic protein in a system that does not produce a fully glycosylated protein. For example, the targeted therapeutic protein may be E. coli. can be produced in E. coli, thereby producing a protein that is not fully glycosylated. Alternatively, unglycosylated proteins are produced in mammalian cells treated with tunicamycin (an inhibitor of Do1-PP-GlcNAc formation). However, if a particular targeted therapeutic agent does not fold correctly in the absence of glycosylation, it is preferably first produced as a glycosylated protein and subsequently deglycosylated, Or functionally under-glycosylated.
[0146]
Under-glycosylated target therapeutic proteins can also be prepared by manipulating a gene encoding a target therapeutic protein, so that the amino acid normally acting as an acceptor for glycosylation is changed to a different amino acid. For example, an asparagine residue that serves as an acceptor for N-linked glycosylation can be changed to a glutamine residue or another residue that is not a glycosylation acceptor. This conservative change is most likely to have minimal impact on the enzyme structure while eliminating glycosylation at this site. Alternatively, other amino acids near the glycosylation acceptor can be modified to destroy the recognition motif for the glycosylation enzyme without having to change the normally glycosylated amino acid.
[0147]
In the case of GUS, removal of any one of the four potential glycosylation sites reduces the amount of glycosylation while retaining high enzymatic activity (Shipley et al. (1993) J. Biol. Chem. 268 (16 ): 12193-8). Removal of several sets of two glycosylation sites from GUS still allows significant enzymatic activity. Removal of all four glycosylation sites eliminates enzymatic activity, similar to treatment of cells with tunicamycin, but deglycosylation of the purified enzyme yields enzymatically active material. Thus, the loss of activity associated with removal of the glycosylation site appears to be due to incorrect folding of the enzyme.
[0148]
However, other enzymes fold correctly even in the absence of glycosylation. For example, bacterial β-glucuronidase is not naturally glycosylated and can be targeted to mammalian lysosomes and / or across the blood brain barrier using the targeting moieties of the present invention. Such enzymes can be synthesized in an unglycosylated state, for example, rather than synthesizing the enzyme as a glycosylated protein and subsequently deglycosylating it.
[0149]
(Deglycosylation)
When the targeted therapeutic agent is produced in a mammalian cell culture system, it is preferably secreted into the growth medium and collected for subsequent purification of the targeted therapeutic agent (eg, chromatographic purification protocols (eg, chromatography involving ion exchange). Graphic purification protocol), gel filtration, hydrophobic chromatography, ConA chromatography, affinity chromatography or immunoaffinity chromatography).
[0150]
Chemical deglycosylation of glycoproteins can be accomplished in a number of ways, including treatment with trifluoromethanesulfonic acid (TFMS) or treatment with hydrogen fluoride (HF).
[0151]
Chemical deglycosylation by TFMS (Sojar et al. (1989) J. Biol. Chem. 264 (5): 2552-9; Sojar et al. (1987) Methods Enzymol. 138: 341-50): 1 mg of GILT-GUS, Dry under vacuum overnight. The dried protein is treated with 150 μl TFMS at 0 ° C. under nitrogen for 0.5-2 hours with occasional shaking. The reaction mixture is cooled below −20 ° C. in a dry ice-ethanol bath, and the reaction is pre-cooled (−20 ° C.) and a solution of 60% pyridine in water is added slowly. By making it neutral. The neutral reaction mixture is then heated at 4 ° C. with NH 4 HCO 3 Dialyze against (pH 7.0) (change several times). Chemical deglycosylation using TFMS can result in modifications to the processed protein, including methylation, succinimide formation and isomerization of aspartic acid residues (Douglass et al. (2001) J. Protein Chem. 20 (7 ): 571-6).
[0152]
Chemical deglycosylation by HF (Sojar et al. (1987) Methods Enzymol. 138: 341-50): This reaction is carried out in a closed reaction system (such as can be obtained from Peninsula Laboratories, Inc.). 10 mg of GILT-GUS is vacuum dried and placed in a reaction vessel, which is then connected to an HF apparatus. After the entire HF line has been evacuated, 10 mL of anhydrous HF is distilled from the reservoir while stirring the reaction vessel. The reaction is continued at 0 ° C. for 1-2 hours. Then, HF is removed for 15 to 30 minutes with a water flow aspirator. The remaining traces of HF are removed under high vacuum. The reaction mixture is dissolved in 2 mL of 0.2 M NaOH to neutralize any remaining HF and the pH is adjusted to 7.5 with cold 0.2 M HCl.
[0153]
Enzymatic deglycosylation (Thotakura et al. (1987) Methods Enzymol. 138: 350-9): N-linked carbohydrates are completely removed from glycoproteins using protein N-glycosidase (PNGase) A or protein N-glycosidase F Can do. In one embodiment, the glycoprotein is denatured prior to treatment with glycosidase to promote the activity of the enzyme on the glycoprotein; the glycoprotein was then discussed in the “In Vitro Refolding” section above. So that it is refolded. In another embodiment, excess glycosidase is used to process the native glycoprotein to promote effective deglycosylation.
[0154]
In the case of a target therapeutic protein that is not actually deglycosylated, reduced glycosylation can expose a protease sensitive site in the target therapeutic protein, which reduces the half-life of the protein. N-linked glycosylation is known to protect a subset of lysosomal enzymes from proteolysis (Kundra et al. (1999) J. Biol. Chem. 274 (43): 31039-46). Such protease sensitive sites are preferably engineered from the protein (eg, by site-directed mutagenesis). As discussed below, the risk of exposing protease sensitive sites or potential epitopes can be minimized by incorporating deglycosylation or altering the carbohydrate structure rather than omitting the carbohydrate at all. .
[0155]
(Carbohydrate structure modification or partial deglycosylation)
In one embodiment, the therapeutic protein is partially deglycosylated. For example, a therapeutic protein can be treated with an endoglycosidase (eg, endoglycosidase H), which cleaves N-linked high mannose carbohydrates, but does not cleave complex types of carbohydrates, and is bound to asparagine. Of GlcNAc residues. A therapeutic protein treated in this manner lacks high mannose carbohydrates and reduces interaction with liver mannose receptors. This receptor recognizes terminal GlcNAc, but the potential for proliferative interaction with a single GlcNAc on the protein surface is not as great as the potential for interaction with an intact high mannose structure. If the therapeutic protein is produced in mammalian cells, any complex carbohydrate present on the protein remains unaffected by endoH treatment and can be sialylated terminally, thereby causing liver carbonization Interaction with hydrogen recognition response may be reduced. Thus, such proteins are for use with an increased half-life. At the same time, steric hindrance due to remaining carbohydrates can block potential epitopes on the protein surface from the immune system and reduce protease access to the protein surface (eg, in a protease-rich lysosomal environment).
[0156]
In other embodiments, glycosylation of the therapeutic protein is modified by, for example, oxidation, reduction, dehydration, substitution, esterification, alkylation, sialylation, carbon-carbon bond cleavage, etc. Reduce clearance. In some preferred embodiments, the therapeutic protein is not sialylated. For example, treatment with periodate and sodium borohydride is effective to alter the carbohydrate structure of most glycoproteins. Treatment with periodide oxidizes vicinal diols, breaks carbon-carbon bonds, and replaces hydroxyl groups with aldehyde groups; hydrogen borohydride reduces these aldehydes to hydroxyls. Many sugar residues contain vicinal diols and are therefore cleaved by this process. As shown in FIG. 4A, the protein can be glycosylated with asparagine residues with high mannose carbohydrates containing N-acetylglucosamine residues near the asparagine residues and mannose residues elsewhere in this structure. As shown in FIG. 4B, the terminal mannose residue has three consecutive carbons with hydroxyl groups; both carbon-carbon bonds involved are cleaved by periodide treatment. Some non-terminal mannose residues also contain vicinal diols, which are similarly cleaved. Nevertheless, while this treatment cleaves cyclic carbohydrates into linear carbohydrates, it does not completely remove this carbohydrate and potentially exposes protease-sensitive or antigenic polypeptide sites. Minimize the risk.
[0157]
The half-life of the lysosomal enzyme β-glucuronidase is known to increase more than 10-fold after continuous treatment with periodate and sodium borohydride (Houba et al. (1996) Bioconjug. Chem. 7 ( 5): 606-11; Stahl et al. (1976) PNAS 73: 4045-4049; Achold et al. (1977) Pediat. Res. 11: 816-822; Achord et al. (1978) Cell 15 (1): 269-78). Similarly, lysine was treated with a mixture of lysate and sodium cyanoborohydride (Thorpe et al. (1985) Eur. J. Biochem. 147: 197). After injection into rats, the percentage of lysine absorbed by the liver decreased from 40% (untreated lysine) to 20% (modified lysine) of the dose injected with chemical treatment. In contrast, the amount of lysine in the blood increased from 20% (untreated lysine) to 45% (treated lysine). Thus, the treated lysine enjoys a wider tissue distribution and a longer half-life in the circulation.
[0158]
A β-glucuronidase construct (or other glycoprotein) coupled with a targeting moiety of the present invention has a half-life when deglycosylated or modified by sequential treatment with periodate and sodium borohydride. Enjoy a similar increase (eg, greater than 2-fold, greater than 4-fold, or greater than 10-fold), but retains high affinity for the cation-dependent M6P receptor and has this receptor This construct is targeted to lysosomes of all cell types. This construct is also expected to cross the blood brain barrier efficiently. In contrast, β-glucuronidase preparations that rely on M6P for lysosomal targeting are deglycosylated or treated with periodate and sodium borohydride, which enjoys an elevated serum half-life, Unable to target lysosomes. This is because the M6P targeting signal was altered by this treatment.
[0159]
Carbohydrate modification by sequential treatment with periodate and sodium borohydride can be carried out as follows: purified GILT-GUS is 40 mM NaIO in 50 mM sodium acetate, pH 4.5. 4 And 2 hours at 4 ° C. The reaction is stopped by the addition of excess ethylene glycol and unreacted reagents are removed by passing the reaction matrix through Sephadex G-25M equilibrated with PBS (pH 7.5). Following this treatment, 40 mM NaBH in PBS (pH 7.5). 4 With incubation at 37 ° C. for 3 hours and then at 4 ° C. for 1 hour. The reaction mixture is passed through a Sephadex G-25M column eluting with PBS (pH 7.5) to terminate the reaction.
[0160]
Another protocol for treatment with periodide and sodium borohydride is described in Hickman et al. (1974) BBRC 57: 55-61. The purified protein is dialyzed into 0.01 M sodium phosphate (pH 6.0), 0.15 M NaCl. Sodium periodate is added to a final concentration of 0.01M and the reaction proceeds at 4 ° C. in the dark for at least 6 hours. Treatment of β-hexosaminidase with periodate under these conditions is sufficient to prevent protein uptake by fibroblasts; uptake usually causes M6P receptor to bind to the fibroblast surface. It depends on the M6P part of β-hexosaminidase. Thus, oxidation with periodate sufficiently modifies M6P to abolish its ability to interact with the M6P receptor.
[0161]
Alternatively, carbohydrates can be obtained from Thorpe et al. (1985) Eur. J. et al. Biochem. 147: 197-206 can be modified by treatment of a one-step reaction with periodate and cyanoborohydride.
[0162]
The presence of carbohydrate in a partially deglycosylated protein or a protein with a modified glycosylation pattern should mask potential polypeptide epitopes that are probably not covered by the complete absence of glycosylation. If the therapeutic protein actually stimulates the immune response, immunosuppressive therapeutics can be used in combination with the therapeutic protein (Brooks (1999) Molecular Genetics and Metabolism 68: 268-275). For example, about 15% of patients with Gaucher disease treated with alglucerase were reported to develop an immune response (Butler et al., The Metabolic and Molecular Bases of Inherited Dissease, 8th edition (2001), edited by Scriber et al.). , 3635-3668). Fortunately, many patients (82/142) that produced antibodies to alglucerase were tolerated by routine treatment regimens (Rosenberg et al. (1999) Blood 93: 2081-2088). Thus, in order to serve a small number of patients who can generate an immune response, patients receiving therapeutic proteins also receive immunosuppressive therapy in some embodiments of the invention.
[0163]
(test)
To confirm that the protein is under-glycosylated, it can be tested by exposure to ConA. Under-glycosylated proteins are expected to show reduced binding to ConA-Sepharose when compared to the corresponding fully glycosylated protein.
[0164]
Indeed underglycosylated proteins can also be degraded by SDS-PAGE and compared to the corresponding fully glycosylated protein. For example, chemically deglycosylated GUS-GILT can be compared to untreated (glycosylated) GUS-GILT and enzymatically deglycosylated GUS-GILT treated with PNGase A. Under-glycosylated proteins are expected to have greater mobility in SDS-PAGE when compared to fully glycosylated proteins.
[0165]
Under-glycosylated targeted therapeutic proteins exhibit uptake dependent on the targeting domain. Under-glycosylated proteins should exhibit reduced uptake (and preferably no substantial uptake) depending on mannose or M6P. These properties can be confirmed experimentally in cell uptake experiments.
[0166]
For example, the GUS-GILT protein synthesized in mammalian cells and subsequently treated with periodate and borohydride has been tested for functional deglycosylation by testing for M6P-dependent and mannose-dependent uptake. Can be tested. To show that M6P-dependent uptake is reduced, uptake assays are performed using GM4668 fibroblasts. In the absence of competitor, the treated and untreated enzymes each show significant uptake. The presence of excess IGF-II significantly reduces the uptake of processed and untreated enzyme, but the untreated enzyme retains residual uptake through a M6P-dependent pathway. Excess M6P reduces the uptake of untreated enzyme, but is less effective in reducing uptake of functionally deglycosylated proteins. For treated and untreated enzymes, the simultaneous presence of both competitors should substantially abolish uptake.
[0167]
An uptake assay to assess mannose-dependent uptake is performed using J774-E cells (a mouse macrophage-like cell line that has a mannose receptor but a small number if present in the M6P receptor) (Diment (1987) J. Leukocyte Biol. 42: 485-490). These cells are cultured in low glucose DMEM (supplemented with 10% FBS, 4 mM glutamine, and antibiotics, antifungal solution) (Sigma, A-5955). Uptake assays using these cells are performed in the same manner as assays performed with fibroblasts. In the presence of excess M6P and IgF-II, which eliminates uptake due to any residual M6P / IGF-II receptor, the fully glycosylated enzyme interacts with the mannose receptor. Due to the action, it shows considerable uptake. Underglycosylation enzymes are expected to show significantly reduced uptake under these conditions. The mannose receptor-dependent uptake of fully glycosylated enzymes can be competed by the addition of excess (100 μg / mL) mannan.
[0168]
The pharmacokinetics of deglycosylated GUS-GILT can be determined by giving intravenous injections of 20,000 enzyme units per time point to groups of 3 MPSVII mice. For each time point, 50 μL of blood is evaluated for enzyme activity.
[0169]
(Equivalent)
The present invention may be embodied in other specific forms without departing from the spirit or essential characteristics of the invention. Accordingly, the above embodiments are to be considered in all aspects illustrative rather than limiting of the invention described herein. Accordingly, the scope of the invention is indicated by the appended claims rather than by the foregoing description, and all changes that come within the meaning and range of equivalency of the claims are embraced therein. Is intended.
[0170]
(Incorporation as a reference)
Patent documents and scientific publications disclosed herein, and U.S. Pat. S. S. N. 60 / 250,446 (filed on November 30, 2000); S. S. N. 60 / 250,444 (filed on November 30, 2000); S. S. N. 60 / 290,281 (filed May 11, 2001); S. S. N. 60 / 287,531 (filed Apr. 30, 2001); S. S. N. 60 / 304,609 (filed July 10, 2001); S. S. N. 60 / 329,461 (filed Oct. 15, 2001), U.S. Pat. S. S. N. 60 / 351,276 (filed January 23, 2002); S. S. N. 10 / 136,841 (filed on April 30, 2002); agent document number SYM-007CP, title of invention “Targeted Therapeutic Proteins” (filed October 16, 2002); agent document number SYM-009, invention The disclosures of each of the names "Targeted Therapeutic Proteins" (filed Oct. 16, 2002); and PCT Application No. PCT / US01 / 44935 (filed Nov. 30, 2001) are hereby incorporated by reference in their entirety. Is done.
[Brief description of the drawings]
[0171]
FIG. 1 shows the sequence alignment of mature human IGF-I (SEQ ID NO: 1) and IGF-II (SEQ ID NO: 2), showing homologous regions and A, B, C, and D domains.
FIG. 2 is a two-dimensional representation of the IGF protein showing the signal sequence, A domain, B domain, C domain and D domain, and the C-terminal sequence.
FIG. 3 shows the protein (FIG. 3A, SEQ ID NO: 3) and nucleic acid (FIG. 3B, SEQ ID NO: 4) sequences for human IGF-I mRNA.
FIG. 4A shows one form of phosphorylated high mannose carbohydrate structure linked to a glycoprotein via an asparagine residue and also shows the structure of mannose and N-acetylglucosamine (GlcNAc).
FIG. 4B shows a portion of a higher level of detailed high mannose carbohydrate structure and shows a position susceptible to cleavage by periodate treatment. The position of the sugar residue in this carbohydrate structure is indicated by capital letters A to H circled; the phosphate group is indicated by capital letter P circled.
FIG. 5 shows several types of glycosylation deficiencies.
Claims (27)
IGF部分に結合した過小グリコシル化ポリペプチドを哺乳動物に提供して、それによって、上記哺乳動物の脳におけるポリペプチドの蓄積を生じる工程
を包含する、方法。A method for targeting a polypeptide to the brain comprising the following steps:
Providing a mammal with an underglycosylated polypeptide linked to an IGF moiety, thereby resulting in accumulation of the polypeptide in the mammalian brain.
IGF部分の結合した過小グリコシル化ポリペプチドを発現して、それによって、CNS標的タグを有する過小グリコシル化ポリペプチドを生成する工程
を包含する、方法。A method of producing a CNS targeted polypeptide comprising the following steps:
Expressing a hyperglycosylated polypeptide having an IGF moiety attached thereto, thereby producing a hypoglycosylated polypeptide having a CNS targeting tag.
過小グリコシル化治療ドメイン;
患者のCNSでの該治療ドメインの局在を増大する下グリコシリ化標的化ドメインであって、該治療ドメインは治療的に活性である、ドメイン;
を含む、タンパク質。An under-glycosylated therapeutic fusion protein comprising:
Underglycosylated therapeutic domain;
A lower glycosyl targeting domain that increases the localization of the therapeutic domain in the patient's CNS, wherein the therapeutic domain is therapeutically active;
Including protein.
(i)哺乳類のリソソームにおいて治療活性である治療剤および哺乳動物CNSにおいて治療剤の蓄積を生じる標的過部分を含む過小グリコシル化標的治療剤を合成する工程;および
(ii)該患者に該標的化治療剤を投与する工程
を包含する、方法。A method of treating a patient, the method comprising:
(I) synthesizing an underglycosylated targeted therapeutic agent comprising a therapeutic agent that is therapeutically active in a mammalian lysosome and a targeted hyper moiety that results in accumulation of the therapeutic agent in the mammalian CNS; and (ii) the targeting to the patient Administering a therapeutic agent.
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US32965001P | 2001-10-16 | 2001-10-16 | |
| US10/136,841 US7396811B2 (en) | 2001-04-30 | 2002-04-30 | Subcellular targeting of therapeutic proteins |
| US10/136,639 US20030072761A1 (en) | 2001-10-16 | 2002-04-30 | Methods and compositions for targeting proteins across the blood brain barrier |
| US38445202P | 2002-05-29 | 2002-05-29 | |
| US38601902P | 2002-06-05 | 2002-06-05 | |
| US40881602P | 2002-09-06 | 2002-09-06 | |
| PCT/US2002/032968 WO2003032727A1 (en) | 2001-10-16 | 2002-10-16 | Methods and compositions for targeting underglycosylated proteins across the blood brain barrier |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009143436A Division JP2009203241A (en) | 2001-10-16 | 2009-06-16 | Method and composition for targeting underglycosylated proteins across blood brain barrier |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2005506340A true JP2005506340A (en) | 2005-03-03 |
| JP2005506340A5 JP2005506340A5 (en) | 2006-01-12 |
Family
ID=27558195
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2003535542A Pending JP2005506340A (en) | 2001-10-16 | 2002-10-16 | Methods and compositions for targeting underglycosylated proteins across the blood brain barrier |
| JP2009143436A Pending JP2009203241A (en) | 2001-10-16 | 2009-06-16 | Method and composition for targeting underglycosylated proteins across blood brain barrier |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009143436A Pending JP2009203241A (en) | 2001-10-16 | 2009-06-16 | Method and composition for targeting underglycosylated proteins across blood brain barrier |
Country Status (6)
| Country | Link |
|---|---|
| EP (1) | EP1446007A4 (en) |
| JP (2) | JP2005506340A (en) |
| AU (3) | AU2002362930A2 (en) |
| CA (1) | CA2463473A1 (en) |
| IL (1) | IL161352A0 (en) |
| WO (2) | WO2003032913A2 (en) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2013542913A (en) * | 2010-06-25 | 2013-11-28 | シャイアー ヒューマン ジェネティック セラピーズ, インコーポレイテッド | Treatment of Sanfilipo syndrome type B |
| JP2015505824A (en) * | 2011-12-01 | 2015-02-26 | アンジオケム インコーポレーテッド | Targeted lysosomal enzyme compounds |
| JP2016094451A (en) * | 2010-06-25 | 2016-05-26 | シャイアー ヒューマン ジェネティック セラピーズ インコーポレイテッド | Treatment of sanfilippo syndrome type b |
Families Citing this family (25)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7560424B2 (en) | 2001-04-30 | 2009-07-14 | Zystor Therapeutics, Inc. | Targeted therapeutic proteins |
| US7629309B2 (en) | 2002-05-29 | 2009-12-08 | Zystor Therapeutics, Inc. | Targeted therapeutic proteins |
| ATE384736T1 (en) | 2001-04-30 | 2008-02-15 | Zystor Therapeutics Inc | SUB-CELLULAR TARGETING OF THERAPEUTIC PROTEINS |
| US20030072761A1 (en) | 2001-10-16 | 2003-04-17 | Lebowitz Jonathan | Methods and compositions for targeting proteins across the blood brain barrier |
| JP2005506340A (en) * | 2001-10-16 | 2005-03-03 | シムバイオンティクス インコーポレイテッド | Methods and compositions for targeting underglycosylated proteins across the blood brain barrier |
| EP1514106A4 (en) * | 2002-05-29 | 2007-05-09 | Zystor Therapeutics Inc | Targeted therapeutic proteins |
| CN1922313B (en) * | 2004-02-10 | 2011-10-26 | 生物马林医药公司 | Acid alpha-glucosidase and fragments thereof |
| EP2182980A4 (en) | 2007-07-27 | 2012-04-18 | Armagen Technologies Inc | Methods and compositions for increasing alpha-iduronidase activity in the cns |
| UA101487C2 (en) * | 2007-12-21 | 2013-04-10 | Ф. Хоффманн-Ля Рош Аг | Humanized b-ly1 antibody formulation |
| ES2629853T3 (en) | 2008-05-07 | 2017-08-16 | Biomarin Pharmaceutical Inc. | Lysosomal direction peptides and uses thereof |
| EP3075386B1 (en) | 2009-06-17 | 2019-10-16 | BioMarin Pharmaceutical Inc. | Formulations for lysosomal enzymes |
| WO2011163647A2 (en) | 2010-06-25 | 2011-12-29 | Shire Human Genetic Therapies, Inc. | Methods and compositions for cns delivery of heparan n-sulfatase |
| EP2593131B1 (en) | 2010-06-25 | 2019-08-21 | Shire Human Genetic Therapies, Inc. | Methods and compositions for cns delivery of iduronate-2-sulfatase |
| NZ605865A (en) | 2010-06-25 | 2015-07-31 | Shire Human Genetic Therapies | Cns delivery of therapeutic agents |
| DK2585104T3 (en) | 2010-06-25 | 2019-10-14 | Shire Human Genetic Therapies | METHODS AND COMPOSITIONS FOR THE SUPPLY OF ARYL SULPHATASE A |
| WO2013096899A2 (en) | 2011-12-23 | 2013-06-27 | Shire Human Genetic Therapies, Inc. | Stable formulations for cns delivery of arylsulfatase a |
| US9687561B2 (en) | 2012-08-14 | 2017-06-27 | Angiochem Inc. | Peptide-dendrimer conjugates and uses thereof |
| TWI711632B (en) | 2012-11-27 | 2020-12-01 | 美商拜奧馬林製藥公司 | Targeted therapeutic lysosomal enzyme fusion proteins and uses thereof |
| WO2014141152A2 (en) * | 2013-03-15 | 2014-09-18 | Glaxosmithkline Intellectual Property (No.2) Limited | Low concentration antibody formulations |
| EP2970413B1 (en) | 2014-04-01 | 2018-07-04 | Swedish Orphan Biovitrum AB (Publ) | Modified sulfamidase and production thereof |
| CN107921143B (en) | 2015-06-15 | 2021-11-19 | 安吉奥开米公司 | Method for treating leptomeningeal carcinomatosis |
| AU2017222620B2 (en) | 2016-02-24 | 2022-06-16 | Biomarin Pharmaceutical Inc. | Targeted therapeutic lysosomal enzyme fusion proteins, associated formulations and uses thereof |
| WO2019213180A1 (en) | 2018-04-30 | 2019-11-07 | Amicus Therapeutics, Inc. | Gene therapy constructs and methods of use |
| SG11202103640VA (en) | 2018-10-10 | 2021-05-28 | Amicus Therapeutics Inc | Disulfide bond stabilized polypeptide compositions and methods of use |
| JP7458404B2 (en) | 2018-12-20 | 2024-03-29 | アーマジェン・インコーポレイテッド | Purification of iduronic acid-2-sulfatase immunoglobulin fusion protein |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4801575A (en) * | 1986-07-30 | 1989-01-31 | The Regents Of The University Of California | Chimeric peptides for neuropeptide delivery through the blood-brain barrier |
| US5672683A (en) * | 1989-09-07 | 1997-09-30 | Alkermes, Inc. | Transferrin neuropharmaceutical agent fusion protein |
| CA2025907A1 (en) * | 1989-09-21 | 1991-03-22 | Franklin D. Collins | Method of transporting compositions across the blood brain barrier |
| US6472140B1 (en) * | 1997-09-05 | 2002-10-29 | The General Hospital Corporation | α-2- macroglobulin therapies and drug screening methods for Alzheimer's disease. |
| ATE384736T1 (en) * | 2001-04-30 | 2008-02-15 | Zystor Therapeutics Inc | SUB-CELLULAR TARGETING OF THERAPEUTIC PROTEINS |
| JP2005506340A (en) * | 2001-10-16 | 2005-03-03 | シムバイオンティクス インコーポレイテッド | Methods and compositions for targeting underglycosylated proteins across the blood brain barrier |
| EP1514106A4 (en) * | 2002-05-29 | 2007-05-09 | Zystor Therapeutics Inc | Targeted therapeutic proteins |
-
2002
- 2002-10-16 JP JP2003535542A patent/JP2005506340A/en active Pending
- 2002-10-16 AU AU2002362930A patent/AU2002362930A2/en not_active Abandoned
- 2002-10-16 WO PCT/US2002/032996 patent/WO2003032913A2/en not_active Application Discontinuation
- 2002-10-16 CA CA002463473A patent/CA2463473A1/en not_active Abandoned
- 2002-10-16 EP EP02801739A patent/EP1446007A4/en not_active Withdrawn
- 2002-10-16 WO PCT/US2002/032968 patent/WO2003032727A1/en active Application Filing
- 2002-10-16 AU AU2002347910A patent/AU2002347910A1/en not_active Abandoned
- 2002-10-16 IL IL16135202A patent/IL161352A0/en unknown
-
2009
- 2009-06-16 JP JP2009143436A patent/JP2009203241A/en active Pending
-
2010
- 2010-08-25 AU AU2010214643A patent/AU2010214643A1/en not_active Abandoned
Cited By (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2013542913A (en) * | 2010-06-25 | 2013-11-28 | シャイアー ヒューマン ジェネティック セラピーズ, インコーポレイテッド | Treatment of Sanfilipo syndrome type B |
| JP2016094451A (en) * | 2010-06-25 | 2016-05-26 | シャイアー ヒューマン ジェネティック セラピーズ インコーポレイテッド | Treatment of sanfilippo syndrome type b |
| US9814764B2 (en) | 2010-06-25 | 2017-11-14 | Shire Human Genetic Therapies, Inc. | Treatment of sanfilippo syndrome type b by intrathecal administration of alpha-n-acetylglucosaminidase |
| US11065307B2 (en) | 2010-06-25 | 2021-07-20 | Shire Human Genetic Therapies, Inc. | Therapeutic fusion protein comprising an alpha-n-acetylglucosaminidase and a lysosomal targeting moiety |
| US11065308B2 (en) | 2010-06-25 | 2021-07-20 | Shire Human Genetic Therapies, Inc. | Methods and compositions for CNS delivery of heparan n-sulfatase |
| US11260112B2 (en) | 2010-06-25 | 2022-03-01 | Shire Human Genetic Therapies, Inc. | Methods and compositions for CNS delivery of iduronate-2-sulfatase |
| JP2015505824A (en) * | 2011-12-01 | 2015-02-26 | アンジオケム インコーポレーテッド | Targeted lysosomal enzyme compounds |
Also Published As
| Publication number | Publication date |
|---|---|
| CA2463473A1 (en) | 2003-04-24 |
| JP2009203241A (en) | 2009-09-10 |
| WO2003032727A1 (en) | 2003-04-24 |
| WO2003032913A2 (en) | 2003-04-24 |
| IL161352A0 (en) | 2004-09-27 |
| EP1446007A4 (en) | 2005-12-07 |
| AU2010214643A1 (en) | 2010-09-16 |
| AU2002347910A1 (en) | 2003-04-28 |
| EP1446007A1 (en) | 2004-08-18 |
| AU2002362930A2 (en) | 2003-04-28 |
| WO2003032913A3 (en) | 2004-08-12 |
| WO2003032913A9 (en) | 2004-04-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10300113B2 (en) | Targeted therapeutic proteins | |
| JP2009203241A (en) | Method and composition for targeting underglycosylated proteins across blood brain barrier | |
| US8207114B2 (en) | Targeted therapeutic proteins | |
| JP4641705B2 (en) | Subcellular targeting of therapeutic proteins | |
| AU2003237314B2 (en) | Targeted therapeutic proteins | |
| US20040005309A1 (en) | Targeted therapeutic proteins | |
| AU2002256423A1 (en) | Subcellular targeting of therapeutic proteins | |
| AU2008200706B2 (en) | Methods and compositions for targeting underglycosylated proteins across the blood brain barrier | |
| JP4828121B2 (en) | Targeted therapeutic protein |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20051014 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20051014 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20051209 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20051209 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20081217 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20090311 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20090318 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20090831 |