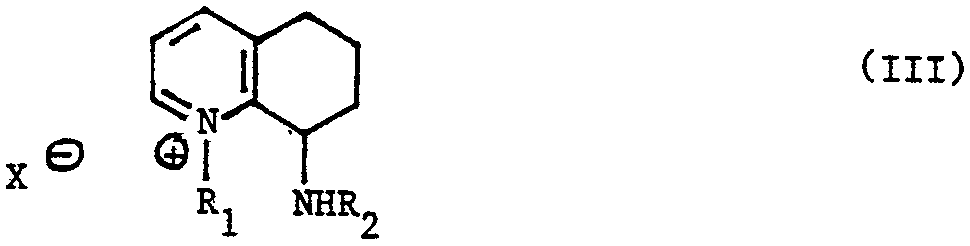FR2617841A1 - Nouveaux derives de la decahydroquinoleine, leur procede de preparation, les nouveaux intermediaires obtenus, leur application a titre de medicaments et les compositions pharmaceutiques les renfermant - Google Patents
Nouveaux derives de la decahydroquinoleine, leur procede de preparation, les nouveaux intermediaires obtenus, leur application a titre de medicaments et les compositions pharmaceutiques les renfermant Download PDFInfo
- Publication number
- FR2617841A1 FR2617841A1 FR8709747A FR8709747A FR2617841A1 FR 2617841 A1 FR2617841 A1 FR 2617841A1 FR 8709747 A FR8709747 A FR 8709747A FR 8709747 A FR8709747 A FR 8709747A FR 2617841 A1 FR2617841 A1 FR 2617841A1
- Authority
- FR
- France
- Prior art keywords
- formula
- sep
- radical
- alpha
- methyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 239000003814 drug Substances 0.000 title claims abstract description 14
- 239000008194 pharmaceutical composition Substances 0.000 title claims description 7
- 238000000034 method Methods 0.000 title abstract description 11
- 238000002360 preparation method Methods 0.000 title abstract description 11
- 239000000543 intermediate Substances 0.000 title abstract description 4
- 125000004856 decahydroquinolinyl group Chemical class N1(CCCC2CCCCC12)* 0.000 title description 3
- 239000002253 acid Substances 0.000 claims abstract description 33
- 125000004432 carbon atom Chemical group C* 0.000 claims abstract description 26
- 150000003839 salts Chemical class 0.000 claims abstract description 25
- 150000007513 acids Chemical class 0.000 claims abstract description 18
- 150000001875 compounds Chemical class 0.000 claims abstract description 18
- 150000003242 quaternary ammonium salts Chemical class 0.000 claims abstract description 7
- 125000002947 alkylene group Chemical group 0.000 claims abstract description 5
- YBYIRNPNPLQARY-UHFFFAOYSA-N 1H-indene Natural products C1=CC=C2CC=CC2=C1 YBYIRNPNPLQARY-UHFFFAOYSA-N 0.000 claims abstract description 4
- -1 alkoxy radical Chemical class 0.000 claims description 65
- 239000000047 product Substances 0.000 claims description 56
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 14
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 10
- CIUQDSCDWFSTQR-UHFFFAOYSA-N [C]1=CC=CC=C1 Chemical group [C]1=CC=CC=C1 CIUQDSCDWFSTQR-UHFFFAOYSA-N 0.000 claims description 8
- QUPDWYMUPZLYJZ-UHFFFAOYSA-N ethyl Chemical group C[CH2] QUPDWYMUPZLYJZ-UHFFFAOYSA-N 0.000 claims description 8
- 150000003254 radicals Chemical class 0.000 claims description 8
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 6
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 claims description 5
- 125000005843 halogen group Chemical group 0.000 claims description 4
- 125000005605 benzo group Chemical group 0.000 claims description 3
- 125000001246 bromo group Chemical group Br* 0.000 claims description 3
- 125000004076 pyridyl group Chemical group 0.000 claims description 3
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 claims description 2
- 150000001412 amines Chemical class 0.000 claims description 2
- 239000000460 chlorine Substances 0.000 claims description 2
- 229910052801 chlorine Inorganic materials 0.000 claims description 2
- 229910052500 inorganic mineral Inorganic materials 0.000 claims description 2
- 239000013067 intermediate product Substances 0.000 claims description 2
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 claims description 2
- 239000011707 mineral Substances 0.000 claims description 2
- 125000001544 thienyl group Chemical group 0.000 claims description 2
- IGYKBGJKBPIQSE-UHFFFAOYSA-N 2-(3,4-dichlorophenoxy)-n-methyl-n-(1-methyl-3,4,4a,5,6,7,8,8a-octahydro-2h-quinolin-8-yl)acetamide Chemical compound C1CCC2CCCN(C)C2C1N(C)C(=O)COC1=CC=C(Cl)C(Cl)=C1 IGYKBGJKBPIQSE-UHFFFAOYSA-N 0.000 claims 1
- 238000004519 manufacturing process Methods 0.000 claims 1
- 239000000203 mixture Substances 0.000 abstract description 10
- 125000000217 alkyl group Chemical group 0.000 abstract description 8
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 abstract description 4
- 125000001624 naphthyl group Chemical group 0.000 abstract description 3
- 125000003545 alkoxy group Chemical group 0.000 abstract description 2
- 125000003454 indenyl group Chemical group C1(C=CC2=CC=CC=C12)* 0.000 abstract description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 32
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 30
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 27
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 15
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 11
- 239000000243 solution Substances 0.000 description 11
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 10
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 9
- 238000011282 treatment Methods 0.000 description 9
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical class [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 8
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 6
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 5
- 239000004480 active ingredient Substances 0.000 description 5
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 5
- ZMANZCXQSJIPKH-UHFFFAOYSA-N N,N-Diethylethanamine Substances CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 4
- 208000002193 Pain Diseases 0.000 description 4
- 241000700159 Rattus Species 0.000 description 4
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 4
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 4
- 0 *N(C(CCC*1CCCN2*)C12S)C(*I)=O Chemical compound *N(C(CCC*1CCCN2*)C12S)C(*I)=O 0.000 description 3
- HGGWYJGOBNJZRY-UHFFFAOYSA-N 8-chloro-5,6,7,8-tetrahydroquinoline Chemical compound C1=CN=C2C(Cl)CCCC2=C1 HGGWYJGOBNJZRY-UHFFFAOYSA-N 0.000 description 3
- DLFVBJFMPXGRIB-UHFFFAOYSA-N Acetamide Chemical compound CC(N)=O DLFVBJFMPXGRIB-UHFFFAOYSA-N 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 230000003288 anthiarrhythmic effect Effects 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 238000004587 chromatography analysis Methods 0.000 description 3
- 238000002425 crystallisation Methods 0.000 description 3
- 230000008025 crystallization Effects 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- MUMZUERVLWJKNR-UHFFFAOYSA-N oxoplatinum Chemical compound [Pt]=O MUMZUERVLWJKNR-UHFFFAOYSA-N 0.000 description 3
- 239000000546 pharmaceutical excipient Substances 0.000 description 3
- 229910003446 platinum oxide Inorganic materials 0.000 description 3
- 102000005962 receptors Human genes 0.000 description 3
- 108020003175 receptors Proteins 0.000 description 3
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 3
- 235000017557 sodium bicarbonate Nutrition 0.000 description 3
- 125000001424 substituent group Chemical group 0.000 description 3
- FGGBJUOJAKQFRD-UHFFFAOYSA-N 1-oxido-5,6,7,8-tetrahydroquinolin-1-ium Chemical compound C1CCCC2=C1C=CC=[N+]2[O-] FGGBJUOJAKQFRD-UHFFFAOYSA-N 0.000 description 2
- ZOUPGSMSNQLUNW-UHFFFAOYSA-N 2-(3,4-dichlorophenyl)acetic acid Chemical compound OC(=O)CC1=CC=C(Cl)C(Cl)=C1 ZOUPGSMSNQLUNW-UHFFFAOYSA-N 0.000 description 2
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 2
- COILTWRTTQEQLM-UHFFFAOYSA-N C1=CCN(C)C2=C1C=CC=C2NC Chemical compound C1=CCN(C)C2=C1C=CC=C2NC COILTWRTTQEQLM-UHFFFAOYSA-N 0.000 description 2
- ZAFNJMIOTHYJRJ-UHFFFAOYSA-N Diisopropyl ether Chemical compound CC(C)OC(C)C ZAFNJMIOTHYJRJ-UHFFFAOYSA-N 0.000 description 2
- QUSNBJAOOMFDIB-UHFFFAOYSA-N Ethylamine Chemical compound CCN QUSNBJAOOMFDIB-UHFFFAOYSA-N 0.000 description 2
- 206010019280 Heart failures Diseases 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- 102000003840 Opioid Receptors Human genes 0.000 description 2
- 108090000137 Opioid Receptors Proteins 0.000 description 2
- 229920002472 Starch Polymers 0.000 description 2
- 239000007983 Tris buffer Substances 0.000 description 2
- PFKFTWBEEFSNDU-UHFFFAOYSA-N carbonyldiimidazole Chemical compound C1=CN=CN1C(=O)N1C=CN=C1 PFKFTWBEEFSNDU-UHFFFAOYSA-N 0.000 description 2
- 230000000747 cardiac effect Effects 0.000 description 2
- 239000012043 crude product Substances 0.000 description 2
- 239000003480 eluent Substances 0.000 description 2
- 239000000706 filtrate Substances 0.000 description 2
- 229910052736 halogen Inorganic materials 0.000 description 2
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 235000019359 magnesium stearate Nutrition 0.000 description 2
- 239000008188 pellet Substances 0.000 description 2
- 230000000144 pharmacologic effect Effects 0.000 description 2
- 238000004237 preparative chromatography Methods 0.000 description 2
- 230000033764 rhythmic process Effects 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 239000000377 silicon dioxide Substances 0.000 description 2
- 239000008107 starch Substances 0.000 description 2
- 235000019698 starch Nutrition 0.000 description 2
- 239000007858 starting material Substances 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 239000000454 talc Substances 0.000 description 2
- 229910052623 talc Inorganic materials 0.000 description 2
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 2
- SEJUQQOPVAUETF-QHLBDZCJSA-N (2r,6r,11s)-3-(cyclopropylmethyl)-6-ethyl-8-hydroxy-11-methyl-3,4,5,6-tetrahydro-2,6-methano-3-benzazocin-1(2h)-one Chemical compound C([C@@]1([C@@H]([C@@H]2C(=O)C=3C1=CC(O)=CC=3)C)CC)CN2CC1CC1 SEJUQQOPVAUETF-QHLBDZCJSA-N 0.000 description 1
- 125000001637 1-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C(*)=C([H])C([H])=C([H])C2=C1[H] 0.000 description 1
- XFSBVAOIAHNAPC-XTHSEXKGSA-N 16-Ethyl-1alpha,6alpha,19beta-trimethoxy-4-(methoxymethyl)-aconitane-3alpha,8,10alpha,11,18alpha-pentol, 8-acetate 10-benzoate Chemical compound O([C@H]1[C@]2(O)C[C@H]3[C@@]45C6[C@@H]([C@@]([C@H]31)(OC(C)=O)[C@@H](O)[C@@H]2OC)[C@H](OC)[C@@H]4[C@]([C@@H](C[C@@H]5OC)O)(COC)CN6CC)C(=O)C1=CC=CC=C1 XFSBVAOIAHNAPC-XTHSEXKGSA-N 0.000 description 1
- IQHSSYROJYPFDV-UHFFFAOYSA-N 2-bromo-1,3-dichloro-5-(trifluoromethyl)benzene Chemical group FC(F)(F)C1=CC(Cl)=C(Br)C(Cl)=C1 IQHSSYROJYPFDV-UHFFFAOYSA-N 0.000 description 1
- 125000003762 3,4-dimethoxyphenyl group Chemical group [H]C1=C([H])C(OC([H])([H])[H])=C(OC([H])([H])[H])C([H])=C1* 0.000 description 1
- 125000004800 4-bromophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1Br 0.000 description 1
- 125000000339 4-pyridyl group Chemical group N1=C([H])C([H])=C([*])C([H])=C1[H] 0.000 description 1
- CFCCLBKXDUBJOI-UHFFFAOYSA-N 8-iodo-1-methyl-5,6,7,8-tetrahydroquinolin-1-ium Chemical compound C1CCC(I)C2=C1C=CC=[N+]2C CFCCLBKXDUBJOI-UHFFFAOYSA-N 0.000 description 1
- 208000004998 Abdominal Pain Diseases 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- XFSBVAOIAHNAPC-UHFFFAOYSA-N Aconitin Natural products CCN1CC(C(CC2OC)O)(COC)C3C(OC)C(C(C45)(OC(C)=O)C(O)C6OC)C1C32C4CC6(O)C5OC(=O)C1=CC=CC=C1 XFSBVAOIAHNAPC-UHFFFAOYSA-N 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 206010007559 Cardiac failure congestive Diseases 0.000 description 1
- 241000700198 Cavia Species 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- 208000002881 Colic Diseases 0.000 description 1
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 1
- JOYRKODLDBILNP-UHFFFAOYSA-N Ethyl urethane Chemical compound CCOC(N)=O JOYRKODLDBILNP-UHFFFAOYSA-N 0.000 description 1
- 206010016654 Fibrosis Diseases 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 206010018910 Haemolysis Diseases 0.000 description 1
- 208000007514 Herpes zoster Diseases 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- 239000012359 Methanesulfonyl chloride Substances 0.000 description 1
- 208000019695 Migraine disease Diseases 0.000 description 1
- HDUJYVNPPAGYMR-UHFFFAOYSA-N N,1-dimethyl-3,4,4a,5,6,7,8,8a-octahydro-2H-quinolin-8-amine Chemical compound C1CCN(C)C2C(NC)CCCC21 HDUJYVNPPAGYMR-UHFFFAOYSA-N 0.000 description 1
- OHLUUHNLEMFGTQ-UHFFFAOYSA-N N-methylacetamide Chemical compound CNC(C)=O OHLUUHNLEMFGTQ-UHFFFAOYSA-N 0.000 description 1
- 208000008636 Neoplastic Processes Diseases 0.000 description 1
- 208000008589 Obesity Diseases 0.000 description 1
- 206010030113 Oedema Diseases 0.000 description 1
- 206010033645 Pancreatitis Diseases 0.000 description 1
- 206010065016 Post-traumatic pain Diseases 0.000 description 1
- 208000004550 Postoperative Pain Diseases 0.000 description 1
- 206010047281 Ventricular arrhythmia Diseases 0.000 description 1
- OCBFFGCSTGGPSQ-UHFFFAOYSA-N [CH2]CC Chemical compound [CH2]CC OCBFFGCSTGGPSQ-UHFFFAOYSA-N 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- BMIBFRRGTCTNAI-UHFFFAOYSA-N acetamide;thiophene Chemical compound CC(N)=O.C=1C=CSC=1 BMIBFRRGTCTNAI-UHFFFAOYSA-N 0.000 description 1
- 229940039750 aconitine Drugs 0.000 description 1
- STDXGNLCJACLFY-UHFFFAOYSA-N aconitine Natural products CCN1CC2(COC)C(O)CC(O)C34C5CC6(O)C(OC)C(O)C(OC(=O)C)(C5C6OC(=O)c7ccccc7)C(C(OC)C23)C14 STDXGNLCJACLFY-UHFFFAOYSA-N 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 150000001351 alkyl iodides Chemical class 0.000 description 1
- 230000000202 analgesic effect Effects 0.000 description 1
- 229940035676 analgesics Drugs 0.000 description 1
- 239000000730 antalgic agent Substances 0.000 description 1
- 230000002253 anti-ischaemic effect Effects 0.000 description 1
- 239000003416 antiarrhythmic agent Substances 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 239000008135 aqueous vehicle Substances 0.000 description 1
- 206010003119 arrhythmia Diseases 0.000 description 1
- 230000006793 arrhythmia Effects 0.000 description 1
- 208000037849 arterial hypertension Diseases 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid group Chemical group C(C1=CC=CC=C1)(=O)O WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- 125000004541 benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 230000027455 binding Effects 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 239000012267 brine Substances 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 125000004106 butoxy group Chemical group [*]OC([H])([H])C([H])([H])C(C([H])([H])[H])([H])[H] 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 239000003054 catalyst Substances 0.000 description 1
- 238000009903 catalytic hydrogenation reaction Methods 0.000 description 1
- 230000002490 cerebral effect Effects 0.000 description 1
- 238000005660 chlorination reaction Methods 0.000 description 1
- 125000001309 chloro group Chemical group Cl* 0.000 description 1
- 230000007882 cirrhosis Effects 0.000 description 1
- 208000019425 cirrhosis of liver Diseases 0.000 description 1
- 235000015165 citric acid Nutrition 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid group Chemical class C(CC(O)(C(=O)O)CC(=O)O)(=O)O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 1
- 229940110456 cocoa butter Drugs 0.000 description 1
- 235000019868 cocoa butter Nutrition 0.000 description 1
- 238000009833 condensation Methods 0.000 description 1
- 230000005494 condensation Effects 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 125000004663 dialkyl amino group Chemical group 0.000 description 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 238000004821 distillation Methods 0.000 description 1
- 230000001882 diuretic effect Effects 0.000 description 1
- 230000002497 edematous effect Effects 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- PSLIMVZEAPALCD-UHFFFAOYSA-N ethanol;ethoxyethane Chemical compound CCO.CCOCC PSLIMVZEAPALCD-UHFFFAOYSA-N 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 235000011087 fumaric acid Nutrition 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- 230000008588 hemolysis Effects 0.000 description 1
- 238000005984 hydrogenation reaction Methods 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- TUJKJAMUKRIRHC-UHFFFAOYSA-N hydroxyl Chemical compound [OH] TUJKJAMUKRIRHC-UHFFFAOYSA-N 0.000 description 1
- 230000001077 hypotensive effect Effects 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 125000001041 indolyl group Chemical group 0.000 description 1
- 229940102223 injectable solution Drugs 0.000 description 1
- 239000002198 insoluble material Substances 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 125000002346 iodo group Chemical group I* 0.000 description 1
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- 210000004731 jugular vein Anatomy 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 238000011866 long-term treatment Methods 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 210000004379 membrane Anatomy 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- QARBMVPHQWIHKH-UHFFFAOYSA-N methanesulfonyl chloride Chemical compound CS(Cl)(=O)=O QARBMVPHQWIHKH-UHFFFAOYSA-N 0.000 description 1
- 238000004452 microanalysis Methods 0.000 description 1
- 235000010755 mineral Nutrition 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 210000004400 mucous membrane Anatomy 0.000 description 1
- 230000003387 muscular Effects 0.000 description 1
- CJRIMTUAFCEBSY-UHFFFAOYSA-M n,1-dimethyl-5,6,7,8-tetrahydroquinolin-1-ium-8-amine;iodide Chemical compound [I-].C1=C[N+](C)=C2C(NC)CCCC2=C1 CJRIMTUAFCEBSY-UHFFFAOYSA-M 0.000 description 1
- VTINDJIPKUJXNT-UHFFFAOYSA-N n-methyl-2-(4-nitrophenyl)acetamide Chemical compound CNC(=O)CC1=CC=C([N+]([O-])=O)C=C1 VTINDJIPKUJXNT-UHFFFAOYSA-N 0.000 description 1
- 230000009871 nonspecific binding Effects 0.000 description 1
- 235000020824 obesity Nutrition 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 239000012074 organic phase Substances 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 125000000636 p-nitrophenyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)[N+]([O-])=O 0.000 description 1
- 125000001037 p-tolyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)C([H])([H])[H] 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 230000002980 postoperative effect Effects 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 230000029058 respiratory gaseous exchange Effects 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 235000011044 succinic acid Nutrition 0.000 description 1
- 239000010414 supernatant solution Substances 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 235000012222 talc Nutrition 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 235000013311 vegetables Nutrition 0.000 description 1
- 238000005303 weighing Methods 0.000 description 1
- 238000009736 wetting Methods 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D215/00—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems
- C07D215/02—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom
- C07D215/16—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D215/38—Nitrogen atoms
- C07D215/40—Nitrogen atoms attached in position 8
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
L'invention concerne les nouveaux composés : (CF DESSIN DANS BOPI) dans laquelle R1 est un alcoyle (C1 -C5 ), R2 est H, alcoyle (C1 -C5 ), A est une chaîne (CH2 )n , n étant un nombre entier de 0 à 5, ou -CH2 -O- ou une chaîne alcoylène substituée par un alcoyle, ayant au total 2 à 8 atomes de carbone, Z est un phényle éventuellement substitué par un naphtyle, un indényle, un hétéromonocycle ayant 5 ou 6 chaînons ou un hétérobicycle, tous ces radicaux étant éventuellement substitués, étant entendu que lorsque Z représente un phényle substitué en ortho par un alcoxy, A ne peut pas représenter (CH2 )n dans lequel n = 0, sous toutes leurs formes énantiomères et diastéréoisomères possibles et sous forme de sels d'addition avec les acides ou de sels d'ammonium quaternaire, leur procédé de préparation et les intermédiaires de préparation, leur application comme médicaments et les compositions les renfermant.
Description
Nouveaux derivés de la décahydroquinoléine, leur procédé de préparation et
les nouveaux intermédiaires obtenus, Leur application à titre de
médicaments et les compositions pharmaceutiques les renfermant.
les nouveaux intermédiaires obtenus, Leur application à titre de
médicaments et les compositions pharmaceutiques les renfermant.
****************************
Société dite : ROUSSEL-UCLAF
****************************
L'invention concerne de nouveaux dérivés de la décahydroquinoléine, leur procédé de préparation et Les nouveaux intermédiaires obtenus, leur application à titre de médicaments et les compositions pharmaceutiques les renfermant.
Société dite : ROUSSEL-UCLAF
****************************
L'invention concerne de nouveaux dérivés de la décahydroquinoléine, leur procédé de préparation et Les nouveaux intermédiaires obtenus, leur application à titre de médicaments et les compositions pharmaceutiques les renfermant.
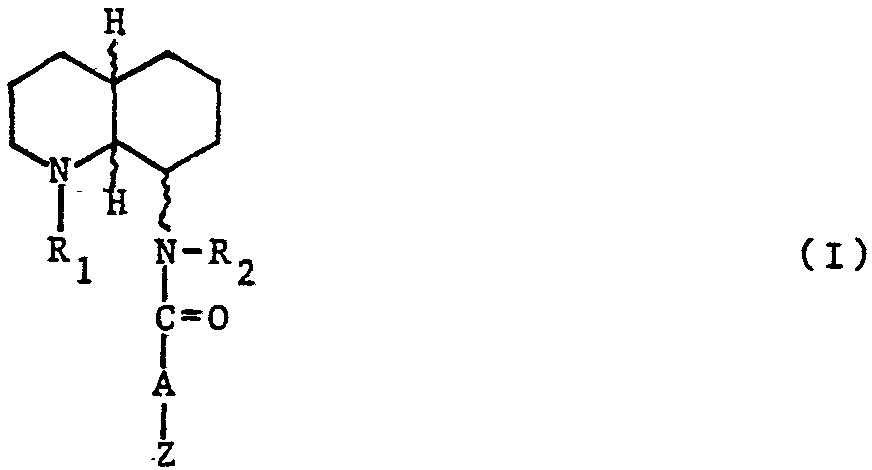
L'invention a pour objet des composés de formule (I) :
dans Laquelle R1 represente un radical alcoyle renfermant de 1 à 5 atomes de carbone, R2 représente un atone d'hydrogène ou un radical alcoyle renfermant de 1 à 5 atomes de carbone, A γ; présente une channe (CH2)n dans laquelle n représente un nombre de O à 5, ou -CH2-O- ou
A représente une chaine alcoyle substituée par un radical alcoyle renfermant au totaL de Z à 8 atomes de carbone, Z représente un radical phényle éventuellement substitué par un ou plusieurs radicaux identiques ou différents, un radical naphtyle, un radical indenyle, un radical hétéromonocyclique renfermant 5 ou 6 chaînons ou un radical hétérobicyclique, tous ces radicaux étant éventuellement substitues par un ou plusieurs radicaux identiques ou différents, étant entendu que Lorsque
Z représente un radical phényle substitué en ortho par un radical alcoxy,
A ne peut pas représenter la va leur (CH2)n dans laquelle n représente le nombre O, lesdits composés de formule formule (I) pouvant être dans toutes les formes énantioméres et diastéréoisomères possibles et sous forme de sels d'addition avec les acides ou de seLs d'ammonium quaternaire.
dans Laquelle R1 represente un radical alcoyle renfermant de 1 à 5 atomes de carbone, R2 représente un atone d'hydrogène ou un radical alcoyle renfermant de 1 à 5 atomes de carbone, A γ; présente une channe (CH2)n dans laquelle n représente un nombre de O à 5, ou -CH2-O- ou
A représente une chaine alcoyle substituée par un radical alcoyle renfermant au totaL de Z à 8 atomes de carbone, Z représente un radical phényle éventuellement substitué par un ou plusieurs radicaux identiques ou différents, un radical naphtyle, un radical indenyle, un radical hétéromonocyclique renfermant 5 ou 6 chaînons ou un radical hétérobicyclique, tous ces radicaux étant éventuellement substitues par un ou plusieurs radicaux identiques ou différents, étant entendu que Lorsque
Z représente un radical phényle substitué en ortho par un radical alcoxy,
A ne peut pas représenter la va leur (CH2)n dans laquelle n représente le nombre O, lesdits composés de formule formule (I) pouvant être dans toutes les formes énantioméres et diastéréoisomères possibles et sous forme de sels d'addition avec les acides ou de seLs d'ammonium quaternaire.
Lorsque Z représente un radical phényle substitué, le ou les substituants sont de préférence choisis dans le groupe constitué par les radicaux alcoyles renfermant de 1 à 5 atomes de carbone, les radicaux alcoxy renfermant de 1 à 5 atomes de carbone, les atomes d'halogenes, les radicaux hydroxyle, trifluorométhyle, nitro, amino, monoalkyl ou dialkylamino dont les radicaux alcoyles renferment de 1 à 5 atomes de carbone.
Lorsque Z représente un radical naphtyle, indényle ou héterocyclique substitué, le ou les substituants sont de préférence choisis dans le groupe constitué par les radicaux alcoyles renfermant de 1 à 5 atomes de carbone, les radicaux alcoxy renfermant de 1 à 5 atomes de carbone, les radicaux trifluorométhyle, nitro, amino, monoalkyl ou dialkylamino dont les radicaux alcoyles renferment de 1 à 5 atomes de carbone et phényle éventuellement substitué par un ou plusieurs radicaux alcoyle renfermant de 1 à 5 atomes de carbone, alcoxy renfermant de 1 à 5 atomes de carbone ou halogènes.
Par substituant alcoyle, alcoxy ou halogène, on entend de préférence méthyle, éthyle, propyle ou butyle linéaire ou ramifié, méthoxy, éthoxy, propoxy ou butoxy linéaire ou ramifié, fluoro, chloro, bromo ou iodo.
Dans les va leurs monoalkyl et dialkylamino, les radicaux allyles sont préférentiellement les radicaux méthyle ou éthyle.
Lorsque Z représente un radical hétéromonocyclique renfermant 5 ou 6 chaînons, il s'agit de préférence d'un radical thiazolyle, pyridinyle, oxazolyle, isoxazolyle, imidazolyle ou thiényle.
Lorsque Z représente un radical hetérobicyclique, il s'agit de préférence d'un radical indolyle, quinoLyle, benzo [b] thiényle, benzimidazolyle, benzoxazolyle ou ou benzothiazolyle.
Lorsque A represente une channe (CH2)n, n est de préférence égal à
O ou 1.
O ou 1.
Lorsque A représente une chaîe alcoylène substituée par un radical alcoyle, par alcoyle on entend de préférence methyle ou ethyle et A est alors de préférence un radical 1,1-éthanediyl, 1-méthyl 1,2-éthanediyl, 1méthyl ou 2-methyl 1,3-propanediyl, 1-éthyl 1,2-éthanediyl.
Par ailleurs, un composé de formule (I) peut exister sous la forme de quatre racemates, ou paire d'énantioméres. Les énantiomères de chaque paire peuvent être séparés par des procédés classiques. L'invention couvre donc toutes Les formes énantiomères et diastéréoisomères des composés de formule (I).
Les sels d'addition avec les acides minéraux ou organiques peuvent être, par exempLe, les sels formes avec les acides chlorhydrique, bromhydrique, nitrique, sulfurique, phosphorique, acétique, propionique, formique, benzoique, matéique, fumarique, succinique, tartrique, citrique, oxalique, glyoxylique, aspartique, alcanesulfoniques tels que L'acide méthane sulfonique et arylsulfoniques, tels que l'acide benzène sulfonique.
L'invention concerne aussi des composés de formule (I) sous forme de seLs d'ammonium quaternaire.
Par sels d'ammonium quaternaire, on entend les composés de formule (I) quaternises par des produits de type R-Y, R etant un radical alcoyle ayant de 1 à 4 atomes de carbone tel qu'un radical méthyle, éthyle, n-propyle ou isopropyle et Y un anion halogénure, par exempLe, un chlorure, un bromure, un iodure.
L'invention concerne notamment les produits de formule (I) dans laquelle R1 représente un radical alcoyle renfermant de 1 à 5 atomes de carbone, A représente une chaine alkylene linéaire -(CH2)n-, n représentant un nombre entier pouvant varier entre O et 5 ou une chaîne alkylène ramifiée renfermant de 2 à 8 atomes de. carbone, R2 représente un atome d'hydrogène ou un radical alcoyLe renfermant de 1 à 5 atomes de carbone, Z représente un radicaL phényle substitué par X et X', identiques ou différents, représentent un atome d'hydrogène, un radical alcoyle renfermant de 1 à 4 atomes de carbone, un radical alkoxy renfermant de 1 à 4 atomes de carbone, un radicaL hydroxyle, un atome d'halogène, un radical trifluoromethyle, nitro, amino, monoalkylamino ou dialkylamino, étant entendu que Lorsque X ou X' représente un radical aLkoxy en position ortho du noyau phényl, n ne peut représenter La va leur 0 Lorsque A représente -(CH2)n-, lesdits composés de formule (I) pouvant être dans toutes les formes énantiomères et diastéréoisomères possibles et sous forme de sels d'addition avec Les acides ou de seLs d'ammonium quaternaire.
L'invention concerne notamment Les composes de formule (I) caractérisés en ce que La jonction des cycles est cis ainsi que leurs sels d'addition avec Les acides et ceux caractérisés en ce que A représente un groupe -CH2- ou -CH2-O-, ainsi que Leurs sels d'addition avec les acides
L'invention a particulièrement pour objet Les composés de formule (I) caractérisés en ce que R1 représente un radical méthyle ou éthyle, R2 represente un atome d'hydrogène, un radical méthyle ou éthyle, Z représente un radical phényle substitué éventuellement par un ou deux radicaux choisis parmi les radicaux méthyle ou éthyle, méthoxy ou ethoxy, les atomes de chlore ou de brome, les radicaux trifluorométhyle ou nitro ainsi que leurs sels d'addition avec les acides et ceux caractérisés en ce que R1 représente un radical méthyle ou éthyle, R2 représente un atome d'hydrogène, un radical methyle ou éthyle, Z représente un radical naphtyle, pyridinyle, benzo [b] thiényle, ainsi que Leurs sels d'addition avec les acides.
L'invention a particulièrement pour objet Les composés de formule (I) caractérisés en ce que R1 représente un radical méthyle ou éthyle, R2 represente un atome d'hydrogène, un radical méthyle ou éthyle, Z représente un radical phényle substitué éventuellement par un ou deux radicaux choisis parmi les radicaux méthyle ou éthyle, méthoxy ou ethoxy, les atomes de chlore ou de brome, les radicaux trifluorométhyle ou nitro ainsi que leurs sels d'addition avec les acides et ceux caractérisés en ce que R1 représente un radical méthyle ou éthyle, R2 représente un atome d'hydrogène, un radical methyle ou éthyle, Z représente un radical naphtyle, pyridinyle, benzo [b] thiényle, ainsi que Leurs sels d'addition avec les acides.
L'invention a tout particulièrement pour objet le [4aRS (4a alpha, 8 alpha, 8a alpha)] (+) N-(decahydro 1-methyl 8-quinoléinyl) 3,4-dichloro Nméthyl benzène acétamide et ses sels d'addition avec acides et le (4a alpha, 8 aLpha, 8a alpha) (+) N-(décahydro 1-méthyl 8-quinoléinyl) [2- (3,4-dichLorophénoxy)) N-méthyl acétamide et ses sels d'addition avec les acides.
L'invention concerne aussi un procédé de preparation des produits de formule (I), caractérise en ce que l'on soumet la 8-chloro 5,6,7,8tétahydroquinoléine, à L'action d'un produit de formule X-R1, R1 étant un radical alcoyle renfermant de 1 à 5 atomes de carbone et X représentant un atome d'halogène pour obtenir un produit de formule (II) :
que l'on fait réagir avec une amine de formule NH2-R2, R2 etant un atome d'hydrogène ou un radical alcoyle renfermant de 1 à 5 atomes de carbone, pour obtenir un produit de formule (III) :
que l'on réduit pour obtenir un produit de formule (IV) sous toutes les formes enantiomères et diastéréoisomères possibles ::
que l'on condense avec un acide de formule (V) ou un dérivé fonctionnel de celui-ci .
que l'on fait réagir avec une amine de formule NH2-R2, R2 etant un atome d'hydrogène ou un radical alcoyle renfermant de 1 à 5 atomes de carbone, pour obtenir un produit de formule (III) :
que l'on réduit pour obtenir un produit de formule (IV) sous toutes les formes enantiomères et diastéréoisomères possibles ::
que l'on condense avec un acide de formule (V) ou un dérivé fonctionnel de celui-ci .
HOOC-(A)-Z
A et Z ayant toutes Les significations données precédemment, pour obtenir un produit de formule (I) dans toutes les formes énantiomères et diastéréoisomères possibles, pouvant être dedouble pour obtenir les formes optiquement actives et que L'on traite si désiré avec un acide minéral ou organique pour en former le sel.
A et Z ayant toutes Les significations données precédemment, pour obtenir un produit de formule (I) dans toutes les formes énantiomères et diastéréoisomères possibles, pouvant être dedouble pour obtenir les formes optiquement actives et que L'on traite si désiré avec un acide minéral ou organique pour en former le sel.
Dans un mode de réalisation préféré du procéde de L'invention : - Le dérivé halogéné X-R1 est un iodure d'alcoyle et la réaction s'effectue dans l'acetonitriLe.
- La réduction du produit de formule (III) est effectuée par hydrogénation catalytique. Le catalyseur utilisé est de préférence L'oxyde de platine.
- L'activation de La fonction carboxyle du composé de formule (V) pour realiser la condensation avec le composé de formule (IV) s'effectue en présence de carbonyLdiimidazole ou de dicyctohexylcarbodiimide. On peut également activer L'acide de formule (V) sous la forme d'un chlorure d'acide ou d'anhydride mixte.
Par ailleurs, Les 2 isomères de formule (IV) correspondant aux orientations alpha ou béta du groupement
par rapport au cycle sont séparés par chromatographie. Chacun des racémiques obtenus peut être dédoubLé par des méthodes usuelles par exemple par séparation des sels des diastéréoisoméres obtenus à partir d'acides optiquement actifs.
par rapport au cycle sont séparés par chromatographie. Chacun des racémiques obtenus peut être dédoubLé par des méthodes usuelles par exemple par séparation des sels des diastéréoisoméres obtenus à partir d'acides optiquement actifs.
Les composés de formule (I) tels que définis ci-dessus ainsi que leurs sels d'addition avec les acides présentent d'intéressantes propriétés pharmacologiques. Ils présentent en particulier une forte affinité pour les récepteurs opiacés et notamment pour les récepteurs K et sont doués de propriétés analgésiques centrales.
Ils sont doués également de propriétés diurétiques, de propriétés anti-arythmiques, anti-ischémiques cérébrales et hypotensives.
Ces propriétés justifient Leur appLication en therapeutique et
L'invention a également pour objet titre de médicaments, les produits tels que définis par la formule (I) ci-dessus ainsi que par leurs sels d'addition avec les acides pharmaceutiquement acceptables et leurs sels d'ammonium quaternaire.
L'invention a également pour objet titre de médicaments, les produits tels que définis par la formule (I) ci-dessus ainsi que par leurs sels d'addition avec les acides pharmaceutiquement acceptables et leurs sels d'ammonium quaternaire.
Les médicaments, objet de L'invention, permettent notamment de soulager une douleur quelle qu'en soit l'origine, par exemple une douleur de nature musculaire, articulaire ou nerveuse.
Ils peuvent être aussi utilisés dans le traitement des douleurs dentaires, des migraines, du zona, dans le traitement des douleurs intenses, en particulier rebelles aux antalgiques périphériques, par exemple au cours du processus néoplasique, dans le traitement des pancréatites, coliques néphrétiques ou biliaires, dans le traitement des douleurs post-opératoires et post-traumatiques.
La posologie varie notamment en fonction de la voie d'administration, de l'affection traitée et du sujet en cause.
Par exemple, chez l'adulte, elle peut varier entre 20 et 400 mg de principe actif par jour, par voie orale et entre 5 et 100 mg par jour, par voie parentérale.
Les médicaments, objet de l'invention, trouvent aussi leur emploi dans le traitement des arythmies.
La dose usuelle, dans ce traitement, variable selon le dérivé utilisé, le sujet et l'affection en cause, peut être par exemple de 50 mg à 1 g par jour.
Par voie orale, le principe actif peut être administré à la dose quotidienne de 200 mg à 800 mg, par exemple pour le traitement des arythmies ventriculaires, supraventriculaires et jonctionnelles, soit environ de 3 mg à 12 mg par kilogramme de poids corporel.
Les médicaments, objet de L'invention peuvent aussi être utilisés dans le traitement des syndromes oedémateux, de l'insuffisance cardiaque, de certaines obésités, des cirrhoses, dans le traitement des oedèmes sévères et réfractaires, en particulier ceux de l'insuffisance cardiaque congestive et dans le traitement au long cours de L'hypertention artérielle.
La dose quotidienne de principe actif est variable. Elle peut être par exemple de 60 à 100 mg/jour par voie orale.
L'invention s'étend aux compositions pharmaceutiques renfermant comme principe actif les médicament définis ci-dessus.
Ces compositions pharmaceutiques peuvent être adminitrées par voie buccale, rectale, par voie parentérale ou par voie locale en application topique sur la peau et les muqueuses.
Ces compositions peuvent être solides ou liquides et se présenter sous les formes pharmaceutiques couramment utilisées en médecine humaine comme par exempLe, les comprimés simples ou dragéifiés, les gélules, les granulés, les suppositoires, les préparations injectables, les pommades, les crèmes, les gels et les préparations en aérosols ; elles sont préparées selon les méthodes usuelles. Le principe actif peut y être incorporé à des excipients habituellement employés dans ces compositions pharmaceutiques, tels que le talc, la gomme arabique, le Lactose, l'amidon, Le stéarate de- magnésium, Le beurre de cacao, les véhicules aqueux ou non, les corps gras d'origine animale ou végétale, les dérives paraffiniques, les glycols, les divers agents mouillants, dispersants ou émulsifiants, les conservateurs.
La posologie varie notamment en fonction de la voie d'administration, de L'affection traitée et du sujet en cause.
Par- exemple, chez l'adulte, elle peut varier entre 20 et 400 mg de principe actif par jour, par voie orale et entre 5 et 100 mg par jour, par voie parentérale.
Par ailleurs, les composés de formule (III) et (IV) sont des produits chimiques nouveaux.
L'invention a donc pour objet ces produits à titre de produits industriels nouveaux, notamment à titre de produits intermédiaires nécessaires à la mise en oeuvre du procédé.
La 8-chloro 5,6,7,8-tétrahydroquinoléine, utilisée comme produit de départ dans le procédé de l'invention, est préparée par chloruration de La 5,6,7,8-tétrahydroquinoléine N-oxyde selon la méthode indiquée dans Le brevet US 3 991 065.
Les exemples donnés ci-apres illustrent l'invention sans toutefois la limiter.
Exemple 1 : [4aRS (4a alpha, 8 alpha, 8a alpha)] (4) N-(décahydro 1 mthyl 8-quinoléinyl) 3,4-dichLoro N-méthyl benzène acétamide et son chlorhydrate.
Stade A : Iodure de 8-iodo 1-méthyl 5,6,7,8-tétrahydro t-quinolinium.
On agite 68 heures à température ambiante une solution renfermant 13,70' g de 5,6,7,8-tetrahydro 8-chloroquinoléine (préparation donnée cidessous), 86 cm3 d'acétonitrite et 15,2 cm3 d'iodure de méthyle. On amorce la cristallisation apres 50 minutes de réaction, essore, rince à l'acétonitrile puis à L'éther, seche sous pression réduite à 20wC et obtient 29,96 g de produit attendu. F = 175#C.
Préparation de La 5,6,7,8-tétrahydro 8-chloroquinoléine utilisee comme produit de depart.
On ajoute Lentement à température ambiante 3 cm3 de chlorure de méthane sulfonyle à 1,49 g de 5,6,7,8-tétrahydroquinoléine N-oxyde sous agitation et atmosphère inerte. On chauffe ensuite 4 heures à 80-82nC puis refroidit à 20C. On verse sur 20 cm3 de solution saturée de bicarbonate de sodium puis ajoute lentement jusqu'à obtention d'un pH alcalin du bicarbonate de sodium. On extrait par du chlorure de méthylène, lave à l'eau, seche les solutions organiques reunies, distille à sec sous pression réduite et obtient 1,53 g de produit attendu sous forme d'une huile.
Stade B : Iodure de 1-methyl 8-(mthylamino) 5,6,7,8-tétrahydro 1quinolinium.
On introduit 8,02 g de produit obtenu au stade A dans 40 cm3 de tétrahydrofuranne et ajoute ensuite en une fois à la pipette 7,4 cm3 d'une solution éthanolique de monoéthylamine. On agite 20 heures à température ambiante la suspension obtenue, essore les cristaux, rince par du tétrahydrofuranne et de l'éther, sèche sous pression réduite à 20nC et obtient 4,76 g de produit attendu. F = 180#C.
Stade C : C4aRS (4a alpha, 8 alpha, 8a alpha)] (+) décahydro N,1 dimethyl 8-quinoléinamine et C4aRS C4a alpha, 8 alpha, 8a alpha)] (#) décahydro N,1-diméthyl 8-quinoléinamine.
On ajoute en une fois 1,029 g d'oxyde de platine dans une solution. de 10,29 g de produit obtenu au stade B dans 150 cm3 d'acide acétique. On hydrogène la suspension à 22-24#C durant 50 heures. Après 29 heures d'hydrogenation, on a rajouté 1 g d'oxyde de platine. On ajoute en fin de réaction 30 cm3 d'eau, filtre, rince au méthanol, distille sous pression réduite. On reprend Le résidu dans 200 cm3 d'éther, ajoute lentement sous agitation et en refroidissant 200 cm3 de lessive de soude diluée au demi.
On agite, décante, extrait la phase aqueuse à L'éther, sèche les phases organiques et distille à sec sous pression réduite. On obtient 5,60 g de produit qui est un mélange des 2 diastéréoisomères à jonction de cycle cis.
Séparation des 2.diastéréoisomères par chromatographie préparative.
On effectue une chromatographie préparative sur silice (éluant acétate d'éthyle-méthanot-triéthylamine 85-10-5) à pression atmosphérique.
On laisse en contact 1 heure avec l'étuant et chromatographie 5,5 g de base brute. On récupère en tête une fraction de 579 mg de mélange de 3 produits mobiles et amene ensuite à sec sous pression réduite les fractions correspondant à l'isomère ayant L'orientation 8 alpha. On obtient 1,122 g de produit à orientation 8 alpha. On amène à sec sous pression réduite les fractions correspondant à l'isomère ayant
L'orientation 8 bêta. On obtient 3,361 g de produit à orientation 8 bêta.
L'orientation 8 bêta. On obtient 3,361 g de produit à orientation 8 bêta.
Stade D : [4aRS (4a alpha, 8 alpha, 8a alpha)3 (+) N-(décahydro 1méthyl 8-quinoléinyl) 3,4-dichloro N-méthyl benzène acétamide et son chlorhydrate.
On mélange à 20nC pendant 1 heure 2,13 g d'acide 3,4-dichlorophényl acétique, 1,69 g de carbonyldiimidazole et 20 cm3 de tétrahydrofuranne. On ajoute ensuite 1,46 g de diastéréoisomère 8 alpha obtenu comme au stade C en solution dans 5 cm3 de tetrahydrofuranne et agite 3 heures 30 minutes à 20-22#C. On élimine le tétrahydrofuranne sous pression réduite, reprend le résidu par 50 cm3 d'éther, lave par une solution saturée de bicarbonate de sodium, puis par de l'eau salée, sèche, rince et concentre sous pression réduite. On obtient 3,73 g de produit brut que l'on purifie par passage à
L'oxalate. On dissout 3,645 g de produit brut dans 10 cm3 d'éthanol et ajoute 1,5 g d'acide oxalique en solution dans 2,5 cm3 d'éthanol.On filtre L'insoluble obtenu, rince à Itéthanol, sèche sous pression réduite à 20nC et obtient 464 mg de produit. On ajoute lentement aux liqueurs mères 120 cm3 d'éther, une gomme précipite. On décante La solution surnageante, rince à l'éther, reprend La gomme à l'eau et alcalinise par du bicarbonate de sodium en présence de 50 cm3 d'éther. On décante, lave à L'eau salée, seche, concentre à sec sous pression réduite. On obtient 2,29 g de produit attendu sous forme d'un extrait sec huileux qui cristallise.
L'oxalate. On dissout 3,645 g de produit brut dans 10 cm3 d'éthanol et ajoute 1,5 g d'acide oxalique en solution dans 2,5 cm3 d'éthanol.On filtre L'insoluble obtenu, rince à Itéthanol, sèche sous pression réduite à 20nC et obtient 464 mg de produit. On ajoute lentement aux liqueurs mères 120 cm3 d'éther, une gomme précipite. On décante La solution surnageante, rince à l'éther, reprend La gomme à l'eau et alcalinise par du bicarbonate de sodium en présence de 50 cm3 d'éther. On décante, lave à L'eau salée, seche, concentre à sec sous pression réduite. On obtient 2,29 g de produit attendu sous forme d'un extrait sec huileux qui cristallise.
F = 92nC.
Préparation du chlorhydrate.
On dissout 2,15 g d'extrait sec dans 5 cm3 d'éthanol à 50-60nC, filtre, rince à l'éthanol et à l'éther. On ajoute 2 cm3 d'acide chlorhydrique dans l'éthanol, amorce la cristallisation, obtient une prise en masse épaisse, dilue par de L'éther, essore, rince à l'éthanol avec un mélange éther-éthanol (3-2) puis à L'éther. On sèche sous pression réduite à 70EC et obtient 2,05 g de produit attendu. F = 253#C.
Exemple 2 : [4aRS (4a aLpha, 8 alpha, 8a alpha) (+) N-(décahydro 1méthyl 8-quinoléinyl) 3,4-dichloro N-méthyl benzène acétamide et son chlorhydrate.
On introduit 1,46 g de dicyclohexylcarbodiimide dans une solution renfermant 1,46 g d'acide 3,4-dichlorophénylacétique, 1,122 g de diastéréoisomère 8 béta obtenu au stade C de l'exemple 1 et 20 cm de chlorure de méthylène. On agite 3 heures 30 minutes, filtre, rince au chlorure de méthylène, concentre à sec le filtrat sous pression réduite et reprend le résidu à L'éther, Lave avec une solution aqueuse saturée en bicarbonate de sodium puis à L'eau salée, sèche, concentre à sec sous pression réduite. On obtient 2,845 g de produit que L'on reprend par 15 cm3 d'éther, amorce la cristallisation, essore, rince à L'éther, sèche sous pression réduite et obtient 2,053 g de produit. On purifie 1,885 g de produit par chromatographie sur silice Céluant : acétate d'éthyle à 2% de triéthylamine). Après avoir amené à sec les fractions homogènes, on récupère 1,477 g de produit que l'on dissout dans du chlorure de méthylène et filtre. On distille le chlorure de méthylène sous pression réduite tout en introduisant de l'éther isopropylique. Le produit cristallise en cours de distillation ; on essore, rince à l'éther isopropylique, sèche sous pression réduite à 50nC et obtient 1,27 g de produit attendu. F-= 139nC sous forme de base.
Préparation du chlorhydrate.
On dissout 1,2 9 de produit obtenu ci-dessus dans 4,8 cm3 d'éthanol et 1 cm3 d'éthanol renfermant de L'acide chlorhydrique (5,75N) a 20nC, filtre, rince à l'éthanol, concentre à sec le filtrat sous pression réduite. On triture le résidu dans 10 cm3 d'éther, essore, rince à l'éther, seche sous pression réduite a 70#C. On obtient 1,259 g de produit attendu. F # 258#C.
En opérant comme à l'exemple 1 au départ de la [4aRS (4a alpha, 8 alpha, 8a alpha)] (#) décahydro N,1-diméthyl 8-quinoléinamine et de
L'acide convenable, on a préparé les produits des exemples 3 à 11 dont les noms suivent.
L'acide convenable, on a préparé les produits des exemples 3 à 11 dont les noms suivent.
Exemple 3 : Cia aLpha, 8 alpha, 8a alpha) (t) N-(décahydro 1-méthyL 8quinoléinyl) N-méthyl 4-nitrobenzène acétamide et son chlorhydrate.
Exemple 4 : [4a alpha, 8 alpha, 8a alpha)] (#) N-(décahydro 1-méthyl 8quinoléinyl) N-méthyl 4-(trifluorométhyl) benzène acétamide et son Ebutene dioate.
Exemple 5 : [4a alpha, 8 alpha, 8a alpha)] 4-bromo N-(décahydro 1-méthyl 8-quinoléinyt > N-méthyl benzène acétamide et son chlorhydrate.
Exemple 6 : [4a alpha, 8 alpha, 8a alpha)] (#) N-(décahydro 1-méthyl 8quinoléinyl) 4,N-diméthyl benzène acétamide et son chlorhydrate.
Exemple 7 : [4a alpha, 8 alpha, 8a alpha)] (#) N-(décahydro 1-méthyl 8quinotéinyl) 2-(3,4-dichlorophénoxy) N-méthyl acétamide et son E-butène dioate.
Exemple 8 : [4a alpha, 8 alpha, 8a alpha)] (#) N-(décahydro 1-méthyl 8quinotéinyl) 3,4-diméthoxy N-méthyl benzène acétamide et son E-butène dioate.
Exemple 9 : [4a alpha, 8 alpha, 8a alpha)] (#) N-(décahydro 1-méthyl 8quinoléinyl) N-méthyl 1-naphtalène acétamide et son E-butène dioate.
Exemple 10 : [4a alpha, 8 alpha, 8a alpha) (t) N-(décahydro 1-méthyl 8quinoléinyl) N-méthyl 4-pyridine acétamide et son oxalate.
Exemple 11 : [a alpha, 8 aLpha, b alpha) (t) N-(décahydro 1-méthyl 8quinoléinyl) N-méthyl benzo (b) thiophène acétamide.
L'acide utilisé, les résultats de la microanalyse et les points de fusion des produits obtenus figurent dans le tableau I ci-après. TABLEAU I
Exemple <SEP> Acide <SEP> utilisé <SEP> au <SEP> départ <SEP> Micbanalyse <SEP> : <SEP> Calculé/Trouvé
<tb> <SEP> C% <SEP> H% <SEP> N% <SEP> Cl% <SEP> Br% <SEP> S% <SEP> F( C)
<tb> 3 <SEP> Acide <SEP> p-nitrophényl <SEP> acétique <SEP> 59,75 <SEP> 7,39 <SEP> 11,00 <SEP> 9,28 <SEP> #228
<tb> <SEP> 59,6 <SEP> 7,3 <SEP> 10,8 <SEP> 9,4 <SEP> (décomp)
<tb> 4 <SEP> Acide <SEP> p-trifluorométhyl <SEP> acétique <SEP> 59,49 <SEP> 6,45 <SEP> 5,78 <SEP> 11,76 <SEP> 180
<tb> <SEP> 59,7 <SEP> 6,77 <SEP> 5,7 <SEP> 11,45
<tb> 5 <SEP> Acide <SEP> p-bromophényl <SEP> acétique <SEP> 54,88 <SEP> 6,79 <SEP> 6,74 <SEP> 8,52 <SEP> 19,22 <SEP> > 260
<tb> <SEP> 54,6 <SEP> 6,9 <SEP> 6,5 <SEP> 8,2 <SEP> 19,0
<tb> 6 <SEP> Acide <SEP> p-tolyl <SEP> acétique <SEP> 68,45 <SEP> 8,90 <SEP> 7,98 <SEP> 10,10 <SEP> > 260
<tb> <SEP> 68,4 <SEP> 9,2 <SEP> 7,8 <SEP> 10,3
<tb> 7 <SEP> Acide <SEP> 3,4-dichlorophénoxy <SEP> acétique <SEP> 55,09 <SEP> 6,03 <SEP> 5,59 <SEP> 14,14 <SEP> 205
<tb> <SEP> 55,1 <SEP> 6,1 <SEP> 5,5 <SEP> 14,0
<tb> 8 <SEP> Acide <SEP> 3,4-diméthoxyphényl <SEP> acétique <SEP> 63,01 <SEP> 7,61 <SEP> 5,88 <SEP> #150
<tb> <SEP> 63,1 <SEP> 7,7 <SEP> 5,6 <SEP> (décomp)
<tb> 9 <SEP> Acide <SEP> 1-napthyl <SEP> acétique <SEP> 69,50 <SEP> 7,34 <SEP> 6,00 <SEP> # <SEP> 199
<tb> <SEP> 69,6 <SEP> 7,4 <SEP> 6,0 <SEP> (décomp)
<tb> 10 <SEP> Acide <SEP> 4-pyridyl <SEP> acétique <SEP> 54,8 <SEP> 6,49 <SEP> 8,73 <SEP> 187
<tb> <SEP> 54,6 <SEP> 6,4 <SEP> 8,7
<tb> 11 <SEP> Acide <SEP> 4-thianaphtène <SEP> acétique <SEP> 64,18 <SEP> 7,44 <SEP> 7,13 <SEP> 9,02 <SEP> 8,16 <SEP> > 260
<tb> <SEP> 63,9 <SEP> 7,4 <SEP> 7,2 <SEP> 9,3 <SEP> 8,0
<tb>
Exemple 12 :
On a préparé des comprimés répondant à la formule suivante : - produit de L'exemple 1 ....................................... 200 mg - excipient q.s.p................................................. 800mg.
<tb> <SEP> C% <SEP> H% <SEP> N% <SEP> Cl% <SEP> Br% <SEP> S% <SEP> F( C)
<tb> 3 <SEP> Acide <SEP> p-nitrophényl <SEP> acétique <SEP> 59,75 <SEP> 7,39 <SEP> 11,00 <SEP> 9,28 <SEP> #228
<tb> <SEP> 59,6 <SEP> 7,3 <SEP> 10,8 <SEP> 9,4 <SEP> (décomp)
<tb> 4 <SEP> Acide <SEP> p-trifluorométhyl <SEP> acétique <SEP> 59,49 <SEP> 6,45 <SEP> 5,78 <SEP> 11,76 <SEP> 180
<tb> <SEP> 59,7 <SEP> 6,77 <SEP> 5,7 <SEP> 11,45
<tb> 5 <SEP> Acide <SEP> p-bromophényl <SEP> acétique <SEP> 54,88 <SEP> 6,79 <SEP> 6,74 <SEP> 8,52 <SEP> 19,22 <SEP> > 260
<tb> <SEP> 54,6 <SEP> 6,9 <SEP> 6,5 <SEP> 8,2 <SEP> 19,0
<tb> 6 <SEP> Acide <SEP> p-tolyl <SEP> acétique <SEP> 68,45 <SEP> 8,90 <SEP> 7,98 <SEP> 10,10 <SEP> > 260
<tb> <SEP> 68,4 <SEP> 9,2 <SEP> 7,8 <SEP> 10,3
<tb> 7 <SEP> Acide <SEP> 3,4-dichlorophénoxy <SEP> acétique <SEP> 55,09 <SEP> 6,03 <SEP> 5,59 <SEP> 14,14 <SEP> 205
<tb> <SEP> 55,1 <SEP> 6,1 <SEP> 5,5 <SEP> 14,0
<tb> 8 <SEP> Acide <SEP> 3,4-diméthoxyphényl <SEP> acétique <SEP> 63,01 <SEP> 7,61 <SEP> 5,88 <SEP> #150
<tb> <SEP> 63,1 <SEP> 7,7 <SEP> 5,6 <SEP> (décomp)
<tb> 9 <SEP> Acide <SEP> 1-napthyl <SEP> acétique <SEP> 69,50 <SEP> 7,34 <SEP> 6,00 <SEP> # <SEP> 199
<tb> <SEP> 69,6 <SEP> 7,4 <SEP> 6,0 <SEP> (décomp)
<tb> 10 <SEP> Acide <SEP> 4-pyridyl <SEP> acétique <SEP> 54,8 <SEP> 6,49 <SEP> 8,73 <SEP> 187
<tb> <SEP> 54,6 <SEP> 6,4 <SEP> 8,7
<tb> 11 <SEP> Acide <SEP> 4-thianaphtène <SEP> acétique <SEP> 64,18 <SEP> 7,44 <SEP> 7,13 <SEP> 9,02 <SEP> 8,16 <SEP> > 260
<tb> <SEP> 63,9 <SEP> 7,4 <SEP> 7,2 <SEP> 9,3 <SEP> 8,0
<tb>
Exemple 12 :
On a préparé des comprimés répondant à la formule suivante : - produit de L'exemple 1 ....................................... 200 mg - excipient q.s.p................................................. 800mg.
détail de l'excipient : lactose, talc, amidon, stéarate de magnésium).
Exemple 13
On a préparé un soLuté injectable (voie intra-musculaire) répondant à la formule suivante : - produit de l'exemple 7 ....................................... 50 mg - solvant stèrite q.s.p........................................... 5 cm3
ETUDE PHARMACOLOGIQUE 1) Liaison au récepteur opiacé K in vitro.
On a préparé un soLuté injectable (voie intra-musculaire) répondant à la formule suivante : - produit de l'exemple 7 ....................................... 50 mg - solvant stèrite q.s.p........................................... 5 cm3
ETUDE PHARMACOLOGIQUE 1) Liaison au récepteur opiacé K in vitro.
On utilise des culots membranaires conservés à -30nC (éventuelLement pendant environ 30 jours) et préparés à partir de cervelets de cobayes.
Ces culots sont remis en suspension dans le tampon Tris pH 7,7. On répartit les fractions de 2 ml dans des tubes à hémolyse et ajoute de la 93H éthylkétocyclazocine 1nM et le produit à étudier. (Le produit d'abord testé à 5X10-6M (en triple). Lorsque le produit testé déplace de plus de 50X la radioactivité liée spécifiquement au récepteur, il est testé à nouveau selon une gamme de 7 doses afin de déterminer la dose qui inhibe de 50X la radioactivité liée spécifiquement au récepteur. On détermine ainsi la concentration inhibitrice 50X).
La liai son non spécifique est déterminée par addition de produit connu sous le nom U-50488 H (Lahti et al. 1982, Life Sci. 31, 2257) a 10-5M (en triple). On incube å 25nC pendant 40 minutes, remet au bain- marie à 0#C, 5 minutes, filtre sous vide, rince au tampon Tris pH 7,7 et compte la radioactivité en présence du scintillant Trition.
Le résultat est exprimé : - directement en concentration inhibitrice 50X (CI50), (c'est-à-dire en concentration de produit étudié, exprimée en nM, nécessaire pour déplacer 50% de la radioactivité spécifique fixée sur le récepteur étudié.
Résultats :
La CI50 trouvée est de 5,6 nanomoles pour le produit de
L'exemple 1 et de 5,3 monomoles pour le produit de l'exemple 7.
La CI50 trouvée est de 5,6 nanomoles pour le produit de
L'exemple 1 et de 5,3 monomoles pour le produit de l'exemple 7.
2) Action antiarythmique chez le rat.
On trachéotomise des rats mâles pesant 300-350 g anesthésies par voie intrapéritonéale à L'aide de 1,20g/kg d'uréthane et les soumet à une respiration artificielle (40-50 insufflations de 3 ml/minute).
On implante des aiguilles en sous cutané de maniere à enregistrer l'électrocardiogramme des rats sur Le signal en dérivation DII.
On administre les produits à tester par voie intraveineuse.
Cinq minutes après l'administration du produit, on perfuse la veine jugulaire des rats avec 10 ug/mn sous 0,2 ml d'une solution d'aconitine et on note le temps d'apparition des troubles du rythme cardiaque.
Les résultats sont exprimés en pourcentage d'allongement du temps d'apparition des troubles du rythme cardiaque par rapport aux témoins et en fonction de la dose du produit testé.
Les résultats figurant sur le tableau ci-apres montrent que certains des produits de la présente demande sont doués de bonnes propriétés antiarythmiques.
<tb>
I <SEP> I
<tb> Produit <SEP> de <SEP> l'exemple <SEP> 2 <SEP> # <SEP> Dose <SEP> j <SEP> Pourcentage <SEP> d'allongement <SEP> I
<tb> I <SEP> j <SEP> mg/kg <SEP> j <SEP> du <SEP> temps
<tb> 10 <SEP> +43%
<tb> I <SEP> I <SEP> I
<tb> 5 <SEP> +28%
<tb> <SEP> t <SEP> I <SEP> I <SEP>
<tb> 2,5 <SEP> + <SEP> 16%
<tb>
<tb> Produit <SEP> de <SEP> l'exemple <SEP> 2 <SEP> # <SEP> Dose <SEP> j <SEP> Pourcentage <SEP> d'allongement <SEP> I
<tb> I <SEP> j <SEP> mg/kg <SEP> j <SEP> du <SEP> temps
<tb> 10 <SEP> +43%
<tb> I <SEP> I <SEP> I
<tb> 5 <SEP> +28%
<tb> <SEP> t <SEP> I <SEP> I <SEP>
<tb> 2,5 <SEP> + <SEP> 16%
<tb>
Claims (11)
- A ne peut pas représenter la va leur (CH2)n dans laquelle n représente le nombre 0, lesdits composes de formule formule (I) pouvant être dans toutes les formes énantioméres et diastéréoisomères possibles et sous forme de sels d'addition avec les acides ou de sels d'ammonium quaternaire.Z represente un radical phényle substitué en ortho par un radical alcoxy,A représente une channe alcoylene substituée par un radical alcoyle renfermant au total de 2 à 8 atomes de carbone, Z représente un radical phényle éventuellement substitué par un ou plusieurs radicaux identiques ou différents, un radical naphtyle, un radical indényle, un radical hetéromonocyclique renfermant 5 ou 6 charnons ou un radical hétérobicyclique, tous ces radicaux étant éventuellement substitués par un ou plusieurs radicaux identiques ou différents, étant entendu que lorsquedans laquelle R1 représente un radical alcoyle renfermant de 1 à 5 atomes de carbone, R2 représente un atome d'hydrogene ou un radical alcoyle renfermant de 1 à 5 atomes de carbone, A représente une channe (CH2)n dans laquelle n represente un nombre de O a 5, ou -CH2-O- ouREVENDICATIONS 1.- Composés de formule (I)
- 2.- Composés de formule (I), tels que définis a la revendication 1, caractérisés en ce que la jonction des cycles est cis ainsi que leurs sels d'addition avec les acides.
- 3.- Composés de formule (I), tels que definis å la revendication 1 et 2, caractérisés en ce que A représente un groupe -CH2- ou -CH2-O-, ainsi que leurs sels d'addition avec les acides.
- 4.- Composés de formule (I), tels que définis aux revendications 1 a 3, caractérisés en ce que R1 représente un radical méthyle ou éthyle, R2 représente un atome d'hydrogene, un radical méthyle ou éthyle, Z représente un radical phényle substitué éventuellement par un ou deux radicaux choisis parmi les radicaux méthyle ou éthyle, méthoxy ou éthoxy, les atomes de chlore ou de brome, les radicaux trifluorométhyle ou nitro ainsi que leurs sels d'addition avec les acides.
- 5.- Composés de formule (I), tels que définis aux revendications 1 a 3, caractérisés en ce que R1 représente un radical méthyle ou éthyle, R2 représente un atome d'hydrogène, un radical méthyle ou éthyle, Z représente un radical naphtyle, pyridinyle, benzo [b] thiényLe, ainsi que leurs sels d'addition avec les arides.
- 6.- Le [4aRS C4a alpha, 8 alpha, 8a alpha) (#) N-(décahydro 1-methyl 8quinoléinyl) 3,4-dichloro N-méthyl benzène acétamide et ses sels d'addition avec acides et le C4a alpha, 8 alpha, 8a alpha) (+) N (décahydro 1-méthyl 8-quinoléinyl) C2-(3,4-dichlorophenoxy)l N-méthyl acétamide et ses sels d'addition avec les acides.
- 7.- Procédé de préparation des produits de formule (I), caractérisé en ce que l'on soumet la 8-chloro 5,6,7,8-tétahydroquinoléine, a L'action d'un produit de formule X-R1, R1 étant un radical alcoyle renfermant de 1 a 5 atomes de carbone et X représentant un atome d'halogène pour obtenir un produit de formule (II)que l'on fait réagir avec une amine de formule NH2-R2, R2 étant un atome d'hydrogene ou un radical alcoyle renfermant de 1 a 5 atomes de carbone, pour obtenir un produit de formule (III) :que L'on réduit pour obtenir un produit de formule (IV) sous toutes les formes énantiomères et diastéréoisomeres possibles ::que l'on condense avec un acide de formule (V) ou un dérivé fonctionnel de celui-ci :HOOC-(A)-Z (v)A et Z ayant toutes les significations données précedemment, pour obtenir 40 un produit de formule (I) dans toutes les formes énantiomeres et diastéréoisoméres possibles, pouvant être dédoublé pour obtenir les formes optiquement actives et que l'on traite si désiré avec un acide minéral ou organique pour en former le sel.
- 8.- A titre de médicaments, les produits de formule (I), tels que définis aux revendications 1 à 5.
- 9.- A titre de médicaments, les produits de formule (I), tels que définis à la revendication 6.
- 10.- Compositions pharmaceutiques contenant, à titre de principe actif, un medicament selon L'une des revendications 8 ou 9.
- 11.- A titre de produits intermédiaires, les produits de formule (III) et (IV).
Priority Applications (10)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR8709747A FR2617841B1 (fr) | 1987-07-09 | 1987-07-09 | Nouveaux derives de la decahydroquinoleine, leur procede de preparation, les nouveaux intermediaires obtenus, leur application a titre de medicaments et les compositions pharmaceutiques les renfermant |
| DE8787401733T DE3770726D1 (de) | 1986-08-12 | 1987-07-24 | Decahydrochinolinderivate, verfahren zu ihrer herstellung und zwischenprodukte davon, ihre verwendung als arzneimittel und ihre pharmazeutischen zusammensetzungen. |
| ES87401733T ES2044964T3 (es) | 1986-08-12 | 1987-07-24 | Procedimiento para preparar derivados de decahidroquinolina. |
| AT87401733T ATE64384T1 (de) | 1986-08-12 | 1987-07-24 | Decahydrochinolinderivate, verfahren zu ihrer herstellung und zwischenprodukte davon, ihre verwendung als arzneimittel und ihre pharmazeutischen zusammensetzungen. |
| EP87401733A EP0258095B1 (fr) | 1986-08-12 | 1987-07-24 | Nouveaux dérivés de la décahydroquinoléine, leur procédé de préparation et les nouveaux intermédiaires obtenus, leur application à titre de médicaments et les compositions pharmaceutiques les renfermant |
| JP62199265A JP2542218B2 (ja) | 1986-08-12 | 1987-08-11 | デカヒドロキノリンの新誘導体、それらの製造法及びそれらを含む薬剤 |
| US07/084,456 US4877796A (en) | 1986-08-12 | 1987-08-12 | Decahydroquinolines and central analgesic method of use thereof |
| CA000544355A CA1294623C (fr) | 1986-08-12 | 1987-08-12 | Derives de la decahydroquinoleine, leur procede de preparation et les nouveaux intermediaires obtenus, leur application a titre de medicaments et_les compositions pharmaceutiques les renfermant |
| US07/371,995 US4963567A (en) | 1986-08-12 | 1989-06-27 | 8-amino decahydroquinolines and medicinal use thereof |
| GR90401171T GR3002264T3 (en) | 1986-08-12 | 1991-07-05 | Decahydroquinoline derivatives, method for their preparation and intermediates thereof, their use as medicaments and their pharmaceutical compositions |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR8709747A FR2617841B1 (fr) | 1987-07-09 | 1987-07-09 | Nouveaux derives de la decahydroquinoleine, leur procede de preparation, les nouveaux intermediaires obtenus, leur application a titre de medicaments et les compositions pharmaceutiques les renfermant |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| FR2617841A1 true FR2617841A1 (fr) | 1989-01-13 |
| FR2617841B1 FR2617841B1 (fr) | 1989-12-01 |
Family
ID=9353028
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| FR8709747A Expired FR2617841B1 (fr) | 1986-08-12 | 1987-07-09 | Nouveaux derives de la decahydroquinoleine, leur procede de preparation, les nouveaux intermediaires obtenus, leur application a titre de medicaments et les compositions pharmaceutiques les renfermant |
Country Status (1)
| Country | Link |
|---|---|
| FR (1) | FR2617841B1 (fr) |
-
1987
- 1987-07-09 FR FR8709747A patent/FR2617841B1/fr not_active Expired
Non-Patent Citations (2)
| Title |
|---|
| JOURNAL OF MEDICINAL CHEMISTRY, vol. 17, no. 11, novembre 1974, pages 1136-1139, American Chemical Society; I.W.MATHISON et al.: "Synthesis, stereochemistry, and antiarrhythmic activity of some 8-substituted decahydroisoquinolines" * |
| JOURNAL OF MEDICINAL CHEMISTRY, vol. 25, no. 10, octobre 1982, pages 1125-1126, American Chemical Society; J.SZMUSZKOVICZ et al.: "Benzeneacetamide amines: structurally novel non-mmu opioids * |
Also Published As
| Publication number | Publication date |
|---|---|
| FR2617841B1 (fr) | 1989-12-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP0233793B1 (fr) | Dérivés de la décahydroquinoléine, leur procédé de préparation, les intermédiaires de préparation, leur application à titre de médicaments et les compositions les renfermant | |
| JP2637737B2 (ja) | 新規な薬剤 | |
| EP0373998B1 (fr) | Ethers d'oxime de propénone, procédé pour leur préparation et compositions pharmaceutiques les contenant | |
| EP0258095B1 (fr) | Nouveaux dérivés de la décahydroquinoléine, leur procédé de préparation et les nouveaux intermédiaires obtenus, leur application à titre de médicaments et les compositions pharmaceutiques les renfermant | |
| EP0258096B1 (fr) | Dérivés de l'indane, leur procédé de préparation, leur application à titre de médicaments, les compositions pharmaceutiques les renfermant et les intermédiaires obtenus | |
| EP0031753B1 (fr) | Nouveaux dérivés de la (pipéridyl-4)-2 (quinolyl-4)-1 éthanone, produits intermédiaires et procédés pour leur préparation, et leur utilisation comme médicaments | |
| EP0437120B1 (fr) | Nouveaux dérivés de la pyridone, leur procédé de préparation, les nouveaux intermédiaires obtenus, leur application à titre de médicaments et les compositions pharmaceutiques les renfermant | |
| EP0272982B1 (fr) | Nouveaux dérivés de l'indane, leur procédé de préparation et les nouveaux intermédiaires ainsi obtenus, leur application comme médicaments et les compositions les renfermant | |
| EP0329563B1 (fr) | Nouveaux dérivés du benzocyclohexane et du benzocycloheptane ainsi que leurs sels, leurs procédé et intermédiaires de préparation, leur application comme médicaments et les compositions les renfermant | |
| FR2522658A1 (fr) | Application a titre de medicaments de derives du trans 4-amino benz (c,d) indol-5-ol ainsi que de leurs sels, compositions les renfermant, nouveaux derives et leur procede de preparation | |
| EP0374054B1 (fr) | Composés dérivés de l'indane, leur procédé et les intermédiaires de préparation, leur application comme médicaments et les compositions pharmaceutiques les renfermant | |
| EP0443918A1 (fr) | Nouveaux dérivés de la 20,21-dinoréburnaménine, leur procédé de préparation et les nouveaux intermédiaires ainsi obtenus, leur application comme médicaments et les compositions les renfermant | |
| EP0456279B1 (fr) | Dérivés condensés de la pipéridine, leur procédé de préparation et les intermédiaires de préparation, leur application comme médicaments et compositions pharmaceutiques les renfermant | |
| FR2617841A1 (fr) | Nouveaux derives de la decahydroquinoleine, leur procede de preparation, les nouveaux intermediaires obtenus, leur application a titre de medicaments et les compositions pharmaceutiques les renfermant | |
| FR2617164A1 (fr) | Nouveaux derives de la decahydroquinoleine, leur procede de preparation, leur application comme medicaments et les compositions pharmaceutiques les renfermant | |
| EP0534844B1 (fr) | Nouveaux dérivés de la décahydroquinoléine, leur procédé de préparation, les intermédiaires de préparation, leur application à titre de médicaments et les compositions les renfermant | |
| FR2602770A1 (fr) | Nouveaux derives de la tetrahydroquinoleine, leur procede de preparation, les nouveaux intermediaires obtenus, leur application a titre de medicaments et les compositions les renfermant | |
| CH636350A5 (fr) | Derives de l'acide 2-/(4-quinoleinyl) amino/ 5-fluorobenzoique, leurs procedes de preparation et les compositions pharmaceutiques les renfermant. | |
| JPH0351711B2 (fr) | ||
| FR2617480A1 (fr) | Nouveaux derives de l'indane, leur procede de preparation, les nouveaux intermediaires obtenus, leur application a titre de medicaments et les compositions pharmaceutiques les renfermant | |
| FR2600065A1 (fr) | Nouveaux derives de l'acide 5-((2-benzofuranyl) carbonyl) thiophene acetique, leurs sels, leurs procedes de preparation, leur application comme medicaments et les compositions pharmaceutiques les renfermant | |
| FR2640625A2 (fr) | Nouveaux composes optiquement actifs derives de l'indane, leur application comme medicaments et les compositions pharmaceutiques les renfermant | |
| WO1990000171A1 (fr) | Nouveaux derives de la 20,21-dinoreburnamenine substitues en 15 par un groupement amine et leurs sels, leur procede de preparation et les intermediaires ainsi obtenus, leur application comme medicaments et les compositions pharmaceutiques les renfermant |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| CA | Change of address | ||
| CD | Change of name or company name | ||
| TP | Transmission of property | ||
| ST | Notification of lapse |