ES2829254T3 - Pyrrolopyrimidine nucleosides and analogs thereof useful as antiviral agents - Google Patents
Pyrrolopyrimidine nucleosides and analogs thereof useful as antiviral agents Download PDFInfo
- Publication number
- ES2829254T3 ES2829254T3 ES16753540T ES16753540T ES2829254T3 ES 2829254 T3 ES2829254 T3 ES 2829254T3 ES 16753540 T ES16753540 T ES 16753540T ES 16753540 T ES16753540 T ES 16753540T ES 2829254 T3 ES2829254 T3 ES 2829254T3
- Authority
- ES
- Spain
- Prior art keywords
- compound
- pharmaceutically acceptable
- alkyl
- aryl
- cycloalkyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 0 C*(C)[C@@](C(OC[C@@](C[C@](CN(CN=C(C)N=C1N)C=C(C(N=*)=O)C1=C)[C@@]1I#CC=C)[C@]1[U])=C)N Chemical compound C*(C)[C@@](C(OC[C@@](C[C@](CN(CN=C(C)N=C1N)C=C(C(N=*)=O)C1=C)[C@@]1I#CC=C)[C@]1[U])=C)N 0.000 description 4
Abstract
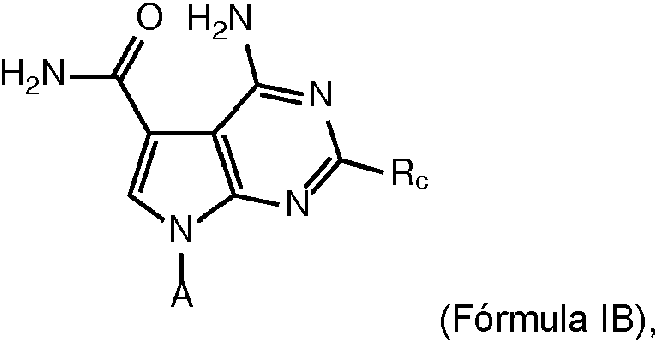
Un compuesto de fórmula IB: **(Ver fórmula)** o una sal, solvato, enantiómero, diastereoisómero, racemato o mezcla farmacéuticamente aceptable de los mismos, en la que: A es: **(Ver fórmula)** X1 es -CR11R12- o -OCH2CH2-, en el que el átomo de oxígeno está distal al resto RIB en A; R11 y R12 son independientemente hidrógeno o alquilo C1-C4, en el que el alquilo está opcionalmente sustituido con uno o más de halógeno, -OH, -SH o -NH2; X2 está ausente, es -O-, -C(O)O-, o -OCH2-, en el que el átomo de oxígeno está distal al resto RIB en A; cada RIB es independientemente hidrógeno, -alquilo C1-C6, **(Ver fórmula)** o RIB es un residuo aminoacídico unido mediante el grupo carbonilo, en el que el alquilo está opcionalmente sustituido con uno o más de halógeno, -OH, -SH o -NH2; v es 0 o 1; n es 0, 1, 2 o 3 y cuando X2 es -C(O)O-, n es 0; p es 2, 3, 4, 5, 6, 7, 8, 9, 10 u 11; q es 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 o 18; Rz es hidrógeno, halógeno, -alquiltio C1-C4, -alcoxi C1-C4, -alquilo C1-C4, -alquenilo C2-C4, -alquinilo C2-C4, arilo, heteroarilo, -cicloalquilo C3-C8, -cicloalquenilo C4-C8 o heterociclo no aromático de 3 a 5 miembros, en el que cada alquiltio, alcoxi, alquilo, alquenilo, alquinilo, arilo, heteroarilo, cicloalquilo, cicloalquenilo o heterociclo está opcionalmente sustituido con uno o más de halógeno, -OH, -SH o -NH2; Ra, Rb, Rx y Ry cada uno se selecciona independientemente del grupo que consiste en hidrógeno, halógeno, -OH, -SH, -alcoxi C1-C6, ariloxi, -alquiltio C1-C6, ariltio, -OC(O)alquilo C1-C6, -OC(O)arilo, -alquilo C1-C6, -alquenilo C2-C6, -25 alquinilo C2-C6, arilo, heteroarilo, -cicloalquilo C3-C8 y -cicloalquenilo C4-C8, en el que cada alcoxi, ariloxi, alquiltio, ariltio, alquilo, arilo, alquenilo, alquinilo, heteroarilo, cicloalquilo o cicloalquenilo está opcionalmente sustituido con uno o más de halógeno, -OH, -SH o -NH2; o dos Ra o Rb cualesquiera, junto con el átomo al que están unidos ambos, pueden combinarse para formar un espirocicloalquilo C3-C8 o espiroheterociclo de 3 a 8 miembros; o dos Ra o Rb cualesquiera, cuando están en átomos adyacentes, pueden combinarse para formar un doble enlace carbono-carbono o un triple enlace carbono-carbono cis o trans; o dos Ra o Rb cualesquiera, cuando están en átomos adyacentes, pueden combinarse para formar un arilo, heteroarilo, -cicloalquilo C3-C10, -cicloalquenilo C4-C10 o heterociclo de 5 a 10 miembros en el anillo; o cualquier CRaRb puede remplazarse por -O-, -S-, -S(O)- o -SO2-; o dos Rx o Ry cualesquiera, junto con el átomo al que están unidos ambos, pueden combinarse para formar un - espirocicloalquilo C3-C8 o espiroheterociclo de 3 a 8 miembros; o dos Rx o Ry cualesquiera, cuando están en átomos adyacentes, pueden combinarse para formar un doble enlace carbono-carbono o un triple enlace carbono-carbono cis o trans; o dos Rx o Ry cualesquiera, cuando están en átomos adyacentes, pueden combinarse para formar un arilo, heteroarilo, -cicloalquilo C3-C10, -cicloalquenilo C4-C10 o heterociclo de 5 a 10 miembros en el anillo; o cualquier CRxRy puede remplazarse por -O-, -S-, -S(O)- o -SO2-; R1 y R45 cada uno es independientemente hidrógeno, halógeno, -N3, -OH, -NH2, -SH, -alquilo C1-C6, -cicloalquilo C3-C6, -alquenilo C2-C6, -cicloalquenilo C4-C8, -alquinilo C2-C6, -cicloalquinilo C8-C12, -alcoxi C1-C6 o -alquiltio C1-C6 en el que cada alquilo, cicloalquilo, alquenilo, cicloalquenilo, alquinilo, cicloalquinilo, alcoxi o alquiltio está independientemente sustituido con uno o más de halógeno, -N3, -OH, -NH2 o -SH; R2, R3, R4 y R44 cada uno es independientemente hidrógeno, halógeno, -N3, -OH, -NH2, -SH, -alquilo C1-C6, -alcoxi C1-C6 o -alquiltio C1-C6, en el que cada alquilo, alcoxi o alquiltio está opcionalmente sustituido con uno o más de halógeno, -N3, -OH, -NH2 o -SH; o R3 y uno de R4 y R44, junto con los átomos a los que están unidos pueden formar un doble enlace carbono-carbono; R5 es independientemente hidrógeno, -RIB, M+, arilo, aralquilo, -alquilo C1-C6, -heteroalquilo C1-C6, cicloalquilo, anillo heterocíclico no aromático o heteroarilo, en el que M+ es un catión y en el que cada arilo, aralquilo, alquilo, heteroalquilo, cicloalquilo, heterociclo o heteroarilo está opcionalmente sustituido con uno o más de halógeno, -N3, -OH, -NH2 o -SH, y en el que R5 no es un aminoácido; y Rc es -alquilo C1-C6, -cicloalquilo C3-C6, -alquenilo C2-C6, -cicloalquenilo C4-C8, -alquinilo C2-C6, -cicloalquinilo C8-C12 o arilo, en el que cada alquilo, cicloalquilo, alquenilo, cicloalquenilo o arilo está opcionalmente sustituido con uno o más de halógeno, -N3, -OH, -NH2 o -SH.A compound of formula IB: ** (See formula) ** or a pharmaceutically acceptable salt, solvate, enantiomer, diastereoisomer, racemate or mixture thereof, wherein: A is: ** (See formula) ** X1 is -CR11R12- or -OCH2CH2-, wherein the oxygen atom is distal to the RIB moiety in A; R11 and R12 are independently hydrogen or C1-C4 alkyl, wherein the alkyl is optionally substituted with one or more of halogen, -OH, -SH, or -NH2; X2 is absent, it is -O-, -C (O) O-, or -OCH2-, wherein the oxygen atom is distal to the RIB moiety in A; each RIB is independently hydrogen, -C1-C6 alkyl, ** (See formula) ** or RIB is an amino acid residue attached via the carbonyl group, wherein the alkyl is optionally substituted with one or more halogen, -OH, -SH or -NH2; v is 0 or 1; n is 0, 1, 2 or 3 and when X2 is -C (O) O-, n is 0; p is 2, 3, 4, 5, 6, 7, 8, 9, 10, or 11; q is 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 or 18; Rz is hydrogen, halogen, -C1-C4 alkylthio, -C1-C4 alkoxy, -C1-C4 alkyl, -C2-C4 alkenyl, -C2-C4 alkynyl, aryl, heteroaryl, -C3-C8 cycloalkyl, -C4 cycloalkenyl- C8 or 3- to 5-membered non-aromatic heterocycle, wherein each alkylthio, alkoxy, alkyl, alkenyl, alkynyl, aryl, heteroaryl, cycloalkyl, cycloalkenyl, or heterocycle is optionally substituted with one or more of halogen, -OH, -SH, or -NH2; Ra, Rb, Rx, and Ry are each independently selected from the group consisting of hydrogen, halogen, -OH, -SH, -C1-C6 alkoxy, aryloxy, -C1-C6 alkylthio, arylthio, -OC (O) C1 alkyl -C6, -OC (O) aryl, -C1-C6 alkyl, -C2-C6 alkenyl, -25 C2-C6 alkynyl, aryl, heteroaryl, -C3-C8 cycloalkyl, and -C4-C8 cycloalkenyl, wherein each alkoxy , aryloxy, alkylthio, arylthio, alkyl, aryl, alkenyl, alkynyl, heteroaryl, cycloalkyl or cycloalkenyl is optionally substituted with one or more of halogen, -OH, -SH or -NH2; or any two Ra or Rb, together with the atom to which they are both attached, may combine to form a 3- to 8-membered spirocycloalkyl or spiroheterocycle; or any two Ra or Rb, when on adjacent atoms, can combine to form a carbon-carbon double bond or a cis or trans carbon-carbon triple bond; or any two Ra or Rb, when on adjacent atoms, may combine to form an aryl, heteroaryl, -C3-C10 -cycloalkyl, -C4-C10 -cycloalkenyl, or 5- to 10-membered ring-membered heterocycle; or any CRaRb can be replaced by -O-, -S-, -S (O) - or -SO2-; or any two Rx or Ry, together with the atom to which they are both attached, may combine to form a 3- to 8-membered - spirocycloalkyl or spiroheterocycle; or any two Rx or Ry, when on adjacent atoms, can combine to form a carbon-carbon double bond or a cis or trans carbon-carbon triple bond; or any two Rx or Ry, when on adjacent atoms, may combine to form an aryl, heteroaryl, -C3-C10 -cycloalkyl, -C4-C10 -cycloalkenyl, or 5- to 10-membered ring heterocycle; or any CRxRy can be replaced by -O-, -S-, -S (O) - or -SO2-; R1 and R45 are each independently hydrogen, halogen, -N3, -OH, -NH2, -SH, -C1-C6 alkyl, -C3-C6 cycloalkyl, -C2-C6 alkenyl, -C4-C8 cycloalkenyl, -C2 alkynyl -C6, -C8-C12 cycloalkynyl, -C 1-6 alkoxy or -C 1-6 alkylthio in which each alkyl, cycloalkyl, alkenyl, cycloalkenyl, alkynyl, cycloalkynyl, alkoxy or alkylthio is independently substituted with one or more halogen, - N3, -OH, -NH2 or -SH; R2, R3, R4, and R44 are each independently hydrogen, halogen, -N3, -OH, -NH2, -SH, -C1-C6 alkyl, -C1-C6 alkoxy, or -C1-C6 alkylthio, wherein each alkyl , alkoxy or alkylthio is optionally substituted with one or more of halogen, -N3, -OH, -NH2 or -SH; or R3 and one of R4 and R44, together with the atoms to which they are attached may form a carbon-carbon double bond; R5 is independently hydrogen, -RIB, M +, aryl, aralkyl, -C1-C6 alkyl, -C1-C6 heteroalkyl, cycloalkyl, non-aromatic heterocyclic ring, or heteroaryl, wherein M + is a cation and wherein each aryl, aralkyl , alkyl, heteroalkyl, cycloalkyl, heterocycle, or heteroaryl is optionally substituted with one or more of halogen, -N3, -OH, -NH2, or -SH, and wherein R5 is not an amino acid; and Rc is -C1-C6 alkyl, -C3-C6 cycloalkyl, -C2-C6 alkenyl, -C4-C8 cycloalkenyl, -C2-C6 alkynyl, -C8-C12 cycloalkynyl or aryl, wherein each alkyl, cycloalkyl, alkenyl , cycloalkenyl or aryl is optionally substituted with one or more of halogen, -N3, -OH, -NH2 or -SH.
Description
DESCRIPCIÓNDESCRIPTION
Nucleósidos de pirrolopirimidina y análogos de los mismos útiles como agentes antivíricosPyrrolopyrimidine nucleosides and analogs thereof useful as antiviral agents
Solicitudes relacionadasRelated requests
Esta solicitud reivindica prioridad a y el beneficio de la solicitud provisional de Estados Unidos n.° 62/202010, presentada el 6 de agosto de 2015, y a la solicitud de Reino Unido n.° 1606645.8, presentada el 15 de abril de 2016.This application claims priority to and benefit from US Provisional Application No. 62/202010, filed August 6, 2015, and UK Application No. 1606645.8, filed April 15, 2016.
Campo técnicoTechnical field
Esta solicitud se refiere a análogos nucleosídicos de pirrolopirimidina y conjugados fosfolipídicos de los mismos y métodos de síntesis de los mismos. Los análogos nucleosídicos de pirrolopirimidina y sus conjugados fosfolipídicos pueden usarse como agentes antivíricos para tratar infecciones víricas. Esta solicitud también se refiere a composiciones farmacéuticas que comprenden análogos nucleosídicos de pirrolopirimidina y conjugados fosfolipídicos de los mismos.This application relates to pyrrolopyrimidine nucleoside analogs and phospholipid conjugates thereof and methods of synthesis thereof. Pyrrolopyrimidine nucleoside analogs and their phospholipid conjugates can be used as antiviral agents to treat viral infections. This application also relates to pharmaceutical compositions comprising pyrrolopyrimidine nucleoside analogs and phospholipid conjugates thereof.
AntecedentesBackground
Las infecciones víricas pueden tener efectos adversos graves en los individuos y la sociedad en su conjunto. Además de infecciones víricas mortales tales como las del virus del Ébola, incluso infecciones que no son mortales pueden tener consecuencias sociales y económicas graves. Por ejemplo, los norovirus (NV) humanos son la causa más común de gastroenteritis aguda epidémica en todo el mundo con una estimación de 19-21 millones de casos cada año en los Estados Unidos, incluyendo 56000-71 000 hospitalizaciones y 570-800 muertes (Hall et al., Emerg.Infect.Dis. agosto 2013; 19(8): 1198-205).Viral infections can have serious adverse effects on individuals and society as a whole. In addition to deadly viral infections such as the Ebola virus, even infections that are not fatal can have serious social and economic consequences. For example, human norovirus (NV) is the most common cause of epidemic acute gastroenteritis worldwide with an estimated 19-21 million cases each year in the United States, including 56,000-71,000 hospitalizations and 570-800 deaths. (Hall et al., Emerg.Infect.Dis. 2013 Aug; 19 (8): 1198-205).
Por consiguiente, es importante el desarrollo de un tratamiento antivírico eficaz que sea eficaz contra los virus para mejorar la salud de los individuos infectados y como medida de salud pública para evitar brotes de otros virus patógenos.Therefore, the development of an effective antiviral treatment that is effective against viruses is important to improve the health of infected individuals and as a public health measure to prevent outbreaks of other pathogenic viruses.
SumarioSummary
La presente divulgación proporciona análogos nucleosídicos de pirrolopirimidina y conjugados fosfolipídicos de los mismos. También se incluyen composiciones farmacéuticas que comprenden los mismos y métodos de síntesis de los mismos.The present disclosure provides pyrrolopyrimidine nucleoside analogs and phospholipid conjugates thereof. Also included are pharmaceutical compositions comprising the same and methods of synthesis thereof.
La presente divulgación también proporciona compuestos y composiciones de la invención para su uso en métodos de tratamiento y/o prevención de infecciones víricas o enfermedades o trastornos asociados con infecciones víricas. La divulgación aborda la necesidad de nuevos tratamientos que puedan usarse para tratar y/o prevenir enfermedades inducidas por virus usando antivíricos y vehículos de administración novedosos.The present disclosure also provides compounds and compositions of the invention for use in methods of treating and / or preventing viral infections or diseases or disorders associated with viral infections. The disclosure addresses the need for new treatments that can be used to treat and / or prevent virus-induced diseases using novel antivirals and delivery vehicles.
En un aspecto, la presente divulgación se refiere a compuestos de fórmula IB:In one aspect, the present disclosure relates to compounds of formula IB:
o una sal, solvato, enantiómero, diastereoisómero, racemato o mezcla farmacéuticamente aceptable de los mismos, en la que:or a pharmaceutically acceptable salt, solvate, enantiomer, diastereoisomer, racemate or mixture thereof, wherein:
A es:A is:
X X1 es -CR11R12- o -OCH2CH2-, en el que el átomo de oxígeno está distal al resto RIB en A;X X1 is -CR11R12- or -OCH2CH2-, wherein the oxygen atom is distal to the RIB moiety in A;
R11 y R12 son independientemente hidrógeno o alquilo C 1-C4, en el que el alquilo está opcionalmente sustituido con uno o más de halógeno, -OH, -SH o -NH2;R11 and R12 are independently hydrogen or C 1 -C4 alkyl, wherein the alkyl is optionally substituted with one or more of halogen, -OH, -SH, or -NH2;
X2 está ausente, es -O-, -C(O)O- u -OCH2-, en el que el átomo de oxígeno está distal al resto RIB en A;X2 is absent, it is -O-, -C (O) O- or -OCH2-, where the oxygen atom is distal to the RIB moiety in A;
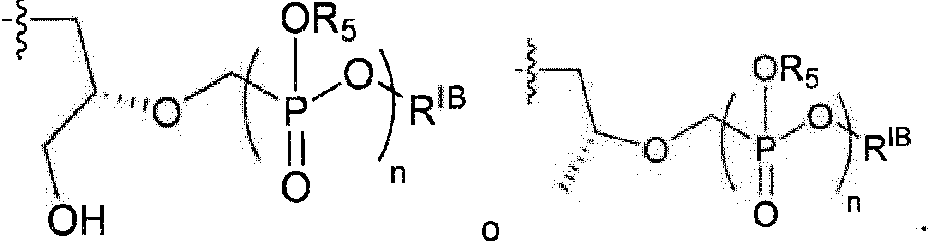
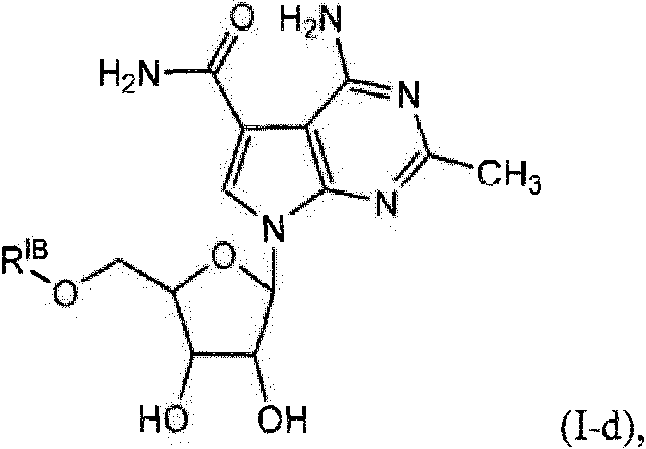
cada RIB es independientemente hidrógeno, -alquilo C1-C6, each RIB is independently hydrogen, -C1-C6 alkyl,
o RIB es un residuo aminoacídico unido mediante el grupo carbonilo, en el que el alquilo está opcionalmente sustituido con uno o más de halógeno, -OH, -SH o -NH2;or RIB is an amino acid residue linked via the carbonyl group, wherein the alkyl is optionally substituted with one or more of halogen, -OH, -SH or -NH2;
v es 0 o 1;v is 0 or 1;
n es 0, 1,2 o 3 y cuando X2 es -C(O)O-, n es 0;n is 0, 1,2 or 3 and when X2 is -C (O) O-, n is 0;
p es 2 , 3 , 4 , 5, 6 , 7, 8, 9, 10 u 11;p is 2, 3, 4, 5, 6, 7, 8, 9, 10, or 11;
Rz es hidrógeno, halógeno, -alquiltio C1-C4, -alcoxi C1-C4, -alquilo C1-C4, -alquenilo C2-C4, -alquinilo C2-C4, arilo, heteroarilo, -cicloalquilo C3-C8, -cicloalquenilo C4-C8 o heterociclo no aromático de 3 a 5 miembros, en el que cada alquiltio, alcoxi, alquilo, alquenilo, alquinilo, arilo, heteroarilo, cicloalquilo, cicloalquenilo o heterociclo está opcionalmente sustituido con uno o más de halógeno, -OH, -SH o -NH2;Rz is hydrogen, halogen, -C1-C4 alkylthio, -C1-C4 alkoxy, -C1-C4 alkyl, -C2-C4 alkenyl, -C2-C4 alkynyl, aryl, heteroaryl, -C3-C8 cycloalkyl, -C4 cycloalkenyl- C8 or non-aromatic 3- to 5-membered heterocycle, wherein each alkylthio, alkoxy, alkyl, alkenyl, alkynyl, aryl, heteroaryl, cycloalkyl, cycloalkenyl, or heterocycle is optionally substituted with one or more of halogen, -OH, -SH, or -NH2;
Ra, Rb, Rx y Ry cada uno se selecciona independientemente del grupo que consiste en hidrógeno, halógeno, -OH, -SH, -alcoxi C1-C6, ariloxi, -alquiltio C1-C6, ariltio, -OC(O)alquilo C1-C6, -OC(O)arilo, -alquilo C1-C6, -alquenilo C2-C6, -alquinilo C2-C6, arilo, heteroarilo, -cicloalquilo C3-C8 y -cicloalquenilo C4-C8, en el que cada alcoxi, ariloxi, alquiltio, ariltio, alquilo, arilo, alquenilo, alquinilo, heteroarilo, cicloalquilo o cicloalquenilo está opcionalmente sustituido con uno o más de halógeno, -OH, -SH o -NH2;Ra, Rb, Rx, and Ry are each independently selected from the group consisting of hydrogen, halogen, -OH, -SH, -C1-C6 alkoxy, aryloxy, -C1-C6 alkylthio, arylthio, -OC (O) C1 alkyl -C6, -OC (O) aryl, -C1-C6 alkyl, -C2-C6 alkenyl, -C2-C6 alkynyl, aryl, heteroaryl, -C3-C8 cycloalkyl and -C4-C8 cycloalkenyl, wherein each alkoxy, aryloxy, alkylthio, arylthio, alkyl, aryl, alkenyl, alkynyl, heteroaryl, cycloalkyl or cycloalkenyl is optionally substituted with one or more of halogen, -OH, -SH or -NH2;
o dos Ra o Rb cualesquiera, junto con el átomo al que están unidos ambos, pueden combinarse para formar un espirocicloalquilo C3-C8 o espiroheterociclo de 3 a 8 miembros;or any two Ra or Rb, together with the atom to which they are both attached, can combine to form a 3 to 8 membered spirocycloalkyl or spiroheterocycle;
o dos Ra o Rb cualesquiera, cuando están en átomos adyacentes, pueden combinarse para formar un doble enlace carbono-carbono o un triple enlace carbono-carbono cis o trans; or any two Ra or Rb, when on adjacent atoms, can combine to form a carbon-carbon double bond or a cis or trans carbon-carbon triple bond;
o dos Ra o Rb cualesquiera, cuando están en átomos adyacentes, pueden combinarse para formar un arilo, heteroarilo, -cicloalquilo C3-C10, -cicloalquenilo C4-C10 o heterociclo de 5 a 10 miembros en el anillo;or any two Ra or Rb, when on adjacent atoms, can combine to form an aryl, heteroaryl, -C3-C10 -cycloalkyl, -C4-C10 -cycloalkenyl, or 5- to 10-membered ring-membered heterocycle;
o cualquier CRaRb puede remplazarse por -O-, -S -, -S(O)- o -SO2-;or any CRaRb can be replaced by -O-, -S -, -S (O) - or -SO2-;
o dos Rx o Ry cualesquiera, junto con el átomo al que están unidos ambos, pueden combinarse para formar un -espirocicloalquilo C3-C8 o espiroheterociclo de 3 a 8 miembros;or any two Rx or Ry, together with the atom to which they are both attached, may combine to form a 3- to 8-membered -spyrocycloalkyl or spiroheterocycle;
o dos Rx o Ry cualesquiera, cuando están en átomos adyacentes, pueden combinarse para formar un doble enlace carbono-carbono o un triple enlace carbono-carbono cis o trans; or any two Rx or Ry, when on adjacent atoms, can combine to form a carbon-carbon double bond or a cis or trans carbon-carbon triple bond;
o dos Rx o Ry cualesquiera, cuando están en átomos adyacentes, pueden combinarse para formar un arilo, heteroarilo, -cicloalquilo C3-C10, -cicloalquenilo C4-C10 o heterociclo de 5 a 10 miembros en el anillo;or any two Rx or Ry, when on adjacent atoms, can combine to form an aryl, heteroaryl, -C3-C10 -cycloalkyl, -C4-C10 -cycloalkenyl, or 5- to 10-membered ring-membered heterocycle;
o cualquier CRxRy puede remplazarse por -O-, -S -, -S(O)- o -SO2-;or any CRxRy can be replaced by -O-, -S -, -S (O) - or -SO2-;
R1 y R45 cada uno es independientemente hidrógeno, halógeno, -N3, -OH, -NH2, -SH, -alquilo C1-C6, -cicloalquilo C3-C 6, -alquenilo C2-C6, -cicloalquenilo C4-C8, -alquinilo C2-C6, -cicloalquinilo C8-C12, -alcoxi C1-C6 o -alquiltio C1-C6, en el que cada alquilo, cicloalquilo, alquenilo, cicloalquenilo, alquinilo, cicloalquinilo, alcoxi o alquiltio está independientemente sustituido con uno o más de halógeno, -N3, -OH, -NH2 o -SH;R1 and R45 are each independently hydrogen, halogen, -N3, -OH, -NH2, -SH, -C1-C6 alkyl, -C3-C6 cycloalkyl, -C2-C6 alkenyl, -C4-C8 cycloalkenyl, -alkynyl C2-C6, -C8-C12 cycloalkynyl, -C1-C6 alkoxy or -C1-C6 alkylthio, wherein each alkyl, cycloalkyl, alkenyl, cycloalkenyl, alkynyl, cycloalkynyl, alkoxy, or alkylthio is independently substituted with one or more halogen , -N3, -OH, -NH2 or -SH;
R2, R3, R4 y R44 cada uno es independientemente hidrógeno, halógeno, -N3, -OH, -NH2, -SH, -alquilo C1-C6, -alcoxi C1-C 6 o -alquiltio C1-C6, en el que cada alquilo, alcoxi o alquiltio está opcionalmente sustituido con uno o más de halógeno, -N3, -OH, -NH2 o -SH;R2, R3, R4, and R44 are each independently hydrogen, halogen, -N3, -OH, -NH2, -SH, -C1-C6alkyl, -C1-C6alkoxy, or -C1-C6alkylthio, wherein each alkyl, alkoxy, or alkylthio is optionally substituted with one or more of halogen, -N3, -OH, -NH2, or -SH;
o R3 y uno de R4 y R44, junto con los átomos a los que están unidos pueden formar un doble enlace carbono-carbono; R5 es independientemente hidrógeno, -R IB, M+, arilo, aralquilo, -alquilo C1-C6, -heteroalquilo C1-C6, cicloalquilo, anillo heterocíclico no aromático o heteroarilo, en el que M+ es un catión y en el que cada arilo, aralquilo, alquilo, heteroalquilo, cicloalquilo, heterociclo o heteroarilo está opcionalmente sustituido con uno o más de halógeno, -N3, -OH, -NH2 o -SH, y en el que R5 no es un aminoácido; yor R3 and one of R4 and R44, together with the atoms to which they are attached may form a carbon-carbon double bond; R5 is independently hydrogen, -R IB, M +, aryl, aralkyl, -C1-C6 alkyl, -C1-C6 heteroalkyl, cycloalkyl, non-aromatic heterocyclic ring or heteroaryl, wherein M + is a cation and wherein each aryl, aralkyl, alkyl, heteroalkyl, cycloalkyl, heterocycle, or heteroaryl is optionally substituted with one or more of halogen, -N3, -OH, -NH2, or -SH, and wherein R5 is not an amino acid; Y
Rc es -alquilo C1-C6, -cicloalquilo C3-C6, -alquenilo C2-C6, -cicloalquenilo C4-C8, -alquinilo C2-C6, -cicloalquinilo C8-C12 o arilo, en el que cada alquilo, cicloalquilo, alquenilo, cicloalquenilo o arilo está opcionalmente sustituido con uno o más de halógeno, -N3, -OH, -NH2 o -SH .Rc is -C1-C6 alkyl, -C3-C6 cycloalkyl, -C2-C6 alkenyl, -C4-C8 cycloalkenyl, -C2-C6 alkynyl, -C8-C12 cycloalkynyl or aryl, wherein each alkyl, cycloalkyl, alkenyl, Cycloalkenyl or aryl is optionally substituted with one or more of halogen, -N3, -OH, -NH2, or -SH.
En otro aspecto, la presente divulgación se refiere a compuestos de fórmula II:In another aspect, the present disclosure relates to compounds of formula II:
o h 2no h 2n
RbÓ ÓRa (II)RbÓ ÓRa (II)
y sales, solvatos, enantiómeros, diastereoisómeros, racematos o mezclas farmacéuticamente aceptables de los mismos, en la que:and pharmaceutically acceptable salts, solvates, enantiomers, diastereoisomers, racemates, or mixtures thereof, wherein:
Y es -C(O)-, o Y is -C (O) -, or
en la que X 1 es independientemente O, NH o S, X 2 es independientemente un enlace, -O-, -S - o -NH-, y X3 es independientemente -OR, -N HRM o -S R M;wherein X 1 is independently O, NH, or S, X 2 is independently a bond, -O-, -S-, or -NH-, and X3 is independently -OR, -N HRM, or -S R M;
cada RM es independientemente -H, -alquilo C1-C20, -alquenilo C2-C20, -alquinilo C2-C20, -cicloalquilo C3-C8, -cicloalquenilo C4-C8, arilo, heteroarilo o heterociclilo, en el que cada alquilo, alquenilo, alquinilo, cicloalquilo, cicloalquenilo, arilo, heteroarilo o heterociclilo está opcionalmente sustituido con uno o más de halógeno, oxo, R1, -O R1, -N R1R2, -S R 1, -OC(O)R1,-C(O)OR1, -NHC(O)OR1 o - NHC(O)R1;each RM is independently -H, -C1-C20 alkyl, -C2-C20 alkenyl, -C2-C20 alkynyl, -C3-C8 cycloalkyl, -C4-C8 cycloalkenyl, aryl, heteroaryl, or heterocyclyl, wherein each alkyl, alkenyl , alkynyl, cycloalkyl, cycloalkenyl, aryl, heteroaryl or heterocyclyl is optionally substituted with one or more of halogen, oxo, R1, -O R1, -N R1R2, -SR 1, -OC (O) R1, -C (O) OR1, -NHC (O) OR1 or -NHC (O) R1;
Ra y Rb son cada uno independientemente, cada vez que aparecen, -H, -alquilo C1-C20, -alquenilo C2-C20, -alquinilo C2-C20, -cicloalquilo C3-C8, -cicloalquenilo C4-C8, arilo, heteroarilo o heterociclilo, en el que cada alquilo, alquenilo, alquinilo, cicloalquilo, cicloalquenilo, arilo, heteroarilo o heterociclilo está opcionalmente sustituido con uno o más de halógeno, oxo, -O R 1, -N R1R2, -S R 1, -OC(O)R1,-C(O)OR1, -NHC(O)OR1 o -NHC(O)R1;Ra and Rb are each independently, each occurrence, -H, -C1-C20 alkyl, -C2-C20 alkenyl, -C2-C20 alkynyl, -C3-C8 cycloalkyl, -C4-C8 cycloalkenyl, aryl, heteroaryl or heterocyclyl, wherein each alkyl, alkenyl, alkynyl, cycloalkyl, cycloalkenyl, aryl, heteroaryl, or heterocyclyl is optionally substituted with one or more of halogen, oxo, -OR 1, -N R1R2, -SR 1, -OC (O) R1, -C (O) OR1, -NHC (O) OR1 or -NHC (O) R1;
R1 y R2 son cada uno independientemente, cada vez que aparecen, -H, -alquilo C1-C20, -alquenilo C2-C20, -alquinilo C2-C20, -cicloalquilo C3-C8, -cicloalquenilo C4-C8, arilo, heteroarilo o heterociclilo, en el que cada alquilo, alquenilo, alquinilo, cicloalquilo, cicloalquenilo, arilo, heteroarilo o heterociclilo está opcionalmente sustituido con uno o más de halógeno, oxo, -R 3, -R 4, -O R3, -N R3R4, -S R 3, -OC(O)R3, -C(O)OR3, -NHC(O)OR3 o -NHC(O)R3;R1 and R2 are each independently, each occurrence, -H, -C1-C20 alkyl, -C2-C20 alkenyl, -C2-C20 alkynyl, -C3-C8 cycloalkyl, -C4-C8 cycloalkenyl, aryl, heteroaryl or heterocyclyl, wherein each alkyl, alkenyl, alkynyl, cycloalkyl, cycloalkenyl, aryl, heteroaryl, or heterocyclyl is optionally substituted with one or more of halogen, oxo, -R 3, -R 4, -O R3, -N R3R4, - SR 3, -OC (O) R3, -C (O) OR3, -NHC (O) OR3 or -NHC (O) R3;
R3 y R4 son cada uno independientemente, cada vez que aparecen, -H, -alquilo C1-C20, -alquenilo C2-C20, -alquinilo C2-C20, -cicloalquilo C3-C8, -cicloalquenilo C4-C8, arilo, heteroarilo o heterociclilo, en el que cada alquilo, alquenilo, alquinilo, cicloalquilo, cicloalquenilo, arilo, heteroarilo o heterociclilo está opcionalmente sustituido con uno o más de halógeno, oxo, arilo, heteroarilo, -OH, -NH2, -SH, -OC(O)H, -C(O)OH, -NHC(O)OH o -NHC(O)H;R3 and R4 are each independently, each occurrence, -H, -C1-C20 alkyl, -C2-C20 alkenyl, -C2-C20 alkynyl, -C3-C8 cycloalkyl, -C4-C8 cycloalkenyl, aryl, heteroaryl or heterocyclyl, wherein each alkyl, alkenyl, alkynyl, cycloalkyl, cycloalkenyl, aryl, heteroaryl, or heterocyclyl is optionally substituted with one or more of halogen, oxo, aryl, heteroaryl, -OH, -NH2, -SH, -OC (O ) H, -C (O) OH, -NHC (O) OH or -NHC (O) H;
Rd es independientemente -H o -D; yRd is independently -H or -D; Y
n es independientemente 0, 1,2 o 3.n is independently 0, 1,2 or 3.
En algunas realizaciones, Ra es -H. En algunas realizaciones, Rb es -H. En algunas realizaciones, Rd es -H. En algunas realizaciones, n es 0. En algunas realizaciones, Ra, Rb y Rd son - H. En algunas realizaciones, Ra, Rb y Rd son -H y n es 0.In some embodiments, Ra is -H. In some embodiments, Rb is -H. In some embodiments, Rd is -H. In some embodiments, n is 0. In some embodiments, Ra, Rb, and Rd are -H. In some embodiments, Ra, Rb, and Rd are -H and n is 0.
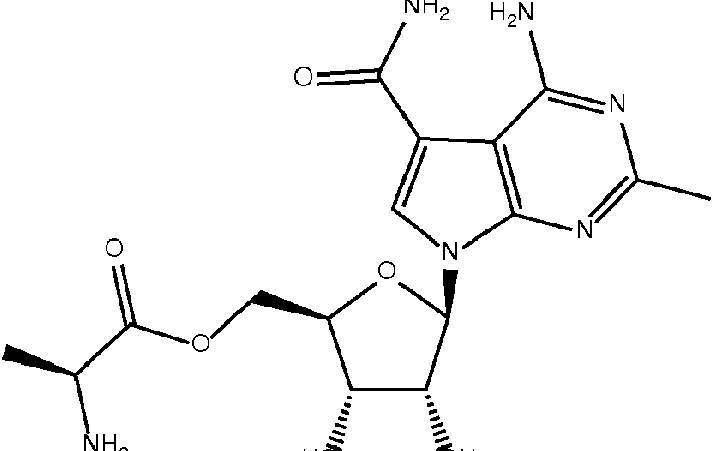
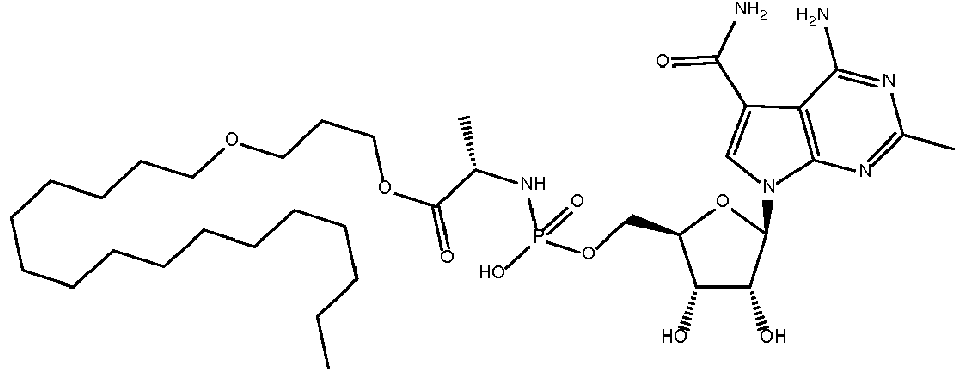
En algunas realizaciones, el compuesto es:In some embodiments, the compound is:
o una sal, solvato, enantiómero, diastereoisómero, racemato o mezcla farmacéuticamente aceptable del mismo; oor a pharmaceutically acceptable salt, solvate, enantiomer, diastereoisomer, racemate, or mixture thereof; or
o una sal, solvato, enantiómero, diastereoisómero, racemato o mezcla farmacéuticamente aceptable del mismo; o or a pharmaceutically acceptable salt, solvate, enantiomer, diastereoisomer, racemate, or mixture thereof; or
o una sal, solvato, enantiómero, diastereoisómero, racemato o mezcla farmacéuticamente aceptable del mismo; o or a pharmaceutically acceptable salt, solvate, enantiomer, diastereoisomer, racemate, or mixture thereof; or
o una sal, solvato, enantiómero, diastereoisómero, racemato o mezcla farmacéuticamente aceptable del mismo; oor a pharmaceutically acceptable salt, solvate, enantiomer, diastereoisomer, racemate, or mixture thereof; or
o una sal, solvato, enantiómero, diastereoisómero, racemato o mezcla farmacéuticamente aceptable del mismo oor a pharmaceutically acceptable salt, solvate, enantiomer, diastereoisomer, racemate or mixture thereof or
o una sal, solvato, enantiómero, diastereoisómero, racemato o mezcla farmacéuticamente aceptable del mismo; oor a pharmaceutically acceptable salt, solvate, enantiomer, diastereoisomer, racemate, or mixture thereof; or
o una sal, solvato, enantiómero, diastereoisómero, racemato o mezcla farmacéuticamente aceptable del mismo. or a pharmaceutically acceptable salt, solvate, enantiomer, diastereoisomer, racemate, or mixture thereof.
En otro aspecto, la presente divulgación se refiere a una composición farmacéutica que comprende un compuesto de fórmula IB, o fórmula II, o una sal, solvato, enantiómero, diastereoisómero, racemato o mezcla farmacéuticamente aceptable del mismo, y un vehículo farmacéuticamente aceptable. En algunas realizaciones, la presente divulgación se refiere una composición farmacéutica que comprende un compuesto 1, o una sal, solvato, enantiómero, diastereoisómero, racemato o mezcla farmacéuticamente aceptable del mismo, y un vehículo farmacéuticamente aceptable. En algunas realizaciones, la composición farmacéutica puede usarse para tratar una infección vírica (por ejemplo, norovirus). In another aspect, the present disclosure relates to a pharmaceutical composition comprising a compound of formula IB, or formula II, or a pharmaceutically acceptable salt, solvate, enantiomer, diastereoisomer, racemate or mixture thereof, and a pharmaceutically acceptable carrier. In some embodiments, the present disclosure refers to a pharmaceutical composition comprising a compound 1, or a pharmaceutically acceptable salt, solvate, enantiomer, diastereoisomer, racemate, or mixture thereof, and a pharmaceutically acceptable carrier. In some embodiments, the pharmaceutical composition can be used to treat a viral infection (eg, norovirus).
En otro aspecto, la presente divulgación también se refiere a una formulación farmacéutica de los compuestos divulgados en este documento, o una sal, solvato, enantiómero, diastereoisómero, racemato o mezcla farmacéuticamente aceptable de los mismos, para su uso en un método para tratar o prevenir una infección vírica o enfermedad o trastorno asociado con infección vírica, por ejemplo, una infección de virus de ADN bicatenario (ADNbc) o de ARN monocatenario (ARNmc). En algunas realizaciones, el compuesto es compuesto 1. En algunas realizaciones, el virus es norovirus.In another aspect, the present disclosure also refers to a pharmaceutical formulation of the compounds disclosed herein, or a pharmaceutically acceptable salt, solvate, enantiomer, diastereoisomer, racemate, or mixture thereof, for use in a method of treating or preventing a viral infection or disease or disorder associated with viral infection, for example, a double-stranded DNA (dsDNA) or single-stranded RNA (ssRNA) virus infection. In some embodiments, the compound is compound 1. In some embodiments, the virus is norovirus.
La presente divulgación también se refiere a un compuesto descrito en este documento, o una sal, solvato, enantiómero, diastereoisómero, racemato o mezcla farmacéuticamente aceptable del mismo, para su uso en el tratamiento o prevención de una infección vírica o una enfermedad o trastorno asociado con infección vírica. El compuesto puede ser un compuesto de fórmula IB o fórmula II. En algunas realizaciones, el compuesto es compuesto 1, o una sal, solvato, enantiómero, diastereoisómero, racemato o mezcla farmacéuticamente aceptable del mismo. En algunas realizaciones, el virus es norovirus.The present disclosure also refers to a compound described herein, or a pharmaceutically acceptable salt, solvate, enantiomer, diastereoisomer, racemate or mixture thereof, for use in treating or preventing a viral infection or associated disease or disorder. with viral infection. The compound can be a compound of formula IB or formula II. In some embodiments, the compound is compound 1, or a pharmaceutically acceptable salt, solvate, enantiomer, diastereoisomer, racemate, or mixture thereof. In some embodiments, the virus is norovirus.
Salvo que se definan de otro modo, todos los términos técnicos y científicos usados en este documento tienen el mismo significado que el comprendido habitualmente por un experto en la materia a la que pertenece esta divulgación. En caso de conflicto, prevalecerá la presente memoria descriptiva, incluyendo las definiciones. En la memoria descriptiva, las formas singulares también incluyen el plural, salvo que el contexto indique claramente lo contrario. Aunque pueden usarse métodos y materiales similares o equivalentes a los descritos en este documento en la práctica o ensayo de la presente divulgación, a continuación se describen métodos y materiales adecuados. Las referencias citadas en este documento no se admiten como técnica anterior a la divulgación reivindicada. Además, los materiales, métodos y ejemplos son ilustrativos únicamente y no están destinados a ser limitantes.Unless defined otherwise, all technical and scientific terms used in this document have the same meaning as commonly understood by one of ordinary skill in the art to which this disclosure belongs. In case of conflict, the present specification, including definitions, shall prevail. In the specification, singular forms also include the plural, unless the context clearly indicates otherwise. Although methods and materials similar or equivalent to those described herein may be used in the practice or testing of the present disclosure, suitable methods and materials are described below. References cited in this document are not admitted as prior art to the claimed disclosure. Furthermore, the materials, methods, and examples are illustrative only and are not intended to be limiting.
Otros rasgos característicos y ventajas de la presente divulgación serán evidentes a partir de la siguiente descripción detallada y reivindicaciones.Other characteristic features and advantages of the present disclosure will be apparent from the following detailed description and claims.
Breve descripción de los dibujosBrief description of the drawings
La figura 1A muestra la concentración de norovirus murino (unidades formadoras de placas por ml) en tejido y heces recogidos 3 días después de la infección como parte del estudio n.° 1.Figure 1A shows the murine norovirus concentration (plaque-forming units per ml) in tissue and stool collected 3 days after infection as part of Study # 1.
La figura 1B muestra la concentración de norovirus murino (unidades formadoras de placas por mg de tejido) en tejido y heces recogidos 3 días después de la infección como parte del estudio n.° 1.Figure 1B shows the murine norovirus concentration (plaque-forming units per mg of tissue) in tissue and stool collected 3 days after infection as part of Study # 1.
La figura 2A muestra la concentración de norovirus murino (unidades formadoras de placas por ml) en tejido y heces recogidos 3 días después de la infección como parte del estudio n.° 2.Figure 2A shows the murine norovirus concentration (plaque-forming units per ml) in tissue and stool collected 3 days after infection as part of Study # 2.
La figura 2B muestra la concentración de norovirus murino (unidades formadoras de placas por mg de tejido) en tejido y heces recogidos 3 días después de la infección como parte del estudio n.° 2.Figure 2B shows the murine norovirus concentration (plaque-forming units per mg of tissue) in tissue and stool collected 3 days after infection as part of Study # 2.
La figura 3A muestra el número de unidades formadoras de placas por gramo de ciego del estudio 1 en una escala lineal.Figure 3A shows the number of plaque-forming units per gram of cecum from Study 1 on a linear scale.
La figura 3B muestra el número de unidades formadoras de placas por gramo de heces del estudio 1 en una escala lineal.Figure 3B shows the number of plaque-forming units per gram of stool from Study 1 on a linear scale.
La figura 4 muestra el primer duplicado de los resultados que demuestran la eficacia in vitro del compuesto 1 para inhibir el norovirus humano en comparación con trifosfato de 2'-C-metilcitidina y compuesto 2.Figure 4 shows the first duplicate of the results demonstrating the in vitro efficacy of Compound 1 to inhibit human norovirus compared to 2'-C-methylcytidine triphosphate and Compound 2.
La figura 5 muestra el segundo duplicado de los resultados que demuestran la eficacia in vitro del compuesto 1 para inhibir el norovirus humano en comparación con trifosfato de 2'-C-metilcitidina y compuesto 2.Figure 5 shows the second duplicate of results demonstrating the in vitro efficacy of Compound 1 to inhibit human norovirus compared to 2'-C-methylcytidine triphosphate and Compound 2.
La figura 6 muestra una superposición del primer y segundo duplicado de los resultados que demuestran la eficacia in vitro del compuesto 1 para inhibir el norovirus humano en comparación con trifosfato de 2'-C-metilcitidina y compuesto 2.Figure 6 shows an overlay of the first and second duplicates of results demonstrating the in vitro efficacy of Compound 1 in inhibiting human norovirus compared to 2'-C-methylcytidine triphosphate and Compound 2.
La figura 7a muestra un diagrama de HPLC del compuesto 1.Figure 7a shows an HPLC diagram of compound 1.
La figura 7b muestra un diagrama de HPLC del compuesto 1 después de suspensión 3 horas a temperatura ambiente. La figura 7c muestra un diagrama de HPLC del compuesto 1 después de suspensión 3 horas a 50 °C.Figure 7b shows an HPLC diagram of compound 1 after suspension for 3 hours at room temperature. Figure 7c shows an HPLC diagram of compound 1 after suspension for 3 hours at 50 ° C.
La figura 7d muestra un diagrama de HPLC del compuesto 1 después de suspensión 24 horas a aproximadamente temperatura ambiente.Figure 7d shows an HPLC diagram of compound 1 after suspension for 24 hours at about room temperature.
La figura 8a muestra un espectro de RMN de 1H del compuesto 1 de aproximadamente -2 a aproximadamente 14 ppm. La figura 8b muestra un espectro de RMN de 1H del compuesto 1 de aproximadamente 2 a aproximadamente 9 ppm. La figura 8c muestra un espectro de RMN de 1H del compuesto 1 de aproximadamente 0 a aproximadamente 9 ppm.Figure 8a shows a 1H NMR spectrum of compound 1 from about -2 to about 14 ppm. Figure 8b shows a 1H NMR spectrum of compound 1 from about 2 to about 9 ppm. Figure 8c shows a 1H NMR spectrum of compound 1 from about 0 to about 9 ppm.
Descripción detalladaDetailed description
Los fosfonatos nucleosídicos (por ejemplo, derivados ribonucleosídicos) representan una clase diana de antivíricos para inhibir virus, que se basan en las enzimas codificadas por los virus que usan ribonucleótidos o desoxirribonucleótidos como sustratos, tales como determinadas polimerasas víricas para muchos virus de ARN y/o helicasas víricas para virus de ARN (por ejemplo, ARNmc) o de ADN. Sin embargo, sin el deseo de limitarse a teoría alguna, un impedimento a la eficacia de esta clase de antivíricos es la necesidad de modificación bioquímica del agente administrado dentro de las células diana para formar el trifosfato nucleosídico antivírico activo. En algunas realizaciones, si se administra un nucleósido, se requieren tres etapas de fosforilación para formar el trifosfato. La administración de fosfonatos nucleosídicos evita de forma eficaz la primera fosforilación, pero puede exacerbar problemas de administración de cantidades clínicamente útiles del fármaco cargado a través de las bicapas lipídicas que rodean las células.Nucleoside phosphonates (eg ribonucleoside derivatives) represent a target class of antivirals for inhibiting viruses, which are based on virus-encoded enzymes that use ribonucleotides or deoxyribonucleotides as substrates, such as certain viral polymerases for many RNA viruses and / or or viral helicases for RNA (eg ssRNA) or DNA viruses. However, without wishing to be bound by theory, an impediment to the efficacy of this class of antivirals is the need for biochemical modification of the administered agent within the target cells to form the active antiviral nucleoside triphosphate. In some In embodiments, if a nucleoside is administered, three phosphorylation steps are required to form the triphosphate. Administration of nucleoside phosphonates effectively prevents the first phosphorylation, but can exacerbate problems of delivering clinically useful amounts of the loaded drug through the lipid bilayers surrounding cells.
Sin el deseo de limitarse a teoría alguna, puede usarse conjugación con lípidos para ocultar los fármacos orales, incluyendo los fosfonatos nucleosídicos, como compuestos naturales que se absorban fácilmente por el organismo. Específicamente, en algunas realizaciones, los fosfonatos nucleosídicos pueden modificarse para que se parezcan a fosfolípidos parcialmente metabolizados (monoacilfosfolípidos). En algunas realizaciones, en contraste con los diacilfosfolípidos normales, los nucleótidos modificados con monoacil lípidos pueden penetrar fácilmente en los enterocitos que revisten la luz del intestino, entrar en la sangre circulante y/o el sistema linfático y, a diferencia de los fármacos convencionales, permanecer intactos. Por consiguiente, el resto lipídico puede hacer algo más que administrar el nucleósido al plasma; puede facilitar la captación eficaz en las células diana. El lípido puede escindirse en el compartimento citoplásmico de las células diana y, en el caso de conjugados de análogos nucleosídicos, puede producir el monofosfato correspondiente. Globalmente, esta estrategia puede dar lugar a niveles enormemente aumentados del antivírico activo en el sitio de replicación del virus.Without wishing to be bound by theory, lipid conjugation can be used to mask oral drugs, including nucleoside phosphonates, as naturally occurring compounds that are readily absorbed by the body. Specifically, in some embodiments, the nucleoside phosphonates can be modified to resemble partially metabolized phospholipids (monoacylphospholipids). In some embodiments, in contrast to normal diacylphospholipids, monacyl lipid-modified nucleotides can easily penetrate enterocytes lining the lumen of the intestine, enter the circulating blood and / or lymphatic system, and, unlike conventional drugs, remain intact. Consequently, the lipid moiety can do more than deliver the nucleoside to the plasma; can facilitate efficient uptake into target cells. The lipid can be cleaved in the cytoplasmic compartment of target cells and, in the case of nucleoside analog conjugates, can produce the corresponding monophosphate. Overall, this strategy can result in greatly increased levels of the active antiviral at the virus replication site.
La presente divulgación proporciona compuestos, composiciones farmacéuticas y métodos de síntesis y uso de los compuestos para tratar o prevenir una infección vírica o enfermedad o trastorno asociado con infección vírica, por ejemplo, una infección por virus de ARNmc.The present disclosure provides compounds, pharmaceutical compositions, and methods of synthesis and use of the compounds to treat or prevent a viral infection or disease or disorder associated with viral infection, for example, a ssRNA virus infection.
En algunas realizaciones, los compuestos de la presente divulgación tienen una relación de eficacia/toxicidad mejorada en comparación con compuestos de la técnica usados de forma similar.In some embodiments, the compounds of the present disclosure have an improved efficacy / toxicity ratio compared to similarly used compounds in the art.
DefinicionesDefinitions
Determinados compuestos de la presente divulgación y definiciones de grupos funcionales específicos también se describen en más detalle a continuación.Certain compounds of the present disclosure and definitions of specific functional groups are also described in more detail below.
Se apreciará que los compuestos, como se describe en este documento, pueden sustituirse con muchísimos sustituyentes o restos funcionales. En general, el término "sustituido", ya esté precedido por el término "opcionalmente" o no, y los sustituyentes contenidos en fórmulas divulgadas en este documento, se refieren al remplazo de radicales hidrógeno en una estructura dada con el radical de un sustituyente especificado. Cuando puede sustituirse más de una posición en cualquier estructura dada con más de un sustituyente seleccionado de un grupo especificado, el sustituyente puede ser igual o diferente en cada posición. Como se usa en este documento, se contempla que el término "sustituido" incluye todos los sustituyentes permisibles de compuestos orgánicos. En un aspecto amplio, los sustituyentes permisibles incluyen sustituyentes acíclicos y cíclicos, ramificados y no ramificados, carbocíclicos y heterocíclicos, aromáticos y no aromáticos de compuestos orgánicos. Para los propósitos de esta divulgación, heteroátomos tales como nitrógeno pueden tener sustituyentes hidrógeno y/o cualquier sustituyente permisible de compuestos orgánicos descritos en este documento que satisfaga las valencias de los heteroátomos. Los heteroátomos de nitrógeno y azufre opcionalmente pueden oxidarse, y el heteroátomo de nitrógeno opcionalmente puede cuaternizarse. Ejemplos de sustituyentes en los restos divulgados en este documento (por ejemplo, grupos alquilo, alquenilo, alquinilo, alcoxi, arilo, heteroarilo, cicloalquilo, cicloalquenilo, heterociclo no aromático) incluyen, aunque sin limitación, alquenilo, alquinilo, halógeno, haloalquilo, alcoxi, alquiltio, alquilsulfinilo, alquilsulfonilo, heteroarilo, arilo, cicloalquilo, cicloalquenilo, heterociclo no aromático, hidroxilo, carbamoilo, oxo, amino, nitro, azido, -SH y -CN.It will be appreciated that compounds, as described herein, can be substituted with very many functional moieties or substituents. In general, the term "substituted", whether preceded by the term "optionally" or not, and the substituents contained in formulas disclosed herein, refer to the replacement of hydrogen radicals in a given structure with the radical of a specified substituent. . When more than one position in any given structure can be substituted with more than one substituent selected from a specified group, the substituent can be the same or different at each position. As used herein, the term "substituted" is contemplated to include all permissible substituents of organic compounds. In a broad aspect, permissible substituents include acyclic and cyclic, branched and unbranched, carbocyclic and heterocyclic, aromatic and non-aromatic substituents of organic compounds. For the purposes of this disclosure, heteroatoms such as nitrogen can have hydrogen substituents and / or any permissible substituents of organic compounds described herein that satisfy the valences of the heteroatoms. The nitrogen and sulfur heteroatoms can optionally be oxidized, and the nitrogen heteroatom can optionally be quaternized. Examples of substituents on the moieties disclosed herein (eg, alkyl, alkenyl, alkynyl, alkoxy, aryl, heteroaryl, cycloalkyl, cycloalkenyl, non-aromatic heterocycle groups) include, but are not limited to, alkenyl, alkynyl, halogen, haloalkyl, alkoxy , alkylthio, alkylsulfinyl, alkylsulfonyl, heteroaryl, aryl, cycloalkyl, cycloalkenyl, non-aromatic heterocycle, hydroxyl, carbamoyl, oxo, amino, nitro, azido, -SH and -CN.
La presente divulgación pretende incluir todos los isótopos de átomos que aparecen en los presentes compuestos. Los isótopos incluyen aquellos átomos que tienen el mismo número atómico, pero diferentes números másicos. En particular uno, alguno o todos los hidrógenos pueden ser deuterio. Pueden usarse isótopos radioactivos, por ejemplo, para análisis estructural o para facilitar el rastreo del destino de los compuestos o sus productos metabólicos después de la administración. A modo de ejemplo general y sin limitación, los isótopos de hidrógeno incluyen deuterio y tritio y los isótopos de carbono incluyen C -13 y C -14. Por ejemplo, los compuestos de fórmula I incluyen aquellos en los que Ri es H o D; R2 y R3 son independientemente H, D, OH, OD, CH3 o CD3; y/o R4 es H, D, CH3 o CD3.The present disclosure is intended to include all isotopes of atoms that appear in the present compounds. Isotopes include those atoms that have the same atomic number, but different mass numbers. In particular one, some or all of the hydrogens can be deuterium. Radioactive isotopes can be used, for example, for structural analysis or to facilitate tracking of the fate of compounds or their metabolic products after administration. By way of general example and without limitation, hydrogen isotopes include deuterium and tritium and carbon isotopes include C -13 and C -14. For example, compounds of formula I include those in which Ri is H or D; R2 and R3 are independently H, D, OH, OD, CH3 or CD3; and / or R4 is H, D, CH3 or CD3.
El término "independientemente" se usa en este documento para indicar que la variable, tal como el átomo o grupo funcional, que se aplica independientemente, varía independientemente de una aplicación a otra. Por ejemplo, cuando existe más de un sustituyente o átomo (carbono o heteroátomo, tal como oxígeno (O), azufre (S) o nitrógeno (N)), cada sustituyente o átomo es independiente de otro sustituyente o átomo y dichos sustituyentes o átomos también pueden alternar.The term "independently" is used herein to indicate that the variable, such as the atom or functional group, which is applied independently, varies independently from one application to another. For example, when there is more than one substituent or atom (carbon or heteroatom, such as oxygen (O), sulfur (S), or nitrogen (N)), each substituent or atom is independent of another substituent or atom and said substituents or atoms they can also alternate.
El término "alquilo", como se usa en este documento, se refiere a radicales hidrocarbonados saturados, de cadena lineal o ramificados que contienen, en determinadas realizaciones, entre uno y veinte, incluyendo entre uno y diez, o entre diez y seis, átomos de carbono. Ramificado significa que uno o más grupos alquilo C1-C6 inferior, tales como metilo, etilo o propilo están unidos a una cadena de alquilo lineal. Grupos alquilo ejemplares incluyen metilo, etilo, npropilo, i-propilo, n-butilo, t-butilo, n-pentilo y 3-pentilo. Ejemplos de radicales alquilo C1-C6 incluyen, aunque sin limitación, radicales metilo, etilo, propilo, isopropilo, butilo, ferc-butilo, neopentilo, n-hexilo; y ejemplos de radicales alquilo Ci -Ca incluyen, aunque sin limitación, radicales metilo, etilo, propilo, isopropilo, n-butilo, tere-butilo, neopentilo, n-hexilo, heptilo, octilo. Ejemplos de radicales alquilo C1-C20 incluyen, aunque sin limitación, hexadecametilo, hexadecaetilo, hexadecapropilo, octadecametilo, octadecaetilo, octadecapropilo y similares.The term "alkyl", as used herein, refers to straight chain or branched saturated hydrocarbon radicals containing, in certain embodiments, between one and twenty, including between one and ten, or between ten and six, atoms. carbon. Branched means that one or more C1-C6 lower alkyl groups, such as methyl, ethyl, or propyl are attached to a linear alkyl chain. Exemplary alkyl groups include methyl, ethyl, n-propyl, i-propyl, n-butyl, t-butyl, n-pentyl, and 3-pentyl. Examples of C1-C6 alkyl radicals include, but are not limited to, methyl, ethyl, propyl, isopropyl, butyl, tert-butyl, neopentyl, n-hexyl radicals; and examples of radicals Ci-Ca alkyl include, but are not limited to, methyl, ethyl, propyl, isopropyl, n-butyl, tere-butyl, neopentyl, n-hexyl, heptyl, octyl radicals. Examples of C1-C20 alkyl radicals include, but are not limited to, hexadecamethyl, hexadecaethyl, hexadecapropyl, octadecamethyl, octadecaethyl, octadecapropyl, and the like.
El término "alquenilo", como se usa en este documento, se refiere a un grupos lineal o ramificado monovalente derivado de un resto hidrocarbonado que contiene, en determinadas realizaciones, de dos a seis, o de dos a ocho, o de dos a veinte átomos de carbono, que tiene al menos un doble enlace carbono-carbono. El doble enlace puede ser o no el punto de adhesión a otro grupo. Ejemplos de grupos alquenilo C2-C8 incluyen, aunque sin limitación, por ejemplo, etenilo, propenilo, butenilo, 1-metil-2-buten-1-ilo, heptenilo, octenilo y similares. Como se define en este documento, los grupos "alquenilo" incluyen isómeros tanto eis como trans. The term "alkenyl", as used herein, refers to a monovalent linear or branched group derived from a hydrocarbon moiety containing, in certain embodiments, two to six, or two to eight, or two to twenty carbon atoms, having at least one carbon-carbon double bond. The double bond may or may not be the point of attachment to another group. Examples of C2-C8 alkenyl groups include, but are not limited to, for example, ethenyl, propenyl, butenyl, 1-methyl-2-buten-1-yl, heptenyl, octenyl, and the like. As defined herein, "alkenyl" groups include both eis and trans isomers.
El término "alquinilo", como se usa en este documento, se refiere a un grupos lineal o ramificado monovalente derivado de un resto hidrocarbonado que contiene, en determinadas realizaciones, de dos a seis, o de dos a ocho, o de dos a veinte átomos de carbono, que tiene al menos un triple enlace carbono-carbono. El triple enlace puede ser o no el punto de adhesión a otro grupo. Ejemplos de grupos alquinilo C2-C8 incluyen, aunque sin limitación, por ejemplo, etinilo, propinilo, butinilo y similares.The term "alkynyl", as used herein, refers to a monovalent linear or branched group derived from a hydrocarbon moiety containing, in certain embodiments, two to six, or two to eight, or two to twenty carbon atoms, having at least one carbon-carbon triple bond. The triple bond may or may not be the point of adhesion to another group. Examples of C2-C8 alkynyl groups include, but are not limited to, for example, ethynyl, propynyl, butynyl, and the like.
El término "alcoxi" se refiere a un radical -O-alquilo.The term "alkoxy" refers to an -O-alkyl radical.
El término "tioalquilo" o "alquiltio" se refiere a un radical -S-alquilo. En algunas realizaciones, el grupo tio puede remplazarse por un sulfinilo (SO) o sulfonilo (SO2).The term "thioalkyl" or "alkylthio" refers to an -S-alkyl radical. In some embodiments, the thio group can be replaced by a sulfinyl (SO) or sulfonyl (SO2).
Los términos "hal", "halo" o "halógeno", como se usan en este documento, se refieren a un átomo seleccionado de flúor, cloro, bromo y yodo.The terms "hal", "halo" or "halogen", as used herein, refer to an atom selected from fluorine, chlorine, bromine and iodine.
Los términos "haloalquilo", "haloalquenilo" o "haloalquinilo", como se usan en este documento, se refieren a un alquilo, alquenilo o alquinilo que está sustituido con uno o más halógenos o grupos halo. Ejemplos de haloalquilo incluyen, aunque sin limitación, CF3, CH2CF3, CCl3.The terms "haloalkyl", "haloalkenyl" or "haloalkynyl", as used herein, refer to an alkyl, alkenyl, or alkynyl that is substituted with one or more halogens or halo groups. Examples of haloalkyl include, but are not limited to, CF3, CH2CF3, CCl3.
El término "arilo", como se usa en este documento, se refiere a un sistema de anillos carbocíclico mono- o policíclico que tiene uno o más anillos aromáticos, condensados o no condensados incluyendo, aunque sin limitación, fenilo, naftilo, tetrahidronaftilo, indanilo, idenilo y similares. El término arilo incluye indolina.The term "aryl", as used herein, refers to a mono- or polycyclic carbocyclic ring system having one or more aromatic rings, fused or uncondensed including, but not limited to, phenyl, naphthyl, tetrahydronaphthyl, indanyl , idenilo and the like. The term aryl includes indoline.
El término "cicloalquilo", como se usa en este documento, se refiere a un grupo monovalente derivado de un compuesto de anillo carbocíclico saturado monocíclico o policíclico. Ejemplos de cicloalquilo C3-C8 (cicloalquilo de 3 a 8 miembros) incluyen, aunque sin limitación, ciclopropilo, ciclobutilo, ciclopentilo, ciclohexilo, ciclopentilo y ciclooctilo; y ejemplos de cicloalquilo C3-C12 incluyen, aunque sin limitación, ciclopropilo, ciclobutilo, ciclopentilo, ciclohexilo, biciclo [2.2.1] heptilo y biciclo [2.2.2]octilo y similares.The term "cycloalkyl", as used herein, refers to a monovalent group derived from a monocyclic or polycyclic saturated carbocyclic ring compound. Examples of C3-C8 cycloalkyl (3- to 8-membered cycloalkyl) include, but are not limited to, cyclopropyl, cyclobutyl, cyclopentyl, cyclohexyl, cyclopentyl, and cyclooctyl; and examples of C3-C12 cycloalkyl include, but are not limited to, cyclopropyl, cyclobutyl, cyclopentyl, cyclohexyl, bicyclo [2.2.1] heptyl and bicyclo [2.2.2] octyl and the like.
El término "cicloalquenilo", como se usa en este documento, se refiere a un grupo monovalente derivado de un compuesto de anillo carbocíclico parcialmente insaturado monocíclico o policíclico (es decir, no aromático). En otras palabras, se refiere a un grupo monovalente derivado de un compuesto de anillo carbocíclico monocíclico o policíclico que tiene al menos un doble enlace carbono-carbono. Los ejemplos de dichos grupos incluyen, aunque sin limitación, ciclopropenilo, ciclobutenilo, ciclopentenilo, ciclohexenilo, cicloheptenilo, ciclooctenilo y similares.The term "cycloalkenyl", as used herein, refers to a monovalent group derived from a monocyclic or polycyclic partially unsaturated carbocyclic ring compound (ie, non-aromatic). In other words, it refers to a monovalent group derived from a monocyclic or polycyclic carbocyclic ring compound having at least one carbon-carbon double bond. Examples of such groups include, but are not limited to, cyclopropenyl, cyclobutenyl, cyclopentenyl, cyclohexenyl, cycloheptenyl, cyclooctenyl, and the like.
El término "cicloalquinilo", como se usa en este documento, indica un grupo monovalente derivado de un compuesto carbocíclico parcialmente insaturado monocíclico o policíclico (es decir, no aromático) que tiene al menos un triple enlace carbono-carbono. Ejemplos incluyen ciclooctino.The term "cycloalkynyl", as used herein, indicates a monovalent group derived from a partially unsaturated monocyclic or polycyclic (ie, non-aromatic) carbocyclic compound having at least one carbon-carbon triple bond. Examples include cyclooctin.
El término "heteroarilo", como se usa en este documento, se refiere a un radical o sistema de anillos mono- o policíclico (por ejemplo, bi- o tricíclico o más) condensado o no condensado, que tiene al menos un anillo aromático, que tiene de cinco a diez átomos en el anillo, de los que al menos un átomo del anillo se selecciona de S, O, P y N. En otras palabras, heteroarilo es arilo que contiene al menos un heteroátomo. Ejemplos de heteroarilo incluyen, aunque sin limitación, piridinilo, furanilo, tiazolilo, imidazolilo, indolilo, benzofuranilo y similares.The term "heteroaryl", as used herein, refers to a mono- or polycyclic (eg, bi- or tricyclic or more) fused or unfused radical or ring system, having at least one aromatic ring, having five to ten ring atoms, of which at least one ring atom is selected from S, O, P and N. In other words, heteroaryl is aryl containing at least one hetero atom. Examples of heteroaryl include, but are not limited to, pyridinyl, furanyl, thiazolyl, imidazolyl, indolyl, benzofuranyl, and the like.
Se acepta que la expresión "heteroarilo de 5 o 6 miembros", significa un anillo que tiene de cinco a doce átomos en el anillo, de los que al menos un átomo del anillo se selecciona de S, O, P y N. Heteroarilo incluye, aunque sin limitación, piridinilo, pirazinilo, pirimidinilo, pirrolilo, pirazolilo, imidazolilo, tiazolilo, oxazolilo, isooxazolilo, tiadiazolilo, oxadiazolilo, tiofenilo, furanilo, quinolinilo, isoquinolinilo, bencimidazolilo, benzooxazolilo, quinoxalinilo y similares.The term "5- or 6-membered heteroaryl" is accepted to mean a ring having from five to twelve ring atoms, of which at least one ring atom is selected from S, O, P, and N. Heteroaryl includes but not limited to pyridinyl, pyrazinyl, pyrimidinyl, pyrrolyl, pyrazolyl, imidazolyl, thiazolyl, oxazolyl, isooxazolyl, thiadiazolyl, oxadiazolyl, thiophenyl, furanyl, quinolinyl, isoquinolinyl, benzimidazolyl, benzooxazolyl, quinoxalyl, and the like.
La expresión anillo "heterocíclico no aromático" o "heterociclo no aromático", como se usa en este documento, se refiere a un sistema saturado o insaturado, no aromático monocíclico o policíclico, condensado o no condensado, donde, por ejemplo, al menos un anillo contiene entre uno y cuatro heteroátomos seleccionados independientemente de oxígeno, azufre, fósforo y nitrógeno. Los heteroátomos de nitrógeno y azufre opcionalmente pueden oxidarse, y el heteroátomo de nitrógeno opcionalmente puede cuaternizarse. Los grupos heterocíclicos no aromáticos representativos incluyen, aunque sin limitación, [1,3]dioxolano, pirrolidinilo, pirazolinilo, pirazolidinilo, imidazolinilo, imidazolidinilo, piperidinilo, piperazinilo, oxazolidinilo, isoxazolidinilo, morfolinilo, tiazolidinilo, isotiazolidinilo y tetrahidrofurilo.The term "non-aromatic heterocyclic" or "non-aromatic heterocycle" ring, as used herein, refers to a saturated or unsaturated, non-aromatic monocyclic or polycyclic, condensed or non-condensed system, where, for example, at least one ring contains between one and four heteroatoms independently selected from oxygen, sulfur, phosphorus, and nitrogen. The nitrogen and sulfur heteroatoms can optionally be oxidized, and the nitrogen heteroatom can optionally be quaternized. Representative non-aromatic heterocyclic groups include, but are not limited to, [1,3] dioxolane, pyrrolidinyl, pyrazolinyl, pyrazolidinyl, imidazolinyl, imidazolidinyl, piperidinyl, piperazinyl, oxazolidinyl, isoxazolidinyl, morpholinyl, thiazolidinyl, isothiazolidinyl, and tetrahydrofuryl.
Como se usa en este documento, se entiende que el término "oxo" describe un grupo carbonilo (es decir, C(O)). As used herein, the term "oxo" is understood to describe a carbonyl group (ie, C (O)).
Como se describe en este documento, los compuestos de la divulgación pueden sustituirse opcionalmente con uno o más sustituyentes, tales como los ilustrados en general anteriormente, o como se ejemplifica por clases, subclases y especies particulares de la divulgación. Se apreciará que la frase "opcionalmente sustituido" se usa indistintamente con la frase "sustituido o sin sustituir". En general, el término "sustituido", ya esté precedido por el término "opcionalmente" o no, se refiere al remplazo de radicales hidrógeno en una estructura dada con el radical de un sustituyente especificado. Salvo que se indique de otro modo, un grupo opcionalmente sustituido puede tener un sustituyente en cada posición sustituible del grupo, y cuando puede sustituirse más de una posición en cualquier estructura dada con más de un sustituyente seleccionado de un grupo especificado, el sustituyente puede ser igual o diferente en cada posición.As described herein, the compounds of the disclosure may optionally be substituted with one or more substituents, such as those generally illustrated above, or as exemplified by particular classes, subclasses, and species of the disclosure. It will be appreciated that the phrase "optionally substituted" is used interchangeably with the phrase "substituted or unsubstituted". In general, the term "substituted", whether preceded by the term "optionally" or not, refers to the replacement of hydrogen radicals in a given structure with the radical of a specified substituent. Unless otherwise indicated, an optionally substituted group may have one substituent at each substitutable position in the group, and when more than one position in any given structure may be substituted with more than one substituent selected from a specified group, the substituent may be the same or different in each position.
El término "protegido", como se describe en este documento, se refiere a grupos funcionales o compuestos de la presente divulgación que tienen un grupo protector usando en la síntesis para enmascarar temporalmente la química característica de un grupo funcional (tal como hidroxilo, amino, carboxilo, etc.) porque interfiere con otra reacción. Después de completarse la reacción, estos grupos protectores se retiran por métodos comunes, o los compuestos protegidos se usan como profármacos o como los compuestos de la divulgación.The term "protected", as described herein, refers to functional groups or compounds of the present disclosure that have a protecting group used in synthesis to temporarily mask the characteristic chemistry of a functional group (such as hydroxyl, amino, carboxyl, etc.) because it interferes with another reaction. After completion of the reaction, these protecting groups are removed by common methods, or the protected compounds are used as prodrugs or as the compounds of the disclosure.
La expresión "profármaco" o "profármacos farmacéuticamente aceptables", como se usa en este documento, se refiere a compuestos que se transforman rápidamente in vivo para producir el compuesto precursor, por ejemplo, por hidrólisis en la sangre (T. Higuchi y V. Stella, Pro-drugs as Novel Delivery Systems, Vol. 14 del A.C.S. Symposium Series; Edward B. Roche, ed., Bioreversible Carriers in Drug Design, American Pharmaceutical Association and Pergamon Press, 1987).The term "prodrug" or "pharmaceutically acceptable prodrugs", as used herein, refers to compounds that are rapidly transformed in vivo to produce the parent compound, for example, by hydrolysis in blood (T. Higuchi and V. Stella, Pro-drugs as Novel Delivery Systems, Vol. 14 of the ACS Symposium Series; Edward B. Roche, ed., Bioreversible Carriers in Drug Design, American Pharmaceutical Association and Pergamon Press, 1987).
La expresión "farmacéutico" o "farmacéuticamente aceptable", cuando se usan en este documento como un adjetivo, significa sustancialmente no tóxico y sustancialmente no perjudicial para el destinatario. Como se usa en este documento, la expresión "farmacéuticamente aceptable" se refiere a aquellos compuestos, materiales, composiciones, vehículos y/o formas farmacéuticas que son, según el juicio médico razonable, adecuados para su uso en contacto con los tejidos de los seres humanos y los animales sin provocar una toxicidad, irritación, respuesta alérgica u otro problema o complicación excesiva, y acordes con una relación de beneficio/riesgo razonable.The term "pharmaceutical" or "pharmaceutically acceptable", when used herein as an adjective, means substantially non-toxic and substantially non-injurious to the recipient. As used herein, the term "pharmaceutically acceptable" refers to those compounds, materials, compositions, carriers, and / or dosage forms that are, within reasonable medical judgment, suitable for use in contact with the tissues of human beings. humans and animals without causing toxicity, irritation, allergic response or other excessive problem or complication, and consistent with a reasonable benefit / risk ratio.
Por "formulación farmacéutica" se entiende además que el vehículo, disolvente, uno o más excipientes y sal deben ser compatibles con el ingrediente activo de la formulación (por ejemplo, un compuesto de la divulgación). Los expertos en la materia entienden que las expresiones "formulación farmacéutica" y "composición farmacéutica" son, en general, intercambiables, y por tanto se usan para los propósitos de esta solicitud e incluyen preparaciones adecuadas para su administración a mamíferos, por ejemplo, seres humanos.By "pharmaceutical formulation" it is further meant that the carrier, solvent, one or more excipients and salt must be compatible with the active ingredient of the formulation (eg, a compound of the disclosure). Those skilled in the art understand that the terms "pharmaceutical formulation" and "pharmaceutical composition" are, in general, interchangeable, and therefore are used for the purposes of this application and include preparations suitable for administration to mammals, for example, human beings. humans.
Una "composición farmacéutica", como se usa en este documento, se refiere a una formulación que contiene un compuesto de la presente divulgación en una forma adecuada para su administración a un sujeto. En una realización, la composición farmacéutica está a granel o en una forma farmacéutica unitaria. La forma farmacéutica unitaria es cualquiera de una diversidad de formas incluyendo, por ejemplo, una cápsula, una bolsa IV, un comprimido, una bomba individual en un inhalador de aerosol o un vial. La cantidad de ingrediente activo (por ejemplo, una formulación del compuesto divulgado o sal, hidrato, solvato o isómero del mismo) en una dosis unitaria de la composición es una cantidad eficaz y se varía de acuerdo con el tratamiento particular implicado. Un experto en la materia apreciará que, a veces, es necesario hacer variaciones rutinarias en la dosificación dependiendo de la edad y estado del paciente. La dosificación también dependerá de la vía de administración. Como se usa en este documento, "vehículo farmacéuticamente aceptable" puede incluir todos los disolventes, diluyentes u otros vehículos líquidos, auxiliares de dispersión o suspensión, agentes tensioactivos, agentes isotónicos, agentes espesantes o emulsionantes, conservantes, aglutinantes sólidos, lubricantes y similares, adecuados para la forma farmacéutica particular deseada. Remington's Pharmaceutical Sciences, decimosexta edición, E. W. Martin (Mack Publishing Co., Easton, Pa., 1980) divulga diversos vehículos usados en la formulación de composiciones farmacéuticas y técnicas conocidas para la preparación de las mismas. Excepto en la medida que cualquier medio de vehículo convencional sea incompatible con los compuestos, tal como al producir algún efecto biológico indeseable o al interactuar de otro modo de una manera perjudicial con cualquier otro componentes o componentes de la composición farmacéutica, su uso se contempla dentro del alcance de esta divulgación. Algunos ejemplos de materiales que pueden servir como vehículos farmacéuticamente aceptables incluyen, aunque sin limitación, glúcidos tales como lactosa, glucosa y sacarosa; almidones tales como almidón de maíz y almidón de patata; celulosa y sus derivados tales como carboximetilcelulosa de sodio, etilcelulosa y acetato de celulosa; tragacanto en polvo; malta; gelatina; talco; excipientes tales como manteca de cacao y ceras de supositorio; aceites tales como aceite de cacahuete, aceite de semilla de algodón; aceite de cártamo, aceite de sésamo; aceite de oliva; acete de maíz y aceite de soja; glicoles; tales como propilenglicol; ésteres tales como oleato de etilo y laurato de etilo; agar; agentes tamponantes tales como hidróxido de magnesio e hidróxido de aluminio; ácido algínico; agua apirógena; solución salina isotónica; solución de Ringer; alcohol etílico y soluciones de tampón fosfato, así como otros lubricantes compatibles atóxicos tales como laurilsulfato de sodio y estearato de magnesio, así como agente colorantes, agentes de liberación, agentes de recubrimiento, agentes edulcorantes, aromatizantes y perfumantes, conservantes y antioxidantes también pueden estar presentes en la composición, de acuerdo con el criterio del formulador. "Excipiente o vehículos farmacéuticamente aceptable" también se refiere a un excipiente o vehículo que es útil en la preparación de una composición farmacéutica que en general es segura, atóxica y ni biológicamente indeseable ni indeseable de otro modo, e incluye un excipiente que es aceptable para uso veterinario, así como uso farmacéutico en seres humanos. Un "excipiente farmacéuticamente aceptable", como se usa en la memoria descriptiva y las reivindicaciones incluye tanto uno como más de uno de dicho excipiente.A "pharmaceutical composition", as used herein, refers to a formulation containing a compound of the present disclosure in a form suitable for administration to a subject. In one embodiment, the pharmaceutical composition is in bulk or in unit dosage form. The unit dosage form is any of a variety of forms including, for example, a capsule, an IV bag, a tablet, a single pump in an aerosol inhaler, or a vial. The amount of active ingredient (eg, a formulation of the disclosed compound or salt, hydrate, solvate or isomer thereof) in a unit dose of the composition is an effective amount and is varied according to the particular treatment involved. One skilled in the art will appreciate that it is sometimes necessary to make routine variations in dosage depending on the age and condition of the patient. The dosage will also depend on the route of administration. As used herein, "pharmaceutically acceptable carrier" can include all solvents, diluents or other liquid carriers, dispersing or suspending aids, surfactants, isotonic agents, thickening or emulsifying agents, preservatives, solid binders, lubricants, and the like, suitable for the particular dosage form desired. Remington's Pharmaceutical Sciences, Sixteenth Edition, EW Martin (Mack Publishing Co., Easton, Pa., 1980) discloses various vehicles used in the formulation of pharmaceutical compositions and known techniques for the preparation thereof. Except insofar as any conventional carrier medium is incompatible with the compounds, such as by producing some undesirable biological effect or otherwise interacting in a deleterious manner with any other components or components of the pharmaceutical composition, its use is contemplated within the scope of this disclosure. Some examples of materials that can serve as pharmaceutically acceptable carriers include, but are not limited to, carbohydrates such as lactose, glucose, and sucrose; starches such as corn starch and potato starch; cellulose and its derivatives such as sodium carboxymethyl cellulose, ethyl cellulose and cellulose acetate; tragacanth powder; malt; jelly; talcum powder; excipients such as cocoa butter and suppository waxes; oils such as peanut oil, cottonseed oil; safflower oil, sesame oil; olive oil; corn oil and soybean oil; glycols; such as propylene glycol; esters such as ethyl oleate and ethyl laurate; agar; buffering agents such as magnesium hydroxide and aluminum hydroxide; alginic acid; pyrogen-free water; isotonic saline; Ringer's solution; Ethyl alcohol and phosphate buffer solutions, as well as other compatible non-toxic lubricants such as sodium lauryl sulfate and sodium stearate. Magnesium, as well as coloring agents, release agents, coating agents, sweetening, flavoring and perfuming agents, preservatives and antioxidants may also be present in the composition, according to the criteria of the formulator. "Pharmaceutically acceptable excipient or carriers" also refers to an excipient or carrier that is useful in the preparation of a pharmaceutical composition that is generally safe, non-toxic, and neither biologically undesirable nor otherwise undesirable, and includes an excipient that is acceptable for veterinary use, as well as pharmaceutical use in humans. A "pharmaceutically acceptable excipient" as used in the specification and claims includes both one and more than one of said excipient.
Los compuestos divulgados en este documento incluyen los propios compuestos, así como sus sales, sus solvatos y sus profármacos, si fuera aplicable. Una sal, por ejemplo, puede formarse entre un anión y un grupo cargado positivamente (por ejemplo, amino protonado) en un compuesto de esta divulgación. Los aniones adecuados incluyen cloruro, bromuro, yoduro, sulfato, bisulfato, sulfamato, nitrato, fosfato, citrato, metanosulfonato, trifluoroacetato, glutamato, glucuronato, glutarato, malato, maleato, succinato, fumarato, tartrato, tosilato, salicilato, lactato, naftalenosulfonato y acetato (por ejemplo, trifluroacetato). La expresión "anión farmacéuticamente aceptable" se refiere a un anión adecuado para formar una sal farmacéuticamente aceptable. Asimismo, una sal también puede formarse entre un catión y un grupo cargado negativamente (por ejemplo, carboxilato) en un compuesto de esta divulgación. Los cationes adecuados incluyen ion sodio, ion potasio, ion magnesio, ion calcio y un catión amonio tal como ion tetrametilamonio. Los compuestos de esta divulgación también incluyen aquellas sales que contienen átomos de nitrógeno cuaternario. Ejemplos de profármacos incluyen ésteres y otros derivados farmacéuticamente aceptables que, tras su administración a un sujeto, pueden proporcionar compuestos activos de esta divulgación.The compounds disclosed herein include the compounds themselves, as well as their salts, solvates, and prodrugs, if applicable. A salt, for example, can be formed between an anion and a positively charged group (eg, protonated amino) in a compound of this disclosure. Suitable anions include chloride, bromide, iodide, sulfate, bisulfate, sulfamate, nitrate, phosphate, citrate, methanesulfonate, trifluoroacetate, glutamate, glucuronate, glutarate, malate, maleate, succinate, fumarate, tartrate, tosylate, salicylate, lactate, naphthalene sulfonate. acetate (eg trifluoroacetate). The term "pharmaceutically acceptable anion" refers to an anion suitable for forming a pharmaceutically acceptable salt. Likewise, a salt can also be formed between a cation and a negatively charged group (eg, carboxylate) in a compound of this disclosure. Suitable cations include sodium ion, potassium ion, magnesium ion, calcium ion, and an ammonium cation such as tetramethylammonium ion. The compounds of this disclosure also include those salts that contain quaternary nitrogen atoms. Examples of prodrugs include esters and other pharmaceutically acceptable derivatives which, upon administration to a subject, can provide active compounds of this disclosure.
Adicionalmente, las sales fisiológicamente aceptables, es decir, farmacéuticamente compatibles pueden ser sales de los compuestos divulgados en este documento con ácidos inorgánicos u orgánicos. Se da preferencia a sales con ácidos inorgánicos tales como, por ejemplo, ácido clorhídrico, ácido bromhídrico, ácido fosfórico o ácido sulfúrico, o a sales con ácidos carboxílicos o sulfónicos orgánicos tales como, por ejemplo, ácido acético, ácido trifluoroacético, ácido propiónico, ácido maleico, ácido fumárico, ácido málico, ácido cítrico, ácido tartárico, ácido láctico, ácido benzoico o ácido metanosulfónico, ácido etanosulfónico, ácido bencenosulfónico, ácido toluenosulfónico o ácido naftalenodisulfónico.Additionally, the physiologically acceptable, ie, pharmaceutically compatible salts can be salts of the compounds disclosed herein with inorganic or organic acids. Preference is given to salts with inorganic acids such as, for example, hydrochloric acid, hydrobromic acid, phosphoric acid or sulfuric acid, or to salts with organic carboxylic or sulfonic acids such as, for example, acetic acid, trifluoroacetic acid, propionic acid, acid maleic, fumaric acid, malic acid, citric acid, tartaric acid, lactic acid, benzoic acid or methanesulfonic acid, ethanesulfonic acid, benzenesulfonic acid, toluenesulfonic acid or naphthalenedisulfonic acid.
Otras sales farmacéuticamente compatibles que pueden mencionarse son sales con bases habituales tales como, por ejemplo, sales de metales alcalinos (por ejemplo sales de sodio o potasio), sales de metales alcalinotérreos (por ejemplo, sales de calcio o magnesio) o sales de amonio, derivadas de amoniaco o aminas orgánicas tales como, por ejemplo, dietilamina, trietilamina, etildiisopropilamina, procaína, dibencilamina, N-metilmorfolina, dihidroabietilamina o metilpiperidina.Other pharmaceutically compatible salts that may be mentioned are salts with customary bases such as, for example, alkali metal salts (for example sodium or potassium salts), alkaline earth metal salts (for example, calcium or magnesium salts) or ammonium salts. derived from ammonia or organic amines such as, for example, diethylamine, triethylamine, ethyldiisopropylamine, procaine, dibenzylamine, N-methylmorpholine, dihydroabiethylamine or methylpiperidine.
Como se usa en este documento, "sales farmacéuticamente aceptables" puede hacer referencia a derivados de los compuestos de la presente divulgación en los que el compuesto precursor se modifica haciendo sales de ácidos o de bases de los mismos. Ejemplos de sales farmacéuticamente aceptables incluyen, aunque sin limitación, sales de ácidos minerales u orgánicos de residuos básicos tales como aminas, sales alcalinas u orgánicas de residuos ácidos tales como ácidos carboxílicos, y similares. Las sales farmacéuticamente aceptables incluyen las sales atóxicas convencionales o las sales de amonio cuaternario del compuesto precursor formadas, por ejemplo, a partir de ácidos inorgánicos u orgánicos atóxicos. Por ejemplo, dichas sales atóxicas convencionales incluyen, aunque sin limitación, las derivadas de ácidos inorgánicos y orgánicos seleccionados de 2-acetoxibenzoico, 2-hidroxietanosulfónico, acético, ascórbico, bencenosulfónico, benzoico, bicarbónico, carbónico, cítrico, edético, etanodisulfónico, 1,2-etanosulfónico, fumárico, glucoheptónico, glucónico, glutámico, glicólico, glicoliarsanílico, hexilresorcínico, hidrabámico, bromhídrico, clorhídrico, yodhídrico, hidroximaleico, hidroxinaftoico, isetiónico, láctico, lactobiónico, laurilsulfónico, maleico, málico, mandélico, metanosulfónico, napsílico, nítrico, oxálico, pamoico, pantoténico, fenilacético, fosfórico, poligalacturónico, propiónico, salicíclico, esteárico, subacético, succínico, sulfámico, sulfanílico, sulfúrico, tánico, tartárico, toluenosulfónico y los aminoácidos de origen naturales, por ejemplo, glicina, alanina, fenilalanina, arginina, etc. As used herein, "pharmaceutically acceptable salts" can refer to derivatives of the compounds of the present disclosure in which the parent compound is modified by making acid or base salts thereof. Examples of pharmaceutically acceptable salts include, but are not limited to, mineral or organic acid salts of basic residues such as amines, alkali or organic salts of acid residues such as carboxylic acids, and the like. Pharmaceutically acceptable salts include the conventional non-toxic salts or the quaternary ammonium salts of the parent compound formed, for example, from non-toxic inorganic or organic acids. For example, such conventional non-toxic salts include, but are not limited to, those derived from inorganic and organic acids selected from 2-acetoxybenzoic, 2-hydroxyethanesulfonic, acetic, ascorbic, benzenesulfonic, benzoic, bicarbonic, carbonic, citric, edetic, ethanedisulfonic, 1, 2-Ethanesulfonic, Fumaric, Glucoheptonic, Gluconic, Glutamic, Glycolic, Glycoliarsanilic, Hexylresorcinic, Hydrabamic, Hydrobromic, Hydrochloric, Hydroiodic, Hydroxymaleic, Hydroxynaphthoic, Isethionic, Lactic, Lactobionic, Mandelic, Nauryl, Methane sulfonic, Lactobionic, Lauryl, Naurylsulfonic, Male oxalic, pamoic, pantothenic, phenylacetic, phosphoric, polygalacturonic, propionic, salicyclic, stearic, subacetic, succinic, sulfamic, sulfanilic, sulfuric, tannic, tartaric, toluenesulfonic and the naturally occurring amino acids, for example, glycine, alanine, phenylalanine , etc.
Otros ejemplos de sales farmacéuticamente aceptables pueden incluir ácido hexanoico, ácido ciclopentanopropiónico, ácido pirúvico, ácido malónico, ácido 3-(4-hidroxibenzoil)benzoico, ácido cinámico, ácido 4-clorobencenosulfónico, ácido 2-naftalenosulfónico, ácido 4-toluenosulfónico, ácido alcanforsulfónico, ácido 4-metilbiciclo-[2.2.2]-oct-2-eno-1-carboxílico, ácido 3-fenilpropiónico, ácido trimetilacético, ácido ferc-butilacético, ácido mucónico, y similares. La presente divulgación también abarca sales formadas cuando un protón ácido presente en el compuesto precursor se remplaza por un ion metálico, por ejemplo, un iones de metal alcalino o un ion de metal alcalinotérreo, por ejemplo, un ion aluminio; o se coordina con una base orgánica tal como etanolamina, dietanolamina, trietanolamina, trometamina, N-metilglucamina, dietilamina, dietilaminoetanol, etilendiamina, imidazol, lisina, arginina, morfolina, 2-hidroxietilmorfolina, dibenciletilendiamina, trimetilamina, piperidina, pirrolidina, bencilamina, hidróxido de tetrametilamonio y similares.Other examples of pharmaceutically acceptable salts may include hexanoic acid, cyclopentanepropionic acid, pyruvic acid, malonic acid, 3- (4-hydroxybenzoyl) benzoic acid, cinnamic acid, 4-chlorobenzenesulfonic acid, 2-naphthalenesulfonic acid, 4-toluenesulfonic acid, camphorsulfonic acid. , 4-methylbicyclo- [2.2.2] -oct-2-ene-1-carboxylic acid, 3-phenylpropionic acid, trimethylacetic acid, tert-butylacetic acid, muconic acid, and the like. The present disclosure also encompasses salts formed when an acidic proton present in the parent compound is replaced by a metal ion, for example an alkali metal ion or an alkaline earth metal ion, for example an aluminum ion; or coordinates with an organic base such as ethanolamine, diethanolamine, triethanolamine, tromethamine, N-methylglucamine, diethylamine, diethylaminoethanol, ethylenediamine, imidazole, lysine, arginine, morpholine, 2-hydroxyethylmorpholine, dibenzylethylenediamine, trimethylglucamine, pyroxylethylenediamine, trimethylamine, pyrimethylamine, pyrimethylamine, trimethylamine tetramethylammonium and the like.
Debe entenderse que todas las referencias a sales farmacéuticamente aceptables incluyen formas de adición de disolvente (solvatos) o formas cristalinas (polimorfos) como se define en este documento, de la misma sal.All references to pharmaceutically acceptable salts are to be understood to include solvent addition forms (solvates) or crystalline forms (polymorphs) as defined herein, of the same salt.
Los compuestos de la presente divulgación también pueden prepararse como profármacos. En determinadas realizaciones, uno o más compuestos de la presente divulgación se formulan como un profármaco. En determinadas realizaciones, tras la administración in vivo, un profármaco se convierte químicamente en la forma biológica, farmacéutica o terapéuticamente más activa. En determinadas realizaciones, los profármacos son útiles porque son más fáciles de administrar que la correspondiente forma activa. Por ejemplo, en determinados casos, un profármaco puede estar más biodisponible (por ejemplo, mediante administración oral) de lo que está la correspondiente forma activa. En determinados casos, un profármaco puede tener solubilidad mejorada en comparación con la correspondiente forma activa. En determinadas realizaciones, los profármacos son menos solubles en agua que la correspondiente forma activa. En determinados casos, dichos profármacos tienen transmisión superior a través de las membranas celulares, donde la solubilidad en agua se perjudicial para la movilidad. En determinadas realizaciones, un profármaco es un éster. En determinadas realizaciones de este tipo, el éster se hidroliza metabólicamente en ácido carboxílico tras su administración. En determinados casos, el compuesto que contiene ácido carboxílico es la correspondiente forma activa. En determinadas realizaciones, un profármaco comprende un péptido corto (poliaminoácido) unido a un grupo ácido. En determinadas realizaciones de este tipo, el péptido se escinde tras su administración para formar la correspondiente forma activa.The compounds of the present disclosure can also be prepared as prodrugs. In certain embodiments, one or more compounds of the present disclosure are formulated as a prodrug. In certain Embodiments, upon in vivo administration, a prodrug is chemically converted to the most biologically, pharmaceutically, or therapeutically active form. In certain embodiments, prodrugs are useful because they are easier to administer than the corresponding active form. For example, in certain cases, a prodrug may be more bioavailable (eg, by oral administration) than the corresponding active form is. In certain cases, a prodrug may have improved solubility compared to the corresponding active form. In certain embodiments, the prodrugs are less soluble in water than the corresponding active form. In certain cases, these prodrugs have superior transmission through cell membranes, where solubility in water is detrimental to mobility. In certain embodiments, a prodrug is an ester. In certain such embodiments, the ester is metabolically hydrolyzed to carboxylic acid after administration. In certain cases, the carboxylic acid-containing compound is the corresponding active form. In certain embodiments, a prodrug comprises a short peptide (polyamino acid) attached to an acid group. In certain such embodiments, the peptide is cleaved upon administration to form the corresponding active form.
En determinadas realizaciones, un profármaco se produce modificando un compuesto farmacéuticamente activo de modo que el compuesto activo se regenerará tras su administración in vivo. El profármaco puede diseñarse para alterar la estabilidad metabólica o las características de transporte de un fármaco, para enmascarar los efectos secundarios o la toxicidad, para mejorar el aroma de un fármaco o para alterar otras características o propiedades de un fármaco. Como consecuencia del conocimiento de los procesos farmacológicos y el metabolismo de los fármacos in vivo, los expertos en la materia, una vez conozcan un compuesto farmacéuticamente activo, podrán diseñar profármacos del compuesto (véase, por ejemplo, Nogrady (1985) Medicinal Chemistry A Biochemical Approach, Oxford University Press, Nueva York, páginas 388-392).In certain embodiments, a prodrug is produced by modifying a pharmaceutically active compound so that the active compound will regenerate after administration in vivo . The prodrug can be designed to alter the metabolic stability or transport characteristics of a drug, to mask side effects or toxicity, to enhance the aroma of a drug, or to alter other characteristics or properties of a drug. As a consequence of the knowledge of the pharmacological processes and the metabolism of drugs in vivo , those skilled in the art, once they know a pharmaceutically active compound, will be able to design prodrugs of the compound (see, for example, Nogrady (1985) Medicinal Chemistry A Biochemical Approach, Oxford University Press, New York, pages 388-392).
Además, los compuestos de la presente divulgación, por ejemplo, las sales de los compuestos, pueden existir en su forma hidratada o no hidratada (la anhidra) o como solvatos con otras moléculas de disolvente. Ejemplos no limitantes de hidratos incluyen monohidratos, dihidratos, etc. Ejemplos no limitantes de solvatos incluyen solvatos de etanol, solvatos de acetona, etc.Furthermore, the compounds of the present disclosure, eg, the salts of the compounds, can exist in their hydrated or non-hydrated (the anhydrous) form or as solvates with other solvent molecules. Non-limiting examples of hydrates include monohydrates, dihydrates, etc. Non-limiting examples of solvates include ethanol solvates, acetone solvates, etc.
Algunos de los compuestos de la presente divulgación pueden existir en formas no solvatadas, así como solvatadas tales como, por ejemplo, hidratos.Some of the compounds of the present disclosure may exist in unsolvated as well as solvated forms such as, for example, hydrates.
"Solvato" significa una forma de adición de disolvente que contiene cantidades estequiométricas o no estequiométricas de disolvente. Algunos compuestos pueden tener una tendencia a atrapar una relación molar fija de moléculas de disolvente en el estado sólido cristalino, formando, por tanto, un solvato. Si el disolvente es agua, el solvato formado es un hidrato, cuando el disolvente es alcohol, el solvato formado es un alcoholato. Los hidratos se forman mediante la combinación de una o más moléculas de agua con una de las sustancias en que el agua retiene su estado molecular como H2O, pudiendo dicha combinación formar uno o más hidratos. En los hidratos, las moléculas de agua se unen a través de valencias secundarias mediante fuerzas intermoleculares, en particular, puentes de hidrógeno. Los hidratos sólidos contienen agua como la denominada agua cristalina en relaciones estequiométricas, donde las moléculas de agua no tienen que ser equivalentes con respecto a su estado de unión. Ejemplos de hidratos son sesquihidratos, monohidratos, dihidratos o trihidratos. Igual de adecuados son los hidratos de sales de los compuestos de la divulgación."Solvate" means a solvent addition form that contains stoichiometric or non-stoichiometric amounts of solvent. Some compounds may have a tendency to trap a fixed molar ratio of solvent molecules in the crystalline solid state, thus forming a solvate. If the solvent is water, the solvate formed is a hydrate, when the solvent is alcohol, the solvate formed is an alcoholate. Hydrates are formed by combining one or more water molecules with one of the substances in which water retains its molecular state as H2O, and this combination can form one or more hydrates. In hydrates, water molecules are linked through secondary valences by intermolecular forces, in particular hydrogen bonds. Solid hydrates contain water such as so-called crystalline water in stoichiometric ratios, where the water molecules do not have to be equivalent with respect to their binding state. Examples of hydrates are sesquihydrates, monohydrates, dihydrates, or trihydrates. Equally suitable are the hydrates of salts of the compounds of the disclosure.
La divulgación también incluye metabolitos de los compuestos descritos en este documento. Los metabolitos de compuestos químicos, ya sean inherentes o farmacéuticos, se forman como parte del proceso bioquímico natural de degradación y eliminación de los compuestos. La tasa de degradación de un compuesto es un determinante importante de la duración e intensidad de su acción. Perfilar los metabolitos de compuestos farmacéuticos, el metabolismo de los fármacos, es una parte importante del descubrimiento de fármacos, que da lugar a una comprensión de cualquier efecto secundario indeseable.The disclosure also includes metabolites of the compounds described herein. The metabolites of chemical compounds, whether inherent or pharmaceutical, are formed as part of the natural biochemical process of degradation and elimination of the compounds. The rate of degradation of a compound is an important determinant of the duration and intensity of its action. Profiling the metabolites of pharmaceutical compounds, drug metabolism, is an important part of drug discovery, leading to an understanding of any undesirable side effects.
Como se usa en este documento, el término "tratar", "que trata" o "tratamiento" significa disminuir los síntomas, marcadores y/o cualquier efecto negativo de una afección en cualquier grado apreciable en un paciente que actualmente tiene la afección. En algunas realizaciones, el tratamiento puede administrarse a un sujeto que muestra solamente signos iniciales de la afección con el fin de disminuir el riesgo de desarrollar la enfermedad, trastorno y/o afección.As used herein, the term "treating", "treating" or "treatment" means decreasing the symptoms, markers, and / or any negative effects of a condition to any appreciable degree in a patient who currently has the condition. In some embodiments, the treatment can be administered to a subject showing only early signs of the condition in order to decrease the risk of developing the disease, disorder, and / or condition.
Como se usa en este documento, el término "prevenir", "prevención" o "que previene" se refiere a cualquier método para prevenir parcial o completamente o retardar la aparición de uno o más síntomas o rasgos característicos de una enfermedad, trastorno y/o afección. El tratamiento de prevención puede administrarse a un sujeto que no muestra signos de una enfermedad, trastorno y/o afección.As used herein, the term "prevent", "prevention" or "preventing" refers to any method of partially or completely preventing or delaying the appearance of one or more symptoms or characteristic features of a disease, disorder and / or condition. The preventive treatment can be administered to a subject showing no signs of a disease, disorder, and / or condition.
La expresión "cantidad terapéuticamente eficaz", como se usa en este documento, se refiere a una cantidad de un agente farmacéutico para tratar, mejorar o prevenir una enfermedad o afección identificada, o para mostrar un efecto terapéutico o inhibidor detectable. El efecto puede detectarse mediante cualquier método de ensayo conocido en la técnica. Como se usa en este documento, "cantidad terapéuticamente eficaz" también puede significar esa cantidad necesaria para generar una mejora clínicamente observada en el paciente. En algunas realizaciones, la composición se formula de tal manera que comprende una cantidad que no provocaría uno o más efectos secundarios indeseados.The term "therapeutically effective amount", as used herein, refers to an amount of a pharmaceutical agent to treat, ameliorate, or prevent an identified disease or condition, or to display a detectable therapeutic or inhibitory effect. The effect can be detected by any test method known in the art. As used herein, "therapeutically effective amount" can also mean that amount necessary to generate a clinically observed improvement in the patient. In some embodiments, the composition it is formulated such that it comprises an amount that would not cause one or more unwanted side effects.
Una cantidad eficaz de un agente farmacéutico también puede significar esa que proporciona una mejora objetivamente identificable apreciada por el médico u otro observador cualificado. La cantidad eficaz precisa para un sujeto dependerá del peso corporal, tamaño y salud del sujeto; la naturaleza y grado de la afección; y el agente terapéutico o combinación de agentes terapéuticos seleccionados para su administración. Las cantidades terapéuticamente eficaces para un situación dada pueden determinarse mediante experimentación rutinaria, acorde a las habilidades y criterio del médico.An effective amount of a pharmaceutical agent can also mean that which provides an objectively identifiable improvement appreciated by the physician or other qualified observer. The precise effective amount for a subject will depend on the subject's body weight, size, and health; the nature and degree of the condition; and the therapeutic agent or combination of therapeutic agents selected for administration. Therapeutically effective amounts for a given situation can be determined by routine experimentation, according to the skill and judgment of the physician.
Como se usa en este documento, "sujeto" significa un ser humano o animal (en el caso de un animal, más típicamente un mamífero). En un aspecto, el sujeto es un ser humano. En un aspecto, el sujeto es masculino. En un aspecto, el sujeto es femenino.As used herein, "subject" means a human or animal (in the case of an animal, more typically a mammal). In one aspect, the subject is a human being. In one aspect, the subject is male. In one respect, the subject is female.
Los compuestos de la presente divulgación también pueden prepararse como ésteres, por ejemplo, ésteres farmacéuticamente aceptables. Por ejemplo, un grupo con función ácido carboxílico en un compuesto puede convertirse en su éster correspondiente, por ejemplo, un metilo, etilo u otro éster. Además, un grupo alcohol o hidroxilo en un compuesto puede convertirse en su éster correspondiente, por ejemplo, acetato, propionato u otros ésteres.The compounds of the present disclosure can also be prepared as esters, for example pharmaceutically acceptable esters. For example, a carboxylic acid functional group in a compound can be converted to its corresponding ester, eg, a methyl, ethyl, or other ester. Furthermore, an alcohol or hydroxyl group in a compound can be converted to its corresponding ester, for example, acetate, propionate, or other esters.
La presente divulgación incluye compuestos nuevos representados en general por la fórmula IB o fórmula II, o sales farmacéuticamente aceptables de los mismos, y métodos para la preparación y usos de los mismos.The present disclosure includes novel compounds generally represented by formula IB or formula II, or pharmaceutically acceptable salts thereof, and methods for the preparation and uses thereof.
Durante toda la descripción, cuando se describen composiciones que tienen, que incluyen o que comprenden componentes específicos, se contempla que las composiciones también consisten esencialmente en, o consisten en, los componentes enumerados.Throughout the description, when describing compositions having, including, or comprising specific components, it is contemplated that the compositions also consist essentially of, or consist of, the listed components.
CompuestosCompounds
La presente divulgación proporciona un compuesto de fórmula IB:The present disclosure provides a compound of formula IB:
y sales, solvatos, enantiómeros, diastereoisómeros, racematos o mezclas farmacéuticamente aceptables de los mismos, en la que:and pharmaceutically acceptable salts, solvates, enantiomers, diastereoisomers, racemates, or mixtures thereof, wherein:
A es:A is:
istal al resto RIB en A; istal to the RIB residue in A;
R11 y R12 son independientemente hidrógeno o alquilo C 1-C4, en el que el alquilo está opcionalmente sustituido con uno o más de halógeno, -OH, -SH o -NH2;R11 and R12 are independently hydrogen or C 1 -C4 alkyl, wherein the alkyl is optionally substituted with one or more of halogen, -OH, -SH, or -NH2;
X2 está ausente, es -O-, -C(O)O- u -OCH2-, en el que el átomo de oxígeno está distal al resto RIB en A;X2 is absent, it is -O-, -C (O) O- or -OCH2-, where the oxygen atom is distal to the RIB moiety in A;
cada RIB es independientemente hidrógeno, -alquilo C1-C6 ,each RIB is independently hydrogen, -C 1 -C 6 alkyl,
o RIB es un residuo aminoacídico unido mediante el grupo carbonilo, en el que el alquilo está opcionalmente sustituido con uno o más de halógeno, -OH, -SH o -NH2;or RIB is an amino acid residue linked via the carbonyl group, wherein the alkyl is optionally substituted with one or more of halogen, -OH, -SH or -NH2;
v es 0 o 1;v is 0 or 1;
n es 0, 1,2 o 3 y cuando X2 es -C(O)O-, n es 0;n is 0, 1,2 or 3 and when X2 is -C (O) O-, n is 0;
p es 2, 3, 4, 5, 6, 7, 8, 9, 10 u 11;p is 2, 3, 4, 5, 6, 7, 8, 9, 10, or 11;
q es 1,2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 o 18;q is 1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17 or 18;
Rz es hidrógeno, halógeno, -alquiltio C1-C4, -alcoxi C1-C4, -alquilo C1-C4, -alquenilo C2-C4, -alquinilo C2-C heteroarilo, -cicloalquilo C3-C8, -cicloalquenilo C4-C8 o heterociclo no aromático de 3 a 5 miembros, en el que cada alquiltio, alcoxi, alquilo, alquenilo, alquinilo, arilo, heteroarilo, cicloalquilo, cicloalquenilo o heterociclo está opcionalmente sustituido con uno o más de halógeno, -OH, -SH o -NH2;Rz is hydrogen, halogen, -C1-C4 alkylthio, -C1-C4 alkoxy, -C1-C4 alkyl, -C2-C4 alkenyl, -C2-C alkynyl heteroaryl, -C3-C8 cycloalkyl, -C4-C8 cycloalkenyl or heterocycle 3 to 5 membered non-aromatic, wherein each alkylthio, alkoxy, alkyl, alkenyl, alkynyl, aryl, heteroaryl, cycloalkyl, cycloalkenyl, or heterocycle is optionally substituted with one or more of halogen, -OH, -SH, or -NH2;
Ra, Rb, Rx y Ry cada uno se selecciona independientemente del grupo que consiste en hidrógeno, halógeno, -OH, -SH, -alcoxi C1-C6, ariloxi, -alquiltio C1-C6, ariltio, -OC(O)alquilo C1-C6, -OC(O)arilo, -alquilo C1-C6, -alquenilo alquinilo C2-C6, arilo, heteroarilo, -cicloalquilo C3-C8 y -cicloalquenilo C4-C8, en el que cada alcoxi, ariloxi, alquiltio, Ra, Rb, Rx, and Ry are each independently selected from the group consisting of hydrogen, halogen, -OH, -SH, -C1-C6 alkoxy, aryloxy, -C1-C6 alkylthio, arylthio, -OC (O) C1 alkyl -C6, -OC (O) aryl, -C1-C6 alkyl, -C2-C6 alkynyl, aryl, heteroaryl, -C3-C8 cycloalkyl and -C4-C8 cycloalkenyl, wherein each alkoxy, aryloxy, alkylthio,
ariltio, alquilo, arilo, alquenilo, alquinilo, heteroarilo, cicloalquilo o cicloalquenilo está opcionalmente sustituido con uno o más de halógeno, -OH, -SH o -NH2;arylthio, alkyl, aryl, alkenyl, alkynyl, heteroaryl, cycloalkyl, or cycloalkenyl is optionally substituted with one or more of halogen, -OH, -SH, or -NH2;
o dos Ra o Rb cualesquiera, junto con el átomo al que están unidos ambos, pueden combinarse para formar un espirocicloalquilo C3-C8 o espiroheterociclo de 3 a 8 miembros;or any two Ra or Rb, together with the atom to which they are both attached, can combine to form a 3 to 8 membered spirocycloalkyl or spiroheterocycle;
o dos Ra o Rb cualesquiera, cuando están en átomos adyacentes, pueden combinarse para formar un doble enlace carbono-carbono o un triple enlace carbono-carbono cis o trans; or any two Ra or Rb, when on adjacent atoms, can combine to form a carbon-carbon double bond or a cis or trans carbon-carbon triple bond;
o dos Ra o Rb cualesquiera, cuando están en átomos adyacentes, pueden combinarse para formar un arilo, heteroarilo, -cicloalquilo C3-C10, -cicloalquenilo C4-C10 o heterociclo de 5 a 10 miembros en el anillo;or any two Ra or Rb, when on adjacent atoms, may combine to form an aryl, heteroaryl, -C3-C10 -cycloalkyl, -C4-C10 -cycloalkenyl, or 5- to 10-membered ring-membered heterocycle;
o cualquier CRaRb puede remplazarse por -O-, -S-, -S(O)- o -SO2-;or any CRaRb can be replaced by -O-, -S-, -S (O) - or -SO2-;
o dos Rx o Ry cualesquiera, junto con el átomo al que están unidos ambos, pueden combinarse para formar un -espirocicloalquilo C3-C8 o espiroheterociclo de 3 a 8 miembros;or any two Rx or Ry, together with the atom to which they are both attached, may combine to form a 3- to 8-membered -spyrocycloalkyl or spiroheterocycle;
o dos Rx o Ry cualesquiera, cuando están en átomos adyacentes, pueden combinarse para formar un doble enlace carbono-carbono o un triple enlace carbono-carbono cis o trans; or any two Rx or Ry, when on adjacent atoms, can combine to form a carbon-carbon double bond or a cis or trans carbon-carbon triple bond;
o dos Rx o Ry cualesquiera, cuando están en átomos adyacentes, pueden combinarse para formar un arilo, heteroarilo, -cicloalquilo C3-C10, -cicloalquenilo C4-C10 o heterociclo de 5 a 10 miembros en el anillo;or any two Rx or Ry, when on adjacent atoms, may combine to form an aryl, heteroaryl, -C3-C10 -cycloalkyl, -C4-C10 -cycloalkenyl, or 5- to 10-membered ring heterocycle;
o cualquier CRxRy puede remplazarse por -O-, -S-, -S(O)- o -SO2-;or any CRxRy can be replaced by -O-, -S-, -S (O) - or -SO2-;
R1 y R45 cada uno es independientemente hidrógeno, halógeno, -N3, -OH, -NH2, -SH, -alquilo C1-C6, -cicloalquilo C3-C6, -alquenilo C2-C6, -cicloalquenilo C4-C8, -alquinilo C2-C6, -cicloalquinilo C8-C12, -alcoxi C1-C6 o -alquiltio C1-C6, en el que cada alquilo, cicloalquilo, alquenilo, cicloalquenilo, alquinilo, cicloalquinilo, alcoxi o alquiltio está independientemente sustituido con uno o más de halógeno, -N3, -OH, -NH2 o -SH;R1 and R45 are each independently hydrogen, halogen, -N3, -OH, -NH2, -SH, -C1-C6 alkyl, -C3-C6 cycloalkyl, -C2-C6 alkenyl, -C4-C8 cycloalkenyl, -C2 alkynyl -C6, -C8-C12 cycloalkynyl, -C1-C6 alkoxy, or -C1-C6 alkylthio, wherein each alkyl, cycloalkyl, alkenyl, cycloalkenyl, alkynyl, cycloalkynyl, alkoxy, or alkylthio is independently substituted with one or more halogen, -N3, -OH, -NH2 or -SH;
R2, R3, R4 y R44 cada uno es independientemente hidrógeno, halógeno, -N3, -OH, -NH2, -SH, -alquilo C1-C6, -alcoxi C1-C6 o -alquiltio C1-C6, en el que cada alquilo, alcoxi o alquiltio está opcionalmente sustituido con uno o más de halógeno, -N3, -OH, -NH2 o -SH;R2, R3, R4, and R44 are each independently hydrogen, halogen, -N3, -OH, -NH2, -SH, -C1-C6 alkyl, -C1-C6 alkoxy, or -C1-C6 alkylthio, wherein each alkyl , alkoxy or alkylthio is optionally substituted with one or more of halogen, -N3, -OH, -NH2 or -SH;
o R3 y uno de R4 y R44, junto con los átomos a los que están unidos pueden formar un doble enlace carbono-carbono; R5 es independientemente hidrógeno, -RIB, M+, arilo, aralquilo, -alquilo C1-C6, -heteroalquilo C1-C6, cicloalquilo, anillo heterocíclico no aromático o heteroarilo, en el que M+ es un catión y en el que cada arilo, aralquilo, alquilo, heteroalquilo, cicloalquilo, heterociclo o heteroarilo está opcionalmente sustituido con uno o más de halógeno, -N3, -OH, -NH2 o -SH, y en el que R5 no es un aminoácido; yor R3 and one of R4 and R44, together with the atoms to which they are attached may form a carbon-carbon double bond; R5 is independently hydrogen, -RIB, M +, aryl, aralkyl, -C1-C6 alkyl, -C1-C6 heteroalkyl, cycloalkyl, non-aromatic heterocyclic ring, or heteroaryl, wherein M + is a cation and wherein each aryl, aralkyl , alkyl, heteroalkyl, cycloalkyl, heterocycle, or heteroaryl is optionally substituted with one or more of halogen, -N3, -OH, -NH2, or -SH, and wherein R5 is not an amino acid; Y
Rc es -alquilo C1-C6, -cicloalquilo C3-C6, -alquenilo C2-C6, -cicloalquenilo C4-C8, -alquinilo C2-C6, -cicloalquinilo C8-C12 o arilo, en el que cada alquilo, cicloalquilo, alquenilo, cicloalquenilo o arilo está opcionalmente sustituido con uno o más de halógeno, -N3, -OH, -NH2 o -SH.Rc is -C1-C6 alkyl, -C3-C6 cycloalkyl, -C2-C6 alkenyl, -C4-C8 cycloalkenyl, -C2-C6 alkynyl, -C8-C12 cycloalkynyl or aryl, wherein each alkyl, cycloalkyl, alkenyl, Cycloalkenyl or aryl is optionally substituted with one or more of halogen, -N3, -OH, -NH2, or -SH.
En algunas realizaciones, A se selecciona de A1 a A14:In some embodiments, A is selected from A1 to A14:
En algunas realizaciones, A esIn some embodiments, A is
En al unas realizaciones, A esIn some embodiments, A is
En algunas realizaciones, A esIn some embodiments, A is
En algunas realizaciones, Ri es -H. En algunas realizaciones, R2 es -OH. En algunas realizaciones, R4 es -OH. En algunas realizaciones, R3 es -H. En algunas realizaciones, R44 es -H. En algunas realizaciones, RIB es -H. En algunas realizaciones, Rc es -CH3. En algunas realizaciones, v es 1, X2 es -O-, n es 0 y RIB es -H. En algunas realizaciones, R5 es -H o M+, en el que M+ es Na+, Li+, K+, C a2+, Mg2+ o NRgRdReRf+, y en el que Rg, Rd, Re y Rf cada uno es independientemente hidrógeno o -alquilo C1-C5.In some embodiments, Ri is -H. In some embodiments, R2 is -OH. In some embodiments, R4 is -OH. In some embodiments, R3 is -H. In some embodiments, R44 is -H. In some embodiments, RIB is -H. In some embodiments, Rc is -CH3. In some embodiments, v is 1, X2 is -O-, n is 0, and RIB is -H. In some embodiments, R5 is -H or M +, where M + is Na +, Li +, K +, C a2 +, Mg2 +, or NRgRdReRf +, and where Rg, Rd, Re, and Rf are each independently hydrogen or -C1- alkyl C5.
En una o más realizaciones, RIB se selecciona de: -H, In one or more embodiments, RIB is selected from: -H,
En una o más realizaciones, el compuesto es de fórmula l-a:In one or more embodiments, the compound is of formula l-a:
o una sal, solvato, enantiómero, diastereoisómero, racemato o mezcla farmacéuticamente aceptable del mismo. En una o más realizaciones, el compuesto es de fórmula l-b:or a pharmaceutically acceptable salt, solvate, enantiomer, diastereoisomer, racemate, or mixture thereof. In one or more embodiments, the compound is of formula l-b:
o una sal, solvato, enantiómero, diastereoisómero, racemato o mezcla farmacéuticamente aceptable del mismo. En una o más realizaciones, el compuesto es de fórmula l-c:or a pharmaceutically acceptable salt, solvate, enantiomer, diastereoisomer, racemate, or mixture thereof. In one or more embodiments, the compound is of formula l-c:
o una sal, solvato, enantiómero, diastereoisómero, racemato o mezcla farmacéuticamente aceptable del mismo. or a pharmaceutically acceptable salt, solvate, enantiomer, diastereoisomer, racemate, or mixture thereof.
En una o más realizaciones, el compuesto es de fórmula l-d:In one or more embodiments, the compound is of formula l-d:
o una sal, solvato, enantiómero, diastereoisómero, racemato o mezcla farmacéuticamente aceptable del mismo.or a pharmaceutically acceptable salt, solvate, enantiomer, diastereoisomer, racemate, or mixture thereof.
En una o más realizaciones, el compuesto de la divulgación es compuesto 1:In one or more embodiments, the compound of the disclosure is compound 1:
(compuesto 1; 4-am¡no-7-((2R,3R,4S,5R)-3,4-d¡h¡drox¡-5-(h¡drox¡metil)tetrah¡drofurano-2-¡l)-2-met¡l-7H-p¡rrolo[2,3-d]pirimidin-5-carboxamida) o una sal, solvato, enantiómero, diastereoisómero, racemato o mezcla farmacéuticamente aceptable del mismo.(Compound 1; 4-amino-7 - ((2R, 3R, 4S, 5R) -3,4-d¡hydrox¡-5- (hydrox¡methyl) tetrahydrofuran-2-¡ l) -2-methyl-7H-pyrrolo [2,3-d] pyrimidine-5-carboxamide) or a pharmaceutically acceptable salt, solvate, enantiomer, diastereoisomer, racemate or mixture thereof.
En una o más realizaciones, el compuesto de la divulgación es compuesto 1 -trifosfato (compuesto 1-TP o compuesto 1-PPP) o una sal, solvato, enantiómero, diastereoisómero, racemato o mezcla farmacéuticamente aceptable del mismo:In one or more embodiments, the compound of the disclosure is 1-triphosphate compound (1-TP compound or 1-PPP compound) or a pharmaceutically acceptable salt, solvate, enantiomer, diastereoisomer, racemate or mixture thereof:
En una o más realizaciones, el compuesto de la divulgación se selecciona de: In one or more embodiments, the compound of the disclosure is selected from:
o una sal, solvato, enantiómero, diastereoisómero, racemato o mezcla farmacéuticamente aceptable del mismo. En una o más realizaciones, el compuesto de la divulgación se selecciona de:or a pharmaceutically acceptable salt, solvate, enantiomer, diastereoisomer, racemate, or mixture thereof. In one or more embodiments, the compound of the disclosure is selected from:
o una sal, solvato, enantiómero, diastereoisómero, racemato o mezcla farmacéuticamente aceptable del mismo. En una o más realizaciones, el compuesto de la divulgación se selecciona de:or a pharmaceutically acceptable salt, solvate, enantiomer, diastereoisomer, racemate, or mixture thereof. In one or more embodiments, the compound of the disclosure is selected from:
o una sal, solvato, enantiómero, diastereoisómero, racemato o mezcla farmacéuticamente aceptable del mismo En una o más realizaciones, el compuesto de la divulgación se selecciona de: or a pharmaceutically acceptable salt, solvate, enantiomer, diastereoisomer, racemate, or mixture thereof. In one or more embodiments, the compound of the disclosure is selected from:
Ċ Ċ
En una o más realizaciones, el compuesto de la divulgación se selecciona de:In one or more embodiments, the compound of the disclosure is selected from:
o una sal, solvato, enantiómero, diastereoisómero, racemato o mezcla farmacéuticamente aceptable del mismo. or a pharmaceutically acceptable salt, solvate, enantiomer, diastereoisomer, racemate, or mixture thereof.
En algunas realizaciones, la presente divulgación proporciona un compuesto como se describe en este documento para su uso en el tratamiento de una enfermedad.In some embodiments, the present disclosure provides a compound as described herein for use in treating a disease.
En algunas realizaciones, la presente divulgación proporciona el compuestoIn some embodiments, the present disclosure provides the compound
para su uso en el tratamiento de una enfermedad. En algunas realizaciones, la enfermedad es una enfermedad vírica. En algunas realizaciones, la infección vírica es infección por norovirus.for use in treating a disease. In some embodiments, the disease is a viral disease. In some embodiments, the viral infection is norovirus infection.
En algunas realizaciones, el compuesto de la divulgación se selecciona de compuesto 1,2, 3, 4, 5, 6, 71, 77, 76, 107, 111, 126, 133, 137, 139, 141, 143 o 145, o una sal, solvato, enantiómero, diastereoisómero, racemato o mezcla farmacéuticamente aceptable del mismo, o cualquier combinación de los mismos.In some embodiments, the compound of the disclosure is selected from compound 1,2, 3, 4, 5, 6, 71, 77, 76, 107, 111, 126, 133, 137, 139, 141, 143, or 145, or a pharmaceutically acceptable salt, solvate, enantiomer, diastereoisomer, racemate or mixture thereof, or any combination thereof.
Métodos de síntesisSynthesis methods
Los compuestos de la presente divulgación pueden prepararse mediante una diversidad de métodos, incluyendo química convencional. Las rutas sintéticas adecuadas se representan en los esquemas dados a continuación.The compounds of the present disclosure can be prepared by a variety of methods, including conventional chemistry. Suitable synthetic routes are represented in the schemes given below.
Los compuestos descritos en este documento (por ejemplo, compuestos de fórmula IB o fórmula II) pueden prepararse por métodos conocidos en la técnica de síntesis orgánica como se expone, en parte, por los siguientes esquemas sintéticos y ejemplos. En los esquemas descritos a continuación, está bien comprendido que se emplean grupos protectores para grupos sensibles o reactivos donde es necesario de acuerdo con los principios generales de química. Los grupos protectores se manipulan de acuerdo con métodos convencionales de síntesis orgánica (T. W. Greene y P. G. M. Wuts, "Protective Groups in Organic Synthesis", tercera edición, Wiley, Nueva York 1999). Estos grupos se retiran en una fase conveniente de la síntesis del compuesto usando métodos que son muy evidentes para los expertos en la materia. Los procesos de selección, así como las condiciones de reacción y el orden de su ejecución, deben ser coherentes con la preparación de compuestos de fórmula IB o fórmula IIThe compounds described herein (eg, compounds of formula IB or formula II) can be prepared by methods known in the art of organic synthesis as set forth, in part, by the following synthetic schemes and examples. In the schemes described below, it is well understood that protecting groups are employed for sensitive or reactive groups where necessary in accordance with general principles of chemistry. Protecting groups are manipulated according to conventional methods of organic synthesis (T. W. Greene and P. G. M. Wuts, "Protective Groups in Organic Synthesis", third edition, Wiley, New York 1999). These groups are removed at a convenient stage in the synthesis of the compound using methods that are well apparent to those of skill in the art. The selection processes, as well as the reaction conditions and the order of their execution, must be consistent with the preparation of compounds of formula IB or formula II.
Los expertos en la materia reconocerán si existe un estereocentro en los compuestos de fórmula IB o fórmula II. Por consiguiente, la presente divulgación incluye ambos posibles estereoisómeros (salvo que se especifique en la síntesis) e incluye no solamente los compuestos racémicos, sino también los enantiómeros y/o diastereoisómeros individuales. Cuando se desea un compuesto como un solo enantiómero o diastereoisómero, puede obtenerse por síntesis estereoespecífica o por resolución del producto final o cualquier intermedio conveniente. La resolución del producto final, un intermedio o un material de partida puede lograrse por cualquier método adecuado conocido en la técnica. Véase, por ejemplo, "Stereochemistry of Organic Compounds" de E. L. Eliel, S. H. Wilen y L. N. Mander (Wileylnterscience, 1994).Those skilled in the art will recognize whether a stereocenter exists in compounds of formula IB or formula II. Accordingly, the present disclosure includes both possible stereoisomers (unless specified in the synthesis) and includes not only racemic compounds, but also individual enantiomers and / or diastereoisomers. When a compound is desired as a single enantiomer or diastereoisomer, it can be obtained by stereospecific synthesis or by resolution of the final product or any convenient intermediate. Resolution of the final product, an intermediate or a starting material can be achieved by any suitable method known in the art. See, for example, "Stereochemistry of Organic Compounds" by E. L. Eliel, S. H. Wilen, and L. N. Mander (Wileylnterscience, 1994).
Los compuestos descritos en este documento pueden prepararse a partir de materiales de partida disponibles en el mercado o sintetizarse usando procesos orgánicos, inorgánicos y/o enzimáticos conocidos.The compounds described herein can be prepared from commercially available starting materials or synthesized using known organic, inorganic and / or enzymatic processes.
Esquema 1: Síntesis general de compuestos de la invención Scheme 1: General synthesis of compounds of the invention
Como se muestra anteriormente en el esquema 1, puede yodarse 4-cloro-2-metil-7H-pirrolo[2,3-d]pirimidina (a; numeración del esquema 1) en presencia de N-yodosuccinimida (NIS). La 4-cloro-5-yodo-2-metil-7H-pirrolo[2,3-d]pirimidina resultante (b) puede tratarse con un furano protegido (c) como se muestra en la etapa 2 para dar el compuesto (d). La sustitución de radicales de (d) da el derivado ciano correspondiente (e) que puede experimentar desprotección y sustitución aromática nucleófila en el carbono unido a cloro para dar el derivado amina (f). Finalmente, la hidratación del nitrilo de (f) da 4-amino-7-((2R,3R,4S,5R)-3,4-dihidroxi-5-(hidroximetil)tetrahidrofuran-2-il)-2-metil-7H-pirrolo[2,3-d]pirimidin-5-carboxamida (1).As shown above in Scheme 1, 4-chloro-2-methyl-7H-pyrrolo [2,3-d] pyrimidine ( a ; numbering from Scheme 1) can be iodinated in the presence of N-iodosuccinimide (NIS). The resulting 4-chloro-5-iodo-2-methyl-7H-pyrrolo [2,3-d] pyrimidine ( b ) can be treated with a protected furan ( c ) as shown in step 2 to give compound ( d ). Radical substitution of ( d ) gives the corresponding cyano derivative ( e ) which can undergo deprotection and nucleophilic aromatic substitution at the chlorine-bound carbon to give the amine derivative ( f ). Finally, hydration of the nitrile of ( f ) gives 4-amino-7 - ((2R, 3R, 4S, 5R) -3,4-dihydroxy-5- (hydroxymethyl) tetrahydrofuran-2-yl) -2-methyl- 7H-pyrrolo [2,3-d] pyrimidine-5-carboxamide ( 1 ).
Esquema 2: Síntesis general de compuestos de la invenciónScheme 2: General synthesis of compounds of the invention
Etapa 1: 4-Amino-6-bromo-2-metil-7H-pirrolo[2,3-d]pirimidin-5-carbonitrilo, dibenzoato de (3R,4R,5R)-2-acetoxi-5-((benzoiloxi)metil)tetrahidrofuran-3,4-diilo y DCE se cargaron en un reactor. Se inició la agitación y se añadió DBU. Se añadió lentamente TMSOTf (8,01 kg). La mezcla de reacción se diluyó con DCM y se inactivó lentamente con agua mientras se enfriaba. La reacción se extrajo con DCM (19,90 kg) y se lavó con NaHCO3 sat. La fase acuosa se extrajo adicionalmente con DCM (19,71 kg) y se lavó con salmuera.Step 1: 4-Amino-6-bromo-2-methyl-7H-pyrrolo [2,3-d] pyrimidine-5-carbonitrile, (3R, 4R, 5R) -2-acetoxy-5 - ((benzoyloxy) dibenzoate ) methyl) tetrahydrofuran-3,4-diyl and DCE were charged into a reactor. Stirring was started and DBU was added. TMSOTf (8.01 kg) was added slowly. The reaction mixture was diluted with DCM and slowly quenched with water while cooling. The reaction was extracted with DCM (19.90 kg) and washed with sat. NaHCO3. The aqueous phase was further extracted with DCM (19.71 kg) and washed with brine.
Etapa 2: En un reactor se cargaron dibenzoato de (2R,3R,4R,5R)-2-(4-amino-6-bromo-5-ciano-2-metil-7H-pirrolo[2,3-d]pirimidin-7-il)-5-((benzoiloxi)metil)tetrahidrofuran-3,4-diilo, Pd al 10 % sobre C y THF. Se envió hidrógeno al reactor y la mezcla se agitó durante aproximadamente 4 horas a temperatura ambiente a aproximadamente 212,35 kPa (31 psi).Step 2: (2R, 3R, 4R, 5R) -2- (4-amino-6-bromo-5-cyano-2-methyl-7H-pyrrolo [2,3-d] pyrimidine dibenzoate was charged into a reactor -7-yl) -5 - ((benzoyloxy) methyl) tetrahydrofuran-3,4-diyl, 10% Pd on C and THF. Hydrogen was sent to the reactor and the mixture was stirred for about 4 hours at room temperature at about 212.35 kPa (31 psi).
La mezcla de reacción se filtró sobre Celite (7,2 kg) y un filtro de pulido y el residuo del filtro se lavó con THF. El filtrado y el lavado combinados se transfirieron a un reactor encamisado de 100 l con la ayuda de un lavado con THF. Los contenidos del reactor se destilaron al vacío con una temperatura discontinua máxima de 30,0 °C durante un periodo de aproximadamente 6 horas hasta un volumen final de 27 l. Se cargó IPA en el reactor. Los contenidos del reactor se destilaron al vacío. Se cargó IPA en el reactor. Los contenidos del reactor se calentaron hasta aproximadamente 60 °C, se agitaron y se enfriaron lentamente hasta aproximadamente 5 °C. Se continuó la agitación en frío durante un periodo de aproximadamente 9 h con una temperatura mínima de aproximadamente 1 °C. La suspensión se filtró y se lavó con IPA. El residuo se secó al vacío con una purga de nitrógeno para proporcionar un LOD de un 0,36 %. Rendimiento: (73,9 %). La RMN de 1H confirma la estructura. Pureza: 97,78 % (HPLC, ABC).The reaction mixture was filtered over Celite (7.2 kg) and a filter polish and the filter residue was washed with THF. The combined filtrate and wash were transferred to a 100 L jacketed reactor with the aid of a THF wash. The reactor contents were vacuum distilled with a maximum batch temperature of 30.0 ° C for a period of approximately 6 hours to a final volume of 27 L. IPA was loaded into the reactor. The contents of the reactor were vacuum distilled. IPA was loaded into the reactor. The reactor contents were heated to about 60 ° C, stirred and slowly cooled to about 5 ° C. Cold stirring was continued for a period of approximately 9 h with a minimum temperature of approximately 1 ° C. The suspension was filtered and washed with IPA. The residue was dried under vacuum with a nitrogen purge to provide a LOD of 0.36%. Yield: (73.9%). 1H NMR confirms the structure. Purity: 97.78% (HPLC, ABC).
Etapa 3: Una solución de dibenzoato de (2R,3R,4R,5R)-2-(4-amino-5-ciano-2-metil-7H-pirrolo[2,3-d]pirimidin-7-il)-5-((benzoiloxi)metil)tetrahidrofuran-3,4-diilo y THF se calentó y se inició la adición de NaOH. La adición inicial dio una mezcla bifásica y respuesta endotérmica, pero según continuó la adición se formó una solución transparente de una sola fase que estuvo acompañada de una exotermia rápida; la temperatura de reacción se mantuvo durante el resto de la adición y durante ~2 A h adicionales. La IPC mostró que no quedaba dibenzoato de (2R,3R,4R,5R)-2-(4-amino-5-ciano-2-metil-7H-pirrolo[2,3-d]pirimidin-7-il)-5-((benzoiloxi)metil)tetrahidrofuran-3,4-diilo.Step 3: A dibenzoate solution of (2R, 3R, 4R, 5R) -2- (4-amino-5-cyano-2-methyl-7H-pyrrolo [2,3-d] pyrimidin-7-yl) - 5 - ((benzoyloxy) methyl) tetrahydrofuran-3,4-diyl and THF was heated and the addition of NaOH was started. The initial addition gave a biphasic mixing and endothermic response, but as the addition continued a clear single phase solution formed which was accompanied by a rapid exotherm; the reaction temperature was maintained for the remainder of the addition and for an additional ~ 2 h. IPC showed that no (2R, 3R, 4R, 5R) -2- (4-amino-5-cyano-2-methyl-7H-pyrrolo [2,3-d] pyrimidin-7-yl) - dibenzoate remained 5 - ((benzoyloxy) methyl) tetrahydrofuran-3,4-diyl.
La mezcla de reacción se enfrió hasta 21 °C y se neutralizó con HCl 3 N con enfriamiento externo hasta pH neutro. La mezcla continuó enfriándose y la mezcla neutralizada resultante se destiló al vacío hasta que se observó aparición de sólidos en el recipiente. La suspensión se enfrió y se agitó durante aproximadamente 2 h a aproximadamente 2 °C. La suspensión beis se filtró para producir un filtrado oscuro; el residuo blanquecino se lavó una vez con agua fría. The reaction mixture was cooled to 21 ° C and neutralized with 3N HCl with external cooling to neutral pH. The mixture continued to cool and the resulting neutralized mixture was vacuum distilled until solids were observed in the vessel. The suspension was cooled and stirred for about 2 h at about 2 ° C. The beige suspension was filtered to produce a dark filtrate; the off-white residue was washed once with cold water.
En determinadas realizaciones, los compuestos de la divulgación, por ejemplo, fórmula IB o fórmula II, pueden prepararse como enantiómeros, diastereoisómeros y racematos. En algunas realizaciones, los compuestos de la divulgación, por ejemplo, fórmula IB o fórmula II, incluyen todas las formas isoméricas (por ejemplo, enantioméricas, diastereoisoméricas y geométricas (o conformacionales)) de la estructura; por ejemplo, las configuraciones R y S para cada centro asimétrico, isómeros de doble enlace (Z) y (E), e isómeros conformacionales (Z) y (E). Por lo tanto, los isómeros estereoquímicos individuales, así como las mezclas enantioméricas, diastereoisoméricas y geométricas (o conformacionales) de los presentes compuestos están dentro del alcance de la divulgación. Salvo que se indique de otro modo, todas las formas tautoméricas de los compuestos divulgados en este documento están dentro del alcance de la divulgación.In certain embodiments, compounds of the disclosure, eg, formula IB or formula II, can be prepared as enantiomers, diastereoisomers, and racemates. In some embodiments, the compounds of the disclosure, eg, formula IB or formula II, include all isomeric (eg, enantiomeric, diastereoisomeric, and geometric (or conformational)) forms of the structure; for example, the R and S configurations for each asymmetric center, double bond isomers (Z) and (E), and conformational isomers (Z) and (E). Therefore, individual stereochemical isomers, as well as enantiomeric, diastereoisomeric, and geometric (or conformational) mixtures of the present compounds are within the scope of the disclosure. Unless otherwise indicated, all tautomeric forms of the compounds disclosed herein are within the scope of the disclosure.
Los compuestos de la divulgación, por ejemplo, fórmula IB o fórmula II, pueden sintetizarse sustancialmente sin impurezas. Los compuestos de la divulgación son más que o igual que aproximadamente un 99 % p/p puros. En determinadas realizaciones, los ésteres fosfonato pueden prepararse a gran escala, por ejemplo, a escala de producción industrial en lugar de a escala experimental/de laboratorio. Por ejemplo, un proceso de tipo discontinuo de acuerdo con los métodos de la divulgación permite la preparación de lotes de al menos 1 g, o al menos 5 g, o al menos 10 g, o al menos 100 g, o al menos 1 kg, o al menos 100 kg de producto de éster fosfonato. Además, los métodos permiten la preparación de un producto de éster fosfonato que tiene una pureza de al menos un 98 %, o al menos un 98,5 %, medida por HPLC. En realizaciones preferidas, estos productos se obtienen en una secuencia de reacción que no implica purificación por cualquier forma de cromatografía (por ejemplo, cromatografía de gases, HPLC, LC preparativa, cromatografía por exclusión de tamaño y similares).Compounds of the disclosure, eg, formula IB or formula II, can be synthesized with substantially no impurities. The compounds of the disclosure are greater than or equal to about 99% w / w pure. In certain embodiments, the phosphonate esters can be prepared on a large scale, eg, on an industrial production scale rather than on an experimental / laboratory scale. For example, a batch type process according to the methods of the disclosure allows the preparation of batches of at least 1 g, or at least 5 g, or at least 10 g, or at least 100 g, or at least 1 kg. , or at least 100 kg of phosphonate ester product. Furthermore, the methods allow the preparation of a phosphonate ester product having a purity of at least 98%, or at least 98.5%, as measured by HPLC. In preferred embodiments, these products are obtained in a reaction sequence that does not involve purification by any form of chromatography (eg, gas chromatography, HPLC, preparative LC, size exclusion chromatography, and the like).
Composiciones farmacéuticas y métodos de tratamientoPharmaceutical compositions and treatment methods
Como se expone anteriormente, en este documento se proporcionan composiciones farmacéuticas que comprenden compuestos de la divulgación (por ejemplo, fórmula IB o fórmula II) o sales farmacéuticamente aceptables de los mismos. En algunas realizaciones, la presente divulgación proporciona composiciones farmacéuticas que comprenden compuestos de fórmula IB o fórmula II o sales farmacéuticamente aceptables de los mismos y un vehículo y/o diluyente farmacéuticamente aceptable. En algunas realizaciones, la presente divulgación proporciona compuestos de fórmula IB o fórmula II formulados como una composición farmacéutica. En una realización, los compuestos de fórmula IB o fórmula II se formulan como un comprimido. En otra realización, los compuestos de fórmula IB o fórmula II se formulan como una suspensión.As set forth above, provided herein are pharmaceutical compositions comprising compounds of the disclosure (eg, formula IB or formula II) or pharmaceutically acceptable salts thereof. In some embodiments, the present disclosure provides pharmaceutical compositions comprising compounds of formula IB or formula II or pharmaceutically acceptable salts thereof and a pharmaceutically acceptable carrier and / or diluent. In some embodiments, the present disclosure provides compounds of formula IB or formula II formulated as a pharmaceutical composition. In one embodiment, the compounds of formula IB or formula II are formulated as a tablet. In another embodiment, the compounds of formula IB or formula II are formulated as a suspension.
Pueden encontrarse técnicas para la formulación y administración de los compuestos divulgados en Remington: the Science and Practice of Pharmacy, 22.a edición, Pharmaceutical Press (2012).Techniques for the formulation and administration of the disclosed compounds can be found in Remington: the Science and Practice of Pharmacy, 22nd edition, Pharmaceutical Press (2012).
En una realización, los compuestos descritos en este documento, y las sales farmacéuticamente aceptables de los mismos, se usan en preparaciones farmacéuticas en combinación con un vehículo o diluyente farmacéuticamente aceptable. Los vehículos farmacéuticamente aceptables adecuados incluyen rellenos sólidos inertes o diluyentes y soluciones acuosas u orgánicas estériles. Los compuestos estarán presentes en dichas composiciones farmacéuticas en cantidades suficientes para proporcionar la cantidad de dosificación deseada en el intervalo descrito anteriormente. In one embodiment, the compounds described herein, and the pharmaceutically acceptable salts thereof, are used in pharmaceutical preparations in combination with a pharmaceutically acceptable carrier or diluent. Suitable pharmaceutically acceptable carriers include inert solid fillers or diluents and sterile aqueous or organic solutions. The compounds will be present in such pharmaceutical compositions in amounts sufficient to provide the desired dosage amount in the range described above.
Los compuestos de la divulgación, por ejemplo, compuestos de fórmula IB o fórmula II o sales farmacéuticamente aceptables de los mismos descritos en este documento pueden combinarse con un vehículo farmacéuticamente aceptable de acuerdo con técnicas de composición farmacéutica convencionales. Además, el vehículo puede adoptar una amplia diversidad de formas dependiendo de la forma de la preparación deseada para administración, por ejemplo, oral, nasal, rectal, vaginal, parenteral (incluyendo inyecciones o infusiones intravenosas). En la preparación de las composiciones para forma farmacéutica oral puede emplearse cualquiera de los medios farmacéuticos usuales. Los medios farmacéuticos usuales incluyen, por ejemplo, agua, glicoles, aceites, alcoholes, agentes aromatizantes, conservantes, agentes colorantes y similares en el caso de preparaciones líquidas orales (tales como, por ejemplo, suspensiones, soluciones, emulsiones y elixires); aerosoles; o vehículos tales como almidones, glúcidos, celulosa microcristalina, diluyentes, agentes de granulación, lubricantes, aglutinantes, agentes disgregantes y similares, en el caso de preparaciones sólidas orales (tales como, por ejemplo, polvos, cápsulas y comprimidos).The compounds of the disclosure, for example, compounds of formula IB or formula II or pharmaceutically acceptable salts thereof described herein can be combined with a pharmaceutically acceptable carrier in accordance with conventional pharmaceutical compounding techniques. Furthermore, the vehicle can take a wide variety of forms depending on the form of the preparation desired for administration, for example, oral, nasal, rectal, vaginal, parenteral (including intravenous injections or infusions). Any of the usual pharmaceutical media can be used in the preparation of the compositions for oral dosage form. Usual pharmaceutical media include, for example, water, glycols, oils, alcohols, flavoring agents, preservatives, coloring agents and the like in the case of oral liquid preparations (such as, for example, suspensions, solutions, emulsions and elixirs); aerosol sprays; or vehicles such as starches, carbohydrates, cellulose microcrystalline, diluents, granulating agents, lubricants, binders, disintegrating agents and the like, in the case of solid oral preparations (such as, for example, powders, capsules and tablets).
En otra realización, la divulgación proporciona un compuesto de fórmula IB o fórmula II o sales farmacéuticamente aceptables del mismo, para su uso en un método para el tratamiento terapéutico y/o profiláctico de infecciones víricas en un sujeto, por ejemplo, un sujeto inmunodeficiente. En algunas realizaciones, la sal tiene una pureza de igual a o mayor de un 91 % p/p, por ejemplo, tiene menos de o igual a un 9 % p/p de impurezas, para el sujeto.In another embodiment, the disclosure provides a compound of formula IB or formula II or pharmaceutically acceptable salts thereof, for use in a method for the therapeutic and / or prophylactic treatment of viral infections in a subject, eg, an immunocompromised subject. In some embodiments, the salt has a purity of equal to or greater than 91% w / w, for example, it has less than or equal to 9% w / w of impurities, for the subject.
Las composiciones farmacéuticas que comprenden los compuestos de la presente divulgación (por ejemplo, compuestos de fórmula IB o fórmula II) pueden formularse para que tengan cualquier concentración deseada. En algunas realizaciones, la composición se formula de modo que comprenda al menos una cantidad terapéuticamente eficaz.Pharmaceutical compositions comprising the compounds of the present disclosure (eg, compounds of formula IB or formula II) can be formulated to have any desired concentration. In some embodiments, the composition is formulated to comprise at least a therapeutically effective amount.
Las composiciones farmacéuticas incluyen aquellas adecuadas para administración oral, sublingual, nasal, rectal, vaginal, tópica, bucal y parenteral (incluyendo subcutánea, intramuscular e intravenosa), aunque la vía más adecuada dependerá de la naturaleza y gravedad de la afección que se esté tratando. Las composiciones puede presentarse convenientemente en forma farmacéutica unitaria, y prepararse por cualquiera de los métodos bien conocidos en la técnica de farmacia. En determinadas realizaciones, la composición farmacéutica se formula para administración oral en forma de una pastilla, cápsula, pastilla para chupar o comprimido. En otras realizaciones, la composición farmacéutica está en forma de una suspensión.Pharmaceutical compositions include those suitable for oral, sublingual, nasal, rectal, vaginal, topical, buccal, and parenteral administration (including subcutaneous, intramuscular, and intravenous), although the most suitable route will depend on the nature and severity of the condition being treated. . The compositions may be conveniently presented in unit dosage form, and prepared by any of the methods well known in the art of pharmacy. In certain embodiments, the pharmaceutical composition is formulated for oral administration in the form of a lozenge, capsule, lozenge, or tablet. In other embodiments, the pharmaceutical composition is in the form of a suspension.
Cuando los compuestos de la presente divulgación son administrados como productos farmacéuticos a mamíferos, por ejemplo, seres humanos, pueden administrarse per se o como una composición farmacéutica que contiene, por ejemplo, de aproximadamente un 0,1 % a un 99,9 %, de aproximadamente un 0,2 a un 98 %, de aproximadamente un 0,3 % a un 97 %, de aproximadamente un 0,4 % a un 96 %, o de aproximadamente un 0,5 a un 95 % de ingrediente activo en combinación con un vehículo farmacéuticamente aceptable. En una realización, una composición farmacéutica que contiene de aproximadamente un 0,5 % a un 90 % de ingrediente activo en combinación con un vehículo farmacéuticamente aceptable es adecuada para su administración a mamíferos, por ejemplo, seres humanos. Algunas realizaciones de la presente divulgación proporcionan una preparación de una composición farmacéutica que comprende de aproximadamente un 0,1 % a un 99,9 %, de aproximadamente un 0,2 a un 98 %, de aproximadamente un 0,3 % a un 97 %, de aproximadamente un 0,4 % a un 96 % o de aproximadamente un 0,5 a un 95 % de los compuestos de fórmula IB o fórmula II o sales farmacéuticamente aceptables de los mismos, por ejemplo, uno cualquiera de los compuestos de la tabla 7 o sal farmacéuticamente aceptable de los mismos, para su uso en el tratamiento, prevención o profilaxis de infecciones víricas o trastornos asociados con infecciones víricas. La presente divulgación proporciona el uso de aproximadamente un 0,1 % a un 99,9 %, de aproximadamente un 0,2 a un 98 %, de aproximadamente un 0,3 % a un 97 %, de aproximadamente un 0,4 % a un 96 % o de aproximadamente un 0,5 a un 95 % de los compuestos de fórmula IB o fórmula II o sales farmacéuticamente aceptables de los mismos para la fabricación de un medicamento que contiene cantidades eficaces del compuesto para su uso en el tratamiento, prevención o profilaxis de infecciones víricas y enfermedades asociadas con infecciones víricas.When the compounds of the present disclosure are administered as pharmaceuticals to mammals, for example, humans, they can be administered per se or as a pharmaceutical composition containing, for example, from about 0.1% to 99.9%, from about 0.2 to 98%, from about 0.3% to 97%, from about 0.4% to 96%, or from about 0.5 to 95% active ingredient in combination with a pharmaceutically acceptable carrier. In one embodiment, a pharmaceutical composition containing from about 0.5% to 90% active ingredient in combination with a pharmaceutically acceptable carrier is suitable for administration to mammals, eg, humans. Some embodiments of the present disclosure provide a preparation of a pharmaceutical composition comprising from about 0.1% to 99.9%, from about 0.2 to 98%, from about 0.3% to 97%. %, from about 0.4% to 96% or from about 0.5 to 95% of the compounds of formula IB or formula II or pharmaceutically acceptable salts thereof, for example, any one of the compounds of Table 7 or pharmaceutically acceptable salt thereof, for use in the treatment, prevention or prophylaxis of viral infections or disorders associated with viral infections. The present disclosure provides the use of about 0.1% to 99.9%, about 0.2 to 98%, about 0.3% to 97%, about 0.4% to 96% or from about 0.5 to 95% of the compounds of formula IB or formula II or pharmaceutically acceptable salts thereof for the manufacture of a medicament containing effective amounts of the compound for use in treatment, prevention or prophylaxis of viral infections and diseases associated with viral infections.
La presente divulgación proporciona un compuesto de fórmula IB o fórmula II para su uso en el tratamiento de una infección vírica o una enfermedad o trastorno asociado con infección vírica. Los compuestos pueden estar en una formulación farmacéutica que comprende de aproximadamente un 0,1 % a un 99,9 %, de aproximadamente un 0,2 a un 98 %, de aproximadamente un 0,3 % a un 97 %, de aproximadamente un 0,4 % a un 96 % o de aproximadamente un 0,5 a un 95 % de los compuestos de fórmula IB o fórmula II.The present disclosure provides a compound of formula IB or formula II for use in treating a viral infection or a disease or disorder associated with viral infection. The compounds may be in a pharmaceutical formulation comprising from about 0.1% to 99.9%, from about 0.2 to 98%, from about 0.3% to 97%, from about a 0.4% to 96% or from about 0.5 to 95% of the compounds of formula IB or formula II.
Para cualquier compuesto, la cantidad terapéuticamente eficaz de un compuesto o composición puede estimarse inicialmente en ensayos de cultivo celular, por ejemplo, de células neoplásicas, o en modelos animales, habitualmente ratas, ratones, conejos, perros o cerdos. El modelo animal también puede usarse para determinar el intervalo de concentración y la vía de administración apropiados. Dicha información entonces puede usarse para determinar las dosis y rutas útiles para administración en seres humanos. La eficacia terapéutica/profiláctica y la toxicidad pueden determinarse por procedimientos farmacéuticos convencionales en cultivos celulares o animales experimentales, por ejemplo, la DE50 (la dosis terapéuticamente eficaz en el 50 % de la población) y la DL50 (la dosis letal para el 50 % de la población). La relación de dosis entre los efectos tóxicos y terapéuticos es el índice terapéutico y puede expresarse como la relación de DL50 /DE50. Se prefieren composiciones farmacéuticas que muestran índices terapéuticos grandes. La dosificación puede variar dentro de este intervalo dependiendo de la forma farmacéutica empleada, la sensibilidad del paciente y la vía de administración.For any compound, the therapeutically effective amount of a compound or composition can be estimated initially in cell culture assays, for example, of neoplastic cells, or in animal models, usually rats, mice, rabbits, dogs or pigs. The animal model can also be used to determine the appropriate concentration range and route of administration. Such information can then be used to determine useful doses and routes for administration in humans. Therapeutic / prophylactic efficacy and toxicity can be determined by standard pharmaceutical procedures in cell cultures or experimental animals, for example, the ED 50 (the therapeutically effective dose in 50% of the population) and the LD 50 (the lethal dose for the 50% of the population). The dose ratio between toxic and therapeutic effects is the therapeutic index and can be expressed as the ratio of LD 50 / ED 50 . Pharmaceutical compositions showing large therapeutic indices are preferred. The dosage can vary within this range depending on the dosage form used, the sensitivity of the patient and the route of administration.
Las composiciones farmacéuticas que contienen compuestos de fórmula IB o fórmula II de la presente divulgación pueden fabricarse de una manera que es conocida en general, por ejemplo, por medio de procesos convencionales de mezcla, disolución, granulación, fabricación de grageas, levigación, emulsión, encapsulación, inclusión o liofilización. Las composiciones farmacéuticas pueden formularse de manera convencional usando uno o más vehículos farmacéuticamente aceptables que comprenden excipientes y/o auxiliares que facilitan el procesamiento de los compuestos activos en preparaciones que pueden usarse farmacéuticamente. La formulación apropiada depende de la vía de administración elegida. Pharmaceutical compositions containing compounds of formula IB or formula II of the present disclosure can be manufactured in a manner that is generally known, for example, by means of conventional mixing, dissolving, granulating, dragee-making, levigating, emulsifying, processes. encapsulation, inclusion or lyophilization. The pharmaceutical compositions can be formulated in a conventional manner using one or more pharmaceutically acceptable carriers comprising excipients and / or auxiliaries that facilitate processing of the active compounds into pharmaceutically usable preparations. The appropriate formulation depends on the chosen route of administration.
Las composiciones farmacéuticas adecuadas para uso inyectable incluyen soluciones acuosas estériles (cuando son solubles en agua) o dispersiones y polvos estériles para la preparación improvisada de soluciones inyectables estériles o dispersión. Para administración intravenosa, los vehículos adecuados incluyen solución salina fisiológica, agua bacteriostática, Cremophor EL™ (BASF, Parsippany, N.J.) o solución salina tamponada con fosfato (PBS). En todos los casos, la composición debe ser estéril y debe ser líquida en la medida que sea fácil de inyectar. Debe ser estable en las condiciones de fabricación y almacenamiento y debe estar conservada contra la acción contaminante de microorganismos tales como bacterias y hongos. El vehículo puede ser un disolvente o medio de dispersión que contenga, por ejemplo, agua, etanol, poliol (por ejemplo, glicerol, propilenglicol y polietilenglicol líquido, y similares), y mezclas adecuadas de los mismos. Se puede mantener la fluidez adecuada, por ejemplo, mediante el uso de un recubrimiento tal como lecitina, mediante el mantenimiento del tamaño de partícula requerido en el caso de una dispersión y mediante el uso de tensioactivos. La prevención de la acción de microorganismos puede conseguirse mediante diversos agentes antibacterianos y antifúngicos, por ejemplo, parabenos, clorobutanol, fenol, ácido ascórbico, timerosal y similares. En muchos casos, será preferible incluir agentes isotónicos, por ejemplo, glúcidos, polialcoholes tales como manitol, sorbitol, cloruro de sodio en la composición. La absorción prolongada de las composiciones inyectables se puede lograr incluyendo en la composición un agente que retarde la absorción, por ejemplo, monoestearato de aluminio y gelatina.Pharmaceutical compositions suitable for injectable use include sterile aqueous solutions (when soluble in water) or dispersions and sterile powders for the improvised preparation of sterile injectable solutions or dispersion. For intravenous administration, suitable vehicles include physiological saline, bacteriostatic water, Cremophor EL ™ (BASF, Parsippany, N.J.), or phosphate buffered saline (PBS). In all cases, the composition must be sterile and must be liquid to the extent that it is easy to inject. It must be stable under the conditions of manufacture and storage and must be preserved against the contaminating action of microorganisms such as bacteria and fungi. The carrier can be a solvent or dispersion medium containing, for example, water, ethanol, polyol (eg, glycerol, propylene glycol, and liquid polyethylene glycol, and the like), and suitable mixtures thereof. Adequate fluidity can be maintained, for example, by the use of a coating such as lecithin, by maintaining the required particle size in the case of a dispersion, and by the use of surfactants. Prevention of the action of microorganisms can be achieved by various antibacterial and antifungal agents, for example, parabens, chlorobutanol, phenol, ascorbic acid, thimerosal, and the like. In many cases, it will be preferable to include isotonic agents, for example, carbohydrates, polyalcohols such as mannitol, sorbitol, sodium chloride in the composition. Prolonged absorption of injectable compositions can be achieved by including in the composition an agent that delays absorption, for example, aluminum monostearate and gelatin.
Pueden prepararse soluciones inyectables estériles incorporando el compuesto activo en la cantidad requerida en un disolvente apropiado con uno o una combinación de ingredientes enumerados anteriormente, según se requiera, seguido de esterilización por filtración. En general, las dispersiones se preparan incorporando el compuesto activo en un vehículo estéril que contiene un medio de dispersión básico y los otros ingredientes requeridos de los enumerados anteriormente. En el caso de polvos estériles para la preparación de soluciones inyectables estériles, métodos de preparación son secado al vacío y liofilización que produce un polvo del ingrediente activo más cualquier ingrediente deseado adicional a partir de una solución previamente filtrada a esterilidad del mismo.Sterile injectable solutions can be prepared by incorporating the active compound in the required amount in an appropriate solvent with one or a combination of ingredients listed above, as required, followed by filter sterilization. In general, dispersions are prepared by incorporating the active compound into a sterile vehicle containing a basic dispersion medium and the required other ingredients from those listed above. In the case of sterile powders for the preparation of sterile injectable solutions, methods of preparation are vacuum drying and lyophilization which produces a powder of the active ingredient plus any additional desired ingredient from a previously sterile filtered solution thereof.
Las composiciones orales en general incluyen un diluyente inerte o un vehículo farmacéuticamente aceptable comestible. Se confinan en cápsulas de gelatina o se comprimen en comprimidos. Con fines de administración terapéutica oral, al compuesto activo se le pueden incorporar excipientes y usarse en forma de comprimidos, trociscos o cápsulas. Las composiciones orales también pueden prepararse usando un vehículo líquido para su uso como colutorio, en las que el compuesto en el vehículo líquido se aplica por vía oral y se remueve enjuagando y se expectora o se traga. Pueden incluirse agentes aglutinantes farmacéuticamente compatibles y/o materiales adyuvantes como parte de la composición. Los comprimidos, pastillas, cápsulas, trociscos y similares pueden contener cualquiera de los siguientes ingredientes, o compuestos de una naturaleza similar: un aglutinante tal como celulosa microcristalina, goma de tragacanto o gelatina; un excipiente tal como almidón o lactosa, un agente disgregante tal como ácido algínico, Primogel o almidón de maíz; un lubricante tal como estearato de magnesio o Sterotes; un emoliente tal como dióxido de silicio coloidal; un agente edulcorante tal como sacarosa o sacarina; o un agente aromatizante tal como menta, salicilato de metilo o aromatizante de naranja.Oral compositions generally include an inert diluent or an edible pharmaceutically acceptable carrier. They are confined in gelatin capsules or compressed into tablets. For oral therapeutic administration purposes, excipients may be incorporated into the active compound and used in the form of tablets, troches, or capsules. Oral compositions can also be prepared using a liquid vehicle for use as a mouthwash, wherein the compound in the liquid vehicle is applied orally and removed by rinsing and expectorated or swallowed. Pharmaceutically compatible binding agents and / or adjunct materials can be included as part of the composition. Tablets, lozenges, capsules, troches, and the like may contain any of the following ingredients, or compounds of a similar nature: a binder such as microcrystalline cellulose, gum tragacanth, or gelatin; an excipient such as starch or lactose, a disintegrating agent such as alginic acid, Primogel or cornstarch; a lubricant such as magnesium stearate or Sterotes; an emollient such as colloidal silicon dioxide; a sweetening agent such as sucrose or saccharin; or a flavoring agent such as peppermint, methyl salicylate, or orange flavoring.
Los compuestos activos pueden prepararse con vehículos farmacéuticamente aceptables que protegeran el compuesto contra la rápida eliminación del organismo, tal como una formulación de liberación controlada, incluyendo implantes y sistemas de administración microencapsulados. Se pueden usar polímeros biodegradables, biocompatibles, tales como acetato de etilenvinilo, polianhídridos, poli(ácido glicólico), colágeno, poliortoésteres y poli(ácido láctico). Los métodos para la preparación de dichas formulaciones serán evidentes para los expertos en la materia. En algunas realizaciones, los materiales también pueden obtenerse en el mercado, por ejemplo, de Alza Corporation y Nova Pharmaceuticals, Inc. También pueden usarse suspensiones liposómicas (que incluyen liposomas dirigidos a las células infectadas, con anticuerpos monoclonales contra antígenos víricos) como vehículos farmacéuticamente aceptables.Active compounds can be prepared with pharmaceutically acceptable carriers that will protect the compound against rapid elimination from the body, such as a controlled release formulation, including implants and microencapsulated delivery systems. Biodegradable, biocompatible polymers can be used, such as ethylene vinyl acetate, polyanhydrides, poly (glycolic acid), collagen, polyorthoesters, and poly (lactic acid). Methods for the preparation of such formulations will be apparent to those skilled in the art. In some embodiments, the materials may also be commercially available, for example, from Alza Corporation and Nova Pharmaceuticals, Inc. Liposomal suspensions (including liposomes targeted to infected cells, with monoclonal antibodies against viral antigens) may also be used as pharmaceutically carriers. acceptable.
Es especialmente ventajoso formular composiciones orales o parenterales en una forma farmacéutica unitaria para facilitar la administración y la uniformidad de la dosificación. La forma farmacéutica unitaria, como se usa en este documento, se refiere a unidades físicamente diferenciadas adecuadas como dosis unitarias para el sujeto a tratar; conteniendo cada unidad una cantidad predeterminada de compuesto activo calculada para producir el efecto terapéutico deseado en asociación con el vehículo farmacéutico requerido. La especificación para las formas farmacéuticas unitarias de la divulgación están dictaminadas por y dependen directamente de las características únicas del compuesto activo y el efecto terapéutico particular a conseguir.It is especially advantageous to formulate oral or parenteral compositions in dosage unit form for ease of administration and uniformity of dosage. Dosage unit form, as used herein, refers to physically discrete units suitable as unit doses for the subject to be treated; each unit containing a predetermined quantity of active compound calculated to produce the desired therapeutic effect in association with the required pharmaceutical carrier. The specification for the unit dosage forms of the disclosure are dictated by and directly dependent on the unique characteristics of the active compound and the particular therapeutic effect to be achieved.
Los compuestos de fórmula IB o fórmula II o sales farmacéuticamente aceptables de los mismos pueden formularse como una composición farmacéutica. Además, la presente divulgación proporciona un compuesto de fórmula IB o fórmula II, o una composición que comprende un compuesto de fórmula IB o fórmula II para su uso en el tratamiento de una infección vírica o una enfermedad o trastorno asociado con infección vírica. La composición puede formularse como un comprimido o suspensión. Los comprimidos de los compuestos de fórmula IB o fórmula II o sales farmacéuticamente aceptables de los mismos se formulan comprendiendo tampones, excipientes, vehículos, incluyendo emulsionantes, potenciadores (por ejemplo, potenciadores de la absorción), disgregantes (por ejemplo, polivinilpolipirrolidona (polivinilpolipirrolidona, PVPP, crospovidona, crospolividona o E1202), que es una modificación altamente reticulada de polivinilpirrolidona (PVP)) y/o polímeros farmacológicamente aceptables divulgados en la presente divulgación y bien conocidos en la técnica. Compounds of formula IB or formula II or pharmaceutically acceptable salts thereof can be formulated as a pharmaceutical composition. Furthermore, the present disclosure provides a compound of formula IB or formula II, or a composition comprising a compound of formula IB or formula II for use in treating a viral infection or a disease or disorder associated with viral infection. The composition can be formulated as a tablet or suspension. Tablets of compounds of formula IB or formula II or pharmaceutically acceptable salts thereof are formulated comprising buffers, excipients, carriers, including emulsifiers, enhancers (eg, absorption enhancers), disintegrants (eg, polyvinylpolypyrrolidone (polyvinylpolypyrrolidone, PVPP, crospovidone, crospolividone or E1202), which is a highly cross-linked modification of polyvinylpyrrolidone (PVP)) and / or pharmacologically acceptable polymers disclosed in the present disclosure and well known in the art.
En una realización, la presente divulgación proporciona la formulación en comprimido de los compuestos de fórmula IB o fórmula II o sales farmacéuticamente aceptables de los mismos para su uso en tratamiento, tratamiento profiláctico o prevención de infecciones víricas y/o enfermedades o trastornos asociados con infecciones víricas. La presente divulgación proporciona la formulación en comprimido de los compuestos de fórmula IB o fórmula II o sales farmacéuticamente aceptables de los mismos para su uso en el tratamiento de sujetos que necesitan dicho tratamiento incluyendo, aunque sin limitación, sujetos inmunodeficientes, o sujetos antes o después del trasplante de órganos y/o tejidos.In one embodiment, the present disclosure provides the tablet formulation of the compounds of formula IB or formula II or pharmaceutically acceptable salts thereof for use in treatment, prophylactic treatment or prevention of viral infections and / or diseases or disorders associated with infections. viral. The present disclosure provides the tablet formulation of the compounds of formula IB or formula II or pharmaceutically acceptable salts thereof for use in treating subjects in need of such treatment including, but not limited to, immunocompromised subjects, or before or after subjects. organ and / or tissue transplantation.
En una realización, la presente divulgación proporciona formulaciones en suspensión de los compuestos de fórmula IB o fórmula II o sales farmacéuticamente aceptables de los mismos para su uso en tratamiento profiláctico o prevención de infecciones víricas y/o enfermedades y/o trastornos asociados con infecciones víricas. La presente divulgación proporciona la formulación en suspensión de los compuestos de fórmula IB o fórmula II o sales farmacéuticamente aceptables de los mismos para su uso en el tratamiento de sujetos que necesitan dicho tratamiento incluyendo, aunque sin limitación, sujetos inmunodeficientes, o sujetos antes o después del trasplante de órganos y/o tejidos.In one embodiment, the present disclosure provides suspension formulations of compounds of formula IB or formula II or pharmaceutically acceptable salts thereof for use in prophylactic treatment or prevention of viral infections and / or diseases and / or disorders associated with viral infections. . The present disclosure provides suspension formulation of compounds of formula IB or formula II or pharmaceutically acceptable salts thereof for use in treating subjects in need of such treatment including, but not limited to, immunocompromised subjects, or before or after subjects. organ and / or tissue transplantation.
En otra realización, excipientes adicionales incluyen, aunque sin limitación, fosfato de sodio, ácido cítrico dibásico (monohidrato) (aproximadamente un 0,01-5 % en peso), citrato de sodio (aproximadamente un 0,01-5 % en peso), goma xantana (aproximadamente un 0,01-5 % en peso), metilparabeno (sal de sodio) (aproximadamente un 0,01-5 % en peso), propilparabeno (sal de sodio) (aproximadamente un 0,01-5 % en peso), sucralosa (aproximadamente un 0,01-5 % en peso), celulosa microcristalina y carboximetilcelulosa de sodio (VivaPur MCG 591) (aproximadamente un 0,5-10 % en peso), jarabe de maíz de alto contenido de fructosa (aproximadamente un 10-70 % en peso), aroma de lima-limón (WONF220J15) (aproximadamente un 0,01-5 % en peso), gránulos de hidróxido de sodio, hidróxido de sodio/ácido clorhídrico y agua purificada (aproximadamente un 68,93 % en peso).In another embodiment, additional excipients include, but are not limited to, sodium phosphate, dibasic citric acid (monohydrate) (approximately 0.01-5% by weight), sodium citrate (approximately 0.01-5% by weight). , xanthan gum (approximately 0.01-5% by weight), methyl paraben (sodium salt) (approximately 0.01-5% by weight), propyl paraben (sodium salt) (approximately 0.01-5% by weight), sucralose (approximately 0.01-5% by weight), microcrystalline cellulose and sodium carboxymethyl cellulose (VivaPur MCG 591) (approximately 0.5-10% by weight), high fructose corn syrup (approximately 10-70% by weight), lemon-lime flavor (WONF220J15) (approximately 0.01-5% by weight), sodium hydroxide granules, sodium hydroxide / hydrochloric acid and purified water (approximately one 68.93% by weight).
En otra realización, la presente divulgación proporciona composiciones (por ejemplo, composiciones farmacéuticas) con características farmacocinéticas deseables. Por ejemplo, las composiciones de la divulgación pueden proporcionar un nivel en sangre de los compuestos de fórmula IB o fórmula II o sales farmacéuticamente aceptables de los mismos que, después del metabolismo en la forma terapéuticamente activa (por ejemplo, el equivalente difosfato), provoca niveles en sangre del metabolito que no inducen toxicidad.In another embodiment, the present disclosure provides compositions (eg, pharmaceutical compositions) with desirable pharmacokinetic characteristics. For example, the compositions of the disclosure can provide a blood level of compounds of formula IB or formula II or pharmaceutically acceptable salts thereof which, after metabolism in the therapeutically active form (eg, diphosphate equivalent), causes blood levels of the metabolite that do not induce toxicity.
En algunas realizaciones, la presente divulgación proporciona una composición farmacéutica que comprende un compuesto descrito en este documento (por ejemplo, compuesto 1, 2, 3, 4, 5, 6, 71, 77, 76, 107, 111, 126, 133, 137, 139, 141, 143 o 145, o una sal, solvato, enantiómero, diastereoisómero, racemato o mezcla farmacéuticamente aceptable de los mismos, o cualquier combinación de los mismos).In some embodiments, the present disclosure provides a pharmaceutical composition comprising a compound described herein (e.g., compound 1, 2, 3, 4, 5, 6, 71, 77, 76, 107, 111, 126, 133, 137, 139, 141, 143 or 145, or a pharmaceutically acceptable salt, solvate, enantiomer, diastereoisomer, racemate or mixture thereof, or any combination thereof).
EnfermedadesDiseases
En este documento se divulga un método de tratamiento de una infección vírica o una enfermedad o trastorno asociado con infección vírica, que comprende administrar a un sujeto que lo necesita un compuesto de la divulgación (por ejemplo, compuesto 1, 2, 3, 4, 5, 6, 71, 77, 76, 107, 111, 126, 133, 137, 139, 141, 143 o 145, o una sal, solvato, enantiómero, diastereoisómero, racemato o mezcla farmacéuticamente aceptable de los mismos, o cualquier combinación de los mismos).Disclosed herein is a method of treating a viral infection or a disease or disorder associated with viral infection, which comprises administering to a subject in need thereof a compound of the disclosure (e.g., compound 1, 2, 3, 4, 5, 6, 71, 77, 76, 107, 111, 126, 133, 137, 139, 141, 143 or 145, or a pharmaceutically acceptable salt, solvate, enantiomer, diastereoisomer, racemate or mixture thereof, or any combination thereof).
En algunas realizaciones, la presente divulgación proporciona un compuesto de la divulgación (por ejemplo, compuesto 1, 2, 3, 4, 5, 6, 71, 77, 76, 107, 111, 126, 133, 137, 139, 141, 143 o 145, o una sal, solvato, enantiómero, diastereoisómero, racemato o mezcla farmacéuticamente aceptable de los mismos, o cualquier combinación de los mismos) para su uso en el tratamiento de una enfermedad (por ejemplo, una infección vírica o una enfermedad o trastorno asociado con infección vírica).In some embodiments, the present disclosure provides a compound of the disclosure (e.g., compound 1, 2, 3, 4, 5, 6, 71, 77, 76, 107, 111, 126, 133, 137, 139, 141, 143 or 145, or a pharmaceutically acceptable salt, solvate, enantiomer, diastereoisomer, racemate, or mixture thereof, or any combination thereof) for use in treating a disease (e.g., a viral infection or a disease or disorder associated with viral infection).
En este documento se divulga el tratamiento y/o prevención de una infección vírica con los compuestos divulgados en este documento y sales farmacéuticamente aceptables de los mismos. Los compuestos representados por la fórmula IB o fórmula II se usan en el tratamiento, prevención y/o fabricación de un medicamento para tratar y/o prevenir al menos un virus seleccionado de, aunque sin limitación, virus de ARNmc. En algunas realizaciones, el virus puede ser un norovirus, citomegalovirus humano (HCMV), virus BK (BKV), virus de Epstein-Barr (EBV), adenovirus, virus JC (JCV), SV40, virus MC (MCV), virus KI (KIV), virus WU (WUV), virus de la variolovacuna, virus del herpes simple 1 (HSV-1), virus del herpes simple 2 (HSV-2), virus del herpes humano 6 (HHV-6), virus del herpes humano 8 (HHV-8), virus de la hepatitis B, virus de la hepatitis C, virus de la varicela-zóster (VZV), viruela grave, viruela leve, viruela, viruela vacuna, viruela de camélidos, viruela de simios, poliovirus, picornaviridae (por ejemplo, rinovirus), paramyxoviridae (por ejemplo, virus respiratorio sincitial, RSV), virus del Ébola, virus de Marburgo, virus de Epstein-Barr (EBV), virus de la gripe, enterovirus (por ejemplo, EV68 y EV71, virus del papiloma, virus del Nilo Occidental, virus de la fiebre amarilla, virus de la fiebre aftosa, virus de la fiebre del Valle de la Gran Falla y otros flavivirus, arenavirus, bunyavirus, alfavirus e infecciones por virus de la inmunodeficiencia humana (HIV (o VIH por sus siglas en español)), y cualquier combinación de los mismos. Disclosed herein is the treatment and / or prevention of a viral infection with the compounds disclosed herein and pharmaceutically acceptable salts thereof. The compounds represented by formula IB or formula II are used in the treatment, prevention and / or manufacture of a medicament for treating and / or preventing at least one virus selected from, but not limited to, ssRNA viruses. In some embodiments, the virus can be a norovirus, human cytomegalovirus (HCMV), BK virus (BKV), Epstein-Barr virus (EBV), adenovirus, JC virus (JCV), SV40, MC virus (MCV), KI virus. (KIV), WU virus (WUV), vaccinia virus, herpes simplex virus 1 (HSV-1), herpes simplex virus 2 (HSV-2), human herpes virus 6 (HHV-6), human herpes 8 (HHV-8), hepatitis B virus, hepatitis C virus, varicella-zoster virus (VZV), severe smallpox, mild smallpox, smallpox, cowpox, camelid pox, ape pox, poliovirus, picornaviridae (eg rhinovirus), paramyxoviridae (eg respiratory syncytial virus, RSV), Ebola virus, Marburg virus, Epstein-Barr virus (EBV), influenza virus, enterovirus (eg EV68 and EV71, papilloma virus, West Nile virus, yellow fever virus, foot-and-mouth disease virus, Great Fault Valley fever virus and other flaviviruses, arenaviruses, bunyaviruses, a lfavirus and human immunodeficiency virus (HIV) infections, and any combination thereof.
En algunas realizaciones, la presente divulgación también proporciona un compuesto de fórmula IB o fórmula II para su uso en el tratamiento, prevención o retardo de la aparición de infecciones víricas o enfermedades o trastornos asociados con infecciones víricas (por ejemplo, norovirus, citomegalovirus humano (HCMV), virus BK (BKV), virus de Epstein-Barr (EBV), adenovirus, virus j C (JCV), SV40, virus MC (MCV), virus KI (KIV), virus WU (w Uv ), virus de la variolovacuna, virus del herpes simple 1 (HSV-1), virus del herpes simple 2 (HSV-2), virus del herpes humano 6 (HHV-6), virus del herpes humano 8 (HHV-8), virus de la hepatitis B, virus de la hepatitis C, virus de la varicela-zóster (VZV), viruela grave, viruela leve, viruela, viruela vacuna, viruela de camélidos, viruela de simios, poliovirus, picornaviridae (por ejemplo, rinovirus), paramyxoviridae (por ejemplo, virus respiratorio sincitial, RSV), virus del Ébola, virus de Marburgo, virus de Epstein-Barr (EBV), virus de la gripe, enterovirus (por ejemplo, EV68 y EV71, virus del papiloma, virus del Nilo Occidental, virus de la fiebre amarilla, virus de la fiebre aftosa, virus de la fiebre del Valle de la Gran Falla y otros flavivirus, arenavirus, bunyavirus, alfavirus e infecciones por virus de la inmunodeficiencia humana (HIV (o VIH por sus siglas en español)), y cualquier combinación de los mismos) administrando por vía oral a un sujeto una composición farmacéutica que comprende una dosis terapéuticamente eficaz de un compuesto de fórmula IB o fórmula II o una sal farmacéuticamente aceptable del mismo, en combinación con uno o más de un compuesto o composición seleccionado de un agente inmunodepresor y/o un agente antivírico.In some embodiments, the present disclosure also provides a compound of formula IB or formula II for use in treating, preventing, or delaying the onset of viral infections or diseases or disorders associated with viral infections (eg, norovirus, human cytomegalovirus ( HCMV), BK virus (BKV), Epstein-Barr virus (EBV), adenovirus, j C virus (JCV), SV40, MC virus (MCV), KI virus (KIV), WU virus (w Uv), vaccinia, herpes simplex virus 1 (HSV-1), herpes simplex virus 2 (HSV-2), human herpes virus 6 (HHV-6), human herpes virus 8 (HHV-8), hepatitis B, hepatitis C virus, varicella-zoster virus (VZV), severe smallpox, mild smallpox, smallpox, cowpox, camelid pox, ape pox, poliovirus, picornaviridae (e.g. rhinovirus), paramyxoviridae ( for example, respiratory syncytial virus (RSV), Ebola virus, Marburg virus, Epstein-Barr virus (EBV), influenza virus, and nteroviruses (for example, EV68 and EV71, papillomavirus, West Nile virus, yellow fever virus, foot-and-mouth disease virus, Great Fault Valley fever virus, and other flaviviruses, arenaviruses, bunyaviruses, alphaviruses and human immunodeficiency virus (HIV) infections, and any combination thereof) by orally administering to a subject a pharmaceutical composition comprising a therapeutically effective dose of a compound of formula IB or Formula II or a pharmaceutically acceptable salt thereof, in combination with one or more of a compound or composition selected from an immunosuppressive agent and / or an antiviral agent.
En algunas realizaciones, la presente divulgación proporciona un compuesto de fórmula IB o fórmula II para su uso en el tratamiento, prevención o retardo de la aparición de infección por virus de Marburgo o enfermedad o trastorno asociado con infección por virus de Marburgo, por administración oral a un sujeto que lo necesita.In some embodiments, the present disclosure provides a compound of Formula IB or Formula II for use in treating, preventing, or delaying the onset of Marburg virus infection or Marburg virus infection-associated disease or disorder, by oral administration. to a subject who needs it.
En algunas realizaciones, la presente divulgación proporciona un compuesto de fórmula IB o fórmula II para su uso en el tratamiento, prevención o retardo de la aparición de infección por virus del Ébola o enfermedad o trastorno asociado con infección por virus del Ébola, por administración oral a un sujeto que lo necesita.In some embodiments, the present disclosure provides a compound of Formula IB or Formula II for use in treating, preventing, or delaying the onset of Ebola virus infection or Ebola virus infection-associated disease or disorder, by oral administration. to a subject who needs it.
En algunas realizaciones, la presente divulgación proporciona un compuesto de fórmula IB o fórmula II para su uso en el tratamiento, prevención o retardo de la aparición de infección por virus de la gripe o enfermedad o trastorno asociado con infección por virus de la gripe, por administración oral a un sujeto que lo necesita.In some embodiments, the present disclosure provides a compound of formula IB or formula II for use in treating, preventing, or delaying the onset of influenza virus infection or disease or disorder associated with influenza virus infection, such as oral administration to a subject in need.
En algunas realizaciones, la presente divulgación proporciona un compuesto de fórmula IB o fórmula II para su uso en el tratamiento, prevención o retardo de la aparición de infección por norovirus o enfermedad o trastorno asociado con infección por norovirus, por administración oral a un sujeto que lo necesita.In some embodiments, the present disclosure provides a compound of formula IB or formula II for use in treating, preventing, or delaying the onset of norovirus infection or disease or disorder associated with norovirus infection, by oral administration to a subject who you need it.
En algunas realizaciones, la presente divulgación proporciona un compuesto de fórmula IB o fórmula II para su uso en el tratamiento, prevención o retardo de la aparición de infección por virus picornaviridae o enfermedad o trastorno asociado con infección por virus picornaviridae, por administración oral a un sujeto que lo necesita.In some embodiments, the present disclosure provides a compound of formula IB or formula II for use in treating, preventing, or delaying the onset of picornaviridae virus infection or disease or disorder associated with picornaviridae virus infection, by oral administration to a subject who needs it.
En algunas realizaciones, la presente divulgación proporciona un compuesto de fórmula IB o fórmula II para su uso en el tratamiento, prevención o retardo de la aparición de infección por virus paramyxoviridae o enfermedad o trastorno asociado con infección por virus paramyxoviridae, por administración oral a un sujeto que lo necesita.In some embodiments, the present disclosure provides a compound of formula IB or formula II for use in treating, preventing, or delaying the onset of paramyxoviridae virus infection or disease or disorder associated with paramyxoviridae virus infection, by oral administration to a subject who needs it.
En algunas realizaciones, la presente divulgación proporciona un compuesto de fórmula IB o fórmula II para su uso en el tratamiento, prevención o retardo de la aparición de infección por enterovirus o enfermedad o trastorno asociado con infección por enterovirus, por administración oral a un sujeto que lo necesita.In some embodiments, the present disclosure provides a compound of formula IB or formula II for use in treating, preventing, or delaying the onset of enterovirus infection or enterovirus infection-associated disease or disorder, by oral administration to a subject who you need it.
En cualquiera de las realizaciones anteriores, el compuesto puede ser compuesto 1.In any of the above embodiments, the compound can be compound 1.
La presente divulgación también proporciona un compuesto de fórmula IB o fórmula II (por ejemplo, compuesto 1) para su uso en el tratamiento profiláctico, prevención o retardo de la aparición de infección por norovirus o una enfermedad o trastorno asociado con infección por norovirus, administrando por vía oral a un sujeto una composición farmacéutica que comprende una dosis terapéuticamente eficaz de un compuesto de fórmula IB o fórmula II o una sal farmacéuticamente aceptable del mismo, en combinación con uno o más agentes antivíricos.The present disclosure also provides a compound of formula IB or formula II (eg, compound 1) for use in the prophylactic treatment, prevention or delay of the onset of norovirus infection or a disease or disorder associated with norovirus infection, administering orally to a subject a pharmaceutical composition comprising a therapeutically effective dose of a compound of formula IB or formula II or a pharmaceutically acceptable salt thereof, in combination with one or more antiviral agents.
La presente divulgación también proporciona un compuesto de fórmula IB o fórmula II para su uso en el tratamiento profiláctico, prevención o retardo de la aparición de infección por enterovirus o una enfermedad o trastorno asociado con infección por enterovirus, administrando por vía oral a un sujeto una composición farmacéutica que comprende una dosis terapéuticamente eficaz de un compuesto de fórmula IB o fórmula II o una sal farmacéuticamente aceptable del mismo, en combinación con uno o más agentes antivíricos.The present disclosure also provides a compound of formula IB or formula II for use in the prophylactic treatment, prevention, or delay of the onset of enterovirus infection or a disease or disorder associated with enterovirus infection, by orally administering to a subject a pharmaceutical composition comprising a therapeutically effective dose of a compound of formula IB or formula II or a pharmaceutically acceptable salt thereof, in combination with one or more antiviral agents.
En una de las realizaciones, los compuestos de fórmula IB o fórmula II se usan para tratar norovirus. En otra realizaciones, los compuestos de fórmula IB o fórmula II se usan para tratar norovirus asociado con genotipos específicos tales como los de los genogrupos I, II y IV, VI y VII que se sabe que infectan a seres humanos (Phan et al., J. Med. Virol. 2007 septiembre; 79(9): 1388-1400).In one embodiment, compounds of formula IB or formula II are used to treat norovirus. In other embodiments, compounds of formula IB or formula II are used to treat norovirus associated with specific genotypes such as those of genogroups I, II and IV, VI, and VII that are known to infect humans (Phan et al., J. Med. Virol. 2007 Sep; 79 (9): 1388-1400).
Pautas posológicasDosage guidelines
La pauta de administración puede lograr lo que constituye una cantidad farmacéuticamente eficaz. Los compuestos de fórmula IB o fórmula II o sales farmacéuticamente aceptables de los mismos pueden administrarse al sujeto antes o después de la aparición de una enfermedad. Además, pueden administrarse varias dosificaciones divididas, así como dosificaciones escalonadas diaria o secuencialmente, o la dosis puede infundirse de forma continua, o puede ser una inyección en embolada. Además, las dosificaciones pueden aumentarse o disminuirse proporcionalmente según indiquen las exigencias de la situación terapéutica o profiláctica. Además, las dosificaciones pueden coadministrarse en combinación con otro antivírico.The administration schedule can achieve what constitutes a pharmaceutically effective amount. Compounds of formula IB or formula II or pharmaceutically acceptable salts thereof can be administered to the subject before or after the onset of a disease. In addition, several divided dosages can be administered, as well as staggered dosages daily or sequentially, or the dose can be infused continuously, or it can be a bolus injection. Furthermore, dosages may be proportionally increased or decreased as indicated by the exigencies of the therapeutic or prophylactic situation. In addition, the dosages can be co-administered in combination with another antiviral.
La pauta posológica que utiliza los compuestos también puede seleccionarse de acuerdo con una diversidad de factores que incluyen el tipo, la especie, la edad, el peso, el sexo y el estado clínico del paciente; la gravedad de la afección a tratar; la vía de administración; la función renal y hepática del paciente; y el compuesto particular o sal del mismo empleado. Un médico o veterinario experto en la materia puede determinar fácilmente y prescribir la cantidad eficaz del fármaco requerida para prevenir, contrarrestar o detener el progreso de la afección.The dosage regimen using the compounds can also be selected according to a variety of factors including the type, species, age, weight, sex, and clinical status of the patient; the severity of the condition to be treated; the route of administration; the kidney and liver function of the patient; and the particular compound or salt of the same employee. A physician or veterinarian skilled in the art can easily determine and prescribe the effective amount of the drug required to prevent, counteract, or halt the progress of the condition.
En algunas realizaciones, al sujeto tratado para una infección vírica (por ejemplo, una infección por norovirus o una enfermedad o trastorno asociado con infección por norovirus) se le administra una o dos veces a la semana aproximadamente 40 mg, 50 mg, 75 mg, 100 mg, 150 mg, 175 mg, 200 mg o 250 mg de un compuesto de fórmula IB o fórmula II o una sal farmacéuticamente aceptable del mismo. La presente divulgación proporciona tratamiento de un sujeto para infección por norovirus o enfermedad o trastorno asociado con infección por norovirus administrando al sujeto una vez a la semana (QW) aproximadamente 200 mg o dos veces a la semana (BIW) aproximadamente 100 mg de un compuesto de fórmula IB o fórmula II, o una sal farmacéuticamente aceptable del mismo. En una realización, el sujeto se trata dos veces a la semana (BIW) con aproximadamente 100 mg del compuesto. En otra realización, el sujeto se trata una vez a la semana (QW) con aproximadamente 200 mg, o dos veces a la semana (BIW) con aproximadamente 100 mg del compuesto.In some embodiments, the subject treated for a viral infection (eg, a norovirus infection or a disease or disorder associated with norovirus infection) is administered once or twice a week about 40 mg, 50 mg, 75 mg, 100 mg, 150 mg, 175 mg, 200 mg or 250 mg of a compound of formula IB or formula II or a pharmaceutically acceptable salt thereof. The present disclosure provides treatment of a subject for norovirus infection or disease or disorder associated with norovirus infection by administering to the subject once a week (QW) about 200 mg or twice a week (BIW) about 100 mg of a compound. of formula IB or formula II, or a pharmaceutically acceptable salt thereof. In one embodiment, the subject is treated twice weekly (BIW) with approximately 100 mg of the compound. In another embodiment, the subject is treated once a week (QW) with about 200 mg, or twice a week (BIW) with about 100 mg of the compound.
En una realización, un compuesto de fórmula IB o fórmula II o sal farmacéuticamente aceptable del mismo que tiene una pureza igual a o mayor de aproximadamente un 91 % se administra por vía oral a un sujeto, por ejemplo, a una dosificación de aproximadamente 0,01 mg/kg a aproximadamente 10 mg/kg o más, por ejemplo, hasta 100 mg/kg, o hasta 400 mg/kg, o hasta 1000 mg/kg.In one embodiment, a compound of formula IB or formula II or pharmaceutically acceptable salt thereof having a purity equal to or greater than about 91% is administered orally to a subject, for example, at a dosage of about 0.01. mg / kg to about 10 mg / kg or more, for example, up to 100 mg / kg, or up to 400 mg / kg, or up to 1000 mg / kg.
En otra realización, un compuesto de fórmula IB o fórmula II o sal farmacéuticamente aceptable del mismo que tiene una pureza igual o mayor de aproximadamente un 91 % p/p se administra a un sujeto a una dosificación de aproximadamente 0,01 mg/kg, 0,05 mg/kg, 0,1 mg/kg, 0,5 mg/kg, 1 mg/kg, 1,5 mg/kg, 2 mg/kg, 2,5 mg/kg, 3 mg/kg, 3,5 mg/kg, 4 mg/kg, 4,5 mg/kg, 5 mg/kg, 5,5 mg/kg, 6 mg/kg, 6,5 mg/kg, 7 mg/kg, 7,5 mg/kg, 8 mg/kg, 8,5 mg/kg, 9 mg/kg, 9,5 mg/kg o 10 mg/kg o más o cualquier intervalo en las mismas.In another embodiment, a compound of formula IB or formula II or pharmaceutically acceptable salt thereof having a purity equal to or greater than about 91% w / w is administered to a subject at a dosage of about 0.01 mg / kg, 0.05 mg / kg, 0.1 mg / kg, 0.5 mg / kg, 1 mg / kg, 1.5 mg / kg, 2 mg / kg, 2.5 mg / kg, 3 mg / kg, 3.5 mg / kg, 4 mg / kg, 4.5 mg / kg, 5 mg / kg, 5.5 mg / kg, 6 mg / kg, 6.5 mg / kg, 7 mg / kg, 7, 5 mg / kg, 8 mg / kg, 8.5 mg / kg, 9 mg / kg, 9.5 mg / kg, or 10 mg / kg or more or any range therein.
En un aspecto preferido, la enfermedad o afección a tratar es infección vírica.In a preferred aspect, the disease or condition to be treated is viral infection.
La dosificación y administración se ajustan para proporcionar niveles suficientes del uno o más agentes activos o para mantener el efecto deseado. Factores que pueden tenerse en cuenta incluyen la gravedad del estado patológico, la salud general del sujeto, la edad, peso y género del sujeto, la dieta, el tiempo y frecuencia de administración, la o las combinaciones de fármacos, las sensibilidades a reacción y la tolerancia/respuesta al tratamiento. Pueden administrarse composiciones farmacéuticas de acción prolongada cada 3 a 4 días, cada semana, una vez cada dos semanas o mensualmente dependiendo de la semivida y la tasa de eliminación de la formulación particular.Dosage and administration are adjusted to provide sufficient levels of the one or more active agents or to maintain the desired effect. Factors that may be taken into account include the severity of the disease state, the general health of the subject, the age, weight and gender of the subject, the diet, the time and frequency of administration, the drug combination (s), the reaction sensitivities and tolerance / response to treatment. Long-acting pharmaceutical compositions can be administered every 3 to 4 days, every week, once every two weeks, or monthly depending on the half-life and clearance rate of the particular formulation.
En algunas realizaciones, la administración continúa para un total de diez dosis. Por ejemplo, los compuestos de fórmula IB o fórmula II pueden administrarse a dosificaciones de aproximadamente 100 mg dos veces a la semana durante cinco semanas (es decir, un total de diez dosis). Como alternativa, los compuestos de fórmula IB o fórmula II pueden administrarse con una dosis de carga de aproximadamente 200 mg seguida de dosis de aproximadamente 100 mg que continúan dos veces a la semana. En algunas realizaciones, la administración continúa para un total de diez dosis. Por ejemplo, los compuestos de fórmula IB o fórmula II pueden administrarse a una dosis de carga de aproximadamente 200 mg seguida de nueve dosis adicionales de aproximadamente 100 mg dos veces a la semana para un total de diez dosis. En una de las realizaciones, los compuestos de fórmula IB o fórmula II pueden dosificarse diariamente en el intervalo de aproximadamente 20-200 mg/día o semanalmente en el intervalo de aproximadamente 200 mg-3000 mg.In some embodiments, administration continues for a total of ten doses. For example, compounds of formula IB or formula II can be administered at dosages of about 100 mg twice weekly for five weeks (ie, a total of ten doses). Alternatively, the compounds of formula IB or formula II can be administered with a loading dose of about 200 mg followed by doses of about 100 mg continuing twice weekly. In some embodiments, administration continues for a total of ten doses. For example, compounds of formula IB or formula II can be administered at a loading dose of about 200 mg followed by nine additional doses of about 100 mg twice weekly for a total of ten doses. In one embodiment, the compounds of formula IB or formula II can be dosed daily in the range of about 20-200mg / day or weekly in the range of about 200mg-3000mg.
En una o más realizaciones, los compuestos de la divulgación son útiles en el tratamiento de una infección vírica tal como una infección por norovirus o una enfermedad o trastorno asociado con infección por norovirus. En algunas realizaciones, el tratamiento de la infección, por ejemplo, infección por norovirus, puede comprender dosificación diaria, o dosificación múltiples veces al día. En algunas realizaciones, la pauta de tratamiento total dura solamente mientras la infección por norovirus esté activa (por ejemplo, entre 1-3 días). En algunas realizaciones, los compuestos de la divulgación pueden dosificarse múltiples veces al día durante 1-3 días para tratar una infección por norovirus.In one or more embodiments, the compounds of the disclosure are useful in treating a viral infection such as a norovirus infection or a disease or disorder associated with norovirus infection. In some embodiments, treating the infection, eg, norovirus infection, may comprise daily dosing, or dosing multiple times daily. In some embodiments, the total treatment regimen lasts only as long as the norovirus infection is active (eg, between 1-3 days). In some embodiments, the compounds of the disclosure can be dosed multiple times per day for 1-3 days to treat a norovirus infection.
En otra realización, los comprimidos o suspensiones de los compuestos de fórmula IB o fórmula II o sales farmacéuticamente aceptables de los mismos se administran a una dosis de aproximadamente 40-3000 mg al día, BID, TID, una vez a la semana (QW) o dos veces a la semana (BIW). En otra realización, los comprimidos o suspensiones de los compuestos de fórmula IB o fórmula II o sales farmacéuticamente aceptables de los mismos se administran a una dosis de aproximadamente 40-400 mg al día, BID, TID, una vez a la semana (QW) o dos veces a la semana (BIW).In another embodiment, tablets or suspensions of compounds of formula IB or formula II or pharmaceutically acceptable salts thereof are administered at a dose of about 40-3000 mg per day, BID, TID, once a week (QW) or twice a week (BIW). In another embodiment, tablets or suspensions of compounds of formula IB or formula II or pharmaceutically acceptable salts thereof are administered at a dose of approximately 40-400 mg per day, BID, TID, once a week (QW) or twice a week (BIW).
En aplicaciones terapéuticas, las dosificaciones de las composiciones farmacéuticas divulgadas en este documento varían dependiendo del agente, la edad, el peso y el estado clínico del paciente destinatario, y la experiencia y criterio del médico o facultativo que administra el tratamiento, entro otros factores que afectan a la dosificación seleccionada. Las dosificaciones pueden variar de aproximadamente 0,01 mg/kg a aproximadamente 100 mg/kg. En aspectos preferidos, las dosificaciones pueden variar de aproximadamente 0,1 mg/kg a aproximadamente 10 mg/kg. En un aspecto, la dosis estará en el intervalo de aproximadamente 1 mg a aproximadamente 1 g; de aproximadamente 10 mg a aproximadamente 500 mg; de aproximadamente 20 mg a aproximadamente 400 mg; de aproximadamente 40 mg a aproximadamente 400 mg; o de aproximadamente 50 mg a aproximadamente 400 mg, en dosis individuales, divididas o continuas (cuya dosis puede ajustarse para el peso del paciente en kg, su área superficial corporal en m2 y su edad en años). En determinadas realizaciones, la cantidad por forma farmacéutica puede ser de aproximadamente 0,1 mg a aproximadamente 3000 mg, por ejemplo, de aproximadamente 0,1 mg, de aproximadamente 0,5 mg, de aproximadamente 1 mg, de aproximadamente 2 mg, de aproximadamente 3 mg, de aproximadamente 4 mg, de aproximadamente 5 mg, de aproximadamente 6 mg, de aproximadamente 7 mg, de aproximadamente 8 mg, de aproximadamente 9 mg, de aproximadamente 10 mg, de aproximadamente 15 mg, de aproximadamente 20 mg, de aproximadamente 25 mg, de aproximadamente 30 mg, de aproximadamente 35 mg, de aproximadamente 40 mg, de aproximadamente 45 mg, de aproximadamente 50 mg, de aproximadamente 55 mg, de aproximadamente 60 mg, de aproximadamente 65 mg, de aproximadamente 70 mg, de aproximadamente 75 mg, de aproximadamente 80 mg, de aproximadamente 85 mg, de aproximadamente 90 mg, de aproximadamente 95 mg , de aproximadamente 100 mg, de aproximadamente 200 mg, de aproximadamente 300 mg, de aproximadamente 400 mg, de aproximadamente 500 mg, de aproximadamente 600 mg, de aproximadamente 700 mg, de aproximadamente 800 mg, de aproximadamente 900 mg, de aproximadamente 1000 mg, de aproximadamente 1250 mg, 1500 mg, de aproximadamente 1750 mg, de aproximadamente 2000 mg, de aproximadamente 2500 mg o de aproximadamente 3000 mg. En una realización, la cantidad puede ser de aproximadamente 20 mg. En una realización, la cantidad puede ser de aproximadamente 50 mg. En otra realización, la dosificación puede ser de aproximadamente 100 mg. En otra realización, la dosis puede ser de 500 mg.In therapeutic applications, the dosages of the pharmaceutical compositions disclosed in this document vary depending on the agent, the age, weight and clinical condition of the recipient patient, and the experience and judgment of the physician or practitioner administering the treatment, among other factors that affect the selected dosage. Dosages can range from about 0.01 mg / kg to about 100 mg / kg. In preferred aspects, dosages can range from about 0.1 mg / kg to about 10 mg / kg. In one aspect, the dose will range from about 1 mg to about 1 g; from about 10 mg to about 500 mg; from about 20 mg to about 400 mg; from about 40 mg to about 400 mg; or from about 50 mg to about 400 mg, in individual, divided or continuous doses (the dose of which can be adjusted for the patient's weight in kg, their body surface area in m2, and their age in years). In certain embodiments, the amount per dosage form may be from about 0.1 mg to about 3000 mg, for example, about 0.1 mg, about 0.5 mg, about 1 mg, about 2 mg, of about 3 mg, about 4 mg, about 5 mg, about 6 mg, about 7 mg, about 8 mg, about 9 mg, about 10 mg, about 15 mg, about 20 mg, of about 25 mg, about 30 mg, about 35 mg, about 40 mg, about 45 mg, about 50 mg, about 55 mg, about 60 mg, about 65 mg, about 70 mg, of about 75 mg, about 80 mg, about 85 mg, about 90 mg, about 95 mg, about 100 mg, about 200 mg, about 300 mg, about 400 mg, of about 500 mg, about 600 mg, about 700 mg, about 800 mg, about 900 mg, about 1000 mg, about 1250 mg, 1500 mg, about 1750 mg, about 2000 mg, about 2500 mg or about 3000 mg. In one embodiment, the amount can be about 20 mg. In one embodiment, the amount can be about 50 mg. In another embodiment, the dosage can be about 100 mg. In another embodiment, the dose can be 500 mg.
En otra realización, los compuestos de fórmula IB o fórmula II o sales farmacéuticamente aceptables de los mismos se administran a un sujeto como una sola dosis. En otra realización, los compuestos de fórmula IB o fórmula II o sales farmacéuticamente aceptables de los mismos se administran a un sujeto en múltiples dosis. Pueden administrarse múltiples dosis de manera regular, por ejemplo, una vez cada 12 horas, una vez al día, cada 2 días, cada 3 días, cada 4 días, cada 5 días, cada 6 días, cada 7 días, cada 8 días, cada 9 días, cada 10 días, cada 11 días, cada 12 días, cada 13 días, cada 14 días o cada 15 días. Por ejemplo, las dosis pueden administrarse dos veces a la semana. Además, cada dosis individual puede administrarse con la misma dosificación o una diferente.In another embodiment, the compounds of formula IB or formula II or pharmaceutically acceptable salts thereof are administered to a subject as a single dose. In another embodiment, the compounds of formula IB or formula II or pharmaceutically acceptable salts thereof are administered to a subject in multiple doses. Multiple doses can be given on a regular basis, for example, once every 12 hours, once a day, every 2 days, every 3 days, every 4 days, every 5 days, every 6 days, every 7 days, every 8 days, every 9 days, every 10 days, every 11 days, every 12 days, every 13 days, every 14 days or every 15 days. For example, doses can be given twice a week. In addition, each individual dose can be administered with the same or a different dosage.
Por ejemplo, a un sujeto se le puede administrar uno cualquiera de los compuestos de fórmula IB o fórmula II o sales farmacéuticamente aceptables de los mismos con una primera dosis de aproximadamente 1-20 mg/kg (por ejemplo, aproximadamente 1 -1,1 mg/kg, aproximadamente 1,1 -1,2 mg/kg, aproximadamente 1,2 -1,3 mg/kg, aproximadamente 1,3 -1,4 mg/kg, aproximadamente 1,4 -1,5 mg/kg, aproximadamente 1,5 -1,6 mg/kg, aproximadamente 1,6 -1,7 mg/kg, aproximadamente 1.7 - 1,8 mg/kg, aproximadamente 1,8-1,9 mg/kg, aproximadamente 1,9-2,0 mg/kg, aproximadamente 2.0- 2,1 mg/kg, aproximadamente 2 ,1-2 ,2 mg/kg, aproximadamente 2,2-2,3 mg/kg, aproximadamente 2,3-2,4 mg/kg, aproximadamente 2,4-2,5 mg/kg, aproximadamente 2,5-2,6 mg/kg, aproximadamente 2,6-2,7 mg/kg, aproximadamente 2,7-2,8 mg/kg, aproximadamente 2,8-2,9 mg/kg, aproximadamente 2,9-3,0 mg/kg, aproximadamente 3,0-3,1 mg/kg, aproximadamente 3,1-3 ,2 mg/kg, aproximadamente 3,2-3,3 mg/kg, aproximadamente 3,3-3,4 mg/kg, aproximadamente 3,4-3,5 mg/kg, aproximadamente 3,5-3,6 mg/kg, aproximadamente 3,6-3,7 mg/kg, aproximadamente 3,7-3,8 mg/kg, aproximadamente 3.8- 3,9 mg/kg, aproximadamente 3,9-4,0 mg/kg, aproximadamente 4,0-5,0 mg/kg, aproximadamente 5.0- 6,0 mg/kg, aproximadamente 6,0-7,0 mg/kg, aproximadamente 7,0-8,0 mg/kg, aproximadamente 8,0-9,0 mg/kg, aproximadamente 9,0-10,0 mg/kg o aproximadamente 10-20 mg/kg) de uno cualquiera de los compuestos de fórmula IB o fórmula II (o una sal farmacéuticamente aceptable de los mismos) seguido de una o más dosis adicionales a 1-4 mg/kg (por ejemplo, aproximadamente 1 -1,1 mg/kg, aproximadamente 1,1 -1,2 mg/kg, aproximadamente 1,2 -1,3 mg/kg, aproximadamente 1,3 -1,4 mg/kg, aproximadamente 1,4 -1,5 mg/kg, aproximadamente 1.5 - 1,6 mg/kg, aproximadamente 1,6 -1,7 mg/kg, aproximadamente 1,7 -1,8 mg/kg, aproximadamente 1,8-1,9 mg/kg, aproximadamente 1,9-2,0 mg/kg, aproximadamente 2,0-2,1 mg/kg, aproximadamente 2 ,1-2,2 mg/kg, aproximadamente 2,2-2,3 mg/kg, aproximadamente 2,3-2,4 mg/kg, aproximadamente 2,4-2,5 mg/kg, aproximadamente 2,5-2,6 mg/kg, aproximadamente 2,6-2,7 mg/kg, aproximadamente 2,7-2,8 mg/kg, aproximadamente 2,8-2,9 mg/kg, aproximadamente 2,9-3,0 mg/kg, aproximadamente 3,0-3,1 mg/kg, aproximadamente 3,1-3 ,2 mg/kg, aproximadamente 3,2-3,3 mg/kg, aproximadamente 3,3-3,4 mg/kg, aproximadamente 3,4-3,5 mg/kg, aproximadamente 3,5-3,6 mg/kg, aproximadamente 3.6- 3 m,7g/kg, aproximadamente 3,7-3,8 mg/kg, aproximadamente 3,8-3,9 mg/kg o aproximadamente 3,9-4,0 mg/kg) de uno cualquiera de los compuestos de fórmula IB o fórmula II (o una sal farmacéuticamente aceptable de los mismos) en la misma semana o en la siguiente semana. Por ejemplo, a un sujeto se le puede administrar una primera dosis de aproximadamente 3 mg/kg seguida de una o más dosis adicionales a aproximadamente 1 mg/kg. Por ejemplo, a un sujeto se le puede administrar una primera dosis de aproximadamente 2 mg/kg seguida de una o más dosis adicionales a aproximadamente 3 mg/kg. Por ejemplo, a un sujeto se le puede administrar una primera dosis de 4 mg/kg seguida de una o más dosis adicionales a aproximadamente 4 mg/kg. For example, a subject may be administered any one of the compounds of formula IB or formula II or pharmaceutically acceptable salts thereof with a first dose of about 1-20 mg / kg (eg, about 1-1.1 mg / kg, about 1.1-1.2 mg / kg, about 1.2-1.3 mg / kg, about 1.3-1.4 mg / kg, about 1.4-1.5 mg / kg, about 1.5-1.6 mg / kg, about 1.6-1.7 mg / kg, about 1.7 - 1.8 mg / kg, about 1.8-1.9 mg / kg, about 1 , 9-2.0 mg / kg, approximately 2.0-2.1 mg / kg, approximately 2.2-2.2 mg / kg, approximately 2.2-2.3 mg / kg, approximately 2.3-2 , 4 mg / kg, about 2.4-2.5 mg / kg, about 2.5-2.6 mg / kg, about 2.6-2.7 mg / kg, about 2.7-2.8 mg / kg, about 2.8-2.9 mg / kg, about 2.9-3.0 mg / kg, about 3.0-3.1 mg / kg, about 3.1-3.2 mg / kg, about 3.2-3.3 mg / kg, about 3.3-3.4 mg / kg, about 3.4 -3.5 mg / kg, about 3.5-3.6 mg / kg, about 3.6-3.7 mg / kg, about 3.7-3.8 mg / kg, about 3.8-3.9 mg / kg, about 3.9-4.0 mg / kg, about 4.0-5.0 mg / kg, about 5.0- 6.0 mg / kg, about 6.0-7.0 mg / kg, about 7.0-8.0 mg / kg, about 8.0-9.0 mg / kg, about 9.0-10.0 mg / kg, or about 10-20 mg / kg) of any one of the compounds of formula IB or formula II (or a pharmaceutically acceptable salt thereof) followed by one or more additional doses at 1-4 mg / kg (e.g., about 1-1.1 mg / kg, about 1.1-1 , 2mg / kg, about 1.2-1.3mg / kg, about 1.3-1.4mg / kg, about 1.4-1.5mg / kg, about 1.5-1.6mg / kg, about 1.6-1.7mg / kg, about 1.7-1.8mg / kg, about 1.8-1.9mg / kg, about 1.9-2.0mg / kg, about 2.0-2.1 mg / kg, about 2.1-2.2 mg / kg, about 2.2-2.3 mg / kg, about 2.3-2 , 4 mg / kg, about 2.4-2.5 mg / kg, about 2.5-2.6 mg / kg, about 2.6-2.7 mg / kg, about 2.7-2.8 mg / kg, about 2.8-2.9 mg / kg, about 2.9-3.0 mg / kg, about 3.0-3.1 mg / kg, about 3.1-3.2 mg / kg, about 3.2-3.3 mg / kg, about 3.3-3.4 mg / kg, about 3.4-3.5 mg / kg, about 3.5-3.6 mg / kg, about 3.6-3 m, 7g / kg, about 3.7-3.8 mg / kg, about 3.8-3.9 mg / kg, or about 3.9-4.0 mg / kg) of any one of the compounds of formula IB or formula II (or a pharmaceutically acceptable salt thereof) in the same week or in the following week. For example, a subject may be administered a first dose of about 3 mg / kg followed by one or more additional doses at about 1 mg / kg. For example, a subject may be administered a first dose of approximately 2 mg / kg followed by one or more additional doses at approximately 3 mg / kg. For example, a subject may be administered a first dose of 4 mg / kg followed by one or more additional doses at about 4 mg / kg.
También pueden administrarse múltiples dosis a intervalos de tiempo variables. Por ejemplo, las primeras 2, 3, 4, 5, 6, 7 o 8 o más dosis pueden administrarse a un intervalo de 6 días seguidas de dosis adicionales administradas a un intervalo de 7 días. Por ejemplo, las primeras 2, 3, 4, 5, 6, 7 o 8 o más dosis pueden administrarse a un intervalo de 7 días seguidas de dosis adicionales administradas a un intervalo de 3 días.Multiple doses can also be administered at varying time intervals. For example, the first 2, 3, 4, 5, 6, 7, or 8 or more doses may be administered at a 6-day interval followed by additional doses administered at a 7-day interval. For example, the first 2, 3, 4, 5, 6, 7, or 8 or more doses can be administered at a 7-day interval followed by additional doses administered at a 3-day interval.
En una realización, los compuestos de fórmula IB o fórmula II o sales farmacéuticamente aceptables de los mismos se administran a un sujeto una vez a la semana a una dosis de aproximadamente 40-3000 mg, o dos veces a la semana a una dosis de aproximadamente 40-3000 mg.In one embodiment, the compounds of formula IB or formula II or pharmaceutically acceptable salts thereof are administered to a subject once a week at a dose of about 40-3000 mg, or twice a week at a dose of about 40-3000 mg.
En algunas realizaciones, la composición farmacéutica de la presente divulgación se administra diariamente, BID, TID, una vez a la semana (QW) o dos veces a la semana (BIW) con aproximadamente 40-3000 mg de compuestos de fórmula IB o fórmula II o sales farmacéuticamente aceptables de los mismos. Las composiciones farmacéuticas de la presente divulgación se administran diariamente, BID, TID, una vez a la semana (QW) o dos veces a la semana (BIW) con aproximadamente 40 mg, 50 mg, 75 mg, 100 mg, 150 mg, 175 mg, 200 mg, 250 mg, 275 mg, 300 mg, 325 mg, 350 mg, 375 mg, 400 mg, 450 mg, 500 mg, 500-600 mg, 600-700 mg, 700-800 mg, 800-900 mg o 900-1000 mg, o dos veces a la semana (BIW) con aproximadamente 40 mg, 50 mg, 75 mg, 100 mg, 150 mg, 175 mg, 200 mg, 250 mg, 275 mg, 300 mg, 325 mg, 350 mg, 375 mg o 400 mg, 450 mg, 500 mg, 500-600 mg, 600-700 mg, 700-800 mg, 800 900 mg o 900-1000 mg de compuestos de fórmula I, fórmula IA, fórmula IB o fórmula II o sales farmacéuticamente aceptables de los mismos.In some embodiments, the pharmaceutical composition of the present disclosure is administered daily, BID, TID, once a week (QW) or twice a week (BIW) with about 40-3000 mg of compounds of formula IB or formula II. or pharmaceutically acceptable salts thereof. The pharmaceutical compositions of the present disclosure are administered daily, BID, TID, once a week (QW) or twice a week (BIW) with approximately 40 mg, 50 mg, 75 mg, 100 mg, 150 mg, 175 mg, 200 mg, 250 mg, 275 mg, 300 mg, 325 mg, 350 mg, 375 mg, 400 mg, 450 mg, 500 mg, 500-600 mg, 600-700 mg, 700-800 mg, 800-900 mg or 900-1000 mg, or twice weekly (BIW) with approximately 40 mg, 50 mg, 75 mg, 100 mg, 150 mg, 175 mg, 200 mg, 250 mg, 275 mg, 300 mg, 325 mg , 350 mg, 375 mg or 400 mg, 450 mg, 500 mg, 500-600 mg, 600-700 mg, 700-800 mg, 800-900 mg or 900-1000 mg of compounds of formula I, formula IA, formula IB or formula II or pharmaceutically acceptable salts thereof.
La presente divulgación proporciona compuestos de fórmula IB o fórmula II administrados a una dosis de aproximadamente 1-100 mg/kg (por ejemplo, 10-20 mg/kg, 20-50 mg/kg, 50-75 mg/kg, 75-100 mg/kg).The present disclosure provides compounds of formula IB or formula II administered at a dose of about 1-100 mg / kg (eg, 10-20 mg / kg, 20-50 mg / kg, 50-75 mg / kg, 75- 100 mg / kg).
Vías de administraciónAdministration routes
Los compuestos de la presente divulgación, o sales, ésteres o derivados farmacéuticamente aceptables de los mismos, pueden administrarse por vía oral, nasal, intranasal, transdérmica, pulmonar, por inhalación, por vía yugal, sublingual, intraperitoneal, subcutánea, intramuscular, intravenosa, rectal, intrapleural, intratecal y parenteral. En una realización, el compuesto se administra por vía oral. Un experto en la materia reconocerá las ventajas de determinadas vías de administración.The compounds of the present disclosure, or pharmaceutically acceptable salts, esters, or derivatives thereof, can be administered orally, nasal, intranasal, transdermal, pulmonary, inhaled, jugal, sublingual, intraperitoneal, subcutaneous, intramuscular, intravenous, rectal, intrapleural, intrathecal and parenteral. In one embodiment, the compound is administered orally. One skilled in the art will recognize the advantages of certain routes of administration.
Las formas farmacéuticas para administración tópica o transdérmica de un compuesto de esta divulgación incluyen polvos, pulverizados, pomadas, pastas, cremas, lociones, geles, soluciones, parches e inhalantes. En una realización, el compuesto activo se mezcla en condiciones estériles con un vehículo farmacéuticamente aceptable, y con cualquier conservante, tampón o propulsor que se requiera.Pharmaceutical forms for topical or transdermal administration of a compound of this disclosure include powders, sprays, ointments, pastes, creams, lotions, gels, solutions, patches, and inhalants. In one embodiment, the active compound is mixed under sterile conditions with a pharmaceutically acceptable carrier, and with any preservatives, buffers, or propellants that are required.
Para su administración por inhalación, los compuestos se administran en forma de una pulverización de aerosol desde un recipiente o dosificador presurizado, que contiene un propulsor adecuado, por ejemplo, un gas tal como dióxido de carbono, o un nebulizador.For administration by inhalation, the compounds are delivered as an aerosol spray from a pressurized container or dispenser, containing a suitable propellant, eg, a gas such as carbon dioxide, or a nebulizer.
La administración sistémica también puede ser por medios transmucosos o transdérmicos. Para administración transmucosa o transdérmica, se usan en la formulación penetrantes apropiados para la barrera a penetrar. Dichos penetrantes en general son conocidos en la técnica, e incluyen, por ejemplo, para administración transmucosa, detergentes, sales biliares y derivados de ácido fusídico. La administración transmucosa puede conseguirse a través del uso de pulverizadores nasales o supositorios. Para administración transdérmica, los compuestos activos se formulan en pomadas, bálsamos, geles o cremas como se conoce en general en la técnica.Systemic administration can also be by transmucosal or transdermal means. For transmucosal or transdermal administration, penetrants appropriate to the barrier to be penetrated are used in the formulation. Such penetrants are generally known in the art, and include, for example, for transmucosal administration, detergents, bile salts, and derivatives of fusidic acid. Transmucosal administration can be achieved through the use of nasal sprays or suppositories. For transdermal administration, the active compounds are formulated into ointments, balms, gels, or creams as is generally known in the art.
Una composición farmacéutica de la divulgación se formula para que sea compatible con su vía de administración pretendida. Ejemplos de vías de administración incluyen administración parenteral, por ejemplo, intravenosa, intradérmica, subcutánea, oral (por ejemplo, inhalación), transdérmica (tópica) y transmucosa. Las soluciones o suspensiones usadas para aplicación parenteral, intradérmica o subcutánea pueden incluir los siguientes componentes: un diluyente estéril tal como agua para inyección, solución salina, aceites fijos, polietilenglicoles, glicerina, propilenglicol u otros disolventes sintéticos; agentes antibacterianos tales como alcohol bencílico o metilparabenos; antioxidantes tales como ácido ascórbico o bisulfito de sodio; agentes quelantes tales como ácido etilendiaminatetraacético; tampones tales como acetatos, citratos o fosfatos, y agentes para el ajuste de la tonicidad tales como cloruro de sodio o dextrosa. El pH pude ajustarse con ácidos o bases, tales como ácido clorhídrico o hidróxido de sodio. La preparación parenteral puede confinarse en ampollas, jeringas desechables o viales multidosis hechos de vidrio o plástico.A pharmaceutical composition of the disclosure is formulated to be compatible with its intended route of administration. Examples of routes of administration include parenteral, eg, intravenous, intradermal, subcutaneous, oral (eg, inhalation), transdermal (topical), and transmucosal administration. Solutions or suspensions used for parenteral, intradermal, or subcutaneous application may include the following components: a sterile diluent such as water for injection, saline, fixed oils, polyethylene glycols, glycerin, propylene glycol, or other synthetic solvents; antibacterial agents such as benzyl alcohol or methyl parabens; antioxidants such as ascorbic acid or sodium bisulfite; chelating agents such as ethylenediaminetetraacetic acid; buffers such as acetates, citrates or phosphates, and tonicity adjusting agents such as sodium chloride or dextrose. The pH can be adjusted with acids or bases, such as hydrochloric acid or sodium hydroxide. The parenteral preparation can be confined in ampoules, disposable syringes, or multidose vials made of glass or plastic.
PoliterapiaPolytherapy
La presente divulgación proporciona métodos para prevenir o tratar una infección vírica en un sujeto (por ejemplo, una infección por norovirus). Los métodos comprenden administrar a un sujeto una cantidad terapéuticamente eficaz de un compuesto descrito en este documento. Los compuestos pueden usarse en una pauta de monoterapia o de politerapia. The present disclosure provides methods for preventing or treating a viral infection in a subject (eg, a norovirus infection). The methods comprise administering to a subject a therapeutically effective amount of a compound described herein. The compounds can be used in a monotherapy or combination therapy regimen.
Como se usa en este documento, "monoterapia" significa o se refiere a la administración de un solo compuesto activo o terapéutico (por ejemplo, un compuesto de fórmula IB o fórmula II) a un sujeto que lo necesita. Preferiblemente, la monoterapia implicará la administración de una cantidad terapéuticamente eficaz de un compuesto activo. Por ejemplo, la monoterapia contra norovirus con uno de los compuestos de la presente divulgación, o una sal, profármaco, metabolito, análogo o derivado farmacéuticamente aceptable del mismo, a un sujeto que necesita tratamiento contra norovirus. La monoterapia puede ser opuesta a la politerapia, en que se administra una combinación de múltiples compuestos activos, preferiblemente con cada componente de la combinación presente en una cantidad terapéuticamente eficaz. En un aspecto, la monoterapia con un compuesto de la presente divulgación, o una sal, profármaco, metabolito, polimorfo o solvato farmacéuticamente aceptable del mismo, es más eficaz que la politerapia para inducir un efecto biológico deseado.As used herein, "monotherapy" means or refers to the administration of a single active or therapeutic compound (eg, a compound of formula IB or formula II) to a subject in need thereof. Preferably, monotherapy will involve the administration of a therapeutically effective amount of an active compound. For example, monotherapy against norovirus with one of the compounds of the present disclosure, or a pharmaceutically acceptable salt, prodrug, metabolite, analog or derivative thereof, to a subject in need of treatment against norovirus. Monotherapy can be as opposed to combination therapy, in which a combination of multiple active compounds is administered, preferably with each component of the combination present in a therapeutically effective amount. In one aspect, monotherapy with a compound of the present disclosure, or a pharmaceutically acceptable salt, prodrug, metabolite, polymorph, or solvate thereof, is more effective than combination therapy in inducing a desired biological effect.
Como se usa en este documento, "politerapia" o "tratamiento conjunto" incluye la administración de un compuesto de la presente divulgación, o una sal, profármaco, metabolito, polimorfo o solvato farmacéuticamente aceptable del mismo, y al menos un segundo agente como parte de una pauta de tratamiento específica destinada a proporcionar el efecto beneficioso de la acción conjunta de estos agentes terapéuticos. El efecto beneficioso de la combinación incluye, aunque sin limitación, acción conjunta farmacocinética o farmacodinámica de la combinación de agentes terapéuticos. La administración de estos agentes terapéuticos en combinación típicamente se realiza durante un periodo de tiempo definido (habitualmente minutos, horas, días o semanas dependiendo de la combinación seleccionada). La "politerapia" puede pretender, pero en general no lo hace, abarcar la administración de dos o más de estos agentes terapéuticos como parte de pautas de monoterapia separadas que provocan de manera accidental y arbitraria las combinaciones de la presente divulgación.As used herein, "combination therapy" or "conjoint treatment" includes administration of a compound of the present disclosure, or a pharmaceutically acceptable salt, prodrug, metabolite, polymorph, or solvate thereof, and at least one second agent as part. of a specific treatment regimen intended to provide the beneficial effect of the joint action of these therapeutic agents. The beneficial effect of the combination includes, but is not limited to, pharmacokinetic or pharmacodynamic joint action of the combination of therapeutic agents. Administration of these therapeutic agents in combination is typically over a defined period of time (usually minutes, hours, days, or weeks depending on the combination selected). "Combination therapy" may be intended, but generally does not, encompass the administration of two or more of these therapeutic agents as part of separate monotherapy regimens that accidentally and arbitrarily elicit the combinations of the present disclosure.
La "politerapia" pretende abarcar la administración de estos agentes terapéuticos de una manera secuencial, en la que cada agente terapéutico se administran en un momento diferente, así como la administración de estos agentes terapéuticos, o al menos dos de los agentes terapéuticos, de una manera sustancialmente simultánea. La administración sustancialmente simultánea puede conseguirse, por ejemplo, administrando al sujeto una sola cápsula que tiene una relación fija de cada agente terapéutico o en múltiples cápsulas individuales para cada uno de los agentes terapéuticos. La administración secuencial o sustancialmente simultánea de cada agente terapéutico puede lograrse mediante cualquier vía apropiada incluyendo, aunque sin limitación, vías orales, vías intravenosas, vías intramusculares y absorción directa a través de tejidos de membrana mucosa. Los agentes terapéuticos pueden administrarse por la misma vía o por diferentes vías. Por ejemplo, un primer agente terapéutico de la combinación seleccionada puede administrarse por inyección intravenosa mientras que los otros agentes terapéuticos de la combinación pueden administrarse por vía oral. Como alternativa, por ejemplo, todos los agentes terapéuticos pueden administrarse por vía oral o todos los agentes terapéuticos pueden administrarse por inyección intravenosa. La secuencia en que se administran los agentes terapéuticos no es estrictamente crucial."Combination therapy" is intended to encompass the administration of these therapeutic agents in a sequential manner, in which each therapeutic agent is administered at a different time, as well as the administration of these therapeutic agents, or at least two of the therapeutic agents, in a substantially simultaneously. Substantially simultaneous administration can be achieved, for example, by administering to the subject a single capsule having a fixed ratio of each therapeutic agent or in multiple individual capsules for each of the therapeutic agents. Sequential or substantially simultaneous administration of each therapeutic agent can be achieved by any appropriate route including, but not limited to, oral routes, intravenous routes, intramuscular routes, and direct absorption through mucous membrane tissues. Therapeutic agents can be administered by the same route or by different routes. For example, a first therapeutic agent of the selected combination can be administered by intravenous injection while the other therapeutic agents of the combination can be administered orally. Alternatively, for example, all therapeutic agents can be administered orally or all therapeutic agents can be administered by intravenous injection. The sequence in which the therapeutic agents are administered is not strictly crucial.
"Politerapia" también abarca la administración de los agentes terapéuticos como se describe anteriormente en combinación adicional con otros ingredientes biológicamente activos y tratamientos sin fármacos. Cuando la politerapia comprende además un tratamiento sin fármacos, el tratamiento sin fármacos puede realizarse en cualquier momento adecuado siembre que se consiga un efecto beneficioso de la acción conjunta de la combinación de los agentes terapéuticos y el tratamiento sin fármacos. Por ejemplo, en casos apropiados, el efecto beneficioso aún se consigue cuando el tratamiento sin fármacos se elimina temporalmente de la administración de los agentes terapéuticos, quizás por días o incluso semanas."Combination therapy" also encompasses the administration of the therapeutic agents as described above in additional combination with other biologically active ingredients and non-drug treatments. When the combination therapy further comprises drug-free treatment, the drug-free treatment can be performed at any suitable time provided that a beneficial effect is achieved from the joint action of the combination of the therapeutic agents and the drug-free treatment. For example, in appropriate cases, the beneficial effect is still achieved when the drug-free treatment is temporarily removed from the administration of the therapeutic agents, perhaps for days or even weeks.
La presente divulgación también proporciona un compuesto de fórmula IB o fórmula II para su uso en el tratamiento, prevención o retardo de la aparición de una infección vírica (por ejemplo, infección vírica por norovirus o enfermedad o trastorno asociado con infección vírica por norovirus; infección por virus de la gripe o enfermedad o afección asociada con infección por virus de la gripe), por administración oral a un sujeto que lo necesita de una composición farmacéutica de una dosis terapéuticamente eficaz de un compuesto de fórmula IB o fórmula II o una sal farmacéuticamente aceptable del mismo en combinación con uno o más agentes antivíricos.The present disclosure also provides a compound of formula IB or formula II for use in treating, preventing, or delaying the onset of a viral infection (eg, norovirus viral infection or disease or disorder associated with norovirus viral infection; infection; influenza virus or disease or condition associated with influenza virus infection), by oral administration to a subject in need thereof of a pharmaceutical composition of a therapeutically effective dose of a compound of formula IB or formula II or a pharmaceutically salt acceptable thereof in combination with one or more antiviral agents.
La presente divulgación también proporciona un compuesto de fórmula IB o fórmula II para su uso en el tratamiento, prevención o retardo de la aparición de una infección vírica por picornaviridae o enfermedad o trastorno asociado con infección vírica por picornaviridae, por administración oral a un sujeto que lo necesita de una composición farmacéutica de una dosis terapéuticamente eficaz de un compuesto de fórmula IB o fórmula II o una sal farmacéuticamente aceptable del mismo en combinación con uno o más agentes antivíricos.The present disclosure also provides a compound of formula IB or formula II for use in treating, preventing or delaying the onset of a picornaviridae viral infection or disease or disorder associated with picornaviridae viral infection, by oral administration to a subject who it requires a pharmaceutical composition of a therapeutically effective dose of a compound of formula IB or formula II or a pharmaceutically acceptable salt thereof in combination with one or more antiviral agents.
La presente divulgación también proporciona un compuesto de fórmula IB o fórmula II para su uso en el tratamiento, prevención o retardo de la aparición de una infección vírica por paramyxoviridae o enfermedad o trastorno asociado con infección vírica por paramyxoviridae, por administración oral a un sujeto que los necesita de una dosis terapéuticamente eficaz de un compuesto de fórmula IB o fórmula II o una sal farmacéuticamente aceptable del mismo en combinación con uno o más agentes antivíricos.The present disclosure also provides a compound of formula IB or formula II for use in treating, preventing or delaying the onset of a paramyxoviridae viral infection or disease or disorder associated with paramyxoviridae viral infection, by oral administration to a subject who it requires a therapeutically effective dose of a compound of formula IB or formula II or a pharmaceutically acceptable salt thereof in combination with one or more antiviral agents.
En una realización, el método de tratamiento de una infección vírica, por ejemplo, infección por virus de la gripe o norovirus, comprende además administrar al menos un agente antivírico adicional. En una realización, el compuesto de fórmula II puede ser para su uso en combinación con un agente antivírico adicional. En una realización, el agente antivírico adicional es un adamantano. En una realización adicional, el agente antivírico adicional es amantadina o rimantadina. En otra realización, el agente antivírico adicional es un inhibidor de neuraminidasa (por ejemplo, oseltamivir, zanamivir, laninamivir y peramivir). En una realización adicional, el agente antivírico adicional es oseltamivir o zanamivir.In one embodiment, the method of treating a viral infection, eg, influenza virus or norovirus infection, further comprises administering at least one additional antiviral agent. In one embodiment, the compound Formula II may be for use in combination with an additional antiviral agent. In one embodiment, the additional antiviral agent is adamantane. In a further embodiment, the additional antiviral agent is amantadine or rimantadine. In another embodiment, the additional antiviral agent is a neuraminidase inhibitor (eg, oseltamivir, zanamivir, laninamivir, and peramivir). In a further embodiment, the additional antiviral agent is oseltamivir or zanamivir.
En algunas realizaciones, la composición farmacéutica de la presente divulgación (por ejemplo, un compuesto de fórmula IB o fórmula II) se administra en combinación con uno o más compuestos o composiciones seleccionados de midazolam, ciclosporina A, tacrólimus, ganciclovir, valganciclovir, foscavir, cidofovir, fármacos anti-CMV de segunda línea, fármacos anti-HCV de segunda línea, foscarnet, filgrastim, pegfilgrastim, corticoesteroides tales como budesonida, beclometasona e inhibidor de CYP de amplio espectro aminobenzotriazol o combinaciones de los mismos. In some embodiments, the pharmaceutical composition of the present disclosure (eg, a compound of formula IB or formula II) is administered in combination with one or more compounds or compositions selected from midazolam, cyclosporin A, tacrolimus, ganciclovir, valganciclovir, foscavir, cidofovir, second-line anti-CMV drugs, second-line anti-HCV drugs, foscarnet, filgrastim, pegfilgrastim, corticosteroids such as budesonide, beclomethasone, and broad spectrum CYP inhibitor aminobenzotriazole or combinations thereof.
En realizaciones adicionales, el compuesto es para su administración en combinación con al menos otro agente inmunodepresor. En una realización, el agente inmunodepresor se administra simultánea o secuencialmente. Los agentes inmunodepresores incluyen, aunque sin limitación, daclizumab, basiliximab, tacrólimus, sirólimus, micofenolato, ciclosporina A, glucocorticoesteroides, anticuerpos monoclonales anti-CD3, globulina antitimocito, anticuerpos monoclonales anti-CD52, azatioprina, everólimus, dactinomicina, ciclofosfamida, platino, nitrosourea, metotrexato, mercaptopurina, muromonab, IFN gamma, infliximab, etanercept, adalimumab, natalizumab, fingolimod y combinaciones de los mismos.In additional embodiments, the compound is for administration in combination with at least one other immunosuppressive agent. In one embodiment, the immunosuppressive agent is administered simultaneously or sequentially. Immunosuppressive agents include, but are not limited to, daclizumab, basiliximab, tacrolimus, sirolimus, mycophenolate, cyclosporin A, glucocorticosteroids, anti-CD3 monoclonal antibodies, antithymocyte globulin, anti-CD52 monoclonal antibodies, azathioprine, everolimus, platinosfynomycin, , methotrexate, mercaptopurine, muromonab, IFN gamma, infliximab, etanercept, adalimumab, natalizumab, fingolimod, and combinations thereof.
Los compuestos o composiciones proporcionados en este documento también pueden usarse en combinación con un agente potenciador, con otros ingredientes activos, o con un agente inmunodepresor. En determinadas realizaciones, los compuestos pueden administrarse en combinación, o secuencialmente, con otro agente terapéutico o un potenciador. Dichos otros agentes terapéuticos incluyen los conocidos para el tratamiento, prevención o mejora de uno o más síntomas asociados con infecciones víricas. Debe entenderse que cualquier combinación adecuada de los compuestos proporcionados en este documento con uno o más de los compuestos mencionados anteriormente y opcionalmente una o más sustancias farmacológicamente activas adicionales se considera dentro del alcance de la presente divulgación. En otra realización, el compuesto proporcionado en este documento se administra antes o después del uno o más ingredientes activos adicionales. En una realización, dos o más de los agentes antivíricos divulgados en este documento se administran en serie o en combinación. La cantidad de algunos potenciadores puede seleccionarse usando métodos conocidos en la técnica para potenciar la biodisponibilidad del agente antivírico. Puede usarse cualquier cantidad que proporcione una respuesta deseada por algunos potenciadores. Las dosificaciones pueden variar, en un ejemplo no limitante, de 0,001 mg a aproximadamente 3000 mg de compuesto por kilogramo de peso corporal por día, por ejemplo, de 0,01 a 500 mg/kg, o por ejemplo, 0,1-20 mg/kg.The compounds or compositions provided herein can also be used in combination with an enhancing agent, with other active ingredients, or with an immunosuppressive agent. In certain embodiments, the compounds can be administered in combination, or sequentially, with another therapeutic agent or an enhancer. Such other therapeutic agents include those known for the treatment, prevention or amelioration of one or more symptoms associated with viral infections. It should be understood that any suitable combination of the compounds provided herein with one or more of the above-mentioned compounds and optionally one or more additional pharmacologically active substances is considered within the scope of the present disclosure. In another embodiment, the compound provided herein is administered before or after the one or more additional active ingredients. In one embodiment, two or more of the antiviral agents disclosed herein are administered in series or in combination. The amount of some enhancers can be selected using methods known in the art to enhance the bioavailability of the antiviral agent. Any amount that provides a response desired by some enhancers can be used. Dosages may range, in a non-limiting example, from 0.001 mg to about 3000 mg of compound per kilogram of body weight per day, for example 0.01 to 500 mg / kg, or for example 0.1-20 mg / kg.
El comportamiento farmacocinético de una composición variará algo de un sujeto a otro dentro de una población. Los números descritos anteriormente para las composiciones divulgadas en este documento se basan en el comportamiento promedio en una población. La presente divulgación pretende abarcar composiciones que de promedio estén dentro de los intervalos divulgados, aunque se entiende que determinados sujetos pueden estar fuera de los intervalos.The pharmacokinetic behavior of a composition will vary somewhat from subject to subject within a population. The numbers described above for the compositions disclosed herein are based on average behavior in a population. The present disclosure is intended to encompass compositions that are on average within the disclosed ranges, although it is understood that certain subjects may be outside the ranges.
Las composiciones farmacéuticas pueden incluirse en un recipiente, envase o dosificador junto con instrucciones para su administración. La presente divulgación proporciona un kit que incluye, además de una composición farmacéutica de uno cualquiera de los compuestos divulgados, un recipiente, envase o dosificador con instrucciones para su administración.The pharmaceutical compositions can be included in a container, pack or dispenser together with instructions for their administration. The present disclosure provides a kit that includes, in addition to a pharmaceutical composition of any one of the disclosed compounds, a container, pack or dispenser with instructions for its administration.
Un compuesto de la presente divulgación, o una sal, profármaco, metabolito, análogo o derivado farmacéuticamente aceptable del mismo, puede administrarse en combinación con un segundo compuesto antivírico. Por ejemplo, como se indica anteriormente, las composiciones de la presente divulgación pueden incluir los compuestos como se describen anteriormente en combinación con uno o más (por ejemplo, 1, 2, 3) agentes activos adicionales tal como se describe en esta sección, de manera análoga a como se conoce en la técnica. Los agentes activos antivíricos adicionales que pueden usarse con los compuestos de la presente divulgación en la realización de los presentes métodos incluyen, aunque sin limitación, los que están dirigidos al canales de iones M2 en virus de la gripe A (por ejemplo, los adamantanos, tales como amantadina y rimantadina); los que inhiben la pérdida de cubierta vírica después de la entrada en la célula, agentes que bloquean la liberación de los viriones recién formados desde la superficie de células infectadas (por ejemplo, los inhibidores de neuraminidasa, tales como oseltamivir y zanamivir). Métodos para preven ir enfermedades o trastornos debidos a reactivación del virus. A compound of the present disclosure, or a pharmaceutically acceptable salt, prodrug, metabolite, analog or derivative thereof, can be administered in combination with a second antiviral compound. For example, as indicated above, the compositions of the present disclosure may include the compounds as described above in combination with one or more (eg, 1, 2, 3) additional active agents as described in this section, of analogous to as is known in the art. Additional antiviral active agents that can be used with the compounds of the present disclosure in performing the present methods include, but are not limited to, those that target the M2 ion channels in influenza A viruses (e.g., adamantanes, such as amantadine and rimantadine); those that inhibit the loss of viral coat after entry into the cell, agents that block the release of newly formed virions from the surface of infected cells (eg, neuraminidase inhibitors, such as oseltamivir and zanamivir). Methods to prevent diseases or disorders due to reactivation of the virus.
En este documento también se divulga un método de prevención de una enfermedad o trastorno en un sujeto en riesgo de reactivación de infección vírica, administrando por vía oral al sujeto una composición farmacéutica de una dosis terapéuticamente eficaz de un compuesto de fórmula IB o fórmula II o una sal farmacéuticamente aceptable del mismo. En algunas realizaciones, el virus en riesgo de reactivación puede ser virus de la gripe, norovirus, EBV, virus del Ébola, picornaviridae, paramyxoviridae y virus de Marburgo. En algunas realizaciones preferidas, el virus en riesgo de reactivación puede ser el virus de la gripe.Also disclosed herein is a method of preventing a disease or disorder in a subject at risk of reactivation of viral infection, orally administering to the subject a pharmaceutical composition of a therapeutically effective dose of a compound of formula IB or formula II or a pharmaceutically acceptable salt thereof. In some embodiments, the virus at risk of reactivation can be influenza virus, norovirus, EBV, Ebola virus, picornaviridae, paramyxoviridae, and Marburg virus. In some preferred embodiments, the virus at risk of reactivation can be the influenza virus.
Efecto de los alimentos Effect of food
En algunas realizaciones, la composición farmacéutica de las presentes realizaciones, por ejemplo, comprimido o suspensión, puede proporcionarse a un sujeto cuando el sujeto está en ayunas o en estado nutrido. En una realización, la composición que comprende un compuesto de fórmula IB o fórmula II (o una sal farmacéuticamente aceptable del mismo) puede proporcionarse a un sujeto que tiene el estómago vacío, por ejemplo, después de ayudar durante menos de 24 horas, pero más de 12 horas, más de 11 horas, más de 10 horas, más de 8 horas o más de 5 horas.In some embodiments, the pharmaceutical composition of the present embodiments, eg, tablet or suspension, can be provided to a subject when the subject is fasting or in a nourished state. In one embodiment, the composition comprising a compound of formula IB or formula II (or a pharmaceutically acceptable salt thereof) can be provided to a subject who has an empty stomach, for example, after helping for less than 24 hours, but longer. 12 hours, more than 11 hours, more than 10 hours, more than 8 hours or more than 5 hours.
En otras realizaciones, la composición que comprende un compuesto de fórmula IB o fórmula II (o una sal farmacéuticamente aceptable del mismo) puede proporcionarse a un sujeto con alimento o después de haber tomado alimento. En una realización, un compuesto de fórmula I, fórmula IA, fórmula IB o fórmula II (o una sal farmacéuticamente aceptable del mismo) puede tomarlo un sujeto con el estómago vacío.In other embodiments, the composition comprising a compound of formula IB or formula II (or a pharmaceutically acceptable salt thereof) can be provided to a subject with food or after food has been taken. In one embodiment, a compound of Formula I, Formula IA, Formula IB, or Formula II (or a pharmaceutically acceptable salt thereof) can be taken by a subject on an empty stomach.
Población de pacientesPatient population
En determinadas realizaciones, los compuestos de fórmula IB o fórmula II (o una sal farmacéuticamente aceptable de los mismos), una composición que comprende un compuesto de fórmula IB o fórmula II, o una politerapia que comprende una composición de fórmula IB o fórmula II se administra a un mamífero que lo necesita (por ejemplo, un ser humano) que es de aproximadamente 1 a 6 meses de edad, de 6 a 12 meses de edad, de 1 a 5 años de edad, de 5 a 10 años de edad, de 10 a 15 años de edad, de 15 a 20 años de edad, de 20 a 25 años de edad, de 25 a 30 años de edad, de 30 a 35 años de edad, de 35 a 40 años de edad, de 40 a 45 años de edad, de 45 a 50 años de edad, de 50 a 55 años de edad, de 55 a 60 años de edad, de 60 a 65 años de edad, de 65 a 70 años de edad, de 70 a 75 años de edad, de 75 a 80 años de edad, de 80 a 85 años de edad, de 85 a 90 años de edad, de 90 a 95 años de edad o de 95 a 100 años de edad. En algunas realizaciones, el mamífero padece una infección vírica (por ejemplo, una infección por virus de ARNmc tal como una infección por norovirus).In certain embodiments, compounds of formula IB or formula II (or a pharmaceutically acceptable salt thereof), a composition comprising a compound of formula IB or formula II, or a combination therapy comprising a composition of formula IB or formula II are administered to a mammal in need of it (e.g. human) that is approximately 1 to 6 months old, 6 to 12 months old, 1 to 5 years old, 5 to 10 years old, 10-15 years old, 15-20 years old, 20-25 years old, 25-30 years old, 30-35 years old, 35-40 years old, 40 to 45 years of age, 45 to 50 years of age, 50 to 55 years of age, 55 to 60 years of age, 60 to 65 years of age, 65 to 70 years of age, 70 to 75 years old, 75-80 years old, 80-85 years old, 85-90 years old, 90-95 years old, or 95-100 years old. In some embodiments, the mammal is suffering from a viral infection (eg, a ssRNA virus infection such as a norovirus infection).
En determinadas realizaciones, un compuesto de fórmula IB o fórmula II, una composición que comprende un compuesto de fórmula IB o fórmula II, o una politerapia que comprende un compuesto de fórmula IB o fórmula II se administra a un ser humano en riesgo de desarrollar una infección vírica. En determinadas realizaciones, un compuesto de fórmula IB o fórmula II, una composición que comprende un compuesto de fórmula IB o fórmula II, o una politerapia que comprende un compuesto de fórmula IB o fórmula II se administra a un ser humano con una infección vírica. En determinadas realizaciones, el paciente es un ser humano de aproximadamente 1 a 6 meses de edad, de 6 a 12 meses de edad, de 1 a 5 años de edad, de 5 a 10 años de edad, de 5 a 12 años de edad, de 10 a 15 años de edad, de 15 a 20 años de edad, de 13 a 19 años de edad, de 20 a 25 años de edad, de 25 a 30 años de edad, de 20 a 65 años de edad, de 30 a 35 años de edad, de 35 a 40 años de edad, de 40 a 45 años de edad, de 45 a 50 años de edad, de 50 a 55 años de edad, de 55 a 60 años de edad, de 60 a 65 años de edad, de 65 a 70 años de edad, de 70 a 75 años de edad, de 75 a 80 años de edad, de 80 a 85 años de edad, de 85 a 90 años de edad, de 90 a 95 años de edad o de 95 a 100 años de edad.In certain embodiments, a compound of formula IB or formula II, a composition comprising a compound of formula IB or formula II, or a combination therapy comprising a compound of formula IB or formula II is administered to a human at risk of developing a viral infection. In certain embodiments, a compound of formula IB or formula II, a composition comprising a compound of formula IB or formula II, or a combination therapy comprising a compound of formula IB or formula II is administered to a human with a viral infection. In certain embodiments, the patient is a human approximately 1 to 6 months old, 6 to 12 months old, 1 to 5 years old, 5 to 10 years old, 5 to 12 years old. , 10-15 years old, 15-20 years old, 13-19 years old, 20-25 years old, 25-30 years old, 20-65 years old, from 30-35 years old, 35-40 years old, 40-45 years old, 45-50 years old, 50-55 years old, 55-60 years old, 60- 65 years old, 65-70 years old, 70-75 years old, 75-80 years old, 80-85 years old, 85-90 years old, 90-95 years old old or 95 to 100 years old.
En algunas realizaciones, un compuesto de fórmula IB o fórmula II, una composición que comprende un compuesto de fórmula IB o fórmula II, o una politerapia que comprende un compuesto de fórmula IB o fórmula II se administra a un lactante humano. En otras realizaciones, un compuesto de fórmula IB o fórmula II, o una politerapia que comprende un compuesto de fórmula IB o fórmula II se administra a un niño humano. En otras realizaciones, un compuesto de fórmula IB o fórmula II, una composición que comprende un compuesto de fórmula IB o fórmula II, o una politerapia que comprende un compuesto de fórmula IB o fórmula II se administra a un adulto humano. En otras realizaciones más, un compuesto de fórmula IB o fórmula II, una composición que comprende un compuesto de fórmula IB o fórmula II, o una politerapia que comprende un compuesto de fórmula IB o fórmula II se administra a un ser humano anciano. In some embodiments, a compound of formula IB or formula II, a composition comprising a compound of formula IB or formula II, or a combination therapy comprising a compound of formula IB or formula II is administered to a human infant. In other embodiments, a compound of formula IB or formula II, or a combination therapy comprising a compound of formula IB or formula II is administered to a human infant. In other embodiments, a compound of formula IB or formula II, a composition comprising a compound of formula IB or formula II, or a combination therapy comprising a compound of formula IB or formula II is administered to a human adult. In still other embodiments, a compound of formula IB or formula II, a composition comprising a compound of formula IB or formula II, or a combination therapy comprising a compound of formula IB or formula II is administered to an elderly human.
Todos los porcentajes y relaciones usados en este documento, salvo que se indique de otro modo, son en peso. Otros rasgos característicos y ventajas de la presente divulgación son evidentes a partir de los diferentes ejemplos. Los ejemplos proporcionados ilustran diferentes componentes y metodología útiles en la práctica de la presente divulgación. Los ejemplos no limitan la divulgación reivindicada. Basándose en la presente divulgación, los expertos en la materia pueden identificar y emplear otros componentes y metodología útiles para la práctica de la presente divulgación. All percentages and ratios used in this document, unless otherwise indicated, are by weight. Other characteristic features and advantages of the present disclosure are apparent from the different examples. The provided examples illustrate different components and methodology useful in the practice of the present disclosure. The examples do not limit the claimed disclosure. Based on the present disclosure, those skilled in the art can identify and employ other components and methodology useful in the practice of the present disclosure.
En algunas realizaciones, el compuesto de fórmula II es:In some embodiments, the compound of formula II is:
o una sal, solvato, enantiómero, diastereoisómero, racemato o mezcla farmacéuticamente aceptable del mismo. En algunas realizaciones, los compuestos son:or a pharmaceutically acceptable salt, solvate, enantiomer, diastereoisomer, racemate, or mixture thereof. In some embodiments, the compounds are:
o sales, solvatos, enantiómeros, diastereoisómeros, racematos o mezclas farmacéuticamente aceptables de los mismos (en los que * indica compuestos que no son de acuerdo con la presente invención.or pharmaceutically acceptable salts, solvates, enantiomers, diastereoisomers, racemates or mixtures thereof (where * indicates compounds not in accordance with the present invention.
Los diagramas de HPLC se registraron en una columna Zorbax Eclipse Plus C18 (4,6 x 50 mm x 1,8 pm). La primera fase móvil fue un 97,5 % de agua : 2,5 % de acetonitrilo : 0,05 % de ácido trifluoroacético. La segunda fase móvil fue un 97,5 % de acetonitrilo : 2,5 % de agua : 0,05 % de ácido trifluoroacético.HPLC charts were recorded on a Zorbax Eclipse Plus C18 column (4.6 x 50 mm x 1.8 pm). The first mobile phase was 97.5% water: 2.5% acetonitrile: 0.05% trifluoroacetic acid. The second mobile phase was 97.5% acetonitrile: 2.5% water: 0.05% trifluoroacetic acid.
Las RMN de 1H se registraron a 300 MHz salvo que se indique otra cosa.1H NMRs were recorded at 300 MHz unless otherwise indicated.
Ensayos antivíricos y de citotoxicidadAntiviral and Cytotoxicity Assays
Cultivo de células y cepas de virus: Se prepararon fibroblastos de prepucio humano (HFF) a partir de tejido de prepucio humano. El tejido se incubó en medio de cultivo celular que consistía en medio esencial mínimo (MEM) con sales de Earle complementado con suero bovino fetal (FBS) al 10 %, y concentraciones convencionales de L-glutamina, fungizone y vancomicina. El tejido entonces se puso en solución salina tamponada con fosfato (PBS), se trituró, se aclaró para retirar los glóbulos rojos y se resuspendió en solución de tripsina/EDTA. La suspensión de tejido se incubó a 37 °C y se agitó suavemente para dispersar las células, que después se recogieron por centrifugación. Las células se resuspendieron en un medio y se pusieron en un matraz de histocultivo y se incubaron a 37 °C en una estufa de incubación de CO2 humidificada. El medio entonces se remplazó con medio reciente y se controló el crecimiento celular diariamente hasta que se formó una monocapa de células confluyentes. Las células HFF entonces se expandieron a través de pases en serie en medio de crecimiento convencional de MEM con sales de Earle complementado con FBS al 10 %, L-glutamina, penicilina y gentamicina. Las células se pasaron de manera rutinaria y se usaron para ensayos en o por debajo del pase 10. Cell culture and virus strains: Human foreskin fibroblasts (HFF) were prepared from human foreskin tissue. The tissue was incubated in cell culture medium consisting of minimal essential medium (MEM) with Earle's salts supplemented with 10% fetal bovine serum (FBS), and standard concentrations of L-glutamine, fungizone and vancomycin. The tissue was then placed in phosphate buffered saline (PBS), ground, rinsed to remove red blood cells, and resuspended in trypsin / EDTA solution. The tissue suspension was incubated at 37 ° C and gently shaken to disperse the cells, which were then collected by centrifugation. Cells were resuspended in medium and placed in a histoculture flask and incubated at 37 ° C in a humidified CO 2 incubator. The medium was then replaced with fresh medium and cell growth was monitored daily until a confluent cell monolayer was formed. The HFF cells were then expanded through serial passages in conventional MEM growth medium with Earle's salts supplemented with 10% FBS, L-glutamine, penicillin, and gentamicin. Cells were routinely passaged and used for assays at or below passage 10.
Virus de la gripe: Los virus de la gripe se pasaron en células de riñón canino para crear soluciones madre de trabajo, que se usaron para los ensayos antivíricos. Influenza Viruses: Influenza viruses were passed into canine kidney cells to create working stock solutions, which were used for antiviral assays.
Ensayos antivíricos: Cada experimento que evaluó la actividad antivírica de los compuestos incluyó compuestos tanto de control positivo como de control negativo para garantizar el funcionamiento de cada ensayo. Se realizó evaluación simultánea de la citotoxicidad cuando fue posible a niveles equivalentes de exposición al compuesto. Los métodos se presentan en concentraciones eficaces que dan reducciones de un 50 % en la replicación vírica in vitro (CE50 ), concentraciones que producen un 50 % de reducción en la viabilidad celular (CC50 ) y el índice de selectividad (IS, calculado como CC50 dividida por CE50 ). Cuando había suficiente material disponible, se realizaron múltiples ensayos para cada evaluación de compuesto para obtener datos estadísticos. Antiviral Assays: Each experiment that evaluated the antiviral activity of compounds included both positive control and negative control compounds to ensure the performance of each assay. Simultaneous evaluation of cytotoxicity was performed when possible at equivalent levels of exposure to the compound. The methods are presented in effective concentrations that give 50% reductions in viral replication in vitro (EC 50 ), concentrations that produce a 50% reduction in cell viability (CC 50 ) and the selectivity index (SI, calculated as CC 50 divided by CE 50 ). When sufficient material was available, multiple tests were performed for each compound evaluation to obtain statistical data.
Ensayos de citotoxicidad: Cada ensayo antivírico incluyó un ensayo paralelo de citotoxicidad con las mismas células usadas para cada virus, el mismo número de células, las mismas concentraciones de fármaco y los mismos tiempos de incubación para proporcionar la misma exposición al fármaco. Para garantizar que la citotoxicidad de todos los compuestos pudiera compararse directamente, se realizó un ensayo de citotoxicidad de captación de rojo neutro convencional para todos los compuestos en células HFF confluyentes con un periodo de incubación de 7 días. Cytotoxicity Assays: Each antiviral assay included a parallel cytotoxicity assay with the same cells used for each virus, the same number of cells, the same drug concentrations, and the same incubation times to provide the same drug exposure. To ensure that the cytotoxicity of all compounds could be directly compared, a standard neutral red uptake cytotoxicity assay was performed for all compounds on confluent HFF cells with an incubation period of 7 days.
Ensayos de citotoxicidad de captación de rojo neutro: Cada compuesto se evaluó en un ensayo de citotoxicidad convencional por métodos convencionales. En resumen, se sembraron células HFF en placas de histocultivo en medio de histocultivo convencional. Después de 24 h de incubación, el medio se remplazó con medio de cultivo celular de mantenimiento y se añadieron los compuestos y después se usaron entonces diluciones en serie de factor 5 para generar una serie de concentraciones de compuesto. Las placas de ensayo se incubaron durante 7 días, y se añadió solución de rojo neutro en PBS a cada pocillo y las placas se incubaron durante 1 h. El colorante entonces se retiró, las placas se aclararon con PBS y el tinte internalizado por las células viables se solubilizó en PBS complementado con etanol al 50 % y ácido acético glacial al 1 %. Entonces se determinó la densidad óptica y se interpolaron los valores de CC50 a partir de los datos experimentales. Neutral Red Uptake Cytotoxicity Assays: Each compound was evaluated in a standard cytotoxicity assay by standard methods. Briefly, HFF cells were seeded in histoculture plates in conventional histoculture medium. After 24 h of incubation, the medium was replaced with maintenance cell culture medium and compounds were added and then serial dilutions of factor 5 were then used to generate a series of compound concentrations. Assay plates were incubated for 7 days, and neutral red solution in PBS was added to each well and the plates were incubated for 1 hr. The dye was then removed, the plates were rinsed with PBS, and the dye internalized by viable cells was solubilized in PBS supplemented with 50% ethanol and 1% glacial acetic acid. The optical density was then determined and the CC 50 values were interpolated from the experimental data.
Para todos los ensayos de reducción de placas en células HFF, se realizaron ensayos de citotoxicidad de rojo neutro en un conjunto paralelo de placas de 6 pocillos que contenían células HFF no infectadas que recibieron las mismas concentraciones de compuesto que las usadas para los ensayos antivíricos. Las placas de citotoxicidad se retiraron de la estufa de incubación en el mismo día que cada ensayo antivírico y se tiñó la monocapa de células con una solución de rojo neutro en PBS. El tinte entonces se retiró, se aclaró el tinte residual de las células con PBS, y se inspeccionaron las monocapas de células visualmente para cualquier signo de toxicidad. La viabilidad celular se determinó usando un ensayo de proliferación celular de acuerdo con las instrucciones del fabricante.For all HFF cell plaque reduction assays, neutral red cytotoxicity assays were performed on a parallel set of 6-well plates containing uninfected HFF cells that received the same compound concentrations as used for antiviral assays. The cytotoxicity plates were removed from the incubator on the same day as each antiviral assay and the cell monolayer was stained with a solution of neutral red in PBS. The dye was then removed, residual dye was rinsed from the cells with PBS, and the cell monolayers were visually inspected for any signs of toxicity. Cell viability was determined using a cell proliferation assay according to the manufacturer's instructions.
Ensayos de proliferación celular: La inhibición de la proliferación de células HFF se usó para refinar las estimaciones de citotoxicidad para algunos compuestos y se realizó de acuerdo con un procedimiento convencional usado en el laboratorio. Las células se sembraron a una baja densidad en placas usando medio de cultivo convencional. Después de 24 h, se aspiró el medio y se preparó una serie de soluciones de compuesto en el medio de crecimiento. Las placas se incubaron durante 72 h a 37 °C, y las células entonces se desprendieron con tripsina y se contaron. Las concentraciones de compuesto que reducían la proliferación celular en un 50 % se interpolaron de los datos experimentales. Cell proliferation assays: Inhibition of HFF cell proliferation was used to refine estimates of cytotoxicity for some compounds and was performed according to a standard procedure used in the laboratory. Cells were plated at low density using standard culture medium. After 24 h, the medium was aspirated and a series of compound solutions were prepared in the growth medium. The plates were incubated for 72 hrs at 37 ° C, and the cells were then detached with trypsin and counted. Compound concentrations that reduced cell proliferation by 50% were interpolated from the experimental data.
Citotoxicidad en ensayos de linfocitos: La viabilidad celular en todos los ensayos con linfocitos se evaluó con un ensayo de viabilidad celular luminiscente. En resumen, se incubaron placas de ensayo a temperatura ambiente durante 30 min, después se añadió reactivo luminiscente a cada pocillo y las placas se mezclaron para lisar las células. Las placas entonces se incubaron a temperatura ambiente y se cuantificó la luminiscencia en un luminómetro. Se usaron métodos convencionales para calcular las concentraciones de fármaco que inhibían la proliferación de las células en un 50 % (CC50 ). Cytotoxicity in lymphocyte assays: Cell viability in all lymphocyte assays was evaluated with a luminescent cell viability assay. Briefly, assay plates were incubated at room temperature for 30 min, then luminescent reagent was added to each well and the plates were mixed to lyse cells. The plates were then incubated at room temperature and luminescence was quantified on a luminometer. Conventional methods were used to calculate drug concentrations that inhibited cell proliferation by 50% (CC 50 ).
Ensayo de norovirus de ratón (MNV): Se incubaron células RAW a 37 °C con un 5 % de CO2 en medio de cultivo celular. El aislado de norovirus de ratón usado en este ensayo se aisló de un ratón natural. Mouse norovirus (MNV) assay: RAW cells were incubated at 37 ° C with 5% CO 2 in cell culture medium. The mouse norovirus isolate used in this assay was isolated from a wild-type mouse.
Se añadieron diluciones en serie de los compuestos de ensayo en DMEM a placas tratadas con histocultivo. Se añadió suspensión celular a las diluciones de compuesto en la placa, y se incubaron a 37 °C con un 5 % de CO2 durante 2 días. Cada placa de ensayo incluía controles de células sin infectar y pocillos de control de virus sin tratar. Después de 2 días de incubación, se añadió reactivo MTS acuoso como indica el fabricante en cada pocillo y se incubó a 37 °C hasta que los controles de células sin tratar revelaron una absorbancia a 490 nm entre 1,1 y 1,8. Se leyeron las lecturas de absorbancia finales y se usó un programa informático para calcular la concentración que protegía las células RAW infectadas con MNV en un 50 % en comparación con controles de células sin infectar (CE50).Serial dilutions of test compounds in DMEM were added to histocultured plates. Cell suspension was added to the compound dilutions on the plate, and incubated at 37 ° C with 5% CO 2 for 2 days. Each assay plate included uninfected cell controls and untreated virus control wells. After 2 days of incubation, aqueous MTS reagent as directed by the manufacturer was added to each well and incubated at 37 ° C until untreated cell controls revealed an absorbance at 490 nm between 1.1 and 1.8. Final absorbance readings were read and a computer program was used to calculate the concentration that protected RAW cells infected with MNV by 50% compared to uninfected cell controls (EC50).
Ensayos de norovirus humano: La actividad antivírica contra un norovirus (NoV) humano se evaluó en un ensayo de 3 días usando una línea celular de replicón de norovirus humano de expresión estable, mantenida como cultivos subconfluyentes. En algunas realizaciones, pueden usarse 4 dosis (etapas de factor 10 o factor 3), por triplicado. La actividad antivírica se determinó por análisis de hibridación en transferencia de ARN de NoV intracelular (normalizado al nivel de ARN de p-actina celular en cada muestra de cultivo). La citotoxicidad se evaluó por captación de tinte rojo neutro en cultivos mantenidos en placas paralelas (Korba y Gerin, 1992, Antivir. Res. 19:55). Human Norovirus Assays: Antiviral activity against a human norovirus (NoV) was evaluated in a 3-day assay using a stable expression human norovirus replicon cell line, maintained as subconfluent cultures. In some embodiments, 4 doses (factor 10 or factor 3 steps) can be used, in triplicate. Antiviral activity was determined by intracellular NoV RNA blot hybridization analysis (normalized to the level of cellular p-actin RNA in each culture sample). Cytotoxicity was evaluated by neutral red dye uptake in cultures maintained in parallel plates (Korba and Gerin, 1992, Antivir. Res. 19:55).
Los valores de CE50 y CC50 se calcularon por análisis de regresión lineal usando datos combinados de todos los cultivos tratados (Korba y Gerin, 1992, Antivir. Res. 19:55; Okuse, et al., 2005, Antivir. Res. 65:23). Las desviaciones típicas para los valores de CE50 y CE90 se calcularon a partir de los errores típicos generados por los análisis de regresión. La CE50 y la CE90 son concentraciones de fármaco a las que se observa un descenso de factor 2 o factor 10 del ARN de NoV intracelular (con respecto a los niveles promedio en cultivos sin tratar), respectivamente. La CC50 es la concentración de fármaco a la que se observa un nivel 2 veces menor de captación de tinte rojo neutro (con respecto a los niveles promedio en cultivos sin tratar). El índice de selectividad (I.S.) se calcula como CC50 /CE50. Se usa interferón 2b humano recombinante (PBL laboratories, Inc.) como control de ensayo.EC 50 and CC 50 values were calculated by linear regression analysis using pooled data from all treated cultures (Korba and Gerin, 1992, Antivir. Res. 19:55; Okuse, et al., 2005, Antivir. Res. 65:23). The standard deviations for the EC 50 and EC 90 values were calculated from the standard errors generated by the regression analyzes. EC 50 and EC 90 are drug concentrations at which there is a factor 2 or factor 10 decrease in intracellular NoV RNA (relative to average levels in untreated cultures), respectively. The CC 50 is the drug concentration at which a 2-fold lower level of neutral red dye uptake is observed (relative to average levels in untreated cultures). The selectivity index (IS) is calculated as CC 50 / EC 50 . Recombinant human interferon 2b (PBL laboratories, Inc.) is used as an assay control.
CE 50 de BKV en células VERO: Se sembraron placas de histocultivo con células Vero en DMEM que contenía suero bovino fetal convencional Hyclone al 2 % y penicilina y estreptomicina Hyclone al 1 %. Las células se inocularon con BKV. Se añadieron diluciones en serie de compuestos de ensayo a las células y las placas se incubaron durante 10 días a 37 °C en un 5 % de CO2. Después de la incubación de 10 días, el sobrenadante se mezcló con tampón de lisis. Cada placa se incubó C. Se midió el ADN de BKV del sobrenadante por reacción en cadena de la polimerasa cuantitativa (qPCR) usando los cebadores directo e inverso de PCR de BKV, y una sonda marcada con FAM. La cuantificación absoluta del número de copias del virus se realizó usando una curva patrón con diluciones de amplicón de ADN de BKV que contenía secuencias homólogas al fragmento amplificado. EC 50 of BKV in VERO cells: Histoculture plates were seeded with Vero cells in DMEM containing 2% Hyclone standard fetal bovine serum and 1% Hyclone penicillin and streptomycin. Cells were inoculated with BKV. Serial dilutions of test compounds were added to the cells and the plates were incubated for 10 days at 37 ° C in 5% CO 2 . After the 10 day incubation, the supernatant was mixed with lysis buffer. Each plate was incubated C. The BKV DNA from the supernatant was measured by quantitative polymerase chain reaction (qPCR) using the BKV PCR forward and reverse primers, and a FAM-labeled probe. Absolute quantification of virus copy number was performed using a standard curve with dilutions of BKV DNA amplicon containing sequences homologous to the amplified fragment.
Ensayos de reducción de placas para HSV-1, HSV-2, VZV y HCMV: Se prepararon monocapas de células en placas de seis pocillos y se incubaron para permitir que las células alcanzaran la confluencia. Entonces se aspiró el medio de los pocillos y se añadió virus a cada uno de los tres pocillos para producir 20-30 placas en cada pocillo. Se permitió que el virus se adsorbiera en las células durante 1 h y las placas se balancearon suavemente cada 15 min para redistribuir el medio. Los compuestos se diluyeron en medio de cultivo celular de mantenimiento que consiste en MEM con sales de Earle complementado con FBS al 2 %, L-glutamina, penicilina y gentamicina. Las soluciones se añadieron a pocillos duplicados y las placas se incubaron durante diversos tiempos, dependiendo del virus usado. El ensayo de reducción de placas con la cepa F de HSV-1 se realizó de una manera similar, pero con células Vero infectadas un día después de la siembra en placa. Para HSV-1 y 2, las monocapas se tiñeron con violeta de genciana al 1 % en metanol al 20 % y el tinte no unido se retiró por lavado con dH2 O. Para ensayos con HCMV y VZV, la monocapa de células se tiñó con solución de rojo neutro al 1 % durante 4 h, después el colorante se aspiró y las células se lavaron con PBS. Para todos los ensayos, se enumeraron las placas usando un estereomicroscopio y la concentración de compuesto que reducía la formación de placas en un 50 % (CE50) se interpoló de los datos experimentales. Plaque Reduction Assays for HSV-1, HSV-2, VZV, and HCMV: Cell monolayers were prepared in six-well plates and incubated to allow cells to reach confluence. The medium was then aspirated from the wells and virus was added to each of the three wells to produce 20-30 plaques in each well. The virus was allowed to adsorb on the cells for 1 h and the plates were gently rocked every 15 min to redistribute the medium. Compounds were diluted in maintenance cell culture medium consisting of MEM with Earle's salts supplemented with 2% FBS, L-glutamine, penicillin, and gentamicin. The solutions were added to duplicate wells and the plates were incubated for various times, depending on the virus used. The plaque reduction assay with HSV-1 strain F was performed in a similar manner, but with infected Vero cells one day after plating. For HSV-1 and 2, monolayers were stained with 1% gentian violet in 20% methanol and unbound dye was washed away with dH 2 O. For HCMV and VZV assays, the cell monolayer was stained with 1% neutral red solution for 4 h, then the dye was aspirated and the cells were washed with PBS. For all tests, the plaques were enumerated using a stereomicroscope and the concentration of compound that reduced plaque formation by 50% (EC50) was interpolated from the experimental data.
Ensayos de reducción de placas para MCMV: Se prepararon fibroblastos de embrión de ratón a partir de embriones de ratón usando un procedimiento similar al resumido anteriormente para células HFF y se suspendieron en medio de histocultivo como se describe anteriormente y se sembraron en placas y se incubaron. El medio se aspiró y las monocapas de células se infectaron con MCMV. Las células infectadas entonces se incubaron a 37 °C durante 1 h y las placas se balancearon ocasionalmente para garantizar que el medio cubría la monocapa completa. Los compuestos se diluyeron en serie en medio de cultivo celular de mantenimiento de tejidos descrito anteriormente y las soluciones se añadieron a las monocapas infectadas. Las monocapas infectadas se incubaron durante 7 días y después se tiñeron con solución de rojo neutro como se describe anteriormente. Las placas se enumeraron y los valores de CE50 se interpolaron de los datos experimentales por métodos convencionales. Plaque Reduction Assays for MCMV: Mouse embryo fibroblasts were prepared from mouse embryos using a procedure similar to that outlined above for HFF cells and suspended in histoculture medium as described above and plated and incubated. . The medium was aspirated and the cell monolayers were infected with MCMV. The infected cells were then incubated at 37 ° C for 1 h and the plates were occasionally rocked to ensure that the medium covered the entire monolayer. Compounds were serially diluted in tissue maintenance cell culture medium described above and the solutions were added to the infected monolayers. The infected monolayers were incubated for 7 days and then stained with neutral red solution as described above. Plates were numbered and EC50 values interpolated from experimental data by standard methods.
Ensayos de cuantificación de ADN para EBV y HHV-6B: Los ensayos para EBV se realizaron en células Akata que se indujeron para que experimentaran una infección lítica con anticuerpo de cabra anti-IgG humana por métodos convencionales. Los compuestos experimentales se diluyeron en placas. Las células Akata se añadieron a las placas y se incubaron. Para HHV-6, los compuestos se diluyeron en serie, después se añadieron células HSB-2 o Molt-3 sin infectar a cada pocillo. La infección se inició añadiendo células H SB-2 infectadas con HHV-6A o células Molt-3 infectadas con HHV-6B, y se incubaron durante 7 días a 37 °C. Para todos los ensayos, se añadió tampón de desnaturalización a cada pocillo para desnaturalizar el ADN y se aspiró una alícuota a través de una membrana de nailon. Entonces se permitió que las membranas se secaran antes de equilibrado en DIG. Se prepararon sondas marcadas con digoxigenina (DIG) específicas para cada virus de acuerdo con el protocolo del fabricante. La detección de la sonda DIG unida específicamente se realizó con anticuerpo anti-DIG usando el protocolo del fabricante. Se capturó una imagen de la película fotográfica y se cuantificó y las concentraciones de compuesto suficientes para reducir la acumulación de ADN vírico en un 50 % (CE50) se interpolaron de los datos experimentales. DNA Quantitation Assays for EBV and HHV-6B: The EBV assays were performed on Akata cells that were induced to undergo lytic infection with goat anti-human IgG antibody by standard methods. The experimental compounds were diluted on plates. The Akata cells were added to the plates and incubated. For HHV-6, compounds were serially diluted, then uninfected HSB-2 or Molt-3 cells were added to each well. The infection was initiated by adding HHV-6A infected H SB-2 cells or HHV-6B infected Molt-3 cells, and incubated for 7 days at 37 ° C. For all assays, denaturation buffer was added to each well to denature DNA and an aliquot was aspirated through a nylon membrane. The membranes were then allowed to dry before equilibration in DIG. Virus-specific digoxigenin-labeled (DIG) probes were prepared according to the manufacturer's protocol. Detection of specifically bound DIG probe was done with anti-DIG antibody using manufacturer's protocol. An image of the photographic film was captured and quantified and compound concentrations sufficient to reduce viral DNA accumulation by 50% (EC50) were interpolated from the experimental data.
Ensayos de cuantificación de ADN para HHV-8: Los compuestos de ensayo se diluyeron en pocillos duplicados. Las células BCBL-1 se indujeron para que experimentaran una infección lítica mediante la adición de 12-miristato 13 -acetato de forbol, las células se añadieron a cada pocillo en la placa. Las células se incubaron durante 7 días a 37 °C en una estufa de incubación con CO 2 humidificada, entonces se preparó el ADN total. El ADN vírico se cuantificó mediante PCR ultrarrápida. Las concentraciones de compuesto suficientes para reducir el número de copias del genoma en un 50 % se calcularon a partir de los datos experimentales. DNA Quantification Assays for HHV-8: Test compounds were diluted in duplicate wells. BCBL-1 cells were induced to undergo lytic infection by the addition of phorbol 12-myristate 13 -acetate, the cells were added to each well in the plate. Cells were incubated for 7 days at 37 ° C in a humidified CO 2 incubator, then total DNA was prepared. Viral DNA was quantified by flash PCR. Compound concentrations sufficient to reduce genome copy number by 50% were calculated from the experimental data.
Ensayos celulares para la gripe: Para las curvas de respuesta a la dosis, se añadieron fármacos individuales a células MDCK en microplacas de 96 pocillos. Se incluyeron pocillos sin tratar de células infectadas (controles de virus) y células sin infectar (controles de célula) en cada placa de ensayo. A los tres días después de la infección, los pocillos de control de virus mostraban un 100 % citopatología. El grado de citopatología vírica en cada pocillo se determinó microscópicamente por inspección y por tinción con rojo neutro (NR). En resumen, las células se tiñeron con NR diluido en MEM para determinar la viabilidad celular. Dos horas después, las placas se procesaron para la cuantificación de la captación de NR en células viables. La cantidad de NR recogido por las células se determinó espectrofotométricamente. Influenza Cell Assays: For dose response curves, single drugs were added to MDCK cells in 96-well microplates. Untreated wells of infected cells (virus controls) and uninfected cells (cell controls) were included in each assay plate. At three days after infection, the virus control wells showed 100% cytopathology. The degree of viral cytopathology in each well was determined microscopically by inspection and by neutral red (NR) staining. Briefly, cells were stained with NR diluted in MEM to determine cell viability. Two hours later, the plates were processed for the quantification of NR uptake in viable cells. The amount of NR collected by the cells was determined spectrophotometrically.
Ensayos de qPCR para BKV y JCV: Se realizaron ensayos principales para virus BK en placas de 96 pocillos que contenían monocapas de células HFF. Se prepararon diluciones de compuesto en placas que contenían células que se infectaron posteriormente con la cepa Gardner de virus BK. Después de una incubación de 7 días, se preparó el ADN total con un kit de purificación y se cuantificó el número de copias del genoma por PCR ultrarrápida. Los compuestos que fueron positivos en este ensayo se confirmaron en un ensayo similar en placas de 96 pocillos con los compuestos añadidos 1 h después de la infección para identificar compuestos que inhiben las primeras fases de replicación, incluyendo adsorción y penetración. El número de copias del genoma se determinó por métodos descritos anteriormente. QPCR Assays for BKV and JCV: Primary assays for BK viruses were performed in 96-well plates containing HFF cell monolayers. Compound dilutions were prepared on plates containing cells that were subsequently infected with the Gardner strain of BK virus. After a 7 day incubation, total DNA was prepared with a purification kit and the genome copy number was quantified by flash PCR. Compounds that were positive in this assay were confirmed in a similar assay in 96-well plates with compounds added 1 hr after infection to identify compounds that inhibit early stages of replication, including adsorption and penetration. The copy number of the genome was determined by methods described above.
También se realizó la evaluación principal de los compuestos contra virus JC por métodos similares a los de ensayos principales para virus BK. Se realizaron ensayos secundarios contra JC V en células CO S7 por métodos similar a los del virus b K para identificar compuestos que inhibían la adsorción o penetración del virus.The main evaluation of the compounds against JC virus was also carried out by methods similar to those of the main tests for BK virus. Secondary assays against JC V were performed in CO S7 cells by methods similar to those of the bK virus to identify compounds that inhibited virus uptake or penetration.
Ensayos de virus de la hepatitis C: Indicador de luciferasa (replicón)/CytoTox-1 (toxicidad). Los compuestos se cribaron por la actividad anti-HCV usando un criterio de valoración del gen indicador de luciferasa (Luc) en el ensayo principal de HCV. El indicador Luc se usó como medida indirecta de replicación de HCV ya que su actividad es directamente proporcional a los niveles de ARN de HCV. Se realiza evaluación de la citotoxicidad en paralelo. Se prepararon soluciones madre de fármaco en DMSO salvo que se indique otra cosa y se diluyeron con medio de histocultivo hasta la concentración de ensayo alta deseada. Para cada ensayo, los compuestos entonces se diluyeron adicionalmente en medio de histocultivo según lo necesario. Después de incubación, las células se procesaron para derivar, donde fuera aplicable, la CE50 y la CE90 (concentración de compuesto que reduce la replicación del replicón en un 50 % y 90 % respectivamente). Los valores de CC50 (concentración que disminuye la viabilidad celular en un 50 % ) e IS50 (CC50/CE50) se determinaron y se presentaron. Se evaluó la actividad anti-HCV con la actividad Luc derivada del replicón (genotipo 1b o 2a) o el virus HCVcc como lectura; mientras que las concentraciones citotóxicas de fármaco que reducen los números de células se evaluaron mediante el ensayo de proliferación celular CytoTox-1 de acuerdo con el protocolo del fabricante. Se usó interferón alfa recombinante como fármaco de control positivo para validar el funcionamiento del ensayo. Hepatitis C virus assays: Luciferase (replicon) / CytoTox-1 (toxicity) indicator. Compounds were screened for anti-HCV activity using a luciferase reporter gene (Luc) endpoint in the primary HCV assay. The Luc indicator was used as an indirect measure of HCV replication since its activity is directly proportional to the levels of HCV RNA. Cytotoxicity evaluation is performed in parallel. Drug stocks were prepared in DMSO unless otherwise noted and diluted with histoculture medium to the desired high assay concentration. For each assay, the compounds were then further diluted in histoculture medium as necessary. After incubation, cells were processed to derive, where applicable, the EC50 and EC90 (concentration of compound that reduces replicon replication by 50% and 90% respectively). The values of CC50 (concentration that decreases cell viability by 50%) and IS50 (CC50 / EC50) were determined and presented. The anti-HCV activity was evaluated with the Luc activity derived from the replicon (genotype 1b or 2a) or the HCVcc virus as reading; while the cytotoxic drug concentrations that reduce cell numbers were evaluated by the CytoTox-1 cell proliferation assay according to the manufacturer's protocol. Recombinant alpha interferon was used as a positive control drug to validate the performance of the assay.
Los ensayos para el virus de la gripe, RSV y SA RS CoV fueron ensayo de efecto citopático/toxicidad usando CellTiter-Glo. Los ensayos de citoprotección antivírica examina los efectos de los compuestos a concentraciones indicadas de respuesta a dosis en tipos celulares específicos para ensayar la eficacia de los compuestos en la prevención del efecto citopático inducido por el virus. Se incluyó ribavirina como fármaco de control positivo para el virus de la gripe y RSV, mientras que se usó el inhibidor calpaína IV para ensayos antivíricos de SARS. Se sembraron cultivos subconfluyentes de células en placas de 96 pocillos para el análisis de viabilidad celular (citotoxicidad) y actividad antivírica (ECP). Para el ensayo convencional, los fármacos se añadieron a las células 24 horas después. Los pocillos E C P también recibieron 100 dosis infecciones de histocultivo (100 DICT50) de virus valorado. A las 72 horas después se determinó la viabilidad celular.Assays for influenza virus, RSV and SA RS CoV were cytopathic effect / toxicity assay using CellTiter-Glo. Antiviral cytoprotection assays examine the effects of compounds at indicated dose-response concentrations in specific cell types to test the efficacy of compounds in preventing virus-induced cytopathic effect. Ribavirin was included as a positive control drug for influenza and RSV viruses, while the IV calpain inhibitor was used for SARS antiviral assays. Subconfluent cell cultures were seeded in 96-well plates for analysis of cell viability (cytotoxicity) and antiviral activity (ECP). For the standard assay, the drugs were added to the cells 24 hours later. ECP wells also received 100 doses of histoculture infections (100 TCID50) of virus titrated. At 72 hours later, cell viability was determined.
La medición del ECP inducido por virus se basó en la cuantificación de ATP, un indicador de células metabólicamente activas. El ensayo de ECP empleó un kit de viabilidad celular luminiscente disponible en el mercado, y fue un método fiable para determinar la citotoxicidad y la proliferación celular en cultivo. El procedimiento implicó añadir el reactivo individual directamente a células subconfluyentes previamente cultivadas en el medio. Esto indujo lisis celular y la producción de una señal bioluminiscente (semivida mayor de 5 horas, dependiendo del tipo celular) que fue proporcional a la cantidad de ATP presente (que es un biomarcador de viabilidad).Measurement of virus-induced CPE was based on quantification of ATP, an indicator of metabolically active cells. The ECP assay used a commercially available luminescent cell viability kit, and was a reliable method to determine cytotoxicity and cell proliferation in culture. The procedure involved adding the individual reagent directly to subconfluent cells previously cultured in the medium. This induced cell lysis and the production of a bioluminescent signal (half-life greater than 5 hours, depending on the cell type) that was proportional to the amount of ATP present (which is a biomarker of viability).
Ensayos para virus del dengue (DENV), virus del Nilo Occidental (WNV), virus de la fiebre amarilla (YFV), virus de la fiebre del Valle de la Gran Falla (RVFV), virus de la encefalitis equina venezolana (VEEV):Assays for Dengue virus (DENV), West Nile virus (WNV), Yellow fever virus (YFV), Great Falla Valley fever virus (RVFV), Venezuelan equine encephalitis virus (VEEV):
Ensayo principal de reducción del efecto citopático (ECP). Se realizaron ensayos de inhibición de ECP de cuatro concentraciones. Se prepararon monocapas de cultivo celular confluyentes o casi confluyentes en microplacas. Las células se mantuvieron en MEM o DMEM complementado con FBS según lo necesario para cada línea celular. Para ensayos antivíricos, se usa el mismo medio, pero con FBS reducido hasta un 2 % o menos y complementado con gentamicina. El compuesto de ensayo se preparó a diferentes concentraciones, u. Los pocillos de control de virus y control de célula estaban en cada microplaca. En paralelo, se ensayó un fármaco activo conocido como fármaco de control positivo usando el mismo método que el que se aplicó para los compuestos de ensayo. El control positivo se ensayó con cada desarrollo de ensayo. El ensayo se estableció retirando en primer lugar el medio de crecimiento de las placas de 96 pocillos de células. Después se aplicó el compuesto de ensayo a los pocillos. El virus se puso en aquellos pocillos indicados para infección con virus. Se puso medio desprovisto de virus en los pocillos de control de toxicidad y pocillos de control de célula. Los pocillos de control de virus se trataron de manera similar con virus. Las placas se incubaron a 37 °C con un 5 % de CO2 hasta que se observó un ECP máximo en los pocillos de control de virus. Las placas entonces se tiñeron con rojo neutro durante aproximadamente dos horas a 37 °C en una estufa de incubación de un 5 % de CO2. El medio de rojo neutro se retiró por aspiración completa, y las células pueden aclararse con solución salina tamponada con fosfato (PBS) para retirar el tinte residual. La PBS se retiró completamente y el rojo neutro incorporado se eluyó con tampón. El contenido de tinte en cada pocillo se cuantifica usando un espectrofotómetro. El contenido de tinte en cada conjunto de pocillos se convirtió en un porcentaje de tinte presente en pocillos de control sin tratar usando una hoja de cálculo de ordenador de basada en Microsoft Excel. Las concentraciones eficaces al 50 % (CE50) y las concentraciones citotóxicas al 50 % (CC50) se calcularon entonces por análisis de regresión lineal. El cociente de CC50 dividido por CE50 da el valor de índice de selectividad (IS).Primary Cytopathic Effect Reduction (CPE) Trial. Four concentration ECP inhibition assays were performed. Confluent or near confluent cell culture monolayers were prepared on microplates. Cells were kept in MEM or DMEM supplemented with FBS as needed for each cell line. For antiviral assays, the same medium is used, but with FBS reduced to 2% or less and supplemented with gentamicin. The test compound was prepared at different concentrations, u. Virus control and cell control wells were on each microplate. In parallel, an active drug known as a positive control drug was tested using the same method as that applied for the test compounds. The positive control was tested with each assay run. The assay was established by first removing the growth medium from the 96-well plates of cells. The test compound was then applied to the wells. The virus was placed in those wells indicated for virus infection. Medium devoid of virus was placed in the toxicity control wells and cell control wells. Virus control wells were similarly treated with virus. The plates were incubated at 37 ° C with 5% CO 2 until a maximum CPE was observed in the virus control wells. The plates were then stained neutral red for approximately two hours at 37 ° C in a 5% CO 2 incubator. The neutral red medium was removed by complete aspiration, and cells can be rinsed with phosphate buffered saline (PBS) to remove residual dye. The PBS was completely removed and the incorporated neutral red was eluted with buffer. The content of dye in each well is quantified using a spectrophotometer. The content of dye in each set of wells was converted to a percentage of dye present in untreated control wells using a Microsoft Excel-based computer spreadsheet. The 50% effective concentrations (EC50) and the 50% cytotoxic concentrations (CC50) were then calculated by linear regression analysis. The quotient of CC50 divided by EC50 gives the Selectivity Index (IS) value.
Ensayos para adenovirus (AdV), virus del sarampión (MEV), poliovirus (POV) y enterovirus (ENTV): El cribado principal fue un ensayo de reducción del efecto citopático (ECP). En resumen, se infectaron cultivos de células con virus en presencia de compuestos de ensayo y se incubaron durante 4-7 días (dependiendo del virus/células específicos). Cada virus se valoró previamente de modo que los pocillos de control mostraran aproximadamente un 95 % de pérdida de viabilidad celular debido a la replicación del virus. Por lo tanto, se observó efecto antivírico, o citoprotección, cuando los compuestos evitaban la replicación del virus. Cada placa de ensayo contenía pocillos de control de célula (células solamente), pocillos de control de virus (células más virus), pocillos de control de toxicidad del compuesto (células más compuesto solamente), pocillos de control colorimétrico de compuesto (compuesto solamente, sin células o virus), así como pocillos experimentales (compuesto más células más virus). Se evaluó la citoprotección y la citotoxicidad del compuesto por reducción de tinte m Ts . El porcentaje de reducción en el ECP del virus (actividad antivírica) y el porcentaje de viabilidad celular (citotoxicidad) se determinaron y presentaron. Assays for adenovirus (AdV), measles virus (MEV), poliovirus (POV), and enterovirus (ENTV): The main screening was a cytopathic effect reduction (CPE) assay. Briefly, cell cultures were infected with virus in the presence of test compounds and incubated for 4-7 days (depending on the specific virus / cells). Each virus was pre-scored so that control wells showed approximately 95% loss of cell viability due to virus replication. Therefore, an antiviral effect, or cytoprotection, was observed when the compounds prevented virus replication. Each assay plate contained cell control wells (cells only), virus control wells (cells plus virus), compound toxicity control wells (cells plus compound only), compound colorimetric control wells (compound only, without cells or virus), as well as experimental wells (composed plus cells plus virus). The cytoprotection and cytotoxicity of the compound was evaluated by dye reduction m Ts. The percentage reduction in the CPE of the virus (antiviral activity) and the percentage of cell viability (cytotoxicity) were determined and presented.
Ensayos para el virus de la variolovacuna (VACV): El ensayo principal fue un ensayo de reducción del efecto citopático (ECP). Células HFF de bajo pase se trataron con tripsina, se contaron y se sembraron en placas de histocultivo. Las células entonces se incubaron durante 24 h a 37 °C. El medio entonces se retiró y se añadió MEM que contenía FBS al 2 % a todas salvo la primera fila. En la primera fila, se añadió medio que contenía el fármaco experimental (por ejemplo, compuesto 1) en pocillos triplicados. Se añadió medio en solitario a los pocillos de control tanto de célula como de virus. El fármaco en la primera fila de pocillos se diluyó entonces en serie 1:5 en todos los pocillos restantes. Las placas entonces se incubaron durante 60 minutos y se añadió una suspensión de virus a cada pocillo, excluyendo los pocillos de control de célula que recibieron MEM. Las placas entonces se incubaron a 37 °C en una estufa de incubación de CO2. Después del periodo de incubación, se aspiró el medio y las células se tiñeron con violeta de genciana en formol durante 4 h. El colorante entonces se retiró y las placas se aclararon hasta que se retiró todo el exceso de colorante. Se permitió que las placas se secaran durante 24 h y se determinó la cantidad de ECP en cada fila. Los valores de CE50 y CC50 se determinaron comparando las células tratadas con fármaco y sin tratar usando un programa informático. Vaccine variovirus (VACV) assays: The main trial was a cytopathic effect reduction (CPE) assay. Low-passage HFF cells were trypsinized, counted, and plated on histoculture plates. The cells were then incubated for 24 h at 37 ° C. The medium was then removed and MEM containing 2% FBS was added to all but the first row. In the first row, medium containing the test drug (eg, compound 1) was added in triplicate wells. Medium alone was added to both cell and virus control wells. The drug in the first row of wells was then serially diluted 1: 5 in all remaining wells. The plates were then incubated for 60 minutes and a virus suspension was added to each well, excluding the cell control wells that received MEM. The plates were then incubated at 37 ° C in a CO 2 incubator. After the incubation period, the medium was aspirated and the cells were stained with gentian violet in formalin for 4 h. The dye was then removed and the plates were rinsed until all excess dye was removed. The plates were allowed to dry for 24 h and the amount of ECP in each row was determined. EC 50 and CC 50 values were determined by comparing drug-treated and untreated cells using a computer program.
Como se expone en el ejemplo 1, a continuación, el compuesto 1 tiene actividad contra norovirus de ratón in vitro. En algunas realizaciones, el compuesto 1 tiene un valor de CE50 de aproximadamente 2,1 y un valor de CC50 de aproximadamente 114 contra norovirus de ratón. Además, el compuesto 1 tiene actividad contra una amplia serie de virus de ADN y ARN.As set forth in Example 1 below, Compound 1 has activity against mouse norovirus in vitro. In some embodiments, Compound 1 has an EC 50 value of about 2.1 and a CC 50 value of about 114 against mouse norovirus. Furthermore, Compound 1 has activity against a wide range of DNA and RNA viruses.
Como se expone en el ejemplo 2, a continuación, el compuesto 1 tiene actividad contra norovirus de ratón in vivo. Como se expone en el ejemplo 2, el compuesto 1 pudo reducir la carga vírica en ratones infectados con norovirus murino de una manera dependiente de la dosis. Los resultados se dan en la figura 1A y figura 1B, que muestran la reducción de la concentración vírica en las heces y el tejido, respectivamente, de ratones en el estudio 1. Además, las figuras 2A y 2B muestran la reducción de la concentración vírica en las heces y tejido, respectivamente, de ratones en el estudio 2. Las figuras 3A y 3B muestran la reducción en la concentración vírica en el tejido y heces, respectivamente, de los ratones en el estudio 1. Los resultados se muestran en una escala lineal. Los ratones se trataron con 30 mg/kg/día, o 100 mg/kg/día, o 300 mg/kg/día de compuesto 1 en el estudio 1. Los ratones se trataron con 150 mg/kg/día, o 300 mg/kg/día de compuesto 1 en el estudio 2.As set forth in Example 2 below, Compound 1 has activity against mouse norovirus in vivo. As set forth in Example 2, Compound 1 was able to reduce viral load in mice infected with norovirus. murine in a dose-dependent manner. The results are given in Figure 1A and Figure 1B, which show the reduction in viral concentration in the stool and tissue, respectively, of mice in Study 1. In addition, Figures 2A and 2B show the reduction in viral concentration. in the stool and tissue, respectively, of mice in Study 2. Figures 3A and 3B show the reduction in viral concentration in the tissue and stool, respectively, of the mice in Study 1. The results are shown on a scale linear. Mice were treated with 30 mg / kg / day, or 100 mg / kg / day, or 300 mg / kg / day of Compound 1 in Study 1. Mice were treated with 150 mg / kg / day, or 300 mg / kg / day of compound 1 in study 2.
El ejemplo 3 demuestra que el compuesto 1 puede inhibir la polimerasa de norovirus in vitro. Sin el deseo de limitarse a teoría alguna, se propone que el compuesto 1 puede proteger contra y tratar el norovirus inhibiendo la polimerasa de norovirus.Example 3 demonstrates that Compound 1 can inhibit norovirus polymerase in vitro. Without wishing to be bound by theory, it is proposed that Compound 1 can protect against and treat norovirus by inhibiting norovirus polymerase.
Como se expone en el ejemplo 4, el compuesto 1 se convierte en un trifosfato in vitro. Como se muestra, cuando las células se incubaban con compuesto 1, se producía el trifosfato correspondiente (es decir, compuesto 1-TP). El nivel de compuesto 1-TP fue de 12 a 23 veces mayor que de compuesto 1 después del periodo de incubación.As set forth in Example 4, Compound 1 is converted to a triphosphate in vitro. As shown, when cells were incubated with Compound 1, the corresponding triphosphate (ie, Compound 1-TP) was produced. The level of Compound 1-TP was 12 to 23 times higher than Compound 1 after the incubation period.
El ejemplo 5, a continuación, demuestra que el compuesto 1 es más eficaz en inhibir el norovirus de ratón que el compuesto 2, o que el trifosfato de 2'-C-metilcitidina. Se da una comparación con DMSO como control por referencia. El experimento se realizó por duplicado y los resultados se muestran en la figura 4 (primer duplicado) y figura 5 (segundo duplicado). La figura 6 muestra una superposición de los resultados del primer y segundo duplicado del experimento. Como se muestra en las figuras 4, 5 y 6, "A" es DMSO, "B" es compuesto 2, "C" es trifosfato de 2'-C-metilcitidina (2'CmeC TP) y "D" es compuesto 1. Las figuras 4-6 demuestran que la concentración vírica aumentaba casi dos órdenes de magnitud cuando se trataba con solamente DMSO o 2'CmeC TP. Sin embargo, la concentración vírica aumentaba menos de un orden de magnitud en presencia de compuesto 1.Example 5, below, demonstrates that Compound 1 is more effective in inhibiting mouse norovirus than Compound 2, or 2'-C-methylcytidine triphosphate. A comparison with DMSO as a control is given by reference. The experiment was performed in duplicate and the results are shown in Figure 4 (first duplicate) and Figure 5 (second duplicate). Figure 6 shows an overlay of the results of the first and second duplicates of the experiment. As shown in Figures 4, 5 and 6, "A" is DMSO, "B" is compound 2, "C" is 2'-C-methylcytidine triphosphate (2'CmeC TP) and "D" is compound 1 Figures 4-6 demonstrate that the viral concentration increased by almost two orders of magnitude when treated with only DMSO or 2'CmeC TP. However, the viral concentration increased by less than an order of magnitude in the presence of compound 1.
El ejemplo 6 muestra una comparación con el compuesto 1 y otros compuestos de fórmula II (tabla 7) y análogos de los mismos. Sin el deseo de limitarse a teoría alguna, los compuestos que son incluso ligeramente diferentes de la estructura de fórmula I pueden tener actividad sustancialmente reducida in vitro. Por ejemplo, el compuesto 7 tiene un grupo hidroxi en lugar de la arilamina y tiene un valor de CE50 >38 pM; el compuesto 35 muestra un análogo del compuesto 1 que carece del grupo arilamina, y tiene un valor de CE50 >100 pM. Además, el compuesto 11 tiene un grupo ciano en lugar de la arilamida y tiene un valor de CE50 >121 pM. Asimismo, los compuestos 36 y 37 muestran aminas metilsustituidas y tienen valores de CE50 >100 pM. Los expertos en la materia entenderán comparaciones adicionales.Example 6 shows a comparison with compound 1 and other compounds of formula II (Table 7) and analogs thereof. Without wishing to be bound by theory, compounds that are even slightly different from the structure of formula I may have substantially reduced activity in vitro. For example, compound 7 has a hydroxy group in place of arylamine and has an EC 50 value> 38 pM; compound 35 shows an analog of compound 1 lacking the arylamine group, and has an EC 50 value> 100 pM. Furthermore, compound 11 has a cyano group in place of the arylamide and has an EC 50 value> 121 pM. Also, compounds 36 and 37 show methyl substituted amines and have EC 50 values> 100 pM. Those skilled in the art will understand additional comparisons.
La figura 7a muestra un dia rama de HPLC del compuesto 1.Figure 7a shows an HPLC day of compound 1.
Sin el deseo de limitarse a teoría alguna, el pico n.° 2 se identificó como ácido benzoico.Without wishing to be bound by theory, peak # 2 was identified as benzoic acid.
La figura 7b muestra un dia rama de HPLC del compuesto 1 después de suspensión 3 horas a temperatura ambiente.Figure 7b shows an HPLC day of compound 1 after suspension for 3 hours at room temperature.
La figura 7c muestra un dia rama de HPLC del compuesto 1 después de suspensión 3 horas a 50 °C.Figure 7c shows an HPLC day of compound 1 after suspension for 3 hours at 50 ° C.
La figura 7d muestra un diagrama de HPLC del compuesto 1 después de suspensión 24 horas a aproximadamente temperatura ambiente.Figure 7d shows an HPLC diagram of compound 1 after suspension for 24 hours at about room temperature.
La figura 8a muestra un espectro de RMN de 1H del compuesto 1 de aproximadamente -2 a aproximadamente 14 ppm. Figure 8a shows a 1H NMR spectrum of compound 1 from about -2 to about 14 ppm.
La figura 8b muestra un espectro de RMN de 1H del compuesto 1 de aproximadamente 2 a aproximadamente 9 ppm. Figure 8b shows a 1H NMR spectrum of compound 1 from about 2 to about 9 ppm.
La figura 8c muestra un espectro de RMN de 1H del compuesto 1 de aproximadamente 0 a aproximadamente 9 ppm.Figure 8c shows a 1H NMR spectrum of compound 1 from about 0 to about 9 ppm.
EJEMPLOSEXAMPLES
Procedimientos generalesGeneral procedures
Los diagramas de HPLC se registraron en una columna Zorbax Eclipse Plus C18 (4,6 x 50 mm x 1,8 pm). La primera fase móvil fue un 97,5 % de agua : 2,5 % de acetonitrilo : 0,05 % de ácido trifluoroacético. La segunda fase móvil fue un 97,5 % de acetonitrilo : 2,5 % de agua : 0,05 % de ácido trifluoroacético.HPLC charts were recorded on a Zorbax Eclipse Plus C18 column (4.6 x 50 mm x 1.8 pm). The first mobile phase was 97.5% water: 2.5% acetonitrile: 0.05% trifluoroacetic acid. The second mobile phase was 97.5% acetonitrile: 2.5% water: 0.05% trifluoroacetic acid.
Las RMN de 1H se registraron a 500 MHz salvo que se indique otra cosa.1H NMRs were recorded at 500 MHz unless otherwise indicated.
Ejemplo 1 - Ensayos antivíricos y de citotoxicidadExample 1 - Antiviral and cytotoxicity tests
Cultivo de células y cepas de virus: Se prepararon fibroblastos de prepucio humano (HFF) a partir de tejido de prepucio humano obtenido de la instalación de obtención de tejidos de la Universidad de Alabama en Birmingham con la aprobación de su CIR. El tejido se incubó a 4 °C durante 4 h en medio de cultivo celular que consistía en medio esencial mínimo (MEM) con sales de Earle complementado con suero bovino fetal (FBS) (Hyclone, Inc. Logan UT) al 10 %, y concentraciones convencionales de L-glutamina, fungizone y vancomicina. El tejido entonces se puso en solución salina tamponada con fosfato (PBS), se trituró, se aclaró para retirar los glóbulos rojos y se resuspendió en solución de tripsina/EDTA. La suspensión de tejido se incubó a 37 °C y se agitó suavemente para dispersar las células, que después se recogieron por centrifugación. Las células se resuspendieron en 4 ml de medio y se pusieron en un matraz de histocultivo de 25 cm2 y se incubaron a 37 °C en una estufa de incubación de CO2 humidificada durante 24 h. El medio entonces se remplazó con medio reciente y se controló el crecimiento celular diariamente hasta que se formó una monocapa de células confluyentes. Las células HFF entonces se expandieron a través de pases en serie en medio de crecimiento convencional de MEM con sales de Earle complementado con FBS al 10 %, L-glutamina, penicilina y gentamicina. Las células se pasaron de manera rutinaria y se usaron para ensayos en o por debajo del pase 10. Cell Culture and Virus Strains: Human foreskin fibroblasts (HFF) were prepared from human foreskin tissue obtained from the University of Alabama at Birmingham Tissue Procurement Facility with the approval of its CIR. The tissue was incubated at 4 ° C for 4 h in cell culture medium consisting of minimal essential medium (MEM) with Earle's salts supplemented with 10% fetal bovine serum (FBS) (Hyclone, Inc. Logan UT), and conventional concentrations of L-glutamine, fungizone, and vancomycin. The tissue was then placed in phosphate buffered saline (PBS), ground, rinsed to remove red blood cells, and resuspended in trypsin / EDTA solution. The tissue suspension was incubated at 37 ° C and gently shaken to disperse the cells, which were then collected by centrifugation. The cells were resuspended in 4 ml of medium and placed in a 25 cm2 histoculture flask and incubated at 37 ° C in a humidified CO 2 incubator for 24 h. The medium was then replaced with fresh medium and cell growth was monitored daily until a confluent cell monolayer was formed. The HFF cells were then expanded through serial passages in conventional MEM growth medium with Earle's salts supplemented with 10% FBS, L-glutamine, penicillin, and gentamicin. Cells were routinely passaged and used for assays at or below passage 10.
Las células Akata infectadas de forma latente con EBV se obtuvieron de John Sixbey (Louisiana State University, Baton Rouge, LA). La cepa GS de HHV-6A se obtuvo a través del AIDS Research and Reference Reagent Program del NIH. Las células HSB-2 y las células BCBL-1 se obtuvieron a través del AIDS Research and Reference Reagent Program del NIH, Division of AIDS, NIAID, NIH. Las células Molt-3 se obtuvieron de Scott Schmid en el Centers for Disease Control and Prevention, Atlanta, GA. Todos los cultivos de linfocitos se mantuvieron rutinariamente en RPMI 1640 (Mediatech, Inc., Herndon, VA) con FBS al 10 %, L-glutamina y antibióticos y se pasaron dos veces a la semana. Las células Vero se obtuvieron de la American Type Culture Collection (ATCC, Manassas, VA), y se mantuvieron en medio de crecimiento convencional de MEM con sales de Earle complementado con FBS al 10 %, L-glutamina, penicilina y estreptomicina.Akata cells latently infected with EBV were obtained from John Sixbey (Louisiana State University, Baton Rouge, LA). HHV-6A strain GS was obtained through the NIH AIDS Research and Reference Reagent Program. HSB-2 cells and BCBL-1 cells were obtained through the AIDS Research and Reference Reagent Program of the NIH, Division of AIDS, NIAID, NIH. Molt-3 cells were obtained from Scott Schmid at the Centers for Disease Control and Prevention, Atlanta, GA. All lymphocyte cultures were routinely maintained in RPMI 1640 (Mediatech, Inc., Herndon, VA) with 10% FBS, L-glutamine, and antibiotics and passaged twice weekly. Vero cells were obtained from the American Type Culture Collection (ATCC, Manassas, VA), and were maintained in standard MEM growth medium with Earle's salts supplemented with 10% FBS, L-glutamine, penicillin, and streptomycin.
Virus de la gripe: Los virus de la gripe A/Nueva Caledonia/20/99 (H1N1) y A/Sydney/05/97 (H3N2) se proporcionaron por el Centers for Disease Control and Prevention (Atlanta, GA). Los virus se pasaron en células de riñón canino Madin-Darby (MDCK) (American Type Culture Collection, Manassas, VA) para crear soluciones madre de trabajo, que se usaron para los ensayos antivíricos. Influenza viruses: Influenza viruses A / New Caledonia / 20/99 (H1N1) and A / Sydney / 05/97 (H3N2) were provided by the Centers for Disease Control and Prevention (Atlanta, GA). Viruses were passaged into Madin-Darby canine kidney cells (MDCK) (American Type Culture Collection, Manassas, VA) to create working stock solutions, which were used for antiviral assays.
Se usaron las cepas E-377 y DM2.1 de HSV-1, así como las cepas MS y 13078 de HSV-2. La cepa F de HSV-1 se obtuvo de la ATCC. Las cepas de HCMV, AD169 y Merlin se obtuvieron de la American Type Culture Collection (ATCC, Manassas, VA) y C8805/37-1-1 y 759RD100 fueron un obsequio de Karen Biron. La cepa Ellen de VZV se obtuvo de la ATCC. La cepa Z29 de HHV-6B fue un obsequio de Scott Schmid en el Centers for Disease Control and Prevention, Atlanta GA. El HHV-8 se obtuvo como células BCBL-1 infectadas de forma latente a través del AIDS Research and Reference Reagent Program del NIH.HSV-1 strains E-377 and DM2.1 were used, as well as HSV-2 strains MS and 13078. HSV-1 strain F was obtained from ATCC. HCMV strains AD169 and Merlin were obtained from the American Type Culture Collection (ATCC, Manassas, VA) and C8805 / 37-1-1 and 759RD100 were a gift from Karen Biron. The Ellen strain of VZV was obtained from ATCC. The HHV-6B Z29 strain was a gift from Scott Schmid at the Centers for Disease Control and Prevention, Atlanta GA. HHV-8 was obtained as latently infected BCBL-1 cells through the NIH AIDS Research and Reference Reagent Program.
Ensayos antivíricos: Cada experimento que evaluó la actividad antivírica de los compuestos incluyó compuestos tanto de control positivo como de control negativo para garantizar el funcionamiento de cada ensayo. Se realizó evaluación simultánea de la citotoxicidad cuando fue posible a niveles equivalentes de exposición al compuesto. Los métodos se presentan siguiendo los datos tabulados en concentraciones eficaces que dan reducciones de un 50 % en la replicación vírica in vitro (CE50), concentraciones que producen un 50 % de reducción en la viabilidad celular (CC50) y el índice de selectividad (IS, calculado como CC50 dividida por CE50). Cuando había suficiente material disponible, se realizaron múltiples ensayos para cada evaluación de compuesto para obtener datos estadísticos. Antiviral Assays: Each experiment that evaluated the antiviral activity of compounds included both positive control and negative control compounds to ensure the performance of each assay. Simultaneous evaluation of cytotoxicity was performed when possible at equivalent levels of exposure to the compound. The methods are presented following the tabulated data in effective concentrations that give 50% reductions in viral replication in vitro (EC50), concentrations that produce a 50% reduction in cell viability (CC50) and the selectivity index (IS , calculated as CC50 divided by EC50). When sufficient material was available, multiple tests were performed for each compound evaluation to obtain statistical data.
Ensayos de citotoxicidad: Cada ensayo antivírico incluyó un ensayo paralelo de citotoxicidad con las mismas células usadas para cada virus, el mismo número de células, las mismas concentraciones de fármaco y los mismos tiempos de incubación para proporcionar la misma exposición al fármaco. Para garantizar que la citotoxicidad de todos los compuestos pudiera compararse directamente, se realizó un ensayo de citotoxicidad de captación de rojo neutro convencional para todos los compuestos en células HFF confluyentes con un periodo de incubación de 7 días. Cytotoxicity Assays: Each antiviral assay included a parallel cytotoxicity assay with the same cells used for each virus, the same number of cells, the same drug concentrations, and the same incubation times to provide the same drug exposure. To ensure that the cytotoxicity of all compounds could be directly compared, a standard neutral red uptake cytotoxicity assay was performed for all compounds on confluent HFF cells with an incubation period of 7 days.
Ensayos de citotoxicidad de captación de rojo neutro: Cada compuesto se evaluó en un ensayo de citotoxicidad convencional por métodos convencionales. En resumen, se sembraron células HFF en placas de histocultivo de 96 pocillos a 2,5 x 104 células/pocillo en medio de histocultivo convencional. Después de 24 h de incubación, el medio se remplazó con medio de cultivo celular de mantenimiento y se añadieron los compuestos a la primera fila y después se usaron entonces diluciones en serie de factor 5 para generar una serie de concentraciones de compuesto con un máximo de 300 pM. Las placas de ensayo se incubaron durante 7 días, y se añadieron 100 pl de una solución de rojo neutro de 0,66 mg/ml en PBS a cada pocillo y las placas se incubaron durante 1 h. El colorante entonces se retiró, las placas se aclararon con PBS y el tinte internalizado por las células viables se solubilizó en PBS complementado con etanol al 50 % y ácido acético glacial al 1 %. Entonces se determinó la densidad óptica a 550 nm y se interpolaron los valores de CC50 de los datos experimentales. Neutral Red Uptake Cytotoxicity Assays: Each compound was evaluated in a standard cytotoxicity assay by standard methods. Briefly, HFF cells were seeded in 96-well histoculture plates at 2.5 x 10 4 cells / well in standard histoculture medium. After 24 h of incubation, the medium was replaced with maintenance cell culture medium and the compounds were added to the first row and then serial dilutions of factor 5 were used to generate a series of compound concentrations with a maximum of 300 pM. Assay plates were incubated for 7 days, and 100 µl of a 0.66 mg / ml solution of neutral red in PBS was added to each well and the plates were incubated for 1 hr. The dye was then removed, the plates were rinsed with PBS, and the dye internalized by viable cells was solubilized in PBS supplemented with 50% ethanol and 1% glacial acetic acid. The optical density at 550 nm was then determined and the CC50 values from the experimental data were interpolated.
Para todos los ensayos de reducción de placas en células HFF, se realizaron ensayos de citotoxicidad de rojo neutro en un conjunto paralelo de placas de 6 pocillos que contenían células HFF no infectadas que recibieron las mismas concentraciones de compuesto que las usadas para los ensayos antivíricos. Las placas de citotoxicidad se retiraron de la estufa de incubación en el mismo día que cada ensayo antivírico y se tiñó la monocapa de células durante 6 h con 2 ml de una solución de rojo neutro a una concentración de 0,165 mg/ml en PBS. El tinte entonces se retiró, se aclaró el tinte residual de las células con PBS, y se inspeccionaron las monocapas de células visualmente para cualquier signo de toxicidad. El ensayos de citotoxicidad con células Vero se realizó con concentraciones de fármaco que varían de 1 pM a 1 mM. La viabilidad celular se determinó usando ensayo de proliferación celular de una solución acuosa CellTiter 96® (Promega) de acuerdo con las instrucciones del fabricante.For all HFF cell plaque reduction assays, neutral red cytotoxicity assays were performed on a parallel set of 6-well plates containing uninfected HFF cells that received the same compound concentrations as used for antiviral assays. The cytotoxicity plates were removed from the incubator on the same day as each antiviral assay and the cell monolayer was stained for 6 h with 2 ml of a neutral red solution at a concentration of 0.165 mg / ml in PBS. The dye was then removed, residual dye was rinsed from the cells with PBS, and the cell monolayers were visually inspected for any signs of toxicity. The Vero cell cytotoxicity assay was performed with drug concentrations ranging from 1 pM to 1 mM. Cell viability was determined using CellTiter 96® aqueous solution cell proliferation assay (Promega) according to manufacturer's instructions.
Ensayos de proliferación celular: La inhibición de la proliferación de células HFF se usó para refinar las estimaciones de citotoxicidad para algunos compuestos y se realizó de acuerdo con un procedimiento convencional usado en el laboratorio. Las células se sembraron a una baja densidad en placas de seis pocillos usando 2,5 x 104 células/pocillo y medio de cultivo convencional. Después de 24 h, el medio se aspiró, y se preparó una serie de soluciones de compuesto en el medio de crecimiento partiendo a 300 pM y se añadió a pocillos duplicados. Las placas se incubaron durante 72 h a 37 °C, y las células entonces se desprendieron con tripsina y se contaron en un Beckman Coulter Counter. Las concentraciones de compuesto que reducían la proliferación celular en un 50 % se interpolaron de los datos experimentales. Cell proliferation assays: Inhibition of HFF cell proliferation was used to refine estimates of cytotoxicity for some compounds and was performed according to a standard procedure used in the laboratory. Cells were seeded at low density in six-well plates using 2.5 x 10 4 cells / well and standard culture medium. After 24 h, the medium was aspirated, and a series of compound solutions were prepared in the growth medium starting at 300 pM and added to duplicate wells. The plates were incubated for 72 h at 37 ° C, and the cells were then detached with trypsin and counted on a Beckman Coulter Counter. Compound concentrations that reduced cell proliferation by 50% were interpolated from the experimental data.
Citotoxicidad en ensayos de linfocitos: La viabilidad celular en todos los ensayos con linfocitos se evaluó con el ensayo de viabilidad celular luminiscente CellTiter-Glo (Promega). En resumen, se incubaron placas de ensayo a temperatura ambiente durante 30 min, después se añadieron 50 pl de reactivo CellTiter-Glo a cada pocillo y las placas se mezclaron durante 2 min en un agitador orbital para lisar las células. Las placas entonces se incubaron durante 10 min adicionales a temperatura ambiente y se cuantificó la luminiscencia en un luminómetro. Se usaron métodos convencionales para calcular las concentraciones de fármaco que inhibían la proliferación de células Akata, HSB-2, BCLB-1 o Molt-3 en un 50 % (CC50). Cytotoxicity in lymphocyte assays: Cell viability in all lymphocyte assays was evaluated with the CellTiter-Glo luminescent cell viability assay (Promega). Briefly, assay plates were incubated at room temperature for 30 min, then 50 µl of CellTiter-Glo reagent was added to each well and the plates were mixed for 2 min on an orbital shaker to lyse the cells. The plates were then incubated for an additional 10 min at room temperature and luminescence was quantified on a luminometer. Standard methods were used to calculate drug concentrations that inhibited Akata, HSB-2, BCLB-1 or Molt-3 cell proliferation by 50% (CC 50 ).
Tabla 1: Actividad de compuesto 1 contra norovirus de ratón en células RAW Table 1: Activity of compound 1 against mouse norovirus in RAW cells
Tabla 2: Actividad de compuesto 1 contra diversos virus de ADN ARN Table 2: Activity of compound 1 against various DNA RNA viruses
Ensayo de norovirus de ratón (MNV): Las células RAW (macrófagos de ratón, ATCC TIV-71) se recibieron de la American Type Culture Collection (ATCC). Las células se incubaron a 37 °C con un 5 % de CO2 en medio de cultivo celular que consistía en medio esencial mínimo de Dulbecco (DMEM) (ATCC) complementado con suero bovino fetal (FBS) al 10 % (Hyclone, Inc., Logan UT), 100 U/ml de penicilina y 100 ug/ml de estreptomicina (Hyclone), MEM NEAA al 1 % (Gibco), GlutaMAX al 1 % (Gibco) y HEPES al 1 % (Hyclone). El aislado de norovirus de ratón usado en este ensayo se aisló de un ratón natural, se adaptó a cultivo celular, se purificó en placa y se confirmó su secuencia genética por Chimerix, Inc. Mouse norovirus (MNV) assay: RAW cells (mouse macrophages, ATCC TIV-71) were received from the American Type Culture Collection (ATCC). Cells were incubated at 37 ° C with 5% CO 2 in cell culture medium consisting of Dulbecco's minimal essential medium (DMEM) (ATCC) supplemented with 10% fetal calf serum (FBS) (Hyclone, Inc. , Logan UT), 100 U / ml penicillin and 100 ug / ml streptomycin (Hyclone), MEM NEAA 1% (Gibco), GlutaMAX 1% (Gibco) and HEPES 1% (Hyclone). The mouse norovirus isolate used in this assay was isolated from a wild-type mouse, adapted to cell culture, plaque purified, and its genetic sequence confirmed by Chimerix, Inc.
Se añadieron 100 pl de diluciones en serie de compuestos de ensayo en DMEM a placas tratadas con histocultivo de 96 pocillos Costar. Se añadieron 100 pl de suspensión celular que contenía 50000 células RAW/pocillos y MNV (MOI = 0,0005) a las diluciones de compuesto en la placa de 96 pocillos, y se incubaron a 37 °C con un 5 % de CO2 durante 2 días. Cada placa de ensayo incluía controles de células sin infectar y pocillos de control de virus sin tratar. Después de 2 días de incubación, los pocillos de control de virus sin tratar mostraron un 100 % de ECP. Después de 2 días de incubación, se añadieron 40 pl de reactivo MTS acuoso Cell Titer 96® (Promega, G111) como indica el fabricante a los 200 pl de medio en cada pocillo y se incubaron a 37 °C hasta que los controles de células sin tratar revelaron una absorbancia a 490 nm entre 1,1 y 1,8. Se leyeron las lecturas de absorbancia finales usando un BioTek Synergy 2, y se usó el programa informático Gen 5 (BioTek Instruments, Inc.) para calcular la concentración que protegía las células RAW infectadas con MNV en un 50 % en comparación con controles de células sin infectar (CE50).100 µl of serial dilutions of test compounds in DMEM were added to histocultured 96-well Costar plates. 100 µl of cell suspension containing 50,000 RAW cells / well and MNV (MOI = 0.0005) were added to the compound dilutions in the 96-well plate, and incubated at 37 ° C with 5% CO 2 for 2 days. Each assay plate included uninfected cell controls and untreated virus control wells. After 2 days of incubation, the untreated virus control wells showed 100% ECP. After 2 days of incubation, 40 µl of Cell Titer 96® aqueous MTS reagent (Promega, G111) was added as indicated by the manufacturer to 200 µl of medium in each well and incubated at 37 ° C until cell controls Untreated revealed an absorbance at 490 nm between 1.1 and 1.8. Final absorbance readings were read using a BioTek Synergy 2, and Gen 5 computer program (BioTek Instruments, Inc.) was used to calculate the concentration that protected MNV-infected RAW cells by 50% compared to cell controls. uninfected (EC50).
Ensayos de norovirus humano: Se evaluó la actividad antivírica contra un norovirus (NoV) humano en un ensayo de 3 días usando la línea celular de replicón de norovirus humano de expresión estable, HG23 (genogrupo I, longitud genómica; línea celular precursora, HuH7) (Chang, et al., 2006, Virol. 353:463) mantenida como cultivos subconfluyentes en placas de 96 pocillos. Típicamente, se usan 4 dosis (etapas de factor 10 o factor 3), por triplicado. La actividad antivírica se determinó por análisis de hibridación en transferencia de ARN de NoV intracelular (normalizado al nivel de ARN de p-actina celular en cada muestra de cultivo). La citotoxicidad se evaluó por captación de tinte rojo neutro en cultivos mantenidos en placas paralelas (Korba y Gerin, 1992, Antivir. Res. 19:55). Human Norovirus Assays: Antiviral activity against a human norovirus (NoV) was evaluated in a 3-day assay using the stable expression human norovirus replicon cell line, HG23 (genogroup I, genomic length; precursor cell line, HuH7) (Chang, et al., 2006, Virol. 353: 463) maintained as subconfluent cultures in 96-well plates. Typically, 4 doses (factor 10 or factor 3 steps) are used, in triplicate. Antiviral activity was determined by intracellular NoV RNA blot hybridization analysis (normalized to the level of cellular p-actin RNA in each culture sample). Cytotoxicity was evaluated by neutral red dye uptake in cultures maintained in parallel plates (Korba and Gerin, 1992, Antivir. Res. 19:55).
Los valores de CE50 y CC50 se calculan por análisis de regresión lineal (MS EXCEL®, QuattroPro®) usando datos combinados de todos los cultivos tratados (Korba y Gerin, 1992, Antivir. Res. 19:55; Okuse, et al., 2005, Antivir. Res.EC 50 and CC 50 values are calculated by linear regression analysis (MS EXCEL®, QuattroPro®) using pooled data from all treated cultures (Korba and Gerin, 1992, Antivir. Res. 19:55; Okuse, et al. ., 2005, Antivir. Res.
65:23). Las desviaciones típicas para los valores de CE50 y CE90 se calcularon a partir de los errores típicos generados por los análisis de regresión. La CE50 y la CE90 son concentraciones de fármaco a las que se observó un descenso de factor 2 o factor 10 del ARN de NoV intracelular (con respecto a los niveles promedio en cultivos sin tratar), respectivamente. La CC50 es la concentración de fármaco a la que se observa un nivel dos veces menor de captación de tinte rojo neutro (con respecto a los niveles promedio en cultivos sin tratar). El índice de selectividad (I.S.) se calculó como CC50 /CE50. Se usa interferón 2b humano recombinante (PBL laboratories, Inc.) como control de ensayo. 65:23). The standard deviations for the EC 50 and EC 90 values were calculated from the standard errors generated by the regression analyzes. EC 50 and EC 90 are drug concentrations at which a factor 2 or factor 10 decrease in intracellular NoV RNA was observed (relative to average levels in untreated cultures), respectively. The CC 50 is the drug concentration at which two times less level of neutral red dye uptake is observed (relative to average levels in untreated cultures). The selectivity index (IS) was calculated as CC 50 / EC 50 . Recombinant human interferon 2b (PBL laboratories, Inc.) is used as an assay control.
CE 50 de BKV en células VERO: Se sembraron placas de histocultivo de pocilios Costar 96 con 10000 células Vero/pocillo en DMEM que contenía suero bovino fetal convencional Hyclone al 2 % (FBS, Cat SH30088.03) y penicilina y estreptomicina Hyclone al 1 %. Los pocillos externos no se usaron para minimizar el efecto de borde producido por incubaciones prolongadas. Las células se inocularon con 115 copias de ADN de BKV/célula (ATCC, cepa Gardner). Se añadieron diluciones en serie de compuestos de ensayo a las células y las placas se incubaron durante 10 días a 37 °C en un 5 % de CO2. Después de la incubación de 10 días, se mezclaron 50 pl de sobrenadante con 50 pl de tampón de lisis 2X que proporcionó una concentración final de 0,5 mg/ml de proteasa K, KCl 50 mM, T ris-Cl 10 mM pH 8,0, MgCl22,5 mM, IGEPAL al 0,45 % y Tween-20 al 0,45 % disuelto en agua tratada con DEPC. Cada placa se incubó durante 2 horas a 55 °C. Se midió el ADN de BKV del sobrenadante por reacción en cadena de la polimerasa cuantitativa (qPCR) usando los cebadores directo e inverso de PCR de BKV, y una sonda marcada con FAM. La cuantificación absoluta del número de copias del virus se realizó usando una curva patrón con diluciones de amplicón de ADN de BKV que contenía secuencias homólogas al fragmento amplificado. Se usaron las siguientes condiciones de amplificación por qPCR: 1 ciclo a 95 °C durante 10 minutos, seguido de 45 ciclos de 95 °C durante 15 segundos y 60 °C durante 60 segundos. Las reacciones de qPCR se realizaron usando un sistema de PCR ultrarrápida Applied Biosystems 7500. Se usó el programa informático Gen 5 (BioTek Instruments, Inc.) para calcular la concentración que inhibía los niveles de ADN vírico de células Vero infectadas por BKV en un 50 % (CE50). EC 50 of BKV in VERO cells: Costar 96 well histoculture plates were seeded with 10,000 Vero cells / well in DMEM containing 2% Hyclone standard fetal bovine serum (FBS, Cat SH30088.03) and Hyclone penicillin and streptomycin 1 %. The outer wells were not used to minimize the edge effect produced by prolonged incubations. Cells were inoculated with 115 copies of BKV DNA / cell (ATCC, Gardner strain). Serial dilutions of test compounds were added to the cells and the plates were incubated for 10 days at 37 ° C in 5% CO 2 . After the 10 day incubation, 50 µl of supernatant was mixed with 50 µl of 2X lysis buffer that gave a final concentration of 0.5 mg / ml of protease K, 50 mM KCl, 10 mM T ris-Cl pH 8 , 0, MgCl22.5 mM, 0.45% IGEPAL and 0.45% Tween-20 dissolved in DEPC-treated water. Each plate was incubated for 2 hours at 55 ° C. BKV DNA from the supernatant was measured by quantitative polymerase chain reaction (qPCR) using the BKV PCR forward and reverse primers, and a FAM-labeled probe. Absolute quantification of virus copy number was performed using a standard curve with dilutions of BKV DNA amplicon containing sequences homologous to the amplified fragment. The following qPCR amplification conditions were used: 1 cycle at 95 ° C for 10 minutes, followed by 45 cycles of 95 ° C for 15 seconds and 60 ° C for 60 seconds. The qPCR reactions were performed using an Applied Biosystems 7500 ultra-fast PCR system. The Gen 5 computer program (BioTek Instruments, Inc.) was used to calculate the concentration that inhibited viral DNA levels of BKV-infected Vero cells by 50 % (EC50).
Ensayos de reducción de placas para HSV-1, HSV-2, VZV y HCMV: Se prepararon monocapas de células HFF en placas de seis pocillos y se incubaron a 37 °C durante 2 días para permitir que las células alcanzaran la confluencia. Entonces se aspiró el medio de los pocillos y se añadieron 0,2 ml de virus a cada uno de los tres pocillos para producir 20-30 placas en cada pocillo. Se permitió que el virus se adsorbiera en las células durante 1 h y las placas se balancearon suavemente cada 15 min para redistribuir el medio. Los compuestos se diluyeron en medio de cultivo celular de mantenimiento que consiste en MEM con sales de Earle complementado con FBS al 2 %, L-glutamina, penicilina y gentamicina. Las soluciones que varían de 300 pM a 0,1 pM se añadieron a pocillos duplicados y las placas se incubaron durante diversos tiempos, dependiendo del virus usado. El ensayo de reducción de placas con la cepa F de HSV-1 se realizó de una manera similar, pero con células Vero infectadas un día después de la siembra en placa. La concentración final de FBS en este ensayo fue de un 5 %. Para HSV-1 y 2, las monocapas se tiñeron con violeta de genciana al 1 % en metanol al 20 % y el tinte no unido se retiró por lavado con dH2 O. Para ensayos con HCMV y VZV, la monocapa de células se tiñó con solución de rojo neutro al 1 % durante 4 h, después el colorante se aspiró y las células se lavaron con PBS. Para todos los ensayos, se enumeraron las placas usando un estereomicroscopio y la concentración de compuesto que reducía la formación de placas en un 50 % (CE50) se interpoló de los datos experimentales. Plaque Reduction Assays for HSV-1, HSV-2, VZV, and HCMV: HFF cell monolayers were prepared in six-well plates and incubated at 37 ° C for 2 days to allow the cells to reach confluence. The medium was then aspirated from the wells and 0.2 ml of virus was added to each of the three wells to produce 20-30 plaques in each well. The virus was allowed to adsorb on the cells for 1 h and the plates were gently rocked every 15 min to redistribute the medium. Compounds were diluted in maintenance cell culture medium consisting of MEM with Earle's salts supplemented with 2% FBS, L-glutamine, penicillin, and gentamicin. Solutions ranging from 300 pM to 0.1 pM were added to duplicate wells and the plates were incubated for various times, depending on the virus used. The plaque reduction assay with HSV-1 strain F was performed in a similar manner, but with infected Vero cells one day after plating. The final concentration of FBS in this assay was 5%. For HSV-1 and 2, monolayers were stained with 1% gentian violet in 20% methanol and unbound dye was washed away with dH 2 O. For HCMV and VZV assays, the cell monolayer was stained with 1% neutral red solution for 4 h, then the dye was aspirated and the cells were washed with PBS. For all tests, the plaques were enumerated using a stereomicroscope and the concentration of compound that reduced plaque formation by 50% (EC50) was interpolated from the experimental data.
Ensayos de reducción de placas para MCMV: Se prepararon fibroblastos de embrión de ratón usando un procedimiento similar al resumido anteriormente para células HFF y se suspendieron en medio de histocultivo como se describe anteriormente y se sembraron en placas de 12 pocillos y se incubaron a 37 °C durante 24 h. El medio se aspiró y las monocapas de células se infectaron con la cepa Smith de MCMV en un volumen final de 0,2 ml en cada uno de los pocillos triplicados. Las células infectadas entonces se incubaron a 37 °C durante 1 h y las placas se balancearon ocasionalmente para garantizar que el medio cubría la monocapa completa. Los compuestos se diluyeron en serie 1:5 en medio de cultivo celular de mantenimiento de tejidos descrito anteriormente y las soluciones se añadieron a las monocapas infectadas. Las monocapas infectadas se incubaron durante 7 días y después se tiñeron con 2 ml de un solución de rojo neutro al 1 % como se describe anteriormente. Las placas se enumeraron y los valores de CE50 se interpolaron de los datos experimentales por métodos convencionales. Plaque reduction assays for MCMV: Mouse embryo fibroblasts were prepared using a procedure similar to that outlined above for HFF cells and suspended in histoculture medium as described above and seeded in 12-well plates and incubated at 37 ° C for 24 h. The medium was aspirated and the cell monolayers were infected with the Smith strain of MCMV in a final volume of 0.2 ml in each of the triplicate wells. The infected cells were then incubated at 37 ° C for 1 h and the plates were occasionally rocked to ensure that the medium covered the entire monolayer. Compounds were serially diluted 1: 5 in tissue maintenance cell culture medium described above and the solutions were added to the infected monolayers. The infected monolayers were incubated for 7 days and then stained with 2 ml of a 1% neutral red solution as described above. Plates were numbered and EC 50 values interpolated from experimental data by standard methods.
Ensayos de cuantificación de ADN para EBV y HHV-6B: Los ensayos para EBV se realizaron en células Akata que se indujeron para que experimentaran una infección lítica con 50 pg/ml de un anticuerpo de cabra anti-IgG humana por métodos convencionales. Los compuestos experimentales se diluyeron en placas de 96 pocillos de fondo redondo para producir concentraciones que varían de 20 a 0,016 pM. Las células Akata se añadieron a las placas a una concentración de 4*104 células por pocillo y se incubaron durante 72 h. Para HHV-6, los compuestos se diluyeron en serie en placas de 96 pocillos, después se añadieron 1 x 104 células HSB-2 o Molt-3 sin infectar a cada pocillo. La infección se inició añadiendo células HSB-2 infectadas con HHV-6A, o células Molt-3 infectadas con HHV-6B, a una relación de aproximadamente 1 célula infectada por cada 10 células HSB-2 o células Molt-3 sin infectar respectivamente y se incubaron durante 7 días a 37 °C. Para todos los ensayos, se añadieron 100 pl de tampón de desnaturalización (NaOH 1,2 M, 80 NaCl 4,5 M) a cada pocillo para desnaturalizar el ADN y se aspiró una alícuota de 50 pl a través de una membrana de nailon Immobilon (Millipore, Bedford, MA) usando un aparato Biodot (Bio-Rad, Hercules, CA). Entonces se permitió que las membranas se secaran antes de equilibrado en DIG Easy Hyb (Roche Diagnostics, Indianápolis, IN) a 56 °C durante 30 min. Se prepararon sondas marcadas con digoxigenina (DIG) específicas para cada virus de acuerdo con el protocolo del fabricante (Roche Diagnostics). Para EBV, los cebadores 5'-CCC AGG AGT CCC AGT AGT CA-3' y 5'-CAG TTC CTC GCC TTA GGT TG-3 amplificaron un fragmento correspondiente a las coordenadas 96802-97234 en el genoma de EBV (AJ507799). Se preparó una sonda marcada con DIG de HHV-6 específica usando los cebadores 5'-CCT TGA TCA t Tc GAC c Gt TT-3' y 5'-TGG GAT TGG GAT TAG AGC TG-3' para amplificar un segmento de ORF2 (coordenadas 37820-38418 en X83413). Las membranas con ADN de EBV se hibridaron durante una noche a 56 °C seguido de lavados secuenciales en SSC 0,2* con SDS al 0,1 % y SSC 0,1* con SDS al 0,1 % a la misma temperatura. Para las transferencias de HHV-6A y HHV-6B, se permitió que la sonda hibridara durante una noche a 42 °C y las transferencias se aclararon a la misma temperatura con SSC 0,2* con SDS al 0,1 % y SSC 0,1* con SDS al 0,1 %. La detección de la sonda DIG unida específicamente se realizó con anticuerpo anti-DIG usando el protocolo del fabricante (Roche Diagnostics). Se capturó una imagen de la película fotográfica y se cuantificó con el programa informático QuantityOne (Bio-Rad) y las concentraciones de compuesto suficientes para reducir la acumulación de ADN vírico en un 50 % (CE50) se interpolaron de los datos experimentales. DNA Quantification Assays for EBV and HHV-6B: The EBV assays were performed on Akata cells that were induced to undergo lytic infection with 50 pg / ml of a goat anti-human IgG antibody by standard methods. The experimental compounds were diluted in round bottom 96 well plates to produce concentrations ranging from 20 to 0.016 pM. Akata cells were added to the plates at a concentration of 4 * 10 4 cells per well and incubated for 72 h. For HHV-6, compounds were serially diluted in 96-well plates, then 1 x 104 uninfected HSB-2 or Molt-3 cells were added to each well. The infection was initiated by adding HHV-6A infected HSB-2 cells, or HHV-6B infected Molt-3 cells, at a ratio of approximately 1 infected cell for every 10 uninfected HSB-2 cells or Molt-3 cells respectively and they were incubated for 7 days at 37 ° C. For all assays, 100 µl Denaturation Buffer (1.2 M NaOH, 80 4.5 M NaCl) was added to each well to denature DNA and a 50 µl aliquot was aspirated through an Immobilon nylon membrane. (Millipore, Bedford, MA) using a Biodot apparatus (Bio-Rad, Hercules, CA). The membranes were then allowed to dry before equilibration in DIG Easy Hyb (Roche Diagnostics, Indianapolis, IN) at 56 ° C for 30 min. Virus-specific digoxigenin-labeled (DIG) probes were prepared according to the manufacturer's protocol (Roche Diagnostics). For EBV, the primers 5'-CCC AGG AGT CCC AGT AGT CA-3 'and 5'-CAG TTC CTC GCC TTA GGT TG-3 amplified a fragment corresponding to coordinates 96802-97234 in the EBV genome (AJ507799). A specific HHV-6 DIG-labeled probe was prepared using the primers 5'-CCT TGA TCA t Tc GAC c Gt TT-3 'and 5'-TGG GAT TGG GAT TAG AGC TG-3' to amplify a segment of ORF2 (coordinates 37820-38418 in X83413). The EBV DNA membranes were hybridized overnight at 56 ° C followed by sequential washes in 0.2 * SSC with 0.1% SDS and 0.1 * SSC with 0.1% SDS at the same temperature. For the HHV-6A and HHV-6B blots, the probe was allowed to hybridize overnight at 42 ° C and the blots were rinsed at the same temperature with 0.2 * SSC with 0.1% SDS and 0 SSC , 1 * with 0.1% SDS. Detection of the specifically bound DIG probe was performed with anti-DIG antibody using manufacturer's protocol (Roche Diagnostics). An image of the photographic film was captured and quantified with QuantityOne software (Bio-Rad) and compound concentrations sufficient to reduce viral DNA accumulation by 50% (EC50) were interpolated from the experimental data.
Ensayos de cuantificación de ADN para HHV-8: Los compuestos de ensayo se diluyeron en pocillos duplicados de una placa de 96 pocillos con la máxima concentración final de 20 pM. Las células BCBL-1 se indujeron para que experimentaran una infección lítica mediante la adición de 12-miristato 13-acetato de forbol (Promega, Madison WI) a una concentración final de 100 ng/ml y se añadieron 2* 104 células a cada pocillo en la placa. Las células se incubaron durante 7 días a 37 °C en una estufa de incubación con CO 2 humidificada, entonces se preparó el ADN total con un kit de purificación de 96 pocillos Wizard SV (Promega). El ADN vírico se cuantificó por PCR ultrarrápida usando el cebador directo 5'-TTC C C C AGA TAC A C G Ac A GAA TC-3', el cebador inverso 5'-CG G A G C G CA G G C TAC CT-3' y la sonda 5'-(FAM) C C T A C G TG T T C G T C G AC (TAMRA)-3'. Se usó el plásmido pMP218 que contenía secuencias de ADN correspondientes a los nucleótidos 14120 -14182 (AF148805.2) para proporcionar cuantificación absoluta del ADN vírico. Las concentraciones de compuesto suficientes para reducir el número de copias del genoma en un 50 % se calcularon a partir de los datos experimentales. DNA quantification assays for HHV-8: Test compounds were diluted in duplicate wells of a 96-well plate to the maximum final concentration of 20 pM. BCBL-1 cells were induced to undergo lytic infection by the addition of phorbol 12-myristate 13-acetate (Promega, Madison WI) to a final concentration of 100 ng / ml and 2 * 104 cells were added to each well. on the plate. Cells were incubated for 7 days at 37 ° C in a humidified CO 2 incubator, then total DNA was prepared with a Wizard SV 96-well purification kit (Promega). Viral DNA was quantified by flash PCR using the forward primer 5'-TTC CCC AGA TAC ACGA c A GAA TC-3 ', the reverse primer 5'-CG GAGCG CA GGC TAC CT-3' and the probe 5 '- ( FAM) CCTACG TG TTCGTCG AC (TAMRA) -3 '. Plasmid pMP218 containing DNA sequences corresponding to nucleotides 14120-14182 (AF148805.2) was used to provide absolute quantification of viral DNA. Compound concentrations sufficient to reduce genome copy number by 50% were calculated from the experimental data.
Ensayos celulares para la gripe: Para las curvas de respuesta a la dosis, se añadieron fármacos individuales a células MDCK en microplacas de 96 pocillos (8 x 104 células/pocillo) usando tres pocillos para cada concentración usada. Los compuestos se añadieron a las siguientes concentraciones: carboxilato de oseltamivir a 0, 0,000032, 0,0001, 0,00032, 0,001, 0,0032, 0,01, 0,032, 0,1, 1,0, 10,0 y 100 pg/ml; amantadina y ribavirina a 0, 0,001, 0,0032, 0,01, 0,032, 0,1, 0,32, 1, 3,2, 10, 32 y 100 pg/ml. Se incluyeron pocillos sin tratar de células infectadas (controles de virus) y células sin infectar (controles de célula) en cada placa de ensayo. A los tres días después de la infección, los pocillos de control de virus mostraban un 100 % citopatología. El grado de citopatología vírica en cada pocillo se determinó microscópicamente por inspección y por tinción con rojo neutro (NR). En resumen, las células se tiñeron con NR al 0,011 % diluido en MEM para determinar la viabilidad celular. Dos horas después, las placas se procesaron para la cuantificación de la captación de NR en células viables. La cantidad de NR recogido por las células se determinó espectrofotométricamente. Influenza Cell Assays: For dose response curves, single drugs were added to MDCK cells in 96-well microplates (8 x 104 cells / well) using three wells for each concentration used. Compounds were added at the following concentrations: oseltamivir carboxylate at 0.000032, 0.0001, 0.00032, 0.001, 0.0032, 0.01, 0.032, 0.1, 1.0, 10.0 and 100 pg / ml; amantadine and ribavirin at 0, 0.001, 0.0032, 0.01, 0.032, 0.1, 0.32, 1, 3.2, 10, 32 and 100 pg / ml. Untreated wells of infected cells (virus controls) and uninfected cells (cell controls) were included in each assay plate. At three days after infection, the virus control wells showed 100% cytopathology. The degree of viral cytopathology in each well was determined microscopically by inspection and by neutral red (NR) staining. Briefly, cells were stained with 0.011% NR diluted in MEM to determine cell viability. Two hours later, the plates were processed for the quantification of NR uptake in viable cells. The amount of NR collected by the cells was determined spectrophotometrically.
Ensayos de qPCR para BKV y JCV: Se realizaron ensayos principales para virus BK en placas de 96 pocillos que contenían monocapas de células HFF. Se prepararon diluciones de compuesto en placas que contenían células que se infectaron posteriormente con la cepa Gardner de virus BK. Después de una incubación de 7 días, se preparó el ADN total con un kit de purificación de 96 pocillos Wizard SV y se cuantificó el número de copias del genoma por PCR ultrarrápida usando los cebadores 5'- Ag T G GA T G G G CA G C C TAT GTA-3', 5'- TCA TAT C T G G G T C C C Ct G GA-3' y la sonda 5'-6-FAM A G G TAG AAG A G G TTA G G G TG T TTG ATG G CA CA G TAMRA-3'. El plásmido pMP526 sirvió como patrón de ADN con fines de cuantificación. Los compuestos que fueron positivos en este ensayo se confirmaron en un ensayo similar en placas de 96 pocillos con los compuestos añadidos 1 h después de la infección para identificar compuestos que inhiben las primeras fases de replicación, incluyendo adsorción y penetración. El número de copias del genoma se determinó por métodos descritos anteriormente. QPCR Assays for BKV and JCV: Primary assays for BK viruses were performed in 96-well plates containing HFF cell monolayers. Compound dilutions were prepared on plates containing cells that were subsequently infected with the Gardner strain of BK virus. After a 7 day incubation, total DNA was prepared with a Wizard SV 96-well purification kit and genome copy number was quantified by flash PCR using primers 5'- A g TG GA TGGG CA GCC TAT GTA -3 ', 5'- TCA TAT CTGGGTCCCC t G GA-3' and the probe 5'-6-FAM AGG TAG AAG AGG TTA GGG TG T TTG ATG G CA CA G TAMRA-3 '. Plasmid pMP526 served as a DNA template for quantification purposes. Compounds that were positive in this assay were confirmed in a similar assay in 96-well plates with compounds added 1 hr after infection to identify compounds that inhibit early stages of replication, including adsorption and penetration. The copy number of the genome was determined by methods described above.
También se realizó la evaluación principal de los compuestos contra virus JC por métodos similares a los de ensayos principales para virus BK, pero se hicieron en células 293TT y utilizaron la cepa 1-4 de JC V en células 293TT. El ADN vírico se cuantificó usando los cebadores 5'-CTG G TC ATG T G G A TG C T G TCA-3' y 5'-G CC A G C A G G C T G TTG ATA CTG-3' y la sonda 5'-6-FAM -CCC TTT G TT TG G C T G CT-TAM RA-3 junto con el plásmido pMP508 para proporcionar una curva patrón para la cuantificación absoluta. Se realizaron ensayos secundarios contra JC V en células CO S7 por métodos similar a los del virus BK para identificar compuestos que inhibían la adsorción o penetración del virus.Compounds were also screened against JC virus by methods similar to BK virus core assays, but they were done on 293TT cells and used JC V strain 1-4 on 293TT cells. The viral DNA was quantified using the primers 5'-CTG G TC ATG TGGA TG CTG TCA-3 'and 5'-G CC AGCAGGCTG TTG ATA CTG-3' and the probe 5'-6-FAM -CCC TTT G TT TG GCTG CT-TAM RA-3 together with plasmid pMP508 to provide a standard curve for absolute quantification. Secondary assays against JC V were performed in CO S7 cells by methods similar to those of the BK virus to identify compounds that inhibited virus uptake or penetration.
Ensayos de virus de la hepatitis C: Indicador de luciferasa (replicón)/CytoTox-1 (toxicidad). Los compuestos se cribaron por la actividad anti-HCV usando un criterio de valoración del gen indicador de luciferasa (Luc) en el ensayo principal de HCV. El indicador Luc se usó como medida indirecta de replicación de HCV ya que su actividad era directamente proporcional a los niveles de ARN de HCV. Se realiza evaluación de la citotoxicidad en paralelo. Se prepararon soluciones madre de fármaco en DMSO salvo que se indique otra cosa y se diluyen con medio de histocultivo hasta la concentración de ensayo alta deseada. Para cada ensayo, los compuestos entonces se diluyeron adicionalmente en medio de histocultivo según lo necesario. Después de incubación, las células se procesaron para derivar, donde fuera aplicable, la CE50 y la CE90 (concentración de compuesto que reduce la replicación del replicón en un 50 % y 90 % respectivamente). Los valores de CC50 (concentración que disminuye la viabilidad celular en un 50 % ) e IS50 (CC50/CE50) se determinaron y se presentaron. Se evaluó la actividad anti-HCV con la actividad Luc derivada del replicón (genotipo 1b o 2a) o el virus HCVcc como lectura; mientras que las concentraciones citotóxicas de fármaco que reducen los números de células se evaluaron mediante el ensayo de proliferación celular CytoTox-1 (Promega, Madison, WI) de acuerdo con el protocolo del fabricante. Se usó interferón alfa recombinante como fármaco de control positivo para validar el funcionamiento del ensayo. Hepatitis C virus assays: Luciferase (replicon) / CytoTox-1 (toxicity) indicator. Compounds were screened for anti-HCV activity using a luciferase reporter gene (Luc) endpoint in the primary HCV assay. The Luc indicator was used as an indirect measure of HCV replication since its activity was directly proportional to the levels of HCV RNA. Cytotoxicity evaluation is performed in parallel. Drug stocks were prepared in DMSO unless otherwise noted and diluted with histoculture medium to the desired high assay concentration. For each assay, the compounds were then further diluted in histoculture medium as necessary. After incubation, cells were processed to derive, where applicable, the EC50 and EC90 (concentration of compound that reduces replicon replication by 50% and 90% respectively). The values of CC50 (concentration that decreases cell viability by 50%) and IS50 (CC50 / EC50) were determined and presented. The anti-HCV activity was evaluated with the Luc activity derived from the replicon (genotype 1b or 2a) or the HCVcc virus as reading; while cytotoxic drug concentrations that reduce cell numbers were evaluated by the CytoTox-1 cell proliferation assay (Promega, Madison, WI) according to the manufacturer's protocol. Recombinant alpha interferon was used as a positive control drug to validate the performance of the assay.
Ensayos para virus de la gripe, virus respiratorio sincitial (RSV) y SARS CoV: Los virus principales y células usados fueron virus de la gripe cepa A/California/7/2009 (H1N1) en células MDCK, virus respiratorio sincitial cepa A -2 en células Hep2 y SA RS CoV cepa Toronto-2 en células VeroE6. Assays for influenza virus, respiratory syncytial virus (RSV) and SARS CoV: The main viruses and cells used were influenza virus strain A / California / 7/2009 (H1N1) in MDCK cells, respiratory syncytial virus strain A -2 in Hep2 cells and SA RS CoV strain Toronto-2 in VeroE6 cells.
Los ensayos para el virus de la gripe, RSV y SARS CoV fueron ensayo de efecto citopático/toxicidad usando CelITiter-Glo. Los ensayos de citoprotección antivírica examinaron los efectos de los compuestos a concentraciones indicadas de respuesta a dosis en tipos celulares específicos para ensayar la eficacia de los compuestos en la prevención del efecto citopático inducido por el virus. Se incluyó ribavirina como fármaco de control positivo para el virus de la gripe y RSV, mientras que se usó el inhibidor calpaína IV para ensayos antivíricos de SARS. Se sembraron cultivos subconfluyentes de células en placas de 96 pocillos para el análisis de viabilidad celular (citotoxicidad) y actividad antivírica (ECP). Para el ensayo convencional, los fármacos se añadieron a las células 24 horas después. Los pocillos ECP también recibieron 100 dosis infecciones de histocultivo (100 DICT50) de virus valorado. A las 72 horas después se determinó la viabilidad celular.Assays for influenza virus, RSV, and SARS CoV were cytopathic effect / toxicity assay using CelITiter-Glo. Antiviral cytoprotection assays examined the effects of compounds at indicated dose-response concentrations in specific cell types to test the efficacy of compounds in preventing virus-induced cytopathic effect. Ribavirin was included as a positive control drug for influenza and RSV viruses, while the IV calpain inhibitor was used for SARS antiviral assays. Subconfluent cell cultures were seeded in 96-well plates for analysis of cell viability (cytotoxicity) and antiviral activity (ECP). For the standard assay, the drugs were added to the cells 24 hours later. The ECP wells also received 100 doses histoculture infections (100 TCID50) of assayed virus. At 72 hours later, cell viability was determined.
La medición del ECP inducido por virus se basó en la cuantificación de ATP, un indicador de células metabólicamente activas. El ensayo de ECP empleó un kit de viabilidad celular luminiscente CellTiter-Glo™ disponible en el mercado (Promega, Madison, WI), y fue un método fiable para determinar la citotoxicidad y la proliferación celular en cultivo. El procedimiento implicó añadir el reactivo individual (reactivo CellTiter-Glo™) directamente a células subconfluyentes previamente cultivadas en el medio. Esto indujo lisis celular y la producción de una señal bioluminiscente (semivida mayor de 5 horas, dependiendo del tipo celular) que fue proporcional a la cantidad de ATP presente (que es un biomarcador de viabilidad).Measurement of virus-induced CPE was based on quantification of ATP, an indicator of metabolically active cells. The ECP assay employed a commercially available CellTiter-Glo ™ luminescent cell viability kit (Promega, Madison, WI), and was a reliable method for determining cytotoxicity and cell proliferation in culture. The procedure involved adding the single reagent (CellTiter-Glo ™ reagent) directly to subconfluent cells previously cultured in the medium. This induced cell lysis and the production of a bioluminescent signal (half-life greater than 5 hours, depending on the cell type) that was proportional to the amount of ATP present (which is a biomarker of viability).
Ensayos para virus del dengue (DENV), virus del Nilo Occidental (WNV), virus de la fiebre amarilla (YFV), virus de la fiebre del Valle de la Gran Falla (RVFV), virus de la encefalitis equina venezolana (VEEV):Assays for Dengue virus (DENV), West Nile virus (WNV), Yellow fever virus (YFV), Great Falla Valley fever virus (RVFV), Venezuelan equine encephalitis virus (VEEV):
Ensayo principal de reducción del efecto citopático (ECP). Se realizaron ensayos de inhibición de ECP de cuatro concentraciones. Se prepararon monocapas de cultivo celular confluyentes o casi confluyentes en microplacas desechables de 96 pocillos. Las células se mantuvieron en MEM o DMEM complementado con FBS según lo necesario para cada línea celular. Para ensayos antivíricos, se usó el mismo medio, pero con FBS reducido hasta un 2 % o menos y complementado con 50 pg/ml de gentamicina. El compuesto de ensayo se preparó a cuatro log 10 de las concentraciones finales, habitualmente 0,1, 1,0, 10 y 100 pg/ml o pM. Los pocillos de control de virus y control de célula estaban en cada microplaca. En paralelo, se ensaya un fármaco activo conocido como fármaco de control positivo usando el mismo método que el que se aplicó para los compuestos de ensayo. El control positivo se ensayó con cada desarrollo de ensayo. El ensayo se estableció retirando en primer lugar el medio de crecimiento de las placas de 96 pocillos de células. Después, se aplicó el compuesto de ensayo en un volumen de 0,1 ml a los pocillos a concentración 2X. El virus, normalmente a <100 dosis infecciosas de cultivo celular del 50 % (DICC50) en un volumen de 0,1 ml, se puso en los pocillos indicados para infección vírica. Se puso medio desprovisto de virus en los pocillos de control de toxicidad y pocillos de control de célula. Los pocillos de control de virus se trataron de manera similar con virus. Las placas se incubaron a 37 °C con un 5 % de CO2 hasta que se observó un ECP máximo en los pocillos de control de virus. Las placas entonces se tiñeron con rojo neutro al 0,011 % durante aproximadamente dos horas a 37 °C en una estufa de incubación de un 5 % de CO2. El medio de rojo neutro se retiró por aspiración completa, y las células pueden aclararse 1X con solución salina tamponada con fosfato (PBS) para retirar el tinte residual. La PBS se retiró completamente y el rojo neutro incorporado se eluye con tampón citrato de Sorensen al 50 %/etanol al 50 % (pH 4,2) durante al menos 30 minutos. El tinte rojo neutro penetra en las células vivas, por tanto, cuando más intenso sea el color rojo, mayor será el número de células viables presentes en los pocillos. El contenido de tinte en cada pocillo se cuantificó usando un espectrofotómetro de 96 pocillos a longitud de onda de 540 nm. El contenido de tinte en cada conjunto de pocillos se convirtió en un porcentaje de tinte presente en pocillos de control sin tratar usando una hoja de cálculo de ordenador de basada en Microsoft Excel. Las concentraciones eficaces al 50 % (CE50) y las concentraciones citotóxicas al 50 % (CC50) se calcularon entonces por análisis de regresión lineal. El cociente de CC50 dividido por CE50 da el valor de índice de selectividad (IS).Primary Cytopathic Effect Reduction (CPE) Trial. Four concentration ECP inhibition assays were performed. Confluent or near confluent cell culture monolayers were prepared in disposable 96-well microplates. Cells were kept in MEM or DMEM supplemented with FBS as needed for each cell line. For antiviral assays, the same medium was used, but with FBS reduced to 2% or less and supplemented with 50 pg / ml gentamicin. The test compound was prepared at four log 10 final concentrations, usually 0.1, 1.0, 10 and 100 pg / ml or pM. Virus control and cell control wells were on each microplate. In parallel, an active drug known as a positive control drug is tested using the same method as that applied for the test compounds. The positive control was tested with each assay run. The assay was established by first removing the growth medium from the 96-well plates of cells. The test compound was then applied in a volume of 0.1 ml to the wells at 2X concentration. Virus, typically at <100 50% cell culture infectious doses (CCID50) in 0.1 ml volume, was placed in the wells indicated for viral infection. Medium devoid of virus was placed in the toxicity control wells and cell control wells. Virus control wells were similarly treated with virus. The plates were incubated at 37 ° C with 5% CO 2 until a maximum CPE was observed in the virus control wells. The plates were then stained with 0.011% neutral red for approximately two hours at 37 ° C in a 5% CO 2 incubator. The neutral red medium was removed by complete aspiration, and cells can be rinsed 1X with phosphate buffered saline (PBS) to remove residual dye. The PBS was removed completely and the incorporated neutral red was eluted with 50% Sorensen citrate / 50% ethanol buffer (pH 4.2) for at least 30 minutes. The neutral red dye penetrates living cells, therefore, the more intense the red color, the greater the number of viable cells present in the wells. The content of dye in each well was quantified using a 96-well spectrophotometer at 540 nm wavelength. The content of dye in each set of wells was converted to a percentage of dye present in untreated control wells using a Microsoft Excel-based computer spreadsheet. The 50% effective concentrations (EC50) and the 50% cytotoxic concentrations (CC50) were then calculated by linear regression analysis. The quotient of CC50 divided by EC50 gives the Selectivity Index (IS) value.
Ensayos para adenovirus (AdV), virus del sarampión (MEV), poliovirus (POV) y enterovirus (ENTV): El cribado principal fue un ensayo de reducción del efecto citopático (ECP). En resumen, se infectaron cultivos de 96 pocillos de células con virus en presencia de compuestos de ensayo y se incubaron durante 4-7 días (dependiendo del virus/células específicos). Cada virus se valoró previamente de modo que los pocillos de control mostraran aproximadamente un 95 % de pérdida de viabilidad celular debido a la replicación del virus. Por lo tanto, se observó efecto antivírico, o citoprotección, cuando los compuestos evitaban la replicación del virus. Cada placa de ensayo contenía pocillos de control de célula (células solamente), pocillos de control de virus (células más virus), pocillos de control de toxicidad del compuesto (células más compuesto solamente), pocillos de control colorimétrico de compuesto (compuesto solamente, sin células o virus), así como pocillos experimentales (compuesto más células más virus). Se evaluó la citoprotección y la citotoxicidad del compuesto por reducción de tinte MTS (reactivo CellTiter®96, Promega, Madison WI). El porcentaje de reducción en el ECP del virus (actividad antivírica) y el porcentaje de viabilidad celular (citotoxicidad) se determinaron y presentaron. Assays for adenovirus (AdV), measles virus (MEV), poliovirus (POV), and enterovirus (ENTV): The main screening was a cytopathic effect reduction (CPE) assay. Briefly, 96-well cell cultures were infected with virus in the presence of test compounds and incubated for 4-7 days (depending on the specific virus / cells). Each virus was pre-scored so that control wells showed approximately 95% loss of cell viability due to virus replication. Therefore, an antiviral effect, or cytoprotection, was observed when the compounds prevented virus replication. Each assay plate contained cell control wells (cells only), virus control wells (cells plus virus), compound toxicity control wells (cells plus compound only), compound colorimetric control wells (compound only, without cells or virus), as well as experimental wells (composed plus cells plus virus). The cytoprotection and cytotoxicity of the compound was evaluated by reduction of MTS dye (CellTiter®96 reagent, Promega, Madison WI). The percentage reduction in the CPE of the virus (antiviral activity) and the percentage of cell viability (cytotoxicity) were determined and presented.
Ensayos para el virus de la variolovacuna (VACV): El ensayo principal fue un ensayo de reducción del efecto citopático (ECP). Células HFF de bajo pase (3-10) se trataron con tripsina, se contaron y se sembraron en placas de histocultivo de 96 pocillos en 0,1 ml de MEM complementado con FBS al 10 %. Las células entonces se incubaron durante 24 h a 37 °C. El medio entonces se retiró y se añadieron 100 pl de MEM que contenía FBS al 2 % a todas salvo la primera fila. En la primera fila, se añadieron 125 pl de medio que contenía el fármaco experimental (es decir, compuesto 1) en pocillos triplicados. Se añadió medio en solitario a los pocillos de control tanto de célula como de virus. El fármaco en la primera fila de pocillos se diluyó entonces en serie 1:5 en todos los pocillos restantes. Las placas entonces se incubaron durante 60 minutos y se añadieron 100 pl de una suspensión de virus a cada pocilio, excluyendo los pocilios de control de célula que recibieron 100 pl de MEM. Las placas entonces se incubaron a 37 °C en una estufa de incubación de C O 2 durante tres días para VACV. Después del periodo de incubación, se aspiró el medio y las células se tiñeron con violeta de genciana en formol durante 4 h. El colorante entonces se retiró y las placas se aclararon hasta que se retiró todo el exceso de colorante. Se permitió que las placas se secaran durante 24 h y se determinó la cantidad de EC P en cada fila usando un lector automatizado de múltiples placas BioTek. Los valores de C E 50 y C C 50 se determinaron comparando las células tratadas con fármaco y sin tratar usando un programa informático. Vaccine variovirus (VACV) assays: The main trial was a cytopathic effect reduction (CPE) assay. Low passage HFF cells (3-10) were trypsinized, counted, and seeded in 96-well histoculture plates in 0.1 ml MEM supplemented with 10% FBS. The cells were then incubated for 24 h at 37 ° C. The medium was then removed and 100 µl of MEM containing 2% FBS was added to all but the first row. In the first row, 125 µl of medium containing the test drug (ie, compound 1) was added in triplicate wells. Medium alone was added to both cell and virus control wells. The drug in the first row of wells was then serially diluted 1: 5 in all remaining wells. The Plates were then incubated for 60 minutes and 100 µl of a virus suspension was added to each well, excluding cell control wells that received 100 µl MEM. The plates were then incubated at 37 ° C in a CO 2 incubator for three days for VACV. After the incubation period, the medium was aspirated and the cells were stained with gentian violet in formalin for 4 h. The dye was then removed and the plates were rinsed until all excess dye was removed. Plates were allowed to dry for 24 h and the amount of EC P in each row was determined using a BioTek automated multi-plate reader. EC 50 and CC 50 values were determined by comparing drug-treated and untreated cells using a computer program.
Ejemplo 2 - Determinación de la eficacia de compuesto 1 contra norovirus murino en ratones Example 2 - Determination of the efficacy of compound 1 against murine norovirus in mice
MetodologíaMethodology
Dos estudios (estudio n.° 1 y estudio n.° 2) examinaron la capacidad del compuesto 1 de proteger a los ratones contra o de reducir la infección por norovirus murino:Two studies (Study # 1 and Study # 2) examined the ability of Compound 1 to protect mice against or reduce murine norovirus infection:
Estudio n.° 1 Se evaluó la eficacia de dosificación dos veces al día de compuesto 1 sobre un intervalo de 30 mg/kg a 300 mg/kg, iniciada antes de la infección de ratones con 106 unidades formadoras de placas (UFP) de norovirus murino (MNV) CR3. También se incluyó un grupo de control de ratones tratados con vehículo. Todas las dosis se iniciaron 2 días (39 horas) antes de la infección. Los grupos de estudio se muestran en la tabla 3.Study # 1 The efficacy of twice daily dosing of Compound 1 was evaluated over a range of 30 mg / kg to 300 mg / kg, initiated prior to infection of mice with 106 plaque-forming units (PFU) of norovirus murine (MNV) CR3. A control group of vehicle-treated mice was also included. All doses were started 2 days (39 hours) before infection. The study groups are shown in Table 3.
El compuesto se administró dos veces al día en las dosis indicadas mediante sonda oral. También se incluyó un grupo de control de ratones tratados con vehículo únicamente. Los ratones se infectaron con norovirus murino pipeteando el virus en la boca 2 días después de la primera dosis. Los ratones usados fueron ratones BALB/c hembra de ~20 gramos, 8 -12 semanas de edad en grupos de 5 (los grupos de estudio se muestran en la tabla 3). Los ratones se alojaron en rejillas metálicas y se recogió la producción fecal combinada cada 24 horas. Se recogieron los tejidos (íleon distal y ciego) y los gránulos fecales individuales en el día 3 después de la inoculación. Todas las muestras se valoraron por ensayo de placas.The compound was administered twice daily in the indicated doses by oral gavage. A control group of mice treated with vehicle only was also included. Mice were infected with murine norovirus by pipetting the virus into the mouth 2 days after the first dose. The mice used were ~ 20 gram female BALB / c mice, 8-12 weeks old in groups of 5 (study groups are shown in Table 3). Mice were housed in metal racks and pooled fecal output was collected every 24 hours. Tissues (distal ileum and cecum) and individual fecal granules were collected on day 3 after inoculation. All samples were titrated by plaque assay.
Tabla 3: Estudio n.° 1: Diseño del estudio para evaluación preliminar de la eficacia de compuesto 1 contra infección or norovirus murino en ratonesTable 3: Study # 1: Study Design for Preliminary Evaluation of Efficacy of Compound 1 Against Infection or Murine Norovirus in Mice
Estudio n.° 2 Se evaluó la eficacia de dosificación dos veces al día de compuesto 1 a 150 mg/kg o 300 mg/kg, iniciada antes de la infección de ratones con 104 ufp de MNV CR3. También se incluyó un grupo de control de ratones tratados con vehículo. La dosis de 150 mg/kg se inició 2 días (39 horas) antes de la inoculación, 1 día (15 horas) antes de la inoculación o en el día de (3 horas antes de) la inoculación; la dosis de 300 mg/kg se inició 2 días (39 horas) antes de la infección. Los grupos de estudio se muestran en la tabla 4.Study # 2 The efficacy of twice daily dosing of Compound 1 at 150 mg / kg or 300 mg / kg, initiated prior to infection of mice with 104 pfu of MNV CR3, was evaluated. A control group of vehicle-treated mice was also included. The 150 mg / kg dose was started 2 days (39 hours) before inoculation, 1 day (15 hours) before inoculation, or on the day of (3 hours before) inoculation; the 300 mg / kg dose was started 2 days (39 hours) before infection. The study groups are shown in Table 4.
Este estudio ensayó la capacidad del compuesto 1 de proteger a los ratones contra o de reducir la infección por norovirus murino. El compuesto se administró dos veces al día en las dosis indicadas mediante sonda oral empezando 2 días antes de la inoculación, 1 día antes de la inoculación o en el momento de la inoculación. También se incluyó un grupo de control de ratones tratados con vehículo únicamente. Los ratones se infectaron con 104 UFP de norovirus murino pipeteando el virus en la boca 3 horas después de la dosis del día 0. Los ratones usados fueron ratones BALB/c hembra de ~20 gramos, 8 -12 semanas de edad en grupos de 5 (los grupos de estudio se muestran en la tabla 4). Todas las muestras se valoraron por ensayo de placas. This study tested the ability of Compound 1 to protect mice against or reduce infection by murine norovirus. The compound was administered twice daily in the indicated doses by oral gavage starting 2 days before inoculation, 1 day before inoculation or at the time of inoculation. A control group of mice treated with vehicle only was also included. Mice were infected with 104 PFU of murine norovirus by pipetting virus into the mouth 3 hours after the day 0 dose. Mice used were ~ 20 gram female BALB / c mice, 8-12 weeks old in groups of 5 (The study groups are shown in table 4). All samples were titrated by plaque assay.
Tabla 4: Estudio n.° 2: Diseño del estudio para evaluación de la eficacia de compuesto 1 contra infección por norovirus murino en ratonesTable 4: Study # 2: Study Design to Evaluate the Efficacy of Compound 1 Against Murine Norovirus Infection in Mice
Para ambos estudios, el compuesto se administró mediante sonda oral en las dosis y tiempos antes de la infección indicados. Los ratones se infectaron con norovirus murino CR3 pipeteando el virus en la boca 3 horas después de que se administrara la primera dosis del día 0 del compuesto 1. Después de la infección, el compuesto se administró dos veces al día hasta el día 3 después de la infección.For both studies, the compound was administered by oral gavage at the indicated doses and times before infection. Mice were infected with murine norovirus CR3 by pipetting the virus into the mouth 3 hours after the first day 0 dose of compound 1 was administered. After infection, the compound was administered twice daily until day 3 after the infection.
Los ratones usados fueron ratones BALB/c hembra de ~20 gramos, 8 -12 semanas de edad en grupos de 5. Los ratones se alojaron en rejillas metálicas y se recogió la producción fecal combinada cada 24 horas, empezando el día -1. Se recogieron los tejidos (~1 cm de íleon distal y ciego) y los gránulos fecales individuales en el día 3 después de la infección y se pesaron. Todas las muestras se valoraron por ensayo de placas (qRT-PCR como respaldo cuando las concentraciones son demasiado bajas); las concentraciones se normalizaron a gramo de tejido o heces. En el día 3, se recogieron muestras duplicadas de tejido (~1 cm de íleon distal y ciego), se aclararon en PBS y se congelaron instantáneamente; también se recogió suero y una muestra de heces duplicada en el día 3 y se congelaron instantáneamente; este conjunto de muestra se envió para análisis de MS para evaluar la biodisponibilidad del fármaco.The mice used were ~ 20 gram female BALB / c mice, 8-12 weeks old in groups of 5. Mice were housed in metal racks and pooled fecal output was collected every 24 hours, starting on day -1. Tissues (~ 1 cm from distal ileum and cecum) and individual fecal granules were collected on day 3 post infection and weighed. All samples were titrated by plaque assay (qRT-PCR as backup when concentrations are too low); concentrations were normalized to gram of tissue or feces. On day 3, duplicate tissue samples (~ 1 cm from distal ileum and cecum) were collected, rinsed in PBS, and snap frozen; serum and a duplicate stool sample were also collected on day 3 and snap frozen; This sample set was submitted for MS analysis to assess the bioavailability of the drug.
ResultadosResults
Los resultados del estudio n.° 1 muestran que el tratamiento dos veces al día con compuesto 1, administrado empezando 2 días antes de la infección, era eficaz en reducir la concentración de norovirus murino tanto en tejido como en heces, con una mayor reducción en la concentración vírica observada con concentración creciente de fármaco como se muestra en la figura 1A y figura 1 B. Los datos también demuestran una reducción significativa en la concentración vírica para animales tratados dos veces al día con 300 mg/kg de compuesto 1 tanto en tejido como en heces en comparación con vehículo.The results of study # 1 show that twice daily treatment with Compound 1, administered beginning 2 days before infection, was effective in reducing the concentration of murine norovirus in both tissue and stool, with a greater reduction in the viral concentration observed with increasing drug concentration as shown in Figure 1A and Figure 1B. The data also demonstrate a significant reduction in viral concentration for animals treated twice daily with 300 mg / kg of Compound 1 in both tissue as in feces compared to vehicle.
Como se muestra en las figuras 1A y 1B, los ratones se trataron mediante sonda oral con las dosis indicadas de compuesto 1 administradas dos veces al día, empezando 2 días antes de la infección con 106 ufp de norovirus murino como se expone en el "estudio n.° 1".As shown in Figures 1A and 1B, mice were orally gavaged with the indicated doses of Compound 1 administered twice daily, beginning 2 days prior to infection with 106 pfu of murine norovirus as set forth in the "study # 1 ".
Los resultados del estudio n.° 2 demuestran que el tratamiento de ratones dos veces al día con 300 mg/kg de compuesto 1, empezando 2 días antes de la infección, reduce significativamente la concentración de norovirus murino tanto en tejido como en heces como se muestra en la figura 2A y la figura 2B. Estos datos confirman los hallazgos del estudio n.° 1 y demuestran que el compuesto 1 es eficaz en reducir la infección por norovirus murino. The results of Study # 2 demonstrate that treating mice twice daily with 300 mg / kg of Compound 1, starting 2 days before infection, significantly reduces the concentration of murine norovirus in both tissue and feces as shown in Figure 2A and Figure 2B. These data confirm the findings of Study # 1 and demonstrate that Compound 1 is effective in reducing murine norovirus infection.
Como se muestra en las figuras 2A y 2B, los ratones se trataron mediante sonda oral con las dosis indicadas de compuesto 1 administradas dos veces al día, empezando en los días indicados antes de la infección con 104 UFP de norovirus murino como se expone en el "estudio n.° 1".As shown in Figures 2A and 2B, mice were orally gavaged with the indicated doses of Compound 1 administered twice daily, beginning on the indicated days prior to infection with 104 PFU of murine norovirus as set forth in "Study # 1".
Las figuras 3A y 3B muestran el número de unidades formadoras de placas por gramo del estudio 1 en una escala lineal en lugar de una escala logarítmica. Como se muestra en la figura 3A, el compuesto 1 dosificado por vía oral BID (dos veces al día) empezando en el día -2 antes de la infección (n = 5/grupo) mostró una reducción en las UFP/gramo con dosis creciente. Como se muestra en la figura 3A y 3B, el compuesto 1 reduce el norovirus de ratón en tejidos y heces.Figures 3A and 3B show the number of plaque-forming units per gram from Study 1 on a linear scale rather than a logarithmic scale. As shown in Figure 3A, Compound 1 dosed orally BID (twice daily) starting on day -2 before infection (n = 5 / group) showed a reduction in PFU / gram with increasing dose. . As shown in Figure 3A and 3B, Compound 1 reduces mouse norovirus in tissues and feces.
Ejemplo 3 - Ensayo de inhibición de la polimerasa de norovirusExample 3 - Norovirus polymerase inhibition assay
Se realizaron reacciones de polimerasa (10 pl) durante 60 minutos a 37 °C. Había trifosfatos nucleosídicos (NTP) presentes a 100 pM cada uno, con 0,05 pCi de a32P-U TP (800 Ci/mmol). Los compuestos se incubaron con la polimerasa (Pol) o pro-polimerasa (ProPol), con o sin genoma de proteínas víricas ligado (VPg) en tampón de reacción en ausencia de NTP durante 10 minutos en hielo. Las reacciones se iniciaron mediante la adición de NTP, y se terminaron mediante la adición de un volumen igual de tinte de carga Tris 2x/borato/EDTA (TBE)/tampón (Invitrogen, Inc.). Los productos de ARN (100 nt) se resolvieron por electroforesis en geles de TBE al 6 %-urea (Invitrogen, Inc.). Se realizó análisis semicuantitativo de los productos de ARN por exposición de geles secados a tamices G E Healthcare Phosphor, seguido de medición de las intensidades relativas de banda usando el programa informático GelQuant.NET (Biochemlab Solutions, Inc.). Los cálculos de CI50 y CI90 se obtuvieron usando regresión lineal. Los resultados se dan a continuación en la tabla 5. Se da una comparación con trifosfato de 2'-C-metilcitidina (2'CmeC TP) por referencia. Tabla 5. En lim r n r irPolymerase reactions (10 µl) were performed for 60 minutes at 37 ° C. Nucleoside triphosphates (NTPs) were present at 100 pM each, with 0.05 pCi of a32P-U TP (800 Ci / mmol). Compounds were incubated with polymerase (Pol) or pro-polymerase (ProPol), with or without linked viral protein genome (VPg) in reaction buffer in the absence of NTP for 10 minutes on ice. Reactions were initiated by the addition of NTP, and were terminated by the addition of an equal volume of 2x Tris loading dye / borate / EDTA (TBE) / buffer (Invitrogen, Inc.). RNA products (100 nt) were resolved by electrophoresis on 6% TBE -urea gels (Invitrogen, Inc.). Semi-quantitative analysis of RNA products was performed by exposure of dried gels to GE Healthcare Phosphor sieves, followed by measurement of relative band intensities using GelQuant.NET software (Biochemlab Solutions, Inc.). IC 50 and IC 90 calculations were obtained using linear regression. The results are given below in Table 5. A comparison with 2'-C-methylcytidine triphosphate (2'CmeC TP) is given by reference. Table 5. In lim rnr go
Ejemplo 4 - Conversión de compuesto 1 en trifosfato en células RAWExample 4 - Conversion of compound 1 to triphosphate in RAW cells
Se incubaron células RAW con compuesto 1 a las concentraciones mostradas en la tabla 6a (ng/célula) y en la tabla 6b (pmol/célula).RAW cells were incubated with Compound 1 at the concentrations shown in Table 6a (ng / cell) and Table 6b (pmol / cell).
Tabla 6a. Conversión de com uesto 1 en trifosfato en n /célulaTable 6a. Conversion of compound 1 to triphosphate in n / cell
Tabla 6b. n r i n m 1 n rif f n m l l lTable 6b. n r i n m 1 n rif f n m l l l
Se incubaron células RAW con cuatro concentraciones diferentes de compuesto 1 durante 48 horas en matraces T75 a una densidad de 1,2 * 107 células/matraz. Después del periodo de incubación, las células se aclararon dos veces con PBS fría y se contaron. El sedimento celular se suspendió en 1000 pl de metanol frío:agua destilada (70:30), se mezcló en agitadora vorticial y se congeló a -80 °C hasta el momento del análisis. Como se muestra en las tablas 6a y 6b, el compuesto 1 y el compuesto 1-T P pudieron detectarse en células RAW tratadas con compuesto 1 a concentraciones de 0,5 pM a 10 pM. La concentración de compuesto 1-T P fue de 12 a 23 veces mayor que de compuesto 1.RAW cells were incubated with four different concentrations of Compound 1 for 48 hours in T75 flasks at a density of 1.2 * 107 cells / flask. After the incubation period, cells were rinsed twice with cold PBS and counted. The cell pellet was suspended in 1000 µl of cold methanol: distilled water (70:30), vortexed and frozen at -80 ° C until analysis. As shown in Tables 6a and 6b, Compound 1 and Compound 1-T P could be detected in RAW cells treated with Compound 1 at concentrations from 0.5 pM to 10 pM. The concentration of compound 1-T P was 12 to 23 times higher than that of compound 1.
Ejemplo 5 - Eficacia del compuesto 1 contra norovirus humanoExample 5 - Efficacy of compound 1 against human norovirus
La eficacia del compuesto 1 para inhibir norovirus se comparó con DMSO (como control), compuesto 2 y trifosfato de 2'-C-metilcitidina (2'CmeC TP). Las células se pretrataron con 25 pM de compuesto experimental durante dos horas. El inóculo del virus se añadió durante dos horas, y el virus no unido se eliminó por lavado y se añadió medio reciente y compuesto experimental reciente.The efficacy of Compound 1 to inhibit norovirus was compared to DMSO (as a control), Compound 2, and 2'-C-methylcytidine triphosphate (2'CmeC TP). Cells were pretreated with 25 pM of experimental compound for two hours. The virus inoculum was added for two hours, and the unbound virus was washed away and fresh medium and fresh test compound were added.
El experimento se realizó por duplicado y los resultados se muestran en la figura 4 (primer duplicado) y figura 5 (segundo duplicado). La figura 6 muestra una superposición de los resultados del primer y segundo duplicado del experimento. Como se muestra en las figuras 4, 5 y 6, "A" es DMSO, "B" es compuesto 2, "C" es trifosfato de 2 '-C -metilcitidina (2'CmeC TP) y "D" es compuesto 1. Las figuras 4-6 demuestran que la concentración vírica aumentaba casi dos órdenes de magnitud cuando se trataba con solamente DMSO o 2'CmeC TP. Sin embargo, la concentración vírica aumentaba menos de un orden de magnitud en presencia de compuesto 1.The experiment was performed in duplicate and the results are shown in Figure 4 (first duplicate) and Figure 5 (second duplicate). Figure 6 shows an overlay of the results of the first and second duplicates of the experiment. As shown in Figures 4, 5 and 6, "A" is DMSO, "B" is compound 2, "C" is 2'-C-methylcytidine triphosphate (2'CmeC TP) and "D" is compound 1 Figures 4-6 demonstrate that the viral concentration increased by almost two orders of magnitude when treated with only DMSO or 2'CmeC TP. However, the viral concentration increased by less than an order of magnitude in the presence of compound 1.
Ejemplo 6 - Concentración eficaz de compuestos de la divulgación y análogos de los mismosExample 6 - Effective concentration of compounds of the disclosure and analogs thereof
La tabla 7 a continuación muestra los valores de C E 50 y C C 50 de algunos compuestos de la divulgación, así como de análogos de los mismos para norovirus murino. En casos donde los compuestos se ensayaron, pero no pudo medirse el valor de C E 50 , el valor de C E 50 se da como N/A.Table 7 below shows the EC 50 and CC 50 values of some compounds of the disclosure, as well as analogs thereof for murine norovirus. In cases where the compounds were tested, but did not measure the value of EC 50, EC 50 value is given as N / A.
Tabla 7. l r E r m f rm l IITable 7. l r E r m f rm l II
Tabla 8 - l r E r m l i l i n n l l mi mTable 8 - l r E r m l i l i n n l l mi m
Ejemplo 7 - Síntesis de compuesto 1Example 7 - Synthesis of compound 1
Etapa 1 (protocolo n.° 1): En un reactor encamisado de 100 l se cargaron 4-amino-6-bromo-2-metil-7H-pirrolo[2,3-d]pirimidin-5-carbonitrilo (3,00 kg), dibenzoato de (3R,4R,5R)-2-acetoxi-5-((benzoiloxi)metil)tetrahidrofuran-3,4-diilo (6,60 kg) y D CE (18,89 kg). Se inició la agitación y se añadió DBU (3,61 kg). Durante un periodo de 03 h y 14 min, se añadió TMSOTf (8,01 kg) entre 30,6 °C y 37,3 °C. La IPC después de 01 h y 30 min a aprox. 32 °C mostró un 4 % de 4-amino-6-bromo-2-metil-7H-pirrolo[2,3-d]pirimidin-5-carbonitrilo (3,00 kg), dibenzoato de (3R,4R,5R)-2-acetoxi-5-((benzoiloxi)metil)tetrahidrofuran-3,4-diilo restante. La IPC después de 03h y 16 min a aprox. 32 °C mostró un 2 % de 4-amino-6-bromo-2-metil-7H-pirrolo[2,3-d]pirimidin-5-carbonitrilo (3,00 kg), dibenzoato de (3R,4R,5R)-2-acetoxi-5-((benzoiloxi)metil)tetrahidrofuran-3,4-diilo restante (espec: <3 % ). La mezcla de reacción se diluyó con DCM (39,81 kg) y se inactivó con agua potable (15,02 kg) durante un periodo de 11 min entre 9,5 °C y 15,6 °C. El pretratamiento extractivo (a aprox. 22 °C) se completó mediante una retroextracción de la fase acuosa con DCM (19,90 kg), un lavado con NaHCO3 sat. (1,3 kg de NaHCO3 en 14,9 kg de agua potable), una retroextracción de la fase de bicarbonato con DCM (19,71 kg) y un lavado con salmuera (4,5 kg de NaCl en 14,9 kg de agua potable). Nota: el reactor se limpió con agua potable, acetona y DCM después de cada lavado/retroextracción.Step 1 (protocol # 1): 4-amino-6-bromo-2-methyl-7H-pyrrolo [2,3-d] pyrimidine-5-carbonitrile (3.00 kg), (3R, 4R, 5R) -2-acetoxy-5 - ((benzoyloxy) methyl) tetrahydrofuran-3,4-diyl dibenzoate (6.60 kg) and D CE (18.89 kg). Stirring was started and DBU (3.61 kg) was added. Over a period of 03 h and 14 min, TMSOTf (8.01 kg) was added between 30.6 ° C and 37.3 ° C. The CPI after 01 h and 30 min at approx. 32 ° C showed 4% 4-amino-6-bromo-2-methyl-7H-pyrrolo [2,3-d] pyrimidine-5-carbonitrile (3.00 kg), dibenzoate (3R, 4R, 5R ) -2-acetoxy-5 - ((benzoyloxy) methyl) tetrahydrofuran-3,4-diyl remaining. The CPI after 03h and 16 min at approx. 32 ° C showed 2% 4-amino-6-bromo-2-methyl-7H-pyrrolo [2,3-d] pyrimidine-5-carbonitrile (3.00 kg), dibenzoate (3R, 4R, 5R ) -2-acetoxy-5 - ((benzoyloxy) methyl) tetrahydrofuran-3,4-diyl remaining (spec: <3%). The reaction mixture was diluted with DCM (39.81 kg) and quenched with potable water (15.02 kg) for a period of 11 min between 9.5 ° C and 15.6 ° C. The extractive pretreatment (at approx. 22 ° C) was completed by a back extraction of the aqueous phase with DCM (19.90 kg), a wash with sat. (1.3 kg of NaHCO3 in 14.9 kg of drinking water), a back extraction of the bicarbonate phase with DCM (19.71 kg) and a brine wash (4.5 kg of NaCl in 14.9 kg of drinking water). Note: The reactor was cleaned with potable water, acetone and DCM after each wash / back extraction.
La fase orgánica agitada en tambor que contenía el producto se cargó en el reactor encamisado de 100 l a través de un filtro en línea seguido de un aclarado con DCM del tambor y el filtro con DCM (2,48 kg). Los contenidos del reactor se destilaron a 31 l con la ayuda de vacío durante un periodo de 06 h y 04 min con una temperatura máxima de 50,1 °C. En este punto se había formado una suspensión espesa. Después, durante un periodo de 39 min, se añadió IPAc (41,88 kg) entre 44,5 °C y 49,5 °C y los contenidos del reactor se calentaron hasta 76,9 °C durante un periodo de 01 h y 25 min. Después, los contenidos del reactor se enfriaron hasta 9,9 °C durante un periodo de 04 h y 21 min y se agitaron durante 12 h y 26 min con una temperatura mínima de 1,6 °C.The drum stirred organic phase containing the product was charged into the 100 L jacketed reactor through an in-line filter followed by a DCM rinse of the drum and the filter with DCM (2.48 kg). The reactor contents were distilled at 31 L with the aid of vacuum for a period of 06 h and 04 min with a maximum temperature of 50.1 ° C. At this point a thick suspension had formed. Then, over a period of 39 min, IPAc (41.88 kg) was added between 44.5 ° C and 49.5 ° C and the reactor contents were heated to 76.9 ° C over a period of 01 h and 25 min. The reactor contents were then cooled to 9.9 ° C over a period of 04 h and 21 min and stirred for 12 h and 26 min with a minimum temperature of 1.6 ° C.
Etapa 1 (Protocolo n.° 2): En un reactor encamisado de 100 l se cargaron 4-amino-6-bromo-2-metil-7H-pirrolo[2,3-d]pirimidin-5-carbonitrilo (3,00 kg), dibenzoato de (3R,4R,5R)-2-acetoxi-5-((benzoiloxi)metil)tetrahidrofuran-3,4-diilo (6,60 kg) y D CE (18,80 kg). Se inició la agitación y se añadió DBU (3,59 kg). Durante un periodo de 01 h y 46 min, se añadió TMSOTf (7,90 kg) entre 30,4 °C y 34,2 °C. La IPC después de 02 h y 49 min a aprox. 34 °C mostró un 1 % de 4-amino-6-bromo-2-metil-7H-pirrolo[2,3-d]pirimidin-5-carbonitrilo restante (espec: <3 % ). La mezcla de reacción se diluyó con DCM (40/70 kg) y se inactivó con agua potable (14,97 kg) durante un periodo de 04 min entre 9,9 °C y 18,0 °C. El pretratamiento extractivo (a aprox. 22 °C) se completó mediante una retroextracción de la fase acuosa con DCM (20,34 kg), un lavado con NaHCO3 sat. (1,30 kg de NaHCO3 en 14,90 kg de agua potable), una retroextracción de la fase de bicarbonato con DCM (20,65 kg) y un lavado con salmuera (4,50 kg de NaCl en 14,96 kg de agua potable). Nota: el reactor se limpió con agua potable, acetona y DCM después de cada lavado/retroextracción.Step 1 (Protocol # 2): 4-amino-6-bromo-2-methyl-7H-pyrrolo [2,3-d] pyrimidine-5-carbonitrile (3.00 kg), (3R, 4R, 5R) -2-acetoxy-5 - ((benzoyloxy) methyl) tetrahydrofuran-3,4-diyl dibenzoate (6.60 kg) and D CE (18.80 kg). Stirring was started and DBU (3.59 kg) was added. Over a period of 01 h and 46 min, TMSOTf (7.90 kg) was added between 30.4 ° C and 34.2 ° C. The CPI after 02 h and 49 min at approx. 34 ° C showed 1% of 4-amino-6-bromo-2-methyl-7H-pyrrolo [2,3-d] pyrimidine-5-carbonitrile remaining (spec: <3%). The reaction mixture was diluted with DCM (40/70 kg) and quenched with potable water (14.97 kg) for a period of 04 min between 9.9 ° C and 18.0 ° C. The extractive pretreatment (at approx. 22 ° C) was completed by a back extraction of the aqueous phase with DCM (20.34 kg), a wash with sat. NaHCO3. (1.30 kg of NaHCO3 in 14.90 kg of drinking water), a back extraction of the bicarbonate phase with DCM (20.65 kg) and a brine wash (4.50 kg of NaCl in 14.96 kg of drinking water). Note: The reactor was cleaned with potable water, acetone and DCM after each wash / back extraction.
La fase orgánica agitada en tambor que contenía el producto se cargó en el reactor encamisado de 100 l a través de un filtro en línea seguido de un aclarado con DCM del tambor y el filtro con DCM (1,49 kg). Los contenidos del reactor se destilaron con la ayuda de vacío durante un periodo de 04 h y 49 min con una temperatura máxima de 45,6 °C. En este punto se había formado una suspensión espesa. Después, durante un periodo de 27 min, se añadió IPAc (41,70 kg) entre 45,6 °C y 48,2 °C y los contenidos del reactor se calentaron hasta 75,7 °C durante un periodo de 01 h y 20 min. Después, los contenidos del reactor se enfriaron hasta 9,4 °C durante un periodo de 04 h y 15 min y se agitaron durante una noche con una temperatura mínima de 2,3 °C.The drum stirred organic phase containing the product was charged into the 100 L jacketed reactor through an in-line filter followed by a DCM rinse of the drum and the filter with DCM (1.49 kg). The contents of the reactor were distilled with the aid of vacuum for a period of 04 h and 49 min with a maximum temperature of 45.6 ° C. At this point a thick suspension had formed. Then, over a period of 27 min, IPAc (41.70 kg) was added between 45.6 ° C and 48.2 ° C and the reactor contents were heated to 75.7 ° C over a period of 01 h and 20 min. The reactor contents were then cooled to 9.4 ° C over a period of 04 h and 15 min and stirred overnight with a minimum temperature of 2.3 ° C.
Etapa 2: En el reactor se cargaron dibenzoato de (2R,3R,4R,5R)-2-(4-amino-6-bromo-5-ciano-2-metil-7H-pirrolo[2,3-d]pirimidin-7-il)-5-((benzoiloxi)metil)tetrahidrofuran-3,4-diilo (10,0 kg), Pd al 10 % sobre C (Degussa, tipo E101NE/W ), trimetilamina (7,3 kg) y THF (44,5 kg). Se envió hidrógeno al reactor y la mezcla se agitó durante 03 h y 54 min entre 24,7 °C y 19,6 °C a aprox. 212,35 kPa (30,8 psig). La IPC (HPLC) mostró que ya no podía detectarse dibenzoato de (2R,3R,4R,5R)-2-(4-amino-6-bromo-5-ciano-2-metil-7H-pirrolo[2,3-d]pirimidin-7-il)-5-((benzoiloxi)metil)tetrahidrofuran-3,4-diilo.Stage 2: (2R, 3R, 4R, 5R) -2- (4-amino-6-bromo-5-cyano-2-methyl-7H-pyrrolo [2,3-d] pyrimidine dibenzoate -7-yl) -5 - ((benzoyloxy) methyl) tetrahydrofuran-3,4-diyl (10.0 kg), 10% Pd on C (Degussa, type E101NE / W), trimethylamine (7.3 kg) and THF (44.5 kg). Hydrogen was sent to the reactor and the mixture was stirred for 03 hr and 54 min between 24.7 ° C and 19.6 ° C at approx. 212.35 kPa (30.8 psig). IPC (HPLC) showed that (2R, 3R, 4R, 5R) -2- (4-amino-6-bromo-5-cyano-2-methyl-7H-pyrrolo [2,3- d] pyrimidin-7-yl) -5 - ((benzoyloxy) methyl) tetrahydrofuran-3,4-diyl.
La mezcla de reacción se filtró sobre Celite (7,2 kg) y un filtro de pulido y el residuo del filtro se lavó con THF (5,2 kg). El filtrado y el lavado combinados se transfirieron a un reactor encamisado de 100 l con la ayuda de un lavado con THF (2,12 kg). Los contenidos del reactor se destilaron al vacío con una temperatura discontinua máxima de 30,0 °C durante un periodo de 05 h y 38 min hasta un volumen final de 27 l. Se cargó IPA (31,48 kg) durante un periodo de 40 min al reactor entre 39,7 °C y 53,2 °C. Los contenidos del reactor se destilaron al vacío con una temperatura discontinua máxima de 53,2 °C durante un periodo de 03 h y 02 min hasta un volumen final de 33 l. Se cargó IPA (48,99 kg) durante un periodo de 43 min al reactor entre 53,1 °C y 57,1 °C. Los contenidos del reactor se calentaron hasta 60,2 °C , se agitaron durante 12 min y se enfriaron durante un periodo de 04 y 28 min hasta 5,4 °C. Se continuó la agitación en frío durante un periodo de 08 h y 55 min con una temperatura mínima de 1,1 °C . La suspensión se filtró y se lavó con IPA (9,41 kg, a aprox. 4,5 °C). El residuo se secó al vacío con un purga de nitrógeno durante un periodo de 11 h y 44 min a una temperatura máxima de 44,0 °C para proporcionar un LOD de un 0,36 % . Rendimiento: 6,58 kg (73,9 % ). La RMN de 1H confirma la estructura. Pureza: 97,78 % (HPLC, ABC).The reaction mixture was filtered over Celite (7.2 kg) and a filter polish and the filter residue was washed with THF (5.2 kg). The combined filtrate and wash were transferred to a 100 L jacketed reactor with the aid of a THF wash (2.12 kg). The reactor contents were vacuum distilled with a maximum batch temperature of 30.0 ° C for a period of 05 h and 38 min to a final volume of 27 L. IPA (31.48 kg) was charged over a 40 min period to the reactor between 39.7 ° C and 53.2 ° C. The reactor contents were vacuum distilled with a maximum batch temperature of 53.2 ° C for a period of 03 h and 02 min to a final volume of 33 l. IPA (48.99 kg) was charged over a 43 min period to the reactor between 53.1 ° C and 57.1 ° C. The reactor contents were heated to 60.2 ° C, stirred for 12 min and cooled over a period of 04 and 28 min to 5.4 ° C. Cold stirring was continued for a period of 08 hr and 55 min with a minimum temperature of 1.1 ° C. The suspension was filtered and washed with IPA (9.41 kg, ca 4.5 ° C). The residue was dried under vacuum with a nitrogen purge for a period of 11 hr and 44 min at a maximum temperature of 44.0 ° C to provide a LOD of 0.36%. Yield: 6.58 kg (73.9%). 1H NMR confirms the structure. Purity: 97.78% (HPLC, ABC).
Etapa 3 :Stage 3:
Materiales PM Equiv./vol Cantidad mmoles Lote n.°Materials PM Equiv./vol Quantity mmol Lot no.
1 100 g de NaOH disueltos en agua potable hasta un volumen total de 1 l; 2500 ml diluidos1100 g of NaOH dissolved in drinking water to a total volume of 1 l; 2500 ml diluted
de HCl conc. en 2 l en total con agua potable of conc. in 2 l in total with drinking water
Una solución de dibenzoato de (2R,3R,4R,5R)-2-(4-amino-5-ciano-2-metil-7H-pirrolo[2,3-d]pirimidin-7-il)-5-((benzoiloxi)metil)tetrahidrofuran-3,4-diilo y THF se calentó hasta 54 °C y se inició la adición de NaOH 2,5 M. La adición inicial dio una mezcla bifásica y respuesta endotérmica (la temperatura bajó hasta 50 °C), pero según continuó la adición se formó una solución transparente de una sola fase que estuvo acompañada de una exotermia rápida hasta 61 °C ; la temperatura de reacción se mantuvo a 60 °C hasta 61 °C durante el resto de la adición y durante 2 A h adicionales. La IPC mostró que no quedaba dibenzoato de (2R,3R,4R,5R)-2-(4-amino-5-ciano-2-metil-7H-pirrolo[2,3-d]pirimidin-7-il)-5-((benzoiloxi)metil)tetrahidrofuran-3,4-diilo. A dibenzoate solution of (2R, 3R, 4R, 5R) -2- (4-amino-5-cyano-2-methyl-7H-pyrrolo [2,3-d] pyrimidin-7-yl) -5- ( (benzoyloxy) methyl) tetrahydrofuran-3,4-diyl and THF was heated to 54 ° C and the addition of 2.5 M NaOH was started. The initial addition gave a biphasic mixture and endothermic response (the temperature dropped to 50 ° C ), but as the addition continued a clear single phase solution formed which was accompanied by a rapid exotherm to 61 ° C; the reaction temperature was maintained at 60 ° C to 61 ° C for the remainder of the addition and for an additional 2 h. IPC showed that no (2R, 3R, 4R, 5R) -2- (4-amino-5-cyano-2-methyl-7H-pyrrolo [2,3-d] pyrimidin-7-yl) - dibenzoate remained 5 - ((benzoyloxy) methyl) tetrahydrofuran-3,4-diyl.
La mezcla de reacción se enfrió hasta 21 °C y se neutralizó con HCl 3 N con enfriamiento externo hasta pH = 7,06 (pehachímetro Denver Instrument UB-10 equipado con un electrodo de pH Sartorius P-P11, el electrodo se comprobó con soluciones tamponantes de pH = 4,00 y pH = 7,00); la mezcla continuó hasta enfriarse a 8 °C. La mezcla neutralizada resultante se destiló al vacío con una temperatura de recipiente de 45 °C a 50 °C hasta que se observó la aparición de sólidos en el recipiente. La suspensión se enfrió y se agitó durante 2 h a 2 °C. La suspensión beis se filtró para producir un filtrado oscuro; el residuo blanquecino se lavó una vez con agua fría (500 ml, 5 °C). Un primer LOD después de 16 h dio un valor de un 18,73 %. La HPLC del material de secado mostró la presencia de un 1,6 % de benzoato.The reaction mixture was cooled to 21 ° C and neutralized with 3N HCl with external cooling to pH = 7.06 (Denver Instrument UB-10 pehachimeter equipped with a Sartorius P-P11 pH electrode, the electrode was checked with solutions buffers of pH = 4.00 and pH = 7.00); the mixture continued to cool to 8 ° C. The resulting neutralized mixture was vacuum distilled at a pot temperature of 45 ° C to 50 ° C until solids were observed in the pot. The suspension was cooled and stirred for 2 h at 2 ° C. The beige suspension was filtered to produce a dark filtrate; the off-white residue was washed once with cold water (500 ml, 5 ° C). A first LOD after 16 h gave a value of 18.73%. HPLC of the drying material showed the presence of 1.6% benzoate.
Se ejecutó un breve estudio de revisión para el compuesto 1 (que contenía un 1,6 % de ácido benzoico por ABC, HPLC) en 10 vol de agua (1 g en 10 ml):A short review study was run for Compound 1 (containing 1.6% benzoic acid by ABC, HPLC) in 10 vol of water (1 g in 10 ml):
3 h de suspensión a temperatura ambiente3 h suspension at room temperature
3 h de suspensión a 50 °C3 h suspension at 50 ° C
24 h de suspensión a temperatura ambiente24 h suspension at room temperature
Los tres experimentos dieron el compuesto 1 con menos de un 0,1 % de ácido benzoico (ABC, HPLC). Las suspensiones fueron fluidas, se agitaron fácilmente y la filtración fue rápida. El secado breve en el filtro dio un sólido parecido a polvo que indica que no se necesita un lavado de desplazamiento con un disolvente orgánico. Sin el deseo de limitarse a teoría alguna, se espera una pérdida de NMT menor de un 1 % (solubilidad de 1 mg/ml). Los datos de HPLC para el compuesto 1 se obtuvieron con un método adecuado para compuestos polares usando una columna Zorbax Eclipse Plus C18 (agua / ACN / TFA, 97,5 / 2,5 / 0,05). Esta es la misma columna usada para las etapas 1 y 2. All three experiments gave compound 1 with less than 0.1% benzoic acid (ABC, HPLC). The suspensions were flowable, easily shaken, and filtration was rapid. Brief drying on the filter gave a powdery solid indicating that a displacement wash with an organic solvent is not required. Without wishing to be bound by theory, an NMT loss of less than 1% (1 mg / ml solubility) is expected. HPLC data for compound 1 was obtained with a method suitable for polar compounds using a Zorbax Eclipse Plus C18 column (water / ACN / TFA, 97.5 / 2.5 / 0.05). This is the same column used for stages 1 and 2.
La suspensión de producto frío se filtró y el reactor y el residuo se lavaron con IPAc frío (aprox. 7,5 °C, 13,16 kg y 13,62 kg) hasta que se hubo obtenido un filtrado incoloro. El residuo se secó al vacío y una purga de nitrógeno < 45 °C durante un periodo de 65 h y 19 min hasta un LOD de un 0 %. Rendimiento: 5,87 kg (70,7 %), la RMN de 1H confirmó la identidad; pureza por Hp Lc de un 98,84 % (ABC).The cold product suspension was filtered and the reactor and residue were washed with cold IPAc (ca 7.5 ° C, 13.16 kg and 13.62 kg) until a colorless filtrate had been obtained. The residue was dried under vacuum and a nitrogen purge <45 ° C for a period of 65 hr and 19 min to a LOD of 0%. Yield: 5.87 kg (70.7%), 1H NMR confirmed the identity; purity by Hp Lc of 98.84% (ABC).
La divulgación puede plasmarse en otras formas específicas sin alejarse de las características esenciales de la misma. Las realizaciones anteriores, por lo tanto, tienen que considerarse en todos los aspectos ilustrativas en lugar de limitantes de la divulgación descrita en este documento. El alcance de la divulgación, por tanto, se indica mediante las reivindicaciones adjuntas en lugar de mediante la descripción anterior. The disclosure can be embodied in other specific forms without departing from the essential characteristics of the same. The above embodiments, therefore, are to be considered in all respects illustrative rather than limiting of the disclosure described herein. The scope of the disclosure, therefore, is indicated by the appended claims rather than by the foregoing description.
Claims (18)
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562202010P | 2015-08-06 | 2015-08-06 | |
| GB201606645 | 2016-04-15 | ||
| PCT/US2016/046056 WO2017024310A1 (en) | 2015-08-06 | 2016-08-08 | Pyrrolopyrimidine nucleosides and analogs thereof useful as antiviral agents |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2829254T3 true ES2829254T3 (en) | 2021-05-31 |
Family
ID=66624636
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES16753540T Active ES2829254T3 (en) | 2015-08-06 | 2016-08-08 | Pyrrolopyrimidine nucleosides and analogs thereof useful as antiviral agents |
Country Status (2)
| Country | Link |
|---|---|
| ES (1) | ES2829254T3 (en) |
| IL (1) | IL257122A (en) |
-
2016
- 2016-08-08 ES ES16753540T patent/ES2829254T3/en active Active
-
2018
- 2018-01-24 IL IL257122A patent/IL257122A/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| IL257122A (en) | 2018-03-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10941175B2 (en) | Pyrrolopyrimidine nucleosides and analogs thereof | |
| JP6043338B2 (en) | 1'-substituted pyrimidine N-nucleoside analogues for antiviral therapy | |
| ES2536831T3 (en) | Methods and compositions for polymerase inhibition | |
| CN110317211B (en) | Substituted polycyclic pyridone compound and prodrug thereof | |
| CA3139977A1 (en) | Peptidomimetics for the treatment of coronavirus and picornavirus infections | |
| ES2741444T3 (en) | Inhibitors of influenza virus replication | |
| ES2684755T3 (en) | Methods for preparing influenza virus replication inhibitors | |
| ES2533863T3 (en) | Novel HIV reverse transcriptase inhibitors | |
| JP6718451B2 (en) | Pyrrolopyrimidine for use in influenza virus infection | |
| WO2014082935A1 (en) | Cyclic nucleoside derivatives and uses thereof | |
| TW200813066A (en) | Novel compounds | |
| ES2829254T3 (en) | Pyrrolopyrimidine nucleosides and analogs thereof useful as antiviral agents | |
| US8883765B2 (en) | Anti-cytomegalovirus activity of artemisinin-derived dimers | |
| EP3077403A1 (en) | Branched chain acyclic nucleoside phosphonate esters and methods of synthesis and uses thereof | |
| CN113940933A (en) | Medicine for resisting new type coronavirus | |
| EA045093B1 (en) | N4-HYDROXYCYTIDINE DERIVATIVE, PHARMACEUTICAL COMPOSITION CONTAINING ITS AND RELATED ANTIVIRAL APPLICATIONS | |
| NZ616732B2 (en) | 1'-substituted pyrimidine n-nucleoside analogs for antiviral treatment |