DE102004018548A1 - Radiation and moisture curing compositions based on silane-terminated polymers, their preparation and use - Google Patents
Radiation and moisture curing compositions based on silane-terminated polymers, their preparation and use Download PDFInfo
- Publication number
- DE102004018548A1 DE102004018548A1 DE200410018548 DE102004018548A DE102004018548A1 DE 102004018548 A1 DE102004018548 A1 DE 102004018548A1 DE 200410018548 DE200410018548 DE 200410018548 DE 102004018548 A DE102004018548 A DE 102004018548A DE 102004018548 A1 DE102004018548 A1 DE 102004018548A1
- Authority
- DE
- Germany
- Prior art keywords
- polymer
- base
- photolatent
- silyl
- group
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Ceased
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08K—Use of inorganic or non-macromolecular organic substances as compounding ingredients
- C08K5/00—Use of organic ingredients
- C08K5/0008—Organic ingredients according to more than one of the "one dot" groups of C08K5/01 - C08K5/59
Abstract
Die Erfindung betrifft härtbare Zusammensetzungen, die mindestens ein silylterminiertes Polymer und mindestens eine photolatente Base enthalten, wobei das silylterminierte Polymer aus einem linearen oder verzweigten, silangruppenfreien Basispolymer zusammengesetzt ist, welches endständige Silangruppen trägt. Ferner wird ein Verfahren zur Herstellung solcher Zusammensetzungen sowie deren Verwendung beschrieben.The invention relates to curable compositions containing at least one silyl-terminated polymer and at least one photolatent base, the silyl-terminated polymer being composed of a linear or branched, silane-free base polymer bearing terminal silane groups. Furthermore, a method for producing such compositions and their use is described.
Description
Die vorliegende Erfindung betrifft Zusammensetzungen, die durch Bestrahlung und Feuchtigkeit aushärten, sowie deren Herstellung und Verwendung.The The present invention relates to compositions obtained by irradiation and moisture, as well as their production and use.
Feuchtigkeitshärtende Klebstoffzusammensetzungen werden im zunehmenden Maße als Beschichtungs-, Dichtungs- und Klebemassen im Bauwesen und in der Automobilindustrie verwendet. An solche Massen werden hohe Anforderungen, insbesondere hinsichtlich Verarbeitbarkeit und Aushärtgeschwindigkeit gestellt.Moisture-curing adhesive compositions are increasing as coating, sealing and adhesive compounds in the construction industry and in used in the automotive industry. Such masses are subject to high demands, especially regarding processability and curing speed posed.
Aus dem Stand der Technik sind eine Vielzahl verschiedener Polymere bekannt, die als vernetzende Bestandteile in Dichtungs-, Beschichtungs- und Klebemassen eingesetzt werden. Solche Massen sollen üblicherweise rasch aushärten, damit die verklebten, beschichteten, abgedichteten oder verfugten Substrate möglichst bald ihrer eigentlichen Bestimmung zugeführt werden können. Andererseits ist es wünschenswert, daß die Massen eine gute Verarbeitbarkeit aufweisen, die es dem Fachmann auf dem Gebiet der Klebe- und Dichtungstechnik ermöglicht größere Bereiche gleichmäßig mit den Massen zu behandeln, ohne daß Teile bereits aushärten. Der Anwendungstechniker befindet sich somit in einem Dilemma zwischen optimaler Aushärtgeschwindigkeit einerseits und Verarbeitbarkeit andererseits. Idealerweise sollten derartige Massen oder Zusammensetzungen solange gleichmäßig verarbeitbar sein, wie das Aufbringen der Zusammensetzungen auf das Substrat dauert. Anschließend sollten die Zusammensetzungen möglichst rasch aushärten.Out The prior art is a variety of different polymers known as crosslinking constituents in sealing, coating and and adhesives are used. Such masses should usually cure quickly, so that the glued, coated, sealed or grouted Substrates as possible soon to their proper destination. on the other hand it is desirable that the Masses have good processability, it is the expert in the field of adhesive and sealing technology allows larger areas evenly with to treat the masses without parts already hardening. Of the Application Engineer is thus in a dilemma between optimum curing speed on the one hand and processability on the other. Ideally, should Such compositions or compositions as long as evenly processed such as applying the compositions to the substrate lasts. Subsequently The compositions should be as possible cure quickly.
Häufig werden in Dichtungs-, Beschichtungs- und Klebemassen silylgruppenterminierte organische Polymere (STOP) als vernetzende Bestandteile eingesetzt. Erhältlich sind STOP praktisch aus nahezu sämtlichen Basispolymeren, indem organofunktionelle alkoxylierte Silane mit reaktiven Enden des Basispolymers zur Reaktion gebracht werden. Beispielsweise können Polyurethane mit endständigen Isocyanatgruppen mit Aminosilanen zur Reaktion gebracht werden. Es ist jedoch auch möglich hydroxyterminierte Polyether, Polyurethane oder Polyester mit Isocyanatosilanen zu STOP umzusetzen. Die physikalischen Eigenschaften der resultierenden STOP werden dabei maßgeblich durch das Basispolymer vorgegeben, wodurch mannigfaltige Variationsmöglichkeiten eröffnet werden.Become frequent in sealants, coatings and adhesives silylgruppenterminierte organic polymers (STOP) used as crosslinking ingredients. Available STOP are practically all of them Base polymers by using organofunctional alkoxylated silanes with reactive ends of the base polymer are reacted. For example, you can Polyurethanes with terminal Isocyanate groups are reacted with aminosilanes. It is also possible hydroxy-terminated polyethers, polyurethanes or polyesters with isocyanatosilanes to convert to STOP. The physical properties of the resulting STOP become decisive predetermined by the base polymer, whereby manifold variations open become.
Häufig werden in Dichtungs-, Beschichtungs- und Klebemassen auch über Alkoxygruppen vernetzende RTV-1-Silikonkautschuke (Alkoxy-Silikone) als vernetzende Bestandteile eingesetzt. Erhältlich sind diese im allgemeinen durch Umsetzung eines Polydimethylsiloxans mit endständigen OH-Gruppen mit Trialkoxyorganosilanen (Vernetzen) in Gegenwart von Katalysatoren. Die physikalischen Eigenschaften der resultierenden Alkoxy-Silikone werden dabei maßgeblich durch das Basissilikon und den gewählten Vernetzen vorgegeben, wodurch auch hier mannigfaltige Variationsmöglichkeiten eröffnet werden.Become frequent in sealing, coating and adhesive compositions also via alkoxy groups Crosslinking RTV-1 silicone rubbers (alkoxy silicones) as crosslinking Components used. Available these are generally by reaction of a polydimethylsiloxane with terminal OH groups with trialkoxyorganosilanes (crosslinking) in the presence of Catalysts. The physical properties of the resulting Alkoxy silicones are decisive given by the base silicone and the selected crosslinks, which also opens up manifold possibilities of variation.
Eine Vernetzung beziehungsweise Härtung der STOP und Alkoxy-Silikone erfolgt üblicherweise basenkatalysiert in Gegenwart von Feuchtigkeit, insbesondere in Gegenwart von Luftfeuchtigkeit, durch hydrolytische Abspaltung der silanständigen Alkoxygruppen unter Freisetzung von Alkanolen und einer damit einhergehenden Quervernetzung der Polymere. Da bereits Luftfeuchtigkeit ausreicht die katalysatorhaltigen Zusammensetzungen auszuhärten, ist zwar üblicherweise eine schnelle Aushärtung gewährleistet, diese geht jedoch zu Lasten einer begrenzten Verarbeitungsdauer. Es werden kurze Hautbildungszeiten erreicht, was jedoch beispielsweise bei Verfugungsarbeiten dazu führt, daß nur kleine Bereiche gleichmäßig verfugt werden können, da ein Glätten bereits in der Verfestigung befindlicher Fugen ein Aufreißen der bereits gebildeten Haut mit sich bringt und somit ungleichmäßige Ergebnisse erhalten werden.A Crosslinking or curing The STOP and alkoxy silicones are usually base-catalyzed in the presence of moisture, especially in the presence of atmospheric moisture, by hydrolytic cleavage of the silane-alkoxy groups Release of alkanols and associated cross-linking the polymers. Since already sufficient humidity, the catalyst-containing Cure compositions is common a quick cure guaranteed However, this is at the expense of a limited processing time. Short skinning times are achieved, but for example leading to jointing work, that only small areas evenly grouted can be there a smoothing already in the consolidation of existing joints tearing the already formed skin and thus uneven results to be obtained.
Um ein zu schnelles Aushärten zu vermeiden muß daher auf weniger reaktive Systeme ausgewichen werden. So besteht zum Beispiel die Möglichkeit die Basenkonzentration herabzusetzen, das heißt die Katalysatormenge zu reduzieren. Auch ist es möglich die Polymere selbst weniger reaktiv zu gestalten, indem schwächer reaktive organofunktionelle Silane als Endgruppen bzw. Vernetzer angebracht werden.Around too fast curing must therefore avoid be avoided on less reactive systems. So exists to Example the possibility To reduce the base concentration, that is, the amount of catalyst to to reduce. It is also possible the polymers themselves become less reactive by being less reactive organofunctional silanes attached as end groups or crosslinkers become.
Zu den schwächer reaktiven Silanen gehören beispielsweise die sogenannten γ-Silane, bei welchen die organofunktionellen Gruppen durch einen Propylenspacer vom Siliciumatom getrennt sind. Um jedoch eine zufriedenstellende Reaktivität der γ-Silane zu gewährleisten, sind fast ausschließlich deren Trialkoxy-Vertreter einsetzbar, wobei als Alkoxygruppe zudem alleine die Methoxygruppe eine vertretbare Reaktivität bei der feuchtigkeitsinduzierten Härtung besitzt.To the weaker include reactive silanes For example, the so-called γ-silanes, in which the organofunctional groups through a propylene spacer of the silicon atom are separated. However, to ensure a satisfactory reactivity of the γ-silanes, are almost exclusive whose trialkoxy representatives can be used, wherein as the alkoxy group additionally alone, the methoxy group is a reasonable reactivity in the moisture-induced hardening has.
Der Einsatz trialkoxylierter γ-Silane ist unter dem Gesichtspunkt des Umweltschutzes nachteilig, da bei der hydrolytischen Quervernetzung eine um 50 % höhere Menge Alkanol freigesetzt wird. Die Tendenz geht daher in Richtung einer Begrenzung der Freisetzung flüchtiger organischer Substanzen. Somit geht die Verwendung weniger reaktiver trialkoxylierter γ-Silane zur Verlängerung der Verarbeitbarkeit mit der Inkaufnahme einer höheren Umweltbelastung einher. Sollte die Umweltbelastung verringert werden, so wäre der Einsatz von beispielsweise dialkoxylierten α-Silanen, die anstelle des Propylenspacers einen Methylenspacer aufweisen, dem von trialkoxylierten γ-Silanen vorzuziehen, wodurch sich jedoch wiederum die Verarbeitbarkeitszeit verkürzt.Of the Use of trialkoxylated γ-silanes is disadvantageous from the point of view of environmental protection, as in the Hydrolytic cross-linking released by a 50% higher amount of alkanol becomes. The tendency is therefore towards a limitation of the release volatile organic substances. Thus, the use is less reactive trialkoxylated γ-silanes for extension processability is accompanied by the acceptance of a higher environmental impact. Should the environmental impact be reduced, then the use would be of, for example, dialkoxylated α-silanes substituted for the propylene spacer have a methylene spacer, that of trialkoxylierten γ-silanes however, this in turn increases the processability time shortened.
Ferner sind ethoxylierte γ-Silane häufig zu reaktionsträge, weshalb methoxylierte γ-Silane eingesetzt werden, wobei bei der Vernetzung Methanol freigesetzt wird. Aufgrund der Toxizität von Methanol ist der Einsatz von Klebstoffen, Dichtstoffen und ähnlichen Zusammensetzungen, welche trimethoxylierte STOP enthalten, in schlecht belüftbaren Räumen nachteilig.Further are ethoxylated γ-silanes often too unresponsive, why methoxylated γ-silanes are used, wherein methanol is released during the crosslinking. Due to the toxicity of methanol is the use of adhesives, sealants and the like Compositions containing trimethoxylated STOP in bad ventilated clear disadvantageous.
Üblicherweise erfordert der Einsatz wenig reaktiver γ-Silane als Endcapper bzw. Vernetzer zusätzlich die Verwendung metallorganischer Verbindungen beim Härtungsprozeß. Besonders zinnorganische Katalysatoren sind aber in jüngerer Zeit aufgrund ihrer toxischen Eigenschaften in Verruf geraten. Darüber hinaus schließt der Einsatz derartiger Katalysatoren in der Regel das Vorliegen von Esterbindungen in diesen Systemen aus, da die Katalysatoren eine Esterspaltung beschleunigen und damit gegebenenfalls Eigenschaftsveränderungen des Systems hervorrufen. Damit ist der Hersteller derartiger Systeme, beispielsweise der Hersteller von Kleb- oder Dichtstoffsystemen für den Heimwerkerbereich, in der Formulierungsfreiheit eingeschränkt.Usually requires the use of less reactive γ-silanes as Endcapper or crosslinker additionally the Use of organometallic compounds in the curing process. Especially organotin However, catalysts are more recent Time has fallen into disrepute due to their toxic properties. In addition, the insert closes such catalysts usually the presence of ester bonds in these systems, since the catalysts have an ester cleavage speed up and thus, if necessary, property changes of the system. This is the manufacturer of such systems, for example, the manufacturer of adhesive or sealant systems for the Home improvement sector, restricted in freedom of expression.
Eine der Aufgaben der vorliegenden Erfindung bestand daher darin, die obengeschilderten Nachteile zu überwinden und das Verarbeitungs-Aushärtungs-Dilemma zu lösen. Insbesondere sollte auch der Einsatz reaktiver silyl-terminierter Polymere, wie z.B. α-silyl-terminierter Polymere in Kleb- und Dichtstoffsystemen bei langer Verarbeitbarkeit ermöglicht werden, indem der Zeitpunkt der Härtung in das Ermessen des Anwenders gestellt wird. Günstigerweise sollten die Zusammensetzungen auch eine hervorragende Lagerstabilität besitzen.A The objects of the present invention therefore consisted in the overcome the above-mentioned disadvantages and to solve the processing hardening dilemma. Especially should also include the use of reactive silyl-terminated polymers, such as e.g. α-silyl-terminated Polymers in adhesive and sealant systems with long processability allows by placing the time of curing at the discretion of the user becomes. conveniently, the compositions should also have excellent storage stability.
Diese Aufgaben konnten überraschenderweise durch Bereitstellung härtbarer Zusammensetzungen gelöst werden, die mindestens ein silyl-terminiertes Polymer und mindestens eine photolatente Base enthalten, wobei das silyl-terminierte Polymer aus einem linearen oder verzweigten, silangruppenfreien Basispolymer-Rest besteht, welcher endständige Silangruppen trägt. Bevorzugt sind insbesondere silylterminierte organische Polymere und/oder silyl-terminierte Silikonpolymere.These Tasks could surprisingly by providing hardenable Compositions solved which contain at least one silyl-terminated polymer and at least containing a photolatent base, wherein the silyl-terminated polymer from a linear or branched, silane-group-free base polymer radical exists, which terminal Silangroups carries. Silyl-terminated organic polymers are particularly preferred and / or silyl-terminated silicone polymers.
Die entsprechenden organischen Polymere oder Silikonpolymere enthalten dabei innerhalb ihrer Hauptkette oder Hauptketten keine Silangruppen, sondern nur an den jeweiligen Kettenenden der Polymerketten. So sind in einem linearen Polymer nur die beiden Enden des Polymers silyl-terminiert, ein solches Polymer wird im folgenden als divalent oder zweiwertig bezeichnet. Bei der Verwendung eines beispielsweise Glycerol gestarteten Polymers können sich ausgehend von den drei Hydroxygruppen des Glycerols drei unabhängige silanfreie Polymerstränge bilden, wobei wiederum erst am Strangende eine Silangruppe als Terminus angebracht sein kann. Ein derart verzweigtes Polymer mit drei Enden wird im folgenden als trivalent oder dreiwertig bezeichnet. Analog werden Polymere mit vier Enden als vierwertig bezeichnet.The corresponding organic polymers or silicone polymers no silane groups within their main chain or main chains, but only at the respective chain ends of the polymer chains. So are in a linear polymer, only the two ends of the polymer silyl-terminated, such a polymer is hereafter considered divalent or divalent. When using an example Glycerol started polymer can starting from the three hydroxy groups of glycerol three independent silane-free polymer strands form again, in turn, only at the strand end a silane group as a term can be appropriate. Such a branched polymer with three ends is referred to below as trivalent or trivalent. Analogous For example, polymers with four ends are termed tetravalent.
Das Fehlen weiterer Silangruppen innerhalb der Basispolymerkette, z.B. als Seitengruppen ermöglicht eine Kontrolle der Vernetzungsdichte, sowie den Erhalt der basispolymerspezifischen Eigenschaften. Bei einer Vernetzung über Seitengruppen könnte beispielsweise die in vielen Fällen gewünschte Elastizität der gehärteten Zusammensetzungen verloren gehen.The Lack of other silane groups within the base polymer chain, e.g. as a page groups allows one Control of the crosslink density, as well as the preservation of the base polymer specific Properties. For example, if networking through page groups in many cases desired elasticity the hardened Compositions are lost.
Die
in den erfindungsgemäßen, härtbaren
Zusammensetzungen enthaltenen silylterminierten organischen Polymere
besitzen vorzugsweise die allgemeine Formel (I)
In Formel (I) stellt A den zwei-, drei- oder vierwertigen Rest eines beliebigen organischen Polymers dar (z = 2 bis 4). Bei den in Frage kommenden organischen Polymeren kann es sich um Polymerisate oder Polykondensate handeln.In Formula (I) represents A the two-, three- or four-valent radical of one any organic polymer (z = 2 to 4). In question coming organic polymers may be polymers or polycondensates act.
Vorzugsweise handelt es sich bei den organischen Polymeren um Polyurethane, Polyether, Polyester, Polyacrylate, Polyvinylester, Polyolefine oder statistische Copolymere und Blockcopolymere dieser Polymere. Besonders bevorzugt sind Polyurethane, Polyester und Polyether, sowie deren Copolymerisate, wie beispielsweise Polyether-Polyester-Copolymere. Typische gewichtsmittlere Molmassen derartiger Reste A liegen im Bereich von etwa 100 bis 50000 g/mol, vorzugsweise 1000 bis 30000 g/mol. Gängige Viskositäten der Basispolymere liegen beispielsweise im Bereich von 1000 mPa·s bis 700000 mPa·s, vorzugsweise 5000 mPa·s bis 300000 mPa·s.Preferably If the organic polymers are polyurethanes, polyethers, Polyesters, polyacrylates, polyvinyl esters, polyolefins or random Copolymers and block copolymers of these polymers. Especially preferred are polyurethanes, polyesters and polyethers, as well as their copolymers, such as polyether-polyester copolymers. Typical weight average Molar masses of such radicals A are in the range of about 100 to 50000 g / mol, preferably 1000 to 30,000 g / mol. Common viscosities of Base polymers are for example in the range of 1000 mPa · s to 700000 mPa.s, preferably 5000 mPa · s up to 300000 mPa · s.
Die in Formel (I) dargestellten Reste X können innerhalb eines Moleküls gleich oder unterschiedlich sein und bilden die Brückenglieder zwischen dem zwei-, drei- oder vierwertigen Rest des Basispolymers und der Methylengruppe des endständigen Silylrests. Die Art der Reste X unterliegt keinen bestimmten Beschränkungen. Somit sind sämtliche üblichen aus dem Polymerbereich bekannten Verknüpfungsreaktionen denkbar, um die Reste X zu erzeugen.The radicals X represented by formula (I) may be the same within a molecule or different, forming the bridge links between the two-, tri- or tetravalent radical of the base polymer and the methylene group of the terminal Silyl group. The nature of the radicals X is not subject to any particular restrictions. Thus all are usual conceivable linkage reactions known from the polymer field to to generate the radicals X.
So können endständige am Basispolymer befindliche Gruppen wie beispielweise Hydroxylgruppen, Aminogruppen oder Isocyanatogruppen direkt mit der an der Alkylengruppe des Silans befindlichen organofunktionellen Gruppe zur Reaktion gebracht werden. Die Silane weisen hierbei beispielweise primäre oder sekundäre Aminogruppen, Epoxygruppen oder Isocyanatogruppen auf. Somit können geeignete Reaktionspartner beispielsweise Aminogruppe und Isocyanatogruppe, Hydroxygruppe und Isocyanatogruppe, Hydroxygruppe und Epoxygruppe, Aminogruppe und Epoxygruppe, Thiolgruppe und Isocyanatogruppe, Epoxygruppe und Thiolgruppe, Carbamatgruppe und Aminogruppe oder Acrylatgruppe und Aminogruppe sein.So can terminal groups present on the base polymer, for example hydroxyl groups, amino groups or isocyanato groups directly with the at the alkylene group of the silane be reacted organofunctional group. The silanes have, for example, primary or secondary amino groups, Epoxy groups or isocyanato groups on. Thus, suitable reactants for example, amino group and isocyanato group, hydroxy group and Isocyanato group, hydroxy group and epoxy group, amino group and Epoxy group, thiol group and isocyanato group, epoxy group and thiol group, Carbamate group and amino group or acrylate group and amino group be.
Es ist jedoch auch möglich die Reste X indirekt zu erzeugen, indem zum Beispiel ein hydroxyterminiertes Basispolymer, beispielsweise ein hydroxyterminierter Polyether, zunächst mit einer difunktionellen Verbindung, bei welcher wenigstens eine Funktion hydroxyreaktiv ist, zur Reaktion gebracht wird. Eine solche difunktionelle Verbindung kann beispielsweise ein Diisocyanat, wie Hexamethylendiisocyanat, sein. Das Reaktionsprodukt aus hydroxyterminiertem Polyether und Hexamethylendiisocyanat kann dann wiederum mit einem isocyanatreaktiven Silan umgesetzt werden.It but it is also possible to indirectly generate residues X, for example, by hydroxy-terminated Base polymer, for example a hydroxy-terminated polyether, first with a difunctional compound in which at least one Function is hydroxyreactive, is reacted. Such For example, difunctional compound may be a diisocyanate such as Hexamethylene diisocyanate. The reaction product of hydroxy-terminated Polyether and hexamethylene diisocyanate can then in turn with a be reacted isocyanate-reactive silane.
Typische Reste X können beispielsweise -O(CO)NH-, -NH(CO)O-, -NH(CO)NH-, -(CO)(NH)L(NH)(CO)NR3-, -NR3(CO)(NH)L(NH)(CO)-, worin R3 ein aliphatischer, cycloaliphatischer oder aromatischer Rest mit 1 bis 12 Kohlenstoffatomen ist und L ein aliphatischer, cycloaliphatischer oder aromatischer Rest mit 1 bis 12 Kohlenstoffatomen ist, -O(CO)-, -(CO)O-, -SH(CO)NH-, oder -NH(CO)SH-, sein.Typical radicals X may be, for example, -O (CO) NH-, -NH (CO) O-, -NH (CO) NH-, - (CO) (NH) L (NH) (CO) NR 3 -, -NR 3 (CO) (NH) L (NH) (CO) -, in which R 3 is an aliphatic, cycloaliphatic or aromatic radical having 1 to 12 carbon atoms and L is an aliphatic, cycloaliphatic or aromatic radical having 1 to 12 carbon atoms, -O ( CO) -, - (CO) O-, -SH (CO) NH-, or -NH (CO) SH-.
Die Reste R1 und R2 können gleich oder unterschiedlich sein und stellen einen geradkettigen oder verzweigten Alkyl- oder Alkenylrest mit 1 bis 6 Kohlenstoffatomen, zum Beispiel Methyl, Ethyl, n-Propyl, iso-Propyl, iso-Propenyl-, n-Butyl, iso-Butyl, tert.-Butyl, Pentyl oder Hexyl dar. Bevorzugt sind hierbei Methyl und Ethyl aufgrund der höheren Reaktivität der Reste OR2 bei der Hydrolyse. Unter diesen Resten ist aufgrund der Toxizität von Methanol der Ethyl-Rest bevorzugt.The radicals R 1 and R 2 may be identical or different and represent a straight-chain or branched alkyl or alkenyl radical having 1 to 6 carbon atoms, for example methyl, ethyl, n-propyl, iso-propyl, iso-propenyl, n-butyl Iso-butyl, tert-butyl, pentyl or hexyl. Preferred here are methyl and ethyl due to the higher reactivity of the radicals OR 2 in the hydrolysis. Among these radicals, due to the toxicity of methanol, the ethyl radical is preferred.
Die Werte für n können in der obigen Formel (I) für jeden der z Reste unabhängig voneinander 0 oder 1 sein. Im Fall, daß n = 0 ist, handelt es sich um eine endständige trialkoxylierte Silylgruppe. Wenn n hingegen 1 beträgt, liegt eine endständige dialkoxylierte Silylgruppe vor. Je nachdem, ob n = 0 oder 1 ist und z = 2, 3 oder 4 beträgt, stehen 4 bis 12 Alkoxy- oder Alkenyloxygruppen für die hydrolytische Vernetzungsreaktion zur Verfügung.The Values for n can in the above formula (I) for each of the z residues independent be 0 or 1 from each other. In the case where n = 0, it is to a terminal trialkoxylierte silyl group. If n is 1, it is a terminal one dialkoxylated silyl group. Depending on whether n = 0 or 1 and z = 2, 3 or 4, stand 4 to 12 alkoxy or alkenyloxy groups for the hydrolytic crosslinking reaction to disposal.
Die Werte für u betragen vorzugsweise 1 bis 3, wobei im Fall von u = 1 von α-Silylgruppen die Rede ist und es sich bei u = 3 um γ-Silylgruppen handelt.The Values for u are preferably 1 to 3, wherein in the case of u = 1 of α-silyl groups Speech and u = 3 are γ-silyl groups.
Alternativ zu den zwei-, drei- oder vierwertigen Resten der organischen Polymere können auch zwei bis vierwertige Silikone eingesetzt werden.alternative to the di-, tri- or tetravalent radicals of the organic polymers can Two to four-valent silicones are used.
Da die härtbaren Zusammensetzungen vorzugsweise in gehärtetem Zustand noch elastische Eigenschaften besitzen sollen, sind die Silangruppen nur terminal an den Enden der Polymerstränge angebracht. Hierdurch wird ermöglicht die durch die Art der Polymerstränge eingebrachte Charakteristik zu erhalten und die Vernetzungsdichte über die endständigen Silangruppen zu regeln.There the curable ones Compositions preferably in the cured state still elastic Properties should have, the silane groups are only terminal at the ends of the polymer strands appropriate. This is possible by the nature of the polymer strands to get introduced characteristic and the crosslink density over the terminal To regulate silane groups.
Neben den STOP oder Alkoxy-Silikonen enthalten die erfindungsgemäßen härtbaren Zusammensetzungen sogenannte photolatente Basen. Unter photolatenten Basen sind vorzugsweise organische Basen mit einem oder mehreren basischen Stickstoffatomen zu verstehen, die zunächst in einer blockierten Form vorliegen und erst nach Bestrahlung mit UV-Licht, sichtbarem Licht oder IR-Strahlung durch Spaltung des Moleküls die basische Form freisetzen.In addition to the STOP or alkoxy silicones, the curable compositions of the invention contain so-called photolatent bases. By photolatent bases are preferably understood organic bases having one or more basic nitrogen atoms, which are initially in a blocked form gene and release the basic form only after irradiation with UV light, visible light or IR radiation by cleavage of the molecule.
Die Wahl der photolatenten Base hängt einerseits von den zu vernetzenden silanterminierten Polymeren ab, andererseits von den weiteren fakultativen Bestandteilen der Zusammensetzung. Bedarf die Vernetzungsreaktion einer starken Base, so muß eine photolatente bzw. photolabile Base gewählt werden, die bei Bestrahlung eine starke Base freisetzt. Enthält die Zusammensetzung weitere UV-absorbierende Bestandteile, so wird vorzugsweise eine photolatente Base gewählt, deren Aktivierungswellenlänge, d.h. Wellenlänge der Abspaltung der freien Base, nicht mit den anderen UV-absorbierenden Bestandteilen interferiert.The Choice of photolatent base depends on the one hand from the silane-terminated polymers to be crosslinked, on the other hand, of the other optional components of the composition. If the crosslinking reaction of a strong base is required, a photolatent one must be used or photolabile base selected which liberates a strong base upon irradiation. Contains the composition other UV-absorbing components, so is preferably a chosen photolatent base, their activation wavelength, i.e. wavelength the cleavage of the free base, not with the other UV-absorbing Components interferes.
Da der Zeitpunkt der Bestrahlung frei gewählt werden kann und somit der Kontakt der härtbaren Polymere mit den freien Basen durch den Anwender bestimmbar ist, kann der Härtungsbeginn ins Belieben und Ermessen des Anwenders gestellt werden.There the time of irradiation can be freely chosen and thus the Contact of the hardenable Polymers with the free bases can be determined by the user, can the beginning of hardening at the discretion of the user.
Prinzipiell können alle photolatenten Basen als geschützte Katalysatoren eingesetzt werden. So kommen beispielsweise auch o-Nitrobenzyloxycarbonylamine, Benzoincarbamate, α,α-Dimethylbenzoyloxycarbonylamine, Formanilid-Derivate oder O-Acyloxime in Frage. Derartige Verbindungen wurden beispielsweise von Cameron et al. im J. Am. Chem. Soc. 118 (1996) 12925, J. Chem. Soc. Perkin Trans. I (1997) 2429 und J. Org. Chem. 55 (1990) 5919, von Nishikubo et al. im Polym. J. 29 (1997) 450 und Polym. J. 25 (1993) 365, sowie Ito et al. im J. Poly. Sci. Part A: Polym. Chem. 32 (1994) 2177 beschrieben.in principle can all photolatent bases used as protected catalysts become. For example, o-nitrobenzyloxycarbonylamines, Benzoincarbamates, α, α-dimethylbenzoyloxycarbonylamines, Formanilide derivatives or O-Acyloxime in question. Such compounds have been described, for example, by Cameron et al. in J. Am. Chem. Soc. 118 (1996) 12925, J. Chem. Soc. Perkin Trans. I (1997) 2429 and J. Org. Chem. 55 (1990) 5919, by Nishikubo et al. in the polym. J. 29 (1997) 450 and polym. J. 25 (1993) 365, and Ito et al. in the J. Poly. Sci. part A: Polym. Chem. 32 (1994) 2177.
Bevorzugt werden jedoch die erst kürzlich beschriebenen photolatenten tertiären Amine und Amidine. Diese sind beispielsweise in der publizierten internationalen Patentanmeldung WO 03/014226 A1 oder in der Veröffentlichung „New latent amines for the coatings industry" von T. Jung, K. Dietlinker und J. Benkhoff (Farbe & Lack 109 (10/2003) 34) beschrieben.Prefers However, they are the most recent described photolatenten tertiary amines and amidines. These are for example in the published international patent application WO 03/014226 A1 or in the publication "New latent amines for the coatings industry "by T. Jung, K. Dietlinker and J. Benkhoff (Paint & Lacquer 109 (10/2003) 34).
Beispiele für geeignete Basen sind unter anderem tertiäre Amine und Amidine, wie Diazabicyclooctan, N-Alkylmorpholine, Tetramethylguanidin (TMG), Diazabicyclononen (DBN), Diazabicycloundecen (DBU) und Imidazol.Examples for suitable Bases include tertiary Amines and amidines, such as diazabicyclooctane, N-alkylmorpholines, tetramethylguanidine (TMG), diazabicyclononene (DBN), diazabicycloundecene (DBU) and imidazole.
Besonders geeignete Amidine sind photolabile Diazabicyclononane, insbesondere 5-Benzyl-1,5-diazabicyclo[4.3.0]nonan, wobei der 5-Benzyl-Rest auch ein- oder mehrfach substituiert sein kann. Geeignete Substituenten am 5-Benzyl-Rest sind beispielsweise Halogenreste, wie Chlor oder Brom, Alkylreste, wie Methyl, Ethyl, oder Propyl, Nitrilreste, Nitrogruppen, Alkoxygruppen, wie Methoxy oder Ethoxy oder an den 5-Benzylrest ankondensierte aromatische Reste, wobei zum Beispiel aus einem 5-(Benzyl)rest ein 5-(Naphth-2-ylmethyl)rest oder ein 5-(Anthracen-9-yl-methyl)rest ableitbar ist. Auch kann anstelle des 5-Benzylrests beispielsweise ein 5-(Anthrachinon-2-yl-methyl)rest treten. Neben den möglichen Substitutionen am 5-Benzyl-Rest kann auch der Diazacyclononanrest weiter substituiert sein, wie zum Beispiel in 5-Benzyl-2-methyl-1,5-diazabicyclo[4.3.0]nonan.Especially suitable amidines are photolabile diazabicyclononanes, in particular 5-benzyl-1,5-diazabicyclo [4.3.0] nonane, wherein the 5-benzyl radical may also be monosubstituted or polysubstituted can. Suitable substituents on the 5-benzyl radical are, for example Halogen radicals, such as chlorine or bromine, alkyl radicals, such as methyl, ethyl, or propyl, nitrile radicals, nitro groups, alkoxy groups, such as methoxy or ethoxy or fused to the 5-benzyl radical Radicals, wherein, for example, a 5- (benzyl) radical is a 5- (naphth-2-ylmethyl) radical or a 5- (anthracene-9-yl-methyl) radical is derivable. Also, for example, instead of the 5-benzyl radical a 5- (anthraquinone-2-yl-methyl) radical to step. In addition to the possible Substitutions on the 5-benzyl radical can also the Diazacyclononanrest be further substituted, such as in 5-benzyl-2-methyl-1,5-diazabicyclo [4.3.0] nonane.
Neben den photolabilen Diazabicyclononanen, besteht auch die Möglichkeit photolabile Diazabicycloundecane, wie beispielsweise 8-Benzyl-1,8-diazabicyclo[5.4.0]undecane und dessen Derivate einzusetzen. Der 8-Benzyl-Rest kann analog dem 5-Benzyl-Rest des 5-Benzyl-1,5-diazabicyclo[4.3.0]nonans weiter substituiert sein oder ersetzt werden. Auch hier besteht die Möglichkeit einer weiteren Substitution am Diazabicyclononane-Rest.Next the photolabile diazabicyclononanes, there is also the possibility photolabile diazabicycloundecanes such as 8-benzyl-1,8-diazabicyclo [5.4.0] undecane and its derivatives. The 8-benzyl radical can analogously 5-benzyl radical of 5-benzyl-1,5-diazabicyclo [4.3.0] nonane on be substituted or replaced. Again, there is the possibility another substitution on the diazabicyclononane residue.
Es können auch photolatente Basen eingesetzt werden, die zwei abspaltbare Basen in einem Molekül enthalten. Ein Vertreter dieser Art ist beispielsweise das 1,4-Bis(1,5-Diazabicyclo[4.3.0]nonanylmethyl)benzol.It can also photolatent bases are used, the two cleavable Contain bases in a molecule. A representative of this type is, for example, 1,4-bis (1,5-diazabicyclo [4.3.0] nonanylmethyl) benzene.
Die Synthese der oben genannten photolatenten Basen ist unter anderem in der WO 03/033500 A1 beschrieben.The Synthesis of the above photolatent bases is among others in WO 03/033500 A1.
Die erfindungsgemäßen Zusammensetzungen können neben den härtbaren Bestandteilen, d.h. vorzugsweise den STOP und/oder Alkoxy-Silikonen, sowie den photolatenten Basen, noch weitere Additive enthalten. Diese Additive werden in der Regel in wasserfreiem Zustand zugegeben.The Compositions of the invention can in addition to the hardenable Ingredients, i. preferably the STOP and / or alkoxy silicones, and the photolatent bases, still contain other additives. These additives are usually added in the anhydrous state.
Zu diesen Additiven zählen beispielsweise Photosensibilisatoren, Füllstoffe, wie Calciumcarbonat, Kalkmehl, Glasfasern, Silikate, gefällte Kieselsäuren, pyrogene Kieselsäuren, Zeolithe, Bentonite, gemahlene Mineralstoffe, Talk, Kaolin, Glimmer, Bariumsulfat, Metalloxide und Metallhydroxide, Ruß, Graphit, synthetische Fasern oder Glaskugeln, Glashohlkugeln, Glasfasern, Kunststoffkugeln, PVC-Pulver, Pigmente, Weichmacher, wie beispielsweise Ester der Abietinsäure, Adipinsäure, Azalainsäure, Benzoesäure, Buttersäure, Essigsäure, höhere Fettsäuren, Glykolsäure, Phosphorsäure, Phthalsäure, Propionsäure, Sebacinsäure, Sulfonsäure, Trimellithsäure, Zitronensäure oder reine sowie gemischte Ether monofunktionaler, linearer oder verzweigter C4-C16-Alkohole, Feuchtigkeitsstabilisatoren, wie Isocyanate, Vinylsilane, Carbamatosilane, Flammschutzmittel, Aufheller, rheologiesteuernde Additive, Antistatika, Antimykotika, Verlaufmittel, Emulgatoren, UV-Schutz-Additive, Alterungsschutz-Additive, Tackifier und Reaktivverdünner.These additives include, for example, photosensitizers, fillers such as calcium carbonate, limestone, glass fibers, silicates, precipitated silicas, fumed silicas, zeolites, bentonites, ground minerals, talc, kaolin, mica, barium sulfate, metal oxides and metal hydroxides, carbon black, graphite, synthetic fibers or Glass beads, glass bubbles, glass fibers, plastic balls, PVC powder, pigments, soft esters such as, for example, esters of abietic acid, adipic acid, azalainic acid, benzoic acid, butyric acid, acetic acid, higher fatty acids, glycolic acid, phosphoric acid, phthalic acid, propionic acid, sebacic acid, sulfonic acid, trimellitic acid, citric acid or pure and mixed ethers of monofunctional, linear or branched C 4 -C 16 -alcohols, moisture stabilizers such as isocyanates, vinylsilanes, carbamatosilanes, flame retardants, brighteners, rheology-controlling additives, antistatic agents, antimycotics, leveling agents, emulsifiers, UV protection additives, anti-aging additives, tackifiers and reactive diluents.
Unter den angegebenen Additiven sind insbesondere Photosensibilisatoren von Bedeutung, da sich diese positiv auf die Quantenausbeute bei der Photoaktivierung der photolatenten Basen auswirken.Under The specified additives are in particular photosensitizers of importance, since these have a positive effect on the quantum yield the photoactivation of the photolatent bases.
Beispiele für Photosensibilisatoren sind aromatische Ketone, wie zum Beispiel substituierte und unsubstituierte Benzophenone, Thioxanthone, Anthrachinone oder Farbstoff, wie Oxazine, Acridine, Phenazine und Rhodamine.Examples for photosensitizers are aromatic ketones, such as substituted and unsubstituted Benzophenones, thioxanthones, anthraquinones or dyes, such as oxazines, Acridines, phenazines and rhodamines.
Besonders geeignet sind substituierte Benzophenone und Thioxanthone. Beispiele für geeignete Vertreter der Benzophenone und Thioxanthone sind neben Benzophenon und Thioxanthon selbst, beispielsweise auch 4,4'-Bis(dimethylamino)benzophenon, 4,4'-Bis-(diethylamino)benzophenon, 4,4'-Bis(ethylmethylamino)benzophenon, 4,4'-Diphenylbenzophenon, 4,4'-Diphenoxybenzophenon, 4,4'-Bis(p-isopropylphenoxy)benzophenon, 4-Methylbenzophenon, 2,4,6-Trimethylbenzophenon, 4-Phenylbenzophenon, 2-Methoxycarbonylbenzophenon, 4-Benzoyl-4'-methyldiphenylsulfid, 4-Methoxy-3,3'-methylbenzophenon, Isopropylthioxanthon, Chlorthioxanthon, 1-Chlor-4-propoxythioxanthon, 2,4-Dimethylthioxanthon, 2,4-Diethylthioxanthon und 1,3-Dimethyl-2-(2-ethylhexyloxy)thioxanthon. Auch Mischungen dieser Substanzen sind als Photosensibilisatoren einsetzbar.Especially suitable are substituted benzophenones and thioxanthones. Examples for suitable Representatives of benzophenones and thioxanthones are in addition to benzophenone and thioxanthone itself, for example also 4,4'-bis (dimethylamino) benzophenone, 4,4'-bis (diethylamino) benzophenone, 4,4'-bis (ethylmethylamino) benzophenone, 4,4'-diphenylbenzophenone, 4,4'-diphenoxybenzophenone, 4,4'-bis (p-isopropylphenoxy) benzophenone, 4-methylbenzophenone, 2,4,6-trimethylbenzophenone, 4-phenylbenzophenone, 2-methoxycarbonylbenzophenone, 4-benzoyl-4'-methyldiphenyl sulfide, 4-methoxy-3,3'-methylbenzophenone, Isopropylthioxanthone, chlorothioxanthone, 1-chloro-4-propoxythioxanthone, 2,4-dimethylthioxanthone, 2,4-diethylthioxanthone and 1,3-dimethyl-2- (2-ethylhexyloxy) thioxanthone. Mixtures of these substances can also be used as photosensitizers.
Weitere Photosensibilisatoren sind beispielsweise 3-Acylcoumarine, wie 3-Benzoylcoumarin, 3-Benzoyl-7-methoxycoumarin, 3-Benzoyl-5,7-di(propoxy)coumarin, 3-Benzoyl-6,8-dichlorcoumarin, 3-Benzoyl-6-chlorcoumarin, 3, 3'-carbonylbis[5,7-di(propoxy)coumarin], 3,3'-Carbonylbis(7-methoxycoumarin), 3,3'-carbonylbis(7-diethylaminocoumarin), 3-Isobutyroylcoumarin, 3-Benzoyl-5,7-dimethoxycoumarin, 3-Benzoyl-5,7-diethoxycoumarin, 3-Benzoyl-5,7-dibutoxycoumarin, 3-Benzoyl-5,7-di(methoxyethoxy)coumarin, 3-Benzoyl-5,7-di (allyloxy)coumarin, 3-Benzoyl-7-dimethylaminocoumarin, 3-Benzoyl-7-diethylaminocoumarin, 3-Isobutyroyl-7-dimethylaminocoumarin, 5,7-Dimethoxy-3-(1-naphthoyl)coumarin, 5,7-Dimethoxy-3-(1-naphthoyl)coumarin, 3-Benzoylbenzo[f]coumarin, 7-Diethylamino-3-thienoylcoumarin, 3-(4-Cyanobenzoyl)-5,7-dimethoxycoumarin oder 3-(Aroylmethylen)thiazoline, wie 3-Methyl-2-benzoylmethylennaphthothiazolin, 3-Methyl-2-benzoylmethylenbenzothiazolin, 3-Methyl-2-propionylmethylen-p-naphthothiazolin oder andere Carbonylverbindungen, wie beispielsweise Acetophenon, 3-Methoxyacetophenon, 4-Phenylacetophenon, 2-Acetylnaphthalin, 2-Naphthaldehyd, 9,10-Anthrachinon, 9-Fluorenon, Dibenzosuberon, Xanthon, 2,5-Bis(4-diethylaminobenzyliden)cyclopentanon, 2-(4-Dimethylaminobenzyliden)indan-1-on oder 3-(4-Dimethylaminophenyl)-1-indan-S-yl-propenon, 3-Phenylthiophthalimid oder N-Methyl-3,5-di(ethylthio)phthalimid.Further Photosensitizers are, for example, 3-acylcoumarins, such as 3-benzoylcoumarin, 3-benzoyl-7-methoxycoumarin, 3-benzoyl-5,7-di (propoxy) coumarin, 3-benzoyl-6,8-dichloro coumarin, 3-benzoyl-6-chlorocoumarin, 3, 3'-carbonylbis [5,7-di (propoxy) coumarin], 3,3'-carbonylbis (7-methoxycoumarin), 3,3'-carbonylbis (7-diethylaminocoumarin), 3-isobutyroylcoumarin, 3-benzoyl-5,7-dimethoxycoumarin, 3-benzoyl-5,7-diethoxycoumarin, 3-benzoyl-5,7-dibutoxycoumarin, 3-benzoyl-5,7-di (methoxyethoxy) coumarin, 3-benzoyl-5,7-di (allyloxy) coumarin, 3-benzoyl-7-dimethylaminocoumarin, 3-benzoyl-7-diethylaminocoumarin, 3-isobutyroyl-7-dimethylaminocoumarin, 5,7-dimethoxy-3- (1-naphthoyl) coumarin, 5,7-dimethoxy-3- (1-naphthoyl) coumarin, 3-benzoylbenzo [f] coumarin, 7-diethylamino-3-thienoylcoumarin, 3- (4-cyanobenzoyl) -5,7-dimethoxycoumarin or 3- (aroylmethylene) thiazolines, such as 3-methyl-2-benzoylmethylenenaphthothiazoline, 3-methyl-2-benzoylmethylenbenzothiazoline, 3-Methyl-2-p-naphthothiazoline propionylmethylen- or other carbonyl compounds, such as acetophenone, 3-methoxyacetophenone, 4-phenylacetophenone, 2-acetylnaphthalene, 2-naphthaldehyde, 9,10-anthraquinone, 9-fluorenone, dibenzosuberone, xanthone, 2,5-bis (4-diethylaminobenzylidene) cyclopentanone, 2- (4-dimethylaminobenzylidene) indan-1-one or 3- (4-dimethylaminophenyl) -1-indan-S-yl-propenone, 3-phenylthiophthalimide or N-methyl-3,5-di (ethylthio) phthalimide.
Die Photosensibilisatoren werden vorzugsweise in Mengen von 0,01 Gew.-% bis 5 Gew.-% bezogen auf das Gesamtgewicht der erfindungsgemäßen Zusammensetzung eingesetzt.The Photosensitizers are preferably used in amounts of 0.01% by weight. to 5 wt .-% based on the total weight of the composition according to the invention used.
Die erfindungsgemäße härtbare Zusammensetzung enthält vorzugsweise bis 99 Gew.-%, bevorzugter 5 bis 95 Gew.-%, noch bevorzugter mehr als 10 Gew.-% des silyl-terminierten Polymers bezogen auf die Gesamtzusammensetzung, sowie vorzugsweise 0,01 bis 20 Gew.-%, bevorzugter 1 bis 10 Gew.-% noch bevorzugter 2 bis 5 Gew.-% der photolatenten Base bezogen auf die Gesamtzusammensetzung und gegebenenfalls bis vorzugsweise 10 Gew.-%, bevorzugter bis 5 Gew.-%, noch bevorzugter bis 3 Gew.-% eines Photosensibilisators bezogen auf die Gesamtzusammensetzung. Des weiteren können die oben genannten Additive enthalten sein, worunter vorzugsweise bis 80 Gew.-% Füllstoffe fallen.The inventive curable composition contains preferably to 99% by weight, more preferably 5 to 95% by weight, more preferably more than 10 wt .-% of the silyl-terminated polymer based on the Total composition, and preferably 0.01 to 20 wt .-%, more preferably 1 to 10 wt .-%, more preferably 2 to 5 wt .-% of the photolatenten Base based on the total composition and optionally bis preferably 10% by weight, more preferably up to 5% by weight, more preferably to 3% by weight of a photosensitizer based on the total composition. Furthermore, you can containing the above-mentioned additives, among which preferably up to 80% by weight of fillers fall.
Die
vorliegende Erfindung stellt auch ein Verfahren zur Herstellung
der erfindungsgemäßen Zusammensetzungen
zur Verfügung.
Dieses erfindungsgemäße Verfahren
umfaßt
in einem ersten Schritt die Umsetzung eines Basispolymers mit 2
bis 4 endständigen
reaktiven Gruppen mit einem oder mehreren Silanen der allgemeinen
Formel:
Beschränkungen hinsichtlich der verwendbaren Silane gibt es nicht, solange diese mit den endständigen Gruppen des Basispolymers auf eine Weise verbunden werden können, die den Erhalt von mindestens zwei R2O-Gruppen in der Silanendgruppe gewährleistet. Somit sind prinzipiell auch Verbindungen der obigen Formel mit n = 0, unter Verlust einer R2O Gruppe, mit dem Basispolymer zum Beispiel durch Kondensation und Freisetzung von R2OH bei Erhalt der Gruppe W verbindbar. In einem solchen Fall ist sogar die Reaktivität der Gruppe W gegenüber den endständigen reaktiven Gruppen des Basispolymers entbehrlich.There are no limitations on the useful silanes, as long as they can be linked to the terminal groups of the base polymer in a manner that ensures the preservation of at least two R 2 O groups in the silane end group. Thus, in principle, compounds of the above formula with n = 0, with loss of an R 2 O group, with the base polymer, for example by condensation and release of R 2 OH on receipt of the group W connectable. In such a case, even the reactivity of the group W over the terminal reactive groups of the base polymer is dispensable.
Zu den im erfindungsgemäßen Verfahren bevorzugt einsetzbaren α-Silanen gehören unter anderem (N-Cyclohexylaminomethyl)methyl-diethoxysilan, (N-Cyclohexylamino-methyl)triethoxysilan, (N-Phenylaminomethyl)methyldimethoxysilan, (N-Phenylamino-methyl)trimethoxysilan, (Methacryloxymethyl)methyldimethoxysilan, (Methacryloxymethyl)trimethoxysilan, (Methacryloxymethyl)methyldiethoxysilan, (Methacryloxymethyl)triethoxysilan, (Isocyanatomethyl)methyldimethoxysilan, (Isocyanatomethyl)trimethoxysilan, oder N-(Trimethoxysilylmethyl)-O-methylcarbamat. Diese Produkte sind beispielsweise von Wacker, Burghausen, Deutschland unter der Handelsbezeichnung GENIOSIL® XL erhältlich.The preferred α-silanes which can be used in the process according to the invention include, inter alia, (N-cyclohexylaminomethyl) methyldiethoxysilane, (N-cyclohexylamino-methyl) triethoxysilane, (N-phenylaminomethyl) methyldimethoxysilane, (N-phenylamino-methyl) trimethoxysilane, (methacryloxymethyl) methyldimethoxysilane, (methacryloxymethyl) trimethoxysilane, (methacryloxymethyl) methyldiethoxysilane, (methacryloxymethyl) triethoxysilane, (isocyanatomethyl) methyldimethoxysilane, (isocyanatomethyl) trimethoxysilane, or N- (trimethoxysilylmethyl) -O-methylcarbamate. These products are available for example from Wacker, Burghausen, Germany under the trade name GENIOSIL® ® XL.
Es können jedoch auch reaktionsträgere Silane, wie beispielsweise γ-Silane eingesetzt werden. Beispiele für entsprechende γ-Silane sind N-(2-Aminoethyl)(3-aminopropyl)trimethoxysilan, (3-Aminopropyl)triethoxysilan, (3-Methacryloxypropyl)trimethoxysilan, (3-Isocyanatopropyl)trimethoxysilan, (3-Glycidoxypropyl)trimethoxysilan, (3-Glycidoxypropyl)triethoxysilan oder (3-Triethoxysilyl)propylbernsteinsäureanhydrid. Diese Produkte sind beispielsweise von Wacker, Burghausen, Deutschland unter der Handelsbezeichnung GENIOSIL® GF erhältlich.However, it is also possible to use more inert silanes, for example γ-silanes. Examples of corresponding γ-silanes are N- (2-aminoethyl) (3-aminopropyl) trimethoxysilane, (3-aminopropyl) triethoxysilane, (3-methacryloxypropyl) trimethoxysilane, (3-isocyanatopropyl) trimethoxysilane, (3-glycidoxypropyl) trimethoxysilane, ( 3-glycidoxypropyl) triethoxysilane or (3-triethoxysilyl) propylsuccinic anhydride. These products are available for example from Wacker, Burghausen, Germany under the trade name GENIOSIL® ® GF.
Bevorzugt werden jedoch die α-Silane aufgrund ihrer höheren Reaktivität bei der Basen katalysierten Vernetzung eingesetzt. Bei der Verwendung von γ-Silanen kann es unter Umständen nötig sein weitere vernetzungsübliche Katalysatoren zuzugeben. Solche konventionellen Katalysatoren können dann jedoch üblicherweise in geringerer Menge eingesetzt werden, da eine Ergänzung durch die aus den photolabilen Basen freigesetzten Basen erfolgt.Prefers however, the α-silanes become because of their higher Reactivity used in the base catalyzed crosslinking. When using of γ-silanes It may be possible be necessary further networking customary Add catalysts. Such conventional catalysts can then but usually used in lesser amounts, as a supplement by the released from the photolabile bases bases takes place.
Die in den erfindungsgemäßen Zusammensetzungen enthaltenen photolatenten Basen können je nach Substitutionsmuster über einen weiten Wellenlängenbereich hinweg, der vom Ultraviolett-Bereich über sichtbares Licht in den Infrarot-Bereich reicht, gespalten werden. Die gewählte Wellenlänge hängt hierbei von der Aktivierungswellenlänge der verwendeten photolatenten Base ab. Bevorzugte Wellenlängen liegen im Bereich von etwa 200 bis 700 nm. Sowohl Sonnenlicht als auch Kunstlicht sind zur Bestrahlungshärtung, beziehungsweise Freisetzung der aktiven Basenform geeignet. Es können sowohl punktförmige Lichtquellen als auch flächige Lichtquellen eingesetzt werden. Beispielhaft seien als Lichtquellen Kohlebogenlampen, Xenonbogenlampen, Quecksilberlampen niedrigen, mittleren und hohen Drucks, Metallhalogenlampen, mikrowellenstimulierte Metalldampflampen, Excimerenlampen, superactinische Fluoreszenzröhren, Fluoreszenzlampen, Glühlampen, Elektronenblitzröhren, Xenonblitzröhren, Scheinwerfer, Elektronen- und Röntgenstrahlen emittierende Röhren, Leuchtdioden und Laserlichtquellen genannt. Der Bestrahlungsabstand mit Kunstlichtquellen kann von 1 cm bis zu 2 m oder mehr betragen, je nach Stärke der Lichtquelle und Empfindlichkeit der photolatenten Basen.The in the compositions of the invention contained photolatenten bases can, depending on the substitution pattern on a wide wavelength range away from the ultraviolet range via visible light in the Infrared range is enough to be split. The selected wavelength depends on this from the activation wavelength the photolatent base used. Preferred wavelengths are in the range of about 200 to 700 nm. Both sunlight and Artificial light are for radiation curing, or release the active base form suitable. It can be both point-like light sources as well as areal Light sources are used. Examples are as light sources Carbon arc lamps, xenon arc lamps, mercury lamps low, medium and high pressure, metal halide lamps, microwave stimulated Metal halide lamps, excimer lamps, superactinic fluorescent tubes, fluorescent lamps, incandescent lamps, Electronic flash tubes, Xenon flash tubes, Headlamps, electron and X-rays emitting tubes, Light emitting diodes and laser light sources called. The irradiation distance with artificial light sources can be from 1 cm to 2 m or more, depending on the strength the light source and sensitivity of the photolatent bases.
Des weiteren betrifft die vorliegende Erfindung die Verwendung der erfindungsgemäßen Zusammensetzungen als lagerstabile Klebstoffe, Dichtungsmassen, Spachtelmassen und Montageschaumstoffe.Of Furthermore, the present invention relates to the use of the compositions according to the invention as storage-stable adhesives, sealants, fillers and Assembly foams.
Die Erfindung betrifft darüber hinaus die Verwendung der erfindungsgemäßen Zusammensetzungen in einem Verfahren, umfassend die Schritte:
- (A) Aufbringen der Zusammensetzung auf ein Substrat,
- (B) Einwirkenlassen von Feuchtigkeit auf die Zusammensetzung und
- (C) Bestrahlen der Zusammensetzung mit Strahlung einer Wellenlänge, bei welcher die photolatente Base in ihre freie Form überführt wird.
- (A) applying the composition to a substrate,
- (B) exposing the composition to moisture and
- (C) irradiating the composition with radiation of a wavelength at which the photolatent base is converted to its free form.
Hierbei kann Feuchtigkeit bereits während des Aufbringens der Zusammensetzung auf das Substrat einwirken, d.h. Schritt (B) zugleich mit Schritt (A) erfolgen. Es ist jedoch auch denkbar Schritt (A) unter Ausschluß von Feuchtigkeit durchzuführen und dann mit Schritt (B) und Schritt (C) in beliebiger Reihenfolge fortzufahren. Es kann jedoch auch, während noch Feuchtigkeit auf das aufgebrachte Substrat einwirkt, mit der Bestrahlung begonnen werden, so daß (A), (B) und (C) quasi gleichzeitig ablaufen oder in beliebiger Weise miteinander verschachtelt sind.in this connection can already moisture during the application of the composition to the substrate, i.e. Step (B) at the same time as step (A). However, it is also possible to perform step (A) under exclusion of moisture and then proceed to step (B) and step (C) in any order. It may, however, while Moisture still acts on the applied substrate, with the Irradiation be started so that (A), (B) and (C) quasi simultaneously expire or are interleaved in any way.
Als Substrate eignen sich insbesondere Metalle, beispielsweise Aluminium, Stahl, Kupfer oder Legierungen und dergleichen, Polymere, wie beispielsweise Polyacrylate, Polymethacrylate, Polyvinylchloride, Polycarbonate und dergleichen, keramische und mineralische Materialien, Glas, Marmor, Beton, Zement, Granit, Sandstein, Spiegel, Holz, Leder, Textilien, Papier, Pappe, Gummi und dergleichen.Suitable substrates are in particular metals, for example aluminum, steel, copper or alloy and the like, polymers such as polyacrylates, polymethacrylates, polyvinyl chlorides, polycarbonates and the like, ceramics and mineral materials, glass, marble, concrete, cement, granite, sandstone, mirrors, wood, leather, textiles, paper, paperboard, rubber and the like ,
Im folgenden wird die Erfindung durch Beispiele veranschaulicht. Diese sollen lediglich der Erläuterung dienen und nicht als beschränkend erachtet werden.in the Following, the invention will be illustrated by examples. These should only be the explanation serve and not as limiting be considered.
Polymer 1: Herstellung eines α-silanterminierten Polymeren (Zinn-Katalyse)Polymer 1: Preparation an α-silane-terminated Polymers (tin catalysis)
282 g (15 mmol) Polypropylenglykol 18000 (Hydroxyzahl = 6,0) wurden in einem 500 ml Dreihalskolben bei 100°C im Vakuum getrocknet. Unter Stickstoffatmosphäre wurde bei 80°C 0,06 g (0,02%) Dibutylzinnlaurat hinzugegeben und anschließend mit 5,5 g (34 mmol) Isocyanatomethyldimethoxymethylsilan (%NCO = 25,7) versetzt. Nach einstündigem Rühren bei 80°C wurde das entstandene Polymer abgekühlt und mit 6 g Carbamatomethyltrimethoxysilan versetzt. Das klare, farblose Produkt wurde feuchtigkeitsdicht unter Stickstoffatmosphäre in einem Glasgefäß gelagert.282 g (15 mmol) of polypropylene glycol 18000 (hydroxy number = 6.0) dried in a 500 ml three-necked flask at 100 ° C in a vacuum. Under nitrogen atmosphere was at 80 ° C Added 0.06 g (0.02%) of dibutyltin laurate and then with 5.5 g (34 mmol) of isocyanatomethyldimethoxymethylsilane (% NCO = 25.7) added. After one hour stir at 80 ° C The resulting polymer was cooled and treated with 6 g of carbamatomethyltrimethoxysilane added. The clear, colorless product was moistureproof under nitrogen atmosphere stored in a glass jar.
Polymer 2: Herstellung eines α-silanterminierten Polymeren (Titan-Katalyse)Polymer 2: Preparation an α-silane-terminated Polymers (titanium catalysis)
282 g (15 mmol) Polypropylenglykol 18000 (Hydroxyzahl = 6,0) wurden in einem 500 ml Dreihalskolben bei 100°C im Vakuum getrocknet. Unter Stickstoffatmosphäre wurde bei 80°C 0,14g (0,05%) Titantetraisopropylat hinzugegeben und anschließend mit 5,5 g (34 mmol) Isocyanatomethyldimethoxymethylsilan (%NCO = 25,7) versetzt. Nach einstündigem Rühren bei 80°C wurde das entstandene Polymer abgekühlt und mit 6 g Carbamatomethyltrimethoxysilan versetzt. Das klare, orangegelbe Produkt wurde feuchtigkeitsdicht unter Stickstoffatmosphäre in einem Glasgefäß gelagert.282 g (15 mmol) of polypropylene glycol 18000 (hydroxy number = 6.0) dried in a 500 ml three-necked flask at 100 ° C in a vacuum. Under nitrogen atmosphere was at 80 ° C 0.14 g (0.05%) of titanium tetraisopropoxide added and then with 5.5 g (34 mmol) of isocyanatomethyldimethoxymethylsilane (% NCO = 25.7) added. After one hour stir at 80 ° C The resulting polymer was cooled and treated with 6 g of carbamatomethyltrimethoxysilane added. The clear, orange-yellow product was moisture-proof under nitrogen atmosphere stored in a glass jar.
PL-DBN: Herstellung der photolatenten Base 5-Benzyl-1,5-diazabicyclo[4.3.0]nonanPL-DBN: Production of the photolatent base 5-benzyl-1,5-diazabicyclo [4.3.0] nonane
5-Benzyl-1,5-diazabicyclo[4.3.0]nonan
(PL-DBN) wurde entsprechend WO 03/033500 A1 aus Benzylchlorid und
1,5-diazabicyclo[4.3.0]nonan hergestellt:
Hierzu wurden 63
g (0,5 mol) 1,5-diazabicyclo[4.3.0]non-5-en (DBN) in 1000 ml tert.
Butylmethylether gelöst und
anschließend
portionsweise mit 9,5 g (0,25 mol) Lithiumaluminiumhydrid bei Raumtemperatur
versetzt. Anschließend
wird drei Stunden unter Rückfluß erhitzt.
Bei 0°C
wurde vorsichtig mit 10 ml Wasser und anschließend 10 ml 10%iger NaOH-Lösung versetzt.
Es wurden weitere 25 ml Wasser zugegeben und anschließend der
Niederschlag abfiltriert. Die organische Phase wurde abgetrennt,
getrocknet und das Lösungsmittel abdestilliert.
Das Rohprodukt wurde im Vakuum destilliert.5-Benzyl-1,5-diazabicyclo [4.3.0] nonane (PL-DBN) was prepared according to WO 03/033500 A1 from benzyl chloride and 1,5-diazabicyclo [4.3.0] nonane:
For this purpose, 63 g (0.5 mol) of 1,5-diazabicyclo [4.3.0] non-5-ene (DBN) in 1000 ml of tert. Butyl methyl ether dissolved and then added in portions with 9.5 g (0.25 mol) of lithium aluminum hydride at room temperature. The mixture is then heated under reflux for three hours. At 0 ° C was added carefully with 10 ml of water and then 10 ml of 10% NaOH solution. An additional 25 ml of water was added and then the precipitate was filtered off. The organic phase was separated, dried and the solvent distilled off. The crude product was distilled in vacuo.
42 g (1 mol) Natriumhydroxid und 11,6 g (0,07 mol) Kaliumjodid wurden in 700 ml Methylenchlorid suspendiert. Es wurden 88,6 g (0,7 mol) Benzylchlorid und 89,4 g (0,7 mol) 1,5-diazabicyclo[4.3.0]nonan zugegeben und 48 h bei Raumtemperatur gerührt. Es wurden 400 ml Wasser zugegeben und die organische Phase abgetrennt. Das Lösungsmittel wurde am Rotationsverdampfer entfernt und zum resultierenden Öl wurden 1000 ml Hexan gegeben. Die ausgefallenen Salze wurden abfiltriert und das organische Lösungsmittel entfernt. Das Rohprodukt wurde im Vakuum destilliert. Das Endprodukt kristallisierte beim Abkühlen aus.42 g (1 mol) of sodium hydroxide and 11.6 g (0.07 mol) of potassium iodide suspended in 700 ml of methylene chloride. There were 88.6 g (0.7 mol) Benzyl chloride and 89.4 g (0.7 mol) of 1,5-diazabicyclo [4.3.0] nonane added and stirred for 48 h at room temperature. There were 400 ml of water added and the organic phase separated. The solvent was removed on a rotary evaporator and the resulting oil became 1000 ml of hexane. The precipitated salts were filtered off and the organic solvent away. The crude product was distilled in vacuo. The final product crystallized on cooling out.
Herstellung von Zusammensetzungen und Katalyseversuche:Preparation of compositions and catalysis experiments:
Die Polymere 1 und 2 wurden mit verschiedenen Katalysatoren versetzt und anschließend in einem 1 mm dicken Film auf eine Glasplatte aufgetragen. Ein Teil der Proben wurde im Dunkeln belassen und ein anderer Teil nach 15 Minuten mit einer UV Lampe (Typ: Loctite 97034, 200W Quecksilber-Höchstdrucklampe, 220–500 nm) für 90 Sekunden bestrahlt. Es wurden die Hautbildungszeit (Skin over time/SOT) sowie die Zeit zur Bildung einer klebfreien Schicht (Tack free time/TFT) bestimmt.The Polymers 1 and 2 were mixed with various catalysts and subsequently applied to a glass plate in a 1 mm thick film. A part the samples were left in the dark and another part after 15 Minutes with a UV lamp (Type: Loctite 97034, 200W high-pressure mercury lamp, 220-500 nm) for 90 Seconds irradiated. The skin formation time (skin over time / SOT) and the time to form a tack-free layer (tack free time / TFT) certainly.
Zur Bestimmung der Lagerstabilität wurden die Proben in einem geschlossenen Behälter für 7 Tage gelagert und die Viskositätserhöhung gemessen. Tabelle 1 Silan GF96 = Aminopropyltrimethoxysilan (Haftvermittler und Cokatalysator)To determine the storage stability, the samples were stored in a closed container for 7 days and the viscosity increase was measured. Table 1 Silane GF96 = aminopropyltrimethoxysilane (adhesion promoter and cocatalyst)
Vergleichsbeispiel 1 enthält neben Polymer 1 auch 0,2 Gew.-% freies 1,5-diazabicyclo[4.3.0]nonan (DBN) als Base. Hierbei kommt es bereits nach 1 min zur unerwünscht schnellen Hautbildung, wodurch der Verarbeitbarkeitszeitraum für praktische Anwendungen viel zu kurz ist.Comparative example 1 contains in addition to polymer 1 also 0.2 wt .-% of free 1,5-diazabicyclo [4.3.0] nonane (DBN) as the base. This leads to the undesirable rapid skin formation after only 1 min, whereby the workability period for practical applications much too short.
Hinsichtlich ihrer Zusammensetzung direkt vergleichbar sind Vergleichsbeispiele 2, 3 und 4 mit den erfindungsgemäßen Beispielen 1, 2 und 3. Einziger Unterschied ist, daß die erfindungsgemäßen Zusammensetzungen einer Belichtung unterzogen wurden, wodurch die photolatente Base (PL-DBN) in die freie Basenform überführt wurde. Diese Beispiele belegen klar die erhöhte Lagerstabilität der Zusammensetzungen gegenüber Vergleichsbeispiel 1, sowie die Wirkung der Bestrahlung bei der Freisetzung der freien Base als Härtungskatalysator.Regarding Comparable directly with their composition are comparative examples 2, 3 and 4 with the examples according to the invention 1, 2 and 3. The only difference is that the compositions according to the invention were subjected to an exposure, whereby the photolatent base (PL-DBN) was converted into the free base form. These examples clearly demonstrate the increased storage stability of the compositions across from Comparative Example 1, and the effect of irradiation in the Release of the free base as a curing catalyst.
Polymer 3: Herstellung eines α- und γ-silanterminierten PolymerenPolymer 3: Preparation an α- and γ-silane-terminated polymers
155,1 g (19 mmol) Polypropylenglykol 8000 (Hydroxyzahl = 14,0) wurden in einem 500 ml Dreihalskolben bei 100°C im Vakuum getrocknet. Unter Stickstoffatmosphäre wurde bei 80°C 0,06 g Dibutylzinnlaurat hinzugegeben und anschließend mit 15,3 g (87 mmol) Toluendiisocyanat (TDI) (%NCO = 47,8) versetzt. Nach einstündigem Rühren bei 80°C wurde das entstandene Polymer mit 103,4 g (105 mmol) Polytetrahydrofuran (PolyTHF) 1000 (Hydroxyzahl = 114) versetzt und eine weitere Stunde bei 80°C gerührt. Es wurde mit einer Mischung aus 10,2 g (45 mmol) Isocyanatopropyltrimethoxysilan (%NCO = 18,3) und 5,5 g (34 mmol) Isocyanatomethyldimethoxymethylsilan (%NCO = 25,7) versetzt und eine weitere Stunde bei 80°C gerührt. Das Polymer wurde abgekühlt und mit 6 g Vinyltrimethoxysilan versetzt. Das Produkt wurde feuchtigkeitsdicht unter Stickstoffatmosphäre in einem Glasgefäß gelagert.155.1 g (19 mmol) of polypropylene glycol 8000 (hydroxy number = 14.0) dried in a 500 ml three-necked flask at 100 ° C in a vacuum. Under nitrogen atmosphere was at 80 ° C Added 0.06 g of dibutyltin laurate and then with 15.3 g (87 mmol) of toluene diisocyanate (TDI) (% NCO = 47.8) were added. After one hour stir at 80 ° C The resulting polymer was treated with 103.4 g (105 mmol) of polytetrahydrofuran (PolyTHF) 1000 (hydroxyl number = 114) and another hour at 80 ° C touched. It was treated with a mixture of 10.2 g (45 mmol) of isocyanatopropyltrimethoxysilane (% NCO = 18.3) and 5.5 g (34 mmol) of isocyanatomethyldimethoxymethylsilane (% NCO = 25.7) and stirred for a further hour at 80 ° C. The Polymer was cooled and mixed with 6 g of vinyltrimethoxysilane. The product became moisture-proof under nitrogen atmosphere stored in a glass jar.
Herstellung von Zusammensetzungen und Katalyseversuchemanufacturing of compositions and catalysis experiments
Das
Polymer 3 wurde mit verschiedenen Katalysatoren/Photosensibilatoren
versetzt und anschließend
in einem 1 mm dicken Film auf eine Glasplatte aufgetragen. Ein Teil
der Proben wurde im Dunkeln belassen und ein anderer Teil nach 15
Minuten mit einer LED Lampe für
5 Minuten bestrahlt. Es wurden die Hautbildungszeit (Skin over time/SOT)
sowie die Zeit zur Bildung einer klebfreien Schicht (Tack free time/TFT)
wie oben bestimmt. Tabelle
2 Genocure ITX: Thioxanthone (Photo-Sensibilisator)
Silan
GF91 = N-Aminoethyl-3-aminopropyltrimethoxysilan (Haftvermittler
und Cokatalysator)The polymer 3 was mixed with various catalysts / photosensitizers and then applied in a 1 mm thick film on a glass plate. One part of the samples was left in the dark and another part was irradiated after 15 minutes with an LED lamp for 5 minutes. Skin over time (SOT) and time to form tack-free layer (Tack free time / TFT) were determined as above. Table 2 Genocure ITX: Thioxanthone (Photo sensitizer)
Silane GF91 = N-aminoethyl-3-aminopropyltrimethoxysilane (coupling agent and cocatalyst)
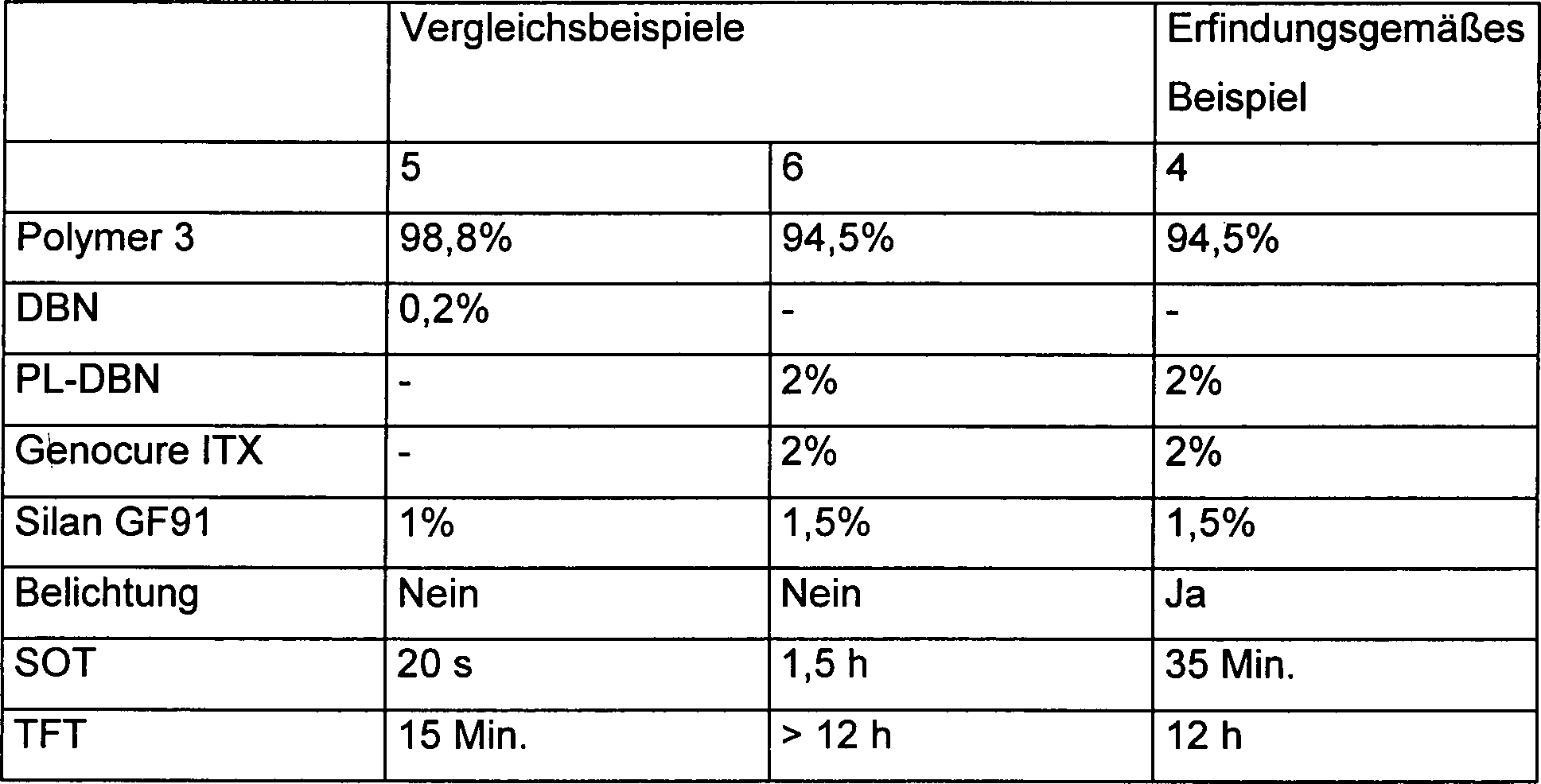
Wie Vergleichsbeispiel 5 zeigt bewirkt die direkte Zugabe einer freien Base (DBN) die quasi sofortige Hautbildung (20 s). In Gegenwart einer photolatenten Base (PL-DBN) findet ohne Belichtung selbst in einer Zusammensetzung, welche weitere Haftvermittler und Cokatalysatoren enthält nur eine langsame Hautbildung statt, die mit einer langen TFT einhergeht (Vergleichsbeispiel 6). Das erfindungsgemäße Beispiel 4 belegt wiederum die vorteilhafte Wirkung der Bestrahlung auf die erfindungsgemäßen Zusammensetzungen, was sich in einer verkürzten SOT und TFT zeigt.As Comparative Example 5 shows the direct addition of a free Base (DBN) the quasi-immediate skin formation (20 s). In present a photolatent base (PL-DBN) finds without exposure even in a composition, which further Adhesion promoters and cocatalysts contain only a slow skin formation, which is accompanied by a long TFT (Comparative Example 6). The inventive example 4 once again demonstrates the advantageous effect of the irradiation on the compositions according to the invention, resulting in a shortened SOT and TFT shows.
Alkoxy-Silikon 1: Herstellung eines Alkoxy-Silikons (Aceton-System):Alkoxy Silicone 1: Preparation of an alkoxy-silicone (acetone system):
75 g α,ω-Bishydroxy-Polydimethylsiloxan (Viskosität 20000 mPa·s/23°C) wurden bei 35°C mit 3,9 g Vinyltriisopropenoxysilan und 0,05 g Tetramethylguanidine versetzt und für 30 Minuten gerührt. Bei Raumtemperatur wurden 20 g einer hydrophoben pyrogenen Kieselsäure eingemischt und anschließend mit 3 g 5-Benzyl-1,5-diazabicyclo[4.3.0]nonan (PL-DBN) versetzt. Mittels Vakuum wurde entstandenes Aceton entfernt und die Masse entgast. Die Masse war in einem geschlossenen Behälter auch nach mehrmaligem Öffnen über Monate stabil.75 g α, ω-bis-hydroxy polydimethylsiloxane (Viscosity 20000 mPa.s / 23 ° C) at 35 ° C with 3.9 g of vinyltriisopropenoxysilane and 0.05 g of tetramethylguanidine offset and for Stirred for 30 minutes. At room temperature, 20 g of a hydrophobic fumed silica were mixed and subsequently with 3 g of 5-benzyl-1,5-diazabicyclo [4.3.0] nonane (PL-DBN) offset. Evolved acetone was removed by vacuum and the crowd is degassed. The crowd was in a closed container too after repeated opening over months stable.
Alkoxy-Silikon 2: Herstellung eines Alkoxy-Silikons (Methoxy-System):Alkoxy silicone 2: preparation of an alkoxy-silicone (methoxy-system):
60 g α,ω-Bishydroxy-Polydimethylsiloxan (Viskosität 20000 mPa·s/23°C) wurden bei 35°C mit 4 g Vinyltrimethoxysilan versetzt und für 30 Minuten gerührt. Es wurde 0,01 g Butyllithium zugegeben und 60 Min. bei 50°C unter Stickstoffatmosphäre und Vakuum gerührt. Bei Raumtemperatur wurden 35 g vorgetrocknetes CaCO3 eingemischt und anschließend mit 3 g 5-Benzyl-1,5-diazabicyclo[4.3.0]nonan (PL-DBN) versetzt. Mittels Vakuum wurde die Masse entgast. Die Masse war in einem geschlossenen Behälter auch nach mehrmaligem Öffnen über Monate stabil.60 g of α, ω-bishydroxy-polydimethylsiloxane (viscosity 20000 mPa · s / 23 ° C) were added at 35 ° C with 4 g of vinyltrimethoxysilane and stirred for 30 minutes. 0.01 g of butyl lithium was added and the mixture was stirred at 50 ° C. for 60 minutes under a nitrogen atmosphere and under reduced pressure. At room temperature, 35 g of pre-dried CaCO 3 were mixed and then treated with 3 g of 5-benzyl-1,5-diazabicyclo [4.3.0] nonane (PL-DBN). By vacuum, the mass was degassed. The mass was stable in a closed container even after repeated opening for months.
Aushärtung der Alkoxy-SilikoneCuring the Alkoxy silicones
Die Alkoxy-Silikone 1 und 2 wurden in 1 mm dicken Filmen auf eine Glasplatte aufgetragen. Ein Teil der Proben wurde im Dunkeln belassen und ein anderer Teil nach 15 Minuten mit einer UV Lampe (Typ: Loctite 97034, 200W Quecksilber-Höchstdrucklampe, 220–500 nm) für 60 Sekunden bestrahlt. Es wurden die Hautbildungszeit (Skin over time/SOT) sowie die Zeit zur Bildung einer klebfreien Schicht (Tack free time/TFT) wie oben bestimmt. Tabelle 3 DBU: 1,8-diazabicyclo[5.4.0]undecenThe alkoxy silicones 1 and 2 were coated on a glass plate in 1 mm thick films. One part of the samples was left in the dark and another part after 15 minutes with a UV lamp (type: Loctite 97034, 200W high-pressure mercury lamp, 220-500 nm) irradiated for 60 seconds. Skin over time (SOT) and time to form tack-free layer (Tack free time / TFT) were determined as above. Table 3 DBU: 1,8-diazabicyclo [5.4.0] undecene
Claims (13)
Priority Applications (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE200410018548 DE102004018548A1 (en) | 2004-04-14 | 2004-04-14 | Radiation and moisture curing compositions based on silane-terminated polymers, their preparation and use |
| PCT/EP2005/003706 WO2005100482A1 (en) | 2004-04-14 | 2005-04-08 | Compositions based on silane-terminated polymers and hardened by radiation and humidity, production and use thereof |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE200410018548 DE102004018548A1 (en) | 2004-04-14 | 2004-04-14 | Radiation and moisture curing compositions based on silane-terminated polymers, their preparation and use |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| DE102004018548A1 true DE102004018548A1 (en) | 2005-11-10 |
Family
ID=34963803
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE200410018548 Ceased DE102004018548A1 (en) | 2004-04-14 | 2004-04-14 | Radiation and moisture curing compositions based on silane-terminated polymers, their preparation and use |
Country Status (2)
| Country | Link |
|---|---|
| DE (1) | DE102004018548A1 (en) |
| WO (1) | WO2005100482A1 (en) |
Cited By (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE102007038030A1 (en) * | 2007-08-10 | 2009-02-19 | Henkel Ag & Co. Kgaa | Curable compositions of dimethoxysilanes |
| DE102008020980A1 (en) * | 2008-04-25 | 2009-10-29 | Henkel Ag & Co. Kgaa | Curable compositions containing silylated polyurethanes based on polyether block polymers |
| DE102008043218A1 (en) | 2008-09-24 | 2010-04-01 | Evonik Goldschmidt Gmbh | Polymeric materials and adhesives and coating materials based on multialkoxysilyl-functional prepolymers |
| EP2194086A1 (en) | 2008-12-05 | 2010-06-09 | Evonik Goldschmidt GmbH | Alkoxysilyl functional polyethersiloxanes and method for preparation |
| DE102009028640A1 (en) | 2009-08-19 | 2011-02-24 | Evonik Goldschmidt Gmbh | Curable composition containing urethane-containing silylated polymers and their use in sealants and adhesives, binders and / or surface modifiers |
| WO2018069526A1 (en) | 2016-10-14 | 2018-04-19 | Basf Se | Hardenable polymer composition |
| WO2018069530A1 (en) | 2016-10-14 | 2018-04-19 | Basf Se | Stabilizer composition |
| WO2020148211A1 (en) | 2019-01-16 | 2020-07-23 | Basf Se | Stabilizer composition for sealants and adhesives |
Families Citing this family (29)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20050234208A1 (en) | 2004-04-14 | 2005-10-20 | Matthias Koch | Fast curing polydiorganosiloxanes |
| DE102007000833A1 (en) | 2007-10-08 | 2009-04-09 | Wacker Chemie Ag | Silane-substituted RAFT reagents and silane-crosslinkable polymers |
| DE102009022630A1 (en) | 2009-05-25 | 2010-12-02 | Evonik Goldschmidt Gmbh | Emulsions based on silyl-group-bearing hydroxyl compounds |
| DE102009022631A1 (en) | 2009-05-25 | 2010-12-16 | Evonik Goldschmidt Gmbh | Curable silyl group-containing compositions and their use |
| DE102009034607A1 (en) | 2009-07-24 | 2011-01-27 | Evonik Goldschmidt Gmbh | Novel silicone polyether copolymers and processes for their preparation |
| DE102009028636A1 (en) | 2009-08-19 | 2011-02-24 | Evonik Goldschmidt Gmbh | Novel urethane-containing silylated prepolymers and process for their preparation |
| DE102010001528A1 (en) | 2010-02-03 | 2011-08-04 | Evonik Goldschmidt GmbH, 45127 | New particles and composite particles, their uses and a new process for their preparation from alkoxysilyl-bearing alkoxylation products |
| DE102010038768A1 (en) | 2010-08-02 | 2012-02-02 | Evonik Goldschmidt Gmbh | Modified alkoxylation products having at least one non-terminal alkoxysilyl group with increased storage stability and increased extensibility of the polymers prepared using them |
| DE102010038774A1 (en) | 2010-08-02 | 2012-02-02 | Evonik Goldschmidt Gmbh | Modified alkoxylation products having at least one non-terminal alkoxysilyl group, with increased storage stability and increased extensibility of the polymers prepared using them |
| DE102010041978A1 (en) | 2010-10-05 | 2012-04-05 | Henkel Ag & Co. Kgaa | Curable composition with special catalyst / plasticizer system |
| US9616460B2 (en) | 2011-12-02 | 2017-04-11 | Toyota Motor Engineering & Manufacturing North America, Inc. | Terminate-on-demand cationic polymerization method for forming a two-dimensional coating |
| DE102012203737A1 (en) | 2012-03-09 | 2013-09-12 | Evonik Goldschmidt Gmbh | Modified alkoxylation products having at least one non-terminal alkoxysilyl group and containing a plurality of urethane groups and their use |
| DE102013213655A1 (en) | 2013-07-12 | 2015-01-15 | Evonik Industries Ag | Curable silyl group-containing compositions with improved storage stability |
| DE102013216781A1 (en) | 2013-08-23 | 2015-02-26 | Evonik Industries Ag | coating materials |
| DE102013216777A1 (en) | 2013-08-23 | 2015-02-26 | Evonik Industries Ag | Room temperature curable silicone resin compositions |
| DE102013216751A1 (en) | 2013-08-23 | 2015-02-26 | Evonik Industries Ag | Modified alkoxylation products containing alkoxysilyl groups containing urethane groups and their use |
| DE102013216787A1 (en) | 2013-08-23 | 2015-02-26 | Evonik Degussa Gmbh | Guanidinruppen containing semi-organic silicon group-containing compounds |
| DE102013218976A1 (en) | 2013-09-20 | 2015-04-16 | Evonik Industries Ag | Hydroxyl-containing silicone-polyester-acrylate binder |
| DE102013218981A1 (en) | 2013-09-20 | 2015-03-26 | Evonik Industries Ag | Room temperature curing silicone-polyester binder |
| US20180305596A1 (en) | 2015-11-26 | 2018-10-25 | Evonik Degussa Gmbh | Binder systems comprising epoxide compounds and prepolymers bearing alkoxysilyl groups, and use thereof |
| DE102016111590A1 (en) | 2016-06-24 | 2017-12-28 | Delo Industrie Klebstoffe Gmbh & Co. Kgaa | One-component composition based on alkoxysilanes and method for joining or casting components using the composition |
| EP3461864A1 (en) | 2017-09-28 | 2019-04-03 | Evonik Degussa GmbH | Curable composition based on polysiloxanes |
| EP3470475B1 (en) | 2017-10-13 | 2021-01-27 | Evonik Operations GmbH | Curable composition for coatings with anti-adhesive property |
| JP2021165368A (en) | 2020-02-18 | 2021-10-14 | エボニック オペレーションズ ゲーエムベーハー | Composition for production of coatings having antimicrobial property |
| EP3929253A1 (en) | 2020-06-26 | 2021-12-29 | Evonik Operations GmbH | Composition for producing coatings with antimicrobial properties |
| EP4074784A1 (en) | 2021-04-13 | 2022-10-19 | Evonik Operations GmbH | Composition for producing coatings with improved luminescent material |
| JP2022183014A (en) | 2021-05-27 | 2022-12-08 | エボニック オペレーションズ ゲーエムベーハー | Universal adhesion promoter based on organofunctional modified polybutadiene |
| JP2022183009A (en) | 2021-05-27 | 2022-12-08 | エボニック オペレーションズ ゲーエムベーハー | Polyester-polyether modified polybutadiene and method for producing the same |
| JP2023138394A (en) | 2022-03-17 | 2023-10-02 | エボニック オペレーションズ ゲーエムベーハー | Process for preparing fluxed up-conversion phosphors |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0966503B1 (en) * | 1997-03-14 | 2003-05-28 | Minnesota Mining And Manufacturing Company | Cure-on-demand, moisture-curable compositions having reactive silane functionality |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB9210653D0 (en) * | 1992-05-19 | 1992-07-01 | Ici Plc | Silane functional oligomer |
| DE10139132A1 (en) * | 2001-08-09 | 2003-02-27 | Consortium Elektrochem Ind | Alkoxy crosslinking one-component moisture-curing compositions |
| DE10317881A1 (en) * | 2003-04-17 | 2004-11-11 | Consortium für elektrochemische Industrie GmbH | Isocyanate-free foamable mixtures with improved fire behavior |
-
2004
- 2004-04-14 DE DE200410018548 patent/DE102004018548A1/en not_active Ceased
-
2005
- 2005-04-08 WO PCT/EP2005/003706 patent/WO2005100482A1/en active Application Filing
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0966503B1 (en) * | 1997-03-14 | 2003-05-28 | Minnesota Mining And Manufacturing Company | Cure-on-demand, moisture-curable compositions having reactive silane functionality |
Non-Patent Citations (1)
| Title |
|---|
| Encyclopedia of Polymer Science and Engineering, 2. Ed, Vol. 15, S. 252 * |
Cited By (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE102007038030A1 (en) * | 2007-08-10 | 2009-02-19 | Henkel Ag & Co. Kgaa | Curable compositions of dimethoxysilanes |
| DE102007038030B4 (en) * | 2007-08-10 | 2009-07-09 | Henkel Ag & Co. Kgaa | Curable compositions of dimethoxysilanes |
| DE102008020980A1 (en) * | 2008-04-25 | 2009-10-29 | Henkel Ag & Co. Kgaa | Curable compositions containing silylated polyurethanes based on polyether block polymers |
| WO2009130297A2 (en) * | 2008-04-25 | 2009-10-29 | Henkel Ag & Co. Kgaa | Curable compositions containing silylated polyether block polymer-based polyurethanes |
| WO2009130297A3 (en) * | 2008-04-25 | 2011-01-06 | Henkel Ag & Co. Kgaa | Curable compositions containing silylated polyether block polymer-based polyurethanes |
| DE102008043218A1 (en) | 2008-09-24 | 2010-04-01 | Evonik Goldschmidt Gmbh | Polymeric materials and adhesives and coating materials based on multialkoxysilyl-functional prepolymers |
| EP2194086A1 (en) | 2008-12-05 | 2010-06-09 | Evonik Goldschmidt GmbH | Alkoxysilyl functional polyethersiloxanes and method for preparation |
| DE102009022628A1 (en) | 2008-12-05 | 2010-06-10 | Evonik Goldschmidt Gmbh | Method for modifying surfaces |
| DE102009028640A1 (en) | 2009-08-19 | 2011-02-24 | Evonik Goldschmidt Gmbh | Curable composition containing urethane-containing silylated polymers and their use in sealants and adhesives, binders and / or surface modifiers |
| EP2289972A1 (en) | 2009-08-19 | 2011-03-02 | Evonik Goldschmidt GmbH | Hardening mass containing urethane groups comprising silylated polymers and the use of same in sealants and adhesives, binding and/or surface modification agents |
| EP3184576A1 (en) | 2009-08-19 | 2017-06-28 | Evonik Degussa GmbH | Hardening mass containing urethane groups comprising silylated polymers and the use of same in sealants and adhesives, binding and/or surface modification agents |
| WO2018069526A1 (en) | 2016-10-14 | 2018-04-19 | Basf Se | Hardenable polymer composition |
| WO2018069530A1 (en) | 2016-10-14 | 2018-04-19 | Basf Se | Stabilizer composition |
| US11001698B2 (en) | 2016-10-14 | 2021-05-11 | Basf Se | Stabilizer composition |
| US11098151B2 (en) | 2016-10-14 | 2021-08-24 | Basf Se | Hardenable polymer composition |
| WO2020148211A1 (en) | 2019-01-16 | 2020-07-23 | Basf Se | Stabilizer composition for sealants and adhesives |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2005100482A1 (en) | 2005-10-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE102004018548A1 (en) | Radiation and moisture curing compositions based on silane-terminated polymers, their preparation and use | |
| EP2176315B1 (en) | Curable compositions composed of silanes with two hydrolyzable groups | |
| EP1529071B1 (en) | Polymer masses based on alkoxysilane-terminated polymers having a regulatable hardening speed | |
| EP1678254B1 (en) | Polymers with improved strength comprising mixed oxyalkyl units | |
| BRPI0617946A2 (en) | α-ethoxysilane modified polymer, process for preparation and use thereof, hardening composition as well as use thereof | |
| EP2076568B1 (en) | Compositions consisting of partially silyl-terminated polymers | |
| DE10139132A1 (en) | Alkoxy crosslinking one-component moisture-curing compositions | |
| JP2013510200A (en) | Adhesives and sealants containing esters based on 2-propylheptanol | |
| DE60028117T2 (en) | Moisture-curable one-component composition | |
| EP2468759A1 (en) | Secondary Aminosilanes | |
| EP3475374B1 (en) | One-component composition based on alkoxysilanes and method of joining or encapsulating components using the composition | |
| DE10351804A1 (en) | Process for increasing the elasticity of moisture-cured elastomers | |
| EP2222751B1 (en) | Curable compositions consisting of silanes with three hydrolysable groups | |
| KR100355646B1 (en) | Novel polyisocyanate and process for producing the same | |
| KR20020013437A (en) | Adhesion promoter for a primer and primer composition | |
| DE4209159A1 (en) | One component heat-pre:curable and moisture-hardenable compsns. - contain urethane] prepolymer with free isocyanate gps., vinyl] polymer contg. siloxy gps., and partly inactivated poly:isocyanate | |
| DE10134634A1 (en) | RTV-1 silicone rubber mixtures crosslinking via alkoxy groups | |
| DE10353663A1 (en) | Polyurethane compositions with NCO and Silylreaktivität | |
| DE10348555A1 (en) | Storage-stable, silyl-bearing polyurethane | |
| DE102010062186A1 (en) | Two-component curable composition | |
| US10072113B2 (en) | Composition, curable composition, production method therefor, and cured product | |
| JP4988083B2 (en) | Room temperature curable composition | |
| JP4125413B2 (en) | Urethane prepolymer composition and one-component urethane sealant | |
| JP2005171159A (en) | One pack type curable resin composition | |
| WO2015012259A1 (en) | Reaction accelerator, urethane compound using same, thiourethane compound, and production method for amide compound or urea compound |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| OP8 | Request for examination as to paragraph 44 patent law | ||
| 8131 | Rejection |