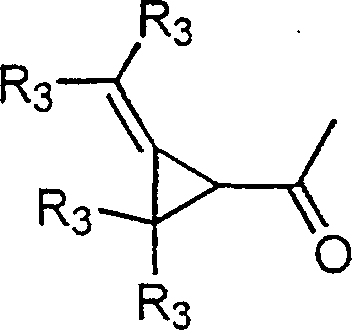
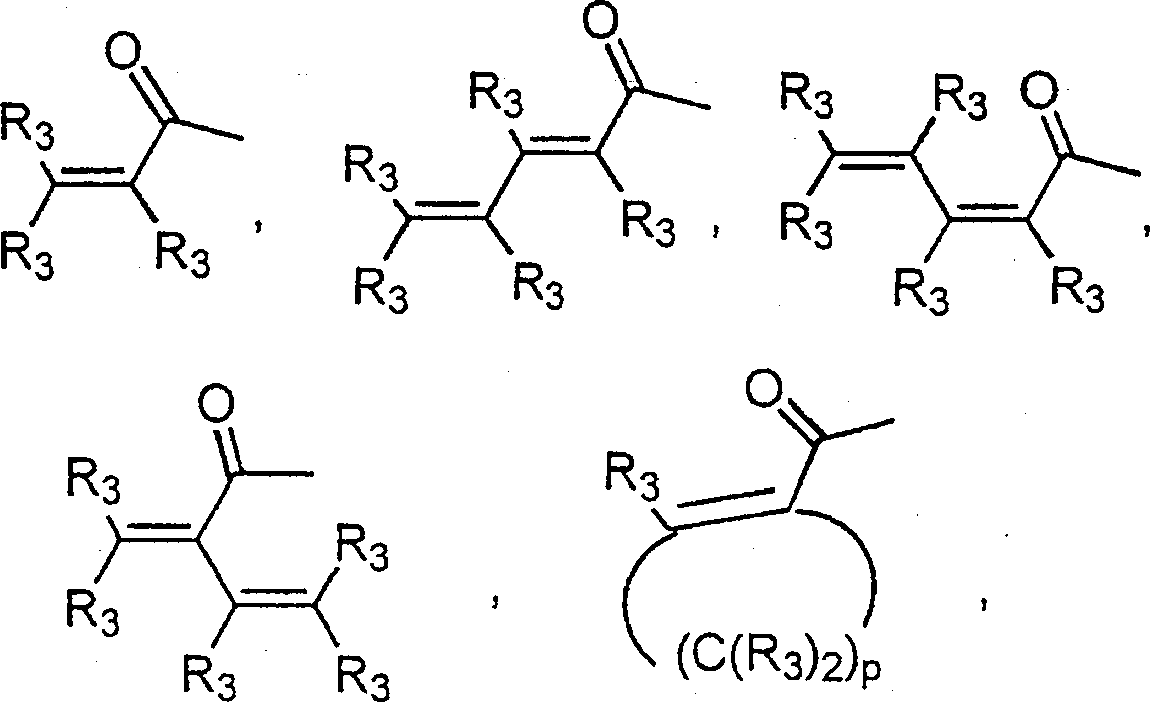
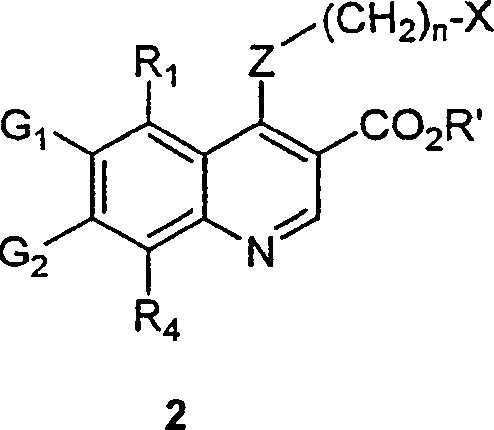
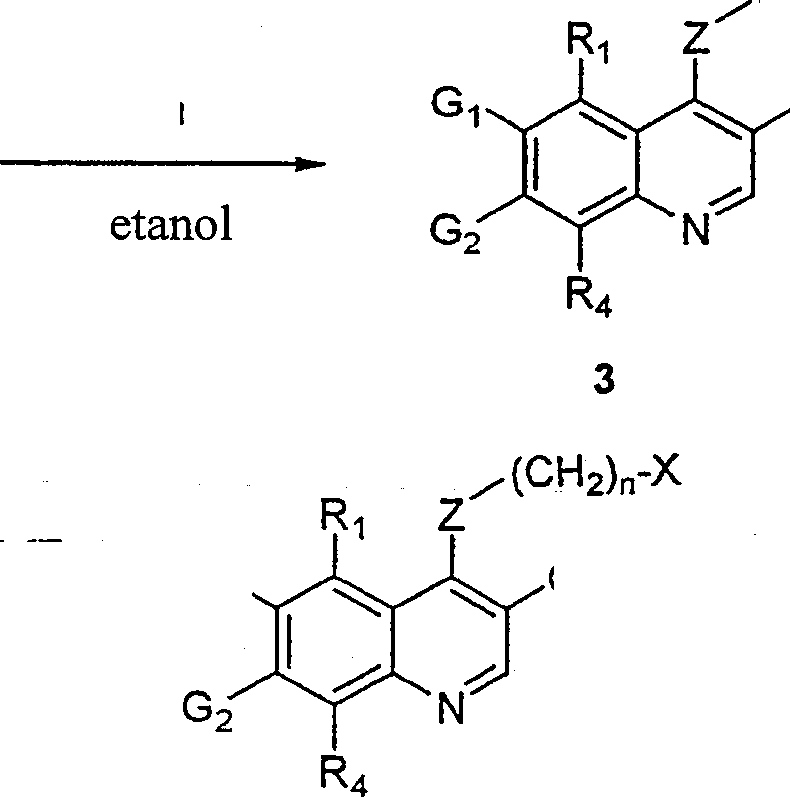
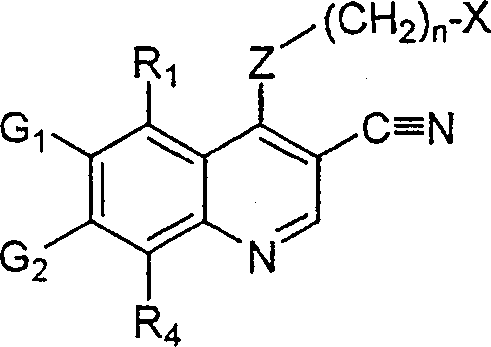
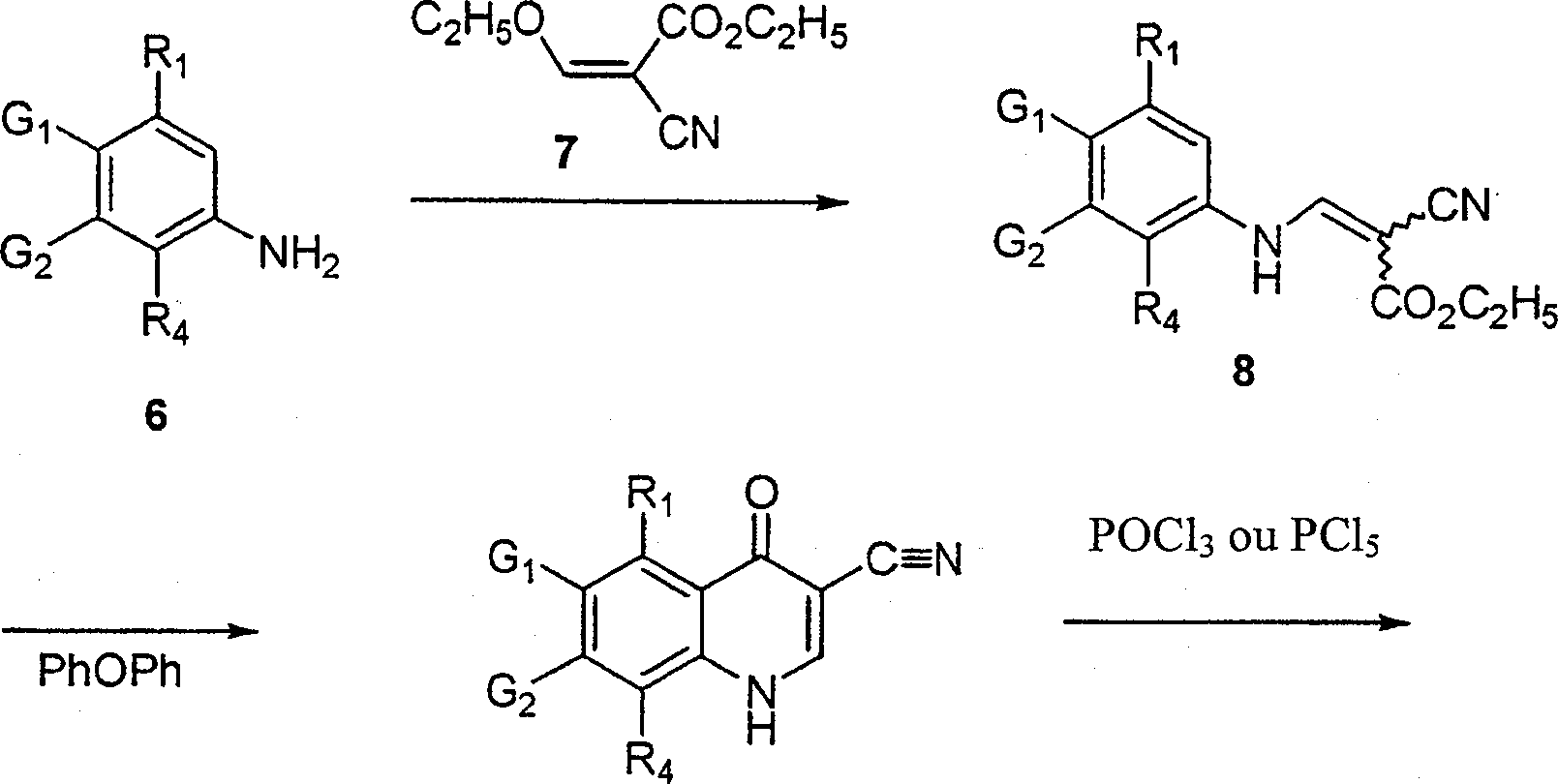
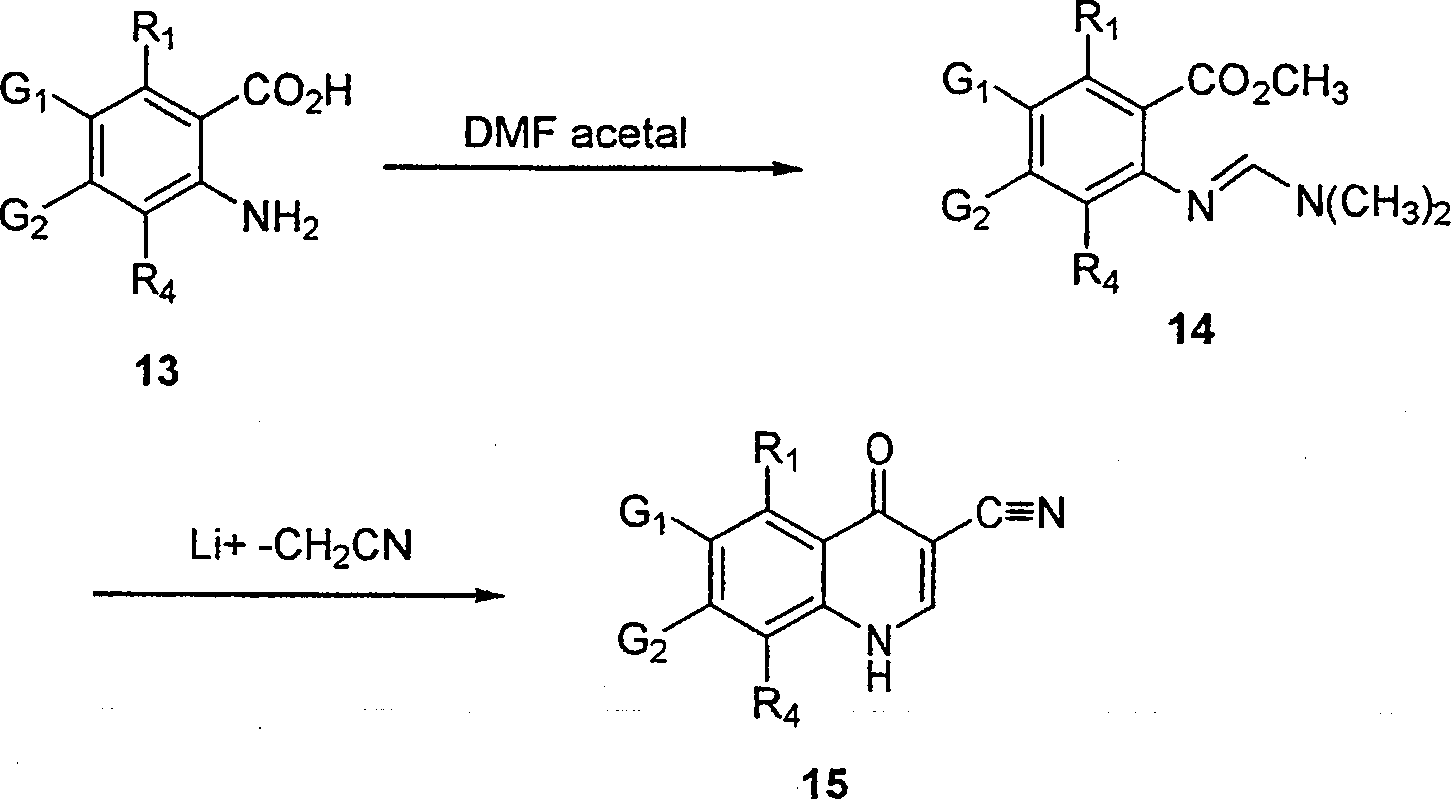
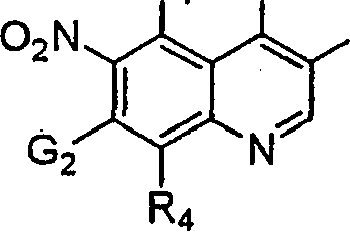
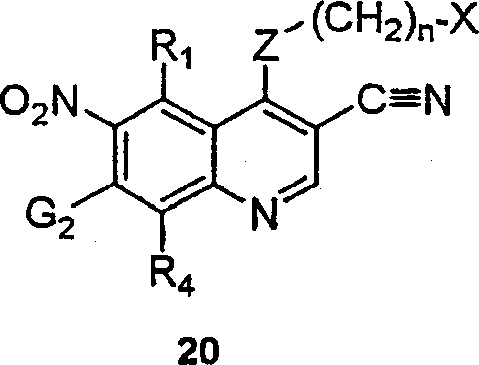
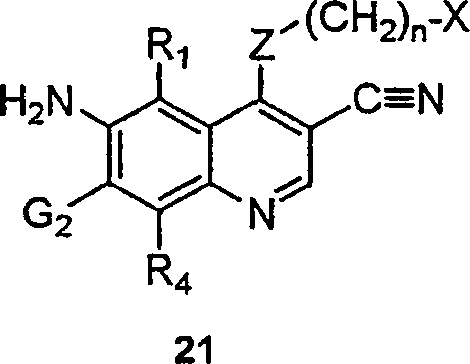
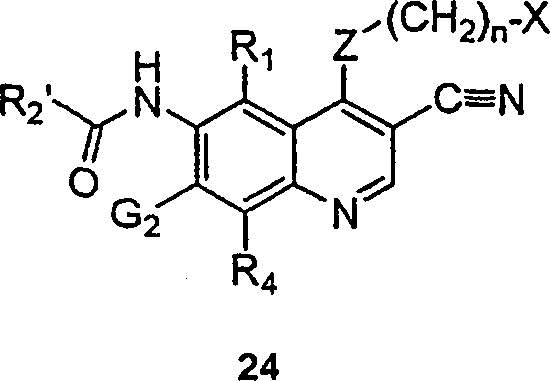
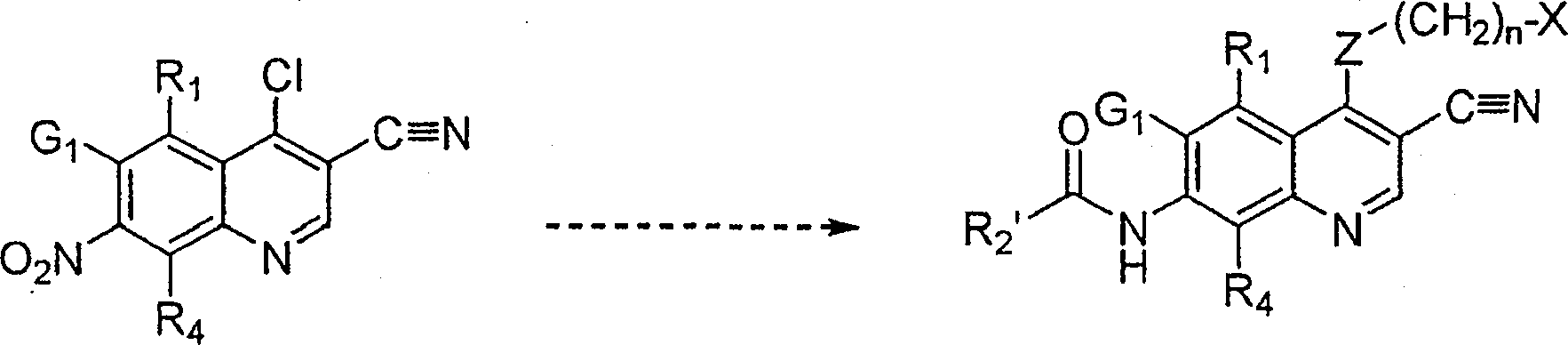
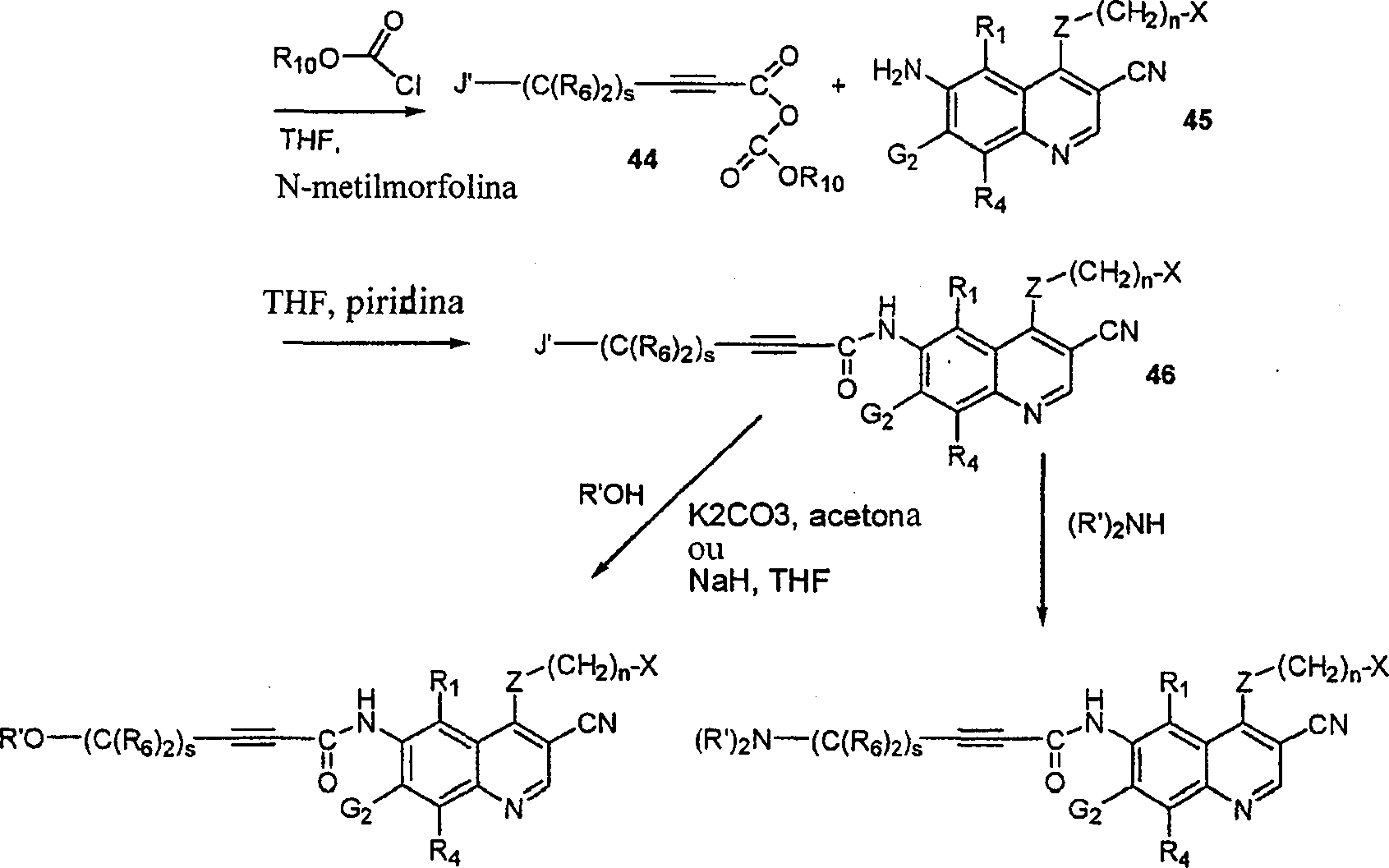
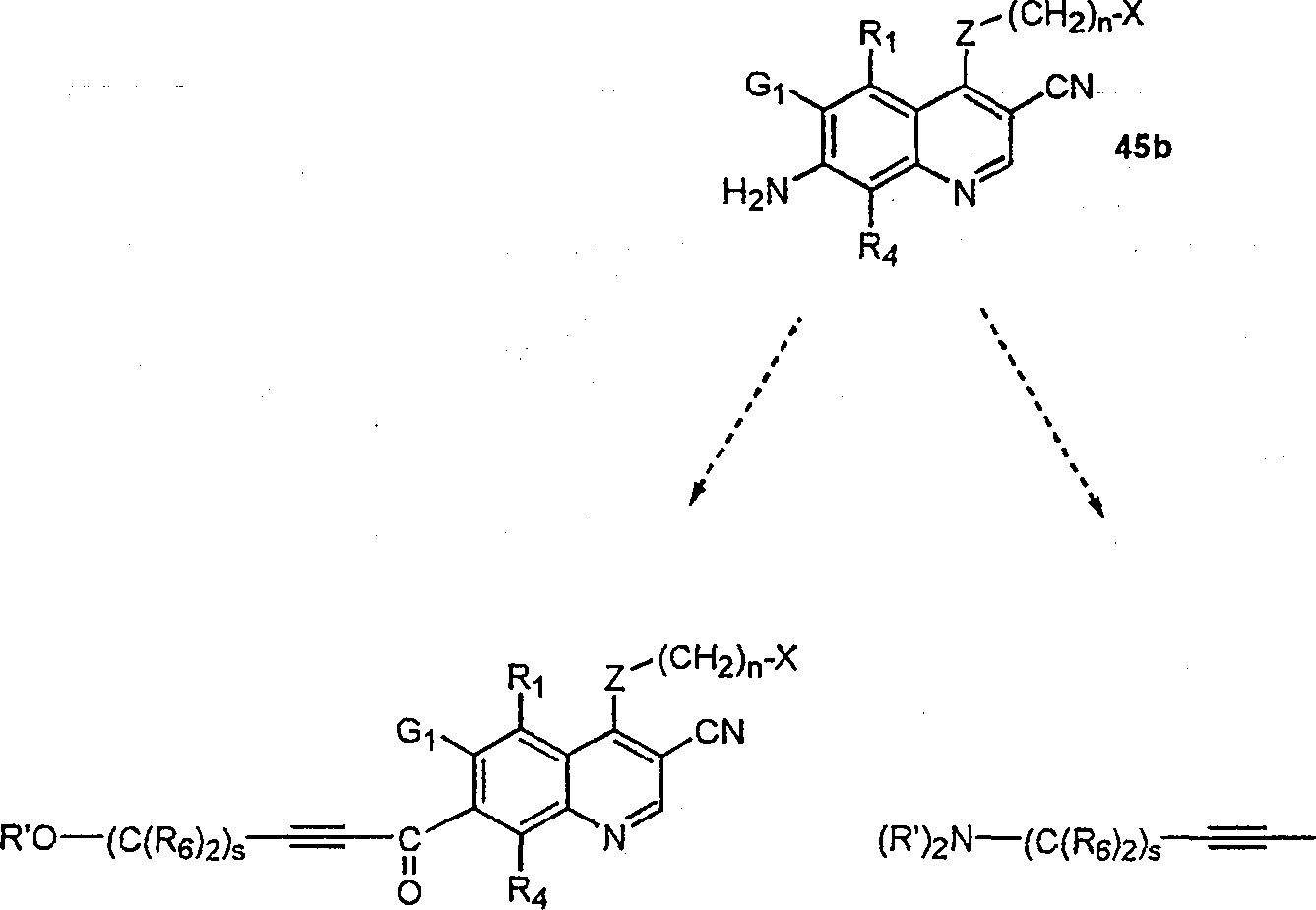
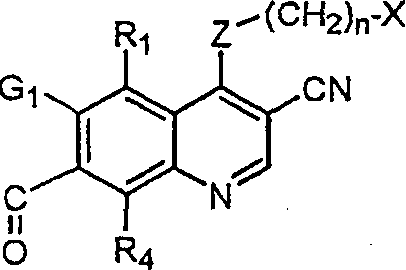
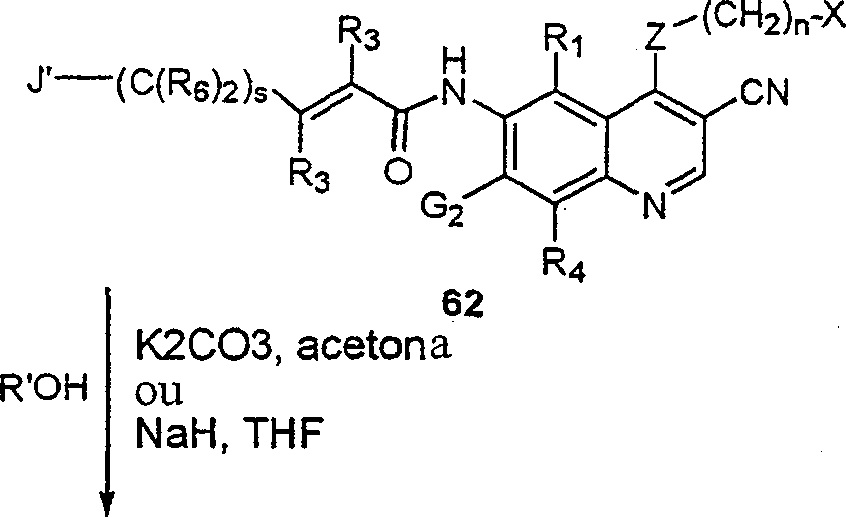
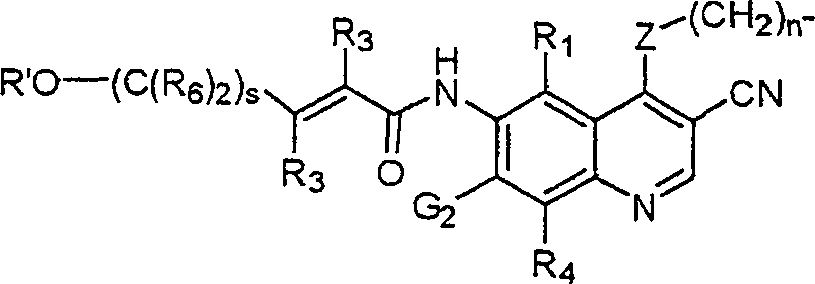
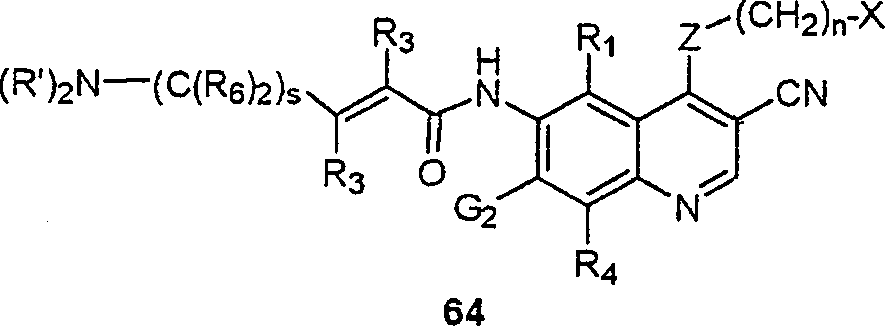
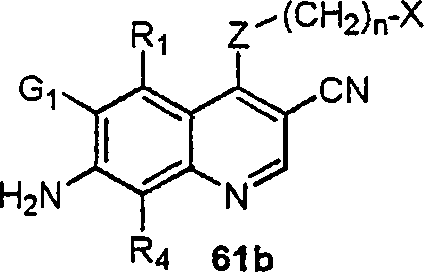
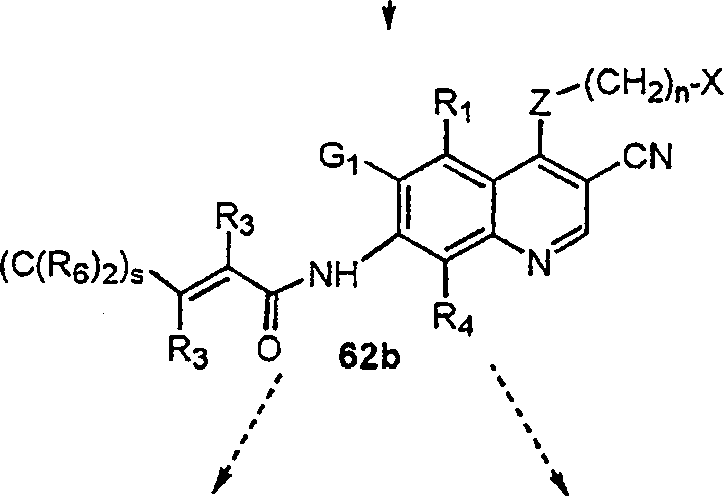
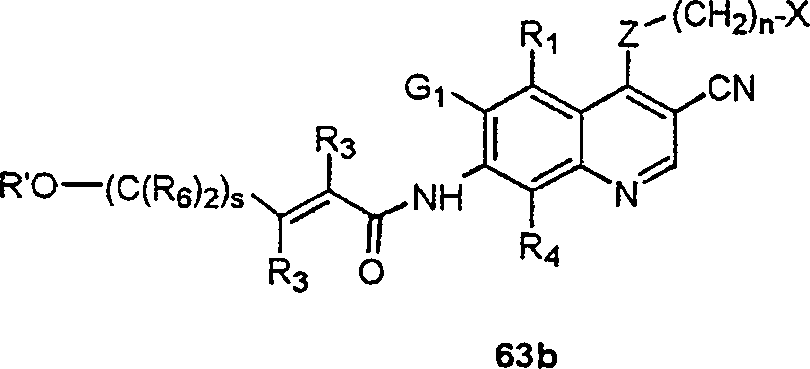
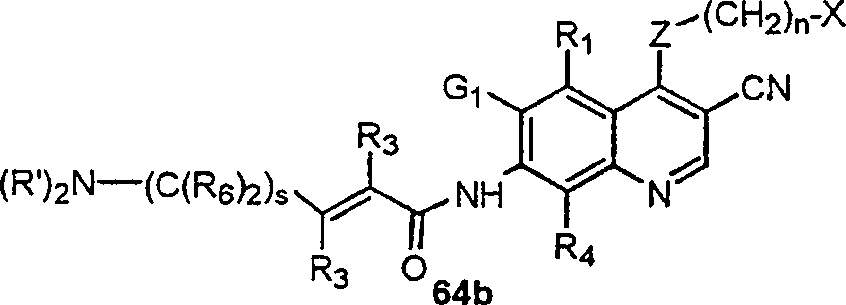
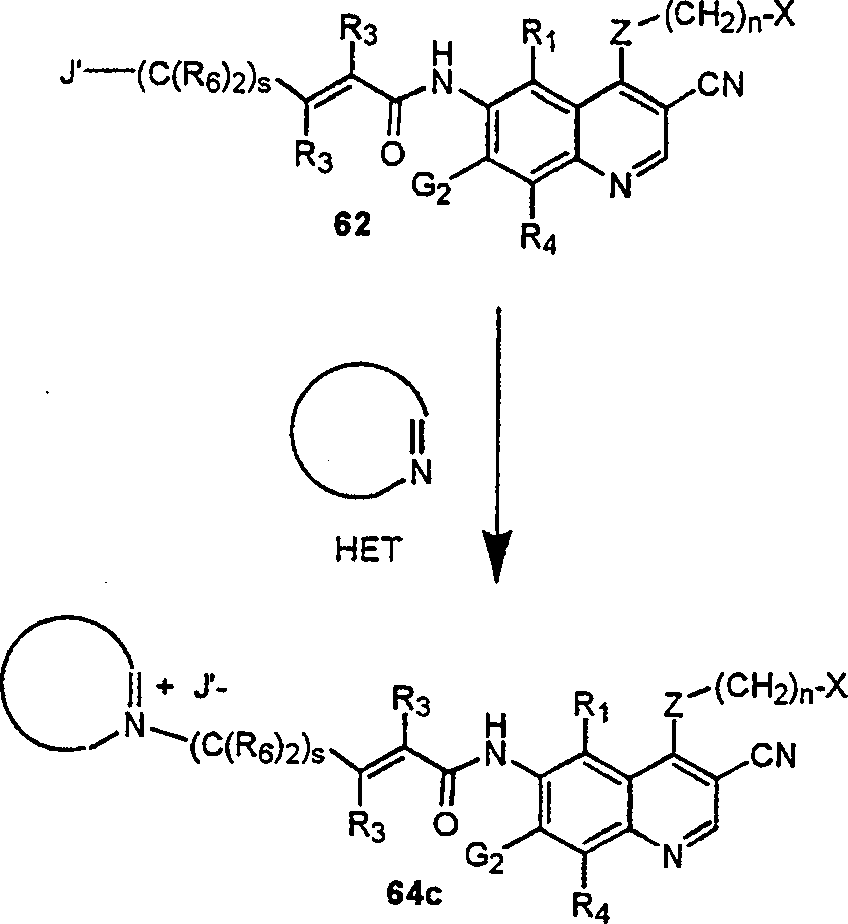
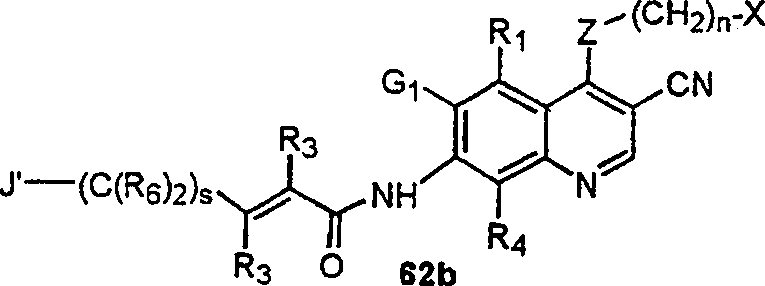
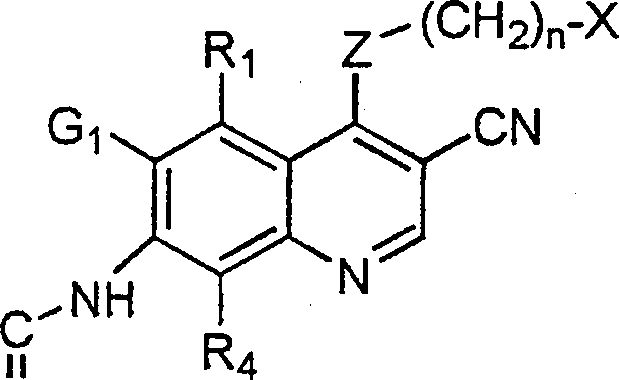
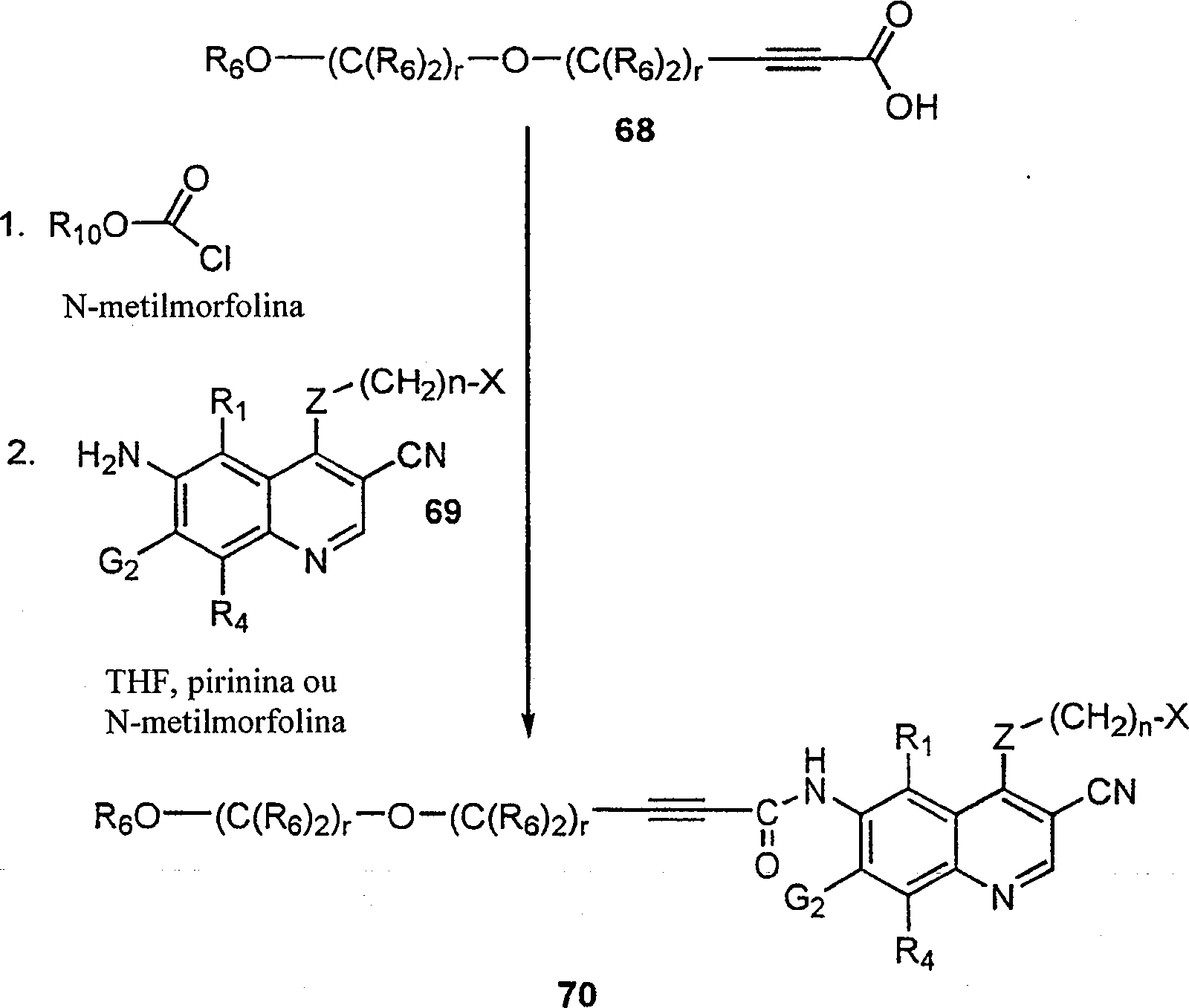
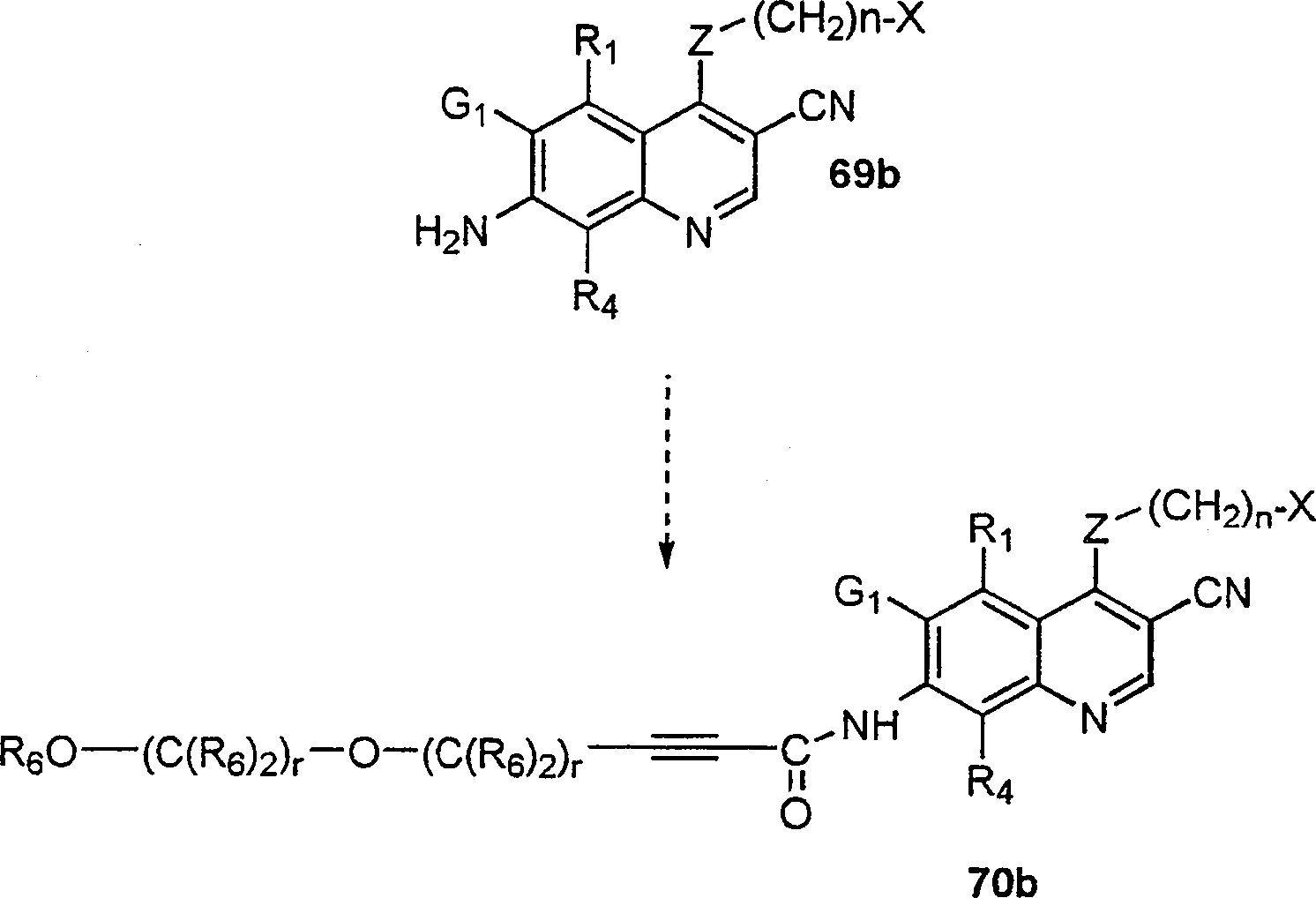
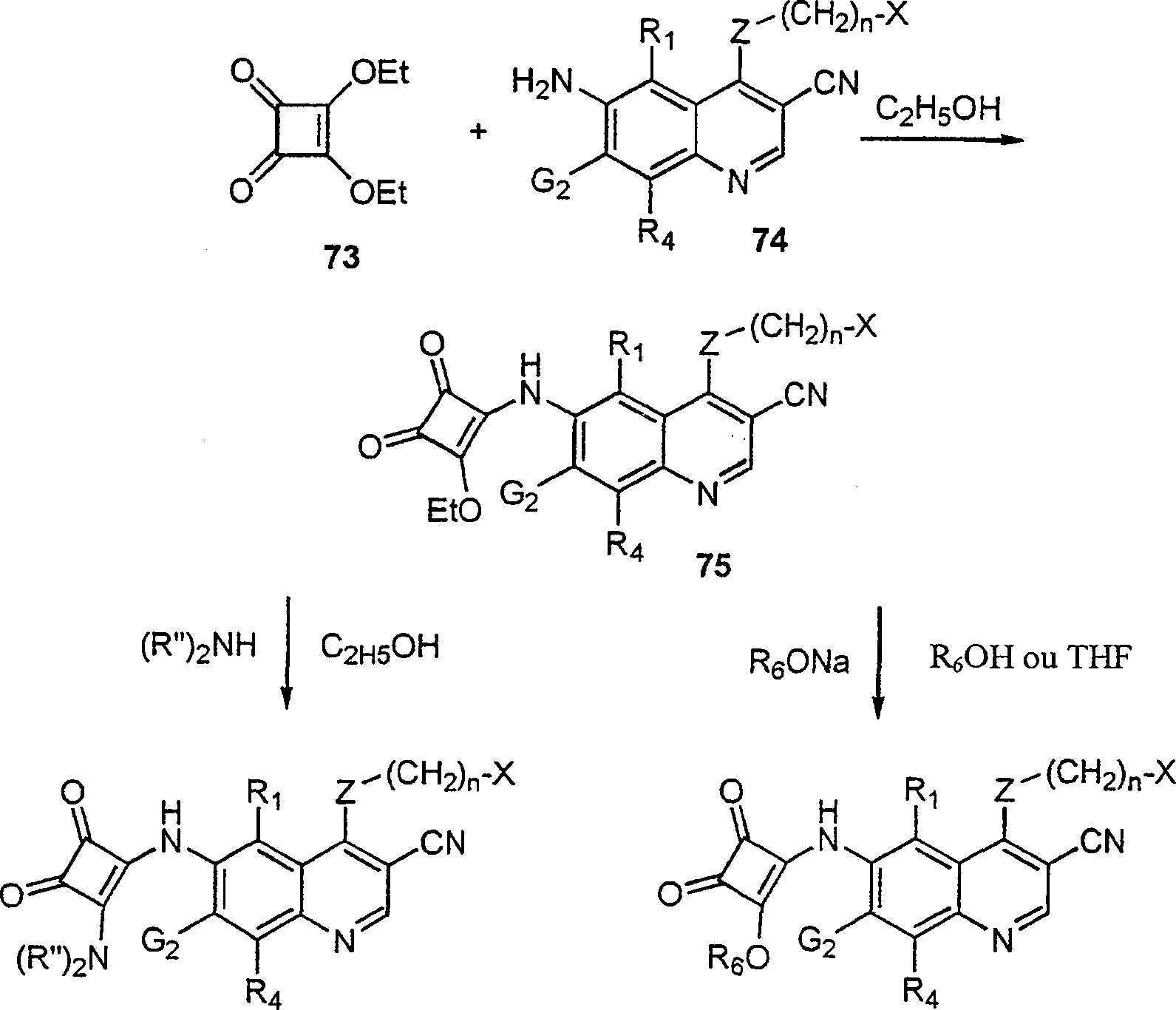
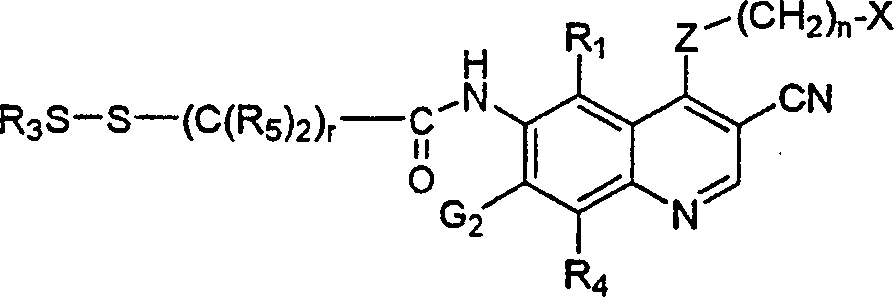
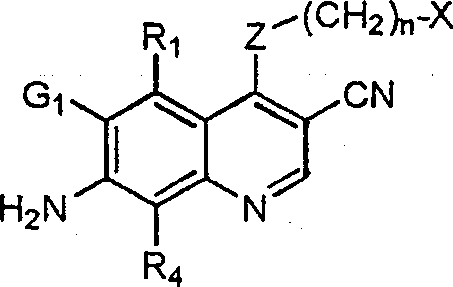
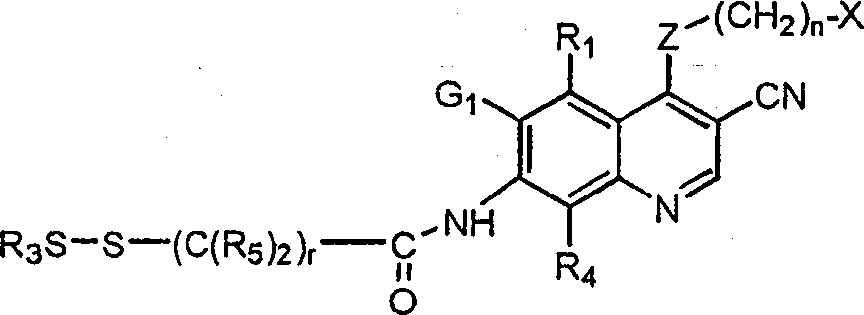
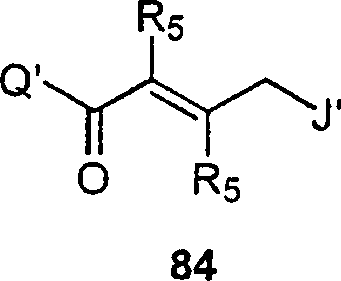
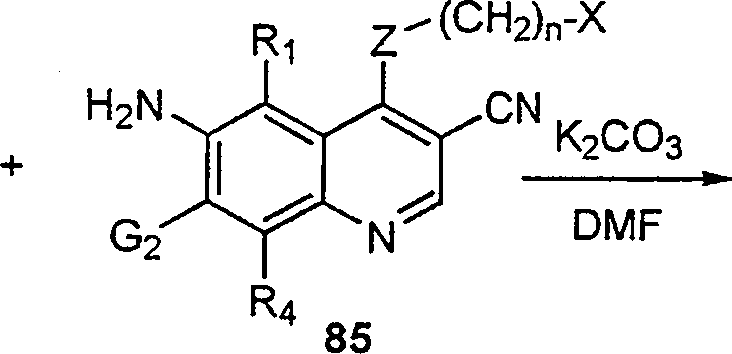
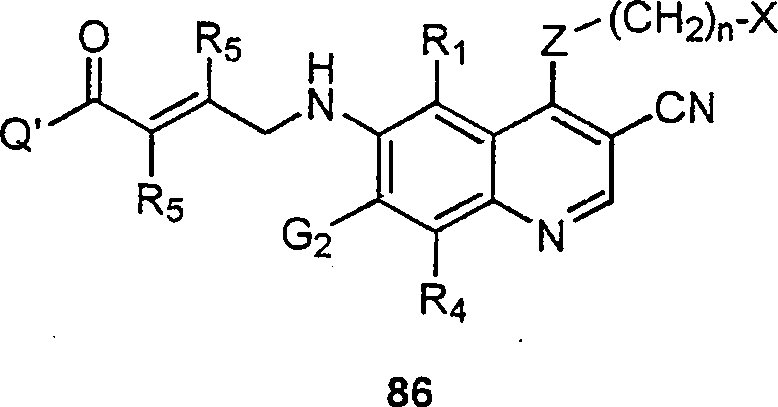
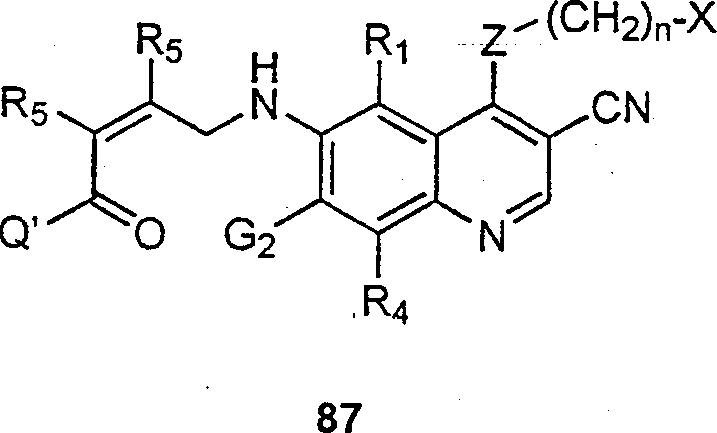
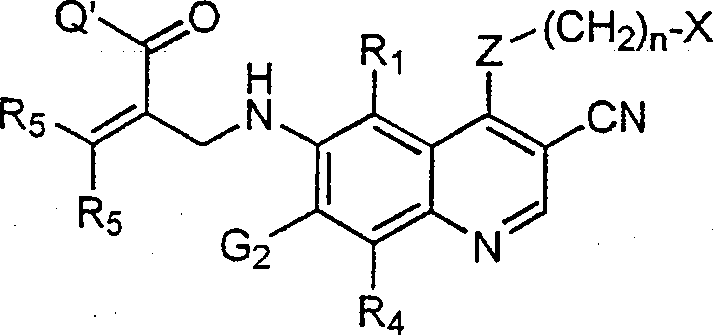
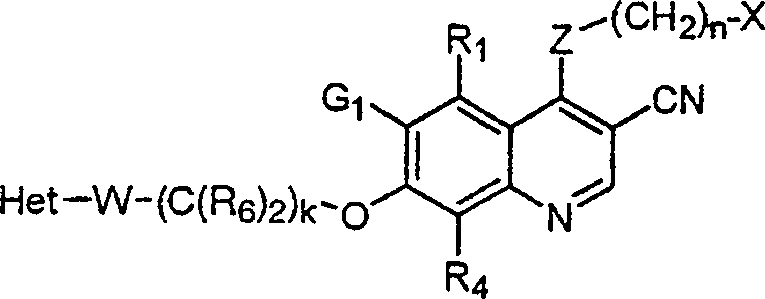
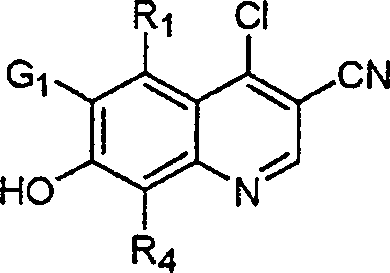
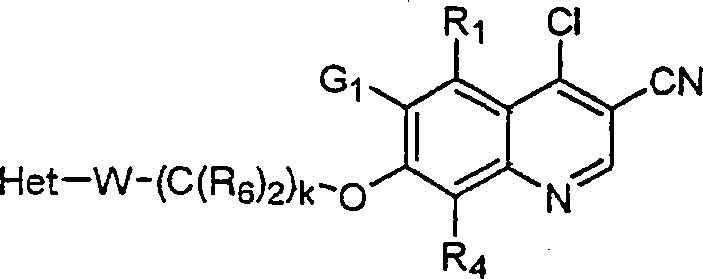
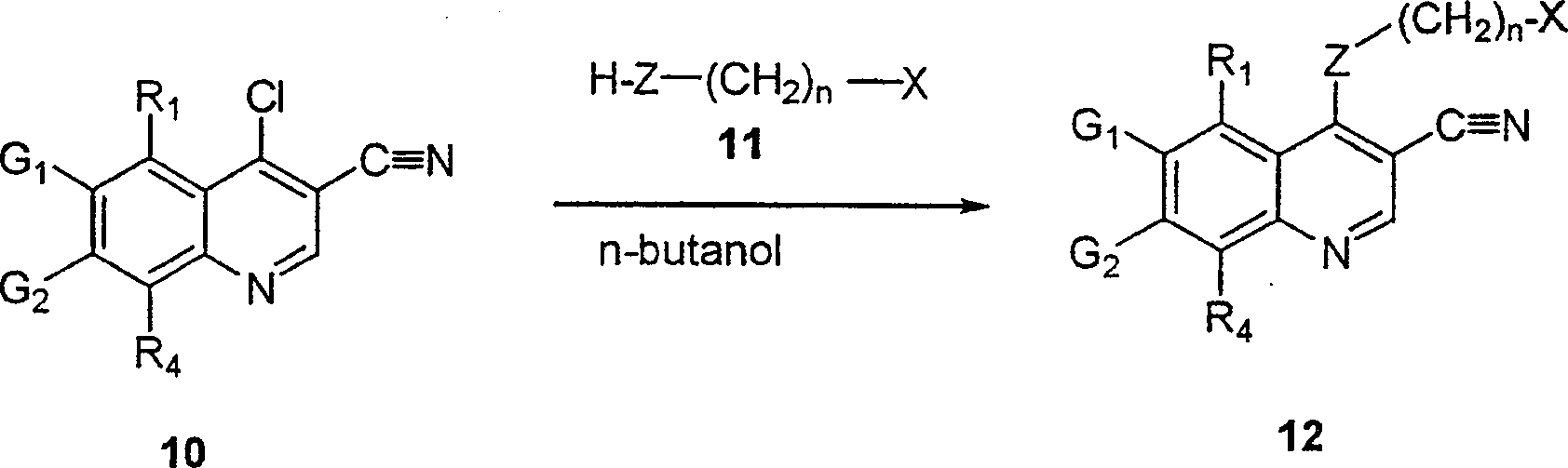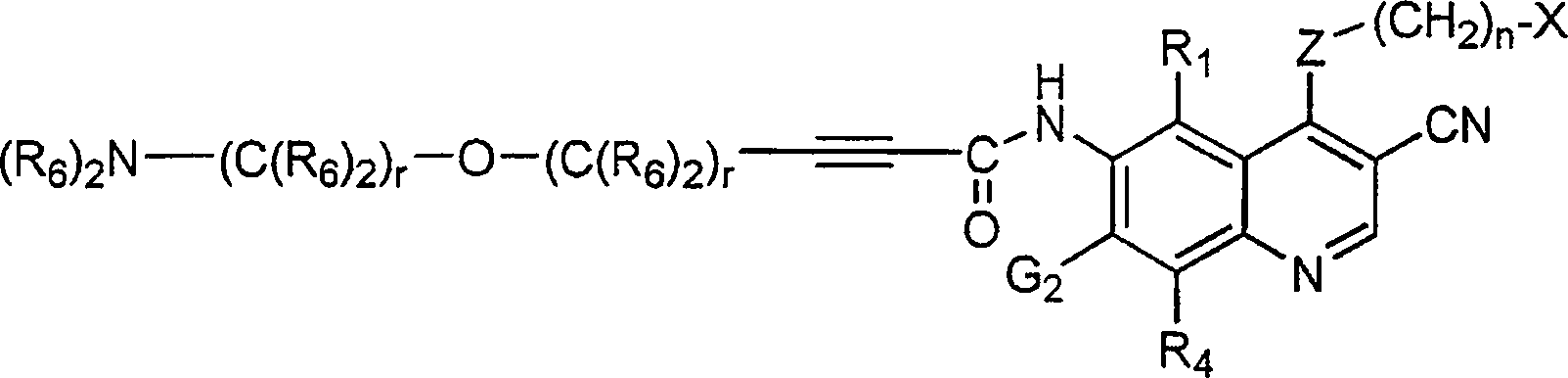BRPI9917841B1 - compostos 3-ciano quinolina substituídos e composições compreendendo os mesmos - Google Patents
compostos 3-ciano quinolina substituídos e composições compreendendo os mesmos Download PDFInfo
- Publication number
- BRPI9917841B1 BRPI9917841B1 BRPI9917841A BRPI9917841A BRPI9917841B1 BR PI9917841 B1 BRPI9917841 B1 BR PI9917841B1 BR PI9917841 A BRPI9917841 A BR PI9917841A BR PI9917841 A BRPI9917841 A BR PI9917841A BR PI9917841 B1 BRPI9917841 B1 BR PI9917841B1
- Authority
- BR
- Brazil
- Prior art keywords
- carbon atoms
- quinoline
- carbonitrile
- mixture
- mmol
- Prior art date
Links
- 239000000203 mixture Chemical class 0.000 title description 200
- QZZYYBQGTSGDPP-UHFFFAOYSA-N quinoline-3-carbonitrile Chemical class C1=CC=CC2=CC(C#N)=CN=C21 QZZYYBQGTSGDPP-UHFFFAOYSA-N 0.000 title description 21
- 150000001875 compounds Chemical class 0.000 claims abstract description 193
- 150000003839 salts Chemical class 0.000 claims abstract description 25
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 4
- 125000004432 carbon atom Chemical group C* 0.000 claims description 188
- -1 lH-indazole Chemical compound 0.000 claims description 161
- YLQBMQCUIZJEEH-UHFFFAOYSA-N Furan Chemical compound C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 claims description 100
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 claims description 42
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 35
- 229910052799 carbon Inorganic materials 0.000 claims description 31
- 125000001424 substituent group Chemical group 0.000 claims description 24
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 claims description 23
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 22
- 125000000217 alkyl group Chemical group 0.000 claims description 21
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 claims description 21
- 229910052739 hydrogen Inorganic materials 0.000 claims description 17
- 125000001072 heteroaryl group Chemical group 0.000 claims description 16
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 16
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 16
- 125000003545 alkoxy group Chemical group 0.000 claims description 15
- 239000001257 hydrogen Substances 0.000 claims description 15
- 150000003254 radicals Chemical group 0.000 claims description 14
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 claims description 13
- 229910052736 halogen Inorganic materials 0.000 claims description 12
- 150000002367 halogens Chemical group 0.000 claims description 12
- 125000005042 acyloxymethyl group Chemical group 0.000 claims description 11
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 11
- LBUJPTNKIBCYBY-UHFFFAOYSA-N tetrahydroquinoline Natural products C1=CC=C2CCCNC2=C1 LBUJPTNKIBCYBY-UHFFFAOYSA-N 0.000 claims description 11
- 125000004429 atom Chemical group 0.000 claims description 10
- XSCHRSMBECNVNS-UHFFFAOYSA-N quinoxaline Chemical compound N1=CC=NC2=CC=CC=C21 XSCHRSMBECNVNS-UHFFFAOYSA-N 0.000 claims description 10
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 claims description 10
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical compound C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 claims description 9
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 claims description 8
- 125000004181 carboxyalkyl group Chemical group 0.000 claims description 8
- 125000004435 hydrogen atom Chemical class [H]* 0.000 claims description 8
- LISFMEBWQUVKPJ-UHFFFAOYSA-N quinolin-2-ol Chemical compound C1=CC=C2NC(=O)C=CC2=C1 LISFMEBWQUVKPJ-UHFFFAOYSA-N 0.000 claims description 7
- FTNJQNQLEGKTGD-UHFFFAOYSA-N 1,3-benzodioxole Chemical compound C1=CC=C2OCOC2=C1 FTNJQNQLEGKTGD-UHFFFAOYSA-N 0.000 claims description 6
- WNZQDUSMALZDQF-UHFFFAOYSA-N 2-benzofuran-1(3H)-one Chemical compound C1=CC=C2C(=O)OCC2=C1 WNZQDUSMALZDQF-UHFFFAOYSA-N 0.000 claims description 6
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 claims description 6
- UFWIBTONFRDIAS-UHFFFAOYSA-N Naphthalene Chemical compound C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 claims description 6
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 claims description 6
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 claims description 6
- 125000004423 acyloxy group Chemical group 0.000 claims description 6
- QNXSIUBBGPHDDE-UHFFFAOYSA-N alpha-indanone Natural products C1=CC=C2C(=O)CCC2=C1 QNXSIUBBGPHDDE-UHFFFAOYSA-N 0.000 claims description 6
- IOJUPLGTWVMSFF-UHFFFAOYSA-N benzothiazole Chemical compound C1=CC=C2SC=NC2=C1 IOJUPLGTWVMSFF-UHFFFAOYSA-N 0.000 claims description 6
- PQNFLJBBNBOBRQ-UHFFFAOYSA-N indane Chemical compound C1=CC=C2CCCC2=C1 PQNFLJBBNBOBRQ-UHFFFAOYSA-N 0.000 claims description 6
- AWJUIBRHMBBTKR-UHFFFAOYSA-N isoquinoline Chemical compound C1=NC=CC2=CC=CC=C21 AWJUIBRHMBBTKR-UHFFFAOYSA-N 0.000 claims description 6
- XKJCHHZQLQNZHY-UHFFFAOYSA-N phthalimide Chemical compound C1=CC=C2C(=O)NC(=O)C2=C1 XKJCHHZQLQNZHY-UHFFFAOYSA-N 0.000 claims description 6
- CXWXQJXEFPUFDZ-UHFFFAOYSA-N tetralin Chemical compound C1=CC=C2CCCCC2=C1 CXWXQJXEFPUFDZ-UHFFFAOYSA-N 0.000 claims description 6
- FLBAYUMRQUHISI-UHFFFAOYSA-N 1,8-naphthyridine Chemical compound N1=CC=CC2=CC=CN=C21 FLBAYUMRQUHISI-UHFFFAOYSA-N 0.000 claims description 5
- BAXOFTOLAUCFNW-UHFFFAOYSA-N 1H-indazole Chemical compound C1=CC=C2C=NNC2=C1 BAXOFTOLAUCFNW-UHFFFAOYSA-N 0.000 claims description 5
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims description 5
- OGYGFUAIIOPWQD-UHFFFAOYSA-N 1,3-thiazolidine Chemical compound C1CSCN1 OGYGFUAIIOPWQD-UHFFFAOYSA-N 0.000 claims description 4
- NSPMIYGKQJPBQR-UHFFFAOYSA-N 4H-1,2,4-triazole Chemical compound C=1N=CNN=1 NSPMIYGKQJPBQR-UHFFFAOYSA-N 0.000 claims description 4
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical compound C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 claims description 4
- LFSXCDWNBUNEEM-UHFFFAOYSA-N phthalazine Chemical compound C1=NN=CC2=CC=CC=C21 LFSXCDWNBUNEEM-UHFFFAOYSA-N 0.000 claims description 4
- JWVCLYRUEFBMGU-UHFFFAOYSA-N quinazoline Chemical compound N1=CN=CC2=CC=CC=C21 JWVCLYRUEFBMGU-UHFFFAOYSA-N 0.000 claims description 4
- 229930192474 thiophene Natural products 0.000 claims description 4
- BCMCBBGGLRIHSE-UHFFFAOYSA-N 1,3-benzoxazole Chemical compound C1=CC=C2OC=NC2=C1 BCMCBBGGLRIHSE-UHFFFAOYSA-N 0.000 claims description 3
- MXBVNILGVJVVMH-UHFFFAOYSA-N 1,7-naphthyridine Chemical compound C1=NC=CC2=CC=CN=C21 MXBVNILGVJVVMH-UHFFFAOYSA-N 0.000 claims description 3
- NLHOVYMVGLRDPF-UHFFFAOYSA-N 1-oxidoquinazolin-1-ium Chemical compound C1=CC=C2[N+]([O-])=CN=CC2=C1 NLHOVYMVGLRDPF-UHFFFAOYSA-N 0.000 claims description 3
- OARGFWQSVACNCO-UHFFFAOYSA-N 1-oxidoquinoxalin-1-ium Chemical compound C1=CC=C2[N+]([O-])=CC=NC2=C1 OARGFWQSVACNCO-UHFFFAOYSA-N 0.000 claims description 3
- HYZJCKYKOHLVJF-UHFFFAOYSA-N 1H-benzimidazole Chemical compound C1=CC=C2NC=NC2=C1 HYZJCKYKOHLVJF-UHFFFAOYSA-N 0.000 claims description 3
- TXJUTRJFNRYTHH-UHFFFAOYSA-N 1h-3,1-benzoxazine-2,4-dione Chemical compound C1=CC=C2C(=O)OC(=O)NC2=C1 TXJUTRJFNRYTHH-UHFFFAOYSA-N 0.000 claims description 3
- YEDUAINPPJYDJZ-UHFFFAOYSA-N 2-hydroxybenzothiazole Chemical compound C1=CC=C2SC(O)=NC2=C1 YEDUAINPPJYDJZ-UHFFFAOYSA-N 0.000 claims description 3
- GOLORTLGFDVFDW-UHFFFAOYSA-N 3-(1h-benzimidazol-2-yl)-7-(diethylamino)chromen-2-one Chemical compound C1=CC=C2NC(C3=CC4=CC=C(C=C4OC3=O)N(CC)CC)=NC2=C1 GOLORTLGFDVFDW-UHFFFAOYSA-N 0.000 claims description 3
- RZIAABRFQASVSW-UHFFFAOYSA-N Isoquinoline N-oxide Chemical compound C1=CC=CC2=C[N+]([O-])=CC=C21 RZIAABRFQASVSW-UHFFFAOYSA-N 0.000 claims description 3
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical compound C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 claims description 3
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 claims description 3
- GIIWGCBLYNDKBO-UHFFFAOYSA-N Quinoline 1-oxide Chemical compound C1=CC=C2[N+]([O-])=CC=CC2=C1 GIIWGCBLYNDKBO-UHFFFAOYSA-N 0.000 claims description 3
- RFRXIWQYSOIBDI-UHFFFAOYSA-N benzarone Chemical compound CCC=1OC2=CC=CC=C2C=1C(=O)C1=CC=C(O)C=C1 RFRXIWQYSOIBDI-UHFFFAOYSA-N 0.000 claims description 3
- BNBQRQQYDMDJAH-UHFFFAOYSA-N benzodioxan Chemical compound C1=CC=C2OCCOC2=C1 BNBQRQQYDMDJAH-UHFFFAOYSA-N 0.000 claims description 3
- QRUDEWIWKLJBPS-UHFFFAOYSA-N benzotriazole Chemical compound C1=CC=C2N[N][N]C2=C1 QRUDEWIWKLJBPS-UHFFFAOYSA-N 0.000 claims description 3
- 239000012964 benzotriazole Substances 0.000 claims description 3
- OTAFHZMPRISVEM-UHFFFAOYSA-N chromone Chemical compound C1=CC=C2C(=O)C=COC2=C1 OTAFHZMPRISVEM-UHFFFAOYSA-N 0.000 claims description 3
- WCZVZNOTHYJIEI-UHFFFAOYSA-N cinnoline Chemical compound N1=NC=CC2=CC=CC=C21 WCZVZNOTHYJIEI-UHFFFAOYSA-N 0.000 claims description 3
- PZOUSPYUWWUPPK-UHFFFAOYSA-N indole Natural products CC1=CC=CC2=C1C=CN2 PZOUSPYUWWUPPK-UHFFFAOYSA-N 0.000 claims description 3
- RKJUIXBNRJVNHR-UHFFFAOYSA-N indolenine Natural products C1=CC=C2CC=NC2=C1 RKJUIXBNRJVNHR-UHFFFAOYSA-N 0.000 claims description 3
- JYGFTBXVXVMTGB-UHFFFAOYSA-N indolin-2-one Chemical compound C1=CC=C2NC(=O)CC2=C1 JYGFTBXVXVMTGB-UHFFFAOYSA-N 0.000 claims description 3
- LPAGFVYQRIESJQ-UHFFFAOYSA-N indoline Chemical compound C1=CC=C2NCCC2=C1 LPAGFVYQRIESJQ-UHFFFAOYSA-N 0.000 claims description 3
- VDBNYAPERZTOOF-UHFFFAOYSA-N isoquinolin-1(2H)-one Chemical compound C1=CC=C2C(=O)NC=CC2=C1 VDBNYAPERZTOOF-UHFFFAOYSA-N 0.000 claims description 3
- CPNGPNLZQNNVQM-UHFFFAOYSA-N pteridine Chemical compound N1=CN=CC2=NC=CN=C21 CPNGPNLZQNNVQM-UHFFFAOYSA-N 0.000 claims description 3
- OHZYAOYVLLHTGW-UHFFFAOYSA-N pyrido[3,2-c]pyridazine Chemical compound C1=CN=NC2=CC=CN=C21 OHZYAOYVLLHTGW-UHFFFAOYSA-N 0.000 claims description 3
- TYLGVQVJCVFREB-UHFFFAOYSA-N pyrido[3,4-b]pyrazine Chemical compound C1=NC=CC2=NC=CN=C21 TYLGVQVJCVFREB-UHFFFAOYSA-N 0.000 claims description 3
- HLVUTYRQJVXXMA-AATRIKPKSA-N (e)-n-[4-(3-chloro-4-pyridin-4-yloxyanilino)-3-cyano-7-ethoxyquinolin-6-yl]-4-(dimethylamino)but-2-enamide Chemical compound C=12C=C(NC(=O)\C=C\CN(C)C)C(OCC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1OC1=CC=NC=C1 HLVUTYRQJVXXMA-AATRIKPKSA-N 0.000 claims description 2
- LRANPJDWHYRCER-UHFFFAOYSA-N 1,2-diazepine Chemical compound N1C=CC=CC=N1 LRANPJDWHYRCER-UHFFFAOYSA-N 0.000 claims description 2
- AZHGGDCFQPMANU-UHFFFAOYSA-N 3,4-dihydro-1h-1,4-benzodiazepine-2,5-dione Chemical compound N1C(=O)CNC(=O)C2=CC=CC=C21 AZHGGDCFQPMANU-UHFFFAOYSA-N 0.000 claims description 2
- 239000003937 drug carrier Substances 0.000 claims description 2
- KGLPWQKSKUVKMJ-UHFFFAOYSA-N 2,3-dihydrophthalazine-1,4-dione Chemical compound C1=CC=C2C(=O)NNC(=O)C2=C1 KGLPWQKSKUVKMJ-UHFFFAOYSA-N 0.000 claims 1
- 238000011282 treatment Methods 0.000 abstract description 32
- 208000030761 polycystic kidney disease Diseases 0.000 abstract description 5
- 239000002246 antineoplastic agent Substances 0.000 abstract description 4
- 229940034982 antineoplastic agent Drugs 0.000 abstract description 2
- 239000007787 solid Substances 0.000 description 235
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 184
- 239000000243 solution Substances 0.000 description 171
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical class CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 169
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 146
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 141
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 133
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 123
- 238000001819 mass spectrum Methods 0.000 description 119
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 96
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 85
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 84
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 80
- 239000000047 product Substances 0.000 description 78
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 72
- 239000002904 solvent Substances 0.000 description 71
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 64
- AOJFQRQNPXYVLM-UHFFFAOYSA-N pyridin-1-ium;chloride Chemical compound [Cl-].C1=CC=[NH+]C=C1 AOJFQRQNPXYVLM-UHFFFAOYSA-N 0.000 description 64
- 238000000034 method Methods 0.000 description 63
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 61
- 238000006243 chemical reaction Methods 0.000 description 59
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 52
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 48
- 239000002253 acid Substances 0.000 description 45
- 229910052757 nitrogen Inorganic materials 0.000 description 45
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 40
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 40
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 37
- 239000012442 inert solvent Substances 0.000 description 37
- 206010028980 Neoplasm Diseases 0.000 description 35
- FVAUCKIRQBBSSJ-UHFFFAOYSA-M sodium iodide Chemical compound [Na+].[I-] FVAUCKIRQBBSSJ-UHFFFAOYSA-M 0.000 description 34
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 33
- 238000010992 reflux Methods 0.000 description 32
- 150000008064 anhydrides Chemical class 0.000 description 30
- 229910000029 sodium carbonate Inorganic materials 0.000 description 30
- ZNQVEEAIQZEUHB-UHFFFAOYSA-N 2-ethoxyethanol Chemical compound CCOCCO ZNQVEEAIQZEUHB-UHFFFAOYSA-N 0.000 description 29
- XHXFXVLFKHQFAL-UHFFFAOYSA-N phosphoryl trichloride Chemical compound ClP(Cl)(Cl)=O XHXFXVLFKHQFAL-UHFFFAOYSA-N 0.000 description 29
- 238000003756 stirring Methods 0.000 description 28
- SJRJJKPEHAURKC-UHFFFAOYSA-N N-Methylmorpholine Chemical compound CN1CCOCC1 SJRJJKPEHAURKC-UHFFFAOYSA-N 0.000 description 27
- 230000008569 process Effects 0.000 description 27
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 26
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 26
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 26
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 25
- 239000000543 intermediate Substances 0.000 description 25
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 24
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 24
- 229960000583 acetic acid Drugs 0.000 description 24
- 239000005457 ice water Substances 0.000 description 24
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 24
- 239000000758 substrate Substances 0.000 description 24
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 23
- 239000003112 inhibitor Substances 0.000 description 22
- 108010055196 EphA2 Receptor Proteins 0.000 description 20
- 230000005764 inhibitory process Effects 0.000 description 20
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 20
- 235000019341 magnesium sulphate Nutrition 0.000 description 20
- 230000002829 reductive effect Effects 0.000 description 20
- 239000000706 filtrate Substances 0.000 description 19
- 238000010438 heat treatment Methods 0.000 description 19
- 125000006239 protecting group Chemical group 0.000 description 19
- 239000000523 sample Substances 0.000 description 19
- 239000000725 suspension Substances 0.000 description 19
- XNWFRZJHXBZDAG-UHFFFAOYSA-N 2-METHOXYETHANOL Chemical compound COCCO XNWFRZJHXBZDAG-UHFFFAOYSA-N 0.000 description 18
- HMLOMVBFQJAMCN-UHFFFAOYSA-N 4-chloro-6,7-dimethoxyquinoline-3-carbonitrile Chemical compound C1=C(C#N)C(Cl)=C2C=C(OC)C(OC)=CC2=N1 HMLOMVBFQJAMCN-UHFFFAOYSA-N 0.000 description 18
- 239000001569 carbon dioxide Substances 0.000 description 18
- 229910002092 carbon dioxide Inorganic materials 0.000 description 18
- 210000004027 cell Anatomy 0.000 description 18
- 239000000741 silica gel Substances 0.000 description 18
- 229910002027 silica gel Inorganic materials 0.000 description 18
- 229910000104 sodium hydride Inorganic materials 0.000 description 18
- 102100030340 Ephrin type-A receptor 2 Human genes 0.000 description 17
- 239000003153 chemical reaction reagent Substances 0.000 description 17
- 230000000694 effects Effects 0.000 description 17
- 230000012010 growth Effects 0.000 description 17
- HRMLDEXYPNWNSJ-UHFFFAOYSA-N 4-chloro-6,7-diethoxyquinoline-3-carbonitrile Chemical compound C1=C(C#N)C(Cl)=C2C=C(OCC)C(OCC)=CC2=N1 HRMLDEXYPNWNSJ-UHFFFAOYSA-N 0.000 description 16
- 150000001412 amines Chemical class 0.000 description 16
- 201000011510 cancer Diseases 0.000 description 16
- 238000001914 filtration Methods 0.000 description 16
- 239000012044 organic layer Substances 0.000 description 16
- 238000012360 testing method Methods 0.000 description 16
- 108010053099 Vascular Endothelial Growth Factor Receptor-2 Proteins 0.000 description 15
- 239000002585 base Substances 0.000 description 15
- 239000000284 extract Substances 0.000 description 15
- 229910000027 potassium carbonate Inorganic materials 0.000 description 15
- 229940093475 2-ethoxyethanol Drugs 0.000 description 14
- 230000000875 corresponding effect Effects 0.000 description 14
- KEJFADGISRFLFO-UHFFFAOYSA-N 1H-indazol-6-amine Chemical compound NC1=CC=C2C=NNC2=C1 KEJFADGISRFLFO-UHFFFAOYSA-N 0.000 description 13
- 102000043136 MAP kinase family Human genes 0.000 description 13
- 108091054455 MAP kinase family Proteins 0.000 description 13
- 108091000080 Phosphotransferase Proteins 0.000 description 13
- 238000009835 boiling Methods 0.000 description 13
- 239000010410 layer Substances 0.000 description 13
- 239000000463 material Substances 0.000 description 13
- 239000003921 oil Substances 0.000 description 13
- 235000019198 oils Nutrition 0.000 description 13
- 102000020233 phosphotransferase Human genes 0.000 description 13
- 238000002360 preparation method Methods 0.000 description 13
- 239000012258 stirred mixture Substances 0.000 description 13
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 description 12
- 235000019270 ammonium chloride Nutrition 0.000 description 12
- 239000013078 crystal Substances 0.000 description 12
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 12
- SPEUIVXLLWOEMJ-UHFFFAOYSA-N 1,1-dimethoxyethane Chemical compound COC(C)OC SPEUIVXLLWOEMJ-UHFFFAOYSA-N 0.000 description 11
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 11
- 102000004190 Enzymes Human genes 0.000 description 11
- 108090000790 Enzymes Proteins 0.000 description 11
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 11
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 11
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 11
- 150000001298 alcohols Chemical class 0.000 description 11
- 125000003342 alkenyl group Chemical group 0.000 description 11
- 125000000623 heterocyclic group Chemical group 0.000 description 11
- 230000026731 phosphorylation Effects 0.000 description 11
- 238000006366 phosphorylation reaction Methods 0.000 description 11
- 239000011541 reaction mixture Substances 0.000 description 11
- 229920006395 saturated elastomer Polymers 0.000 description 11
- 239000012312 sodium hydride Substances 0.000 description 11
- 235000009518 sodium iodide Nutrition 0.000 description 11
- 125000003396 thiol group Chemical class [H]S* 0.000 description 11
- VYXXCBNRHWHIHK-UHFFFAOYSA-N 7-(2-chloroethoxy)-4-(1h-indazol-6-ylamino)-6-methoxyquinoline-3-carbonitrile Chemical compound C1=C2C=NNC2=CC(NC2=C3C=C(C(=CC3=NC=C2C#N)OCCCl)OC)=C1 VYXXCBNRHWHIHK-UHFFFAOYSA-N 0.000 description 10
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 10
- 102000001301 EGF receptor Human genes 0.000 description 10
- 108060006698 EGF receptor Proteins 0.000 description 10
- 125000000304 alkynyl group Chemical group 0.000 description 10
- 125000002490 anilino group Chemical group [H]N(*)C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 10
- 239000000460 chlorine Substances 0.000 description 10
- 238000001816 cooling Methods 0.000 description 10
- 239000007788 liquid Substances 0.000 description 10
- CTSLXHKWHWQRSH-UHFFFAOYSA-N oxalyl chloride Chemical compound ClC(=O)C(Cl)=O CTSLXHKWHWQRSH-UHFFFAOYSA-N 0.000 description 10
- 235000011181 potassium carbonates Nutrition 0.000 description 10
- 108090000765 processed proteins & peptides Proteins 0.000 description 10
- 235000017557 sodium bicarbonate Nutrition 0.000 description 10
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 10
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 10
- 230000004614 tumor growth Effects 0.000 description 10
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 9
- 108090000744 Mitogen-Activated Protein Kinase Kinases Proteins 0.000 description 9
- 102000004232 Mitogen-Activated Protein Kinase Kinases Human genes 0.000 description 9
- 108010073929 Vascular Endothelial Growth Factor A Proteins 0.000 description 9
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 9
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 9
- 125000004849 alkoxymethyl group Chemical group 0.000 description 9
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 9
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 9
- 229910000024 caesium carbonate Inorganic materials 0.000 description 9
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 9
- 125000004970 halomethyl group Chemical group 0.000 description 9
- 238000000746 purification Methods 0.000 description 9
- 102000005962 receptors Human genes 0.000 description 9
- 108020003175 receptors Proteins 0.000 description 9
- 239000000126 substance Substances 0.000 description 9
- YVPONOUVXOCATL-UHFFFAOYSA-N 4-chloro-6-methoxy-7-phenylmethoxyquinoline-3-carbonitrile Chemical compound COC1=CC2=C(Cl)C(C#N)=CN=C2C=C1OCC1=CC=CC=C1 YVPONOUVXOCATL-UHFFFAOYSA-N 0.000 description 8
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N N-phenyl amine Natural products NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 description 8
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 8
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 8
- 239000012298 atmosphere Substances 0.000 description 8
- 238000004587 chromatography analysis Methods 0.000 description 8
- 239000012043 crude product Substances 0.000 description 8
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 8
- 229910000041 hydrogen chloride Inorganic materials 0.000 description 8
- 229910052742 iron Inorganic materials 0.000 description 8
- 230000000144 pharmacologic effect Effects 0.000 description 8
- UHZYTMXLRWXGPK-UHFFFAOYSA-N phosphorus pentachloride Chemical compound ClP(Cl)(Cl)(Cl)Cl UHZYTMXLRWXGPK-UHFFFAOYSA-N 0.000 description 8
- 150000003248 quinolines Chemical class 0.000 description 8
- 238000010998 test method Methods 0.000 description 8
- 229940086542 triethylamine Drugs 0.000 description 8
- XSFHICWNEBCMNN-UHFFFAOYSA-N 2h-benzotriazol-5-amine Chemical compound NC1=CC=C2NN=NC2=C1 XSFHICWNEBCMNN-UHFFFAOYSA-N 0.000 description 7
- WRAPTBOWJHVKIF-UHFFFAOYSA-N 6-methoxy-4-oxo-7-phenylmethoxy-1h-quinoline-3-carbonitrile Chemical compound COC1=CC2=C(O)C(C#N)=CN=C2C=C1OCC1=CC=CC=C1 WRAPTBOWJHVKIF-UHFFFAOYSA-N 0.000 description 7
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 7
- 125000003282 alkyl amino group Chemical group 0.000 description 7
- 125000003277 amino group Chemical group 0.000 description 7
- 239000000872 buffer Substances 0.000 description 7
- 150000001721 carbon Chemical class 0.000 description 7
- 239000003054 catalyst Substances 0.000 description 7
- 238000009903 catalytic hydrogenation reaction Methods 0.000 description 7
- 125000004663 dialkyl amino group Chemical group 0.000 description 7
- 201000010099 disease Diseases 0.000 description 7
- 239000003814 drug Substances 0.000 description 7
- 229940079593 drug Drugs 0.000 description 7
- 238000001704 evaporation Methods 0.000 description 7
- 239000000843 powder Substances 0.000 description 7
- QAEDZJGFFMLHHQ-UHFFFAOYSA-N trifluoroacetic anhydride Chemical compound FC(F)(F)C(=O)OC(=O)C(F)(F)F QAEDZJGFFMLHHQ-UHFFFAOYSA-N 0.000 description 7
- HGUFODBRKLSHSI-UHFFFAOYSA-N 2,3,7,8-tetrachloro-dibenzo-p-dioxin Chemical compound O1C2=CC(Cl)=C(Cl)C=C2OC2=C1C=C(Cl)C(Cl)=C2 HGUFODBRKLSHSI-UHFFFAOYSA-N 0.000 description 6
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 description 6
- WMBCMCMNNWELKB-UHFFFAOYSA-N 4-chloro-7-methoxyquinoline-3-carbonitrile Chemical compound ClC1=C(C#N)C=NC2=CC(OC)=CC=C21 WMBCMCMNNWELKB-UHFFFAOYSA-N 0.000 description 6
- RUBZFZDEKLOULN-UHFFFAOYSA-N 6-aminoquinoline-3-carbonitrile Chemical compound N1=CC(C#N)=CC2=CC(N)=CC=C21 RUBZFZDEKLOULN-UHFFFAOYSA-N 0.000 description 6
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 6
- 108010043945 Ephrin-A1 Proteins 0.000 description 6
- 102000020086 Ephrin-A1 Human genes 0.000 description 6
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 6
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 6
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 6
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 6
- 125000004414 alkyl thio group Chemical group 0.000 description 6
- 229940111121 antirheumatic drug quinolines Drugs 0.000 description 6
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 6
- 230000015572 biosynthetic process Effects 0.000 description 6
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 6
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 6
- 150000001735 carboxylic acids Chemical class 0.000 description 6
- 230000003197 catalytic effect Effects 0.000 description 6
- 230000008020 evaporation Effects 0.000 description 6
- QXOXUEFXRSIYSW-UHFFFAOYSA-N methyl 3-hydroxy-4-methoxybenzoate Chemical compound COC(=O)C1=CC=C(OC)C(O)=C1 QXOXUEFXRSIYSW-UHFFFAOYSA-N 0.000 description 6
- 229910017604 nitric acid Inorganic materials 0.000 description 6
- YORCIIVHUBAYBQ-UHFFFAOYSA-N propargyl bromide Chemical compound BrCC#C YORCIIVHUBAYBQ-UHFFFAOYSA-N 0.000 description 6
- CIIFKVFOVFJZDM-UHFFFAOYSA-N quinoline-8-carbonitrile Chemical compound C1=CN=C2C(C#N)=CC=CC2=C1 CIIFKVFOVFJZDM-UHFFFAOYSA-N 0.000 description 6
- 238000001953 recrystallisation Methods 0.000 description 6
- RMVRSNDYEFQCLF-UHFFFAOYSA-N thiophenol Chemical compound SC1=CC=CC=C1 RMVRSNDYEFQCLF-UHFFFAOYSA-N 0.000 description 6
- 239000003981 vehicle Substances 0.000 description 6
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 5
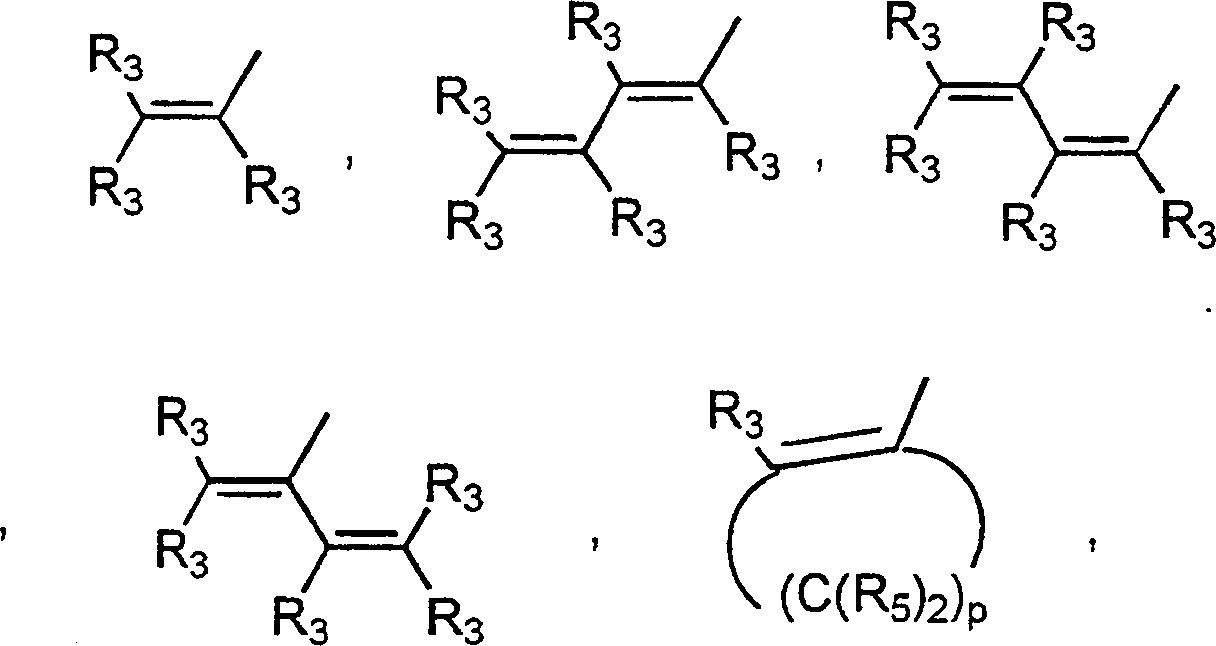
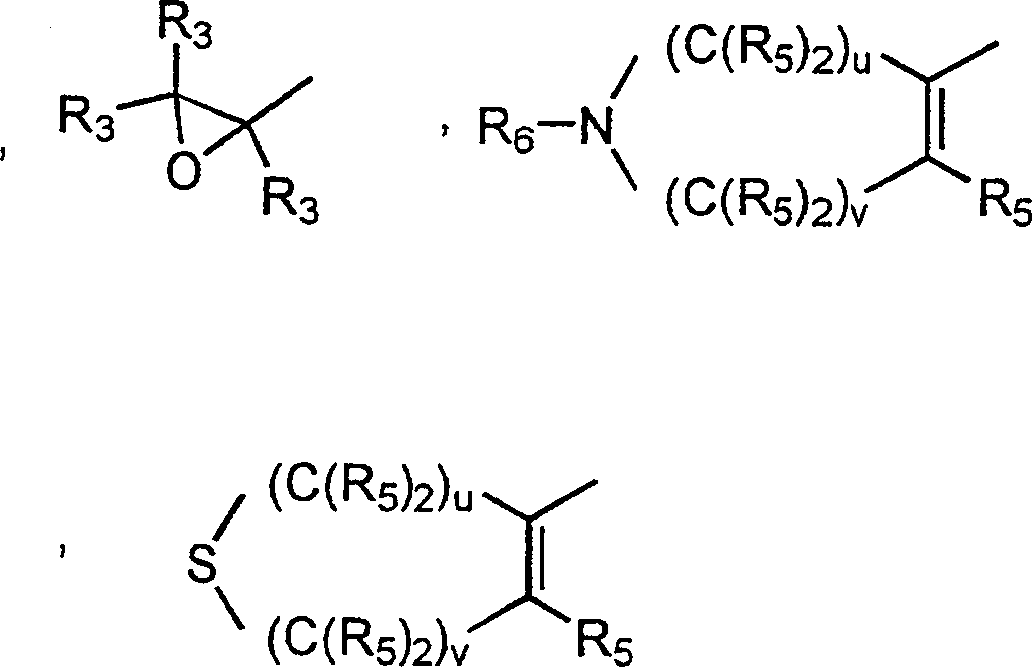
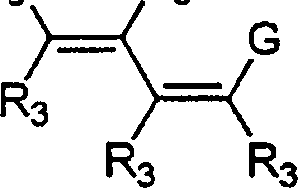
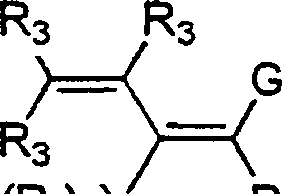
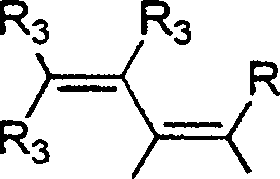
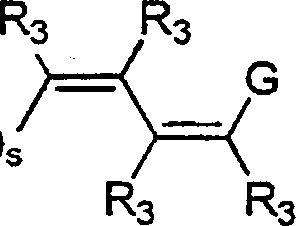
- 0 C*c(c(c(*)c(c(N)c1*)I)c1nc1)c1C#N Chemical compound C*c(c(c(*)c(c(N)c1*)I)c1nc1)c1C#N 0.000 description 5
- 239000007995 HEPES buffer Substances 0.000 description 5
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical group [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 5
- 241000699670 Mus sp. Species 0.000 description 5
- ZSXGLVDWWRXATF-UHFFFAOYSA-N N,N-dimethylformamide dimethyl acetal Chemical compound COC(OC)N(C)C ZSXGLVDWWRXATF-UHFFFAOYSA-N 0.000 description 5
- 102100037787 Protein-tyrosine kinase 2-beta Human genes 0.000 description 5
- 125000005236 alkanoylamino group Chemical group 0.000 description 5
- 125000000852 azido group Chemical group *N=[N+]=[N-] 0.000 description 5
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 description 5
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 5
- 230000010261 cell growth Effects 0.000 description 5
- 239000003638 chemical reducing agent Substances 0.000 description 5
- KTMGNAIGXYODKQ-VOTSOKGWSA-N ethyl (e)-2-cyano-3-ethoxyprop-2-enoate Chemical compound CCO\C=C(/C#N)C(=O)OCC KTMGNAIGXYODKQ-VOTSOKGWSA-N 0.000 description 5
- 150000002431 hydrogen Chemical class 0.000 description 5
- 238000001727 in vivo Methods 0.000 description 5
- 229910052744 lithium Inorganic materials 0.000 description 5
- DLEDOFVPSDKWEF-UHFFFAOYSA-N lithium butane Chemical compound [Li+].CCC[CH2-] DLEDOFVPSDKWEF-UHFFFAOYSA-N 0.000 description 5
- 239000002244 precipitate Substances 0.000 description 5
- 108090000623 proteins and genes Proteins 0.000 description 5
- 150000003246 quinazolines Chemical class 0.000 description 5
- 125000005270 trialkylamine group Chemical group 0.000 description 5
- MHCVCKDNQYMGEX-UHFFFAOYSA-N 1,1'-biphenyl;phenoxybenzene Chemical compound C1=CC=CC=C1C1=CC=CC=C1.C=1C=CC=CC=1OC1=CC=CC=C1 MHCVCKDNQYMGEX-UHFFFAOYSA-N 0.000 description 4
- ZCBIFHNDZBSCEP-UHFFFAOYSA-N 1H-indol-5-amine Chemical compound NC1=CC=C2NC=CC2=C1 ZCBIFHNDZBSCEP-UHFFFAOYSA-N 0.000 description 4
- NGNBDVOYPDDBFK-UHFFFAOYSA-N 2-[2,4-di(pentan-2-yl)phenoxy]acetyl chloride Chemical compound CCCC(C)C1=CC=C(OCC(Cl)=O)C(C(C)CCC)=C1 NGNBDVOYPDDBFK-UHFFFAOYSA-N 0.000 description 4
- YOETUEMZNOLGDB-UHFFFAOYSA-N 2-methylpropyl carbonochloridate Chemical compound CC(C)COC(Cl)=O YOETUEMZNOLGDB-UHFFFAOYSA-N 0.000 description 4
- QRUCHOLKZVCUAH-UHFFFAOYSA-N 4-chloro-6-nitroquinoline-3-carbonitrile Chemical compound N1=CC(C#N)=C(Cl)C2=CC([N+](=O)[O-])=CC=C21 QRUCHOLKZVCUAH-UHFFFAOYSA-N 0.000 description 4
- JSPIITUWOZXTTO-UHFFFAOYSA-N 4-chloro-8-methoxyquinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C(OC)=CC=CC2=C1Cl JSPIITUWOZXTTO-UHFFFAOYSA-N 0.000 description 4
- KCRWFINJQDRSKE-UHFFFAOYSA-N 7-ethoxy-4-oxo-1h-quinoline-3-carbonitrile Chemical compound OC1=C(C#N)C=NC2=CC(OCC)=CC=C21 KCRWFINJQDRSKE-UHFFFAOYSA-N 0.000 description 4
- YWXULSPHZDNVAN-UHFFFAOYSA-N 7-ethoxy-6-nitro-4-oxo-1h-quinoline-3-carbonitrile Chemical compound C1=C(C#N)C(O)=C2C=C([N+]([O-])=O)C(OCC)=CC2=N1 YWXULSPHZDNVAN-UHFFFAOYSA-N 0.000 description 4
- BRANBXSWAAPZNW-UHFFFAOYSA-N 7-methoxy-4-oxo-1h-quinoline-3-carbonitrile Chemical compound N1C=C(C#N)C(=O)C=2C1=CC(OC)=CC=2 BRANBXSWAAPZNW-UHFFFAOYSA-N 0.000 description 4
- JCEPZAWNXDUVPK-UHFFFAOYSA-N 8-methoxy-6-nitro-4-oxo-1h-quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C(OC)=CC([N+]([O-])=O)=CC2=C1O JCEPZAWNXDUVPK-UHFFFAOYSA-N 0.000 description 4
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 4
- PNKUSGQVOMIXLU-UHFFFAOYSA-N Formamidine Chemical compound NC=N PNKUSGQVOMIXLU-UHFFFAOYSA-N 0.000 description 4
- 102000009465 Growth Factor Receptors Human genes 0.000 description 4
- 108010009202 Growth Factor Receptors Proteins 0.000 description 4
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 4
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 4
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 4
- 230000009471 action Effects 0.000 description 4
- 230000004913 activation Effects 0.000 description 4
- HAXFWIACAGNFHA-UHFFFAOYSA-N aldrithiol Chemical compound C=1C=CC=NC=1SSC1=CC=CC=N1 HAXFWIACAGNFHA-UHFFFAOYSA-N 0.000 description 4
- 125000005422 alkyl sulfonamido group Chemical group 0.000 description 4
- 150000001409 amidines Chemical class 0.000 description 4
- 230000002491 angiogenic effect Effects 0.000 description 4
- 229910052794 bromium Inorganic materials 0.000 description 4
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 4
- 229910052801 chlorine Inorganic materials 0.000 description 4
- USIUVYZYUHIAEV-UHFFFAOYSA-N diphenyl ether Chemical compound C=1C=CC=CC=1OC1=CC=CC=C1 USIUVYZYUHIAEV-UHFFFAOYSA-N 0.000 description 4
- 238000004821 distillation Methods 0.000 description 4
- 210000002889 endothelial cell Anatomy 0.000 description 4
- ZKQFHRVKCYFVCN-UHFFFAOYSA-N ethoxyethane;hexane Chemical compound CCOCC.CCCCCC ZKQFHRVKCYFVCN-UHFFFAOYSA-N 0.000 description 4
- 125000002768 hydroxyalkyl group Chemical group 0.000 description 4
- 125000004029 hydroxymethyl group Chemical group [H]OC([H])([H])* 0.000 description 4
- 230000002401 inhibitory effect Effects 0.000 description 4
- BVWTXUYLKBHMOX-UHFFFAOYSA-N methyl vanillate Chemical compound COC(=O)C1=CC=C(O)C(OC)=C1 BVWTXUYLKBHMOX-UHFFFAOYSA-N 0.000 description 4
- 125000004433 nitrogen atom Chemical group N* 0.000 description 4
- 230000000269 nucleophilic effect Effects 0.000 description 4
- 150000007530 organic bases Chemical class 0.000 description 4
- 229910052760 oxygen Inorganic materials 0.000 description 4
- 230000037361 pathway Effects 0.000 description 4
- 230000000737 periodic effect Effects 0.000 description 4
- 239000011591 potassium Substances 0.000 description 4
- 235000018102 proteins Nutrition 0.000 description 4
- 102000004169 proteins and genes Human genes 0.000 description 4
- 230000009467 reduction Effects 0.000 description 4
- 238000006722 reduction reaction Methods 0.000 description 4
- 230000004044 response Effects 0.000 description 4
- 125000000467 secondary amino group Chemical group [H]N([*:1])[*:2] 0.000 description 4
- 230000019491 signal transduction Effects 0.000 description 4
- 239000011734 sodium Substances 0.000 description 4
- 229910052938 sodium sulfate Inorganic materials 0.000 description 4
- 235000011152 sodium sulphate Nutrition 0.000 description 4
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical class O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 4
- 239000006188 syrup Substances 0.000 description 4
- 235000020357 syrup Nutrition 0.000 description 4
- 230000001225 therapeutic effect Effects 0.000 description 4
- 210000004881 tumor cell Anatomy 0.000 description 4
- 239000005483 tyrosine kinase inhibitor Substances 0.000 description 4
- 125000006570 (C5-C6) heteroaryl group Chemical group 0.000 description 3
- PAWQVTBBRAZDMG-UHFFFAOYSA-N 2-(3-bromo-2-fluorophenyl)acetic acid Chemical compound OC(=O)CC1=CC=CC(Br)=C1F PAWQVTBBRAZDMG-UHFFFAOYSA-N 0.000 description 3
- 125000006012 2-chloroethoxy group Chemical group 0.000 description 3
- 125000004200 2-methoxyethyl group Chemical group [H]C([H])([H])OC([H])([H])C([H])([H])* 0.000 description 3
- SRVXSISGYBMIHR-UHFFFAOYSA-N 3-[3-[3-(2-amino-2-oxoethyl)phenyl]-5-chlorophenyl]-3-(5-methyl-1,3-thiazol-2-yl)propanoic acid Chemical compound S1C(C)=CN=C1C(CC(O)=O)C1=CC(Cl)=CC(C=2C=C(CC(N)=O)C=CC=2)=C1 SRVXSISGYBMIHR-UHFFFAOYSA-N 0.000 description 3
- VEKOZCQMIHXUDA-UHFFFAOYSA-N 3-chloro-4-(1-methylimidazol-2-yl)sulfanylaniline Chemical compound CN1C=CN=C1SC1=CC=C(N)C=C1Cl VEKOZCQMIHXUDA-UHFFFAOYSA-N 0.000 description 3
- PZVZGDBCMQBRMA-UHFFFAOYSA-N 3-pyridin-4-ylpropan-1-ol Chemical compound OCCCC1=CC=NC=C1 PZVZGDBCMQBRMA-UHFFFAOYSA-N 0.000 description 3
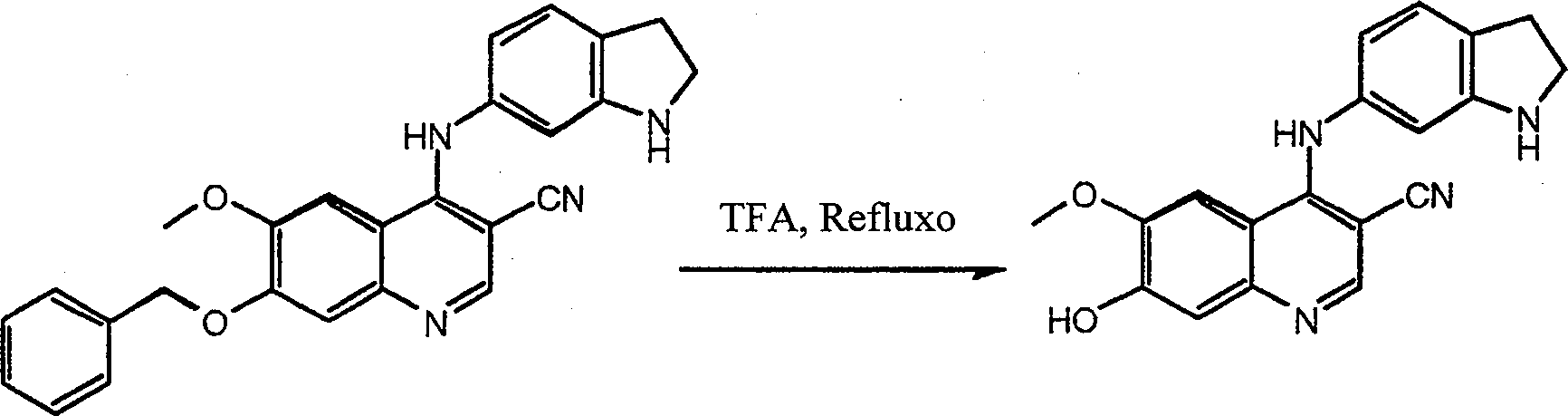
- CCHGREJDDRGOMA-UHFFFAOYSA-N 4-(2,3-dihydro-1H-indol-6-ylamino)-7-hydroxy-6-methoxyquinoline-3-carbonitrile Chemical compound C1=C2CCNC2=CC(NC2=C3C=C(C(=CC3=NC=C2C#N)O)OC)=C1 CCHGREJDDRGOMA-UHFFFAOYSA-N 0.000 description 3
- RKXZGFHWKOWSRT-UHFFFAOYSA-N 4-(2,3-dihydro-1h-indol-6-ylamino)-6-methoxy-7-phenylmethoxyquinoline-3-carbonitrile Chemical compound COC1=CC2=C(NC=3C=C4NCCC4=CC=3)C(C#N)=CN=C2C=C1OCC1=CC=CC=C1 RKXZGFHWKOWSRT-UHFFFAOYSA-N 0.000 description 3
- PEVGALUKPXHMSG-UHFFFAOYSA-N 4-chloro-6,7,8-trimethoxyquinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C(OC)=C(OC)C(OC)=CC2=C1Cl PEVGALUKPXHMSG-UHFFFAOYSA-N 0.000 description 3
- RLXUEEGTWNCIML-UHFFFAOYSA-N 4-chloro-6-ethoxy-7-methoxyquinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OC)C(OCC)=CC2=C1Cl RLXUEEGTWNCIML-UHFFFAOYSA-N 0.000 description 3
- GAOYRWYHERKJQE-UHFFFAOYSA-N 4-chloro-7-(2-chloroethoxy)-6-methoxyquinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OCCCl)C(OC)=CC2=C1Cl GAOYRWYHERKJQE-UHFFFAOYSA-N 0.000 description 3
- QIORUBTUDLGIII-UHFFFAOYSA-N 4-chloro-7-hydroxy-6-methoxyquinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(O)C(OC)=CC2=C1Cl QIORUBTUDLGIII-UHFFFAOYSA-N 0.000 description 3
- MQGQSQDWNVXHPH-UHFFFAOYSA-N 6-ethoxy-7-methoxy-4-oxo-1h-quinoline-3-carbonitrile Chemical compound N1C=C(C#N)C(=O)C2=C1C=C(OC)C(OCC)=C2 MQGQSQDWNVXHPH-UHFFFAOYSA-N 0.000 description 3
- KTZRTSATHWBRBI-UHFFFAOYSA-N 7-methoxy-6-nitro-4-oxo-1h-quinoline-3-carbonitrile Chemical compound N1C=C(C#N)C(=O)C2=C1C=C(OC)C([N+]([O-])=O)=C2 KTZRTSATHWBRBI-UHFFFAOYSA-N 0.000 description 3
- BEVFOGIUYIGEEB-UHFFFAOYSA-N 7-methoxyquinoline-3-carbonitrile Chemical compound C1=C(C#N)C=NC2=CC(OC)=CC=C21 BEVFOGIUYIGEEB-UHFFFAOYSA-N 0.000 description 3
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 3
- 208000026310 Breast neoplasm Diseases 0.000 description 3
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 3
- 102000004127 Cytokines Human genes 0.000 description 3
- 108090000695 Cytokines Proteins 0.000 description 3
- ROSDSFDQCJNGOL-UHFFFAOYSA-N Dimethylamine Chemical compound CNC ROSDSFDQCJNGOL-UHFFFAOYSA-N 0.000 description 3
- LELOWRISYMNNSU-UHFFFAOYSA-N Hydrocyanic acid Natural products N#C LELOWRISYMNNSU-UHFFFAOYSA-N 0.000 description 3
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 3
- LSDPWZHWYPCBBB-UHFFFAOYSA-N Methanethiol Chemical compound SC LSDPWZHWYPCBBB-UHFFFAOYSA-N 0.000 description 3
- 125000005118 N-alkylcarbamoyl group Chemical group 0.000 description 3
- 108700020796 Oncogene Proteins 0.000 description 3
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 3
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 3
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical compound [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 description 3
- 102000016549 Vascular Endothelial Growth Factor Receptor-2 Human genes 0.000 description 3
- 239000004480 active ingredient Substances 0.000 description 3
- 125000004644 alkyl sulfinyl group Chemical group 0.000 description 3
- 125000004390 alkyl sulfonyl group Chemical group 0.000 description 3
- 230000029936 alkylation Effects 0.000 description 3
- 238000005804 alkylation reaction Methods 0.000 description 3
- 235000011114 ammonium hydroxide Nutrition 0.000 description 3
- 230000033115 angiogenesis Effects 0.000 description 3
- 229940027991 antiseptic and disinfectant quinoline derivative Drugs 0.000 description 3
- 108010060350 arginyl-arginyl-leucyl-isoleucyl-glutamyl-aspartyl-alanyl-glutamyl-tyrosyl-alanyl-alanyl-arginyl-glycine Proteins 0.000 description 3
- 125000000043 benzamido group Chemical group [H]N([*])C(=O)C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 3
- 239000012267 brine Substances 0.000 description 3
- 230000004663 cell proliferation Effects 0.000 description 3
- 239000007810 chemical reaction solvent Substances 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- 210000001072 colon Anatomy 0.000 description 3
- 238000009833 condensation Methods 0.000 description 3
- 230000005494 condensation Effects 0.000 description 3
- 230000001086 cytosolic effect Effects 0.000 description 3
- 230000003831 deregulation Effects 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 230000018109 developmental process Effects 0.000 description 3
- FAMRKDQNMBBFBR-BQYQJAHWSA-N diethyl azodicarboxylate Substances CCOC(=O)\N=N\C(=O)OCC FAMRKDQNMBBFBR-BQYQJAHWSA-N 0.000 description 3
- 239000006185 dispersion Substances 0.000 description 3
- 238000001035 drying Methods 0.000 description 3
- 102000052116 epidermal growth factor receptor activity proteins Human genes 0.000 description 3
- 108700015053 epidermal growth factor receptor activity proteins Proteins 0.000 description 3
- 239000012259 ether extract Substances 0.000 description 3
- 239000006260 foam Substances 0.000 description 3
- 125000000524 functional group Chemical group 0.000 description 3
- 230000014509 gene expression Effects 0.000 description 3
- 125000005843 halogen group Chemical group 0.000 description 3
- 125000005842 heteroatom Chemical group 0.000 description 3
- 230000003993 interaction Effects 0.000 description 3
- HVTICUPFWKNHNG-UHFFFAOYSA-N iodoethane Chemical compound CCI HVTICUPFWKNHNG-UHFFFAOYSA-N 0.000 description 3
- USSRZSRGYKCCEK-UHFFFAOYSA-N methyl 2-(dimethylaminomethylideneamino)-3,6-dimethoxybenzoate Chemical compound COC(=O)C1=C(OC)C=CC(OC)=C1N=CN(C)C USSRZSRGYKCCEK-UHFFFAOYSA-N 0.000 description 3
- BDUDCBNHFCERIU-UHFFFAOYSA-N methyl 2-amino-5-ethoxy-4-methoxybenzoate Chemical compound CCOC1=CC(C(=O)OC)=C(N)C=C1OC BDUDCBNHFCERIU-UHFFFAOYSA-N 0.000 description 3
- PCDOQKFPBWQJCT-UHFFFAOYSA-N methyl 3-ethoxy-4-methoxybenzoate Chemical compound CCOC1=CC(C(=O)OC)=CC=C1OC PCDOQKFPBWQJCT-UHFFFAOYSA-N 0.000 description 3
- JHXYNNDKQUYNFY-UHFFFAOYSA-N methyl 5-ethoxy-4-methoxy-2-nitrobenzoate Chemical compound CCOC1=CC(C(=O)OC)=C([N+]([O-])=O)C=C1OC JHXYNNDKQUYNFY-UHFFFAOYSA-N 0.000 description 3
- 150000004702 methyl esters Chemical class 0.000 description 3
- HNFCLQLANGSACZ-UHFFFAOYSA-N n,n-bis(2-methoxyethyl)prop-2-yn-1-amine Chemical compound COCCN(CC#C)CCOC HNFCLQLANGSACZ-UHFFFAOYSA-N 0.000 description 3
- YOHYSYJDKVYCJI-UHFFFAOYSA-N n-[3-[[6-[3-(trifluoromethyl)anilino]pyrimidin-4-yl]amino]phenyl]cyclopropanecarboxamide Chemical compound FC(F)(F)C1=CC=CC(NC=2N=CN=C(NC=3C=C(NC(=O)C4CC4)C=CC=3)C=2)=C1 YOHYSYJDKVYCJI-UHFFFAOYSA-N 0.000 description 3
- 230000002018 overexpression Effects 0.000 description 3
- KDLHZDBZIXYQEI-UHFFFAOYSA-N palladium Substances [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 3
- 229960005141 piperazine Drugs 0.000 description 3
- 239000000902 placebo Substances 0.000 description 3
- 229920001223 polyethylene glycol Polymers 0.000 description 3
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 3
- DJXNJVFEFSWHLY-UHFFFAOYSA-N quinoline-3-carboxylic acid Chemical compound C1=CC=CC2=CC(C(=O)O)=CN=C21 DJXNJVFEFSWHLY-UHFFFAOYSA-N 0.000 description 3
- 230000002285 radioactive effect Effects 0.000 description 3
- 230000035484 reaction time Effects 0.000 description 3
- 230000009257 reactivity Effects 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 238000012956 testing procedure Methods 0.000 description 3
- 125000001412 tetrahydropyranyl group Chemical group 0.000 description 3
- 210000001519 tissue Anatomy 0.000 description 3
- 125000005490 tosylate group Chemical group 0.000 description 3
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 3
- 238000001291 vacuum drying Methods 0.000 description 3
- GVJHHUAWPYXKBD-UHFFFAOYSA-N (±)-α-Tocopherol Chemical compound OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 2
- UWYZHKAOTLEWKK-UHFFFAOYSA-N 1,2,3,4-tetrahydroisoquinoline Chemical compound C1=CC=C2CNCCC2=C1 UWYZHKAOTLEWKK-UHFFFAOYSA-N 0.000 description 2
- PVOAHINGSUIXLS-UHFFFAOYSA-N 1-Methylpiperazine Chemical compound CN1CCNCC1 PVOAHINGSUIXLS-UHFFFAOYSA-N 0.000 description 2
- FCEHBMOGCRZNNI-UHFFFAOYSA-N 1-benzothiophene Chemical compound C1=CC=C2SC=CC2=C1 FCEHBMOGCRZNNI-UHFFFAOYSA-N 0.000 description 2
- BUCGXUKNUAIELU-UHFFFAOYSA-N 2,3-dihydro-1h-indol-6-amine;dihydrochloride Chemical compound [Cl-].[Cl-].[NH3+]C1=CC=C2CC[NH2+]C2=C1 BUCGXUKNUAIELU-UHFFFAOYSA-N 0.000 description 2
- HIXDQWDOVZUNNA-UHFFFAOYSA-N 2-(3,4-dimethoxyphenyl)-5-hydroxy-7-methoxychromen-4-one Chemical compound C=1C(OC)=CC(O)=C(C(C=2)=O)C=1OC=2C1=CC=C(OC)C(OC)=C1 HIXDQWDOVZUNNA-UHFFFAOYSA-N 0.000 description 2
- RANOMAHFIQOQIG-UHFFFAOYSA-N 2-aminoquinoline-3-carbonitrile Chemical class C1=CC=C2C=C(C#N)C(N)=NC2=C1 RANOMAHFIQOQIG-UHFFFAOYSA-N 0.000 description 2
- GVBHRNIWBGTNQA-UHFFFAOYSA-N 2-methoxy-4-nitroaniline Chemical compound COC1=CC([N+]([O-])=O)=CC=C1N GVBHRNIWBGTNQA-UHFFFAOYSA-N 0.000 description 2
- LGDHZCLREKIGKJ-UHFFFAOYSA-N 3,4-dimethoxyaniline Chemical compound COC1=CC=C(N)C=C1OC LGDHZCLREKIGKJ-UHFFFAOYSA-N 0.000 description 2
- WEZAHYDFZNTGKE-UHFFFAOYSA-N 3-ethoxyaniline Chemical compound CCOC1=CC=CC(N)=C1 WEZAHYDFZNTGKE-UHFFFAOYSA-N 0.000 description 2
- LBKFGYZQBSGRHY-UHFFFAOYSA-N 3-hydroxy-4-methoxybenzoic acid Chemical compound COC1=CC=C(C(O)=O)C=C1O LBKFGYZQBSGRHY-UHFFFAOYSA-N 0.000 description 2
- TVXVKHGYFDHAET-UHFFFAOYSA-N 4-(1h-indazol-5-ylamino)-6,7-dimethoxyquinoline-3-carbonitrile Chemical compound C1=C2NN=CC2=CC(NC=2C(C#N)=CN=C3C=C(C(=CC3=2)OC)OC)=C1 TVXVKHGYFDHAET-UHFFFAOYSA-N 0.000 description 2
- RHKJQRDAZXRLRK-UHFFFAOYSA-N 4-(1h-indazol-6-ylamino)-5,8-dimethoxyquinoline-3-carbonitrile Chemical compound C1=C2C=NNC2=CC(NC2=C3C(OC)=CC=C(C3=NC=C2C#N)OC)=C1 RHKJQRDAZXRLRK-UHFFFAOYSA-N 0.000 description 2
- ZOESNMKXJDKRGQ-UHFFFAOYSA-N 4-(1h-indazol-6-ylamino)-6,7,8-trimethoxyquinoline-3-carbonitrile Chemical compound C1=C2C=NNC2=CC(NC2=C3C=C(C(=C(OC)C3=NC=C2C#N)OC)OC)=C1 ZOESNMKXJDKRGQ-UHFFFAOYSA-N 0.000 description 2
- ABKSPJGBRHIABU-UHFFFAOYSA-N 4-(1h-indazol-6-ylamino)-6,7-bis(2-methoxyethoxy)quinoline-3-carbonitrile Chemical compound C1=C2C=NNC2=CC(NC=2C(C#N)=CN=C3C=C(C(=CC3=2)OCCOC)OCCOC)=C1 ABKSPJGBRHIABU-UHFFFAOYSA-N 0.000 description 2
- ANCMEMUICRYIKS-UHFFFAOYSA-N 4-(1h-indazol-6-ylamino)-7-methoxyquinoline-3-carbonitrile Chemical compound C1=C2C=NNC2=CC(NC=2C3=CC=C(C=C3N=CC=2C#N)OC)=C1 ANCMEMUICRYIKS-UHFFFAOYSA-N 0.000 description 2
- CBCKPWFSIFRZCL-UHFFFAOYSA-N 4-(1h-indol-4-ylamino)-6,7-dimethoxyquinoline-3-carbonitrile Chemical compound C=12C=C(OC)C(OC)=CC2=NC=C(C#N)C=1NC1=CC=CC2=C1C=CN2 CBCKPWFSIFRZCL-UHFFFAOYSA-N 0.000 description 2
- CZSICXGIAZSBSO-UHFFFAOYSA-N 4-(1h-indol-5-ylamino)-6-nitroquinoline-3-carbonitrile Chemical compound C1=C2NC=CC2=CC(NC2=C(C#N)C=NC3=CC=C(C=C32)[N+](=O)[O-])=C1 CZSICXGIAZSBSO-UHFFFAOYSA-N 0.000 description 2
- WNMBOXLSIRVMAA-UHFFFAOYSA-N 4-(isoquinolin-5-ylamino)-6,7-dimethoxyquinoline-3-carbonitrile Chemical compound N1=CC=C2C(NC=3C(C#N)=CN=C4C=C(C(=CC4=3)OC)OC)=CC=CC2=C1 WNMBOXLSIRVMAA-UHFFFAOYSA-N 0.000 description 2
- XUMPXASXBIBARL-UHFFFAOYSA-N 4-chloro-5,8-dimethoxyquinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C(OC)=CC=C(OC)C2=C1Cl XUMPXASXBIBARL-UHFFFAOYSA-N 0.000 description 2
- BPEDILCALKIVRC-UHFFFAOYSA-N 4-chloro-6-methoxy-7-(3-pyridin-4-ylpropoxy)quinoline-3-carbonitrile Chemical compound COC1=CC2=C(Cl)C(C#N)=CN=C2C=C1OCCCC1=CC=NC=C1 BPEDILCALKIVRC-UHFFFAOYSA-N 0.000 description 2
- VIKNILFXAQPQEF-UHFFFAOYSA-N 4-chloro-6-methoxyquinoline-3-carbonitrile Chemical compound N1=CC(C#N)=C(Cl)C2=CC(OC)=CC=C21 VIKNILFXAQPQEF-UHFFFAOYSA-N 0.000 description 2
- BEGHZKYNLSIHIA-UHFFFAOYSA-N 4-chloro-7-(3-chloropropoxy)-6-methoxyquinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OCCCCl)C(OC)=CC2=C1Cl BEGHZKYNLSIHIA-UHFFFAOYSA-N 0.000 description 2
- QYYNVWZMCITGFR-UHFFFAOYSA-N 4-chloro-7-ethoxy-6-methoxyquinoline-3-carbonitrile Chemical compound C1=C(C#N)C(Cl)=C2C=C(OC)C(OCC)=CC2=N1 QYYNVWZMCITGFR-UHFFFAOYSA-N 0.000 description 2
- JTNOADATUOSXCU-UHFFFAOYSA-N 4-chloro-7-methoxy-6-nitroquinoline-3-carbonitrile Chemical compound C1=C(C#N)C(Cl)=C2C=C([N+]([O-])=O)C(OC)=CC2=N1 JTNOADATUOSXCU-UHFFFAOYSA-N 0.000 description 2
- JVVRCYWZTJLJSG-UHFFFAOYSA-N 4-dimethylaminophenol Chemical compound CN(C)C1=CC=C(O)C=C1 JVVRCYWZTJLJSG-UHFFFAOYSA-N 0.000 description 2
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 2
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-dimethylaminopyridine Substances CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 2
- 125000004195 4-methylpiperazin-1-yl group Chemical group [H]C([H])([H])N1C([H])([H])C([H])([H])N(*)C([H])([H])C1([H])[H] 0.000 description 2
- RBNLMAXLHADNEU-UHFFFAOYSA-N 4-oxo-1h-quinoline-3-carbonitrile Chemical compound C1=CC=C2C(=O)C(C#N)=CNC2=C1 RBNLMAXLHADNEU-UHFFFAOYSA-N 0.000 description 2
- 125000002373 5 membered heterocyclic group Chemical group 0.000 description 2
- ORBNORBNTUFCFT-UHFFFAOYSA-N 5,8-dimethoxy-4-oxo-1h-quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C(OC)=CC=C(OC)C2=C1O ORBNORBNTUFCFT-UHFFFAOYSA-N 0.000 description 2
- 125000004070 6 membered heterocyclic group Chemical group 0.000 description 2
- QTRNLGSLYVLFAW-UHFFFAOYSA-N 6,7,8-trimethoxy-4-oxo-1h-quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C(OC)=C(OC)C(OC)=CC2=C1O QTRNLGSLYVLFAW-UHFFFAOYSA-N 0.000 description 2
- RHZWXKPCVURCIH-UHFFFAOYSA-N 6,7-diethoxy-4-(1h-indazol-6-ylamino)quinoline-3-carbonitrile Chemical compound C1=C2C=NNC2=CC(NC=2C(C#N)=CN=C3C=C(C(=CC3=2)OCC)OCC)=C1 RHZWXKPCVURCIH-UHFFFAOYSA-N 0.000 description 2
- QWCQIVFJQVQFHH-UHFFFAOYSA-N 6,7-diethoxy-4-(1h-indol-6-ylamino)quinoline-3-carbonitrile Chemical compound C1=C2C=CNC2=CC(NC=2C(C#N)=CN=C3C=C(C(=CC3=2)OCC)OCC)=C1 QWCQIVFJQVQFHH-UHFFFAOYSA-N 0.000 description 2
- YCRZFANDTCRLLT-UHFFFAOYSA-N 6,7-diethoxy-4-[(1-oxo-2,3-dihydroinden-5-yl)amino]quinoline-3-carbonitrile Chemical compound C1=C2C(=O)CCC2=CC(NC=2C(C#N)=CN=C3C=C(C(=CC3=2)OCC)OCC)=C1 YCRZFANDTCRLLT-UHFFFAOYSA-N 0.000 description 2
- SKWITGADMHWLHT-UHFFFAOYSA-N 6,7-diethoxy-4-[(4-methyl-2-oxochromen-7-yl)amino]quinoline-3-carbonitrile Chemical compound CC1=CC(=O)OC2=CC(NC=3C(C#N)=CN=C4C=C(C(=CC4=3)OCC)OCC)=CC=C21 SKWITGADMHWLHT-UHFFFAOYSA-N 0.000 description 2
- AZZNBKGDUSZEML-UHFFFAOYSA-N 6,7-dimethoxy-4-(quinolin-8-ylamino)quinoline-3-carbonitrile Chemical compound C1=CN=C2C(NC=3C(C#N)=CN=C4C=C(C(=CC4=3)OC)OC)=CC=CC2=C1 AZZNBKGDUSZEML-UHFFFAOYSA-N 0.000 description 2
- BGIWARPQKBADBO-UHFFFAOYSA-N 6,7-dimethoxy-4-[(4-methyl-2-oxo-1h-quinolin-7-yl)amino]quinoline-3-carbonitrile Chemical compound CC1=CC(=O)NC2=CC(NC=3C(C#N)=CN=C4C=C(C(=CC4=3)OC)OC)=CC=C21 BGIWARPQKBADBO-UHFFFAOYSA-N 0.000 description 2
- NQVAAWNLOZNKOX-UHFFFAOYSA-N 6-ethoxy-4-(1h-indazol-6-ylamino)-7-methoxyquinoline-3-carbonitrile Chemical compound C1=C2C=NNC2=CC(NC2=C3C=C(C(=CC3=NC=C2C#N)OC)OCC)=C1 NQVAAWNLOZNKOX-UHFFFAOYSA-N 0.000 description 2
- ROOZTGHVHGPROJ-UHFFFAOYSA-N 7-(2-chloroethoxy)-6-methoxy-4-oxo-1h-quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OCCCl)C(OC)=CC2=C1O ROOZTGHVHGPROJ-UHFFFAOYSA-N 0.000 description 2
- TUVSLUWYBFYQLA-UHFFFAOYSA-N 7-(3-chloropropoxy)-6-methoxy-4-oxo-1h-quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OCCCCl)C(OC)=CC2=C1O TUVSLUWYBFYQLA-UHFFFAOYSA-N 0.000 description 2
- XYYZLOVSXBIDIM-UHFFFAOYSA-N 7-ethoxy-6-methoxy-4-oxo-1h-quinoline-3-carbonitrile Chemical compound N1C=C(C#N)C(=O)C2=C1C=C(OCC)C(OC)=C2 XYYZLOVSXBIDIM-UHFFFAOYSA-N 0.000 description 2
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical group [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 2
- PPOYMBZZLRCTCT-UHFFFAOYSA-N 8-methoxy-4-oxo-1h-quinoline-3-carbonitrile Chemical compound N1C=C(C#N)C(=O)C2=C1C(OC)=CC=C2 PPOYMBZZLRCTCT-UHFFFAOYSA-N 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 2
- KZBUYRJDOAKODT-UHFFFAOYSA-N Chlorine Chemical compound ClCl KZBUYRJDOAKODT-UHFFFAOYSA-N 0.000 description 2
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 2
- XJUZRXYOEPSWMB-UHFFFAOYSA-N Chloromethyl methyl ether Chemical compound COCCl XJUZRXYOEPSWMB-UHFFFAOYSA-N 0.000 description 2
- 206010009944 Colon cancer Diseases 0.000 description 2
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 2
- JIGUQPWFLRLWPJ-UHFFFAOYSA-N Ethyl acrylate Chemical compound CCOC(=O)C=C JIGUQPWFLRLWPJ-UHFFFAOYSA-N 0.000 description 2
- 229910004373 HOAc Inorganic materials 0.000 description 2
- OAKJQQAXSVQMHS-UHFFFAOYSA-N Hydrazine Chemical compound NN OAKJQQAXSVQMHS-UHFFFAOYSA-N 0.000 description 2
- 206010021143 Hypoxia Diseases 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical group CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 2
- 229910017917 NH4 Cl Inorganic materials 0.000 description 2
- 101100030361 Neurospora crassa (strain ATCC 24698 / 74-OR23-1A / CBS 708.71 / DSM 1257 / FGSC 987) pph-3 gene Proteins 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 102000004278 Receptor Protein-Tyrosine Kinases Human genes 0.000 description 2
- 108090000873 Receptor Protein-Tyrosine Kinases Proteins 0.000 description 2
- 108091005682 Receptor kinases Proteins 0.000 description 2
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 description 2
- 238000000692 Student's t-test Methods 0.000 description 2
- NKANXQFJJICGDU-QPLCGJKRSA-N Tamoxifen Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 NKANXQFJJICGDU-QPLCGJKRSA-N 0.000 description 2
- 239000007983 Tris buffer Substances 0.000 description 2
- CKUAXEQHGKSLHN-UHFFFAOYSA-N [C].[N] Chemical class [C].[N] CKUAXEQHGKSLHN-UHFFFAOYSA-N 0.000 description 2
- 230000002159 abnormal effect Effects 0.000 description 2
- 150000001299 aldehydes Chemical class 0.000 description 2
- 125000003302 alkenyloxy group Chemical group 0.000 description 2
- 150000004703 alkoxides Chemical class 0.000 description 2
- 125000006524 alkoxy alkyl amino group Chemical group 0.000 description 2
- 150000001350 alkyl halides Chemical class 0.000 description 2
- 125000005133 alkynyloxy group Chemical group 0.000 description 2
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 2
- 125000004103 aminoalkyl group Chemical group 0.000 description 2
- 229910021529 ammonia Inorganic materials 0.000 description 2
- 239000000908 ammonium hydroxide Substances 0.000 description 2
- 150000001448 anilines Chemical class 0.000 description 2
- 150000001450 anions Chemical class 0.000 description 2
- 239000000010 aprotic solvent Substances 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 125000003118 aryl group Chemical group 0.000 description 2
- RQPZNWPYLFFXCP-UHFFFAOYSA-L barium dihydroxide Chemical compound [OH-].[OH-].[Ba+2] RQPZNWPYLFFXCP-UHFFFAOYSA-L 0.000 description 2
- 229910001863 barium hydroxide Inorganic materials 0.000 description 2
- 125000005605 benzo group Chemical group 0.000 description 2
- 125000001584 benzyloxycarbonyl group Chemical group C(=O)(OCC1=CC=CC=C1)* 0.000 description 2
- 125000002619 bicyclic group Chemical group 0.000 description 2
- ILAHWRKJUDSMFH-UHFFFAOYSA-N boron tribromide Chemical compound BrB(Br)Br ILAHWRKJUDSMFH-UHFFFAOYSA-N 0.000 description 2
- 210000000481 breast Anatomy 0.000 description 2
- 230000005587 bubbling Effects 0.000 description 2
- 229910002091 carbon monoxide Inorganic materials 0.000 description 2
- PFKFTWBEEFSNDU-UHFFFAOYSA-N carbonyldiimidazole Chemical compound C1=CN=CN1C(=O)N1C=CN=C1 PFKFTWBEEFSNDU-UHFFFAOYSA-N 0.000 description 2
- 229940061627 chloromethyl methyl ether Drugs 0.000 description 2
- DIOQZVSQGTUSAI-UHFFFAOYSA-N decane Chemical compound CCCCCCCCCC DIOQZVSQGTUSAI-UHFFFAOYSA-N 0.000 description 2
- 239000012024 dehydrating agents Substances 0.000 description 2
- SWXVUIWOUIDPGS-UHFFFAOYSA-N diacetone alcohol Natural products CC(=O)CC(C)(C)O SWXVUIWOUIDPGS-UHFFFAOYSA-N 0.000 description 2
- 238000010790 dilution Methods 0.000 description 2
- 239000012895 dilution Substances 0.000 description 2
- 208000035475 disorder Diseases 0.000 description 2
- 230000008482 dysregulation Effects 0.000 description 2
- 238000010828 elution Methods 0.000 description 2
- 238000006911 enzymatic reaction Methods 0.000 description 2
- 150000002148 esters Chemical class 0.000 description 2
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 description 2
- UIOISEYUJOHZNT-UHFFFAOYSA-N ethyl 2-cyano-3-(2-methyl-4-nitrophenyl)prop-2-enoate Chemical compound CCOC(=O)C(C#N)=CC1=CC=C([N+]([O-])=O)C=C1C UIOISEYUJOHZNT-UHFFFAOYSA-N 0.000 description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 2
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 2
- 239000012091 fetal bovine serum Substances 0.000 description 2
- 229910052731 fluorine Chemical group 0.000 description 2
- 238000001640 fractional crystallisation Methods 0.000 description 2
- 239000012362 glacial acetic acid Substances 0.000 description 2
- 239000003102 growth factor Substances 0.000 description 2
- 230000009036 growth inhibition Effects 0.000 description 2
- 239000008241 heterogeneous mixture Substances 0.000 description 2
- 230000007954 hypoxia Effects 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- 229910052740 iodine Inorganic materials 0.000 description 2
- 238000005567 liquid scintillation counting Methods 0.000 description 2
- 238000011068 loading method Methods 0.000 description 2
- 239000011777 magnesium Substances 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- 239000002609 medium Substances 0.000 description 2
- HCOQITXMGNCWIN-UHFFFAOYSA-N methyl 1,4-dioxine-2-carboxylate Chemical compound COC(=O)C1=COC=CO1 HCOQITXMGNCWIN-UHFFFAOYSA-N 0.000 description 2
- STIXSFPLHFQZNA-UHFFFAOYSA-N methyl 2-(dimethylaminomethylideneamino)-4-ethoxy-5-methoxybenzoate Chemical compound CCOC1=CC(N=CN(C)C)=C(C(=O)OC)C=C1OC STIXSFPLHFQZNA-UHFFFAOYSA-N 0.000 description 2
- WIUQTTCGYDCFAS-UHFFFAOYSA-N methyl 2-(dimethylaminomethylideneamino)-5-methoxy-4-phenylmethoxybenzoate Chemical compound C1=C(N=CN(C)C)C(C(=O)OC)=CC(OC)=C1OCC1=CC=CC=C1 WIUQTTCGYDCFAS-UHFFFAOYSA-N 0.000 description 2
- OKYLJMNWFOOEKE-UHFFFAOYSA-N methyl 2-amino-4-(2-chloroethoxy)-5-methoxybenzoate Chemical compound COC(=O)C1=CC(OC)=C(OCCCl)C=C1N OKYLJMNWFOOEKE-UHFFFAOYSA-N 0.000 description 2
- ZQWYDHOFFKWQAC-UHFFFAOYSA-N methyl 2-amino-4-ethoxy-5-methoxybenzoate Chemical compound CCOC1=CC(N)=C(C(=O)OC)C=C1OC ZQWYDHOFFKWQAC-UHFFFAOYSA-N 0.000 description 2
- LQVPFNOFBAQSAZ-UHFFFAOYSA-N methyl 4-(2-chloroethoxy)-3-methoxybenzoate Chemical compound COC(=O)C1=CC=C(OCCCl)C(OC)=C1 LQVPFNOFBAQSAZ-UHFFFAOYSA-N 0.000 description 2
- UMBVDMOFTQTPPF-UHFFFAOYSA-N methyl 4-(3-chloropropoxy)-5-methoxy-2-nitrobenzoate Chemical compound COC(=O)C1=CC(OC)=C(OCCCCl)C=C1[N+]([O-])=O UMBVDMOFTQTPPF-UHFFFAOYSA-N 0.000 description 2
- HVLQOCXAZMSAPT-UHFFFAOYSA-N methyl 4-ethoxy-3-methoxybenzoate Chemical compound CCOC1=CC=C(C(=O)OC)C=C1OC HVLQOCXAZMSAPT-UHFFFAOYSA-N 0.000 description 2
- ACWQHKOWQNOPIB-UHFFFAOYSA-N methyl 4-ethoxy-5-methoxy-2-nitrobenzoate Chemical compound CCOC1=CC([N+]([O-])=O)=C(C(=O)OC)C=C1OC ACWQHKOWQNOPIB-UHFFFAOYSA-N 0.000 description 2
- 244000005700 microbiome Species 0.000 description 2
- 239000002480 mineral oil Substances 0.000 description 2
- 235000010446 mineral oil Nutrition 0.000 description 2
- 239000003226 mitogen Substances 0.000 description 2
- ODTQGXAPSKBFFW-UHFFFAOYSA-N n-(2-methoxyethyl)-n-methylprop-2-yn-1-amine Chemical compound COCCN(C)CC#C ODTQGXAPSKBFFW-UHFFFAOYSA-N 0.000 description 2
- MTSNDBYBIZSILH-UHFFFAOYSA-N n-phenylquinazolin-4-amine Chemical class N=1C=NC2=CC=CC=C2C=1NC1=CC=CC=C1 MTSNDBYBIZSILH-UHFFFAOYSA-N 0.000 description 2
- 230000017095 negative regulation of cell growth Effects 0.000 description 2
- 150000002829 nitrogen Chemical class 0.000 description 2
- 230000003287 optical effect Effects 0.000 description 2
- 125000001181 organosilyl group Chemical group [SiH3]* 0.000 description 2
- 239000001301 oxygen Substances 0.000 description 2
- 239000000825 pharmaceutical preparation Substances 0.000 description 2
- UYWQUFXKFGHYNT-UHFFFAOYSA-N phenylmethyl ester of formic acid Chemical group O=COCC1=CC=CC=C1 UYWQUFXKFGHYNT-UHFFFAOYSA-N 0.000 description 2
- 229940080469 phosphocellulose Drugs 0.000 description 2
- 229940068196 placebo Drugs 0.000 description 2
- 235000015320 potassium carbonate Nutrition 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 230000000770 proinflammatory effect Effects 0.000 description 2
- TVDSBUOJIPERQY-UHFFFAOYSA-N prop-2-yn-1-ol Chemical compound OCC#C TVDSBUOJIPERQY-UHFFFAOYSA-N 0.000 description 2
- 125000004076 pyridyl group Chemical group 0.000 description 2
- 125000000714 pyrimidinyl group Chemical group 0.000 description 2
- 238000005932 reductive alkylation reaction Methods 0.000 description 2
- 150000003335 secondary amines Chemical class 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- BEOOHQFXGBMRKU-UHFFFAOYSA-N sodium cyanoborohydride Chemical compound [Na+].[B-]C#N BEOOHQFXGBMRKU-UHFFFAOYSA-N 0.000 description 2
- 239000007858 starting material Substances 0.000 description 2
- 238000007619 statistical method Methods 0.000 description 2
- 230000000638 stimulation Effects 0.000 description 2
- 238000003860 storage Methods 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- 125000000446 sulfanediyl group Chemical group *S* 0.000 description 2
- 229910052717 sulfur Inorganic materials 0.000 description 2
- 239000000375 suspending agent Substances 0.000 description 2
- 238000004809 thin layer chromatography Methods 0.000 description 2
- 125000002813 thiocarbonyl group Chemical group *C(*)=S 0.000 description 2
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Chemical compound ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 description 2
- YNJBWRMUSHSURL-UHFFFAOYSA-N trichloroacetic acid Chemical compound OC(=O)C(Cl)(Cl)Cl YNJBWRMUSHSURL-UHFFFAOYSA-N 0.000 description 2
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 2
- 125000001493 tyrosinyl group Chemical group [H]OC1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 2
- 210000003556 vascular endothelial cell Anatomy 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- 229910000166 zirconium phosphate Inorganic materials 0.000 description 2
- VCGRFBXVSFAGGA-UHFFFAOYSA-N (1,1-dioxo-1,4-thiazinan-4-yl)-[6-[[3-(4-fluorophenyl)-5-methyl-1,2-oxazol-4-yl]methoxy]pyridin-3-yl]methanone Chemical compound CC=1ON=C(C=2C=CC(F)=CC=2)C=1COC(N=C1)=CC=C1C(=O)N1CCS(=O)(=O)CC1 VCGRFBXVSFAGGA-UHFFFAOYSA-N 0.000 description 1
- SOHAVULMGIITDH-ZXPSTKSJSA-N (1S,9R,14E)-14-(1H-imidazol-5-ylmethylidene)-2,11-dimethoxy-9-(2-methylbut-3-en-2-yl)-2,13,16-triazatetracyclo[7.7.0.01,13.03,8]hexadeca-3,5,7,10-tetraene-12,15-dione Chemical compound C([C@]1(C2=CC=CC=C2N([C@@]21NC1=O)OC)C(C)(C)C=C)=C(OC)C(=O)N2\C1=C\C1=CNC=N1 SOHAVULMGIITDH-ZXPSTKSJSA-N 0.000 description 1
- XSXGVVNOCWAISP-VIFPVBQESA-N (2s)-2-(methoxymethyl)-1-prop-2-ynylpyrrolidine Chemical compound COC[C@@H]1CCCN1CC#C XSXGVVNOCWAISP-VIFPVBQESA-N 0.000 description 1
- MAYZWDRUFKUGGP-VIFPVBQESA-N (3s)-1-[5-tert-butyl-3-[(1-methyltetrazol-5-yl)methyl]triazolo[4,5-d]pyrimidin-7-yl]pyrrolidin-3-ol Chemical compound CN1N=NN=C1CN1C2=NC(C(C)(C)C)=NC(N3C[C@@H](O)CC3)=C2N=N1 MAYZWDRUFKUGGP-VIFPVBQESA-N 0.000 description 1
- KEOPTZKJOKJEIM-VDNREOAASA-N (4s)-4-[[(2s)-2-[[(2s)-2-[[(2s)-2-[[(2s,3s)-2-[[(2s)-2-[[(2s)-2-[[(2s)-2-amino-5-(diaminomethylideneamino)pentanoyl]amino]-5-(diaminomethylideneamino)pentanoyl]amino]-4-methylpentanoyl]amino]-3-methylpentanoyl]amino]-4-carboxybutanoyl]amino]-3-carboxyprop Chemical compound NC(N)=NCCC[C@H](N)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@H](C(=O)N[C@@H](C)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCN=C(N)N)C(=O)NCC(O)=O)CC1=CC=C(O)C=C1 KEOPTZKJOKJEIM-VDNREOAASA-N 0.000 description 1
- VTQDJAUGGZFPOI-UHFFFAOYSA-N (8-hydroxyquinolin-1-ium-5-yl)azanium;dichloride Chemical compound Cl.Cl.C1=CC=C2C(N)=CC=C(O)C2=N1 VTQDJAUGGZFPOI-UHFFFAOYSA-N 0.000 description 1
- ZFGQEJSYGKJUAA-DHZHZOJOSA-N (e)-n-[3-cyano-7-ethoxy-4-[4-[(4-phenyl-1,3-thiazol-2-yl)sulfanyl]-3-(trifluoromethyl)anilino]quinolin-6-yl]-4-(dimethylamino)but-2-enamide Chemical compound C=12C=C(NC(=O)\C=C\CN(C)C)C(OCC)=CC2=NC=C(C#N)C=1NC(C=C1C(F)(F)F)=CC=C1SC(SC=1)=NC=1C1=CC=CC=C1 ZFGQEJSYGKJUAA-DHZHZOJOSA-N 0.000 description 1
- ZUGIORDBUDEWIO-SNAWJCMRSA-N (e)-n-[4-[3-chloro-4-(1,3-thiazol-2-ylsulfanyl)anilino]-3-cyano-7-methoxyquinolin-6-yl]-4-[2-methoxyethyl(methyl)amino]but-2-enamide Chemical compound N#CC1=CN=C2C=C(OC)C(NC(=O)/C=C/CN(C)CCOC)=CC2=C1NC(C=C1Cl)=CC=C1SC1=NC=CS1 ZUGIORDBUDEWIO-SNAWJCMRSA-N 0.000 description 1
- JTZDJBDPDBIKJS-BQYQJAHWSA-N (e)-n-[4-[3-chloro-4-(4,6-dimethylpyrimidin-2-yl)sulfanylanilino]-3-cyano-7-ethoxyquinolin-6-yl]-4-(dimethylamino)but-2-enamide Chemical compound C=12C=C(NC(=O)\C=C\CN(C)C)C(OCC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1SC1=NC(C)=CC(C)=N1 JTZDJBDPDBIKJS-BQYQJAHWSA-N 0.000 description 1
- SKQFSMOEJQBLOK-VOTSOKGWSA-N (e)-n-[4-[3-chloro-4-(4-methylpyrimidin-2-yl)sulfanylanilino]-3-cyano-7-ethoxyquinolin-6-yl]-4-(dimethylamino)but-2-enamide Chemical compound C=12C=C(NC(=O)\C=C\CN(C)C)C(OCC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1SC1=NC=CC(C)=N1 SKQFSMOEJQBLOK-VOTSOKGWSA-N 0.000 description 1
- QDRWCBFRDFJYSO-AATRIKPKSA-N (e)-n-[4-[3-chloro-4-(imidazol-1-ylmethyl)anilino]-3-cyano-7-ethoxyquinolin-6-yl]-4-(dimethylamino)but-2-enamide Chemical compound C=12C=C(NC(=O)\C=C\CN(C)C)C(OCC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1CN1C=CN=C1 QDRWCBFRDFJYSO-AATRIKPKSA-N 0.000 description 1
- ZGYIXVSQHOKQRZ-COIATFDQSA-N (e)-n-[4-[3-chloro-4-(pyridin-2-ylmethoxy)anilino]-3-cyano-7-[(3s)-oxolan-3-yl]oxyquinolin-6-yl]-4-(dimethylamino)but-2-enamide Chemical compound N#CC1=CN=C2C=C(O[C@@H]3COCC3)C(NC(=O)/C=C/CN(C)C)=CC2=C1NC(C=C1Cl)=CC=C1OCC1=CC=CC=N1 ZGYIXVSQHOKQRZ-COIATFDQSA-N 0.000 description 1
- DXEKWPPZNDPFEA-JXMROGBWSA-N (e)-n-[4-[3-chloro-4-[(2-phenylsulfanylacetyl)amino]anilino]-3-cyano-7-methoxyquinolin-6-yl]-4-(dimethylamino)but-2-enamide Chemical compound C=12C=C(NC(=O)\C=C\CN(C)C)C(OC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1NC(=O)CSC1=CC=CC=C1 DXEKWPPZNDPFEA-JXMROGBWSA-N 0.000 description 1
- YAWRCBHLRDCILP-DHZHZOJOSA-N (e)-n-[4-[3-chloro-4-[(4-phenyl-1,3-thiazol-2-yl)sulfanyl]anilino]-3-cyano-7-ethoxyquinolin-6-yl]-4-(dimethylamino)but-2-enamide Chemical compound C=12C=C(NC(=O)\C=C\CN(C)C)C(OCC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1SC(SC=1)=NC=1C1=CC=CC=C1 YAWRCBHLRDCILP-DHZHZOJOSA-N 0.000 description 1
- RCGGMGGKBHUJBA-JXMROGBWSA-N (e)-n-[4-[3-chloro-4-[(4-phenyl-1,3-thiazol-2-yl)sulfanyl]anilino]-3-cyano-7-methoxyquinolin-6-yl]-4-(dimethylamino)but-2-enamide Chemical compound C=12C=C(NC(=O)\C=C\CN(C)C)C(OC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1SC(SC=1)=NC=1C1=CC=CC=C1 RCGGMGGKBHUJBA-JXMROGBWSA-N 0.000 description 1
- BXBBCTASDUZGMZ-JXMROGBWSA-N (e)-n-[4-[3-chloro-4-[(5-phenyl-1,3-thiazol-2-yl)sulfanyl]anilino]-3-cyano-7-methoxyquinolin-6-yl]-4-(dimethylamino)but-2-enamide Chemical compound C=12C=C(NC(=O)\C=C\CN(C)C)C(OC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1SC(S1)=NC=C1C1=CC=CC=C1 BXBBCTASDUZGMZ-JXMROGBWSA-N 0.000 description 1
- UEJSIAUMKKZSFX-AATRIKPKSA-N (e)-n-[4-[3-chloro-4-[[5-(trifluoromethyl)-1,3,4-thiadiazol-2-yl]amino]anilino]-3-cyano-7-ethoxyquinolin-6-yl]-4-(dimethylamino)but-2-enamide Chemical compound C=12C=C(NC(=O)\C=C\CN(C)C)C(OCC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1NC1=NN=C(C(F)(F)F)S1 UEJSIAUMKKZSFX-AATRIKPKSA-N 0.000 description 1
- MESWYWMBFAXRMT-SOFGYWHQSA-N (e)-n-[4-[4-[acetyl(pyridin-3-ylmethyl)amino]-3-chloroanilino]-3-cyano-7-methoxyquinolin-6-yl]-4-(dimethylamino)but-2-enamide Chemical compound C=12C=C(NC(=O)\C=C\CN(C)C)C(OC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1N(C(C)=O)CC1=CC=CN=C1 MESWYWMBFAXRMT-SOFGYWHQSA-N 0.000 description 1
- MOWXJLUYGFNTAL-DEOSSOPVSA-N (s)-[2-chloro-4-fluoro-5-(7-morpholin-4-ylquinazolin-4-yl)phenyl]-(6-methoxypyridazin-3-yl)methanol Chemical compound N1=NC(OC)=CC=C1[C@@H](O)C1=CC(C=2C3=CC=C(C=C3N=CN=2)N2CCOCC2)=C(F)C=C1Cl MOWXJLUYGFNTAL-DEOSSOPVSA-N 0.000 description 1
- KRUCRVZSHWOMHC-UHFFFAOYSA-N 1,1-dioxo-1-benzothiophen-6-amine Chemical compound NC1=CC=C2C=CS(=O)(=O)C2=C1 KRUCRVZSHWOMHC-UHFFFAOYSA-N 0.000 description 1
- NWUYHJFMYQTDRP-UHFFFAOYSA-N 1,2-bis(ethenyl)benzene;1-ethenyl-2-ethylbenzene;styrene Chemical compound C=CC1=CC=CC=C1.CCC1=CC=CC=C1C=C.C=CC1=CC=CC=C1C=C NWUYHJFMYQTDRP-UHFFFAOYSA-N 0.000 description 1
- XGNXYCFREOZBOL-UHFFFAOYSA-N 1,3-benzodioxol-5-amine Chemical compound NC1=CC=C2OCOC2=C1 XGNXYCFREOZBOL-UHFFFAOYSA-N 0.000 description 1
- WNXJIVFYUVYPPR-UHFFFAOYSA-N 1,3-dioxolane Chemical compound C1COCO1 WNXJIVFYUVYPPR-UHFFFAOYSA-N 0.000 description 1
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 1
- KPKNTUUIEVXMOH-UHFFFAOYSA-N 1,4-dioxa-8-azaspiro[4.5]decane Chemical compound O1CCOC11CCNCC1 KPKNTUUIEVXMOH-UHFFFAOYSA-N 0.000 description 1
- LXOHISCRPIDIIG-UHFFFAOYSA-N 1,4-dioxine-2-carboxylic acid Chemical compound OC(=O)C1=COC=CO1 LXOHISCRPIDIIG-UHFFFAOYSA-N 0.000 description 1
- NDOVLWQBFFJETK-UHFFFAOYSA-N 1,4-thiazinane 1,1-dioxide Chemical compound O=S1(=O)CCNCC1 NDOVLWQBFFJETK-UHFFFAOYSA-N 0.000 description 1
- YHIIJNLSGULWAA-UHFFFAOYSA-N 1,4-thiazinane 1-oxide Chemical compound O=S1CCNCC1 YHIIJNLSGULWAA-UHFFFAOYSA-N 0.000 description 1
- APWRZPQBPCAXFP-UHFFFAOYSA-N 1-(1-oxo-2H-isoquinolin-5-yl)-5-(trifluoromethyl)-N-[2-(trifluoromethyl)pyridin-4-yl]pyrazole-4-carboxamide Chemical compound O=C1NC=CC2=C(C=CC=C12)N1N=CC(=C1C(F)(F)F)C(=O)NC1=CC(=NC=C1)C(F)(F)F APWRZPQBPCAXFP-UHFFFAOYSA-N 0.000 description 1
- MBLOVZIAFQVXIN-UHFFFAOYSA-N 1-(bromomethyl)-2-chloro-4-nitrobenzene Chemical compound [O-][N+](=O)C1=CC=C(CBr)C(Cl)=C1 MBLOVZIAFQVXIN-UHFFFAOYSA-N 0.000 description 1
- BBKQRTBYEIDUFY-UHFFFAOYSA-N 1-[(2-chloro-4-nitrophenyl)methyl]imidazole Chemical compound ClC1=CC([N+](=O)[O-])=CC=C1CN1C=NC=C1 BBKQRTBYEIDUFY-UHFFFAOYSA-N 0.000 description 1
- ABDDQTDRAHXHOC-QMMMGPOBSA-N 1-[(7s)-5,7-dihydro-4h-thieno[2,3-c]pyran-7-yl]-n-methylmethanamine Chemical compound CNC[C@@H]1OCCC2=C1SC=C2 ABDDQTDRAHXHOC-QMMMGPOBSA-N 0.000 description 1
- NOXAORINZJERRC-UHFFFAOYSA-N 1-methyl-4-prop-2-ynylpiperazine Chemical compound CN1CCN(CC#C)CC1 NOXAORINZJERRC-UHFFFAOYSA-N 0.000 description 1
- VSNHCAURESNICA-NJFSPNSNSA-N 1-oxidanylurea Chemical compound N[14C](=O)NO VSNHCAURESNICA-NJFSPNSNSA-N 0.000 description 1
- QWENRTYMTSOGBR-UHFFFAOYSA-N 1H-1,2,3-Triazole Chemical compound C=1C=NNN=1 QWENRTYMTSOGBR-UHFFFAOYSA-N 0.000 description 1
- YDTDKKULPWTHRV-UHFFFAOYSA-N 1H-indazol-3-amine Chemical compound C1=CC=C2C(N)=NNC2=C1 YDTDKKULPWTHRV-UHFFFAOYSA-N 0.000 description 1
- IHWDSEPNZDYMNF-UHFFFAOYSA-N 1H-indol-2-amine Chemical compound C1=CC=C2NC(N)=CC2=C1 IHWDSEPNZDYMNF-UHFFFAOYSA-N 0.000 description 1
- XBTOSRUBOXQWBO-UHFFFAOYSA-N 1h-indazol-5-amine Chemical compound NC1=CC=C2NN=CC2=C1 XBTOSRUBOXQWBO-UHFFFAOYSA-N 0.000 description 1
- MIMYTSWNVBMNRH-UHFFFAOYSA-N 1h-indol-6-amine Chemical compound NC1=CC=C2C=CNC2=C1 MIMYTSWNVBMNRH-UHFFFAOYSA-N 0.000 description 1
- NHBKXEKEPDILRR-UHFFFAOYSA-N 2,3-bis(butanoylsulfanyl)propyl butanoate Chemical compound CCCC(=O)OCC(SC(=O)CCC)CSC(=O)CCC NHBKXEKEPDILRR-UHFFFAOYSA-N 0.000 description 1
- BZKOZYWGZKRTIB-UHFFFAOYSA-N 2,3-dihydro-1,4-benzodioxin-6-amine Chemical compound O1CCOC2=CC(N)=CC=C21 BZKOZYWGZKRTIB-UHFFFAOYSA-N 0.000 description 1
- JWZQJTGQFHIRFQ-UHFFFAOYSA-N 2,3-dihydro-1,4-benzodioxine-6-carboxylic acid Chemical compound O1CCOC2=CC(C(=O)O)=CC=C21 JWZQJTGQFHIRFQ-UHFFFAOYSA-N 0.000 description 1
- LEWZOBYWGWKNCK-UHFFFAOYSA-N 2,3-dihydro-1h-inden-5-amine Chemical compound NC1=CC=C2CCCC2=C1 LEWZOBYWGWKNCK-UHFFFAOYSA-N 0.000 description 1
- CYIXXDBODNSLQN-UHFFFAOYSA-N 2,4-dimethoxyquinoline-3-carbonitrile Chemical compound C1=CC=C2C(OC)=C(C#N)C(OC)=NC2=C1 CYIXXDBODNSLQN-UHFFFAOYSA-N 0.000 description 1
- IHJOQFXXQGYWMJ-UHFFFAOYSA-N 2-(4-amino-2-chlorophenyl)sulfanyl-1h-quinazolin-4-one Chemical compound ClC1=CC(N)=CC=C1SC1=NC2=CC=CC=C2C(=O)N1 IHJOQFXXQGYWMJ-UHFFFAOYSA-N 0.000 description 1
- UPLJIGHHFZZBEF-UHFFFAOYSA-N 2-(dimethylaminomethylideneamino)-3-methoxybenzoic acid Chemical compound COC1=CC=CC(C(O)=O)=C1N=CN(C)C UPLJIGHHFZZBEF-UHFFFAOYSA-N 0.000 description 1
- IOOMXAQUNPWDLL-UHFFFAOYSA-N 2-[6-(diethylamino)-3-(diethyliminiumyl)-3h-xanthen-9-yl]-5-sulfobenzene-1-sulfonate Chemical compound C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=C(S(O)(=O)=O)C=C1S([O-])(=O)=O IOOMXAQUNPWDLL-UHFFFAOYSA-N 0.000 description 1
- RRQMXQWSIJERLR-UHFFFAOYSA-N 2-amino-3,6-dimethoxybenzoic acid Chemical compound COC1=CC=C(OC)C(C(O)=O)=C1N RRQMXQWSIJERLR-UHFFFAOYSA-N 0.000 description 1
- DPHCXXYPSYMICK-UHFFFAOYSA-N 2-chloro-1-fluoro-4-nitrobenzene Chemical compound [O-][N+](=O)C1=CC=C(F)C(Cl)=C1 DPHCXXYPSYMICK-UHFFFAOYSA-N 0.000 description 1
- 125000003635 2-dimethylaminoethoxy group Chemical group [H]C([H])([H])N(C([H])([H])[H])C([H])([H])C([H])([H])O* 0.000 description 1
- 125000000954 2-hydroxyethyl group Chemical group [H]C([*])([H])C([H])([H])O[H] 0.000 description 1
- IBZKBSXREAQDTO-UHFFFAOYSA-N 2-methoxy-n-(2-methoxyethyl)ethanamine Chemical compound COCCNCCOC IBZKBSXREAQDTO-UHFFFAOYSA-N 0.000 description 1
- KOHBEDRJXKOYHL-UHFFFAOYSA-N 2-methoxy-n-methylethanamine Chemical compound CNCCOC KOHBEDRJXKOYHL-UHFFFAOYSA-N 0.000 description 1
- MDRKEUXLMJBPCY-UHFFFAOYSA-N 2-methoxyquinoline-3-carbonitrile Chemical compound C1=CC=C2C=C(C#N)C(OC)=NC2=C1 MDRKEUXLMJBPCY-UHFFFAOYSA-N 0.000 description 1
- ZNIGVBCUUZGYDU-UHFFFAOYSA-N 2-methyl-1,3-benzothiazol-5-amine;dihydrochloride Chemical compound [Cl-].[Cl-].[NH3+]C1=CC=C2SC(C)=[NH+]C2=C1 ZNIGVBCUUZGYDU-UHFFFAOYSA-N 0.000 description 1
- UJYKXBDYOPPOCY-UHFFFAOYSA-N 2-methyl-3h-benzimidazol-5-amine Chemical compound C1=C(N)C=C2NC(C)=NC2=C1 UJYKXBDYOPPOCY-UHFFFAOYSA-N 0.000 description 1
- XTTIQGSLJBWVIV-UHFFFAOYSA-N 2-methyl-4-nitroaniline Chemical compound CC1=CC([N+]([O-])=O)=CC=C1N XTTIQGSLJBWVIV-UHFFFAOYSA-N 0.000 description 1
- WFCSWCVEJLETKA-UHFFFAOYSA-N 2-piperazin-1-ylethanol Chemical compound OCCN1CCNCC1 WFCSWCVEJLETKA-UHFFFAOYSA-N 0.000 description 1
- HCDMJFOHIXMBOV-UHFFFAOYSA-N 3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-ethyl-8-(morpholin-4-ylmethyl)-4,7-dihydropyrrolo[4,5]pyrido[1,2-d]pyrimidin-2-one Chemical compound C=1C2=C3N(CC)C(=O)N(C=4C(=C(OC)C=C(OC)C=4F)F)CC3=CN=C2NC=1CN1CCOCC1 HCDMJFOHIXMBOV-UHFFFAOYSA-N 0.000 description 1
- BYHQTRFJOGIQAO-GOSISDBHSA-N 3-(4-bromophenyl)-8-[(2R)-2-hydroxypropyl]-1-[(3-methoxyphenyl)methyl]-1,3,8-triazaspiro[4.5]decan-2-one Chemical compound C[C@H](CN1CCC2(CC1)CN(C(=O)N2CC3=CC(=CC=C3)OC)C4=CC=C(C=C4)Br)O BYHQTRFJOGIQAO-GOSISDBHSA-N 0.000 description 1
- WNEODWDFDXWOLU-QHCPKHFHSA-N 3-[3-(hydroxymethyl)-4-[1-methyl-5-[[5-[(2s)-2-methyl-4-(oxetan-3-yl)piperazin-1-yl]pyridin-2-yl]amino]-6-oxopyridin-3-yl]pyridin-2-yl]-7,7-dimethyl-1,2,6,8-tetrahydrocyclopenta[3,4]pyrrolo[3,5-b]pyrazin-4-one Chemical compound C([C@@H](N(CC1)C=2C=NC(NC=3C(N(C)C=C(C=3)C=3C(=C(N4C(C5=CC=6CC(C)(C)CC=6N5CC4)=O)N=CC=3)CO)=O)=CC=2)C)N1C1COC1 WNEODWDFDXWOLU-QHCPKHFHSA-N 0.000 description 1
- NGXOEMGATVAFKE-UHFFFAOYSA-N 3-bromoprop-1-yne;n-(2-methoxyethyl)-n-methylprop-2-yn-1-amine Chemical compound BrCC#C.COCCN(C)CC#C NGXOEMGATVAFKE-UHFFFAOYSA-N 0.000 description 1
- CXBMZBDYEDCGKC-UHFFFAOYSA-N 3-chloro-4-(1,3-thiazol-2-ylsulfanyl)aniline Chemical compound ClC1=CC(N)=CC=C1SC1=NC=CS1 CXBMZBDYEDCGKC-UHFFFAOYSA-N 0.000 description 1
- FCBHQMOJUBMEQO-UHFFFAOYSA-N 3-chloro-4-(4,6-dimethylpyrimidin-2-yl)sulfanylaniline Chemical compound CC1=CC(C)=NC(SC=2C(=CC(N)=CC=2)Cl)=N1 FCBHQMOJUBMEQO-UHFFFAOYSA-N 0.000 description 1
- TYKICIVELAQYGM-UHFFFAOYSA-N 3-chloro-4-(4-methylpyrimidin-2-yl)sulfanylaniline Chemical compound CC1=CC=NC(SC=2C(=CC(N)=CC=2)Cl)=N1 TYKICIVELAQYGM-UHFFFAOYSA-N 0.000 description 1
- NQCQVNHLNXCSPY-UHFFFAOYSA-N 3-chloropropyl 4-methylbenzenesulfonate Chemical compound CC1=CC=C(S(=O)(=O)OCCCCl)C=C1 NQCQVNHLNXCSPY-UHFFFAOYSA-N 0.000 description 1
- SXOPCLUOUFQBJV-UHFFFAOYSA-N 3-methoxyanthranilic acid Chemical compound COC1=CC=CC(C(O)=O)=C1N SXOPCLUOUFQBJV-UHFFFAOYSA-N 0.000 description 1
- ASFAFOSQXBRFMV-LJQANCHMSA-N 3-n-(2-benzyl-1,3-dihydroxypropan-2-yl)-1-n-[(1r)-1-(4-fluorophenyl)ethyl]-5-[methyl(methylsulfonyl)amino]benzene-1,3-dicarboxamide Chemical compound N([C@H](C)C=1C=CC(F)=CC=1)C(=O)C(C=1)=CC(N(C)S(C)(=O)=O)=CC=1C(=O)NC(CO)(CO)CC1=CC=CC=C1 ASFAFOSQXBRFMV-LJQANCHMSA-N 0.000 description 1
- OCVLSHAVSIYKLI-UHFFFAOYSA-N 3h-1,3-thiazole-2-thione Chemical compound SC1=NC=CS1 OCVLSHAVSIYKLI-UHFFFAOYSA-N 0.000 description 1
- DCIGBUYSYRJHIJ-UHFFFAOYSA-N 4-(1h-indazol-6-ylamino)-5-methoxyquinoline-3-carbonitrile Chemical compound C1=C2C=NNC2=CC(NC=2C(C#N)=CN=C3C=CC=C(C=23)OC)=C1 DCIGBUYSYRJHIJ-UHFFFAOYSA-N 0.000 description 1
- ZFEGVOZAULXMAI-UHFFFAOYSA-N 4-(1h-indazol-6-ylamino)-6,7-dimethoxyquinoline-3-carbonitrile Chemical compound C1=C2C=NNC2=CC(NC=2C(C#N)=CN=C3C=C(C(=CC3=2)OC)OC)=C1 ZFEGVOZAULXMAI-UHFFFAOYSA-N 0.000 description 1
- XEIXNXYVWHRHIG-UHFFFAOYSA-N 4-(1h-indazol-6-ylamino)-6-methoxy-7-(2-morpholin-4-ylethoxy)quinoline-3-carbonitrile Chemical compound COC1=CC2=C(NC=3C=C4NN=CC4=CC=3)C(C#N)=CN=C2C=C1OCCN1CCOCC1 XEIXNXYVWHRHIG-UHFFFAOYSA-N 0.000 description 1
- OMSAOAKIZAHJQS-UHFFFAOYSA-N 4-(1h-indazol-6-ylamino)-6-methoxy-7-(2-thiomorpholin-4-ylethoxy)quinoline-3-carbonitrile Chemical compound COC1=CC2=C(NC=3C=C4NN=CC4=CC=3)C(C#N)=CN=C2C=C1OCCN1CCSCC1 OMSAOAKIZAHJQS-UHFFFAOYSA-N 0.000 description 1
- RITJETIJBGFZSI-UHFFFAOYSA-N 4-(1h-indazol-6-ylamino)-6-methoxy-7-(3-morpholin-4-ylpropoxy)quinoline-3-carbonitrile Chemical compound COC1=CC2=C(NC=3C=C4NN=CC4=CC=3)C(C#N)=CN=C2C=C1OCCCN1CCOCC1 RITJETIJBGFZSI-UHFFFAOYSA-N 0.000 description 1
- BJYQPZAVSHQNCD-UHFFFAOYSA-N 4-(1h-indazol-6-ylamino)-6-methoxyquinoline-3-carbonitrile Chemical compound C1=C2C=NNC2=CC(NC2=C(C#N)C=NC3=CC=C(C=C32)OC)=C1 BJYQPZAVSHQNCD-UHFFFAOYSA-N 0.000 description 1
- OYHUXDIFPVETOK-UHFFFAOYSA-N 4-(1h-indazol-6-ylamino)-7-methoxy-6-(3-morpholin-4-ylpropoxy)quinoline-3-carbonitrile Chemical compound COC1=CC2=NC=C(C#N)C(NC=3C=C4NN=CC4=CC=3)=C2C=C1OCCCN1CCOCC1 OYHUXDIFPVETOK-UHFFFAOYSA-N 0.000 description 1
- NGKIUYTYCDGUQN-UHFFFAOYSA-N 4-(1h-indazol-6-ylamino)-8-methoxyquinoline-3-carbonitrile Chemical compound C1=C2C=NNC2=CC(NC2=C3C=CC=C(C3=NC=C2C#N)OC)=C1 NGKIUYTYCDGUQN-UHFFFAOYSA-N 0.000 description 1
- BKVDWYDOKDMLQD-UHFFFAOYSA-N 4-(1h-indol-5-ylamino)-6,7-dimethoxyquinoline-3-carbonitrile Chemical compound C1=C2NC=CC2=CC(NC=2C(C#N)=CN=C3C=C(C(=CC3=2)OC)OC)=C1 BKVDWYDOKDMLQD-UHFFFAOYSA-N 0.000 description 1
- WDZXAWAANRQCGP-UHFFFAOYSA-N 4-(1h-indol-5-ylamino)-7-methoxyquinoline-3-carbonitrile Chemical compound C1=C2NC=CC2=CC(NC=2C3=CC=C(C=C3N=CC=2C#N)OC)=C1 WDZXAWAANRQCGP-UHFFFAOYSA-N 0.000 description 1
- IRYNXXKQLIQSNU-UHFFFAOYSA-N 4-(2,3-dihydro-1h-inden-5-ylamino)-6,7-diethoxyquinoline-3-carbonitrile Chemical compound C1=C2CCCC2=CC(NC=2C(C#N)=CN=C3C=C(C(=CC3=2)OCC)OCC)=C1 IRYNXXKQLIQSNU-UHFFFAOYSA-N 0.000 description 1
- WBFSZZFPFIBEKO-UHFFFAOYSA-N 4-(2,3-dihydro-1h-indol-6-ylamino)-6,7-diethoxyquinoline-3-carbonitrile Chemical compound C1=C2CCNC2=CC(NC=2C(C#N)=CN=C3C=C(C(=CC3=2)OCC)OCC)=C1 WBFSZZFPFIBEKO-UHFFFAOYSA-N 0.000 description 1
- LPXLCMLBLVOTHO-UHFFFAOYSA-N 4-(2,4-dichloro-5-methoxyanilino)-6-methoxy-7-[2-(triazol-1-yl)ethoxy]quinoline-3-carbonitrile Chemical compound C1=C(Cl)C(OC)=CC(NC=2C3=CC(OC)=C(OCCN4N=NC=C4)C=C3N=CC=2C#N)=C1Cl LPXLCMLBLVOTHO-UHFFFAOYSA-N 0.000 description 1
- RDHQDDFAQBBVFW-UHFFFAOYSA-N 4-(2-amino-4-chloroanilino)-6,7-dimethoxyquinoline-3-carbonitrile Chemical compound C=12C=C(OC)C(OC)=CC2=NC=C(C#N)C=1NC1=CC=C(Cl)C=C1N RDHQDDFAQBBVFW-UHFFFAOYSA-N 0.000 description 1
- KSDHXIMUUMNNKR-UHFFFAOYSA-N 4-(2-chloro-5-methoxyanilino)-5-methoxyquinoline-3-carbonitrile Chemical compound COC1=CC=C(Cl)C(NC=2C3=C(OC)C=CC=C3N=CC=2C#N)=C1 KSDHXIMUUMNNKR-UHFFFAOYSA-N 0.000 description 1
- OXWHCUAMAHBZCE-UHFFFAOYSA-N 4-(2-chloroethoxy)-5-methoxy-2-nitrobenzoic acid Chemical compound COC1=CC(C(O)=O)=C([N+]([O-])=O)C=C1OCCCl OXWHCUAMAHBZCE-UHFFFAOYSA-N 0.000 description 1
- ZJLXXZQYFCMKJD-UHFFFAOYSA-N 4-(2h-benzotriazol-5-ylamino)-6,7,8-trimethoxyquinoline-3-carbonitrile Chemical compound C1=C2N=NNC2=CC(NC2=C3C=C(C(=C(OC)C3=NC=C2C#N)OC)OC)=C1 ZJLXXZQYFCMKJD-UHFFFAOYSA-N 0.000 description 1
- GDMGDNKXZKMWTF-UHFFFAOYSA-N 4-(2h-benzotriazol-5-ylamino)-6,7-diethoxyquinoline-3-carbonitrile Chemical compound C1=C2NN=NC2=CC(NC=2C(C#N)=CN=C3C=C(C(=CC3=2)OCC)OCC)=C1 GDMGDNKXZKMWTF-UHFFFAOYSA-N 0.000 description 1
- JWMBVLJKYAGLMR-UHFFFAOYSA-N 4-(2h-benzotriazol-5-ylamino)-6-methoxyquinoline-3-carbonitrile Chemical compound C1=C2N=NNC2=CC(NC2=C(C#N)C=NC3=CC=C(C=C32)OC)=C1 JWMBVLJKYAGLMR-UHFFFAOYSA-N 0.000 description 1
- AMNZDZLZSGVOSM-UHFFFAOYSA-N 4-(2h-benzotriazol-5-ylamino)-7-methoxy-6-(3-morpholin-4-ylpropoxy)quinoline-3-carbonitrile;hydrochloride Chemical compound Cl.COC1=CC2=NC=C(C#N)C(NC=3C=C4N=NNC4=CC=3)=C2C=C1OCCCN1CCOCC1 AMNZDZLZSGVOSM-UHFFFAOYSA-N 0.000 description 1
- BQPYRSRITIQRBG-UHFFFAOYSA-N 4-(2h-benzotriazol-5-ylamino)-8-methoxyquinoline-3-carbonitrile Chemical compound C1=C2N=NNC2=CC(NC2=C3C=CC=C(C3=NC=C2C#N)OC)=C1 BQPYRSRITIQRBG-UHFFFAOYSA-N 0.000 description 1
- DUWTXLKMDXBMEH-UHFFFAOYSA-N 4-(3-chloro-4-imidazol-1-ylanilino)-6-methoxy-7-(3-morpholin-4-ylpropoxy)quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OCCCN3CCOCC3)C(OC)=CC2=C1NC(C=C1Cl)=CC=C1N1C=CN=C1 DUWTXLKMDXBMEH-UHFFFAOYSA-N 0.000 description 1
- YZUCBZHBBMZNFL-UHFFFAOYSA-N 4-(3-chloro-4-imidazol-1-ylanilino)-7-methoxy-6-nitroquinoline-3-carbonitrile Chemical compound C=12C=C([N+]([O-])=O)C(OC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1N1C=CN=C1 YZUCBZHBBMZNFL-UHFFFAOYSA-N 0.000 description 1
- AKDWVSXIHDEBDY-UHFFFAOYSA-N 4-(3-chloro-4-pyridin-4-yloxyanilino)-6-methoxy-7-(3-morpholin-4-ylpropoxy)quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OCCCN3CCOCC3)C(OC)=CC2=C1NC(C=C1Cl)=CC=C1OC1=CC=NC=C1 AKDWVSXIHDEBDY-UHFFFAOYSA-N 0.000 description 1
- AFBVAKVQERCPNX-UHFFFAOYSA-N 4-(3-chloro-4-pyridin-4-yloxyanilino)-7-ethoxy-6-nitroquinoline-3-carbonitrile Chemical compound C=12C=C([N+]([O-])=O)C(OCC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1OC1=CC=NC=C1 AFBVAKVQERCPNX-UHFFFAOYSA-N 0.000 description 1
- IOJGGTMAKCBHSL-UHFFFAOYSA-N 4-(3-chloropropoxy)-3-methoxybenzoic acid Chemical compound COC1=CC(C(O)=O)=CC=C1OCCCCl IOJGGTMAKCBHSL-UHFFFAOYSA-N 0.000 description 1
- PIAZYBLGBSMNLX-UHFFFAOYSA-N 4-(3-chloropropyl)morpholine Chemical compound ClCCCN1CCOCC1 PIAZYBLGBSMNLX-UHFFFAOYSA-N 0.000 description 1
- UPNHCRXYRMEMCJ-UHFFFAOYSA-N 4-(4-benzylanilino)-6-methoxy-7-[2-(triazol-1-yl)ethoxy]quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OCCN3N=NC=C3)C(OC)=CC2=C1NC(C=C1)=CC=C1CC1=CC=CC=C1 UPNHCRXYRMEMCJ-UHFFFAOYSA-N 0.000 description 1
- OMPVKDKRQSTCRY-UHFFFAOYSA-N 4-(4-benzylanilino)-6-methoxy-7-[2-(triazol-2-yl)ethoxy]quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OCCN3N=CC=N3)C(OC)=CC2=C1NC(C=C1)=CC=C1CC1=CC=CC=C1 OMPVKDKRQSTCRY-UHFFFAOYSA-N 0.000 description 1
- LUNUNJFSHKSXGQ-UHFFFAOYSA-N 4-Aminoindole Chemical compound NC1=CC=CC2=C1C=CN2 LUNUNJFSHKSXGQ-UHFFFAOYSA-N 0.000 description 1
- COSYWMZOAGREHD-UHFFFAOYSA-N 4-[(1,3-dioxoisoindol-5-yl)amino]-6,7-diethoxyquinoline-3-carbonitrile Chemical compound C1=C2C(=O)NC(=O)C2=CC(NC=2C(C#N)=CN=C3C=C(C(=CC3=2)OCC)OCC)=C1 COSYWMZOAGREHD-UHFFFAOYSA-N 0.000 description 1
- IOYKBTRVEQLCOW-UHFFFAOYSA-N 4-[(1,4-dioxo-2,3-dihydrophthalazin-6-yl)amino]-6,7-diethoxyquinoline-3-carbonitrile Chemical compound O=C1NNC(=O)C=2C1=CC(NC=1C(C#N)=CN=C3C=C(C(=CC3=1)OCC)OCC)=CC=2 IOYKBTRVEQLCOW-UHFFFAOYSA-N 0.000 description 1
- IMPFMBHLMWTDCL-UHFFFAOYSA-N 4-[(2-hydroxynaphthalen-1-yl)amino]-6,7-dimethoxyquinoline-3-carbonitrile Chemical compound C1=CC=C2C(NC=3C(C#N)=CN=C4C=C(C(=CC4=3)OC)OC)=C(O)C=CC2=C1 IMPFMBHLMWTDCL-UHFFFAOYSA-N 0.000 description 1
- SSZLDEGEMCYNDX-UHFFFAOYSA-N 4-[(4-chloronaphthalen-1-yl)amino]-6,7-dimethoxyquinoline-3-carbonitrile Chemical compound C1=CC=C2C(NC=3C(C#N)=CN=C4C=C(C(=CC4=3)OC)OC)=CC=C(Cl)C2=C1 SSZLDEGEMCYNDX-UHFFFAOYSA-N 0.000 description 1
- CNSPCGJFXFXSNP-UHFFFAOYSA-N 4-[(4-phenyl-1,3-thiazol-2-yl)sulfanyl]-3-(trifluoromethyl)aniline Chemical compound FC(F)(F)C1=CC(N)=CC=C1SC1=NC(C=2C=CC=CC=2)=CS1 CNSPCGJFXFXSNP-UHFFFAOYSA-N 0.000 description 1
- XDUKVKRZCJUKFV-UHFFFAOYSA-N 4-[(6-hydroxynaphthalen-1-yl)amino]-6,7-dimethoxyquinoline-3-carbonitrile Chemical compound OC1=CC=C2C(NC=3C(C#N)=CN=C4C=C(C(=CC4=3)OC)OC)=CC=CC2=C1 XDUKVKRZCJUKFV-UHFFFAOYSA-N 0.000 description 1
- BYNRKWQKBHWGGE-UHFFFAOYSA-N 4-[(8-hydroxyquinolin-5-yl)amino]-6,7-dimethoxyquinoline-3-carbonitrile Chemical compound C1=CC=C2C(NC=3C(C#N)=CN=C4C=C(C(=CC4=3)OC)OC)=CC=C(O)C2=N1 BYNRKWQKBHWGGE-UHFFFAOYSA-N 0.000 description 1
- FDTPFIHQZMKVHQ-UHFFFAOYSA-N 4-[2-chloro-4-(1,3-thiazol-2-ylsulfanyl)anilino]-6-methoxy-7-(3-morpholin-4-ylpropoxy)quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OCCCN3CCOCC3)C(OC)=CC2=C1NC(C(=C1)Cl)=CC=C1SC1=NC=CS1 FDTPFIHQZMKVHQ-UHFFFAOYSA-N 0.000 description 1
- RLFKVPONPJXBKA-UHFFFAOYSA-N 4-[3-chloro-4-(1,3-dimethyl-2,4,6-trioxo-1,3-diazinan-5-yl)anilino]-7-methoxy-6-nitroquinoline-3-carbonitrile Chemical compound C=12C=C([N+]([O-])=O)C(OC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1C1C(=O)N(C)C(=O)N(C)C1=O RLFKVPONPJXBKA-UHFFFAOYSA-N 0.000 description 1
- CMVKEXAGGLTLLN-UHFFFAOYSA-N 4-[3-chloro-4-(1,3-thiazol-2-ylsulfanyl)anilino]-7-methoxy-6-nitroquinoline-3-carbonitrile Chemical compound C=12C=C([N+]([O-])=O)C(OC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1SC1=NC=CS1 CMVKEXAGGLTLLN-UHFFFAOYSA-N 0.000 description 1
- QSENMPAGYMUVDE-UHFFFAOYSA-N 4-[3-chloro-4-(1-methylimidazol-2-yl)sulfanylanilino]-6-methoxy-7-(3-morpholin-4-ylpropoxy)quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OCCCN3CCOCC3)C(OC)=CC2=C1NC(C=C1Cl)=CC=C1SC1=NC=CN1C QSENMPAGYMUVDE-UHFFFAOYSA-N 0.000 description 1
- QQYYVYVMWSUSFE-UHFFFAOYSA-N 4-[3-chloro-4-(1-methylimidazol-2-yl)sulfanylanilino]-6-methoxy-7-[3-(triazol-1-yl)propoxy]quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OCCCN3N=NC=C3)C(OC)=CC2=C1NC(C=C1Cl)=CC=C1SC1=NC=CN1C QQYYVYVMWSUSFE-UHFFFAOYSA-N 0.000 description 1
- JBPRXEZRICHEQL-UHFFFAOYSA-N 4-[3-chloro-4-(1-methylimidazol-2-yl)sulfanylanilino]-7-methoxy-6-nitroquinoline-3-carbonitrile Chemical compound C=12C=C([N+]([O-])=O)C(OC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1SC1=NC=CN1C JBPRXEZRICHEQL-UHFFFAOYSA-N 0.000 description 1
- FHKKUUWSSRVDSR-UHFFFAOYSA-N 4-[3-chloro-4-(4,6-dimethylpyrimidin-2-yl)sulfanylanilino]-6,7-dimethoxyquinoline-3-carbonitrile Chemical compound C=12C=C(OC)C(OC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1SC1=NC(C)=CC(C)=N1 FHKKUUWSSRVDSR-UHFFFAOYSA-N 0.000 description 1
- NIYHIVAMBMDDMF-UHFFFAOYSA-N 4-[3-chloro-4-(4,6-dimethylpyrimidin-2-yl)sulfanylanilino]-6-methoxy-7-(3-morpholin-4-ylpropoxy)quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OCCCN3CCOCC3)C(OC)=CC2=C1NC(C=C1Cl)=CC=C1SC1=NC(C)=CC(C)=N1 NIYHIVAMBMDDMF-UHFFFAOYSA-N 0.000 description 1
- KSGUZNOLQLUPIO-UHFFFAOYSA-N 4-[3-chloro-4-(4,6-dimethylpyrimidin-2-yl)sulfanylanilino]-7-ethoxy-6-nitroquinoline-3-carbonitrile Chemical compound C=12C=C([N+]([O-])=O)C(OCC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1SC1=NC(C)=CC(C)=N1 KSGUZNOLQLUPIO-UHFFFAOYSA-N 0.000 description 1
- XDYANSYIIQQVFA-UHFFFAOYSA-N 4-[3-chloro-4-(4-methylpyrimidin-2-yl)sulfanylanilino]-7-ethoxy-6-nitroquinoline-3-carbonitrile Chemical compound C=12C=C([N+]([O-])=O)C(OCC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1SC1=NC=CC(C)=N1 XDYANSYIIQQVFA-UHFFFAOYSA-N 0.000 description 1
- KPZRSEIRPLNMMY-UHFFFAOYSA-N 4-[3-chloro-4-(pyridin-3-ylmethylamino)anilino]-7-methoxy-6-nitroquinoline-3-carbonitrile Chemical compound C=12C=C([N+]([O-])=O)C(OC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1NCC1=CC=CN=C1 KPZRSEIRPLNMMY-UHFFFAOYSA-N 0.000 description 1
- LDCKKEMYYQNVNO-UHFFFAOYSA-N 4-[3-chloro-4-[(4-phenyl-1,3-thiazol-2-yl)sulfanyl]anilino]-7-methoxy-6-nitroquinoline-3-carbonitrile Chemical compound C=12C=C([N+]([O-])=O)C(OC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1SC(SC=1)=NC=1C1=CC=CC=C1 LDCKKEMYYQNVNO-UHFFFAOYSA-N 0.000 description 1
- NHLHWCWINCXYMW-UHFFFAOYSA-N 4-[3-chloro-4-[[5-(trifluoromethyl)-1,3,4-thiadiazol-2-yl]amino]anilino]-7-ethoxy-6-nitroquinoline-3-carbonitrile Chemical compound C=12C=C([N+]([O-])=O)C(OCC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1NC1=NN=C(C(F)(F)F)S1 NHLHWCWINCXYMW-UHFFFAOYSA-N 0.000 description 1
- YMIFNGSPHYEZKY-UHFFFAOYSA-N 4-[4-(1h-imidazol-2-ylmethyl)anilino]-6-methoxy-7-(3-morpholin-4-ylpropoxy)quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OCCCN3CCOCC3)C(OC)=CC2=C1NC(C=C1)=CC=C1CC1=NC=CN1 YMIFNGSPHYEZKY-UHFFFAOYSA-N 0.000 description 1
- BHTRIOACHHZTHX-UHFFFAOYSA-N 4-[4-(2,6-dimethoxyphenoxy)anilino]-6-methoxy-7-(3-morpholin-4-ylpropoxy)quinoline-3-carbonitrile Chemical compound COC1=CC=CC(OC)=C1OC(C=C1)=CC=C1NC1=C(C#N)C=NC2=CC(OCCCN3CCOCC3)=C(OC)C=C12 BHTRIOACHHZTHX-UHFFFAOYSA-N 0.000 description 1
- LUEWNRLTDMQMAK-UHFFFAOYSA-N 4-[4-(furan-2-ylmethyl)anilino]-6-methoxy-7-(3-morpholin-4-ylpropoxy)quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OCCCN3CCOCC3)C(OC)=CC2=C1NC(C=C1)=CC=C1CC1=CC=CO1 LUEWNRLTDMQMAK-UHFFFAOYSA-N 0.000 description 1
- XZEXYZLBZDJFEC-UHFFFAOYSA-N 4-[4-(furan-3-ylmethyl)anilino]-6-methoxy-7-(3-morpholin-4-ylpropoxy)quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OCCCN3CCOCC3)C(OC)=CC2=C1NC(C=C1)=CC=C1CC=1C=COC=1 XZEXYZLBZDJFEC-UHFFFAOYSA-N 0.000 description 1
- KVCQTKNUUQOELD-UHFFFAOYSA-N 4-amino-n-[1-(3-chloro-2-fluoroanilino)-6-methylisoquinolin-5-yl]thieno[3,2-d]pyrimidine-7-carboxamide Chemical compound N=1C=CC2=C(NC(=O)C=3C4=NC=NC(N)=C4SC=3)C(C)=CC=C2C=1NC1=CC=CC(Cl)=C1F KVCQTKNUUQOELD-UHFFFAOYSA-N 0.000 description 1
- CYAPADVQYMCNRE-UHFFFAOYSA-N 4-aminobenzene-1,2-dicarbohydrazide;hydrate Chemical compound O.NNC(=O)C1=CC=C(N)C=C1C(=O)NN CYAPADVQYMCNRE-UHFFFAOYSA-N 0.000 description 1
- QEYAMZRQGHAJKB-UHFFFAOYSA-N 4-chloro-8-methoxy-6-nitroquinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C(OC)=CC([N+]([O-])=O)=CC2=C1Cl QEYAMZRQGHAJKB-UHFFFAOYSA-N 0.000 description 1
- HCXMIOZRXOIQHX-UHFFFAOYSA-N 4-chloroquinoline-3-carbonitrile Chemical class C1=CC=C2C(Cl)=C(C#N)C=NC2=C1 HCXMIOZRXOIQHX-UHFFFAOYSA-N 0.000 description 1
- TYMLOMAKGOJONV-UHFFFAOYSA-N 4-nitroaniline Chemical compound NC1=CC=C([N+]([O-])=O)C=C1 TYMLOMAKGOJONV-UHFFFAOYSA-N 0.000 description 1
- IRPVABHDSJVBNZ-RTHVDDQRSA-N 5-[1-(cyclopropylmethyl)-5-[(1R,5S)-3-(oxetan-3-yl)-3-azabicyclo[3.1.0]hexan-6-yl]pyrazol-3-yl]-3-(trifluoromethyl)pyridin-2-amine Chemical compound C1=C(C(F)(F)F)C(N)=NC=C1C1=NN(CC2CC2)C(C2[C@@H]3CN(C[C@@H]32)C2COC2)=C1 IRPVABHDSJVBNZ-RTHVDDQRSA-N 0.000 description 1
- PXRKCOCTEMYUEG-UHFFFAOYSA-N 5-aminoisoindole-1,3-dione Chemical compound NC1=CC=C2C(=O)NC(=O)C2=C1 PXRKCOCTEMYUEG-UHFFFAOYSA-N 0.000 description 1
- DTVYNUOOZIKEEX-UHFFFAOYSA-N 5-aminoisoquinoline Chemical compound N1=CC=C2C(N)=CC=CC2=C1 DTVYNUOOZIKEEX-UHFFFAOYSA-N 0.000 description 1
- KDOPAZIWBAHVJB-UHFFFAOYSA-N 5h-pyrrolo[3,2-d]pyrimidine Chemical compound C1=NC=C2NC=CC2=N1 KDOPAZIWBAHVJB-UHFFFAOYSA-N 0.000 description 1
- OSEUPZCZARJHJZ-UHFFFAOYSA-N 6,7-dimethoxy-4-(5,6,7,8-tetrahydronaphthalen-1-ylamino)quinoline-3-carbonitrile Chemical compound C1CCCC2=C1C=CC=C2NC1=C(C=C(C(OC)=C2)OC)C2=NC=C1C#N OSEUPZCZARJHJZ-UHFFFAOYSA-N 0.000 description 1
- KKDPSZLBMSZVEO-UHFFFAOYSA-N 6,7-dimethoxy-4-(quinolin-5-ylamino)quinoline-3-carbonitrile Chemical compound C1=CC=C2C(NC=3C(C#N)=CN=C4C=C(C(=CC4=3)OC)OC)=CC=CC2=N1 KKDPSZLBMSZVEO-UHFFFAOYSA-N 0.000 description 1
- WQLLLESRGXOQFZ-UHFFFAOYSA-N 6,7-dimethoxy-4-(quinolin-6-ylamino)quinoline-3-carbonitrile Chemical compound N1=CC=CC2=CC(NC=3C(C#N)=CN=C4C=C(C(=CC4=3)OC)OC)=CC=C21 WQLLLESRGXOQFZ-UHFFFAOYSA-N 0.000 description 1
- VSGIFDHTTJILBR-UHFFFAOYSA-N 6,7-dimethoxy-4-[(2-methyl-1,3-benzothiazol-5-yl)amino]quinoline-3-carbonitrile Chemical compound C1=C2SC(C)=NC2=CC(NC=2C(C#N)=CN=C3C=C(C(=CC3=2)OC)OC)=C1 VSGIFDHTTJILBR-UHFFFAOYSA-N 0.000 description 1
- ODERNHJDCVUTLA-UHFFFAOYSA-N 6,7-dimethoxy-4-[(2-methyl-3h-benzimidazol-5-yl)amino]quinoline-3-carbonitrile Chemical compound C1=C2NC(C)=NC2=CC(NC=2C(C#N)=CN=C3C=C(C(=CC3=2)OC)OC)=C1 ODERNHJDCVUTLA-UHFFFAOYSA-N 0.000 description 1
- MCJNSBHWFQPQQJ-UHFFFAOYSA-N 6,7-dimethoxy-4-[(2-oxo-3h-1,3-benzothiazol-6-yl)amino]quinoline-3-carbonitrile Chemical compound C1=C2NC(=O)SC2=CC(NC=2C(C#N)=CN=C3C=C(C(=CC3=2)OC)OC)=C1 MCJNSBHWFQPQQJ-UHFFFAOYSA-N 0.000 description 1
- NKKAXMBPKIGDGY-UHFFFAOYSA-N 6,7-dimethoxy-4-[(2-sulfanylidene-3h-1,3-benzothiazol-6-yl)amino]quinoline-3-carbonitrile Chemical compound C1=C2N=C(S)SC2=CC(NC=2C(C#N)=CN=C3C=C(C(=CC3=2)OC)OC)=C1 NKKAXMBPKIGDGY-UHFFFAOYSA-N 0.000 description 1
- VZJDHPYFCBLKGI-UHFFFAOYSA-N 6,7-dimethoxy-4-oxo-1h-quinoline-3-carbonitrile Chemical compound N1C=C(C#N)C(=O)C2=C1C=C(OC)C(OC)=C2 VZJDHPYFCBLKGI-UHFFFAOYSA-N 0.000 description 1
- BPOVRKHDPWHCSU-UHFFFAOYSA-N 6,7-dimethoxyquinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OC)C(OC)=CC2=C1 BPOVRKHDPWHCSU-UHFFFAOYSA-N 0.000 description 1
- KCBWAFJCKVKYHO-UHFFFAOYSA-N 6-(4-cyclopropyl-6-methoxypyrimidin-5-yl)-1-[[4-[1-propan-2-yl-4-(trifluoromethyl)imidazol-2-yl]phenyl]methyl]pyrazolo[3,4-d]pyrimidine Chemical compound C1(CC1)C1=NC=NC(=C1C1=NC=C2C(=N1)N(N=C2)CC1=CC=C(C=C1)C=1N(C=C(N=1)C(F)(F)F)C(C)C)OC KCBWAFJCKVKYHO-UHFFFAOYSA-N 0.000 description 1
- QEQDLBKVHJXPJA-UHFFFAOYSA-N 6-amino-1h-3,1-benzoxazine-2,4-dione Chemical compound N1C(=O)OC(=O)C2=CC(N)=CC=C21 QEQDLBKVHJXPJA-UHFFFAOYSA-N 0.000 description 1
- UOJCPAAEKXNPQT-UHFFFAOYSA-N 6-amino-2,3-dihydroinden-1-one Chemical compound NC1=CC=C2CCC(=O)C2=C1 UOJCPAAEKXNPQT-UHFFFAOYSA-N 0.000 description 1
- CLYCLRFHPKKUBR-UHFFFAOYSA-N 6-amino-3h-1,3-benzothiazol-2-one Chemical compound NC1=CC=C2N=C(O)SC2=C1 CLYCLRFHPKKUBR-UHFFFAOYSA-N 0.000 description 1
- ZIJZDNKZJZUROE-UHFFFAOYSA-N 6-amino-3h-2-benzofuran-1-one Chemical compound NC1=CC=C2COC(=O)C2=C1 ZIJZDNKZJZUROE-UHFFFAOYSA-N 0.000 description 1
- YQPBIUPQEGURNY-UHFFFAOYSA-N 6-amino-4-(3-chloro-4-imidazol-1-ylanilino)-7-methoxyquinoline-3-carbonitrile Chemical compound C=12C=C(N)C(OC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1N1C=CN=C1 YQPBIUPQEGURNY-UHFFFAOYSA-N 0.000 description 1
- UQGPWYWABDOKTK-UHFFFAOYSA-N 6-amino-4-(3-chloro-4-pyridin-4-yloxyanilino)-7-ethoxyquinoline-3-carbonitrile Chemical compound C=12C=C(N)C(OCC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1OC1=CC=NC=C1 UQGPWYWABDOKTK-UHFFFAOYSA-N 0.000 description 1
- NUSCBIGVFAHUHY-UHFFFAOYSA-N 6-amino-4-[3-chloro-4-(1,3-thiazol-2-ylsulfanyl)anilino]-7-methoxyquinoline-3-carbonitrile Chemical compound C=12C=C(N)C(OC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1SC1=NC=CS1 NUSCBIGVFAHUHY-UHFFFAOYSA-N 0.000 description 1
- FWSAEOZGQGWIJV-UHFFFAOYSA-N 6-amino-4-[3-chloro-4-(1-methylimidazol-2-yl)sulfanylanilino]-7-methoxyquinoline-3-carbonitrile Chemical compound C=12C=C(N)C(OC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1SC1=NC=CN1C FWSAEOZGQGWIJV-UHFFFAOYSA-N 0.000 description 1
- LOPQLRVLRXSZPG-UHFFFAOYSA-N 6-amino-4-[3-chloro-4-(1-methylimidazol-2-yl)sulfanylanilino]quinoline-3-carbonitrile Chemical compound CN1C=CN=C1SC(C(=C1)Cl)=CC=C1NC1=C(C#N)C=NC2=CC=C(N)C=C12 LOPQLRVLRXSZPG-UHFFFAOYSA-N 0.000 description 1
- AJIPBLTYUBMDEJ-UHFFFAOYSA-N 6-amino-4-[3-chloro-4-(4,6-dimethylpyrimidin-2-yl)sulfanylanilino]-7-ethoxyquinoline-3-carbonitrile Chemical compound C=12C=C(N)C(OCC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1SC1=NC(C)=CC(C)=N1 AJIPBLTYUBMDEJ-UHFFFAOYSA-N 0.000 description 1
- VFECEXZTRGISFT-UHFFFAOYSA-N 6-amino-4-[3-chloro-4-(4-methylpyrimidin-2-yl)sulfanylanilino]-7-ethoxyquinoline-3-carbonitrile Chemical compound C=12C=C(N)C(OCC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1SC1=NC=CC(C)=N1 VFECEXZTRGISFT-UHFFFAOYSA-N 0.000 description 1
- ZBQAEIFINZSTGB-UHFFFAOYSA-N 6-amino-4-[3-chloro-4-(imidazol-1-ylmethyl)anilino]-7-ethoxyquinoline-3-carbonitrile Chemical compound C=12C=C(N)C(OCC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1CN1C=CN=C1 ZBQAEIFINZSTGB-UHFFFAOYSA-N 0.000 description 1
- CWYQLHDZSHSODK-UHFFFAOYSA-N 6-amino-4-[3-chloro-4-[(4-oxo-1h-quinazolin-2-yl)sulfanyl]anilino]-7-methoxyquinoline-3-carbonitrile Chemical compound C1=CC=C2NC(SC3=CC=C(C=C3Cl)NC=3C(C#N)=CN=C4C=C(C(=CC4=3)N)OC)=NC(=O)C2=C1 CWYQLHDZSHSODK-UHFFFAOYSA-N 0.000 description 1
- HNQTYYYXUJWSFD-UHFFFAOYSA-N 6-amino-4-[3-chloro-4-[(4-phenyl-1,3-thiazol-2-yl)sulfanyl]anilino]-7-methoxyquinoline-3-carbonitrile Chemical compound C=12C=C(N)C(OC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1SC(SC=1)=NC=1C1=CC=CC=C1 HNQTYYYXUJWSFD-UHFFFAOYSA-N 0.000 description 1
- KXIIIRSFDCABIP-UHFFFAOYSA-N 6-amino-4-[3-chloro-4-[[5-(trifluoromethyl)-1,3,4-thiadiazol-2-yl]amino]anilino]-7-ethoxyquinoline-3-carbonitrile Chemical compound C=12C=C(N)C(OCC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1NC1=NN=C(C(F)(F)F)S1 KXIIIRSFDCABIP-UHFFFAOYSA-N 0.000 description 1
- AEALQRHQTLBCMC-UHFFFAOYSA-N 6-methoxy-4-(4-phenoxyanilino)-7-[2-(triazol-1-yl)ethoxy]quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OCCN3N=NC=C3)C(OC)=CC2=C1NC(C=C1)=CC=C1OC1=CC=CC=C1 AEALQRHQTLBCMC-UHFFFAOYSA-N 0.000 description 1
- LJLWBEHPUCOZAE-UHFFFAOYSA-N 6-methoxy-4-[4-(1-methylimidazol-2-yl)sulfanylanilino]-7-(3-morpholin-4-ylpropoxy)quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OCCCN3CCOCC3)C(OC)=CC2=C1NC(C=C1)=CC=C1SC1=NC=CN1C LJLWBEHPUCOZAE-UHFFFAOYSA-N 0.000 description 1
- YQVKMSHSJBSSJL-UHFFFAOYSA-N 6-methoxy-7-(3-morpholin-4-ylpropoxy)-4-(4-pyridin-2-yloxyanilino)quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OCCCN3CCOCC3)C(OC)=CC2=C1NC(C=C1)=CC=C1OC1=CC=CC=N1 YQVKMSHSJBSSJL-UHFFFAOYSA-N 0.000 description 1
- CNUJRUAZLVYTTE-UHFFFAOYSA-N 6-methoxy-7-(3-morpholin-4-ylpropoxy)-4-(4-pyridin-3-yloxyanilino)quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OCCCN3CCOCC3)C(OC)=CC2=C1NC(C=C1)=CC=C1OC1=CC=CN=C1 CNUJRUAZLVYTTE-UHFFFAOYSA-N 0.000 description 1
- UDXWFLNFPZDWSV-UHFFFAOYSA-N 6-methoxy-7-(3-morpholin-4-ylpropoxy)-4-[4-(2-phenylethyl)anilino]quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OCCCN3CCOCC3)C(OC)=CC2=C1NC(C=C1)=CC=C1CCC1=CC=CC=C1 UDXWFLNFPZDWSV-UHFFFAOYSA-N 0.000 description 1
- NQGYYZDCTPJNBS-UHFFFAOYSA-N 6-methoxy-7-(3-morpholin-4-ylpropoxy)-4-[4-(2h-tetrazol-5-ylmethyl)anilino]quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OCCCN3CCOCC3)C(OC)=CC2=C1NC(C=C1)=CC=C1CC1=NN=NN1 NQGYYZDCTPJNBS-UHFFFAOYSA-N 0.000 description 1
- VXPXKGRZCZHQEL-UHFFFAOYSA-N 6-methoxy-7-(3-morpholin-4-ylpropoxy)-4-[4-(oxolan-2-ylmethyl)anilino]quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OCCCN3CCOCC3)C(OC)=CC2=C1NC(C=C1)=CC=C1CC1CCCO1 VXPXKGRZCZHQEL-UHFFFAOYSA-N 0.000 description 1
- MSBNCZIUNMVKFX-UHFFFAOYSA-N 6-methoxy-7-(3-morpholin-4-ylpropoxy)-4-[4-(oxolan-3-ylmethyl)anilino]quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OCCCN3CCOCC3)C(OC)=CC2=C1NC(C=C1)=CC=C1CC1CCOC1 MSBNCZIUNMVKFX-UHFFFAOYSA-N 0.000 description 1
- HXESXTKTHOPRIA-UHFFFAOYSA-N 6-methoxy-7-(3-morpholin-4-ylpropoxy)-4-[4-(pyridin-2-ylmethyl)anilino]quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OCCCN3CCOCC3)C(OC)=CC2=C1NC(C=C1)=CC=C1CC1=CC=CC=N1 HXESXTKTHOPRIA-UHFFFAOYSA-N 0.000 description 1
- KFOLNPBBIZYUEJ-UHFFFAOYSA-N 6-methoxy-7-(3-morpholin-4-ylpropoxy)-4-[4-(pyridin-3-ylmethyl)anilino]quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OCCCN3CCOCC3)C(OC)=CC2=C1NC(C=C1)=CC=C1CC1=CC=CN=C1 KFOLNPBBIZYUEJ-UHFFFAOYSA-N 0.000 description 1
- YWMGQGRFIAHXCH-UHFFFAOYSA-N 6-methoxy-7-(3-morpholin-4-ylpropoxy)-4-[4-(pyridin-4-ylmethyl)anilino]quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OCCCN3CCOCC3)C(OC)=CC2=C1NC(C=C1)=CC=C1CC1=CC=NC=C1 YWMGQGRFIAHXCH-UHFFFAOYSA-N 0.000 description 1
- MQNXFMWVOMGPAV-UHFFFAOYSA-N 6-methoxy-7-(3-morpholin-4-ylpropoxy)-4-[4-(tetrazol-1-ylmethyl)anilino]quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OCCCN3CCOCC3)C(OC)=CC2=C1NC(C=C1)=CC=C1CN1C=NN=N1 MQNXFMWVOMGPAV-UHFFFAOYSA-N 0.000 description 1
- QUVCRVSEGFQHRT-UHFFFAOYSA-N 6-methoxy-7-(3-morpholin-4-ylpropoxy)-4-[4-(thiophen-2-ylmethyl)anilino]quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OCCCN3CCOCC3)C(OC)=CC2=C1NC(C=C1)=CC=C1CC1=CC=CS1 QUVCRVSEGFQHRT-UHFFFAOYSA-N 0.000 description 1
- FFARQPCCHAWUOM-UHFFFAOYSA-N 6-methoxy-7-(3-morpholin-4-ylpropoxy)-4-[4-(thiophen-3-ylmethyl)anilino]quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OCCCN3CCOCC3)C(OC)=CC2=C1NC(C=C1)=CC=C1CC=1C=CSC=1 FFARQPCCHAWUOM-UHFFFAOYSA-N 0.000 description 1
- QQBVQWPBSQWLPY-UHFFFAOYSA-N 6-methoxy-7-(3-morpholin-4-ylpropoxy)-4-[4-(triazol-1-ylmethyl)anilino]quinoline-3-carbonitrile Chemical compound N#CC1=CN=C2C=C(OCCCN3CCOCC3)C(OC)=CC2=C1NC(C=C1)=CC=C1CN1C=CN=N1 QQBVQWPBSQWLPY-UHFFFAOYSA-N 0.000 description 1
- PZIXIFBGEDRCAM-UHFFFAOYSA-N 6-nitro-4-oxo-1h-quinoline-3-carbonitrile Chemical compound N1C=C(C#N)C(=O)C2=CC([N+](=O)[O-])=CC=C21 PZIXIFBGEDRCAM-UHFFFAOYSA-N 0.000 description 1
- WDYVUKGVKRZQNM-UHFFFAOYSA-N 6-phosphonohexylphosphonic acid Chemical compound OP(O)(=O)CCCCCCP(O)(O)=O WDYVUKGVKRZQNM-UHFFFAOYSA-N 0.000 description 1
- ZWQHQQHGQPCDRZ-UHFFFAOYSA-N 7-(2-methoxyethoxy)quinoline-3-carbonitrile Chemical compound COCCOC1=CC=C2C=C(C=NC2=C1)C#N ZWQHQQHGQPCDRZ-UHFFFAOYSA-N 0.000 description 1
- XVNGCGSASYONOK-UHFFFAOYSA-N 7-(3-chloropropoxy)-4-(1h-indazol-6-ylamino)-6-methoxyquinoline-3-carbonitrile Chemical compound C1=C2C=NNC2=CC(NC2=C3C=C(C(=CC3=NC=C2C#N)OCCCCl)OC)=C1 XVNGCGSASYONOK-UHFFFAOYSA-N 0.000 description 1
- MJXYFLJHTUSJGU-UHFFFAOYSA-N 7-amino-4-methyl-1h-quinolin-2-one Chemical compound NC1=CC=C2C(C)=CC(=O)NC2=C1 MJXYFLJHTUSJGU-UHFFFAOYSA-N 0.000 description 1
- UWYRRKURMGDFSI-UHFFFAOYSA-N 7-ethoxy-4-(1h-indazol-6-ylamino)-6-methoxyquinoline-3-carbonitrile Chemical compound C1=C2C=NNC2=CC(NC=2C(C#N)=CN=C3C=C(C(=CC3=2)OC)OCC)=C1 UWYRRKURMGDFSI-UHFFFAOYSA-N 0.000 description 1
- NUWXFORPZDSWAN-UHFFFAOYSA-N 7-ethoxy-6-nitro-4-[4-[(4-phenyl-1,3-thiazol-2-yl)sulfanyl]-3-(trifluoromethyl)anilino]quinoline-3-carbonitrile Chemical compound C=12C=C([N+]([O-])=O)C(OCC)=CC2=NC=C(C#N)C=1NC(C=C1C(F)(F)F)=CC=C1SC(SC=1)=NC=1C1=CC=CC=C1 NUWXFORPZDSWAN-UHFFFAOYSA-N 0.000 description 1
- NGWOZKQCIQCFCV-UHFFFAOYSA-N 7-hydroxy-4-(1H-indazol-6-ylamino)quinoline-3-carbonitrile Chemical compound C1=C2C=NNC2=CC(NC=2C3=CC=C(C=C3N=CC=2C#N)O)=C1 NGWOZKQCIQCFCV-UHFFFAOYSA-N 0.000 description 1
- CYJRNFFLTBEQSQ-UHFFFAOYSA-N 8-(3-methyl-1-benzothiophen-5-yl)-N-(4-methylsulfonylpyridin-3-yl)quinoxalin-6-amine Chemical compound CS(=O)(=O)C1=C(C=NC=C1)NC=1C=C2N=CC=NC2=C(C=1)C=1C=CC2=C(C(=CS2)C)C=1 CYJRNFFLTBEQSQ-UHFFFAOYSA-N 0.000 description 1
- WREVVZMUNPAPOV-UHFFFAOYSA-N 8-aminoquinoline Chemical compound C1=CN=C2C(N)=CC=CC2=C1 WREVVZMUNPAPOV-UHFFFAOYSA-N 0.000 description 1
- WRDABNWSWOHGMS-UHFFFAOYSA-N AEBSF hydrochloride Chemical compound Cl.NCCC1=CC=C(S(F)(=O)=O)C=C1 WRDABNWSWOHGMS-UHFFFAOYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 239000005995 Aluminium silicate Substances 0.000 description 1
- 102400000068 Angiostatin Human genes 0.000 description 1
- 108010079709 Angiostatins Proteins 0.000 description 1
- 108010087765 Antipain Proteins 0.000 description 1
- 244000105624 Arachis hypogaea Species 0.000 description 1
- NOWKCMXCCJGMRR-UHFFFAOYSA-N Aziridine Chemical compound C1CN1 NOWKCMXCCJGMRR-UHFFFAOYSA-N 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 108010006654 Bleomycin Proteins 0.000 description 1
- BTBUEUYNUDRHOZ-UHFFFAOYSA-N Borate Chemical compound [O-]B([O-])[O-] BTBUEUYNUDRHOZ-UHFFFAOYSA-N 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 1
- 239000004255 Butylated hydroxyanisole Substances 0.000 description 1
- 239000004322 Butylated hydroxytoluene Substances 0.000 description 1
- NLZUEZXRPGMBCV-UHFFFAOYSA-N Butylhydroxytoluene Chemical compound CC1=CC(C(C)(C)C)=C(O)C(C(C)(C)C)=C1 NLZUEZXRPGMBCV-UHFFFAOYSA-N 0.000 description 1
- FMMQYTGMMPPSFK-UHFFFAOYSA-N C(C)OC=1C=C2C=C(C=NC2=CC=1OCC)C#N Chemical compound C(C)OC=1C=C2C=C(C=NC2=CC=1OCC)C#N FMMQYTGMMPPSFK-UHFFFAOYSA-N 0.000 description 1
- 108010075254 C-Peptide Proteins 0.000 description 1
- GDOPTJXRTPNYNR-UHFFFAOYSA-N CC1CCCC1 Chemical compound CC1CCCC1 GDOPTJXRTPNYNR-UHFFFAOYSA-N 0.000 description 1
- 101100283604 Caenorhabditis elegans pigk-1 gene Proteins 0.000 description 1
- KLWPJMFMVPTNCC-UHFFFAOYSA-N Camptothecin Natural products CCC1(O)C(=O)OCC2=C1C=C3C4Nc5ccccc5C=C4CN3C2=O KLWPJMFMVPTNCC-UHFFFAOYSA-N 0.000 description 1
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 1
- 208000017667 Chronic Disease Diseases 0.000 description 1
- 239000012625 DNA intercalator Substances 0.000 description 1
- 206010012689 Diabetic retinopathy Diseases 0.000 description 1
- 235000019739 Dicalciumphosphate Nutrition 0.000 description 1
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 1
- LCGLNKUTAGEVQW-UHFFFAOYSA-N Dimethyl ether Chemical compound COC LCGLNKUTAGEVQW-UHFFFAOYSA-N 0.000 description 1
- MYMOFIZGZYHOMD-UHFFFAOYSA-N Dioxygen Chemical compound O=O MYMOFIZGZYHOMD-UHFFFAOYSA-N 0.000 description 1
- 101150029707 ERBB2 gene Proteins 0.000 description 1
- 102000003951 Erythropoietin Human genes 0.000 description 1
- 108090000394 Erythropoietin Proteins 0.000 description 1
- 240000001414 Eucalyptus viminalis Species 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 102100037362 Fibronectin Human genes 0.000 description 1
- 108010067306 Fibronectins Proteins 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 101001014196 Homo sapiens Dual specificity mitogen-activated protein kinase kinase 1 Proteins 0.000 description 1
- 101001052493 Homo sapiens Mitogen-activated protein kinase 1 Proteins 0.000 description 1
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 102000016844 Immunoglobulin-like domains Human genes 0.000 description 1
- 108050006430 Immunoglobulin-like domains Proteins 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 1
- 239000012448 Lithium borohydride Substances 0.000 description 1
- 230000005723 MEK inhibition Effects 0.000 description 1
- 206010027480 Metastatic malignant melanoma Diseases 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- QPJVMBTYPHYUOC-UHFFFAOYSA-N Methyl benzoate Natural products COC(=O)C1=CC=CC=C1 QPJVMBTYPHYUOC-UHFFFAOYSA-N 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- 102000044589 Mitogen-Activated Protein Kinase 1 Human genes 0.000 description 1
- 108700015928 Mitogen-activated protein kinase 13 Proteins 0.000 description 1
- 238000006751 Mitsunobu reaction Methods 0.000 description 1
- AYCPARAPKDAOEN-LJQANCHMSA-N N-[(1S)-2-(dimethylamino)-1-phenylethyl]-6,6-dimethyl-3-[(2-methyl-4-thieno[3,2-d]pyrimidinyl)amino]-1,4-dihydropyrrolo[3,4-c]pyrazole-5-carboxamide Chemical compound C1([C@H](NC(=O)N2C(C=3NN=C(NC=4C=5SC=CC=5N=C(C)N=4)C=3C2)(C)C)CN(C)C)=CC=CC=C1 AYCPARAPKDAOEN-LJQANCHMSA-N 0.000 description 1
- BKAYIFDRRZZKNF-VIFPVBQESA-N N-acetylcarnosine Chemical compound CC(=O)NCCC(=O)N[C@H](C(O)=O)CC1=CN=CN1 BKAYIFDRRZZKNF-VIFPVBQESA-N 0.000 description 1
- PHSPJQZRQAJPPF-UHFFFAOYSA-N N-alpha-Methylhistamine Chemical compound CNCCC1=CN=CN1 PHSPJQZRQAJPPF-UHFFFAOYSA-N 0.000 description 1
- OPKOKAMJFNKNAS-UHFFFAOYSA-N N-methylethanolamine Chemical compound CNCCO OPKOKAMJFNKNAS-UHFFFAOYSA-N 0.000 description 1
- IDRGFNPZDVBSSE-UHFFFAOYSA-N OCCN1CCN(CC1)c1ccc(Nc2ncc3cccc(-c4cccc(NC(=O)C=C)c4)c3n2)c(F)c1F Chemical compound OCCN1CCN(CC1)c1ccc(Nc2ncc3cccc(-c4cccc(NC(=O)C=C)c4)c3n2)c(F)c1F IDRGFNPZDVBSSE-UHFFFAOYSA-N 0.000 description 1
- 108010074118 Oncogene Proteins v-erbB Proteins 0.000 description 1
- 235000019502 Orange oil Nutrition 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- SOHAVULMGIITDH-UHFFFAOYSA-N Oxaline Natural products O=C1NC23N(OC)C4=CC=CC=C4C3(C(C)(C)C=C)C=C(OC)C(=O)N2C1=CC1=CN=CN1 SOHAVULMGIITDH-UHFFFAOYSA-N 0.000 description 1
- 108091008606 PDGF receptors Proteins 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 229930012538 Paclitaxel Natural products 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 102000003992 Peroxidases Human genes 0.000 description 1
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 1
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 1
- 102000011653 Platelet-Derived Growth Factor Receptors Human genes 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 208000006994 Precancerous Conditions Diseases 0.000 description 1
- 102000001708 Protein Isoforms Human genes 0.000 description 1
- 108010029485 Protein Isoforms Proteins 0.000 description 1
- 102000001253 Protein Kinase Human genes 0.000 description 1
- 108700020978 Proto-Oncogene Proteins 0.000 description 1
- 102000052575 Proto-Oncogene Human genes 0.000 description 1
- 201000004681 Psoriasis Diseases 0.000 description 1
- 239000012980 RPMI-1640 medium Substances 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- DHXVGJBLRPWPCS-UHFFFAOYSA-N Tetrahydropyran Chemical compound C1CCOCC1 DHXVGJBLRPWPCS-UHFFFAOYSA-N 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- ATJFFYVFTNAWJD-UHFFFAOYSA-N Tin Chemical compound [Sn] ATJFFYVFTNAWJD-UHFFFAOYSA-N 0.000 description 1
- 108091023040 Transcription factor Proteins 0.000 description 1
- 102000040945 Transcription factor Human genes 0.000 description 1
- 102100023935 Transmembrane glycoprotein NMB Human genes 0.000 description 1
- 239000013504 Triton X-100 Substances 0.000 description 1
- 229920004890 Triton X-100 Polymers 0.000 description 1
- 229940076850 Tyrosine phosphatase inhibitor Drugs 0.000 description 1
- 108091008605 VEGF receptors Proteins 0.000 description 1
- 102000009484 Vascular Endothelial Growth Factor Receptors Human genes 0.000 description 1
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 1
- 229930003427 Vitamin E Natural products 0.000 description 1
- 240000008042 Zea mays Species 0.000 description 1
- LXRZVMYMQHNYJB-UNXOBOICSA-N [(1R,2S,4R)-4-[[5-[4-[(1R)-7-chloro-1,2,3,4-tetrahydroisoquinolin-1-yl]-5-methylthiophene-2-carbonyl]pyrimidin-4-yl]amino]-2-hydroxycyclopentyl]methyl sulfamate Chemical compound CC1=C(C=C(S1)C(=O)C1=C(N[C@H]2C[C@H](O)[C@@H](COS(N)(=O)=O)C2)N=CN=C1)[C@@H]1NCCC2=C1C=C(Cl)C=C2 LXRZVMYMQHNYJB-UNXOBOICSA-N 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- HFBMWMNUJJDEQZ-UHFFFAOYSA-N acryloyl chloride Chemical compound ClC(=O)C=C HFBMWMNUJJDEQZ-UHFFFAOYSA-N 0.000 description 1
- 230000010933 acylation Effects 0.000 description 1
- 238000005917 acylation reaction Methods 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 229940009456 adriamycin Drugs 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 206010064930 age-related macular degeneration Diseases 0.000 description 1
- 239000005456 alcohol based solvent Substances 0.000 description 1
- 125000000033 alkoxyamino group Chemical group 0.000 description 1
- 125000003418 alkyl amino alkoxy group Chemical group 0.000 description 1
- 239000002168 alkylating agent Substances 0.000 description 1
- 229940100198 alkylating agent Drugs 0.000 description 1
- 125000005139 alkynylsulfonyl group Chemical group 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 235000012211 aluminium silicate Nutrition 0.000 description 1
- 150000001408 amides Chemical group 0.000 description 1
- 235000001014 amino acid Nutrition 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 150000001414 amino alcohols Chemical class 0.000 description 1
- 125000005122 aminoalkylamino group Chemical group 0.000 description 1
- 125000004202 aminomethyl group Chemical group [H]N([H])C([H])([H])* 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 239000000538 analytical sample Substances 0.000 description 1
- 239000002870 angiogenesis inducing agent Substances 0.000 description 1
- 239000004037 angiogenesis inhibitor Substances 0.000 description 1
- 230000001093 anti-cancer Effects 0.000 description 1
- 229940046836 anti-estrogen Drugs 0.000 description 1
- 230000001833 anti-estrogenic effect Effects 0.000 description 1
- 230000000340 anti-metabolite Effects 0.000 description 1
- 230000001028 anti-proliverative effect Effects 0.000 description 1
- 230000000259 anti-tumor effect Effects 0.000 description 1
- 229940100197 antimetabolite Drugs 0.000 description 1
- 239000002256 antimetabolite Substances 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- SDNYTAYICBFYFH-TUFLPTIASA-N antipain Chemical compound NC(N)=NCCC[C@@H](C=O)NC(=O)[C@H](C(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 SDNYTAYICBFYFH-TUFLPTIASA-N 0.000 description 1
- 239000007900 aqueous suspension Substances 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- FZCSTZYAHCUGEM-UHFFFAOYSA-N aspergillomarasmine B Natural products OC(=O)CNC(C(O)=O)CNC(C(O)=O)CC(O)=O FZCSTZYAHCUGEM-UHFFFAOYSA-N 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 230000003305 autocrine Effects 0.000 description 1
- 230000035578 autophosphorylation Effects 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 229960001561 bleomycin Drugs 0.000 description 1
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 125000005997 bromomethyl group Chemical group 0.000 description 1
- 244000309464 bull Species 0.000 description 1
- 235000019282 butylated hydroxyanisole Nutrition 0.000 description 1
- 235000010354 butylated hydroxytoluene Nutrition 0.000 description 1
- 229910052792 caesium Inorganic materials 0.000 description 1
- TVFDJXOCXUVLDH-UHFFFAOYSA-N caesium atom Chemical compound [Cs] TVFDJXOCXUVLDH-UHFFFAOYSA-N 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- VSJKWCGYPAHWDS-FQEVSTJZSA-N camptothecin Chemical compound C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-FQEVSTJZSA-N 0.000 description 1
- 229940127093 camptothecin Drugs 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 235000011089 carbon dioxide Nutrition 0.000 description 1
- 125000002843 carboxylic acid group Chemical group 0.000 description 1
- 230000024245 cell differentiation Effects 0.000 description 1
- 230000032823 cell division Effects 0.000 description 1
- 210000003855 cell nucleus Anatomy 0.000 description 1
- 239000003610 charcoal Substances 0.000 description 1
- 239000012320 chlorinating reagent Substances 0.000 description 1
- OQNGCCWBHLEQFN-UHFFFAOYSA-N chloroform;hexane Chemical compound ClC(Cl)Cl.CCCCCC OQNGCCWBHLEQFN-UHFFFAOYSA-N 0.000 description 1
- 125000004218 chloromethyl group Chemical group [H]C([H])(Cl)* 0.000 description 1
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 1
- 229960004316 cisplatin Drugs 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 238000004040 coloring Methods 0.000 description 1
- 238000002648 combination therapy Methods 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 238000004590 computer program Methods 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 239000002285 corn oil Substances 0.000 description 1
- 235000005687 corn oil Nutrition 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- GLNDAGDHSLMOKX-UHFFFAOYSA-N coumarin 120 Chemical compound C1=C(N)C=CC2=C1OC(=O)C=C2C GLNDAGDHSLMOKX-UHFFFAOYSA-N 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 125000000753 cycloalkyl group Chemical group 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 230000018044 dehydration Effects 0.000 description 1
- 238000006297 dehydration reaction Methods 0.000 description 1
- 239000012649 demethylating agent Substances 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- 230000002074 deregulated effect Effects 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- NEFBYIFKOOEVPA-UHFFFAOYSA-K dicalcium phosphate Chemical compound [Ca+2].[Ca+2].[O-]P([O-])([O-])=O NEFBYIFKOOEVPA-UHFFFAOYSA-K 0.000 description 1
- 229940038472 dicalcium phosphate Drugs 0.000 description 1
- 229910000390 dicalcium phosphate Inorganic materials 0.000 description 1
- YDVNLQGCLLPHAH-UHFFFAOYSA-N dichloromethane;hydrate Chemical compound O.ClCCl YDVNLQGCLLPHAH-UHFFFAOYSA-N 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- LTMHNWPUDSTBKD-UHFFFAOYSA-N diethyl 2-(ethoxymethylidene)propanedioate Chemical compound CCOC=C(C(=O)OCC)C(=O)OCC LTMHNWPUDSTBKD-UHFFFAOYSA-N 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 230000029087 digestion Effects 0.000 description 1
- 238000006471 dimerization reaction Methods 0.000 description 1
- 125000002147 dimethylamino group Chemical group [H]C([H])([H])N(*)C([H])([H])[H] 0.000 description 1
- 239000002612 dispersion medium Substances 0.000 description 1
- VSJKWCGYPAHWDS-UHFFFAOYSA-N dl-camptothecin Natural products C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)C5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-UHFFFAOYSA-N 0.000 description 1
- 239000003534 dna topoisomerase inhibitor Substances 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 239000008157 edible vegetable oil Substances 0.000 description 1
- 238000002330 electrospray ionisation mass spectrometry Methods 0.000 description 1
- 230000003511 endothelial effect Effects 0.000 description 1
- HKSZLNNOFSGOKW-UHFFFAOYSA-N ent-staurosporine Natural products C12=C3N4C5=CC=CC=C5C3=C3CNC(=O)C3=C2C2=CC=CC=C2N1C1CC(NC)C(OC)C4(C)O1 HKSZLNNOFSGOKW-UHFFFAOYSA-N 0.000 description 1
- 208000017338 epidermoid cysts Diseases 0.000 description 1
- 230000008029 eradication Effects 0.000 description 1
- 229940105423 erythropoietin Drugs 0.000 description 1
- 210000003238 esophagus Anatomy 0.000 description 1
- 125000004185 ester group Chemical group 0.000 description 1
- 239000000328 estrogen antagonist Substances 0.000 description 1
- ZUTHKISSJOMZON-UHFFFAOYSA-N ethanol;4-methylmorpholine Chemical compound CCO.CN1CCOCC1 ZUTHKISSJOMZON-UHFFFAOYSA-N 0.000 description 1
- WUTRNJUWTWFJAP-UHFFFAOYSA-N ethyl 2-(dimethylaminomethylideneamino)-4,5-bis(2-methoxyethoxy)benzoate Chemical compound CCOC(=O)C1=CC(OCCOC)=C(OCCOC)C=C1N=CN(C)C WUTRNJUWTWFJAP-UHFFFAOYSA-N 0.000 description 1
- VPIRXVBLQOIGLC-UHFFFAOYSA-N ethyl 2-(dimethylaminomethylideneamino)-4,5-diethoxybenzoate Chemical compound CCOC(=O)C1=CC(OCC)=C(OCC)C=C1N=CN(C)C VPIRXVBLQOIGLC-UHFFFAOYSA-N 0.000 description 1
- YZOWMIHUDJVXBH-UHFFFAOYSA-N ethyl 2-amino-4,5-bis(2-methoxyethoxy)benzoate Chemical compound CCOC(=O)C1=CC(OCCOC)=C(OCCOC)C=C1N YZOWMIHUDJVXBH-UHFFFAOYSA-N 0.000 description 1
- UDIHMWWUBNTTKL-UHFFFAOYSA-N ethyl 2-cyano-3-(3,4-dimethoxyanilino)prop-2-enoate Chemical compound CCOC(=O)C(C#N)=CNC1=CC=C(OC)C(OC)=C1 UDIHMWWUBNTTKL-UHFFFAOYSA-N 0.000 description 1
- CRIVSDDAATXAGJ-UHFFFAOYSA-N ethyl 2-cyano-3-(4-nitroanilino)prop-2-enoate Chemical compound CCOC(=O)C(C#N)=CNC1=CC=C([N+]([O-])=O)C=C1 CRIVSDDAATXAGJ-UHFFFAOYSA-N 0.000 description 1
- ZIUSEGSNTOUIPT-UHFFFAOYSA-N ethyl 2-cyanoacetate Chemical compound CCOC(=O)CC#N ZIUSEGSNTOUIPT-UHFFFAOYSA-N 0.000 description 1
- LMEHZFXGGDLYMH-UHFFFAOYSA-N ethyl 6,7-dimethoxy-4-oxo-1h-quinoline-3-carboxylate Chemical compound COC1=C(OC)C=C2C(=O)C(C(=O)OCC)=CNC2=C1 LMEHZFXGGDLYMH-UHFFFAOYSA-N 0.000 description 1
- OAYLNYINCPYISS-UHFFFAOYSA-N ethyl acetate;hexane Chemical class CCCCCC.CCOC(C)=O OAYLNYINCPYISS-UHFFFAOYSA-N 0.000 description 1
- FAMRKDQNMBBFBR-UHFFFAOYSA-N ethyl n-ethoxycarbonyliminocarbamate Chemical compound CCOC(=O)N=NC(=O)OCC FAMRKDQNMBBFBR-UHFFFAOYSA-N 0.000 description 1
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 1
- 229960005420 etoposide Drugs 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 210000002950 fibroblast Anatomy 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 229960002949 fluorouracil Drugs 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 239000012458 free base Substances 0.000 description 1
- 102000037865 fusion proteins Human genes 0.000 description 1
- 108020001507 fusion proteins Proteins 0.000 description 1
- WIGCFUFOHFEKBI-UHFFFAOYSA-N gamma-tocopherol Natural products CC(C)CCCC(C)CCCC(C)CCCC1CCC2C(C)C(O)C(C)C(C)C2O1 WIGCFUFOHFEKBI-UHFFFAOYSA-N 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 230000036252 glycation Effects 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 150000004795 grignard reagents Chemical class 0.000 description 1
- 150000004820 halides Chemical class 0.000 description 1
- 230000002140 halogenating effect Effects 0.000 description 1
- 239000007902 hard capsule Substances 0.000 description 1
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 1
- KWHDXJHBFYQOTK-UHFFFAOYSA-N heptane;toluene Chemical compound CCCCCCC.CC1=CC=CC=C1 KWHDXJHBFYQOTK-UHFFFAOYSA-N 0.000 description 1
- 102000045373 human MAPK1 Human genes 0.000 description 1
- 210000004408 hybridoma Anatomy 0.000 description 1
- 150000003840 hydrochlorides Chemical class 0.000 description 1
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 1
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 1
- 230000003463 hyperproliferative effect Effects 0.000 description 1
- 230000001976 improved effect Effects 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 208000027866 inflammatory disease Diseases 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 108091006086 inhibitor proteins Proteins 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 229940102223 injectable solution Drugs 0.000 description 1
- 229940102213 injectable suspension Drugs 0.000 description 1
- 239000002198 insoluble material Substances 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 239000003456 ion exchange resin Substances 0.000 description 1
- 229920003303 ion-exchange polymer Polymers 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- NLYAJNPCOHFWQQ-UHFFFAOYSA-N kaolin Chemical compound O.O.O=[Al]O[Si](=O)O[Si](=O)O[Al]=O NLYAJNPCOHFWQQ-UHFFFAOYSA-N 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 229940043355 kinase inhibitor Drugs 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 210000000867 larynx Anatomy 0.000 description 1
- 108020001756 ligand binding domains Proteins 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- NCBZRJODKRCREW-UHFFFAOYSA-N m-anisidine Chemical compound COC1=CC=CC(N)=C1 NCBZRJODKRCREW-UHFFFAOYSA-N 0.000 description 1
- 208000002780 macular degeneration Diseases 0.000 description 1
- NXPHGHWWQRMDIA-UHFFFAOYSA-M magnesium;carbanide;bromide Chemical compound [CH3-].[Mg+2].[Br-] NXPHGHWWQRMDIA-UHFFFAOYSA-M 0.000 description 1
- 201000001441 melanoma Diseases 0.000 description 1
- 208000021039 metastatic melanoma Diseases 0.000 description 1
- GXHMMDRXHUIUMN-UHFFFAOYSA-N methanesulfonic acid Chemical group CS(O)(=O)=O.CS(O)(=O)=O GXHMMDRXHUIUMN-UHFFFAOYSA-N 0.000 description 1
- GRWIABMEEKERFV-UHFFFAOYSA-N methanol;oxolane Chemical compound OC.C1CCOC1 GRWIABMEEKERFV-UHFFFAOYSA-N 0.000 description 1
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 1
- RWIKCBHOVNDESJ-NSCUHMNNSA-N methyl (e)-4-bromobut-2-enoate Chemical compound COC(=O)\C=C\CBr RWIKCBHOVNDESJ-NSCUHMNNSA-N 0.000 description 1
- GYUXWAIDEGEMEE-UHFFFAOYSA-N methyl 2,3-dihydro-1,4-benzodioxine-6-carboxylate Chemical compound O1CCOC2=CC(C(=O)OC)=CC=C21 GYUXWAIDEGEMEE-UHFFFAOYSA-N 0.000 description 1
- ZVKQLOCFMSUXFU-UHFFFAOYSA-N methyl 2-(dimethylaminomethylideneamino)-3-methoxybenzoate Chemical compound COC(=O)C1=CC=CC(OC)=C1N=CN(C)C ZVKQLOCFMSUXFU-UHFFFAOYSA-N 0.000 description 1
- OWQMAKRMHORJCK-UHFFFAOYSA-N methyl 2-(dimethylaminomethylideneamino)benzoate Chemical compound COC(=O)C1=CC=CC=C1N=CN(C)C OWQMAKRMHORJCK-UHFFFAOYSA-N 0.000 description 1
- WYHBJUPMCJWBDD-UHFFFAOYSA-N methyl 2-amino-4,5-diethoxybenzoate Chemical compound CCOC1=CC(N)=C(C(=O)OC)C=C1OCC WYHBJUPMCJWBDD-UHFFFAOYSA-N 0.000 description 1
- CKHQUPXMMAOBTC-UHFFFAOYSA-N methyl 2-amino-5-methoxy-4-phenylmethoxybenzoate Chemical compound C1=C(N)C(C(=O)OC)=CC(OC)=C1OCC1=CC=CC=C1 CKHQUPXMMAOBTC-UHFFFAOYSA-N 0.000 description 1
- AXZCWNLUZBSALR-UHFFFAOYSA-N methyl 4-(2-chloroethoxy)-5-methoxy-2-nitrobenzoate Chemical compound COC(=O)C1=CC(OC)=C(OCCCl)C=C1[N+]([O-])=O AXZCWNLUZBSALR-UHFFFAOYSA-N 0.000 description 1
- SJSPWXDMJNLLKK-UHFFFAOYSA-N methyl 4-(3-chloropropoxy)-3-methoxybenzoate Chemical compound COC(=O)C1=CC=C(OCCCCl)C(OC)=C1 SJSPWXDMJNLLKK-UHFFFAOYSA-N 0.000 description 1
- FOTPSTARXZXRFU-UHFFFAOYSA-N methyl 6-amino-2,3-dihydro-1,4-benzodioxine-7-carboxylate Chemical compound O1CCOC2=C1C=C(C(=O)OC)C(N)=C2 FOTPSTARXZXRFU-UHFFFAOYSA-N 0.000 description 1
- LJOUDGUKJXHDQH-UHFFFAOYSA-N methyl 6-nitro-2,3-dihydro-1,4-benzodioxine-7-carboxylate Chemical compound O1CCOC2=C1C=C(C(=O)OC)C([N+]([O-])=O)=C2 LJOUDGUKJXHDQH-UHFFFAOYSA-N 0.000 description 1
- 229940095102 methyl benzoate Drugs 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 239000002829 mitogen activated protein kinase inhibitor Substances 0.000 description 1
- 230000000394 mitotic effect Effects 0.000 description 1
- XONPDZSGENTBNJ-UHFFFAOYSA-N molecular hydrogen;sodium Chemical compound [Na].[H][H] XONPDZSGENTBNJ-UHFFFAOYSA-N 0.000 description 1
- 125000000896 monocarboxylic acid group Chemical group 0.000 description 1
- 238000010172 mouse model Methods 0.000 description 1
- 210000000214 mouth Anatomy 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- SYSQUGFVNFXIIT-UHFFFAOYSA-N n-[4-(1,3-benzoxazol-2-yl)phenyl]-4-nitrobenzenesulfonamide Chemical class C1=CC([N+](=O)[O-])=CC=C1S(=O)(=O)NC1=CC=C(C=2OC3=CC=CC=C3N=2)C=C1 SYSQUGFVNFXIIT-UHFFFAOYSA-N 0.000 description 1
- XHFGWHUWQXTGAT-UHFFFAOYSA-N n-methylpropan-2-amine Chemical compound CNC(C)C XHFGWHUWQXTGAT-UHFFFAOYSA-N 0.000 description 1
- 230000014399 negative regulation of angiogenesis Effects 0.000 description 1
- 239000002736 nonionic surfactant Substances 0.000 description 1
- 210000004940 nucleus Anatomy 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- 239000010502 orange oil Substances 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 210000001672 ovary Anatomy 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- 229960001592 paclitaxel Drugs 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- 230000008506 pathogenesis Effects 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- PNJWIWWMYCMZRO-UHFFFAOYSA-N pent‐4‐en‐2‐one Natural products CC(=O)CC=C PNJWIWWMYCMZRO-UHFFFAOYSA-N 0.000 description 1
- 230000010412 perfusion Effects 0.000 description 1
- 230000035699 permeability Effects 0.000 description 1
- 108040007629 peroxidase activity proteins Proteins 0.000 description 1
- 239000003444 phase transfer catalyst Substances 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 239000003757 phosphotransferase inhibitor Substances 0.000 description 1
- HDOWRFHMPULYOA-UHFFFAOYSA-N piperidin-4-ol Chemical compound OC1CCNCC1 HDOWRFHMPULYOA-UHFFFAOYSA-N 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 208000014081 polyp of colon Diseases 0.000 description 1
- 239000013641 positive control Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- OXCMYAYHXIHQOA-UHFFFAOYSA-N potassium;[2-butyl-5-chloro-3-[[4-[2-(1,2,4-triaza-3-azanidacyclopenta-1,4-dien-5-yl)phenyl]phenyl]methyl]imidazol-4-yl]methanol Chemical compound [K+].CCCCC1=NC(Cl)=C(CO)N1CC1=CC=C(C=2C(=CC=CC=2)C2=N[N-]N=N2)C=C1 OXCMYAYHXIHQOA-UHFFFAOYSA-N 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 230000002028 premature Effects 0.000 description 1
- 238000012746 preparative thin layer chromatography Methods 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- LJZPPWWHKPGCHS-UHFFFAOYSA-N propargyl chloride Chemical compound ClCC#C LJZPPWWHKPGCHS-UHFFFAOYSA-N 0.000 description 1
- 125000002572 propoxy group Chemical group [*]OC([H])([H])C(C([H])([H])[H])([H])[H] 0.000 description 1
- 108060006633 protein kinase Proteins 0.000 description 1
- 239000003586 protic polar solvent Substances 0.000 description 1
- PMZDQRJGMBOQBF-UHFFFAOYSA-N quinolin-4-ol Chemical compound C1=CC=C2C(O)=CC=NC2=C1 PMZDQRJGMBOQBF-UHFFFAOYSA-N 0.000 description 1
- XMIAFAKRAAMSGX-UHFFFAOYSA-N quinolin-5-amine Chemical compound C1=CC=C2C(N)=CC=CC2=N1 XMIAFAKRAAMSGX-UHFFFAOYSA-N 0.000 description 1
- RJSRSRITMWVIQT-UHFFFAOYSA-N quinolin-6-amine Chemical compound N1=CC=CC2=CC(N)=CC=C21 RJSRSRITMWVIQT-UHFFFAOYSA-N 0.000 description 1
- WDXARTMCIRVMAE-UHFFFAOYSA-N quinoline-2-carbonitrile Chemical compound C1=CC=CC2=NC(C#N)=CC=C21 WDXARTMCIRVMAE-UHFFFAOYSA-N 0.000 description 1
- BLTDCIWCFCUQCB-UHFFFAOYSA-N quinoline-3-carboxamide Chemical class C1=CC=CC2=CC(C(=O)N)=CN=C21 BLTDCIWCFCUQCB-UHFFFAOYSA-N 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 239000000700 radioactive tracer Substances 0.000 description 1
- 238000001959 radiotherapy Methods 0.000 description 1
- 230000021014 regulation of cell growth Effects 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 206010039073 rheumatoid arthritis Diseases 0.000 description 1
- 239000004576 sand Substances 0.000 description 1
- 239000012047 saturated solution Substances 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- XIIOFHFUYBLOLW-UHFFFAOYSA-N selpercatinib Chemical compound OC(COC=1C=C(C=2N(C=1)N=CC=2C#N)C=1C=NC(=CC=1)N1CC2N(C(C1)C2)CC=1C=NC(=CC=1)OC)(C)C XIIOFHFUYBLOLW-UHFFFAOYSA-N 0.000 description 1
- 230000009758 senescence Effects 0.000 description 1
- 125000003607 serino group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C(O[H])([H])[H] 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- 102000035025 signaling receptors Human genes 0.000 description 1
- 108091005475 signaling receptors Proteins 0.000 description 1
- 238000010898 silica gel chromatography Methods 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- XGVXKJKTISMIOW-ZDUSSCGKSA-N simurosertib Chemical compound N1N=CC(C=2SC=3C(=O)NC(=NC=3C=2)[C@H]2N3CCC(CC3)C2)=C1C XGVXKJKTISMIOW-ZDUSSCGKSA-N 0.000 description 1
- 239000002002 slurry Substances 0.000 description 1
- 210000000329 smooth muscle myocyte Anatomy 0.000 description 1
- JVBXVOWTABLYPX-UHFFFAOYSA-L sodium dithionite Chemical compound [Na+].[Na+].[O-]S(=O)S([O-])=O JVBXVOWTABLYPX-UHFFFAOYSA-L 0.000 description 1
- CMZUMMUJMWNLFH-UHFFFAOYSA-N sodium metavanadate Chemical compound [Na+].[O-][V](=O)=O CMZUMMUJMWNLFH-UHFFFAOYSA-N 0.000 description 1
- PVGBHEUCHKGFQP-UHFFFAOYSA-N sodium;n-[5-amino-2-(4-aminophenyl)sulfonylphenyl]sulfonylacetamide Chemical compound [Na+].CC(=O)NS(=O)(=O)C1=CC(N)=CC=C1S(=O)(=O)C1=CC=C(N)C=C1 PVGBHEUCHKGFQP-UHFFFAOYSA-N 0.000 description 1
- 239000011343 solid material Substances 0.000 description 1
- 239000008247 solid mixture Substances 0.000 description 1
- 239000012265 solid product Substances 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- HKSZLNNOFSGOKW-FYTWVXJKSA-N staurosporine Chemical compound C12=C3N4C5=CC=CC=C5C3=C3CNC(=O)C3=C2C2=CC=CC=C2N1[C@H]1C[C@@H](NC)[C@@H](OC)[C@]4(C)O1 HKSZLNNOFSGOKW-FYTWVXJKSA-N 0.000 description 1
- CGPUWJWCVCFERF-UHFFFAOYSA-N staurosporine Natural products C12=C3N4C5=CC=CC=C5C3=C3CNC(=O)C3=C2C2=CC=CC=C2N1C1CC(NC)C(OC)C4(OC)O1 CGPUWJWCVCFERF-UHFFFAOYSA-N 0.000 description 1
- 239000008223 sterile water Substances 0.000 description 1
- 210000002784 stomach Anatomy 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- BDHFUVZGWQCTTF-UHFFFAOYSA-M sulfonate Chemical compound [O-]S(=O)=O BDHFUVZGWQCTTF-UHFFFAOYSA-M 0.000 description 1
- 235000011149 sulphuric acid Nutrition 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 238000013268 sustained release Methods 0.000 description 1
- 239000012730 sustained-release form Substances 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 229960001603 tamoxifen Drugs 0.000 description 1
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 1
- ILMRJRBKQSSXGY-UHFFFAOYSA-N tert-butyl(dimethyl)silicon Chemical group C[Si](C)C(C)(C)C ILMRJRBKQSSXGY-UHFFFAOYSA-N 0.000 description 1
- DPKBAXPHAYBPRL-UHFFFAOYSA-M tetrabutylazanium;iodide Chemical compound [I-].CCCC[N+](CCCC)(CCCC)CCCC DPKBAXPHAYBPRL-UHFFFAOYSA-M 0.000 description 1
- YJBKVPRVZAQTPY-UHFFFAOYSA-J tetrachlorostannane;dihydrate Chemical compound O.O.Cl[Sn](Cl)(Cl)Cl YJBKVPRVZAQTPY-UHFFFAOYSA-J 0.000 description 1
- RAOIDOHSFRTOEL-UHFFFAOYSA-N tetrahydrothiophene Chemical compound C1CCSC1 RAOIDOHSFRTOEL-UHFFFAOYSA-N 0.000 description 1
- DLYUQMMRRRQYAE-UHFFFAOYSA-N tetraphosphorus decaoxide Chemical compound O1P(O2)(=O)OP3(=O)OP1(=O)OP2(=O)O3 DLYUQMMRRRQYAE-UHFFFAOYSA-N 0.000 description 1
- 150000003536 tetrazoles Chemical class 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 230000004797 therapeutic response Effects 0.000 description 1
- 238000001149 thermolysis Methods 0.000 description 1
- 150000003557 thiazoles Chemical class 0.000 description 1
- BRNULMACUQOKMR-UHFFFAOYSA-N thiomorpholine Chemical compound C1CSCCN1 BRNULMACUQOKMR-UHFFFAOYSA-N 0.000 description 1
- 125000000341 threoninyl group Chemical group [H]OC([H])(C([H])([H])[H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 1
- 229940044693 topoisomerase inhibitor Drugs 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 108091007466 transmembrane glycoproteins Proteins 0.000 description 1
- FAQYAMRNWDIXMY-UHFFFAOYSA-N trichloroborane Chemical compound ClB(Cl)Cl FAQYAMRNWDIXMY-UHFFFAOYSA-N 0.000 description 1
- 125000000876 trifluoromethoxy group Chemical group FC(F)(F)O* 0.000 description 1
- 238000001665 trituration Methods 0.000 description 1
- 241000701447 unidentified baculovirus Species 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 210000003932 urinary bladder Anatomy 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 229960003048 vinblastine Drugs 0.000 description 1
- JXLYSJRDGCGARV-XQKSVPLYSA-N vincaleukoblastine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 JXLYSJRDGCGARV-XQKSVPLYSA-N 0.000 description 1
- 235000019165 vitamin E Nutrition 0.000 description 1
- 229940046009 vitamin E Drugs 0.000 description 1
- 239000011709 vitamin E Substances 0.000 description 1
Landscapes
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
composto, e, composição farmacêutica. esta invenção provê compostos de fórmula (1) em que r1, g1, g2, r4, z, x e n saio como aqui definidos, ou um sal farmaceuticamente aceitável do mesmo, que são utilizáveis como agentes antineoplásticos e no tratamento de doença de rim policístico.
Description
(54) Título: COMPOSTOS 3-CIANO QUINOLINA SUBSTITUÍDOS E COMPOSIÇÕES
COMPREENDENDO OS MESMOS (51) Int.CI.: C07D 401/12; A61K 31/47; C07D 417/12; C07D 405/12; C07D 491/10; C07D 405/14; C07D 401/14; C07D 215/54; C07D 413/12; C07D 409/12; C07D 491/04 (30) Prioridade Unionista: 29/09/1998 US 09/162802 (73) Titular(es): WYETH HOLDINGS CORPORATION (72) Inventor(es): PHILIP ROSS HAMANN; HWEI-RU TSOU; ALLAN WISSNER; DAN MAARTEN BERGER; MIDDLETOWN BRAWNER FLOYD, JR; NAN ZHANG; MARK ERNEST SALVATI; PHILIP FROST
1/1
COMPOSTOS 3-CIANO QUINOLINA SUBSTITUÍDOS E COMPOSIÇÕES COMPREENDENDO OS MESMOS “Pedido Dividido do PI9914167-1, depositado em 22/09/1999” FUNDAMENTOS DA INVENÇÃO
Esta invenção refere-se a alguns compostos 3-ciano quinolina substituídos assim como sal farmaceuticamente aceitável dos mesmos. Os compostos da presente invenção inibem a ação de algumas tirosina quinases de proteína de receptor de fator de crescimento (PTK) e outras quinases de proteína assim inibindo o crescimento anormal de alguns tipos de célula. Os compostos desta invenção são, assim, utilizáveis para o tratamento de algumas doenças, que são o resultado de desregulagem destes PTKs. Os compostos desta invenção são agentes anti-câncer e são utilizáveis para o tratamento de câncer em mamíferos. Além disso, os compostos desta invenção são utilizáveis para o tratamento da doença de rim policístico em mamíferos. Esta invenção também se refere à fabricação de 3-ciano quinolinas, seu uso para o tratamento de câncer e doença de rim policístico, e as preparações farmacêuticas contendo os mesmos.
As tirosina quinases de proteína são uma classe de enzimas que catalisam a transferência de um grupo fosfato de ATP para um resíduo de tirosina localizado em um substrato de proteína. As tirosina quinases de proteína desempenham claramente um papel no crescimento de célula normal. Muitas das proteínas de receptor de fator de crescimento claramente desempenham um papel no crescimento de célula normal. Muitas das proteínas de receptor de fator de crescimento funcionam como tirosina quinases e é por este processo que elas efetuam sinalização. A interação de fatores de crescimento que com estes receptores é um evento necessário em regulagem normal de crescimento de célula. No entanto, sob algumas condições, como um resultado de mutação ou super-expressão, estes receptores podem se tomar desregulados, o resultado disto é proliferação de célula descontrolada que pode levar a crescimento de tumor e, por fim, à doença conhecida como câncer [Wilks A.F. Adv. Câncer Res. 60, 43 (1993) e Parsons, J.T.: Parsons S.J. Important Advances in Oncology, DeVita V.T. Ed. J.B. Lippincott Co. Phila, 3 (1993)). Dentre as quinases de receptor de fator de crescimento e seus protooncogenes que foram identificados e que são marcações dos compostos desta invenção estão a quinase de receptor de fator de crescimento epidérmico (quinase EGF-R, o produto de proteína de oncogene erbB), e o produto produzido pelo oncogene erbB-2 (também como neu ou EGER2). Porque o evento de fosforilação é um sinal necessário para divisão celular ocorrer e porque quinases superexpressas ou mudadas foram associadas com câncer, um inibidor deste evento, um inibidor de tirosina quinases de proteína, terá valor terapêutico para o tratamento de câncer e outras doenças caracterizadas por crescimento de célula descontrolado e anormal. Por exemplo, a superexpressão do produto de quinase receptor de oncogene erbB-2 foi associada com canceres do ovário e de mama humano (Slamon, D.J., et al, Science, 244, 707 (1989), e Science 235, 1146 (1987)]. A desregulagem de EGF-R quinase foi associada com tumores epidermóides (Reiss, M. et al, Câncer Res. 51, 6254 (1991)), tumores de mama [Macias, A. et al, Anticancer Res., 7, 459 (1987)], e tumores envolvendo outros órgãos principais (Gullick, W. J. Brit. Med. Bull. 47, 87 (1991)]. Devido à importância do papel desempenhado pelas quinases de receptor desreguladas na patogenese de câncer, muitos estudos recentes trataram com o desenvolvimento de inibidores de PTK específicos como agentes terapêuticos anti-câncer em potencial (alguns estudos recentes: Burke, T.R. Drugs Future, 17, 119 (1992) e Chang, C.J. Geahlen, R.L. J. Nat. Pro d.
55, 1529 (1992)]. Os compostos desta invenção inibem a atividade de quinase de EGF-R e são assim utilizáveis para o tratamento de alguns estados doentios, como câncer, que resultam, pelo menos em parte, da desregulagem deste receptor. Os compostos desta invenção são assim utilizáveis para o tratamento e prevenção de alguns condições pré-cancerosas, como o crescimento de pólipos de cólon, que resultam, pelo menos em parte, da desregulagem deste receptor.
Também se sabe que a desregulagem de receptores EGF é um fator no crescimento de cistos epiteliais na doença descrita como doença de rim policístico (Du. J. Wilson P. D. Amer. J. Physiol. 269 (2 Pt 1), 487 (1995), Nauta J. et al, Pedíatric Research, 37(6), 755 (1995), Gattone V.H. et al, Development Biology, 169 (2), 504 (1995), Wilson P.D. et al, Eur. J. Cell. Biol. 61(1), 131, (1993)]. Os compostos desta invenção, que inibem a função catalítica dos receptores EGF, são consequentemente utilizáveis para o tratamento desta doença.
A via de quinase de proteína ativada por mitogênio (MAPK) é uma via principal na cascata de transdução de sinal celular dos fatores de crescimento para o núcleo da célula. A via envolve quinases em dois níveis: quinase quinases MAP (MAPKK), e seus substratos quinases MAP (MAPK). Existem diferentes isoformas na família de quinase MAP. (Para estudo, ver Rony Seger e Edwing G. Krebs, FASEB, vol. 9, 726, junho 1995). Os compostos desta invenção podem inibir a ação de duas destas quinases: MEK, uma quinase quinase MAP, e seu substrato ERK, uma quinase MAP. MEK é ativado por fosforilação em dois resíduos serina por quinases a montante como membros da família raf. Quanto ativado, MEK catalisa a fosforilação em uma treonina e um resíduo tirosina de ERK. O ERK ativado então fosforila e ativa os fatores de transcrição no núcleo, como fos e jun, ou outras marcações celulares com sequências PXT/SP. ERK um p42 MAPK, é verificado como sendo essencial para proliferação e diferenciação celular. A super-expressão e/ou super-ativação de Mek ou ERK foi verificada como associada com vários canceres humanos (por exemplo, Vimala S. Sivaraman, Hsien-yu Wang, Gerard J. Nuovo, e Craig C. Malbon, J. Clin. Invest. Vol. 99, no. 7, abril 1997). Foi demonstrado que a inibição de MEK evita a ativação de ERK e subsequente ativação de substratos ERK em células, resultando na inibição de estímulo de crescimento de célula e reversão do fenótipo de células transformadas ras (David T. Dudley, Long Pang, Stuart J. Decker, Alexander J. Bridges, e Alan R. Saltiel, PNAS, vol. 92, 7686, agosto 1995). Porque, como demonstrado abaixo, os compostos desta invenção podem inibir a ação acoplada de MEK e ERK, eles são utilizáveis para o tratamento de doenças como câncer que são caracterizadas por proliferação de célula descontrolada e que, pelo menos em parte, dependem da via MAPK.
A quinase de célula epitelial (ECK) é uma tirosina quinase de proteína receptor (RPTK) pertencendo à família de EPH (hepatoma produzindo eritropoietina). Apesar de originalmente identificada como uma tirosina quinase específica para linhagem epitelial, ECK foi subsequentemente mostrada como sendo expressa em células endoteliais vasculares, células de músculo liso, e fibroblastos. ECK é uma glicoproteína de transmembrana de tipo I com o domínio de ligação de ligando extracelular consistindo de região rica em cisteína seguido por três repetições de tipo III de fibronectina. O domínio intracelular de ECK possui um domínio catalítico de tirosina quinase que inicia uma cascata de transdução de sinal refletindo a função ECK. ECK liga e é subsequentemente ativado por seu contra-receptor, ligando para quinase relacionada com Eph (LERK)-1, que é um produto de gene de resposta prematura imediata prontamente indutível em um modo não limitado a linhagem com citocinas pro-inflamatórias como IL-1 ou TNF. LERK-1 solúvel foi mostrado para estimular angiogenese em parte por estímulo de ECK em um modelo de murinos de angiogenese comeal. Diferente de suas contrapartes normais, células de tumor de várias linhagens expressam de modo constitutivo LERK-1 e sua expressão pode ainda ser regulada por hipoxia e citocinas proinflamatórias. Muitas destas células de tumor também expressam ECK em maiores níveis do que suas contra-partes normais, assim criando uma oportunidade para estímulo de autocrina via interação ECK: LERK-1. A expressão aumentada de tanto ECK como LERK-1 está correlacionada com a transformação de melanomas da fase horizontal não invasiva de crescimento em melanomas metastáticos crescendo verticalmente muito invasivos. No conjunto, a interação ECK : LERK-1 promove, como se acredita, o crescimento do tumor via efeitos angiogênicos e de promoção do crescimento de tumor. Assim, a inibição de atividade de tirosina quinase ECK mediando a cascata de sinalização induzida por sua ligação e reticulação a LERK-1 pode ser terapeuticamente benéfica em câncer, doenças inflamatórias, e distúrbios hiperproliferativos. Como mostrado abaixo, os compostos desta invenção inibem a atividade de tirosina quinase de ECK e são assim utilizáveis no tratamento de distúrbios acima mencionados.
O crescimento da maior parte dos tumores sólidos é dependente de angiogenese envolvendo ativação, proliferação e migração de células endoteliais vasculares e sua subsequente diferenciação em tubos capilares. A angiogenização de tumores permite aos mesmos acesso a nutrientes e oxigênio derivado do sangue, e também provê os mesmos com perfusão adequada. Assim, a inibição de angiogenese é uma estratégia terapêutica importante não somente em câncer, mas também em várias doenças crônicas como artrite reumatóide, psoríase, retinopatia diabética, degeneração macular relacionada com a idade, e outros. As células de tumor produzem várias moléculas angiogênicas. O fator de crescimento endotelila vascular (VEGF) é um tal fator angiogênico. VEGF, um membro ligado a dissulfeto homodimérico da família PDGF, é um mitogênio específico para célula endotelial sendo conhecido como provocando um profundo aumento na permeabilidade endotelial vascular nos tecidos afetados. VEGF é também um fator de sobrevivência evitando a senescência para células endoteliais. Quase todos os tecidos nucleados no corpo possuem a capacidade de expressar VEGF em resposta a vários estímulos incluindo hipoxia, falta de glucose, produtos de glicação avançados, citocinas inflamatórias, etc. Os efeitos angiogênicos promotores do crescimento de VEGF são mediados de modo predominante via seu receptor contendo domínio de inserto de quinase de receptor de sinalização (KDR). A expressão de KDR é baixa na maior parte das células endoteliais, no entanto, a ativação com agentes, angiogênicos resulta em uma regulagem significante de KDR em células endoteliais. A maior parte dos vasos de sangue angiogenizados expressa altos níveis de KDR. KDR é uma tirosina quinase de proteína receptora com um domínio de ligação de VEGF extracelular consistindo de 7 domínios semelhantes a imunoglobulina e um domínio citoplásmico contendo o domínio de tirosina quinase catalítico dividido por uma região de inserto de quinase. A ligação a VEGF causa a dimerização de KDR resultando em sua autofosforilação e iniciação de cascata de sinalização. A atividade de tirosina quinase de KDR é essencial para a mediação de seus efeitos funcionais como um receptor para VEGF. A inibição de efeitos funcionais mediados por KDR por inibição da atividade catalítica de KDR é considerada como sendo uma estratégia terapêutica importante no tratamento de estados doentios angiogenizados incluindo câncer. Como é mostrado abaixo, os compostos desta invenção inibem a atividade de tirosina quinase de KDR e são assim utilizáveis para o tratamento dos estados doentios acima mencionados.
Além das utilidades acima, alguns dos compostos desta invenção são utilizáveis na preparação de outros compostos desta invenção.
Os compostos desta invenção são algumas 3-ciano quinolinas substituídas. Em todo este pedido de patente, o sistema de anel quinolina será numerado como indicado na fórmula abaixo; a numeração do sistema de anel quinazolina é também mostrada:
| 5 | 4 | 5 | 4 |
| θίί^Τ | 3 6ÍÍ | As | r^N3 |
| s | |||
| 7 | N 2 7 | N 2 | |
| 8 | 1 | 8 | 1 |
| Não foram registradas 3-ciano | quinolinas que tem atividade |
biológica como inibidores de tirosina quinases de proteína. Uma 3-ciano quinolina com um substituinte 4-(2-metil anilino) tendo atividade inibidora (fC/K+)-ATPase gástrica em altas concentrações foi descrita (Ife R.J. et al, J. Med. Chem. 35 (18), 3413 (1992)].
Existem quinolinas que não tem o substituinte 3-ciano e, diferente dos compostos desta invenção, não são substituídos na posição 4, mas são registrados como sendo inibidores de tirosina quinases de proteína (Gazit et al, J. Med. Chem. 39(11), 2170 (1996)]. Uma série de quinolinas que tem um substituinte 3-piridila e nenhum substituinte na posição 4 foram descritos como inibidores de quinase de receptor de fator de crescimento derivado de plaquetas (Dolle, R.E. et al, J. Med. Chem. 372, 2627 (1994) e Maguire M.P. et al, J. Med. Chem. 372, 129 (1994)). Os pedidos de patente WO 96 09294 e WO9813350 descrevem inibidores de tirosina quinases de proteína que incluem 4anilino quinolinas com uma grande variedade de substituintes nas posições 5-8 mas que devem ter também um átomo de hidrogênio ou flúor na posição 3. A patente US 5 480 883 descreve derivados de quinolinas que são inibidores de tirosina quinases de proteína, mas estes derivados não tem a combinação singular de substituintes, incluindo o grupo 3-ciano, contido nos compostos da presente invenção. Os pedidos WO-9802434 e WO-9802438 descreve derivados de quinolinas que são inibidores de tirosina quinases mas estas quinolinas não tem o substituinte 3-ciano importante.
Além de quinolinas, alguns derivados de quinolinas que são similares, em alguns aspectos, aos compostos desta invenção, são conhecidos como inibidores de tirosina quinases de proteína. O pedido EP-520722
descreve 4-anilinoquinazolinas que contém substituintes simples como grupos cloro, trifluorometila, ou nitro, em posições 5 a 8. O pedido EP 566226 é similar mas com uma variedade bem maior do que os substituintes agora mostrados em posições 5 a 8. O pedido WO 9609294 descreve os compostos com substituintes similares em posições 5 a 8 e com o substituinte na posição 4 consistindo de alguns sistemas de anel policíclicos. Algumas quinazolinas substituídas simples são também descritas nos pedidos WO-9524190, WO9521613 e WO 9515758. Os pedidos EP 602851 e WO 9523141 cobrem derivados de quinazolinas similares que são o grupo arila fixado na posição 4 pode ser uma variedade de estruturas de anel heterocíclicas. O pedido EP635498 descreve alguns derivados de quinazolina que tem grupos alquenoilamino e alquinoilamino dentre os substituintes na posição 6 e um átomo de halogênio na posição 7. O pedido WO-9519774 descreve compostos onde um ou mais dos átomos de carbono em posições 5-8 podem ser substituídos com heteroátomos resultando em uma grande variedade de sistemas bicíclicos onde o anel à esquerda é um anel heterocíclico de 5 e 6 membros; além disso, vários substituintes são deixados no anel à esquerda. O pedido EP 682027-A1 descreve alguns inibidores de pirrolopirimidina de PTKs. O pedido WO-9519970 descreve compostos em que o anel aromático à esquerda da estrutura quinazolina básica foi substituído com uma ampla variedade de diferentes anéis heterocíclicos de modo que os inibidores resultantes são tricíclicos. O pedido EP 635507 descreve quinazolinas onde um anel heterocíclico de 5 ou 6 membros adicional com substituição opcional é fundido nas posições 5 e 6.
Além dos pedidos de patente acima mencionados, várias publicações descrevem 4-anilinoquinazolinas: Fry. D.W. et al, Science, 265, 1093 (1994), Rewcastle, G.W. et al, J. Med. Chem. 38; 3482 (1995), e Bridges, A.J., et al, J. Med. Chem. 39, 267 (1996). Não se tem publicações que descrevem 3-ciano quinolinas como inibidores de PTK.
DESCRIÇÃO DA INVENÇÃO
Esta invenção provê um composto de fórmula 1:
em que
X é um sistema de anel arila bicíclica ou heteroarila bicíclica de 8 a 12 átomos, onde o anel heteroarila bicíclico contém 1 a 4 heteroátomos selecionados dentre N, O e S com a condição que o anel heteroarila bicíclico não contenha ligações O-O, S-S, ou S-O, e onde o anel arila bicíclico ou heteroarila bicíclico pode ser opcionalmente mono-, di-, tri-, ou tetrasubstituído com um substituinte selecionado dentre o grupo consistindo de halogênio, oxo, tio, alquila de 1-6 átomos de carbono , alquenila de 2-6 átomos de carbono, alquinila de 2-6 átomos de carbono , azido, hidroxialquila de 1-6 átomos de carbono, halometila, alcoximetila de 2-7 átomos de carbono , alcanoiloximetila de 2-7 átomos de carbono, alcóxi de 1-6 átomos de carbono, alquiltio de 1-6 átomos de carbono, hidroxi, trifluorometila, ciano, nitro, carboxi, carboalcoxi de 2-7 átomos de carbono, carboalquila de 2-7 átomos de carbono, fenoxi, fenila, tiofenóxi, benzoíla, benzila, amino, alquilamino de 1-6 átomos de carbono, dialquilamino de 2 a 12 átomos de carbono, fenilamino, benzilamino, alcanoilamino de 1-6 átomos de carbono, alquenoilamino de 3-8 átomos de carbono, alquinoilamino de 3-8 átomos de carbono, carboxialquila de 2-7 átomos de carbono, carboalcoxialquila de 3-8 átomos de carbono, aminoalquila de 1-5 átomos de carbono, N-alquilaminoalquila de 2-9 átomos de carbono, Ν,Ν-dialquilaminoalquila de 3-10 átomos de carbono, N-
alquilaminoalcoxi de 2-9 átomos de carbono, Ν,Ν-dialquilaminoalcoxi de 3-10 átomos de carbono, mercapto, e benzoilamino; ou
X é um radical tendo a fórmula
em que A é um anel piridinila, pirimidinila, ou fenila, em que o anel piridinila, pirimidinila ou fenila pode ser opcionalmente mono-ou disubstituído com um substituinte selecionado dentre o grupo consistindo de halogênio, alquila de 1-6 átomos de carbono , alquenila de 2-6 átomos de carbono, alquimia de 2-6 átomos de carbono , azido, hidroxialquila de 1-6 átomos de carbono, halometila, alcoximetila de 2-7 átomos de carbono , alcanoiloximetila de 2-7 átomos de carbono, alcóxi de 1-6 átomos de carbono, alquiltio de 1-6 átomos de carbono, hidróxi, trifluorometila, ciano, nitro, carboxi, carboalcoxi de 2-7 átomos de carbono, carboalquila de 2-7 átomos de carbono, fenoxi, fenila, tiofenóxi, benzoíla, benzila, amino, alquilamino de 1-6 átomos de carbono, dialquilamino de 2 a 12 átomos de carbono, fenilamino, benzilamino, alcanoilamino de 1-6 átomos de carbono, alquenoilamino de 3-8 átomos de carbono, alquinoilamino de 3-8 átomos de carbono, carboxialquila de 2-7 átomos de carbono, carboalcoxialquila de 3-8 átomos de carbono, aminoalquila de 1-5 átomos de carbono, N-alquilaminoalquila de 2-9 átomos de carbono, Ν,Ν-dialquilaminoalquila de 3-10 átomos de carbono, Nalquilaminoalcoxi de 2-9 átomos de carbono, Ν,Ν-dialquilaminoalcoxi de 3-10 átomos de carbono, mercapto, e benzoilamino;
T é ligado a um carbono de A e é:
-NH(CH2)m-,-O(CH2)m-,-S(CH2)ra-,-NR(CH2)m-,-(CH2)m-(CH2)mNH-,-(CH2)mO-,-(CH2)mS-, ou-(CH2)mNR-;
L é um anel fenila não substituído ou um anel fenila mono-, diou tri-substituído com um substituinte selecionado dentre o grupo consistindo de halogênio, alquila de 1-6 átomos de carbono , alquenila de 2-6 átomos de
carbono, alquinila de 2-6 átomos de carbono , azido, hidroxialquila de 1-6 átomos de carbono, halometila, alcoximetila de 2-7 átomos de carbono , alcanoiloximetila de 2-7 átomos de carbono, alcóxi de 1-6 átomos de carbono, alquiltio de 1-6 átomos de carbono, hidróxi, trifluorometila, ciano, nitro, carboxi, carboalcoxi de 2-7 átomos de carbono, carboalquila de 2-7 átomos de carbono, fenoxi, fenila, tiofenóxi, benzoíla, benzila, amino, alquilamino de 1-6 átomos de carbono, dialquilamino de 2 a 12 átomos de carbono, fenilamino, benzilamino, alcanoilamino de 1-6 átomos de carbono, alquenoilamino de 3-8 átomos de carbono, alquinoilamino de 3-8 átomos de carbono, carboxialquila de 2-7 átomos de carbono, carboalcoxialquila de 3-8 átomos de carbono, aminoalquila de 1-5 átomos de carbono, N-alquilaminoalquila de 2-9 átomos de carbono, Ν,Ν-dialquilaminoalquila de 3-10 átomos de carbono, Nalquilaminoalcoxi de 2-9 átomos de carbono, Ν,Ν-dialquilaminoalcoxi de 3-10 átomos de carbono, mercapto, e benzoilamino; desde que L possa ser um anel fenila não substituído somente quando m > 0 e T não é-CH2NH-ou-CH2O-; ou
L é um anel heteroarila de 5 ou 6 membros, onde o anel heteroarila contém de 1 a 3 heteroátomos selecionados dentre N, O e S, com a condição que o anel heteroarila não contém ligações O-O, S-S ou S-O, e onde o anel heteroarila é opcionalmente mono-ou di-substituído com um substituinte selecionado dentre o grupo consistindo de halogênio, oxo, tio, alquila de 1-6 átomos de carbono , alquenila de 2-6 átomos de carbono, alquinila de 2-6 átomos de carbono , azido, hidroxialquila de 1-6 átomos de carbono, halometila, alcoximetila de 2-7 átomos de carbono , alcanoiloximetila de 2-7 átomos de carbono, alcóxi de 1-6 átomos de carbono, alquiltio de 1-6 átomos de carbono, hidróxi, trifluorometila, ciano, nitro, carboxi, carboalcoxi de 2-7 átomos de carbono, carboalquila de 2-7 átomos de carbono, fenoxi, fenila, tiofenóxi, benzoíla, benzila, amino, alquilamino de 1-6 átomos de carbono, dialquilamino de 2 a 12 átomos de carbono, fenilamino, benzilamino, alcanoilamino de 1-6 átomos de carbono, alquenoilamino de 3-8 átomos de
carbono, alquinoilamino de 3-8 átomos de carbono, carboxialquila de 2-7 átomos de carbono, carboalcoxialquila de 3-8 átomos de carbono, aminoalquila de 1-5 átomos de carbono, N-alquilaminoalquila de 2-9 átomos de carbono, Ν,Ν-dialquilaminoalquila de 3-10 átomos de carbono, N-alquilaminoalcoxi de
2-9 átomos de carbono, Ν,Ν-dialquilaminoalcoxi de 3-10 átomos de carbono, mercapto, e benzoilamino;
Z é-NH-,-O-,-S-ou-NR-;
R é alquila de 1-6 átomos de carbono, ou carboalquila de 2-7 átomos de carbono;
Gi, G2, Ri e R4 são cada, independentemente, hidrogênio, halogênio, alquila de 1-6 átomos de carbono, alquenila de 2-6 átomos de carbono, alquinila de 2-6 átomos de carbono, alqueniloxi de 2-6 átomos de carbono, alquiniloxi de 2-6 átomos de carbono, hidroximetila, halometila, alcanoiloxi de 1-6 átomos de carbono, alquenoiloxi de 3-8 átomos de carbono, alquinoiloxi de 3-8 átomos de carbono, alcanoiloximetila de 2-7 átomos de carbono, alquenoiloximetila de 4-9 átomos de carbono, alquinoiloximetila de
4-9 átomos de carbono, alcoximetila de 2-7 átomos de carbono, alcóxi de 1-6 átomos de carbono, alquiltio de 1-6 átomos de carbono, alquilsulfinila de 1-6 átomos de carbono, alquilsulfonila de 1-6 átomos de carbono, alquilsulfonamido de 1-6 átomos de carbono, alquenilsulfonamido de 2-6 átomos de carbono, alquinilsulfonamido de 2-6 átomos de carbono, hidróxi, trifluorometila, trifluorometoxi, ciano, nitro, carboxi, carboalcoxi de 2-7 átomos de carbono, carboalquila de 2-7 átomos de carbono, fenóxi, fenila, tiofenóxi, benzila, amino, hidroxiamino, alcoxiamino de 1-4 átomos de carbono, alquilamino de 1-6 átomos de carbono, dialquilamino de 2 a 12 átomos de carbono, N-alquilcarbamoíla, Ν,Ν-dialquilcarbamoíla, N-alquil-Nalquenilamino de 4 a 12 átomos de carbono, Ν,Ν-dialquenilamino de 6-12 átomos de carbono, fenilamino, benzilamino,
(C(Re)2)p / \
R7-(C(R6)2)P— Νχ /N-(C(R6)2)k-Y- , R3Ra-CH-M~(C(RB)2)k-Y- , (C(R6)2)p
R7-(C(R6)2)g-Y- , R7-(C(R6)2}p-JVI-(C(Re)2)k-Y- ou Het-(C(R6)2)q-W-(C(R6)2)k-Y- = ou Ri a R4 são como definidos acima eGi eG2 ou ambos são R2-NH-;
ou se qualquer um dos substituintes Rb G2, G3 ou G4 estão localizados em átomos de carbono contíguos, então eles podem ser tomados juntos como o radical divalente-O-C(R^)2-O-;
Y é um radical divalente selecionado dentre o grupo consistindo de —(CH2)a- , — O— , e —N— K6
R7 é-NR6R6,-OR<,—J,-N(R6)3 +, ou-NRf/ORg);
M é > NRfc-O-, > N-(C(R6)2)p NR^Rô ou > N-(C-(R6)2)P-OR6;
W é > NR^-O-ou é uma ligação;
Het é selecionado dentre o grupo consistindo de morfolina, tiomorfolina, tiomorfolina S-óxido, tiomorfolina S,S-dióxido, piperidina, pirrolidina, aziridina, piridina, imidazol, 1,2,3-triazol, 1,2,4-triazol, tiazol, tiazolidina, tetrazol, piperazina, furano, tiofeno, tetrahidrotiofeno, tetrahidrofurano, dioxano, 1,3-dioxolano, tetrahidropirano e (OCH2CH2O)r
N
H ;
em que Het é opcionalmente mono-ou di-substituído em carbono ou nitrogênio com R^, opcionalmente mono-ou di-substituído em carbono com hidróxi,-N(Rô)2, ou-OR^, opcionalmente mono-ou di-substituído carbono com hidroxi,-N(Ré)2, ou-OR^, opcionalmente mono-ou di-substituído em carbono com os radicais mono-valentes-(C(Ré)2)s ORó ou-(C(Ré)2)sN(Ré)2 e opcionalmente mono-ou di-substituídos em carbono saturado com radicais divalentes-O-ou-O(C(Ré)2)sO-;
Ré é hidrogênio, alquila de 1-6 átomos de carbono, alquenila de
2-6 átomos de carbono, alquinila de 2-6 átomos de carbono, cicloalquila de 1-6 átomos de carbono, carboalquila de 2-7 átomos de carbono, carboxialquila (2-7 átomos de carbono), fenila, ou fenila opcionalmente substituída com um ou mais halogênio, alcóxi de 1-6 átomos de carbono, trifluorometila, amino, alquilamino de 1-3 átomos de carbono, dialquilamino de 2-6 átomos de carbono, nitro, ciano, azido, halometila, alcoximetila de 2-7 átomos de carbono, alcanoiloximetila de 2-7 átomos de carbono, alquiltio de 1-6 átomos de carbono, hidroxi, carboxila, carboalcoxi de 2-7 átomos de carbono, fenoxi, fenila, tiofenoxi, benzoíla, benzila, fenilamino, benzilamino, alcanoilamino de
1-6 átomos de carbono, ou alquila de 1-6 átomos de carbono; com a condição que a porção alquenila ou alquinila é ligada a um átomo de nitrogênio ou oxigênio através de um átomo de carbono saturado;
R2 é selecionado dentre o grupo consistindo de r3
CO
R3-S-S-(C(R3)2)r
Ro O x ° r3
C> NR6 /
Re r6-n (C(R5)2)u^Jk X (C(R5)2)v Rs ’ // \ p
O crRs (C(R5)2)u\Jk (C(R5)2)v R5
O, ,(C(R5)2)u^Jk ( A X (C(R5)2)v R5
V/
N i
Re
Rc
SOo J“(ch2)s (ch2)s-j
Rc
O
J-(CH2)£ \
Rc CH<
\
Rr CH
Rs Rs
Q R5 O
R
Q
O
R3 é independentemente hidrogênio, alquila de 1-6 átomos de carbono, carboxi, carboalcóxi de 1-6 átomos de carbono, fenila, carboalquila de 2-7 átomos de carbono, (C(R6)2)p / \ | R7-(C(R6)2)p-N^ ^-(CfRefeV (C(Re)2)p
R7-(C(R6)2)s· . R7-(C(R6)2)p-M-(C(R6)2)rR8R9-CH-M- (C(R6)2),. , c -3t-(C(R6)2)q-W-(C(R6)2)r- I
R5 é independentemente hidrogênio, alquila de 1-6 átomos de carbono, carboxi, carboalcoxi de 1-6 átomos de carbono, fenila, carboalquila de 2-7 átomos de carbono, (C(R6)2)p / \
R7-(C(R6)2)p-Nx N-(C(R6)2)r(C(R6)2)p
R7-(C(R6)2)s- . R7-(C(R6)2)P-M-(C(R6)2)rll
R8R9-CH-M-(C(R6)2)r- ,or Het-(C(R6)2)q-W-(C(R6)2)r- i
R8 e R.9 são cada independentemente (C(RA)rNRóRó °u_ (C(R6)2)r ORô;
J é independentemente hidrogênio, cloro, flúor ou bromo;
Q é alquila de 1-6 átomos de carbono ou hidrogênio; a = 0 ou 1; g=l-6, k = 0-4; n é 0-1; m é 0-3;
P = 2-4; q = 0-4; r= 1-4; s = 1-6;
u = 0-4 e v = 0-4, em que a soma de u+v é 2-4; ou um sal farmaceuticamente aceitável do mesmo, desde que quando é alquenila de 2-7 átomos de carbono ou alquinila de
2-7 átomos de carbono, esta porção alquenila ou alquinila é ligada a um átomo de oxigênio ou nitrogênio através de um átomo de carbono saturado;
e ainda desde que quando Y é-NR^-e R7 é-NR6R6,-N(R6)3+, ou-NR^OR^), então g = 2-6;
quando M é-O-, e R7 é-OR^, então p = 1-4; quando Y é-NRô, então k = 2-4;
quando Y é-O-e M ou W é-O-, então k = 1-4;
quando W não é uma ligação com Het ligado através de um átomo de nitrogênio, então q = 2-4;
e quando W é uma ligação com Het ligado através de um átomo de nitrogênio e Y é-O-ou-NRô-então k = 2-4.
Os sais farmaceuticamente aceitáveis são os derivados de ácidos orgânicos e inorgânico s como ácidos acético, láctico, cítrico, tartárico, succínico, maleico, malonico, glucônico, clorídrico, bromídrico, fosfórico, nítrico, sulfurico, metanossulfônico e ácidos similarmente conhecidos aceitáveis.
Os sistemas de anel arila bicíclica ou heteroarila bicíclica são selecionados dentre o grupo consistindo de naftaleno, 1,2,3,4tetrahidronaftaleno, indano, 1-oxo-indano, 1,2,3,4-tetrahidroquinolina, naftiridina, benzofurano, 3-oxo-l,3-dihidro-isobenzofurano, benzotiofeno,
1,1-dioxo-benzotiafeno, indol, 2,3-dihidroindol, l,3-dioxo-2,3-dihidro-lHisoindol, benzotriazol, lH-indazol, indolina, benzopirazol, 1,3-benzodioxol, benzooxazol, purina, ftalimida, cumarina, cromona, quinolina, tetrahidroquinolina, isoquinolina, benzimidazol, quinazolina, pirido[2,3-b] piridina, pirido[3,4-b] pirazina, pirido [3,2-c] piridazina, pirido[3,4-b] piridina, lH-pirazol[3,4-d] pirimidina, 1,4-benzodioxano, pteridina, 2(1H)quinolona, l(2H)-iso-quinolona, 2-oxo-2,3-di-hidro-benztiazol, 1,2metilenodioxibenzeno, 2-oxindol, 1,4-benzisoxazina, benzotiazol, quinoxalina, quinolina-N-óxido, isoquinolina-N-óxido, quinoxalina-N-óxido, quinazolina-N-óxido, benzoazina, ftalazina, 1,4-dioxo-1,2,3,4-tetrahidro25 ftalazina, 2-oxo-l,2-dihidro-quinolina, 2,4-dioxo-l,4-dihidro-2Hbenzo[d] [1,3] oxazina, 2,5-dioxo-2,3,4,5-tetrahidro- lH-benzo[e] [1,4]diazepina, e cinnolina.
Quando L é um anel heteroarila de 5 ou 6 membros, os anéis heteroarila preferidos incluem piridina, pirimidina, imidazol, tiazol, tiazolidina, pirrol, furano, tiofeno, oxazol ou 1,2,4-triazol.
Cada um ou ambos os anéis de grupo arila bicíclico ou heteroarila bicíclico podem ser completamente insaturados, parcialmente saturados ou completamente saturados. Um substituinte oxo na porção arila bicíclica ou heteroarila bicíclica significa que um dos átomos de carbono tem um grupo carbonila. Um substituinte tio na porção arila bicíclica ou heteroarila bicíclica significa que um dos átomos de carbono tem um grupo tiocarbonila.
Quando L é um anel heteroarila de 5 ou 6 membros, ele pode ser completamente insaturado, parcialmente saturado ou totalmente saturado. O anel heteroarila pode ser ligado a A via carbono ou nitrogênio. Um substituinte oxo no anel heteroarila significa que um dos átomos de carbono tem um grupo carbonila. Um substituinte tio no anel heteroarila significa que um dos átomos de carbono tem um grupo tiocarbonila.
A porção alquila de substituintes alquila, alcóxi, alcanoiloxi, alcoximetila, alcanoiloximetila, alquilsulfinila, alquilsulfonila, alquilsulfonamido, carboalcoxi, carboalquila, carboxialquila, carboalcoxi alquila, alcanoilamino, N-alquilcarbamoíla, e Ν,Ν-dialquilcarbamoíla, Nalquilaminoalcoxi, Ν,Ν-dialquilaminoalcoxi incluem tanto as cadeias retas como cadeias de carbono ramificadas. A porção alquenila de substituintes alquenila, alquenoiloximetila, alqueniloxi, alquenilsulfonamido, incluem tanto cadeias retas como cadeias de carbono ramificadas e um ou mais sítios de insaturação e todos os isômeros configuracionais possíveis. A porção alquinila de substituintes alquinila, alquinoiloximetila, alquinilsulfonamido, alquiniloxi, inclui tanto cadeias retas como cadeias de carbono ramificadas e um ou mais sítios de insaturação. Carboxi é definido como um radical-CO2H. Carboalcoxi de 2-7 átomos de carbono é definido como um radical-CO2R, onde R é um radical alquila de 1-6 átomos de carbono. Carboxialquila é definido como HO2C-R-radical, onde R' é um radical alquila divalente de 1-6 átomos de carbono. Carboalcoxialquila é definida como radical RO2C-R' onde R' é um radical alquila divalente e onde R e R' juntos tem 2-7 átomos de carbono. Carboalquila é definido como um radical-COR, onde R é um radical alquila de 1-6 átomos de carbono. Alcanoiloxi é definido como um radical-OCOR, onde R é um radical alquila de 1-6 átomos de carbono. Alcanoiloximetila é definido como um radical RCO2CH2-, onde R é um radical alquila de 1-6 átomos de carbono. Alcoximetila é definida como radical ROCH2, onde R é um radical alquila de 1-6 átomos de carbono. Alquilsulfinila é definida como radical RSO-, onde R é um radical alquila de 1-6 átomos de carbono. Alquilsulfonila é definido como um radical RSO2-, onde R é um radical alquila de 1-6 átomos de carbono. Alquilsulfonamido, alquenilsulfonamido, alquinilsulfonamido são definidos como radical RSO2NH-, onde R é um radical alquila de 1-6 átomos de carbono, um radical alquenila de 2-6 átomos de carbono, ou um radical alquinila de 2-6 átomos de carbono, respectivamente. N-alquilcarbamoíla é definida como radical RNHCO-, onde R é um radical alquila de 1-6 átomos de carbono. Ν,Ν-dialquilcarbamoíla é definida como radical R R'NCO-, onde R é um radical alquila de 1-6 átomos de carbono. R' é um radical alquila de 1-6 átomos de carbono e R', e R podem ser idênticos ou diferentes. Quando X é substituído, prefere-se que seja mono-, di-ou tri-substituído, com mono-substituído sendo mais preferido. Prefere-se que os substituintes RI e R4, pelo menos um seja hidrogênio e mais preferido que ambos sejam hidrogênio. Prefere-se também que X seja um anel fenila, Z é-NH-, e n = 0.
Het é um heterociclo, como acima mencionado, que pode ser opcionalmente mono-ou di-substituído com R$ no carbono ou nitrogênio, opcionalmente, mono ou di-substituído em carbono com hidróxi,-N(Rô)2 ouORô, opcionalmente mono-ou di-substituído em carbono com-(C(R6)2)sORó ou(C(R6)2)sN(R6)2, e opcionalmente mono-ou di-substituído em um carbono saturado com divalentes-0-ou-0(C(R6)2)sO-(grupos carbonila ou cetal,
respectivamente), em alguns casos, quando Het é substituído com-O(carbonila), o grupo carbonila pode ser hidratado. Het pode ser ligado a W quando q = 0 via um átomo de carbono no anel heterocíclico, ou quando Het é um heterociclo contendo nitrogênio que também contém uma ligação carbononitrogênio saturada, este heterociclo pode ser ligado ao carbono, via o nitrogênio, quando W é uma ligação. Quando q = 0, e Het é um heterociclo contendo nitrogênio, que também contém uma ligação carbono-nitrogênio insaturada, que o átomo de nitrogênio do heterociclo pode ser ligado a carbono quando W é uma ligação e o heterociclo resultante irá conter uma carga positiva. Quando Het é substituído com Ré, esta substituição pode ser no carbono do anel, ou no caso de um heterociclo contendo nitrogênio, que também contém um carbono-nitrogênio saturado, este nitrogênio pode ser substituído com R<$ ou no caso de um heterociclo contendo nitrogênio, que também contém um carbono-nitrogênio insaturado, este nitrogênio pode ser substituído com R$ neste caso o heterociclo irá conter uma carga positiva. Os heterociclos preferidos incluem piridina, morfolina 2,6-di-substituída, tiomorfolina 2,5-di-substituída, imidazol 2-substituído, tiazol substituído, imidazol N-substituído, 1,4-piperazinaN-substituída, piperadina N-substituída, e pirrolidina N-substituída.
Os compostos desta invenção podem conter um ou mais átomos de carbono assimétricos, nestes casos, os compostos desta invenção incluem os diastereômeros individuais, os racematos, e os enantiômeros R e S individuais dos mesmos. Alguns dos compostos desta invenção podem conter uma ou mais duplas ligações, em tais casos, os compostos desta invenção mcluem dada um dos possíveis isômeros configuracionais assim como misturas destes isômeros.
Os compostos tendo a fórmula 1 e seus sais podem ser preparados por um processo que compreende:
(a) reagir um composto tendo a fórmula
em que Rb Gb G2, R4, Z, neX são como definidos acima com um agente desidratante de modo a converter o grupo aminocarbonila em um grupo ciano, ou (b) reagir um composto tendo a fórmula
ArNH-A2 ou um sal do mesmo com um composto tendo a fórmula Q-a3 onde Q é um grupo de saída e Ab A2 e A3 são tais que Ai-NA2A3 é um composto de acordo com a fórmula 1; ou (c) reagir um composto tendo a fórmula
A4-OH ou um sal do mesmo com um composto tendo a fórmula Q-A5 em que Q é como definido acima e A4 e A5 são tais que A4-OA5 é um composto de acordo com a fórmula 1; ou (d) adicionar um ácido a um composto tendo a fórmula 1, de modo que um sal de adição de ácido é preparado.
A preparação dos compostos e intermediários desta invenção englobados pela fórmula 5 é descrita abaixo no fluxograma 1 onde Ζ, X, n, Rb G2, Gi e R4 são como descrito acima. De acordo com a sequência de reação dada no Fluxograma 1, um éster de ácido quinolina-3-carboxilico de fórmula 2 é hidroxilado com base para fornecer um ácido carboxílico de fórmula 3. O grupo de ácido carboxílico de 3 é convertido em um acil imidazol por aquecimento do mesmo com carbonil diimidazol em um solvente inerte como dimetilformamida (DMF) seguido pela adição de amônia para dar a amida 4. A desidratação de grupo funcional amida com um agente desidratante como anidrido trifluoroacético em piridina, pentóxico fosforoso, em um solvente inerte, ou outros dá as 3-ciano quinolinas, 5, desta invenção. Nestes casos onde qualquer um dos intermediários tem um átomo de carbono assimétrico, eles podem ser usados como o racemato ou como os enantiômeros R ou S individuais neste caso os compostos da invenção estarão nas formas racêmicas ou R e S opticamente ativas, respectivamente. Os ésteres de ácido quinolina-3 carboxílico de fórmula 2, os ácidos quinolina-3-carboxílicos de fórmula 3 e as amidas quinolina-3-carboxílicas de fórmula 4 necessárias para preparar os compostos desta invenção são ou já conhecidos na arte ou podem ser preparados por procedimentos conhecidos na arte como detalhado pelas seguintes referências:
FLUXOGRAMA 1
carbonildiimidazol, DMF
2. NH3
NaOH
(CH2)n-X
CO2H piridina
CO2NH2 (CF3CO)2O
A preparação dos compostos desta invenção englobados pela fórmula 12 é descrita abaixo no fluxograma 2, onde X, Z, n, Rb G2, Gi e R4 são como descritos acima. A anilina substituída de fórmula 6 é aquecida com ou sem um solvente com o reagente 7 para dar intermediário 8 como uma mistura de isômeros. A termólise de 8 em um solvente de alto ponto de ebulição como éter difenilico a 200-350 °C dá as 3-ciano quinolinas de fórmula 9, estes intermediários também podem existir na forma tautomérica de 4-hidroxi quinolina. Nestes casos, onde R4 é um átomo de hidrogênio, os intermediários 9 podem ser formados como uma mistura de dois regioisômeros. Estes isômeros podem ser separados por processos bem conhecidos dos versados na arte incluindo, mas não são limitados a cristalização fracional e processos de cromatografia. Os isômeros separados podem ser então convertidos de modo separado nos compostos da invenção. Altemativamente, os isômeros podem ser separados em um estágio posterior da síntese. O aquecimento dos compostos 9 com ou sem solvente com um agente clorante como oxicloreto fosforoso ou pentacloreto fosforoso dá as 4-cloro-3-ciano quinolinas de fórmula 10. A condensação de 10 com uma amina nucleófila, anilina, mercaptano, tiofenol, fenol, ou reagente de álcool de fórmula 11 dá os intermediários de 3-ciano quinolinas de fórmula 12; esta condensação pode ser acelerada por aquecimento da mistura de reação ou por uso de catalisadores básicos como trialquilaminas, hidreto de sódio em um solvente inerte, alcóxidos de sódio ou potássio, em solventes de álcool, e outros. Nestes casos, onde os substituintes podem contribuir com um átomo de carbono assimétrico, os intermediários podem ser usados como o racemato ou como os enantiômeros R ou S individuais neste caso os compostos desta invenção estarão nas formas racêmicas ou R e S opticamente ativas, respectivamente. Nos casos onde os substituintes podem contribuir com mais de um dos átomos de carbono assimétricos, diasteriômeros podem estar presentes; estes podem ser separados por processos bem conhecidos dos versados na arte incluindo, mas não são limitados a cristalização fracional e processos de cromatografia. Nos casos onde as porções Rb G2, Gi e R4 contém grupos amino primários ou secundários, os grupos amino podem primeiro ter de ser usados em forma protegida antes da reação com reagente 7. Os grupos de proteção apropriados incluem, mas não são limitados a terc-butoxicarbonila (BOC) e grupos de proteção benziloxicarbonila (CBZ). O primeiro grupo de proteção pode ser removido dos produtos finais de fórmula 12, por tratamento com um ácido como ácido trifluoroacético enquanto o último grupo de proteção pode ser removido por hidrogenação catalítica. Nestes casos, onde as porções Rb G2, Gi e R4 contém grupos hidroxila, os grupos hidroxila podem primeiro precisar ser usados na forma protegida antes da reação com reagente 7. Os grupos de proteção apropriados incluem, mas não são limitados a grupos de proteção tbutildimetilsilila, tetrahidropiranila, ou benzila. Os primeiros dois grupos de proteção podem ser removidos dos produtos finais de fórmula 12 por tratamento com um ácido como ácido acético ou ácido clorídrico enquanto o último grupo de proteção pode ser removido por hidrogenação catalítica.
FLUXOGRAMA 2
A preparação de intermediário 15 (idêntico ao intermediário 9 de fluxograma 2) também pode ser preparada como descrito abaixo no fluxograma 3. O aquecimento de anilina substituída de fórmula 13 com dimetilformamida dimetil acetal com ou sem um solvente dá intermediários para fórmula 14. A reação de 14 com o ânion lítio de acetonitrila preparado usando uma base como n-butil lítio ou outro em um solvente inerte dá 3-ciano quinolinas, 15, ou os tautômeros de 3-ciano-4-hidroxi quinolina dos mesmos que podem ser convertidos nos compostos da invenção. Nestes casos, onde as porções Rb G2, Gi e R4 contém grupos amino primários ou secundários, os grupos amino podem primeiro precisar ser usados na forma protegida. Os grupos de proteção apropriados incluem, mas não são limitados a grupos de
proteção terc-butoxi carbonila (BOC) e benziloxicarbonila (CBZ). O primeiro grupo de proteção pode ser removido dos produtos finais de fórmula 15 por tratamento com um ácido, como ácido trifluoroacético enquanto o último grupo de proteção pode ser removido por hidrogenação catalítica. Nos casos onde as porções Rb G2, Gi e R4 contém grupos hidroxila, os grupos hidroxila podem primeiro precisar ser usados em forma protegida. Os grupos de proteção apropriados incluem, mas não são limitados a grupos de proteção tbutildimetilsilila, tetrahidropiranila, ou benzila. Os primeiros dois grupos de proteção podem ser removidos dos produtos finais de fórmula 15 por tratamento com um ácido como ácido acético ou ácido clorídrico enquanto o último grupo de proteção pode ser removido por hidrogenação catalítica.
FLUXOGRAMA 3
A preparação dos compostos da invenção englobados pela fórmula 24 é descrita abaixo no fluxograma 4, em que Rb G2, R4, Ζ, n e X são definidos. R10 é alquila de 1-6 átomos de carbono (preferivelmente isobutila). R2' é um radical selecionado dentre o grupo consistindo de
R3-S-S-(C(R5)2)r
(C(R5)2)u^/ (C(R5)2V r5
J-(CH2)s
J-(CH2)s' (CH2)s-J
J-(CH2)s—== em que R^, R3, R5, J, s, r, u e v são definidos. De acordo com as reações descritas no fluxograma 4, uma 4-cloro-3-ciano-6-nitro quinolina 16, pode ser reagida com uma amina ou anilina 17 por aquecimento em um solvente inerte como tetrahidrofurano, butanol ou metoxietanol para dar os compostos de fórmula 20, onde Z é-NH-. A reação de 16 com um mercaptano ou tiofenol 18 em um solvente inerte pode ser obtida usando uma base como hidreto de sódio para dar compostos de fónnula 20 onde Z é-S-. A reação de 16 com um álcool ou fenol 19 em um solvente inerte pode ser obtida usando uma base como hidreto de sódio para dar compostos de fórmula 20, onde Z é-O-. Os compostos de fórmula 20 podem ser reduzidos em 6-amino-3-ciano quinolina,
21, usando um agente de redução como hidrossulfito de sódio em um sistema de duas fases consistindo de tetrahidrofurano e água na presença de uma quantidade pequena de catalisador de transferência de fase ou usando ferro em refluxo de solventes próticos contendo ácido acético ou cloreto de amônio. A acilação de 21 com ou cloreto de ácido de fórmula 22 ou um anidrido misto de fórmula 23 (que é preparado do ácido carboxílico correspondente) em um solvente inerte como tetrahidrofurano (THF) na presença de uma base orgânica como piridina, trietilamina, diisopropiletilamina, ou N-metil morfolina dá os compostos desta invenção de fórmula 24. Nestes casos onde 22 ou 23 tem um átomo de carbono assimétrico, eles podem ser usados como o racemato ou como os enantiômeros R ou S individuais neste caso os compostos desta invenção estarão nas formas racêmicas ou R e S opticamente ativas, respectivamente. Nos casos onde R2' contém grupos amino primários ou secundários, os grupos amino terão primeiro protegidos antes de formação de cloreto de ácido ou anidrido. Os grupos de proteção apropriados incluem, mas não são limitados a terc-butoxicarbonila (BOC) e grupos de proteção benziloxicarbonila (CBZ). O primeiro grupo de proteção pode ser removido dos produtos finais de fórmula 24, por tratamento com um ácido como ácido trifluoroacético enquanto o último grupo de proteção pode ser removido por hidrogenação catalítica. Nestes casos, onde R2' contém grupos hidroxila, os grupos hidroxila podem primeiro precisar ser protegidos antes da formação de cloreto de ácido ou anidrido. Os grupos de proteção apropriados incluem, mas não são limitados a grupos de proteção t-butildimetilsilila, tetrahidropiranila, ou benzila. Os primeiros dois grupos de proteção podem ser removidos dos produtos finais de fórmula 24 por tratamento com um ácido como ácido acético ou ácido clorídrico enquanto o último grupo de proteção pode ser removido por hidrogenação catalítica. Nestes casos, nos intermediários 17, 18 ou 19, onde X contém grupos amino primários ou secundários ou grupos hidroxila, pode ser necessário proteger estes grupos antes da reação com 16. Os mesmos grupos de
proteção amina ou álcool descritos acima podem ser usados e eles podem ser removidos dos produtos 24, como previamente descrito.
FLUXOGRAMA 4
H2N-(CH2)n-X (17)
OU
HS-(CH2)n-X (18), NaH, THF
R, Cl
o
R2'-< OU R2’-<
Cl
Fe ch3co2h, c2h5oh
OCOR-io
THF, piridina ou (C2H5)3N
Ao usar processos similares aos descritos acima no fluxograma 5 4, os intermediários 25 podem ser convertidos nos compostos desta invenção
26.
A fim de preparar os compostos desta invenção, algumas aminas são requeridas. Algumas aminas representativas são mostradas abaixo na Lista A em que R^, p e r são como acima. Estas aminas são comercialmente disponíveis, são conhecidas na literatura química ou podem ser preparadas por procedimentos simples que são bem conhecidos dos versados na arte. Em alguns casos estas aminas podem ter átomos de carbono assimétricos, elas podem ser usados como o racemato ou podem ser resolvidas e usadas como os enantiômeros R ou S individuais neste caso os compostos desta invenção estarão nas formas racêmicas opticamente ativas, respectivamente. Em todo este pedido nos fluxogramas mostrados abaixo, estas aminas e outras aminas similares, serão representadas pela estrutura genérica de fórmula:
(R')2NH, em que esta fórmula pode representar uma amina primária ou secundária.
Lista A
Re
Re
ORfi
Re
NH
NH (Ç(Re)2)P
Re
Re
Re
N-(C(R6)áp —NH R6
Rj-O-(CfRjfc), —NH
Re ;n-(C(R6)2)p —NH Re
R6-O-(C(R6)2)r
R6-O-(C(R6)2)r
Re
-NH
R« (Ç(Re)2)p ^-(ClRs^p —NH R6
Re
R6-N-(C(R6)2)r \ ?s
Re / NH
R6-N-(C(R6)2)r 7
OR« (Ç(R6)2)p
R6-O-(C(R6)2)r
Re
R6-N-(C(R6)2)r
Re
NH
R6-O-(C(R6)2)p —NH
Çnh
R6c>
A fim de preparar os compostos desta invenção, alguns álcoois são requeridos. Alguns álcoois representativos são mostrados abaixo na Lista B em que Ró, per são como acima. Estes álcoois são comercialmente disponíveis, são conhecidas na literatura química ou podem ser preparadas por
procedimentos simples que são bem conhecidos dos versados na arte. Em alguns casos estes álcoois podem ter átomos de carbono assimétricos, eles podem ser usados como o racemato ou podem ser resolvidos e usados como os enantiômeros R ou S individuais neste caso os compostos desta invenção estarão nas formas racêmicas ou opticamente ativas, respectivamente. Em todo este pedido nos fluxogramas mostrados abaixo, estes álcoois e outros álcoois similares, serão representados pela estrutura genérica de fórmula:
R’OH Lista B
Re r6_OH n-(C(R6)2)-OH R6-O-(C(R6)2)r-OH R6
R6_O-(C(R6)2)r
OH
Re-O*-(C(Re)2)r
Re-N-(C(Re)2)r R6-O-(C(R6)2)r
V OH Vo»
Re-N-tCÍRetó; R6-N-(C(Rá2)f
R6 Hg
OH
OH
A fim de preparar alguns dos compostos desta invenção, alguns anidridos mistos das fórmulas 31, 34 e 38 são requeridos; estes são preparados como descrito abaixo nos fluxogramas 5-6 em que R^, Rio, X, Ζ, n e s são como acima definidos. J’ é um átomo de halogênio, cloro, bromo ou iodo, ou é um grupo tosilato (p-toluenossulfonato) ou mesilato (metanossulfonato). A reação de 27 com uma amina da Lista A é realizada aquecendo em um solvente inerte como tetrahidrofurano ou N,Ndimetilformamida, ou usando carbonato de potássio ou césio em acetona. A temperatura e duração do aquecimento dependerão da reatividade de 27;
β7 tempos de reação mais longos e temperaturas mais altas podem ser requeridos quando s é maior do que 1. Tratamento de 28 com um reagente alquil lítio seguido por resfriamento brusco com uma atmosfera de dióxido de carbono seco fornece os ácidos carboxílicos da fórmula 29. Estes podem ser convertidos em anidridos mistos da fórmula 31 usando um reagente como cloroformato de isobutila em um solvente inerte como tetrahidrofurano na presença de uma base como N-metilmorfolina. Estes anidridos podem então ser usados para preparar os compostos desta invenção como descrito acima no fluxograma 4. A reação de 27 com um álcool da Lista B é realizada usando hidreto de sódio ou outra base não nucleófila como carbonato de potássio ou de césio em um solvente inerte como tetrahidrofurano, acetona ou N,N-dimetilformamida. Em alguns casos, o álcool da Lista B também pode ser o solvente da reação. Tratamento de 32 com um reagente alquil lítio seguido por resfriamento brusco com uma atmosfera de dióxido de carbono seco fornece os ácidos carboxílicos da fórmula 33. Estes podem ser convertidos em anidridos mistos da fórmula 34 usando um reagente como cloroformato de isobutila em um solvente inerte como tetrahidrofurano na presença de uma base como N-metilmorfolina. Estes anidridos então podem ser usados para preparar os compostos desta invenção, como descrito acima no fluxograma 4.
(R’)2N—(C(R6)2)s28
FLUXOGRAMA 5 (R')2NH
J1—(C(R6)2)s — η
-H
1. THF, n-BuLi
2. CO2 (R’)2N—(C(R6)2)s29 =—co2h
R10O-C 30 Cl
THF,
N-metilmorfolina (R’)2N—(C(R6)2)s31 zP çf \y-R10
J’-(C(R6)2)S—=
1. THF, n-BuLi
2. CO2
R’OH •H -► R'O
K2CO3, acetona ou
NaH, THF
R’O—(C(R6)2)s—==-CO2H (C(R6)2)s--=......H
O
R10O—30 Cl
THF,
N-metilmorfolina
R’O—(C(R6)2)s — C'
Y θ OR10 34
Como descrito no fluxograma 6 abaixo, em que Rb G2, R4, R<s, Rio, X, Ζ, n e s são como acima definidos, álcoois 35 podem ser protegidos com grupo de proteção t-butil dimetilsilila pela reação com o cloreto de silila respectivo em cloreto de metileno na presença de trietilamina e 4-N,Ndimetilamino piridina (DMAP). Os álcoois protegidos resultantes, 36, são convertidos nos reagentes de Grignard acetilênicos que, por sua vez, são mantidos sob uma atmosfera de dióxido de carbono seco para dar os ácidos carboxílicos 37. Como descrito acima, estes são convertidos nos anidridos mistos 38 que, em reação com a 6-amino-3-cianoquinolina 39, dá 40. Na etapa final da sequência, o grupo de proteção silila é removido tratando com ácido em uma mistura de solvente aprótico para dar os compostos representados pela fórmula 41.
FLUXOGRAMA 6
HO—(C(R6)2)s35 t-BuSi(CH3)2-CI ch2ci2, (C2H5)3. DMAP t-BuSi(CH3)2—O— (C(Re)2)s—=
1.THF, MeMgBr ZO THF, R10O—-4^
- t-BuSi(CH3)2—O—(C(R6)2)S—=-< -SI
2- θθ2 OH N-metilmorfolina
Os compostos desta invenção também são preparados como mostrado abaixo no fluxograma 7, em que Rb G2, R4, Ró, Rio, X, Ζ, n e s são como acima definidos. J’ é um átomo de halogênio, cloro, bromo ou iodo, ou é um grupo tosilato ou mesilato. Tratamento de 42 com um reagente alquil lítio em temperatura baixa seguido por resfriamento brusco com uma
atmosfera de dióxido de carbono seco fornece os ácidos carboxílicos da fórmula 43. Estes podem ser convertidos em anidridos mistos da fórmula 44 usando um reagente como cloroformato de isobutila em um solvente inerte como tetrahidrofurano na presença de uma base como N-metilmorfolina.
Estes anidridos então podem ser usados para preparar os compostos desta invenção como pela reação com as 6-amino-3-cianoquinolinas 45 descritas acima nos fluxogramas. A reação de 46 com um álcool da Lista B é realizada usando hidreto de sódio ou outra base não nucleófila em um solvente inerte como tetrahidrofurano ou Ν,Ν-dimetilformamida para dar os compostos desta invenção representados por 47. Em alguns casos, o álcool da Lista B também pode ser o solvente da reação. A reação de 46 com uma amina da Lista A dá os compostos desta invenção representados por 48 é realizada aquecendo em um solvente inerte como tetrahidrofurano ou Ν,Ν-dimetilformamida, ou usando carbonato de potássio ou de césio em acetona. A temperatura e duração do aquecimento dependerão da reatividade de 46; tempos de reação mais longos e temperaturas mais altas podem ser requeridos quando s é maior do que 1.
FLUXOGRAMA 7 j· (C(R6)2)S—=-H 42
1. THF, n-BuLi
--- J’
2. CO2 (C(R6>2):
Usando processos similares aos resumidos acima, 45b pode ser convertido em 47b ou 48b.
b
48b
Outros cloretos de ácido carboxílico e anidridos necessários para preparar alguns dos compostos desta invenção são preparados como mostrado abaixo no fluxograma 8, em que R^, R3, Rio, X, Z, J’, n e s são como acima definidos. Q’ é um grupo alquila de 1-6 átomos de carbono. Os ésteres 49, 53 ou 57 podem ser hidrolisados com uma base como hidróxido de bário para dar o ácido carboxílico respectivo 50, 54 ou 58. Este ácido pode ser convertido nos cloretos de ácido carboxílico respectivos 51 ou 56 usando cloreto de oxalila e Ν,Ν-dimetilformamida catalítica em um solvente inerte ou anidridos mistos respectivos 55 ou 59 usando cloroformato de isobutila e uma base orgânica como N-metilmorfolina. O grupo de partida nos compostos representados pela fórmula 52 pode ser substituídos pelas aminas da Lista A ou os álcoois da Lista B usando procedimentos descritos previamente para dar os intermediários 57 e 53, respectivamente. Estes cloretos de ácido carboxílico 51 e 56 e estes anidridos 55 e 59 podem ser usados para preparar alguns dos compostos desta invenção usando os processos descritos aqui acima nos fluxogramas.
FLUXOGRAMA 8 r3 ,co2q’ J'-(CfRefe)/ R3
Ba(OH)2 etanol. H?O
R3 co2h
Z=^ ’(C(R6)2)s' R3 (COCI)2 R3 coei
CH2C12, DMF (cat) J’-(C(R6)2)s R3 r3 co2q·
J'-(C(R6)2)H,3
R'OH r3 co2q'
K2CO3, acetona Ro' (c(R6)2)s R3 ou
NaH.THF
Ba(OH)2
R3 co2h )=(
RO'—(CfReh)/ Rs
RioO^.
Cl
THF
N-metilmorfolina etanol, H2O
Js ou (COCI)2i CH2CI2, DMF (cat.) r,Vx-°r,°
Z~<
RO'-(C(R6)2)' R3 ou
R3 COCI
RO’—(C(R6)2)s Rs
R3 co2q z=x
J’-(C(R6)2)' R3
Ba(OH)2 (Rj2NH (Rj2N~(C(R6)2)s' 57
R3 ,CO2Q r3 etanol, H2O r3 co2h z=( (R’)2n—(C(R6)2)' r3 r7o-<
,0
Cl R3_%AcfR7 ( ° (R')2N—(CíRefe)/ R3
THF
ΝΓ-m i 1 rrt nrfn 11 n a
Usando os processos idênticos aos descritos acima no fluxograma 8, é possível preparar os cloretos de ácido carboxílico e anidridos análogos dados abaixo na Lista C, em que R^, R3, p e s são como definidos previamente. G é o radical:
J3R10
0° e A é o radical:
-N(R’)2,-OR’,ou-J’ em que-N (R’)2 é derivado das aminas da Lista A,-0R’ são derivados dos álcoois da Lista B, e J’ é um grupo de partida como definido previamente. Usando estes cloretos de ácido carboxílico e anidridos, seguindo os processos resumidos acima nos fluxogramas, e de acordo com os detalhes descritos nos exemplos dados abaixo, muitos dos compostos desta invenção podem ser preparados.
LISTA C
A-(C(Re)2)s G / \ R3 R3
i\3
R3 G
R3 (C(R6)2)s-A
R3 (C(R6)2)s-A
Μ Λ r3
r3
r3
A-(C(R6)2)s. g r3 r3 ,r3 r3
Α’
R3 (C(R6)2)s-A
G r3 r3
A-(C(Re)2). R,
A-(C^;2;s K3
R3 (C(R6)2)s-a
A-(C(R6)2)!
Rs (C(Re)2)s-A
A-(C(R6)2)
(C(R3)2)P
Os compostos desta invenção representados pelas fórmulas
62-63 podem ser preparados como mostrado no fluxograma 9, em que Rb G2, R4, Rô, R3, Rio, X, Z, J’, n e s são como definidos acima. A reação dos cloretos de ácido carboxílico 60 e as 6-amino-3-cianoquinolinas 61 usando uma base orgânica em um solvente inerte dá os compostos desta invenção representados pela fórmula 62. A reação de 62 com um álcool da Lista B é realizada usando hidreto de sódio ou outra base não nucleófila como carbonato de potássio e de césio em um solvente inerte como tetrahidrofurano, acetona ou Ν,Ν-dimetilformamida para dar os compostos desta invenção representados por 63. Em alguns casos, o álcool da Lista B também pode ser o solvente da reação. A reação de 62 com uma amina da Lista A para dar os compostos desta invenção representados por 64 é realizada aquecendo em um solvente inerte como tetrahidrofurano ou Ν,Νdimetilformamida. A temperatura e duração do aquecimento dependerão da reatividade de 62; tempos de reação mais longos e temperaturas mais altas podem sem requeridos quando s é maior do que 1. Além disso, usando este processo, os cloretos de ácido carboxílico e anidridos mistos na Lista C podem ser usados para preparar os compostos análogos desta invenção.
FLUXOGRAMA 9 r3 coci /=7
J·-(C(R6)2)s Ra
(Rj2NH
Aplicando os processos resumidos acima,
61b pode ser convertido em 63b e 64b via o intermediário 62b.
A reação de 62 ou 62b com um nitrogênio contendo heterociclo HET que também contém uma ligação carbono-nitrogênio insaturada é realizada refluxando em um solvente inerte e dá os compostos desta invenção 64c e 64d, respectivamente, onde o composto carrega uma carga positiva. O contra ânion J’-pode ser substituído com qualquer outro ânion farmaceuticamente aceitável usando a resina de troca iônica apropriada.
Alguns dos compostos desta invenção podem ser preparados como descrito abaixo no fluxograma 10, em que Rb G2, R3, Rt, Ró, Rio? X, Z, J’, n e r são como acima definidos. Os álcoois acetilênicos 65 podem ser copulados aos halogenetos, mesilatos ou tosilados 66 usando uma base como hidreto de sódio em um solvente inerte como tetrahidrofurano. O acetileno resultante, 67, é então tratado com um reagente alquil lítio em temperatura baixa. Mantendo a reação sob uma atmosfera de dióxido de carbono dá, então, os ácidos carboxílicos 68. Estes, por sua vez, são reagidos com as 6amino-3-cianoquinolinas 69, via os anidridos misturados, para dar os compostos desta invenção representados pela fórmula 70. Altemativamente, os intermediários 67 podem ser preparados iniciando com um álcool 71, tratando primeiro com uma base como hidreto de sódio em um solvente inerte como tetrahidrofurano e então adicionando um acetileno 72 que tem um grupo de partida apropriado. De um modo similar, os amino álcoois representados pela fórmula: (Ró)2 N-(C(Ró)2)r-OH reagindo com 72, e aplicando a química do fluxograma 10, podem ser convertidos nos compostos desta invenção representados pelas fórmulas:
(R6)2N—(C(R6)2)r-O-(C(R6)2)r
II
O
FLUXOGRAMA 10
HO—(C(R6)2)r = H
1. THF, NaH
2. R6O—(C(R6)2)r-J'
1.THF, n-BuLi
R6O—(Ç(R6)2)r-O-(C(R6)2)r—ΞΞΞ-Η ->
2. CO2
1. THF, NaH
R6O—(C(R6)2)r-OH -*2. J'-(C(R6)2)r—-ΞΞΞΞ—H
72
R6o—(C(R6)2)r-O-(C(R6)2)r-ΞΞΞΞ—H
Aplicando processos similares como acima descrito, 69b pode ser convertido nos compostos desta invenção representados por 70b.
Os compostos desta invenção representados pelas fórmulas 76 e 77 são preparados como mostrado abaixo no fluxograma 11, em que Rb R3,
R4, Rô e n definidos acima, e as aminas HN (R”)2 são selecionadas do grupo:
hvZ/° H\3N-Re ’e >
Refluxo de 73 e 74 em um solvente como etanol dá o intermediário 75 que pode reagir com uma amina e refluxando etanol para dar os compostos desta invenção representados pela fórmula 76. Tratamento 75 com um excesso de um alcóxido de sódio em um solvente inerte ou um solvente do qual o alcóxido é derivado dá os compostos desta invenção da fórmula 77.
FLUXOGRAMA 11
77
De um modo similar ao descrito acima, 74b pode convertido em 76b ou 77b.
ser
Os compostos desta invenção representados pela fórmula 83 pode ser preparado como mostrado no fluxograma 12, em que Rb G2, R4, Ró, Rs, Rio, X, Ζ, n e r são como definidos acima. A reação dos ácidos carboxílicos mercapto 78 com os reagentes 79 dá os compostos representados pela fórmula 80. Altemativamente, 80 pode ser preparado do mercaptano
R3SH usando o ácido mercapto 78, trietilamina e dissulfeto de 2,2’-dipiridila.
Formação de anidrido misturado para dar 81 seguido pela condensação com as 6-amino-3-cianoquinolinas 82 dá os compostos desta invenção.
FLUXOGRAMA 12 o2 h3c-s-sr3
HS—(C(R6)2) — COOH ou dissulfeto de 2,2’-dipiridila, R3SH R3S-·S (C(Rs)2)r COOH
R10OCl
Et3N, THF
THF
N-metilmorfolina
THF, piridina
O
R3s-s—(C(R6)2)r—C-O-CO2R10
Aplicando processos similares como descrito acima, 82b pode ser convertido em 83b.
Os compostos desta invenção representados pelas fórmulas 86-88 podem ser preparados como mostrado no fluxograma 13, em que Rb G2, Ri, R4, R5, J’, X, Z e n são como definidos acima. Q’ é alquila de 1-6 átomos de hidrogênio, alcóxi de 1-6 átomos de hidrogênio, hidróxi ou hidrogênio. Alquilação de 84 com as 6-amino-3-cianoquinolinas 85 pode ser
realizada aquecendo em um solvente inerte como Ν,Ν-dimetilformamida usando uma base como carbonato de potássio para dar os compostos desta invenção representados pela fórmula 86. Quando Q’ é alcóxi, o grupo éster pode ser hidrolisado em um ácido usando uma base como hidróxido de sódio em metanol. De um modo similar, usando intermediários 89 e 90, os compostos desta invenção representados pelas fórmulas 87 e 88 podem ser preparados, respectivamente.
FLUXOGRAMA 13
l5
Rs
Q'^0
Rs J
Aplicando processos similares como descrito acima, 85b pode ser convertido em 86b-88b.
Os compostos desta invenção representados pela fónnula 93 podem ser preparados como mostrado no fluxograma 14, em que Rb G2, Ri,
R4, R5, X, Z e n são como definidos acima. A reação do reagente 91 com as 6amino-3-cianoquinolinas 92 é realizada usando um excesso de uma base orgânica como trietilamina e um solvente inerte como tetrahidrofurano para dar os compostos desta invenção representados pela fórmula 93.
FLUXOGRAMA 14
Os compostos desta invenção representados pela fórmula 96 podem ser preparados como mostrado no fluxograma 15, em que Rb Gb Rb R4, R5, R6, W, Het, X, Z, k e n são como definidos acima pela reação de
Mitsunobu de fenol 94 e um álcool 95 em um solvente inerte. Altemativamente, a reação de Mitsunobu pode ser aplicada ao composto 97 para dar 98. Este composto pode ser convertido em 96 como descrito acima no fluxograma 4. O heterociclo pode ser introduzido na posição 6 usando os compostos correspondentes onde Gi é hidróxi e G2 está localizado na posição
7.
FLUXOGRAMA 15
N=N 1· EtO2C CO2Et PPh3
2. Het-W-(C(R6)2)K-O-H 95
N=N 1' EtO2c' CO2Et PPh3
2. Het-W-(C(R6)2)k-O-H 95
H2N-(CH2)n-X (17)
OU
HS-(CH2)n-X (18), NaH, THF
OU
HO-(CH2)n-X (19), NaH, THF
Existem certas manipulações de grupos funcionais que são utilizáveis para preparar os compostos desta invenção que podem ser aplicadas a várias 3-cianoquinolinas intermediárias bem como aos compostos finais desta invenção. Estas manipulações referem-se aos substituintes Rb Gb G2 ou R4 que estão localizados nas 3-cianoquinolinas mostradas nos fluxogramas abaixo. Algumas destas manipulações de grupos funcionais são descritas abaixo:
Onde um ou mais de Rb Gb G2 ou R4 é um grupo nitro, ele pode ser convertido nos grupos amino correspondentes por redução usando um agente de redução como ferro em ácido acético ou por hidrogenação catalítica. Onde um ou mais de Rb Gb G2 ou R4 é um grupo amino, ele pode ser convertido no grupo dialquilamino correspondentes de 2 a 12 átomos de
carbono por alquilação com pelo menos dois equivalentes de um halogeneto de alquila de 1 a 6 átomos de carbono aquecendo em um solvente inerte ou por alquilação redutiva usando um aldeído de 1 a 6 átomos de carbono e um agente de redução como cianoboroidreto de sódio. Onde um ou mais de Rb Gb G2 ou R4 é um grupo metóxi, ele pode ser convertido no grupo hidróxi correspondente por reação com um agente desmetilante como tribrometo de boro em um solvente inerte ou aquecendo com cloreto de piridínio com ou sem solvente. Onde um ou mais de Rb Gb G2 ou R4 é um grupo amino, ele pode ser convertido no grupo alquilsulfonamido, alquenilsulfonamido ou alquinilsulfonamido correspondente de 2 a 6 átomos de carbono pela reação com um cloreto de alquilsulfonila, cloreto de alquenilsulfonila ou cloreto de alquinilsulfonila, respectivamente, em um solvente inerte, usando um catalisador básico como trietilamina ou piridina. Onde um ou mais de Rb Gb G2 ou R4 é um grupo amino, ele pode ser convertido no grupo alquilamino correspondente de 1 a 6 átomos de carbono por alquilação com um equivalente de um halogeneto de alquila de 1 a 6 átomos de carbono aquecendo em um solvente inerte ou por alquilação redutiva usando um aldeído de 1 a 6 átomos de carbono e um agente de redução como cianoboroidreto de sódio em um solvente aprótico como água ou álcool, ou misturas dos mesmos. Onde um ou mais de Rb Gb G2 ou R4 é hidróxi, ele pode ser convertido no grupo alcanoiloxi correspondente de 1 a 6 átomos de carbono por reação com um cloreto de ácido carboxílico apropriado, anidrido ou anidrido misturado em um solvente inerte, usando piridina ou uma trialquilamina como um catalisador. Onde um ou mais de Rb Gb G2 ou R4 é hidróxi, ele pode ser convertido no grupo alquenoiloxi correspondente de 1-6 átomos de carbono por reação com um cloreto de ácido carboxílico apropriado, anidrido ou anidrido misturado em um solvente inerte, usando piridina ou uma trialquilamina como um catalisador. Onde um ou mais de Rb Gb G2 ou R4 é hidróxi, ele pode ser convertido-no grupo alquinoiloxi correspondente de 1-6 átomos de carbono por reação com um cloreto de ácido carboxílico apropriado, anidrido ou anidrido misturado em um solvente inerte, usando piridina ou uma trialquilamina como um catalisador. Onde um ou mais de Rb Gb G2 ou R^ é carboxi ou um grupo carboalcoxi de 2-7 átomos de carbono, ele pode ser convertido no grupo hidroximetila correspondente por redução com um agente de redução apropriado como borato, boroidreto de litio ou alumínio hidreto de litio em um solvente inerte; o grupo hidroximetila, por sua vez, pode ser convertido no grupo halometila correspondente por reação em um solvente inerte com um reagente halogenante como tribrometo de fósforo para dar um grupo bromometila, ou pentacloreto de fósforo para dar um grupo clorometila. O grupo hidroximetila pode ser acilado com um cloreto de ácido apropriado, anidrido ou anidrido misturado em um solvente inerte usando piridina ou uma trialquilamina como um catalisador para dar os compostos desta invenção com o grupo alcanoiloximetila correspondente e 2-7 átomos de carbono, grupo alquenoiloximetila de 2-7 átomos de carbono, ou grupo alquinoiloximetila de
2-7 átomos de carbono. Onde um ou mais de Rb Gb G2 ou R4 é um grupo halometila, ele pode ser convertido em um grupo alcoximetila de 2-7 átomos de carbono substituindo o átomo de halogênio com um alcóxido de sódio em um solvente inerte. Onde um ou mais de Rb Gb G2 ou R4 é um grupo halometila, ele pode ser convertido em um grupo aminometila, grupo Nalquilaminometila de 2-7 átomos de carbono ou grupo N,Ndialquilaminometila de 3-14 átomos de carbono substituindo o átomo de halogênio com amônia, uma amina primária ou secundária, respectivamente, em um solvente inerte.
Além dos processos acima descritos, existe um número de pedidos de patente que descrevem processos que são utilizáveis para a preparação dos compostos desta invenção. Apesar destes processos descreverem a preparação de certas quinazolinas, eles também são aplicáveis na preparação de 3-cianoquinolinas correspondentemente substituídas. Os procedimentos químicos descritos no pedido WO-9633981 podem ser usados para preparar os intermediários 3-cianoquinolina usados nesta invenção, em que Ri, Gb G2 ou R4 são grupos alcoxialquilamino. Os procedimentos químicos descritos no pedido WO-9633980 podem ser usados para preparar os intermediários 3-cianoquinolina usados nesta invenção, em que Rb Gb G2 ou R4 são grupos aminoalquilalcoxi. Os procedimentos químicos descritos no pedido WO-9633979 podem ser usados para preparar os intermediários 3cianoquinolina usados nesta invenção, em que Rb Gb G2 ou R4 são grupos alcoxialquilamino. Os procedimentos químicos descritos no pedido WO9633978 podem ser usados para preparar os intermediários 3-cianoquinolina usados nesta invenção, em que Rb Gb G2 ou R4 são grupos aminoalquilamino. Os procedimentos químicos descritos no pedido WO0633977 podem ser usados para preparar os intermediários 3-cianoquinolina usados nesta invenção, em que Rb Gb G2 ou R4 são grupos aminoalquilalcoxi. Apesar dos pedidos de patente acima descreverem compostos onde o grupo funcional indicado foi introduzido na posição 6 de uma quinazolina, a mesma química pode ser usada para introduzir os mesmos grupos até posições ocupadas pelos substituintes Rb Gb G2 e R4 dos compostos desta invenção.
Compostos representativos desta invenção foram avaliados em vários procedimentos de testes farmacológicos padrão que mostraram que os compostos desta invenção possuem atividade significativa como inibidores de proteína tirosina quinase e são agentes antiproliferativos. Com base na atividade mostrada nos procedimentos de testes farmacológicos padrão, os compostos desta invenção são, consequentemente, utilizáveis como agentes antineoplásticos, Os procedimentos de teste usados e resultados obtidos são mostrados abaixo.
Inibição de quinase do receptor do fator de crescimento epidérmico (EGF-R) usando enzima recombinante
Compostos de teste representativos foram avaliados por sua capacidade de inibir a fosforilação do resíduo de tirosina de um substrato de peptídeo catalisado pela enzima quinase do receptor do fator de crescimento epidérmico. O substrato de peptídeo (RR-SRC) tem a sequência arg-arg-leuile-glu-asp-ala-glu-tyr-ala-ala-arg-gly. A enzima usada neste ensaio é o domínio citoplásmico marcado His de EGFR. Um baculovírus recombinante (vHcEGFR52) foi construído, contendo os aminoácidos 645-1186 codificando cDNA de EGFR precedidos por Met-Ala-(His)ô. Células Sf9 em placas de 100 mm foram infectadas em um meio de 10 pfu/ célula e as células foram coletadas 48 h após infecção. Um extrato citoplásmico foi preparado usando 1% de Triton X-100 e aplicado à coluna Ni-NTA. após lavar a coluna com imidazol 20 mM, HcEGFR foi eluído com imidazol 250 mM (em Na2HPO4 50 mM, pH 8,0, NaCl 300 mM). Frações coletadas foram dialisadas contra HEPES 10 mM, pH 7,0, NaCl 50 mM, 10% de glicerol, 1 pg/ ml de antipaína e lepipeptina e Pefabloc SC 0,1 mM. A proteína foi congelada em gelo seco / metanol e armazenada a-70°C.
Compostos de teste foram preparados em 10 mg/ ml de soluções de carga em 100% de sulfóxido de dimetila (DMSO). Antes da experiência, soluções de carga foram diluídas em 500 μΜ com 100% de DMSO e então diluídas em série na concentração desejada com tampão HEPES (HEPES 30 mM, pH 7,4).
Para a reação da enzima, 10 μΐ de cada inibidor (em várias concentrações) foram adicionados em cada reservatório de uma placa de 96 reservatórios. A isto foram adicionados 3 μΐ de enzima (diluição 1:10 em HEPES 10 mM, pH 7,4 para concentração final de 1: 120). Esta foi deixada assentar durante 10 min em gelo e seguido pela adição de 5 μΐ de peptídeo (concentração final 80 μΜ), 10 μΐ de 4X tampão (tabela A), 0,25 μΐ 33P-ATP e 12 μΐ de H2O. A reação foi deixada correr durante 90 min em temperatura
ambiente e seguida por coloração do volume total sobre papéis de filtro P81 pré-cortados. Os discos de filtro foram lavados 2X com 0,5% de ácido fosfórico e a radioatividade foi medida usando um contador de cintilação líquido.
| Reagente | Final | 100 Ciclos |
| HEPES 1 M (pH 7,4) | 12,5 mM | 50 μΐ |
| Na3VO4 | 50 μΜ | 20 μΐ |
| MnCl2 1 M | 10 mM | 40 μΐ |
| ATP 1 mM | 20 μΜ | 80 μΐ |
| 33p-atp | 2,5 μθΐ | 25 μΐ |
Os dados de inibição para compostos representativos da invenção são mostrados abaixo na tabela 1. O IC50 é a concentração do composto de teste necessário para reduzir a quantidade total de substrato fosforilado em 50%. A % de inibição do composto de teste foi determinada por pelo menos três concentrações diferentes e o valor IC50 foi avaliado da curva de resposta de dosagem. A % de inibição foi avaliada com a seguinte fórmula:
% de inibição = 100-[CPM (droga) / CPM (controle)] x 100 onde CPM (droga) está em unidades de contagens por minuto e é um número expressando a quantidade de ATP radiorrotulado (γ- P) incorporada no substrato de peptídeo RR-SRC pela enzima após 90 minutos em temperatura ambiente na presença do composto de teste, como medido por contagem de cintilação líquida. CPM (controle) está em unidades de contagens por minuto e foi um número expressando a quantidade de ATP radiorrotulado (y- ±) incorporado no substrato de peptídeo RR-SR.C pela enzima após 90 minutos em temperatura ambiente na ausência do composto de teste, como medido por contagem de cintilação líquida. Os valores CPM foram corrigidos para as contagens de fundo produzidas por ATP na ausência de reação enzimática. Onde foi possível determinar um valor IC5o, ele é registrado na tabela 1, de outra forma, a % de inibição em uma concentração de 0,5 μΜ de composto de teste é mostrada na tabela 1. Entradas múltiplas para o mesmo composto indicam que ele foi testado múltiplas vezes.
TABELA 1 Inibição de quinase EGF-R (Enzima recombinante)
Exemplo IC50 (uM) %Inh @ 0.5 uM
| 173 | 0.5 | |
| 172 | 0.09 | |
| 176 | 0.01 | |
| 96 | >10 | 6 |
| 97 | >10 | 7 |
| 101 | >1 | 27 |
| 111 | >] | 10 |
| 148 | >1 | 11 |
| 115 | >0.5 | 49 |
| 167 | >1 | 0 |
| 126 | .45 | |
| 168 | >1 | I |
| 127 | >1 | 25 |
| 144 | >1 . | 14 |
| 149 | >1 | 9 |
| 156 | >1 | 34 |
| 141 | >1 | 5.5 |
| 142 | >1 | 24 |
| 130 | >1 | 5 |
| 129 | >1 | 6.7 |
| 131 | >1 | 0 |
| 150 | .0015 | |
| 150 | 0.004 | |
| 151 | >1 | 34 |
| 152 | >1 | 24 |
| 132 | >1 | 0 |
| 133 | >1 | 0 |
| 134 | >1 | 35 |
| 135 | >1 | 0 |
| 153 | >1 | 14 |
| 136 | >1 | 33 |
| 137 | 0.15 |
Inibição de quinase de célula epitelial (ECK)
Neste procedimento de teste farmacológico padrão, um substrato de peptídeo biotinilado é primeiro imobilizado em placas de microtitulação revestidas com neutravidina. A droga de teste, a quinase de <27 célula epitelial (ECK), Mg*4-, vanadato de sódio (uma proteína do inibidor de fosfatase tirosina) e um tampão apropriado para manter pH (7,2) são então adicionados aos, reservatórios de microtitulação contendo substrato imobilizado. ATP então é adicionado para iniciar fosforilação. Após incubação, as placas de teste são lavadas com um tampão apropriado deixando peptídeo fosforilado que é exposto a anticorpo monoclonal antifosfotirosina conjugado com peroxidase de raiz forte (HRP). As placas tratadas com anticorpo são novamente lavadas e a atividade de HRP em reservatórios individuais é quantificada como uma reflexão do tipo de fosforilação de substrato. Este formato não radioativo foi usado para identificar inibidores da atividade de tirosina quinase ECK onde o IC5o é a concentração da droga que inibe fosforilação do substrato em 50%. Os resultados obtidos para os compostos representativos desta invenção são listados na tabela 2. Entradas múltiplas para um dado composto é indicação de que ele foi testado em tempos múltiplos.
Inibição do receptor contendo domínio de inserto de quinase (KDR: o domínio catalítico do receptor VEGF)
Neste procedimento de teste farmacológico padrão, proteína
KDR é misturada, na presença ou ausência de um composto inibidor, com um peptídeo substrato a ser fosforilado (um copolímero de ácido glutâmico e tirosina, E:Y :: 4:1) e outros cofatores como MG++ e vanadato de sódio (um inibidor de proteína tirosina fosfatase) em um tampão apropriado para manter pH (7,2). ATP e um traçador não radioativo (ATP rotulado tanto com 32Pcromo com 33P) são então adicionados para iniciar fosforilação. Após incubação, o fosfato radioativo associado com a fração insolúvel em ácido da mistura de teste é então quantificado como reflexão de fosforilação do substrato. Este formato radiativo foi usado para identificar inibidores da atividade de tirosina quinase KDR onde o IC50 é a concentração da droga que inibe fosforilação do substrato em 50%. Os resultados obtidos para
compostos representativos desta invenção são listados na tabela 2. Entradas múltiplas para um dado composto é indicação de que ele foi testado em tempos múltiplos.
Teste da quinase de proteína ativada com mitogênio (MAPK)
Para avaliar inibidores de quinase MAP (proteína ativada com mitogênio), um procedimento de teste farmacológico padrão copulado de dois componentes, que mede fosforilação de um resíduo de serina / treonina em uma sequência apropriada no substrato na presença e ausência de um inibidor putativo, foi usado. MWEK 1 (MAPKK) humano recombinante foi usado primeiro para ativar ERK2 (MAPK) humano recombinante e o MAPK (ERK) ativado foi incubado com substrato (peptídeo MBP ou peptídeo MYC) na presença de ATP, Mg e ATP radiorrotulado com P. O peptídeo fosforilado foi capturado em um filtro de fosfocelulose P 81 (filtro de papel ou embutido em placa de microtitulação) lavado e contado por processos de cintilação.
Os substratos de peptídeo usados neste teste são substrato de peptídeo MBP (APRTPGGRR), ou substrato Myc sintético (KKFELLPTPPLSPSRR*5 TF A. As enzimas recombinantes usadas foram preparadas como proteínas de fusão GST de ERK 2 humano e MEK 1 humano. Amostras de inibidores foram preparadas como 10X cargas em 10% de DMSO e uma alíquota apropriada foi usada para liberar tanto 10 pg/ ml para uma dosagem de triagem de ponto como concentração final de 100, 10, 1 e 0,1 pM para uma curva de resposta de dosagem. Concentrações de DMSO finais foram menos do que ou iguais a 1%.
A reação foi realizada como a seguir em tampão quinase Tris 50 mM, pH 7,4 em um volume de reação de 50 pl. O volume apropriado de tampão quinase e amostra de inibidor foi adicionado ao tubo. Diluição apropriada de enzima foi liberada para dar 2-5 pg de MAPK recombinante (Erk) por tubo. O inibidor foi incubado com MPK (Erk) durante 30 min em 0 grau C. Mek recombinante (MAPKK) (0,5-2,5 pg) ou Mek totalmente ativado (0,005-0,1 unidades) foi adicionado para ativar o Erk e incubado durante 30 min a 30°C. Então, substrato e ATP 33P gama foram adicionados para dar uma concentração final de MBPP 0,5-1 mM ou Myc 250-500 μΜ; 0,2-0,5 pCi ATP P 33 gama / tubo; concentração final de ATP 50 μΜ. Amostras foram incubadas a 30°C durante 30 minutos e a reação foi interrompida adicionando 25 μΐ de 10% de TCA resfriado com gelo. Após as amostras serem resfriadas em gelo durante 30 minutos, 20 μΐ de amostra foram transferidos em papel de filtro de fosfocelulose P 81 ou MTP apropriado com filtro P 81 embutido. Papéis de filtro ou MTP foram lavados 2 vezes com um volume grande de 1% de ácido acético, depois 2 vezes com água. Os filtros ou MTP foram brevemente secados com ar antes da adição de cintilante e as amostras foram contadas no contador de cintilação apropriado ajustado para leitura do ísótopo P. As amostras incluíam um controle positivo (enzima ativada mais substrato); nenhum controle de enzima; nenhum controle de substrato; amostras com concentrações diferentes de inibidor putativo; e amostras com inibidores de referência (outros compostos ativos ou inibidores não específicos como estaurosporina ou K252 B).
Os dados brutos foram capturados como cpm. Réplicas de amostras foram calculadas em média e corrigidas para contagem de fundo. Dados cpm médios foram tabulados por grupo e % de inibição por um composto de teste foi calculada como (controle de cpm corrigido-amostra/ controle de cpm corrigido) X 100 = % de inibição. Se várias concentrações de inibidor foram testadas, valores I50 (a concentração que dá 50% de inibição) foram determinados graficamente da curva de resposta de dosagem para % de inibição ou por um programa de computador apropriado. Os resultados obtidos para compostos representativos desta invenção são listados na tabela 2 onde podem haver entradas separadas para o mesmo composto; isto é uma indicação de que o composto foi avaliado mais do que uma vez.
TABELA 2
Inibição do receptor contendo domínio de inserto de quinase (KDR), quinase de célula epitelial (Eck) e quinase da proteína ativada com mitogênio (Mek-Erk)
Exemplo
KDR Eck Mek-Erk üM_uM_uM
| 96 | 8.0214 | > 53.476 | 0 | |
| < | 1 | |||
| 0.8 | ||||
| 97 | > 2.5610 | > 2.561 | 55 | |
| 98 | : 52.9872 | > 2.649 | 2.5 | |
| > 2.6494 | < | 1 | ||
| 0.4 | ||||
| < | 0.1 |
Tabela 2 cont.
KDR Eck Mek-Erk
Efeemplo mM uM bM
21.4247 < 1 < 1
0.08
0.05
0.08
0.3
0.07
0.08 < 1 0.2 0.3 < 1
0.2 < 1
0.2 0.15 0.25 0.25 0.15 0.8 < 1 < 1
0.2
0.2
0.3
0.4
1.1
0.4
0.25
0.4
0.05
0.299
0.04
0.1
0.1
0.2
0.4 < 0.001 0.06 0.06 0.09 < 0.001 0.09 0.4
100 > 72.2892 > 48.193 > 100
3.5 >100
Tabela 2 cont.
KDR Eck Mek-Erk uM_uM uM
Exemplo
| 101 | 5.3706 | > | 53.706 | < < | 0.8 1 0.001 0.001 |
| 102 | 14.1123 | > | 56.449 | 10 | |
| 0.5 | |||||
| 0.1 | |||||
| 1 1 | |||||
| 0.5 | |||||
| 103 | >53.419 | 1.5 | |||
| 0J | |||||
| < | 1 | ||||
| < | 0.001 | ||||
| 104 | > 74.5527 | > | 49.702 | 35 | |
| 105 | 76.6479 | > | 51.099 | ||
| 106 | 23.0734 | > | 46.147 | 1.1 | |
| 02 | |||||
| 107 | > 71.8735 | > | 47.916 | ||
| 108 | > 80.3428 | > | 2.678 | ||
| > 2.6781 | |||||
| 109 | 23.9006 | > | 47.801 | > | 100 |
| > | 100 | ||||
| 110 | > 77.4393 | 0.155 | > | 100 | |
| > 25.8131 | 0.036 | 50 | |||
| 111 | > 77.0416 | > | 51.361 | > | 100 |
| > | 100 | ||||
| 112 | > 71.1744 | > | 47.450 | > | 100 |
| 113 | 8.6630 | ||||
| 115 | 5.5648 | > | 27.824 | 25 | |
| > 2.7824 | > | 2.782 | |||
| 119 | 1.5504 | 22.148 | |||
| 2.2148 | > | 2.215 | |||
| 125 | 35 | ||||
| 126 | 8.3565 | > | 27.855 | > | 100 |
| > 2.7855 | > | 2.786 | |||
| > 2.Ί&55 | > | 2.786 | |||
| 127 | > '67.3428 | > | 44.895 | > | 100 |
| 128 | > 79.9148 | > | 53.277 | > | 100 |
| 100 | |||||
| 129 | > 25.8790 | > | 25.879 | > | 100 |
| 130 | > 26.5647 | > | 26.565 | > | 100 |
| 131 | > 26.4262 | > | 26.426 | > | 100 |
| 132 | > 28.0594 | > | 28.059 | 90 | |
| 133 | > 28.0594 | > | 28.059 | 90 | |
| 134 | > 28.0594 | > | 28.059 | > | 100 |
Tabela 2 cont
| Exemplo | KDR uM | Eck uM | Mek-Erk uM | |||
| 135 | 26.8538 | 0.537 | > | 100 | ||
| 136 | > | 29.0377 | 0.871 | 1.8 | ||
| > | 2.9038 | 3 | ||||
| 137 | 28.9553 | > | 2.896 | 1.1 | ||
| > | 2.8955 | 0 | ||||
| 138 | > | 86.8634 | > | 28.954 | > | 100 |
| > | 2.8954 | > | 2.895 | |||
| 139 | > | 21.8093 2.1809 | > | 2.181 | 15 | |
| 140 | 21.7623 | 2.176 | 22 | |||
| 2.1762 | 15 | |||||
| 141 | 63.4242 | > | 31.712 | 1.1 | ||
| 3 | ||||||
| 3 | ||||||
| 2 | ||||||
| 142 | 94.8392 | > | 31.613 | 30 | ||
| 143 | 47.5682 | > | 31.712 | 6 | ||
| > | 3.1712 | > | 3.171 | 6 | ||
| 2 | ||||||
| 144 | > | 94.8392 | > | 31.613 | > | 100 |
| 94.8392 | > | 100 | ||||
| 146 | 3 | |||||
| 147 | ||||||
| 148 | > | 95.1363 | > | 63.424 | > | 100 |
| 149 | > | 94.8392 | > | 31.613 | > | 100 |
| > | 100 | |||||
| 150 | 0.5808 | > | 29.038 | < | 1 | |
| 2 | ||||||
| 0.8 | ||||||
| 0.3 | ||||||
| 152 | 28.9550 | > | 28.955 | 20 | ||
| 152 | > | 0.0000 | > | 27.825 | > | 100 |
| 153 | > | 28.0594 | > | 28.059 | > | 100 |
| 154 | 12.8256 | 0.770 | 0.5 | |||
| > | 2.5651 | < | 0.1 | |||
| 155 | 4 | |||||
| 156 | > | 79.7071 | > | 26.569 | 35 | |
| 35 | ||||||
| 171 | < | 1 0.001 0.0025 | ||||
| < | 0.001 | |||||
| 166 | > | 2.5391 | 0.762 | |||
| 167 | 24.8472 | 0.025 | 8 | |||
| 2.4847 | > | 2.485 | ||||
| 168 | 4.4995 | > | 22.497 | < | 1 |
Inibição do crescimento de células de câncer como medido por número de células
Linhagens de células de tumor humanas foram depositadas em placas com 96 reservatórios (250 μΐ/ reservatório, 1-6 χ 104 células/ ml) em meio RPMI 1640, contendo 5% de FBS (soro de bovino fetal). Vinte e quatro horas após deposição em placa, compostos de teste foram adicionados em cinco concentrações log (0,01-100 mg/ ml) ou em concentrações mais baixas para os compostos mais potentes. Após 48 horas de exposição a compostos de testes, as células foram fixadas com ácido tricloroacético e coloridas com Sulforhodamina B. Após lavar com ácido tricloroacético, corante ligado foi solubilizado em base Tris 10 mM e densidade ótica foi determinada usando leitora de placa. Em condições de teste, a densidade ótica é proporcional ao número de células no reservatório. IC50S (concentrações causando 50% de inibição do crescimento de células) foi determinado de gráficos de inibição de crescimento. O procedimento de teste é descrito em detalhes por Philip Skehan et al., J. Natl. Canc. Inst. 82, 1107-1112 (1990). Estes dados são mostrados abaixo na tabela 3. Informação sobre algumas das linhagens de células usadas nestes procedimentos de teste está disponível de American Type Tissue Collection: Cell Lines and Hybridomas, 1994 Reference Guide, 8a edição.
TABELA 3
Inibição do crescimento de células de câncer como medido pelo número de células (IC50 pg/ ml)
| MDA-MB- | ||||||||
| Ex. ΛΛ | 435 | A431 | SK-BR3 | A2780 DDP | SW620 3T3 | 3T3/c-er&&2 | ||
| yy | 0.020 | 0.025 | 0.016 | 0.032 | 0.036 | 0.033 | ||
| 100 | 0.067 | 0369 | 0.429 | 0.270 | 0.249 | 0.325 | ||
| 101 | 0.073 | 0.216 | 0.18 | 0.231 | 0.313 | 0.326 | ||
| 101 | 0.365 | 0.123 | 0.0374 | 0.286 | 1.53 | 0.933 | ||
| 102 | 0.490 | 1.309 | 0.780 | 1.491 | 3.054 | 2.18 | ||
| 103 | 0.309 | 1.611 | 0.767 | 2.391 | 2.690 | 2.637 | ||
| 104 | 0.021 | 0.049 | 0.034 | 0.044 | 0.107 | 0.207 | ||
| 105 | 0.235 | 0.270 | 0.281 | 0.411 | 0.853 | 0.375 | ||
| 106 | 2.045 | 1.961 | >5 | >5 | >5 | >5 | ||
| 107 | >5 | >5 | >5 | >5 | >5 | >5 | ||
| <.108 | 0.352 | 0.342 | 0.294 | <.0005 | 0.525 | 0.0198 | ||
| 109 | >5 | >5 | >5 | 2.922 | >5 | 4.616 | ||
| Tio | 0.0280 | 0.0244 | 0.0281 | 0.0183 | 0.0923 | 0.0311 | ||
| llí | 3.404 | >5 | >5 | 1.565 | >5 | 3.301 | ||
| 112 | 0.0033 | 0.257 | 0.336 | 0.146 | 0.392 | 0.251 | ||
| 115 | 0.0359 | 0.0368 | 0.0220 | 0.0212 | 0.344 | 0.0267 | ||
| 126 | 2.626 | 0.786 | 2.094 | 4.313 | 3.219 | 4.801 | ||
| 127 | >5 | >5 | >5 | >5 | >5 | >5 |
Inibição in vivo do crescimento de carcinoma de cólon humano SW620
Os compostos representativos desta invenção (listados abaixo) foram avaliados em um procedimento de teste farmacológico padrão in vivo que mediu sua capacidade de inibir o crescimento de tumores epidermóides humanos. As células SW620 de carcinona de cólon humano (American Type Culture Collection, Rockville, Maryland, #CCL-227) foram cultivadas in vitro como descrito acima. Os camundongos do sexo feminino BALB/C nu/nu (Charles River, Wilmington, MA) foram usados neste procedimento de teste farmacológico padrão in vivo. Uma unidade de 7 x 106 células foi injetada SC em camundongos. Quando os tumores atingiram uma massa de entre 80 e 120 mg, os camundongos foram divididos de modo aleatório em grupos de óoS tratamento (dia zero). Os camundongos foram tratados IP uma vez por dia nos dias 1 a 2 após escalonamento com dosagens tanto de 30, 10, 3 ou 1 mg/ kg/ dosagem do composto a ser avaliado em 0,2% de Klucel. Animais de controle receberam veículo apenas. Massa de tumor foi determinada a cada 7 dias [(comprimento X largura)/ 2] durante 28 dias após escalonamento. Crescimento de tumor relativo (massa de tumor média no dia 7, 14, 21 e 28 dividida pela massa de tumor média no dia zero) é determinado para cada grupo de tratamento. Análise estatística (teste Student-t) de crescimento de tumor relativo log compara grupo tratado versus controle. Um valor p (p <
0,05) indica uma redução estatisticamente significante em crescimento de tumor relativo de grupo tratado comparado com o controle de veículo.
O composto do exemplo 99 foi avaliado para sua capacidade para inibir o crescimento de carcinoma de cólon humano in vivo usando o procedimento de teste farmacológico descrito acima. Os resultados obtidos são mostrados na tabela 4.
TABELA 4
Inibição in vivo do crescimento de carcinona de cólon humano SW620 (9791 CD-186) em camundongos pelo composto do exemplo 99. Crescimento de tumor relativo.
| a | b | c | d | b | c | d | b | c | d | e |
| Tratamento com Droga mg/kg/dose | Dia 7 | % T/C | (P) | Dia 14 | % T/C | (P) | Dia 21 | % T/C | (P) | S/T |
| Klucel (Placebo) | 4,10 | 11,59 | 11,23 | 13/15 | ||||||
| Exemplo 99 (30 IP) | 1,81 | 44 | <0,01 | 3,85 | 33 | <0,01 | 4,44 | 40 | 0,02 | 4/5 |
| Exemplo 99 (10 IP) | 3,69 | 90 | 0,37 | 7,88 | 68 | 0,18 | 9,75 | 87 | 0,36 | 5/5 |
| Exemplo 99 (3 IP) | 3,80 | 93 | 0,62 | 12,53 | 108 | 0,78 | 16,47 | 147 | 0,54 | 5/5 |
a) composto administrado nos dias 1 a 20 IP
b) Crescimento de tumor relativo = Massa de tumor média no dia 7, 14, 21,
Massa de tumor média no dia 0
c) % T/C = Crescimento de tumor relativo do grupo tratado Crescimento de tumor relativo do grupo de placebos X 100
d) Análise estatística (Teste T de Student) do crescimento de tumor relativo Log. Um valor p (p = 0,05) indica uma redução estatisticamente significante em crescimento de tumor relativo de grupo tratado, comparado com controle placebo.
e) S/T = no. sobreviventes/ no. tratados no dia + 21 pós escalonamento do tumor.
Como mostrado na tabela 4, o composto do exemplos 99 inibiu o crescimento de tumor; por exemplo a 30m g/kg (administrado i.p. durante dias 1-20), crescimento de tumor foi inibido em 56% no dia 7, 67% no dia 14 e 60% no dia 21.
Com base nos resultados obtidos para compostos representativos desta invenção, os compostos desta invenção são agentes antioneoplásticos que são utilizáveis no tratamento, inibição do crescimento de, ou erradicação de neoplasmas. Em particular, os compostos desta invenção são utilizáveis para tratar, inibir o crescimento de, ou erradicar neoplasmas que expressam EGFR como os da mama, rim, bexiga, boca, laringe, esôfago, estômago, cólon, ovário ou pulmão. Além disso, os compostos desta invenção são utilizáveis no tratamento, inibição do crescimento de, ou erradicar neoplasmas da mama que expressam a proteína 73 receptora produzida pelo oncogene erbB2 (Her2). Com base nos resultados obtidos, os compostos desta invenção também são utilizáveis no tratamento de doença de rim policístico.
Os compostos desta invenção podem ser formulados simples ou podem ser combinados com um ou mais veículos farmaceuticamente aceitáveis para administração. Por exemplo, solventes, diluentes e outros, e podem ser administrados oralmente em formas de comprimidos, cápsulas, pós dispersíveis, grânulos ou suspensões contendo, por exemplo, de cerca de 0,05 a 5% de agente de suspensão, xaropes contendo, por exemplo, de cerca de 10 a 50% de açúcar, e elixires contendo, por exemplo, de cerca de 20 a 50% de etanol, e outros, ou parenteralmente na forma de solução injetável estéril ou suspensão contendo de cerca de 0,05 a 5% de agente de suspensão em um meio isotônico. As preparações farmacêuticas podem conter, por exemplo, de cerca de 0,05 a cerca de 90% de ingrediente ativo em combinação com o veículo, mais comumente entre cerca de 5% e 60%, em peso.
A dosagem eficaz do ingrediente ativo empregado pode variar dependendo do composto particular empregado, do modo de administração e da gravidade da condição sendo tratada. No entanto, em geral, resultados satisfatórios são obtidos quando os compostos da invenção são administrados em uma dosagem diária de cerca de 0,5 a cerca de 1000 mg/ kg do peso do corpo, opcionalmente dada em dosagens divididas duas a quatro vezes ao dia, ou na forma de liberação sustentada. A dosagem diária total é projetada para ser de cerca de 1 a 1000 mg/ kg, preferivelmente de cerca de 2 a 500 mg. Formas de dosagens apropriadas para uso interno compreendem de cerca de 0,5 a 1000 mg do composto ativo em mistura íntima com um veículo farmaceuticamente aceitável líquido ou sólido. Este regime de dosagem pode ser ajustado para prover a resposta terapêutica ótima. Por exemplo, várias dosagens divididas podem ser administradas oralmente ou a dosagem pode ser reduzida proporcionalmente como indicado pelas exigências da situação bcA terapêutica.
Os compostos desta invenção podem ser administrados oralmente bem como por vias intravenosa, intramuscular ou subcutânea. Veículos sólidos incluem amido, lactose, fosfato dicálcio, celulose microcristalina, sacarose e caulim, enquanto veículos líquidos incluem água estéril, polietileno glicóis, tensoativos não iônicos e óleos comestíveis como óleos de milho, amendoim e gergelim, como são apropriados à natureza do ingrediente ativo e à forma particular de administração desejada. Adjuvantes comumente empregados na preparação de composições farmacêuticas podem ser vantajosamente incluídos, como agentes aromatizantes, agentes colorantes, agentes de conservação e antioxidantes, por exemplo, vitamina E, ácido ascórbico, BHT e BHA.
As composições farmacêuticas preferidas do ponto de vista de facilidade de preparação e administração são composições sólidas, particularmente comprimidos e cápsulas carregadas líquidas com carregadas duras. Prefere-se administração oral dos compostos.
Em alguns casos pode ser desejável administrar os compostos diretamente às vias aéreas na forma de um aerossol.
Os compostos desta invenção também podem ser administrados parenteralmente ou intraperitonealmente. Soluções ou suspensões destes compostos ativos como uma base livre ou sal farmaceuticamente aceitável podem ser preparadas em água misturada apropriadamente com um tensoativo como hidroxipropilcelulose. Dispersões também podem ser preparadas em glicerol, polietileno glicóis líquidos e misturas dos mesmos em óleos. Em condições normais de armazenagem e uso, estas preparações contêm um conservante para evitar o crescimento de microorganismos.
As formas farmacêuticas apropriadas para uso injetável incluem soluções aquosas estéreis ou dispersões e pós estéreis para a
5οΞ>
preparação extemporânea de soluções injetáveis estéreis ou dispersões. Em todos os casos, a forma deve ser estéril e deve ser fluida na extensão de que existe facilidade de aplicação com seringa. A mesma deve ser estável nas condições de fabricação e armazenagem e deve ser preservada contra a ação contaminante de microorganismos como bactérias e fungos. O veículo pode ser um solvente ou meio de dispersão contendo, por exemplo, água, etanol, poliol (por exemplo, glicerol, propileno glicol e polietileno glicol líquido), misturas apropriadas dos mesmos, e óleos vegetais.
Para o tratamento de câncer, os compostos desta invenção podem ser administrados em combinação com outras substâncias antitumor ou com terapia de radiação. Estas outras substâncias ou tratamentos de radiação podem ser dadas ao mesmo tempo ou em tempos diferentes como os compostos desta invenção. As terapias combinadas podem efetuar sinergia e resultar em eficácia melhorada. Por exemplo, os compostos desta invenção podem ser usados em combinação com inibidores mitóticos como taxol ou vinblastina, agentes de alquilação como cisplatina ou ciclofosamida, antimetabólitos como 5-fluorouracila ou hidroxiuréia, intercaladores de DNA como adriamicina ou bleomicina, inibidores de topoisomerase como etoposídeo ou camptotecina, agentes anti-angiogênicos como angiostatina, e anti-estrogênios como tamoxifen.
A preparação de exemplos representativos dos compostos desta invenção é descrita abaixo.
Exemplo 1 l,4-Dihidro-7-metóxi-4-oxo-quinolina-3-carbonitrila
Uma mistura de 30,2 g (245,2 mmoles) de 3-metóxi anilina e
41,5 g (245,2 mmoles) de (etoximetileno)-cianoacetato de etila foi aquecida na ausência de solvente a 140°C durante 30 minutos. Ao óleo resultante foram adicionados 1200 ml de Dowtherm. A solução foi refluxada com agitação sob nitrogênio durante 22 h. A mistura foi resfriada em temperatura ambiente e sólido coletado e lavado com hexanos. O sólido foi recristalizado de ácido acético para dar 17 g de l,4-dihidro-7-metoxi-4-oxo-quinolina-3carbonitrila: espectro de massa (eletropulverização, m/e): M+H = 200,9.
Exemplo 2
1,4-Dihidro-7-metoxi-6-nitro-4-oxo-quinolina-3 -carbonitrila
A uma suspensão de 10 g (49,6 mmoles) de l,4-dihidro-7metoxi-4-oxo-quinolina-3-carbonitrila em 160 ml de anidrido trifluoroacético foram adicionados 6 g (74,9 mmoles) de nitrato de amônio durante um período de 3 h. A mistura foi agitada por mais duas horas. Anidrido em excesso foi removido em pressão reduzida a 45°C. O resíduo foi agitado com 500 ml de água. O sólido foi coletado e lavado com água. O sólido foi dissolvido em 1000 ml de ácido acético em ebulição e a solução tratada com carvão descolorante. A mistura foi filtrada e concentrada em um volume de 300 ml. Resfriamento deu um sólido que foi coletado, dando 5,4 g de 1,4dihidro-7-metoxi-6-nitro-4-oxo-quinolina-3-carbonitrila como um sólido marrom: espectro de massa (eletropulverização, m/e): M+H = 246.
Exemplo 3
4-Cloro-7-metoxi-6-nitro-quinolina-3-carbonitrila Uma mistura de 5,3 g (21,6 mmoles) de l,4-dihidro-7-metoxi6-nitro-4-oxo-quinolina-3-carbonitrila e 9 g (43,2 mmoles) de pentacloreto de fósforo foi aquecida a 165°C durante 2 h. A mistura foi diluída com hexanos e o sólido coletado. O sólido foi dissolvido em 700 ml de acetato de etila e lavado com solução de hidróxido de sódio diluído fria. A solução foi secada sobre sulfato de magnésio e filtrada através de um chumaço de sílica gel, dando 5,2 g de 4-cloro-7-metoxi-6-nitro-quinolina-3-carbonitrila como um sólido castanho.
Exemplo 4
Ester etílico de ácido 2-ciano-3-(4-nitiOfenilamino) acrílico
4-Nitroanilina (60,0 g, 0,435 mol) e (etoximetileno)-
cianoacetato de etila (73,5 g, 0,435 mol) foram misturados em um frasco. A mistura foi aquecida a 100°C durante 0,5 h após a mesma ser fundida e resolidificada. Uma porção de 114 g do produto bruto foi recristalizada de dimetilformamida para dar 44,2 g de cristais amarelos; p.f. 227-228,5°C.
Exemplo 5 l,4-Dihidroquinolina-6-nitro-4-oxo-3-carbonitrila Uma suspensão de 25,0 g (95,8 mmoles) de éster etílico de ácido 2-ciano-3-(4-nitrofenilamino) acrílico em 1,0 1 de Dowtherm A foi aquecida a 260°C sob N2 durante 12,5 h. A reação resfriada foi despejada em
1,5 1 de hexano. O produto foi coletado, lavado com hexano e etanol quente e secado in vacuo. Foram obtidos 18,7 g de sólido marrom. Uma amostra analítica foi obtida por recristalização de dimetilformamida / etanol: espectro de massa (eletropulverização, m/e): M+H = 216.
Exemplo 6
4-Cloro-6-nitro-quinolina-3-carbonitrila Uma mistura de 31,3 g (0,147 mol) de 6-nitro-4-oxo-l,4dihidro-quinolina-3-carbonitrila e 160 ml de oxicloreto de fósforo foi refluxada durante 5,5 h. O oxicloreto de fósforo foi removido in vacuo e o resíduo despejado sobre gelo e neutralizado com bicarbonato de sódio. O produto foi coletado, lavado com água e secado in vacuo (50°C). Foram obtidos 33,5 g de sólido castanho; sólido: espectro de massa (eletropulverização, m/e): M+H = 234.
Exemplo 7
Éster etílico de ácido 2-ciano-3-(2-metil-4-nitrofenil) acrílico
Uma mistura de 2-metil-4-nitroanilina (38,0 g, 250 mmoles), (etoximetileno)-cianoacetato de etila (50,8 g, 300 mmoles) e 200 ml de tolueno foi refluxada durante 24 h, resfriada, diluída com éter-hexano 1:1 e filtrada. O sólido branco resultante foi lavado com hexano-éter e secado para dar 63,9 g, p.f. 180-210°C.
Exemplo 8
1,4-Dihidroquinolina-8-metil-6-nitro-3 -carbonitrila Uma mistura agitada de 64 g (230 mmoles) de éster etílico de ácido 2-ciano-3-(2-metil-4-nitrofenil) acrílico e 1,5 1 de Dowtherm A foi aquecida a 260°C durante 12 h, resfriada, diluída com hexano e filtrada. O sólido cinza assim obtido foi lavado com hexano e secado para dar 51,5 g, p.f. 295-305°C.
Exemplo 9
4-Cloro-8-metil-6-nitro-quinolina-3-carbonitrila
Uma mistura agitada de l,4-dihidroquinolina-8-metil-6-nitro3-carbonitrila (47 g, 200 mmoles) e 200 ml de oxicloreto de fósforo foi refluxada durante 4 h. O oxicloreto de fósforo foi removido in vacuo e o resíduo agitado com cloreto de metileno a 0°C e tratado com uma suspensão de gelo e carbonato de sódio. A camada orgânica foi separada e lavada com água. A solução foi secada e concentrada em um volume de 700 ml. O produto foi precipitado pela adição de hexano e resfriamento a 0°C. O sólido branco foi filtrado e secado para dar 41,6 g, p.f. 210-212°C.
Exemplo 10
7-Etoxi-4-hidroxi-quinolina-3-carbonitrila Uma mistura de 10 g (73 mmoles) de 3-etóxi anilina e 12,3 g (73 mmoles) de (etoximetileno) cianoacetato de etila foi aquecida em 90 ml de Dowther a 140°C durante 7 h. A esta mistura foram adicionados 250 ml de Dowther. A solução foi agitada e refluxada sob nitrogênio durante 12 h com destilação periódica de etanol eliminado. A mistura foi resfriada em temperatura ambiente e o sólido coletado e lavado com hexano. O sólido bruto foi tratado com etanol em ebulição e então filtrado para dar 9,86 g de sólido marrom: espectro de massa (eletropulverização, m/e): M+H 214,7.
Exemplo 11
7-Etoxi-4-hidroxi-6-nitro-quinolina-3-carbonitrila
A uma suspensão de 5 g (23 mmoles) de 7-etoxi-4-hidroxiquinolina-3-carbonitrila em 75 ml de anidrido trifluoroacético foram adicionados 5,5 g (69 mmoles) de nitrato de amônio durante um período de 6 h em temperatura ambiente. Anidrido em excesso foi removido em pressão reduzida a 45°C. O resíduo foi agitado com 300 ml de água. O sólido foi coletado e tratado com etanol em ebulição para dar 3,68 g de sólido castanho: espectro de massa (eletropulverízação, m/e): M+H 259,8.
Exemplo 12
4-Cloro-7-etoxi-6-nitro-quinolina-3 -carbonitrila
Uma mistura de 3,45 g (13 mmoles) de 7-etoxi-4-hidroxi-6nitro-quinolina-3-carbonitrila, 5,55 g (26 mmoles) de pentacloreto de fósforo e 10 ml de oxicloreto de fósforo foi refluxada em 3 h. A mistura foi diluída com hexano e o sólido coletado. O sólido foi dissolvido em 500 ml de acetato de etila e lavado com solução de hidróxido de sódio diluído fria. A solução foi secada sobre sulfato de magnésio e filtrada através de um chumaço de sílica gel. O solvente foi removido, dando 2,1 g de sólido bege: espectro de massa (eletropulverízação, m/e): M+H 277,7.
Exemplo 13
8-Metoxi-4-hidroxi-6-nitro-quinolina-3-carbonitrila
Uma mistura de 12,6 g (75 mmoles) de 2-metoxi-4-nitro anilina e 12,7 g (75 mmoles) de (etoximetileno) cianoacetato de etila foi aquecida em 100 ml de Dowther a 120°C durante a noite e 180°C durante 20 h. A esta mistura foram adicionados 300 ml de Dowther. A solução foi agitada e refluxada sob nitrogênio durante 12 h com destilação periódica de etanol eliminado. A mistura foi resfriada em temperatura ambiente e o sólido coletado e lavado com hexano. O sólido bruto foi tratado com etanol em ebulição e depois filtrado para dar 12 g de sólido marrom: espectro de massa (eletropulverízação, m/e): M+H 245,8.
Exemplo 14 t-fo
4-Cloro-8-metoxi-6-nitro-quinolina-3-carbonitrila
Uma mistura de 4 g (16 mmoles) de 8-metoxi-4-hidroxi-6nitro-quinolina-3-carbonitrila, 6,66 g (32 mmoles) de pentacloreto de fósforo e 15 ml de oxicloreto de fósforo foi refluxada durante 2,5 h. A mistura foi diluída com hexano e o sólido coletado. O sólido foi dissolvido em 500 ml de acetato de etila e lavado com solução de hidróxido de sódio diluído fria. A solução foi secada sobre sulfato de magnésio e filtrada através de um chumaço de sílica gel. O solvente foi removido, dando 2,05 g de sólido castanho: espectro de massa (eletropulverização, m/e): M+H 263,7.
Exemplo 15 r
Acido 4-cloro-but-2-ianóico
Cloreto de propargila (2 ml, 26,84 mmoles) foi dissolvido em 40 ml de tetrahidrofurano sob nitrogênio e resfriado a-78°C. Após adição de n-butil lítio (5,4 ml, 13,42 mmoles, 2,5 M em n-hexano) e agitado durante 15 min, uma corrente de dióxido de carbono seco foi passada através do mesmo a-78°C durante duas horas. A solução da reação foi filtrada e neutralizada com 3,5 ml de ácido sulfúrico a 10%. Após evaporação da solução, o resíduo foi extraído com éter. A solução de éter foi lavada com solução de salmoura saturada e secada sobre sulfato de sódio. Após evaporação da solução de éter seca, 0,957 g (60%) de um produto de óleo foi obtido: ESMS m/z 116,6 (ΜΗ).
Exemplo 16 r
Acido 4-dimetilamino-but-2-enóico n-Butil lítio em hexano (96 ml, 2,5 em n-hexano) foi adicionado lentamente a l-dimetilamino-2-propina (20 g, 240 mmoles) em 100 ml de tetrahidrofurano sob nitrogênio. A mistura foi agitada durante 1 h a-78°C, então dióxido de carbono seco foi passado através durante a noite. A solução resultante foi despejada em água e lavada com acetato de etila. A camada aquosa foi evaporada sob pressão reduzida para dar o ácido bruto. O ácido seco foi dissolvido em metanol e o sal insolúvel foi removido via filtragem. O filtrado foi coletado e secado in vacuo para dar 15,6 g de ácido 4-dimetilamino-but-2-inóico: espectro de massa (m/e): M-H 126.
Exemplo 17
Bis-(2-metóxi-etil)-prop-2-inil-amina
Brometo de propargila (17,8 g, 150 mmoles) foi adicionado em gotas a uma mistura de bis (2-metoxi-etil) amina (20 g, 150 mmoles) e carbonato de césio (49 g, 150 mmoles) em 350 ml de acetona. A mistura foi agitada durante a noite sob nitrogênio em temperatura ambiente. Os sais inorgânicos foram então filtrados e o solvente foi removido. O resíduo foi dissolvido em solução de bicarbonato de sódio saturada e extraído com acetato de etila. Os extratos orgânicos forma então evaporados para dar 20 g de bis-(2-metoxi-etil)-prop-2-inil-amina: espectro de massa (m/e): M+H 172.
Exemplo 18
Ácido 4-rBis-(2-metoxi-etil)-aminol-but-2-inóico n-Butil lítio em hexano (42 ml, 2,5M em n-hexano) foi adicionado lentamente a bis-(2-metoxi-etil)-prop-2-inil-amina (18 g, 105 mmoles) em 80 ml de tetrahidrofurano sob nitrogênio. A mistura foi agitada durante 1 h a-78°C, depois dióxido de carbono seco foi passada através durante a noite. A solução resultante foi despejada em água e lavada com acetato de etila. A camada aquosa foi evaporada sob pressão reduzida para dar o ácido bruto. O ácido seco foi dissolvido em metanol e o sal insolúvel removido via filtragem. O filtrado foi coletado e secado in vacuo para dar 18 g de ácido 4-[bis-(2-metoxi-etil)-amino]-but-2-inóico: espectro de massa (m/e): M+H 214.
Exemplo 19 l-metil-4-prop-2-inil-piperadina Brometo de propargila (23,8 g, 200 mmoles) foi adicionado em gotas a uma mistura de 1-metil-piperazina (20 g, 200 mmoles) e
carbonato de césio (65 g, 200 moles) em 350 ml de acetona. A mistura foi agitada durante a noite sob nitrogênio em temperatura ambiente. Os sais inorgânicos foram então filtrados e o solvente foi removido. O resíduo foi dissolvido em solução de bicarbonato de sódio saturada e extraído com acetato de etila. Os extratos orgânicos foram então evaporados para dar 7,5 g de l-metil-4-prop-2-inil-piperazina: espectro de massa (m/e): M+H 139.
Exemplo 20
Ácido 4-(40 Metil-piperazin-l-il)-but-2-inóico n-Butil lítio em hexano (17,2 ml, 2,5M em n-hexano) foi adicionado lentamente a l-metil-4-prop-2-inil-piperazina (6,0 g, 43,5 mmoles) em 40 ml de tetrahidrofurano sob nitrogênio. A mistura foi agitada durante 1 h a-78°C, então dióxido de carbono seco foi passado através durante a noite. A solução resultante foi despejada em água e lavada com acetato de etila. A camada aquosa foi evaporada sob pressão reduzida para dar o ácido bruto. O ácido seco foi dissolvido em metanol e o sal insolúvel removido via filtragem. O filtrado foi coletado e secado in vacuo para dar 7 g de ácido 4-(4-metil-piperazin-l-il)-but-2-inóico: espectro de massa (m/e): ΜΗ 181.
Exemplo 21 (2-Metoxi-etil)-metil-prop-2-inil-amina Brometo de propargila (26,8 g, 225 mmoles) foi adicionado em gotas a uma mistura de N-(2-metoxietil) metil amina (20 g, 225 mmoles) e carbonato de césio (73 g, 225 mmoles) em 350 ml de acetona. A mistura foi agitada durante a noite sob nitrogênio em temperatura ambiente. Os sais inorgânicos foram filtrados, e o solvente foi removido. O resíduo foi dissolvido em solução de bicarbonato de sódio saturada e extraído com acetato de etila. Os extratos orgânicos então foram evaporados para dar 14 g de (2-metoxi-etil)-metil-prop-2-inil-amina: espectro de massa (m/e): M+H 127.
Exemplo 22
Ácido 4-rf2-Metoxi-etil)-metil-ammol-but-2-inóico n-Butil lítio em hexano (37,8 ml, 2,5 M em n-hexano) foi adicionado lentamente a (2-metoxi-etil)-metil-prop-2-inil-amina (12,0 g, 94,5 mmoles) em 90 ml de tetrahidrofurano sob nitrogênio. A mistura foi agitada durante 1 h a-78°C, depois dióxido de carbono seco foi passado através durante a noite. A solução resultante foi despejada em água e lavada com acetato de etila. A camada aquosa foi evaporada sob pressão reduzida para dar o ácido bruto. O ácido seco foi dissolvido em metanol e o sal insolúvel removido via filtragem. O filtrado foi coletado e secado in vacuo para dar 15 g de ácido 4-[(2-metoxi-etil)-metil-amino]-but-2-inóico: espectro de massa (m/e): M-H 170.
Exemplo 23
Alil-metil-prop-2-inil-amina
Brometo de propargila (33,4 g, 281 mmoles) foi adicionado em gotas a uma mistura de isopropil-metil-amina (20 g, 281 mmoles) e carbonato de césio (90 g, 281 mmoles) em 350 ml de acetona. A mistura foi agitada durante a noite sob nitrogênio em temperatura ambiente. Os sais inorgânicos foram então filtrados, e o solvente foi removido. O resíduo foi dissolvido em solução de bicarbonato de sódio saturada e extraído com acetato de etila. Os extratos orgânicos foram então evaporados para dar 4,6 g de alil-metil-prop-2-inil-amina: espectro de massa (m/e): M+H 110.
Exemplo 24 r
Acido 4-(Alil-metil-amino)-but-2-inóico n-Butil lítio em hexano (16,4 ml, 2,5 M em n-hexano) foi adicionado lentamente a alil-metil-prop-2-inil-amina (4,5 g, 46 mmoles) em 50 ml de tetrahidrofurano sob nitrogênio. A mistura foi agitada durante 1 h a78°C, depois dióxido de carbono seco foi passado através durante a noite. A solução resultante foi despejada em água e lavada com acetato de etila. A ló camada aquosa foi evaporada sob pressão reduzida para dar o ácido bruto. O ácido seco foi dissolvido em metanol e o sal insolúvel removido via filtragem. O filtrado foi coletado e secado in vacuo para dar 4,1 g de ácido 4(alil-metil-amino)-but-2-inóico: espectro de massa (m/e): M-H 152.
Exemplo 25 r
Acido 4-Metoximetoxi-but-2-inóico
A uma suspensão de 8,2 g de hidreto de sódio a 60% em óleo mineral em 271 ml de tetrahidrofurano a 0°C com agitação sob nitrogênio foram adicionados em gotas 10 g de álcool propargílico durante 15 min. A mistura foi agitada por mais 30 min. À mistura agitada a 0°C foram adicionados 15,8 g de éter clorometilmetílico. Agitação continuou em temperatura ambiente durante a noite. A mistura foi filtrada e o solvente foi removido do filtrado. O resíduo foi destilado (35-38°C, 4 mm) dando 8,5 g de um líquido. O destilado foi dissolvido em 200 ml de éter. A solução foi agitada sob nitrogênio e resfriada a-78°C quando 34,1 ml de n-butil lítio 2,5 molar em hexanos foram adicionados durante 15 min. Agitação continuou por mais 1,5 h. Dióxido de carbono seco foi deixado passar sobre a superfície da mistura de reação em agitação quando aqueceu de-78°C para temperatura ambiente. A mistura foi agitada sob uma atmosfera de dióxido de carbono durante a noite. A mistura foi despejada em uma mistura de 14 ml de ácido hidroclórico e 24 ml de água. A camada orgânica foi separada e secada sobre sulfato de magnésio. O solvente foi removido e o resíduo mantido a 100°C em 4 mm durante 1 h, dando 10,4 g de ácido 4-metoximetoxi-but-2-inóico.
Exemplo 26
Acido 4-Bromo crotônico
Após o processo de Braum [Giza Braun, J. Am. Chem. Soc.
52, 3167 (1930)], 11,76 ml (17,9 g, 0,1 mol) de 4-bromo crotonato de metila em 32 ml de etanol e 93 ml de água foram resfriados a-ll°C. A reação foi vigorosamente agitada e 15,77 g (0,05 mol) de hidróxido de bário finamente em pó foram adicionados em porções durante um período de cerca de uma hora. Resfriamento e agitação vigorosa continuaram durante cerca de 16 h. A mistura de reação foi então extraída com 100 ml de éter. A camada aquosa foi tratada com 2,67 ml (4,91 g; 0,05 mol) de ácido sulfurico concentrado. A mistura resultante foi extraída com porções de éter de 3-100 ml. Os extratos etéreos combinados foram lavados com 50 ml de salmoura, depois secados sobre sulfato de sódio. A solução foi tomada em um óleo in vacuo. Este óleo foi absorvido em cerca de 400 ml de heptano em ebulição, dando um goma. A solução de heptano foi separada e fervida a cerca de 50 ml. Resfriamento deu 3,46 g de produto.
Exemplo 27 r
Acido 4-(2-metoxi-etóxi)-but-2-inóico A uma suspensão de 6,04 g (151 mmoles) de hidreto de sódio a 60%, em 200 ml de tetrahidrofurano a 0°C, foram adicionados 10g(131,4 mmoles) de 2-metoxietanol em gotas durante 15 min. Após 1 h, 19,54 g (131,4 mmoles) de brometo de propargila a 80% foram adicionados em gotas. Após agitar 17 h em temperatura ambiente, a mistura foi filtrada e o solvente foi removido. O resíduo foi destilado (48-51°C, 4 mm) para dar 11,4 g de um líquido incolor. Este foi dissolvido em 250 ml de éter e resfriado a-78°C com agitação sob nitrogênio. A esta solução foram adicionados 39,95 ml (99,9 mmoles) de solução de n-butil lítio 2,5 M em hexanos, em gotas, durante 15 min. Após 1,5 h, dióxido de carbono seco foi borbulhado quando a mistura aqueceu lentamente em temperatura ambiente. A mistura foi mantida em uma atmosfera de dióxido de carbono durante a noite. À mistura foram adicionados 100 ml de ácido hidroclórico 3N e cloreto de sódio sólido. A camada orgânica foi separada e secada sobre sulfato de magnésio. O solvente foi removido e o resíduo mantido sob vácuo, dando 11,4 g do composto titular: espectro de massa (eletropulverização, m/e, modo negativo): M-H
156,8.
Exemplo 28 r e
Acido 4-(metoximetóxi)-but-2-inóico
A uma suspensão de 8,2 g (205 mmoles) de hidreto de sódio a
60% em 271 ml de tetrahidrofurano foram adicionados em gotas a 0°C, com agitação, 10,0 g (178,4 mmoles) de álcool propargílico. Após 30 min, 15,8 g (196,2 mmoles) de éter clorometilmetílico foram adicionados. Após agitar durante o final de semana em temperatura ambiente, a mistura foi filtrada e o solvente foi removido. O resíduo foi destilado (35-38°C, 4 mm) para dar 8,54 g de um líquido incolor. Este foi dissolvido em 200 ml de éter e resfriado a78°C com agitação sob nitrogênio. A esta solução foram adicionados 34,1 ml (85,3 mmoles) de solução de n-butil lítio 2,5M em hexanos em gotas durante 15 min. Após 1,5 h, dióxido de carbono seco foi borbulhado quando a mistura aqueceu lentamente em temperatura ambiente. A mistura foi mantida em uma atmosfera de dióxido de carbono durante a noite. A mistura foram adicionados 14 ml de ácido hidroclórico em 24 ml de água. A camada orgânica foi separada e secada sobre sulfato de magnésio. O solvente foi removido e o resíduo mantido sob vácuo, dando 10,4 g do composto titular como um líquido.
Exemplo 29
Ácido 4-((2S)-2-Metoximetilpirrolidin-l-il) butinóico
Solução de n-butil lítio em hexano (35,9 mmoles) foi adicionada durante 10 min a uma solução de 5,49 g (35,9 mmoles) de (2S)-2metoxifenil-l-prop-2-inilpirrolidina em 100 ml de THF a-78°C sob N2. Após agitar a frio durante 1 h, CO2 foi borbulhado na solução quando a mesma chegou lentamente a 25°C. Após agitar durante a noite, 100 ml de água foi adicionado, a reação foi extraída com acetato de etila e os extratos foram descartados. A reação foi ajustada em pH 7 com 20% de H2SC>4 e o solvente foi removido. O resíduo foi colocado em suspensão com metanol e filtrado. O filtrado foi evaporado e secado in vacuo para dar 7,06 g de ácido 4-((2S)-287 metoximetilpiiTolidin-l-il) butinóico como uma espuma marrom: espectro de massa (eletropulverização, m/e): M+H 198,0.
Exemplo 30 í2S)-2-Metoximetil-1 -prop-2-inilpirrolidina Uma mistura de 4,82 g (41,9 mmoles) de S-2-(metoximetil) pirrolidina, 13,7 g (41,9 mmoles) de carbonato de césio e 5,00 g (41,9 mmoles) de brometo de propargila em 80 ml de acetona foi agitada a 25°C durante a noite. A reação foi filtrada e solvente foi removido do filtrado. O resíduo foi diluído com uma pequena quantidade de água e NaHCO3 saturado e extraído com éter. O extrato foi tratado com Darco, secado e evaporado para dar 5,93 g de (2S)-2-metoximetil-l-prop-2-inilpirrolidina como um óleo amarelo laranja: espectro de massa (eletropulverização, m/e): 153,8.
Exemplo 31
Ácido 4-(l,4-Dioxa-8-azaspiro Γ4,51 dec-8-il) but-2-inóico n-Butil lítio em hexano (55,8 mmoles) foi adicionado em gotas a uma solução de 10,1 g (55,8 mmoles) de 3-(l,4-dioxa-8-azaspiro [4,5] dec-8-il) but-2-ina em 185 ml de THF a-78°C sob N2. Após agitar a-78°C durante 1 h, CO2 foi borbulhado na solução quando chegou lentamente a 25°C. Após agitar durante a noite, a reação foi diluída com 150 ml de água, extraída com acetato de etila e os extratos descartados. A solução foi ajustada em pH 6 com ácido sulfurico 2 M e evaporada. O resíduo foi colocado em suspensão com metanol e filtrado. O filtrado foi evaporado e secado in vacuo para dar 4,5 g de ácido 4-(l,4-dioxa-8-azaspiro [4,5] dec-8-il) but-2-inóico como um sólido amorfo marrom: espectro de massa (eletropulverização, m/e): M+H 225,8.
Exemplo 32
3-(l,4-Dioxa-8-azaspiro [4,51 dec-8-il) but-2-ina
Uma mistura de 10,0 g (69,9 mmoles) de l,4-dioxa-8-azaspiro [4,5] decano, 22,8 g (69,9 mmoles) de carbonato de césio e 8,32 g (69,9 mmoles) de brometo de propargila em 165 ml de acetona foi agitada durante a noite a 25°C. A reação foi filtrada e o filtrado evaporado até secura. Uma pequena quantidade de água de NaHCO3 saturado foi adicionada ao resíduo e o mesmo foi extraído com éter. Os extratos etéreos foram tratados com Darco, secados e evaporados para dar 10,8 g de 3-(l,4-dioxa-8-azaspiro [4,5] dec-8-il) but-2-ina como um óleo amarelo laranja: espectro de massa (eletropulverização, m/e): M+H 181,8.
Exemplo 33
4-Benziloxi-2-(dimetilaminometilenoamino)-5-metoxibenzoato de metila
Uma mistura agitada de 70,0 g (244 mmoles) de 2-amino-4benziloxi-5-metoxibenzoato de metila (Phytochemistry 1976, 15, 1095) e 52 ml de dimetil acetal dimetilformamida foi aquecida a 100°C durante 1,5 h, resfriada e evaporada diretamente sob alto vácuo para dar 81,3 g de sólido branco indefinido, p.f. 134-140°C; RMN (CDC13) d 3,01 (s, Me2N).
Exemplo 34
7-Benziloxi-4-hidroxi-6-metoxi-quinolina-3-carbonitrila
A uma solução agitada de 26,9 ml de n-butii lítio (2,5 M em hexano) em 50 ml de THF a-78°C foram adicionados 3,51 ml de acetonitrila em 20 ml de THF durante 10 min. Após agitar a-78°C durante 30 min, a mistura foi tratada com 10 g de 4-benziloxi-2-(dimetilaminometilenoamino)5- metoxibenzoato de metila em 20 ml de THF durante 5 min. Após 15 min a78°C, a mistura agitada foi aquecida a 0°C durante mais 30 min. A mesma então foi tratada com 5 ml de ácido acético, aquecida a 25°C e agitada durante 30 min. A mistura foi evaporada até secura e diluída com bicarbonato de sódio aquoso. O sólido branco indefinido resultante foi fdtrado, lavado com água, acetato de etila e éter. Após secar, 4,5 g de 7-benziloxi-4-hidroxi6- metoxi-quinolina-3-carbonitrila foram obtidos como um sólido branco indefinido, dec > 255°C; espectro de massa (eletropulverização, m/e): M+H 307.
Exemplo 35
7-benziloxi-4-cloro-6-metoxi-quinolina-3-carbonitrila
A uma suspensão agitada de 1 g de 7-benziloxi-4-hidroxi-6metoxi-quinolina-3-carbonitrila em 10 ml de cloreto de metileno foram adicionados 5 ml de cloreto de oxalina (2M em cloreto de metileno) e 2 gotas de Ν,Ν-dimetilformamida. A mistura foi refluxada durante 20 min e à mesma foi adicionado lentamente bicarbonato de sódio aquoso até o borbulhamento cessar. Após separação das camadas, a camada orgânica foi evaporada em um pequeno volume, depois passada através de uma tampa de magnesol. Eluição com 50 ml de cloreto de metileno, seguido por evaporação deu 0,6 g de 7benziloxi-4-cloro-6-metoxi-quinolina-3-carbonitrila como um sólido amarelo pálido, p.f. 282-284°C; espectro de massa (eletropulverização, m/e): M+E[ 325.
Exemplo 36
4-Cloro-7-hidroxi-6-metoxi-quinolina-3 -carbonitrila Uma suspensão agitada de 0,54 g de 7-benziloxi-4-cloro-6metoxi-quinolina-3-carbonitrila em 10 ml de cloreto de metileno foi resfriada a 0°C. A esta foram adicionados 10 ml de tricloreto de boro (1M em cloreto de metileno). A mistura escureceu quando aquecida em temperatura ambiente e um sólido precipitou. Após agitar durante 1 h, nenhuma outra reação foi observada. O sólido (material de partida não reagido) foi filtrado, a solução restante foi resfriada a 0°C e resfriada bruscamente pela adição em gotas de metanol. Após evaporação do solvente, o resíduo foi dissolvido em cloreto de metileno / metanol / acetona. Purificação do resíduo foi realizada usando cromatografia em sílica gel, eluindo com um gradiente solvente de 1 a 5 por cento de metanol / cloreto de metileno, para dar 0,075 g de 4-cloro-7-hidroxi6-metoxi-quinolina-3-carbonitrila como um sólido amarelo, dec > 245°C; espectro de massa (eletropulverização, m/e): M+H 35,2.
Exemplo 37 £2©
4-cloro-6-metoxi-7-(3-piridin-4-il-propoxi)-quinolina-3-carbonitrila
Uma mistura de 0,070 g de 4-cloro-7-hidroxi-6-metoxiquinolina-3-carbonitrila, 0,062 g de 3-(4-piridil)-l-propanol e 0,235 g de trifenilfosfina em 3 ml de cloreto de metileno sob nitrogênio foi resfriada a 0 °C. A isto foi adicionado 0,14 ml de azodicarboxilato de dietila em gotas. Após 30 min, a mistura de reação foi aquecida em temperatura ambiente e ainda agitada durante 2 horas. A mistura foi concentrada a 1 ml e purificada por cromatografia em sílica gel, eluindo com um gradiente de solvente a 1 a 2 por cento de metanol/ cloreto de metileno , para prover 0,090 g de 4-cloro-6metoxi-7-(3-piridin-4-il-propoxi)-quinolina-3-carbonitrila como uma goma de branco indefinido.
Exemplo 38
4-Cloro-7-metoxi-quinolina-3-carbonitrila
Uma mistura de 4,0 g (20 mmol) de 1,4-dihidro-7-metoxi-4oxo-quinolina-3-carbonitrila e 8,3 g (40 mmol) de pentacloreto de fósforo foi aquecida a 165°C durante 3 horas. A mistura foi diluída com hexanos e o sólido foi coletado. O sólido foi misturado com salmoura e uma solução de hidróxido de sódio diluído e extraído várias vezes com uma mistura de tetrahidrofurano e acetato de etila. A solução foi secada sobre sulfato de magnésio e filtrada em um chumaço de sílica gel dando 3,7 g de 4-cloro-7metoxi-quinolina-3-carbonitrila como um sólido branco : espectro de massa (eletropulverização, m/e): M+H 218,9.
Exemplo 39
3-Carbetoxi-4-hidroxi-6,7-dimetoxiquinolina
Uma mistura de 30,6 e de 4-aminoveratrol e 43,2 g de etoximetilenomalonato de dietila foi aquecida a 100 durante 2 horas e a 165°C durante 0,75 horas. O intermediário assim obtido foi dissolvido em 600 ml de éter difenílico, e a solução resultante foi aquecida em temperatura de refluxo durante 2 horas, resfriada, e diluída com hexano. O sólido
resultante foi filtrado, lavado com hexano seguido por éter, e secado para prover o composto titular como um sólido marrom, p.f. 275-285°C.
Exemplo 40
3-Carbetoxi-4-cloro-6,7-dimetoxilquinolina Uma mistura de 28,8 g de 3-carbetoxi-4-hidroxi-6,7dimetoxiquinolina e 16,6 ml de oxicloreto fosforoso foi agitada a 100°C durante 30 minutos, resfriada a 0°C, e tratada com uma mistura de gelo e hidróxido de amônio. O sólido cinza resultante foi filtrado, lavado com água e éter, e secado, p.f. 147-150°C.
Exemplo 41
2-Ciano-3-f3,4-dimetoxifenilamino) acrilato de etila Uma mistura de 7,66 g de 4-aminoveratrol, 8,49 g de etoximetilenociano-acetato de etila, e 20 ml de tolueno foi aquecida a 100°C durante 90 minutos. O tolueno foi evaporado para dar um sólido, p.f. 150155°C.
Exemplo 42 l,4-Dihidro-6,7-dimetoxi-4-oxo-quinolina-3-earbonitrila
Uma mistura de 40 g de 2-ciano-3-(3,4-dimetoxifenilamino) acrilato de etila e 1,2 L de Dowtherm® A foi refluxada durante 10 horas, resfriada, e diluída com hexano. O sólido resultante foi filtrado, lavado com hexano seguido por diclorometano, e secado; p.f. 330-350°C (dec).
Exemplo 43
4-Cloro-6,7-dimetoxi-quinolina-3-carbonitrila Uma mistura agitada de 20 g de l,4-dihidro-6,7-dimetoxi-4oxo-quinolina-3-carbonitrila e 87 ml de oxicloreto fosforoso foi refluxada durante 2 horas, resfriada, e evaporada isenta de material volátil. O resíduo foi agitado a 0°C com diclorometano-água à medida que carbonato de sódio sólido foi adicionado até a camada aquosa foi pH 8. A camada orgânica foi separada, lavada com água, secada e concentrada. Recristalização de diclorometano deu um sólido, p.f. 220-223°C.
Exemplo 44
2-(Dimetilaminometilenoamino) benzoato de metila A uma solução agitada de 7,56 g de antranilato de metila em ml de dimetilformamida a 0°C foi adicionado 5,6 ml de oxicloreto fosforoso durante 15 minutos. A mistura foi aquecida a 55 durante 45 minutos, resfriada a 0, e diluída com diclorometano. A mistura foi tomada básica a 0°C por adição lenta de IN NaOH frio a pH 9. A camada de diclorometano foi separada, lavada com água, secada e concentrada a um óleo.
Exemplo 45 l,4-Dihidro-4-oxo-quinolina-3-carbonitrila Uma mistura agitada de 1,03 g de 2(dimetilaminometilenoamino) benzoato de metila, 0,54 g de metóxido de sódio 1,04 ml de acetonitrila, e 10 ml de tolueno foi refluxada durante 18 horas. A mistura foi resfriada, tratada com água, e levada a pH 3 por adição de HC1 diluído. O sólido resultante foi extraído com acetato de etila. O extrato foi lavado com água, secado e evaporado. O resíduo foi recristalizado de metanol para dar um sólido, p.f. 290-3 00°C.
Exemplo 46
Ester metílico de ácido 4-(3-cloro-propoxi)-5-metoxi-benzóico
Uma mistura de 102,4 g (411,7 mmol) de sulfonato de 3cloropropil p-tolueno, 75 g (411,7 mmol) de éster metílico de ácido 4hidroxi-5-metoxi-benzóico, 75,7 g (547,5 mmol) de carbonato de potássio, e 1,66 (4,1 mmol) de cloreto de metil-tricapril amônio em 900 ml de acetona foi agitada rapidamente a refluxo durante 18 horas. A mistura foi filtrada e o solvente foi removido dando 106 g de composto titular após recristalização de uma mistura clorofórmio-hexano.
Exemplo 47 r
Ester metílico de ácido 4-(2-cloro-etoxi)-5-metoxi-benzóico
Ao usar um processo idêntico como no exemplo 46, 77 g de éster metílico de ácido 4-hidroxi-5-metoxi-benzóico, 99,2 g de sulfonato de
2-cloroetil p-tolueno, 77,7 g de carbonato de potássio, e 1,7 g (4,1 mmol) de cloreto de metil-tricapril amônio foram convertidos em 91,6 g de composto titular : espectro de massa (eletropulverização, m/e,): M+H 245,0.
Exemplo 48
Ester metílico de ácido 4-(3-cloro-propoxi)-5-metoxi-2-nitro-benzóico
A uma solução de 100 g (386,5 mmol) de éster metílico de ácido 4-(3-cloro-propoxi)-5-metoxi-benzóico em 300 ml de ácido acético foram adicionados em gotas 100 ml de 70% de ácido nítrico. A mistura foi aquecida a 50°C durante 1 hora e então despejada em água gelada. A mistura foi extraída com clorofórmio. A solução orgânica foi lavada com hidróxido de sódio diluído e então secada sobre sulfato de magnésio. O solvente foi removido. Éter foi adicionado e a mistura foi agitada até sólido ser depositado. O sólido foi coletado por filtragem dando 98 g de éster metílico de ácido 4-(3-cloro-propoxi)-5-metoxi-2-nitro-benzóico como cristais brancos : espectro de massa (eletropulverização, m/e,): M+H 303,8; 2M+NH4
623,9.
Exemplo 49
Éster metílico de ácido 4-(2-cloro-etoxi)-5-metoxi-2-nitro-benzóico
Ao usar um processo idêntico como no exemplo 48, 85 g de éster metílico de ácido 4-(2-cloro-etoxi)-5-metoxi-benzóico foi nitrada para dar 72 g do composto titular : espectro de massa (eletropulverização, m/e,): 2M+NH4 595,89.
Exemplo 50
Ester metílico de ácido 2-amino-4-f3-cloro-propoxi)-5-metoxi-benzóico
Uma mistura de 91 g (299,6 mmol) de éster metílico de ácido
4-(3-cloro-propoxi)-5-metoxi-2-nitro-benzóico e 55,2 g (988,8 mmol) de ferro foi mecanicamente agitada a refluxo em uma mistura contendo 60,1 g de cloreto de amônio, 500 ml de água, e 1300 ml de metanol durante 5,5 horas. A mistura foi concentrada e misturada com acetato de etila. A solução orgânica foi lavada com água e bicarbonato de sódio saturado. A solução foi secada sobre sulfato de magnésio e filtrada a uma coluna curta de sílica gel. O solvente foi removido e o resíduo misturado com 300 ml de éter-hexano 2:1. Depois de permanecer, 73,9 g de composto titular foram obtidos como um sólido rosa : espectro de massa (eletropulverização, m/e,): 2M-HC1+H 511,0; M+H 273,8.
Exemplo 51
Éster metílico de ácido 2-amino-4-(2-cloro-etoxi)-5-metoxi-benzóico
Uma mistura de 68,2 g (235,4 mmol) de éter metílico de ácido 4-(2-cloro-etoxi)-5-metoxi-2-nitro-benzóico e 52,6 g (941,8 mmol) de ferro foi mecanicamente agitada em refluxo em uma mistura contendo 62,9 g de cloreto de amônio, 393 ml de água, e 1021 ml de metanol durante 15 horas. A mistura foi concentrada e misturada com acetato de etila. A solução orgânica foi lavada com água e bicarbonato de sódio saturado. A solução foi secada sobre sulfato de magnésio e filtrada em uma coluna curta de sílica gel. A solução foi concentrada a 200 ml e diluída com 250 de hexano quente. Após a permanência, 47,7 g de composto titular foi obtido como um sólido : espectro de massa (eletropulverização, m/e,): M+H 259,8.
Exemplo 52
7-(2-Cloro-etoxi)-4-hidroxi-6-metoxi-quinolina-3-carbonitrila
Uma mistura de 25 g (96,3 mmol) de éster metílico de ácido 2amino-4-(2-cloro-etoxi)-5-metoxi-benzóico e 17,2 g (144,4 mmol) de dimetilformamida dimetil acetal foi aquecida a refluxo da refluxo durante 1,5 horas. Reagentes em excesso foram removidos a pressão reduzida deixando 30,3 g de um resíduo que foi dissolvido em 350 ml de tetrahidrofurano. Em um frasco separado, a uma solução agitada de 80,9 ml de 2,5M de n-butil lítio em hexano em 300 ml de tetrahidrofurano a-78°C, foram adicionados em gotas 8,3 g (202,1 mmol) de acetonitrila durante 40 minutos. Após 30 minutos, a solução acima de amidina foi adicionada em gotas durante 45 minutos a-78°C. Após 1 horas, 27,5 ml de ácido acético foi adicionado e a mistura foi deixada aquecer em temperatura ambiente. O solvente foi removido e foi adicionado água. O sólido foi coletado por filtragem e lavado com água e éter. Depois de secar a vácuo, 18,5 g de composto titular foram obtidos como um pó castanho : espectro de massa (eletropulverização, m/e,): M+H 278,8.
Exemplo 53
7-(3-Cloro-propoxi)-4-hidroxi-6-metoxi-quinolina-3-carbonitrila
Ao usar o processo de exemplo 52 e partindo com 6,01 g de amidina correspondente, 1,58 g de acetonitrila, e 15,35 ml de uma solução nbutil lítio, 3,7 g de composto titular foram obtidos como um pó castanho : espectro de massa (eletropulverização, m/e,): M+H 292,8; 2M+H 584,2.
Exemplo 54
7-(3-Cloro-propoxi)-4-cloro-6-metoxi-quinolina-3-carbonitrila
Uma mistura de 3,5 g (12 mmol) de 7-(3-cloro-propoxi)-4hidroxi-6-metoxi-quinolina-3-carbonitrila e 28 ml de oxicloreto fosforoso foi refluxada durante 1,5 horas. Reagente em excesso foi removido a pressão reduzida. O resíduo foi misturado com hidróxido de sódio resfriado com gelo e diluído e acetato de etila. A mistura foi extraída com uma combinação de acetato de etila e tetrahidrofurano. Os extratos combinados foram lavados com uma solução saturada de bicarbonato de sódio, secados sobre sulfato de magnésio, e filtrados a uma coluna curta de sílica gel. Os solventes foram removidos dando 3,2 g de composto titular como um sólido rosa que é usado com purificação adicional.
Exemplo 55
7-(2-Cloro-etoxi)-4-cloro-6-metoxi-quinolina-3-carbonitrila
Uma solução de 8 g (28,7 mmol) de 7-(2-cloro-etoxi)-4hidroxi-6-metoxi-quinolina-3-carbonitrila e 18,2 g (143,5 mmol) de cloreto de oxalila em 80 ml de cloreto de metileno contendo 0,26 de dimetilformamida foi agitada em refluxo durante 2,5 horas. O solvente foi removido. O resíduo foi misturado com hidróxido de sódio diluído, resfriado com gelo, e extraído várias vezes com acetato de etila e tetrahidrofurano. Os extratos combinados foram secados sobre sulfato de magnésio e a solução foi passada a uma coluna em sílica gel curta. Os solventes foram removidos dando 6,0 g de composto titular como um sólido branco indefinido que é usado sem purificação adicional.
Exemplo 56
4-Cloro-6-etoxi-7-metoxiquinolina-3-carbonitrila
Uma mistura de 7,95 g (32,6 mmol) de 6-etoxi-7-metoxi-4oxo-l,4-dihidroquinolina-3-carbonitrila e 50 mL de oxicloreto fosforoso foi refluxada durante 3 horas e 40 minutos. O oxicloreto fosforoso foi removido a vácuo e o resíduo foi colocado em suspensão com água gelada. NaHCCL sólido foi adicionado (pH 8) e o produto foi coletado por filtragem, lavado bem com água e secado a vácuo (40°C). O rendimento foi 7,75 g de 4-cloro6-etoxi-7-metoxiquinolina-3-carbonitrila como um sólido castanho : espectro de massa (eletropulverização, m/e): M+H 262,8, 264,8.
Exemplo 57
6-Etoxi-7-metoxi-4-oxo-l,4-dihidroquinolina-3-carbonitrila
Uma solução de 10,2 g (45,3 mmol) de 2-amino-5-etoxi-4metoxi benzoato de metila e 10,8 g (90,7 mmol) de dimetil acetal dimetilformamida em 50 mL de dimetilformamida foi refluxada durante 3 horas. O material volátil foi removido e o resíduo foi azeotropado com tolueno e secado a vácuo para dar a formamidina como um xarope roxo, nButil lítio (100 mmol) em hexano foi diluído com 60 mL de tetrahidrofurano a-78°C. Uma solução de 4,18 g (102 mmol) de acetonitrila em 80 mL de
tetrahidrofurano foi adicionada durante 15 minutos e a solução foi agitada durante 20 minutos. A formamidina bruta foi dissolvida em 80 mL de tetrahidrofurano e adicionada em gotas a uma solução fria durante 0,5 hora. Após agitação durante 2 horas, a reação foi resfriada bruscamente a-78°C com 13 mL de ácido acético. Ela foi deixada aquecer em temperatura ambiente e o material volátil foi removido a vácuo. O resíduo foi colocado em suspensão com água e o produto bruto foi coletado por filtragem, lavado com água e secado. Este material foi então lavado com clorofórmio e secado para dar 7,95 g de 6-etoxi-7-metoxi-4-oxo-l,4-dihidroquinolina-3carbonitrila como cristais amarelos : espectro de massa (eletropulverízação, m/e): M-H 243,2.
Exemplo 58
2-Amino-5-etoxi-4-metoxibenzoato de metila Uma mistura de 17,0 g (66,7 mmol) de 5-etoxi-4-metoxi-2nitrobenzoato de metila, 13,1 g (233 mmol) de ferro em pó e 17,7 g (334 mmol) de cloreto de amônio em 95 mL de água e 245 mL de metanol foi refluxado durante 4,5 horas. Mais de 13,1 g de ferro foi adicionado seguido por refluxo durante 2,5 horas. Então Mais 13,1 g de ferro e 17,7 g de cloreto de amônio foi adicionado e refluxo foi continuado durante 12 horas. A reação foi filtrada a Celite e metanol foi removido do filtrado. O filtrado foi extraído com clorofórmio e os extratos foram tratados com Darco, evaporados e secados a vácuo (50°C). O rendimento foi 11,0 g de 2-amino-5-etoxi-4metoxibenzoato de metila como cristais castanhos : espectro de massa (eletropulverízação, m/e): M+H 225,9.
Exemplo 59
5-Etoxi-4-metoxi-2-nitrobenzoato de metila Uma mistura de 15,0 g (74,1 mmol) de 3-etoxi-4metoxibenzoato de metila em 45 mL de ácido acético foi tratada com 15 mL de ácido nítrico em gotas concentrado durante 12 minutos. A reação foi
mantida a 55°C durante 45 minutos, resfriada a 25°C e despejada em água gelada. O produto foi extraído em cloreto de metileno e os extratos foram lavados com água e hidróxido de sódio, secado e evaporado. O rendimento foi 17,8 g de 5-etoxi-4-metoxi-2-nitrobenzoato de metila como cristais amarelos : espectro de massa (eletropulverização, m/e): M+H 256,0.
Exemplo 60
3-Etoxi-4-metoxibenzoato de metila Uma mistura de 24,3 g (134 mmol) de 3-hidroxi-4metoxibenzoato de metila, 36,8 g (267 mmol) de carbonato de potássio anidro e 31,4 g (201 mmol) de iodeto de etila em 500 mL de dimetilformamida foi agitada a 100°C durante 5,5 horas. Uma quantidade adicional de iodeto de etila (31,4 g) e carbonato de potássio (18,4 g) foi adicionada e o aquecimento foi continuado durante mais 2 horas. A reação foi filtrada e o material volátil foi removido do filtrado a vácuo. O resíduo foi colocado em suspensão com água e filtrado para coletar o produto que foi lavado com água e secado. Recristalização de heptano deu 15,6 g de 3-etoxi4-metoxibenzoato de metila como cristais brancos : espectro de massa (eletropulverização, m/e): M+H 210,9.
Exemplo 61
3-Hidroxi-4-metoxibenzoato de metila Uma solução de 30,8 g (183 mmol) de ácido 3-hidroxi-4metoxibenzóico e 6 mL de ácido sulfurico concentrado em 600 mL de metanol foi refluxada durante a noite. Mais solvente foi removido e a solução restante foi despejada em 600 mL de água contendo 25 g de bicarbonato de sódio. O produto foi extraído em éter, tratado com Darco, secado e evaporado. O rendimento foi 31,8 g de 3-hidroxi-4-metoxibenzoato de metila como cristais amarelos.
Exemplo 62
N'-r2-(Carbetoxi-4,5-bis (2-metoxietoxi) fenill-N, N-dimetilformamidina
A uma solução agitada de 15,7 g (50 mmol) de 2-amino-4,5bis (2-metoxietoxi) benzoato de etila (WO-96130347) em 50 ml de DMF a 0°C foi adicionado oxicloreto fosforoso (5,6 ml, 60 mmol) durante 15 minutos. A solução resultante foi aquecida a 55°C durante 45 m, resfriada, diluída com cloreto de metileno, e tratada a 0°C com 200 ml de N/l hidróxido de sódio durante 2 m. A camada orgânica foi separada e lavada a 0°C com água. A solução foi secada e evaporada com tolueno adicionado presente para dar 18,4 g de óleo âmbar; RMN (CDC13) δ 3,02 (s, Me?N).
Exemplo 63
1,4-Dihidroquinolina-5,6-bis (2-metoxietoxi)-3-carbonitrila
A uma solução agitada de n-butil lítio (44 ml de 2,5 M em hexano; 110 mmol) em 65 ml de TEEF a-78°C foi adicionada uma solução de acetonitrila (5,85 ml, 112 mmol) em 110 ml de THF durante 10 minutos. Após agitação a-78°C durante 15 minutos, a mistura foi tratada com uma solução de N'-[2-carbetoxi-4,5-bis (2-metoxietoxi) fenil]-N, N-dimetilformamidina em 75 ml de THF durante 20 minutos. Após 30 minutos a-78°C a mistura agitada foi tratada com ácido acético (14,3 ml, 250 mmol). A mistura foi aquecida a 25°C e agitada durante 2 horas. A mistura foi evaporada até secura, e diluída com água. O sólido branco resultante foi filtrado, lavado com água, e secado para dar 10,7 g; espectro de massa (eletropulverização, m/e): M+H 319,2.
Exemplo 64
4-Cloro-5,6-bis (2-metoxietoxi)-quinolina-3-carbonitrila
Uma mistura agitada de l,4-dihidroquinolina-5,6-bis (2metoxietoxi)-3-carbonitrila 9,68 g, 30,4 mmol) e 30 ml de oxicloreto fosforoso foi refluxada durante 1,5 hora. A solução resultante foi concentrada sob vácuo, e o resíduo foi agitado com cloreto de metileno a 0°C com água gelada e carbonato de sódio foram adicionados até pH de mistura foi 8-9. A camada orgânica foi separada, lavada com água, secada e concentrada para
100 dar um sólido castanho; espectro de massa (eletropulverização, m/e): M+H 337,1,33,9,1.
Exemplo 65
4-Metoxi-3-(3-morfolin-4-il-propoxi)) benzoato de metila
Uma mistura agitada de isovanilato de metila (22,6 g, 124 mmol), N-(3-cloropropil)-morfolina (25,4 g, 155 mmol), carbonato de potássio (18,8 g, 136 mmol), iodeto de tetrabutilamônio (0,92 g, 2,5 mmol), e 248 ml de 2-butanona foi refluxada durante 20 horas. O 2-butanona foi evaporado, e o resíduo foi agitado com água a 0°C. O sólido branco resultante foi filtrado, lavado sucessivamente com água e hexano, e secado; p.f. 9094°C.
Exemplo 66
4-Metoxi-5 -(3 -morfolin-4-il-propoxi))-2-nitrobenzoato de metila
A uma solução agitada de 4-metoxi-3-(3-morfolin-4-ilpropoxi)) benzoato de metila (30,9 g, 100 mmol) em 100 ml de ácido acético a 25°C foram adicionados 50 ml de 70% de ácido nítrico durante 30 minutos. A solução foi aquecida a 45°C, neste ponto a reação iniciou e foi autosustentada nesta temperatura. Após um total de 1,5 horas a 45-50°C a mistura foi resfriada a 0°C, tratada com água gelada e 240 g (1,75 mol) de carbonato de potássio, e extraída com acetato de etila. O extrato foi lavado com água, secado, e concentrado para dar um sólido amarelo, p.f. 78-82°C.
Exemplo 67
2-Amino-4-metoxi-5-(3-morfolin-4-il-propoxi)) benzoato de metila
Uma solução de 4-metoxi-3-(3-morfolin-4-il-propoxi))-2nitrobenzoato de metila (32,5 g, 91,7 mmol) em 110 ml de metanol e 220 ml de acetato de etila foi hidrogenada a 3,86 kg/cm na presença de 2,0 g de 10% Pd em catalisador de carbono a 25°C. Após 4 horas, a mistura foi filtrada, e o filtrado foi evaporado até secura. O resíduo foi recristalizado de acetonahexano para dar um sólido castanho, p.f. 78-82°C.
101
Exemplo 68
2-(dimetilaminometilenoamino)-4-metoxi-5-(3-morfolin-4-il-propoxi)) benzoato de etila
Uma mistura de 2-amino-4-metoxi-5-(3-morfolin-4-ilpropoxi)) benzoato de metila (6,49 g, 20 mmol) e dimetil acetal dimetilformamida(4,25 ml, 30 mmol) foi aquecida a 100°C durante 1,5 horas. Todos materiais voláteis foram evaporados diretamente a 70°C para dar um xarope; espectro de massa (eletropulverização, m/e): M+H 380,5.
Exemplo 69 l,4-Dihidroquinolina-7-metoxi-6-(3-morfolin-4-il-propoxi))-4-oxo-3carbonitrila
A uma solução agitada de n-butil lítio (17,6 ml de 2,5 M em hexano; 44 mmol) em 26 ml de THF a-78°C foi adicionada uma solução de acetonitrila (1,85 ml, 45 mmol) em 44 ml de THF durante 10 minutos. Após agitação a-78°C durante 15 minutos, a mistura foi tratada com uma solução de 2-(dimetilaminometilenoamino)-4-metoxi-5 -(3 -morfolin-4-il-propoxi)) benzoato de etila (7,6 g, 20 mmol) em 30 ml de THF durante 20 minutos. Após 90 minutos, a-78°C, a mistura foi tratada com dióxido de carbono enquanto aquecendo lentamente a 25°C e então evaporada até secura. O resíduo foi dividido com n-butanol (200 ml) e uma solução de NaCl meiosaturado (40 ml). A camada orgânica foi separada, lavada com uma solução de NaCl saturado, e evaporada até secura. O sólido resultante foi triturado sucessivamente com ebulição de acetona e metanol, filtrado, e secado para dar um sólido castanho, p.f. 255-260°C.
T7 VAT-ntAl r\ 7Π
4-Cloro-7-metoxi-6-(3-morfolin-4-il-propoxi))-quinolina-3-carbonitrila
Uma mistura agitada de l,4-dihidroquinolina-7-metoxi-6-(3morfolin-4-il-propoxi))-4-oxo3-carbonitrila (4,75 g, 13,8 mmol), 0,10 ml de DMF, e 55 ml de cloreto de tionila foi refluxada durante 3 horas. O material
102 volátil foi removido por evaporação a 30°C, e o resíduo foi agitado a 0°C com uma mistura de cloreto de metileno e água contendo carbonato de potássio para dar pH 9-10. A camada orgânica foi separada, lavada com água, secada e concentrada para dar um sólido marrom; espectro de massa (eletropulverização, m/e): M+H 362,4, 364,4.
Exemplo 71
4-Cloro-7-etoxi-6-metoxi-quinolina-3-carbonitrila
122 mg (0,50 mmol) 7-etoxi-l,4-dihidro-6-metoxi-4-oxoquinolina-3-carbonitrila e 2,0 ml de cloreto de metileno foram misturados sob N2 e mantidos na temperatura próxima de 25°C.
Foram adicionados 218 μΐ (2,5 mmol) de cloreto de oxalila e 10 μΐ (0,125 mmol) de DMF. Eles foram agitados durante a noite, diluídos com clorofórmio e agitados em bicarbonato de sódio saturado até ficarem básicos. As camadas foram separadas e os orgânicos secados com sulfato de magnésio, extraídos com solvente e secados em vácuo, dando 117 mg de sólido castanho: espectro de massa (eletropulverização, m/e): M+H 262,8, 264,8.
Exemplo 72
7-Etoxi-1,4-dihidro-6-metoxi-4-oxo-quinolina-3-carbonitrila
Foram adicionados 54,0 ml (135 mmol) de n-butil lítio a 150 ml de THF e resfriados a-78°C sob N2. Foram adicionados em gotas durante 20 minutos 7,05 ml (135 mmol) de acetonitrila em 200 ml de THF. Eles foram agitados 15 minutos e adicionados a uma solução de 17,99 g (64,2 mmol) de 4-etoxi-5-metoxi-2-(dimetilaminometilenoamino) benzoato de metila em 150 ml de THF em gotas durante 20 minutos. Deixou-se agitar durante 0,5 hora a-78°C. Foram adicionados 11,0 ml (193 mmol) de ácido acético e aquecidos gradualmente a 25°C. Após 2,5 horas, foram extraídos com solvente, colocados em suspensão com resíduo com água, os sólidos foram coletados e secados em vácuo, dando 13,025 g de sólido amarelo :
103
OC espectro de massa (eletropulverização, m/e): M+H = 245,2.
Exemplo 73
4-Etoxi-5-metoxi-2-(dimetilaminometilenoamino) benzoato de metila
Uma mistura de 15,056 g (66,9 mmol) de 2-amino-4-etoxi-5metoxibenzoato de metila e 14,1 ml (100 mmol) de N, N-dimetilformamida dimetilacetal foi aquecida a 100°C sob N2. A 4,5 horas, foram adicionados
4,7 ml (33,3 mmol) de mais DMF/DMA e removidos com calor em 5 h. Extraiu-se com solvente, tratou-se com azeotropo com tolueno, e secou-se em vácuo, dando 18,211 g de sólido marrom cinza : espectro de massa (eletropulverização, m/e): M+H = 281,3.
Exemplo 74
2-Amino-4-etoxi-5-metoxibenzoato de metila
Uma mistura de 24,110 g (94,5 mmol) de 4-etoxi-5-metoxi-2nitrobenzoato de metila, 15,81 g (283 mmol) pó de ferro, 25,28 g (472 mmol) de cloreto de amônio, 135 ml de água, e 350 ml de metanol foi aquecida a refluxo sob N2. Tanto em 3 como em 5,5 horas, foi adicionada a mesma quantidade de ferro e cloreto de amônio. Removeu-se com calor a 6,5 horas, adicionou-se acetato de etila e bicarbonato de sódio saturado, filtrou com celite e as camadas foram separadas. A camada orgânica foi lavada com bicarbonato de sódio saturado, secada com sulfato de magnésio, extraída com solvente, e secada em vácuo, dando 17,594 g de sólido rosa: : espectro de massa (eletropulverização, m/e): M+H = 226,2.
Exemplo 75
4-Etoxi-5-metoxi-2-nitrobenzoato de metila
5,00 g (23,7 mmol) de 4-etoxi-3-metoxibenzoato de metila foram dissolvidos em 25 ml de ácido acético sob N2 e adicionados 6,1 ml (95,1 mmol) 69% de ácido nítrico em gotas durante 30 minutos. Aqueceu-se a 50 °C durante 1,5 h e despejou-se em banho de gelo. Extraiu-se com clorofórmio, lavou-se com solução de hidróxido de sódio diluída e filtrou-se
104 através de sulfato de magnésio. Extraiu-se com solvente e secou-se em vácuo, dando 5,268 g de sólido branco indefinido : espectro de massa (eletropulverização, m/e): M+H = 255,8.
Exemplo 76
4-Etoxi-3-metoxibenzoato de metila Uma mistura de 25,0 g (137 mmol) de vanilato de metila,
38,87 g (274 mmol) de carbonato de potássio, 500 ml de DMF, e 16,5 ml (206 mmol) de iodeto de etila foi aquecida a 100°C sob N2. A 2,5 h, os sólidos foram resfriados e removidos. Extraiu-se com solvente, e dividiu-se entre água e cloreto de metileno. O solvente foi extraído e secado em vácuo, dando 25,85 g de sólido branco : espectro de massa (EI m/e): M = 210,0.
Exemplo 77
7-Etoxi-4-hidroxi-quinolina-3-carbonitrila Uma mistura de 10 g (73 mmol) de 3-etoxi anilina e 12,3 g (73 mmol) de (etoximetileno) cianoacetato de etila foi aquecida em 90 ml de Dowther a 140°C durante 7 horas. A esta mistura foi adicionado 250 ml de Dowther. A solução foi agitada e refluxada sob nitrogênio durante 12 horas com destilação periodicamente do etanol. A mistura foi resfriada em temperatura ambiente e o sólido foi coletado e lavado com hexano. O sólido bruto foi tratado com etanol em ebulição e então filtrado para dar 9,86 g de sólido marrom : espectro de massa (eletropulverização, m/e): M+H 214,7.
Exemplo 78
7-Etoxi-4-hidroxi-6-nitro-quinolina-3-carbonitrila A uma suspensão de 5 g (23 mmol) de 7-etoxi-4-hidroxiquinolina-3-carbonitrila em 75 mi de anidrido trifluroacético foram adicionados 5,5 g (69 mmol) de nitrato de amônio durante um período de 6 horas em temperatura ambiente. Excesso de anidrido foi removido a pressão reduzida a 45°C. O resíduo foi agitado com 300 ml de água. O sólido foi coletado e tratado com etanol em ebulição para dar 3,68 g de sólido de
105 estanho : espectro de massa (eletropulverização, m/e): M+H 259,8.
Exemplo 79
4-Cloro-7-etoxi-6-nitro-quinolina-3-carbonitrila
Uma mistura de 3,45 g (13 mmol) de 7-etoxi-4-hidroxi-6nitro-quinolina-3-carbonitrila, 5,55 g (26 mmol) de pentacloreto fosforoso, e 10 ml de oxicloreto fosforoso foi refluxada durante 3 horas. A mistura foi diluída com hexano e o sólido foi coletado. O sólido foi dissolvido em 500 ml de acetato de etila e lavado com uma solução de hidróxido de sódio diluído frio. A solução foi secada sobre sulfato de magnésio e filtrada em um chumaço de sílica gel. O solvente foi removido dando 2,1 g de sólido bege : espectro de massa (eletropulverização, m/e): M+H 277,7.
Exemplo 80
8-Metoxi-4-hidroxi-6-nitro-quinolina-3-carbonitrila Uma mistura de 12,6 g (75 mmol) de 2-metoxi-4-nitro anilina e 12,7 g (75 mmol) de (etoximetileno) cianoacetato de etila foi aquecida em 100 ml de Dowther a 120°C durante a noite e a 180°C durante 20 horas. A esta mistura foi adicionado 300 ml de Dowther. A solução foi agitada e refluxada sob nitrogênio durante 12 horas com distilação periodicamente do etanol eliminado. A mistura foi resfriada em temperatura ambiente e o sólido foi coletado e lavado com hexano. O sólido bruto foi tratado com etanol em ebulição e então filtrado para dar 12 g de sólido marrom : espectro de massa (eletropulverização, m/e): M+H 245,8.
Exemplo 81
4-Cloro-8-metoxi-6-nitro-quinolina-3-carbonitrila Uma mistura de 4 g (16 mmol) de 8-metoxi-4-hidroxi-6-nitroquinolina-3-carbonitrila, 6,66 g (32 mmol) de pentacloreto fosforoso, e 15 ml de oxicloreto fosforoso foi refluxado durante 2,5 horas. A mistura foi diluída com hexano e o sólido foi coletado. O sólido foi dissolvido em 500 ml de acetato de etila e lavado com uma solução de hidróxido de sódio diluído frio.
106
A solução foi secada sobre sulfato de magnésio e filtrada em um chumaço de sílica gel. O solvente foi removido dando 2,05 g de sólido castanho : espectro de massa (eletropulverização, m/e): M+H 263,7.
Exemplo 82
4-Hidroxi-6, 7, 8-trimetoxi-quinolina-3-carbonitrila
Uma mistura de 4,82 g de 3, 4, 5-trimetoxiantranilato de metila em 20 ml de N, N-dimetilformamida dimetil acetal foi refluxada durante 18 horas e concentrada a vácuo. O produto amidina bruto foi usado na próxima etapa sem outra purificação.
A 25 ml de tetrahidrofurano a-78°C foram adicionados 17,6 ml de 2,5 M de n-butil lítio em hexanos. Então 2,35 ml de acetonitrila em 45 ml de tetrahidrofurano foram adicionados em gotas. A mistura foi agitada a78°C durante 15 minutos. Então, uma solução de amidina bruta em 30 ml de tetrahidrofurano foi adicionada em gotas. A mistura foi agitada a-78°C durante 30 minutos, então 5,7 ml de ácido acético foram adicionados. A mistura foi aquecida em temperatura ambiente, e 100 ml de água foram adicionados. O produto foi coletado, lavado com água, e secado para dar 4,14 g de 4-hidroxi-6, 7, 8-trimetoxi-quinolina-3-carbonitrila como um sólido, p.f. 280°C (decomposto); espectro de massa (eletropulverização, m/e): M+H
261,2.
Exemplo 83
4-Cloro-6, 7, 8-trimetoxi-quinolina-3-carbonitrila Uma mistura agitada de 1,30 g de 4-hidroxi-6, 7, 8-trimetoxiquinolina-3-carbonitrila, 10 ml de oxicloreto fosforoso, e 1 gota de N, Ndimetiifórmamida foi refluxada durante minutos e evaporada isenta de material volátil. O resíduo foi agitado com 20 ml de 5% de álcool metílico em acetato de etila. O produto foi coletado e secado para dar 1,12 g de 4-cloro-6, 7, 8-trimetoxi-quinolina-3-carbonitrila como um sólido, p.f. 161-163°C; espectro de massa (EI, m/e): M 278,0452.
107
Exemplo 84 r
Ester metílico de ácido 2-(dimetilamino-metilenoamino)-3,6-dimetoxibenzóico
Uma mistura de 3,46 g de ácido 2-amino-3,6dimetoxibenzóico (Manouchehr Azadi-Ardakani e Timothy W. Wallace, Tetrahedron, vol. 44, n°. 18, pp. 5939 a 5952, 1988) em 20 ml de dimetil acetal N, N-dimetilformamida foi refluxada durante 18 horas e concentrada a vácuo. Ao resíduo foram adicionados 180 ml de acetato de etila. A mistura foi filtrada, e 200 ml de hexanos foram adicionados ao filtrado. A mistura foi então concentrada a 100 ml. O produto foi coletado e secado para dar 3,25 g de éster metílico de ácido 2-(dimetilamino-metilenoamino)-3,6-dimetoxibenzóico como um sólido, p.f. 81-83°C; espectro de massa (EI, m/e): M 266,1263.
Exemplo 85
4-Hidroxi-5,8-dimetoxi-quinolina-3-carbonitrila
Para 12,5 ml de tetrahidrofurano a-78°C foram adicionados
8,8 ml de 2,5 M de n-butil lítio em hexanos. Então 1,18 ml de acetonitrila em 25 ml de tetrahidrofurano foi adicionado em gotas. A mistura foi agitada a78°C durante 15 minutos. Então uma solução de éster metílico de ácido 2(dimetilamino-metilenoamino)-3,6-dimetoxi-benzóico em 62 ml de tetrahidrofurano foi adicionada em gotas. A mistura foi agitada a-78°C durante 10 minutos, então aquecida em temperatura ambiente em 15 minutos. Ácido acético (3 ml) foi adicionado, seguido por 200 ml de água. O produto foi coletado, lavado com água, e secado para dar 1,57 g de 4-hidroxi-5,8dimetoxi-quinolina-3-carbonitrila como um sólido, p.f. 300-305°C; espectro de massa (EI, m/e): M 230,0685.
Exemplo 86
4-Cloro-5,8-dimetoxi-quinolina-3-carbonitrila
Uma mistura agitada de 1,30 g de 4-hidroxi-5,8-dimetoxi-
108 quinolina-3-carbonitrila, 10 ml de oxicloreto fosforoso, e 2 gotas de N, Ndimetilformamida foi refluxada durante 10 minutos e evaporada isenta de material volátil. O resíduo foi agitado com 50 ml de água. O produto foi coletado e secado para dar 1,74 g de 4-cloro-5,8-dimetoxi-quinolina-3carbonitrila como um sólido, p.f. 165-167°C; espectro de massa (EI, m/e): M 248,0346.
Exemplo 87
2-(Dimetilaminometilenoarnino)-4,5-dietoxibenzoato de metila
A uma solução agitada de 2-amino-4,5-dietoxibenzoato de metila (4,79 g, 20 mmol) em 20 ml de DMF a 0°C foi adicionado oxicloreto fosforoso (2,24 ml, 24 mmol) durante 15 minutos. A mistura foi aquecida a 55°C e agitada durante 45 minutos. A solução resultante foi diluída com cloreto de metileno, resfriada a 0°C, e tratada com 80 ml de N/l hidróxido de sódio pré-resfriado durante 5 minutos. A camada orgânica foi separada e lavada a 0°C com água. A solução foi secada e concentrada para dar um óleo âmbar; RMN (CDC13) δ 3,00 (s, Me2NY
Exemplo 88 l,4-Dihidroquinolina-6,7-dietoxi-4-oxo-3-carbonitrila
A uma solução agitada de n-butil lítio (17,6 ml de 2,5 M em hexano; 44 mmol) em 25 ml de THF a-78°C foi adicionada uma solução de acetonitrila (2,35 ml, 45 mmol) em 44 ml de THF durante 10 minutos. Após agitação a-78°C durante 15 minutos, a mistura foi tratada com uma solução de 2-(dimetilaminometilenoamino)-4,5-dietoxibenzoato de etila (5,83 g, 19,8 mmol) em 30 ml de THF durante 30 minutos. Após 30 minutos a-78°C a mistura foi tratada com 5,7 ml (100 mmol) de ácido acético e evaporada to secura. O resíduo foi agitado em água, e o precipitado resultante foi filtrado, lavado com água, e secado para dar 4,01 g de sólido branco indefinido; RMN (DMSO-d6) d 8,58 (s, 2-H).
Exemplo 89
109 t2Q
4-Cloro-6,7-dietoxi-quinolina-3-carbonitrila Como no exemplo 64, o tratamento de 1,4-dihidroquinolina6,7-dietoxi-4-oxo-3-carbonitrila com oxicloreto fosforoso deu o composto titular como um sólido rosa, p.f. 170-175°C.
Exemplo 90
Éster metílico de ácido 2-(dimetilamino-metilenoamino)-3-metoxi-benzóico
Uma mistura de reação de 5,0 g (29,9 mmol) de ácido 2amino-3-metoxi-benzóico em 25,0 mL de DMF-DMA foi aquecida a 100105°C durante 2,5 horas, e então o solvente foi removido para dar um óleo viscoso vermelho-roxo. Após permanecer em um refrigerador, o óleo solidificado para dar 5,8 g de produto como um sólido vermelho-roxo em 82,8% de rendimento, espectro de massa (eletropulverização, m/e): M+H
236,9.
Exemplo 91 l,4-Dihidro-8-metoxi-4-oxo-quinolina-3-carbonitrila
Para 35,0 mL de THF foram adicionados 26,6 mL (66,4 mmol) de solução n-BuLi durante 5 minutos a-78°C. A solução agitada foi adicionada uma solução de 3,55 mL (67,9 mmol) de CH3CN em 65 mL de THF durante 10 minutos, sendo que desta vez a solução se tomou uma suspensão branca, e então foi deixada agitar durante 15 minutos a-78°C. Para a suspensão foi adicionada uma solução de 5,8 g (24,5 mmol) de éster metílico de ácido 2-(dimetilamino-metilenoamino)-3-metoxi-benzóico em 45 mL de THF durante 30 minutos, e então deixada agitar 30 minutos a-78°C, sendo que desta vez, a mistura se tomou gradualmente límpida. A solução foi resfriada bruscamente com 8,5 mL de HOAc. A suspensão espessa resultante foi agitada e aquecida em temperatura ambiente. Depois mais solvente foi evaporado, o resíduo foi diluído com água gelada. O sólido separado foi coletado por filtragem e lavado com água. Depois de secar a vácuo, obteve-se
3,8 g de produto como um sólido de branco indefinido em 77,6% de
110 rendimento, p.f. 270°C (dec.), espectro de massa (eletropulverízação, m/e): M+H 201,1.
Exemplo 92
4-Cloro-8-metoxi-quinolina-3-carbonitrila Uma mistura de 3,8 g (19 mmol) de l,4-dihidro-8-metoxi-4oxo-quinolina-3-carbonitrila e 40 mL de oxicloreto fosforoso e 5 gotas de DMF foram refluxadas durante 0,5 horas. A mistura foi evaporada até secura e diluída com hexanos. O sólido foi coletado e misturado com uma solução de carbonato de sódio diluído frio e extraído várias vezes com acetato de etila. A camada orgânica foi secada sobre sulfato de sódio e filtrada em um chumaço de sílica gel. A remoção do solvente deu 3,8 g de 4-cloro-8-metoxiquinolina-3-carbonitrila como um sólido branco indefinido em 91% de rendimento, espectro de massa (eletropulverízação, m/e): M+H 219,1.
Exemplo 93
4-Cloro-7-metoxi-quinolina-3-carbonitrila Como no exemplo 64, tratamento de l,4-dihidroquinolin-7metoxi-4-oxo-3-carbonitrila com oxicloreto fosforoso deu o composto titular como um sólido castanho; espectro de massa (eletropulverízação, m/e): M+H
219,2, 221,2.
Exemplo 94
7-Benziloxi-4-hidroxi-6-metoxi-quinolina-3-carbonitrila
A uma solução agitada de 26,9 ml de zz-butil lítio (2,5 M em hexano) em 50 ml de THF a-78°C foi adicionado 3,51 ml de acetonitrila em 20 ml de THF durante 10 minutos. Depois de agitar a-78°C durante 30 minutos, a mistura foi tratada com 10 g de L17741-150 (B. Floyd) em 20 ml de THF durante 5 minutos. Depois de 15 minutos a-78°C a mistura agitada foi aquecida a 0°C durante ainda 30 minutos. Ela foi então tratada com 5 ml de ácido acético, aquecida a 25°C e agitada durante 30 minutos. A mistura foi evaporada até secura, e diluída com bicarbonato de sódio aquoso. O sólido
111 branco indefinido resultante foi filtrado, lavado com água, acetato de etila e éter. Depois de secar, 4,5 g de 7-benziloxi-4-hidroxi-6-metoxi-quinolina-3carbonitrila foram obtidos como um sólido branco indefinido, dec>255°C; espectro de massa (eletropulverização, m/e): M+H 307.
Exemplo 95
7-Benziloxi-4-cloro-6-metoxi-quinolina-3-carbonitrila
A uma suspensão agitada de 1 g de 7-benziloxi-4-hidroxi-6metoxi-quinolina-3-carbonitrila em 10 ml de cloreto de metileno, foram adicionados 5 ml de cloreto de oxalila (2M em cloreto de metileno), e 2 gotas de N, N-dimetilformamida. A mistura foi refluxada durante 20 minutos e à medida foi adicionado lentamente bicarbonato de sódio aquoso até cessar borbulhamento. Após separação das camadas, a camada orgânica foi evaporada a um volume pequeno, então passada a um tampão de magnesol. Eluição com 50 ml de cloreto de metileno, seguido por evaporação deu 0,6 g de 7-benziloxi-4-cloro-6-metoxi-quinolina-3-carbonitrila como um sólido amarelo pálido, p.f. 282-284°C; espectro de massa (eletropulverização, m/e): M+H 325.
Exemplo 96
4-(2,3-Dihidro-lH-indol-6-ilamino)-6,7-dietoxi-quinolina-3-carbonitrila
Uma solução de 400 mg (1,44 mM) de 4-cloro-6,7-dietoxiquinolina-3-carbonitrila e 258 mg (1,88 mM) de sal dihidrocloreto de 6λ aminomdolina em 10 ml de etanol foi refluxada durante 3 horas. A solução aquecida, foi adicionado 1 ml de 1M carbonato de sódio e a amostra foi aquecida durante 5 minutos a 100°C, então despejada em 300 ml de água gelada. O sólido foi coletado, lavado com água seguido por éter e secado sob vácuo a 80°C. O sólido foi dissolvido em 50/50 metanol / clorofórmio e secado sobre sílica gel e purificado por cromatografia usando um gradiente de 20% a 50% de acetona em hexano para dar 496 mg de composto titular como um sólido castanho : espectro de massa (eletropulverização, m/e): M+H
112
375,1, p.f. = 121-124°C.
Exemplo 97
Sal HCl 4-(benzotiazol-6-ilamino)-6,7-dietoxi-quinolina-3-carbonitrila
Uma solução de 500 mg (1,8 mM) de 4-cloro-6,7-dietoxiquinolina-3-carbonitrila e 353 mg (2,35 mM) de 6-aminobenzotiozol em 15 ml de etanol foi refluxada durante 3 horas. A solução quente, foram adicionadas 2 gotas de HCl concentrado e a amostra foi aquecida durante 5 minutos a 100°C, então o sólido foi isolado por filtragem. O sólido foi tomado em 20 ml de etanol e digerido durante 1 hora. A solução quente foi filtrada e o sólido isolado foi lavado com etanol e secado sob vácuo a 80°C para dar 666 mg de sal HCl 4-(benzotiazol-6-ilamino)-6,7-dietoxi-quinolina3-carbonitrila como um sólido castanho : espectro de massa (eletropulverização, m/e): M+H 391,0, p.f. = 285-287°C.
Exemplo 98
4-(Benzo [1.31 dioxol-5-ilamino)-6,7-dietoxi-quinolina-3-carbonitrila
Uma solução de 400 mg (1,44 mM) de 4-cloro-6,7-dietoxiquinolina-3-carbonitrila e 258 mg (1,88 mM) de 3,4-(metilenodioxi) anilina em 10 ml de etanol foi refluxada durante 3 horas. A solução quente foi adicionado 1 ml de 1M de carbonato de sódio e a amostra foi aquecida durante 5 minutos a 100°C, então despejada em 300 ml de água gelada. O sólido foi coletado, lavado com água seguido por éter e secado sob vácuo a 80°C para dar 526 mg de 4-(benzo [1.3] dioxol-5-ilamino)-6,7-dietoxiquinolina-3-carbonitrila como um sólido castanho : espectro de massa (eletropulverização, m/e): M+H 378,0, p.f. = 200-203°C.
Exemplo 99
6,7-Dietoxi-4-(lH-indazol-6-ilamino)-quinolina-3-carbonitrila
Uma solução de 400 mg (1,44 mM) de 4-cloro-6,7-dietoxiquinolina-3-carbonitrila e 250 mg (1,88 mM) de 6-aminoindazol em 10 ml de etanol foi refluxada durante 3 horas. A solução quente foi adicionado 1 ml de
113
1Μ de carbonato de sódio e a amostra foi aquecida durante 5 minutos a 100°C, então despejada em 300 ml de água gelada. O sólido foi coletado, lavado com água seguido por éter e secado sob vácuo a 80°C para dar 448 mg de 6,7-dietoxi-4-(lH-indazol-6-ilamino)-quinolina-3-carbonitrila como um sólido castanho : espectro de massa (eletropulverização, m/e): M+H 374,1, p.f. = 143-145°C.
Exemplo 100
6,7-dietoxi-4-(4-metil-2-oxo-2H-cromen-7-ilamino)-quinolina-3-carbonitrila
Uma solução de 400 mg (1,44 mM) de 4-cloro-6,7-dietoxiquinolina-3-carbonitrila e 330 mg (1,88 mM) de 7-amino-4-metil-coumarina em 15 ml de 2-metoxietanol foi refluxada durante 3 horas. A solução quente, foi adicionado 1 ml de 1M de carbonato de sódio e a amostra foi aquecida durante 5 minutos a 100°C, então despejada em 300 ml de água gelada. O sólido foi coletado, lavado com água seguido por éter e secado sob vácuo a 80°C para dar 431 mg de 6,7-dietoxi-4-(4-metil-2-oxo-2H-cromen-7ilamino)-quinolina-3-carbonitrila como um sólido castanho : espectro de massa (eletropulverização, m/e): M+H 416,0, p.f. = 282-284°C.
Exemplo 101
6,7-Dietoxi-4-(lH-indol-6-ilamino)-quinolina-3-carbonitrila
Uma solução de 964 mg (3,50 mM) de 4-cloro-6,7-dietoxiquinolina-3-carbonitrila e 830 mg (6,29 mM) de 6-aminoindol em 5 ml de 2metoxietanol foi refluxada durante 3 horas. A solução quente, foi adicionado 1 ml de 1M de carbonato de sódio e a amostra foi aquecida durante 5 minutos a 100°C, então despejada em 300 ml de água gelada. O sólido foi coletado, lavado com água seguido por éter e secado sob vácuo a 80°C para dar 712 mg de 6,7-dietoxi-4-(lH-indol-6-ilamino)-quinolina-3-carbonitrila como um sólido amarelo : espectro de massa (eletropulverização, m/e): M+H 373,0, p.f. = 128-130°C.
Exemplo 102
114
6,7-Dimetoxi-4-(lH-indazol-6-ilamino)-quinolina-3-carbonitrila
Uma solução de 500 mg (2,00 mM) de 4-cloro-6,7-dimetoxiquinolina-3-carbonitrila e 975 mg (2,61 mM) de 6-aminoindazol em 15 ml de 2-metoxietanol foi refluxada durante 3 horas. À solução quente, foi adicionado 1 ml de 1M de carbonato de sódio e a amostra foi aquecida durante 5 minutos a 100°C, então despejada em 300 ml de água gelada. O sólido foi coletado, lavado com água seguido por éter e secado sob vácuo a 80°C para dar 738 mg de composto titular como um sólido castanho : espectro de massa (eletropulverização, m/e): M+H 345,9, p.f. = 180-183°C.
Exemplo 103
4-(lH-Benzotriazol-5-ilamino)-6,7-dietoxi-quinolina-3-carbonitrila
Uma solução de 1,07 mg (3,87 mM) de 4-cloro-6,7-dietoxiquinolina-3-carbonitrila e 675 mg (5,00 mM) de 5-aminobenzotriazol em 15 ml de 2-metoxietanol foi refluxada durante 3 horas. A solução quente, foi adicionado 1 ml de 1M de carbonato de sódio e a amostra foi aquecida durante 5 minutos a 100°C, então despejada em 300 ml de água gelada. A solução foi tomada acética por adição de HC1 concentrado e o sólido foi coletado, lavado com água seguido por éter e secado sob vácuo a 80°C. O sólido foi tomado em 200 ml de metanol e 500 pl de 5 N de hidróxido de sódio e fervido durante 20 minutos. A esta mistura heterogênea foram adicionados 100 ml de ácido acético glacial e o volume foi reduzido a um total de 100 ml por ebulição. A uma mistura em temperatura ambiente, 500 ml de água gelada foram adicionados e o sólido foi coletado, lavado com água seguido por éter e secado sob vácuo a 80°C para dar 738 mg de Name como um sólido marron : espectro de massa (eletropulverização, m/e): M+H 375,0, p.f. = decomposto a 115°C.
Exemplo 104
4-( 1,3 -Dioxo-2,3 -dihidro-1 H-isoindol-5-ilamino)-6,7-dietoxi-quinolina-3 carbonitrila
115
Uma solução de 400 mg (1,44 mM) de 4-cloro-6,7-dietoxiquinolina-3-carbonitrila e 305 mg (1,88 mM) de 4-aminoftalimida em 10 ml de etanol foi refluxada durante 3 horas. À solução quente, foi adicionado 1 ml de 1M de carbonato de sódio e a amostra foi aquecida durante 5 minutos a 100°C, então despejada em 300 ml de água gelada. O sólido foi coletado, lavado com água seguido por éter e secado sob vácuo a 80°C para dar 348 mg de 4-(l,3-dioxo-2,3-dihidro-lH-isoindol-5-ilamino)-6,7-dietoxi-quinolinacarbonitrila como um sólido amarelo : espectro de massa (eletropulverização, m/e): M+H 402,9, p.f. = 248-251°C.
Exemplo 105
4-(2,3-Dihidro-benzo Γ1.41 dioxin-6-ilamino)-6,7-dietoxi-quinolina-3carbonitrila
Uma solução de 400 mg (1,44 mM) de 4-cloro-6,7-dietoxiquinolina-3-carbonitrila e 232 mg (1,54 mM) de 1,4-benzodioxano-6-amina em 15 ml de 2-metoxietanol foi refluxada durante 3 horas. À solução quente, foi adicionado 1 ml de 1M de carbonato de sódio e a amostra foi aquecida durante 5 minutos a 100°C, então despejada em 300 ml de água gelada. O sólido foi coletado, lavado com água seguido por éter e secado sob vácuo a 80°C para dar 526 mg de 4-(2,3-dihidro-benzo [1.4] dioxin-6-ilamino)-6,7dietoxi-quinolina-carbonitrila como um sólido amarelo : espectro de massa (eletropulverização, m/e): M+H 402,9, p.f. = 225-227°C.
Exemplo 106
4-(lH-Indazol-6-ilamino)-6,7-bis-(2-metoxi-etoxi)-quinolina-3-carbonitrila
Uma solução de 400 mg (1,19 mM) de 4-cloro-6,7-(2metoxietoxi)-quinolina-3-carbonitrila e 174 mg (1,31 mM) de 6aminoindazol em 12 ml de 2-metoxietanol foi refluxada durante 3 horas. A solução quente, foi adicionado 1 ml de 1M de carbonato de sódio e a amostra foi aquecida durante 5 minutos a 100°C, então despejada em 300 ml de água gelada. O sólido foi coletado, lavado com água seguido por éter e secado sob
116 vácuo a 80°C para dar 362 mg de 4-(lH-indazol-6-ilamino)-6,7-bis-(2metoxi-etoxi)-quinolina-3-carbonitrila como um sólido laranja : espectro de massa (eletropulverização, m/e): M+H 434,0, p.f. = 105-110°C.
Exemplo 107
4-(l,4-Dioxo-l, 2, 3, 4-tetrahidro-ftalazin-6-ilamino)-6,7-dietoxi-quinolina3-carbonitrila
Uma solução de 400 mg (1,44 mM) de 4-cloro-6,7-dietoxiquinolina-3-carbonitrila e 273 mg (1,54 mM) de hidrato de 4aminoftalhidrazida em 15 ml de 2-metoxietanol foi refluxada durante 3 horas. À solução quente, foi adicionado 1 ml de 1M de carbonato de sódio e a amostra foi aquecida durante 5 minutos a 100°C, então despejada em 300 ml de água gelada. O sólido foi tomado acético por adição de HC1 concentrado e o sólido foi coletado, lavado com água seguido por éter e secado sob vácuo a 80°C. O sólido foi tomado em 200 ml de metanol e 500 μΐ de 5 N de hidróxido de sódio e fervido durante 20 minutos. A esta mistura heterogênea, foram adicionados 100 ml de ácido acético glacial e o volume foi reduzido a um total de 100 ml por ebulição. A uma mistura de temperatura ambiente, 500 ml de água gelada foram adicionados e o sólido foi coletado, lavado com água seguido por éter e secado sob vácuo a 80°C. O sólido foi digerido em 400 ml de etanol até o volume ter sido reduzido a 150 ml. A solução quente foi filtrada e o sólido foi lavado com etanol e secado sob vácuo a 80°C para dar 121 mg de composto titular como um sólido branco : espectro de massa (eletropulverização, m/e): M+H 418,0, p.f. = >270°C.
Exemplo 108 ó,7-Dietoxi-4-findan-5-ilamino)-guinolina-3-carbonitrila
Uma solução de 400 mg (1,44 mM) de 4-cloro-6,7-dietoxiquinolina-3-carbonitrila e 205 mg (1,54 mM) de 5-aminoindano em 12 ml de
2-metoxietanol foi refluxada durante 3 horas. À solução quente, foi adicionado 1 ml de 1M de carbonato de sódio e a amostra foi aquecida
117 durante 5 minutos a 100°C, então despejada em 300 ml de água gelada. O sólido foi coletado, lavado com água seguido por éter e secado sob vácuo a 80°C. O sólido marrom foi dissolvido digerido em 200 ml de etanol e o volume foi reduzido a 100 ml. O sólido foi isolado da solução quente e lavado com etanol seguido por éter e secado sob vácuo a 80°C para dar 435 mg de 6,7-dietoxi-4-(indan-5-ilamino)-quinolina-3-carbonitrila como um sólido marrom : espectro de massa (eletropulverização, m/e): M+H 374,0, p.f. =85-88°C.
Exemplo 109
4-(2,4-Dioxo-l,4-dihidro-2H-benzo fdl [1.31 oxazin-6-ilamino)-6,7-dietoxiquinolina-3 -carbonitrila
Uma solução de 400 mg (1,44 mM) de 4-cloro-6,7-dietoxiquinolina-3-carbonitrila, 274 mg (1,54 mM) de anidrido de 5-aminoisatóico em 161 mg (1,44 mM) de hidrocloreto de piridina em 15 ml de 2metoxietanol foi refluxada durante 3 horas. A solução quente foi filtrada e o sólido foi lavado com etanol e secado sob vácuo a 60°C para dar 482 mg de sal de HC1 de 4-(2,4-dioxo-l,4-dihidro-2H-benzo [d] [1,3] oxazin-6-ilamino)6,7-dietoxi-quinolina-3-carbonitrila como um sólido cinza : espectro de massa (eletropulverização, m/e): M+H 418,9, p.f. = >270°C.
Exemplo 110
6,7-Dietoxi-4-(l-oxo-indan-5-ilamino)-quinolina-3-carbonitrila
Uma solução de 400 mg (1,44 mM) de 4-cloro-6,7-dietoxiquinolina-3-carbonitrila, 227 mg (1,54 mM) de 6-amino-l-indanona em 161 mg (1,44 mM) de hidrocloreto de piridina em 12 ml de 2-metoxietanol foi refluxada durante 3 horas. A solução quente, foi adicionado 1 ml de 1M de carbonato de sódio e a amostra foi aquecida durante 5 minutos a 100°C, então despejada em 300 ml de água gelada. O sólido foi coletado, lavado com água seguido por éter e secado sob vácuo a 80°C para dar 483 mg de 6,7-dietoxi-4(l-oxo-indan-5-ilamino)-quinolina-3-carbonitrila como um sólido branco :
118 espectro de massa (eletropulverização, m/e): M+H 388,0, p.f. = decomposto a 263°C.
Exemplo 111
6,7-Dietoxi-4-(3-oxo-l,3-dihidro-isobenzofuran-5-ilamino)-quinolina-3carbonitrila
Uma solução de 400 mg (1,44 mM) de 4-cloro-6,7-dietoxiquinolina-3-carbonitrila, 230 mg (1,54 mM) de 6-aminoftaleto em 161 mg de hidrocloreto de piridina em 12 ml de 2-metoxietanol foi refluxada durante 3 horas. À solução quente, foi adicionado 1 ml de 1M de carbonato de sódio e a amostra foi aquecida durante 5 minutos a 100°C, então despejada em 300 ml de água gelada. O sólido foi coletado, lavado com água seguido por éter e secado sob vácuo a 80°C para dar 535 mg de 6,7-dietoxi-4-(3-oxo-l,3dihidro-isobenzofuran-5-ilamino)-quinolina-3-carbonitrila como um sólido branco : espectro de massa (eletropulverização, m/e): M+H 390,1, p.f. = 280284°C.
Exemplo 112
4-(1,1 -Dioxo- ΙΗ-benzo fbl tiofen-6-ilamino)-6,7-dietoxi-quinolina-3carbonitrila
Uma solução de 400 mg (1,44 mM) de 4-cloro-6,7-dietoxiquinolina-3-carbonitrila, 230 mg (1,54 mM) de 6-amino-l,l-dioxobenzo [b] tiofeno e 161 mg de hidrocloreto de piridina em 12 ml de 2-metoxietanol foi refluxada durante 6 horas. A solução quente, foi adicionado 1 ml de 1M de carbonato de sódio e a amostra foi aquecida durante 5 minutos a 100°C, então despejada em 300 ml de água gelada. O sólido foi coletado, lavado com água seguido por éter e secado sob vácuo a 80°C. O sólido foi dissolvido em acetona e secado sobre sílica gel sob vácuo elevado. Purificação do composto foi obtida por cromatografia usando um gradiente de 30% a 50% de acetona em hexano. O primeiro dos três componentes da mistura isolada da coluna foi o produto desejado. A remoção do solvente por evaporação deu 69 mg de 4119 (1,1 -dioxo- ΙΗ-benzo [b] tiofen-6-ilamino)-6,7-dietoxi-quinolina-3carbonitrila como um sólido amarelo : espectro de massa (eletropulverização, m/e): M+H 421,9, p.f. = 155-160°C.
Exemplo 113
4-(2,3-Dihidro-lH-indol-6-ilamino)-6,7-metoxi-quinolina-3-carbonitrila
Uma solução de 400 mg (1,61 mM) de 4-cloro-6,7-metoxiquinolina-3-carbonitrila e 366 mg (1,77 mM) de dihidrocloreto de 6aminoindolina em 12 ml de 2-metoxietanol foi refluxada durante 3 horas. A solução quente foi filtrada para isolar o sólido resultante que foi então lavado com água seguido por éter e secado sob vácuo a 80°C. O sólido foi dissolvido em 1 a 1 metanol e clorofórmio e secado sobre sílica gel sob vácuo elevado. Purificação do composto foi obtida por cromatografia usando um gradiente de 30% a 60% de acetona em hexano. O primeiro dos três componentes da mistura isolada da coluna foi o produto desejado. As frações de coluna foram reduzidas para um volume de 10 ml e então diluídas com 250 ml de hexano. O sólido resultante foi isolado, lavado com hexano e secado sob vácuo a 80°C para dar 16 mg de 4-(2,3-dihidro-lH-indol-6-ilamino)-6,7-metoxiquinolina-3-carbonitrila como um sólido castanho : espectro de massa (eletropulverização, m/e): M+H 347,0, p.f. = decomposto a 175°C.
Exemplo 114
4-(lH-Indol-5-ilamino)-6-nitro-quinolina-3-carbonitrila
Uma mistura de 5,00 g (21,5 mmol) de 4-cloro-6-nitro-3quinolina carbonitrila, 200 ml de etanol, e 3,40 g (25,8 mmol) de 5aminoindol foi aquecida a refluxo sob N2 durante 3,5 horas. Ela foi removida com calor, tomada básica com bicarbonato de sódio saturado e extraída com solventes, e azeotropo com etanol. Os sólidos foram coletados e lavados com hexano, então água. Os sólidos foram dissolvidos em 200 ml de acetato de etila, foi adicionado Darco e filtrados. Eles foram extraídos com solvente e secado em vácuo durante a noite (50 °C). Foram lavados duas vezes mais com
120 éter para remover o material de partida aminoindol. 4,372 g de sólido vermelho-marrom:
espectro de massa (eletropulverização, m/e): M+H = 330,2. Exemplo 115
7-Etoxi-4-(indazol-6-ilamino)-6-metoxi-quinolina-3-carbonitrila
Uma mistura de 500 mg (1,90 mmol) de 4-cloro-7-etoxi-6metoxi-quinolina-3-carbonitrila, 30 ml de etanol, e 304 mg (2,28 mmol) de 6aminoindazol foi aquecida a refluxo sob N2. O calor foi removido em 4 h e ela foi tomada básica com bicarbonato de sódio saturado. Foi extraída com solvente, colocada em suspensão com hexano, os sólidos foram coletados e secados. Foi lavada com água e secada em vácuo, dando 546 mg de sólido castanho : espectro de massa (eletropulverização, m/e): M+H = 359,9.
Exemplo 116
7-Benziloxi-4-cloro-6-metoxi-quinolina-3-carbonitrila
Um total de 500 mg (1,63 mM) de 7-benziloxi-4-hidroxi-6metoxi-quinolina-3-carbonitrila foi tomado em 3 ml de cloreto de oxalila (2M em CHCI3) e deixado permanecer durante 15 minutos seguido por refluxo durante 1 hora. A solução foi deixada resfriar e então diluída com 300 mg de hexano para dar um sólido verde. O sólido foi isolado e lavado com excesso de hexano e secado sob vácuo a 40°C para dar 586 mg de 7-benziloxi-4cloro-6-metoxi-quinolina-3-carbonitrila como sal de cloreto de hidrogênio. Este composto foi tomado imediatamente para a próxima etapa.
Exemplo 117
7-Benziloxi-4-(2,3-dihidro-lH-indol-6-ilamino)-6-metoxi-quinolina-3carbonitrila
Uma solução de 586 mg (1,60 mM) de 7-benziloxi-4-cloro-6metoxi-quinolina-3-carbonitrila, 560 mg (1,70 mM) de dihidrocloreto de sal de 6-aminoindolina e 208 mg (1,80 mM) de hidrocloreto de piridina em 13 ml de 2-metoxietanol foi refluxada durante 3 horas. A reação foi deixada
151
121 resfriar em temperatura ambiente e o sólido resultante foi isolado e lavado com excesso de etanol e secado sob vácuo a 80°C. O sólido resultante foi digerido em 300 ml de etanol e o volume foi reduzido para 100 ml. O sólido foi isolado da solução quente e o processo de digestão foi repetido uma segunda vez. O sólido foi uma vez mais isolado da solução quente para dar 206 mg de 7-benziloxi-4-(2,3-dihidro-lH-indol-6-ilamino)-6-metoxiquinolina-3-carbonitrila como um sólido castanho.
Exemplo 118
4-(2,3-Dihidro-lH-indol-6-ilamino)-7-hidroxi-6-metoxi-quinolina-3carbonitrila
A 5 ml de ácido trifluoroacético foram adicionados 206 mg de 7-benziloxi-4-(2,3-dihidro-lH-indol-6-ilamino)-6-metoxi-quinolina-3carbonitrila e a reação foi refluxada durante 1,5 horas. O TF A foi removido sob vácuo e a película resultante foi dissolvida em 7 ml de metanol seguido pela adição de 50 ml de bicarbonato de sódio saturado frio. A solução foi deixada permanecer a 10°C durante 1 hora. O sólido resultante foi isolado, lavado com excesso de água e secado sob vácuo a 80°C para dar 107 mg de 4-(2,3-dihidro-1 H-indol-6-ilamino)-7-hidroxi-6-metoxi-quinolina-3carbonitrila. Este composto foi tomado diretamente na próxima etapa sem purificação.
Exemplo 119
4-(2,3-dihidro-lH-indol-6-ilamino)-6-metoxi-7-(3-piridin-4-il-propoxi')quinolina-3-carbonitrila
122
A uma solução a 0° consistindo de 2 ml de clorofórmio, 1 ml de tetrahidrofurano, 167 mg (0,64 mM) de trifenil fosfina, 52 μΐ (0,40 mM) de 4-hidroxipropilpiridina e 107 mg (0,32 mM) de 4-(2,3-dihidro-1 H-indol-6ilamino)-7-hidroxi-6-metoxi-quinolina-3 -carbonitrila, foram lentamente adicionados 101 pL (0,64 mM) de DEAD. A reação foi deixada a 0°C durante 15 minutos e então deixada aquecer em temperatura ambiente. A solução heterogênea foi deixada agitar a temperatura ambiente durante 7 horas. TCL e ES MS não mostraram sinais de formação de produto. Mais 1 ml de clorofórmio e 500 mL de tetrahidrofurano foi adicionado e a reação foi refluxada durante 14 horas. Novamente não foram vistos sinais de formação de produto. O volume da reação foi reduzido a 1 ml por aquecimento e então levado a 4 ml por adição de tetrahidrofurano. Uma vez que a reação tinha resfriada a temperatura ambiente, e mais 80 mg (0,32 mM) de trifenil fosfina, 25 μΐ (0,20 mM) de 4-hidroxipropilpiridina foram adicionados, seguido pela adição lenta de 50 pL (0,32 mM) de DEAD. A reação rapidamente se tomou uma solução marrom claro. Depois de seis horas a temperatura ambiente, TLC e o espectro de massa mostraram que a reação estava completa, à mistura de reação, foram adicionados 10 ml de IN HC1 seguido por 20 ml de água. A solução foi extraída cinco vezes com porções de 25 ml de clorofórmio. A camada de água foi deixada permanecer durante três horas a temperatura ambiente e o sólido marrom resultante foi isolado por filtragem. O filtrado foi tratado com bicarbonato de sódio sólido até um sólido amarelo de solução. O precipitado foi isolado e lavado com excesso de água seguido por 1 ml de éter dietílico e secado sob vácuo a 80°C para dar 57 mg de 4-(2,3dihidro-lH-indol-6-ilamino)-6-metoxi-7-(3-piridin-4-il-propoxi)-quinolina-3carbonitrila como um sólido amarelo : espectro de massa (eletropulverização, m/e): 452,3 M+H, 226,7 M+2H/2, p.f. = 100-105°C.
Exemplo 120
Ester metílico de ácido 2,3-dihidro-benzo fl.41 dioxina-6-carboxílico
123 tS2?
Uma solução de 19,6 g (109 mmol) de ácido 2,3-dihidrobenzo [1,4] dioxina-6-carboxílico (J. Chem. Soc., 3445, 1957) em 400 mL de MeOH contendo 4 mL de H2SO4 foi refluxada durante a noite. Bicarbonato de sódio (18 g) foi adicionado, o solvente foi removido e o resíduo triturado várias vezes com Et2O. As lavagens foram combinadas, filtradas a MgSO4 anidro e evaporadas para dar 20,7 g de composto titular como um óleo amarelo pálido : espectro de massa (impacto de elétron, m/e): 194.
Exemplo 121
Éster metílico de ácido 7-nitro-2,3-dihidro-benzo [1,41 dioxina-6-carboxílico
Ácido nítrico (18 mL) foi adicionado em gotas a uma solução de 15,0 g (77,3 mmol) de éster metílico de ácido 2,3-dihidro-benzo [1,4] dioxina-6-carboxílico em 45 mL de HOAc. A solução foi aquecida a 60°C durante 1,5 horas. Mais 9 mL de HNO3 foi então adicionado e aquecimento foi continuado durante 1,5 horas a 70°C. A reação foi despejada em H2O-gelo e o produto sólido foi coletado, lavado bem com H2O e secado. Recristalização de heptano-tolueno deu 16,8 g de composto titular como cristais amarelos : espectro de massa (impacto de elétrons, m/e): 239.
Exemplo 122
Éster metílico de ácido 7-amino-2,3-dihidro-benzo [1,4] dioxina-6carboxílico
Uma mistura de 12,0 g (50,2 mmol) de éster metílico de ácido 7-nitro-2,3-dihidro-benzo [1,4] dioxina-6-carboxílico, 11,2 g (201 mmol) de Fe em pó e 13,3 g (257 mmol) de NH4CI em 175 ml de MeOH e 70 mL de H2O foi refluxada durante 5,5 horas. Mais 11,2 g de Fe e 13,3 g de NH4CI foi adicionado e a minutos foi aquecida durante mais 5,5 horas. Finalmente, 5,5 g de Fe e 6,5 g de NH4CI foram adicionados e a mistura foi aquecida durante 4 horas. A reação resfriada foi filtrada a Celite, o chumaço foi lavado bem com MeOH e o filtrado e lavagens foram combinadas. O solvente foi removido e o resíduo foi colocado em suspensão em H2O e coletado. O produto bruto foi
124 filtrado a sílica (CHCI3) para dar 9,5 g de composto titular como cristais castanhos : espectro de massa (eletropulverização, m/e): M+H 209,9.
Exemplo 123
9-Oxo-2, 3, 6, 9-tetrahidro-U,41 dioxino [2,3-g] quinolina-8-carbonitrila
Uma solução de 9,71 g (46,5 mmol) de éster metílico de ácido 7-amino-2,3-dihidro-benzo [1.4] dioxina-6-carboxílico e 11,1 g (92,9 mmol) de dimetilformamida dimetil acetal em 45 mL de DMF foi refluxada sob N3 durante 6 horas. O material volátil foi removido e o resíduo foi azeotropado com tolueno e secado a vácuo para dar a formamidina como um xarope roxo.
n-Butillítio (102 mmol) em hexano foi diluído com 70 mL de THF a-78°C sob N2. Uma solução de 4,31 g (105 mmol) de acetonitrila em 85 mL de THF foi adicionada durante 15 minutos e a solução foi agitada durante 25 minutos. A formamidina bruta foi dissolvida em 90 mL de THF e adicionada em gotas a uma solução fria durante 0,5 horas. Depois de agitar durante 1,25 horas, a reação foi resfriada bruscamente a-78°C com 13,4 mL de ácido acético. Ela foi deixada aquecer em temperatura ambiente e o material volátil foi removido a vácuo. O resíduo foi colocado em suspensão com H2O e o produto bruto foi coletado por filtragem, lavado com H2O e secado. O material sólido foi fervido com MeOH, coletado e secado a vácuo (50°C) para dar 7,62 g de composto titular como um pó castanho : espectro de massa (eletropulverização, m/e): M+H 228,8.
Exemplo 124
9-Cloro-2,3-dihidro Γ1.4] dioxino [2,3-g] quinolina-8-carbonitrila
Uma mistura de 7,06 g (31,0 mmol) de WAY 170839 e 35 mL de POCI3 foi refluxada durante 3,5 horas. O POCI3 foi removido e gelo-H2O foi adicionado seguido por NaHCO3 sólido a pH 8. O produto foi coletado, lavado bem com H2O e secado a vácuo para dar 7,42 g de 9-cloro-2,3-dihidro [1.4] dioxino [2.3-g] quinolina-8-carbonitrila como um sólido castanho : espectro de massa (eletropulverização, m/e): M+H 246,8.
125
Exemplo 125
9-(lH-Indazol-6-ilamino)-2,3-dihidro Γ1.41 dioxino [2.3-gl quinolina-8carbonitrila
Uma mistura de 1,00 g (4,07 mmol) de 9-cloro-2,3-dihidro [1.4] dioxino [2.3-g] quinolina-8-carbonitrila e 0,649 g (4,88 mmol) de 6aminoindazol em 25 mL de EtOH foi refluxada sob N2 durante 5,7 horas. NaHCC>3 saturado foi adicionado e o solvente foi removido. O resíduo foi colocado em suspensão com H2O, filtrado, lavado com H2O e EtOH frio e secado. O produto bruto foi fervido com EtOH, filtrado e secado a vácuo (50°C) para dar 1,06 g de 9-(lH-indazol-6-ilamino)-2,3-dihidro [1.4] dioxino[2.3-] quinolina-8-carbonitrila como cristais castanhos : espectro de massa (eletropulverízação, m/e): M+H 344,3.
Exemplo 126
6-Etoxi-4-(lH-indazol-6-ilamino)-7-metoxiquinolina-3-carbonitrila
Uma mistura de 1,00 g (3,82 mmol) de 4-cloro-6-etoxi-7metoxiquinolina-3-carbonitrila e 0,609 g (4,58 mmol) de 6-aminoindazol em 20 mL de EtOH foi refluxada sob N2 durante 8 horas. NaHCO3 saturado foi adicionado, o solvente foi removido e o resíduo foi azeotropado duas vezes com EtOH. O sólido foi colocado em suspensão com EtOH frio, coletado, lavado duas vezes com H2O e secado. Recristalização de EtOH deu 0,646 g de 6-etoxi-4-(lH-indazol-6-ilamino)-7-metoxiquinolina-3-carbonitrila como cristais castanhos : espectro de massa (eletropulverízação, m/e): M+H 359,9.
Exemplo 127
6,7-Dietoxi-4-(l-metil-2,5-dioxo-2, 3, 4, 5-tetrahidro-lH-benzo [e] [1.4] diazepin-7-ilamino)-quinolina-3-carbonitrila
Uma mistura de 0,5 g (1,8 mmol) de 4-cloro-6,7-dietoxiquinolina-3-carbonitrila, 0,35 g (1,8 mmol) de 7-amino-l-metil-2,5-dioxo-2, 3, 4, 5-tetrahidro-lH-benzo [e] [1.4] diazepina, e 0,21 g de hidrocloreto de piridina foi refluxado em etoxietanol durante 5 horas. O solvente foi
126 removido a pressão reduzida. O resíduo foi agitado com hidróxido de amônio e o material insolúvel foi coletado para dar 0,8 g de composto titular como cristais sólidos castanhos : espectro de massa (eletropulverização, m/e): M+H 446,0.
Exemplo 128
4-(lH-Indazol-6-ilamino)-6, 7, 8-trimetoxi-quinolina-3-carbonitrila
Uma mistura de 0,279 g de 4-cloro-6, 7, 8-trimetoxiquinolina-3-carbonitrila, 0,147 g de 6-aminoindazol, 0,020 de hidrocloreto de piridina, e 15 ml de etoxietanol foi agitada sob nitrogênio, e em temperatura de refluxo durante 1 hora. A mistura foi resfriada e adicionada a 100 ml de água. A esta mistura foi adicionado carbonato de sódio a pH 9. O produto foi coletado, lavado com água, e secado para dar 0,332 g de 4-(lH-indazol-6ilamino)-6, 7, 8-trimetoxi-quinolina-3-carbonitrila como um sólido, p.f. 243245°C; espectro de massa (EI, m/e): M 375,1331.
Exemplo 129
6,7-Dimetoxi-4-(4-metil-2-oxo-l,2-dihidro-quinolin-7-ilamino)-quinolina-3carbonitrila
Uma mistura de 0,249 g de 4-cloro-6,7-dimetoxi-quinolin-3carbonitrila, 0,174 g de carbostiril 124, 0,020 g de hidrocloreto de piridina, e 10 ml de etoxietanol foi agitada sob nitrogênio, e em temperatura de refluxo durante 30 minutos. A mistura foi resfriada e adicionada a 40 ml de água. A esta mistura, foi adicionado carbonato de sódio a pH 9. O produto foi coletado, lavado com água, e secado para dar 0,356 g de 6,7-dimetoxi-4-(4metil-2-oxo-l,2-dihidro-quinolin-7-ilamino)-quinolina-3-carbonitrila como um sólido, p.f. >300°C; espectro de massa (eletropulverização, m/e): M+H 387,1446.
Exemplo 130
6,7-Dimetoxi-4-(2-metil-benzotialzol-5-ilamino)-quinolina-3-carbonitrila
Uma mistura de 0,249 g de 4-cloro-6,7-dimetoxi-quinolin-3-
127 carbonitrila, 0,237 g de dihidrocloreto de 5-amino-2-metilbenzotiazol, 0,158 g de piridina, e 10 ml de etoxietanol foi agitada sob nitrogênio, em temperatura de refluxo durante 20 minutos. A mistura foi resfriada e adicionada a 40 ml de água. A esta mistura foi adicionado carbonato de sódio a pH 9. O produto foi coletado, lavado com água, e secado para dar 0,356 g de 6,7-dimetoxi-4-(2-metil-benzotiazol-5-ilamino)-quinolina-3-carbonitrila como um sólido, p.f. 118-120°C; espectro de massa (EI, m/e): M 376,0973.
Exemplo 131
6,7-Dimetoxi-4-f2-oxo-2,3-dihidro-benzotiazol-6-ilamino)-quinolina-3carbonitrila
Uma mistura de 0,249 g de 4-cloro-6,7-dimetoxi-quinolin-3carbonitrila, 0,166 g de 6-amino-2-benzotiazolinona, 0,020 g de hidrocloreto de piridina, e 10 ml de etoxietanol foi agitada sob nitrogênio, em temperatura de refluxo durante 20 minutos. A mistura foi resfriada e adicionada a 40 ml de água. A esta mistura foram adicionados carbonato de sódio e ácido clorídrico concentrado para ajustar a pH 7. O produto foi coletado, lavado com água, e secado para dar 0,326 g de 6,7-dimetoxi-4-(2-oxo-2,3-dihidrobenzotiazol-6-ilamino)-quinolina-3-carbonitrila como um sólido, p.f. 285287°C; espectro de massa (eletropulverização, m/e): M+El 379,0858.
Exemplo 132
6,7-Dimetoxi-4-(qumolin-5-ilamino)-quinolina-3-carbonitrila
Uma mistura de 0,249 g de 4-cloro-6,7-dimetoxi-quinolin-3carbonitrila, 0,288 g de 5-aminoquinolina, 0,020 g de hidrocloreto de piridina, e 10 ml de etoxietanol foi aquecida sob nitrogênio em um tubo selado a 200°C durante 2 horas. A mistura foi resfriada e adicionada a 100 ml de água. A esta mistura foi adicionado carbonato de sódio a pH 9. O produto foi coletado, lavado com água, e secado para dar 0,132 g de 6,7-dimetoxi-4(quinolin-5-ilamino)-quinolina-3-carbonitrila como um sólido, p.f. 115°C (decomposto); espectro de massa (EI, m/e): M 356,1276.
128
Exemplo 133
4-(Isoquinolin-5-ilamino)-6,7-dimetoxi-quinolina-3-carbonitrila
Uma mistura de 0,249 g de 4-cloro-6,7-dimetoxi-quinolin-3carbonitrila, 0,288 g de 5-aminoisoquinolina, 0,020 g de hidrocloreto de piridina, e 10 ml de etoxietanol foi aquecido sob nitrogênio em um tubo selado a 200°C durante 2 horas. A mistura foi resfriada e adicionada a 100 ml de água. A esta mistura foi adicionado carbonato de sódio a pH 9. O produto foi coletado, lavado com água, e secado para dar 0,100 g de 4-(isoquinolin-5ilamino)-6,7-dimetoxi-quinolina-3-carbonitrila como um sólido, p.f. 140°C (decomposto); espectro de massa (EI, m/e): M 356,1279.
Exemplo 134
6,7-Dimetoxi-4-(quinolin-8-ilamino)-quinolina-3-carbonitrila
Uma mistura de 0,249 g de 4-cloro-6,7-dimetoxi-quinolin-3carbonitrila, 0,288 g de 8-aminoquinolina, 0,020 g de hidrocloreto de piridina, e 10 ml de etoxietanol foi aquecida sob nitrogênio em um tubo selado a 200°C durante 2 horas. A mistura foi resfriada e adicionada a 100 ml de água. A esta mistura foi adicionado carbonato de sódio a pEI 9. O produto foi coletado, lavado com água, e secado para dar 0,167 g de 6,7-dimetoxi-4(quinolin-8-ilamino)-quinolina-3-carbonitrila como um sólido, p.f. 150°C (decomposto); espectro de massa (EI, m/e): M 356,1271.
Exemplo 135
4-(8-Hidroxi-quinolin-5-ilamino)-6,7-dimetoxi-quinolina-3-carbonitrila
Uma mistura de 0,249 g de 4-cloro-6,7-dimetoxi-quinolin-3carbonitrila, 0,233 g de dihidrocloreto de 5-amino-8-hidroxiquinolina, 0,158 g de piridina, e 10 ml de etoxietanol foi agitada sob nitrogênio, em temperatura de refluxo durante 2 horas. A mistura foi resfriada e adicionada a 40 ml de água. A esta mistura foi adicionado carbonato de sódio e ácido clorídrico concentrado para ajustar a pH 7. O produto foi coletado, lavado com água, e secado para dar 0,210 g de 4-(8-hidroxi-quinolin-5-ilamino)-6,7-
129 dimetoxi-quinolina-3-carbonitrila como um sólido, p.f. 150°C (decomposto); espectro de massa (EI, m/e): M 372,1228.
Exemplo 136
4-(lH-Indol-4-ilamino)-6,7-dimetoxi-quinolina-3-carbonitrila
Uma mistura de 0,249 g de 4-cloro-6,7-dimetoxi-quinolin-3carbonitrila, 0,132 g de 4-aminoindol, 0,020 g de hidrocloreto de piridina, e 10 ml de etoxietanol foi agitada sob nitrogênio, em temperatura de refluxo durante 2 horas. A mistura foi resfriada e adicionada a 40 ml de água. A esta mistura foi adicionado carbonato de sódio e ácido clorídrico concentrado para ajustar a pEl 7. O produto foi coletado, lavado com água, e secado para dar 0,249 g de 4-(lH-indol-4-ilamino)-6,7-dimetoxi-quinolina-3-carbonitrila como um sólido, p.f. 260°C (decomposto); espectro de massa (EI, m/e): M 344,1282.
Exemplo 137
4-(l-H-Indazol-5-ilamino)-6,7-dimetoxi-quinolina-3-carbonitrila
Uma mistura de 0,249 g de 4-cloro-6,7-dimetoxi-quinolin-3carbonitrila, 0,132 g de 5-aminoindazol, 0,020 g de hidrocloreto de piridina, e 10 ml de etoxietanol foi agitada sob nitrogênio, em temperatura de refluxo durante 2 horas. A mistura foi resfriada e adicionada a 40 ml de água. A esta mistura foi adicionado carbonato de sódio e ácido clorídrico concentrado para ajustar a pH 7. O produto foi coletado, lavado com água, e secado para dar 0,252 g de 4-(lH-indazol-5-ilamino)-6,7-dimetoxi-quinolina-3-carbonitrila como um sólido, p.f. 290-295°C; espectro de massa (EI, m/e): M 345,1217.
Exemplo 138
4-(l-H-Indazol-6-ilamino)-5,8-dimetoxi-quinolina-3-carbonitrila
Uma mistura de 0,148 g de 4-cloro-5,8-dimetoxi-quinolin-3carbonitrila, 0,093 g de 6-aminoindazol, e 5 ml de etoxietanol foi agitada sob nitrogênio, em temperatura de refluxo durante 30 minutos. A mistura foi resfriada e adicionada a 50 ml de água. A esta mistura foi adicionado
130 carbonato de sódio a pH 9. O produto foi coletado, lavado com água, secado, e lavado com 10 ml de acetato de etila-hexanos (4:1) para dar 0,189 g de 4(lH-indazol-6-ilamino)-5,8-dimetoxi-quinolina-3-carbonitrila como um sólido, p.f. 302-305°C; espectro de massa (EI, m/e): M 345,1223.
Exemplo 139
Hidrocloreto de 4-( 1 -H-indazol-6-ilamino)-7-metoxi-6-(3-morfolin-4-ilpropoxi)-quinolina-3-carbonitrila Uma mistura de 0,362 g de 4-cloro-7-metoxi-6-(3-morfolin-4il-propoxi))-quinolina-3-carbonitrila, 0,267 g de 6-aminoindazol, e 10 ml de etoxietanol foi agitada sob nitrogênio, em temperatura de refluxo durante 30 minutos. A mistura foi resfriada e adicionada a 50 ml de uma mistura de acetato de etila/acetona/metil álcool (5:5:2). O produto foi coletado, lavado com água, secado, e lavado com 10 ml de hexanos-acetato de etila (4:1) para dar 0,189 g de hidrocloreto de 4-(lH-indazol-6-ilamino)-7-metoxi-6-(3morfolin-4-il-propoxi)-quinolina-3-carbonitrila como um sólido, p.f. 100°C (decomposto); espectro de massa (eletropulverização, m/e): M+H 459,2146.
Exemplo 140
Hidrocloreto de 4-(3H-benzotriazol-5-ilamino)-7-metoxi-6-(3-morfolin-4-ilpropoxi)-quinolina-3-carbonitrila Uma mistura de 0,362 g de 4-cloro-7-metoxi-6-(3-morfolin-4il-propoxi))-quinolina-3-carbonitrila, 0,268 g de 5-aminobenzotriazol, e 10 ml de etoxietanol foi agitada sob nitrogênio, em temperatura de refluxo durante 30 minutos. A mistura foi resfriada e adicionada a 50 ml de uma mistura de acetato de etila/acetona/metil álcool (5:5:2). O produto foi coletado, lavado com água, secado, e lavado com 10 ml de hexanos-acetato de etila (4:1) para dar 0,142 g de hidrocloreto de 4-(3H-benzotriazol-6ilamino)-7-metoxi-6-(3-morfolin-4-il-propoxi)-quinolina-3-carbonitrila como um sólido, p.f. 260°C (decomposto); espectro de massa (eletropulverização, m/e): M+H 460,2096.
131
Exemplo 141
4-( 1 -H-Indazol 6-ilamino)-6-metoxi-quinolina-3-carbonitrila
A uma suspensão de 218,6 g de (1,0 mmol) de 4-cloro-6metoxi-3-quinolina carbonitrila e 159,8 mg (1,2 mmol) de 6-aminoindazol em 10 mL de 2-etoxietanol foram adicionados 115,6 mg (1,0 mmol) de hidrocloreto de piridina. A mistura de reação resultante foi refluxada durante 1 hora. Depois de resfriar, a maior parte de solvente foi evaporada e o resíduo foi diluído com éter. O precipitado foi coletado por filtragem e foi tomado em água. A suspensão aquosa foi neutralizada a PH 7-8 por adição de uma solução aquosa de carbonato de sódio saturada e agitada durante 15 minutos. O sólido separado foi filtrado e levado com água e éter. Depois de secar a vácuo, 297,5 mg (94,3%) do produto foram obtidos como um sólido amarelo profundo, p.f. >250°C, massa (eletropulverização, m/e): M+H 315,8. HRCIMS m/z: calculado 315,112 para CigH^NsO (M+), observado 315,1124
Exemplo 142
4-(3H-Benzotriazol-5-ilamino)-6-metoxi-quinolina-3-carbonitrila
Usando um procedimento análogo ao descrito no exemplo 141, 218,6 mg (1 mmol) de 4-cloro-6-metoxi-3-quinolina carbonitrila em 10 mL de 2-etoxietanol e na presença de 115,6 mg (1 mmol) de hidrocloreto de piridina foram reagidos com 161,0 mg (1,2 mmol) de 5-aminobenzotriazol para dar 302,9 mg (95,8%) do produto como um sólido amarelo, p.f. >250°C, massa (eletropulverização, m/e): M+H 316,9. HRCIMS calculado: 316,107 para CnH^NôO (M+), observado 316,1081
Exemplo 143
4-(lH-Indazol-6-ilamino)-7-metoxi-quinolina-3-carbonitrila
Usando um procedimento análogo ao descrito no exemplo 141, 200,0 mg (0,914 mmol) de 4-cloro-7-metoxi-3-quinolina carbonitrila em 10 mL de 2-etoxietanol e na presença de 105,6 mg (0,914 mmol) de hidrocloreto de piridina foram reagidos com 147,8 mg (1,1 mmol) de 6132 aminoindazol para dar 280,0 mg (97,3%) do produto como um sólido amarelo profundo, p.f. >250°C, massa (eletropulverização, m/e): M+H 315,9. HRCIMS calculado: 315,112 para C18H13N5O (M4), observado 315,1124.
Exemplo 144
4-f3H-Benzotriazol-5-ilamino)-7-metoxi-quinolina-3-carbonitrila
Usando um procedimento análogo ao descrito no exemplo 141, 218,6 mg (1,0 mmol) de 4-cloro-7-metoxi-3-quinolina carbonitrila em 10 mL de 2-etoxietanol e na presença de 115,6 mg (1,0 mmol) de hidrocloreto de piridina foi reagido com 161,0 mg (1,2 mmol) de 5aminobenzotriazol para dar 231,0 mg (73,1%) do produto como um sólido marrom claro, p.f. >250°C, massa (eletropulverização, m/e): M+H 316,9. HRCIMS: calculado: 316,107 para C17H12N6O (M4), observado 316,1063.
Exemplo 145
7-Hidroxi-4-(lH-indazol-6-ilamino)-quinolina-3-carbonitrila
Uma mistura de reação de 1,74 g (5,52 mmol) de 4-(lHindazol-6-ilamino)-7-metoxi-quinolina-3-carbonitrila e 15,3 g de hidrocloreto de piridina foi aquecida a 200-210°C durante 1,5 horas. Depois de resfriar, a mistura foi tomada em 3% de uma solução aquosa de NH4OH. O precipitado foi coletado por filtragem e lavado com água. Secagem a vácuo deu 1,66 g (63,8%) do produto como sólido marrom profundo, p.f. >25°C, massa (eletropulverização, m/e): M+H 301,9. HRCIMS: calculado: 302,1042 para C17H11N5O (M4), observado 302,1079.
Exemplo 146
4-(lH-Indol-5-ilamino)-7-metoxi-quinolina-3-carbonitrila
Usando um procedimento análogo ao descrito no exemplo 141, 1,0 g (4,57 mmol) de 4-cloro-7-metoxi-3-quinolina carbonitrila, 724,8 mg (5,48 mmol) de 5-aminoindol e 528,3 mg (4,57 mmol) de 5-aminoindol em 35 mL de 2-etoxietanol foi aquecido a 120°C durante 2 horas. O trabalho deu 1,38 g do produto como um sólido cinza esverdeado, p.f. >250°C, massa
133
É+3 (eletropulverização, m/e): M+H 314,9. HRCIMS: calculado: 314,117 para C19H14N4O (M+), observado 314,1135.
Exemplo 147
7-Hidroxi-4-(3H-benzotrizol-5-ilamino)-quinolina-3-carbonitrila
Usando um procedimento análogo ao descrito no exemplo 145, 1,45 g (4,58 mmol) de 4-(3H-benzotrizol-5-ilamino)-7-metoxiquinolina-3-carbonitrila e 10 g de hidrocloreto de piridina foram aquecidos durante 1 hora. O trabalho deu 1,04 g (75,4%) do produto como um sólido marrom escuro, p.f. >250°C, massa (eletropulverização, m/e): M+H 303,3. HRCIMS: calculado: 301,0838 para Ci6Hi0N6O (ΜΓ), observado 301,10833.
Exemplo 148
4-(lH-Indazol-6-ilamino)-8-metoxi-quinolina-3-carbonitrila
Usando um procedimento análogo ao descrito no exemplo 141, 328,0 mg (1,5 mmol) de 4-cloro-8-metoxi-3-quinolina carbonitrila,
219,7 mg (1,65 mmol) de 6-aminoindazol e 105,6 mg (173,3 mmol) de hidrocloreto de piridina em 15 mL de 2-etoxietanol foram aquecidos a 100°C durante 2 horas. O trabalho deu 373,8 mg (79%) do produto como um sólido amarelo, p.f. 242°C (dec.), massa (eletropulverização, m/e): M+H 315,9. HRCIMS: calculado: 315,112 para Ci8Hi3N5O (M+), observado 315,1126.
Exemplo 149
4-(3H-Benzotriazol-5-ilamino)-8-metoxi-quinolina-3-carbonitrila
Usando um procedimento análogo ao descrito no exemplo 141, 218,6 mg (1 mmol) de 4-cloro-8-metoxi-3-quinolina carbonitrila, 161,0 mg (1,2 mmol) de 5-aminobenzotriazol e 115,6 mg (1 mmol) de hidrocloreto de piridina em 10 mL de 2-etoxietanol foram aquecidos a 100°C durante 1 hora. O trabalho deu 213,5 mg (67,6%) do produto como um sólido amarelo, p.f. >250°C, massa (eletropulverização, m/e): M+H 316,9. HRCIMS: calculado: 316,107 para CnH^NôO (M+), observado 316,1079.
Exemplo 150
134
4-(lH-Indol-5-ilamino)-6,7-dimetoxi-quinolina-3-carbonitrila
Usando um procedimento análogo ao descrito no exemplo 141, 248,7 mg (1 mmol) de 4-cloro-6,7-dimetoxi-3-quinolina carbonitrila, 158,6 mg (1,2 mmol) de 5-aminoindol e 115,6 mg (1 mmol) de hidrocloreto de piridina em 10 mL de 2-etoxietanol foram refluxados durante 0,5 horas. O trabalho deu 338,7 mg (98,5%) do produto como um sólido amarelo, p.f. >250°C, massa (eletropulverização, m/e): M+H 344,9. HRCIMS: calculado: 344,127 para C2oH16N402 (M+), observado 344,1277.
Exemplo 151
4-flH-Benzoimidazol-5-ilamino)-6,7-dimetoxi-quinolina-3-carbonitrila
Usando um procedimento análogo ao descrito no exemplo 150, 248,7 mg (1 mmol) de 4-cloro-6,7-dimetoxi-3-quinolina carbonitrila,
159,8 mg (1,2 mmol) de 5-aminobehzoimdazol e 115,6 mg (1 mmol) de hidrocloreto de piridina em 10 mL de 2-etoxietanol foram refluxados durante 1 hora. O trabalho deu 233,6 mg (67,7%) do produto como um sólido marrom, p.f. 230°C (dec.), massa (eletropulverização, m/e): M+H 345,9. HRCIMS: calculado: 346,1304 para Ci9Hi5N5O2 (M1), observado 346,1325.
Exemplo 152
6,7-Dimetoxi-4-(2-metil-lH-benzoimidazol-5-ilamino)-quinolina-3carbonitrila
Usando um procedimento análogo ao descrito no exemplo 150, 248,7 mg (1 mmol) de 4-cloro-6,7-dimetoxi-3-quinolina carbonitrila, 294,4 mg (2,0 mmol) de 2-metil-5-aminobenzimidazol e 115,6 mg (1 mmol) de hidrocloreto de piridina em 10 mL de 2-etoxietanol foram refluxados durante 4 horas. O trabalho deu 220,2 mg (61,3%) do produto como um sólido de areia colorida , p.f. 207°C (dec.), massa (eletropulverização, m/e): M+H 359,9. HRCIMS: calculado: 359,138 para C2oHi7N502 (M+), observado 359,1403.
Exemplo 153
135
6,7-Dimetoxi-4-(quinolina-6-ilamino)-quinolina-3-carbonitrila
Usando um procedimento análogo ao descrito no exemplo 150, 248,7 mg (1 mmol) de 4-cloro-6,7-dimetoxi-3-quinolina carbonitrila,
173,8 mg (1,2 mmol) de 6-aminoquinolina e 115,6 mg (1 mmol) de hidrocloreto de piridina em 15 mL de 2-etoxietanol foram refluxados durante 6 horas. O trabalho deu 212,5 mg (59,5%) do produto como um sólido laranja, p.f. 241-243°C, massa (eletropulverização, m/e): M+H 356,8. HRCIMS: calculado: 356,127 para C2oH17N502 (M4), observado 356,1275.
Exemplo 154
4-(4-Cloro-naftalen-l-ilamino)-6,7-dimetoxi-quinolina-3-carbonitrila
Usando um procedimento análogo ao descrito no exemplo 150, 248,7 mg (1 mmol) de 4-cloro-6,7-dimetoxi-3-quinolina carbonitrila, 213,2 mg (1,2 mmol) de l-amino-4-cloronaftaleneno e 115,6 mg (1 mmol) de hidrocloreto de piridina em 12 mL de 2-etoxietanol foram refluxados durante a noite. O trabalho deu 290,1 mg (74,4%) do produto como um sólido verde amarelado, p.f. >250°C, massa (eletropulverização, m/e): M+H 390,2. HRCIMS: calculado: 389,093 para C22H16N3O2C1 (M4), observado 389,0938.
Exemplo 155
6,7-Dimetoxi-4-(5, 6, 7, 8-tetrahidro-naftalen-l-ilamino)-quinolina-3carbonitrila
Usando um procedimento análogo ao descrito no exemplo 150, 248,7 mg (1 mmol) de 4-cloro-6,7-dimetoxi-3-quinolina carbonitrila, 176,7 mg (1,2 mmol) de l-amino-5, 6, 7, 8-tetrahidronaftaleno e 115,6 mg (1 mmol) de hidrocloreto de piridina em 12 mL de 2-etoxietanol foram refluxados durante 2 horas. O trabalho deu 195,1 mg (54,3%) do produto como um sólido amarelo, p.f. 248°C (dec.), massa (eletropulverização, m/e): M+H 360,1. HRCIMS: calculado: 359,163 para C22H16N3O2C1 (M+), observado 359,1632.
Exemplo 156
136
4-(3H-Benzotriazol-5-ilamino)-6, 7, 8-trimetoxi-quinolina-3-carbonitrila
Usando um procedimento análogo ao descrito no exemplo 150, 278,7 mg (1 mmol) de 4-cloro-6,7-dimetoxi-3-quinolina carbonitrila, 161,3 mg (1,2 mmol) de 5-aminobenzotriazol e 115,6 mg (1 mmol) de hidrocloreto de piridina em 10 mL de 2-etoxietanol foram refluxados durante 10 minutos. O trabalho deu 246,3 mg (65,4%) do produto como um sólido amarelo, p.f. 205°C (dec.), massa (eletropulverização, m/e): M+H 376,9. HRCIMS: calculado: 376,128 para Ci9Hi6N6O3 (M), observado 376,1264.
Exemplo 157
4-( 1 H-Indazol-6-ilamino)-6-metoxi-7- F2-f 4-metil-piperazin-1 -il)-etoxilquinolina-3 -carbonitrila
Uma mistura de reação de 196,5 mg (0,5 mmol) de 7-(2-cloroetoxi)-4-(lH-indazol-6-ilamino)-6-metoxi-quinolina-3-carbonitrila, 500,9 mg (5 mmol) de 1-metilpiperazina e 74,5 mg (0,5 mmol) de iodeto de sódio em 10 mL de DME foi aquecida a 135°C durante 15 horas sob N2 em um tubo selado. Depois de resfriar, o solvente foi removido e o resíduo foi tomado em 15 mL de salmoura. A solução aquosa foi extraída com 15% de metanol/cloreto de metileno. O solvente orgânico foi secado sobre Na2SO4 e filtrado. A remoção do solvente deu o sólido de produto bruto. Purificação do produto bruto em TLC preparativo (revelação de solvente : 15% de metanol/cloreto de metileno) para dar um sólido de espuma amarelo. Trituração do sólido de espuma com éter deu 117,9 mg (51,6%) do produto como sólido amarelo, p.f. 179°C (dec.), massa (eletropulverização, m/e): M+H 458,0.
Exemplo 158
7-12- [Y2-Hidroxi-etil)-aminol -etoxi 1-4(1 H-indazol-6-ilamino)-6-metoxiquinolina-3 -carbonitrila
Usando um procedimento análogo ao descrito no exemplo 157, 196,5 mg (0,5 mmol) de 7-(2-cloro-etoxi)-4-(lH-indazol-6-ilamino)-6-
137 metoxi-quinolina-3-carbonitrila, 375,6 mg (5,0 mmol) de 2-(metilamino)etanol e 75,0 mg (0,5 mmol) de iodeto de sódio em 5 mL de DME foram aquecidos a 135°C durante 15 horas. O trabalho deu 116,4 mg (54,0%) do produto como um sólido amarelo, p.f. 179°C (dec.), massa (eletropulverização, m/e): M+H 433,0.
Exemplo 159
7-{2-rBis-(2-hidroxi-etil)-aminol-etoxil--4-(lH-indazol-6-ilamino)-6-metoxiquinolina-3 -carbonitrila
Usando um procedimento análogo ao descrito no exemplo 157, 196,5 mg (0,5 mmol) de 7-(2-cloro-etoxi)-4-(lH-indazol-6-ilamino)-6metoxi-quinolina-3-carbonitrila, 525,7 mg (5,0 mmol) de dietanolamina e 75,0 mg (0,5 mmol) de iodeto de sódio em 6 mL de DME foram aquecidos a 135°C durante 15 horas. O trabalho deu 109,1 mg (47,2%) do produto como um sólido amarelo, p.f. 150°C (dec.), massa (eletropulverização, m/e): M+H 463,0.
Exemplo 160
7-r2-(4-Hidroxi-piperidin-l-il)-etoxil-4-(-indazol-6-ilamino)-6-metoxiquinolina-3 -carbonitrila
Usando um procedimento análogo ao descrito no exemplo 157, 196,5 mg (0,5 mmol) de 7-(2-cloro-etoxi)-4-(lH-indazol-6-ilamino)-6metoxi-quinolina-3-carbonitrila, 505,8 mg (5,0 mmol) de 4-hidroxipiperidina e 75,0 mg (0,5 mmol) de iodeto de sódio em 5 mL de DME foram aquecidos a135°C durante 16 horas. O trabalho deu 97,9 mg (42,8%) do produto como um sólido branco indefinido, p.f. 174°C (dec.), massa (eletropulverização, m/e): M+H 459,0.
Exemplo 161
7-{2-r(4-(2-Hidroxi-etil)-piperazin-l-il)-etoxi1-4-(lH-indazol-6-ilamino)-6metoxi-quinolina-3-carbonitrila
Usando um procedimento análogo ao descrito no exemplo
138
157, 196,5 mg (0,5 mmol) de 7-(2-cloro-etoxi)-4-(lH-indazol-6-ilamino)-6metoxi-quinolina-3-carbonitrila, 651,0 mg (5,0 mmol) de 1-(2-hidroxietil) piperazina e 75,0 mg (0,5 mmol) de iodeto de sódio em 5 mL de DME foram aquecidos a 135°C durante 16 horas. O trabalho deu 90,5 mg (37,1%) do produto como um sólido amarelo, p.f. 174°C (dec.), massa (eletropulverização, m/e): M+H 488,0.
Exemplo 162
7-(2-(1,4 Dioxa-8-aza-spiro [4.51 dec-8-il)-etoxil-4-(lH-indazol-6-ilamino)6-metoxi-quinolina-3-carbonitrila
Usando um procedimento análogo ao descrito no exemplo 157, 196,5 mg (0,5 mmol) de 7-(2-cloro-etoxi)-4-(lH-indazol-6-ilamino)-6metoxi-quinolina-3-carbonitrila, 716,0 mg (5,0 mmol) de l,4-dioxa-8-azapiro [4.5] decano e 75,0 mg (0,5 mmol) de iodeto de sódio em 5 mL de DME foram aquecidos a 135°C durante 16 horas. O trabalho deu 173,1 mg (69,2%) do produto como um sólido branco indefinido, p.f. 245°C (dec.), massa (eletropulverização, m/e): M+H 501,0.
Exemplo 163
4-(lH-Indazol-6-ilamino)-6-metoxi-7-(2-tiomorfolin-4-il-etoxi)-quinolina-3carbonitrila
Usando um procedimento análogo ao descrito no exemplo 157, 173,0 mg (0,44 mmol) de 7-(2-cloro-etoxi)-4-(lH-indazol-6-ilamino)-6metoxi-quinolina-3-carbonitrila, 454,0 mg (4,4 mmol) de tiomofolina e 66,0 mg (0,44 mmol) de iodeto de sódio em 4 mL de DME foram aquecidos a 135°C durante 16 horas. O trabalho deu 108,4 mg (53,5%) do produto como um sólido amarelo claro, p.f. 213-215°C., massa (eletropulverização, m/e): M+H 461,0.
Exemplo 164
7-[2-([ 1.31 Dioxolan-2-ilmetil-metil-amino)-etoxil-4-(lH-indazol-6-ilamino)6-metoxi-quinolina-3-carbonitrila
139
Usando um procedimento análogo ao descrito no exemplo 157, 173,0 mg (0,44 mmol) de 7-(2-cloro-etoxi)-4-(lH-indazol-6-ilamino)-6metoxi-quinolina-3-carbonitrila, 515,5 mg (4,4 mmol) de 2-([1.3]-dioxolan-2ilmetil-metilamina e 66,0 mg (0,44 mmol) de iodeto de sódio em 4 mL de DME foram aquecidos a 135°C durante 16 horas. O trabalho deu 136,1 mg (65,2%) do produto como um sólido amarelo, p.f. 185-187°C., massa (eletropulverização, m/e): M+H 475,1.
Exemplo 165
7-r2-(3,4-Dihidro-lH-isoquinolin-2-il)-etoxil-4-(lH-indazol-6-ilamino)-6metoxi-quinolina-3-carbonitrila
Usando um procedimento análogo ao descrito no exemplo 157, 173,0 mg (0,44 mmol) de 7-(2-cloro-etoxi)-4-(lH-indazolr6-ilamino)-6metoxi-quinolina-3-carbonitrila, 586,0 mg (4,4 mmol) de 1, 2, 3, 4tetrahidroisoquinolina e 66,0 mg (0,44 mmol) de iodeto de sódio em 4 mL de DME foram aquecidos a 135°C durante 16 horas. O trabalho deu 109,3 mg (50,6%) do produto como um sólido amarelo, p.f. 170-173°C., massa (eletropulverização, m/e): M+H 491,0.
Exemplo 166
7-(2-Cloroetoxi)-4-(lH-indazol-6-ilamino)-6-metoxiquinolina-3-carbonitrila
Uma mistura de 0,50 g (1 equivalente) de 7-(2-cloro-etoxi)-4cloro-6-metoxi-quinolina-3-carbonitrila, 0,25 g (1,1 equivalentes) de 6aminoindazol, 0,22 g (1,1 equivalentes) de hidrocloreto de piridina e 15 ml de 2-metoxietanol foi aquecida em 120°C em banho de óleo durante 2 horas. O progresso de reação foi monitorado por cromatografia de camada fina (acetona/hexano 1:1). Depois de 2 horas, a mistura de reação foi resfriada em temperatura ambiente, um total de 25 ml de 1M de bicarbonato de sódio foi adicionado e a reação foi agitada durante 1 hora. O precipitado resultante foi coletado, lavado com água e secado in vacuo a 60°C durante a noite para dar 0,645 g (97%) do produto desejado. :espectro de massa (eletropulverização,
140 m/e): M+H = 393,9 (M+H)+; Análise calculada para C20H16CIN5O2: 2 H2O: Calculado C: 55,88; H: 4,69; N: 16,29; Encontrado C: 55,63; H: 4,78; N: 15,24.
Exemplo 167
7-f 2-Dimetilaminoetoxi)-4-f 1 H-indazol-6-ilamino)-6-metoxiquinolina-3 carbonitrila
Uma mistura de 0,67 g (1 equivalente) de 7-(2-cloroetoxi)-4(lH-indazol-6-ilamino)-6-metoxiquinolina-3-carbonitrila, 0,097 g (0,4 equivalente) de iodeto de sódio e 15 ml de 2M de dimetilamina em tetrahidrofurano foi aquecida a 135°C durante 14 horas em um tubo selado. A mistura de reação foi diluída com acetato de etila, lavada com bicarbonato de sódio saturado, a camada orgânica foi secada sobre sulfato de magnésio e concentrada para dar 0,50 g. O produto bruto foi purificado por cromatografia (Sílica gel: acetato de etila, acetato de etila/metil álcool/trietilamina 6:4:0,1) para dar 0,312 g (46%) de produto puro.
P.F. 218-219°C: espectro de massa (eletropulverização, m/e):
M+H = 402,9.
Exemplo 168
4-(lH-Indazol-6-ilamino)-6-metoxi-7-(2-morfolin-4-il-etoxi) quinolina-3carbonitrila
O composto titular foi preparado pelo procedimento do exemplo 167 usando 0,616 g de 7-(2-cloroetoxi)-4-(lH-indazol-6-ilamino)-6metoxiquinolina-3-carbonitrila, 0,094 de iodeto de sódio e 2,03 ml de morfolina para dar depois purificação por cromatografia (Sílica gel: acetato de etila, acetato de etila/metil álcool/trietilamina 6:4:0,1) 0,196 g (28%) de produto desejado. P.F. 133-135°C: espectro de massa (eletropulverização, m/e): M+H = 445,0.
Exemplo 169
4-(3H-Benzotriazol-5-ilamino)-7-(2-cloroetoxi)-6-metoxiquinolina-3141 carbonitrila
O composto titular foi preparado pelo procedimento do exemplo 166 usando 0,442 g de 7-(2-cloro-etoxi)-4-cloro-6-metoxiquinolina-3-carbonitrila, 0,22 g de 5-aminobenzotriazol, 0,190 g de hidrocloreto de piridina e 15 ml de 2-metoxietanol para dar 0,48 g (82%) de produto desejado : espectro de massa (eletropulverização, m/e): M+H = 394,8.
Exemplo 170
7-(3-Cloropropoxi)-4-(lH-indazol-6-ilamino)-6-metoxiquinolina-3carbonitrila
O composto titular foi preparado pelo procedimento do exemplo 166 usando 0,311 g de 7-(3-cloro-propoxi)-4-cloro-6-metoxiquinolina-3-carbonitrila, 0,147 g de 6-aminoimidazol, 0,128 g de hidrocloreto de piridina e 12 ml de etoxietanol para dar 0,367 g (90%) de produto desejado. P.F. 280-285°C : espectro de massa (eletropulverização, m/e): M+H - 407,9.
Exemplo 171
4-( 1 H-Indazol-6-ilamino)-6-metoxi-7-(3 -morfolin-4-ilpropoxi) quinolina-3 carbonitrila
O composto titular foi preparado pelo procedimento do exemplo 167 usando 0,408 g de-(3-cloropropoxi)-4-(lH-indazol-6-ilamino)6-metoxiquinolina-3-carbonitrila, 1,4 ml de morfolina, 0,060 g de iodeto de sódio e 12 ml de éter dimetílico etileno glicol para dar 0,255 g (56%) de produto desejado. P.F. 143-145°C; HRMS: C25H26N6O3: m/z 458,2084; δ (um)-1,7.
Exemplo 172
4-r3-Cloro-4-( 1 -metil-2-imidazoliltio) fenilaminol-6,7-dietoxi-3-quinolina carbonitrila
Como no exemplo 141 reação de 4-cloro-6,7-dietoxi-3-
142 quinolina-carbonitrila com 3-cloro-4-(l-metil-2-imidazoliltio) anilina (WO9615118) deu o composto titular como um sólido castanho, p.f. 285-290°C.
Exemplo 173
4-Γ3-Cloro-4-( 1 -metil-2-imidazoliltio) fenilamino]-6,7-dimetoxi-3 -quinolina carbonitrila
Como no exemplo 141 reação de 4-cloro-6,7-dimetoxi-3quinolina-carbonitrila com 3-cloro-4-(l-metil-2-imidazoliltio) anilina (WO9615118) deu o composto titular como um sólido branco, p.f. 302-307°C.
Exemplo 174
4-r3-Cloro-4-(l-metil-lH-imidazol-2-ilsulfanil)-fenilamino1-6-nitroquinolina-3-carbonitrila
Uma mistura de 5,00 g (21,5 mmol) de 4-cloro-6-nitro-3quinolina carbonitrila, 250 ml de etanol, e 6,18 g (25,8 mmol) de 3-cloro-4(1-metil-lH-imidazol-2-ilsulfanil)-anilina (WO-9615118) foi aquecida a refluxo sob N2. Foi removida com calor em 3 horas Vz e tomada básica com uma solução de bicarbonato de sódio saturado. Os solventes foram extraídos e azeotropados com etanol. O resíduo foi colocado em suspensão com hexano e os sólidos coletados. Eles foram lavados com água, secados a vácuo. Os sólidos foram fervidos em hexano para remover anilina em excesso, e secados ao ar. Eles foram fervidos em 2 L de acetato de etila, e devido à insolubilidade extrema, os sólidos foram coletados e secados a vácuo, dando 5,90 g de sólido amarelo: espectro de massa (eletropulverização, m/e): M+H = 437,2,439,1.
Exemplo 175
6-Amino-4- Γ 3 -cloro-4-( 1 -metil-1 H-imidazol-2-ilsulfanil)-fenilamino] quinolina-3-carbonitrila
Uma mistura de 5,734 g (13,1 mmol) de 4-[3-cloro-4-(l-metillH-imidazol-2-ilsulfanil)-fenilamino]-6-nitro-quinolina-3-carbonitrila, 250 ml de etanol, e 14,83 g (65,6 mmol) de cloreto de estanho diidratado foi
143 aquecida a refluxo sob N2. Ela foi removida com calor a 2 horas Vi e adicionada em um volume grande de água gelada. Ela foi tomada básica com bicarbonato de sódio e agitada durante 2 horas. Com a mistura ainda básica, ela foi extraída com clorofórmio, a camada orgânica foi agitada com Darco, secada com sulfato de sódio e filtrada. O solvente foi extraído e secado a vácuo, dando 2,86 g de sólido amarelo-marrom: espectro de massa (eletropulverização, m/e): M+H = 407,3, 409,3.
Exemplo 176
N- f 4- Γ3 -Cloro-4-( 1 -metil-1 H-imidazol-2-ilsulfanil)-fenilaminol -3 -cianoquinolin-6-il 1 -acrilamida
Foi dissolvida a maior parte de 1,00 g (2,46 mmol) 6-amino-4[3-cloro-4-(l-metil-lH-imidazol-2-ilsulfanil)-fenilamino]-quinolina-3carbonitrila em 3,5 ml de DMF quente, foram adicionados 12 ml de THF e resfriados a 0°C. Foram adicionados 377 μΐ de trietil amina e 225 μΐ (2,70 mmol) de cloreto de acriloíla. O banho de gelo foi removido em 15 minutos e extraído com solvente em 2 horas. O resíduo foi colocado em suspensão em água, sólidos coletados e secados ao ar durante a noite. Ele foi fervido em acetato de etila, os sólidos coletados e secados a vácuo, dando 670 mg de sólido amarelo-marrom: espectro de massa (eletropulverização, m/e): M+H =
461,1,462,2.
Exemplo 177
6-Amino-4-flH-indol-5-ilamino)-quinolina-3-carbonitrila
Foram cobertos 200 mg de 10% de paládio em carbono com 75 ml de etanol. Foram adicionados 2,00 g (6,07 mmol) de 4-(lH-indol-5ilamino)-6-nitro-quinolina-3-carbonitrila e 477 μΐ (15,2 mmol) de hidrazina. Aqueceu-se em refluxo sob N2 durante 2 horas. Foram filtrados a quente através de celite e lavados com metanol quente. O solvente foi removido e secado a vácuo (50°C), dando 1,89 g de sólido marrom : espectro de massa (eletropulverização, m/e): M+H = 300,2.
144
Exemplo 178
3-Cloro-4-(l ,3-tiazol-2-ilsulfanil) anilina
A uma suspensão de 3,8 g de hidreto de sódio (60% em óleo mineral) em 100 ml de dimetilformamida foi adicionada lentamente uma solução de 10,0 g de 2-mercapto tiazol em 100 ml de dimetilformamida. Depois de 15 minutos, uma solução de 15,0 g de 3-cloro-4-fluoro nitrobenzeno em 50 ml de dimetilformamida foi adicionada. Depois de 4 horas, a mistura foi despejada em água. O sólido resultante foi coletado, lavado com água, e secado a vácuo. Este material foi mecanicamente agitado em refluxo em uma mistura de 830 ml de metanol, 230 ml de água, 37,0 g de cloreto de amônio, e 30,1 g de pó de ferro durante 4 horas. A mistura em ebulição foi filtrada. O solvente foi removido do filtrado e o resíduo foi extraído com acetato de etila quente. A solução de acetato de etila foi filtrada a uma coluna de sílica gel curta. O solvente foi removido e o resíduo foi recristalizado de éter hexano dando 17,7 g de um sólido branco indefinido : espectro de massa (eletropulverização, m/e): M+H 243,1.
Ao usar um procedimento similar ao descrito acima, os seguintes intermediários necessários para preparar alguns dos compostos desta invenção podem ser feitos.
-cloro-4-( 1 H-imidazol-1 -il) anilina
2-[(4-amino-2-clorofenil) sulfanil]-4-(3H)-quinazolinona
N-(4-amino-2-clorofenil)-N-(3-piridinilmetil) acetamida
2- cloro-N-l-[5-(trifluorometil)-l, 3, 4-tiadiazol-2-il]-l,4benzenodiamina
3- cloro-4-[(4,6-dimetil-2-pirimidinil) sulfanil] anilina
3- cloro-4-[(4-metil-2-pirimidinil) sulfanil] anilina
4- [(4-fenil-l,3-tiazol-2-il) sulfanil]-3-(trifluorometil) anilina
4-[(4-fenil-l,3-tiazol-2-il) sulfanil]-3-(cloro) anilina
Exemplo 179
145
-(2-Cloro-4-aminobenzil)-1 H-imidazol
Uma solução de 10 g de 4-bromometil-3-cloro nitrobenzeno e 5,44 g de imidazol em 125 ml de tetrahidrofurano foi refluxada durante 4 horas. O solvente foi removido e o resíduo foi dissolvido em acetato de etila.
A solução foi lavada com água e secada sobre sulfato de magnésio. O solvente foi removido e o resíduo foi extraído várias vezes com éter. Os extratos éter foram diluídos com dois volumes de hexanos. 1-(2-Cloro-4nitrobenzil)-lH-imidazol (4,3 g) cristalizado como um sólido branco. Uma porção de 4 gramas deste material foi mecanicamente agitada em refluxo com
153 ml de metanol, 52 ml de água, 8,1 g de cloreto de amônio, e 6,6 g de pó de ferro durante 2 horas. A mistura quente foi filtrada e os sólidos foram lavados com misturas de metanol-tetrahidrofurano quente. Os solventes foram removidos a partir dos filtrados combinados. O resíduo foi extraído várias vezes com acetato de etila quente. A solução de acetato de etila foi tratada com sulfato de magnésio e carvão ativado. A filtragem e remoção do solvente deram 3,9 g de composto titular.
Ao usar os processos descritos nos exemplos 1-179 acima e os processos descritos nos pedidos da patente WO-98/43960 e WO-99/09016, os compostos desta invenção listados na tabela 5 foram preparados.
146
Tabela 5
| Exemplo | Composto | P.f. CC) | espectro de massa |
| 180 | 4-(2-Hidroxi-naftalen-1 -ilamino)-6,7-dimetoxiquinolina-3-carbonitrila | 240 dec | 371,9 (M+H) |
| 181 | 4-(2, 3-Dihidro-benzo [1.4] dioxin-6-ilamino)6,7-dimetoxi-quinolina-3 -carbonitrila | 200-201 | 364,0 (M+H) |
| 182 | 4-(2-Mercapto-benzotiazol-6-ilamino)-6,7dimetoxi-quinolina-3 -carbonitrila | >255 dec | 394,8 (M+H) |
| 183 | 4-(6-Hidroxi-naftalen-l-ilamino)-6,7-dimetoxiquinolina-3 -carbonitrila | 205 dec | 372,0 (M+H) |
| 184 | 4-( 1 H-Indazol-6-ilamino)-5-metoxi-quinolina-3 carbonitrila | >260 | 315,8 (M+H) |
| 185 | 4-(2-Cloro-5-metoxianilino)-5-metoxiquinolina3-carbonitrila | 185-187 | 339,9 (M+H) |
| 186 | 4-[(2-Amino-4-clorofenil) amino]-6,7-dimetoxi3-quinolina carbonitrila | 215 dec | 354,9 (M+H) |
| 187 | 4- [(3 -Hidroxi-2-naftil) amino] -6,7-dimetoxi-3 - quinolina carbonitrila | 277-282 dec | 372,2 (M+H) |
| 188 | 4- { 3 -Cloro-4- [(1 -metil-1 H-imidazol-2-il) sulfanil] anilino}-7-metoxi-6-nitro-3-quinolina carbonitrila | 467,2 (M+H) | |
| 189 | 6-amino-4- {3 -cloro-4- [(1 -metil-1 H-imidazol-2il) sulfanil] anilino}-7-metoxi-3-quinolina carbonitrila | 437,0 (M+H) | |
| 190 | (E)-N-(4- { 3 -cloro-4- [(1 -metil-1 H-imidazol-2-il) sulfanil] anilino} -3 -ciano-7 -metoxi-6- quinolinil)-4-(dimetilamino)-2-butenamida | 548,1 (M+H) 274,7 (M+2H)+2 | |
| 191 | 4-[3-Cloro-4-(l ,3-tiazol-2-ilsulfanil) anilino]-7metoxi-6-nitro-3 -quinolina carbonitrila | 470,0 (M+H) | |
| 192 | 6-Amino-4-[3-cloro-4-(l,3-tiazol-2-ilsulfanil) anilino] -7 -metoxi-3 -quinolina carbonitrila | 440,1 (M+H) | |
| 193 | (E)-N- {4- [3 -Cloro-4-( 1,3 -tiazol-2-ilsulfanil) anilino]-3-ciano-7-ffietoxi-6—quinolinil}-4(dimetilamino)-2-butenamida | 551.1 (M+H) 276.2 (M+2H)+2 | |
| 194 | 4- [3 -Cloro-4-( 1 H-imidazol-1 -il) anilino] -7- metoxi-6-nitro-3-quinolina carbonitrila | 421,3 (M+H) 211,1 (M+2H)+2 | |
| 195 | 6-Amino-4- [3 -cloro-4-( 1 H-imidazol-1 -il) anilino] -7-metoxi-3 -quinolina carbonitrila | 391.2 (M+H), 196.2 (M+2H)+2 | | |
| 196 | (E)-N- { 4- [3 -Cloro-4-( 1 H-imidazol-il) anilino] -3 ciano-7-metoxi-6-quinolinil} -4-(dimetilamino)2-butenamida | 502,4 (M+H), 251,7 (M+2H)+2 j | |
| 197 | 4- { 3 -Cloro-4- [(4-oxo-3,4-dihidro-2-quinazolinil) sunfanil] anilino} -7-metoxi-6-nitro-3 -quinolina carbonitrila | 531.2 (M+H), 266.2 (M+2H)+2 [ | |
| 198 | 6-Amino-4-{3-cloro-4-[(4-oxo-3,4-dihidro-2quinazolinil) sulfanil] anilino}-7-metoxi-3quinolina carbonitrila | 501,3 (M+H), 251,1 (M+2H)+2 | | |
| 199 | (E)-N-(4-{3-Cloro-4-[(4-oxo-3,4-dihidro-2- | 612,4 (M+H), |
147
| quinazolinil) sulfanil] anilino}-3-ciano-7-metoxi6-quinolinil)-4-(dimetilamino)-2-butenamida | 306,7 (M+2H)+2 | ||
| 200 | 6-Metoxi-7 - [3 -(4-morfolinil) propoxi] -4- [4-(4 - piridinilmetil) anilino]-3-quinolina carbonitrila | 139-141 | 510,2 (M+H), 255,7 (M+2H)+2 |
| 201 | 6-Metoxi-7- [3 -(4-morfolinil) propoxi] -4- [4 - (3 piridinilmetil) anilino]-3-quinolina carbonitrila | 112-114 | ! 510,3 (M+H), 255,7 (M+2H)+2 |
| 202 | 6-Metoxi-7- [3 -(4-morfolinil) propoxi] -4- [4-(2 - piridinilmetil) anilino]-3-quinolina carbonitrila | 168-170 | 510,2 (M+H), 255,7 (M+2H)+2 |
| 203 | (E)-N-(4-{4-[acetil (3-piridinilmetil) amino]-3- cloroanilino}-3-ciano-7-metoxi-6-quinolinil)-4- (dimetilamino)-2-butenamida | 584,1 (M+H), 292,7 (M+2H)+2 | |
| 204 | N - {2-Cloro-4- [(3 -ciano-7 -metoxi-6-nitro-4quinolinil) amino] fenil }-N-(3—piridinilmetil) acetamida | 503.1 (M+H), 252.1 (M+2H)+2 | |
| 205 | N-{4-[(6-Amino-3-ciano-7-metoxi-4-quinolinil) amino] -2-clorofenil} -N-(3 -piridinilmetil) acetamida | 473.1 (M+H), 237.2 (M+2H)+2 | |
| 206 | N-(4-{[6-(Acetilamino)-3-ciano-7-metoxi-4quinolinil] amino}-2-clorofenil)-N-(3- piridinilmetil) acetamida | 515,1 (M+H) | |
| 207 | 4-[3-Cloro-4-(l,3-dimetil-2, 4, 6- trioxohexahidro-5 -pirimidinil) anilino] -7-metoxi6-nitro-3-quinolina carbonitrila | 270-272 | 509,2 (M+H) |
| 208 | 4- { 3 -Cloro-4- [(4-fenil-1,3 -tiazol-2-il) sulfanil] anilino}-7-metoxi-6-nitro-3-quinolina carbonitrila | 256-262 | 546,2 (M+H) |
| 209 | 6-Metoxi-7 - [3 -(4-morfolinil) propoxi] -4- [4-(3 - tienilmetil) anilino]-3-quinolina carbonitrila | 152-153 | 515.3 (M+H), 258.3 (M+2H)+2 |
| 210 | 6-metoxi-7 - [3 -(4-morfolinil) propoxi] -4- [4-(2- tienilmetil) anilino]-3-quinolina carbonitrila | 152-154 | 515.3 (M+H), 258.3 (M+2H)+2 |
| 211 | 6-Metoxi-4-(4-fenoxianilino)-7-[2-(2H-l, 2, 3triazol-2-il) etoxi]-3-quinolina carbonitrila | 154-155 | 479,3 (M+H) |
| 212 | 6-Metoxi-4-(4-fenoxianilino)-7-[2-(lH-l, 2, 3triazol-1 -il) etoxi] -3 -quinolina carbonitrila | 188-189 | 479,3 (M+H) 1 |
| 213 | 4-(4-Benzilanilino)-6-metoxi-7-[2-(2H-l, 2, 3triazol-2-il) etoxi]-3-quinolina carbonitrila | 167-170 | 477,4 (M+H) |
| 214 | 4-(4-Benzilanilino)-6-metoxi-7-[2-(lH-l, 2, 3triazol-l-il) etoxi]-3-quinolina carbonitrila | 477,5 (M+H) | | |
| 215 | 6-Metoxi-7-[3-(4-morfolinil) propoxi]-4-[4-(2piridiniloxi) anilino]-3-quinolina carbonitrila | 127-130 | 512,6 (M+H), 256,8 (M+2H)+2 | |
| 216 | 4- {3 -Cloro-4- [(1 -metil-1 H-imidazol-2-il) sulfanil] anilino } -6-metoxi-7- [3 -(4-morfolinil) propoxi]-3-quinolina carbonitrila | 234-235 | 565.4 (M+H), 283.5 (M+2H)+2 | |
| 217 | 4-[4-(2-furilmetil) anilino]-6-metoxi-7-[3-(4- morfolinil) propoxi]-3-quinolina carbonitrila | 149-151 | 499,5 (M+H), 250,3 (M+2H)+2 | |
1/
148
| 218 | 6-Metoxi-7 - [3 -(4-morfolinil) propoxi] -4- [4- (tetrahidro-2-furanilmetil) anilino] -3 -quinolina carbonitrila | 132-134 | 503.4 (M+H), 252.4 (M+2H)+2 |
| 219 | 4- [4-(3 -Furilmetil) anilino]-6-metoxi-7- [3 -(4- morfolinil) propoxi]-3-quinolina carbonitrila | 163-165 | 499,5 (M+H), 250,3 (M+2H)+2 |
| 220 | 6-Metoxi-7 - [3 -(4-morfolinil) propoxi] -4- [4- (tetrahidro-3 -furanilmetil) anilino] -3 -quinolina carbonitrila | 123-125 | 503,4 (M+H), 252,2 (M+2H)+2 |
| 221 | 4-(3-Cloro-4-{[5-(trifluorometil)-l, 3, 4- tiadiazol-2-il] amino} anilino)-7-etoxi-6-nitro-3quinolina carbonitrila | 536,1 (M+H) | |
| 222 | (E)-N-[4-(3-Cloro-4-{[5-(trifluorometil)-l, 3, 4tiadiazol-2-il] amino} anilino)-3-ciano-7-etoxi-6quinolinil]-4-(dimetilamino)-2-butenamida | 617.3 (M+H), 309.3 (M+2H)+2 | |
| 223 | 4- [3 -Cloro-4-(4-piridiniloxi) anilino] -7-etoxi-6nitro-3-quinolina carbonitrila | 462,2 (M+H), 231,6 (M+2H)+2 | |
| 224 | 6-Amino-4-[3-cloro-4-(4-piridiniloxi) anilino]-7etoxi-3-quinolina carbonitrila | 432,4 (M+H), 216,6 (M+2H)+2 | |
| 225 | (E)-N- {4- [3 -Cloro-4-(4-piridiniloxi) anilino]-3 - ciano-7-etoxi-6-quinolinil}-4-(dimetilamino)-2- butenamida | 543,4 (M+H), 272,2 (M+2H)+2 | |
| 226 | 4-{3-Cloro-4-[(3-piridinilmetil) amino] anilino}7-metoxi-6-nitro-3 -quinolina carbonitrila | 461.3 (M+H), 231.4 (M+2H)+2 | |
| 227 | 6-Amino-4- {3 -cloro-4-[(4-fenil-1,3 -tiazol-2-il) sulfanil] anilino } -7 -metoxi-3 -quinolina carbonitrila | 166-172 | 516,2 (M+H) |
| 228 | 6-Amino-4-(3 -cloro-4- {[5-(trifluorometil)-1, 3, 4-tiadiazol-2-il] amino} anilino)-7-etoxi-3quinolina carbonitrila | 506,3 (M+H) | |
| 229 | 6-Metoxi-7- [3-(4-morfolinil) propoxi] -4- [4-(2- feniletil) anilino]-3-quinolina carbonitrila | 106-108 | 523,5 (M+H), 262,4 (M+2H)+2 |
| 230 | (E)-N-(4-{3-cloro-4-[(4-fenil-l,3-tiazol-2-il) sulfanil] anilino } -3 -ciano-7-metoxi-6- quinolinil)-4-(dimetilamino)-2-butenamida | 154-157 | 627.3 (M+H), 314.3 (M+2H)+2 |
| 231 | 4-[3 -Cloro-4-(l H-imidazol-1 -il) anilino] -6- metoxi-7-[3-(4-morfolinil) propoxi]-3-quinolina carbonitrila | 130-133 | 519.3 (M+H), 260.3 (M+2H)+2 |
| 232 | 6-metoxi-7-[3 -(4-morfolinil) propoxi] -4- [4-(3 - piridiniloxi) anilino]-3-quinolina carbonitrila | 135-137 | 512,2 (M+H), 1 256,7 (M+2H)+2 1 |
| 233 | 4- [3 -Cloro-4-(4-piridiniloxi) anilino] -6-metoxi7- [3 -(4-morfolinil) propoxi] -3 -quinolina carbonitrila | 174 dec | 546,1 (M+H), 273,8 (M+2H)+2 | |
| 234 | 6-Metoxi-7- [3 -(4-morfolinil) propoxi] -4- [4-(4piridinil) anilino]-3-quinolina carbonitrila | 129-131 | 512,1 (M+H), 256,8 (M+2H)+2 | |
| 235 | 4-[2-Cloro-4-(l ,3-tiazol-2-ilsulfanil) anilino]-6metoxi-7- [3 -(4-morfolinil) propoxi] -3 -quinolina carbonitrila | 122 | 568,0 (M+H), 1 284,7 (M+2H)+2 I |
149
1^9
| 236 | N- [2-Cloro-4-( {3-ciano-6-metoxi-7-[3 -(4morfolinil) propoxi]-4-quinolinil} anilino) fenilN-(3-piridinilmetil) acetamida | 120 dec | 601,1 (M+H), 301,3 (M+2H)+2 |
| 237 | 6-metoxi-7- [3 -(4-morfolinil) propoxi] -4- [4-( 1Htetraazol-5-ilmetil) anilino]-3-quinolina carbonitrila | 208 dec | 501,2 (M+H), 251,0 (M+2H)+2 |
| 238 | 6-metoxi-7- [3 -(4-morfolinil) propoxil -4- [4-(2H1, 2, 3-triazol-2-ilmetil) anilino]-3-quinolina carbonitrila | 186-187 | 500,3 (M+H), 250,8 (M+2H)+2 |
| 239 | 6-Metoxi-7-[3-(4-morfolinil) propoxi]-4- [4-( 1H1, 2, 3-triazol-l-ilmetil) anilino]-3-quinolina carbonitrila | 200-201 | 500,2 (M+H), 250,7 (M+2H)+2 |
| 240 | 4-(2,4-Dicloro-5-metoxianilino)-6-metoxi-7-[2(2H)-1, 2, 3-triazol-2-il) etoxi]-3-quinolina carbonitrila | 223-226 | 485,1 (M+H) |
| 241 | 4-(2,4-Dicloro-5-metoxianilino)-6-metoxi-7-[2(1H-1, 2, 3-triazol-l-il) etoxi]-3-quinolina carbonitrila | 196-197 | 485,1 (M+H) |
| 242 | 7-Etoxi-6-nitro-4- [4- [(4-fenil-1,3 -tiazol-2-il) sulfanil] -3 -(trifluorometil) anilino] -3 -quinolina carbonitrila | 594,0 (M+H) | |
| 243 | 6-Amino-7-etoxi-4-[4-[(4-fenil, 1,3-tiazol-2-il) sulfanil] -3 -(trifluorometil) anilino] -3 -quinolina carbonitrila | 564,0 (M+H) | |
| 244 | (E)-N- { 3 -ciano-7-etoxi-4- [4- [(4-fenil-1,3-tiazol2-il) sulfanil]-3-(trifluorometil) anilino]-6quinolinil} -4-(dimetilamino)-2-butenamida | 675,0 (M+H), 338,3 (M+2H)+2 | |
| 245 | 4- [3 -Cloro-4-( 1 H-imidazol-1 -ilmetil) anilino] -7etoxi-6-nitro-3 -quinolina carbonitrila | 449.1 (M+H), 225.2 (M+2H)+2 | |
| 246 | 6-Amino-4- [3 -cloro-4-( 1 H-imidazol-1 -ilmetil) anilino] -7-etoxi-3 -quinolina carbonitrila | 419.2 (M+H), 210.3 (M+2H)+2 | |
| 247 | (E)-N- {4- [3 -Cloro-4-(l H-imidazol-1 -ilmetil) anilino] -3 -ciano-7-etoxi-6-quinolinil} -4(dimetilamino)-2-butenamida | 530,2 (M+H)k 265,8 (M+2H)+2 | |
| 248 | 4- { 3 -Cloro-4- [(4-metil-2-pirimidinil) sulfanil] anilino}-7-etoxi-6-nitro-3-quinolina carbonitrila | 493,0 (M+H) | |
| 249 | 6-amino-4- { 3 -cloro-4-[(4-metil-2-pirimidinil) sulfanil] anilino}-7-etoxi-3-quinolina carbonitrila | 463,1 (M+H) | |
| 250 | (E)-N-(4- { 3 -Cloro-4- [(4-metil-2-pirimidinil) sulfanil] anilino } -3 -ciano-7-etoxi-6-quinolinil)4-(dimetilamino)-2-butenamida | 574,1 (M+H), 287,8 (M+2H)+2 | |
| 251 | 4- { 3 -Cloro-4- [(4,6-dimetil-2-pirimidinil) sulfanil] anilino}-7-etoxi-6-nitro-3-quinolina carbonitrila | 507,1 (M+H) |
150
| 252 | 6-Amino-4-{3-cloro-4-[(4,6-dimetil-2pirimidinil) sulfanil] anilino}-7-etoxi-3-quinolina carbonitrila | 477,1 (M+H) | |
| 253 | (E)-N-(4-{3-cloro-4-[(4,6-dimetil-2-pirimidinil) sulfanil] anilino}-3-ciano-7-etoxi-6-quinolinil)4-(dimetilamino)-2-butenamida | 588,1 (M+H), 294,8 (M+2H)+2 | |
| 254 | 4- [4-( 1 H-imidazol-2-ilmetil) anilino] -6-metoxi7- [3 -(4-morfolinil) propoxi] -3 -quinolina carbonitrila | 156-158 | 499.3 (M+H), 250.3 (M+2H)+2 |
| 255 | 6-Metoxi-7- [3 -(4-morfolinil) propoxi] -4- [4-( 1Htetraazol-l-ilmetil) anilino]-3-quinolina carbonitrila | 180 dec | 501.3 (M+H), 251.3 (M+2H)+2 |
| 256 | 6-Metoxi-7- [3 -(4-morfoünil) propoxi] -4- [4-(2Htetraazol-2-ilmetil) anilino] -3 -quinolina carbonitrila | 123 dec | 501.2 (M+H), 251.3 (M+2H)+2 |
| 257 | 4- { 3-Cloro-4-[(4,6-dimetil-2-pirimidinil) sulfanil] anilino} -6-metoxi-7 - [3 -(4-morfolinil) propoxi]-3-quinolina carbonitrila | 110-113 | 591.1 (M+H), 296.2 (M+2H)+2 |
| 258 | 4-{3-Cloro-4-[(4-metil-2-pirimidinil) sulfanil] anilino} -6-metoxi-7- [3-(4-morfolinil) propoxi-3 quinolina carbonitrila | 10-113 | 577,1 (M+H), 2.89,2 (M+2H)+2 577.1 (M+H), 289.2 (M+2H)+2 |
| 259 | (E)-N-[4-(3-Cloro-4- {[2-(fenilsulfanil) acetil] amino } anilino)-3 -ciano-7-metoxi-6-quinolinil] 4-(dimetilamino)-2-butenamida | 194-198 | 601,3 (M+H), 301,1 (M+2H)+2 |
| 260 | 4-[4-(2,6-dimetoxifenoxi) anilino]-6-metoxi-7[3 -(4-morfolinil) propoxi] -3 -quinolina carbonitrila | 160-162 | 571,4 (M+H) |
| 261 | 6-Metoxi-4- [4-(3 -metoxifenoxi) anilino] -7- [3 -(4morfolinil) propoxi]-3-quinolina carbonitrila | 132-134 | 5 41,5 (M+H) |
| 262 | 6-Metoxi-4- {4- [(1 -metil-1 H-imidazol-2-il) sulfanil] anilino}-7-[3-(4-morfolinil) propoxi]-3quinolina carbonitrila | 208-210 | 531,4 (M+H) |
| 263 | (E)-N-{4-[3-Cloro-4-(l ,3-tiazol-2-ilsulfanil) anilino]-3 -ciano-7-metoxi-6-quinolinil} -4-[(2metoxietil) (metil) amino]-2-butenamida | 595.1 (M+H), 298.1 (M+2H)+2 | |
| 264 | (E)-N-(4- {3 -Cloro-4- [(5-fenil-1,3 -tiazol-2-il) sulfanil] anilino}-3-ciano-7-metoxi-6- quinolinil)-4-(dimetilamino)-2-butenamida | 627.1 (M+H), 314.1 (M+2H)+2 | |
| 265 | (E)-N-(4-{3-Cloro-4-[(4-fenil-l,3-tiazol-2-il) sulfanil] anilino}-3-ciano-7-etoxi-6-quinolinil)4-(dimetilamino)-2-butenamida | 641,3 (M+H), 321,2 (M+21I)'2 I | |
| 266 | 4- { 3 -Cloro-4- [(4,6-dimetil-2-pirimidinil) sulfanil] anilino}-6,7-dimetoxi-3-quinolina carbonitrila | 173-176 | 478,4 (M+H) Ι |
| 267 | 6,7-dimetoxi-4-({6-[(4-fenil-l,3-tiazol-2-il) sulfanil]-3-piridinil} anilino)-3-quinolina carbonitrila | 250 (dec) | 498,3 (M+H) |
| 268 | 4- {3 -Cloro-4- [(1 -metil-1 H-imidazol-2-il) | 232-234 | 547,3 (M+H) |
151 ιδν
| sulfanil] anilino}-6-metoxi-7-[3-(2H-l, 2, 3triazol-2-il) propoxi]-3-quinolina carbonitrila | |||
| 269 | 4- {3-Cloro-4-[(l -metil-1 H-imidazol-2-il) sulfanil] anilino}-6-metoxi-7-[3-(lH-l, 2, 3triazol-l-il) propoxi]-3-quinolina carbonitrila | 208-210 | 547,3 (M+H) |
1/5
Claims (6)
- REIVINDICAÇÕES1. Composto, caracterizado pelo fato de ter a fórmula 1 com a estrutura:em queX é um sistema de anel arila bicíclica ou heteroarila bicíclica selecionado dentre naftalina, 1,2,3,4-tetraidronaftalina, indano, 1-oxo-indano,1.2.3.4- tetraidroquinolina, naftiridina, benzofurano, 3-oxo-l,3-diidroisobenzofurano, benzotiafeno, 1,1-dioxo-benzotiafeno, indol, 2,3-diidroindol, l,3-dioxo-2,3-diidro-lH-isoindol, benzotriazol, lH-indazol, indolina, benzopirazol, 1,3-benzodioxol, benzooxazol, purina, ftalimida, cumarina, cromona, quinolina, tetraidroquinolina, isoquinolina, benzimidazol, quinazolina, pirido[2,3-b]piridina, pirido[3,4-b]pirazina, pirido[3,2-c] piridazina, pirido[3,4-b] piridina, lH-pirazol[3,4-d]pirimidina, 1,4benzodioxano, pteridina, 2(lH)-quinolona, l(2H)-iso-quinolona, 2-oxo-2,3diidro-benztiazol, 1,2-metilenodioxibenzeno, 2-oxindol, 1,4-benzisoxazina, benzotiazol, quinoxalina, quinolina-N-óxido, isoquinolina-N-óxido, quinoxalina-N-óxido, quinazolina-N-óxido, benzoazina, ftalazina, 1,4-dioxo1.2.3.4- tetraidro-ftalazina, 2-oxo-1,2-diidro-quinolina, 2,4-dioxo-1,4-diidro2H-benzo[d][l,3]oxazina, 2,5-dioxo-2,3,4,5-tetraidro-lH-benzo[e][l,4]diazepina, e cinnolina; ouX é um radical tendo a fórmula
- 2/5 em que A é um anel fenila, em que o anel fenila é mono-ou disubstituído com um substituinte selecionado dentre o grupo consistindo de halogênio, alquila de 1-6 átomos de carbono e carboxialquila de 2-7 átomos de
carbono; T é ligado a um carbono de A e é: -(CH2)mO-; L é um anel heteroarila de 6 membros, onde 0 anel heteroarila é selecionado dentre piridina, pirimidina, imidazol, tiazol, tiazolidina, pirrol, furano, tiofeno, oxazol, e 1,2,4-triazol, onde o anel heteroarila é opcionalmente mono- ou di-substituído com um substituinte selecionado dentre halogênio e alquila de 1 -6 átomos de carbono;contanto que X não seja um anel 2,4-di-halo-5-alcóxi Cw fenila; Z é -NH-; Ri é hidrogênio, trifluorometila ou alcóxi de 1-6 átomos de carbono; G, é -NH-R2; R2 é -C(O)C(R3)=CR3R3; R3 é H ou -(C(R<,)2)SR7; R7 é -NR6R6; R<, é H ou alquila- C|.6, e s=l;G2 é alcóxi de 1-6 átomos de carbono, alcanoilóxi de 1-6 átomos de carbono, alcanoiloximetila de 2-7 átomos de carbono, amino ounitro; R4 é hidrogênio, hidroxila, ciano ou alcóxi de 1-6 átomos de carbono; Né0-l;e M é 0-3, ou um sal farmaceuticamente aceitável do mesmo; contanto que o composto não seja (E)-N-{4-[3-Cloro-4-(4piridiniloxi) anilino]-3-ciano-7-etoxi-6-quinolinil}-4-(dimetilamino)-2butenamida. - 3/52. Composto de acordo com a reivindicação 1, caracterizado pelo fato de que Z é -NH- e n = 0 ou um sal farmaceuticamente aceitável do mesmo.3. Composto de acordo com a reivindicação 2, caracterizado pelo fato de que X é o radical:A é um anel fenila substituído e L é um anel heteroarila de 6 membros, ou um sal farmaceuticamente aceitável do mesmo.
- 4. Composto de acordo com a reivindicação 1, caracterizado pelo fato de que R| e Rq são hidrogênio, ou um sal farmaceuticamente aceitável do mesmo.
- 5. Composto de acordo com a reivindicação 3, caracterizado pelo fato de que o anel heteroarila é piridina, ou um sal farmaceuticamente aceitável do mesmo.
- 6. Composição farmacêutica, caracterizada pelo fato de compreender um composto de fórmula 1 conforme definido em qualquer uma das reivindicações 1 a 5, com a estrutura em queX é um sistema de anel arila bicíclica ou heteroarila bicíclica selecionado dentre naftalina, 1,2,3,4-tetraidronaftalina, indano, 1-oxo-indano,1,2,3,4-tetraidroquinolina, naftiridina, benzofurano, 3-oxo-l,3-diidroisobenzofurano, benzotiafeno, 1,1-dioxo-benzotiafeno, indol, 2,3-diidroindol,4/51,3-dioxo-2,3-diidro-1 H-isoindol, benzotriazol, lH-indazol, indolina, benzopirazol, 1,3-benzodioxol, benzooxazol, purina, ftalimida, cumarina, cromona, quinolina, tetraidroquinolina, isoquinolina, benzimidazol, quinazolina, pirido[2,3-b]piridina, pirido[3,4-b]pirazina, pirido[3,2-c] piridazina, pirido[3,4-b] piridina, lH-pirazol[3,4-d]pirimidina, 1,4benzodioxano, pteridina, 2(lH)-quinolona, l(2H)-iso-quinolona, 2-oxo-2,3diidro-benztiazol, 1,2-metilenodioxibenzeno, 2-oxindol, 1,4-benzisoxazina, benzotiazol, quinoxalina, quinolina-N-óxido, isoquinolina-N-óxido, quinoxalina-N-óxido, quinazolina-N-óxido, benzoazina, ftalazina, 1,4-dioxo1,2,3,4-tetraidro-ftalazina, 2-oxo-l,2-diidro-quinolina, 2,4-dioxo-l ,4-diidro2H-benzo[d][ 1,3]oxazina, 2,5-dioxo-2,3,4,5-tetraidro-1 H-benzo[e][ 1,4]diazepina, e cinnolina; ouX é um radical tendo a fónnula em que A é um anel fenila, em que o anel fenila é mono-ou disubstituído com um substituinte selecionado dentre o grupo consistindo de halogênio, alquila de 1-6 átomos de carbono e carboxialquila de 2-7 átomos de carbono;T é ligado a um carbono de A e é:-(CH2)mO-;L é um anel heteroarila de 6 membros, onde o anel heteroarila é selecionado dentre piridina, pirimidina, imidazol, tiazol, tiazolidina, pirrol, furano, tiofeno, oxazol, e 1,2,4-triazol, onde o anel heteroarila é opcionalmente mono- ou di-substituído com um substituinte selecionado dentre halogênio e alquila de 1-6 átomos de carbono;Z é -NH-;Ri é hidrogênio, trifluorometila ou alcóxi de 1-6 átomos de carbono;G, é -NH-R2; R2 é -C(O)C(R3)=CR3R3; R3 é H ou -(C(R<,)2)S5/5R7; R7 é -NR6R6; R(, é H ou alquila- Ci.6, e s=l;G2 é alcóxi de 1-6 átomos de carbono, alcanoilóxi de 1-6 átomos de carbono, alcanoiloximetila de 2-7 átomos de carbono, amino ou nitro;5 R4 é hidrogênio, hidroxila, ciano ou alcóxi de 1-6 átomos de carbono;NéO-l;e M é 0-3, ou um sal farmaceuticamente aceitável do mesmo, e um veículo farmacêutico.1/1
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US16280298A | 1998-09-29 | 1998-09-29 | |
| BRPI9914167 | 1999-09-22 | ||
| PCT/US1999/022054 WO2000018761A1 (en) | 1998-09-29 | 1999-09-22 | Substituted 3-cyanoquinolines as protein tyrosine kinases inhibitors |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| BRPI9917841B1 true BRPI9917841B1 (pt) | 2018-07-17 |
| BRPI9917841B8 BRPI9917841B8 (pt) | 2021-05-25 |
Family
ID=62983198
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| BRPI9917841A BRPI9917841B8 (pt) | 1998-09-29 | 1999-09-22 | compostos 3-ciano quinolina substituídos e composições compreendendo os mesmos |
Country Status (1)
| Country | Link |
|---|---|
| BR (1) | BRPI9917841B8 (pt) |
-
1999
- 1999-09-22 BR BRPI9917841A patent/BRPI9917841B8/pt not_active IP Right Cessation
Also Published As
| Publication number | Publication date |
|---|---|
| BRPI9917841B8 (pt) | 2021-05-25 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR100705142B1 (ko) | 단백질 티로신 키나제 억제제로서 치환 3-시아노퀴놀린 | |
| US6288082B1 (en) | Substituted 3-cyanoquinolines | |
| KR100736502B1 (ko) | 단백질 티로신 키나제 억제제로서 치환된 3-시아노퀴놀린 | |
| US6002008A (en) | Substituted 3-cyano quinolines | |
| RU2262935C2 (ru) | Производные хиназолина в качестве ингибиторов ангиогенеза | |
| US6297258B1 (en) | Substituted 3-cyanoquinolines | |
| ES2209124T3 (es) | "3-cianoquinolinas sustituidas". | |
| EP1178966B1 (en) | Quinoline derivatives as inhibitors of mek enzymes | |
| JP2003528880A (ja) | 三環系タンパクキナーゼ阻害薬 | |
| BRPI9917841B1 (pt) | compostos 3-ciano quinolina substituídos e composições compreendendo os mesmos | |
| AU2012209038B2 (en) | Substituted 3-cyanoquinolines as protein tyrosine kinases inhibitors | |
| HU230095B1 (hu) | Protein tirozin kinázokat gátló hatású szubsztituált 3-cianokinolinok | |
| AU2010227057B2 (en) | Substituted 3-cyanoquinolines as protein tyrosine kinases inhibitors | |
| MXPA01003230A (en) | Substituted 3-cyanoquinolines as protein tyrosine kinases inhibitors | |
| HK1035188B (en) | Substituted 3-cyanoquinolines as protein tyrosine kinases inhibitors |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| B06A | Patent application procedure suspended [chapter 6.1 patent gazette] | ||
| B06A | Patent application procedure suspended [chapter 6.1 patent gazette] | ||
| B07D | Technical examination (opinion) related to article 229 of industrial property law [chapter 7.4 patent gazette] | ||
| B07E | Notification of approval relating to section 229 industrial property law [chapter 7.5 patent gazette] | ||
| B09A | Decision: intention to grant [chapter 9.1 patent gazette] | ||
| B16A | Patent or certificate of addition of invention granted [chapter 16.1 patent gazette] | ||
| B16C | Correction of notification of the grant [chapter 16.3 patent gazette] |
Free format text: PRAZO DE VALIDADE: 20 (VINTE) ANOS CONTADOS A PARTIR DE 22/09/1999 OBSERVADAS AS CONDICOES LEGAIS. PATENTE CONCEDIDA CONFORME ADI 5.529/DF |
|
| B21A | Patent or certificate of addition expired [chapter 21.1 patent gazette] |
Free format text: PATENTE EXTINTA EM 22/09/2019 |