BR112015014308B1 - Aparelho e método para guiar um usuário que manuseia uma sonda de imageamento - Google Patents
Aparelho e método para guiar um usuário que manuseia uma sonda de imageamento Download PDFInfo
- Publication number
- BR112015014308B1 BR112015014308B1 BR112015014308-3A BR112015014308A BR112015014308B1 BR 112015014308 B1 BR112015014308 B1 BR 112015014308B1 BR 112015014308 A BR112015014308 A BR 112015014308A BR 112015014308 B1 BR112015014308 B1 BR 112015014308B1
- Authority
- BR
- Brazil
- Prior art keywords
- probe
- user
- view
- pause
- heart
- Prior art date
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01S—RADIO DIRECTION-FINDING; RADIO NAVIGATION; DETERMINING DISTANCE OR VELOCITY BY USE OF RADIO WAVES; LOCATING OR PRESENCE-DETECTING BY USE OF THE REFLECTION OR RERADIATION OF RADIO WAVES; ANALOGOUS ARRANGEMENTS USING OTHER WAVES
- G01S7/00—Details of systems according to groups G01S13/00, G01S15/00, G01S17/00
- G01S7/52—Details of systems according to groups G01S13/00, G01S15/00, G01S17/00 of systems according to group G01S15/00
- G01S7/52017—Details of systems according to groups G01S13/00, G01S15/00, G01S17/00 of systems according to group G01S15/00 particularly adapted to short-range imaging
- G01S7/52023—Details of receivers
- G01S7/52036—Details of receivers using analysis of echo signal for target characterisation
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B8/00—Diagnosis using ultrasonic, sonic or infrasonic waves
- A61B8/08—Detecting organic movements or changes, e.g. tumours, cysts, swellings
- A61B8/0833—Detecting organic movements or changes, e.g. tumours, cysts, swellings involving detecting or locating foreign bodies or organic structures
- A61B8/085—Detecting organic movements or changes, e.g. tumours, cysts, swellings involving detecting or locating foreign bodies or organic structures for locating body or organic structures, e.g. tumours, calculi, blood vessels, nodules
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T3/00—Geometric image transformation in the plane of the image
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B8/00—Diagnosis using ultrasonic, sonic or infrasonic waves
- A61B8/08—Detecting organic movements or changes, e.g. tumours, cysts, swellings
- A61B8/0883—Detecting organic movements or changes, e.g. tumours, cysts, swellings for diagnosis of the heart
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B8/00—Diagnosis using ultrasonic, sonic or infrasonic waves
- A61B8/42—Details of probe positioning or probe attachment to the patient
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B8/00—Diagnosis using ultrasonic, sonic or infrasonic waves
- A61B8/42—Details of probe positioning or probe attachment to the patient
- A61B8/4245—Details of probe positioning or probe attachment to the patient involving determining the position of the probe, e.g. with respect to an external reference frame or to the patient
- A61B8/4254—Details of probe positioning or probe attachment to the patient involving determining the position of the probe, e.g. with respect to an external reference frame or to the patient using sensors mounted on the probe
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B8/00—Diagnosis using ultrasonic, sonic or infrasonic waves
- A61B8/46—Ultrasonic, sonic or infrasonic diagnostic devices with special arrangements for interfacing with the operator or the patient
- A61B8/461—Displaying means of special interest
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B8/00—Diagnosis using ultrasonic, sonic or infrasonic waves
- A61B8/52—Devices using data or image processing specially adapted for diagnosis using ultrasonic, sonic or infrasonic waves
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01S—RADIO DIRECTION-FINDING; RADIO NAVIGATION; DETERMINING DISTANCE OR VELOCITY BY USE OF RADIO WAVES; LOCATING OR PRESENCE-DETECTING BY USE OF THE REFLECTION OR RERADIATION OF RADIO WAVES; ANALOGOUS ARRANGEMENTS USING OTHER WAVES
- G01S15/00—Systems using the reflection or reradiation of acoustic waves, e.g. sonar systems
- G01S15/88—Sonar systems specially adapted for specific applications
- G01S15/89—Sonar systems specially adapted for specific applications for mapping or imaging
- G01S15/8906—Short-range imaging systems; Acoustic microscope systems using pulse-echo techniques
- G01S15/8909—Short-range imaging systems; Acoustic microscope systems using pulse-echo techniques using a static transducer configuration
- G01S15/8915—Short-range imaging systems; Acoustic microscope systems using pulse-echo techniques using a static transducer configuration using a transducer array
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01S—RADIO DIRECTION-FINDING; RADIO NAVIGATION; DETERMINING DISTANCE OR VELOCITY BY USE OF RADIO WAVES; LOCATING OR PRESENCE-DETECTING BY USE OF THE REFLECTION OR RERADIATION OF RADIO WAVES; ANALOGOUS ARRANGEMENTS USING OTHER WAVES
- G01S15/00—Systems using the reflection or reradiation of acoustic waves, e.g. sonar systems
- G01S15/88—Sonar systems specially adapted for specific applications
- G01S15/89—Sonar systems specially adapted for specific applications for mapping or imaging
- G01S15/8906—Short-range imaging systems; Acoustic microscope systems using pulse-echo techniques
- G01S15/8993—Three dimensional imaging systems
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01S—RADIO DIRECTION-FINDING; RADIO NAVIGATION; DETERMINING DISTANCE OR VELOCITY BY USE OF RADIO WAVES; LOCATING OR PRESENCE-DETECTING BY USE OF THE REFLECTION OR RERADIATION OF RADIO WAVES; ANALOGOUS ARRANGEMENTS USING OTHER WAVES
- G01S7/00—Details of systems according to groups G01S13/00, G01S15/00, G01S17/00
- G01S7/52—Details of systems according to groups G01S13/00, G01S15/00, G01S17/00 of systems according to group G01S15/00
- G01S7/52017—Details of systems according to groups G01S13/00, G01S15/00, G01S17/00 of systems according to group G01S15/00 particularly adapted to short-range imaging
- G01S7/52053—Display arrangements
- G01S7/52057—Cathode ray tube displays
- G01S7/52073—Production of cursor lines, markers or indicia by electronic means
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01S—RADIO DIRECTION-FINDING; RADIO NAVIGATION; DETERMINING DISTANCE OR VELOCITY BY USE OF RADIO WAVES; LOCATING OR PRESENCE-DETECTING BY USE OF THE REFLECTION OR RERADIATION OF RADIO WAVES; ANALOGOUS ARRANGEMENTS USING OTHER WAVES
- G01S7/00—Details of systems according to groups G01S13/00, G01S15/00, G01S17/00
- G01S7/52—Details of systems according to groups G01S13/00, G01S15/00, G01S17/00 of systems according to group G01S15/00
- G01S7/52017—Details of systems according to groups G01S13/00, G01S15/00, G01S17/00 of systems according to group G01S15/00 particularly adapted to short-range imaging
- G01S7/52076—Luminous indicators
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01S—RADIO DIRECTION-FINDING; RADIO NAVIGATION; DETERMINING DISTANCE OR VELOCITY BY USE OF RADIO WAVES; LOCATING OR PRESENCE-DETECTING BY USE OF THE REFLECTION OR RERADIATION OF RADIO WAVES; ANALOGOUS ARRANGEMENTS USING OTHER WAVES
- G01S7/00—Details of systems according to groups G01S13/00, G01S15/00, G01S17/00
- G01S7/52—Details of systems according to groups G01S13/00, G01S15/00, G01S17/00 of systems according to group G01S15/00
- G01S7/52017—Details of systems according to groups G01S13/00, G01S15/00, G01S17/00 of systems according to group G01S15/00 particularly adapted to short-range imaging
- G01S7/52079—Constructional features
- G01S7/52084—Constructional features related to particular user interfaces
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T7/00—Image analysis
- G06T7/0002—Inspection of images, e.g. flaw detection
- G06T7/0012—Biomedical image inspection
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T7/00—Image analysis
- G06T7/10—Segmentation; Edge detection
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T7/00—Image analysis
- G06T7/70—Determining position or orientation of objects or cameras
- G06T7/73—Determining position or orientation of objects or cameras using feature-based methods
- G06T7/75—Determining position or orientation of objects or cameras using feature-based methods involving models
-
- H—ELECTRICITY
- H04—ELECTRIC COMMUNICATION TECHNIQUE
- H04N—PICTORIAL COMMUNICATION, e.g. TELEVISION
- H04N23/00—Cameras or camera modules comprising electronic image sensors; Control thereof
- H04N23/60—Control of cameras or camera modules
- H04N23/63—Control of cameras or camera modules by using electronic viewfinders
-
- H—ELECTRICITY
- H04—ELECTRIC COMMUNICATION TECHNIQUE
- H04N—PICTORIAL COMMUNICATION, e.g. TELEVISION
- H04N23/00—Cameras or camera modules comprising electronic image sensors; Control thereof
- H04N23/60—Control of cameras or camera modules
- H04N23/63—Control of cameras or camera modules by using electronic viewfinders
- H04N23/633—Control of cameras or camera modules by using electronic viewfinders for displaying additional information relating to control or operation of the camera
-
- H—ELECTRICITY
- H04—ELECTRIC COMMUNICATION TECHNIQUE
- H04N—PICTORIAL COMMUNICATION, e.g. TELEVISION
- H04N7/00—Television systems
- H04N7/18—Closed-circuit television [CCTV] systems, i.e. systems in which the video signal is not broadcast
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B2576/00—Medical imaging apparatus involving image processing or analysis
- A61B2576/02—Medical imaging apparatus involving image processing or analysis specially adapted for a particular organ or body part
- A61B2576/023—Medical imaging apparatus involving image processing or analysis specially adapted for a particular organ or body part for the heart
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B8/00—Diagnosis using ultrasonic, sonic or infrasonic waves
- A61B8/06—Measuring blood flow
- A61B8/065—Measuring blood flow to determine blood output from the heart
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B8/00—Diagnosis using ultrasonic, sonic or infrasonic waves
- A61B8/08—Detecting organic movements or changes, e.g. tumours, cysts, swellings
- A61B8/0858—Detecting organic movements or changes, e.g. tumours, cysts, swellings involving measuring tissue layers, e.g. skin, interfaces
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B8/00—Diagnosis using ultrasonic, sonic or infrasonic waves
- A61B8/42—Details of probe positioning or probe attachment to the patient
- A61B8/4272—Details of probe positioning or probe attachment to the patient involving the acoustic interface between the transducer and the tissue
- A61B8/429—Details of probe positioning or probe attachment to the patient involving the acoustic interface between the transducer and the tissue characterised by determining or monitoring the contact between the transducer and the tissue
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B8/00—Diagnosis using ultrasonic, sonic or infrasonic waves
- A61B8/44—Constructional features of the ultrasonic, sonic or infrasonic diagnostic device
- A61B8/4427—Device being portable or laptop-like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B8/00—Diagnosis using ultrasonic, sonic or infrasonic waves
- A61B8/44—Constructional features of the ultrasonic, sonic or infrasonic diagnostic device
- A61B8/4444—Constructional features of the ultrasonic, sonic or infrasonic diagnostic device related to the probe
- A61B8/4455—Features of the external shape of the probe, e.g. ergonomic aspects
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B8/00—Diagnosis using ultrasonic, sonic or infrasonic waves
- A61B8/48—Diagnostic techniques
- A61B8/483—Diagnostic techniques involving the acquisition of a 3D volume of data
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B8/00—Diagnosis using ultrasonic, sonic or infrasonic waves
- A61B8/52—Devices using data or image processing specially adapted for diagnosis using ultrasonic, sonic or infrasonic waves
- A61B8/5215—Devices using data or image processing specially adapted for diagnosis using ultrasonic, sonic or infrasonic waves involving processing of medical diagnostic data
- A61B8/5223—Devices using data or image processing specially adapted for diagnosis using ultrasonic, sonic or infrasonic waves involving processing of medical diagnostic data for extracting a diagnostic or physiological parameter from medical diagnostic data
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T2207/00—Indexing scheme for image analysis or image enhancement
- G06T2207/10—Image acquisition modality
- G06T2207/10132—Ultrasound image
-
- G—PHYSICS
- G06—COMPUTING; CALCULATING OR COUNTING
- G06T—IMAGE DATA PROCESSING OR GENERATION, IN GENERAL
- G06T2207/00—Indexing scheme for image analysis or image enhancement
- G06T2207/30—Subject of image; Context of image processing
- G06T2207/30004—Biomedical image processing
- G06T2207/30048—Heart; Cardiac
-
- G—PHYSICS
- G16—INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR SPECIFIC APPLICATION FIELDS
- G16H—HEALTHCARE INFORMATICS, i.e. INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR THE HANDLING OR PROCESSING OF MEDICAL OR HEALTHCARE DATA
- G16H30/00—ICT specially adapted for the handling or processing of medical images
- G16H30/40—ICT specially adapted for the handling or processing of medical images for processing medical images, e.g. editing
Abstract
APARELHO, MÍDIA LEGÍVEL POR COMPUTADOR, E DISPOSITIVO-GUIA PARA O USUÁRIO A presente invenção refere-se a um aparelho que inclui uma sonda de imageamento e que é configurado para dispor dinamicamente uma apresentação de retroinformação visual (144) para guiar o ajuste manual, através da sonda, de um local e de uma orientação associados à sonda. A disposição é seletivamente baseada em comparações (321) entre campos de visão da sonda e resultados respectivos de segmentação de dados de imagem capturados através da sonda. Em uma modalidade, a retroinformação não inclui (175) uma representação em escala de tons de cinza dos dados de imagem. Transformações do sistema de coordenadas que correspondem a comparações respectivas podem ser computadas. A seleção pode ser baseada em, e dinamicamente responsiva a, um conteúdo de imageamento que é capturado dinamicamente através da sonda.
Description
[001] A presente invenção refere-se a um guia para o usuário para ajustar o local e a orientação de uma sonda de imageamento e, mais particularmente, ao guia ser visual.
[002] A insuficiência cardíaca é uma doença grave com cinco milhões de pacientes somente nos Estados Unidos e dezenas de milhões em todo o mundo. Estima-se que o número de indivíduos com risco de insuficiência cardíaca somente nos Estados Unidos seja de 60 milhões; um milhão estão hospitalizados e o resto está sob os cuidados de clínicas de insuficiência cardíaca. Informações básicas sobre o coração são necessárias nas clínicas de insuficiência cardíaca ou nos consultórios de clínicos gerais para tratamento do paciente. Essas informações incluem imagens e dados de quantificação, como fração de ejeção, calculados a partir das imagens, depois que as imagens são capturadas. O ultrassom é uma modalidade de imageamento confiável e com boa relação custo/benefício para tecido mole, como o coração.
[003] A captura de uma imagem de ultrassom exige um ultrassonografista profissional. Um parâmetro que o ultrassonografista, ou outro médico treinado em sonografia, otimiza é o campo de visão. A vista apical das quatro cavidades é padrão para exames de rotina do coração. O médico coloca a cabeça da sonda de ultrassom, ou “sonda transdutora”, no paciente. A determinação de um local eficaz na pele do paciente para o posicionamento da sonda para várias vistas é parte do treinamento do médico, e o local pode variar de um paciente para o outro. Para a vista apical das quatro cavidades, a sonda é colocada sobre o ápice do coração. A sonda também precisa ser inclinada manualmente, tipicamente em direções diferentes até o órgão ser capturado para imageamento. Isso é feito interativamente, com o médico vendo a imagem, que é normalmente um sonograma, na tela. A interpretação do sonograma é uma habilidade que precisa ser desenvolvida, por exemplo através de treinamento e prática. A experiência do médico diz a ele ou ela, em um processo iterativo contínuo, como deslocar e inclinar a sonda para conseguir uma janela acústica eficaz.
[004] O que é proposto mais adiante neste documento é direcionado a resolver um ou mais dos problemas acima.
[005] O acesso a um exame de ultrassom completo em clínicas de insuficiência cardíaca e em consultórios de clínicos gerais não é fácil. Tornar o sistema de ultrassom portátil ajudaria. Entretanto, ainda que a maioria dos cardiologistas poderia usar um sistema de ultrassom convencional portátil, eles são em geral ocupados demais para executar esse procedimento sozinhos.
[006] Ainda assim, o imageamento em série, no qual imagens do coração são obtidas periodicamente, por exemplo, melhoraria o tratamento do paciente.
[007] É necessária uma solução de ponto de tratamento que permite a medição volumétrica automática com base no ultrassom do coração durante a consulta regular do paciente, que seria especialmente útil em clínicas de insuficiência cardíaca. Um enfermeiro treinado em colocar os eletrodos do ECG, mas sem treinamento em ecocardiografia, seria responsável por operar o sistema portátil, e o cardiologista receberia as imagens diagnósticas junto com as medições automáticas, como o tamanho do ventrículo e a fração de ejeção.
[008] Essa tecnologia reduziria a barreira do uso de dados do ultrassom para diagnóstico cardíaco e exames de acompanhamento.
[009] De acordo com um aspecto da presente invenção, um aparelho inclui uma sonda de imageamento. Ele inclui adicionalmente um processador-guia para o usuário configurado para dispor dinamicamente uma apresentação de retroinformação visual para guiar o ajuste manual, através da sonda, de uma localização e de uma orientação associadas à sonda. A disposição é seletivamente baseada em comparações entre campos de visão da sonda e resultados respectivos de segmentação de dados de imagem capturados através da sonda.
[010] Em um subaspecto, a disposição inclui a apresentação da retroinformação. A retroinformação inclui instruções ao usuário sobre o manuseio manual da sonda.
[011] Em um subaspecto adicional, a retroinformação não inclui uma representação em escala de tons de cinza dos dados de imagem capturados através da sonda.
[012] Em um outro subaspecto, o aparelho é configurado para computar as transformações do sistema de coordenadas que correspondem àquelas respectivas das comparações.
[013] Em um primeiro subaspecto adicional, a computação é dinamicamente baseada em resultados.
[014] Em um segundo subaspecto adicional, a seleção é respectivamente baseada nas magnitudes dos componentes translacionais e rotacionais das transformações.
[015] Em um terceiro subaspecto adicional, a computação é responsiva às respectivas pausas no ajuste.
[016] Em um subaspecto relevante, a sonda inclui um sensor. O aparelho é configurado para decidir, com base na saída do sensor, que qualidade de acoplamento acústico é insuficiente e para emitir um alerta ao usuário após a decisão.
[017] Em um subaspecto relacionado, a segmentação é baseada em modelo.
[018] Em um subaspecto associado, a seleção é baseada e dinamicamente responsiva a um conteúdo de imageamento sendo dinamicamente capturado através da sonda.
[019] Em um subaspecto específico, a sonda de imageamento é ou inclui uma sonda de imageamento por ultrassom.
[020] Em um subaspecto mais completo, a apresentação guia dinamicamente um usuário em um procedimento para obter uma vista apical de um coração.
[021] Como um subaspecto adicionado, pelo menos um dos campos de visão é tridimensional.
[022] Em um diferente subaspecto, a captura dos dados de imagem a serem segmentados ocorre respectivamente a partir dos campos de visão.
[023] Em um subaspecto específico, um campo de visão dentre os campos de visão tem um ponto de vista que coincide com a localização. A orientação coincide com uma orientação da visualização do campo de visão.
[024] Em um subaspecto implementacional, o aparelho compreende adicionalmente uma tela e um console operável pelo usuário. O aparelho é configurado para: a) capturar dados de imagem através da sonda b) segmentar c) mostrar a retroinformação através da tela e d) portabilidade, como uma unidade que pode ser manualmente transportada.
[025] Em mais um outro subaspecto, a emissão de um alerta ao usuário para parar o ajuste é responsiva a um conteúdo de imageamento dinamicamente capturado através da sonda.
[026] Como um subaspecto adicional, o aparelho é configurado para detectar a parada.
[027] Em um outro subaspecto adicional, o aparelho é configurado adicionalmente para, responsivo à detecção de que houve uma parada, fazer a segmentação.
[028] Em um outro subaspecto específico, o aparelho é configurado para a segmentação em um modo relativamente grosseiro e em um modo relativamente fino. E é adicionalmente configurado para realizar a medição volumétrica com base em um ou mais segmentos formados como resultado da segmentação espacialmente mais fina. Realizar as medições é responsivo à conclusão da segmentação espacialmente mais fina.
[029] Em ainda um outro subaspecto, uma instrução para parar, como parte da retroinformação, está sujeita a um resultado de uma comparação entre a localização atual e a orientação atual da sonda e a localização e a orientação derivadas da segmentação.
[030] Em um subaspecto similar, a retroinformação inclui um indicador progressivo do andamento geral da captura da vista-alvo.
[031] Detalhes da tecnologia-guia de identificação com janela acústica inovadora, em tempo real, conduzida pela pausa do usuário, são apresentados adicionalmente abaixo, com o auxílio dos desenhos a seguir, que não são desenhados em escala.
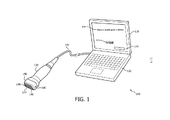
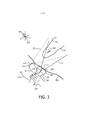
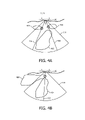
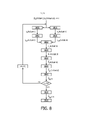
[032] A Figura 1 é uma vista em perspectiva de uma forma de aparelho portátil de acordo com a presente invenção; as Figuras 2A e 2B são fluxogramas de um procedimento clínico de ultrassom exemplificador de acordo com a presente invenção; a Figura 3 é um diagrama conceitual de como o aparelho é capaz de guiar, em tempo real, a colocação da janela acústica; as Figuras 4A e 4B são diagramas mostrando exemplos de esquemas para evitar o bloqueio do imageamento que usa imagens de guia na tela de segmentos dispostas em relação a um campo de visão de uma sonda ultrassônica, de acordo com a presente invenção; a Figura 5 é um fluxograma, e uma lista de fórmulas, relacionadas à Figura 4A; as Figuras 6A, 6B e 6C são, respectivamente, gráficos exemplificadores de dados da radiofrequência usados para distinguir o tecido pulmonar do tecido cardíaco e um algoritmo usado na distinção, de acordo com a presente invenção; a Figura 7 é um fluxograma representativo de um algoritmo de identificação do pulmão exemplificador com base em uma sonda unidimensional e a Figura 8 é um fluxograma representativo de um algoritmo de identificação do pulmão exemplificador com base em uma sonda de matriz.
[033] A Figura 1 mostra um aparelho portátil 100 como um exemplo de uma implementação de tecnologia-guia de identificação com janela acústica inovadora, em tempo real, conduzida pela pausa do usuário proposta na presente invenção. Embora mostrado aqui em uma forma facilmente transportável de uma sala para outra, em um ambiente clínico, o aparelho 100 pode, em vez disso, ser implementado como um dispositivo estacionário. O aparelho 100 inclui uma tela 110, um console do usuário 120, uma sonda de ecocardiografia transtorácica (TTE) 130 e um cabo da sonda 140 de comprimento estendido, conforme representado pelas linhas tracejadas na Figura 1. A tela 110 e o console do usuário podem ser similares aos usados em um computador laptop. Com um peso total de ao redor de 10 libras, a unidade 100 pode ser transportada à mão. A descrição abaixo presumirá o uso de um sistema de ultrassom, embora qualquer tipo de sistema baseado em sonda de imageamento controlado manualmente esteja dentro do escopo pretendido da invenção. Além disso, embora a quantificação volumétrica e o imageamento tridimensional ao vivo sejam recursos da modalidade abaixo, o que é proposto na presente invenção se aplica também ao imageamento bidimensional.
[034] O aparelho 100 é configurado para usar ultrassom para fazer um imageamento volumétrico, como calcular o tamanho do ventrículo esquerdo do coração ou calcular a fração de ejeção. Os resultados do cálculo são armazenados em uma memória (não mostrada). O imageamento ao vivo capturado através da sonda 130, e a partir do qual os cálculos são baseados, também é armazenado na memória. O conjunto de circuitos (não mostrado) para funções padrões, como formação de feixes dinâmica, conversão de varredura e obtenção de imagem também é incluído no aparelho 100. Dois ou mais formadores de feixes podem ser incluídos para detecção automática do bloqueio da imagem, que é discutida mais abaixo. O conjunto de circuitos adicional (não mostrado) inclui um processador-guia para o usuário configurado para apresentação dinâmica da retroinformação visual, isto é, as instruções ao usuário. Elas são de um tipo especificamente para guiar o ajuste manual, através da sonda 130, de uma localização e orientação associadas com a sonda, e consequentemente uma janela acústica. O processador dispõe dinamicamente a apresentação e dispõe a mesma seletivamente para guiar o usuário e em conformidade com as “atualizações” dos respectivos campos de visão tridimensionais. A atualização é um novo campo de visão, que é sugerido por um ou mais segmentos criados pela segmentação de uma imagem no campo de visão atual da sonda. O modelo no qual a segmentação é baseada fornece o novo campo de visão, com base em uma orientação e posição do(s) segmento(s). Esse novo campo de visão, quando comparado ao campo de visão atual da sonda, serve de indicador para notificar ao médico não treinado em sonografia como manipular a sonda 130. O processador emite todas as instruções ao usuário sobre como manusear manualmente a sonda 130 para obter iterativamente a janela acústica ideal.
[035] A segmentação não precisa ser tão detalhada para a “condução” descrita acima do campo de visão quanto para a quantificação depois que a janela acústica alvo é obtida. Um exemplo de segmentação com base em modelo que usa redes grossas e finas é encontrado na publicação de patente de propriedade comum US número 2009/0202150 concedida a Fradkin et al. (“Fradkin”). Os critérios de término de adaptação da Fradkin podem ser definidos para manter a segmentação grosseira para conduzir o campo de visão na presente modalidade do aparelho 100, ou definidos para proceder para a segmentação fina para a quantificação volumétrica com base em dados da presente modalidade. A condução e a quantificação são discutidas adicionalmente abaixo.
[036] Para localizar uma imagem para segmentação, o aparelho 100 é configurado adicionalmente para executar uma transformada de Hough generalizada (GHT). Um método para realizar uma GHT é discutido na publicação de patente de propriedade comum US n° 2008/0260254 conferida a Schramm et al.
[037] A revelação inteira de ambas as publicações está aqui incorporada, a título de referência.
[038] O aparelho 100 tem adicionalmente o recurso para detectar o movimento da sonda 130. O usuário vai frequentemente pausar o movimento da sonda de modo que a segmentação da imagem possa ocorrer. Além disso, o aparelho 100 vai verificar se uma instrução para pausar, por exemplo, porque a sonda 130 está perto de obter uma janela acústica alvo, ainda não foi seguida. Em uma modalidade, o aparelho 100 inclui a calculadora de incremento 80 revelada na patente de propriedade comum US n° 5.529.070 conferida a Augustine et al (“Augustine”). A calculadora de incremento 80 recebe valores por meio do cabo da sonda 140 que se originam dos acelerômetros (não mostrados) residentes na sonda 130. Ao contrário de Augustine, as leituras posicionais não precisam corresponder à captura de imagem. Assim, a calculadora de incremento pode ser simplificada para simplesmente detectar o movimento na localização e/ou orientação da sonda 130. Os acelerômetros podem ser distribuídos entre a parte distal e proximal da sonda 130, conforme visto nas Figuras 4, 5 e 5a de Augustine. A revelação inteira de Augustine relacionada à modalidade do acelerômetro está aqui incorporada, a título de referência. Alternativamente, um exemplo de uso dos sensores eletromagnéticos (EM) no rastreamento de uma ferramenta clínica é fornecido na patente de propriedade comum US n° 7.933.007 conferida a Stanton et al. Um sistema similar que também é fixa à ferramenta um sensor óptico é revelado na publicação de patente de propriedade comum US n° 2010/0168556 conferida a Shen et al. O movimento pode também ser detectado comparando-se imagens sucessivas em tempo real, conforme descrito na patente US n° de propriedade comum 6.299.579 conferida a Peterson et al. Todos os três documentos estão aqui incorporados a título de referência em sua totalidade.
[039] As funções acima para as quais o aparelho 100 é configurado podem ser implementadas com qualquer combinação adequada e conhecida de software, firmware e hardware. O processador-guia para o usuário pode ser realizado, por exemplo, em um dispositivo tendo um ou mais circuitos integrados, ou como uma mídia legível por computador programada adequadamente.
[040] A sonda 130 tem uma cabeça 150 contendo uma matriz 160 que inclui elementos transdutores 170. Embora, por uma questão de simplicidade, um número relativamente pequeno de elementos 170 sejam mostrados na Figura 1, o número pode ser tipicamente na casa dos milhares. Além disso, embora a matriz 160 seja mostrada como genericamente retangular, ela pode ser quadrada, circular, oval ou em um outro formato. E pode também ser plana, como em uma disposição linear, ou curva, como em uma matriz de setor.
[041] Mostrada para propósitos ilustrativos, na tela 110, está a retroinformação visual 144 do tipo especificamente para guiar o ajuste manual, através da sonda 130, da localização e orientação da matriz. Vantajosamente, um usuário não treinado em sonografia não precisa depender das imagens da escala de tons de cinza, como sonogramas, para se guiar. Então, não existe uma dependência da função de exibição da escala de tons de cinza (GSDF - “grayscale display function”), como representado pela observação na tela 175 que é riscada e representada na Figura 1. Em particular, a retroinformação visual 144 da modalidade mostrada na Figura 1 não inclui uma representação em escala de tons de cinza dos dados de imagem capturados através da sonda 130. Um outro exemplo de retroinformação visual 144 é a barra de andamento total na tela 178. Ela pode ser exibida como uma porcentagem, como “82%”, ou pode ser progressivamente preenchida e limitada por uma estrutura que representa 100%, isto é, conclusão.
[042] A sonda 130 tem, também, um par de luzes indicadores de pausar/prosseguir 180 (uma das quais está visível na Figura 1, com a outra no lado oposto da sonda) concebível como diodos emissores de luz (LEDs) vermelho/verde. Quando verde, a luz 180 indica que o usuário deveria buscar na tela 100 instruções e então proceder movendo a sonda 130 conforme instruído. Quando verde, a luz 180 indica que o usuário deve pausar o movimento da sonda 130. Ambas as luzes são simultaneamente da mesma cor.
[043] Como alternativa para as luzes 180, ou como uma implementação adicional para as luzes, luzes indicadoras de direção podem ser fornecidas. Nessa modalidade alternativa, quando uma luz está verde, a outra está vermelha. Quando verde, a luz indica que o usuário deve deslocar na direção do feixe de luz verde. O aparelho 100 já determinou que a sonda 130 está posicionado de maneira válida ao longo do espaço intercostal entre as duas costelas circundando a matriz 160, conforme discutido adicionalmente abaixo. Por outro lado, quando vermelha, a luz indica que o usuário deveria deslocar na direção oposta. Alternativamente ou além disso, a instrução para o deslocamento pode aparecer na tela 110.
[044] A sonda pode também incorporar um sensor de qualidade de acoplamento acústico (não mostrado). Distribuídos esparsamente entre os elementos do transdutor 170, isto é, no lugar dos elementos individuais, estão os sensores de pressão 190 dedicados a detectar pressão. A detecção é intercalada com a captura de imagem. Quando os elementos do transdutor 170 próximos de um sensor de pressão 190 estão ativos, e a leitura do sensor de pressão indica falta de pressão, isso indica um acoplamento acústico fraco. De modo mais genérico, se e quando o aparelho 100 decide, com base na saída do sensor de qualidade de acoplamento acústico, que a qualidade do acoplamento acústico é insuficiente, um alerta de usuário é emitido no momento da decisão. Alerta visual ou auditivo para os usuários pode ser fornecido, através da sonda 130 ou outras partes do aparelho 100. Como exemplo, o sensor de qualidade de acoplamento acústico pode compreender simplesmente 8 sensores de pressão 190 que estão dispostos entre 10.000 elementos do transdutor 170.
[045] As Figuras 2A e 2B mostram, por meio de exemplo ilustrativo e não-limitante, um procedimento de ultrassom clínico 200 demonstrando como o aparelho 100 guia visualmente um enfermeiro, ou outro usuário, sem experiência em sonografia. Nessa modalidade, uma vista apical das quatro cavidades do coração para imageamento deve ser registrada e as medições volumétricas cardíacas devem ser obtidas e armazenadas. O processo é em dois estágios. No primeiro estágio, o usuário move a sonda 130 até que o imageamento detecta pelo menos parte do coração, ou outro órgão de interesse. No segundo estágio, o usuário move a sonda 130, pausando frequentemente e recebendo instruções adicionais logo após cada pausa. Às vezes, o aparelho 100 determina que uma transição deve ser feita, do segundo estágio, de volta para o primeiro estágio. A conclusão bem-sucedida do procedimento de ultrassom 200 ocorre durante, isto é, no final, do segundo estágio.
[046] Operacionalmente, primeiro, o enfermeiro coloca os eletrodos do eletrocardiograma (ECG) sobre o paciente ou indivíduo do ultrassom, humano ou animal (etapa S202). O ECG fará parte do exame cardíaco. Ele também facilita a análise do imageamento cardíaco ao vivo que será registrado. No início, o usuário é instruído genericamente sobre o imageamento que será realizado, que as instruções ficarão visíveis na tela 110 e através das luzes 180, para interromper o movimento da sonda 130 imediatamente quando instruído, e, quando instruído, para mover a sonda, para pausar frequentemente de modo que o sistema possa fazer as leituras (etapa S204). Além disso, um marcador do estágio dois é desativado como parte da inicialização, já que o usuário está inicialmente no estágio um do procedimento 200. O usuário é então instruído a fazer com que o paciente se deite do seu lado esquerdo, de modo que o coração fique para frente no tórax do paciente para imageamento mais fácil (etapa S206). O usuário é instruído a começar da parte inferior da caixa torácica em um ponto abaixo do mamilo esquerdo, e contar até entre a quarta e a quinta costelas a partir da parte inferior da caixa torácica (etapa S208) até um ponto no qual ele deve colocar a cabeça 150 da sonda 130 para uma janela acústica inicial. A captura de imagem pela sonda é ao vivo e contínua. As instruções também mencionam que a sonda deve ser inclinada para cima para apontar em direção à base do pescoço do paciente para uma primeira estimativa. A instrução agora é: lembrar o posicionamento, retirar a sonda 130; aplicar o gel de acoplamento ao redor da face da sonda cobrindo a matriz 160; e reassumir o posicionamento da sonda em relação à localização e à orientação (etapa S210). Se, por um algoritmo de identificação de bloqueio, discutido adicionalmente abaixo, nenhuma costela for detectada (etapas S212, S214), uma ramificação leva de volta à etapa S206. De outro modo, se apenas uma costela for detectada (etapa S214), o usuário é instruído a deslocar ligeiramente para cima ou para baixo para ficar entre as duas costelas (etapa S216). Na tela, uma representação gráfica pode ser exibida de uma sonda direcionada a uma costela sendo deslocada para cima e para baixo do posicionamento entre duas costelas. O processamento retorna à etapa S212. Nesse circuito de processamento, e todos os circuitos de processamento que envolvem emitir uma instrução ao usuário, a instrução não é mencionada novamente se já tiver sido mostrada na tela. Se, por outro lado, outras costelas são detectadas, então, esse aspecto de posicionamento correto da sonda é validado. É feita uma pergunta sobre se um pulmão está bloqueando o campo de visão atual da sonda 130 (etapa S218). Essa determinação é feita pelo algoritmo de identificação de bloqueio discutido mais abaixo. Se houver tecido pulmonar presente no campo de visão (etapa S218), o usuário é instruído a fazer com que o paciente expire e segure a respiração (etapa S220). Isso pode tirar o pulmão do campo de visão, já que o pulmão pode sair e entrar no campo de visão com cada inspiração e expiração do paciente. Se o pulmão é detectado novamente e, portanto, ainda estiver bloqueando o campo de visão (etapa S222), o usuário é instruído a fazer com que o paciente volte a respirar normalmente (etapa S224). Como o pulmão bloqueando o coração seria o pulmão esquerdo e como o pulmão é menos central no tórax que o coração, o usuário é instruído a deslocar a sonda 130 para cima, isto é, em direção ao esterno (etapa S226). As luzes indicadoras de pausar/prosseguir 180 na sonda 130 estarão verdes. O usuário pode também ser instruído a inclinar a sonda 130 ligeiramente em direção mais para o lado esquerdo do paciente, quando a sonda é deslocada para cima. É feito um retorno para a etapa S212. Alternativamente ou além disso, um “V” invertido na tela pode ser mostrado ao usuário pelo qual o usuário pode interativamente deslocar e inclinar a sonda 130 para evitar o pulmão. O mesmo “V” poderia ser usado para guiar o usuário a inclinar e trasladar a sonda para evitar as costelas. Se, por outro lado, depois de fazer com que o paciente segure a respiração (etapa S220), os pulmões não bloquearem mais o campo de visão (etapa S222), ou se os pulmões não estavam bloqueando inicialmente (etapa S218), é feita uma pergunta de se pelo menos parte do coração é detectada no imageamento ao vivo pela sonda 130 (S228). A GHT de Schramm, mencionada acima, é utilizada para essa detecção. Embora o ventrículo esquerdo (LV) possa ser a parte do coração para a qual a quantificação é desejada, detectar parte do coração pode envolver até detectar simplesmente o átrio esquerdo, ou a válvula mitral, por exemplo. Um nível de confiança predeterminado precisa ser satisfeito na decisão de se ocorreu detecção. Por exemplo, na referência de Schramm, a medição da determinação ideal do conjunto de parâmetros de transformação pode ser necessária para satisfazer ao limite predeterminado.
[047] Se o coração não é detectado (S228), o usuário é instruído a “Deslocar lentamente para baixo na direção contrária ao esterno, deslocar lentamente para cima em direção ao esterno, cada vez mais”. Uma representação gráfica do movimento do padrão pode ser exibida na tela 110 (etapa S230). O procedimento 200 volta à etapa S212.
[048] Se, por outro lado, parte do coração é detectado (etapa S228), é feita a pergunta sobre se o marcador do estágio dois, que foi desativado durante a inicialização na etapa S204 for reativado (etapa S232). Se não estiver (etapa S232), o usuário é instruído a pausar e esperar as instruções (etapa S234). A pausa é necessária porque a segmentação, mesmo a segmentação grosseira, requer um período de tempo curto, por exemplo, dois segundos. Especificamente, as luzes indicadoras de pausar/prosseguir 180 na sonda 130 ficarão vermelhas e/ou a exibição 110 vai mostrar, em vermelho, uma instrução para pausar. Um curto bipe de áudio também será emitido. O aparelho 100 detecta, através dos acelerômetros na sonda 130, se o movimento da sonda foi pausado (etapa S236). Até o movimento pausar (etapa S236), a retroinformação visual e de áudio para pausar é mantida (etapa S238). Quando uma pausa é detectada (etapa S236), uma verificação é novamente feita de se parte do coração foi detectada (etapa S240). Essa precaução é tomada para determinar se o usuário pausou rápido o bastante para ainda estar capturando imagem de parte do coração.
[049] Se não houver mais detecção de parte do coração (etapa S240), a instrução (etapa S242) é “Retorne lentamente pelo seu movimento mais recente e pause quando instruído para obter novamente a visão (parcial) do coração... caso contrário, mude de direção conforme instruído”. É feito então um retorno para a etapa S212.
[050] Por outro lado, se pelo menos parte do coração ainda é detectado (etapa S240), uma segmentação de imagem grosseira do órgão corporal (no caso, o coração) é feita (etapa S244) com o uso de um modelo (etapa S245).
[051] Se o aparelho 100 tiver o recurso de direcionamento eletrônico, uma pergunta é feita agora sobre se o coração inteiro, julgando pelo(s) segmento(s), está dentro do campo de visão atual da sonda 130 (etapa S246).
[052] Se o coração inteiro não estiver dentro do campo de visão atual (etapa S246) ou se o aparelho 100 não tiver o recurso de condução eletrônica, uma transformação do sistema de coordenadas é calculada (etapa S247). Em particular, a segmentação produz um ou mais segmentos do coração tendo uma localização e orientação no espaço da imagem da sonda 130. A localização e orientação são conhecidas do modelo. Com base na localização e orientação, é determinado o que seria um ponto de vista e orientação de visualização ideais para um campo de visão geometricamente fixo da sonda que cobre o coração inteiro ou seção do coração, por exemplo, o ventrículo esquerdo, sendo investigado. Por exemplo, tanto a válvula mitral quanto o ápice do coração podem ser identificados por segmentação, e um eixo conectando ambos pode ser, ou pode ser próximo a, uma orientação de visualização ideal para as imagens cardíacas de quantificação e diagnóstico. O campo de visão é geometricamente fixo, porque pressupõe-se que o usuário não é treinado em sonografia e, por uma questão de simplicidade, está sendo guiado simplesmente para mover a sonda de acordo com as instruções visuais. O ponto de vista e a orientação da visualização ideal derivada será, em geral, diferente do ponto de vista e orientação atuais da sonda. Os pontos de vista e as orientações de visualização estão todos no espaço da imagem da sonda 130. O aparelho 100 calcula uma transformação no sistema de coordenadas que faria o ponto de vista e a orientação atuais coincidir com o ponto de vista e a orientação ideais derivados.
[053] Depois que a transformação é calculada, a barra de andamento total na tela 178 é atualizada (etapa S248).
[054] O andamento tem por base a magnitude do componente de translação da transformação e, em um grau menor ou em um estágio posterior, a magnitude do componente de rotação da transformação.
[055] O comprimento da barra de andamento 177 seria, dessa forma, relacionado à porcentagem, 100 menos uma média ponderada dos dois componentes que é não-negativa e menos que a unidade.
[056] A mesma métrica, ou similar, é usada pelo aparelho 100 para decidir se a vista atual está suficientemente sobre o alvo para começar a quantificação e opcionalmente a captura de imagens ao vivo para armazenamento. Alternativamente ou além disso, o aparelho 100 pode determinar, com base no modelo, se o coração, ou seção coração, está inteiro ou suficientemente dentro do campo de visão atual da sonda 130 (etapa S249).
[057] Se for determinado na etapa S249 que o campo de visão atual da sonda 130 não está suficientemente próximo ao campo de visão ideal, uma decisão é tomada de se a inclinação ou deslocamento predominam como a seleção para a próxima instrução ao usuário (etapa S250). De modo geral, o deslocamento vai predominar se sobrar algum; embora, se o restante for muito pequeno, a inclinação poderá ser suficiente. Os parâmetros para tomar a decisão podem ser estabelecidos de forma empírica. Seguindo adiante nessa parte do procedimento 200, a apresentação ao usuário da retroinformação visual 144 é disposta dinamicamente com base seletiva em uma comparação entre o campo de visão atual da sonda 130 e o ponto de vista e a orientação da visualização ideais derivadas da etapa S247. Por exemplo, tem por base a necessidade de deslocar e/ou inclinar, sendo essas necessidades avaliadas com base na comparação. A seleção ocorre inerentemente de acordo com quais instruções ao usuário mencionadas abaixo são emitidas no procedimento 200. É observado aqui que a disposição da apresentação de retroinformação visual 144 mais cedo no procedimento 200, como nas etapas S212-S228, é realizada dinamicamente e seletivamente e tem por base o conteúdo da imagem capturada, mas não a comparação mencionada acima. Portanto, alguma, mas não toda a disposição seletiva dinâmica da retroinformação visual 144 dentro do procedimento 200 tem por base a comparação.
[058] Se o deslocamento predomina (etapa S250), é feita a pergunta sobre se a translação indicada envolveria atravessar uma costela para entrar no espaço intercostal adjacente, dada a posição das costelas (etapa S251). O aparelho 100 sabe a posição das costelas através de um algoritmo de identificação de bloqueio mencionado acima em relação às etapas S212 e S214 e discutido adicionalmente mais adiante neste documento. Se a translação não é possível (etapa S251), o usuário é consequentemente instruído a, depois de aplicar novamente o gel de acoplar à sonda 130, deslocar para cima ou para baixo da caixa torácica (etapa S253). O marcador do estágio dois é desativado, e o processamento volta à etapa S210. Se, por outro lado, a translação é possível (etapa S251), o usuário é instruído a deslocar lentamente na direção determinada pelo aparelho 100, pausando frequentemente (etapa S254). Dessa forma, a instrução para o usuário fica entre aquelas dinamicamente e seletivamente dispostas com base na comparação mencionada acima.
[059] Se, por outro lado, o deslocamento não predominar na etapa S250, o usuário é instruído a inclinar a sonda 130 lentamente na direção determinada (etapa S255). A instrução pode ser “inclinar lentamente apontando para dentro em direção ao esterno, parando frequentemente” ou “inclinar lentamente apontando para baixo em direção aos pés do paciente, parando frequentemente”, alguma combinação dessas duas instruções, etc. Essa instrução está então entre aquelas dinamicamente e seletivamente dispostas com base na comparação mencionada acima.
[060] Alternativamente ou além disso, a tela 110 pode mostrar uma representação gráfica interativa do órgão segmentado, aqui os segmentos definindo um coração, como um objeto segmentado na tela com um “V” invertido sobreposto representando o campo de visão da sonda 130. Uma segunda representação separada concomitante pode ser mostrada para um “V” na direção ortogonal. A representação gráfica é discutida mais abaixo.
[061] Depois da instrução para as emissões da etapa S254 ou S255, é feita uma pergunta sobre se ocorreu movimento desde a etapa S236. Isso pode ser determinado através dos acelerômetros na sonda 130. Se tal movimento ocorreu e se não há mais movimento agora (etapa S256), o marcador do estágio dois é reativado (etapa S257), e o processamento volta à etapa S212.
[062] Se, por outro lado, for determinado na etapa S249 que o campo de visão atual da sonda 130 está suficientemente próximo ao campo de visão ideal, o aparelho 100 emite uma instrução para parar (etapa S258). Especificamente, as luzes indicadoras de pausar/prosseguir 180 na sonda 130 ficarão vermelhas e/ou a exibição 110 vai mostrar, em vermelho, uma instrução para parar. Um breve bipe de áudio também será emitido. O aparelho 100 detecta, através dos acelerômetros na sonda 130, se o movimento da sonda foi parado, isto é, pausado ou interrompido (etapa S260). Até o movimento ser parado (etapa S260), a retroinformação visual e de áudio para parar é mantida (etapa S262). Depois que o movimento é parado (etapa S260), é feita a pergunta, como na etapa S249, sobre se a vista atual está suficientemente sobre o alvo para começar a quantificação e opcionalmente a captura de imagens ao vivo para armazenamento (etapa S264). Se a vista atual não estiver, isto é, não estiver mais sobre o alvo (etapa S264), a barra de andamento 178 é consequentemente reduzida para refletir o retrocesso no andamento em direção à conclusão do procedimento 200 (etapa S266). É emitida uma instrução para o usuário retornar lentamente ao movimento mais recente da sonda, parando frequentemente (etapa S268). O processamento ramifica para a etapa S257. Se, por outro lado, a vista atual está suficientemente sobre o alvo para começar a quantificação e opcionalmente a captura de imagens ao vivo para armazenamento (etapa S264), o usuário é instruído a manter a sonda parada para a conclusão do procedimento 200 (etapa S270). A segmentação fina é realizada para a quantificação (etapa S272). O modelo é utilizado para esse propósito (etapa S274). O aparelho 100 começa a gravar o imageamento ao vivo do coração ou seção do coração (etapa S276). Se o aparelho 100 inclui um recurso de condução eletrônica, várias vistas do coração, como as vistas padrão podem ser reproduzidas novamente na gravação. O aparelho também faz medições volumétricas a partir da segmentação (etapa S278). Por exemplo, o tamanho do ventrículo esquerdo (VE) é calculado, em um ciclo do coração, encontrando-se o comprimento médio ou máximo e encontrando-se a respiração média ou máxima, por exemplo. De modo semelhante, a fração de ejeção é calculada detectando, em um ciclo cardíaco, o volume máximo e mínimo do VE, e obtendo-se uma razão das duas quantidades. Os dados da quantificação são armazenados na memória (etapa S280).
[063] Se, por outro lado, o coração inteiro estiver dentro do campo de visão atual (etapa S246) e se o aparelho 100 tiver um recurso de condução eletrônica, a barra de andamento 177 vai mostrar uma quase conclusão (etapa S282). Uma instrução para parar é fornecida na etapa S284. Enquanto o movimento da sonda 130 é detectado (etapa S286), um alerta para o usuário parar é mantido (etapa S288). Depois que for detectado que a sonda 130 foi parada (etapa S286), é feita novamente a pergunta sobre se o coração inteiro está no campo de visão (etapa S290). Se o coração inteiro ainda estiver no campo de visão (etapa S290), o processamento se ramifica para a etapa S270 para instruir o usuário a pausar para a conclusão do procedimento 200. Caso contrário, se o coração inteiro não estiver mais dentro do campo de visão (etapa S290), o processamento se ramifica para a etapa S266 para tentar recuperar a imagem do coração inteiro.
[064] A Figura 3 mostra, conceitualmente, como o aparelho 100 consegue guiar, em tempo real, o posicionamento da janela acústica. Uma sonda 302 é mantida pela mão do médico 304 contra a pele 306 de um paciente. Mais especificamente, a sonda 302 tem uma cabeça 308 que tem uma face 310 para ser colocada contra a pele 306, separada da pele apenas pelo meio de acoplamento acústico, como um gel especializado. Dentro da cabeça 308 e ao longo da face 310 está uma matriz 312. Estendendo-se a partir da matriz 312 está um campo de visão 314. O coração 316 do paciente está parcialmente, aqui principalmente, dentro do campo de visão 314, e sua imagem está sendo obtida através da sonda 302. Como parte do coração 316 é detectado com um nível suficiente de confiança, o médico foi instruído a pausar e fez isso imediatamente. Como resultado da segmentação da imagem em segmentos 318, o aparelho 100 determina, através do modelo, uma orientação 320 que forneceria uma vista ideal ou direcionada do coração 316 se a sonda 302, ou alguma parte da sonda, como a matriz 312, assumissem essa orientação de uma localização adequada 318. O modelo também fornece a localização 318. Por uma questão de simplicidade de explicação, uma seta curva 321 na Figura 3 inicia em uma localização 322 e orientação 324 da sonda 302. Ela termina na localização fornecida pelo modelo 318 e na orientação fornecida pelo modelo 320 que são derivadas da segmentação da imagem. A seta curva 321 representa a comparação do campo de visão 314 com a localização e a orientação fornecidas pelo modelo 318, 320. A comparação envolve uma transformação do sistema de coordenadas que faria a localização e orientação fornecidas pelo modelo 318, 320 coincidir com a localização atual 322 e a orientação atual 324 da sonda 302. A transformação tem um componente translacional 326 e um componente rotacional 328. A retroinformação visual 144 no procedimento 200 é selecionada com base nas magnitudes dos componentes 326, 328, como, por exemplo, nas etapas S248, S249 e S264 das Figuras 2A e 2B. Uma outra seta curva 330 na Figura 3 mostra a mão do médico 304 manuseando a sonda 302, com base na retroinformação 144, em uma vista apical 332.
[065] No exemplo mostrado, o coração 316 está parcialmente fora do campo de visão atual 314. A condução eletrônica para um campo de visão favorável correspondendo à vista apical 332 ainda não consegue capturar o conteúdo de imageamento que estava fora de visão antes da condução eletrônica. Consequentemente, confiar na condução eletrônica no exemplo mostrado para reduzir o procedimento 200 pode comprometer o resultado, dependendo do impacto da perda desse conteúdo de imagem específico.
[066] Se, entretanto, a Figura 3 for redesenhada, com o coração 316 completamente dentro do campo de visão atual 314, o procedimento de condução eletrônica procede, conforme descrito acima, desde que o aparelho 100 tenha o recurso de condução eletrônica. Dessa forma, a vista apical 332 é obtida sem o manuseio da sonda 302, manuseio esse sendo representado pela seta curva 330. Em vez disso, é obtida por condução eletrônica. Embora o manuseio manual da sonda 203 pode ter sido necessário mais cedo no procedimento para obter a detecção de parte do coração 316 (etapa S228), a condução eletrônica pode, quando o coração inteiro estiver sendo visualizado, reduzir a necessidade do manuseio manual adicional da sonda.
[067] Vantajosamente, o usuário é guiado por um procedimento para obter uma vista apical do coração.
[068] Conforme mencionado anteriormente neste documento, a detecção de que as costelas próximas ao espaço intercostal atual estão dentro do campo de visão faz parte da validação de que a janela acústica atual, colocada para encontrar uma janela acústica ideal, é válida. Instruções ao usuário sobre como manusear a sonda ao redor dos pulmões para visualizar o coração também são mencionadas anteriormente neste documento.
[069] A ecocardiografia é difícil, já que o coração é circundado pelas costelas e tecido pulmonar. O ultrassom mal pode penetrar nas costelas calcificadas (encontradas tipicamente na vista apical) e no tecido pulmonar por causa do grave desacordo da impedância acústica entre eles e outros tecidos moles. Além disso, a absorção do ultrassom nas costelas é muito alta em comparação com o tecido. Convencionalmente, a otimização da qualidade da imagem de ultrassom é feita somente pelo usuário com base nas imagens de ultrassom em tempo real representadas pela escala de tons de cinza na tela. Ainda que usuários experientes são geralmente capazes de reconhecer a degradação da imagem e melhorar a qualidade da imagem consequentemente deslocando a sonda para uma posição melhor, usuários menos experientes podem capturar imagens comprometidas devido a uma coordenação inferior de mão-olho e conhecimento menor dos artefatos. Um ultrassom bem- sucedido depende fortemente do treinamento e da experiência do usuário. Para ajudar os usuários inexperientes ou menos experientes a obter informações significativas do coração com o uso de ecocardiografia, um sistema de ultrassom anatomicamente inteligente é desejado.
[070] Como o ultrassom mal pode penetrar na costela calcificada, é pouco provável que ecos profundos de um feixe de ultrassom atingindo a costela calcificada sejam dos tecidos abaixo da costela. Ao invés disso, eles podem ser captados pelos lóbulos laterais. O artefato visual é passível de reconhecimento por um ultrassonografista experiente visualizando o (escala de tons de cinza) sonograma, mas pode ser facilmente não reconhecido pelo usuário inexperiente.
[071] Além disso, para se obter uma boa qualidade de imagem para um usuário inexperiente, um sistema de ultrassom deve estar ciente da presença do tecido pulmonar.
[072] Um algoritmo de identificação de bloqueio descrito a seguir é especializado para detectar tecido pulmonar, e especificamente tecido das costelas, bloqueando o campo de visão. Um segundo algoritmo de identificação de bloqueio descrito a seguir é projetado especificamente para detectar o bloqueio do tecido pulmonar. Eles são discutidos na vista dos desenhos a seguir.
[073] As Figuras 4A e 4B mostram exemplos de esquemas para evitar o bloqueio do imageamento que usa imagens de guia na tela de segmentos dispostas em relação a um campo de visão de uma sonda ultrassônica.
[074] Ambas as figuras apresentam um sonograma. O sonograma da Figura 4A é um pedaço da imagem que corre ao longo do comprimento de um paciente; enquanto o sonograma da Figura 4B é um pedaço da imagem que corre ao longo da largura de um paciente.
[075] A Figura 4A refere-se não somente ao primeiro algoritmo, mas também a uma tela interativa como parte da retroinformação visual 144.
[076] A matriz 160 tem um campo de visão atual 314 que inclui parcialmente as costelas 404, 408 e inclui parcialmente (e aqui mais inteiramente) um coração 412. O primeiro algoritmo calcula as linhas de contorno do bloqueio 416, 420 que correspondem ao contorno entre feixes de ultrassom bons e aqueles que são ruins devido ao bloqueio por parte das costelas 404, 408.
[077] A coerência dos dados da canaleta é usada para detectar o bloqueio. Cada canaleta fornece sua respectiva magnitude de dados de radiofrequência associada ao seu respectivo elemento transdutor fixo 170 ou porções de elementos. Quando um eco de ultrassom volta, amostras das suas pressões incidentes sobre os elementos 170 são rápida e periodicamente tomadas. As amostras são atrasadas uma em relação à outra de acordo com a geometria do tempo de deslocamento da linha de visão do ponto de campo sendo avaliado. Aqui, “coerência” significa similaridade entre os dados registrados pelas diferentes canaletas de uma matriz após a aplicação dos atrasos de focalização dos receptores mencionados acima.
[078] Uma medida de coerência é um método de estimativa de coerência com base em dados somados dos feixes, como o descrito na publicação de patente US n° 2009/0141957 concedida a Yen et al., cuja revelação está aqui incorporada, a título de referência.
[079] O método de estimativa pode ser projetado para detectar o bloqueio da costela e do pulmão, e é demonstrado abaixo com o uso de dois formadores de feixe. Sejaos dados da canaleta (valores reais) na profundidade r recebidos pela ja canaleta depois da aplicação do atraso de focalização, e sejam S e C1 e C2 o conjunto de canaletas usadas no primeiro e no segundo formador de feixes, respectivamente. A saída do k° (k = 1, 2) formador de feixes é cuja fórmula é mostrada na Figura 5. Quando todos os ρ dados da canaleta forem idênticos para todas as canaletas, e serão altamente correlacionados não importa como C1 e C2- forem escolhidos. Por outro lado, quando os dados da canaleta forem contribuídos principalmente por espalhadores nas regiões do lóbulo lateral, a correlação entre b1 e b2 pode cair significativamente se e C- forem escolhidos adequadamente. C1 e C2 podem ser complementares, intercalando aberturas. Resumindo, é possível distinguir sinais no eixo e sinais fora do eixo com base na correlação entre b1 e b2. A saída do correlacionador é o coeficiente de correlação de e definido, conforme mencionado na Figura 5, onde w é uma função da ponderação simétrica real. passa então por um filtro passa-baixo para obter um mapa de correlação suavizado que é usado para detecção de bloqueio. Um diagrama de fluxo do algoritmo, isto é, o “primeiro algoritmo”, é mostrado na Figura 5. As somas de são obtidas para C1 (etapa S510) e para C2 etapa S520). Elas são correlacionadas para calcular o coeficiente de correlação (etapa S530) que passa por um filtro passa-baixo (etapa S540) para produzir o mapa de correlação suavizado usado para detecção de bloqueio (etapa S550). A linhas de borda são então geradas para a exibição do “V” invertido (etapa S560).
[080] Em um exemplo específico, os dados são capturados a uma taxa de amostragem de 32 MHz em um modo de inversão de pulso com o uso de uma sonda que tem 80 elementos 170. Cada quadro tem 44 feixes e a densidade de feixe é 0,4944 feixe/grau. A frequência central é 1,3 e 2,6 MHz na transmissão e na recepção, respectivamente. 2 = {20-22, 26-28, 32-34, 38-40, 44-46, 50-52, 56-58} e 2-= {23-25, 29-31, 35-37, 41-43, 47-49, 53-55, 59-61}. A função-peso w usada no correlacionador é um vagão de 51 (axialmente ou na direção r) por 1 (lateralmente ou na direção θ) e o filtro de suavização é um vagão de 501 por 3. Devido à estrutura periódica das aberturas, a sensibilidade do coeficiente de correlação aos sinais fora do eixo varia periodicamente com a direção dos sinais fora do eixo. Essa periodicidade pode ser reduzida pela randomização dos tamanhos das subaberturas mantendo, ao mesmo tempo, ambas as aberturas complementares.
[081] Para verificar se um feixe está bloqueado, uma contagem é feita a partir do número de pontos com um coeficiente de correlação maior que 0,55 entre 72 e 180 mm de profundidade. Se pelo menos 400 pontos (taxa de amostragem de 32 MHz) em um feixe têm alta coerência, esse feixe é considerado penetrante no tecido. Caso contrário, é considerado bloqueado por uma costela.
[082] Com referência novamente à Figura 4A, e contando as 80 canaletas da esquerda para a direita, talvez a 20a canaleta apresente o primeiro feixe exibindo alta coerência; enquanto o 19° feixe não exibe alta coerência. Dessa forma, a linha de contorno do primeiro bloqueio 416 é mostrada na Figura 4A no 19° feixe. De modo semelhante, se a 59a canaleta exibe alta coerência, mas a 60a canaleta não exibe alta coerência, a linha de contorno do segundo bloqueio 420 é colocada em coincidência com o 59° feixe.
[083] O limite superior da faixa de profundidade não é de importância crítica. 72 mm, muito maior que a profundidade das costelas humanas em geral, pode ser escolhido como o limite inferior porque os valores elevados do fator de coerência podem estar presentes nas regiões logo abaixo de uma costela devido a reflexões múltiplas (ou reverberação), e tais reflexões tendem a desaparecer com a profundidade.
[084] As aberturas descritas não incluem canaletas em ambas as extremidades da abertura completa. Embora as aberturas possam ser ampliadas para incluir essas canaletas, o número de feixes bloqueados pode ser subestimado se aberturas grandes forem usadas. Isso se deve ao fato de que o coeficiente de correlação das saídas de aberturas complementares poderia ainda ser alto se parte das aberturas grandes complementares não estiver bloqueada.
[085] Embora a modalidade acima use imagens 2D capturadas com uma sonda 1D, a metodologia pode ser aplicada em sondas da matriz e, portanto, imageamento volumétrico 3D para guiar usuários novatos na obtenção de capturas volumétricas.
[086] A Figura 4A também mostra uma imagem que pode ser exibida para guiar interativamente o médico. A imagem do coração 412 pode ser implementada como o(s) segmento(s) definindo o coração em virtude da segmentação grosseira (etapa S244). O coração 412 está praticamente, mas parcialmente, fora do campo de visão 314. Quando o médico desloca a sonda 302 de acordo com a retroinformação visual 144 na tela ou sob a forma de luz verde 180 na sonda, a imagem da Figura 4A é atualizada em tempo real. O “V” invertido pode facilmente ser feito para englobar completamente o órgão desejado, no caso, um coração. A imagem da Figura 4A, como parte da retroinformação visual 144, pode suplementar as etapas S212, S214 e S255 descritas acima em conjunto com as Figuras 2A e 2B.
[087] Para otimizar o posicionamento da sonda, a amplitude do V pode ser aumentada com o uso de uma tela no plano x.
[088] Análoga à Figura 4A, a Figura 4B refere- se não somente ao segundo algoritmo, mas também a uma tela interativa como parte da retroinformação visual 144.
[089] A matriz 160 tem um campo de visão atual 314 que inclui um coração 424 e parte de um pulmão 428. O segundo algoritmo calcula uma linha de contorno de bloqueio 432 que corresponde ao limite entre feixes de ultrassom bons e aqueles que são ruins devido ao bloqueio por parte do pulmão 428.
[090] No segundo algoritmo, a frequência central dos dados da radiofrequência (RF) capturados em modos de inversão de pulso (IP) é usada como o parâmetro para distinguir o tecido pulmonar do tecido cardíaco.
[091] Dados de amostra de radiofrequência com uma frequência central de transmissão de 2,1 MHz são mostrados nas Figuras 6A e 6B. O gráfico da Figura 6A representa a interrogação do tecido pulmonar; enquanto o gráfico da Figura 6B representa a interrogação do tecido cardíaco. Os tecidos pulmonar e cardíaco parecem mais diferentes no imageamento com inversão de pulso do que no imageamento convencional. Por exemplo, o tecido pulmonar respondeu melhor a frequências mais baixas.
[092] O gráfico da Figura 6A resultou da resposta linear do tecido pulmonar aos sinais autodemodulados. Com a transmissão de banda larga, após a propagação não linear, a soma do pulso positivo e negativo apresentará um sinal finito ao redor de 1 MHz, aproximadamente metade da frequência central na transmissão, um fenômeno chamado de autodemodulação. O tecido pulmonar responde a esse sinal de baixa frequência melhor que o tecido cardíaco. Por outro lado, se comparado com o tecido pulmonar, o tecido cardíaco tende a favorecer componentes de frequência mais alta em um modo IP devido aos seus resultados de movimento mais fortes em supressão menos perfeita em frequências mais altas.
[093] Parte do segundo algoritmo envolve a estimativa da frequência central dos dados de RF. Sendo r(n) uma amostra de um sinal da linha A e R(n) e; seu envelope complexo. fc(n)a frequência central local de r(n) é relacionada R(n) por Onde denota fase/argumento e fs é a taxa de amostragem. Estimadores de fc(n) podem ser derivados com base em (1). Um exemplo de um estimador é: como estimador. Obter a média com base na função da janela w(i) reduz a variância.
[094] Em um exemplo, a transmissão é de 2,1 MHz em um modo de alta resolução, a taxa de amostragem é de 32 MHz e a densidade de feixe é 0,72 feixe/grau. Uma imagem ou quadro consiste de 64 feixes com 2 transmissões por feixe. Os ecos da RF em um quadro são denotados como , onde os subscritos p e n correspondem ao pulso positivo e negativo na transmissão respectivamente, e n e θ = 0(k) (k é o índice de feixe) denotam o índice de tempo e o ângulo respectivamente.
[095] A Figura 6C mostra o fluxograma da primeira versão do segundo algoritmo, onde denota convolução e h(n) é um filtro de passagem de banda (passa- faixa) de lado único de 121 derivações complexo entre 0,95 e 2,05 MHz. O mapa da frequência central é obtido de feixe em feixe com base na equação (2) com uma janela de Hamming de 301 derivações e depois suavizado por um filtro vagão de 301 (axialmente ou na direção n) por 5 (lateralmente ou na direção θ) para obter . A última etapa é estimar o ângulo de contorno entre o coração e o pulmão usando o mapa de frequência central suavizado As etapas na Figura 6C são a adição (etapa S610), a filtragem temporal complexa (etapa S620) a estimativa da frequência central (etapa S630), filtragem 2D (etapa S640) e estimativa do contorno (etapa S650).
[096] A estimativa do ângulo de contorno envolve limiarização múltipla. Inicializando com a primeira relação de limiarização: Para um feixe (isto é, dado um θ) para qualificar como uma região do coração, a frequência central tem que satisfazer à seguinte condição:
[097] Ou seja, apenas se nenhuma das frequências centrais médias entre o 1500° e o 3000° pontos (entre 36 mm e 72 mm), entre o 1501° e o 3001° pontos, _, e entre o 2500° e o 4000° pontos (entre 60 mm e 96 mm) for menor que fu1, um feixe pode ser considerado como passando pelo tecido cardíaco. A coleção de índices de feixes qualificados é denotada como o conjunto A1. Por exemplo, (observando que os 64 feixes são contados da direita para a esquerda na Figura 4B e que os dois primeiros e os dois últimos feixes não estão qualificados por causa do filtro de suavização espacial) para . . Consequentemente, o ângulo de contorno pode ser estimado como o ângulo médio dos feixes 32 e 33,(k) sendo uma função crescente de k. A linha de contorno do bloqueio 432 corresponde ao ângulo de contorno.
[098] O tecido pulmonar nunca pode aparecer do lado direito do coração (da perspectiva do paciente) se a sonda estiver posicionada corretamente, a menos que a imagem mostrada na Figura 4B esteja, na verdade, invertida. Podemos, assim, sempre estimar o contorno com base no feixe da extrema esquerda que satisfaz à condição definida em (3). Por exemplo, se ., o ângulo de contorno ainda poderia ser estimado como o ângulo médio sobre os feixes 32 e 33.
[099] A robustez da identificação do pulmão pode ser aprimorada com a inclusão de critérios adicionais. O segundo limiar é usado para detectar regiões com frequência central muito baixa: Dado um ângulo do feixe de luz θ, se a frequência central satisfizer pode ser considerado que esse feixe passou através do tecido pulmonar. A coleção de índice de feixes que satisfazem (4) é denotada como A2. . no caso mostrado na Figura 4 for e portanto não tem conflito com o correspondente A1.
[0100] O terceiro (e último) limiar é usado para detectar regiões com frequência central muito elevada: Dado um ângulo do feixe de luz θ(k), se a frequência central satisfizer pode ser considerado que esse feixe passou através do tecido cardíaco. Ou seja, se 5 feixes consecutivos apresentam frequência central muito elevada, o feixe central tem uma grande possibilidade de passar pelo tecido cardíaco. A coleção de índices de feixes que satisfazem (5) é denotada como A3.
[0101] Na prática A1,A2 e A3 podem não ser consistentes um com o outro. Por exemplo, a intersecção de A1 e A2 pode ser não vazia, significando que poderia ser considerado que algum feixe passou pelo tecido cardíaco e pulmonar. Consequentemente, as coleções podem ser organizadas de acordo com a prioridade. Especificamente A3 (a condição de muito alta frequência definida em (5)) recebe prioridade máxima e A1 (a condição de alta frequência definida em (3) ) recebe prioridade mínima. “Tecido cardíaco ajustado configurado” é definido como onde é o elemento máximo de A3 e é definido como se A3 está vazio. A seguinte definição é equivalente: onde
[0102] O contorno entre o coração e o pulmão é estimado com base no maior elemento de Ah . Por exemplo, se e ., então, , e o ângulo estimado de contorno . é o ângulo médio sobre os feixes 48 e 49. Um .Ah, vazio indica o tecido pulmonar ocupando toda a imagem. Se Ah, não está vazio, onde . Como o filtro de suavização 2D deteriora os feixes pelos lados, conclui-se que nenhum tecido pulmonar aparece na imagem se (número de feixes) - (metade da dimensão lateral do filtro de suavização 2D)
[0103] O papel de fu1 é muito mais importante que o de f1, mas ocasionalmente, a existência de .A2 contribui positivamente na determinação do contorno. Para recapitular, nessa primeira versão do segundo algoritmo,
e
[0104] Uma segunda versão do segundo algoritmo também refere-se a sondas 1D e dados IP capturados em modo de alta resolução. Conforme mencionado acima, o tecido pulmonar responde bem aos componentes de sinal de baixa frequência de maneira linear, e o movimento causa uma supressão menos perfeita em frequências mais altas no tecido cardíaco em um modo IP. Isso implica na possibilidade do aprimoramento do desempenho substituindo por um sinal compósito na cadeia de processamento de sinal mostrada na Figura 6C. Por esse motivo, há uma segunda versão do segundo algoritmo. A Figura 7 mostra como é formado, onde: que é a etapa S710 , , a etapa S730 é idêntica à etapa S610, que e a etapa S740 , que é a etapa S750 h1(n) é um filtro passa-baixa real de 101 derivações com frequência de corte em 0,8 MHz, e hu(n) é um filtro passa-alta real de 101 derivações com frequência de corte em 1,15 MHz. Ecos do tecido pulmonar favorecem (porque respondem bem aos componentes de baixa frequência) e ecos do tecido cardíaco favorecem (por causa do maior movimento), wd e ws são pesos usados para equilibrar as duas forças. O processamento de sinal que segue permanece igual ao que segue na Figura 6C, Parâmetros exemplificadores são wd = 12, ws, = 1, e
[0105] Uma versão da sonda da matriz do segundo algoritmo tem por base a segunda versão - sinais compósitos são usados para estimar a frequência central, Os dados de RF podem ser coletados, por exemplo, com o uso do modo de imageamento por penetração com IP habilitado e a frequência central de 2,2 MHz, As espessuras lateral e elevacional podem ser máximas,
[0106] Cada volume tem linhas A de 40 (lateral) por 33 (elevacional) na transmissão (com 2 eventos de transmissão por linha A devido à aquisição de PI) e linhas A de 80 por 66 na recepção amostradas a 16 MHz por causa do 4X formador de feixes, Os quatro sinais de cada direção da transmissão são somados para obter os ecos da RF com 40 valores de r e 33 valores de . A densidade do feixe lateral é de 0,41 feixe por grau.
[0107] A Figura 8 mostra o fluxograma da versão da sonda da matriz do segundo algoritmo, com a taxa de amostragem temporal em 16 MHz. As etapas são: subtração (etapa S805), filtro passa-baixa (etapa S810), adição (etapa S815), filtro passa-alta (etapa S820), adição ponderada (etapa S825), filtragem temporal complexa (etapa S830), estimativa da frequência central (etapa S835), filtragem 2D (etapa S840), estimativa do contorno (etapa S845), filtragem mediana (etapa S850) e visualização pelos planos (etapa S855). Resumindo, H1(n) é um filtro passa-baixa real de 51 derivações com frequência de corte de 0,8 MHz,hu(n) é um filtro passa-alta real de 51 derivações com frequência de corte de 1,3 MHz, wd = 2 , e ws = 1 . O envelope complexo onde h(n) é um filtro de passagem de banda (passa-faixa) de 61 derivações complexo de lado único entre 0,95 e 2,05 MHz. Em cada plano elevacional, o mapa da frequência central é obtido de feixe em feixe com base na equação (2) com uma janela de Hamming de 151 derivações e depois suavizado por um filtro vagão de 151 (na direção ) por 3 (na direção )) para obter
[0108] Para estimativa de contorno, são definidos:
onde . De modo equivalente,
e configurado . O ângulo de contorno entre o coração e o pulmão no v° plano é
[0109] Um filtro mediano de 5 derivações (uma função de v) na direção elevacional é então aplicado a e a saída é denotada como . A partir dos ângulos de contorno filtrados um mapa indicando a região do coração pode ser derivado para fornecer uma visualização de plano transversal. Para remover os resultados fora dos limites do contorno entre o coração e o pulmão, que aparecerão ocasionalmente, apenas a última região conectada é exibida. O médico pode usar a tela da Figura 4B para manusear de forma interativa a sonda 130 para evitar o pulmão, na etapa S226.
[0110] Um aparelho inclui uma sonda de imageamento e é configurado para dispor dinamicamente a apresentação de retroinformação visual para guiar o ajuste manual, através da sonda, de uma localização e orientação, associadas à sonda. A disposição é seletivamente baseada em comparações entre campos de visão da sonda e resultados respectivos de segmentação de dados de imagem capturados através da sonda. Em uma modalidade, a retroinformação não inclui uma representação em escala de tons de cinza dos dados de imagem. Transformações do sistema de coordenadas que correspondem a comparações respectivas podem ser computadas. A seleção pode ser baseada em, e dinamicamente responsiva a, um conteúdo de imageamento sendo dinamicamente capturado através da sonda.
[0111] Além de tornar o exame cardíaco diagnóstico executável por enfermeiros ou outros médicos que podem não ser treinados especificamente em sonografia, o aparelho 100 pode guiar ultrassonografistas novatos. O aparelho 100 pode apresentar, para esse propósito ou esse modo, um sonograma regular (escala de tons de cinza), juntamente com a retroinformação visual 144 anteriormente descritos neste documento. Alternativamente, a retroinformação visual 144 inovadora do aparelho 100 pode acelerar o fluxo de trabalho de ultrassonografistas treinados ou experientes.
[0112] Embora a invenção tenha sido ilustrada e descrita em detalhe com referência aos desenhos e à descrição supracitada, tal ilustração e descrição devem ser consideradas meramente ilustrativas ou exemplificadoras e não restritivas, isto é, a invenção não se limita às modalidades aqui apresentadas.
[0113] Por exemplo, o cabo da sonda 140 pode ser omitido em uma modalidade de sonda sem fio.
[0114] Outras variações das modalidades apresentadas podem ser entendidas e realizadas pelos versados na técnica na prática de uma invenção reivindicada a partir de um grupo de desenhos, da revelação e das reivindicações anexas. Nas reivindicações, o uso do verbo “compreender” não exclui outros elementos ou etapas, e o artigo indefinido “um(a)” não exclui a presença de uma pluralidade de tais elementos. Qualquer sinal de referência nas reivindicações não deve ser interpretado como limitador do escopo.
[0115] O programa de computador pode ser armazenado momentaneamente, temporariamente ou durante um período mais longo de tempo em uma mídia legível por computador adequado, como uma mídia de armazenamento óptico ou uma mídia em estado sólido. Essa mídia é não transitória somente no sentido de que não é um sinal transitório de propagação, mas inclui outras formas de mídias legíveis por computador como memória de registro, cache de processador, RAM e outra memória volátil.
[0116] Um único processador ou outra unidade pode desempenhar as funções de vários itens referidos nas reivindicações. O simples fato de que certas medições são mencionadas em diferentes reivindicações mutuamente dependentes não indica que uma combinação dessas medições não pode ser usada em seu benefício.
Claims (17)
1. APARELHO, compreendendo: uma sonda de imageamento (130); e um processador-guia para o usuário, em que o processador é configurado para dispor dinamicamente uma apresentação de retroinformação visual para guiar o ajuste manual, através da dita sonda, de um local e uma orientação associados à dita sonda, caracterizado pela disposição compreender: a) instruir (S234) um usuário a pausar o ajuste da sonda e detectar (S236) uma pausa associada à instrução, ou b) detectar uma pausa no movimento da sonda, em que, durante a pausa detectada associada com a instrução ou a pausa detectada no movimento da sonda, o processador está adaptado para: c) segmentar (S244) dados de imagem adquiridos pela sonda, d) comparar (S246) um campo de visão da sonda com os dados de imagem segmentados, e e) calcular (S247) uma transformação do sistema de coordenadas correspondente à dita comparação.
2. APARELHO, de acordo com a reivindicação 1, caracterizado pela dita disposição compreender apresentar a dita retroinformação, sendo que a dita retroinformação compreende instruções ao usuário (144) sobre como manobrar manualmente a dita sonda.
3. APARELHO, de acordo com a reivindicação 1, caracterizado por ser configurado adicionalmente para não depender de, e, portanto, não fornecer (175), uma representação em escala de tons de cinza dos dados de imagem capturados através da dita sonda.
4. APARELHO, de acordo com a reivindicação 1, caracterizado pela dita computação ser dinamicamente baseada nos resultados (318, 320) da segmentação.
5. APARELHO, de acordo com a reivindicação 1, caracterizado pela comparação ser baseada respectivamente em magnitudes de componentes translacionais e rotacionais (326, 328) das ditas transformações.
6. APARELHO, de acordo com a reivindicação 1, caracterizado pela dita sonda compreender um sensor (190), e em que o dito aparelho é configurado para decidir, com base em uma saída do dito sensor, que a qualidade de acoplamento acústico é insuficiente e para emitir um alerta ao usuário após a decisão.
7. APARELHO, de acordo com a reivindicação 1, caracterizado pela dita segmentação ser baseada em modelo (S245).
8. APARELHO, de acordo com a reivindicação 1, caracterizado pela dita sonda de imageamento compreender uma sonda de imageamento por ultrassom.
9. APARELHO, de acordo com a reivindicação 1, caracterizado pela retroinformação visual ser para orientar um usuário em um procedimento para obter uma vista apical (332) de um coração.
10. APARELHO, de acordo com a reivindicação 1, caracterizado pelo campo de visão da sonda ser tridimensional (326, 328).
11. APARELHO, de acordo com a reivindicação 1, caracterizado por compreender adicionalmente: uma tela (110); e um console operável pelo usuário (120), em que o dito aparelho é configurado para: adquirir os ditos dados de imagem através da dita sonda; a dita segmentação; exibir a dita retroinformação através da dita tela; e, ser portátil, como uma unidade que pode ser transportada manualmente.
12. APARELHO, de acordo com a reivindicação 1, caracterizado por ser configurado para, em resposta a um conteúdo de imageamento capturado dinamicamente através da dita sonda, emitir um alerta ao usuário para parar o dito ajuste (S258).
13. APARELHO, de acordo com a reivindicação 12, caracterizado por ser configurado para detectar a dita parada (S260).
14. APARELHO, de acordo com a reivindicação 13, caracterizado por, em resposta a uma detecção de que ocorreu a dita parada, ser configurado adicionalmente para executar a dita segmentação (S272).
15. APARELHO, de acordo com a reivindicação 1, caracterizado por ser configurado para que a dita segmentação seja feita de um modo relativamente grosseiro e de um modo relativamente fino, e para fazer uma medição volumétrica (S278) com base em um ou mais segmentos formados como resultado da segmentação espacialmente mais fina, sendo que a dita medição é responsiva ao término da dita segmentação espacialmente mais fina.
16. APARELHO, de acordo com a reivindicação 1, caracterizado pela dita retroinformação compreender um indicador progressivo (178) do andamento geral da captura da vista-alvo.
17. MÉTODO PARA GUIAR UM USUÁRIO QUE MANUSEIA UMA SONDA DE IMAGEAMENTO, compreendendo os atos de: dispor dinamicamente uma apresentação de retroinformação visual para guiar um ajuste manual (330), através da dita sonda, de um local e de uma orientação associados à dita sonda, caracterizado pela disposição compreender: - instruir (S234) um usuário a pausar o ajuste da sonda e detectar (S236) uma pausa associada à instrução, ou - detectar uma pausa no movimento da sonda, em que, durante a pausa detectada associada com a instrução ou a pausa detectada no movimento da sonda, o método compreende: a) segmentação (S244) de dados de imagem adquiridos pela sonda, b) comparar (S246) um campo de visão da sonda com os dados de imagem segmentados, e c) calcular (S247) uma transformação do sistema de coordenadas correspondente à referida comparação.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261740595P | 2012-12-21 | 2012-12-21 | |
| US61/740,595 | 2012-12-21 | ||
| PCT/IB2013/060908 WO2014097090A1 (en) | 2012-12-21 | 2013-12-13 | Anatomically intelligent echocardiography for point-of-care |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| BR112015014308A2 BR112015014308A2 (pt) | 2017-07-11 |
| BR112015014308B1 true BR112015014308B1 (pt) | 2022-10-11 |
Family
ID=50159298
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| BR112015014308-3A BR112015014308B1 (pt) | 2012-12-21 | 2013-12-13 | Aparelho e método para guiar um usuário que manuseia uma sonda de imageamento |
Country Status (7)
| Country | Link |
|---|---|
| US (3) | US10424044B2 (pt) |
| EP (1) | EP2934328B1 (pt) |
| JP (1) | JP6271579B2 (pt) |
| CN (1) | CN104883982B (pt) |
| BR (1) | BR112015014308B1 (pt) |
| RU (1) | RU2674228C2 (pt) |
| WO (1) | WO2014097090A1 (pt) |
Families Citing this family (38)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10134125B2 (en) | 2013-02-28 | 2018-11-20 | Rivanna Medical Llc | Systems and methods for ultrasound imaging |
| US10109072B2 (en) * | 2013-03-21 | 2018-10-23 | Koninklijke Philips N.V. | View classification-based model initialization |
| RU2016102638A (ru) | 2013-06-28 | 2017-08-02 | Конинклейке Филипс Н.В. | Идентификация легочной ткани в эхокардиографии с интеллектуальной анатомической навигацией |
| BR112015032362B1 (pt) | 2013-06-28 | 2022-03-08 | Koninklijke Philips N.V | Ferramenta de orientação visual interativa para um dispositivo |
| WO2015087218A1 (en) * | 2013-12-09 | 2015-06-18 | Koninklijke Philips N.V. | Imaging view steering using model-based segmentation |
| FR3024350B1 (fr) * | 2014-07-30 | 2016-08-19 | Bf Systemes | Systeme et procede de mesure de flux sanguin |
| US11123041B2 (en) | 2014-08-28 | 2021-09-21 | Samsung Electronics Co., Ltd. | Ultrasound diagnosis apparatus for self-diagnosis and remote-diagnosis, and method of operating the ultrasound diagnosis apparatus |
| KR101705120B1 (ko) * | 2014-08-28 | 2017-02-09 | 삼성전자 주식회사 | 자가 진단 및 원격 진단을 위한 초음파 진단 장치 및 초음파 진단 장치의 동작 방법 |
| US10799723B2 (en) * | 2014-11-14 | 2020-10-13 | Koninklijke Philips N.V. | Ultrasound device for sonothrombolysis therapy |
| KR20160066927A (ko) * | 2014-12-03 | 2016-06-13 | 삼성전자주식회사 | 컴퓨터 보조 진단 지원 장치 및 방법 |
| US10548564B2 (en) | 2015-02-26 | 2020-02-04 | Rivanna Medical, LLC | System and method for ultrasound imaging of regions containing bone structure |
| WO2016141449A1 (en) * | 2015-03-09 | 2016-09-15 | Her Majesty The Queen In Right Of Canada, As Represented By The Minister Of The Department Of National Defence | Computer-assisted focused assessment with sonography in trauma |
| EP3673953B1 (en) * | 2015-03-27 | 2022-09-14 | Zoll Medical Corporation | Ecg and defibrillator electrode detection and tracking system |
| JP6865695B2 (ja) * | 2015-06-10 | 2021-04-28 | コーニンクレッカ フィリップス エヌ ヴェKoninklijke Philips N.V. | 超音波撮像装置 |
| EP3313282A4 (en) * | 2015-06-25 | 2019-03-06 | Rivanna Medical, LLC | ULTRASOUND GUIDANCE OF A PROBE IN RELATION TO ANATOMICAL CHARACTERISTICS |
| CN204945377U (zh) * | 2015-08-24 | 2016-01-06 | 广州索诺星信息科技有限公司 | 一种无线探头式b超 |
| JP6653544B2 (ja) * | 2015-09-25 | 2020-02-26 | ジーイー・メディカル・システムズ・グローバル・テクノロジー・カンパニー・エルエルシー | 超音波診断装置及びその制御プログラム |
| US20190015076A1 (en) * | 2015-12-21 | 2019-01-17 | Koninklijke Philips N.V. | Ultrasound imaging apparatus and ultrasound imaging method for inspecting a volume of a subject |
| KR20170093632A (ko) * | 2016-02-05 | 2017-08-16 | 삼성전자주식회사 | 전자 장치 및 그의 동작 방법 |
| US20170273664A1 (en) * | 2016-03-24 | 2017-09-28 | Elwha Llc | Wearable ultrasonic fetal imaging device |
| CA3021697A1 (en) | 2016-04-21 | 2017-10-26 | The University Of British Columbia | Echocardiographic image analysis |
| US20190271771A1 (en) * | 2016-05-16 | 2019-09-05 | Bk Medical Holding Company, Inc. | Segmented common anatomical structure based navigation in ultrasound imaging |
| TWI765895B (zh) | 2016-06-20 | 2022-06-01 | 美商蝴蝶網路公司 | 用於協助使用者操作超音波裝置的自動化影像獲取之系統和方法 |
| EP3517048B1 (en) | 2016-09-21 | 2021-02-17 | Fujifilm Corporation | Ultrasound diagnostic device and method for control of ultrasound diagnostic device |
| KR20180034117A (ko) * | 2016-09-27 | 2018-04-04 | 삼성메디슨 주식회사 | 초음파 진단 장치 및 초음파 진단 장치의 작동 방법 |
| EP3552554B1 (en) * | 2016-12-06 | 2024-03-27 | FUJIFILM Corporation | Ultrasonic diagnosis apparatus and method for controlling ultrasonic diagnosis apparatus |
| KR101922180B1 (ko) * | 2016-12-09 | 2018-11-26 | 삼성메디슨 주식회사 | 초음파 영상 처리 장치 및 초음파 영상 처리 방법 |
| EP3366221A1 (en) * | 2017-02-28 | 2018-08-29 | Koninklijke Philips N.V. | An intelligent ultrasound system |
| GB201703575D0 (en) | 2017-03-06 | 2017-04-19 | Thinksono Ltd | Blood vessel obstruction diagnosis method, apparatus & system |
| EP3398519A1 (en) * | 2017-05-02 | 2018-11-07 | Koninklijke Philips N.V. | Determining a guidance signal and a system for providing a guidance for an ultrasonic handheld transducer |
| WO2019156975A1 (en) * | 2018-02-07 | 2019-08-15 | Atherosys, Inc. | Apparatus and method to guide ultrasound acquisition of the peripheral arteries in the transverse plane |
| WO2019222317A1 (en) * | 2018-05-15 | 2019-11-21 | New York University | System and method for orientating capture of ultrasound images |
| US10751029B2 (en) | 2018-08-31 | 2020-08-25 | The University Of British Columbia | Ultrasonic image analysis |
| US20200245970A1 (en) * | 2019-01-31 | 2020-08-06 | Bay Labs, Inc. | Prescriptive guidance for ultrasound diagnostics |
| CN109919918A (zh) * | 2019-02-21 | 2019-06-21 | 清华大学 | 弹性成像的控制方法及装置、计算机设备及可读存储介质 |
| US11844654B2 (en) | 2019-08-19 | 2023-12-19 | Caption Health, Inc. | Mid-procedure view change for ultrasound diagnostics |
| CN110946615B (zh) * | 2019-11-19 | 2023-04-25 | 苏州佳世达电通有限公司 | 超声波诊断装置及使用其的操作方法 |
| CN116744855A (zh) | 2020-12-18 | 2023-09-12 | 皇家飞利浦有限公司 | 基于超声图像的解剖扫描窗口、探头取向和/或患者位置的识别 |
Family Cites Families (28)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB9025431D0 (en) | 1990-11-22 | 1991-01-09 | Advanced Tech Lab | Three dimensional ultrasonic imaging |
| GB2308661B (en) * | 1993-11-29 | 1998-07-29 | Univ Victoria Hospital Corp | Three-dimensional ultrasound imaging system |
| US5474073A (en) * | 1994-11-22 | 1995-12-12 | Advanced Technology Laboratories, Inc. | Ultrasonic diagnostic scanning for three dimensional display |
| US5906578A (en) * | 1997-06-18 | 1999-05-25 | Rajan; Govinda N. | Method and system for probe positioning in transesophageal echocardiography |
| US5952577A (en) * | 1997-07-21 | 1999-09-14 | Sonotron Ltd. | Ultrasonic imaging system |
| US6299579B1 (en) | 1999-06-30 | 2001-10-09 | Atl Ultrasound | Extended field of view ultrasonic diagnostic imaging with image reacquisition |
| JP4088104B2 (ja) * | 2002-06-12 | 2008-05-21 | 株式会社東芝 | 超音波診断装置 |
| US6705994B2 (en) * | 2002-07-08 | 2004-03-16 | Insightec - Image Guided Treatment Ltd | Tissue inhomogeneity correction in ultrasound imaging |
| WO2004009011A1 (en) * | 2002-07-23 | 2004-01-29 | Healthsouth Corporation | Improved powered gait orthosis and method of utilizing same |
| US7270634B2 (en) * | 2003-03-27 | 2007-09-18 | Koninklijke Philips Electronics N.V. | Guidance of invasive medical devices by high resolution three dimensional ultrasonic imaging |
| JP2007502186A (ja) * | 2003-05-21 | 2007-02-08 | コーニンクレッカ フィリップス エレクトロニクス エヌ ヴィ | 体の臓器の動作を記録する機器及び方法 |
| US7658714B2 (en) * | 2003-10-31 | 2010-02-09 | Siemens Medical Solutions Usa, Inc. | Intelligent ultrasound examination storage system |
| US20060004290A1 (en) * | 2004-06-30 | 2006-01-05 | Smith Lowell S | Ultrasound transducer with additional sensors |
| KR100719035B1 (ko) * | 2005-07-01 | 2007-05-16 | 엘지전자 주식회사 | 플라즈마 디스플레이 패널 |
| KR100870412B1 (ko) * | 2005-12-01 | 2008-11-26 | 주식회사 메디슨 | Svm 기반 질감분류를 이용하여 추출된 태아의 표면영상을 기초로 태아의 3차원 초음파 영상을 형성하는초음파 시스템 및 방법 |
| JP5379491B2 (ja) | 2005-12-15 | 2013-12-25 | コーニンクレッカ フィリップス エヌ ヴェ | 場発生器の位置最適化のための方法および装置 |
| WO2007072391A2 (en) | 2005-12-22 | 2007-06-28 | Koninklijke Philips Electronics N.V. | Automatic 3-d object detection |
| JP2009531116A (ja) | 2006-03-31 | 2009-09-03 | コーニンクレッカ フィリップス エレクトロニクス エヌ ヴィ | 電磁式追跡システムにおける局所的誤差補償システム |
| JP2009542288A (ja) | 2006-06-28 | 2009-12-03 | コーニンクレッカ フィリップス エレクトロニクス エヌ ヴィ | 可変解像度モデルに基づく画像の区分 |
| US8303502B2 (en) | 2007-03-06 | 2012-11-06 | General Electric Company | Method and apparatus for tracking points in an ultrasound image |
| JP5127371B2 (ja) * | 2007-08-31 | 2013-01-23 | キヤノン株式会社 | 超音波画像診断システム、及びその制御方法 |
| US8254654B2 (en) | 2007-10-31 | 2012-08-28 | University Of Southern California | Sidelobe suppression in ultrasound imaging using dual apodization with cross-correlation |
| RU2011109232A (ru) * | 2008-08-14 | 2012-09-20 | Конинклейке Филипс Электроникс, Н.В. (Nl) | Акустическое устройство формирования изображения с управлением без использования рук |
| JP2010088584A (ja) * | 2008-10-06 | 2010-04-22 | Toshiba Corp | 超音波診断装置 |
| US20100217123A1 (en) * | 2009-02-23 | 2010-08-26 | Aharon Eran | Methods and systems of managing ultrasonographic diagnosis |
| JP5400466B2 (ja) * | 2009-05-01 | 2014-01-29 | キヤノン株式会社 | 画像診断装置、画像診断方法 |
| CN101699280B (zh) * | 2009-10-15 | 2011-08-17 | 北京索瑞特医学技术有限公司 | 超声无损检测粘弹性介质弹性的方法及其装置 |
| GB2507987A (en) * | 2012-11-15 | 2014-05-21 | Imp Innovations Ltd | Method of automatically processing an ultrasound image |
-
2013
- 2013-12-13 JP JP2015548818A patent/JP6271579B2/ja active Active
- 2013-12-13 US US14/652,317 patent/US10424044B2/en active Active
- 2013-12-13 BR BR112015014308-3A patent/BR112015014308B1/pt active IP Right Grant
- 2013-12-13 RU RU2015129802A patent/RU2674228C2/ru active
- 2013-12-13 CN CN201380067300.5A patent/CN104883982B/zh active Active
- 2013-12-13 WO PCT/IB2013/060908 patent/WO2014097090A1/en active Application Filing
- 2013-12-13 EP EP13831906.6A patent/EP2934328B1/en active Active
-
2019
- 2019-08-28 US US16/553,211 patent/US10929951B2/en active Active
-
2021
- 2021-01-15 US US17/149,839 patent/US11562463B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| RU2015129802A (ru) | 2017-01-27 |
| RU2674228C2 (ru) | 2018-12-05 |
| US10424044B2 (en) | 2019-09-24 |
| EP2934328A1 (en) | 2015-10-28 |
| CN104883982A (zh) | 2015-09-02 |
| US10929951B2 (en) | 2021-02-23 |
| US20150310581A1 (en) | 2015-10-29 |
| EP2934328B1 (en) | 2018-09-26 |
| US20210142441A1 (en) | 2021-05-13 |
| US11562463B2 (en) | 2023-01-24 |
| JP6271579B2 (ja) | 2018-01-31 |
| CN104883982B (zh) | 2019-01-11 |
| JP2016501605A (ja) | 2016-01-21 |
| US20200043129A1 (en) | 2020-02-06 |
| WO2014097090A1 (en) | 2014-06-26 |
| BR112015014308A2 (pt) | 2017-07-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11562463B2 (en) | Anatomically intelligent echochardiography for point-of-care | |
| JP7268087B2 (ja) | モデルベースセグメンテーションを用いた像撮像誘導 | |
| AU2008202449B2 (en) | Cardiac mechanical assessment using ultrasound | |
| US9196046B2 (en) | Medical imaging | |
| Yli-Ollila et al. | Axial and radial waveforms in common carotid artery: An advanced method for studying arterial elastic properties in ultrasound imaging | |
| JP2017524455A (ja) | 血管を識別する超音波システム及び方法 | |
| BR112017008908B1 (pt) | Métodos e aparelhos de formação de imagem para realizar formação de imagem por elastografia com onda de cisalhamento | |
| JP2014525328A (ja) | 針を検出して追跡する方法 | |
| JP7278272B2 (ja) | 超音波撮像システム及び方法 | |
| JP7375140B2 (ja) | 超音波診断装置、医用画像診断装置、医用画像処理装置及び医用画像処理プログラム | |
| BR112020014733A2 (pt) | Método implementado por computador para a obtenção de medições anatômicas em uma imagem de ultrassom, meios de programa de computador, dispositivo de análise de imagem e método de imageamento por ultrassom | |
| JP2017523004A (ja) | 液体プールを検出し識別するための音響流 | |
| JP5982602B2 (ja) | 解剖学的に知的な心エコー法における肺組織同定 | |
| US20230255588A1 (en) | Workflow assistance for medical doppler ultrasound evaluation | |
| Joseph et al. | An image-free ultrasound method to estimate artery wall thickness surrogate for screening | |
| US20230263501A1 (en) | Determining heart rate based on a sequence of ultrasound images | |
| US20240057968A1 (en) | System and method for measuring total blood volume with ultrasound |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| B06F | Objections, documents and/or translations needed after an examination request according [chapter 6.6 patent gazette] | ||
| B15I | Others concerning applications: loss of priority |
Free format text: VIDE PARECER |
|
| B12F | Other appeals [chapter 12.6 patent gazette] | ||
| B06U | Preliminary requirement: requests with searches performed by other patent offices: procedure suspended [chapter 6.21 patent gazette] | ||
| B09A | Decision: intention to grant [chapter 9.1 patent gazette] | ||
| B16A | Patent or certificate of addition of invention granted [chapter 16.1 patent gazette] |
Free format text: PRAZO DE VALIDADE: 20 (VINTE) ANOS CONTADOS A PARTIR DE 13/12/2013, OBSERVADAS AS CONDICOES LEGAIS |