NL8900725A - Werkwijze en combinatie van middelen voor het isoleren van nucleinezuur. - Google Patents
Werkwijze en combinatie van middelen voor het isoleren van nucleinezuur. Download PDFInfo
- Publication number
- NL8900725A NL8900725A NL8900725A NL8900725A NL8900725A NL 8900725 A NL8900725 A NL 8900725A NL 8900725 A NL8900725 A NL 8900725A NL 8900725 A NL8900725 A NL 8900725A NL 8900725 A NL8900725 A NL 8900725A
- Authority
- NL
- Netherlands
- Prior art keywords
- nucleic acid
- dna
- silica particles
- lanes
- silica
- Prior art date
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/10—Processes for the isolation, preparation or purification of DNA or RNA
- C12N15/1003—Extracting or separating nucleic acids from biological samples, e.g. pure separation or isolation methods; Conditions, buffers or apparatuses therefor
- C12N15/1006—Extracting or separating nucleic acids from biological samples, e.g. pure separation or isolation methods; Conditions, buffers or apparatuses therefor by means of a solid support carrier, e.g. particles, polymers
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
Description
BESCHRIJVING
Werkwijze en combinatie van middelen voor het isoleren van nucleïnezuur
De uitvinding heeft betrekking op een werkwijze en een combinatie van middelen (d.w.z. een kit) voor het isoleren van nucleïnezuur uit een nucleïnezuur-bevattend uitgangsmateriaal. Meer in het bijzonder heeft de uitvinding betrekking op een werkwijze en een kit voor het isoleren van nucleïnezuur uit een nucleïnezuur-bevattend biologisch materiaal, zoals vol bloed, bloed serum, buffy coat (de crusta phlogistica of leucocyten-fractie van bloed), urine, faeces, liquor cerebrospmalis, sperma, speeksel, weefsels, celcultures, en dergelijke.
Bekende methoden voor het isoleren van nucleïnezuur (NA) uit complexe uitgangsmaterialen zoals vol bloed, bloed serum, urine of faeces omvatten veelal een lysis van biologisch materiaal door een detergent in tegenwoordigheid van eiwit-afbrekende enzymen, gevolgd door verscheidene extracties met organische oplosmiddelen, zoals bijvoorbeeld fenol en/of chloroform, precipitatie met ethanol en dialyse van de nucleïnezuren. Deze bekende methoden voor het bijvoorbeeld isoleren van (dubbelstrengs) DNA uit klinisch materiaal zijn zeer omslachtig en langdurig. Het relatief grote aantal stappen, dat voor de zuivering van NA uit dergelijke uitgangsmaterialen nodig is, vergroot het gevaar dat bij gelijktijdige verwerking van meerdere klinische monsters overdracht van NA van een monster naar een ander monster optreedt. Wanneer het NA geïsoleerd wordt om vervolgens met behulp van de uiterst gevoelige polymerase-ketting-reactie (PCR, Saiki et al, Science 230, 1985, 1350) de aanwezigheid van NA van bijv. een pathogeen (bijv. een virus of een bacterie) te bepalen, betekent het verhoogde risico van een dergelijke overdracht van NA tussen verschillende monsters, waardoor vals-positieve uitslagen worden veroorzaakt, een belangrijk nadeel.
Een voorbeeld van een dergelijke, contaminatiegevoelige bekende methode is de in Analytical Biochemistry 162. 1987, 156 beschreven procedure voor het isoleren van totaal RNA uit weefsels en celcultures. Volgens deze methode wordt het RNA in één stap met behulp van een mengsel van een zuur guanidinium thiocyanaat, fenol en chloroform uit het biologische uitgangsmateriaal geëxtraheerd. Na fasenscheiding kan het RNA door verdere opwerkingen van de waterfase binnen 4 uur in een bruikbare vorm worden gewonnen.
In Analytical Biochemistry 162. 1987, 463 wordt een procedure voor het isoleren van DNA uit weefsels en cellijnen beschreven, waarbij de cellen in een guanidine hydrochloride bevattende buffer worden gedispergeerd en met ethanol worden geprecipiteerd. Met deze bekende, contaminatiegevoelige methode kan na verdere opwerkingen van het afgescheiden DNA eveneens binnen enkele uren een bruikbaar NA produkt worden geïsoleerd.
Deze bekende procedures kunnen echter niet met succes worden toegepast bij complexe uitgangsmaterialen zoals bijv. vol bloed en bloed serum.
Doel van de uitvinding is om een werkwijze ter beschikking te stellen, die de nadelen van de bekende werkwijzen opheft.
Meer in het bijzonder beoogt de uitvinding een werkwijze te verschaffen, waarmee direct (zonder voorbehandelingen) uit complexe uitgangsmaterialen, zoals uiteenlopende soorten van biologische materialen, op een ongekend snelle, eenvoudige en reproduceerbare wijze DNA en/of RNA (d.w.z. in principe elk type nucleïnezuur) kan worden geïsoleerd in een zodanig ongeschonden toestand en hoge zuiverheid, dat het vervolgens als reagens in moleculair biologische reacties kan worden toegepast.
Voorts wordt door de uitvinding beoogd om een werkwijze te verschaffen, die zich van de bekende werkwijzen onderscheidt door een laag contaminatiegevaar ten opzichte van andere monsters en personen, d.w.z. simultane verwerking van meerdere klinische monsters met minimaal gevaar voor overdracht van NA tussen verschillende monsters mogelijk maakt en ook zo weinig mogelijk risico van besmetting van personen door eventueel in de te verwerken monsters aanwezige virussen of bacteriën betekent.
Deze doeleinden worden volgens de uitvinding gerealiseerd door een werkwijze voor het isoleren van nucleïnezuur uit een nucleïnezuur-bevattend uitgangsmateriaal, gekenmerkt doordat men het uitgangsmateriaal mengt met een chaotroop guanidinium-zout en met silica-deeltjes, de silica-deeltjes met het daaraan gebonden nucleïnezuur afscheidt van de vloeistof en, eventueel nadat de silica-nucleïnezuur-complexen zijn gewassen, het nucleïnezuur uit deze complexen elueert.
Hoewel de uitvinding in brede zin bij elk nucleïnezuur-bevattend uitgangsmateriaal toepasbaar is, met inbegrip van mogelijk door een virus of een bacterie besmette voedings- en genotmiddelen, vaccins en melk, is de uitvinding in het bijzonder van toepassing op een werkwijze, waarbij men als uitgangsmateriaal een nucleïnezuur-bevattend biologisch materiaal, zoals vol bloed, bloed serum, buffy coat, urine, faeces, liquor cerebrospinalis, sperma, speeksel, weefsels en celcultures (zoals zoogdiercelcultures en bacteriecultures) toepast. Uiteraard kan de werkwijze volgens de uitvinding ook worden toegepast op relatief zuivere inputmaterialen, zoals het produkt van een PCR of het nog verder te zuiveren produkt van een andere werkwijze voor het winnen van nucleïnezuren. Enkele soorten van nucleïnezuur-bevattende biologische materialen, zoals plantaardig materiaal, sommige grampositieve bacteriën en sommige gisten en schimmels, kunnen echter niet direct als inputmateriaal bij de werkwijze volgens de onderhavige uitvinding dienst doen omdat ze vanwege hun bijzondere celwandopbouw niet lyseren in een chaotroop guanidiniumzout.
Bij dergelijke uitgangsmaterialen is derhalve een voorbehandeling nodig, welke de cellen toegankelijk maakt, bijv. een voorafgaande cellysis waarna het daarbij verkregen lysaat aan de werkwijze volgens de uitvinding kan worden onderworpen.
Met nucleïnezuur (NA) worden zowel DNA als RNA bedoeld, beide in elke mogelijke verschijningsvorm, d.w.z. in de vorm van dubbelstrengs (ds) nucleïnezuur, of in de vorm van enkelstrengs (ss) nucleïnezuur, of als een combinatie daarvan (partieel ds of ss).
Een essentiële maatregel volgens de uitvinding bestaat uit de toepassing van silica-deeltjes, die in staat zijn om het NA in tegenwoordigheid van een chaotroop guanidiniumzout te binden. Met silica worden SiC>2 kristallen en andere vormen van siliciumoxide, zoals uit SiC>2 opgebouwde skeletten van diatomeeën (kiezelwieren), amorf siliciumoxyde en glaspoeder bedoeld.
Overigens was uit PNAS 7£, 1979, 615 bekend, dat ds-DNA in een hoog-geconcentreerde oplossing van het chaotrope zout Nal (natriumjodide) uit agarose kan worden vrijgemaakt en aan glas kan worden gebonden. In deze publikatie worden twee procedures voor het isoleren van DNA uit een agarose gel beschreven, die beide in een eerste stap gebruik maken van een Nal oplossing om de agarose op te lossen. Bij de ene procedure wordt het DNA in een tweede stap met aceton neergeslagen, terwijl volgens de andere procedure het DNA in een tweede stap aan glasdeeltjes wordt gebonden om vervolgens in een waterige buffer te worden geëlueerd. Deze methode is echter onbruikbaar bij meer complexe uitgangsmaterialen, zoals lichaamsvloeistoffen en andere biologische uitgangsmaterialen.
Het verdient volgens de uitvinding aanbeveling om silica-deeltjes te gebruiken met een geschikt gekozen deeltjesgrootte, teneinde direct uit een onzuiver uitgangsmateriaal een hoge graad van zuiverheid van het gebonden en daarna te elueren nucleïnezuur te verkrijgen.
Een voorkeursuitvoeringsvorm van de uitvinding wordt gekenmerkt doordat men silica-deeltjes met een in hoofdzaak tussen 0,05 en 500 μπι gelegen deeltjesgrootte toepast. Met de woorden "in hoofdzaak" wordt bedoeld, dat 80 % of meer, bij voorkeur meer dan 90 % van de silica-deeltjes in het vermelde deeltjesgrootte-bereik liggen. Om een gemakkelijke opwerking van het gebonden NA te verzekeren heeft het de voorkeur, dat men silica-deelt jes met een in hoofdzaak tussen 0,1 en 200 μιη gelegen deeltjesgrootte toepast, terwijl de grootste voorkeur uitgaat naar een werkwijze, waarbij men silica-deeltjes met een in hoofdzaak tussen 1 en 200 μπι gelegen deeltjesgrootte toepast. Weliswaar is het NA bindend vermogen van de silica-deeltjes groter naarmate de deeltjes kleiner zijn, maar vooral in het geval van een NA-rijk inputmateriaal en in het geval van betrekkelijk lange NA molekulen heeft het gebruik van extreem kleine silicadeeltjes tot gevolg, dat de gevormde NA-silica complexen niet meer efficiënt geherdispergeerd kunnen worden. Dit betekent dat het gebonden NA niet in een zuivere vorm uit de complexen kan worden gewonnen. Bij gebruik van humaan bloed als inputmateriaal doet zich dit probleem soms voor wanneer een niet-gefractioneerd silica met deeltjesafmetingen in het bereik van 0,2-10 μπι wordt toegepast. Het daarbij ontstaan van niet meer herdispergeerbare aggregaten kan worden voorkomen door een gefractioneerd silica te gebruiken, waarvan de deeltjesgrootte in het bereik van 1-10 μπι ligt. Bij toepassing van een celrijk inputmateriaal, zoals bacteriecultures, blijkt echter het gebruik van een dergelijke grove silicafractie niet toereikend om de vorming van moeilijk herdispergeerbare aggregaten te voorkomen en worden optimale resultaten bereikt wanneer een nog grover silica, zoals een diatomeeënaarde met deeltjesafmetingen in het bereik van 2-200 μπι, wordt toegepast.
Volgens de uitvinding is essentiëel, dat men naast de genoemde silica-deeltjes tevens een chaotroop guanidiniumzout toepast. Guanidiniumzouten met een chaotrope werking zijn aan de deskundige bekend. Voorbeelden daarvan zijn guanidinium-thiocyanaat (dat in de literatuur ook wel aangeduid wordt als guanidinium-isothiocyanaat) en guanidine hydrochloride. Volgens de uitvinding wordt als chaotroop guanidiniumzout bij voorkeur guanidinium-thiocyanaat (GuSCN) toegepast.
De werkwijze volgens de uitvinding zal men gewoonlijk zo uitvoeren, dat men het uitgangsmateriaal met voldoend grote hoeveelheden chaotroop guanidiniumzout en silica-deeltjes mengt om in essentie al het in het uitgangsmateriaal aanwezige nucleïnezuur vrij te maken en aan de silica-deeltjes te binden. Een geschikt protocol is bijvoorbeeld het toevoegen van een suspensie van silica-deeltjes aan een zich in een reactievaat je bevindende gebufferde GuSCN oplossing, gevolgd door toevoeging van het monster en goed mengen. Er zal dan lysis plaats vinden van cellen en eventueel aanwezige virussen, en vrijkomend NA zal vrijwel instantaan aan de silica-deeltjes worden gebonden. De gevormde silica-nucleïnezuur-complexen zal men dan van de vloeistof afscheiden, bijvoorbeeld door snelle sedimentatie (centrifugeren) en verwijdering van de supernatant (bij voorbeeld door afzuigen), en vervolgens zullen de complexen (bijv. in de vorm van een silica-nucleïnezuur pellet) worden gewassen (herdispergering of homogenisatie), bijvoorbeeld met een chaotroop guanidiniumzout bevattende wasbuffer onder toepassing van bijv. een vortex mixer, en opnieuw worden gesedimenteerd. Het heeft de voorkeur, dat men de met wasbuffer gewassen silica-nucleïnezuur-complexen achtereenvolgens verder wast met een alkohol-water oplossing (liefst ca. 70 % ethanol om opbrengstverliezen te beperken) en met aceton, en daarna droogt om het aceton te verwijderen (bijvoorbeeld onder verwarming). Daarna wordt het in de gewassen en gedroogde silica-nucleïnezuur-complexen aanwezige NA met behulp van een waterige elutiebuffer geëlueerd. De keuze van de elutiebuffer wordt mede bepaald door de beoogde toepassing van het geïsoleerde NA. Voorbeelden van geschikte elutiebuffers zijn TE-buffer, aqua bidest en PCR-buffer (zie het gedeelte "Materialen en Methoden"). Bij voorkeur worden al deze stappen in één enkel reactievaatje (bijv. een 1,5 ml Eppendorff buisje van polypropeen) uitgevoerd en wordt het gezuiverde NA gewonnen in een relatief klein volume, bijv. minder dan 100 μΐ. Het aldus geïsoleerde NA is vrij van nucleïnezuur-afbrekende enzymen en heeft een zodanig hoge zuiverheid, dat het direct dienst kan doen als substraat voor diverse enzymen, zoals DNA polymerasen (bijvoorbeeld Taq-DNA polymerase), DNA restrictie-enzymen, DNA-ligase, en reverse transcriptase (zoals AMV reverse transcriptase).
Met de werkwijze volgens de uitvinding kan men bijv. uit 50 μΐ vol bloed, zonder voorafgaande scheiding van plasma en cellen, in ca. 45 minuten een voldoende hoeveelheid NA isoleren om met behulp van de PCR-methode NA sequenties aan te tonen. De uitvinding is echter ook van toepassing op velerlei andere biologische materialen, die NA bevatten, zoals serum, faeces, urine, enz. De uitvinding kan daarom toepassing vinden in de diagnostiek van bacteriële en virale infecties, alsmede bij een bestudering van gen-polymorfismen in het kader van de prenatale diagnostiek en de diagnostiek van predispositie voor erfelijke tumoren.
Het risico van contaminatie is bij de NA isolatiemethode volgens de uitvinding uiterst gering, omdat de gehele procedure in één enkel reactievaat je kan worden uitgevoerd en het in de eerste stap van de werkwijze uit het ruwe uitgangsmateriaal vrijgemaakte NA voor ten minste een aanzienlijk gedeelte tijdens de gehele verdere zuiveringsprocedure aan de vaste silica-deeltjes is gebonden. De risico's voor personen, inherent aan de verwerking van mogelijk met virussen of bacteriën besmet materiaal, blijven in essentie beperkt tot de eerste stap van de isolatieprocedure, waarin het monster in het reactievaatje wordt gebracht. Voor de uitvoering van de werkwijze is geen speciale randapparatuur (een vortex mixer, een centrifuge van het 12 kg Eppendorff type en een waterbad of Eppendorff verwarmingsblok behoren tot de standaard laboratorium uitrusting) en geen specialistische biochemische kennis nodig, zodat de werkwijze uitermate geschikt is voor routinematige NA-isolatie uit grote aantallen monsters. Met de werkwijze volgens de uitvinding kunnen in ongeveer 1 uur meer dan 10 en zelfs 24 of nog meer verschillende monsters worden verwerkt.
De uitvinding betreft niet alleen een werkwijze, maar tevens een combinatie van middelen (d.w.z. een "kit”) voor het isoleren van nucleïnezuur uit een nucleïnezuur-bevattend uitgangsmateriaal, omvattende (a) chaotroop guanidiniumzout, (b) silica-deeltjes, eventueel (c) wasvloeistof en eventueel (d) elutievloeistof.
Een voorkeursuitvoeringsvorm van een kit volgens de uitvinding omvat (a) een guanidiniumthiocyanaat bevattende lysis buffer, (b) een waterige suspensie van silica-deeltjes met een in hoofdzaak tussen 0,05 en 500 μτη, bij voorkeur tussen 0,1 en 200 Mm, liefst tussen 1 en 200 Mm gelegen deeltjesgrootte, (c) een guanidiniumthiocyanaat bevattende wasbuffer en eventueel (d) een elutiebuffer.
Een kit volgens de uitvinding kan bijvoorbeeld uit de volgende 4 componenten bestaan: component 1: een gebufferde guanidiniumthiocyanaat oplossing; component 2: een suspensie van silica-deeltjes; component 3: een wasbuffer; en (optioneel) component 4: een elutiebuffer.
De componenten 1 en 2 zouden eventueel kunnen worden gecombineerd, hetgeen echter een beperkte houdbaarheid tot gevolg heeft.
Overige reagentia, die bij voorkeur bij de NA-isolatie methode volgens de uitvinding worden gebruikt, zoals ethanol en aceton, behoren tot de standaard laboratorium uitrusting.
De uitvinding zal nu verder aan de hand van een aantal voorbeelden nader worden toegelicht. In het daaraan voorafgaande gedeelte worden de toegepaste materialen en methoden beschreven.
MATERIALEN EN METHODEN
A) Suspensie van grof silica (SC)
Gebruikt werd siliciumdioxide (S1O2), geleverd door Sigma, met een deeltjesgrootteverdeling van 0,5-10 μπι, waarvan 80 % tussen 1 en 5 Mm lag.
Men suspendeerde 60 g silica in aqua bidest (tot een volume van 500 ml) in een cylinder met een diameter van 5 cm; de waterkolom had een hoogte van 27,5 cm. Na sedimentatie bij lxg gedurende 25 uur bij kamertemperatuur werd supernatant afgezogen totdat 70 ml overbleef. Men voegde aqua bidest toe tot 500 ml en bracht de deeltjes opnieuw in suspensie door de cylinder te schudden. Na 5 uur sedimentatie bij lxg werd supernatant afgezogen totdat 60 ml overbleef. Na toevoegen van 600 μΐ 32 % (w/v) HC1 werden de deeltjes opnieuw in suspensie gebracht door vortexen. De suspensie werd in porties van 4 ml verdeeld over 6 ml flesjes en deze werden goed gesloten gedurende 20 minuten in een autoclaaf op 121 °C verwarmd. Dit sedimentatie-protocol leidde tot een verrijking van de grotere silica-deeltjes, d.w.z. de deeltjes met een deeltjesgrootte boven 1 Mm, zoals door een electronenmicroscopisch onderzoek werd vastgesteld. Bovendien heeft de autoclaaf-behandeling van een zure (pH ongeveer 2) silica suspensie tot gevolg, dat eventueel aanwezig nucleïnezuur volledig wordt afgebroken. De aldus verkregen suspensie van grof silica zal verder worden aangeduid met SC.
B) T.?-buffer L2-buffer (0,1 M Tris.Cl pH 6,4) werd bereid door 12,1 g TRIS (Boehringer) op te lossen in 800 ml aqua bidest, 8,1 ml 37 % (w/v) HC1 toe te voegen en het volume met aqua bidest op 1 liter te brengen.
C) Wasvloei stof L2
De wasvloeistof L2 werd bereid door 120 g GuSCN (guanidine thiocyanaat van Fluka) in 100 ml L2-buffer op te lossen.
D) TiV^ «buffer L5
De lysisbuffer L5 werd bereid uit 100 ml L2-buffer door daarin 120 g GuSCN op te lossen (lichtjes schudden op een warm waterbad van ca. 60 °C), vervolgens 26,0 g van een 40 %'s (w/v) Dextransulfaat (Pharmacia LKB) oplossing, 22 ml van 0,2 M EDTA pH 8, en 2,6 g Triton X-100 (Packard) toe te voegen en daarna de oplossing te homogeniseren. De 0,2 M EDTA pH 8 oplossing werd bereid door 37,2 g EDTA (Titriplex van Merck) en 4,4 g NaOH (Merck) in 500 ml water op te lossen.
E) y.ygi «buffer L6
De lysisbuffer L6 werd bereid uit 100 ml L2-buffer door daarin 120 g GuSCN op te lossen (lichtjes schudden op een warm waterbad van ca. 60 °C), vervolgens 22 ml van 0,2 M EDTA pH 8, en 2,6 g Triton X-100 (Packard) toe te voegen en tenslotte de oplossing te homogeniseren.
F) T.vsisbuffer GEDTA
Met GEDTA wordt een oplossing van 120 g GuSCN in 100 ml 0,2 M EDTA pH 8 bedoeld.
G) TE-buffer
Een voor elutie bruikbare buffer is een 10 mM Tris.Cl, 1 mM EDTA oplossing met pH 7,5 (TE-buffer) die desgewenst 0,5 U/μΙ RNAsin (Promega) bevat.
H) Tftstbuizen
De testbuizen werden op de dag van de extractieprocedure gereed gemaakt door 900 μΐ lysisbuffer en 40 μΐ van een NA-drager (een silica, zoals SC of diatomeeënaarde) toe te voegen aan Eppendorff centrifugebuisjes (type 3810, 1,5 ml).
I) Wasprocedure
Het wassen van een pellet geschiedt door 1 ml wasvloeistof toe te voegen, daarna te vortexen totdat de pellet opnieuw gesuspendeerd is, 15 sec bij 12000xg te centrifugeren en de supernatant door afzuigen te verwijderen.
J) Elutieorocedure
De elutie geschiedt door ten minste 25 μΐ, liever ten minste 40 μΐ elutiebuffer toe te voegen, even (2 sec) te vortexen en 10 min op 56 °C te incuberen.
K) Protocol B
Dit protocol is geschikt voor het isoleren van dsDNA uit complexe uitgangsmaterialen zoals humaan serum, vol bloed, waterige faeces en urine en maakt gebruik van Eppendorff testbuizen met 900 μΐ GEDTA en 40 μΐ SC.
1. Vortex de testbuis totdat de pellet geresuspendeerd is.
2. Voeg 50 μΐ uitgangsmateriaal (bijv. serum, vol bloed, faeces of urine) toe en vortex onmiddellijk tot homogeen (5-10 sec).
3. laat 10 min op kamertemperatuur en vortex 5 sec.
4. centrifugeer 15 sec bij 12000xg en verwijder supernatant door afzuigen.
5. was de pellet lx met GEDTA.
6. was de pellet 2x met 70 % ethanol.
7. was de pellet lx met aceton.
8. droog de pellet in 10 min bij 56 °C met open deksel.
9. elueer het DNA met 50 μΐ TE-buffer zonder RNAsin.
10. centrifugeer 2 min bij 12000xg; de supernatant bevat het DNA.
L) Protocol Y
Dit protocol is geschikt voor het isoleren van NA (simultane zuivering van dsDNA, ssDNA, dsRNA en ssRNA) uit complexe uitgangsmaterialen zoals humaan serum, vol bloed, waterige faeces en urine en maakt gebruik van Eppendorff testbuizen met 900 μΐ L6 en 40 μΐ SC.
1. Vortex de testbuis totdat de pellet geresuspendeerd is.
2. Voeg 50 μΐ uitgangsmateriaal (serum, vol bloed, faeces of urine) toe en vortex onmiddellijk tot homogeen (ca. 5 sec).
3. laat 10 min op kamertemperatuur en vortex 5 sec.
4. centrifugeer 15 sec bij 12000xg en verwijder supernatant door afzuigen.
5. was de pellet 2x met L2.
6. was de pellet 2x met 70 % ethanol.
7. was de pellet lx met aceton.
8. droog de pellet in 10 min bij 56 °C met open deksel.
9. elueer het NA met 50 μΐ TE-buffer, al dan niet in tegenwoordigheid van RNAsin.
10. centrifugeer 2 min bij 12000xg; de supernatant bevat het NA.
M) Protocol Ζ
Dit protocol is geschikt voor het isoleren van NA uit complexe uitgangsmaterialen zoals humaan serum, vol bloed, waterige faeces en urine en maakt gebruik van Eppendorff testbuizen met 900 μΐ L5 en 40 μΐ SC. Het geïsoleerde NA kan voor hybridisatiereacties worden gebruikt, maar is minder geschikt als substraat voor restrictie-enzymen. T4-DNA-ligase is echter actief. Vergeleken met protocol Y leidt dit protocol Z tot een hogere NA opbrengst.
1. Vortex de testbuis totdat de pellet geresuspendeerd is.
2. Voeg 50 μΐ uitgangsmateriaal <serum, vol bloed, faeces of urine) toe en vortex onmiddellijk tot homogeen (ca. 5 sec).
3. laat 10 min op kamertemperatuur en vortex 5 sec.
4. centrifugeer 15 sec bij 12000xg en verwijder supernatant door afzuigen.
5. was de pellet 2x met L2.
6. was de pellet 2x met 70 % ethanol.
7. was de pellet lx met aceton.
8. droog de pellet in 10 min bij 56 °C met open deksel.
9. elueer het NA met 50 μΐ TE-buffer, eventueel in tegenwoordigheid van RNAsin.
10. centrifugeer 2 min bij 12000xg; de supernatant bevat het NA.
N) pitaaftCLSj^-ejisasn
De voorbeelden zijn als volgt in secties ingedeeld, onder meer (secties A-D) naar de aard van het uitgangsmateriaal: sectie A: humaan serum sectie B: humaan vol bloed sectie C: humane urine
Deze secties A, B en C zijn vooral bedoeld om te laten zien, dat zowel dsDNA als ssRNA in zuivere vorm kunnen worden geïsoleerd.
sectie D: humane faeces
Deze sectie D laat onder andere zien, dat ook dsRNA kan worden geïsoleerd, sectie E: enkelstrengs DNA
Deze sectie E bevat experimenten, die toepasbaarheid van de uitvinding voor het isoleren van ssDNA aantonen, sectie F: diatomeeënaarde
Deze sectie F laat zien, dat kiezelwier-skeletten zeer goed bruikbaar zijn als de volgens de uitvinding te gebruiken silica-deeltjes. Daarbij wordt tevens aangetoond, dat de uitvinding gebruikt kan worden voor het isoleren van NA uit diverse gramnegatieve bacteriën.
Steeds werd een hoeveelheid van 50 μΐ toegepast. Het in secties B en F gebruikte bloed was steeds vers bloed, afgetapt in tegenwoordigheid van EDTA om stolling te voorkomen (hiertoe werd gebruik gemaakt van het Venojectsysteem van Terumo N.V., Leuven, België, verzamelbuizen van het type VT-574 TKZ). De in de overige secties toegepaste uitgangsmaterialen (serum, urine en faeces) waren ingevroren. In de voorbeelden Al, A2, A3, BI, B2, B5, B7 en F1 was het serum resp. bloed van dezelfde persoon afkomstig.
O) Verdere methoden
Een deel van de geëlueerde hoeveelheid NA werd voor gel-elektroforetisch onderzoek op een neutrale agarose-gel overgebracht, die 1 μg/ml ethidiumbromide bevatte in het door Aaij en Borst beschreven buffersysteem (Biochim.Biophys.Acta 269. 1972, 192). Foto's werden genomen onder UV-belichting van de gel.
In sommige experimenten werd een bekende hoeveelheid van een gezuiverd DNA (input DNA) aan het klinische monster toegevoegd. In deze gevallen werd op dezelfde gel ook een hoeveelheid input DNA aangebracht, overeenkomende met een extractie-rendement van 100 %.
Bacteriëel plasmide-DNA werd op de door Ish-Horowicz en Burke beschreven wijze (Nucleic Acids Res. 2., 1981, 2989) uit Escherichia coli HB101 gezuiverd, waarna kolomchromatografie met Sepharose CL 2B (Pharmacia, Ine.) en precipitatie met ethanol plaats vonden. Het pCMV-E bevat een 0,4 kb humaan cytomegalovirus DNA fragment, gekloneerd in de 2 kb vector pHC 624 (Boros in Gene 3flL, 1984, 257); pEBV-10 bevat een in dezelfde vector gekloneerd 0,9 kb Epstein Barr virus DNA fragment. Om een plasmide preparaat te verkrijgen, dat verrijkt was aan relaxed circulaire (CU) molekulen, werd pEBV-10 DNA (2,9 kb) met DNAse I behandeld. Component II molekulen dienen als model voor zuivering van Hepatitis B viraal DNA, dat xn virions aanwezig is als een relaxed circulair DNA molekuul van 3,2 kb.
In de meeste RNA isolatie experimenten (voorbeelden A3, B5, B6, B7, C2, Dl, El, Fl en F2) werden geen andere voorzorgsmaatregelen dan het eventuele gebruik van RNAsin in de elutie-buffer getroffen om RNA afbraak tijdens de zuiveringsprocedure te verhinderen. Handschoenen werden alleen gedragen tijdens het in de testbuizen brengen van de klinische monsters; er werden bij de bereiding van de reagentia geen RNAse inhibitors toegepast; en er werden niet-geautoclaveerde Eppendorff vaatjes en pipet-punten gebruikt. Uit onder andere de voorbeelden Fl en F2 is gebleken, dat de aanwezigheid van RNAsin tijdens de elutie niet strikt noodzakelijk is.
De gebruikte enzymen waren in de handel verkrijgbaar en werden volgens voorschrift van de producent toegepast. Alle restrictie-enzymen waren, evenals RNAse A, T4-ligase en AMV-reverse transcriptase, afkomstig van Boehringer (Mannheim). Tao-DNA polymerase was afkomstig van Cetus Ine. De polymerase ketting reacties (PCR) werden uitgevoerd met een Perkin Elmer Cetus DNA-thermal cycler.
Voor verschillende toepassingen is het van wezenlijk belang, dat de bij de werkwijze volgens de uitvinding gebruikte reagentia, in het bijzonder de NA-drager (silicadeeltjes) en de lysis- en wasbuffers, die het chaotrope guanidiniumzout bevatten, niet verontreinigd zijn door nucleïnezuur (bijv. door NA bevattende bacteriën of virussen). Dit kan voor de NA-drager worden verzekerd door deze 20 min bij 121 °C in een autoclaaf te verwarmen. Deze methode is echter niet bruikbaar bij de GuSCN bevattende lysis- en wasbuffers (-GEDTA, L5, L6, en L2) , zowel wegens een mogelijk verlies van activiteit als vanwege het daaraan verbonden gevaar voor de omgeving. Teneinde deze reagentia (zo veel mogelijk) nucleïnezuur-vrij te maken kunnen ze, conform de uitvinding, door een kolom van silicadeeltjes worden geleid. Dankzij de lyserende eigenschappen van de GuSCN bevattende buffers en de eigenschap van silica om NA te binden bij aanwezigheid van de chaotrope stof GuSCN, leidt een dergelijke procedure tot een NA-vrije buffer. De kolom zelf kan nucleïnezuur-vrij worden gemaakt door bijv. één of meerdere uren te verhitten op bijv. 500 °C of hoger.
P) DNA-soorten
Cl : covalent gesloten circulair DNA (plasmide) CII :relaxed (nicked) circulair DNA (plasmide) CIII :lineair DNA (gelineariseerd plasmide) LMW :laag moleculair gewicht DNA (< 0,5 kb); Hpall digest van pHC 624, fragmenten van 471 bp, 404 bp, 242 bp (2 fragmenten), 190 bp, 147 bp, 110 bp, 67 bp en enkele kleinere fragmenten van onbepaalde lengte.
MMW :medium moleculair gewicht DNA (0,5-29 kb); Hindlll digest van faag lambda DNA, fragmenten van 23 kb, 9,4 kb, 6,7 kb, 4,4 kb, 2,3 kb, 2,0 kb en 0,56 kb.
HMW :hoog moleculair gewicht DNA (> 29 kb) ssDNA:faag M13mp9 enkelstrengs DNA (Boehringer) SECTIE A; DNA/RNA zuivering uit humaan serum
In humaan serum kan NA bijv. in virussen of bacteriën aanwezig zijn. Deze organismen kunnen zowel in vrije vorm als ook gebonden in immuuncomplexen voorkomen. De hoeveelheden NA zijn doorgaans dermate laag, dat detectie via agarose gel-elektroforese en UV-belichting van ethidiumbromide/NA complexen onmogelijk is. Om aan te tonen dat DNA uit humaan serum kan worden gezuiverd, werden microgram hoeveelheden van gezuiverd DNA aan het serum toegevoegd, waarna het DNA volgens protocol B werd geïsoleerd (voorbeelden Al en A2). Om aan te tonen dat DNA en RNA tegelijk uit humaan serum kunnen worden gezuiverd, werden gekweekte zoogdiercellen of bacteriën (met daarin een klein plasmide) aan het serum toegevoegd, waarna het NA werd geïsoleerd volgens protocol Y (voorbeeld A3). Ten slotte wordt in voorbeeld A4 aangetoond, dat met protocol Y in humaan serum aanwezig RNA van HIV (het Human Immunodeficiency Virus) gezuiverd en door de PCR methode gedetecteerd kan worden.
Voorbeeld Al: DNA zuivering uit-humaan^aerum
Humaan serum (500 μΐ) werd gemengd met bekende hoeveelheden gezuiverd DNA [100 μΐ LMW (45 μg), 20 μΐ MMW (20 μg), 40 μΐ CI/II (20 μg); zie figuur Al] en 10 monsters van 66 μΐ werden gebruikt als input materiaal voor 10 DNA extracties volgens protocol B. De hoeveelheid SC (suspensie van grof silica) in de testbuizen werd in dit experiment gevariëerd tussen 2,5 en 40 μΐ (lanen 1 en 2: 2,5 μΐ; lanen 3 en 4: 5 μΐ; lanen 8 en 9: 10 μΐ; lanen 10 en 11: 20 μΐ; lanen 12 en 13: 40 μΐ). De extracties werden in duplo uitgevoerd en de helft (30 μΐ) van het geëlueerde DNA van elk monster werd aan elektroforese door een 1 % agarose gel onderworpen. Ter vergelijking werd ook de halve hoeveelheid van de input DNAs op dezelfde gel aangebracht (lanen 5, 6 en 7).
Figuur Al laat zien, dat dsDNA, zowel lineair (bereik van 23 kb tot ongeveer 60 bp), covalent gesloten (Cl) als relaxed circulair (CII) DNA efficiënt uit humaan serum werd geïsoleerd wanneer meer dan 10 μΐ SC werd gebruikt. De opbrengst van het grootste MMW-fragment (ca. 23 kb) lijkt relatief laag in vergelijking met de kleinere fragmenten, hetgeen op grond van andere experimenten kan worden toegeschreven aan het optreden van breuken (’’shearing") in fragmenten met hoog moleculair gewicht.
De merker lanen 5, 6 en 7 tonen resp. de hoeveelheid LMW, CU/Cl en MMW DNA die bij een extractie-rendement van 100 % zouden worden gevonden. Zoals eerder is vermeld, werd een CII-rijk (met DNAse I behandeld) 3 kb plasmide (pEBV-10) als input materiaal gebruikt.
Voorbeeldt: uit humaan serum geïsoleerd DNA is een goed substraat.. voor rest riet ie-enzvmen en T4-DNA-liaase
Gezuiverde DNA preparaten werden toegevoegd aan 12 humaan serum monsters van 50 μΐ. Het DNA werd volgens protocol B uit deze 12 mengsels geïsoleerd; elutie geschiedde met 50 μΐ TE. De helft van het geëlueerde DNA werd (in duplo) hetzij behandeld met één van de volgende drie restrictie-enzymen: EcoRI. BamHI en EalII (deze zijn resp. actief in buffers met laag, medium en hoog zoutgehalte), hetzij behandeld met T4-DNA-ligase, hetzij niet behandeld. De DNA monsters werden aan elektroforese door een 1 % agarose gel onderworpen en door ÜV-belichting zichtbaar gemaakt (figuur A2).
De merker laan 3 toont de helft van de hoeveelheid LMW-DNA, die als input materiaal voor de eerste vier serum monsters werd gebruikt en daarmede de hoeveelheid LMW-DNA, die bij een extractie-rendement van 100 % zou worden gevonden voor de onbehandelde monsters 1 en 2. De lanen 1 en 2 tonen de opbrengst van LMW-DNA uit serum (onbehandelde monsters). De lanen 4 en 5 laten de resultaten van de behandeling met T4-ligase zien (1 uur bij 37 °C, 3 eenheden T4-ligase in een reactievolume van 30 μΐ); een dergelijke behandeling resulteert in een verschuiving van het moleculair gewicht van de DNA fragmenten en wijst er op, dat het uit humaan serum geïsoleerde DNA niet significant door exonucleolytische afbraak is aangetast.
De lanen 6-13 tonen de resultaten voor 8 serum monsters waaraan een gezuiverd plasmide (pCMV-E; 3,3 μg; 1,5 μΐ) was toegevoegd. De lanen 6 en 7 tonen de helft van de output hoeveelheden (onbehandelde monsters). De lanen 8 en 9, 10 en 11, en 12 en 13 tonen resp. de EcoRI digests, de BamHI digests en de Belli digests, die elk tot linearisatie van het plasmide leidden. Alle incubaties met restrictie-enzym werden gedurende 1 uur bij 37 °C met 9 eenheden enzym in een reactievolume van 30 μΐ uitgevoerd. Cl en gelineariseerd (CIII) plasmide DNA zijn met pijlen aangeduid.
Voorbeeld A3: qeliiktiidiae isolatie van DNA en ssRNA uit een humaan, .sex.um
Omdat in humaan serum slechts zeer lage RNA gehaltes aanwezig zijn (bijv. in virussen, bacteriën of cellen), die niet door UV-belichting van met ethidiumbromide gekleurde gels kunnen worden gedetecteerd, werden exogene RNA bronnen aan monsters van een humaan serum toegevoegd. Onder verwijzing naar figuur A3, werden als exogene RNA bronnen zoogdiercellen (lanen 3, 4, 10 en 11) of bacteriën (lanen 5, 6, 12 en 13) toegepast. De lanen 1, 2, 8 en 9 betreffen monsters, waaraan geen exogene RNA bronnen zijn toegevoegd. Het NA werd volgens protocol Y uit de monsters geïsoleerd en in 50 μΐ TE met 0,5 U RNAsin per μΐ in afwezigheid (lanen 1-6) of in tegenwoordigheid (lanen 8-13) van RNAseA (40 ng per μΐ van de elutiebuffer) geëlueerd. Figuur A3 toont de resultaten van de daarna uitgevoerde elektroforese door een 1 % neutrale agarose gel. De merker laan 7 bevat 1 μg MMW-DNA. Ribosomale RNAs zijn aangegeven. Als zoogdiercellen werden per 50 μΐ serum monster 5xl05 ratte-10B cellen (Boom et al, J. Gen. Virol. ££, 1988, 1179) toegevoegd, terwijl als bacteriën per 50 μΐ serum de celpellet van een 100 μΐ overnacht cultuur van de E. coli stam HB101 met daarin het plasmide pCMV-E (Cl is in figuur A3 aangegeven) werd toegevoegd.
Voorbeeld A4: Polvmerase ketting reactie voor de detectie van uit humaan serum geïsoleerd Human Immunodeficiency.Virus. RNA
NA (75 μΐ) werd volgens protocol Y geïsoleerd uit 2 humane serum monsters van elk 50 μΐ (patiënten F en H). Het serum van patiënt F bevatte een hoog (2700 pg/ml) gehalte van het HIV antigeen P24 (volgens de HIV P24 antigeen solid phase immunoassay van Abbott Laboratories), maar was negatief voor HIV antilichamen (volgens de HIV antilichamen ELISA van Abbott Laboratories), terwijl het serum van patiënt H in beide tests negatief was.
Een deel van het geïsoleerde NA (43 μΐ) werd gedurende 90 min bij 37 °C behandeld met RNAse-vrij DNAse (Boehringer; 1 U DNAse/μΙ) . Na ethanol-pre-cipitatie en inactivering door 15 min verwarming op 68 °C werd het RNA in 15 μΐ TE-buffer gesuspendeerd. Een 5 μΐ portie van dit RNA preparaat werd al dan niet behandeld met 0,4 U/μΙ AMV-reverse-transcriptase (30 min bij 42 °C; reactievolume 20 μΐ) in tegenwoordigheid van HIV-specifieke primers. Het reactievolume werd vervolgens op 100 μΐ gebracht door 80 μΐ toe te voegen van een 1,25 keer geconcentreerde PCR buffer met dNTPs, waarna 1 U van Taq-DNA-polymerase werd toegevoegd en de vermeerdering (amplificatie) werd gestart ( een cyclus omvatte 1 min op 95 °C, 1 min op 55 °C, 2 min op 72 °C). Van de reactiemengsels werden na 20, 25, 30 en 35 cycli porties van 10 μΐ afgenomen, die op een 2 % agarose gel werden aangebracht. De resultaten zijn in figuur A4 weergegeven. Het verwachte HIV amplimeer fragment van 330 bp werd reeds na 25 cycli voor het met reverse-transcriptase behandelde RNA van patiënt F waargenomen, waaruit kan worden afgeleid dat HIV RNA in zijn serum aanwezig was.
In figuur A4 is het 330 bp amplimeer met een pijl aangeduid. De merker lanen 9 bevatten 2 μg LMW-DNA. De lanen 1-4 betreffen de met reverse transcriptase behandelde RNA preparaten na resp. 20, 25, 30 en 35 PCR cycli; de lanen 5-8 betreffen de niet met reverse transcriptase behandelde RNA preparaten na resp. 20, 25, 30 en 35 PCR cycli.
SECTIE B.; DNA/RNA zuivering uit humaan vol bloed
Humaan bloed bevat per ml ongeveer 5xl09 erythrocyten, die geen kern bevatten en daarom niet bijdragen aan de hoeveelheid NA in het bloed. De NA-hoeveelheid van bloed wordt in hoofdzaak bepaald door de witte bloedcellen (ongeveer 4-10xl06 per ml) . Deze cellen zijn ingebed in een waterig medium (plasma) dat grote hoeveelheden eiwitten bevat (ongeveer 70 mg/ml bloed).
Vol bloed is derhalve een buitengewoon onzuivere bron voor de zuivering van NA. In de voorbeelden van sectie B wordt aangetoond, dat met de protocols B en Y desondanks NA uit vol bloed kan worden geïsoleerd.
Voorbeeld BI: DNA isolatie uit humaan vol bloed
Humaan bloed (500 μΐ) werd gemengd met bekende hoeveelheden gezuiverd DNA [100 μΐ LMW (45 μg), 80 μΐ CI/II (40 μg); zie figuur BI] en 10 monsters van 68 μΐ werden gebruikt als input materiaal voor 10 DNA extracties volgens protocol B. De hoeveelheid SC (suspensie van grof silica) in de testbuizen werd in dit experiment gevariëerd tussen 2,5 en 40 μΐ (lanen 1 en 2: 40 μΐ; lanen 3 en 4: 20 μΐ; lanen 5 en 6: 10 μΐ; lanen 10 en 11: 5 μΐ; lanen 12 en 13: 2,5 μΐ). De extracties werden in duplo uitgevoerd en de helft (30 μΐ) van het geëlueerde DNA van elk monster werd aan elektroforese door een 1 % agarose gel onderworpen. Ter vergelijking werd ook de halve hoeveelheid van de input DNAs op dezelfde gel aangebracht (lanen 8 en 9); deze lanen tonen dus de hoeveelheden CII/CI DNA resp. LMW DNA, die bij een extractierendement van 100 % zouden worden waargenomen. De merker laan 7 bevatte 1 μg MMW-DNA.
Figuur BI laat zien, dat dsDNA, zowel lineair, covalent gesloten (Cl) als relaxed circulair (CU) DNA efficiënt uit humaan vol bloed werd geïsoleerd wanneer meer dan 10 μΐ SC werd gebruikt. De uit vol bloed gewonnen hoeveelheid DNA was tot ongeveer 10 μΐ evenredig met de hoeveelheid SC. Grotere hoeveelheden leken verzadigend te zijn.
Voorbeeld B2: uit humaan vol bloed geïsoleerd DNA..is „een__go_ed substraat voor restrictie-enzymen en T4-DNA-ligase
Gezuiverde DNA preparaten werden toegevoegd aan 12 humaan bloed monsters van 50 μΐ. Het DNA werd volgens protocol B uit deze 12 mengsels geïsoleerd; elutie geschiedde met 50 μΐ TE. De helft van het geëlueerde DNA werd hetzij behandeld met één van de volgende drie restrictie-enzymen: E££RI, £amHI en BglII (deze zijn resp. actief in buffers met laag, medium en hoog zoutgehalte), hetzij behandeld met T4-DNA-ligase, hetzij niet behandeld. De DNA monsters werden aan elektroforese door een 1 % agarose gel onderworpen en door UV-belichting zichtbaar gemaakt (figuur B2).
De merker laan 3 toont de helft van de hoeveelheid LMW-DNA (2 μ9), die als input materiaal voor de eerste vier bloed monsters werd gebruikt en daarmede de hoeveelheid LMW-DNA, die bij een extractie-rendement van 100 % zou worden gevonden voor de onbehandelde monsters 1 en 2. De lanen 1 en 2 tonen de opbrengst (naar schatting 40 %) van LMW-DNA uit bloed (onbehandelde monsters). De lanen 4 en 5 laten de resultaten van de behandeling met T4-ligase zien (1 uur bij 37 °C, 3 eenheden T4-ligase in een reactievolume van 30 μΐ); een dergelijke behandeling resulteert in een verschuiving naar een hoger moleculair gewicht van de DNA fragmenten en wijst er op, dat het uit humaan bloed geïsoleerde DNA niet significant door exonucleolytische afbraak is aangetast.
De lanen 6-13 tonen de resultaten voor 8 bloed monsters waaraan een gezuiverd plasmide (pCMV-E; 3,3 μg; 1,5 μΐ) was toegevoegd. De lanen 6 en 7 tonen de helft van de output hoeveelheden (onbehandelde monsters). De lanen 8 en 9, 10 en 11, en 12 en 13 tonen resp. de EcoRI digests, de BamHi digests en de ËgjLII digests, die elk tot linearisatie van het plasmide leidden. Alle incubaties met restrictie-enzym werden gedurende 1 uur bij 37 °c met 9 eenheden enzym in een reactievolume van 30 μΐ uitgevoerd. Cl en gelineariseerd (CIII) plasmide DNA zijn met pijlen aangeduid.
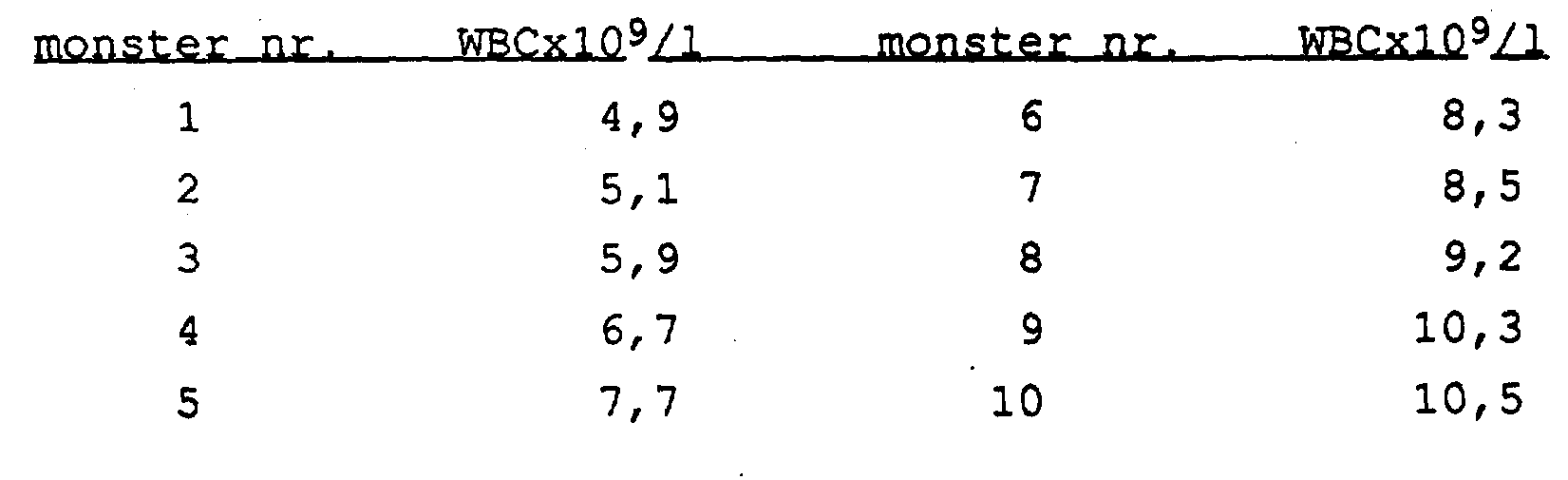
Vgprfreeld B3; DMA, isolatie uit 10 verschillende monsters bloed
In dit voorbeeld worden 10 verschillende monsters van humaan bloed, naar willekeur gekozen uit een bloedbank, als uitgangsmateriaal gebruikt. Het aantal witte bloedcellen (WBC) was van elk van de monsters bekend. Volgens protocol B werd DNA uit 50 μΐ van de monsters geïsoleerd, waarbij met 75 μΐ TE werd geëlueerd. Éénderde van het geïsoleerde DNA werd direct op een 1 % agarose gel aangebracht (de lanen 2-11 in het bovenste paneel van figuur B3), terwijl een deel (2 μΐ) van het overblijvende gedeelte voor een PCR werd gebruikt (zie voorbeeld B4).
Dezelfde monsters werden aan dezelfde isolatie-procedure onderworpen nadat aan elk 50 μΐ monster 3 μΐ LMW-DNA (6 μg) was toegevoegd. Ook nu werd 25 μΐ van het eluaat (75 μΐ) direct op de gel aangebracht (figuur B3, lanen 2-11 van het middelste paneel). Een andere portie van 25 μΐ van het eluaat werd eerst behandeld met T4-DNA-ligase (1 uur bij 37 °C, 2 U in een reactievolume van 30 μΐ) en daarna op dezelfde gel aangebracht (lanen 2-11 in het onderste paneel van figuur B3) .
De lanen 1 en 12 van figuur B3 zijn merker lanen. In het bovenste paneel bevatten beide merker lanen MMW-DNA. In het middelste en onderste paneel bevatten beide lanen 1 LMW-DNA en bevatten beide lanen 12 MMW-DNA. De merker laan 1 van het middelste paneel toont de hoeveelheid LMW-DNA, die bij een isolatie-rendement van 100 % zou worden verkregen.
Het gehalte aan witte bloedcellen (WBC) van de bloedmonsters 1-10 was als volgt:
Voorbeeld B4: polymerase ketting reactie voor.de detectiê_van het humane beta-qlobine gen in humane witte bloedcellen
Om aan te tonen dat volgens protocol B uit humaan vol bloed geïsoleerd DNA een goed substraat is voor Taq-DNA-polymerase, werd 2 μΐ van het volgens voorbeeld B3 uit tien verschillende bloedmonsters geïsoleerde DNA aan een PCR met beta-globine specifieke primers onderworpen. De PCR omvatte 32 cycli, waarvan elke cyclus bestond uit 1 min op 94 °C en daarna 3 min op 65 °C. Een deel van de amplimeren (50 %) werd aan elektroforese door een 2 % agarose gel onderworpen. De resultaten zijn weergegeven in de lanen 2-11 van figuur B4. Merker laan 1 bevatte 2 μg LMW-DNA. De merker laan 12 is een negatieve controle, met water als input voor de PCR. Met pijlen zijn het 120 bp amplimeer en de primer banden aangeduid.
Voorbeeld B5: gelijktijdige zuivering van DNA en ssRNA uit humaan bloed (reproduceerbaarheid)
Om aan te tonen dat DNA en RNA op een reproduceerbare wijze uit humaan bloed kunnen worden gezuiverd, werden van één persoon 6 bloedmonsters van elk 50 μΐ aan protocol Y onderworpen, waarbij het NA geëlueerd werd met 75 μΐ TE met RNAsin (0,5 U/μΙ). Een 25 μΐ portie van het eluaat werd op een neutrale 1 % agarose gel aangebracht en aan elektroforese onderworpen. De resultaten zijn in de lanen 1-6 van figuur B5 weergegeven. De merker laan 7 bevatte 1 μg MMW-DNA. Genomisch DNA en ribosomale RNAs zijn aangeduid.
Voorbeel.d_B.6L gelijktijdige zuivering van DNA en ssRNA uit humaan bloed (10 verschillende monsters)
Bloedmonsters van 50 μΐ, afkomstig van 10 verschillende personen (zie voorbeeld B3), werden aan protocol Y onderworpen, waarbij het NA geëlueerd werd met 40 μΐ TE met 0,5 ϋ/μΐ RNAsin. Eluaatporties van 30 μΐ werden aan elektroforese door een neutrale 1 % agarose gel onderworpen. Het resultaat wordt in de lanen 2-11 van figuur B6 getoond. Deze lanen hebben dezelfde volgorde als in figuur B3. De merker lanen 1 en 12 bevatten 1 μg MMW-DNA. Aangegeven zijn de 28S en 18S ribosomale RNAs.
Voorbeeld B7; gelijktijdige zuivering van DNA en ssRNA uit humaan bloed
Er werden exogene RNA bronnen aan monsters van een humaan bloed toegevoegd. Onder verwijzing naar figuur B7, werden als exogene RNA bronnen zoogdiercellen (lanen 3, 4, 10 en 11) of bacteriën (lanen 5, 6, 12 en 13) toegepast. De lanen 1, 2, 8 en 9 betreffen monsters, waaraan geen exogene RNA bronnen zijn toegevoegd. He't NA werd volgens protocol Y uit de monsters geïsoleerd en in 50 μΐ TE + 0,5 U/μΙ RNAsin in afwezigheid (lanen 1-6) of in tegenwoordigheid (lanen 8-13) van RNAseA (40 ng per μΐ van de elutiebuffer) geëlueerd. Figuur B7 toont de resultaten van de daarna uitgevoerde elektroforese van 25 μΐ van het eluaat door een 1 % neutrale agarose gel. De merker laan 7 bevat 1 μg MMW-DNA. Als zoogdiercellen werden per 50 μΐ bloed monster 5xl05 ratte-10B cellen (Boom et al, J. Gen.
Virol. JL£, 1988, 1179) toegevoegd, terwijl als bacteriën per 50 μΐ bloed de celpellet van een 100 μΐ overnacht cultuur van de E. coli stam HB101 met daarin het plasmide pCMV-E werd toegevoegd.
Uit de resultaten blijkt, dat zowel zoogdier ssRNA (18S en 28S ribosomale RNAs)als bacteriëel ssRNA (16S en 23S ribosomale RNAs) uit humaan vol bloed kunnen worden gezuiverd. Bovendien worden ook genomisch DNA en plasmide (vorm I) DNA efficiënt teruggewonnen.
SECTIE C: DNAZRNA zuivering uit humane urine
In humane urine kan NA bijv. aanwezig zijn in virussen of bacteriën, alsmede in cellen van de urine-wegen. De hoeveelheden zijn doorgaans dermate laag, dat detectie via agarose gel-elektroforese en UV-belichting van ethidiumbromide/NA complexen onmogelijk is. Om aan te tonen dat DNA uit humane urine kan worden gezuiverd, werden microgram hoeveelheden van gezuiverd DNA aan urine toegevoegd, waarna het DNA volgens protocol B werd geïsoleerd (voorbeeld Cl). Om aan te tonen dat DNA en RNA tegelijk uit humane urine kunnen worden gezuiverd, werden gekweekte bacteriën (met daarin een klein plasmide) aan urine toegevoegd, waarna het NA werd geïsoleerd volgens protocol ï (voorbeeld C2).
y.g.QEkeeld Cl.:. PljA-Z-uiveri-ag-ult.-humane urine
Aan 10 willekeurig gekozen humane urine monsters van 50 μΐ met uiteenlopende troebelheid (de monsters 4, 5, 6 en 7 waren helder, de monsters 1, 2, 3 en 8 waren in lichte mate troebel en de monsters 9 en 10 waren zeer troebel) werd 3 μΐ LMW-DNA (6 μg) toegevoegd. Het DNA werd volgens protocol B geïsoleerd, waarbij voor de elutie 75 μΐ TE-buffer werd toegepast. Éénderde van elk eluaat werd op een 1 % agarose gel aangebracht (lanen 2-11 van het onderste paneel in figuur Cl bevatten het DNA, resp. geïsoleerd uit de urinemonsters 1-10). Een ander deel van 25 μΐ werd met 1,8 U T4-DNA-ligase behandeld (1 uur bij 37 °C in een reactievolume van 30 μΐ) en op dezelfde gel aangebracht (lanen 2-11 van het bovenste paneel van figuur Cl). De merker lanen 1 en 12 bevatten resp. LMW-DNA en MMW-DNA. De hoeveelheid LMW-DNA (2 μg) in de lanen 1 vertegenwoordigt de hoeveelheid, die bij een extractie-rendement van 100 % zou worden waargenomen.
De resultaten tonen aan, dat DNA met protocol B efficiënt uit humane urine kan worden gezuiverd en een goed substraat is voor T4-DNA-ligase.
Het uit urine monster nr. 10 (laan 11 van het onderste paneel in figuur Cl) geïsoleerde LMW-DNA is duidelijk aan afbraak onderhevig geweest. Het was echter te verwachten, dat naakt DNA (zoals in dit experiment werd toegepast) zou worden afgebroken wanneer een urine monster rijk is aan nucleasen. De afbraak heeft dan ook waarschijnlijk eerder plaats gevonden tijdens de bereiding van de urine/DNA-mengsels dan tijdens de zuivering. In het volgende voorbeeld (C2) wordt aangetoond, dat DNA en zelfs in cellen aanwezig (in tegenstelling tot naakt) ssRNA efficiënt uit urine monster nr. 10 kunnen worden teruggewonnen.
Yaortofild C2; gelijktijdige zuivering van DNA en ssRNA uit humane urine
In dit experiment werden dezelfde 10 urine monsters als in voorbeeld Cl werden gebruikt, gemengd met bacteriën, die een 2,4 kb plasmide (pCMV-E) bevatten. Het NA werd uit deze mengsels geïsoleerd volgens protocol Y en daarbij geëlueerd in 75 μΐ TE-buffer met 0,5 U/μΙ RNAsin. Éénderde van het eluaat werd aan elektroforese door een 1 % agarose gel onderworpen (lanen 2-11 van het bovenste paneel van figuur C2). Een andere 25 μΐ portie van het eluaat werd behandeld met 10 ü van het restrictie-enzym EfifiRI, dat pCMV-E lineariseert (1 uur bij 37 °C in een reactievolume van 30 μΐ). Deze behandeling werd uitgevoerd in tegenwoordigheid van 40 ng/μΐ RNAseA. Het elektroforese resultaat is voor de urinemonsters 1-10 weer- gegeven in de lanen 2-11 van het onderste paneel van figuur C2. De merker lanen 1 en 12 bevatten 1 μς MMW-DNA. In de figuur zijn de 23S en 16S ribosomale RNAs, alsmede de covalent . gesloten (Cl) en lineaire (CIII) vormen van plasmide DNA aangegeven. '
Voorbeeld Dl: zuivering van rotaviraal dsRNA uit humane. jf.ae.c es
Leden van de virus familie der Reoviridae hebben een uit dubbelstrengs RNA bestaand genoom. Belangrijke pathogenen, die tot deze familie behoren, zijn de Rotavirussen welke een ernstige diarree kunnen veroorzaken en dan in aanzienlijke hoeveelheden in faeces-monsters aanwezig zijn. Het rotavirale genoom bestaat uit 11 dsRNA segmenten (zie Hishino in J. Clin. Microbiol. 21/ 1985, 425) die volgens protocol B uit de supernatant van faeces konden worden geïsoleerd. Voor de isolatie werd 100 μΐ supernatant gebruikt, verkregen door 2 min centrifugeren van het diarree monster bij 12000xg.
In figuur Dl worden de resultaten getoond voor monsters van 6 verschillende patiënten met bewezen rotavirale infectie (bewezen door de Wellcome Rotavirus latex test en door het Kallestad Pathfinder Rotavirus direct antigeen detectie systeem). De resultaten (gel elektroforese op 1 % agarose gels) bewijzen, dat dsRNA kan worden geëxtraheerd. In figuur Dl zijn de Rotavirus genen 1-11 aangegeven.
Soortgelijke resultaten (gewoonlijk met hogere opbrengsten aan rotaviraal dsRNA) werden verkregen wanneer de eerste centrifugeringsstap werd weggelaten en de faeces-monsters direct als input materiaal voor protocol B of Y werden gebruikt (niet getoond).
Voorbeeld El; zuivering van ssDNA.uit_ humaan bloed, serum en
Om aan te tonen (voor de resultaten, zie figuur El) dat enkelstrengs-DNA eveneens uit klinische monsters kan worden geïsoleerd, werd 1 μς (4 μΐ) van gezuiverd faag M13 DNA (M13mp9 DNA, Boehringer) toegevoegd aan 50 μΐ humaan serum (figuur El, lanen 1-4), humaan bloed (figuur El, lanen 5-8) of humane urine (figuur El, lanen 10-13) en gezuiverd volgens protocol B (figuur El, bovenste paneel) of volgens protocol Y (figuur El, onderste paneel). Alle extracties werden in viervoud uitgevoerd. DNA werd geëlueerd in 50 μΐ TE-buffer en 25 μΐ werd aan elektroforese door een 1 % agarosegel onderworpen. De merkerlaan 9 bevat 500 ng van M13 ssDNA.
Uit de resultaten blijkt dat met behulp van protocol Y, en in mindere mate ook met behulp van protocol B, enkelstrengs DNA uit humaan bloed, serum of urine kan worden geïsoleerd.
SECTIE F; binding van NA aan diatomeeënaarde
Aangezien de skeletten van diatomeeënaarden vrijwel volledig uit Si02 bestaan, werd onderzocht of zij wellicht als het te gebruiken silica dienst zouden kunnen doen. Van elk van vijf verschillende, in de handel verkrijgbare diatomeeënaarde produkten [Celatom FW14, Celatom FW50, Celatom FW60, Celite (AK) en Celite 521, Janssen Biochimica, Leuven, België] werd 10 g gemengd met 50 ml aqua bidest en 500 μΐ 37 %'s HC1, waarna de verkregen suspensies gedurende 20 min. in een autoclaaf op 121 °C werden verwarmd. De aldus verkregen suspensies werden in de voorbeelden F1 en F2 gebruikt voor NA extracties volgens protocol Y.
Voorbee_ld__FlNA. isolatie uit humaan bloed
Humaan bloed werd gemengd met E.coli HB101 bacteriën, die het plasmide pCMV-E bevatten, waarbij de bacteriepellet van 100 μΐ van een overnachtse culture aan 50 μΐ bloed werd toegevoegd. Als input materiaal voor NA extracties volgens protocol Y werden monsters van 50 μΐ gebruikt. In plaats van 40 μΐ SC werd 40 μΐ van de bovenstaand genoemde suspensies van diatomeeënaarde toegepast. Het NA werd geëlueerd in 75 μΐ TE-buffer, zonder gebruik van RNAse inhibitor, en 20 μΐ van het eluaat werd direct op de gel aangebracht (figuur Fl, bovenste paneel). Een andere portie van 20 μΐ van het eluaat werd 1 uur lang bij 37 °C behandeld met RNAse A (40 ng/μΐ), samen met 9 U
van BamHI. in een reactievolume van 25 μΐ en daarna op de gel aangebracht (figuur Fl, onderste paneel).
In figuur Fl betreffen de lanen 1 en 2 de resultaten met
Celatom FW14 als NA drager, de lanen 3 en 4 de resultaten met
Celatom FW50 als NA drager, de lanen 5 en 6 de resultaten met
Celatom FW60 als NA drager, de lanen 8 en 9 de resultaten met
Celite (AK) als NA drager, de lanen 10 en 11 de resultaten met Celite 521 als NA drager, en de lanen 12 en 13 de resultaten met SC als NA drager. Laan 7 is een merker laan, die 1 μg MMW DNA bevat.
Uit de resultaten blijkt, dat de diatomeeënaarde-suspensies soortgelijke NA bindende eigenschappen bezitten als SC. Zowel dsDNA (component I molekulen zijn aangegeven) als ssRNA ;23S en 16S rRNAs zijn aangegeven) werden gebonden. Plasmide DNA was voldoende zuiver voor volledige linearisatie (component III is aangegeven) door BamHI.
Voorbeeld F2: NA zuivering uit aramneaatieve bacteriën
Op vaste agar-platen werden 9 verschillende soorten van gramnegatieve bacteriën gekweekt, die bij de mens een ziekte kunnen veroorzaken. Van elk van deze bacteriesoorten werd 5 tot 10 μΐ van de platen geschraapt en als input materiaal gebruikt voor NA extracties volgens protocol Y, waarbij 40 μΐ SC of 40 μΐ van de Celite 521 suspensie als NA drager werd gebruikt.
De extracties, waarbij SC werd gebruikt, moesten bij de eerste was-stap worden beëindigd omdat de NA-silica complexen niet meer gehomogeniseerd konden worden, zelfs niet door lange tijd (meer dan 3 minuten) te vortexen. Daarentegen verliepen extracties, waarbij Celite 521 werd gebruikt, zonder problemen, waarschijnlijk ten gevolge van de grotere deeltjesafmetingen van de diatomeeënaarde ten opzichte van de SC deeltjes. Het NA werd geëlueerd met 70 μΐ TE-buffer zonder RNAsin en een deel van het eluaat (20 μΐ) werd aan elektroforese door een 1 % agarose gel onderworpen (figuur F2).
In figuur F2 zijn lanen 1 en 12 merker lanen die 1 μg MMW DNA bevatten. De lanen 2-11 betreffen de resultaten voor resp. de volgende soorten bacteriën: laan 2 : Campylobacter pylori laan 3 : Yersinia enterolytica type 3 laan 4 : Neisseria meningitidis laan 5 : Neisseria aonorrhoeae laan 6 : Haemophilus influenzae type b laan 7 : Klebsiella pneumoniae laan 8 : Salmonella tvphimurium laan 9 : Streptococcus pneumoniae type 7 laan 10: Pseudomonas aeruginosa laan 11: Escherichia coli Kl-083 HMW bacteriëel DNA en rRNAs zijn met pijlen aangeduid. In figuur F2 laat laan 9 zien, dat de procedure niet geschikt is om NA uit de grampositieve bacterie Streptococcus pneumoniae te extraheren. Dit kan worden toegeschreven aan een ontoereikende lysis van dit organisme in de lysisbuffer. Voor een andere grampositieve bacterie (2.· aureus spec.) werden soortgelijke resultaten verkregen (niet getoond).
Claims (13)
1. Werkwijze voor het isoleren van nucleïnezuur uit een nucleïnezuur-bevattend uitgangsmateriaal, met het kenmerk, dat men het uitgangsmateriaal mengt met een chaotroop guanidinium-zout en met silica-deeltjes, de silica-deeltjes met het daaraan gebonden nucleïnezuur afscheidt van de vloeistof en, eventueel nadat de silica-nucleïnezuur-complexen zijn gewassen, het nucleïnezuur uit deze complexen elueert.
2. Werkwijze volgens conclusie 1, met het kenmerk, dat men als uitgangsmateriaal een nucleïnezuur-bevattend biologisch materiaal, zoals vol bloed, bloed serum, buffy coat, urine, faeces, liquor cerebrospinalis, sperma, speeksel, weefsels en celcultures toepast.
3. Werkwijze volgens conclusie 1 of 2, met het kenmerk, dat men als chaotroop guanidiniumzout guanidinium-thiocyanaat toepast.
4. Werkwijze volgens een van de conclusies 1-3, met het kenmerk, dat men DNA en/of RNA isoleert.
5. Werkwijze volgens een van de conclusies 1-4, met het kenmerk, dat men silica-deeltjes met een in hoofdzaak tussen 0,05 en 500 μπι gelegen deeltjesgrootte toepast.
6. Werkwijze volgens een van de conclusies 1-4, met het kenmerk, dat men silica-deeltjes met een in hoofdzaak tussen 0,1 en 200 Mm gelegen deeltjesgrootte toepast.
7. Werkwijze volgens een van de conclusies 1-4, met het kenmerk, dat men silica-deeltjes met een in hoofdzaak tussen 1 en 200 pm gelegen deeltjesgrootte toepast.
8. Werkwijze volgens een van de conclusies 1-7, met het kenmerk, dat men het uitgangsmateriaal met voldoend grote hoeveelheden chaotroop guanidiniumzout en silica-deeltjes mengt om in essentie al het in het uitgangsmateriaal aanwezige nucleïnezuur vrij te maken en aan de silica-deeltjes te binden.
9. Werkwijze volgens een van de conclusies 1-8, met het kenmerk, dat men de gevormde silica-nucleïnezuur-complexen van de vloeistof afscheidt door sedimentatie en verwijdering van de supernatant en de complexen vervolgens wast met een chaotroop guanidiniumzout bevattende wasbuffer.
10. Werkwijze volgens conclusie 9, met het kenmerk, dat men de met wasbuffer gewassen silica-nucleïnezuur-complexen achtereenvolgens verder wast met een alkohol-water oplossing en met aceton, en daarna droogt.
11. Werkwijze volgens conclusie 10, met het kenmerk, dat men in de gewassen en gedroogde silica-nucleïnezuur-complexen aanwezig nucleïnezuur elueert met behulp van een elutiebuffer.
12. Combinatie van middelen voor het isoleren van nucleïnezuur uit een nucleïnezuur-bevattend uitgangsmateriaal, omvattende (a) chaotroop guanidiniumzout, (b) silica-deeltjes, eventueel (c) wasvloeistof en eventueel (d) elutievloeistof.
13. Combinatie van middelen volgens conclusie 12, omvattende (a) een guanidiniumthiocyanaat bevattende lysis buffer, (b) een waterige suspensie van silica-deeltjes met een in hoofdzaak tussen 0,05 en 500 μιη, bij voorkeur tussen 0,1 en 200 pm en liefst tussen 1 en 200 Mm gelegen deeltjesgrootte, (c) een guanidiniumthiocyanaat bevattende wasbuffer en eventueel (d) een elutiebuffer.
Priority Applications (19)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| NL8900725A NL8900725A (nl) | 1989-03-23 | 1989-03-23 | Werkwijze en combinatie van middelen voor het isoleren van nucleinezuur. |
| ZA902190A ZA902190B (en) | 1989-03-23 | 1990-03-21 | Process for insolating nucleic acid |
| KR1019900004012A KR0148693B1 (ko) | 1989-03-23 | 1990-03-22 | 핵산 분리방법 |
| CA002012777A CA2012777C (en) | 1989-03-23 | 1990-03-22 | Process for isolating nucleic acid |
| CA002271603A CA2271603A1 (en) | 1989-03-23 | 1990-03-22 | Process for isolating nucleic acid |
| DK90200678T DK0389063T4 (da) | 1989-03-23 | 1990-03-22 | Fremgangsmåde til isolering af nukleinsyre |
| ES90200678T ES2085245T5 (es) | 1989-03-23 | 1990-03-22 | Procedimiento de purificacion de acidos nucleicos. |
| EP97200395A EP0819696A3 (en) | 1989-03-23 | 1990-03-22 | Process for isolating nucleic acid |
| DE0389063T DE389063T1 (de) | 1989-03-23 | 1990-03-22 | Verfahren zur Reinigung von Nukleinsäuren. |
| AU52153/90A AU641641B2 (en) | 1989-03-23 | 1990-03-22 | Process for isolating nucleic acid |
| EP90200678A EP0389063B2 (en) | 1989-03-23 | 1990-03-22 | Process for isolating nucleic acid |
| AT90200678T ATE156830T1 (de) | 1989-03-23 | 1990-03-22 | Verfahren zur reinigung von nukleinsäuren |
| DE69031237T DE69031237T3 (de) | 1989-03-23 | 1990-03-22 | Verfahren zur Reinigung von Nukleinsäuren |
| JP2075323A JP2680462B2 (ja) | 1989-03-23 | 1990-03-23 | 核酸の単離方法 |
| US07/728,007 US5234809A (en) | 1989-03-23 | 1991-07-01 | Process for isolating nucleic acid |
| GR960300019T GR960300019T1 (en) | 1989-03-23 | 1996-03-31 | Process for isolating nucleic acid |
| JP9117203A JPH1072485A (ja) | 1989-03-23 | 1997-05-07 | 核酸の単離方法 |
| GR970402992T GR3025351T3 (en) | 1989-03-23 | 1997-11-12 | Process for isolating nucleic acid |
| JP2000247680A JP2001078790A (ja) | 1989-03-23 | 2000-08-17 | 核酸の単離方法 |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| NL8900725A NL8900725A (nl) | 1989-03-23 | 1989-03-23 | Werkwijze en combinatie van middelen voor het isoleren van nucleinezuur. |
| NL8900725 | 1989-03-23 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| NL8900725A true NL8900725A (nl) | 1990-10-16 |
Family
ID=19854348
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| NL8900725A NL8900725A (nl) | 1989-03-23 | 1989-03-23 | Werkwijze en combinatie van middelen voor het isoleren van nucleinezuur. |
Country Status (12)
| Country | Link |
|---|---|
| EP (2) | EP0819696A3 (nl) |
| JP (3) | JP2680462B2 (nl) |
| KR (1) | KR0148693B1 (nl) |
| AT (1) | ATE156830T1 (nl) |
| AU (1) | AU641641B2 (nl) |
| CA (2) | CA2271603A1 (nl) |
| DE (2) | DE69031237T3 (nl) |
| DK (1) | DK0389063T4 (nl) |
| ES (1) | ES2085245T5 (nl) |
| GR (2) | GR960300019T1 (nl) |
| NL (1) | NL8900725A (nl) |
| ZA (1) | ZA902190B (nl) |
Families Citing this family (180)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU1978692A (en) * | 1991-04-12 | 1992-11-17 | Minnesota Mining And Manufacturing Company | Purification of nucleic acids using metal oxide supports |
| US5329000A (en) * | 1991-10-31 | 1994-07-12 | Becton, Dickinson And Company | Purification of DNA with silicon tetrahydrazide |
| DE4143639C2 (de) | 1991-12-02 | 2002-10-24 | Qiagen Gmbh | Verfahren zur Isolierung und Reinigung von Nukleinsäuren |
| DE4321904B4 (de) * | 1993-07-01 | 2013-05-16 | Qiagen Gmbh | Verfahren zur chromatographischen Reinigung und Trennung von Nucleinsäuregemischen |
| GB9314249D0 (en) * | 1993-07-09 | 1993-08-18 | Proofname Ltd | Purification method and apparatus |
| WO1995004140A1 (en) * | 1993-07-28 | 1995-02-09 | Akzo Nobel N.V. | Process for isolating nucleic acid from gram positive microorganisms |
| JP3451667B2 (ja) * | 1993-08-24 | 2003-09-29 | 東ソー株式会社 | 核酸抽出及び特定核酸配列の検出方法 |
| CA2170604C (en) * | 1993-08-30 | 2007-03-13 | Vikas V. Padhye | Nucleic acid purification compositions and methods |
| US6043032A (en) * | 1993-09-22 | 2000-03-28 | Tosoh Corporation | Method of extracting nucleic acids and method of detecting specified nucleic acid sequences |
| GB2282138B (en) * | 1993-09-28 | 1997-09-03 | Tosoh Corp | Method of extracting nucleic acids and method of detecting specified nucleic acid sequences |
| GB9323305D0 (en) * | 1993-11-11 | 1994-01-05 | Medinnova Sf | Isoaltion of nucleic acid |
| WO1995021849A1 (de) | 1994-02-11 | 1995-08-17 | Qiagen Gmbh | Verfahren zur trennung von doppelstrang/einzelstrangnukleinsäurestrukturen |
| ATE184013T1 (de) * | 1994-06-14 | 1999-09-15 | Invitek Gmbh | Universelles verfahren zur isolierung und reinigung von nukleinsäuren aus extrem geringen mengen sowie sehr stark verunreinigten unterschiedlichsten ausgangsmaterialien |
| DE4420732A1 (de) | 1994-06-15 | 1995-12-21 | Boehringer Mannheim Gmbh | Vorrichtung zur Behandlung von Nukleinsäuren aus einer Probe |
| DE4420900A1 (de) | 1994-06-15 | 1995-12-21 | Boehringer Mannheim Gmbh | Verfahren zur mehrmaligen Entnahme von Flüssigkeiten |
| JPH10504834A (ja) * | 1994-08-29 | 1998-05-12 | アクゾ・ノベル・エヌ・ベー | 核酸などの生物材料の単離に使用する装置 |
| GB9425138D0 (en) | 1994-12-12 | 1995-02-08 | Dynal As | Isolation of nucleic acid |
| NL9402122A (nl) * | 1994-12-14 | 1996-07-01 | Univ Nijmegen | Werkwijze voor het bereiden van aan kunststof gekoppelde niet-eiwitachtige macrobiomoleculen welke sterk negatief geladen zijn, aan kunststof gekoppelde negatief geladen niet-eiwitachtige macrobiomoleculen alsmede een microtiterplaat waarvan de putjes zijn bekleed met negatief geladen niet-eiwitachtige macrobiomoleculen. |
| US5576196A (en) * | 1995-01-13 | 1996-11-19 | Vical Incorporated | Process for reducing RNA concentration in a mixture of biological material using diatomaceous earth |
| DE19512368A1 (de) * | 1995-04-01 | 1996-10-02 | Boehringer Mannheim Gmbh | System zur Freisetzung und Isolierung von Nukleinsäuren |
| US6919175B1 (en) | 1995-04-01 | 2005-07-19 | Roche Diagnostics Gmbh | System for releasing and isolating nucleic acids |
| KR100463475B1 (ko) | 1995-06-08 | 2005-06-22 | 로셰 디아그노스틱스 게엠베하 | 자기성피그먼트 |
| DE19520398B4 (de) * | 1995-06-08 | 2009-04-16 | Roche Diagnostics Gmbh | Magnetisches Pigment |
| EP1260595B1 (en) * | 1995-07-07 | 2006-09-13 | Toyo Boseki Kabushiki Kaisha | Nucleic acid-bondable magnetic carrier and method for isolating nucleic acid using the same |
| JP2965131B2 (ja) * | 1995-07-07 | 1999-10-18 | 東洋紡績株式会社 | 核酸結合用磁性担体およびそれを用いる核酸単離方法 |
| DE19530132C2 (de) * | 1995-08-16 | 1998-07-16 | Max Planck Gesellschaft | Verfahren zur Reinigung, Stabilisierung oder Isolierung von Nukleinsäuren aus biologischen Materialien |
| US5783686A (en) * | 1995-09-15 | 1998-07-21 | Beckman Instruments, Inc. | Method for purifying nucleic acids from heterogenous mixtures |
| CA2245888C (en) * | 1996-02-14 | 2008-12-23 | Jaap Goudsmit | Isolation and amplification of nucleic acid materials |
| DE19607202A1 (de) * | 1996-02-26 | 1997-08-28 | Uwe Dr Michel | Reagenzienkit zur Präparation von Nukleinsäuren |
| NL1002781C1 (nl) * | 1996-04-03 | 1997-10-06 | Amsterdam Support Diagnostics | Isolatie en/of amplificatie van hepatitis-C-virus-(HCV) -nucleïnezuren uit monsters waarvan vermoed wordt dat zij HCV bevatten. |
| EP0814156B1 (en) * | 1996-06-18 | 2003-03-05 | The Institute Of Physical & Chemical Research | Method for the purification of DNA |
| US5990302A (en) * | 1996-07-12 | 1999-11-23 | Toyo Boseki Kabushiki Kaisha | Method for isolating ribonucleic acid |
| US5763185A (en) * | 1996-12-30 | 1998-06-09 | Becton Dickinson And Company | Method for reducing inhibitors of nucleic acid hybridization |
| US6210881B1 (en) | 1996-12-30 | 2001-04-03 | Becton, Dickinson And Company | Method for reducing inhibitors of nucleic acid hybridization |
| GB9709728D0 (en) | 1997-05-13 | 1997-07-02 | Dynal As | Single step method |
| EP0991456B1 (en) * | 1997-06-27 | 2003-09-03 | Life Technologies, Inc. | One step device and process for concentration and purification of biological molecules |
| US6881537B1 (en) | 1997-08-08 | 2005-04-19 | Biomerieux, B.V. | Nucleic acid sequences that can be used as primers and probes in the amplification and detection of all subtypes of HIV-1 |
| EP1027145A4 (en) | 1997-09-17 | 2004-08-25 | Gentra Systems Inc | APPARATUS AND METHODS FOR ISOLATING NUCLEIC ACID |
| JP4304348B2 (ja) * | 1997-09-22 | 2009-07-29 | 独立行政法人理化学研究所 | Dnaの単離方法 |
| DE19746874A1 (de) * | 1997-10-23 | 1999-04-29 | Qiagen Gmbh | Verfahren zur Isolierung und Reinigung von Nukleinsäuren an hydrophoben Oberflächen - insbesondere unter Verwendung hydrophober Membranen |
| JP4025399B2 (ja) * | 1997-10-28 | 2007-12-19 | 株式会社日立製作所 | 核酸の回収方法及び装置 |
| US6914137B2 (en) | 1997-12-06 | 2005-07-05 | Dna Research Innovations Limited | Isolation of nucleic acids |
| DE19858447A1 (de) * | 1997-12-18 | 1999-07-01 | Invitek Gmbh | Verfahren zur Isolierung von kurz- und langkettigen Nukleinsäuren |
| ZA99493B (en) * | 1998-01-30 | 1999-07-22 | Akzo Nobel Nv | Method for the isolation of nucleic acid. |
| EP2290099B1 (en) * | 1998-02-02 | 2012-10-10 | QIAGEN North American Holdings, Inc. | Processes for isolating, amplifying and characterizing DNA |
| WO1999039009A1 (en) * | 1998-02-02 | 1999-08-05 | Gentra Systems, Inc. | Processes for isolating, amplifying and characterizing dna |
| CA2319775C (en) * | 1998-02-02 | 2009-05-05 | Gentra Systems, Inc. | Compositions and methods for using a lysing matrix for isolating dna |
| JP2004500002A (ja) * | 1998-02-02 | 2004-01-08 | ジエントラ・システムズ・インコーポレーテツド | Dnaを単離するための溶出試薬、方法およびキット |
| JPH11266864A (ja) * | 1998-03-19 | 1999-10-05 | Hitachi Ltd | 核酸の精製方法および精製用装置 |
| DE19818485B4 (de) * | 1998-04-24 | 2005-03-24 | IBL Gesellschaft für Immunchemie und Immunbiologie mbH | Reaktionsgefäße, beschichtet mit einem cis-Diol-spezifischen Affinitätsmedium, sowie Verfahren zu deren Herstellung |
| DE19836559A1 (de) * | 1998-08-12 | 2000-03-23 | Antigen Gmbh | Gefäß zur Entnahme von Blut |
| WO2000015776A1 (en) * | 1998-09-10 | 2000-03-23 | Flinders Technologies Pty. Ltd. | Product and method for separation of a sample containing multiple sources of genetic material using a solid medium |
| US6958392B2 (en) | 1998-10-09 | 2005-10-25 | Whatman, Inc. | Methods for the isolation of nucleic acids and for quantitative DNA extraction and detection for leukocyte evaluation in blood products |
| US6492162B1 (en) | 1998-10-27 | 2002-12-10 | Hitachi, Ltd. | Apparatus for the recovery of nucleic acids |
| JP2000166556A (ja) * | 1998-12-10 | 2000-06-20 | Hitachi Ltd | 核酸の回収方法及び装置 |
| US7790865B1 (en) | 1999-02-02 | 2010-09-07 | Qiagen North American Holdings, Inc | Eluting reagents, methods and kits for isolating DNA |
| CA2270106C (en) * | 1999-04-23 | 2006-03-14 | Yousef Haj-Ahmad | Nucleic acid purification and process |
| EP1203240A2 (de) * | 1999-08-09 | 2002-05-08 | Bilatec Gesellschaft Zur Entwicklung Biotechnologischer Systeme MBH | Labor-roboter und verfahren und reagenzienkit zur isolierung von nukleinsäuren |
| DE19943374A1 (de) * | 1999-09-10 | 2001-03-29 | Max Planck Gesellschaft | Verfahren zum Anbinden von Nukleinsäuren an eine Festphase |
| US6383783B1 (en) | 1999-09-21 | 2002-05-07 | 3M Innovative Properties Company | Nucleic acid isolation by adhering to hydrophobic solid phase and removing with nonionic surfactant |
| DE19946597A1 (de) * | 1999-09-29 | 2001-04-12 | Nigu Chemie Gmbh | Stabilisiertes Guanidinlthiocyanat und dessen Verwendung |
| PL202358B1 (pl) | 1999-11-17 | 2009-06-30 | Roche Diagnostics Gmbh | Sposób wytwarzania kompozycji magnetycznych cząstek szklanych, magnetyczne cząstki szklane, kompozycja magnetycznych cząstek szklanych, zawiesina z magnetycznymi cząstkami szklanymi, probówka z kompozycją lub zawiesiną magnetycznych cząstek szklanych, zestaw części z tą probówką, zastosowanie kompozycji, zawiesiny i zestawu zawierających magnetyczne cząstki szklane, sposób izolowania materiału biologicznego |
| GB0001450D0 (en) | 2000-01-21 | 2000-03-08 | Genpoint As | Cell isolation method |
| DE10004927C2 (de) * | 2000-02-04 | 2003-02-06 | Qiagen Gmbh | Nukleinsäure-Isolierung aus Stuhlproben und anderen biologischen Materialien, die reich an Inhibitoren sind |
| DE10006662A1 (de) | 2000-02-15 | 2001-08-23 | Antigen Produktions Gmbh | Gefäß zur Nukleinsäureanalytik |
| US6815215B2 (en) | 2000-02-28 | 2004-11-09 | Hitachi, Ltd. | Method of recovering a plurality of nucleic acids by an identical stationary phase and an apparatus thereof |
| EP1266385B1 (en) | 2000-03-24 | 2008-12-31 | QIAGEN GmbH | Porous ferro- or ferrimagnetic glass particles for isolating molecules |
| GB0009771D0 (en) * | 2000-04-19 | 2000-06-07 | Angiomed Ag | Method for linking nucleic acids |
| GB0013658D0 (en) | 2000-06-05 | 2000-07-26 | Dynal Asa | Nucleic acid isolation |
| WO2002078847A1 (fr) | 2001-03-28 | 2002-10-10 | Hitachi, Ltd. | Instrument et procede permettant de recuperer de l'acide nucleique |
| US6818762B2 (en) * | 2001-05-25 | 2004-11-16 | Maine Molecular Quality Controls, Inc. | Compositions and methods relating to nucleic acid reference standards |
| JP2002191351A (ja) * | 2001-10-19 | 2002-07-09 | Hitachi Ltd | 核酸の精製用装置および核酸捕捉用チップ |
| DE60234464D1 (de) | 2001-11-28 | 2009-12-31 | Applied Biosystems Llc | Zusammensetzungen und Verfahren zur selektiven Nukleinsäureisolierung |
| CN100422342C (zh) | 2002-01-07 | 2008-10-01 | 诺奇普公司 | 检测人乳头瘤病毒mRNA的方法 |
| WO2003057910A2 (en) | 2002-01-08 | 2003-07-17 | Roche Diagnostics Gmbh | Use of silica material in an amplification reaction |
| EP1468116A2 (en) | 2002-01-16 | 2004-10-20 | Dynal Biotech ASA | Method for isolating nucleic acids and protein from a single sample |
| GB0205455D0 (en) | 2002-03-07 | 2002-04-24 | Molecular Sensing Plc | Nucleic acid probes, their synthesis and use |
| DE10231659B4 (de) * | 2002-07-12 | 2006-01-19 | Preanalytix Gmbh | Zusammensetzung zum Binden von Nukleinsäure an eine Festphase |
| US9394332B2 (en) | 2002-08-29 | 2016-07-19 | Epigenomics Ag | Method for bisulfite treatment |
| WO2004079333A2 (en) * | 2003-01-15 | 2004-09-16 | Ic & G Co., Ltd. | Method and kit for extracting rna from sputum |
| ATE373673T1 (de) | 2003-01-29 | 2007-10-15 | Hoffmann La Roche | Verbessertes verfahren zur behandlung durch bisulfit |
| US7601491B2 (en) | 2003-02-06 | 2009-10-13 | Becton, Dickinson And Company | Pretreatment method for extraction of nucleic acid from biological samples and kits therefor |
| CA2518933C (en) | 2003-03-19 | 2012-04-03 | Hamamatsu Foundation For Science And Technology Promotion | Method of detecting colon cancer marker |
| WO2005007852A2 (en) * | 2003-07-09 | 2005-01-27 | Genvault Corporation | Room temperature elution of nucleic acids |
| WO2005008209A2 (ja) * | 2003-07-16 | 2005-01-27 | Toyo Boseki | 生体成分分離用デバイス、およびそれを用いた生体成分の分離方法 |
| ATE554166T1 (de) † | 2003-07-25 | 2012-05-15 | Life Technologies Corp | Verfahren und zusammensetzungen zur herstellung von rna aus einer fixierten probe |
| US20050059024A1 (en) | 2003-07-25 | 2005-03-17 | Ambion, Inc. | Methods and compositions for isolating small RNA molecules |
| GB0319671D0 (en) * | 2003-08-21 | 2003-09-24 | Secr Defence | Apparatus for processing a fluid sample |
| US7501240B2 (en) | 2003-12-02 | 2009-03-10 | Roche Molecular Systems, Inc. | Method for bisulfite treatment |
| DE10358137A1 (de) * | 2003-12-12 | 2005-07-07 | Merck Patent Gmbh | Verfahren und Kit zur Isolierung von RNA |
| US20050130177A1 (en) | 2003-12-12 | 2005-06-16 | 3M Innovative Properties Company | Variable valve apparatus and methods |
| WO2005064010A1 (de) * | 2003-12-19 | 2005-07-14 | Preanalytix Gmbh | Zusammensetzung zum binden von nukleinsäure an eine festphase |
| US7727710B2 (en) | 2003-12-24 | 2010-06-01 | 3M Innovative Properties Company | Materials, methods, and kits for reducing nonspecific binding of molecules to a surface |
| US7939249B2 (en) | 2003-12-24 | 2011-05-10 | 3M Innovative Properties Company | Methods for nucleic acid isolation and kits using a microfluidic device and concentration step |
| US8586350B2 (en) | 2004-02-12 | 2013-11-19 | Gl Sciences Incorporated | Mechanism of separating and purifying DNA and the like |
| AU2005200670B2 (en) | 2004-02-20 | 2007-05-03 | F. Hoffmann-La Roche Ag | Adsorption of nucleic acids to a solid phase |
| JP4539125B2 (ja) * | 2004-03-08 | 2010-09-08 | ブラザー工業株式会社 | 核酸単離部材 |
| US20050208501A1 (en) * | 2004-03-16 | 2005-09-22 | Ambion, Inc. | Process and reagents for extraction of RNA from fractionated blood leukocytes |
| US7897378B2 (en) | 2004-03-18 | 2011-03-01 | Roche Molecular Systems, Inc. | Method and device for purifying nucleic acids |
| JP4080462B2 (ja) * | 2004-07-09 | 2008-04-23 | 株式会社日立製作所 | 核酸の回収方法 |
| DE102004034433A1 (de) * | 2004-07-15 | 2006-02-02 | Qiagen Gmbh | Verfahren zur Reinigung und Isolierung von Nukleinsäuren unter Verwendung kationischer Detergentien |
| EP1632578A1 (en) | 2004-09-03 | 2006-03-08 | Roche Diagnostics GmbH | DNA decontamination method |
| JP2006166711A (ja) * | 2004-12-13 | 2006-06-29 | Okayama Univ | 糞便由来遺伝子の簡便増幅方法 |
| JP4764966B2 (ja) * | 2005-03-30 | 2011-09-07 | 独立行政法人科学技術振興機構 | メッセンジャーrnaの分離方法 |
| DE102005040259A1 (de) | 2005-08-24 | 2007-03-01 | Qiagen Gmbh | Verfahren zur Gewinnung von Nukleinsäuren aus Blut |
| JP4699868B2 (ja) | 2005-11-04 | 2011-06-15 | 株式会社日立ハイテクノロジーズ | 核酸精製方法及び核酸精製器具 |
| US7981606B2 (en) | 2005-12-21 | 2011-07-19 | Roche Molecular Systems, Inc. | Control for nucleic acid testing |
| US20100178510A1 (en) | 2006-06-20 | 2010-07-15 | Hitachi Metals, Ltd. | Fine metal particles and biomaterial-extracting magnetic beads, and their production methods |
| JP2008005781A (ja) * | 2006-06-29 | 2008-01-17 | Olympus Corp | 試料処理方法 |
| US20080113357A1 (en) * | 2006-06-29 | 2008-05-15 | Millipore Corporation | Filter device for the isolation of a nucleic acid |
| US10131935B2 (en) * | 2006-07-11 | 2018-11-20 | Aj Innuscreen Gmbh | Method for parallel isolation of viral nucleic acids |
| EP1911844A1 (en) | 2006-10-10 | 2008-04-16 | Qiagen GmbH | Methods and kit for isolating nucleic acids |
| EP1932913B1 (en) | 2006-12-11 | 2013-01-16 | Roche Diagnostics GmbH | Nucleic acid isolation using polidocanol and derivatives |
| JP5354894B2 (ja) | 2006-12-11 | 2013-11-27 | エフ.ホフマン−ラ ロシュ アーゲー | ポリドカノールおよび誘導体を用いた核酸単離 |
| CN101627065B (zh) * | 2006-12-21 | 2012-05-23 | 茵维特罗根戴纳股份公司 | 颗粒和其在分离核酸的方法或分离磷蛋白的方法中的应用 |
| DE102007009347B4 (de) | 2007-02-27 | 2009-11-26 | Agowa Gmbh | Verfahren zur Isolierung von Nukleinsäuren |
| DE102007016707A1 (de) | 2007-04-04 | 2008-10-09 | Qiagen Gmbh | Verfahren zur Aufreinigung von Biomolekülen |
| CA2629586C (en) * | 2007-04-20 | 2016-05-24 | F.Hoffmann-La Roche Ag | Adsorption of nucleic acids to solid phases under low-salt conditions |
| CA2629589C (en) * | 2007-04-20 | 2016-03-29 | F.Hoffmann-La Roche Ag | Isolation and purification of nucleic acid molecules with a solid phase |
| DE102007035250A1 (de) * | 2007-07-27 | 2009-01-29 | Qiagen Gmbh | Verfahren zum Abtrennen von nicht-proteinhaltigen Biomolekülen, insbesondere Nukleinsäuren aus proteinhaltigen Proben |
| EP2036988A1 (en) | 2007-09-12 | 2009-03-18 | Siemens Healthcare Diagnostics GmbH | A method for predicting the response of a tumor in a patient suffering from or at risk of developing recurrent gynecologic cancer towards a chemotherapeutic agent |
| JP4097687B2 (ja) * | 2007-09-21 | 2008-06-11 | 株式会社日立製作所 | 核酸の回収方法 |
| EP2065399A1 (en) | 2007-11-30 | 2009-06-03 | Siemens Healthcare Diagnostics GmbH | The present invention relates to methods for prediction of the therapeutic success of breast cancer therapy |
| ATE468917T1 (de) | 2007-10-31 | 2010-06-15 | Hoffmann La Roche | Verfahren und vorrichtung zur reinigung von nukleinsäuren |
| EP2065474A1 (en) | 2007-11-28 | 2009-06-03 | Siemens Healthcare Diagnostics GmbH | A method to assess prognosis and to predict therapeutic response to endocrine treatment |
| WO2009068423A2 (en) | 2007-11-30 | 2009-06-04 | Siemens Healthcare Diagnostics Gmbh | Method for predicting therapy responsiveness in basal like tumors |
| EP2065475A1 (en) | 2007-11-30 | 2009-06-03 | Siemens Healthcare Diagnostics GmbH | Method for therapy prediction in tumors having irregularities in the expression of at least one VEGF ligand and/or at least one ErbB-receptor |
| EP2071034A1 (en) | 2007-12-12 | 2009-06-17 | bioMérieux | Method for treating a solution in order to destroy any ribonucleic acid after amplification |
| DE102008010692A1 (de) | 2008-02-22 | 2009-08-27 | Qiagen Gmbh | Neue Matrices, Verfahren zu ihrer Herstellung und ihre Verwendung in Verfahren zur Isolierung von Biomolekülen |
| DE102008010693A1 (de) | 2008-02-22 | 2009-08-27 | Qiagen Gmbh | Neue Matrixmaterialien, Verfahren zu ihrer Herstellung und ihre Verwendung in Verfahren zur Isolierung von Biomolekülen |
| EP2128169A1 (de) | 2008-05-30 | 2009-12-02 | Qiagen GmbH | Verfahren zur Isolierung von kurzkettigen Nukleinsäuren |
| DE102008029356A1 (de) | 2008-06-20 | 2009-12-24 | Siemens Healthcare Diagnostics Gmbh | Verfahren zur Aufreinigung von Nukleinsäuren, insbesondere aus fixiertem Gewebe |
| US8158405B2 (en) | 2008-06-30 | 2012-04-17 | General Electric Company | Process for concentrating and processing fluid samples |
| US8546127B2 (en) | 2008-06-30 | 2013-10-01 | General Electric Company | Bacteria/RNA extraction device |
| WO2010012464A1 (en) | 2008-08-01 | 2010-02-04 | Roche Diagnostics Gmbh | Improved lysis and reverse transcription for mrna quantification |
| EP2157181A1 (de) | 2008-08-13 | 2010-02-24 | AGOWA Gesellschaft für molekularbiologische Technologie mbH | Verfahren zur Isolation von Nukleinsäuren und Testkit |
| DE102008047790A1 (de) | 2008-09-17 | 2010-04-15 | Qiagen Gmbh | Verfahren zur Normierung des Gehalts von Biomolekülen in einer Probe |
| CA2682439A1 (en) | 2008-10-17 | 2010-04-17 | F. Hoffmann-La Roche Ag | Cell monitoring and molecular analysis |
| DE102008061714A1 (de) | 2008-12-12 | 2010-06-17 | Siemens Healthcare Diagnostics Inc., Deerfield | Verfahren zur Aufreinigung von Nukleinsäuren, inbesondere aus fixiertem Gewebe |
| FR2940805B1 (fr) | 2009-01-05 | 2015-10-16 | Biomerieux Sa | Procede d'amplification et/ou de detection d'acides nucleiques, kits et utilisations de ce procede |
| KR20130069866A (ko) | 2009-01-16 | 2013-06-26 | 아크레이 가부시키가이샤 | 핵산 시료의 제조 방법, 및, 그것을 사용한 핵산 증폭물의 제조 방법 |
| DE102009022513A1 (de) | 2009-05-25 | 2010-12-02 | Qiagen Gmbh | Verfahren zum Schutz von Membranen |
| MX2012001236A (es) * | 2009-08-04 | 2012-03-16 | Du Pont | Proceso y dispositivo para recolectar acidos nucleicos de microorganismos de una muestra en particulas. |
| FR2959312B1 (fr) | 2010-04-23 | 2023-01-20 | Biomerieux Sa | Dispositif de preparation et/ou de traitement d'un echantillon biologique |
| JP5454338B2 (ja) | 2010-04-28 | 2014-03-26 | 株式会社島津製作所 | 液滴操作によるリアルタイム核酸増幅法 |
| CN102276937B (zh) * | 2010-06-12 | 2013-06-05 | 中国石油化工股份有限公司 | 一种抗菌聚苯乙烯组合物及其制备方法 |
| GB201010237D0 (en) | 2010-06-18 | 2010-07-21 | Lgc Ltd | Methods and apparatuses |
| WO2012013733A1 (en) | 2010-07-29 | 2012-02-02 | F. Hoffmann - La Roche Ag | Generic sample preparation |
| DE102010043015B4 (de) * | 2010-10-27 | 2019-12-19 | Robert Bosch Gmbh | Verfahren zur Konzentration von Probenbestandteilen und Amplifikation von Nukleinsäuren |
| WO2012054975A1 (en) | 2010-10-28 | 2012-05-03 | Clinical Genomics Pty. Ltd. | Method of microvesicle enrichment |
| JP5455878B2 (ja) | 2010-11-30 | 2014-03-26 | シスメックス株式会社 | 被検物質の電気化学的検出方法 |
| JP5578241B2 (ja) | 2010-12-21 | 2014-08-27 | 株式会社島津製作所 | 管内で対象成分を操作するためのデバイス及び方法 |
| KR101193765B1 (ko) * | 2011-05-16 | 2012-10-24 | (주)나노헬릭스 | 초고속 핵산의 정제방법 |
| EP2546199A1 (en) | 2011-07-14 | 2013-01-16 | Université Catholique De Louvain | Solid iron oxide support for isolation of microorganisms |
| JP5807542B2 (ja) | 2011-12-22 | 2015-11-10 | 株式会社島津製作所 | 対象成分を操作するためのチップデバイス及びそれを用いた方法 |
| CN104350152B (zh) * | 2012-06-01 | 2017-08-11 | 欧米伽生物技术公司 | 选择性核酸片段回收 |
| DE102012012523B4 (de) | 2012-06-26 | 2015-02-12 | Magnamedics Gmbh | Reinigung von Nukleinsäuren |
| JP6024266B2 (ja) * | 2012-08-01 | 2016-11-16 | セイコーエプソン株式会社 | Dnaの抽出方法 |
| JP6093530B2 (ja) * | 2012-09-24 | 2017-03-08 | 東芝メディカルシステムズ株式会社 | 乳中の微生物を濃縮および乳中の微生物の核酸を回収する方法 |
| JP6255034B2 (ja) | 2012-12-11 | 2017-12-27 | キアゲン ゲーエムベーハー | シリカ粒子の調製 |
| EP2954054B1 (en) | 2013-02-08 | 2018-12-05 | Qiagen GmbH | Method for separating dna by size |
| AU2013202805B2 (en) | 2013-03-14 | 2015-07-16 | Gen-Probe Incorporated | System and method for extending the capabilities of a diagnostic analyzer |
| CN105120986B (zh) | 2013-03-15 | 2019-03-12 | 雅培分子公司 | 用于核酸纯化的一步程序 |
| CN105358688B (zh) | 2013-07-03 | 2019-01-18 | 株式会社岛津制作所 | 粒子操作方法以及粒子操作器件 |
| EP3124608B1 (en) * | 2014-03-26 | 2019-09-18 | Universal Bio Research Co., Ltd. | Method and reagent for extracting nucleic acid |
| EA201691696A1 (ru) | 2014-04-25 | 2017-03-31 | Шир Хьюман Дженетик Терапис, Инк. | Способы очистки матричной рнк |
| EP3174970A1 (en) | 2014-07-30 | 2017-06-07 | F. Hoffmann-La Roche AG | Automated system for processing particles |
| JP6437250B2 (ja) | 2014-09-03 | 2018-12-12 | 株式会社ミズホメディー | 前処理方法及びそれに用いられる核酸抽出キット |
| WO2016193490A1 (en) | 2015-06-05 | 2016-12-08 | Qiagen Gmbh | Method for separating dna by size |
| EP4186980A1 (en) | 2015-06-09 | 2023-05-31 | Biocartis NV | Automatable method for nucleic acid isolation |
| CN113122535A (zh) | 2015-09-10 | 2021-07-16 | 株式会社钟化 | 从含有核酸的样品中分离核酸的方法及用于该方法的样品处理试剂 |
| US11427815B2 (en) | 2015-12-28 | 2022-08-30 | Koninklijke Philips N.V. | Nucleic acid purification system using a single wash and elution buffer solution |
| TWI694146B (zh) * | 2016-02-02 | 2020-05-21 | 日商美之賀美蒂股份有限公司 | 前處理方法及用於其之核酸萃取套組 |
| EP3205722B1 (de) * | 2016-02-11 | 2018-08-01 | Sarstedt AG & Co. KG | Vorrichtung und verfahren zur isolierung von nukleinsäuren aus vollblut |
| ES2900272T3 (es) * | 2016-04-22 | 2022-03-16 | BioNTech SE | Métodos para proporcionar ARN monocatenario |
| JP6979797B2 (ja) * | 2017-05-31 | 2021-12-15 | シスメックス株式会社 | 固液分離方法、固液分離装置およびそれに用いるピペットチップ、粒子およびキット |
| CN108130325A (zh) * | 2018-02-02 | 2018-06-08 | 苏州优卡新材料科技有限公司 | 一种核糖核酸提取用无机材料滤芯的高效纯化柱 |
| JP2020024202A (ja) * | 2018-08-06 | 2020-02-13 | 積水化学工業株式会社 | 分析用具及び洗浄方法 |
| WO2020104390A2 (en) | 2018-11-19 | 2020-05-28 | Biocartis Nv | Enhanced detection of low-copy-number nucleic acids in an integrated workflow |
| US20230399633A1 (en) | 2019-08-08 | 2023-12-14 | Biocartis Nv | Novel Nucleic Acid Purification Chemistry |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS59227744A (ja) * | 1983-06-08 | 1984-12-21 | Rikaken Kk | Dna回収用ガラス粉粒物 |
| US4900677A (en) * | 1986-09-26 | 1990-02-13 | E. I. Du Pont De Nemours And Company | Process for rapid isolation of high molecular weight DNA |
-
1989
- 1989-03-23 NL NL8900725A patent/NL8900725A/nl not_active Application Discontinuation
-
1990
- 1990-03-21 ZA ZA902190A patent/ZA902190B/xx unknown
- 1990-03-22 DK DK90200678T patent/DK0389063T4/da active
- 1990-03-22 EP EP97200395A patent/EP0819696A3/en not_active Withdrawn
- 1990-03-22 AU AU52153/90A patent/AU641641B2/en not_active Expired
- 1990-03-22 DE DE69031237T patent/DE69031237T3/de not_active Expired - Lifetime
- 1990-03-22 CA CA002271603A patent/CA2271603A1/en not_active Abandoned
- 1990-03-22 DE DE0389063T patent/DE389063T1/de active Pending
- 1990-03-22 CA CA002012777A patent/CA2012777C/en not_active Expired - Lifetime
- 1990-03-22 ES ES90200678T patent/ES2085245T5/es not_active Expired - Lifetime
- 1990-03-22 KR KR1019900004012A patent/KR0148693B1/ko not_active IP Right Cessation
- 1990-03-22 EP EP90200678A patent/EP0389063B2/en not_active Expired - Lifetime
- 1990-03-22 AT AT90200678T patent/ATE156830T1/de not_active IP Right Cessation
- 1990-03-23 JP JP2075323A patent/JP2680462B2/ja not_active Expired - Lifetime
-
1996
- 1996-03-31 GR GR960300019T patent/GR960300019T1/el unknown
-
1997
- 1997-05-07 JP JP9117203A patent/JPH1072485A/ja active Pending
- 1997-11-12 GR GR970402992T patent/GR3025351T3/el unknown
-
2000
- 2000-08-17 JP JP2000247680A patent/JP2001078790A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| ATE156830T1 (de) | 1997-08-15 |
| GR960300019T1 (en) | 1996-03-31 |
| JP2001078790A (ja) | 2001-03-27 |
| ES2085245T3 (es) | 1997-11-01 |
| DE389063T1 (de) | 1996-10-10 |
| DK0389063T3 (da) | 1998-03-30 |
| ZA902190B (en) | 1991-12-24 |
| ES2085245T5 (es) | 2007-06-01 |
| KR900014594A (ko) | 1990-10-24 |
| GR3025351T3 (en) | 1998-02-27 |
| AU641641B2 (en) | 1993-09-30 |
| DK0389063T4 (da) | 2007-02-19 |
| KR0148693B1 (ko) | 1998-08-01 |
| EP0389063B1 (en) | 1997-08-13 |
| EP0389063A2 (en) | 1990-09-26 |
| JP2680462B2 (ja) | 1997-11-19 |
| DE69031237D1 (de) | 1997-09-18 |
| CA2271603A1 (en) | 1990-09-23 |
| CA2012777C (en) | 1999-08-31 |
| EP0389063B2 (en) | 2006-10-25 |
| AU5215390A (en) | 1990-09-27 |
| JPH1072485A (ja) | 1998-03-17 |
| CA2012777A1 (en) | 1990-09-23 |
| EP0819696A2 (en) | 1998-01-21 |
| DE69031237T2 (de) | 1998-01-02 |
| JPH02289596A (ja) | 1990-11-29 |
| EP0819696A3 (en) | 1998-07-15 |
| EP0389063A3 (en) | 1992-04-15 |
| DE69031237T3 (de) | 2007-06-06 |
| ES2085245T1 (es) | 1996-06-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| NL8900725A (nl) | Werkwijze en combinatie van middelen voor het isoleren van nucleinezuur. | |
| US5234809A (en) | Process for isolating nucleic acid | |
| JP7408229B2 (ja) | ポリヌクレオチド捕捉材料およびその使用方法 | |
| US10087439B1 (en) | Rapid methods for the extraction of nucleic acids from biological samples | |
| JP3787354B2 (ja) | 核酸の単離方法 | |
| JP4175670B2 (ja) | 固体相核酸の単離 | |
| JP3943601B2 (ja) | アルカリプロテアーゼを用いる核酸の単離方法 | |
| WO1995004140A1 (en) | Process for isolating nucleic acid from gram positive microorganisms | |
| JPH0713077B2 (ja) | 長鎖核酸を分離する方法 | |
| US8202693B2 (en) | Method of isolation of nucleic acids | |
| JP2008529516A (ja) | エチレングリコール多量体の使用を含む核酸の単離方法 | |
| AU4095400A (en) | Nucleic acid purification and process | |
| JP2008510456A (ja) | 多官能基コート化固相担体を用いる核酸の単離方法 | |
| JP2002543980A (ja) | 混合床固相及び核酸の単離におけるその使用 | |
| JP2006517225A (ja) | 核酸抽出のための生物学的試料の化学処理および該処理用のキット | |
| JPH09327291A (ja) | Rnaの抽出精製方法 | |
| JP2001516763A (ja) | 迅速rna単離方法 | |
| US20170121705A1 (en) | Methods and kits for nucleic acid isolation | |
| JP2003529314A (ja) | Dnaを単離し、増幅し、そして特性化するための方法 | |
| Thatcher | Nucleic acid isolation | |
| US20190071665A1 (en) | Methods for co-isolation of nucelic acids and proteins |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A1B | A search report has been drawn up | ||
| BV | The patent application has lapsed |