KR20190057305A - 자궁내막증에 대한 바이오마커로서의 microRNAs - Google Patents
자궁내막증에 대한 바이오마커로서의 microRNAs Download PDFInfo
- Publication number
- KR20190057305A KR20190057305A KR1020197009115A KR20197009115A KR20190057305A KR 20190057305 A KR20190057305 A KR 20190057305A KR 1020197009115 A KR1020197009115 A KR 1020197009115A KR 20197009115 A KR20197009115 A KR 20197009115A KR 20190057305 A KR20190057305 A KR 20190057305A
- Authority
- KR
- South Korea
- Prior art keywords
- mir
- mirna
- endometriosis
- subject
- sample
- Prior art date
Links
- 239000002679 microRNA Substances 0.000 title claims abstract description 478
- 201000009273 Endometriosis Diseases 0.000 title claims abstract description 421
- 108700011259 MicroRNAs Proteins 0.000 title claims description 131
- 239000000090 biomarker Substances 0.000 title description 100
- 108091070501 miRNA Proteins 0.000 claims abstract description 362
- 238000000034 method Methods 0.000 claims abstract description 321
- 230000014509 gene expression Effects 0.000 claims abstract description 89
- 239000000523 sample Substances 0.000 claims description 206
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 111
- 150000007523 nucleic acids Chemical class 0.000 claims description 109
- 108091065175 miR-3613 stem-loop Proteins 0.000 claims description 104
- 102000039446 nucleic acids Human genes 0.000 claims description 93
- 238000011282 treatment Methods 0.000 claims description 93
- 108020004707 nucleic acids Proteins 0.000 claims description 92
- 108091084619 miR-125b-1 stem-loop Proteins 0.000 claims description 89
- 108091063409 miR-125b-2 stem-loop Proteins 0.000 claims description 89
- 108091050014 miR-125b-3 stem-loop Proteins 0.000 claims description 88
- 201000010099 disease Diseases 0.000 claims description 86
- 108091055145 miR-342 stem-loop Proteins 0.000 claims description 85
- 239000012472 biological sample Substances 0.000 claims description 60
- 108091049400 miR-6755 stem-loop Proteins 0.000 claims description 52
- 210000002966 serum Anatomy 0.000 claims description 51
- 241000282414 Homo sapiens Species 0.000 claims description 50
- 108091046841 MiR-150 Proteins 0.000 claims description 50
- 239000002299 complementary DNA Substances 0.000 claims description 46
- 108091090860 miR-150 stem-loop Proteins 0.000 claims description 46
- 108091038400 miR-553 stem-loop Proteins 0.000 claims description 44
- 230000001105 regulatory effect Effects 0.000 claims description 43
- 108091064282 miR-125 stem-loop Proteins 0.000 claims description 42
- 108091037066 miR-125-1 stem-loop Proteins 0.000 claims description 42
- 108091062107 miR-125-2 stem-loop Proteins 0.000 claims description 42
- 108091079767 miR-125-3 stem-loop Proteins 0.000 claims description 42
- -1 miR-451 Proteins 0.000 claims description 41
- 210000003296 saliva Anatomy 0.000 claims description 41
- 108091062221 miR-18a stem-loop Proteins 0.000 claims description 39
- 238000003752 polymerase chain reaction Methods 0.000 claims description 37
- 108091007423 let-7b Proteins 0.000 claims description 36
- 108091038080 miR-18a-1 stem-loop Proteins 0.000 claims description 36
- 108091032770 miR-451 stem-loop Proteins 0.000 claims description 36
- 108091030646 miR-451a stem-loop Proteins 0.000 claims description 36
- 108091028684 Mir-145 Proteins 0.000 claims description 35
- 210000001124 body fluid Anatomy 0.000 claims description 35
- 239000010839 body fluid Substances 0.000 claims description 34
- 238000006243 chemical reaction Methods 0.000 claims description 33
- 108091073532 miR-143 stem-loop Proteins 0.000 claims description 33
- 238000012163 sequencing technique Methods 0.000 claims description 33
- 108091055732 miR-4668 stem-loop Proteins 0.000 claims description 31
- 230000003321 amplification Effects 0.000 claims description 30
- 238000003199 nucleic acid amplification method Methods 0.000 claims description 30
- 210000002381 plasma Anatomy 0.000 claims description 29
- 230000035945 sensitivity Effects 0.000 claims description 28
- 108091028066 Mir-126 Proteins 0.000 claims description 26
- 108091027766 Mir-143 Proteins 0.000 claims description 26
- 108091053592 miR-145-1 stem-loop Proteins 0.000 claims description 26
- 108091056559 miR-145-2 stem-loop Proteins 0.000 claims description 26
- 238000003556 assay Methods 0.000 claims description 25
- 210000004369 blood Anatomy 0.000 claims description 25
- 239000008280 blood Substances 0.000 claims description 25
- 150000001875 compounds Chemical class 0.000 claims description 25
- 108091043157 miR-500a stem-loop Proteins 0.000 claims description 25
- 210000002700 urine Anatomy 0.000 claims description 25
- 108091087529 miR-500 stem-loop Proteins 0.000 claims description 24
- 108091036496 miR-500-2 stem-loop Proteins 0.000 claims description 24
- 108091026807 MiR-214 Proteins 0.000 claims description 22
- 208000024891 symptom Diseases 0.000 claims description 19
- 206010036790 Productive cough Diseases 0.000 claims description 17
- 210000003802 sputum Anatomy 0.000 claims description 17
- 208000024794 sputum Diseases 0.000 claims description 17
- 238000012544 monitoring process Methods 0.000 claims description 16
- 210000001175 cerebrospinal fluid Anatomy 0.000 claims description 15
- 239000003814 drug Substances 0.000 claims description 15
- 239000012530 fluid Substances 0.000 claims description 15
- 210000001179 synovial fluid Anatomy 0.000 claims description 15
- 210000002751 lymph Anatomy 0.000 claims description 14
- 108091027698 miR-18-1 stem-loop Proteins 0.000 claims description 14
- 108091090961 miR-18-2 stem-loop Proteins 0.000 claims description 14
- 210000003097 mucus Anatomy 0.000 claims description 14
- 238000003753 real-time PCR Methods 0.000 claims description 14
- 239000003153 chemical reaction reagent Substances 0.000 claims description 13
- 210000003608 fece Anatomy 0.000 claims description 13
- 230000002829 reductive effect Effects 0.000 claims description 13
- 238000010839 reverse transcription Methods 0.000 claims description 13
- 238000002493 microarray Methods 0.000 claims description 12
- 230000027455 binding Effects 0.000 claims description 11
- 230000008859 change Effects 0.000 claims description 11
- 238000001794 hormone therapy Methods 0.000 claims description 11
- 239000000579 Gonadotropin-Releasing Hormone Substances 0.000 claims description 10
- 101000857870 Squalus acanthias Gonadoliberin Proteins 0.000 claims description 10
- 239000000556 agonist Substances 0.000 claims description 10
- XLXSAKCOAKORKW-AQJXLSMYSA-N gonadorelin Chemical group C([C@@H](C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)NCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 XLXSAKCOAKORKW-AQJXLSMYSA-N 0.000 claims description 10
- 229940035638 gonadotropin-releasing hormone Drugs 0.000 claims description 10
- 108091023663 let-7 stem-loop Proteins 0.000 claims description 10
- 108091063478 let-7-1 stem-loop Proteins 0.000 claims description 10
- 108091049777 let-7-2 stem-loop Proteins 0.000 claims description 10
- 108091091807 let-7a stem-loop Proteins 0.000 claims description 10
- 108091057746 let-7a-4 stem-loop Proteins 0.000 claims description 10
- 108091028376 let-7a-5 stem-loop Proteins 0.000 claims description 10
- 108091024393 let-7a-6 stem-loop Proteins 0.000 claims description 10
- 108091091174 let-7a-7 stem-loop Proteins 0.000 claims description 10
- 229940079593 drug Drugs 0.000 claims description 8
- 230000002441 reversible effect Effects 0.000 claims description 8
- 108700028369 Alleles Proteins 0.000 claims description 7
- 238000012165 high-throughput sequencing Methods 0.000 claims description 7
- 208000002193 Pain Diseases 0.000 claims description 6
- 239000003433 contraceptive agent Substances 0.000 claims description 6
- 238000009830 intercalation Methods 0.000 claims description 6
- 108091091360 miR-125b stem-loop Proteins 0.000 claims description 6
- 230000036407 pain Effects 0.000 claims description 6
- 239000002474 gonadorelin antagonist Substances 0.000 claims description 5
- 108091058688 miR-141 stem-loop Proteins 0.000 claims description 5
- 108091089775 miR-200b stem-loop Proteins 0.000 claims description 5
- 108091059199 miR-200a stem-loop Proteins 0.000 claims description 4
- 108091090583 miR-34c stem-loop Proteins 0.000 claims description 4
- 108091082133 miR-34c-1 stem-loop Proteins 0.000 claims description 4
- 239000013642 negative control Substances 0.000 claims description 4
- 239000013641 positive control Substances 0.000 claims description 4
- 230000004044 response Effects 0.000 claims description 4
- 229910052500 inorganic mineral Inorganic materials 0.000 claims description 3
- 108091037327 miR-449 stem-loop Proteins 0.000 claims description 3
- 108091040525 miR-449a stem-loop Proteins 0.000 claims description 3
- 239000011707 mineral Substances 0.000 claims description 3
- 239000005557 antagonist Substances 0.000 claims description 2
- 229940124558 contraceptive agent Drugs 0.000 claims description 2
- 108091041042 miR-18 stem-loop Proteins 0.000 claims description 2
- 108091056935 miR-145b stem-loop Proteins 0.000 claims 2
- 108091029500 miR-183 stem-loop Proteins 0.000 claims 2
- 230000003054 hormonal effect Effects 0.000 claims 1
- 108091043994 let-7g stem-loop Proteins 0.000 claims 1
- 108091053972 let-7g-1 stem-loop Proteins 0.000 claims 1
- 108091024867 let-7g-2 stem-loop Proteins 0.000 claims 1
- 239000000203 mixture Substances 0.000 abstract description 30
- 239000013615 primer Substances 0.000 description 58
- 210000004027 cell Anatomy 0.000 description 44
- 238000003745 diagnosis Methods 0.000 description 30
- 239000002773 nucleotide Substances 0.000 description 29
- 125000003729 nucleotide group Chemical group 0.000 description 29
- 238000012360 testing method Methods 0.000 description 28
- 108090000623 proteins and genes Proteins 0.000 description 27
- 238000009396 hybridization Methods 0.000 description 26
- 208000035475 disorder Diseases 0.000 description 24
- 108020004414 DNA Proteins 0.000 description 21
- 239000003550 marker Substances 0.000 description 20
- 108020004711 Nucleic Acid Probes Proteins 0.000 description 18
- 230000000295 complement effect Effects 0.000 description 18
- 238000001514 detection method Methods 0.000 description 18
- 239000002853 nucleic acid probe Substances 0.000 description 18
- 108090000765 processed proteins & peptides Proteins 0.000 description 18
- 241001465754 Metazoa Species 0.000 description 17
- 108091028043 Nucleic acid sequence Proteins 0.000 description 17
- 239000000463 material Substances 0.000 description 17
- 239000000047 product Substances 0.000 description 17
- 210000001519 tissue Anatomy 0.000 description 17
- 230000000694 effects Effects 0.000 description 16
- 108091026331 miR-214 stem-loop Proteins 0.000 description 15
- 108091048888 miR-214-1 stem-loop Proteins 0.000 description 15
- 108091078347 miR-214-2 stem-loop Proteins 0.000 description 15
- 108091035552 miR-214-3 stem-loop Proteins 0.000 description 15
- 238000001356 surgical procedure Methods 0.000 description 15
- 238000005259 measurement Methods 0.000 description 14
- 108091023084 miR-126 stem-loop Proteins 0.000 description 14
- 108091065272 miR-126-1 stem-loop Proteins 0.000 description 14
- 108091081187 miR-126-2 stem-loop Proteins 0.000 description 14
- 108091030790 miR-126-3 stem-loop Proteins 0.000 description 14
- 108091092317 miR-126-4 stem-loop Proteins 0.000 description 14
- 102000004169 proteins and genes Human genes 0.000 description 13
- 238000004458 analytical method Methods 0.000 description 11
- 102000004196 processed proteins & peptides Human genes 0.000 description 11
- 238000002560 therapeutic procedure Methods 0.000 description 11
- 108091050724 let-7b stem-loop Proteins 0.000 description 10
- 230000001225 therapeutic effect Effects 0.000 description 10
- 239000003795 chemical substances by application Substances 0.000 description 9
- 108091007772 MIRLET7C Proteins 0.000 description 8
- 230000000692 anti-sense effect Effects 0.000 description 8
- 238000005119 centrifugation Methods 0.000 description 8
- 239000000975 dye Substances 0.000 description 8
- 238000011156 evaluation Methods 0.000 description 8
- 108020004999 messenger RNA Proteins 0.000 description 8
- 239000002987 primer (paints) Substances 0.000 description 8
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 7
- 238000012300 Sequence Analysis Methods 0.000 description 7
- 230000001413 cellular effect Effects 0.000 description 7
- 230000002357 endometrial effect Effects 0.000 description 7
- 239000003112 inhibitor Substances 0.000 description 7
- 230000003902 lesion Effects 0.000 description 7
- 108091024449 let-7e stem-loop Proteins 0.000 description 7
- 108091044227 let-7e-1 stem-loop Proteins 0.000 description 7
- 108091071181 let-7e-2 stem-loop Proteins 0.000 description 7
- 230000008569 process Effects 0.000 description 7
- 239000011541 reaction mixture Substances 0.000 description 7
- 238000013518 transcription Methods 0.000 description 7
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 7
- 102000004190 Enzymes Human genes 0.000 description 6
- 108090000790 Enzymes Proteins 0.000 description 6
- 206010028980 Neoplasm Diseases 0.000 description 6
- 238000011529 RT qPCR Methods 0.000 description 6
- 239000012190 activator Substances 0.000 description 6
- 230000008901 benefit Effects 0.000 description 6
- 201000011510 cancer Diseases 0.000 description 6
- 239000012634 fragment Substances 0.000 description 6
- 108091033319 polynucleotide Proteins 0.000 description 6
- 102000040430 polynucleotide Human genes 0.000 description 6
- 239000002157 polynucleotide Substances 0.000 description 6
- 229920001184 polypeptide Polymers 0.000 description 6
- 230000004083 survival effect Effects 0.000 description 6
- 230000035897 transcription Effects 0.000 description 6
- 108020005187 Oligonucleotide Probes Proteins 0.000 description 5
- 208000000450 Pelvic Pain Diseases 0.000 description 5
- 108091093037 Peptide nucleic acid Proteins 0.000 description 5
- 230000004913 activation Effects 0.000 description 5
- 230000015572 biosynthetic process Effects 0.000 description 5
- 238000012512 characterization method Methods 0.000 description 5
- 238000007796 conventional method Methods 0.000 description 5
- 230000000875 corresponding effect Effects 0.000 description 5
- 238000001727 in vivo Methods 0.000 description 5
- 208000000509 infertility Diseases 0.000 description 5
- 230000036512 infertility Effects 0.000 description 5
- 231100000535 infertility Toxicity 0.000 description 5
- 230000000977 initiatory effect Effects 0.000 description 5
- 108091033753 let-7d stem-loop Proteins 0.000 description 5
- 108091007427 let-7g Proteins 0.000 description 5
- 230000035772 mutation Effects 0.000 description 5
- 238000002966 oligonucleotide array Methods 0.000 description 5
- 239000002751 oligonucleotide probe Substances 0.000 description 5
- 230000002285 radioactive effect Effects 0.000 description 5
- 238000007619 statistical method Methods 0.000 description 5
- 238000006467 substitution reaction Methods 0.000 description 5
- 238000003786 synthesis reaction Methods 0.000 description 5
- 238000013519 translation Methods 0.000 description 5
- 102000053602 DNA Human genes 0.000 description 4
- 241000124008 Mammalia Species 0.000 description 4
- 238000000585 Mann–Whitney U test Methods 0.000 description 4
- 108091005461 Nucleic proteins Proteins 0.000 description 4
- 230000002159 abnormal effect Effects 0.000 description 4
- 239000000730 antalgic agent Substances 0.000 description 4
- 238000013459 approach Methods 0.000 description 4
- 238000002512 chemotherapy Methods 0.000 description 4
- 238000013211 curve analysis Methods 0.000 description 4
- 238000012217 deletion Methods 0.000 description 4
- 230000037430 deletion Effects 0.000 description 4
- 238000011161 development Methods 0.000 description 4
- 230000018109 developmental process Effects 0.000 description 4
- 230000003828 downregulation Effects 0.000 description 4
- 230000036541 health Effects 0.000 description 4
- 230000001976 improved effect Effects 0.000 description 4
- 238000002357 laparoscopic surgery Methods 0.000 description 4
- 108091063986 let-7f stem-loop Proteins 0.000 description 4
- 230000000670 limiting effect Effects 0.000 description 4
- 230000002018 overexpression Effects 0.000 description 4
- 230000007170 pathology Effects 0.000 description 4
- 238000002360 preparation method Methods 0.000 description 4
- 238000012545 processing Methods 0.000 description 4
- 238000003757 reverse transcription PCR Methods 0.000 description 4
- 229940124597 therapeutic agent Drugs 0.000 description 4
- 238000011285 therapeutic regimen Methods 0.000 description 4
- 229940121710 HMGCoA reductase inhibitor Drugs 0.000 description 3
- 108091030146 MiRBase Proteins 0.000 description 3
- 108091034117 Oligonucleotide Proteins 0.000 description 3
- 241000282520 Papio Species 0.000 description 3
- 238000007792 addition Methods 0.000 description 3
- 150000001413 amino acids Chemical group 0.000 description 3
- 229940035676 analgesics Drugs 0.000 description 3
- 238000000137 annealing Methods 0.000 description 3
- 238000003491 array Methods 0.000 description 3
- 239000007795 chemical reaction product Substances 0.000 description 3
- 238000012790 confirmation Methods 0.000 description 3
- 239000013068 control sample Substances 0.000 description 3
- 230000002559 cytogenic effect Effects 0.000 description 3
- 230000007423 decrease Effects 0.000 description 3
- 230000007812 deficiency Effects 0.000 description 3
- KPUWHANPEXNPJT-UHFFFAOYSA-N disiloxane Chemical class [SiH3]O[SiH3] KPUWHANPEXNPJT-UHFFFAOYSA-N 0.000 description 3
- 238000013399 early diagnosis Methods 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 231100000502 fertility decrease Toxicity 0.000 description 3
- 239000007850 fluorescent dye Substances 0.000 description 3
- 239000000499 gel Substances 0.000 description 3
- 230000009368 gene silencing by RNA Effects 0.000 description 3
- 230000007062 hydrolysis Effects 0.000 description 3
- 238000006460 hydrolysis reaction Methods 0.000 description 3
- 230000006872 improvement Effects 0.000 description 3
- 238000000338 in vitro Methods 0.000 description 3
- 238000000099 in vitro assay Methods 0.000 description 3
- 239000004615 ingredient Substances 0.000 description 3
- 230000005764 inhibitory process Effects 0.000 description 3
- 238000002372 labelling Methods 0.000 description 3
- 238000002844 melting Methods 0.000 description 3
- 230000008018 melting Effects 0.000 description 3
- 239000008194 pharmaceutical composition Substances 0.000 description 3
- 229920000642 polymer Polymers 0.000 description 3
- 238000011002 quantification Methods 0.000 description 3
- 230000009467 reduction Effects 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- 229940126585 therapeutic drug Drugs 0.000 description 3
- 238000012800 visualization Methods 0.000 description 3
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 2
- 229930024421 Adenine Natural products 0.000 description 2
- GFFGJBXGBJISGV-UHFFFAOYSA-N Adenine Chemical compound NC1=NC=NC2=C1N=CN2 GFFGJBXGBJISGV-UHFFFAOYSA-N 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- 208000001154 Dermoid Cyst Diseases 0.000 description 2
- 238000002965 ELISA Methods 0.000 description 2
- 108091062170 Mir-22 Proteins 0.000 description 2
- 238000000636 Northern blotting Methods 0.000 description 2
- RJKFOVLPORLFTN-LEKSSAKUSA-N Progesterone Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H](C(=O)C)[C@@]1(C)CC2 RJKFOVLPORLFTN-LEKSSAKUSA-N 0.000 description 2
- 238000001190 Q-PCR Methods 0.000 description 2
- 238000002123 RNA extraction Methods 0.000 description 2
- 108091030071 RNAI Proteins 0.000 description 2
- 108020004459 Small interfering RNA Proteins 0.000 description 2
- ISAKRJDGNUQOIC-UHFFFAOYSA-N Uracil Chemical compound O=C1C=CNC(=O)N1 ISAKRJDGNUQOIC-UHFFFAOYSA-N 0.000 description 2
- 229960000643 adenine Drugs 0.000 description 2
- 230000001668 ameliorated effect Effects 0.000 description 2
- 239000008346 aqueous phase Substances 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- 239000012620 biological material Substances 0.000 description 2
- 238000001574 biopsy Methods 0.000 description 2
- 238000009534 blood test Methods 0.000 description 2
- 238000010805 cDNA synthesis kit Methods 0.000 description 2
- 230000001684 chronic effect Effects 0.000 description 2
- 230000004087 circulation Effects 0.000 description 2
- 238000003776 cleavage reaction Methods 0.000 description 2
- 238000004590 computer program Methods 0.000 description 2
- 210000000805 cytoplasm Anatomy 0.000 description 2
- OPTASPLRGRRNAP-UHFFFAOYSA-N cytosine Chemical compound NC=1C=CNC(=O)N=1 OPTASPLRGRRNAP-UHFFFAOYSA-N 0.000 description 2
- 238000004925 denaturation Methods 0.000 description 2
- 230000036425 denaturation Effects 0.000 description 2
- 238000002405 diagnostic procedure Methods 0.000 description 2
- 238000011984 electrochemiluminescence immunoassay Methods 0.000 description 2
- 210000005168 endometrial cell Anatomy 0.000 description 2
- 201000002595 endometriosis of ovary Diseases 0.000 description 2
- 210000004696 endometrium Anatomy 0.000 description 2
- 230000008029 eradication Effects 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 239000000284 extract Substances 0.000 description 2
- 230000002349 favourable effect Effects 0.000 description 2
- 230000035558 fertility Effects 0.000 description 2
- 238000007672 fourth generation sequencing Methods 0.000 description 2
- 230000004927 fusion Effects 0.000 description 2
- UYTPUPDQBNUYGX-UHFFFAOYSA-N guanine Chemical compound O=C1NC(N)=NC2=C1N=CN2 UYTPUPDQBNUYGX-UHFFFAOYSA-N 0.000 description 2
- 231100001261 hazardous Toxicity 0.000 description 2
- 230000013632 homeostatic process Effects 0.000 description 2
- 229940088597 hormone Drugs 0.000 description 2
- 239000005556 hormone Substances 0.000 description 2
- 238000003384 imaging method Methods 0.000 description 2
- 238000012309 immunohistochemistry technique Methods 0.000 description 2
- 238000009169 immunotherapy Methods 0.000 description 2
- 238000005462 in vivo assay Methods 0.000 description 2
- 208000027866 inflammatory disease Diseases 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- 238000003780 insertion Methods 0.000 description 2
- 230000037431 insertion Effects 0.000 description 2
- 230000009545 invasion Effects 0.000 description 2
- 238000002350 laparotomy Methods 0.000 description 2
- 108091030917 let-7b-1 stem-loop Proteins 0.000 description 2
- 108091082924 let-7b-2 stem-loop Proteins 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 239000000891 luminescent agent Substances 0.000 description 2
- 238000007726 management method Methods 0.000 description 2
- 108091044988 miR-125a stem-loop Proteins 0.000 description 2
- 108091045872 miR-135 stem-loop Proteins 0.000 description 2
- 108091043249 miR-135-1 stem-loop Proteins 0.000 description 2
- 108091064876 miR-135-2 stem-loop Proteins 0.000 description 2
- 108091026523 miR-135a stem-loop Proteins 0.000 description 2
- 108091046933 miR-18b stem-loop Proteins 0.000 description 2
- 108091050398 miR-500b stem-loop Proteins 0.000 description 2
- 108091024443 miRa-135-1 stem-loop Proteins 0.000 description 2
- 238000010208 microarray analysis Methods 0.000 description 2
- BQJCRHHNABKAKU-KBQPJGBKSA-N morphine Chemical compound O([C@H]1[C@H](C=C[C@H]23)O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O BQJCRHHNABKAKU-KBQPJGBKSA-N 0.000 description 2
- 230000009871 nonspecific binding Effects 0.000 description 2
- 210000004940 nucleus Anatomy 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- 210000003463 organelle Anatomy 0.000 description 2
- 208000030747 ovarian endometriosis Diseases 0.000 description 2
- 230000036961 partial effect Effects 0.000 description 2
- 230000001575 pathological effect Effects 0.000 description 2
- PTMHPRAIXMAOOB-UHFFFAOYSA-L phosphoramidate Chemical compound NP([O-])([O-])=O PTMHPRAIXMAOOB-UHFFFAOYSA-L 0.000 description 2
- 230000001323 posttranslational effect Effects 0.000 description 2
- 230000002062 proliferating effect Effects 0.000 description 2
- 230000000069 prophylactic effect Effects 0.000 description 2
- 230000001850 reproductive effect Effects 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 230000007017 scission Effects 0.000 description 2
- 230000003248 secreting effect Effects 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 239000002924 silencing RNA Substances 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- 238000001308 synthesis method Methods 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- 230000008685 targeting Effects 0.000 description 2
- RYYWUUFWQRZTIU-UHFFFAOYSA-K thiophosphate Chemical compound [O-]P([O-])([O-])=S RYYWUUFWQRZTIU-UHFFFAOYSA-K 0.000 description 2
- RWQNBRDOKXIBIV-UHFFFAOYSA-N thymine Chemical compound CC1=CNC(=O)NC1=O RWQNBRDOKXIBIV-UHFFFAOYSA-N 0.000 description 2
- 230000003827 upregulation Effects 0.000 description 2
- 210000004291 uterus Anatomy 0.000 description 2
- 230000000007 visual effect Effects 0.000 description 2
- WWYNJERNGUHSAO-XUDSTZEESA-N (+)-Norgestrel Chemical compound O=C1CC[C@@H]2[C@H]3CC[C@](CC)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=C1 WWYNJERNGUHSAO-XUDSTZEESA-N 0.000 description 1
- ZGGHKIMDNBDHJB-NRFPMOEYSA-M (3R,5S)-fluvastatin sodium Chemical compound [Na+].C12=CC=CC=C2N(C(C)C)C(\C=C\[C@@H](O)C[C@@H](O)CC([O-])=O)=C1C1=CC=C(F)C=C1 ZGGHKIMDNBDHJB-NRFPMOEYSA-M 0.000 description 1
- PIINGYXNCHTJTF-UHFFFAOYSA-N 2-(2-azaniumylethylamino)acetate Chemical group NCCNCC(O)=O PIINGYXNCHTJTF-UHFFFAOYSA-N 0.000 description 1
- 206010000060 Abdominal distension Diseases 0.000 description 1
- DLFVBJFMPXGRIB-UHFFFAOYSA-N Acetamide Chemical compound CC(N)=O DLFVBJFMPXGRIB-UHFFFAOYSA-N 0.000 description 1
- RZVAJINKPMORJF-UHFFFAOYSA-N Acetaminophen Chemical compound CC(=O)NC1=CC=C(O)C=C1 RZVAJINKPMORJF-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 208000003200 Adenoma Diseases 0.000 description 1
- 206010001233 Adenoma benign Diseases 0.000 description 1
- 108020000948 Antisense Oligonucleotides Proteins 0.000 description 1
- 108020005544 Antisense RNA Proteins 0.000 description 1
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 1
- XUKUURHRXDUEBC-KAYWLYCHSA-N Atorvastatin Chemical compound C=1C=CC=CC=1C1=C(C=2C=CC(F)=CC=2)N(CC[C@@H](O)C[C@@H](O)CC(O)=O)C(C(C)C)=C1C(=O)NC1=CC=CC=C1 XUKUURHRXDUEBC-KAYWLYCHSA-N 0.000 description 1
- XUKUURHRXDUEBC-UHFFFAOYSA-N Atorvastatin Natural products C=1C=CC=CC=1C1=C(C=2C=CC(F)=CC=2)N(CCC(O)CC(O)CC(O)=O)C(C(C)C)=C1C(=O)NC1=CC=CC=C1 XUKUURHRXDUEBC-UHFFFAOYSA-N 0.000 description 1
- 208000023275 Autoimmune disease Diseases 0.000 description 1
- 108090001008 Avidin Proteins 0.000 description 1
- 238000009010 Bradford assay Methods 0.000 description 1
- 108010037003 Buserelin Proteins 0.000 description 1
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- 208000005623 Carcinogenesis Diseases 0.000 description 1
- 208000024172 Cardiovascular disease Diseases 0.000 description 1
- 108090000994 Catalytic RNA Proteins 0.000 description 1
- 102000053642 Catalytic RNA Human genes 0.000 description 1
- 108091033380 Coding strand Proteins 0.000 description 1
- 208000035473 Communicable disease Diseases 0.000 description 1
- 206010011732 Cyst Diseases 0.000 description 1
- 201000005171 Cystadenoma Diseases 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- 102000012410 DNA Ligases Human genes 0.000 description 1
- 108010061982 DNA Ligases Proteins 0.000 description 1
- 108020003215 DNA Probes Proteins 0.000 description 1
- 239000003155 DNA primer Substances 0.000 description 1
- 239000003298 DNA probe Substances 0.000 description 1
- 108010014303 DNA-directed DNA polymerase Proteins 0.000 description 1
- 102000016928 DNA-directed DNA polymerase Human genes 0.000 description 1
- GJKXGJCSJWBJEZ-XRSSZCMZSA-N Deslorelin Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CNC2=CC=CC=C12 GJKXGJCSJWBJEZ-XRSSZCMZSA-N 0.000 description 1
- SHIBSTMRCDJXLN-UHFFFAOYSA-N Digoxigenin Natural products C1CC(C2C(C3(C)CCC(O)CC3CC2)CC2O)(O)C2(C)C1C1=CC(=O)OC1 SHIBSTMRCDJXLN-UHFFFAOYSA-N 0.000 description 1
- 206010061818 Disease progression Diseases 0.000 description 1
- 206010061819 Disease recurrence Diseases 0.000 description 1
- 206010014733 Endometrial cancer Diseases 0.000 description 1
- 206010014759 Endometrial neoplasm Diseases 0.000 description 1
- 206010016654 Fibrosis Diseases 0.000 description 1
- 108010069236 Goserelin Proteins 0.000 description 1
- BLCLNMBMMGCOAS-URPVMXJPSA-N Goserelin Chemical compound C([C@@H](C(=O)N[C@H](COC(C)(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N1[C@@H](CCC1)C(=O)NNC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 BLCLNMBMMGCOAS-URPVMXJPSA-N 0.000 description 1
- 101000829171 Hypocrea virens (strain Gv29-8 / FGSC 10586) Effector TSP1 Proteins 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 102100034343 Integrase Human genes 0.000 description 1
- 108010000817 Leuprolide Proteins 0.000 description 1
- 239000005089 Luciferase Substances 0.000 description 1
- 108060001084 Luciferase Proteins 0.000 description 1
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 1
- 108060004795 Methyltransferase Proteins 0.000 description 1
- 108091007780 MiR-122 Proteins 0.000 description 1
- 108091080995 Mir-9/mir-79 microRNA precursor family Proteins 0.000 description 1
- PCZOHLXUXFIOCF-UHFFFAOYSA-N Monacolin X Natural products C12C(OC(=O)C(C)CC)CC(C)C=C2C=CC(C)C1CCC1CC(O)CC(=O)O1 PCZOHLXUXFIOCF-UHFFFAOYSA-N 0.000 description 1
- 108010085220 Multiprotein Complexes Proteins 0.000 description 1
- 102000007474 Multiprotein Complexes Human genes 0.000 description 1
- 108010021717 Nafarelin Proteins 0.000 description 1
- 206010029260 Neuroblastoma Diseases 0.000 description 1
- TTZMPOZCBFTTPR-UHFFFAOYSA-N O=P1OCO1 Chemical compound O=P1OCO1 TTZMPOZCBFTTPR-UHFFFAOYSA-N 0.000 description 1
- BRUQQQPBMZOVGD-XFKAJCMBSA-N Oxycodone Chemical compound O=C([C@@H]1O2)CC[C@@]3(O)[C@H]4CC5=CC=C(OC)C2=C5[C@@]13CCN4C BRUQQQPBMZOVGD-XFKAJCMBSA-N 0.000 description 1
- 206010058674 Pelvic Infection Diseases 0.000 description 1
- 208000012896 Peritoneal disease Diseases 0.000 description 1
- 229920002594 Polyethylene Glycol 8000 Polymers 0.000 description 1
- TUZYXOIXSAXUGO-UHFFFAOYSA-N Pravastatin Natural products C1=CC(C)C(CCC(O)CC(O)CC(O)=O)C2C(OC(=O)C(C)CC)CC(O)C=C21 TUZYXOIXSAXUGO-UHFFFAOYSA-N 0.000 description 1
- 108091034057 RNA (poly(A)) Proteins 0.000 description 1
- 108020004518 RNA Probes Proteins 0.000 description 1
- 238000010802 RNA extraction kit Methods 0.000 description 1
- 238000012228 RNA interference-mediated gene silencing Methods 0.000 description 1
- 101710086015 RNA ligase Proteins 0.000 description 1
- 239000003391 RNA probe Substances 0.000 description 1
- 108010092799 RNA-directed DNA polymerase Proteins 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 102000006382 Ribonucleases Human genes 0.000 description 1
- 108010083644 Ribonucleases Proteins 0.000 description 1
- RYMZZMVNJRMUDD-UHFFFAOYSA-N SJ000286063 Natural products C12C(OC(=O)C(C)(C)CC)CC(C)C=C2C=CC(C)C1CCC1CC(O)CC(=O)O1 RYMZZMVNJRMUDD-UHFFFAOYSA-N 0.000 description 1
- AJLFOPYRIVGYMJ-UHFFFAOYSA-N SJ000287055 Natural products C12C(OC(=O)C(C)CC)CCC=C2C=CC(C)C1CCC1CC(O)CC(=O)O1 AJLFOPYRIVGYMJ-UHFFFAOYSA-N 0.000 description 1
- 108091081021 Sense strand Proteins 0.000 description 1
- 102000039471 Small Nuclear RNA Human genes 0.000 description 1
- 108010090804 Streptavidin Proteins 0.000 description 1
- 238000000692 Student's t-test Methods 0.000 description 1
- 206010042618 Surgical procedure repeated Diseases 0.000 description 1
- 108700005078 Synthetic Genes Proteins 0.000 description 1
- 108010050144 Triptorelin Pamoate Proteins 0.000 description 1
- 102000006943 Uracil-DNA Glycosidase Human genes 0.000 description 1
- 108010072685 Uracil-DNA Glycosidase Proteins 0.000 description 1
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 1
- DUDJTRNGXIUJEB-UHFFFAOYSA-N [N].NCC(O)=O Chemical compound [N].NCC(O)=O DUDJTRNGXIUJEB-UHFFFAOYSA-N 0.000 description 1
- 229960001138 acetylsalicylic acid Drugs 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 230000032683 aging Effects 0.000 description 1
- 238000007844 allele-specific PCR Methods 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- 239000003098 androgen Substances 0.000 description 1
- 229940030486 androgens Drugs 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 230000003466 anti-cipated effect Effects 0.000 description 1
- 239000000074 antisense oligonucleotide Substances 0.000 description 1
- 238000012230 antisense oligonucleotides Methods 0.000 description 1
- 239000003886 aromatase inhibitor Substances 0.000 description 1
- 229940046844 aromatase inhibitors Drugs 0.000 description 1
- 238000007846 asymmetric PCR Methods 0.000 description 1
- 229960005370 atorvastatin Drugs 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 230000031018 biological processes and functions Effects 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 239000005082 bioluminescent agent Substances 0.000 description 1
- 239000000091 biomarker candidate Substances 0.000 description 1
- 229960002685 biotin Drugs 0.000 description 1
- 235000020958 biotin Nutrition 0.000 description 1
- 239000011616 biotin Substances 0.000 description 1
- 208000024330 bloating Diseases 0.000 description 1
- 210000000601 blood cell Anatomy 0.000 description 1
- 230000017531 blood circulation Effects 0.000 description 1
- 238000004820 blood count Methods 0.000 description 1
- 210000000988 bone and bone Anatomy 0.000 description 1
- 229960002719 buserelin Drugs 0.000 description 1
- CUWODFFVMXJOKD-UVLQAERKSA-N buserelin Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](COC(C)(C)C)NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CC=C(O)C=C1 CUWODFFVMXJOKD-UVLQAERKSA-N 0.000 description 1
- 238000010804 cDNA synthesis Methods 0.000 description 1
- VTYYLEPIZMXCLO-UHFFFAOYSA-L calcium carbonate Substances [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 1
- 230000036952 cancer formation Effects 0.000 description 1
- 231100000504 carcinogenesis Toxicity 0.000 description 1
- 230000000747 cardiac effect Effects 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 230000024245 cell differentiation Effects 0.000 description 1
- 230000004709 cell invasion Effects 0.000 description 1
- 230000010001 cellular homeostasis Effects 0.000 description 1
- 229960005110 cerivastatin Drugs 0.000 description 1
- SEERZIQQUAZTOL-ANMDKAQQSA-N cerivastatin Chemical compound COCC1=C(C(C)C)N=C(C(C)C)C(\C=C\[C@@H](O)C[C@@H](O)CC(O)=O)=C1C1=CC=C(F)C=C1 SEERZIQQUAZTOL-ANMDKAQQSA-N 0.000 description 1
- 239000005081 chemiluminescent agent Substances 0.000 description 1
- 238000000546 chi-square test Methods 0.000 description 1
- 230000035606 childbirth Effects 0.000 description 1
- 238000004891 communication Methods 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 239000003184 complementary RNA Substances 0.000 description 1
- 230000001276 controlling effect Effects 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 229940111134 coxibs Drugs 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 230000001351 cycling effect Effects 0.000 description 1
- 239000003255 cyclooxygenase 2 inhibitor Substances 0.000 description 1
- 208000031513 cyst Diseases 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- 229940104302 cytosine Drugs 0.000 description 1
- POZRVZJJTULAOH-LHZXLZLDSA-N danazol Chemical compound C1[C@]2(C)[C@H]3CC[C@](C)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=CC2=C1C=NO2 POZRVZJJTULAOH-LHZXLZLDSA-N 0.000 description 1
- 229960000766 danazol Drugs 0.000 description 1
- 230000009849 deactivation Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 238000003935 denaturing gradient gel electrophoresis Methods 0.000 description 1
- 239000005549 deoxyribonucleoside Substances 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- 238000000586 desensitisation Methods 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 229960005408 deslorelin Drugs 0.000 description 1
- 108700025485 deslorelin Proteins 0.000 description 1
- 230000006866 deterioration Effects 0.000 description 1
- 239000000104 diagnostic biomarker Substances 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- 235000015872 dietary supplement Nutrition 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 238000007847 digital PCR Methods 0.000 description 1
- QONQRTHLHBTMGP-UHFFFAOYSA-N digitoxigenin Natural products CC12CCC(C3(CCC(O)CC3CC3)C)C3C11OC1CC2C1=CC(=O)OC1 QONQRTHLHBTMGP-UHFFFAOYSA-N 0.000 description 1
- SHIBSTMRCDJXLN-KCZCNTNESA-N digoxigenin Chemical compound C1([C@@H]2[C@@]3([C@@](CC2)(O)[C@H]2[C@@H]([C@@]4(C)CC[C@H](O)C[C@H]4CC2)C[C@H]3O)C)=CC(=O)OC1 SHIBSTMRCDJXLN-KCZCNTNESA-N 0.000 description 1
- NAGJZTKCGNOGPW-UHFFFAOYSA-K dioxido-sulfanylidene-sulfido-$l^{5}-phosphane Chemical compound [O-]P([O-])([S-])=S NAGJZTKCGNOGPW-UHFFFAOYSA-K 0.000 description 1
- 230000005750 disease progression Effects 0.000 description 1
- 238000006073 displacement reaction Methods 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 238000011304 droplet digital PCR Methods 0.000 description 1
- 238000002651 drug therapy Methods 0.000 description 1
- JGMOKGBVKVMRFX-HQZYFCCVSA-N dydrogesterone Chemical compound C1=CC2=CC(=O)CC[C@@]2(C)[C@H]2[C@@H]1[C@@H]1CC[C@H](C(=O)C)[C@@]1(C)CC2 JGMOKGBVKVMRFX-HQZYFCCVSA-N 0.000 description 1
- 229960004913 dydrogesterone Drugs 0.000 description 1
- 201000006828 endometrial hyperplasia Diseases 0.000 description 1
- 208000016018 endometrial polyp Diseases 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 230000003628 erosive effect Effects 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 210000001808 exosome Anatomy 0.000 description 1
- 238000010195 expression analysis Methods 0.000 description 1
- 210000001723 extracellular space Anatomy 0.000 description 1
- 230000004761 fibrosis Effects 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 229960003765 fluvastatin Drugs 0.000 description 1
- 238000001502 gel electrophoresis Methods 0.000 description 1
- 238000001415 gene therapy Methods 0.000 description 1
- 238000002695 general anesthesia Methods 0.000 description 1
- 229960002913 goserelin Drugs 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 201000000079 gynecomastia Diseases 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 1
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 1
- 230000002962 histologic effect Effects 0.000 description 1
- 108700020746 histrelin Proteins 0.000 description 1
- 229960002193 histrelin Drugs 0.000 description 1
- HHXHVIJIIXKSOE-QILQGKCVSA-N histrelin Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)CC(N=C1)=CN1CC1=CC=CC=C1 HHXHVIJIIXKSOE-QILQGKCVSA-N 0.000 description 1
- 238000007849 hot-start PCR Methods 0.000 description 1
- 239000002471 hydroxymethylglutaryl coenzyme A reductase inhibitor Substances 0.000 description 1
- 238000009802 hysterectomy Methods 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 238000007901 in situ hybridization Methods 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 208000021267 infertility disease Diseases 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 238000005304 joining Methods 0.000 description 1
- GFIJNRVAKGFPGQ-LIJARHBVSA-N leuprolide Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CC=C(O)C=C1 GFIJNRVAKGFPGQ-LIJARHBVSA-N 0.000 description 1
- 229960004338 leuprorelin Drugs 0.000 description 1
- 229960004400 levonorgestrel Drugs 0.000 description 1
- 208000019423 liver disease Diseases 0.000 description 1
- 238000001325 log-rank test Methods 0.000 description 1
- 238000007477 logistic regression Methods 0.000 description 1
- 229960004844 lovastatin Drugs 0.000 description 1
- PCZOHLXUXFIOCF-BXMDZJJMSA-N lovastatin Chemical compound C([C@H]1[C@@H](C)C=CC2=C[C@H](C)C[C@@H]([C@H]12)OC(=O)[C@@H](C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 PCZOHLXUXFIOCF-BXMDZJJMSA-N 0.000 description 1
- QLJODMDSTUBWDW-UHFFFAOYSA-N lovastatin hydroxy acid Natural products C1=CC(C)C(CCC(O)CC(O)CC(O)=O)C2C(OC(=O)C(C)CC)CC(C)C=C21 QLJODMDSTUBWDW-UHFFFAOYSA-N 0.000 description 1
- 235000019689 luncheon sausage Nutrition 0.000 description 1
- 201000005202 lung cancer Diseases 0.000 description 1
- 208000020816 lung neoplasm Diseases 0.000 description 1
- 210000004880 lymph fluid Anatomy 0.000 description 1
- 239000006166 lysate Substances 0.000 description 1
- 238000007403 mPCR Methods 0.000 description 1
- 238000002595 magnetic resonance imaging Methods 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 238000013160 medical therapy Methods 0.000 description 1
- 229960002985 medroxyprogesterone acetate Drugs 0.000 description 1
- PSGAAPLEWMOORI-PEINSRQWSA-N medroxyprogesterone acetate Chemical compound C([C@@]12C)CC(=O)C=C1[C@@H](C)C[C@@H]1[C@@H]2CC[C@]2(C)[C@@](OC(C)=O)(C(C)=O)CC[C@H]21 PSGAAPLEWMOORI-PEINSRQWSA-N 0.000 description 1
- 239000000155 melt Substances 0.000 description 1
- 210000004379 membrane Anatomy 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 230000006894 menstrual cycle phase Effects 0.000 description 1
- 125000000325 methylidene group Chemical group [H]C([H])=* 0.000 description 1
- YACKEPLHDIMKIO-UHFFFAOYSA-N methylphosphonic acid Chemical compound CP(O)(O)=O YACKEPLHDIMKIO-UHFFFAOYSA-N 0.000 description 1
- 229950009116 mevastatin Drugs 0.000 description 1
- AJLFOPYRIVGYMJ-INTXDZFKSA-N mevastatin Chemical compound C([C@H]1[C@@H](C)C=CC2=CCC[C@@H]([C@H]12)OC(=O)[C@@H](C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 AJLFOPYRIVGYMJ-INTXDZFKSA-N 0.000 description 1
- BOZILQFLQYBIIY-UHFFFAOYSA-N mevastatin hydroxy acid Natural products C1=CC(C)C(CCC(O)CC(O)CC(O)=O)C2C(OC(=O)C(C)CC)CCC=C21 BOZILQFLQYBIIY-UHFFFAOYSA-N 0.000 description 1
- 108091051828 miR-122 stem-loop Proteins 0.000 description 1
- 108091026375 miR-135b stem-loop Proteins 0.000 description 1
- 108091086065 miR-135b-2 stem-loop Proteins 0.000 description 1
- 108091091751 miR-17 stem-loop Proteins 0.000 description 1
- 108091044046 miR-17-1 stem-loop Proteins 0.000 description 1
- 108091065423 miR-17-3 stem-loop Proteins 0.000 description 1
- 108091025686 miR-199a stem-loop Proteins 0.000 description 1
- 108091029956 miR-200a-1 stem-loop Proteins 0.000 description 1
- 108091088721 miR-200a-2 stem-loop Proteins 0.000 description 1
- 108091070312 miR-200a-3 stem-loop Proteins 0.000 description 1
- 108091056309 miR-200b-1 stem-loop Proteins 0.000 description 1
- 108091026985 miR-200b-2 stem-loop Proteins 0.000 description 1
- 108091049679 miR-20a stem-loop Proteins 0.000 description 1
- 108091083237 miR-451b stem-loop Proteins 0.000 description 1
- 108091060293 miR-453 stem-loop Proteins 0.000 description 1
- 108091025542 miR-668 stem-loop Proteins 0.000 description 1
- 108091047084 miR-9 stem-loop Proteins 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 239000003607 modifier Substances 0.000 description 1
- 230000000897 modulatory effect Effects 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 229960005181 morphine Drugs 0.000 description 1
- 210000000214 mouth Anatomy 0.000 description 1
- 208000004707 mucinous cystadenoma Diseases 0.000 description 1
- 238000010202 multivariate logistic regression analysis Methods 0.000 description 1
- 238000002703 mutagenesis Methods 0.000 description 1
- 231100000350 mutagenesis Toxicity 0.000 description 1
- RWHUEXWOYVBUCI-ITQXDASVSA-N nafarelin Chemical compound C([C@@H](C(=O)N[C@H](CC=1C=C2C=CC=CC2=CC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N1[C@@H](CCC1)C(=O)NCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 RWHUEXWOYVBUCI-ITQXDASVSA-N 0.000 description 1
- 229960002333 nafarelin Drugs 0.000 description 1
- 239000011807 nanoball Substances 0.000 description 1
- 230000003533 narcotic effect Effects 0.000 description 1
- 238000007857 nested PCR Methods 0.000 description 1
- 238000007481 next generation sequencing Methods 0.000 description 1
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 1
- 229940053934 norethindrone Drugs 0.000 description 1
- VIKNJXKGJWUCNN-XGXHKTLJSA-N norethisterone Chemical compound O=C1CC[C@@H]2[C@H]3CC[C@](C)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=C1 VIKNJXKGJWUCNN-XGXHKTLJSA-N 0.000 description 1
- 238000002515 oligonucleotide synthesis Methods 0.000 description 1
- 238000009806 oophorectomy Methods 0.000 description 1
- 229940127234 oral contraceptive Drugs 0.000 description 1
- 239000003539 oral contraceptive agent Substances 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 230000009818 osteogenic differentiation Effects 0.000 description 1
- 201000008968 osteosarcoma Diseases 0.000 description 1
- 208000025661 ovarian cyst Diseases 0.000 description 1
- 201000010302 ovarian serous cystadenocarcinoma Diseases 0.000 description 1
- 230000027758 ovulation cycle Effects 0.000 description 1
- 229960002085 oxycodone Drugs 0.000 description 1
- 229960005489 paracetamol Drugs 0.000 description 1
- 239000013610 patient sample Substances 0.000 description 1
- 206010034260 pelvic mass Diseases 0.000 description 1
- 210000003200 peritoneal cavity Anatomy 0.000 description 1
- 239000012466 permeate Substances 0.000 description 1
- 150000004713 phosphodiesters Chemical class 0.000 description 1
- 150000008300 phosphoramidites Chemical class 0.000 description 1
- 239000005080 phosphorescent agent Substances 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 229960002797 pitavastatin Drugs 0.000 description 1
- VGYFMXBACGZSIL-MCBHFWOFSA-N pitavastatin Chemical compound OC(=O)C[C@H](O)C[C@H](O)\C=C\C1=C(C2CC2)N=C2C=CC=CC2=C1C1=CC=C(F)C=C1 VGYFMXBACGZSIL-MCBHFWOFSA-N 0.000 description 1
- 210000004910 pleural fluid Anatomy 0.000 description 1
- 229920002401 polyacrylamide Polymers 0.000 description 1
- 230000008488 polyadenylation Effects 0.000 description 1
- 230000001124 posttranscriptional effect Effects 0.000 description 1
- 229960002965 pravastatin Drugs 0.000 description 1
- TUZYXOIXSAXUGO-PZAWKZKUSA-N pravastatin Chemical compound C1=C[C@H](C)[C@H](CC[C@@H](O)C[C@@H](O)CC(O)=O)[C@H]2[C@@H](OC(=O)[C@@H](C)CC)C[C@H](O)C=C21 TUZYXOIXSAXUGO-PZAWKZKUSA-N 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 230000035935 pregnancy Effects 0.000 description 1
- 238000004321 preservation Methods 0.000 description 1
- 238000002203 pretreatment Methods 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 239000000186 progesterone Substances 0.000 description 1
- 229960003387 progesterone Drugs 0.000 description 1
- 239000000583 progesterone congener Substances 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 230000035752 proliferative phase Effects 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 239000013074 reference sample Substances 0.000 description 1
- 108091008146 restriction endonucleases Proteins 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 239000002342 ribonucleoside Substances 0.000 description 1
- 108091092562 ribozyme Proteins 0.000 description 1
- 238000005096 rolling process Methods 0.000 description 1
- 229960000672 rosuvastatin Drugs 0.000 description 1
- BPRHUIZQVSMCRT-VEUZHWNKSA-N rosuvastatin Chemical compound CC(C)C1=NC(N(C)S(C)(=O)=O)=NC(C=2C=CC(F)=CC=2)=C1\C=C\[C@@H](O)C[C@@H](O)CC(O)=O BPRHUIZQVSMCRT-VEUZHWNKSA-N 0.000 description 1
- 238000007480 sanger sequencing Methods 0.000 description 1
- 238000007423 screening assay Methods 0.000 description 1
- 238000007789 sealing Methods 0.000 description 1
- 239000004065 semiconductor Substances 0.000 description 1
- 238000007841 sequencing by ligation Methods 0.000 description 1
- 208000005893 serous cystadenoma Diseases 0.000 description 1
- 230000007727 signaling mechanism Effects 0.000 description 1
- 229960002855 simvastatin Drugs 0.000 description 1
- RYMZZMVNJRMUDD-HGQWONQESA-N simvastatin Chemical compound C([C@H]1[C@@H](C)C=CC2=C[C@H](C)C[C@@H]([C@H]12)OC(=O)C(C)(C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 RYMZZMVNJRMUDD-HGQWONQESA-N 0.000 description 1
- 238000007860 single-cell PCR Methods 0.000 description 1
- 108091029842 small nuclear ribonucleic acid Proteins 0.000 description 1
- 239000012453 solvate Substances 0.000 description 1
- 238000011895 specific detection Methods 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 150000003457 sulfones Chemical class 0.000 description 1
- 230000000153 supplemental effect Effects 0.000 description 1
- 238000005382 thermal cycling Methods 0.000 description 1
- 150000003568 thioethers Chemical class 0.000 description 1
- 229940113082 thymine Drugs 0.000 description 1
- 230000002103 transcriptional effect Effects 0.000 description 1
- 230000001052 transient effect Effects 0.000 description 1
- 229960004824 triptorelin Drugs 0.000 description 1
- VXKHXGOKWPXYNA-PGBVPBMZSA-N triptorelin Chemical compound C([C@@H](C(=O)N[C@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)NCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 VXKHXGOKWPXYNA-PGBVPBMZSA-N 0.000 description 1
- 230000005760 tumorsuppression Effects 0.000 description 1
- 238000002604 ultrasonography Methods 0.000 description 1
- 238000012285 ultrasound imaging Methods 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 229940035893 uracil Drugs 0.000 description 1
- 206010046811 uterine polyp Diseases 0.000 description 1
- 230000035899 viability Effects 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 239000011782 vitamin Substances 0.000 description 1
- 235000013343 vitamin Nutrition 0.000 description 1
- 229940088594 vitamin Drugs 0.000 description 1
- 229930003231 vitamin Natural products 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 230000005186 women's health Effects 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/689—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids related to pregnancy or the gonads
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6883—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/5308—Immunoassay; Biospecific binding assay; Materials therefor for analytes not provided for elsewhere, e.g. nucleic acids, uric acid, worms, mites
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/106—Pharmacogenomics, i.e. genetic variability in individual responses to drugs and drug metabolism
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/112—Disease subtyping, staging or classification
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/158—Expression markers
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/178—Oligonucleotides characterized by their use miRNA, siRNA or ncRNA
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/36—Gynecology or obstetrics
- G01N2800/364—Endometriosis, i.e. non-malignant disorder in which functioning endometrial tissue is present outside the uterine cavity
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Immunology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biomedical Technology (AREA)
- Analytical Chemistry (AREA)
- Hematology (AREA)
- Urology & Nephrology (AREA)
- General Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Biochemistry (AREA)
- Physics & Mathematics (AREA)
- Pathology (AREA)
- Microbiology (AREA)
- Biotechnology (AREA)
- Medicinal Chemistry (AREA)
- Wood Science & Technology (AREA)
- Food Science & Technology (AREA)
- General Physics & Mathematics (AREA)
- Cell Biology (AREA)
- Genetics & Genomics (AREA)
- Zoology (AREA)
- Reproductive Health (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pregnancy & Childbirth (AREA)
- Gynecology & Obstetrics (AREA)
- Biophysics (AREA)
- General Engineering & Computer Science (AREA)
- Tropical Medicine & Parasitology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Endocrinology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
Abstract
본원에는 자궁내막증과 관련된 적어도 하나의 miRNA의 발현 수준을 기반으로, 필요로 하는 대상체에서 자궁내막증을 진단, 평가, 및 특성화하기에 유용한 조성물 및 방법이 개시된다.
Description
관련 출원에 대한 상호 참조
본 출원은 2016년 8월 30일에 출원된, 미국 가특허출원 일련 번호 62/381,130으로부터의 우선권을 주장하며, 상기 출원의 전체 내용은 본원에 참조로 포함된다.
기술분야
본 발명은 자궁내막증에 대한 바이오마커로서의 마이크로RNA에 관한 것이다.
마이크로RNA(miRNA)는 19 내지 24개의 뉴클레오타이드의 고도로 보존된 작은 내인성 비암호화(noncoding), 기능성 RNA 분자 부류이다; 그것들은 상보적인 부위에 염기쌍을 이룸으로써 표적화된 RNA의 번역 및 안정성을 제어하고 메신저 RNA 전사물의 억제 또는 분해를 유도한다(Bartel et al., 2009, Cell, 136:215-233). 그것들은 다양한 생물학적 과정의 발달의 조절 및 세포 항상성에서 중심적인 역할을 한다(Hassan et al., 2015, Bone, 81:746-756). 그것들은 세포내에뿐만 아니라 혈청에도 존재하며(Corcoran et al., 2011, Clin Chem, 57(1):18-32), 그것들을 다양한 질환의 진단을 위한 유망한 바이오마커(biomarker) 후보로 만드는 특이적 특성들을 가진다(Sayed et al., 2014, Heart Lung Cir,23:503-510, Coskun et al., 2012, World J Gastroenterol, 18:4629-4634, Dorval et al., 2013, Front Mol Neurosci, 6:24, Jin et al., 2013, Cell Mol Neurobiol, 5:601-613, Liu et al., 2014, World J Gastroenterol, 20:12007-12017, Ulivi et al., 2014, Molecules, 19:8220-8237, Zhu et al., 2014, Front Genet, 5:149, Bandiera et al., 2015, J Hepatol, 62:448-457). 세포-유리(cell-free) miRNA는 혈청 및 혈장, 소변, 및 타액을 포함한 여러 체액에 안정적으로 존재한다(Chen et al., 2008, Cell Res, 18:997-1006). 혈청 miRNA 발현은 안정적이고, 복제가 가능하며, 개인들 간에 일관된다. 특이적 발현 패턴은 암을 포함한 수많은 질환에 대한 바이오마커로서 확인되었다(Schwarzenbach et al., 2014, Nat Rev ClinOncol, 11:145-156). miRNA는 그것들이 막 소포 내(Gallo et al., 2012, PLoS One, 7: e30679), 또는 단백질 복합체에 결합되어(Turchinovich et al., 2011, Nucleic Acids Res, 39:7223-7233, Arroyo et al., 2011, Proc Natl Acad Sci U S A, 108:5003-5008) 세포로부터 세포외 공간(extracellular space)으로 방출되기 때문에 안정적인 채로 유지된다. 혈액 중의 miRNA 수준의 변경은 정상적인 생리적 과정 중의 변화를 반영하는 것일 수 있고(Lai et al., 2014, Aging Cell, 13:679-689, Redni et al., 2011, Front Genet, 2:49) 부인과 질환을 포함한 여러 병리적 상태에 관련되어 있다(Zhao et al., 2012, Clin Chem, 58:896-905, Murriet al., 2013, J Clin Endocrinol Metab, 98:E1835-1844).
자궁내막증(Endometriosis)은 통상적인 부인과 질환으로, 생식가능연령 여성의 10%에 영향을 미친다(Taylor et al., 2011, ReprodSci, 18(9):814-823). 그것은 자궁강(uterine cavity) 외부에서 자궁내막 세포의 침적 및 증식을 특징으로 한다(Giudice et al., 2010, N Engl J Med, 362:2389-2398,Bulun et al., 2009, N Engl J Med, 360:268-279). 자궁내막증의 주요 증상은 환자의 50%에서의 골반 통증(Eskenazi et al., 1997, ObstetGynecolClin North Am, 24:235-258) 및 환자의 40 내지 50%에서의 불임(Ozkan et al., 2008, Ann N Y Acad Sci, 1127:92-100, Moradi et al., 2014, BMC Womens Health, 14:123)이다. 유감스럽게도, 현재 활용 가능한 이 질환의 정확한 혈청 바이오마커는 없다. 초음파와 같은 영상화 기법들은 자궁내막증의 진단 및 병기 결정(staging)에 있어 신뢰할 수 없다(Dunselman et al., 2014, Hum Reprod, 29:400-412). 자궁내막증의 확정적 진단은 종종 복강경 검사(laparascopy)에 의한 병변의 직접 시각화 및 병리의 확인에 의해 질환의 마지막 단계에서만 이루어진다. 자궁내막증의 성공적인 치료의 주요 장애물은 초기 단계에서 진단의 실패이다. 자궁내막증-특이적 바이오마커에 대한 간단한 혈액 테스트는 질환의 보다 시기적절하고 정확한 진단을 제공할 수 있을 것이며, 조기 치료 개입으로 이어질 수 있다. 비록 그러한 바이오마커를 확인하기 위해 상당한 노력이 있었지만(Wang et al., 2012, ClinChem Lab Med, 50:1423-1428, Jia et al., 2013, Hum Reprod, 28:322-330, Suryawanshi et al., 2013, Clin Cancer Res, 19:1213-1224), 그러한 비침습적 진단 도구에 대한 분명한 선택은 확인된 바 없다. 혈청 CA-125가 자궁내막증에 걸린 일부 여성에서는 상승하지만, 특이적인 것은 아니며 빈약한 민감도 및 특이도를 가진다. 상기에서 기술된 것과 같이, miRNA는 여러 질환에 대한 바이오마커로서 세심하게 평가되어 왔으며; 그것들은 자궁내막증의 진단 마커에 대한 조짐을 갖고 있다.
자궁내막증이 모든 생식가능연령 여성의 10%, 및 불임 여성의 20 내지 50%에 존재한다는 사실에도 불구하고, 아직 활용할 수 있는 자궁내막증에 대한 확실한 진단용 바이오마커는 없다. 영상화 기법, 예컨대 초음파 및 자기 공명 영상은 이 질환의 진단 또는 병기 결정에는 신뢰할 수 없는 것으로 밝혀졌다. 수술 절차를 통한 병변의 직접 시각화 및 조직학적 확인이 현재 자궁내막증의 확정적 진단에 필수적이며, 전신마취(general anesthesia), 발달된 수술적 기술, 수술 비용, 및 잠재적 합병증의 위험을 요구한다.
그러므로, 자궁내막증에 대한 새로운 비침습적 진단 마커의 개발은 질환의 초기 진단 및 적절한 치료 및 관리에 중대하다. 그러므로 당업계에는 자궁내막증의 비침습적 바이오마커에 대한 개선된 조성물 및 방법에 대한 필요성이 있다. 본 발명은 이러한 충족되지 않는 필요성을 만족시킨다.
본 발명은 자궁내막증을 가진 것으로 의심되는 여성 대상체에서 자궁내막증을 검출, 진단, 및/또는 예측하는 신규한 방법, 뿐만 아니라 자궁내막증을 치료하는 신규한 방법을 제공한다. 본원에 제공된 많은 방법은 일반적으로 혈액, 혈청, 또는 타액과 같은 샘플에서 miRNA 바이오마커를 검출하는 것에 관련된다. 이와 같이, 상기 방법은 자궁내막증을 검출하기 위한 비침습적 또는 최소-침습적 검정에 사용될 수 있고 많은 여성 환자들이 자궁내막 조직의 생검과 같은 보다 침습적인 과정을 피하는 것을 도울 수 있다. 상기 방법은 또한 초기 진단을 촉진할 수 있고 환자가 보다 중증이거나 심각한 증상들을 나타내기 전에, 초기 단계에서 자궁내막증의 치료를 촉진할 수 있다.
한 측면으로, 본 발명은 자궁내막증을 가진 것으로 의심되는 대상체를 진단하는 방법을 제공하며, 그 방법은 (a) 대상체로부터 타액, 가래, 소변, 림프액, 활액, 뇌척수액, 대변, 또는 점액 샘플을 제공하는 단계로서, 상기 타액, 가래, 소변, 림프액, 활액, 뇌척수액, 대변, 또는 점액 샘플은 자궁내막증과 관련된 miRNA를 포함하며; (b) 자궁내막증과 관련된 상기 miRNA의 수준을 검출하는 단계; (c) 상기 타액, 가래, 소변, 림프액, 활액, 뇌척수액, 대변, 또는 점액 샘플 중의 자궁내막증과 관련된 miRNA의 상대적인 수준을 측정하기 위하여 자궁내막증과 관련된 상기 miRNA의 검출된 수준을 기준값과 비교하는 단계; 및 (d) 상기 타액, 가래, 소변, 림프액, 활액, 뇌척수액, 대변, 또는 점액 샘플 중의 자궁내막증과 관련된 상기 miRNA의 상대적인 수준을 기반으로 상기 대상체를 자궁내막증으로 진단하는 단계로서, 이때 상기 대상체를 자궁내막증으로 진단하는 것은 90%보다 큰 특이도 또는 민감도를 가지는 것인 단계를 포함한다.
일부 구체예에서, 상기 샘플은 유체이다. 다른 구체예에서, 상기 샘플은 혈액, 혈장, 또는 혈청이다. 또 다른 구체예에서, 상기 샘플은 타액이다. 또 다른 구체예에서, 상기 샘플은 세포-유리 샘플이다.
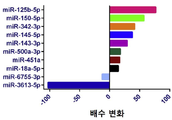
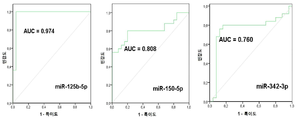
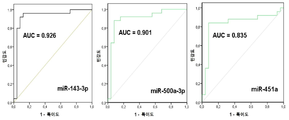
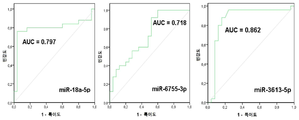
다른 구체예에서, 상기 miRNA는 miR-125, miR-451, 및 miR-3613으로 구성되는 군으로부터 선택된다. 또 다른 구체예에서, 상기 miRNA는 miR-125b이다. 또 다른 구체예에서, 상기 miRNA는 miR-125b-5p이다. 또 다른 구체예에서, 상기 miRNA는 miR-451a이다. 또 다른 구체예에서, 상기 miRNA는 miR-3613-5p이다. 일부 구체예에서, 적어도 하나의 miRNA는 let-7, let-7a, let-7b, let-7b-3p, let-7b-5p, let-7c, let-7d, let-7e, let-7f, 또는 let-7g이다. 일부 구체예에서, 상기 miRNA는 다음: miR-125b-5p, let-7b, miR-150, miR-342, 및 miR-3613 중 적어도 2개이다. 일부 구체예에서, 상기 기준값은 자궁내막증을 갖지 않은 대상체로부터의 샘플 중에 적어도 하나의 miRNA가 존재하는 것이다.
다른 측면으로, 본 발명은 miRNA를 검출하는 방법을 제공하는데, 그 방법은 (a) 대상체로부터 타액, 가래, 소변, 림프액, 활액, 뇌척수액, 대변, 또는 점액 샘플을 제공하는 단계로서, 상기 샘플은 핵산을 포함하며 상기 대상체는 자궁내막증을 가진 것으로 의심되는 것인 단계; (b) 상기 샘플 중의 적어도 하나의 miRNA의 존재를 검출하기 위하여 상기 핵산에 대해 증폭 또는 서열분석 반응을 수행하는 단계로로서, 상기 적어도 하나의 miRNA는 miR-18, miR-125, miR-126, miR-143, miR-145, miR-150, miR-214, miR-342, miR-451, miR-500, miR-553, miR-3613, miR-4668, 및 miR-6755로 구성되는 군으로부터 선택되는 것인 단계; 및 (c) 상기 miRNA의 존재를 기준값에 비교하는 단계를 포함한다.
일부 구체예에서, 상기 샘플은 유체이다. 다른 구체예에서, 상기 샘플은 혈액, 혈장, 또는 혈청이다. 또 다른 구체예에서, 상기 샘플은 타액이다. 또 다른 구체예에서, 상기 샘플은 세포-유리이다.
다른 구체예에서, 상기 miRNA는 miR-125, miR-451, 및 miR-3613으로 구성되는 군으로부터 선택된다. 또 다른 구체예에서, 상기 miRNA는 miR-125b이다. 또 다른 구체예에서, 상기 miRNA는 miR-125b-5p이다. 또 다른 구체예에서, 상기 miRNA는 miR-451a이다. 또 다른 구체예에서, 상기 miRNA는 miR-3613-5p이다. 일부 구체예에서, 상기 miRNA는 다음: miR-125b-5p, let-7b, miR-150, miR-342, 및 miR-3613 중 적어도 2개이다. 일부 구체예에서, 상기 기준값은 자궁내막증을 갖지 않은 대상체로부터의 샘플 중에 적어도 하나의 miRNA가 존재하는 것이다.
또 다른 측면으로, 본 발명은 (a) 대상체로부터 샘플을 제공하는 단계로서, 상기 샘플은 핵산을 포함하고 상기 대상체는 자궁내막증을 가진 것으로 의심되는 것인 단계; (b) 상기 샘플 중의 적어도 하나의 miRNA의 존재를 검출하기 위하여 상기 핵산에 대해 서열분석 반응을 수행하는 단계로서, 상기 적어도 하나의 miRNA는 miR-18, miR-125, miR-126, miR-143, miR-145, miR-150, miR-214, miR-342, miR-451, miR-500, miR-553, miR-3613, miR-4668, 및 miR-6755로 구성되는 군으로부터 선택되는 것인 단계; 및 (c) 상기 miRNA의 존재를 기준값에 비교하는 단계를 포함하는 방법을 제공한다. 일부 구체예에서, 상기 적어도 하나의 miRNA는 고처리량 또는 대량-병렬 서열분석에 의해 검출된다. 일부 구체예에서, 상기 miRNA는 다음: miR-125b-5p, miR-451a, 및 miR-3613-5p 중 적어도 하나, 적어도 2개 또는 전부이다. 일부 구체예에서, 상기 miRNA는 다음: miR-125b-5p, let-7b, miR-150, miR-342, 및 miR-3613의 적어도 하나 또는 전부이다. 일부 구체예에서, 상기 miRNA는 다음: miR-125b-5p, let-7b, miR-150, miR-342, 및 miR-3613 중 적어도 2개이다.
또 다른 측면으로, 본 발명은 자궁내막증의 증상을 나타내는 또는 자궁내막증을 가진 것으로 의심되는 대상체를 진단하는 방법을 제공하며, 그 방법은 (a) let-7, miR-135, miR-449a, miR-34c, miR-200a, miR-200b, miR-141, miR-125b-5p, miR-150-5p, miR-342-3p, miR-145-5p, miR-143-3p, miR-500a-3p, miR-451a, miR-18a-5p, miR-6755-3p, 또는 miR-3613-5p가 아닌 적어도 하나의 miRNA의 존재를 검출하는 단계; 및 (b) 검출된 상기 miRNA 수준이 한계 수준을 초과할 때 대상체를 자궁내막증으로 진단하는 단계를 포함하며, 여기서 대상체를 자궁내막증으로 진단하는 것은 90%보다 큰 특이도 또는 민감도를 가진다. 일부 구체예에서, 본 발명은 (a) let-7, let-7a, let-7b, let-7c, let-7d, let-7e, let-7f, let-7g, miR-17-5p, miR-20a, miR-22, miR-135a, miR-135b, miR-135, miR-449a, miR-34c, miR-199a, miR-122, miR-145, miR-141, miR-542-3p, miR-9, miR-200a, miR-200a-3p, miR-200b-3p, miR-200b, miR-141, miR-141-3p, miR-125b-5p, miR-150-5p, miR-342-3p, miR-145-5p, miR-143-3p, miR-500a-3p, miR-451a, miR-18a-5p, miR-6755-3p, 또는 miR-3613-5p가 아닌 적어도 하나의 miRNA의 존재를 검출하는 단계를 포함하는 방법을 제공한다.
일부 구체예에서, 상기 miRNA는 세포-유리이다. 일부 구체예에서, 상기 miRNA는 세포-유리 샘플, 예컨대 세포-유리 혈장, 혈청, 타액 및/또는 소변에 존재한다.
일부 구체예에서, 상기 대상체를 자궁내막증으로 진단하는 단계는 대상체를 초기 단계 자궁내막증으로 진단하는 단계이다. 다른 구체예에서, 상기 대상체를 자궁내막증으로 진단하는 단계는 대상체를 중등도 내지 중증 질환으로 진단하는 단계이다. 또 다른 구체예에서, 상기 대상체를 자궁내막증으로 진단하는 단계는 대상체를 단계 III 또는 단계 IV 자궁내막증으로 진단하는 단계이다. 또 다른 구체예에서, 상기 대상체를 자궁내막증으로 진단하는 단계는 추가로 치료 후 miRNA 발현 수준의 변화에 대해 대상체를 모니터링하는 단계를 포함한다.
다른 구체예에서, 상기 대상체를 자궁내막증으로 진단하는 단계는 75%보다 큰, 80%보다 큰, 85%보다 큰, 90%보다 큰, 95%보다 큰, 또는 99%보다 큰 특이도 또는 민감도를 가진다. 또 다른 구체예에서, 상기 대상체를 자궁내막증으로 진단하는 단계는 95%보다 큰 특이도 또는 민감도를 가진다.
일부 구체예에서, 상기 방법은 추가로 자궁내막증에 대해 대상체를 치료하는 단계를 포함한다. 다른 구체예에서, 상기 치료는 통증을 완화시키기 위한 약물 치료이다. 또 다른 구체예에서, 상기 치료는 호르몬 요법이다. 또 다른 구체예에서, 상기 치료는 호르몬 피임제이다. 또 다른 구체예에서, 상기 치료는 생식샘 자극호르몬-방출 호르몬 작용물질(agonist)이다. 또 다른 구체예에서, 치료는 생식샘 자극호르몬-방출 호르몬 길항물질(antagonist)이다.
일부 구체예에서, 검출하는 단계는 (i) 적어도 하나의 miRNA에 특이적으로 결합하는 프라이머를 사용하는 또는 보편적인 프라이머를 사용하는 역전사 검정을 수행함으로써 샘플 내의 miRNA를 증폭시켜서 cDNA를 생성하는 단계; (ii) 생성된 상기 cDNA를 적어도 하나의 miRNA에 특이적인 프로브와 접촉시키는 단계로서, 상기 프로브는 생성된 상기 cDNA와 결합할 때 신호를 방출하는 단계; 및 (iii) 검출기를 사용하여 상기 프로브에 의해 방출된 신호를 검출하는 단계를 포함한다.
추가의 측면으로, 본 발명은 miRNA를 검출하는 방법을 제공하며, 그 방법은 (a) 대상체로부터 샘플을 제공하는 단계로서, 상기 샘플은 핵산을 포함하고 상기 대상체는 자궁내막증을 가진 것으로 의심되는 것인 단계; (b) 상기 핵산에 대해 증폭, 마이크로어레이(microarray) 또는 서열분석 반응을 수행하는 단계; (c) 상기 샘플 중의 적어도 하나의 miRNA의 존재를 검출하는 단계로서, 상기 적어도 하나의 miRNA는 miR-126, miR-214, miR-553, 및 miR-4668로 구성되는 군으로부터 선택되는 것인 단계; 및 (d) 상기 miRNA의 존재를 기준값과 비교하는 단계를 포함한다. 일부 구체예에서, 상기 샘플은 유체이다. 다른 구체예에서, 상기 샘플은 혈액, 혈장, 타액, 또는 혈청이다. 일부 구체예에서, 상기 기준값은 자궁내막증을 갖지 않은 대상체로부터의 샘플 중에 적어도 하나의 miRNA가 존재하는 것이다.
일부 구체예에서, 상기 검출하는 단계는 중합효소 연쇄 반응(PCR)에 의한 것이다. 다른 구체예에서, 상기 검출하는 단계는 정량적 PCR에 의한 것이다. 일부 구체예에서, 상기 검출하는 단계는 실시간 PCR에 의한 것이다. 다른 구체예에서, 상기 검출하는 단계는 특유한 프라이머를 적어도 하나의 miRNA에 또는 적어도 하나의 miRNA로부터 유래된 cDNA에 혼성화시키는 단계를 포함한다. 또 다른 구체예에서, 상기 검출하는 단계는 적어도 하나의 miRNA에 특이적인 적어도 하나의 프라이머 또는 프로브를 사용하여 또는 적어도 하나의 보편적 프라이머를 사용하여 역전사 반응을 적어도 하나의 miRNA에 대해 수행하는 단계를 추가로 포함한다. 또 다른 구체예에서, 상기 검출하는 단계는 (i) 적어도 하나의 miRNA에 특이적으로 결합하는 프라이머를 사용하는 또는 보편적 프라이머를 사용하는 역전사 검정을 수행함으로써 샘플 내의 miRNA를 증폭시켜서 cDNA를 생성시키는 단계; (ii) 생성된 상기 cDNA를 신호를 방출하는 인터컬레이팅 다이(intercalating dye)와 접촉시키는 단계; 및 (iii) 검출기를 사용하여 시간 경과에 따라 방출된 상기 신호를 검출하는 단계를 포함한다. 또 다른 구체예에서, 상기 검출하는 단계는 (i) 적어도 하나의 miRNA에 특이적으로 결합하는 프라이머를 사용하는 또는 보편적 프라이머를 사용하는 역전사 검정을 수행함으로써 샘플 내의 miRNA를 증폭시켜서 cDNA를 생성시키는 단계; (ii) 생성된 상기 cDNA를 적어도 하나의 miRNA에 특이적인 프로브와 접촉시키는 단계로서, 상기 프로브는 생성된 상기 cDNA에 결합할 때 신호를 방출하는 것인 단계; 및 (iii) 검출기를 사용하여 상기 프로브에 의해 방출된 신호를 검출하는 단계를 포함한다. 또 다른 구체예에서, 상기 프로브는 형광발색단 및 소광물질(quencher)에 부착된다. 또 다른 구체예에서, 상기 검출하는 단계는 서열분석에 의한 것이다.
일부 구체예에서, 상기 자궁내막증은 적어도 하나의 miRNA가 기준값보다 적어도 2배 더 클 때 진단된다. 다른 구체예에서, 상기 자궁내막증은 적어도 하나의 miRNA가 기준값보다 적어도 2배 더 적을 때 진단된다. 또 다른 구체예에서, 상기 자궁내막증은 miRNA-125b-5p가 상향조절되거나, miR-150-5p가 상향조절되거나, miR-342-3p가 상향조절되거나, miR-145-5p가 상향조절되거나, miR-143-3p가 상향조절되거나, miR-500a-3p가 상향조절되거나, 또는 miR-18a-5p가 상향조절되는 때 진단된다. 또 다른 구체예에서, 상기 자궁내막증은 적어도 3개의 miRNA가 상향조절되는 때 진단되고, 이때 적어도 3개의 miRNA는 miRNA-125b-5p, miR-150-5p, miR-342-3p, miR-145-5p, miR-143-3p, miR-500a-3p, 및 miR-18a-5p로 구성되는 군으로부터 유래된다. 또 다른 구체예에서, 상기 자궁내막증은 miR-6755-3p가 하향조절되거나 miR-3613-5p가 하향조절되는 때 진단된다. 또 다른 구체예에서, 상기 자궁내막증은 miR-125b-5p가 상향조절되고, miR-451a가 상향조절되고, miR-3613-5p가 하향조절되는 때 진단된다. 일부 구체예에서, 자궁내막증은 miR-125b-5p가 상향조절되는 때 진단된다. 일부 구체예에서, 상기 자궁내막증은 let-7b가 상향조절되는 때 진단된다.
일부 구체예에서, 상기 대상체는 KRAS 변종 대립유전자의 존재에 대해 음성이다. 다른 구체예에서, 상기 검출된 miRNA 수준이 질환의 중증도를 측정하기 위하여 사용된다. 다른 구체예에서, 상기 대상체는 인간 대상체이다.
또 추가의 측면으로, 본 발명은 자궁내막증에 걸린 대상체를 치료하는 방법을 제공하며, 그 방법은 비교기(comparator)와 비교하여 대상체의 생물학적 샘플 중의 miR-18a-5p, miR-125, miR-126, miR-143, miR-145, miR-150-5p, miR-214, miR-342, miR-451, miR-500, miR-553, miR-3613, miR-4668, 및 miR-6755로 구성되는 군으로부터 선택된 적어도 하나의 miRNA의 차등 수준을 가지는 것으로 확인된 대상체에게 자궁내막증 치료를 투여하는 단계를 포함한다. 일부 구체예에서, 상기 방법은 대상체가 비교기와 비교하여, miR-18a-5p, miR-125, miR-126, miR-143, miR-145, miR-150-5p, miR-214, miR-342, miR-451, miR-500, miR-553, miR-3613, miR-4668, 및 miR-6755로 구성되는 군으로부터 선택된 적어도 하나의 miRNA의 차등 수준을 가지는 것으로 확인될 때 상기 대상체를 자궁내막증으로 진단하는 단계를 추가로 포함한다.
일부 구체예에서, 대상체를 자궁내막증으로 진단하는 단계는 상기 대상체로부터 생물학적 샘플을 제공하는 단계 및 생물학적 샘플에서 비교기와 비교하여, miR-18a-5p, miR-125, miR-126, miR-143, miR-145, miR-150-5p, miR-214, miR-342, miR-451, miR-500, miR-553, miR-3613, miR-4668, 및 miR-6755로 구성되는 군으로부터 선택된 적어도 하나의 miRNA의 차등 수준을 검출하는 단계를 포함한다. 일부 구체예에서, 상기 적어도 하나의 miRNA는 다음: miR-125b-5p, miR-451a, 및 miR-3613-5p 중 적어도 하나, 적어도 2개, 또는 전부이다. 일부 구체예에서, 상기 적어도 하나의 miRNA는 다음: miR-125b-5p, let-7b, miR-150, miR-342, 및 miR-3613 중 적어도 하나 또는 전부이다. 일부 구체예에서, 상기 적어도 하나의 miRNA는 다음: miR-125b-5p, let-7b, miR-150, miR-342, 및 miR-3613 중 적어도 2개이다.
일부 구체예에서, 상기 생물학적 샘플은 체액이다. 일부 구체예에서, 상기 체액은 혈액, 혈장, 또는 혈청이다. 일부 구체예에서, 상기 체액은 타액이다. 일부 구체예에서, 상기 체액은 소변이다.
일부 구체예에서, 상기 대상체를 자궁내막증으로 진단하는 단계는 상기 대상체를 초기 단계 자궁내막증으로 진단하는 단계이다. 다른 구체예에서, 상기 대상체를 자궁내막증으로 진단하는 단계는 상기 대상체를 중등도 내지 중증 질환으로 진단하는 단계이다. 또 다른 구체예에서, 상기 대상체를 자궁내막증으로 진단하는 단계는 상기 대상체를 단계 III 또는 단계 IV 자궁내막증으로 진단하는 단계이다. 또 다른 구체예에서, 상기 대상체를 자궁내막증으로 진단하는 단계는 치료 후 miRNA 발현 수준의 변화에 대해 상기 대상체를 모니터링하는 단계를 추가로 포함한다.
일부 구체예에서, 상기 대상체를 자궁내막증으로 진단하는 단계는 95%보다 큰 특이도 또는 민감도를 가진다. 다른 구체예에서, 상기 치료는 통증을 완화시키기 위한 약물 치료이다. 또 다른 구체예에서, 상기 치료는 호르몬 요법이다. 또 다른 구체예에서, 상기 치료는 호르몬 피임제, 생식샘 자극호르몬-방출 호르몬 작용물질, 및 생식샘 자극호르몬-방출 호르몬 길항물질로 구성되는 군으로부터 선택된다.
일부 구체예에서, 방법은 중합효소 연쇄 반응(PCR)을 수행함으로써 적어도 하나의 miRNA를 검출하는 단계를 추가로 포함한다. 일부 구체예에서, 방법은 정량적(quantitative) PCR을 수행함으로써 적어도 하나의 miRNA를 검출하는 단계를 추가로 포함한다. 일부 구체예에서, 상기 방법은 (i) 적어도 하나의 miRNA에 특이적으로 결합하는 프라이머를 사용하는 또는 보편적 프라이머를 사용하는 역전사 검정을 수행함으로써 샘플 내의 miRNA를 증폭시켜서 cDNA를 생성시키는 단계; (ii) 생성된 상기 cDNA를 신호를 방출하는 인터컬레이팅 다이(intercalating dye)와 접촉시키는 단계; 및 (iii) 검출기를 사용하여 시간에 따라 방출된 상기 신호를 검출하는 단계에 의해 적어도 하나의 miRNA를 검출하는 단계를 추가로 포함한다. 다른 구체예에서, 상기 방법은 (i) 적어도 하나의 miRNA에 특이적으로 결합하는 프라이머를 사용하는 또는 보편적 프라이머를 사용하는 역전사 검정을 수행함으로써 샘플 내의 miRNA를 증폭시켜서 cDNA를 생성시키는 단계; (ii) 생성된 상기 cDNA를 적어도 하나의 miRNA에 특이적인 프로브와 접촉시키는 단계로서, 상기 프로브는 생성된 상기 cDNA에 결합할 때 신호를 방출하는 것인 단계; 및 (iii) 검출기를 사용하여 상기 프로브에 의해 방출된 신호를 검출하는 단계에 의하여 적어도 하나의 miRNA를 검출하는 단계를 추가로 포함한다. 또 다른 구체예에서, 방법은 서열분석에 의하여 적어도 하나의 miRNA를 검출하는 단계를 추가로 포함한다. 또 다른 구체예에서, 상기 방법은 고처리량 서열분석 또는 대량 병렬 서열분석에 의하여 적어도 하나의 miRNA를 검출하는 단계를 추가로 포함한다.
일부 구체예에서, 상기 적어도 하나의 miRNA는 기준값보다 적어도 2배 더 큰 수준으로 존재한다. 일부 구체예에서, 상기 대상체는 KRAS 변종 대립유전자의 존재에 대해 음성이다. 일부 구체예에서, 상기 대상체는 인간 대상체이다. 일부 구체예에서, 상기 적어도 하나의 miRNA의 수준이 질환의 중증도를 측정하기 위해 사용된다.
일부 구체예에서, 상기 자궁내막증은 miRNA-125b-5p가 상향조절되거나, miR-150-5p가 상향조절되거나, miR-342-3p가 상향조절되거나, miR-145-5p가 상향조절되거나, miR-143-3p가 상향조절되거나, miR-500a-3p가 상향조절되거나, 또는 miR-18a-5p가 상향조절되는 때 진단된다. 다른 구체예에서, 상기 자궁내막증은 적어도 3개의 miRNA가 상향조절되는 때 진단되고, 여기서 적어도 3개의 miRNA는 miRNA-125b-5p, miR-150-5p, miR-342-3p, miR-145-5p, miR-143-3p, miR-500a-3p, 및 miR-18a-5p로 구성되는 군으로부터 유래된다. 또 다른 구체예에서, 상기 자궁내막증은 miR-6755-3p가 하향조절되거나 또는 miR-3613-5p가 하향조절되는 때 진단된다. 또 다른 구체예에서, 상기 자궁내막증은 miR-125b-5p가 상향조절되고, miR-451a가 상향조절되며, miR-3613-5p가 하향조절되는 때 진단된다. 다른 구체예에서, 상기 자궁내막증은 miR-125b-5p가 상향조절되는 때 진단된다.
추가의 측면으로, 본 발명은 자궁내막증을 가진 것으로 의심되는 대상체를 진단하고 치료하는 방법을 제공하며, 그 방법은 (a) 대상체로부터 타액, 가래, 소변, 림프액, 활액, 뇌척수액, 대변, 또는 점액 샘플을 제공하는 단계로서, 상기 샘플은 자궁내막증과 관련된 miRNA를 포함하는 것인 단계; (b) 상기 자궁내막증과 관련된 miRNA의 수준을 검출하는 단계; (c) 유체 샘플 중의 자궁내막증과 관련된 miRNA의 상대적인 수준을 측정하기 위하여 상기 자궁내막증과 관련된 miRNA의 검출된 수준을 기준값과 비교하는 단계; (d) 상기 타액, 가래, 소변, 림프액, 활액, 뇌척수액, 대변 또는 점액 샘플 중의 자궁내막증과 관련된 miRNA의 상대적인 수준을 기반으로 상기 대상체를 자궁내막증으로 진단하는 단계로서, 상기 대상체를 자궁내막증으로 진단하는 단계는 90%보다 큰 민감도 또는 특이도를 가지는 것인 단계; 및 (e) 자궁내막증으로 진단된 상기 대상체에게 치료를 투여하는 단계를 포함한다.
일부 구체예에서, 상기 대상체로부터의 샘플은 타액 샘플이다. 일부 경우에, 대상체로부터의 샘플은 소변 샘플이다. 일부 경우에, 대상체로부터의 샘플은 점액 샘플이다.
일부 구체예에서, 상기 대상체를 자궁내막증으로 진단하는 단계는 대상체를 초기 단계 자궁내막증으로 진단하는 단계이다. 다른 구체예에서, 상기 대상체를 자궁내막증으로 진단하는 단계는 대상체를 중등도 내지 중증 질환으로 진단하는 단계이다. 또 다른 구체예에서, 상기 대상체를 자궁내막증으로 진단하는 단계는 상기 대상체를 단계 III 또는 단계 IV 자궁내막증으로 진단하는 단계이다. 또 다른 구체예에서, 상기 대상체를 자궁내막증으로 진단하는 단계는 치료 후에 miRNA 발현 수준의 변화에 대하여 상기 대상체를 모니터링하는 단계를 추가로 포함한다.
일부 구체예에서, 상기 대상체를 자궁내막증으로 진단하는 단계는 95%보다 큰 특이도 또는 민감도를 가진다. 다른 구체예에서, 상기 치료는 통증을 완화시키기 위한 약물 치료이다. 또 다른 구체예에서, 상기 치료는 호르몬 요법이다. 또 다른 구체예에서, 상기 치료는 호르몬 피임제, 생식샘 자극호르몬-방출 호르몬 작용물질, 및 생식샘 자극호르몬-방출 호르몬 길항물질로 구성되는 군으로부터 선택된다.
일부 구체예에서, 상기 방법은 중합효소 연쇄 반응(PCR)을 수행함으로써 적어도 하나의 miRNA를 검출하는 단계를 추가로 포함한다. 일부 구체예에서, 상기 방법은 정량적 PCR을 수행함으로써 적어도 하나의 miRNA를 검출하는 단계를 추가로 포함한다. 일부 구체예에서, 상기 방법은 (i) 적어도 하나의 miRNA에 특이적으로 결합하는 프라이머를 사용하는 또는 보편적 프라이머를 사용하는 역전사 검정을 수행함으로써 샘플 내의 miRNA를 증폭시켜서 cDNA를 생성시키는 단계; (ii) 생성된 상기 cDNA를 신호를 방출하는 인터컬레이팅 다이(intercalating dye)와 접촉시키는 단계; 및 (iii) 검출기를 사용하여 시간에 따라 방출된 상기 신호를 검출하는 단계에 의해 적어도 하나의 miRNA를 검출하는 단계를 추가로 포함한다. 다른 구체예에서, 상기 방법은 (i) 적어도 하나의 miRNA에 특이적으로 결합하는 프라이머를 사용하는 또는 보편적 프라이머를 사용하는 역전사 검정을 수행함으로써 샘플 내의 miRNA를 증폭시켜서 cDNA를 생성시키는 단계; (ii) 생성된 상기 cDNA를 적어도 하나의 miRNA에 특이적인 프로브와 접촉시키는 단계로서, 상기 프로브는 생성된 상기 cDNA에 결합할 때 신호를 방출하는 단계; 및 (iii) 검출기를 사용하여 상기 프로브에 의해 방출된 상기 신호를 검출하는 단계에 의하여 적어도 하나의 miRNA를 검출하는 단계를 추가로 포함한다. 또 다른 구체예에서, 상기 방법은 서열분석에 의하여 적어도 하나의 miRNA를 검출하는 단계를 추가로 포함한다. 또 다른 구체예에서, 상기 방법은 고처리량 서열분석 또는 대량 병렬 서열분석에 의하여 적어도 하나의 miRNA를 검출하는 단계를 추가로 포함한다.
일부 구체예에서, 상기 적어도 하나의 miRNA는 기준값보다 적어도 2배 더 큰 수준으로 존재한다. 일부 구체예에서, 상기 대상체는 KRAS 변종 대립유전자의 존재에 대하여 음성이다. 일부 구체예에서, 상기 대상체는 인간 대상체이다. 일부 구체예에서, 상기 적어도 하나의 miRNA의 수준은 질환의 중증도를 측정하기 위하여 사용된다.
일부 구체예에서, 상기 자궁내막증은 miRNA-125b-5p가 상향조절되거나, miR-150-5p가 상향조절되거나, miR-342-3p가 상향조절되거나, miR-145-5p가 상향조절되거나, miR-143-3p가 상향조절되거나, miR-500a-3p가 상향조절되거나, 또는 miR-18a-5p가 상향조절되는 때 진단된다. 다른 구체예에서, 상기 자궁내막증은 적어도 3개의 miRNA가 상향조절되는 때 진단되고, 이때 상기 적어도 3개의 miRNA는 miRNA-125b-5p, miR-150-5p, miR-342-3p, miR-145-5p, miR-143-3p, miR-500a-3p, 및 miR-18a-5p로 구성되는 군으로부터 유래된다. 다른 구체예에서, 상기 자궁내막증은 miR-6755-3p가 하향조절되거나 또는 miR-3613-5p가 하향조절되는 때 진단된다. 다른 구체예에서, 상기 자궁내막증은 miR-125b-5p가 상향조절되고, miR-451a가 상향조절되며, miR-3613-5p가 하향조절되는 때 진단된다. 다른 구체예에서, 상기 자궁내막증은 miR-125b-5p가 상향조절되는 때 진단된다.
추가의 측면으로, 본 발명은 자궁내막증을 가진 것으로 의심되는 대상체를 진단하고 치료하는 방법을 제공하며, 그 방법은 (a) let-7, miR-449a, miR-34c, miR-200a, miR-200b, miR-150, miR-18a, 또는 miR-141이 아닌 적어도 하나의 miRNA의 존재를 검출하는 단계; (b) 검출된 상기 miRNA 수준이 한계 수준을 초과할 때 대상체를 자궁내막증으로 진단하는 단계로서, 상기 대상체를 자궁내막증으로 진단하는 단계는 90%보다 큰 특이도 또는 민감도를 가지는 것인 단계; 및 (c) 자궁내막증으로 진단된 상기 대상체에게 치료를 투여하는 단계를 포함한다.
일부 구체예에서, 상기 적어도 하나의 miRNA는 miR-125b-5p, miR-451a, 및 miR-3613-5p를 포함한다. 다른 구체예에서, 상기 적어도 하나의 miRNA는 miR-125b-5p이다. 또 다른 구체예에서, 상기 적어도 하나의 miRNA는 miR-3613-5p이다. 또 다른 구체예에서, 상기 적어도 하나의 miRNA는 세포-유리 miRNA이다. 또 다른 구체예에서, 상기 적어도 하나의 miRNA는 비교기와 비교하여 적어도 2배 변화로 존재한다.
일부 구체예에서, 상기 대상체를 자궁내막증으로 진단하는 단계는 상기 대상체를 초기 단계 자궁내막증으로 진단하는 단계이다. 다른 구체예에서, 상기 대상체를 자궁내막증으로 진단하는 단계는 상기 대상체를 중등도 내지 중증 질환으로 진단하는 단계이다. 또 다른 구체예에서, 상기 대상체를 자궁내막증으로 진단하는 단계는 상기 대상체를 단계 III 또는 단계 IV 자궁내막증으로 진단하는 단계이다. 또 다른 구체예에서, 상기 대상체를 자궁내막증으로 진단하는 단계는 치료 후 miRNA 발현 수준의 변화에 대해 상기 대상체를 모니터링하는 단계를 추가로 포함한다.
일부 구체예에서, 상기 대상체를 자궁내막증으로 진단하는 단계는 95%보다 큰 특이도 또는 민감도를 가진다. 다른 구체예에서, 상기 치료는 통증을 완화시키기 위한 약물 치료이다. 또 다른 구체예에서, 상기 치료는 호르몬 요법이다. 또 다른 구체예에서, 상기 치료는 호르몬 피임제, 생식샘 자극호르몬-방출 호르몬 작용물질, 및 생식샘 자극호르몬-방출 호르몬 길항물질로 구성되는 군으로부터 선택된다.
일부 구체예에서, 상기 방법은 중합효소 연쇄 반응(PCR)을 수행함으로써 적어도 하나의 miRNA를 검출하는 단계를 추가로 포함한다. 일부 구체예에서, 상기 방법은 정량적 PCR을 수행함으로써 적어도 하나의 miRNA를 검출하는 단계를 추가로 포함한다. 일부 구체예에서, 상기 방법은 (i) 적어도 하나의 miRNA에 특이적으로 결합하는 프라이머를 사용하는 또는 보편적 프라이머를 사용하는 역전사 검정을 수행함으로써 샘플 내의 miRNA를 증폭시켜서 cDNA를 생성시키는 단계; (ii) 생성된 상기 cDNA를 신호를 방출하는 인터컬레이팅 다이(intercalating dye)와 접촉시키는 단계; 및 (iii) 검출기를 사용하여 시간에 따라 방출된 상기 신호를 검출하는 단계에 의해 적어도 하나의 miRNA를 검출하는 단계를 추가로 포함한다. 다른 구체예에서, 방법은 (i) 적어도 하나의 miRNA에 특이적으로 결합하는 프라이머를 사용하는 또는 보편적 프라이머를 사용하는 역전사 검정을 수행함으로써 샘플 내의 miRNA를 증폭시켜서 cDNA를 생성시키는 단계; (ii) 생성된 상기 cDNA를 적어도 하나의 miRNA에 특이적인 프로브와 접촉시키는 단계로서, 상기 프로브는 생성된 상기 cDNA에 결합할 때 신호를 방출하는 단계; 및 (iii) 검출기를 사용하여 상기 프로브에 의해 방출된 상기 신호를 검출하는 단계에 의하여 적어도 하나의 miRNA를 검출하는 단계를 추가로 포함한다. 또 다른 구체예에서, 상기 방법은 서열분석에 의하여 적어도 하나의 miRNA를 검출하는 단계를 추가로 포함한다. 또 다른 구체예에서, 상기 방법은 고처리량 서열분석 또는 대량 병렬 서열분석에 의하여 적어도 하나의 miRNA를 검출하는 단계를 추가로 포함한다.
일부 구체예에서, 상기 적어도 하나의 miRNA는 기준값보다 적어도 2배 더 큰 수준으로 존재한다. 일부 구체예에서, 상기 대상체는 KRAS 변종 대립유전자의 존재에 대하여 음성이다. 일부 구체예에서, 상기 대상체는 인간 대상체이다. 일부 구체예에서, 상기 적어도 하나의 miRNA의 수준은 질환의 중증도를 측정하기 위하여 사용된다.
일부 구체예에서, 상기 자궁내막증은 miRNA-125b-5p가 상향조절되거나, miR-150-5p가 상향조절되거나, miR-342-3p가 상향조절되거나, miR-145-5p가 상향조절되거나, miR-143-3p가 상향조절되거나, miR-500a-3p가 상향조절되거나, 또는 miR-18a-5p가 상향조절되는 때 진단된다. 다른 구체예에서, 상기 자궁내막증은 적어도 3개의 miRNA가 상향조절되는 때 진단되고, 이때 상기 적어도 3개의 miRNA는 miRNA-125b-5p, miR-150-5p, miR-342-3p, miR-145-5p, miR-143-3p, miR-500a-3p, 및 miR-18a-5p로 구성되는 군으로부터 유래된다. 다른 구체예에서, 상기 자궁내막증은 miR-6755-3p가 하향조절되거나 또는 miR-3613-5p가 하향조절되는 때 진단된다. 다른 구체예에서, 상기 자궁내막증은 miR-125b-5p가 상향조절되고, miR-451a가 상향조절되며, miR-3613-5p가 하향조절되는 때 진단된다. 다른 구체예에서, 상기 자궁내막증은 miR-125b-5p가 상향조절되는 때 진단된다.
다른 측면으로, 본 발명은 대상체에서 자궁내막증을 진단하는 방법을 제공한다. 일부 구체예에서, 상기 방법은 대상체의 생물학적 샘플에서 적어도 하나의 miRNA의 수준을 측정하는 단계로서, 상기 miRNA는 miR-125, miR-150, miR-342, miR-145, miR-143, miR-500, miR-451, miR-18, miR-214, miR-126, miR-6755, miR-3613, miR-553, 및 miR-4668로 구성되는 군으로부터 선택되는 것인 단계; 및 생물학적 샘플의 적어도 하나의 miRNA의 수준을 비교기의 적어도 하나의 miRNA의 수준과 비교하는 단계를 포함하며, 여기서 상기 생물학적 샘플의 적어도 하나의 miRNA의 수준이 비교기의 적어도 하나의 miRNA의 수준과 상이할 때, 대상체는 자궁내막증으로 진단된다. 일부 구체예에서, 상기 방법은 자궁내막증에 대해 대상체를 치료하는 단계를 추가로 포함한다.
일부 구체예에서, 상기 적어도 하나의 miRNA는 miR-125, miR-451 및 miR-3613의 조합이다.
일부 구체예에서, 상기 대상체는 인간이다.
일부 구체예에서, 상기 비교기는 양성 대조군, 음성 대조군, 정상 대조군, 야생형 대조군, 과거 대조군, 및 과거 표준으로 구성되는 군으로부터 선택된 적어도 하나의 비교기이다.
일부 구체예에서, 본 발명은 대상체에서 자궁내막증을 진단하는 방법을 제공하며, 그 방법은 miR-125, miR-150, miR-342, miR-145, miR-143, miR-500, miR-451, miR-18, miR-214, 및 miR-126 중 적어도 하나의 수준이 비교기에서의 수준과 비교하여 생물학적 샘플에서 증가되는 것을 검출하는 단계를 포함한다. 또 다른 구체예에서, 본 발명은 대상체에서 자궁내막증을 진단하는 방법을 제공하며, 그 방법은 miR-6755, miR-3613, miR-553, 및 miR-4668 중 적어도 하나의 수준이 비교기에서의 수준과 비교하여 생물학적 샘플에서 감소하는 것을 검출하는 단계를 포함한다.
일부 구체예에서, 상기 적어도 하나의 miRNA의 수준을 측정하는 단계는 역전사, PCR, 및 마이크로어레이로 구성되는 군으로부터 선택된 적어도 하나의 기법을 활용한다.
일부 구체예에서, 상기 생물학적 샘플은 혈액, 혈청, 혈장 및 그것들의 임의의 조합으로 구성되는 군으로부터 선택된다.
다른 측면으로, 본 발명은 또한 대상체에서 자궁내막증을 진단 또는 예측을 제공하는 방법을 제공하며, 그 방법은 자궁내막증이 의심되는 또는 자궁내막증을 가진 대상체의 생물학적 샘플 중의 miR-125, miR-150, miR-342, miR-145, miR-143, miR-500, miR-451, miR-18, miR-214, miR-126, miR-6755, miR-3613, miR-553, 및 miR-4668로 구성되는 군으로부터 선택된 적어도 하나의 유전자의 변경된 발현을 검출하는 단계를 포함한다.
일부 구체예에서, 상기 적어도 하나의 유전자는 miR-125, miR-451 및 miR-3613의 조합이다.
일부 구체예에서, 상기 생물학적 샘플은 혈액, 혈청, 혈장, 및 그것들의 임의의 조합으로 구성되는 군으로부터 선택된다.
본 발명은 또한 적어도 하나의 miRNA에 선택적으로 결합하는 시약을 포함한 키트를 제공하며, 상기 적어도 하나의 miRNA는 miR-125, miR-150, miR-342, miR-145, miR-143, miR-500, miR-451, miR-18, miR-214, miR-126, miR-6755, miR-3613, miR-553, 및 miR-4668로 구성되는 군으로부터 선택된 적어도 하나이다. 일부 구체예에서, 키트는 적어도 3개의 시약을 포함하고, 이때 제 1 시약은 miR-125에 선택적으로 결합하며, 제 2 시약은 miR-451에 선택적으로 결합하며, 제 3 시약은 miR-3613에 선택적으로 결합한다.
다른 측면으로, 본 발명은 자궁내막증을 가진 대상체를 치료하는 방법을 제공하며, 그 방법은 비교기와 비교하여 대상체의 생물학적 샘플에서 miR-125, miR-150, miR-342, miR-145, miR-143, miR-500, miR-451, miR-18, miR-214, miR-126, miR-6755, miR-3613, miR-553, 및 miR-4668로 구성되는 군으로부터 선택된 적어도 하나의 차등 수준을 가지는 것으로 확인된 대상체에 자궁내막증 치료를 투여하는 단계를 포함한다.
다른 측면으로, 본 발명은 자궁내막증에 대해 치료되는 대상체에서 자궁내막증 치료에 대한 반응을 모니터링하는 방법을 제공하며, 그 방법은 대상체의 생물학적 샘플에서 적어도 하나의 miRNA의 수준을 측정하는 단계로서, 상기 miRNA는 miR-125, miR-150, miR-342, miR-145, miR-143, miR-500, miR-451, miR-18, miR-214, miR-126, miR-6755, miR-3613, miR-553, 및 miR-4668로 구성되는 군으로부터 선택된 적어도 하나인 것인 단계, 및 상기 생물학적 샘플의 적어도 하나의 miRNA의 수준을 비교기의 적어도 하나의 miRNA의 수준과 비교하는 단계를 포함한다.
본 발명의 바람직한 구체예들의 다음의 상세한 설명은 첨부된 도면과 함께 판독될 때 더 잘 이해될 것이다. 본 발명을 예시할 목적에 대해, 현재 바람직한 구체예들이 도면에 도시된다. 그러나, 본 발명은 도면에 나타낸 구체예들의 정확한 배열 및 수단들에 제한되지 않는 것이 인지되어야 한다.
도 1은 마이크로어레이 분석으로 차등적으로 발현된 miRNA의 결과를 묘사하는 이미지이다.
도 2는 도 2a 및 도 2b를 포함하며, 실시간 정량적 PCR에 의해 측정된, 자궁내막증 및 대조군 그룹에서 차등적으로 발현된 miRNA의 결과를 묘사하는 이미지의 세트이다. p-값은 Mann-Whitney U 테스트를 사용하는 분석을 기반으로 한다.
도 3은 도 3a, 도 3b, 도 3c, 및 도 3d를 포함하며, 차등적으로 발현된 miRNA의 AUC 값의 결과를 묘사하는 이미지의 세트이다. 도 3a는 혈청 miR-125b-5p, miR-150-5p, 및 miR-342-3p의 수신자 조작 특성(Receiver Operationg Characteristic; ROC) 곡선 분석을 예시하는 이미지이다. 도 3b는 혈청 miR-451a, miR-500a-3p, miR-143-3p의 ROC 곡선 분석을 예시하는 이미지이다. 도 3c는 혈청 miR-18a-5p, miR-6755-3p, 및 miR-3613-5p의 ROC 곡선 분석을 예시하는 이미지이다. miR-125b-5p(도 3a)가 0.974의 최고 AUC를 보였다. 도 3d는 혈청 miR-125-b-5p, miR-451a, 및 miR-3613-5p의 조합이 1.000의 최고 AUC 값을 보여준 것을 예시하는 이미지이다.
도 4는 실시간 정량적 PCR에 의해 측정된, 개코원숭이에서 자궁내막증 및 치료 그룹에서의 miRNA의 상대적인 발현의 결과를 묘사하는 이미지이다. p-값은 Mann-Whitney U 테스트를 사용하는 분석을 기반으로 한다.
도 5는 자궁내막증 및 대조군 그룹에서 타액에서의 miRNA의 상대적인 발현의 결과를 묘사하는 이미지이다.
도 6은 자궁내막증 및 대조군 그룹에서 타액에서의 miRNA의 상대적인 발현의 결과를 묘사하는 이미지이다.
도 7은 자궁내막증의 존재가 확인된(질환 그룹) 또는 다른 양성 병리학이 밝혀진(대조군 그룹) 복강경 검사 또는 개복술이 수행된 여성의 혈청에서의 miRNA의 발현 수준을 묘사하는 이미지이다.
도 1은 마이크로어레이 분석으로 차등적으로 발현된 miRNA의 결과를 묘사하는 이미지이다.
도 2는 도 2a 및 도 2b를 포함하며, 실시간 정량적 PCR에 의해 측정된, 자궁내막증 및 대조군 그룹에서 차등적으로 발현된 miRNA의 결과를 묘사하는 이미지의 세트이다. p-값은 Mann-Whitney U 테스트를 사용하는 분석을 기반으로 한다.
도 3은 도 3a, 도 3b, 도 3c, 및 도 3d를 포함하며, 차등적으로 발현된 miRNA의 AUC 값의 결과를 묘사하는 이미지의 세트이다. 도 3a는 혈청 miR-125b-5p, miR-150-5p, 및 miR-342-3p의 수신자 조작 특성(Receiver Operationg Characteristic; ROC) 곡선 분석을 예시하는 이미지이다. 도 3b는 혈청 miR-451a, miR-500a-3p, miR-143-3p의 ROC 곡선 분석을 예시하는 이미지이다. 도 3c는 혈청 miR-18a-5p, miR-6755-3p, 및 miR-3613-5p의 ROC 곡선 분석을 예시하는 이미지이다. miR-125b-5p(도 3a)가 0.974의 최고 AUC를 보였다. 도 3d는 혈청 miR-125-b-5p, miR-451a, 및 miR-3613-5p의 조합이 1.000의 최고 AUC 값을 보여준 것을 예시하는 이미지이다.
도 4는 실시간 정량적 PCR에 의해 측정된, 개코원숭이에서 자궁내막증 및 치료 그룹에서의 miRNA의 상대적인 발현의 결과를 묘사하는 이미지이다. p-값은 Mann-Whitney U 테스트를 사용하는 분석을 기반으로 한다.
도 5는 자궁내막증 및 대조군 그룹에서 타액에서의 miRNA의 상대적인 발현의 결과를 묘사하는 이미지이다.
도 6은 자궁내막증 및 대조군 그룹에서 타액에서의 miRNA의 상대적인 발현의 결과를 묘사하는 이미지이다.
도 7은 자궁내막증의 존재가 확인된(질환 그룹) 또는 다른 양성 병리학이 밝혀진(대조군 그룹) 복강경 검사 또는 개복술이 수행된 여성의 혈청에서의 miRNA의 발현 수준을 묘사하는 이미지이다.
본 발명은 특정 마이크로RNA(miRNA)의 발현 수준이 자궁내막증, 예컨대 증식 단계 중의 자궁내막증과 관련된다는 발견에 관련된다. 그러므로, 본원에 기술된 다양한 구체예에서, 본 발명의 방법은 대상체를 자궁내막증을 가지는 것으로 진단하는 방법, 자궁내막증을 가지는 또는 자궁내막증이 발병되는 대상체의 위험을 평가하는 방법, 대상체의 자궁내막증의 중증도를 평가하는 방법, 임상 실험에서의 평가를 위해 자궁내막증을 가진 대상체를 계층화하는 방법, 및 대상체에서 자궁내막증 치료를 모니터링하는 방법에 관련된다. 그러므로, 본 발명은 자궁내막증과 관련된 적어도 하나의 miRNA의 발현 수준을 기반으로, 필요로 하는 대상체에서 자궁내막증의 진단, 평가, 및 특성화를 위해 miRNA의 검출 및 정량화에 유용한 조성물 및 방법에 관련된다. 본 발명의 마커들은 자궁내막증을 선별하고, 진단하며, 개시를 모니터링하고, 진행을 모니터링하며, 치료를 평가하기 위해 사용될 수 있다. 본 발명의 마커들은 치료 계획을 확립하고 평가하기 위해 사용될 수 있다.
일부 구체예에서, 자궁내막증과 관련된 miRNA는 자궁내막증의 마커 또는 바이오마커이다. 다양한 구체예에서, 본 발명의 바이오마커는 miR-125, miR-150, miR-342, miR-145, miR-143, miR-500, miR-451, miR-18, miR-214, miR-126, miR-6755, miR-3613, miR-553, 및 miR-4668 중 하나 이상을 포함한다. 일부 구체예에서, 본 발명의 바이오마커는 miR-125b, miR-451, 및 miR-3613의 조합을 포함한다. 일부 구체예에서, 본 발명의 바이오마커는 다음: miR-125b-5p, let-7b, miR-150, miR-342, 및 miR-3613 중 적어도 2개를 포함한다. 일부 구체예에서, 본 발명의 바이오마커는 다음: miR-125b-5p, miR-451a, 및 miR-3613-5p 중 적어도 하나, 적어도 2개, 또는 전부를 포함한다. 일부 구체예에서, 바이오마커는 다음: miR-125b-5p, let-7b, miR-150, miR-342, 및 miR-3613 중 적어도 하나, 적어도 2개, 또는 전부를 포함한다. 일부 경우에, 바이오마커는 추가로 miR-451을 포함할 수 있다.
일부 구체예에서, 자궁내막증과 관련된 miRNA는 자궁내막증의 마커 또는 바이오마커이다. 다양한 구체예에서, 본 발명의 바이오마커는 miR-125b-5p, miR-150-5p, miR-342-3p, miR-145-5p, miR-143-3p, miR-500a-3p, miR-451a, miR-18a-5p, miR-214-3p, miR-126-3p, miR-6755-3p, miR-3613-5p, miR-553, 및 miR-4668-3p 중 하나 이상을 포함한다. 일부 구체예에서, 본 발명의 바이오마커는 miR-125b-5p, miR-451a, 및 miR-3613-5p의 조합을 포함한다. 일부 구체예에서, 바이오마커는 다음: miR-125b-5p, let-7b, miR-150, miR-342, 및 miR-3613 중 적어도 2개를 포함한다. 일부 구체예에서, 바이오마커는 다음: miR-125b-5p, miR-451a, 및 miR-3613-5p 중 적어도 하나, 적어도 2개, 또는 전부를 포함한다. 일부 구체예에서, 바이오마커는 다음: miR-125b-5p, let-7b, miR-150, miR-342, 및 miR-3613 중 적어도 하나, 적어도 2개, 또는 전부를 포함한다. 바이오마커는, 일부 경우에, 추가로 let-7b를 포함할 수 있다.
일부 구체예에서, 본 발명은 개체의 자궁내막증이 발병될 위험을 예측하는 마커를 제공한다. 일부 구체예에서, 본 발명의 마커는 질환의 출현이 방지되도록 예방 치료법이 투여될 수 있을 때 위험을 예측할 수 있다.
일부 구체예에서, 본 발명의 마커는 수술 과정 없이 질환의 초기 검출을 가능하게 하는 자궁내막증에 대한 비침습적 바이오마커이다. 예를 들어, 자궁내막증에 걸린 대상체의 생물학적 샘플에서 특이적 miRNA의 변경된 발현은 다른 임상 매개변수들, 예컨대 골반 통증, 불임, 및 질환 재발과 상관이 있을 수 있다. 그러므로, 본 발명의 마커는 질환의 바이오마커로서뿐만 아니라, 예측 및 재발에 대한 마커로서도 사용될 수 있다. 이것은 자궁내막증 및 관련된 합병증을 진단하기 위해 당업계에서 사용되는 반복된 수술 과정을 피할 수 있기 때문에 유리하다.
본 발명은 자궁내막증의 진단 및 예측에 대한 바이오마커를 제공한다. 일반적으로, 본 발명의 방법은 환자로부터의 혈액, 혈장 또는 혈청에서 차등적으로 발현된(상향- 또는 하향-조절된) 바이오마커의 발현 수준을 검출함으로써 자궁내막증을 진단하거나 예측을 제공하기 위해 사용된다. 유사하게, 이 마커들은 자궁내막증에 걸린 환자에서 감소된 수정 능력을 진단하거나 자궁내막증을 앓고 있는 환자에서 수정 시도에 대한 예측을 제공하기 위해 사용될 수 있다. 본 발명은 또한 자궁내막증을 치료 또는 예방하기 위한 화합물을 확인하는 방법을 제공한다. 본 발명은 자궁내막증의 진단 또는 예측을 위한 키트를 제공한다.
정의
다르게 정의되지 않는 한, 본원에서 사용된 모든 기술적인 및 과학적인 용어들은 본 발명이 속한 기술분야에서 당업자에 의해 통상적으로 이해되는 것과 동일한 의미를 가진다. 비록 본원에 기술된 것들과 유사하거나 동등한 임의의 방법 및 물질이 본 발명의 실시 또는 실험에 사용될 수 있지만, 바람직한 방법 및 물질이 기술된다.
본원에서 사용되는 다음 용어들의 각각은 본 단원에서 그것과 관련된 의미를 가진다
본원에서 하나를 나타내는 용어는 그 주체의 하나 또는 하나 이상(즉, 적어도 하나)을 나타내기 위해 사용된다. 예를 들면, "요소"는 한 개의 요소 또는 하나 이상의 요소를 의미한다.
본원에서 사용되는 "약"은 양, 시간적인 기간, 등과 같은 측정 가능한 값을 언급할 때, 명시된 값으로부터 ±20%, ±10%, ±5%, ±1%, 또는 ±0.1%의 변량을 포함하는 것을 의미하며, 그러한 변량은 본 개시된 방법을 수행하기에 적절하다.
용어 "비정상"은 유기체, 조직, 세포 또는 그것들의 구성요소의 맥락에서 사용될 때, "정상적인"(예상된) 각각의 특성을 나타내는 유기체, 조직, 세포 또는 그것들의 구성요소로부터의 적어도 하나의 관찰 가능한 또는 검출 가능한 특성(예컨대 연령, 치료, 시각, 등)이 상이한 그런 유기체, 조직, 세포 또는 그것들의 구성요소를 나타낸다. 한 세포 또는 조직 유형에 대해 정상적인 또는 예상되는 특성들은 상이한 세포 또는 조직 유형에 대해 비정상일 수 있다.
본원에서 사용되는 "안티센스"는 표적 서열에 상보하는, 예컨대, 한 예를 들면, 이에 한정되는 것은 아니지만, 성숙한 표적 miRNA 서열, 또는 그것의 하위서열을 포함한 표적 miRNA 서열에 상보하는 핵산 서열을 나타낸다. 전형적으로, 안티센스 서열은 안티센스 핵산 서열의 전장을 가로질러 표적 서열에 전체적으로 상보한다.
본원에서 사용되는 용어 "체액(body fluid 또는 bodily fluid)"은 동물의 신체로부터의 임의의 유체를 나타낸다. 체액의 실례로는, 이에 한정되는 것은 아니지만, 혈장, 혈청, 혈액, 림프액, 뇌척수액, 활액, 소변, 타액, 점액, 담 및 가래를 포함한다. 체액 샘플은 임의의 적합한 방법에 의해 수집될 수 있다. 체액 샘플은 즉시 사용되거나 나중의 사용을 위해 보관될 수 있다. 당업계에 알려져 있는 임의의 적합한 보관 방법이 체액 샘플을 보관하기 위해 사용될 수 있다: 예를 들어, 샘플은 약 -20℃ 내지 약 -70℃에서 냉동될 수 있다. 적합한 체액은 무세포성 유체이다. "무세포성" 유체는 세포가 없거나 측정된 miRNA 수준이 세포의 부분에서보다는 샘플의 액체 부분에서의 수준을 반영하는 그런 적은 양으로 존재하는 체액 샘플을 포함한다. 그러한 무세포성 체액은 일반적으로 세포-함유 체액을, 예를 들어 원심분리 또는 여과에 의해 처리하여 세포를 제거함으로써 생성된다. 전형적으로, 무세포성 체액은 온전한 세포를 함유하지 않지만, 일부는 세포 단편 또는 세포 파편을 함유할 수 있다. 무세포성 유체의 실례로는 혈장 또는 혈청, 또는 세포가 제거된 체액을 들 수 있다.
본원에서 사용되는 용어 "세포-유리(cell-free)"는 샘플이 신체로부터 얻어지기 전에 직접적으로 신체에서 나타나는 것과 같은 핵산의 상태를 나타낸다. 예를 들어, 핵산은 그것이 세포와 관련되지 않았다는 점에서 세포-유리 상태의 혈액 또는 타액과 같은 체액에 존재할 수 있다. 그러나, 세포-유리 핵산은 원래 혈류 또는 다른 체액으로 들어가기 전의 세포, 예컨대 자궁내막 세포와 관련되어 있을 수 있다. 대조적으로, 신체에서 세포와 단독으로 관련되는 핵산은 일반적으로 "세포-유리"인 것으로 간주되지 않는다. 예를 들어, 세포 샘플로부터 추출된 핵산은 일반적으로, 그 용어가 본원에서 사용되는 것과 같이 "세포-유리"로 간주되지 않는다.
본원에서 사용되는 용어 "임상 인자"는 의사가 질환의 진단 또는 예측을 결정하는 데 고려할 수 있는 임의의 데이터를 나타낸다. 그러한 인자들로는, 이에 한정되는 것은 아니지만, 환자의 병력, 환자의 신체 검사, 일반혈액검사(전혈구검사, complete blood count), 효소들의 활성의 분석, 세포 검사, 세포유전학, 및 혈액 세포의 면역표현형이 있다.
본원에서 사용되는 "상보하는"은 두 핵산 사이의 하위단위(subunit) 서열 상보성의 넓은 개념을 나타낸다. 두 분자에서의 뉴클레오타이드 위치가 정상적으로 서로 염기쌍을 이룰 수 있는 뉴클레오타이드에 의해 점유될 때, 핵산들은 이 위치에서 서로 상보하는 것으로 간주된다. 그러므로, 두 핵산은 각각의 분자의 상응하는 위치의 적어도 약 50%, 바람직하게는 적어도 약 60%, 보다 바람직하게는 적어도 약 80%가 정상적으로 서로 염기쌍을 이룰 수 있는(예컨대, A:T 및 G:C 뉴클레오타이드 쌍) 뉴클레오타이드에 의해 점유될 때 서로 실질적으로 상보한다.
본원에서 사용되는 용어 "진단"은 질환 또는 장애를 검출하는 것 또는 질환 또는 장애의 단계 또는 정도를 측정하는 것을 의미한다. 보통, 질환 또는 장애의 진단은 하나 이상의 인자 및/또는 질환을 나타내는 증상들의 평가를 기반으로 한다. 즉, 진단은 질환 또는 질병의 존재 또는 부재를 나타내는 인자의 존재, 부재 또는 양을 기반으로 이루어질 수 있다. 특정 질환의 진단을 나타내는 것으로 여겨지는 각각의 인자 또는 증상은 특정 질환에 독점적으로 관련될 필요는 없다; 즉 진단용 인자 또는 증상으로부터 추론될 수 있는 진단들에는 차이가 있을 수 있다. 마찬가지로, 특정 질환을 나타내는 인자 또는 증상이 특정 질환을 갖고 있지 않은 개체에 존재하는 경우가 있을 수 있다. 진단 방법은 독립적으로, 또는 특정 질환 또는 장애에 대해 의료 기술분야에서 알려져 있는 다른 진단 및/또는 병기결정 방법과 조합되어 사용될 수 있다.
본원에서 사용되는 표현 "수준의 차이"는 대조군 또는 기준 수준과 비교하여 샘플 중의 특정 마커, 예컨대 핵산 또는 단백질의 양의 차이를 나타낸다. 예를 들어, 특정 바이오마커의 양이 질환을 가진 환자의 샘플에서 기준 수준과 비교하여 상승된 양으로 또는 감소된 양으로 존재할 수 있다. 일부 구체예에서, "수준의 차이"는 대조군과 비교하여 샘플에 존재하는 특정 바이오마커의 양 사이의 적어도 약 1%, 적어도 약 2%, 적어도 약 3%, 적어도 약 5%, 적어도 약 10%, 적어도 약 15%, 적어도 약 20%, 적어도 약 25%, 적어도 약 30%, 적어도 약 35%, 적어도 약 40%, 적어도 약 50%, 적어도 약 60%, 적어도 약 75%, 적어도 약 80% 또는 그 이상의 차이일 수 있다. 일부 구체예에서, "수준의 차이"는 대조군과 비교하여 샘플에 존재하는 바이오마커의 양 사이의 통계적으로 유의한 차이일 수 있다. 예를 들어, 차이는 바이오마커의 측정된 수준이 임의의 대조군 또는 기준 그룹의 평균의 약 1.0 표준 편차, 약 1.5 표준 편차, 약 2.0 표준 편차, 또는 약 2.5 표준 편차 밖에 있다면 통계적으로 유의할 수 있다.
"질환"은 동물이 항상성을 유지할 수 없고, 만약 질환이 개선되지 않는다면 동물의 건강이 계속해서 악화되는 동물의 건강 상태이다.
대조적으로, 동물의 "장애"는 동물이 항상성을 유지할 수는 있지만, 동물의 건강 상태가 그 장애가 없을 때보다는 덜 유리한 상태이다. 치료되지 않은 채로 방치되더라도, 장애는 동물의 건강 상태의 추가적 저하를 반드시 유발하지는 않는다.
질환 또는 장애는, 만약 그 질환 또는 장애의 신호 또는 증상의 중증도, 그러한 신호 또는 증상을 환자가 겪는 빈도, 또는 둘 모두가 감소된다면 "완화된다".
용어 "비교기(comparator)"는 본 발명의 하나 이상의 마커(또는 바이오마커)의 마커(또는 바이오마커) 발현 생성물의 하나 이상을 포함하지 않거나, 또는 정상, 저, 또는 고 수준으로 포함하는 물질을 기술하는 것이어서, 비교기는 그것에 대해 샘플이 비교될 수 있는 대조군 또는 기준 표준으로서 작용할 수 있다.
본원에서 사용되는 용어 "조절장애된" 및 "조절장애"는 대상체로부터 얻어진 샘플에 존재하는 및 검출된 miRNA의, 비교기 샘플, 예컨대 하나 이상의 정상, 위험성이 없는 대상체로부터, 또는 상이한 시점에 동일한 대상체로부터 얻어진 비교기 샘플에서의 그 miRNA의 발현 수준과 비교하여, 감소된(하향조절된) 또는 증가된(상향조절된) 발현 수준을 기술한다. 일부 경우에, miRNA 발현 수준은 하나 이상의 위험성이 없는 개체로부터 얻어진 평균 값과 비교된다. 다른 경우에, miRNA 발현 수준은 하나의 정상, 위험성이 없는 대상체로부터 얻어진 샘플에서 평가된 miRNA 수준과 비교된다.
구절 "마커(또는 바이오마커) 발현 수준을 측정하는 것"은 임의의 마커 발현 생성물의 충분한 부분을 검출하기 위해 당업자에게 활용될 수 있는 기술을 사용하여, 핵산 또는 단백질 수준에서 샘플 중의 마커의 발현 정도의 평가를 의미한다.
용어 "결정", "측정", "평가" 및 "검정(분석, assay)"은 상호교환적으로 사용되며 정량적 및 정성적 측정을 포함하고, 특질, 특성, 또는 특색이 존재하는지의 여부를 측정하는 것을 포함한다. 평가하는 것은 상대적이거나 절대적일 수 있다. "의 존재를 평가하는 것"은 존재하는 어떤 것의 양을 측정하는 것뿐만 아니라, 그것이 존재하는지 또는 부재하는지를 측정하는 것을 포함한다.
"차등적으로 증가된 발현" 또는 "상향 조절"은 비교기보다 적어도 10% 이상, 예를 들어 20%, 30%, 40%, 또는 50%, 60%, 70%, 80%, 90% 더 높거나 그 이상인, 및/또는 1.1배, 1.2배, 1.4배, 1.6배, 1.8배, 2.0배 더 높거나 그 이상인, 및 그 사이에 임의의 및 전부의 전체 또는 부분적인 증분이 있는 발현 수준을 나타낸다.
"차등적으로 감소된 발현" 또는 "하향 조절"은 비교기보다 적어도 10% 이상, 예를 들어 20%, 30%, 40%, 또는 50%, 60%, 70%, 80%, 90% 더 낮거나 그 미만인, 및/또는 2.0배, 1.8배, 1.6배, 1.4배, 1.2배, 1.1배 더 낮거나 그 미만인, 및 그 사이에 임의의 및 전부의 전체 또는 부분적인 증분이 있는 발현 수준을 나타낸다.
본원에서 사용되는 "내인성"은 유기체, 세포, 조직 또는 시스템 내부로부터의 또는 내부에서 생성된 임의의 물질을 나타낸다.
본원에서 사용되는 용어 "발현"은 특정 뉴클레오타이드 서열의 전사 및/또는 번역으로서 정의된다.
본원에서 사용되는 "상동성"은 두 중합체 분자 사이의, 예컨대 두 핵산 분자, 예컨대, 두 DNA 분자 또는 두 RNA 분자 사이의, 또는 두 폴리펩타이드 분자 사이의 하위단위 서열 유사성을 나타낸다. 두 분자 둘 다에서 하위단위 위치가 동일한 모노머 하위단위에 의해 점유될 때, 예컨대 두 DNA 분자 각각에서의 위치가 아데닌에 의해 점유된다면, 그것들은 그 위치에서 상동성이다. 두 서열 사이의 상동성은 일치하는 또는 상동하는 위치들의 수의 직접 함수이다, 예컨대 두 화합물 서열의 위치들의 절반(예컨대, 길이가 10개의 하위단위인 중합체에서 5개의 위치)이 상동성이면 두 서열은 50% 상동성이고, 위치들의 90%, 예컨대, 10개 중 9개가 일치하거나 상동한다면, 두 서열은 90% 상동성을 공유한다. 예를 들면, DNA 서열 5'-ATTGCC-3' 및 5'-TATGGC-3'는 50% 상동성을 공유한다.
본원에서 사용되는 "상동성"은 "동일성"과 동의어로 사용된다.
마커의 "억제제", "활성화제" 및 "조절제"는 자궁내막증 바이오마커의 시험관내 및 생체내 검정을 사용하여 확인된 활성화, 억제, 또는 조절 분자를 나타내기 위해 사용된다. 억제제는, 예컨대, 부분적으로 또는 전체적으로 자궁내막증 바이오마커의 활성을 차단하거나, 자궁내막증 바이오마커의 활성 또는 발현을 감소시키거나, 방지하거나, 활성화를 지연시키거나, 비활성화시키거나, 둔감화시키거나, 또는 하향 조절하기 위해 결합하는 화합물이다. 활성화제는 자궁내막증 바이오마커의 활성을 증가시키거나, 개방시키거나, 활성화하거나, 촉진하거나, 활성화를 향상시키거나, 민감하게 하거나, 작용시키거나, 또는 상향 조절하는 화합물, 예컨대 작용물질이다. 억제제, 활성화제, 또는 조절제는 또한 자궁내막증 바이오마커의 유전자 변형된 형태(version), 예컨대 변경된 활성을 가진 형태, 뿐만 아니라 자연적으로 발생하는 및 합성 리간드, 길항물질, 작용물질, 항체, 펩타이드, 고리형 펩타이드, 핵산, 안티센스 분자, 리보자임, RNAi, 마이크로RNA, 및 siRNA 분자, 작은 유기 분자 등을 포함한다. 억제제 및 활성화제에 대한 그러한 검정은, 본원의 다른 곳에서 기술된 것과 같이, 예컨대 자궁내막증 바이오마커를 시험관내에서, 세포에서, 또는 세포 추출물에서 발현시키는 것, 추정되는 조절제 화합물을 적용시키는 것, 및 그런 후 활성에 미치는 기능적 영향을 측정하는 것을 포함한다.
본원에서 사용되는 "설명용 자료"는 본원에서 인용된 다양한 질환 또는 장애의 완화를 이루기 위해 키트에서 본 발명 화합물, 조성물, 벡터, 방법 또는 전달 시스템의 유용성을 교신하기 위해 사용될 수 있는 출판물, 기록, 다이아그램, 또는 임의의 다른 표현 매체를 포함한다. 선택적으로, 또는 대안적으로, 설명용 자료는 포유류의 세포 또는 조직에서 질환 또는 장애를 완화시키는 하나 이상의 방법을 기술할 수 있다. 본 발명의 키트의 설명용 자료는, 예를 들어, 본 발명의 확인된 화합물, 조성물, 벡터, 또는 전달 시스템을 함유하는 용기에 부착되거나, 또는 확인된 화합물, 조성물, 벡터, 또는 전달 시스템을 함유하는 용기와 함께 운송될 수 있다. 대안적으로, 설명용 자료는 설명용 자료 및 화합물이 수령인에 의해 협조적으로 사용될 수 있다는 의도로 용기와 별도로 운송될 수 있다.
본원에서 사용되는 "분리된"은 인간의 직접적인 또는 간접적인 행동을 통해 자연 상태로부터 변경된 또는 제거된 것을 의미한다. 예를 들어, 살아있는 동물에 자연적으로 존재하는 핵산 또는 펩타이드는 "분리된" 것은 아니지만, 그것의 자연 상태의 공존하는 물질로부터 부분적으로 또는 완전하게 분리된 동일한 핵산 또는 펩타이드는 "분리된" 것이다. 분리된 핵산 또는 단백질은 실질적으로 정제된 형태로 존재하거나, 또는 예를 들어 숙주 세포와 같은 비-자연 환경에 존재할 수 있다.
"측정하는" 또는 "측정", 또는 대안적으로 "검출하는" 또는 "검출"은 임상 또는 대상체-유래 샘플 내에서 주어진 물질의 존재, 부재, 수량 또는 양(유효량일 수 있음)을, 이를테면 그러한 물질의 정성적 또는 정량적 농도의 유래를 포함하여, 평가하는 것, 또는 그렇지 않으면 대상체의 임상적 매개변수들의 값 또는 범주화를 평가하는 것을 의미한다.
본원에서 사용되는 "마이크로RNA" 또는 "miRNA"는, 예를 들어, RNA 간섭(RNAi)으로 명명되는 과정을 통해 유전자 발현을 조절하는 데 역할을 할 수 있는, 일반적으로 길이가 약 15 내지 약 50개, 바람직하게는 17 내지 23개 뉴클레오타이드인 작은 비암호화 RNA 분자를 묘사한다. RNAi는 그로써 표적 유전자 메신저 RNA(mRNA)의 서열에 상보하거나 안티센스인 RNA 서열의 존재가 표적 유전자의 발현의 억제를 초래하는 현상을 나타낸다. miRNA는 RNAse III 효소에 의한 순차적인 절단을 통해 일차 전사물(pri-miRNA)로부터 유래된 약 70개 이상의 뉴클레오타이드(pre-miRNA)의 헤어핀 전구체로부터 처리된다. miRBase는 모든 목적에 대해 그 전체가 본원에 참조로 포함된, www.mirbase.org에 위치한 포괄적인 마이크로RNA 데이터베이스이다.
본원에서 사용되는 "돌연변이"는 기준 서열(바람직하게는 자연 발생적인 정상 또는 "야생형" 서열)에 비해 핵산 또는 폴리펩타이드 서열의 변화를 나타내며, 전위, 결실, 삽입, 및 치환/점 돌연변이를 포함한다. 본원에서 사용되는 "돌연변이체"는 돌연변이를 포함한 핵산 또는 단백질을 나타낸다.
본원에서 사용되는 "자연 발생적인"은 인공적으로 제조되는 것과는 구별되는, 자연에서 발견될 수 있는 조성물을 나타낸다. 예를 들어, 자연에서의 공급원으로부터 분리될 수 있고 사람에 의해 의도적으로 변형되지 않은, 유기체에 존재하는 뉴클레오타이드 서열이 자연 발생적이다.
"핵산"은 데옥시리보뉴클레오사이드 또는 리보뉴클레오사이드로 구성되든지, 및 포스포다이에스테르(phosphodiester) 결합 또는 변형된 결합, 예컨대 포스포트라이에스테르(phosphotriester), 포스포라미데이트(phosphoramidate), 실록산(siloxane), 카보네이트(carbonate), 카르복시메틸에스테르(carboxymethylester), 아세트아미데이트(acetamidate), 카바메이트(carbamate), 싸이오에테르(thioether), 가교된 포스포라미데이트(bridged phosphoramidate), 가교된 메틸렌 포스포네이트(bridged methylene phosphonate), 포스포로싸이오에이트(phosphorothioate), 메틸포스포네이트(methylphosphonate), 포스포로다이티오에이트(phosphorodithioate), 가교된 포스포로티오에이트(bridged phosphorothioate) 또는 설폰(sulfone) 결합, 및 이런 결합들의 조합으로 구성되든지, 임의의 핵산을 의미한다. 용어 핵산은 또한 구체적으로 5개의 생물학적으로 발생하는 염기(아데닌, 구아닌, 티민, 시토신 및 우라실) 이외의 염기들로 구성된 핵산을 포함한다.
종래의 표기법은 본원에서 폴리뉴클레오타이드 서열을 기술하기 위해 사용된다: 단일 가닥 폴리뉴클레오타이드 서열의 왼손 단부는 5'-단부이고; 이중 가닥 폴리뉴클레오타이드 서열의 왼손 방향은 5'-방향으로서 언급된다.
전사물의 신생 RNA에 대한 뉴클레오타이드의 5'에서 3'쪽으로의 첨가 방향은 전사 방향으로서 언급된다. mRNA와 동일한 서열을 가진 DNA 가닥은 "코딩 가닥"으로서 언급된다. DNA에서 기준점에 대해 5'에 위치한 DNA 가닥 상의 서열은 "상류 서열"로서 언급된다. DNA에서 기준점에 대해 3'인 DNA 가닥 상의 서열은 "하류 서열"로서 언급된다.
본원에서 사용되는 "폴리뉴클레오타이드"는 cDNA, RNA, DNA/RNA 하이브리드, 안티센스 RNA, siRNA, miRNA, 게놈의 DNA, 합성 형태, 및 혼합된 중합체, 센스와 안티센스 가닥 두 가지 모두를 포함하고, 비천연 또는 유도체화된, 합성, 또는 반합성 뉴클레오타이드 염기를 함유하도록 화학적으로 또는 생화학적으로 변형될 수 있다. 또한, 본 발명의 범위 내에는, 이에 한정되는 것은 아니지만, 결실, 삽입, 하나 이상의 뉴클레오타이드의 치환, 또는 다른 폴리뉴클레오타이드 서열에의 융합을 포함한, 야생형 또는 합성 유전자의 변경이 포함된다.
본원에서 사용되는, 증폭을 위한 "프라이머"는 표적 또는 마커 뉴클레오타이드 서열에 특이적으로 어닐링하는 올리고뉴클레오타이드이다. 프라이머의 3' 뉴클레오타이드는 중합효소에 의한 최적의 프라이머 연장을 위해 상응하는 뉴클레오타이드 위치에서 표적 또는 마커 서열에 동일해야 한다. 본원에서 사용되는 "전방향 프라이머"는 이중 가닥 DNA(dsDNA)의 안티센스 가닥에 어닐링하는 프라이머이다. "역방향 프라이머"는 dsDNA의 센스 가닥에 어닐링한다.
본원에서 사용되는 용어 "재조합 DNA"는 상이한 공급원으로부터 유래한 DNA의 조각들을 연결시킴으로써 생성된 DNA로서 정의된다.
본원에서 사용되는 용어 "예측을 제공하는"은 중증도, 기간, 회복 기회, 등의 예측을 포함한, 자궁내막증의 유력한 과정 및 결과의 예측을 제공하는 것을 나타낸다. 방법은 또한 적합한 치료 계획을 고안하기 위해, 예컨대, 질병이 여전히 초기 단계에 있는지의 여부를 나타냄으로써 또는 질병이 적극적인 치료법이 비효과적일 수 있을 단계로 진전되었다면 사용될 수 있다.
바이오마커의 "기준 수준"은 특정 질환 상태, 표현형, 또는 그것의 결핍뿐만 아니라, 질환 상태들, 표현형들, 또는 그것들의 결핍의 조합을 나타내는 바이오마커의 수준을 의미한다. 바이오마커의 "양성" 기준 수준은 특정 질환 상태 또는 표현형을 나타내는 수준을 의미한다. 바이오마커의 "음성" 기준 수준은 특정 질환 상태 또는 표현형의 결핍을 나타내는 수준을 의미한다.
본원에서 사용되는 "샘플" 또는 "생물학적 샘플"은 개체로부터 분리된 생물학적 물질을 의미한다. 생물학적 샘플은 원하는 바이오마커를 검출하기에 적합한 임의의 생물학적 물질을 포함하고, 개체로부터 얻어진 세포성 및/또는 비세포성 물질을 포함할 수 있다.
본원에서 사용된 "표준 대조군 값"은 생물학적 샘플에서 검출 가능한 특정 단백질 또는 핵산의 예정된 양을 나타낸다. 표준 대조군 값은 생물학적 샘플에 존재하는 관심있는 단백질 또는 핵산의 양을 비교하기 위하여, 본 발명의 방법의 사용에 적합하다. 표준 대조군으로서 작용하는 확립된 샘플은 합리적으로 일치하는 배경, 예컨대, 성별, 연령, 인종, 및 병력의 평균적이고 건강한 사람에 전형적인 생물학적 샘플 중의 관심있는 단백질 또는 핵산의 평균 양을 제공한다. 표준 대조군 값은 관심있는 단백질 또는 핵산 및 샘플(예컨대, 혈청)의 성질에 따라 달라질 수 있다.
용어 "대상체", "환자", "개체" 등은 본원에서 상호교환적으로 사용되며, 본원에 기술된 방법을 시험관내에서나 생체내에서 잘 따를 수 있는 임의의 동물, 또는 그것의 세포를 나타낸다. 특정한 비제한 구체예에서, 환자, 대상체 또는 개체는 인간이다.
용어 "저발현하다", "저발현", "저발현된", 또는 "하향조절된"은 상호교환적으로, 자궁내막증이 없는 여성으로부터의 생물학적 샘플과 비교하여, 자궁내막증에 걸린 여성으로부터의 생물학적 샘플에서 검출 가능하게 더 낮은 수준에서 전사되거나 번역되는 단백질 또는 핵산을 나타낸다. 용어는 대조군과 비교하여, 전사, 전사 후 프로세싱, 번역, 번역 후 프로세싱, 세포의 정위(예컨대, 세포 소기관, 세포질, 핵, 세포 표면), 및 RNA 및 단백질 안정성으로 인한 저발현을 포함한다. 저발현은 mRNA를 검출하기 위한 종래 기법(즉, Q-PCR, RT-PCR, PCR, 혼성화) 또는 단백질을 검출하기 위한 종래 기법(즉, ELISA, 면역조직화학 기법)을 사용하여 검출될 수 있다. 저발현은 대조군과 비교하여 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% 또는 그 미만일 수 있다. 특정 경우에, 저발현은 대조군과 비교하여 전사 또는 번역 수준이 1-, 2-, 3-, 4-, 5-, 6-, 7-, 8-, 9-, 10-배 이상으로 더 낮다.
용어 "과발현하다", "과발현", "과발현된", 또는 "상향조절된"은 상호교환적으로, 자궁내막증이 없는 여성으로부터의 생물학적 샘플과 비교하여, 자궁내막증에 걸린 여성으로부터의 생물학적 샘플에서 보통, 검출 가능하게 더 큰 수준에서 전사되거나 번역되는 단백질 또는 핵산(RNA)을 나타낸다. 용어는 자궁내막증이 없는 여성으로부터의 세포와 비교하여, 전사, 전사 후 프로세싱, 번역, 번역 후 프로세싱, 세포의 정위(예컨대, 세포 소기관, 세포질, 핵, 세포 표면), 및 RNA 및 단백질 안정성으로 인한 과발현을 포함한다. 과발현은 mRNA를 검출하기 위한 종래 기법(즉, Q-PCR, RT-PCR, PCR, 혼성화) 또는 단백질을 검출하기 위한 종래 기법(즉, ELISA, 면역조직화학 기법)을 사용하여 검출될 수 있다. 과발현은 자궁내막증이 없는 여성으로부터의 세포와 비교하여 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% 또는 그 이상일 수 있다. 특정 경우에, 과발현은 자궁내막증이 없는 여성으로부터의 세포와 비교하여 전사 또는 번역 수준이 1-, 2-, 3-, 4-, 5-, 6-, 7-, 8-, 9-, 10-배, 또는 그 이상으로 더 높다.
본원에서 사용되는 용어 "변종"은 각각 기준 핵산 서열 또는 펩타이드 서열과 서열이 상이하지만, 기준 분자의 본질적인 특성은 보유한 핵산 서열 또는 펩타이드 서열이다. 핵산 변종의 서열의 변화는 기준 핵산에 의해 암호화된 펩타이드의 아미노산 서열을 변경시킬 수 없거나, 또는 아미노산 치환, 첨가, 결실, 융합 및 절단을 초래할 수 있다. 펩타이드 변종의 서열의 변화는 전형적으로 제한되거나 보존적이어서, 기준 펩타이드 및 변종의 서열들은 전체적으로 매우 유사하며, 많은 영역에서 동일하다. 변종 및 기준 펩타이드는 임의의 조합의 하나 이상의 치환, 첨가, 결실에 의하여 아미노산 서열이 상이할 수 있다. 핵산 또는 펩타이드의 변종은 대립유전자 변종과 같은 자연 발생적인 것이거나, 자연적으로 발생하는 것으로 알려져 있지 않은 변종일 수 있다. 핵산 및 펩타이드의 비자연 발생적인 변종은 돌연변이생성 기법에 의해 또는 직접 합성에 의해 만들어질 수 있다.
본원에서 사용되는 용어 "치료하다", "개선하다", "치료", 및 "치료하는"은 상호 교환적으로 사용된다. 이 용어들은, 이에 한정되는 것은 아니지만, 치료적 유익 및/또는 예방적 유익을 포함한, 유익한 또는 원하는 결과를 얻기 위한 접근법을 나타낸다. 치료적 유익은 치료되는 근본적인 장애의 근절 또는 개선을 의미한다. 또한, 치료적 유익은, 환자가 여전히 근본적인 장애의 영향을 받을 수 있음에도 불구하고, 개선이 환자에게서 관찰되도록 근본적인 장애와 관련된 하나 이상의 생리적 증상의 근절 또는 개선으로 이루어진다. 예방적 유익의 경우, 치료는, 특정 질환의 진단이 이루어지지 않을 수 있지만, 특정 질환이 발병할 위험이 있는 환자에게, 또는 질환의 하나 이상의 생리적 증상을 보고하는 환자에게 투여될 수 있다.
본원에서 및 개시 전체에서 사용되는 용어 "또는"은 일반적으로, 맥락이 다른 것을 지시하지 않는 한 "및/또는"을 의미한다.
본원에서 사용되는 용어 "순환하는 miRNA"는 체액이 전통적으로 순환계의 일부인 것으로 간주되는 것과 관계없이 체액 중의 임의의 miRNA를 나타낸다. 예를 들어, "순환하는 miRNA"는 대상체의 혈액에 존재하는 miRNA를 포함할 것이고, 또한 대상체의 타액, 소변, 또는 기타 체액에 존재하는 miRNA를 포함할 것이다.
범위(ranges): 본 발명 전체에서, 본 발명의 다양한 측면들은 범위 포맷으로 제공될 수 있다. 범위 포맷의 서술은 단지 편리성 및 간결성을 위한 것이고 본 발명의 범주에 대한 확고한 제한으로서 해석되지 않아야 한다. 따라서, 범위의 서술은 구체적으로 개시된 모든 가능한 하위범위뿐만 아니라 그 범위 내의 각각의 수치를 가지는 것으로 간주되어야 한다. 예를 들어, 1 내지 6과 같은 범위의 서술은 1 내지 3, 1 내지 4, 1 내지 5, 2 내지 4, 2 내지 6, 3 내지 6, 등과 같은 구체적으로 개시된 하위범위뿐만 아니라, 그 범위 내의 각각의 수, 예를 들어 1, 2, 2.7, 3, 4, 5, 5.3, 및 6을 가지는 것으로 간주되어야 한다. 이것은 범위의 폭과 관계없이 적용된다.
설명
한 측면으로, 본 발명은 자궁내막증과 순환하는 miRNA 수준의 변경 사이의 연결의 발견과 관련된다. 일부 구체예에서, 순환하는 miRNA의 수준은, 단독으로 및 종래의 자궁내막증 혈청 마커와 조합하여, 자궁내막증 검출을 개선하기 위하여 사용된다. 예시적인 구체예에서, miRNA는 miR-125, miR-150, miR-342, miR-145, miR-143, miR-500, miR-451, miR-18, miR-214, miR-126, miR-6755, miR-3613, miR-553, 및 miR-4668 및 그것들의 임의의 조합으로 구성되는 군으로부터 선택된다. 예시적인 구체예에서, miRNA는 miR-125b-5p, miR-150-5p, miR-342-3p, miR-145-5p, miR-143-3p, miR-500a-3p, miR-451a, miR-18a-5p, miR-214-3p, miR-126-3p, miR-6755-3p, miR-3613-5p, miR-553, 및 miR-4668-3p 및 그것들의 임의의 조합으로 구성되는 군으로부터 선택된다. 일부 구체예에서, miRNA는 다음: miR-125b-5p, let-7b, miR-150, miR-342, 및 miR-3613 중 적어도 2개이다. 일부 구체예에서, miRNA는 다음: miR-125b-5p, miR-451a, 및 miR-3613-5p 중 적어도 하나, 적어도 둘, 또는 전부이다. 일부 구체예에서, miRNA는 다음: miR-125b-5p, let-7b, miR-150, miR-342, 및 miR-3613 중 적어도 하나, 적어도 둘, 또는 전부이다. 일부 경우에, 본 발명의 miRNA는 추가로 let-7b를 포함한다.
한 측면으로, 상기 방법은 일반적으로 환자 샘플에서 순환하는 miRNA의 패턴의 검출, 측정, 및 비교를 제공한다. 다른 측면으로, 상기 방법은 일반적으로 체액의 샘플(예컨대 혈액, 혈장, 혈청, 타액, 소변)에 존재하는 miRNA의 패턴의 검출, 측정, 및 비교를 제공한다. 자궁내막증의 맥락에서, 병든 세포에 접근하는 것은 흔히 어렵다. 이와 같이, 혈액 유출 또는 타액의 수집과 같은 상대적으로 비침습적 방법을 사용하여 자궁내막증을 검출하는 방법은 매우 유익할 수 있을 것이다. 다양한 구체예에서, 본 방법은 간 질환이 있는 환자의 혈장에서 miRNA의 수준을 측정함으로써 암 진단의 문제를 극복한다. 대상체로부터 얻어진 샘플 중의 miRNA 유전자 생성물의 수준의 변경(즉 증가 또는 감소)은, 대조군 샘플 중의 상응하는 miRNA 유전자 생성물의 수준과 비교하여, 대상체에서 자궁내막증의 존재를 나타낸다. 일부 구체예에서, 테스트 샘플 중의 적어도 하나의 miRNA 유전자 생성물의 수준은 대조군 샘플 중의 상응하는 miRNA 유전자 생성물의 수준보다 더 크다. 다른 구체예에서, 상기 테스트 샘플 중의 적어도 하나의 miRNA 유전자 생성물의 수준은 대조군 샘플 중의 상응하는 miRNA 유전자 생성물의 수준보다 더 적다.
추가의 진단 마커는 질환의 존재 또는 부재 또는 단계를 예측하기 위한 모델을 구성하기 위해 순환하는 miRNA 수준과 조합될 수 있다. 예를 들어, 자궁내막증 질환의 진단과 관련된 임상 인자들로는, 이에 한정되는 것은 아니지만, 환자의 병력, 신체 검사, 및 다른 바이오마커를 들 수 있다. 자궁내막증의 진단은 또한 증상의 유형, 증상의 지속 기간 및 증상의 정도를 포함한, 환자의 증상에 의해 알 수 있다.
일반적으로, 본 발명의 방법은 환자로부터의 혈액 또는 혈청에서 차등적으로 발현되는(상향- 또는 하향-조절된) 바이오마커의 발현 수준을 검출함으로써 자궁내막증을 진단하거나 예측을 제공하는 데 사용될 수 있다. 이 마커들은 자궁내막증의 단계 또는 중증도를 구별하기 위해 사용될 수 있다. 이 마커들은 또한 자궁내막증이 있는 환자에서 치료 과정에 대한 예측을 제공하기 위해 사용될 수 있다.유사하게, 이 마커들은 자궁내막증이 있는 환자에서 불임을 진단하거나 자궁내막증에 걸린 환자에서 수정 시도에 대한 예측을 제공하기 위해 사용될 수 있다. 본 발명의 바이오마커는 자궁내막증의 진단 또는 예측을 위해 단독으로 또는 조합되어 사용될 수 있다.
일부 구체예에서, 본 발명의 방법은 자궁내막증에 걸린 환자에게 치료를 배정하는 데 사용될 수 있다. 여기서 발견된 바이오마커의 발현 수준을 검출함으로써, 적절한 치료가 자궁내막증에 걸린 환자에게 배정될 수 있다. 이런 치료들로는, 이에 한정되는 것은 아니지만, 호르몬 요법, 화학요법, 면역요법, 및 수술적 치료를 들 수 있다. 유사하게, 본 발명의 방법은 자궁내막증으로 인해 수정력이 감소된 환자에게 치료를 배정하기 위해 사용될 수 있다. 이런 방식으로, 본원에서 발견된 바이오마커의 검출을 통해 환자의 수정 능력이 감소된 정도를 측정함으로써, 적절한 치료가 배정될 수 있다. 관련 치료로는, 이에 한정되는 것은 아니지만, 호르몬 요법, 화학요법, 면역요법, 및 수술적 치료를 들 수 있다.
사용을 위한 하나 이상의 마커를 포함하는 진단 및 예측 키트가 본원에서 제공된다. 또한 본원에는 개시에 의해, 확인된 유전자 하위세트 중 임의의 하나에서 발견된 마커의 발현 수준 또는 활성을 조정함으로써 자궁내막증 또는 자궁내막증에 의해 유발된 감소된 수정 능력을 예방 또는 치료할 수 있는 화합물을 확인하는 방법이 제공된다. 자궁내막증 또는 자궁내막증에 의해 유발된 감소된 수정 능력이 본 발명의 마커를 표적으로 하는 작용제를 사용하여 치료되는 치료 방법이 제공된다.
다양한 구체예에서, 본 발명의 방법들은 자궁내막증을 가질 또는 자궁내막증이 발병될 대상체의 위험을 평가하는 방법, 대상체의 자궁내막증의 중증도를 평가하는 방법, 자궁내막증을 진단하는 방법, 자궁내막증을 특성화하는 방법, 및 임상 실험에서 자궁내막증을 가진 대상체를 계층화하는 방법에 관련된다.
본원에서 기술되는 본 발명의 조성물 및 방법의 다양한 구체예에서, 자궁내막증과 관련된 miRNA는 다음의 miRNA들: miR-125, miR-150, miR-342, miR-145, miR-143, miR-500, miR-451, miR-18, miR-214, miR-126, miR-6755, miR-3613, miR-553, 및 miR-4668 중 적어도 하나이다. miRNA 패밀리 구성원들의 서열은 (www.mirbase.org)의 miRBase로부터 공공연하게 활용 가능하다. 일부 구체예에서, 자궁내막증과 관련된 miRNA는 다음의 miRNA들: let-7, let-7a, let-7b, let-7b-3p, let-7b-5p, let-7c, let-7d, let-7e, let-7f, 또는 let-7g 중 적어도 하나이거나, 또는 추가로 그 중 하나를 포함한다. 일부 구체예에서, 자궁내막증과 관련된 miRNA는 다음: miR-125b-5p, let-7b, miR-150, miR-342, 및 miR-3613 중 적어도 2개이다. 일부 구체예에서, miRNA는 다음: miR-125b-5p, miR-451a, 및 miR-3613-5p 중 적어도 하나, 적어도 둘, 또는 전부이다. 일부 구체예에서, miRNA는 다음: miR-125b-5p, let-7b, miR-150, miR-342, 및 miR-3613 중 적어도 하나, 적어도 둘, 또는 전부이다.
본원에서 기술되는 본 발명의 조성물 및 방법의 다양한 구체예에서, 자궁내막증과 관련된 miRNA는 다음의 miRNA들: miR-125b-5p, miR-150-5p, miR-342-3p, miR-145-5p, miR-143-3p, miR-500a-3p, miR-451a, miR-18a-5p, miR-214-3p, miR-126-3p, miR-6755-3p, miR-3613-5p, miR-553, 및 miR-4668-3p 중 적어도 하나이다. miRNA 패밀리 구성원들의 서열은 (www.mirbase.org)의 miRBase로부터 공공연하게 활용 가능하다.
일부 구체예에서, 본 발명의 바이오마커는 miR-125, miR-150, miR-342, miR-145, miR-143, miR-500, miR-451, miR-18a, miR-214, miR-126, miR-6755, miR-3613, miR-553, 및 miR-4668 중 하나 이상을 포함한다. 일부 구체예에서, 자궁내막증을 진단하기에 유용한 본 발명의 바이오마커는 miR-125b, miR-150, miR-342, miR-145, miR-143, miR-500, miR-451, miR-18, miR-214, miR-126, miR-6755, miR-3613, miR-553, 및 miR-4668 중 하나 이상을 포함한다. 일부 구체예에서, 자궁내막증을 진단하기에 유용한 본 발명의 바이오마커는 miR-125b, miR-451 및 miR-3613의 조합을 포함한다. 추가의 구체예에서, 자궁내막증을 진단하기에 유용한 바이오마커는 추가로 다음: let-7, let-7a, let-7b, let-7b-3p, let-7b-5p, let-7c, let-7d, let-7e, let-7f, 또는 let-7g 중 하나 이상을 포함한다. 일부 특정 경우에, 바이오마커는 추가로 let-7b를 포함한다. 일부 구체예에서, 바이오마커는 다음: miR-125b-5p, let-7b, miR-150, miR-342, 및 miR-3613 중 적어도 2개를 포함한다. 일부 구체예에서, 바이오마커는 다음: miR-125b-5p, miR-451a, 및 miR-3613-5p 중 적어도 하나, 적어도 둘, 또는 전부를 포함한다. 일부 구체예에서, 바이오마커는 다음: miR-125b-5p, let-7b, miR-150, miR-342, 및 miR-3613 중 적어도 하나, 적어도 둘, 또는 전부를 포함한다. 일부 경우에, 바이오마커는 추가로 miR-451을 포함할 수 있다.
일부 구체예에서, 본 발명의 바이오마커는 miR-125b-5p, miR-150-5p, miR-342-3p, miR-145-5p, miR-143-3p, miR-500a-3p, miR-451a, miR-18a-5p, miR-214-3p, miR-126-3p, miR-6755-3p, miR-3613-5p, miR-553, 및 miR-4668-3p중 하나 이상을 포함한다. 일부 구체예에서, 자궁내막증을 진단하기에 유용한 본 발명의 바이오마커는 miR-125b-5p, miR-150-5p, miR-342-3p, miR-145-5p, miR-143-3p, miR-500a-3p, miR-451a, miR-18a-5p, miR-214-3p, miR-126-3p, miR-6755-3p, miR-3613-5p, miR-553, 및 miR-4668-3p 중 하나 이상을 포함한다. 바람직한 구체예에서, 자궁내막증을 진단하기에 유용한 본 발명의 바이오마커는 miR-125b-5p, miR-451a 및 miR-3613-5p의 조합을 포함한다. 일부 구체예에서, 자궁내막증을 진단하기에 유용한 바이오마커는 다음: miR-125b-5p, let-7b, miR-150, miR-342, 및 miR-3613 중 적어도 2개를 포함한다. 일부 구체예에서, 자궁내막증을 진단하기에 유용한 바이오마커는 다음: miR-125b-5p, miR-451a, 및 miR-3613-5p 중 적어도 하나, 적어도 둘, 또는 전부를 포함한다. 일부 구체예에서, 자궁내막증을 진단하기에 유용한 바이오마커는 다음: miR-125b-5p, let-7b, miR-150, miR-342, 및 miR-3613 중 적어도 하나, 적어도 둘, 또는 전부를 포함한다. 일부 경우에, 그것들은 추가로 miR-451을 포함할 수 있다. 일부 경우에, 그것들은 추가로 let-7b를 포함할 수 있다.
일부 구체예에서, 본 발명의 바이오마커는 하향 조절된, 또는 정상 수준보다 낮은 수준으로 발현된, 자궁내막증과 관련된 하나 이상의 miRNA이다. 예를 들어, miR-6755, miR-3613, miR-553, 및 miR-4668은 자궁내막증을 가진 대상체에서 하향 조절되거나 정상 수준보다 낮은 수준으로 발현되는 것으로 본원에서 기술된다. 그러므로, 특정 구체예에서, 본 발명은 miR-6755, miR3613, miR-553, 및 miR-4668 중 적어도 하나의 감소된 수준의 검출을 기반으로 한, 그것을 필요로 하는 대상체에서 자궁내막증의 진단, 평가, 및 특성화에 유용한 조성물 및 방법에 관련된다.
일부 구체예에서, 본 발명의 바이오마커는 하향 조절된, 또는 정상 수준보다 낮은 수준으로 발현된, 자궁내막증과 관련된 하나 이상의 miRNA이다. 예를 들어, miR-6755-3p, miR-3613-5p, miR-553, 및 miR-4668-3은 자궁내막증을 가진 대상체에서 하향 조절되거나 정상 수준보다 낮은 수준으로 발현되는 것으로 본원에서 기술된다. 그러므로, 특정 구체예에서, 본 발명은 miR-6755-3p, miR3613-5p, miR-553, 및 miR-4668-3p 중 적어도 하나의 감소된 수준의 검출을 기반으로 한, 그것을 필요로 하는 대상체에서 자궁내막증의 진단, 평가, 및 특성화에 유용한 조성물 및 방법에 관련된다.
일부 구체예에서, 본 발명의 바이오마커는 상향 조절된, 또는 정상 수준보다 높은 수준으로 발현된, 자궁내막증과 관련된 하나 이상의 miRNA이다. 예를 들어, miR-125, miR-150, miR-342, miR-145, miR-143, miR-500, miR-451, miR-18, miR-214, 및 miR-126은 자궁내막증을 가진 대상체에서 상향 조절되거나 정상 수준보다 높은 수준으로 발현되는 것으로 본원에서 기술된다. 그러므로, 특정 구체예에서, 본 발명은 miR-125, miR-150, miR-342, miR-145, miR-143, miR-500, miR-451, miR-18, miR-214, 및 miR-126 중 적어도 하나의 증가된 수준의 검출을 기반으로 한, 그것을 필요로 하는 대상체에서 자궁내막증의 진단, 평가, 및 특성화에 유용한 조성물 및 방법에 관련된다. 일부 경우에, 다음의 miRNA 중 하나 이상이 자궁내막증을 가진 대상체에서 상향조절되거나 정상 수준보다 높은 수준으로 발현된다: let-7, let-7a, let-7b, let-7b-3p, let-7b-5p, let-7c, let-7d, let-7e, let-7f, 또는 let-7g.
일부 구체예에서, 본 발명의 바이오마커는 상향 조절된, 또는 정상 수준보다 높은 수준으로 발현된, 자궁내막증과 관련된 하나 이상의 miRNA이다. 예를 들어, miR-125b-5p, miR-150-5p, miR-342-3p, miR-145-5p, miR-143-3p, miR-500a-3p, miR-451a, miR-18a-5p, miR-214-3p, 및 miR-126-3p는 자궁내막증을 가진 대상체에서 상향 조절되거나 정상 수준보다 높은 수준으로 발현되는 것으로 본원에서 기술된다. 그러므로, 특정 구체예에서, 본 발명은 miR-125b-5p, miR-150-5p, miR-342-3p, miR-145-5p, miR-143-3p, miR-500a-3p, miR-451a, miR-18a-5p, miR-214-3p, 및 miR-126-3p 중 적어도 하나의 증가된 수준의 검출을 기반으로 한, 그것을 필요로 하는 대상체에서 자궁내막증의 진단, 평가, 및 특성화에 유용한 조성물 및 방법에 관련된다.
일부 구체예에서, 본 발명은 자궁내막증의 마커를 검출하는 방법을 제공한다. 일부 구체예에서, 본 발명은 치료에 대한 반응으로 miRNA의 수준을 모니터링하는 방법을 제공한다. 일부 구체예에서, 본 발명은 치료 후에 miR-125b-5p, miR-150-5p, miR-342-3p, miR-145-5p, miR-143-3p, miR-500a-3p, miR-451a, miR-18a-5p, miR-214-3p, miR-126-3p,miR-6755-3p, miR-3613-5p, miR-553, 및 miR-4668-3p 중 적어도 하나를 모니터링하는 방법을 제공한다. 일부 구체예에서, 본 발명은 자궁내막증 치료 후에 miR-125b-5p, miR-150-5p, miR-3613-5p 또는 그것들의 임의의 조합의 수준을 모니터링하는 방법을 제공한다. 일부 구체예에서, 본 발명은 종종 본원에서 제공된 또 다른 miRNA에 더불어 let-7, let-7a, let-7b, let-7b-3p, let-7b-5p, let-7c, let-7d, let-7e, let-7f, 또는 let-7g의 수준을 모니터링하는 방법을 제공한다. 일부 구체예에서, 모니터링된 miRNA는 다음: miR-125b-5p, let-7b, miR-150, miR-342, 및 miR-3613 중 적어도 2개이다. 일부 구체예에서, 모니터링된 miRNA는 다음: miR-125b-5p, miR-451a, 및 miR-3613-5p 중 적어도 하나, 적어도 둘, 또는 전부이다. 일부 구체예에서, 모니터링된 miRNA는 다음: miR-125b-5p, let-7b, miR-150, miR-342, 및 miR-3613 중 적어도 하나, 적어도 둘, 또는 전부이다.
일부 경우에, 방법은 다음의 miRNA: let-7a, let-7b, let-7c, let-7c, let-7d, let-7e, let-7f, 및 let-7g 중 적어도 하나의 수준을 측정함으로써 자궁내막증을 진단하는 단계를 포함할 수 있다. 일부 경우에, 방법은 다음의 miRNA: let-7a, let-7b, let-7c, let-7c, let-7d, let-7e, let-7f, 및 let-7g 중 적어도 2개의 수준을 측정함으로써 자궁내막증을 진단하는 단계를 포함할 수 있다. 일부 경우에, 방법은 다음의 miRNA: let-7a, let-7b, let-7c, let-7c, let-7d, let-7e, let-7f, 및 let-7g 중 적어도 3개의 수준을 측정함으로써 자궁내막증을 진단하는 단계를 포함할 수 있다.
일부 구체예에서, 본 발명은 표 1에 열거된 miRNA들 중 적어도 하나, 적어도 2개, 적어도 3개, 적어도 4개, 적어도 5개, 또는 적어도 10개를 검출하는 방법을 제공한다. 일부 구체예에서, 본 발명은 표 1에 열거된 서열들 중 적어도 하나에 대해 적어도 50%, 적어도 55%, 적어도 60%, 적어도 65%, 적어도 70%, 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 또는 적어도 100% 상동성을 가지는 핵산을 검출하는 방법을 제공한다.
| SEQ ID NO.: | 명칭 | 서열 |
| 1 | miR-18a-3p | ACUGCCCUAAGUGCUCCUUCUGG |
| 2 | miR-18a-5p | UAAGGUGCAUCUAGUGCAGAUAG |
| 3 | miR-18b-3p | UGCCCUAAAUGCCCCUUCUGGC |
| 4 | miR-18b-5p | UAAGGUGCAUCUAGUGCAGUUAG |
| 5 | miR-125a-3p | ACAGGUGAGGUUCUUGGGAGCC |
| 6 | miR-125a-5p | UCCCUGAGACCCUUUAACCUGUGA |
| 7 | miR-125b-1-3p | ACGGGUUAGGCUCUUGGGAGCU |
| 8 | miR-125b-2-3p | UCACAAGUCAGGCUCUUGGGAC |
| 9 | miR-125b-5p | UCCCUGAGACCCUAACUUGUGA |
| 10 | miR-126-3p | UCGUACCGUGAGUAAUAAUGCG |
| 11 | miR-126-5p | CAUUAUUACUUUUGGUACGCG |
| 12 | miR-143-3p | UGAGAUGAAGCACUGUAGCUC |
| 13 | miR-143-5p | GGUGCAGUGCUGCAUCUCUGGU |
| 14 | miR-145-3p | GGAUUCCUGGAAAUACUGUUCU |
| 15 | miR-145-5p | GUCCAGUUUUCCCAGGAAUCCCU |
| 16 | miR-150-3p | CUGGUACAGGCCUGGGGGACAG |
| 17 | miR-150-5p | UCUCCCAACCCUUGUACCAGUG |
| 18 | miR-214-3p | ACAGCAGGCACAGACAGGCAGU |
| 19 | miR-214-5p | UGCCUGUCUACACUUGCUGUGC |
| 20 | miR-342-3p | UCUCACACAGAAAUCGCACCCGU |
| 21 | miR-342-5p | AGGGGUGCUAUCUGUGAUUGA |
| 22 | miR-451a | AAACCGUUACCAUUACUGAGUU |
| 23 | miR-451b | UAGCAAGAGAACCAUUACCAUU |
| 24 | miR-500a-3p | AUGCACCUGGGCAAGGAUUCUG |
| 25 | miR-500a-5p | UAAUCCUUGCUACCUGGGUGAGA |
| 26 | miR-500b-3p | GCACCCAGGCAAGGAUUCUG |
| 27 | miR-500b-5p | AAUCCUUGCUACCUGGGU |
| 28 | miR-553 | AAAACGGUGAGAUUUUGUUUU |
| 29 | miR-3613-3p | ACAAAAAAAAAAGCCCAACCCUUC |
| 30 | miR-3613-5p | UGUUGUACUUUUUUUUUUGUUC |
| 31 | miR-4668-3p | GAAAAUCCUUUUUGUUUUUCCAG |
| 32 | miR-4668-5p | AGGGAAAAAAAAAAGGAUUUGUC |
| 33 | miR-6755-3p | UGUUGUCAUGUUUUUUCCCUAG |
| 34 | miR-6755-5p | UAGGGUAGACACUGACAACGUU |
| 35 | let-7b-3p | CUAUACAACCUACUGCCUUCCC |
| 36 | let-7b-5p | UGAGGUAGUAGGUUGUGUGGUU |
따라서, 본 발명은, 흔히 상대적으로 높은 민감도를 가진, 자궁내막증의 마커를 검출하기 위한, 새롭고 편리한 플랫폼을 제공할 수 있다. 일부 구체예에서, 본 발명의 시스템은 적어도 80% 민감도, 바람직하게는 적어도 90%, 바람직하게는 적어도 91%, 바람직하게는 적어도 92%, 바람직하게는 적어도 93%, 바람직하게는 적어도 94%, 바람직하게는 적어도 95%, 바람직하게는 적어도 96%, 바람직하게는 적어도 97%, 바람직하게는 적어도 98%, 바람직하게는 적어도 99%, 바람직하게는 적어도 100% 민감도로 자궁내막증의 마커를 검출하기 위한 플랫폼을 제공한다.
일부 구체예에서, 본 발명의 시스템은 자궁내막증의 마커를 검출하기 위한 플랫폼을 제공한다. 일부 구체예에서, 본 발명의 시스템은 적어도 80% 특이도, 바람직하게는 적어도 90%, 바람직하게는 적어도 91%, 바람직하게는 적어도 92%, 바람직하게는 적어도 93%, 바람직하게는 적어도 94%, 바람직하게는 적어도 95%, 바람직하게는 적어도 96%, 바람직하게는 적어도 97%, 바람직하게는 적어도 98%, 바람직하게는 적어도 99%, 바람직하게는 적어도 100% 특이도로 자궁내막증의 마커를 검출하기 위한 플랫폼을 제공한다.
일부 구체예에서, 본 발명은 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 100% 민감도; 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 100% 특이도; 또는 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 100% 민감도 및 특이도 둘 다로, 자궁내막증의 마커를 검출하기 위한 시스템을 제공한다. 일부 구체예에서, 본 발명은 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 100% 정확도로 자궁내막증의 마커를 검출하기 위한 시스템을 제공한다.
따라서, 본 발명은, 흔히 상대적으로 높은 민감도를 가진, 자궁내막증의 하나 이상의 마커를 검출하기 위한, 새롭고 편리한 방법을 제공할 수 있다. 일부 구체예에서, 방법은 자궁내막증을 적어도 80% 민감도, 바람직하게는 적어도 90%, 바람직하게는 적어도 91%, 바람직하게는 적어도 92%, 바람직하게는 적어도 93%, 바람직하게는 적어도 94%, 바람직하게는 적어도 95%, 바람직하게는 적어도 96%, 바람직하게는 적어도 97%, 바람직하게는 적어도 98%, 바람직하게는 적어도 99%, 바람직하게는 적어도 100% 민감도로 검출 또는 진단한다.
일부 구체예에서, 본 발명의 방법은 적어도 80% 특이도, 바람직하게는 적어도 90%, 바람직하게는 적어도 91%, 바람직하게는 적어도 92%, 바람직하게는 적어도 93%, 바람직하게는 적어도 94%, 바람직하게는 적어도 95%, 바람직하게는 적어도 96%, 바람직하게는 적어도 97%, 바람직하게는 적어도 98%, 바람직하게는 적어도 99%, 바람직하게는 적어도 100% 특이도으로 자궁내막증을 검출한다. 일부 구체예에서, 본 발명은 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 100% 민감도; 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 100% 특이도; 또는 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 100% 민감도 및 특이도 둘 다로 자궁내막증을 검출 또는 진단하는 방법을 제공한다. 일부 구체예에서, 본 발명은 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 100% 정확도로 자궁내막증을 진단하는 방법을 제공한다.
샘플 제조
비세포성 체액의 테스트 샘플 또는 세포-함유 샘플은 개체 또는 환자로부터 얻어질 수 있다. 테스트 샘플을 얻는 방법은 당업자들에게 잘 알려져 있고, 이에 한정되는 것은 아니지만, 혈액 또는 기타 유체의 흡인 또는 유출을 포함한다. 샘플로는, 이에 한정되는 것은 아니지만, 전혈, 혈청, 혈장, 타액, 뇌척수액(CSF), 심장막액, 흉수(pleural fluid), 소변, 및 눈의 유체를 들 수 있다. 테스트 샘플이 세포를 함유하는 일부 구체예에서, 세포는 샘플의 액체 부분으로부터 비세포성 체액을 생산하기 위하여 당업계에 알려져 있는 방법들(예컨대 원심분리)에 의하여 제거될 수 있다. 적합한 구체예에서, 혈청 또는 혈장은 비세포성 체액 샘플로서 사용된다. 혈장 및 혈청은 전혈로부터 당업계에 잘 알려져 있는 적합한 방법을 사용하여 제조될 수 있다. 이런 구체예들에서, 데이터는 비세포성 체액의 부피에 의해 표준화될 수 있다.
일부 구체예에서, 타액의 테스트 샘플이 대상체로부터 얻어질 수 있다. 타액 샘플을 얻는 방법으로는, 이에 한정되는 것은 아니지만, 대상체의 구강으로부터의 강제 방출(예컨대, 침뱉기), 흡인, 면봉 또는 기타 수집 도구에 의한 제거, 또는 업계에 알려져 있는 임의의 다른 방법을 들 수 있다. 본원에서 사용되는 용어 "타액"은 가래를 포함하지 않는데, 왜냐하면 가래는 점액 또는 담 샘플에 속하기 때문이다. 일부 구체예에서, 타액은 당업계에 알려져 있는 방법(예컨대 원심분리)에 의해 세포성 및 비-세포성 분획으로 분리될 수 있다. 일부 구체예에서, 핵산은 세포성 및 비-세포성 분획으로부터 추출될 수 있다.
세포-함유 샘플의 샘플 제조의 변동성은 데이터를, 예를 들어 단백질 함량 또는 세포 수의 표준화에 의해 교정될 수 있다. 특정 구체예에서, 샘플은 샘플 중의 총 단백질 함량에 관하여 표준화될 수 있다. 샘플 중의 총 단백질 함량은, 제한 없이, Bradford 검정 및 Lowry 방법을 포함한, 표준 과정을 사용하여 측정될 수 있다. 다른 구체예에서, 샘플은 세포 수에 관하여 표준화될 수 있다.
검정(Assays)
본 발명은 특정 miRNA의 발현 수준이 자궁내막증의 존재, 발달, 진행 및 중증도와 관련된다는 발견에 관련된다. 다양한 구체예에서, 본 발명은 대상체에서 자궁내막증과 관련된 적어도 하나의 miRNA의 발현 수준을 측정하기 위하여 대상체의 유전자 스크리닝 검정에 관련된다. 본 발명은 자궁내막증과 관련된 적어도 하나의 miRNA의 수준을 평가하는 방법뿐만 아니라, 자궁내막증과 관련된 적어도 하나의 miRNA의 발현 수준을 기반으로 하여 대상체를 자궁내막증을 가지는 것으로, 또는 자궁내막증에 걸릴 위험이 있는 것으로 진단하는 방법을 제공한다. 일부 구체예에서, 본원에 기술된 진단용 검정은 시험관내 검정이다.
일부 구체예에서, 본 발명의 방법은 자궁내막증과 관련된 적어도 하나의 miRNA의 수준이 대상체로부터 얻어진 생물학적 샘플에서 감소되는지의 여부를 측정함으로써, 필요로 하는 대상체에서 자궁내막증의 존재, 발달, 진행 및 중증도를 평가하기 위한 진단용 검정이다. 다양한 구체예에서, 자궁내막증과 관련된 적어도 하나의 miRNA의 수준이 대상체로부터 얻어진 생물학적 샘플에서 감소되는지의 여부를 측정하기 위하여, 적어도 하나의 miRNA의 수준이 적어도 하나의 비교기 대조군, 예컨대 양성 대조군, 음성 대조군, 정상 대조군, 야생형 대조군, 과거 대조군, 과거 표준, 또는 생물학적 샘플 중의 또 다른 기준 분자의 수준과 비교된다. 일부 구체예에서, 본 발명의 진단용 검정은 시험관내 검정이다. 다른 구체예에서, 본 발명의 진단용 검정은 생체내 검정이다. 검정에 의해 확인된 miRNA는 자궁내막증과 관련된 임의의 miRNA일 수 있다. 일부 구체예에서, miRNA는 miR-125, miR-150, miR-342, miR-145, miR-143, miR-500, miR-451, miR-18, miR-214, miR-126, miR-6755, miR-3613, miR-553, 및 miR-4668 중 적어도 하나이다. 검정에 의해 확인된 miRNA는 자궁내막증과 관련된 임의의 miRNA일 수 있다. 일부 구체예에서, miRNA는 miR-125b-5p, miR-150-5p, miR-342-3p, miR-145-5p, miR-143-3p, miR-500a-3p, miR-451a, miR-18a-5p, miR-214-3p, miR-126-3p, miR-6755-3p, miR-3613-5p, miR-553, 및 miR-4668-3p 중 적어도 하나이다. 본 발명의 다양한 구체예에서, 자궁내막증과 관련된 적어도 하나의 miRNA는 적어도 2개의 miRNAs, 적어도 3개의 miRNAs, 적어도 4개의 miRNAs, 적어도 5개의 miRNAs, 적어도 6개의 miRNAs, 적어도 7개의 miRNAs, 적어도 8개의 miRNA이다. 진단용 검정의 결과는 단독으로, 또는 대상체로부터의 다른 정보, 또는 대상체로부터 얻어진 생물학적 샘플로부터의 다른 정보와 조합되어 사용될 수 있다.
본 발명의 검정의 다양한 구체예에서, 자궁내막증과 관련된 적어도 하나의 miRNA의 수준은 적어도 하나의 miRNA의 수준이 비교기 대조군과 비교할 때, 적어도 10% 만큼, 적어도 20% 만큼, 적어도 30% 만큼, 적어도 40% 만큼, 적어도 50% 만큼, 적어도 60% 만큼, 적어도 70% 만큼, 적어도 80% 만큼, 적어도 90% 만큼, 적어도 100% 만큼, 적어도 125% 만큼, 적어도 150% 만큼, 적어도 175% 만큼, 적어도 200% 만큼, 적어도 250% 만큼, 적어도 300% 만큼, 적어도 400% 만큼, 적어도 500% 만큼, 적어도 600% 만큼, 적어도 700% 만큼, 적어도 800% 만큼, 적어도 900% 만큼, 적어도 1000% 만큼, 적어도 1500% 만큼, 적어도 2000% 만큼, 또는 적어도 5000% 만큼 감소될 때 하향 조절되는 것으로 측정된다.
본 발명의 검정의 다양한 구체예에서, 자궁내막증과 관련된 적어도 하나의 miRNA의 수준은 적어도 하나의 miRNA의 수준이 비교기 대조군과 비교할 때, 적어도 10% 만큼, 적어도 20% 만큼, 적어도 30% 만큼, 적어도 40% 만큼, 적어도 50% 만큼, 적어도 60% 만큼, 적어도 70% 만큼, 적어도 80% 만큼, 적어도 90% 만큼, 적어도 100% 만큼, 적어도 125% 만큼, 적어도 150% 만큼, 적어도 175% 만큼, 적어도 200% 만큼, 적어도 250% 만큼, 적어도 300% 만큼, 적어도 400% 만큼, 적어도 500% 만큼, 적어도 600% 만큼, 적어도 700% 만큼, 적어도 800% 만큼, 적어도 900% 만큼, 적어도 1000% 만큼, 적어도 1500% 만큼, 적어도 2000% 만큼, 또는 적어도 5000% 만큼 증가될 때 상향 조절되는 것으로 측정된다.
본 발명의 검정의 다양한 구체예에서, 자궁내막증과 관련된 적어도 하나의 miRNA의 수준은 적어도 하나의 miRNA의 수준이 비교기 대조군과 비교될 때, 적어도 1.5-배, 적어도 2-배, 적어도 3-배, 적어도 5-배, 적어도 10-배, 적어도 25-배, 적어도 50-배, 적어도 100-배, 적어도 150-배, 적어도 200-배, 또는 적어도 500-배 감소될 때 하향 조절되는 것으로 측정된다. 본 발명의 검정의 다양한 구체예에서, 자궁내막증과 관련된 적어도 하나의 miRNA의 수준은 적어도 하나의 miRNA의 수준이 비교기 대조군과 비교될 때, 적어도 1.5-배, 적어도 2-배, 적어도 3-배, 적어도 5-배, 적어도 10-배, 적어도 25-배, 적어도 50-배, 적어도 100-배, 적어도 150-배, 적어도 200-배, 또는 적어도 500-배 증가될 때 상향 조절되는 것으로 측정된다.
본 발명의 검정 방법에서, 대상체로부터의 테스트 생물학적 샘플은 자궁내막증과 관련된 적어도 하나의 miRNA의 발현 수준에 대해 평가된다. 테스트 생물학적 샘플은 시험관내 샘플 또는 생체내 샘플일 수 있다. 다양한 구체예에서, 대상체는 인간 대상체이고, 임의의 인종, 성별 및 연령의 대상체일 수 있다. 대표적인 대상체는 자궁내막증을 가진 것으로 의심되는 사람들, 자궁내막증으로 진단되었던 사람들, 자궁내막증을 가지는 사람들, 자궁내막증을 가졌던 사람들, 자궁내막증의 재발 위험이 있는 사람들, 및 자궁내막증이 발병될 위험이 있는 사람들을 포함한다.
일부 구체예에서, 자궁내막증 관련된 miRNA-결합 분자는 자궁내막증의 진단을 위해 생체내에서 사용된다. 일부 구체예에서, 자궁내막증 관련된 miRNA-결합 분자는 본 발명의 자궁내막증 관련된 miRNA와 혼성화하는 핵산이다.
일부 구체예에서, 테스트 샘플은 자궁내막증과 관련된 miRNA를 포함하는 핵산의 적어도 단편을 함유하는 샘플이다. 본원에서 사용되는 용어 "단편"은 그것을 자궁내막증과 관련된 miRNA를 포함하는 것으로서 확인하기에 충분한 핵산의 부분(예컨대, DNA, mRNA 또는 cDNA)을 나타낸다.
일부 구체예에서, 테스트 샘플은 대상체로부터 얻어진 생물학적 샘플로부터 제조된다. 생물학적 샘플은 자궁내막증 관련된 miRNA를 포함하는 핵산을 함유하는 임의의 공급원, 예컨대 체액(예컨대, 혈액, 혈장, 혈청, 타액, 소변, 등), 또는 조직, 또는 엑소좀, 또는 세포, 또는 그것들의 조합으로부터의 샘플일 수 있다. 생물학적 샘플은, 예를 들자면, 생검 또는 유체 유출과 같은 적절한 방법에 의하여 얻어질 수 있다. 생물학적 샘플은 테스트 샘플로서 사용될 수 있다; 대안적으로, 생물학적 샘플은 폴리펩타이드, 핵산, 또는 핵산의 복사물(예컨대, 자궁내막증과 관련된 miRNA를 포함하는 핵산의 복사물)에 대한 접근을 향상시키기 위해 처리될 수 있고, 그런 후 처리된 생물학적 샘플은 테스트 샘플로서 사용될 수 있다. 예를 들어, 다양한 구체예에서, 핵산은 생물학적 샘플로부터, 방법에 사용하기 위하여 제조된다. 대안적으로, 또는 그에 더불어, 필요하다면, 자궁내막증과 관련된 miRNA의 발현 수준의 평가에서 테스트 샘플로서 사용하기 위하여, 생물학적 샘플 중의 핵산의 전부 또는 단편을 포함하는 핵산을 증폭시키기 위한 증폭 방법이 사용될 수 있다.
테스트 샘플은 대상체의 핵산에 존재하는 자궁내막증과 관련된 적어도 하나의 miRNA의 발현 수준을 측정하기 위해 평가된다. 일반적으로, miRNA를 검출하는 것은 테스트 샘플 중의 관심있는 miRNA를 함유하는 핵산의 존재 또는 부재를 측정함으로써 수행될 수 있다.
일부 구체예에서, 혼성화 방법, 예컨대 노던 분석, 또는 제자리 혼성화(in situ hybridization)가 사용될 수 있다(Current Protocols in Molecular Biology, 2012, Ausubel, F. et al., eds., John Wiley & Sons, 및 모든 보충자료 포함 참조). 예를 들어, 자궁내막증과 관련된 miRNA의 존재는 핵산 프로브에 대한 혼성화에 의해 나타날 수 있다. 본원에서 사용되는 "핵산 프로브"는 DNA 프로브 또는 RNA 프로브와 같은 핵산 프로브일 수 있다. 핵산 프로브의 사용의 대표적인 실례에 대해서는 예를 들어, 미국 특허 제 5,288,611호 및 제 4,851,330호를 참조한다.
관심있는 적어도 하나의 miRNA를 검출하기 위하여, 혼성화 샘플은 테스트 샘플을 적어도 하나의 핵산 프로브와 접촉시킴으로써 형성된다. miRNA를 검출하기 위한 바람직한 프로브는 miRNA에 혼성화할 수 있는 표지된 핵산 프로브이다. 핵산 프로브는, 예를 들어, 전장(full-length) 핵산 분자, 또는 그것의 일부분, 예컨대 길이가 적어도 10, 15, 또는 25개의 뉴클레오타이드이고 적절한 miRNA에 대한 엄격한 조건 하에서 특이적으로 혼성화하기에 충분한 올리고뉴클레오타이드일 수 있다. 혼성화 샘플은 관심있는 miRNA 표적에 대한 핵산 프로브의 특이적 혼성화를 가능하게 하기에 충분한 조건 하에서 유지된다. 특이적 혼성화는, 필요에 따라, 매우 엄격한 조건 또는 보통의 엄격한 조건 하에서 수행될 수 있다. 바람직한 구체예에서, 특이적 혼성화에 대한 혼성화 조건은 매우 엄격하다. 특이적 혼성화는, 존재하는 경우, 다음 단계로 표준 방법을 사용하여 검출된다. 만약 특이적 혼성화가 핵산 프로브와 테스트 샘플 중의 miRNA 사이에서 일어난다면, 핵산 프로브에 존재하는 서열은 또한 대상체의 miRNA에도 존재한다. 하나 이상의 핵산 프로브가 이 방법에서 동시에 사용될 수 있다. 핵산 프로브들 중 임의의 하나의 특이적 혼성화는 본원에 기술된 것과 같이, 관심있는 miRNA의 존재를 나타낸다.
대안적으로, 펩타이드 핵산(PNA) 프로브가 본원에 기술된 혼성화 방법에서 핵산 프로브 대신 사용될 수 있다. PNA는 메틸렌 카르보닐 링커를 통해 글리신 질소에 부착된 유기 염기(A, G, C, T 또는 U)를 가진, 펩타이드-유사한, 무기 골격, 예컨대 N-(2-아미노에틸)글리신 단위를 가진 DNA 모방물이다(예를 들어, 1994, Nielsen et al., Bioconjugate Chemistry 5:1 참조). PNA 프로브는 관심있는 적어도 하나의 miRNA를 포함하는 핵산 서열에 특이적으로 혼성화하도록 설계될 수 있다. 핵산 서열에 대한 PNA 프로브의 혼성화는 관심있는 miRNA의 존재를 나타낸다.
직접 서열 분석이 또한 관심있는 miRNA를 검출하기 위해 사용될 수 있다. 핵산을 포함하는 샘플이 사용될 수 있고, PCR 또는 다른 적절한 방법이, 필요하다면, 핵산의 전체 또는 단편, 및/또는 그것의 플랭킹 서열을 증폭시키기 위해 사용될 수 있다.
다른 구체예에서, 대상체로부터의 표적 핵산 서열에 상보하는 올리고뉴클레오타이드 프로브의 어레이가 자궁내막증과 관련된 miRNA를 검출, 확인 및 정량화하기 위해 사용될 수 있다. 예를 들어, 일부 구체예에서, 올리고뉴클레오타이드 어레이가 사용될 수 있다. 올리고뉴클레오타이드 어레이는 전형적으로 상이한 공지된 위치에서 기질의 표면에 결합되는 복수의 상이한 올리고뉴클레오타이드 프로브를 포함한다. "유전자칩"으로도 알려져 있는 이런 올리고뉴클레오타이드 어레이는 일반적으로 당업계에, 예를 들면 미국 특허 제 5,143,854호 및 PCT 특허 출원 WO 90/15070 및 92/10092에 기술되어 있다. 이런 어레이들은 일반적으로 포토리소그래픽 방법 및 고상 올리고뉴클레오타이드 합성법의 조합을 포함하는 기계적 합성법 또는 광 유도 합성 방법(light directed synthesis method)을 사용하여 제조될 수 있다. Fodor et al., Science, 251:767-777 (1991), Pirrung et al., 미국 특허 제 5,143,854호(또한 PCT 출원 번호 WO 90/15070) 및 Fodor et al., PCT 공개 번호 WO 92/10092 및 미국 특허 제 5,424,186호 참조. 기계적 합성법을 사용하는 이런 어레이들의 합성을 위한 기법은 예컨대 미국 특허 제 5,384,261호에 기술된다.
올리고뉴클레오타이드 어레이가 제조된 후, miRNA를 함유하는 샘플이 어레이와 혼성화되고 miRNA에 대해 스캔된다. 혼성화 및 스캐닝은 일반적으로 본원에 및, 예컨대, 공개된 PCT 출원 WO 92/10092 및 WO 95/11995, 및 미국 특허 제 5,424,186호(이것들의 전체 교시는 본원에 참조로 포함됨)에 기술된 방법에 의해 수행된다.
간단히 설명하면, 표적 miRNA 서열은 잘 알려져 있는 증폭 기법, 예컨대, RT, PCR에 의해 증폭된다. 전형적으로, 이것은 표적 miRNA에 상보하는 프라이머 서열의 사용을 포함한다. 그런 다음, 일반적으로 표지를 포함하는 증폭된 표적이 적절한 조건 하에서 어레이와 혼성화된다. 어레이의 혼성화 및 세척이 완료되었을 때, 어레이는 표적 서열이 혼성화하는 어레이 상의 위치를 측정하기 위해 스캐닝된다. 스캔으로부터 얻어진 혼성화 데이터는 전형적으로 어레이 상의 위치의 함수로서의 형광 세기의 형태이다.
핵산 분석의 다른 방법들이 관심있는 miRNA를 검출하기 위해 사용될 수 있다. 대표적인 방법으로는 직접 수동 서열분석(direct manual sequencing, 1988, Church and Gilbert, Proc. Natl. Acad. Sci. USA 81:1991-1995; 1977, Sanger et al., Proc. Natl. Acad. Sci. 74:5463-5467; Beavis et al. U.S. Pat. No. 5,288,644); 자동화된 형광 서열분석; 단일 가닥의 형태 다형태 검정(SSCP); 클램프 변성 겔 전기영동(CDGE); 변성 구배 겔 전기영동(DGGE)(Sheffield et al., 1981, Proc. Natl. Acad. Sci. USA 86:232-236), 이동성 시프트 분석(Orita et al., 1989, Proc. Natl. Acad. Sci. USA 86:2766-2770; Rosenbaum and Reissner, 1987, Biophys. Chem. 265:1275; 1991, Keen et al., Trends Genet. 7:5); RNase 보호 검정(Myers, et al., 1985, Science 230:1242); LuminexxMAPTM 기술; 고처리량 서열분석(HTS)(Gundry and Vijg, 2011, Mutat Res, doi:10.1016/j.mrfmmm.2011.10.001); 차세대 서열분석(NGS)(Voelkerding et al., 2009, Clinical Chemistry 55:641-658; Su et al., 2011, Expert Rev MolDiagn. 11:333-343; Ji and Myllykangas, 2011, Biotechnol Genet Eng Rev 27:135-158); 및/또는 이온 반도체 서열분석(Rusk, 2011, Nature Methods doi:10.1038/nmeth.f.330; Rothberg et al., 2011, Nature 475:348-352)을 들 수 있다. 이런 및 다른 방법들은 단독으로 또는 조합되어, 대상체로부터 얻어진 생물학적 샘플 중의, 관심있는 적어도 하나의 miRNA를 검출하고 정량화하기 위해 사용될 수 있다. 본 발명의 일부 구체예에서, 관심있는 miRNA를 검출 및 정량화하기 위하여 생물학적 샘플을 평가하는 방법은, 본원에 기술된 것과 같이, 필요로 하는 대상체에서 자궁내막증을 진단, 평가 및 특성화하기 위해 사용된다.
일부 구체예에서, 서열분석은 차세대 서열분석 검정을 사용하여 수행될 수 있다. 본워에서 사용되는 용어 "차세대"는 당업계에서 잘 인지되고 일반적으로, 이에 한정되는 것은 아니지만, 다음 중 하나 이상을 포함하는, 임의의 고처리량 서열분석 접근법을 나타낸다: 대규모-병렬 시그니처 서열분석, 피로서열분석(예컨대, Roche 454 서열분석 장치를 사용함), Illumina(Solexa) 서열분석, 합성에 의한 서열분석(Illumina), 이온 토렌트(torrent) 서열분석, 결찰에 의한 서열분석(예컨대, SOLiD 서열분석), 단일 분자 실시간(SMRT) 서열분석(예컨대, Pacific Bioscience), 폴로니(polony) 서열분석, DNA 나노볼(nanoball) 서열분석, 헬리스코프 단일 분자 서열분석(Helicos Biosciences), 및 나노기공 서열분석(예컨대, Oxford Nanopore). 일부 경우에, 서열분석 검정은 나노기공 서열분석을 사용한다. 일부 경우에, 서열분석 검정은 Sanger 서열분석의 일부 형태를 포함한다. 일부 경우에, 서열분석은 샷건 서열분석을 포함하고; 일부 경우에, 서열분석은 가교 PCR을 포함한다. 일부 경우에, 서열분석은 광범위 스펙트럼이다. 일부 경우에, 서열분석은 표적화된다.
본 발명에 따르는 프로브 및 프라이머는 당업자들에게 잘 알려져 있는 방법들에 의해, 검출 가능한 및/또는 정량화 가능한 신호를 얻기 위하여 방사성 또는 비방사성 화합물로 직접 또는 간접적으로 표지될 수 있다; 본 발명에 따르는 프라이머 또는 프로브의 표지화는 방사성 요소 또는 비방사성 분자로 수행된다. 사용된 방사성 동위원소 중에서, 32P, 33P, 35S 또는 3H를 언급할 수 있다. 비방사성 실체는 비오틴, 아비딘, 스트렙트아비딘 또는 디곡시게닌, 합텐, 염료, 및 발광제, 예컨대 방사성발광제, 화학발광제, 생물발광제, 형광제 또는 인광제와 같은 리간드로부터 선택된다.
핵산은 공지의 기법을 사용하여 생물학적 샘플로부터 얻어질 수 있다. 여기서 핵산은 mRNA, miRNA, 등을 포함한 RNA를 포함한다. 핵산은 이중 가닥이거나 단일 가닥(즉, 센스 또는 안티센스 단일 가닥)일 수 있고 폴리펩타이드를 암호화하는 핵산에 상보할 수 있다. 핵산 함량은 또한 신선한 또는 고정된 생물학적 샘플에 대해 수행된 추출로부터 얻어질 수 있다.
특이적 핵산 서열의 검출을 위한 많은 방법이 당업계에 알려져 있고 새로운 방법들이 연속적으로 보고된다. 대다수의 공지된 특이적 핵산 검출 방법은 특이적 혼성화 반응에 핵산 프로브를 이용한다.
노던 블롯에서, 핵산 프로브는 바람직하게는 태그로 표지된다. 그 태그는 방사성 동위원소, 형광 염료 또는 다른 잘 알려져 있는 물질일 수 있다. 당업계에 알려져 있는 신체 샘플 중의 외인성 유기체의 핵산의 특이적 검출을 위한 또 다른 유형의 방법은 미국 특허 제 6,159,693호 및 제 6,270,974호, 및 관련 특허에 의해 예시된 혼성화 방법이다. 그런 방법들 중 하나를 간단히 요약하면, 관심있는 표적 핵산의 원하는 영역에 상보하는 서열을 가진, 적어도 10개 뉴클레오타이드, 바람직하게는 적어도 15개 뉴클레오타이드, 보다 바람직하게는 적어도 25개 뉴클레오타이드의 핵산 프로브가 샘플에서 혼성화되고, 탈중합 조건이 수행되며, 샘플은, 핵 서열이 존재한다면 발광할 ATP/루시페라제 시스템으로 처리된다. 정량적 노던 블롯팅에서, 다형태 핵산의 수준은 핵산의 야생형 수준과 비교될 수 있다.
혼성화된 핵산의 검출을 위한 추가의 방법은 중합효소 연쇄 반응(PCR)의 장점을 취한다. PCR 방법은 당업계에 잘 알려져 있다(미국 특허 제 4,683,195호, 제 4,683,202호, 및 제 4,800,159호). PCR을 간단히 요약하면, 핵산 증폭 표적 핵산 서열의 반대 가닥에 상보하는 핵산 프라이머가 변성된 샘플에 어닐링되도록 허용된다. DNA 중합효소(전형적으로 열 안정적인)는 DNA 듀플렉스를 혼성화된 프라이머로부터 연장시킨다. 방법은 핵산 표적을 증폭시키기 위해 반복된다. 핵산 프라이머가 샘플에 혼성화하지 않으면, 상응하는 증폭된 PCR 생성물은 없다.
PCR에서, 핵산 프로브는 앞서 논의된 태그로 표지될 수 있다. 가장 바람직하게는 듀플렉스의 검출이 표적 핵산에 대해 지정된 적어도 하나의 프라이머를 사용하여 시행된다. PCR의 또 다른 구체예에서, 혼성화된 듀플렉스의 검출은 전기영동적 겔 분리와 이어서 염료-기반 시각화를 포함한다.
PCR에 의한 핵산 증폭 과정은 잘 알려져 있고 미국 특허 제 4,683,202호에서 기술된다. 간단히 설명하면, 프라이머는 서로 구별되는 및 반대 방향의 부위들에서 표적 핵산에 어닐링된다. 표적 서열에 어닐링된 프라이머는 열 안정성 중합효소의 효소 작용에 의해 연장된다. 연장 생성물은 그런 다음 가열에 의해 표적 서열로부터 변성되고, 방법이 반복된다. 두 가닥에 대한 이 과정의 연속적인 순환은 프라이머들에 의해 플랭킹된 영역의 지수적 증폭을 제공한다.
그런 다음 증폭이 PCR-형 기법, 즉, PCR 기법 또는 임의의 다른 관련된 기법을 사용하여 수행된다. 표적 핵산 서열에 상보하는 2개의 프라이머가 그런 다음 중합효소를 따라 핵산 내용물에 첨가되고, 중합효소는 프라이머들 사이의 DNA 영역을 증폭시킨다.
증폭은 핵산 서열의 복사물의 수를 증가시키기 위한 임의의 방법을 나타낼 수 있다. 예를 들어, 증폭은 중합효소로, 예컨대 하나 이상의 중합효소 연쇄 반응으로 수행될 수 있다. 증폭은 당업계에 알려져 있는 방법을 사용하여 수행될 수 있다. 이 방법들은 흔히 핵산 또는 그것의 보체의 다수의 복사물의 생성물 촉매된 형성에 좌우된다. 그런 방법들 중 하나는 AFLP(증폭된 단편 길이 다형태) PCR, 대립유전자-특이적 PCR, Alu PCR, 어셈블리, 비대칭 PCR, 콜로니 PCR, 헬리카제 의존성 PCR, 고온 출발(hot start) PCR, 반전 PCR, 제자리 PCR, 서열간-특이적 PCR 또는 IS SR PCR, 디지털 PCR, 액적 디지털 PCR, 지수형 후 선형(linear-after-the-exponential)-PCR 또는 후기 PCR, 긴 PCR, 중첩된(nested) PCR, 실시간 PCR, 듀플렉스 PCR, 멀티플렉스 PCR, 정량적 PCR, 또는 단일 셀 PCR을 포함한, 중합효소 연쇄 반응(PCR)이다. 리가아제 사슬 반응(LCR), 핵산 서열 기반 증폭(NASBA), 선형 증폭, 등온 선형 증폭, Q-베타-복제효소 방법, 3SR, 전사 매개 증폭(TMA), 가닥 치환 증폭(SDA), 또는 롤링 서클 증폭(Rolling Circle Amplification, RCA) 다른 증폭 방법 또한 사용될 수 있다.
스템-루프 RT-PCR은 관심있는 miRNA 를 증폭 및 정량화하기 위한 본 발명의 방법에 유용한 PCR 방법이다(Caifu et al., 2005, Nucleic Acids Research 33:e179; Mestdagh et al., 2008, Nucleic Acids Research 36:e143; Varkonyi-Gasic et al., 2011, Methods Mol Biol.744:145-57 참조). 간단히 설명하면, 방법은 두 단계를 포함한다: RT 및 실시간 PCR. 먼저, 스템-루프 RT 프라이머가 miRNA 분자에 혼성화되고 그런 후 역전사효소로 역전사된다. 그런 다음, RT 생성물이 종래의 실시간 PCR을 사용하여 정량화된다.
엄격한 조건에서 특이적으로 혼성화된다는 표현은 프로브 또는 프라이머로서 선택된 올리고뉴클레오타이드 서열이 증폭 중에 일어날 수 있는 비특이적 결합의 양을 최소화하기 위하여 적당한 길이 및 충분히 명백한 것으로서 선택되는, 본 발명의 방법에서 혼성화 단계를 나타낸다. 본원에서 기술된 올리고뉴클레오타이드 프로브 또는 프라이머는 화학적 합성법과 같은 임의의 적합한 방법에 의해 제조될 수 있다.
혼성화는 전형적으로 올리고뉴클레오타이드 프로브 또는 프라이머를, 비특이적 결합을 방지하지만 프로브 또는 프라이머와 유의한 상동성 수준을 가지는 주형 핵산의 결합을 허용하는 엄격한 조건 하에서 주형 핵산에 어닐링함으로써 이루어진다.
엄격한 조건 중에는 프라이머 세트를 사용하는 증폭 단계에 대한 용융 온도(Tm)가 있는데, 그것은 약 50℃ 내지 약 95℃의 범위이다. 전형적인 혼성화 및 세척 엄격성 조건은 부분적으로는 주형 핵산 또는 올리고뉴클레오타이드 프로브의 크기(즉, 길이로 뉴클레오타이드의 수), 염기 조성 및 일가 및 이가 양이온 농도에 좌우된다(Ausubel et al., 1994, eds Current Protocols in Molecular Biology).
바람직한 구체예에서, 본 발명에 따르는 정량적 및 정성적 프로파일을 측정하는 방법은 증폭이, 핵산 서열, 또는 다형태 핵산 서열의 분절과 엄격한 조건에서 특이적으로 혼성화할 수 있는 표지된 프로브, 바람직하게는 표지된 가수분해-프로브를 사용하여 수행된 실시간 증폭이라는 점에서 특성화된다. 표지된 프로브는 각 증폭 사이클이 일어나는 모든 시점에서 검출 가능한 신호를 방출할 수 있다.
실시간 PCR과 같은 실시간 증폭은 당업계에 잘 알려져 있고, 다양한 공지의 기법이 본 방법의 실행을 위해 최상의 방식으로 사용될 것이다. 이런 기법들은 가수분해 프로브, 혼성화 인접 프로브, 또는 분자 비콘(molecular beacon)과 같은, 프로브의 다양한 범주를 사용하여 수행된다. 가수분해 프로브 또는 분자 비콘을 사용하는 기법은 형광 소광물질/리포터 시스템의 사용을 기반으로 하고, 혼성화 인접 프로브는 형광 억셉터/도너 분자의 사용을 기반으로 한다.
형광 소광물질/리포터 시스템을 가진 가수분해 프로브는 시판 중이며, 예를 들어 Applied Biosystems 그룹(미국)에 의해 상용화된다. 많은 형광 염료, 예컨대 FAM 염료(6-카르복시-플루오레세인), 또는 임의의 다른 염료 포스포라미다이트 시약이 사용될 수 있다.
본 발명의 가수분해-프로브들 중 임의의 하나에 대해 적용된 엄격한 조건 중에 Tm이 있는데, 그것은 약 50℃ 내지 95℃의 범위이다. 바람직하게, 본 발명의 가수분해-프로브들 중 임의의 하나에 대한 Tm은 약 55℃ 내지 약 80℃의 범위이다. 가장 바람직하게, 본 발명의 가수분해-프로브들 중 임의의 하나에 대한 Tm은 약 75℃이다.
또 다른 바람직한 구체예에서, 본 발명에 따르는 정량적 및 정성적 프로파일을 측정하는 방법은 증폭 생성물이 신장될 수 있다는 점에서 특성화되며, 여기서 신장 생성물은 그것의 길이에 관련하여 분리된다. 신장 생성물에 대해 얻어진 신호는 측정되며, 신장 생성물 길이에 관련하여 표지화 세기의 정량적 및 정성적 프로파일이 확립된다.
런-오프(run-off) 반응으로도 불리는 신장 단계는 당업자가 증폭 생성물의 길이를 측정하는 것을 가능하게 한다. 길이는, 예를 들어, 분리용 폴리아크릴아미드 겔과 같은 겔, DNA 서열분석기, 및 조정된 소프트웨어를 사용하는 종래의 기법을 사용하여 측정될 수 있다. 일부 돌연변이가 길이 이질성을 나타내기 때문에, 일부 돌연변이는 신장 생성물의 길이의 변화에 의해 측정될 수 있다.
한 측면으로, 본 발명은 관심있는 miRNA의 핵산 서열에 상보하는 프라이머를 포함하고, 보다 구체적으로 프라이머는 관심있는 miRNA의 서열에 실질적으로 상보하는 12개 이상의 연속적인 뉴클레오타이드를 포함한다. 바람직하게, 본 발명의 특징적인 프라이머는 약 12 내지 25개 뉴클레오타이드의 핵산 서열에 혼성화하기 위해 충분히 상보하는 뉴클레오타이드 서열을 포함한다. 보다 바람직하게, 프라이머는 표적 뉴클레오타이드 서열과 1, 2, 또는 3개 이하의 뉴클레오타이드만큼 상이하다. 다른 측면으로, 프라이머의 길이는 길이가 달라질 수 있는데, 바람직하게는 길이로 약 15 내지 28개 뉴클레오타이드(예컨대, 길이로 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27 또는 28개 뉴클레오타이드)로 달라질 수 있다.
치료법 또는 예측의 유효성 측정
한 측면으로, 환자의 생물학적 샘플 중의 하나 이상의 순환하는 miRNA의 수준이 질환의 치료 또는 예측의 유효성을 모니터링하기 위해 사용된다. 일부 구체예에서, 치료된 환자로부터 얻어진 테스트 샘플 중의 하나 이상의 순환하는 miRNA의 수준은 치료가 개시되기 전 그 환자로부터 얻어진 기준 샘플로부터의 수준과 비교될 수 있다. 치료의 임상적인 모니터링은 전형적으로 각 환자가 환자 자신의 기준선 대조군으로서 작용하는 것을 수반한다. 일부 구체예에서, 테스트 샘플은 치료의 투여 후에 다중 시점에서 얻어진다. 이런 구체예들에서, 테스트 샘플 중의 하나 이상의 순환하는 miRNA의 수준의 측정은 치료의 생체내 효과의 정도 및 기간의 표시를 제공한다.
바이오마커 수준의 측정은 질환의 치료 과정이 모니터링되는 것을 가능하게 한다. 질환에 대한 치료 양생법의 유효성은 시간이 지남에 따라 대상체로부터 얻어진 샘플로부터의 유효량 중의 하나 이상의 바이오마커를 검출하고 검출된 바이오마커의 양을 비교함으로써 모니터링될 수 있다. 예를 들어, 첫 번째 샘플은 대상체가 치료를 받기 전에 얻어질 수 있고 하나 이상의 후속되는 샘플은 대상체의 치료 후에 또는 도중에 취해진다. 샘플 전체에서 바이오마커 수준의 변화는 치료법의 유효성에 대한 것과 같은 표시를 제공할 수 있다.
일부 구체예에서, 본 발명은 치료에 대한 반응으로 miRNA의 수준을 모니터링하는 방법을 제공한다. 예를 들어, 특정 구체예에서, 본 발명은 본원에 기술된 하나 이상의 miRNA의 수준을 측정함으로써, 대상체에서 치료 효능을 측정하는 방법을 제공한다. 일부 구체예에서, 하나 이상의 miRNA의 수준은 시간 경과에 따라 측정될 수 있고, 여기서 치료의 개시 후 한 시점에서의 수준은 치료의 개시 후 또 다른 시점에서의 수준과 비교된다. 일부 구체예에서, 하나 이상의 miRNA의 수준은 시간 경과에 따라 측정될 수 있고, 여기서 치료의 개시 후 한 시점에서의 수준은 치료의 개시 전 수준과 비교된다. 일부 구체예에서, 본 발명은 치료 후 miR-125, miR-150, miR-342, miR-145, miR-143, miR-500, miR-451, miR-18, miR-214, miR-126,miR-6755, miR-3613, miR-553, 및 miR-4668 중 적어도 하나를 모니터링하는 방법을 제공한다. 일부 구체예에서, 본 발명은 자궁내막증 치료 후에 miR-125, miR-150, miR-3613 또는 그것들의 임의의 조합의 수준을 모니터링하는 방법을 제공한다.
일부 구체예에서, 본 발명은 치료 후 miR-125b-5p, miR-150-5p, miR-342-3p, miR-145-5p, miR-143-3p, miR-500a-3p, miR-451a, miR-18a-5p, miR-214-3p, miR-126-3p, miR-6755-3p, miR-3613-5p, miR-553, 및 miR-4668-3p 중 적어도 하나를 모니터링하는 방법을 제공한다. 일부 구체예에서, 본 발명은 자궁내막증 치료 후에 miR-125, miR-150, miR3613 또는 그것들의 임의의 조합의 수준을 모니터링하는 방법을 제공한다.
일부 구체예에서, 본 발명은 자궁내막증 치료의 효능을 평가하는 방법을 제공한다. 예를 들어, 일부 구체예에서, 방법은 miR-125의 수준이 치료를 받지 않은 대조군 질환 대상체 또는 집단과 비교하여 치료된 대상체의 샘플에서 감소된 때 치료가 효과적인 것을 나타낸다. 일부 구체예에서, 방법은 miR-150의 수준이 치료를 받지 않은 대조군 질환 대상체 또는 집단과 비교하여 치료된 대상체의 샘플에서 증가된 때 치료가 효과적인 것을 나타낸다. 일부 구체예에서, 방법은 miR-3613의 수준이 치료를 받지 않은 대조군 질환 대상체 또는 집단과 비교하여 치료된 대상체의 샘플에서 증가된 때 치료가 효과적인 것을 나타낸다.
일부 구체예에서, 본 발명은 자궁내막증 치료의 효능을 평가하는 방법을 제공한다. 예를 들어, 일부 구체예에서, 방법은 miR-125b-5p의 수준이 치료를 받지 않은 대조군 질환 대상체 또는 집단과 비교하여 치료된 대상체의 샘플에서 감소된 때 치료가 효과적인 것을 나타낸다. 일부 구체예에서, 방법은 miR-150-5p의 수준이 치료를 받지 않은 대조군 질환 대상체 또는 집단과 비교하여 치료된 대상체의 샘플에서 증가된 때 치료가 효과적인 것을 나타낸다. 일부 구체예에서, 방법은 miR-3613-5p의 수준이 치료를 받지 않은 대조군 질환 대상체 또는 집단과 비교하여 치료된 대상체의 샘플에서 증가된 때 치료가 효과적인 것을 나타낸다.
특정 대상체에 대해 적절한 치료제 또는 약물을 확인하기 위하여, 대상체로부터의 테스트 샘플은 또한 치료제 또는 약물에 노출될 수 있고, 하나 이상의 바이오마커의 수준이 측정될 수 있다. 바이오마커 수준은 치료제 또는 약물에 대한 치료 또는 노출 전과 후의 대상체로부터 유래된 샘플과 비교되거나, 또는 그러한 치료 또는 노출의 결과로서 질환에 관한 개선을 보여준 한 명 이상의 대상체로부터 유래된 샘플과 비교될 수 있다. 그러므로, 한 측면으로, 본 발명은 대상체로부터의 제 1 샘플에서 바이오마커 패널의 제 1 측정을 취하는 단계; 대상체와 관련하여 치료법을 실시하는 단계; 대상체로부터의 제 2 샘플 중의 바이오마커 패널의 제 2 측정을 취하고 치료법의 효능을 평가하기 위하여 제 1 측정과 제 2 측정을 비교하는 단계를 포함하는, 대상체와 관련하여 치료법의 효능을 평가하는 방법을 제공한다.
추가적으로, 특정 대상체에게 투여하기에 적합한 치료제는 대상체로부터 얻어진 샘플로부터의 유효량에서 하나 이상의 바이오마커를 검출하는 단계 및 대상체-유래 샘플 중의 바이오마커(들)의 양을 측정하는 테스트 화합물에 대상체-유래 샘플을 노출시키는 단계에 의해 확인될 수 있다. 따라서, 자궁내막증을 가진 대상체에서 사용하기 위한 치료 또는 치료 양생법은 대상체로부터 얻어진 샘플 중의 바이오마커의 양을 기반으로 선택되고 기준 값과 비교될 수 있다. 둘 이상의 치료 또는 치료 양생법은 질환의 개시를 지연시키기 위하여, 또는 질환의 진행을 둔화시키기 위하여 대상체에서 사용하기에 가장 효과적일 수 있을 치료 또는 치료 양생법을 측정하기 위해 나란히 평가될 수 있다. 다양한 구체예에서, 질환을 치료를 개시하는지 또는 계속하는지에 대한 권고가 이루어진다.
예측은 환자가 생존할 것으로 예상될 수 있는 시간의 양으로서 표시될 수 있다. 대안적으로, 예측은 질환이 차도를 보이는 가능성 또는 질환이 차도를 유지할 것으로 예상될 수 있는 시간의 양을 나타낼 수 있다. 예측은 다양한 방식으로 표현될 수 있다; 예를 들어, 예측은 환자가 1년 후, 5년 후, 10년 후 등에 생존할 퍼센트 기회로서 표현될 수 있다. 대안적으로, 예측은 환자가 질병 또는 질환의 결과로서 생존할 것으로 예상될 수 있는 평균적인 연수로서 표현될 수 있다. 환자의 예측은 궁극적인 결과에 영향을 미치는 많은 인자들을 포함한, 상대적인 표현으로서 간주될 수 있다. 예를 들어, 특정 질병을 가진 환자의 경우, 예측은 질병이 치료될 수 있거나 치유될 수 있는 가능성, 또는 질환이 차도를 보일 가능성으로서 적절하게 표현될 수 있는 반면, 보다 중증의 질병을 가진 환자의 경우 예측은 명시된 기간 동안 생존할 가능성으로서 보다 적절하게 표현될 수 있다. 추가적으로, 기준선 수준으로부터의 임상적 인자의 변화는 환자의 예측에 영향을 줄 수 있고, 임상 인자의 수준의 변화의 정도는 부작용의 중증도와 관련이 있을 수 있다. 통계적 유의성은 흔히 둘 이상의 집단을 비교하고, 신뢰도 간격 및/또는 p 값을 측정함으로써 측정된다.
순환하는 miRNA 수준의 다중 측정이 이루어질 수 있고, 활성의 일시적인 변화는 예측을 측정하기 위해 사용될 수 있다. 예를 들어, 환자의 비세포성 체액의 순환하는 miRNA가 다중 시점에서 비교 측정될 수 있고, 둘 이상의 시점에서 순환하는 miRNA 값의 비교가 특정 예측을 나타내는 것일 수 있다.
특정 구체예에서, 하나 이상의 순환하는 miRNA의 활성 수준이 바람직하지 못한 예측의 지표로서 사용된다. 방법에 따르면, 예측의 측정은 측정된 순환하는 miRNA 수준을 건강한 개체로부터의 비슷한 샘플에서 측정된 수준과 또는 바람직한 또는 바람직하지 못한 결과와 상응하는 것으로 알려진 수준과 비교함으로써 수행될 수 있다. 얻어진 순환하는 miRNA 수준은, 이에 한정되는 것은 아니지만, 검정을 수행하는 실험실, 사용된 검정 방법, 사용된 체액 샘플의 유형 및 환자가 걸린 질환의 유형을 포함한, 많은 인자에 좌우될 수 있다. 방법에 따라, 값은 특정 장애를 가진 일련의 환자들로부터 그 장애에 대한 순환하는 miRNA의 적절한 기준 범위를 측정하기 위하여 수집될 수 있다. 당업자는 측정된 수준을 환자들의 관찰된 결과와 비교하는 후향적 연구를 수행하고 특정 장애를 가진 환자들의 예측을 지정하기 위하여 사용될 수 있는 수준의 범위를 확립할 수 있다. 예를 들어, 최저 범위의 수준은 보다 유리한 예측을 나타내는 것일 수 있는 한편, 최고 범위의 순환하는 miRNA 수준은 바람직하지 못한 예측을 나타내는 것일 수 있다. 그러므로, 이 측면에서 용어 "상승된 수준"은 기준 값의 범위보다 높은 수준을 나타낸다. 일부 구체예에서, "높은" 또는 "상승된" 수준을 가진 환자들은 그 질환을 가진 환자 집단에서의 중앙치 활성보다 높은 수준을 가진다. 특정 구체예에서, 특정 질환을 가진 환자에 대해 "높은" 또는 "상승된" 수준은 그 장애를 가진 환자들에 대한 중간 값보다 위에 있고 그 장애를 가진 환자들의 상위 40% 내에 있는 수준을 나타내거나, 또는 그 장애를 가진 환자들의 상위 20% 내에 있는 수준을 나타내거나, 또는 그 장애를 가진 환자들의 상위 10% 내에 있는 수준을 나타내거나, 또는 그 장애를 가진 환자들의 상위 5% 내에 있는 수준을 나타낸다.
환자로부터의 테스트 샘플 중의 순환하는 miRNA의 수준이 연속적인 방식으로 환자의 예측과 관련되기 때문에, 예측의 측정은 측정된 순환하는 miRNA 수준을 환자의 예측에 연관시키기 위해 통계적 분석을 사용하여 수행될 수 있다. 당업자는 적절한 통계적 방법을 설계할 수 있다. 예를 들어, 방법은 예측을 측정하는 데 카이-제곱 테스트, 카플란-마이어 방법, 로그-등급 테스트, 다변량 로지스틱 회귀 분석, 콕스 비례 위험 모델 등을 사용할 수 있다. 컴퓨터 및 컴퓨터 소프트웨어 프로그램이 데이터를 조직화하고 통계적 분석을 수행하는 데 사용될 수 있다. Giles 등에 의한 접근법(Giles et. al., British Journal of Hemotology, 121:578-585)이 예시적이다. Giles 등의 방법에서와 같이, 범주형 변수들(예컨대, miRNA 수준 및 임상적 특성들) 사이의 관련은 교차 분석 및 피셔의 정확성 테스트를 통해 평가될 수 있다. 미조정 생존 확률은 카플란과 마이어의 방법을 사용하여 추정될 수 있다. 콕스 비례 위험 회귀 모델 또한 환자 특성(예컨대 miRNA 수준)의 생존율 예측 능력을, Grambsch-Therneau 테스트, Schoenfeld 잔차 그림, 마팅게일 잔차 그림 및 우도 비율 통계에 의해 평가된 '적합도'로 평가하기 위해 사용될 수 있다(Grambsch et al, 1995 참조). 일부 구체예에서, 이 접근법은 개인용 컴퓨터 또는 개인 정보 단말기(PDA)로 사용될 수 있는 간단한 컴퓨터 프로그램으로서 조정될 수 있다. 환자의 순환하는 miRNA 수준을 기반으로 한 환자의 생존 시간의 예측은 마이크로소프트 엑셀 내에서 개발된 비주얼 베이직 포 애플리케이션(VBA) 컴퓨터 프로그램의 사용을 통하여 수행될 수 있다. 핵심 구성 및 분석은 콕스 비례 위험 모델을 기반으로 할 수 있다. VBA 응용은 기본 위험률 및 매개변수 추정값을 얻음으로써 개발될 수 있다. 이런 통계적 분석은 SAS 비례 위험 회귀, PHREG, 과정과 같은 통계 프로그램을 사용하여 수행될 수 있다. 추정값은 그런 다음 환자의 공변량이 제공되면 1개월부터 24개월까지의 생존 가능성을 얻기 위해 사용될 수 있다. 프로그램은 주어진 환자의 예측된 생존 곡선의 그래픽 표현을 생성하기 위해 추정된 확률을 사용할 수 있다. 특정 구체예에서, 프로그램은 또한 6개월, 1년 및 18개월 생존 확률을 제공한다. 그래픽 인터페이스가 사용자에게 친숙한 방식으로 환자 특성을 입력하기 위해 사용될 수 있다. 본 발명의 일부 구체예에서, 순환하는 miRNA 수준을 포함한 다중 예측 인자가, 환자의 예측을 측정할 때 고려된다. 예를 들어, 자궁내막증 대상체의 예측은 체액 중의 miRNA의 존재 및, 세포유전학, 수행 상태, 연령, 성별 및 이전의 진단으로 구성되는 군으로부터 선택된 하나 이상의 예측 인자를 기반으로 측정될 수 있다. 또 다른 실례에서, 암 환자의 예측은 순환하는 miRNA 및, 세포유전학, 수행 상태, 연령, 성별 및 이전의 진단으로 구성되는 군으로부터 선택된 하나 이상의 예측 인자를 기반으로 측정될 수 있다. 특정 구체예에서, 다른 예측 인자들은 순환하는 miRNA 수준 또는 더 큰 정확도로 예측을 측정하기 위한 알고리즘의 다른 바이오마커와 조합될 수 있다.
치료
본 발명은 자궁내막증의 치료 또는 예방을 위한 치료 분자를 제공한다. 일부 구체예에서, 치료 분자는, 이에 한정되는 것은 아니지만 본 발명의 마커들의 억제제, 활성화제, 및 조정제를 포함한다. 예를 들어, 유전자가 자궁내막증에서 하향조절되면, 치료법의 형태로서 활성화제를 사용하여 하향조절된 유전자의 발현을 정상 수준으로 증가시키는 것이 바람직할 것이다. 활성화제는 자궁내막증 바이오마커들의 활성을 증가시키는, 개방하는, 활성화하는, 용이하게 하는, 활성화를 향상시키는, 민감화하는, 작용시키는, 또는 상향 조절하는 화합물이다. 대안적으로, 유전자가 자궁내막증에서 상향조절되면, 치료법의 형태로서 억제제를 사용하여 상향조절된 유전자의 발현을 정상 수준으로 감소시키는 것이 바람직할 것이다. 억제제는, 예컨대 자궁내막증 바이오마커들의 활성 또는 발현을 부분적으로 또는 전체적으로 활성을 차단하거나, 감소시키거나, 방지하거나, 활성화를 지연시키거나, 비활성화하거나, 탈감작시키거나, 또는 하향 조절하기 위해 결합하는 화합물이다.
본 발명의 마커들의 발현 수준을 증가 또는 감소시키기 위한 방법 및 물질은 잘 알려져 있고 당업자들의 숙련도 내에 있다. 공지된 방법 및 물질의 비제한적인 목록은 식이요법, 비타민, 식이 보충물, 유전자 치료 방법, 안티센스 올리고뉴클레오타이드, 약물 및 호르몬 약물치료를 포함한다.
본 발명은 본원에서 기술된 miRNA를 표적화함으로써 자궁내막증을 치료하는 방법을 제공한다. 예를 들어, 일부 구체예에서, 본 발명은 본원에서 기술된 하나 이상의 miRNA의 발현 또는 수준을 증가시키는 작용제를 투여하는 단계를 포함하는, 대상체에서 자궁내막증을 치료하는 방법을 제공한다. 예를 들어, 일부 구체예에서, 방법은 miR-6755, miR3613, miR-553, 및 miR-4668 중 하나 이상의 발현 또는 수준을 증가시키는 작용제를 투여하는 단계를 포함한다. 일부 구체예에서, 본 발명은 본원에서 기술된 하나 이상의 miRNA의 발현 또는 수준을 감소시키는 작용제를 투여하는 단계를 포함하는, 대상체에서 자궁내막증을 치료하는 방법을 제공한다. 예를 들어, 일부 구체예에서, 방법은 miR-125, miR-150, miR-342, miR-145, miR-143, miR-500, miR-451, miR-18, miR-214, 및 miR-126 중 하나 이상의 발현 또는 수준을 감소시키는 작용제를 투여하는 단계를 포함한다.
본 발명은는 본원에서 기술된 miRNA를 표적화함으로써 자궁내막증을 치료하는 방법을 제공한다. 예를 들어, 일부 구체예에서, 본 발명은 본원에서 기술된 하나 이상의 miRNA의 발현 또는 수준을 증가시키는 작용제를 투여하는 단계를 포함하는, 대상체에서 자궁내막증을 치료하는 방법을 제공한다. 예를 들어, 일부 구체예에서, 방법은 miR-6755-3p, miR3613-5p, miR-553, 및 miR-4668-3p 중 하나 이상의 발현 또는 수준을 증가시키는 작용제를 투여하는 단계를 포함한다. 일부 구체예에서, 본 발명은 본원에서 기술된 하나 이상의 miRNA의 발현 또는 수준을 감소시키는 작용제를 투여하는 단계를 포함하는, 대상체에서 자궁내막증을 치료하는 방법을 제공한다. 예를 들어, 일부 구체예에서, 방법은 miR-125b-5p, miR-150-5p, miR-342-3p, miR-145-5p, miR-143-3p, miR-500a-3p, miR-451a, miR-18a-5p, miR-214-3p, 및 miR-126-3p 중 하나 이상의 발현 또는 수준을 감소시키는 작용제를 투여하는 단계를 포함한다.
일단 환자가 자궁내막증을 가진 것으로 또는 자궁내막증을 가질 위험이 있는 것으로 진단된 후에는, 환자는 당업계에 알려져 있는 방법들을 사용하여 치료될 수 있다. 자궁내막증에 대한 잘 알려져 있는 치료로는, 이에 한정되는 것은 아니지만, 진통제, 호르몬 치료, 화학요법, 및 수술적 치료가 있다. 자궁내막증의 치료를 위해 사용된 진통제는 단순한 진통제, 예컨대 파라세타몰(paracetamol), COX-2 억제제, 아스피린, 및 당업계에 잘 알려져 있는 기타 비스테로이드성 항염증 약물, 및 마약성 진통제, 예컨대 몰핀, 코딘, 옥시코돈, 및 당업계에 잘 알려져 있는 기타 두 가지를 모두 포함한다. 호르몬 치료는, 이에 한정되는 것은 아니지만, 경구 피임제, 프로게스틴, 예컨대 다이드로게스테론(Dydrogesterone), 메드록시프로게스테론 아세테이트(Medroxyprogesterone acetate), 데포 메드록시프로게스테론 아세테이트, 노르에티스테론(Norethisterone), 레보노르게스트렐(Levonorgestrel) 및 당업계에 잘 알려 있는 기타, 프로게스테론 및 프로게스테론-유사 물질, GnRH 작용물질, 예컨대 류프로렐린(leuprorelin), 부세렐린(buserelin), 고세렐린(goserelin), 히스트렐린(histrelin), 데스로렐린(deslorelin), 나파렐린(nafarelin), 및 트리프토렐린(triptorelin), 안드로겐(androgens) 및 합성 안드로겐 유사 다나졸(Danazol), 및 아로마타제 억제제를 포함한다. 수술적 치료는, 이에 한정되는 것은 아니지만, 복강경 검사 수술, 자궁 절제술, 및 난소 절제술을 포함한다. 본 발명에 사용하기 위해 특히 잘 맞는 다른 치료는 당업계에 잘 알려져 있다. 일부 구체예에서, 환자는, 이에 한정되는 것은 아니지만, 아토르바스타틴(atorvastatin), 세리바스타틴(cerivastatin), 플루바스타틴(fluvastatin), 로바스타틴(lovastatin), 메바스타틴(mevastatin), 피타바스타틴(pitavastatin), 프라바스타틴(pravastatin), 로수바스타틴(rosuvastatin) 및 심바스타틴(simvastatin)을 포함한, 스타틴을 사용하여 치료될 수 있다.
키트
본원은 또한 본 발명의 방법에 유용한 키트와 관련된다. 그러한 키트는, 예를 들어, 혼성화 프로브 또는 프라이머(예컨대, 표지된 프로브 또는 프라이머), 표지된 분자의 검출을 위한 시약, 올리고뉴클레오타이드 어레이, 제한 효소, 항체, 대립유전자-특이적 올리고뉴클레오타이드, 대상체의 핵산의 증폭을 위한 수단, 대상체의 RNA를 역전사하기 위한 수단, 대상체의 핵산 서열을 분석하기 위한 수단, 및 설명용 자료를 포함하여, 본원에 기술된 임의의 방법에서 유용한 구성요소들을 포함한다. 예를 들어, 일부 구체예에서, 키트는 자궁내막증과 관련된 적어도 하나의 miRNA의 검출 및 정량화에 유용한 구성요소들을 포함한다. 본 발명의 바람직한 구체예에서, 키트는 본원의 다른 곳에서 기술된, 자궁내막증과 관련된 하나 이상의 miRNA를 검출하기 위한 구성요소들을 포함한다.
본 발명은 또한 자궁내막증에서 차등적으로 발현되는 것으로 알려져 있는 하나 이상의 핵산 바이오마커에 대한 프로브를 포함하는, 자궁내막증 또는 자궁내막증에 의해 유발된 감소된 수정능력을 진단하기 위한 키트를 제공한다. 한 특정 구체예에서, 키트는 선택된 바이오마커들의 정량적 증폭을 위한 시약들을 포함한다. 대안적으로, 키트는 마이크로어레이를 포함할 수 있다. 일부 구체예에서, 키트는 둘 이상의 프로브를 포함한다. 다른 구체예에서, 키트는 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25개, 또는 그 이상의 프로브를 함유할 수 있다.
본원은 또한 본 발명의 방법에서 유용한 키트에 관련된다. 그러한 키트는, 예를 들어 본 발명의 바이오마커(예컨대, 폴리펩타이드 및/또는 핵산)를 정량적으로 분석하기 위한 물질, 본 발명의 바이오마커(예컨대, 폴리펩타이드 및/또는 핵산)의 활성을 평가하기 위한 물질, 및 설명용 자료를 포함하여, 본원의 다른 곳에서 기술된 임의의 방법에 유용한 구성요소들의 다양한 조합을 포함한다. 예를 들어, 일부 구체예에서, 키트는 생물학적 샘플 중의 원하는 핵산의 정량화에 유용한 구성요소들을 포함한다.
추가의 구체예에서, 키트는 설명용 자료 및 대상체로부터 얻어진 생물학적 샘플 중의 본 발명의 바이오마커의 수준이 치료의 투여 중에 또는 후에 조정되는지를 측정하기 위한 구성요소를 함유한, 필요로 하는 대상체에게 투여된 치료의 유효성을 모니터링하기 위한 검정의 구성요소들을 포함한다. 다양한 구체예에서, 본 발명의 바이오마커의 수준이 대상체로부터 얻어진 생물학적 샘플에서 조정되는지를 측정하기 위하여, 바이오마커의 수준이 키트에 함유된 적어도 하나의 비교기 대조군, 예컨대 양성 대조군, 음성 대조군, 과거 대조군, 과거 표준, 또는 생물학적 샘플 중의 또 다른 기준 분자의 수준과 비교된다. 특정 구체예에서, 바이오마커 및 기준 분자의 비율은 치료의 모니터링을 보조하기 위해 결정된다.
실험 실시예
본 발명은 추가로 다음의 실험 실시예를 참조로 상세하게 기술된다. 이 실시예들은 단지 예시의 목적으로 제공되며, 다르게 명시되지 않는 한 제한하려는 의도가 아니다. 그러므로, 본 발명은 어떠한 방식으로든 다음의 실시예들로 제한되는 것으로 해석되지 않아야 하며, 오히려, 본원에 제공된 교시의 결과로서 명백해지는 임의의 및 모든 변화들을 포함하는 것으로 해석되어야 한다.
추가의 설명 없이, 당업자는 전술한 설명 및 다음의 예시적인 실시예들을 사용하여, 본 발명을 제조 및 이용하고 청구된 방법을 실시할 수 있다. 그러므로 다음의 작업 실시예들은 본 발명의 바람직한 구체예들을 구체적으로 지적하며, 본 발명의 나머지를 어떠한 방식으로든 제한하는 것으로서 해석되지 않는다.
실시예 1: 자궁내막증의 진단 마커로서의 혈청 마이크로RNA; 포괄적인 어레이 기반 분석
자궁내막증이 있거나 없는 여성의 정상적인 및 이소성(ectopic) 자궁내막 조직으로부터의 마이크로어레이 연구는 여러 miRNA의 차등적인 발현을 보여준다(Ohlsson et al., 2009, Mol Endocrinol, 23:265-275, Petracco et al., 2011, J Clin Endocrinol Metab, 96:E1925-1933). 그것들은 유전자 발현을 조절함으로써 자궁내막증의 병인론 및 관련된 불임에 중요한 역할을 한다(Teague et al., 2010, Hum Reprod Update, 16:142-165). 조직 miRNA는 병리적 조직으로부터 순환계로 흘러가고, 강한 상관관계가 순환하는 수준과 조직 수준 사이에서 나타났다(Resnick et al., 2009, Gynecol Oncol, 112:55-59). 차등적으로 발현된 여러 miRNA가 자궁내막증 환자의 혈청에서 확인되었다(Jia et al., 2013, Hum Reprod, 28:322-330, Wang et al., 2013, J Clin Endocrinol Metab, 98:281-289). 앞서 let-7b 및 miR-135a가 자궁내막증 환자로부터의 혈청에서 차등적으로 발현되었고 질환의 유용한 바이오마커인 것이 증명되었다(Cho et al., 2015, Fertil Steril, 103(5):1252-1260). 이 연구에서는, 다른 miRNA들이 이 질환의 마커인 것이 증명되었다. 이 연구는 자궁내막증을 가진 여성들의 혈청에서 세계적인 miRNA 프로파일의 포괄적인 평가이고 질환의 비침습적 바이오마커로서 사용된 여러 miRNA를 확인해준다.
이 실험들에서 사용된 물질 및 방법이 이제 기술된다.
연구 집단
혈청 샘플을 자궁내막증이 있거나 없는 48명의 여성으로부터 수집하였다. 연구 집단을 2010년 6월과 2013년 3월 사이에 골반 종괴, 골반 통증, 불임, 및 자궁내막증을 포함하여 다중 양성 징후에 대해 복강경 검사를 실시했던 환자들로부터 선택하였다. 환자들은 연구에 참여한다는 사전 동의를 제공하였다. 포함 기준은 20세 내지 50세였고, 수술에 앞서 적어도 3개월 동안 호르몬 치료를 받지 않았으며, 다른 염증성 질환이 없었다. 배제 기준은 폐경기후 상태, 수술 3개월 이내에 이전의 호르몬 또는 생식샘 자극호르몬-방출 호르몬(GnRH) 작용물질 사용, 자궁선근종, 자궁내막암, 과증식, 또는 자궁내막 용종, 감염성 질환, 만성 또는 급성 염증성 질환, 악성 종양, 자가면역 질환, 및 심혈관 질환을 포함하였다. 모든 환자에서 치료전 혈청 CA-125 수준을 Roche/Hitachi Modular Analytics E170 시스템(Roche Diagnostics)으로 CA-125 II 전기화학발광 면역검정(ECLIA)을 사용하여 측정하였다. 수술 중에, 모든 가능한 자궁내막 병변을 절제하고 최종 진단을 위해 조사하였다. 환자들을 절제된 조직의 병리적인 확인 후에 자궁내막증 그룹에 배정하였다. 자궁내막증의 정도를 미국 재생 의학 협회(American Society of Reproductive Medicine, ASRM) 개정 분류를 사용하여 측정하였다(Revised American Society for Reproductive Medicine classification of endometriosis. Fertil Steril 1996, 67:817-821). 24명의 환자가 조직학적으로, 중등도 내지 중증 질환인(단계 III 및 IV) 복막 및/또는 난소 자궁내막증으로 확인되었다. 24명의 환자를 대조군으로서 참여시켰는데, 유피 낭종(n = 10명), 장액성 낭선종(n = 5명), 점액성 낭선종(n = 3명), 단순 난소 낭종(n = 5명), 및 부난관 낭종(n = 1명)의 10가지 사례를 포함하였다.
샘플 수집 및 RNA 추출
혈액 샘플(10 ml)을 수술 전 8시간 동안 금식 후에 수집하였다. 첨가제를 함유하지 않은 멸균된 튜브를 사용하였다. 샘플을 즉시 원심분리하고 혈청을 -80℃에서 추가의 분석을 위해 냉동시켰다. 각 개체로부터의 샘플의 절반을 마이크로어레이 분석을 위해 모으고 샘플의 나머지 절반을 마이크로RNA의 각각의 분석을 위해 사용하였다. 총 RNA를 400μl의 혈청으로부터 miRVana RNA 분리 키트(Applied Biosystems)를 사용하여 제조자의 명세서에 따라 추출하고, 50 ml의 뉴클레아제-유리 물로 용출하였다. RNA의 수율을 Nano Drop ND-2000-분광광도계(Nano drop Technologies, USA)를 사용하여 측정하였다.
miRNA 마이크로어레이 발현 프로파일링
자궁내막증이 있는 여성들 및 대조군의 모아진 샘플로부터의 총 RNA를 마이크로RNA 마이크로어레이 프로파일링에 사용하였다. 총 RNA(100 ng)를 마이크로RNA로 표지하였다. 완전한 표지화 및 Hyb 키트(Affymetrix, USA) 및, 1205개의 인간 및 144개의 인간 바이러스 마이크로RNA에 대한 60000개의 프로브를 함유한 인간 마이크로RNA 마이크로어레이 키트(Release 16.0, Affymetrix) 상에 혼성화하였다. 혼성화 신호를 Affymetrix 마이크로어레이 스캐너(Affymetrix)로 검출하였고 스캐닝된 이미지를 Affymetrix Feature 추출 소프트웨어(Affymetrix)를 사용하여 분석하였다.
miRNA에 대한 정량적 실시간 중합효소 연쇄 반응
Invitrogen NCode miRNA 제 1-가닥 cDNA 합성 MIRC-50 키트(Life Technologies)는 제조사의 설명을 따른다. 각 샘플로부터의 총 RNA(25 ng)를 역전사시키고, miRNA를 iQ SYBR Green 수퍼믹스 키트(Bio-Rad Laboratories)를 사용하여, miR-125b-5p(SEQ ID NO:37), miR-150-5p(SEQ ID NO:38), miR-342-3p(SEQ ID NO:39),miR-145-5p(SEQ ID NO:40), miR-143-3p(SEQ ID NO:41), miR-500a-3p(SEQ ID NO:42), miR-451a(SEQ ID NO:43), miR-18a-5p(SEQ ID NO:44), miR-6755-3p(SEQ ID NO:45), miR-3613-5p(SEQ ID NO:46), miR-553(SEQ ID NO:47), miR-4668-3p(SEQ ID NO:48)에 대한 특이적인 전방향 프라이머 및 앵커 프라이머에 상보하는 보편적인 역방향 프라이머로 정량화하였다:
miR-125b-5p 전방향 UCCCUGAGACCCUAACUUGUGA; (SEQ ID NO:37)
miR-150-5p 전방향 UCUCCCAACCCUUGUACCAGUG; (SEQ ID NO:38)
miR-342-3p 전방향 UCUCACACAGAAAUCGCACCCGU; (SEQ ID NO:39)
miR-145-5p 전방향 GUCCAGUUUUCCCAGGAAUCCCU; (SEQ ID NO:40)
miR-143-3p 전방향 UGAGAUGAAGCACUGUAGCUC; (SEQ ID NO:41)
miR-500a-3p 전방향 AUGCACCUGGGCAAGGAUUCUG; (SEQ ID NO:42)
miR-451a 전방향 AAACCGUUACCAUUACUGAGUU; (SEQ ID NO:43)
miR-18a-5p 전방향 UAAGGUGCAUCUAGUGCAGAUAG; (SEQ ID NO:44)
miR-6755-3p 전방향 UGUUGUCAUGUUUUUUCCCUAG; (SEQ ID NO:45)
miR-3613-5p 전방향 UGUUGUACUUUUUUUUUUGUUC; (SEQ ID NO:46)
miR-553 전방향 AAAACGGUGAGAUUUUGUUUU; (SEQ ID NO:47)
miR-4668-3p 전방향 GAAAAUCCUUUUUGUUUUUCCAG; (SEQ ID NO:48)
miR-214-3p 전방향 ACAGCAGGCACAGACAGGCAGU; (SEQ ID NO:49)
miR-126-3p 전방향 UCGUACCGUGAGUAAUAAUGCG; (SEQ ID NO:50)
반응 혼합물은 10 μl의 최종 반응 부피에 대해 4 μl의 cDNA, 5 μl의 iQSYBR Green 수퍼믹스, 0.5 μl의 전방향 프라이머, 0.5 μl의 보편적 정량적 중합효소 연쇄 반응 프라이머를 포함하였다. 열 사이클링 조건을 50℃에서 2분 동안의 우라실-N-글리코실라제 활성화 및 95℃에서 15분 동안의 초기 변성에 의해 시작하였고, 이어서 95℃에서 15초 동안의 50회 사이클 및 59℃에서 50초 동안의 어닐링이 이어졌다. 한계값 사이클 및 용융 곡선을 Bio-Rad iCycleri Qsystem(Bio-Rad Laboratories)의 정량화 및 용융 곡선 프로그램을 사용함으로써 획득하였다. 앵커 역전사 프라이머를 음성 대조군에 대한 주형으로서 사용하였고, U6(U6 전방향, CTCGCTTCGGCAGCACA)(SEQ ID NO:51) 작은 핵 RNA를 상대적인 miRNA 발현을 측정하기 위한 대조군으로서 사용하였다(Kuwabara et al., 2011, Circ Cardiovasc Genet, 4:446-454). 상대적인 miRNA 수준을 비교 사이클 한계값(Ct) 방법(2△△CT 방법으로 알려져 있음)을 사용하여 측정하였다.
통계적 분석
자궁내막증과 대조군 그룹 사이의 임상적 특성의 차이의 통계적 유의성을 측정하기 위하여 학생 t-테스트 및 피셔의 정확성 테스트를 사용하였다. 그룹들 간의 혈청 miRNA의 발현 수준을 Mann-Whitney U 테스트를 사용하여 비교하였다. 자궁내막증과 대조군 사이의 분화에 대한 혈장 마이크로RNA의 진단 값을 평가하기 위해 수신자 조작 특성(ROC) 곡선 및 ROC 곡선 아래의 면적(AUC)을 확립하였다. ROC 분석을 기반으로, 혈장 miRNA의 최상의 통계적 컷-오프 값을 계산하였고, 그런 후 선택된 컷-오프 포인트에 대해 민감도 및 특이도를 평가하였다. 모든 통계적 분석을 SPSS 16.0(SPSS Inc, Chicago, IL)을 사용하여 수행하였다. 0.05 미만의 P를 통계적으로 유의한 것으로 간주하였다.
실험의 결과를 이제 기술한다.
임상적 특성
자궁내막증을 가진 여성들의 평균(SD) 연령은 33.08±6.63세였고 대조군에서는 32.16±9.46세였다(p>0.05). 또한 임신, 출산 경력, 알코올 사용 및 다른 동반이환을 포함한 다른 임상적 매개변수들 사이의 통계적으로 유의한 차이는 없었다. VAS(시각적 아날로그 척도)로 측정된 자궁내막증 그룹의 골반 통증 세기는 대조군 그룹보다 더 높았다(각각 5.4±3.4, 2.1±2.4, p<0.001). CA-125 값은 대조군 그룹보다 자궁내막증 그룹에서 유의하게 더 높았지만 고도로 가변적이었다(각각 103.3±21.7, 17.5±6.3, p<0.003). 자궁내막증을 가진 모든 여성은 난소 자궁내막증을 가졌고, 그들 중 16명은 복막 질환이 있었으며 그들 중 8명은 심층 침윤성 자궁내막증을 가졌다.
연구 집단의 혈청에서 순환하는 miRNA의 발현
아피메트릭스(Affymetrix) miRNA 4.0 어레이를 모아진 샘플의 miRNA 프로파일을 검출하기 위해 사용하였고 이 어레이 연구로부터 총 36,354개의 miRNA를 분석하였다. 이들 miRNA 중에서 11,653개는 하향 조절되었고 10,010개는 상향조절되었다. 자궁내막증과 대조군 그룹 사이에서 그것들의 발현에서 10배 이상의 변화로 차등적으로 발현된 miRNA를 선택하였다(도 1). 도 1에서 나타낸 것과 같이, miR-125b-5p, miR-150-5p, miR-342-3p, miR-145-5p, miR-143-3p, miR-500a-3p, miR-451a, miR-18a-5p는 상향조절된 한편, miR-3613-5p, 및 miR-6755-3p는 하향 조절되었다.
자궁내막증이 있거나 없는 여성들의 혈청에서 miR-125b-5p, miR-150-5p, miR-342-3p, miR-145-5p, miR-143-3p, miR-500a-3p, miR-451a, miR-18a-5p, miR-6755-3p, miR-3613-5p의 상대적 발현을 실시간 정량적 중합효소 연쇄 반응을 사용하여 평가하였다. 도 2a 및 도 2b에서 나타낸 것과 같이 자궁내막증을 가진 여성에서 miR-125b-5p, miR-150-5p, miR-342-3p, miR-145-5p, miR-143-3p, miR-500a-3p, miR-451a, miR-18a-5p의 발현 수준은 상향조절되었고(p<0.05), 한편 miR-6755-3p 및 miR-3613-5p 수준은 하향조절되었다(p<0.05). 월경 주기를 통한 이 miRNA들의 변화를 또한 측정하였다. 자궁내막증 그룹에서 각각 8개 및 16개의 증식성 및 분비 샘플이 있었다. 대조군 그룹에서는 13개의 증식성 및 11개의 분비 샘플이 있었다. 자궁내막증 환자들 중에서 이 miRNA의 차등적인 월경 주기성 단계 특이적 발현은 없었다(p>0.05).
자궁내막증에서 순환하는 miRNA의 진단 값의 평가
두 그룹간에 차등적으로 발현된 혈청 miRNA의 ROC 곡선 분석을 수행하였다. 차등적으로 발현된 miRNA의 AUC 값을 표 2 및 도 3에 나타낸다. 차등적으로 발현된 miRNA 중에서, 0.0688의 컷 오프 값에 대해, miR-125b-5p발현 수준이 최고의 AUC를 나타냈고(0.974, 95% 신뢰도 간격 [CI], 0.00-1.00, p<0.001), 이때 민감도 및 특이도는 각각 100% 및 96%였다. 자궁내막증을 진단하는 데 있어 miRNA 발현은 대조군 샘플에 대비한 질환으로 로지스틱 회귀 모델을 데이터에 적용함으로써 개선되었다. 모든 바이오마커의 분포가 정상적으로 왜곡되지 않았기 때문에, 변수들을 대수적으로 변형시켰다(도 3a 내지 3c). 높은 AUC를 miR-125b-5p 단독에 대해 관찰하였다. 1,000까지의 AUC의 추가의 증가는 예측변수 125b-5p, 451a 및 3613-5p를 조합할 때 이루어졌다(도 3d). 민감도 및 특이도는 이 세 가지의 마이크로RNA를 조합했을 때 100%에 도달하였다. 그러므로, 마이크로RNA들의 조합은 임의의 개별적인 마이크로RNA를 능가하는 개선된 진단 능력을 증명하였다. 다음의 로지스틱 모델을 선택하였다: miRNA 조합 = 118.406 + 108.751 x log10(125b-5p) + 41.015 x log10(451a) - 57.935 x log10(3613-5p). 표 3에 나타낸 마이크로어레이 데이터는 상부 miRNA 히트 및 대조군(C1)에 대비된 자궁내막증(E1) 상향조절, C1에 대비된 E1 하향조절의 비교를 증명한다.
자궁내막증에 대한 바이오마커로서의 마이크로RNA에 대한 사용
이 연구에서, 자궁내막증에 대한 바이오마커로서 차등적으로 발현된 순환하는 miRNA를 증명하였다. 결과는 miR-125b-5p 발현이 마이크로어레이 데이터에서 확인된 miRNA들 중에서 최고 AUC 수준을 가졌음을 증명하였다. 자궁내막증은 6.7년의 평균 진단 지연과 관련되며, 질환의 진행 및 삶의 질의 손상을 초래한다(Nnoaham et al., 2011, Fertil Steril, 96:366-373). 자궁내막증의 초기 진단은 즉각적인 치료, 삶의 질의 개선 및 수정 능력의 잠재적 보존을 허용하게 될 것이다. 여러 성장 인자들 및 사이토카인들이 이 질환의 잠재적 바이오마커로서 혈청, 혈장 및 소변에서 연구되었다(Cho et al., 2012, Hum Reprod, 27:515-522, Reis et al., 2012, Hum Reprod, 27:1445-1450); 그러나, 이것들 중 어느 것도 자궁내막증에 대한 임상적 진단 도구로 해석될 정도로 충분히 민감하거나 특이적이지 않았다(May et al., 2010, Hum Reprod, 16:651-674).
miRNA가 혈장으로 수송되는 메커니즘 및 멀리 떨어져 있는 기관에 미치는 그것들의 생물학적 영향에 대해서는 거의 알려진 것이 없다. 정상적인 자궁내막뿐만 아니라 쌍을 이룬 정상적 및 이소성 자궁내막 샘플은 차등적인 miRNA 발현 패턴을 가진다(Jia et al., 2013, Hum Reprod, 28:322-330). 나아가, 혈청/혈장의 miRNA 프로파일과 조직 사이의 강력한 관련은 여러 암을 조사하는 연구에서 증명되었다(Resnick et al., 2009, Gynecol Oncol, 112:55-59, Wang et al., 2013, J Clin Endocrinol Metab, 98:281-289). 바이오마커로서의 역할에 더불어, 순환하는 miRNA는 멀이 떨어져 있는 조직에 대해 조절 효과를 가진다. 본원에서 확인된 순환하는 miRNA는 자궁내막증과 자궁내막 사이의 소통의 수단이다. 추가로, 그것들은 멀리 떨어져 있는 기관 시스템을 변경시키는 전신 효과를 가진다. 동물 모델에서 복막 강과 동떨어진 자궁내막증은 자궁의 유전자 발현에 영향을 미치는 것이 증명되었다(Naqvi et al., 2016, Reprod Sci, 23:186-191). 순환하는 miRNA는 자궁내막증이 자궁에영향을 갖게 되는 신호전달 메커니즘이다.
miRNA는 비정상적인 세포 분화, 침습 및 염증을 조절함으로써 자궁내막증의 발병에 기여하는 것으로 증명되었다(Petracco et al., 2011, J Clin Endocrinol Metab, 96:E1925-E1933, Teague et al., 2010, Hum Reprod Update, 16:142-165, Naqvi et al., 2016, Reprod Sci, 23:186-191). 또한 많은 각각의 순환하는 miRNA가 자궁내막증에서 확인되는 것이 증명되었다(Jia et al., 2013, Hum Reprod, 28:322-330, Wang et al., 2013, J ClinEndocrinolMetab, 98:281-289, Cho et al., 2015, Fertil Steril, 103(5):1252-1260). Jia 등은 혈장 miR-17-5p, miR-20a 및 miR-22가 자궁내막증을 가진 여성들에게서 하향 조절된 것으로 보고하였는데(Jia et al., 2013, Hum Reprod, 28:322-330), 그러나 이 miRNA들은 컷 오프 한계값에 도달하지 못하였고 추가로 이 연구에서 조사되지 않았다. 확인된 miRNA의 차이는 연령, 인종 질환 중증도 또는 의학적 치료법의 사용의 차이에 기인한다.
자궁내막증을 가진 여성들의 순환에서 모든 miRNA의 첫 번째 포괄적인 분석에서 miR-125b-5p는 자궁내막증의 최상의 단일 후보 바이오마커인 것으로 확인되었다. miR-125b-5p는 자궁내막증을 가진 여성들의 혈청에서 유의하게 상향조절되었고 최고 AUC뿐만 아니라 임의의 단일 miRNA의 민감도 및 특이도를 가졌다(AUC=0.974, 95% 신뢰도 간격 [CI], 0.00-1.00, p<0.001) (각각 100% 및 96%). miR-125b-5p는 암의 침습 및 발병에서 역할을 하는 것으로 증명되었고 폐암에서 발암유전자로서 작용한다(Wang et al., 2015, Mol Med Rep, 11(5):3880-3887). 그것은 유방암 환자의 혈청에서 상향조절되고 화학요법 내성, 더 높은 발현 수준을 가지는 한편(Wang et al., 2012, PLoS One, 7:e34210, Matamala et al., 2015, Clin Chem, 61(8):1098-1106), HBV 양성 간세포 암종 환자의 혈청에서 발견된 유의하게 더 높은 수준을 가지는(Giray et al., 2014, Mol Biol Rep, 41(7):4513-4519) 화학요법 내성, 비반응성 환자와 관련된다. 또한 miR-125b-5p는 Osx 발현의 조정을 통해 hBMSC의 골형성성 분화를 조절하는 것이 증명되었다(Chen et al., 2014, Mol Med Rep, 9(5):1820-1826). 이 연구에서, 사례의 대부분은 그 표현형에 기여하는 침습 및 miRNA 125를 가진 중증의 자궁내막증을 가졌다. 이 연구에서 발견된 다른 miRNA는 또한 이 질환의 병인학에 기여한다. miR-451a는 신경모세포종 및 골육종에서 종양 억제 기능을 가지며(Liu et al., 2016, Mol Med Rep, doi: 10.3892/mmr. 4770, Xu et al., 2014, Cell Biochem Biophys, 69(1):163-168) 자궁내막 병변 세포 생존을 제한하는 기능을 하는 자궁내막 조직에서 상승된 수준이 발견된다(Graham et al., 2015, Hum Reprod, 30(3):642-652).
결론적으로, 이 연구는 자궁내막증에서 순환하는 miRNA들, 특히 miR-125b-5p의 차등적인 발현을 나타냈다. 발견사항들은 또한 이 질환의 진단에서 혈장 miRNA 프로파일링의 임상적 이용을 지지한다. 질환의 바이오마커의 결핍 및 진단의 지연이 있다면, miRNA는 초기 검출 및 개입에 유용하다. 추가로, 순환하는 miRNA의 역할은 자궁내막증의 전신적 영향의 더 나은 이해를 제공하고 보다 신규한 치료를 가능하게 한다.
| miRNA | AUC | 95% CI | p-값 |
| miR-125b-5p | 0.974 | 0.000-1.000 | <0.001 |
| miR-150-5p | 0.808 | 0.680-0.936 | <0.001 |
| miR-342-3p | 0.760 | 0.608-0.912 | 0.002 |
| miR-143-3p | 0.926 | 0.000-1.000 | <0.001 |
| miR-500a-3p | 0.901 | 0.803-0.998 | <0.001 |
| miR-451a | 0.835 | 0.707-0.963 | <0.001 |
| miR-18a-5p | 0.797 | 0.653-0.940 | 0.001 |
| miR-6755-3p | 0.718 | 0.577-0.860 | 0.008 |
| miR-3613-5p | 0.862 | 0.740-0.985 | <0.001 |
| miR-125b-5p | 77.07 | C1 대비 E1 상향 |
| miR-214-3p | 62.5954 | C1 대비 E1 상향 |
| miR-150-5p | 57.2203 | C1 대비 E1 상향 |
| miR-342-3p | 41.5546 | C1 대비 E1 상향 |
| miR-145-5p | 38.1178 | C1 대비 E1 상향 |
| miR-143-3p | 29.4994 | C1 대비 E1 상향 |
| miR-126-3p | 27.3483 | C1 대비 E1 상향 |
| miR-500a-3p | 18.0946 | C1 대비 E1 상향 |
| miR-451a | 16.8822 | C1 대비 E1 상향 |
| miR-18a-5p | 14.4632 | C1 대비 E1 상향 |
| miR-6755-3p | -12.4883 | C1 대비 E1 하향 |
| miR-553 | -18.6982 | C1 대비 E1 하향 |
| miR-3613-5p | -102.613 | C1 대비 E1 하향 |
| miR-4668-3p | -124.901 | C1 대비 E1 하향 |
실시예 2: 개코원숭이의 자궁내막증 병변에서의 miRNA의 상대적인 발현
개코원숭이의 자궁내막 병변에서의 miRNA의 상대적인 발현을 도 4에서 나타낸 것과 같이 실시간 정량적 PCR에 의해 측정한다. miR-125b-5p, miR-150-5p 및 miR-3613-5p의 상대적인 발현의, 스타틴 치료 후 각각의 miRNA의 상대적인 발현 수준과의 비교를 수행하였다. 병변은 스타틴 치료된 동물에서 수축된 것으로 관찰되었다. 미치료 동물의 샘플에서 miR-125b-5p 발현 수준은 치료된 동물로부터 취한 샘플보다 더 높은 상대적 발현 수준을 가지는 것으로 나타났다. 추가로, miR-3613-5p의 상대적 수준은 치료된 동물로부터의 샘플 중의 miR-3613-5p의 수준과 비교하여 대조군 미치료 동물로부터의 샘플에서 더 낮은 것으로 관찰되었다. 마지막으로, miR-150-5p의 상대적 수준은 치료된 동물로부터의 샘플 중의 miR-150-5p의 수준과 비교하여 대조군 미치료 동물로부터의 샘플에서 더 낮은 것으로 관찰되었다.
실시예 3: 자궁내막증에 대한 진단 마커로서의 타액 마이크로RNA
단계 1: 타액으로부터의 RNA 추출
타액 샘플(200 μL)을 수집하고 1.5 mL 튜브에 옮겼다. 총 샘플 부피를 200 μL로 만들기 위하여 RNase가 없는 물을 샘플에 200 μL 미만의 부피로 첨가하였다. 1 mL의 QIAzol 용해 시약(Qiagen)을 샘플에 첨가하였다. 튜브를 짧게 와동(vortex)시키고, 샘플을 실온에서 5분 동안 인큐베이션되도록 놓아두었다. 그런 다음, 200 μL의 클로로포름을 용해물에 첨가하고 대략 15초 동안 와동시켰다. 그런 다음 샘플 혼합물을 2분 동안 실온에서 인큐베이션하고 12,000 x g에서 15분 동안 저온실(대략 4℃)에서 원심분리하였다. 대략 560 μL의 수성 상을 새로운 1.5 mL 튜브에 옮겼다. 840 μL의 100% 에탄올을 560 μL의 수성 상에 첨가하여 총 부피 1400 μL를 얻었다. 그런 후 700 μL의 혼합물을 2 mL의 수집 튜브가 달린 RNeasy MiniElute 스핀 칼럼에 옮겼다. 수집 튜브가 달린 스핀 칼럼을 9,000 x g에서 15초 동안 원심분리하였다. 통과액을 버리고 남아있는 700 μL의 혼합물을 수집 튜브가 달린 스핀 칼럼에 옮기고 다시 9,000 x g에서 15초 동안 원심분리하였다. 통과액을 버리고 700 μL의 완충액 RWT를 각각의 스핀 칼럼에 첨가한 후 9,000 x g에서 15초 동안 원심분리하였다. 관통액을 버리고 500 μL의 완충액 RPE를 각 스핀 칼럼에 첨가한 후 9,000 x g에서 15초 동안 원심분리하였다. 관통액을 버리고 또 다른 500 μL의 완충액 RPE를 각 스핀 칼럼에 첨가한 후 다시 9,000 x g에서 15초 동안 원심분리하였다. 그런 다음, 500 μL의 80% 에탄올을 스핀 칼럼에 첨가하고 9,000 x g에서 2분 동안 원심분리하였다. 관통액 및 수집 튜브를 그 후에 버리고 스핀 카럼을 새로운 2 mL 수집 튜브에 옮겼다. 스핀 칼럼의 뚜껑을 열린 채로 남겨둔 후 12,000 x g에서 5분 동안 원심분리하여 막을 건조시켰다. 그런 다음 스핀 칼럼을 1.5 mL 튜브에 넣었다. 14 μL의 RNase-유리 물을 스핀 칼럼에 첨가하고 그것을 12,000 x g에서 1분 동안 원심분리하여 총 RNA를 용출하였다. 스핀 칼럼을 버리고 RNA를 -80℃에서 보관하였다.
단계 2: cDNA의 제조
TaqMan Advanced miRNA cDNA 합성 키트를 사용하여 4개의 순차적인 단계: A, B, C 및 D로 cDNA(ThermoFisher, 카탈로그 번호: A28007)를 제조하였다.
단계 A를 각 반응에서 다음의 내용물로 수행하였다: 0.5 μL의 10X 폴리 A 완충액; 0.5 μL의 10 mM ATP; 0.3 μL의 폴리 A 효소, 5 U/μL; 1.7 μL의 RNase-유리 물; 2.0 μL의 샘플. 플레이트 또는 튜브를 밀봉하고 짧게 와동시켰다. 플레이트 또는 튜브를 원심분리하여 내용물을 스핀 다운시키고 임의의 기포를 제거하였다. 플레이트 또는 튜브를 열 순환기에 넣고 다음의 설정으로 인큐베이션하였다:
1. 37℃에서 45분 동안 폴리아데닐화.
2. 65℃에서 10분 동안 중단 반응.
3. 4℃에서 보유.
단계 B를 각 반응에서 다음의 내용물로 수행하였다: 3.0 μL의 5X DNA 리가아제 완충액; 4.5 μL의 50% PEG 8000; 0.6 μL의 25X 결찰 어댑터; 1.5 μL의 RNA 리가아제; 0.4 μL의 RNase-유리 물. 결찰 반응 혼합물을 와동시켜서 내용물을 철저하게 혼합한 후 짧게 원심분리하여 내용물을 스핀 다운시키고 기포를 제거하였다. 10 μL의 결찰 반응 혼합물을 반응 플레이트의 각 웰 또는 폴리(A) 테일링 반응 생성물을 함유한 각 반응 튜브에 옮겼다. 반응 플레이트 또는 튜브를 밀봉한 후, 짧게 와동시키거나 흔들어서(EppendorfTM MixMateTM으로 1분 동안 1,900 RPM) 내용물을 철저하게 혼합하였다. 반응 플레이트 또는 튜브를 짧게 원심분리하여 내용물을 스핀 다운시켰다. 플레이트 또는 튜브를 열 순환기에 넣었다.
단계 C를 각 반응에서 다음의 내용물로 수행하였다: 6 μL의 5X RT 완충액; 1.2 μL의 dNTP 혼합물 (각각 25 mM); 1.5 μL의 20X 보편적 RT 프라이머; 3 μL의 10X RT 효소 혼합물; 3.3 μL의 RNase-유리 물. RT 반응 혼합물을 와동시켜서 내용물을 철저하게 혼합한 후, 짧게 원심분리하여 내용물을 스핀 다운시키고 기포를 제거하였다. 15 μl의 RT 반응 혼합물을 반응 플레이트의 각 웰 또는 어댑터 결찰 반응 생성물을 함유한 각 반응 튜브에 옮겼다. 총 부피를 웰 또는 튜브당 30 μL였다. 그런 후 반응 플레이트 또는 튜브를 밀봉하고 짧게 와동시켜서 내용물을 철저하게 혼합하였다. 그런 다음 반응 플레이트 또는 튜브를 짧게 원심분리하여 내용물을 스핀 다운시켰다. 플레이트 또는 튜브를 열 순환기에 넣고 다음의 설정으로 인큐베이션하였다:
1. 42℃에서 15분 동안 역전사.
2. 85℃에서 5분 동안 중단 반응.
3. 4℃에서 보유.
단계 D를 각 반응에서 다음의 내용물로 수행하였다: 25 μL의 2X miR-Amp 마스터 혼합물; 2.5 μL의 20X miR-Amp 프라이머 혼합물; 17.5 μL의 RNase-유리 물. miR-Amp 반응 혼합물을 와동시켜서 내용물을 철저하게 혼합한 후, 짧게 원심분리하여 내용물을 스핀 다운시키고 기포를 제거하였다. 45 μL의 miR-Amp 반응 혼합물을 새로운 반응 플레이트의 각 웰 또는 반응 튜브에 옮겼다. 5 μL의 RT 반응 생성물을 각 반응 웰 또는 반응 튜브에 첨가하였다. 각 웰 또는 튜브의 총 부피는 50 μL였다. 반응 플레이트 또는 튜브를 밀봉한 후 짧게 와동시켜서 내용물을 철저하게 혼합하였다. 그런 다음 반응 플레이트 또는 튜브를 짧게 원심분리하여 내용물이 혼합되도록 스핀 다운시켰다. 반응 플레이트 또는 튜브를 열 순환기에 넣은 후 다음의 설정, MAX 램프 속도, 및 표준 순환을 사용하여 인큐베이션하였다:
1. 95℃에서 5분 동안 효소 활성화, 1 사이클
2. 95℃에서 3초 동안 변성, 14 사이클
3. 60℃에서 30초 동안 어닐링/연장, 14 사이클
4. 99℃에서 10분 동안 중단 반응, 1 사이클.
5. 4℃에서 보유.
단계 3: 마이크로RNA의 증폭
RT-PCR 프로토콜:
1. 95℃에서 3분 동안
2. 95℃에서 15초 동안
3. 59℃에서 5초 동안
4. 72℃에서 55초 동안
5. 2 내지 4단계를 39 사이클 동안 반복함
6. 55℃에서 10초 동안 용융 곡선
7. 95℃에서 5초 동안
8. 4℃에서 보유
대조군 그룹과 자궁내막증 그룹 사이에서 차등적으로 발현된 타액 miRNA의 상대적인 발현을 도 5 및 도 6에 나타낸다. 데이터는 각 그룹에서 15개의 샘플을 나타낸다. miR 125b-5p, Let7b 및 miR150-5p에 대한 배수 변화는 각각 25, 7 및 1.8배이다. 이런 배수 변화는, p-값이 상기 miR들에 대해 0.05 미만(p < 0.05)이기 때문에, 자궁내막증 그룹을 대조군 그룹에 비교할 때 통계적으로 유의하다. p-값은 다음과 같다: miR 125b-5p(p < 0.001), Let7b(p < 0.025) 및 miR 150-5p(p < 0.047). miR-3613-5p의 통계적으로 유의한 하향조절이 관찰되었다.
실시예 4: 수술적 진단 전에 자궁내막증을 진단하기 위해 사용된 혈청 마이크로RNA
양성 부인과 징후에 대해 복강경 검사 또는 개복술을 실시했던 생식가능연령 여성들을 유망한 사례 대조군 연구에 등록시켰다. 환자들을, 만약 수술이 자궁내막증의 존재를 확인하였다면 질환 그룹으로, 그리고 만약 수술이 다른 양성의 병리를 나타냈다면 대조군으로 계층화하였다. 23명의 대조군 환자 및 17명의 자궁내막증 환자를 등록시켰고, 연구의 포함 기준을 충족하였다. 대조군은 유피 낭종 환자 4명, 낭선종 환자 3명, 유섬유종 환자 6명, 만성 골반 감염의 증거를 보이는 2명, 및 비정상적인 병리가 없는 8명을 포함하였다. 마이크로RNA 125b 및 150의 발현 수준은 대조군과 비교하여 자궁내막증 환자에서 유의하게 더 높았다(각각, 마이크로RNA 125: X 대 Y; p=0.028, 마이크로RNA 150: Z 대 W; p=0.014). 골반 통증 및 의심되는 자궁내막증을 가진 4명의 환자는 수술 평가시 자궁내막증을 갖지 않은 것으로 나타났다. 이 환자들에서 125b 및 150의 발현은 대조군의 그것과 일치하였고, 수술적으로 확인된 자궁내막증을 가진 환자의 그것과는 상이하였다.
총 마이크로RNA를 miRNeasy 미티 키트(Qiagen)를 사용하여, 제조사 프로토콜을 따라 혈청으로부터 추출하였다. cDNA의 제조를 TaqMan Advanced miRNA cDNA 합성 키트(ThermoFisher)를 사용하여 수행하였다. 정량적 실시간 중합효소 연쇄 반응(qRT-PCR)을 수행하여 마이크로RNAs 125b-5p 및 150-5p의 발현 수준을 측정하였다. 대조군과 자궁내막증 그룹 사이의 혈청 마이크로RNA의 발현 수준을 Mann-Whitney U 테스트를 사용하여 비교하였다. 연구 결과(도 7)는 마이크로RNA 125b-5p 및 150-5p가 대조군과 비교하여 자궁내막증을 가진 환자들에게서 유의하게 상승되었음을 보여주었다.
실시예 5: 자궁내막증의 진단 및 치료
이 예언적인 실시예에서, 혈액 또는 타액 샘플을 자궁내막증의 증상을 가진 여성 환자로부터 취한다. 그런 다음 마이크로RNA 125b-5p의 양을 샘플에서 측정하고, 그 양이 한계값을 초과하면 환자를 자궁내막증으로 진단한다. 환자를 치료적 유효량의 화합물로 치료한다. 화합물을 환자에게 경구, 정맥내, 또는 근육내 투여에 의해 제공한다. 화합물은 자궁내막증의 증상의 감소를 유발한다. 환자는 매달 약 1회 치료된다. 치료 후 1개월 후, 치료후 6개월 후, 및 치료 후 1년 후, 환자를 자궁내막증의 증상의 감소에 대해 평가한다.
본 발명의 바람직한 구체예들이 본원에서 제시되고 기술된 한편, 당업자들에게는 그러한 구체예들이 단지 실례로 제공된 것임이 명백할 것이다. 많은 변화, 변경, 및 치환이 이제 발명으로부터 벗어나지 않으면서 당업자들에게 일어날 것이다. 본원에 기술된 본 발명의 구체예들에 대한 다양한 대체물이 발명의 실시예 사용될 수 있다는 것이 인지되어야 한다. 다음의 청구범위는 발명의 범주를 규정하고 그로써 이 청구범위 및 그것들의 동등물의 범주 내에서 방법 및 구조가 포함되는 것으로 의도된다.
<110> Yale University
<120> microRNAs as Biomarkers for Endometriosis
<130> MPI19-008
<150> US 62/381,130
<151> 2016-08-30
<160> 51
<170> KoPatentIn 3.0
<210> 1
<211> 23
<212> RNA
<213> Homo sapiens
<400> 1
acugcccuaa gugcuccuuc ugg 23
<210> 2
<211> 23
<212> RNA
<213> Homo sapiens
<400> 2
uaaggugcau cuagugcaga uag 23
<210> 3
<211> 22
<212> RNA
<213> Homo sapiens
<400> 3
ugcccuaaau gccccuucug gc 22
<210> 4
<211> 23
<212> RNA
<213> Homo sapiens
<400> 4
uaaggugcau cuagugcagu uag 23
<210> 5
<211> 22
<212> RNA
<213> Homo sapiens
<400> 5
acaggugagg uucuugggag cc 22
<210> 6
<211> 24
<212> RNA
<213> Homo sapiens
<400> 6
ucccugagac ccuuuaaccu guga 24
<210> 7
<211> 22
<212> RNA
<213> Homo sapiens
<400> 7
acggguuagg cucuugggag cu 22
<210> 8
<211> 22
<212> RNA
<213> Homo sapiens
<400> 8
ucacaaguca ggcucuuggg ac 22
<210> 9
<211> 22
<212> RNA
<213> Homo sapiens
<400> 9
ucccugagac ccuaacuugu ga 22
<210> 10
<211> 22
<212> RNA
<213> Homo sapiens
<400> 10
ucguaccgug aguaauaaug cg 22
<210> 11
<211> 21
<212> RNA
<213> Homo sapiens
<400> 11
cauuauuacu uuugguacgc g 21
<210> 12
<211> 21
<212> RNA
<213> Homo sapiens
<400> 12
ugagaugaag cacuguagcu c 21
<210> 13
<211> 22
<212> RNA
<213> Homo sapiens
<400> 13
ggugcagugc ugcaucucug gu 22
<210> 14
<211> 22
<212> RNA
<213> Homo sapiens
<400> 14
ggauuccugg aaauacuguu cu 22
<210> 15
<211> 23
<212> RNA
<213> Homo sapiens
<400> 15
guccaguuuu cccaggaauc ccu 23
<210> 16
<211> 22
<212> RNA
<213> Homo sapiens
<400> 16
cugguacagg ccugggggac ag 22
<210> 17
<211> 22
<212> RNA
<213> Homo sapiens
<400> 17
ucucccaacc cuuguaccag ug 22
<210> 18
<211> 22
<212> RNA
<213> Homo sapiens
<400> 18
acagcaggca cagacaggca gu 22
<210> 19
<211> 22
<212> RNA
<213> Homo sapiens
<400> 19
ugccugucua cacuugcugu gc 22
<210> 20
<211> 23
<212> RNA
<213> Homo sapiens
<400> 20
ucucacacag aaaucgcacc cgu 23
<210> 21
<211> 21
<212> RNA
<213> Homo sapiens
<400> 21
aggggugcua ucugugauug a 21
<210> 22
<211> 22
<212> RNA
<213> Homo sapiens
<400> 22
aaaccguuac cauuacugag uu 22
<210> 23
<211> 22
<212> RNA
<213> Homo sapiens
<400> 23
uagcaagaga accauuacca uu 22
<210> 24
<211> 22
<212> RNA
<213> Homo sapiens
<400> 24
augcaccugg gcaaggauuc ug 22
<210> 25
<211> 23
<212> RNA
<213> Homo sapiens
<400> 25
uaauccuugc uaccugggug aga 23
<210> 26
<211> 20
<212> RNA
<213> Homo sapiens
<400> 26
gcacccaggc aaggauucug 20
<210> 27
<211> 18
<212> RNA
<213> Homo sapiens
<400> 27
aauccuugcu accugggu 18
<210> 28
<211> 21
<212> RNA
<213> Homo sapiens
<400> 28
aaaacgguga gauuuuguuu u 21
<210> 29
<211> 24
<212> RNA
<213> Homo sapiens
<400> 29
acaaaaaaaa aagcccaacc cuuc 24
<210> 30
<211> 22
<212> RNA
<213> Homo sapiens
<400> 30
uguuguacuu uuuuuuuugu uc 22
<210> 31
<211> 23
<212> RNA
<213> Homo sapiens
<400> 31
gaaaauccuu uuuguuuuuc cag 23
<210> 32
<211> 23
<212> RNA
<213> Homo sapiens
<400> 32
agggaaaaaa aaaaggauuu guc 23
<210> 33
<211> 22
<212> RNA
<213> Homo sapiens
<400> 33
uguugucaug uuuuuucccu ag 22
<210> 34
<211> 22
<212> RNA
<213> Homo sapiens
<400> 34
uaggguagac acugacaacg uu 22
<210> 35
<211> 22
<212> RNA
<213> Homo sapiens
<400> 35
cuauacaacc uacugccuuc cc 22
<210> 36
<211> 22
<212> RNA
<213> Homo sapiens
<400> 36
ugagguagua gguugugugg uu 22
<210> 37
<211> 22
<212> RNA
<213> Artificial Sequence
<220>
<223> chemically synthesized
<400> 37
ucccugagac ccuaacuugu ga 22
<210> 38
<211> 22
<212> RNA
<213> Artificial Sequence
<220>
<223> chemically synthesized
<400> 38
ucucccaacc cuuguaccag ug 22
<210> 39
<211> 23
<212> RNA
<213> Artificial Sequence
<220>
<223> chemically synthesized
<400> 39
ucucacacag aaaucgcacc cgu 23
<210> 40
<211> 23
<212> RNA
<213> Artificial Sequence
<220>
<223> chemically synthesized
<400> 40
guccaguuuu cccaggaauc ccu 23
<210> 41
<211> 21
<212> RNA
<213> Artificial Sequence
<220>
<223> chemically synthesized
<400> 41
ugagaugaag cacuguagcu c 21
<210> 42
<211> 22
<212> RNA
<213> Artificial Sequence
<220>
<223> chemically synthesized
<400> 42
augcaccugg gcaaggauuc ug 22
<210> 43
<211> 22
<212> RNA
<213> Artificial Sequence
<220>
<223> chemically synthesized
<400> 43
aaaccguuac cauuacugag uu 22
<210> 44
<211> 23
<212> RNA
<213> Artificial Sequence
<220>
<223> chemically synthesized
<400> 44
uaaggugcau cuagugcaga uag 23
<210> 45
<211> 22
<212> RNA
<213> Artificial Sequence
<220>
<223> chemically synthesized
<400> 45
uguugucaug uuuuuucccu ag 22
<210> 46
<211> 22
<212> RNA
<213> Artificial Sequence
<220>
<223> chemically synthesized
<400> 46
uguuguacuu uuuuuuuugu uc 22
<210> 47
<211> 21
<212> RNA
<213> Artificial Sequence
<220>
<223> chemically synthesized
<400> 47
aaaacgguga gauuuuguuu u 21
<210> 48
<211> 23
<212> RNA
<213> Artificial Sequence
<220>
<223> chemically synthesized
<400> 48
gaaaauccuu uuuguuuuuc cag 23
<210> 49
<211> 22
<212> RNA
<213> Artificial Sequence
<220>
<223> chemically synthesized
<400> 49
acagcaggca cagacaggca gu 22
<210> 50
<211> 22
<212> RNA
<213> Artificial Sequence
<220>
<223> chemically synthesized
<400> 50
ucguaccgug aguaauaaug cg 22
<210> 51
<211> 17
<212> DNA
<213> Artificial Sequence
<220>
<223> chemically synthesized
<400> 51
ctcgcttcgg cagcaca 17
Claims (106)
- 자궁내막증을 가진 것으로 의심되는 대상체를 진단하는 방법으로서,
a. 상기 대상체로부터 타액, 가래, 소변, 림프액, 활액, 뇌척수액, 대변, 또는 점액 샘플을 제공하는 단계로서, 상기 타액, 가래, 소변, 림프액, 활액, 뇌척수액, 대변, 또는 점액 샘플은 자궁내막증과 관련된 miRNA를 포함하는 것인 단계;
b. 자궁내막증과 관련된 상기 miRNA의 수준을 검출하는 단계;
c. 상기 타액, 가래, 소변, 림프액, 활액, 뇌척수액, 대변, 또는 점액 샘플 중의 자궁내막증과 관련된 miRNA의 상대적인 수준을 측정하기 위하여 자궁내막증과 관련된 상기 miRNA의 검출된 수준을 기준값과 비교하는 단계; 및
d. 상기 타액, 가래, 소변, 림프액, 활액, 뇌척수액, 대변, 또는 점액 샘플 중의 자궁내막증과 관련된 상기 miRNA의 상대적인 수준을 기반으로 상기 대상체를 자궁내막증으로 진단하는 단계로서, 상기 대상체를 자궁내막증으로 진단하는 것은 90%보다 큰 특이도 또는 민감도를 가지는 것인 단계
를 포함하는 방법.
- miRNA를 검출하는 방법으로서,
a. 대상체로부터 타액, 가래, 소변, 림프액, 활액, 뇌척수액, 대변, 또는 점액 샘플을 제공하는 단계로서, 상기 샘플은 핵산을 포함하고 상기 대상체는 자궁내막증을 가진 것으로 의심되는 것인 단계;
b. 상기 샘플 중의 적어도 하나의 miRNA의 존재를 검출하기 위하여 상기 핵산에 대해 증폭 또는 서열분석 반응을 수행하는 단계로서, 상기 적어도 하나의 miRNA는 miR-18, miR-125, miR-126, miR-143, miR-145, miR-150, miR-214, miR-342, miR-451, miR-500, miR-553, miR-3613, miR-4668, 및 miR-6755로 구성되는 군으로부터 선택되는 것인 단계; 및
c. 상기 miRNA의 존재를 기준값에 비교하는 단계
를 포함하는 방법.
- 제 1 항 또는 제 2 항에 있어서, 상기 샘플은 유체인 것인 방법.
- 제 1 항 내지 제 3 항 중 어느 한 항에 있어서, 상기 샘플은 혈액, 혈장, 또는 혈청인 것인 방법.
- 제 1 항 내지 제 4 항 중 어느 한 항에 있어서, 상기 샘플은 타액인 것인 방법.
- 제 1 항 내지 제 5 항 중 어느 한 항에 있어서, 상기 샘플은 세포-유리(cell-free)인 것인 방법.
- 제 1 항 내지 제 6 항 중 어느 한 항에 있어서, 상기 기준값은 자궁내막증을 갖지 않은 대상체로부터의 샘플 중에 적어도 하나의 miRNA가 존재하는 것인 방법.
- 제 1 항 내지 제 7 항 중 어느 한 항에 있어서, 상기 miRNA는 miR-125, miR-451, 및 miR-3613으로 구성되는 군으로부터 선택되는 것인 방법.
- 제 1 항 내지 제 8 항 중 어느 한 항에 있어서, 상기 miRNA는 miR-125b인 것인 방법.
- 제 1 항 내지 제 9 항 중 어느 한 항에 있어서, 상기 miRNA는 miR-125b-5p인 것인 방법.
- 제 1 항 내지 제 10 항 중 어느 한 항에 있어서, 상기 miRNA는 miR-451a인 것인 방법.
- 제 1 항 내지 제 11 항 중 어느 한 항에 있어서, 상기 miRNA는 miR-3613-5p인 것인 방법.
- a. 대상체로부터 샘플을 제공하는 단계로서, 상기 샘플은 핵산을 포함하고 상기 대상체는 자궁내막증을 가진 것으로 의심되는 것인, 단계;
b. 상기 샘플 중의 적어도 하나의 miRNA의 존재를 검출하기 위하여 상기 핵산에 대해 서열분석 반응을 수행하는 단계로서, 상기 적어도 하나의 miRNA는 miR-18, miR-125, miR-126, miR-143, miR-145, miR-150, miR-214, miR-342, miR-451, miR-500, miR-553, miR-3613, miR-4668, 및 miR-6755로 구성되는 군으로부터 선택되는 것인, 단계; 및
c. 상기 miRNA의 존재를 기준값에 비교하는 단계
를 포함하는 방법.
- 제 1 항 내지 제 13 항 중 어느 한 항에 있어서, 상기 적어도 하나의 miRNA는 고처리량 또는 대량 병렬 서열분석에 의해 검출되는 것인 방법.
- 자궁내막증의 증상을 나타내는 또는 자궁내막증을 가진 것으로 의심되는 대상체를 진단하는 방법으로서,
a. let-7, miR-135, miR-449a, miR-34c, miR-200a, miR-200b, miR-141, miR-125b-5p, miR-150-5p, miR-342-3p, miR-145-5p, miR-143-3p, miR-500a-3p, miR-451a, miR-18a-5p, miR-6755-3p, miR-3613-5p가 아닌 적어도 하나의 miRNA의 존재를 검출하는 단계; 및
b. 검출된 상기 miRNA 수준이 한계 수준을 초과할 때 대상체를 자궁내막증으로 진단하는 단계를 포함하며, 상기 대상체를 자궁내막증으로 진단하는 것은 90%보다 큰 특이도 또는 민감도를 가지는 것인 방법.
- 제 1 항 내지 제 15 항 중 어느 한 항에 있어서, 상기 miRNA는 세포-유리인 것인 방법.
- 제 1 항 내지 제 16 항 중 어느 한 항에 있어서, 상기 대상체를 자궁내막증으로 진단하는 것은 대상체를 초기 단계 자궁내막증으로 진단하는 것인 방법.
- 제 1 항 내지 제 17 항 중 어느 한 항에 있어서, 상기 대상체를 자궁내막증으로 진단하는 것은 대상체를 중등도 내지 중증 질환으로 진단하는 것인 방법.
- 제 1 항 내지 제 18 항 중 어느 한 항에 있어서, 상기 대상체를 자궁내막증으로 진단하는 것은 대상체를 단계 III 또는 단계 IV 자궁내막증으로 진단하는 것인 방법.
- 제 1 항 내지 제 19 항 중 어느 한 항에 있어서, 상기 대상체를 자궁내막증으로 진단하는 것은 대상체를 치료 후 miRNA 발현 수준의 변화에 대해 모니터링하는 단계를 더 포함하는 것인 방법.
- 제 1 항 내지 제 20 항 중 어느 한 항에 있어서, 상기 대상체를 자궁내막증으로 진단하는 것은 85%보다 큰 특이도 또는 민감도를 가지는 것인 방법.
- 제 1 항 내지 제 21 항 중 어느 한 항에 있어서, 상기 대상체를 자궁내막증으로 진단하는 것은 95%보다 큰 특이도 또는 민감도를 가지는 것인 방법.
- 제 1 항 내지 제 22 항 중 어느 한 항에 있어서, 상기 방법은 대상체를 자궁내막증에 대해 치료하는 단계를 더 포함하는 것인 방법.
- 제 1 항 내지 제 23 항 중 어느 한 항에 있어서, 상기 치료는 통증을 완화시키기 위한 약물치료인 것인 방법.
- 제 1 항 내지 제 24 항 중 어느 한 항에 있어서, 상기 치료는 호르몬 요법인 것인 방법.
- 제 1 항 내지 제 25 항 중 어느 한 항에 있어서, 상기 치료는 호르몬 피임제인 것인 방법.
- 제 1 항 내지 제 26 항 중 어느 한 항에 있어서, 상기 치료는 생식샘 자극호르몬-방출 호르몬 작용물질인 것인 방법.
- 제 1 항 내지 제 27 항 중 어느 한 항에 있어서, 상기 치료는 생식샘 자극호르몬-방출 호르몬 길항물질인 것인 방법.
- 제 1 항 내지 제 28 항 중 어느 한 항에 있어서, 상기 검출 단계는 (i) 적어도 하나의 miRNA에 특이적으로 결합하는 프라이머를 사용하는 또는 보편적 프라이머를 사용하는 역전사 검정을 수행함으로써 샘플 내의 miRNA를 증폭시켜서 cDNA를 생성시키는 단계; (ii) 생성된 상기 cDNA를 적어도 하나의 miRNA에 특이적인 프로브와 접촉시키는 단계로서, 상기 프로브는 생성된 상기 cDNA에 결합할 때 신호를 방출하는 것인 단계; 및 (iii) 검출기를 사용하여 상기 프로브에 의해 방출된 신호를 검출하는 단계를 포함하는 것인 방법.
- miRNA를 검출하는 방법으로서,
a. 대상체로부터 샘플을 제공하는 단계로서, 상기 샘플은 핵산을 포함하고 상기 대상체는 자궁내막증을 가진 것으로 의심되는 것인 단계;
b. 상기 핵산에 대해 증폭, 마이크로어레이 또는 서열분석 반응을 수행하는 단계;
c. 상기 샘플 중의 적어도 하나의 miRNA의 존재를 검출하는 단계로서, 상기 적어도 하나의 miRNA는 miR-126, miR-214, miR-553, 및 miR-4668로 구성되는 군으로부터 선택되는 것인 단계; 및
d. 상기 miRNA의 존재를 기준값과 비교하는 단계
를 포함하는 방법.
- 제 1 항 내지 제 30 항 중 어느 한 항에 있어서, 상기 샘플은 유체인 것인 방법.
- 제 1 항 내지 제 31 항 중 어느 한 항에 있어서, 상기 샘플은 혈액, 혈장, 타액, 또는 혈청인 것인 방법.
- 제 1 항 내지 제 32 항 중 어느 한 항에 있어서, 상기 기준값은 자궁내막증을 갖지 않은 대상체로부터의 샘플 중에 적어도 하나의 miRNA가 존재하는 것인 방법.
- 제 1 항 내지 제 33 항 중 어느 한 항에 있어서, 상기 검출 단계는 중합효소 연쇄 반응(PCR)에 의한 것인 방법.
- 제 1 항 내지 제 34 항 중 어느 한 항에 있어서, 상기 검출 단계는 정량적 PCR에 의한 것인 방법.
- 제 1 항 내지 제 35 항 중 어느 한 항에 있어서, 상기 검출 단계는 특유한 프라이머를 적어도 하나의 miRNA에 또는 적어도 하나의 miRNA로부터 유래된 cDNA에 혼성화시키는 단계를 포함하는 것인 방법.
- 제 1 항 내지 제 36 항 중 어느 한 항에 있어서, 상기 검출 단계는 적어도 하나의 프라이머 또는 적어도 하나의 miRNA에 특이적인 프로브를 사용하여 또는 적어도 하나의 보편적 프라이머를 사용하여 적어도 하나의 miRNA에 대해 역전사 반응을 수행하는 단계를 더 포함하는 것인 방법.
- 제 1 항 내지 제 37 항 중 어느 한 항에 있어서, 상기 검출 단계는 (i) 적어도 하나의 miRNA에 특이적으로 결합하는 프라이머를 사용하는 또는 보편적 프라이머를 사용하는 역전사 검정을 수행함으로써 샘플 내의 miRNA를 증폭시켜서 cDNA를 생성시키는 단계; (ii) 생성된 상기 cDNA를 신호를 방출하는 인터컬레이팅 다이(intercalating dye)와 접촉시키는 단계; 및 (iii) 검출기를 사용하여 시간 경과에 따라 방출된 상기 신호를 검출하는 단계를 포함하는 것인 방법.
- 제 1 항 내지 제 38 항 중 어느 한 항에 있어서, 상기 검출 단계는 (i) 적어도 하나의 miRNA에 특이적으로 결합하는 프라이머를 사용하는 또는 보편적 프라이머를 사용하는 역전사 검정을 수행함으로써 샘플 내의 miRNA를 증폭시켜서 cDNA를 생성시키는 단계; (ii) 생성된 상기 cDNA를 적어도 하나의 miRNA에 특이적인 프로브와 접촉시키는 단계로서, 상기 프로브는 생성된 상기 cDNA와 결합할 때 신호를 방출하는 것인 단계; 및 (iii) 검출기를 사용하여 상기 프로브에 의해 방출된 신호를 검출하는 단계를 포함하는 것인 방법.
- 제 1 항 내지 제 39 항 중 어느 한 항에 있어서, 상기 프로브는 형광발색단 및 소광물질에 부착되는 것인 방법.
- 제 1 항 내지 제 40 항 중 어느 한 항에 있어서, 상기 검출 단계는 서열분석에 의한 것인 방법.
- 제 1 항 내지 제 41 항 중 어느 한 항에 있어서, 상기 자궁내막증은 적어도 하나의 miRNA가 기준값보다 적어도 2배 더 클 때 진단되는 것인 방법.
- 제 1 항 내지 제 42 항 중 어느 한 항에 있어서, 상기 자궁내막증은 적어도 하나의 miRNA가 기준값보다 적어도 2배 더 적을 때 진단되는 것인 방법.
- 제 1 항 내지 제 43 항 중 어느 한 항에 있어서, 상기 자궁내막증은 miRNA-125b-5p가 상향조절되거나, miR-150-5p가 상향조절되거나, miR-342-3p가 상향조절되거나, miR-145-5p가 상향조절되거나, miR-143-3p가 상향조절되거나, miR-500a-3p가 상향조절되거나, 또는 miR-18a-5p가 상향조절되는 때 진단되는 것인 방법.
- 제 1 항 내지 제 44 항 중 어느 한 항에 있어서, 상기 자궁내막증은 적어도 3개의 miRNA가 상향조절되는 때 진단되고, 상기 적어도 3개의 miRNA는 miRNA-125b-5p, miR-150-5p, miR-342-3p, miR-145-5p, miR-143-3p, miR-500a-3p, 및 miR-18a-5p로 구성되는 군으로부터 유래되는 것인 방법.
- 제 1 항 내지 제 45 항 중 어느 한 항에 있어서, 상기 자궁내막증은 miR-6755-3p가 하향조절되거나 miR-3613-5p가 하향조절되는 때 진단되는 것인 방법.
- 제 1 항 내지 제 46 항 중 어느 한 항에 있어서, 상기 자궁내막증은 miR-125b-5p가 상향조절되고, miR-451a가 상향조절되며, miR-3613-5p가 하향조절되는 때 진단되는 것인 방법.
- 제 1 항 내지 제 47 항 중 어느 한 항에 있어서, 상기 자궁내막증은 miR-125b-5p가 상향조절되는 때 진단되는 것인 방법.
- 제 1 항 내지 제 48 항 중 어느 한 항에 있어서, 상기 대상체는 KRAS 변종 대립유전자의 존재에 대해 음성인 것인 방법.
- 제 1 항 내지 제 49 항 중 어느 한 항에 있어서, 상기 검출된 miRNA 수준은 질환의 중증도를 측정하기 위해 사용되는 것인 방법.
- 제 1 항 내지 제 50 항 중 어느 한 항에 있어서, 상기 대상체는 인간 대상체인 것인 방법.
- 자궁내막증에 걸린 대상체를 치료하는 방법으로서, 비교기와 비교하여 대상체의 생물학적 샘플에서 miR-18a-5p, miR-125, miR-126, miR-143, miR-145, miR-150-5p, miR-214, miR-342, miR-451, miR-500, miR-553, miR-3613, miR-4668, 및 miR-6755로 구성되는 군으로부터 선택된 적어도 하나의 miRNA의 차등 수준을 가지는 것으로서 확인된 대상체에게 자궁내막증 치료를 투여하는 단계를 포함하는 방법.
- 제 52 항에 있어서, 대상체가 비교기와 비교하여, miR-18a-5p, miR-125, miR-126, miR-143, miR-145, miR-150-5p, miR-214, miR-342, miR-451, miR-500, miR-553, miR-3613, miR-4668, 및 miR-6755로 구성되는 군으로부터 선택된 적어도 하나의 miRNA의 차등 수준을 가지는 것으로서 확인될 때 상기 대상체를 자궁내막증으로 진단하는 단계를 더 포함하는 것인 방법.
- 제 53 항에 있어서, 상기 대상체를 자궁내막증으로 진단하는 단계는 대상체로부터 생물학적 샘플을 제공하는 단계 및 생물학적 샘플에서 비교기와 비교하여, miR-18a-5p, miR-125, miR-126, miR-143, miR-145, miR-150-5p, miR-214, miR-342, miR-451, miR-500, miR-553, miR-3613, miR-4668, 및 miR-6755로 구성되는 군으로부터 선택된 적어도 하나의 miRNA의 차등적 수준을 검출하는 단계를 포함하는 것인 방법.
- 제 54 항에 있어서, 상기 생물학적 샘플은 체액인 것인 방법.
- 제 55 항에 있어서, 상기 체액은 혈액, 혈장, 또는 혈청인 것인 방법.
- 제 55 항에 있어서, 상기 체액은 타액인 것인 방법.
- 제 55 항에 있어서, 상기 체액은 소변인 것인 방법.
- 자궁내막증을 가진 것으로 의심되는 대상체를 진단 및 치료하는 방법으로서,
a. 상기 대상체로부터 타액, 가래, 소변, 림프액, 활액, 뇌척수액, 대변, 또는 점액 샘플을 제공하는 단계로서, 상기 샘플은 자궁내막증과 관련된 miRNA를 포함하는 것인 단계;
b. 상기 자궁내막증과 관련된 miRNA의 수준을 검출하는 단계;
c. 상기 자궁내막증과 관련된 miRNA의 검출된 수준을 유체 샘플 중의 자궁내막증과 관련된 miRNA의 상대적인 수준을 측정하기 위하여 기준값과 비교하는 단계;
d. 상기 타액, 가래, 소변, 림프액, 활액, 뇌척수액, 대변 또는 점액 샘플 중의 자궁내막증과 관련된 miRNA의 상대적인 수준을 기반으로 상기 대상체를 자궁내막증으로 진단하는 단계로서, 상기 대상체를 자궁내막증으로 진단하는 단계는 90%보다 큰 민감도 또는 특이도를 가지는 것인 단계; 및
e. 자궁내막증으로 진단된 상기 대상체에게 치료를 투여하는 단계
를 포함하는 방법.
- 자궁내막증을 가진 것으로 의심되는 대상체를 진단 및 치료하는 방법으로서,
a. let-7, miR-449a, miR-34c, miR-200a, miR-200b, miR-150, miR-18a, 또는 miR-141이 아닌 적어도 하나의 miRNA의 존재를 검출하는 단계;
b. 검출된 상기 miRNA 수준이 한계 수준을 초과할 때 대상체를 자궁내막증으로 진단하는 단계로서, 상기 대상체를 자궁내막증으로 진단하는 것은 90%보다 큰 특이도 또는 민감도를 가지는 것인, 단계; 및
c. 자궁내막증으로 진단된 상기 대상체에게 치료를 투여하는 단계
를 포함하는 방법.
- 제 1 항 내지 제 60 항 중 어느 한 항에 있어서, 상기 적어도 하나의 miRNA는 miR-125b-5p, miR-451a, 및 miR-3613-5p를 포함하는 것인 방법.
- 제 1 항 내지 제 61 항 중 어느 한 항에 있어서, 상기 적어도 하나의 miRNA는 miR-125b-5p인 것인 방법.
- 제 1 항 내지 제 62 항 중 어느 한 항에 있어서, 상기 적어도 하나의 miRNA는 miR-3613-5p인 것인 방법.
- 제 1 항 내지 제 63 항 중 어느 한 항에 있어서, 상기 적어도 하나의 miRNA는 세포-유리 miRNA인 것인 방법.
- 제 1 항 내지 제 64 항 중 어느 한 항에 있어서, 상기 적어도 하나의 miRNA는 비교기와 비교하여 적어도 2배 변화로 존재하는 것인 방법.
- 제 1 항 내지 제 65 항 중 어느 한 항에 있어서, 상기 대상체를 자궁내막증으로 진단하는 것은 대상체를 초기 단계 자궁내막증으로 진단하는 것인 방법.
- 제 1 항 내지 제 66 항 중 어느 한 항에 있어서, 상기 대상체를 자궁내막증으로 진단하는 것은 대상체를 중등도 내지 중증 질환으로 진단하는 것인 방법.
- 제 1 항 내지 제 67 항 중 어느 한 항에 있어서, 상기 대상체를 자궁내막증으로 진단하는 것은 대상체를 단계 III 또는 단계 IV 자궁내막증으로 진단하는 것인 방법.
- 제 1 항 내지 제 68 항 중 어느 한 항에 있어서, 상기 대상체를 자궁내막증으로 진단하는 것은 대상체를 치료 후 miRNA 발현 수준의 변화에 대해 모니터링하는 단계를 더 포함하는 것인 방법.
- 제 1 항 내지 제 69 항 중 어느 한 항에 있어서, 상기 대상체를 자궁내막증으로 진단하는 것은 95%보다 큰 특이도 또는 민감도를 가지는 것인 방법.
- 제 1 항 내지 제 70 항 중 어느 한 항에 있어서,
- 제 1 항 내지 제 71 항 중 어느 한 항에 있어서, 상기 치료는 통증을 완화시키기 위한 약물치료인 것인 방법.
- 제 1 항에 있어서, 상기 치료는 호르몬 요법, 호르몬 피임제, 생식샘 자극호르몬-방출 호르몬 작용물질, 및 생식샘 자극호르몬-방출 호르몬 길항물질로 구성되는 군으로부터 선택되는 것인 방법.
- 제 2 항에 있어서, 중합효소 연쇄 반응(PCR)을 수행함으로써 적어도 하나의 miRNA를 검출하는 단계를 더 포함하는 것인 방법.
- 제 2 항에 있어서, 정량적(quantitative) PCR을 수행함으로써 적어도 하나의 miRNA를 검출하는 단계를 더 포함하는 것인 방법.
- 제 2 항에 있어서, (i) 적어도 하나의 miRNA에 특이적으로 결합하는 프라이머를 사용하는 또는 보편적 프라이머를 사용하는 역전사 검정을 수행함으로써 샘플 내의 miRNA를 증폭시켜서 cDNA를 생성시키는 단계; (ii) 생성된 상기 cDNA를 신호를 방출하는 인터컬레이팅 다이(intercalating dye)와 접촉시키는 단계; 및 (iii) 검출기를 사용하여 시간 경과에 따라 방출된 상기 신호를 검출하는 단계에 의해 적어도 하나의 miRNA를 검출하는 단계를 더 포함하는 것인 방법.
- 제 2 항에 있어서, (i) 적어도 하나의 miRNA에 특이적으로 결합하는 프라이머를 사용하는 또는 보편적 프라이머를 사용하는 역전사 검정을 수행함으로써 샘플 내의 miRNA를 증폭시켜서 cDNA를 생성시키는 단계; (ii) 생성된 상기 cDNA를 적어도 하나의 miRNA에 특이적인 프로브와 접촉시키는 단계로서, 상기 프로브는 생성된 상기 cDNA에 결합할 때 신호를 방출하는 단계; 및 (iii) 검출기를 사용하여 프로브에 의해 방출된 상기 신호를 검출하는 단계에 의해 적어도 하나의 miRNA를 검출하는 단계를 더 포함하는 것인 방법.
- 제 2 항에 있어서, 서열분석에 의하여 적어도 하나의 miRNA를 검출하는 단계를 더 포함하는 것인 방법.
- 제 2 항에 있어서, 고처리량 서열분석 또는 대량 병렬 서열분석에 의하여 적어도 하나의 miRNA를 검출하는 단계를 더 포함하는 것인 방법.
- 제 2 항에 있어서, 상기 적어도 하나의 miRNA는 기준값보다 적어도 2배 더 큰 수준으로 존재하는 것인 방법.
- 제 1 항에 있어서, 상기 대상체는 KRAS 변종 대립유전자의 존재에 대해 음성인 것인 방법.
- 제 1 항에 있어서, 상기 적어도 하나의 miRNA의 수준은 질환의 중증도를 측정하기 위해 사용되는 것인 방법.
- 제 1 항 또는 제 3 항에 있어서, 상기 대상체는 인간 대상체인 것인 방법.
- 제 2 항에 있어서, 상기 자궁내막증은 miRNA-125b-5p가 상향조절되거나, miR-150-5p가 상향조절되거나, miR-342-3p가 상향조절되거나, miR-145-5p가 상향조절되거나, miR-143-3p가 상향조절되거나, miR-500a-3p가 상향조절되거나, 또는 miR-18a-5p가 상향조절되는 때 진단되는 것인 방법.
- 제 2 항에 있어서, 상기 자궁내막증은 적어도 3개의 miRNA가 상향조절되는 때 진단되고, 상기 적어도 3개의 miRNA는 miRNA-125b-5p, miR-150-5p, miR-342-3p, miR-145-5p, miR-143-3p, miR-500a-3p, 및 miR-18a-5p로 구성되는 군으로부터 유래되는 것인 방법.
- 제 2 항에 있어서, 상기 자궁내막증은 miR-6755-3p가 하향조절되거나 miR-3613-5p가 하향조절되는 때 진단되는 것인 방법.
- 제 2 항에 있어서, 상기 자궁내막증은 miR-125b-5p가 상향조절되고, miR-451a가 상향조절되며, miR-3613-5p가 하향조절되는 때 진단되는 것인 방법.
- 제 2 항에 있어서, 상기 자궁내막증은 miR-125b-5p가 상향조절되는 때 진단되는 것인 방법.
- 샘플 중의 마이크로RNA("miRNA")를 검출하는 방법으로서,
a. 대상체로부터 타액, 가래, 소변, 림프액, 활액, 뇌척수액, 대변, 또는 점액 샘플을 제공하는 단계로서, 상기 샘플은 핵산을 포함하고 상기 대상체는 자궁내막증을 가진 것으로 의심되는 것인 단계;
b. 상기 핵산에 대해 증폭 또는 서열분석 반응을 수행하는 단계;
c. 상기 샘플 중의 적어도 하나의 miRNA의 존재를 검출하는 단계로서, 상기 적어도 하나의 miRNA는 miR-18, miR-125, miR-126, miR-143, miR-145, miR-150, miR-214, miR-342, miR-451, miR-500, miR-553, miR-3613, miR-4668, 및 miR-6755로 구성되는 군으로부터 선택되는 것인 단계; 및
d. 상기 miRNA의 존재를 기준값에 비교하는 단계
를 포함하는 방법.
- 대상체에서 자궁내막증을 진단하는 방법으로서,
a. 대상체의 생물학적 샘플에서 적어도 하나의 miRNA의 수준을 측정하는 단계로서, 상기 miRNA는 miR-125, miR-150, miR-342, miR-145, miR-143, miR-500, miR-451, miR-18, miR-214, miR-126, miR-6755, miR-3613, miR-553, 및 miR-4668로 구성되는 군으로부터 선택된 적어도 하나인 것인 단계, 및
b. 상기 생물학적 샘플 중의 적어도 하나의 miRNA의 수준을 비교기의 적어도 하나의 miRNA의 수준과 비교하는 단계로서, 상기 생물학적 샘플 중의 적어도 하나의 miRNA의 수준이 비교기의 적어도 하나의 miRNA의 수준과 상이할 때, 상기 대상체는 자궁내막증으로 진단되는 단계
를 포함하는 방법.
- 제 1 항 내지 제 90 항 중 어느 한 항에 있어서, 상기 적어도 하나의 miRNA는 miR-125, miR-451 및 miR-3613의 조합인 것인 방법.
- 제 1 항 내지 제 91 항 중 어느 한 항에 있어서, 상기 대상체는 인간인 것인 방법.
- 제 1 항 내지 제 92 항 중 어느 한 항에 있어서, 상기 대상체를 자궁내막증에 대해 치료하는 단계를 더 포함하는 것인 방법.
- 제 1 항 내지 제 93 항 중 어느 한 항에 있어서, 상기 비교기는 양성 대조군, 음성 대조군, 정상 대조군, 야생형 대조군, 과거 대조군, 및 과거 표준으로 구성되는 군으로부터 선택된 적어도 하나의 비교기인 것인 방법.
- 제 1 항 내지 제 94 항 중 어느 한 항에 있어서, 상기 방법은 miR-125, miR-150, miR-342, miR-145, miR-143, miR-500, miR-451, miR-18, miR-214, 및 miR-126 중 적어도 하나의 수준이 비교기의 수준과 비교하여 생물학적 샘플에서 증가되는 것을 검출하는 단계를 포함하는 것인 방법.
- 제 1 항 내지 제 95 항 중 어느 한 항에 있어서, 상기 방법은 miR-6755, miR-3613, miR-553, 및 miR-4668 중 적어도 하나의 수준이 비교기의 수준과 비교하여 생물학적 샘플에서 감소되는 것을 검출하는 단계를 포함하는 것인 방법.
- 제 1 항 내지 제 96 항 중 어느 한 항에 있어서, 상기 적어도 하나의 miRNA의 수준을 측정하는 단계는 역전사, PCR, 및 마이크로어레이로 구성되는 군으로부터 선택되는 적어도 하나의 기법을 이용하는 것인 방법.
- 제 1 항 내지 제 97 항 중 어느 한 항에 있어서, 상기 생물학적 샘플은 혈액, 혈청, 혈장, 및 그것들의 임의의 조합으로 구성되는 군으로부터 선택되는 것인 방법.
- 대상체에서 자궁내막증을 진단하거나 자궁내막증에 대한 예측을 제공하는 방법으로서, 자궁내막증으로 의심되는 또는 자궁내막증을 가진 대상체의 생물학적 샘플에서 miR-125, miR-150, miR-342, miR-145, miR-143, miR-500, miR-451, miR-18, miR-214, miR-126, miR-6755, miR-3613, miR-553, 및 miR-4668로 구성되는 군으로부터 선택된 적어도 하나의 miRNA의 변경된 발현을 검출하는 단계를 포함하는 방법.
- 제 1 항 내지 제 99 항 중 어느 한 항에 있어서, 상기 적어도 하나의 miRNA는 miR-125, miR-451, 및 miR-3613의 조합인 것인 방법.
- 제 1 항 내지 제 100 항 중 어느 한 항에 있어서, 상기 생물학적 샘플은 혈액, 혈청, 혈장, 및 그것들의 임의의 조합으로 구성되는 군으로부터 선택되는 것인 방법.
- 적어도 하나의 miRNA에 선택적으로 결합하는 시약을 포함하는 키트로서, 상기 적어도 하나의 miRNA는 miR-125, miR-150, miR-342, miR-145, miR-143, miR-500, miR-451, miR-18, miR-214, miR-126, miR-6755, miR-3613, miR-553, 및 miR-4668로 구성되는 군으로부터 선택된 적어도 하나인 것인 키트.
- 제 97 항에 있어서, 적어도 3개의 시약을 포함하며, 여기서 제 1 시약은 miR-125에 선택적으로 결합하고, 제 2 시약은 miR-451에 선택적으로 결합하며 제 3 시약은 miR-3613에 선택적으로 결합하는 것인 키트.
- 자궁내막증을 가진 대상체를 치료하는 방법으로서, 비교기와 비교하여 대상체의 생물학적 샘플 중의 miR-125, miR-150, miR-342, miR-145, miR-143, miR-500, miR-451, miR-18, miR-214, miR-126, miR-6755, miR-3613, miR-553, 및 miR-4668로 구성되는 군으로부터 선택된 적어도 하나의 miRNA의 차등적 수준을 가지는 것으로서 확인된 대상체에 자궁내막증 치료를 투여하는 단계를 포함하는 방법.
- 자궁내막증에 대해 치료되는 대상체에서 자궁내막증 치료에 대한 반응을 모니터링하는 방법으로서,
a. 대상체의 생물학적 샘플에서 적어도 하나의 miRNA의 수준을 측정하는 단계로서, 상기 miRNA는 miR-125, miR-150, miR-342, miR-145, miR-143, miR-500, miR-451, miR-18, miR-214, miR-126, miR-6755, miR-3613, miR-553, 및 miR-4668로 구성되는 군으로부터 선택된 적어도 하나인 것인 단계, 및
b. 상기 생물학적 샘플 중의 상기 적어도 하나의 miRNA의 수준을 비교기의 적어도 하나의 miRNA의 수준과 비교하는 단계
를 포함하는 방법.
- 제 1 항 내지 제 105 항 중 어느 한 항에 있어서, 상기 적어도 하나의 miRNA는 let-7, let-7a, let-7b, let-7c, let-7d, let-7e, let-7f, 또는 let-7g를 포함하는 것인 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662381130P | 2016-08-30 | 2016-08-30 | |
| US62/381,130 | 2016-08-30 | ||
| PCT/US2017/049284 WO2018044979A1 (en) | 2016-08-30 | 2017-08-30 | Micrornas as biomarkers for endometriosis |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20190057305A true KR20190057305A (ko) | 2019-05-28 |
Family
ID=61301726
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020197009115A KR20190057305A (ko) | 2016-08-30 | 2017-08-30 | 자궁내막증에 대한 바이오마커로서의 microRNAs |
Country Status (11)
| Country | Link |
|---|---|
| US (3) | US10982282B2 (ko) |
| EP (1) | EP3506912B1 (ko) |
| JP (2) | JP2019528081A (ko) |
| KR (1) | KR20190057305A (ko) |
| CN (1) | CN109890394A (ko) |
| AU (1) | AU2017319325A1 (ko) |
| BR (1) | BR112019004075A2 (ko) |
| CA (1) | CA3035429A1 (ko) |
| MX (1) | MX2019002425A (ko) |
| SG (2) | SG11201901834WA (ko) |
| WO (1) | WO2018044979A1 (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR102242639B1 (ko) * | 2020-01-28 | 2021-04-21 | 고려대학교 산학협력단 | 간 섬유화 진단용 바이오마커 miRNA4668-5p |
Families Citing this family (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3122905B1 (en) | 2014-03-27 | 2020-09-09 | Yale University | Circulating micrornas as biomarkers for endometriosis |
| SG11201901834WA (en) | 2016-08-30 | 2019-03-28 | Univ Yale | Micrornas as biomarkers for endometriosis |
| MX2020002216A (es) * | 2017-08-30 | 2020-08-20 | Dot Laboratories Inc | Metodos y composiciones para detectar y tratar endometriosis. |
| WO2020014566A2 (en) * | 2018-07-13 | 2020-01-16 | Yale University | Compositions and methods for treating endometriosis |
| KR102089559B1 (ko) * | 2018-08-31 | 2020-03-16 | 차의과학대학교 산학협력단 | 난소의 fsh에 대한 반응성의 진단 또는 예측용 바이오마커 및 이의 용도 |
| US20210404002A1 (en) * | 2018-10-31 | 2021-12-30 | Yale University | Quantitative Algorithm for Endometriosis |
| US11315660B2 (en) | 2018-10-31 | 2022-04-26 | Dot Laboratories, Inc. | Method of detecting and treating endometriosis in a female subject |
| WO2020146544A1 (en) * | 2019-01-09 | 2020-07-16 | Research Institute At Nationwide Children's Hospital | A novel method for monitoring endometriosis and associated disorders |
| US20220136067A1 (en) | 2019-03-07 | 2022-05-05 | Toray Industries, Inc. | Kit, device, and method for detecting uterine leiomyosarcoma |
| ES2787725A1 (es) * | 2019-04-15 | 2020-10-16 | Univ Granada | Metodo de obtencion de datos utiles para diagnosticar telangiectasia hemorragica hereditaria |
| CN110144394A (zh) * | 2019-04-18 | 2019-08-20 | 辽宁省肿瘤医院 | 一种子宫内膜异位症诊断、预后标志物及其应用 |
| KR20220024782A (ko) * | 2019-07-22 | 2022-03-03 | 에프. 호프만-라 로슈 아게 | 자궁내막증의 비침습적 진단을 위한 혈액 바이오마커로서의 s100a8 |
| CN114144674A (zh) * | 2019-07-22 | 2022-03-04 | 豪夫迈·罗氏有限公司 | P物质作为用于子宫内膜异位症的非侵入性诊断的血液生物标志物 |
| US11965879B2 (en) | 2019-08-23 | 2024-04-23 | Mcmaster University | Method for diagnosing and assessing endometriosis |
| KR102316507B1 (ko) * | 2020-02-28 | 2021-10-22 | 차의과학대학교 산학협력단 | 난소 예비력 바이오마커 및 이의 용도 |
| CN111909997B (zh) * | 2020-09-09 | 2021-09-28 | 上海交通大学 | miRNA标志物在制备奥氮平治疗精神分裂症疗效评估方面的产品中的应用及试剂盒 |
Family Cites Families (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2009143181A2 (en) | 2008-05-19 | 2009-11-26 | The Regents Of The University Of California | Micro-rna profile in human saliva and its use for detection of oral cancer |
| EP3181705A1 (en) | 2008-11-12 | 2017-06-21 | Caris Life Sciences Switzerland Holdings GmbH | Methods and systems of using exosomes for determining phenotypes |
| WO2011109440A1 (en) * | 2010-03-01 | 2011-09-09 | Caris Life Sciences Luxembourg Holdings | Biomarkers for theranostics |
| US20120244530A1 (en) * | 2011-01-26 | 2012-09-27 | Cepheid | Methods of detecting lung cancer |
| US20140024590A1 (en) * | 2011-02-18 | 2014-01-23 | Yale University | KRAS-Variant And Endometriosis |
| FR2984358A1 (fr) * | 2011-12-16 | 2013-06-21 | Genethon | Methodes pour le diagnostic de dystrophies musculaires |
| WO2013148151A1 (en) | 2012-03-29 | 2013-10-03 | University Of Pittsburgh - Of The Commonwealth System Of Higher Education | Plasma microribonucleic acids as biomarkers for endometriosis and endometriosis-associated ovarian cancer |
| EP3071712B1 (en) * | 2013-11-18 | 2020-06-24 | DiamiR, LLC | Methods of using mirnas from bodily fluids for detection and monitoring of parkinson's disease (pd) |
| GB201403489D0 (en) | 2014-02-27 | 2014-04-16 | Univ London Queen Mary | Biomarkers for endometriosis |
| US9650676B2 (en) | 2014-03-19 | 2017-05-16 | University Of South Carolina | Leukocyte MicroRNAS for use in diagnosis and treatment of endometriosis |
| EP3122905B1 (en) | 2014-03-27 | 2020-09-09 | Yale University | Circulating micrornas as biomarkers for endometriosis |
| EP2924126B1 (en) * | 2014-03-28 | 2018-04-18 | Tervisetehnoloogiate Arenduskeskus AS | Method for using microRNA (miRNA) for detection of endometriosis |
| GB201603967D0 (en) * | 2016-03-08 | 2016-04-20 | Univ Birmingham | Biomarkers of traumatic brain injury |
| SG11201901834WA (en) | 2016-08-30 | 2019-03-28 | Univ Yale | Micrornas as biomarkers for endometriosis |
| MX2020002216A (es) | 2017-08-30 | 2020-08-20 | Dot Laboratories Inc | Metodos y composiciones para detectar y tratar endometriosis. |
| US20210404002A1 (en) | 2018-10-31 | 2021-12-30 | Yale University | Quantitative Algorithm for Endometriosis |
| US11315660B2 (en) | 2018-10-31 | 2022-04-26 | Dot Laboratories, Inc. | Method of detecting and treating endometriosis in a female subject |
| EP3963094A4 (en) | 2019-04-29 | 2024-02-28 | Univ Yale | CLASSIFIERS FOR DETECTION OF ENDOMETRIOSIS |
-
2017
- 2017-08-30 SG SG11201901834WA patent/SG11201901834WA/en unknown
- 2017-08-30 BR BR112019004075A patent/BR112019004075A2/pt unknown
- 2017-08-30 EP EP17847431.8A patent/EP3506912B1/en active Active
- 2017-08-30 CN CN201780066779.9A patent/CN109890394A/zh active Pending
- 2017-08-30 JP JP2019511953A patent/JP2019528081A/ja active Pending
- 2017-08-30 AU AU2017319325A patent/AU2017319325A1/en not_active Abandoned
- 2017-08-30 US US16/329,436 patent/US10982282B2/en active Active
- 2017-08-30 WO PCT/US2017/049284 patent/WO2018044979A1/en unknown
- 2017-08-30 KR KR1020197009115A patent/KR20190057305A/ko not_active Application Discontinuation
- 2017-08-30 MX MX2019002425A patent/MX2019002425A/es unknown
- 2017-08-30 CA CA3035429A patent/CA3035429A1/en active Pending
- 2017-08-30 SG SG10202102509TA patent/SG10202102509TA/en unknown
-
2021
- 2021-02-25 US US17/184,894 patent/US11220713B2/en active Active
- 2021-11-02 US US17/517,014 patent/US20220049312A1/en active Pending
-
2022
- 2022-09-16 JP JP2022147738A patent/JP2022188086A/ja active Pending
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR102242639B1 (ko) * | 2020-01-28 | 2021-04-21 | 고려대학교 산학협력단 | 간 섬유화 진단용 바이오마커 miRNA4668-5p |
Also Published As
| Publication number | Publication date |
|---|---|
| CN109890394A (zh) | 2019-06-14 |
| CA3035429A1 (en) | 2018-03-08 |
| JP2019528081A (ja) | 2019-10-10 |
| BR112019004075A2 (pt) | 2019-05-28 |
| US10982282B2 (en) | 2021-04-20 |
| US20210180134A1 (en) | 2021-06-17 |
| EP3506912A4 (en) | 2020-08-19 |
| SG10202102509TA (en) | 2021-04-29 |
| MX2019002425A (es) | 2019-08-16 |
| AU2017319325A1 (en) | 2019-03-21 |
| WO2018044979A1 (en) | 2018-03-08 |
| US11220713B2 (en) | 2022-01-11 |
| US20190276893A1 (en) | 2019-09-12 |
| JP2022188086A (ja) | 2022-12-20 |
| SG11201901834WA (en) | 2019-03-28 |
| EP3506912A1 (en) | 2019-07-10 |
| EP3506912B1 (en) | 2024-04-03 |
| US20220049312A1 (en) | 2022-02-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11220713B2 (en) | MicroRNAs as biomarkers for endometriosis | |
| JP5690588B2 (ja) | 肝細胞癌のサブタイプを決定し、肝癌幹細胞を検出するための方法 | |
| AU2010321555B2 (en) | Materials and methods useful for affecting tumor cell growth, migration and invasion | |
| US11993816B2 (en) | Circulating microRNA as biomarkers for endometriosis | |
| EP2734636B1 (en) | Micro-rna biomarkers for identifying risk of and/or for diagnosing lung tumour | |
| JP2010510769A (ja) | 食道癌の診断ならびに患者の生存の予後および改善のための方法および組成物 | |
| AU2016300175A1 (en) | FGFR expression and susceptibility to an FGFR inhibitor | |
| EP3873487A2 (en) | A quantitative algorithm for endometriosis | |
| US20150159225A1 (en) | Uveal melanoma prognosis | |
| WO2018095933A1 (en) | Method of prognosticating, or for determining the efficiency of a compound for treating cancer | |
| US20190316207A1 (en) | Mir-320e and colorectal cancer | |
| WO2020234072A1 (en) | Pcos diagnosis | |
| Zhou | tRNA Fragments: Expression and Function in Ovarian Cancer | |
| WO2015006543A1 (en) | Method for predicting and detecting tumor metastasis in kidney cancer |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |