KR20180033586A - 전달을 위한 유전적으로 인코딩된 내재적으로 무질서화된 스텔스 중합체 및 이의 이용 방법 - Google Patents
전달을 위한 유전적으로 인코딩된 내재적으로 무질서화된 스텔스 중합체 및 이의 이용 방법 Download PDFInfo
- Publication number
- KR20180033586A KR20180033586A KR1020187006140A KR20187006140A KR20180033586A KR 20180033586 A KR20180033586 A KR 20180033586A KR 1020187006140 A KR1020187006140 A KR 1020187006140A KR 20187006140 A KR20187006140 A KR 20187006140A KR 20180033586 A KR20180033586 A KR 20180033586A
- Authority
- KR
- South Korea
- Prior art keywords
- conjugate
- amino acid
- cancer
- polypeptide
- subject
- Prior art date
Links
- 238000000034 method Methods 0.000 title claims description 129
- 229920000642 polymer Polymers 0.000 title description 51
- 108090000765 processed proteins & peptides Proteins 0.000 claims abstract description 181
- 102000004196 processed proteins & peptides Human genes 0.000 claims abstract description 174
- 229920001184 polypeptide Polymers 0.000 claims abstract description 169
- 239000003814 drug Substances 0.000 claims abstract description 117
- 229940079593 drug Drugs 0.000 claims abstract description 112
- 150000001413 amino acids Chemical group 0.000 claims description 173
- 235000001014 amino acid Nutrition 0.000 claims description 169
- 229940024606 amino acid Drugs 0.000 claims description 168
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 76
- 201000010099 disease Diseases 0.000 claims description 73
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 claims description 36
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 claims description 34
- 108091033319 polynucleotide Proteins 0.000 claims description 34
- 239000002157 polynucleotide Substances 0.000 claims description 34
- 102000040430 polynucleotide Human genes 0.000 claims description 34
- 229920001223 polyethylene glycol Polymers 0.000 claims description 30
- 239000002202 Polyethylene glycol Substances 0.000 claims description 29
- 108090000623 proteins and genes Proteins 0.000 claims description 29
- 229930012538 Paclitaxel Natural products 0.000 claims description 27
- 229960001592 paclitaxel Drugs 0.000 claims description 27
- 235000018102 proteins Nutrition 0.000 claims description 26
- 102000004169 proteins and genes Human genes 0.000 claims description 26
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 claims description 25
- 206010028980 Neoplasm Diseases 0.000 claims description 22
- 239000000203 mixture Substances 0.000 claims description 18
- 201000011510 cancer Diseases 0.000 claims description 17
- 235000018417 cysteine Nutrition 0.000 claims description 15
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 claims description 14
- 230000001225 therapeutic effect Effects 0.000 claims description 14
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 claims description 13
- 239000004474 valine Substances 0.000 claims description 13
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 claims description 12
- 208000026310 Breast neoplasm Diseases 0.000 claims description 11
- 230000002829 reductive effect Effects 0.000 claims description 11
- 150000003384 small molecules Chemical group 0.000 claims description 11
- 206010009944 Colon cancer Diseases 0.000 claims description 10
- 230000005847 immunogenicity Effects 0.000 claims description 10
- 206010006187 Breast cancer Diseases 0.000 claims description 9
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 claims description 9
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 claims description 9
- 208000023178 Musculoskeletal disease Diseases 0.000 claims description 9
- 239000004475 Arginine Substances 0.000 claims description 8
- 208000024172 Cardiovascular disease Diseases 0.000 claims description 8
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 claims description 8
- 239000004471 Glycine Substances 0.000 claims description 8
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 claims description 8
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 claims description 8
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 claims description 8
- 239000004472 Lysine Substances 0.000 claims description 8
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 claims description 8
- 235000009697 arginine Nutrition 0.000 claims description 8
- 235000003704 aspartic acid Nutrition 0.000 claims description 8
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 claims description 8
- 235000013922 glutamic acid Nutrition 0.000 claims description 8
- 239000004220 glutamic acid Substances 0.000 claims description 8
- 235000018977 lysine Nutrition 0.000 claims description 8
- 208000030159 metabolic disease Diseases 0.000 claims description 8
- 229940124597 therapeutic agent Drugs 0.000 claims description 8
- 208000023275 Autoimmune disease Diseases 0.000 claims description 7
- 239000013598 vector Substances 0.000 claims description 7
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 6
- 208000029742 colonic neoplasm Diseases 0.000 claims description 6
- 239000002773 nucleotide Substances 0.000 claims description 6
- 125000003729 nucleotide group Chemical group 0.000 claims description 6
- 150000003573 thiols Chemical class 0.000 claims description 6
- 230000015572 biosynthetic process Effects 0.000 claims description 5
- 150000001720 carbohydrates Chemical class 0.000 claims description 5
- 235000014633 carbohydrates Nutrition 0.000 claims description 5
- 208000016097 disease of metabolism Diseases 0.000 claims description 5
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 claims description 4
- FDKWRPBBCBCIGA-REOHCLBHSA-N (2r)-2-azaniumyl-3-$l^{1}-selanylpropanoate Chemical compound [Se]C[C@H](N)C(O)=O FDKWRPBBCBCIGA-REOHCLBHSA-N 0.000 claims description 4
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 claims description 4
- 206010005003 Bladder cancer Diseases 0.000 claims description 4
- 206010005949 Bone cancer Diseases 0.000 claims description 4
- 208000018084 Bone neoplasm Diseases 0.000 claims description 4
- 208000003174 Brain Neoplasms Diseases 0.000 claims description 4
- 208000001333 Colorectal Neoplasms Diseases 0.000 claims description 4
- FDKWRPBBCBCIGA-UWTATZPHSA-N D-Selenocysteine Natural products [Se]C[C@@H](N)C(O)=O FDKWRPBBCBCIGA-UWTATZPHSA-N 0.000 claims description 4
- 208000000461 Esophageal Neoplasms Diseases 0.000 claims description 4
- 208000008839 Kidney Neoplasms Diseases 0.000 claims description 4
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 claims description 4
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 claims description 4
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 claims description 4
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 claims description 4
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 claims description 4
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 claims description 4
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 claims description 4
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 claims description 4
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 claims description 4
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 claims description 4
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 claims description 4
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 4
- 206010027406 Mesothelioma Diseases 0.000 claims description 4
- 206010030155 Oesophageal carcinoma Diseases 0.000 claims description 4
- 206010060862 Prostate cancer Diseases 0.000 claims description 4
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims description 4
- 208000015634 Rectal Neoplasms Diseases 0.000 claims description 4
- 206010038389 Renal cancer Diseases 0.000 claims description 4
- 206010039491 Sarcoma Diseases 0.000 claims description 4
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 claims description 4
- 208000000453 Skin Neoplasms Diseases 0.000 claims description 4
- 208000032383 Soft tissue cancer Diseases 0.000 claims description 4
- 208000005718 Stomach Neoplasms Diseases 0.000 claims description 4
- 208000024313 Testicular Neoplasms Diseases 0.000 claims description 4
- 206010057644 Testis cancer Diseases 0.000 claims description 4
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 claims description 4
- 239000004473 Threonine Substances 0.000 claims description 4
- 208000024770 Thyroid neoplasm Diseases 0.000 claims description 4
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 claims description 4
- 235000004279 alanine Nutrition 0.000 claims description 4
- 235000009582 asparagine Nutrition 0.000 claims description 4
- 229960001230 asparagine Drugs 0.000 claims description 4
- 201000004571 bone carcinoma Diseases 0.000 claims description 4
- 206010006007 bone sarcoma Diseases 0.000 claims description 4
- 239000012830 cancer therapeutic Substances 0.000 claims description 4
- 201000004101 esophageal cancer Diseases 0.000 claims description 4
- 206010017758 gastric cancer Diseases 0.000 claims description 4
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 claims description 4
- 235000004554 glutamine Nutrition 0.000 claims description 4
- 125000003630 glycyl group Chemical group [H]N([H])C([H])([H])C(*)=O 0.000 claims description 4
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 claims description 4
- 235000014304 histidine Nutrition 0.000 claims description 4
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 claims description 4
- 229960000310 isoleucine Drugs 0.000 claims description 4
- 201000010982 kidney cancer Diseases 0.000 claims description 4
- 201000005202 lung cancer Diseases 0.000 claims description 4
- 208000020816 lung neoplasm Diseases 0.000 claims description 4
- 201000001441 melanoma Diseases 0.000 claims description 4
- 229930182817 methionine Natural products 0.000 claims description 4
- 206010038038 rectal cancer Diseases 0.000 claims description 4
- 201000001275 rectum cancer Diseases 0.000 claims description 4
- ZKZBPNGNEQAJSX-UHFFFAOYSA-N selenocysteine Natural products [SeH]CC(N)C(O)=O ZKZBPNGNEQAJSX-UHFFFAOYSA-N 0.000 claims description 4
- 229940055619 selenocysteine Drugs 0.000 claims description 4
- 235000016491 selenocysteine Nutrition 0.000 claims description 4
- 235000004400 serine Nutrition 0.000 claims description 4
- 201000000849 skin cancer Diseases 0.000 claims description 4
- 201000011549 stomach cancer Diseases 0.000 claims description 4
- 201000003120 testicular cancer Diseases 0.000 claims description 4
- 235000008521 threonine Nutrition 0.000 claims description 4
- 201000002510 thyroid cancer Diseases 0.000 claims description 4
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 claims description 4
- 201000005112 urinary bladder cancer Diseases 0.000 claims description 4
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 claims description 3
- 206010061902 Pancreatic neoplasm Diseases 0.000 claims description 3
- 208000035475 disorder Diseases 0.000 claims description 3
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 claims description 3
- 201000002528 pancreatic cancer Diseases 0.000 claims description 3
- 208000008443 pancreatic carcinoma Diseases 0.000 claims description 3
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 claims description 3
- 230000002483 superagonistic effect Effects 0.000 claims description 3
- 206010044285 tracheal cancer Diseases 0.000 claims description 3
- 206010033128 Ovarian cancer Diseases 0.000 claims description 2
- 206010061535 Ovarian neoplasm Diseases 0.000 claims description 2
- 201000010536 head and neck cancer Diseases 0.000 claims description 2
- 208000014829 head and neck neoplasm Diseases 0.000 claims description 2
- 201000007270 liver cancer Diseases 0.000 claims description 2
- 208000014018 liver neoplasm Diseases 0.000 claims description 2
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 claims 1
- 239000000562 conjugate Substances 0.000 description 179
- 239000000523 sample Substances 0.000 description 52
- 125000003275 alpha amino acid group Chemical group 0.000 description 39
- 125000005647 linker group Chemical group 0.000 description 39
- 210000004027 cell Anatomy 0.000 description 33
- 101800001385 Protein VP1-2A Proteins 0.000 description 27
- 229920001059 synthetic polymer Polymers 0.000 description 22
- 230000007704 transition Effects 0.000 description 15
- 239000000243 solution Substances 0.000 description 13
- 238000001514 detection method Methods 0.000 description 12
- 239000000090 biomarker Substances 0.000 description 11
- 241000588724 Escherichia coli Species 0.000 description 10
- 210000004369 blood Anatomy 0.000 description 10
- 239000008280 blood Substances 0.000 description 10
- 238000001727 in vivo Methods 0.000 description 10
- 101100505161 Caenorhabditis elegans mel-32 gene Proteins 0.000 description 9
- 238000004458 analytical method Methods 0.000 description 9
- 230000021615 conjugation Effects 0.000 description 9
- 150000007523 nucleic acids Chemical class 0.000 description 9
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 9
- 230000027455 binding Effects 0.000 description 8
- 239000000463 material Substances 0.000 description 8
- 102000039446 nucleic acids Human genes 0.000 description 8
- 108020004707 nucleic acids Proteins 0.000 description 8
- 210000002381 plasma Anatomy 0.000 description 8
- -1 polyethylene Polymers 0.000 description 8
- 238000006467 substitution reaction Methods 0.000 description 8
- 238000013461 design Methods 0.000 description 7
- 238000012377 drug delivery Methods 0.000 description 7
- 230000006870 function Effects 0.000 description 7
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 7
- NIXOWILDQLNWCW-UHFFFAOYSA-M Acrylate Chemical compound [O-]C(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-M 0.000 description 6
- 238000003556 assay Methods 0.000 description 6
- 230000001351 cycling effect Effects 0.000 description 6
- 239000013604 expression vector Substances 0.000 description 6
- 238000000338 in vitro Methods 0.000 description 6
- 238000002347 injection Methods 0.000 description 6
- 239000007924 injection Substances 0.000 description 6
- 239000000178 monomer Substances 0.000 description 6
- 238000000746 purification Methods 0.000 description 6
- 230000002441 reversible effect Effects 0.000 description 6
- 150000003839 salts Chemical class 0.000 description 6
- 238000012546 transfer Methods 0.000 description 6
- YGHSQRJSHKYUJY-SCZZXKLOSA-N Gly-Val-Pro Chemical compound CC(C)[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)CN YGHSQRJSHKYUJY-SCZZXKLOSA-N 0.000 description 5
- 230000004071 biological effect Effects 0.000 description 5
- 238000005119 centrifugation Methods 0.000 description 5
- 238000012512 characterization method Methods 0.000 description 5
- 150000001875 compounds Chemical class 0.000 description 5
- 238000002296 dynamic light scattering Methods 0.000 description 5
- 239000012634 fragment Substances 0.000 description 5
- 239000002105 nanoparticle Substances 0.000 description 5
- 230000036470 plasma concentration Effects 0.000 description 5
- 241000124008 Mammalia Species 0.000 description 4
- GIAZPLMMQOERPN-YUMQZZPRSA-N Val-Pro Chemical compound CC(C)[C@H](N)C(=O)N1CCC[C@H]1C(O)=O GIAZPLMMQOERPN-YUMQZZPRSA-N 0.000 description 4
- SJRUJQFQVLMZFW-WPRPVWTQSA-N Val-Pro-Gly Chemical compound CC(C)[C@H](N)C(=O)N1CCC[C@H]1C(=O)NCC(O)=O SJRUJQFQVLMZFW-WPRPVWTQSA-N 0.000 description 4
- 230000001580 bacterial effect Effects 0.000 description 4
- 230000003833 cell viability Effects 0.000 description 4
- 230000000295 complement effect Effects 0.000 description 4
- 229920001577 copolymer Polymers 0.000 description 4
- 231100000135 cytotoxicity Toxicity 0.000 description 4
- 230000003013 cytotoxicity Effects 0.000 description 4
- 230000000694 effects Effects 0.000 description 4
- 238000011156 evaluation Methods 0.000 description 4
- 108020001507 fusion proteins Proteins 0.000 description 4
- 102000037865 fusion proteins Human genes 0.000 description 4
- 238000004128 high performance liquid chromatography Methods 0.000 description 4
- 229920001519 homopolymer Polymers 0.000 description 4
- 230000005764 inhibitory process Effects 0.000 description 4
- 230000003993 interaction Effects 0.000 description 4
- 239000003550 marker Substances 0.000 description 4
- 238000001869 matrix assisted laser desorption--ionisation mass spectrum Methods 0.000 description 4
- 239000000693 micelle Substances 0.000 description 4
- 230000014207 opsonization Effects 0.000 description 4
- 125000002987 valine group Chemical group [H]N([H])C([H])(C(*)=O)C([H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 4
- HKZAAJSTFUZYTO-LURJTMIESA-N (2s)-2-[[2-[[2-[[2-[(2-aminoacetyl)amino]acetyl]amino]acetyl]amino]acetyl]amino]-3-hydroxypropanoic acid Chemical compound NCC(=O)NCC(=O)NCC(=O)NCC(=O)N[C@@H](CO)C(O)=O HKZAAJSTFUZYTO-LURJTMIESA-N 0.000 description 3
- BZTDTCNHAFUJOG-UHFFFAOYSA-N 6-carboxyfluorescein Chemical compound C12=CC=C(O)C=C2OC2=CC(O)=CC=C2C11OC(=O)C2=CC=C(C(=O)O)C=C21 BZTDTCNHAFUJOG-UHFFFAOYSA-N 0.000 description 3
- 238000002965 ELISA Methods 0.000 description 3
- 241000699670 Mus sp. Species 0.000 description 3
- 108091005461 Nucleic proteins Proteins 0.000 description 3
- 241000288906 Primates Species 0.000 description 3
- 206010047741 Vulval cancer Diseases 0.000 description 3
- 208000004354 Vulvar Neoplasms Diseases 0.000 description 3
- 238000002835 absorbance Methods 0.000 description 3
- 239000000427 antigen Substances 0.000 description 3
- 102000036639 antigens Human genes 0.000 description 3
- 108091007433 antigens Proteins 0.000 description 3
- 125000000637 arginyl group Chemical group N[C@@H](CCCNC(N)=N)C(=O)* 0.000 description 3
- 239000012472 biological sample Substances 0.000 description 3
- 238000004587 chromatography analysis Methods 0.000 description 3
- 238000001142 circular dichroism spectrum Methods 0.000 description 3
- 238000009826 distribution Methods 0.000 description 3
- 230000008030 elimination Effects 0.000 description 3
- 238000003379 elimination reaction Methods 0.000 description 3
- 238000013401 experimental design Methods 0.000 description 3
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 description 3
- 230000002209 hydrophobic effect Effects 0.000 description 3
- 230000028993 immune response Effects 0.000 description 3
- 238000003018 immunoassay Methods 0.000 description 3
- 239000002502 liposome Substances 0.000 description 3
- 238000001840 matrix-assisted laser desorption--ionisation time-of-flight mass spectrometry Methods 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 230000007935 neutral effect Effects 0.000 description 3
- 239000002245 particle Substances 0.000 description 3
- 238000001742 protein purification Methods 0.000 description 3
- 102000005962 receptors Human genes 0.000 description 3
- 108020003175 receptors Proteins 0.000 description 3
- 125000006853 reporter group Chemical group 0.000 description 3
- 238000010839 reverse transcription Methods 0.000 description 3
- 239000006228 supernatant Substances 0.000 description 3
- 230000001629 suppression Effects 0.000 description 3
- 238000003786 synthesis reaction Methods 0.000 description 3
- 210000001519 tissue Anatomy 0.000 description 3
- 231100000419 toxicity Toxicity 0.000 description 3
- 230000001988 toxicity Effects 0.000 description 3
- 229960005486 vaccine Drugs 0.000 description 3
- 201000005102 vulva cancer Diseases 0.000 description 3
- JOOXCMJARBKPKM-UHFFFAOYSA-N 4-oxopentanoic acid Chemical compound CC(=O)CCC(O)=O JOOXCMJARBKPKM-UHFFFAOYSA-N 0.000 description 2
- VTQMJCSAHXYXPJ-UHFFFAOYSA-N 5-ethenyl-2h-tetrazole Chemical compound C=CC1=NN=NN1 VTQMJCSAHXYXPJ-UHFFFAOYSA-N 0.000 description 2
- LRFVTYWOQMYALW-UHFFFAOYSA-N 9H-xanthine Chemical compound O=C1NC(=O)NC2=C1NC=N2 LRFVTYWOQMYALW-UHFFFAOYSA-N 0.000 description 2
- 102000009027 Albumins Human genes 0.000 description 2
- 108010088751 Albumins Proteins 0.000 description 2
- 125000001433 C-terminal amino-acid group Chemical group 0.000 description 2
- 108010001857 Cell Surface Receptors Proteins 0.000 description 2
- 210000001783 ELP Anatomy 0.000 description 2
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 2
- CEXINUGNTZFNRY-BYPYZUCNSA-N Gly-Cys-Gly Chemical compound [NH3+]CC(=O)N[C@@H](CS)C(=O)NCC([O-])=O CEXINUGNTZFNRY-BYPYZUCNSA-N 0.000 description 2
- 241000238631 Hexapoda Species 0.000 description 2
- 206010025323 Lymphomas Diseases 0.000 description 2
- AAORVPFVUIHEAB-YUMQZZPRSA-N Lys-Asp-Gly Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC(O)=O)C(=O)NCC(O)=O AAORVPFVUIHEAB-YUMQZZPRSA-N 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- BAPJBEWLBFYGME-UHFFFAOYSA-N Methyl acrylate Chemical compound COC(=O)C=C BAPJBEWLBFYGME-UHFFFAOYSA-N 0.000 description 2
- 241000699666 Mus <mouse, genus> Species 0.000 description 2
- 238000005481 NMR spectroscopy Methods 0.000 description 2
- UFWIBTONFRDIAS-UHFFFAOYSA-N Naphthalene Chemical compound C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 description 2
- 108700022034 Opsonin Proteins Proteins 0.000 description 2
- 208000002193 Pain Diseases 0.000 description 2
- 239000004793 Polystyrene Substances 0.000 description 2
- ZLXKLMHAMDENIO-DCAQKATOSA-N Pro-Lys-Asp Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(O)=O)C(O)=O ZLXKLMHAMDENIO-DCAQKATOSA-N 0.000 description 2
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 2
- 241000607142 Salmonella Species 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- ISAKRJDGNUQOIC-UHFFFAOYSA-N Uracil Chemical compound O=C1C=CNC(=O)N1 ISAKRJDGNUQOIC-UHFFFAOYSA-N 0.000 description 2
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 2
- 230000002159 abnormal effect Effects 0.000 description 2
- 230000002776 aggregation Effects 0.000 description 2
- 238000004220 aggregation Methods 0.000 description 2
- BFNBIHQBYMNNAN-UHFFFAOYSA-N ammonium sulfate Chemical compound N.N.OS(O)(=O)=O BFNBIHQBYMNNAN-UHFFFAOYSA-N 0.000 description 2
- 229910052921 ammonium sulfate Inorganic materials 0.000 description 2
- 235000011130 ammonium sulphate Nutrition 0.000 description 2
- 230000001640 apoptogenic effect Effects 0.000 description 2
- 230000006907 apoptotic process Effects 0.000 description 2
- 239000013060 biological fluid Substances 0.000 description 2
- 230000008827 biological function Effects 0.000 description 2
- 230000015556 catabolic process Effects 0.000 description 2
- 239000013592 cell lysate Substances 0.000 description 2
- 210000002421 cell wall Anatomy 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 238000011097 chromatography purification Methods 0.000 description 2
- 230000006957 competitive inhibition Effects 0.000 description 2
- 239000000306 component Substances 0.000 description 2
- 208000029078 coronary artery disease Diseases 0.000 description 2
- 239000011557 critical solution Substances 0.000 description 2
- 230000001186 cumulative effect Effects 0.000 description 2
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 2
- OPTASPLRGRRNAP-UHFFFAOYSA-N cytosine Chemical compound NC=1C=CNC(=O)N=1 OPTASPLRGRRNAP-UHFFFAOYSA-N 0.000 description 2
- 238000002784 cytotoxicity assay Methods 0.000 description 2
- 231100000263 cytotoxicity test Toxicity 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 238000006731 degradation reaction Methods 0.000 description 2
- 231100000673 dose–response relationship Toxicity 0.000 description 2
- 210000001163 endosome Anatomy 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 230000007515 enzymatic degradation Effects 0.000 description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 238000005189 flocculation Methods 0.000 description 2
- 230000016615 flocculation Effects 0.000 description 2
- 230000002068 genetic effect Effects 0.000 description 2
- 102000034238 globular proteins Human genes 0.000 description 2
- 108091005896 globular proteins Proteins 0.000 description 2
- KWIUHFFTVRNATP-UHFFFAOYSA-N glycine betaine Chemical compound C[N+](C)(C)CC([O-])=O KWIUHFFTVRNATP-UHFFFAOYSA-N 0.000 description 2
- 108010084264 glycyl-glycyl-cysteine Proteins 0.000 description 2
- UYTPUPDQBNUYGX-UHFFFAOYSA-N guanine Chemical compound O=C1NC(N)=NC2=C1N=CN2 UYTPUPDQBNUYGX-UHFFFAOYSA-N 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- FDGQSTZJBFJUBT-UHFFFAOYSA-N hypoxanthine Chemical compound O=C1NC=NC2=C1NC=N2 FDGQSTZJBFJUBT-UHFFFAOYSA-N 0.000 description 2
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Substances C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 2
- 210000002865 immune cell Anatomy 0.000 description 2
- 210000000987 immune system Anatomy 0.000 description 2
- 230000006698 induction Effects 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 150000002500 ions Chemical class 0.000 description 2
- DRAVOWXCEBXPTN-UHFFFAOYSA-N isoguanine Chemical compound NC1=NC(=O)NC2=C1NC=N2 DRAVOWXCEBXPTN-UHFFFAOYSA-N 0.000 description 2
- 238000002789 length control Methods 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 150000002632 lipids Chemical class 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 238000001906 matrix-assisted laser desorption--ionisation mass spectrometry Methods 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 102000006240 membrane receptors Human genes 0.000 description 2
- 210000003205 muscle Anatomy 0.000 description 2
- 208000010125 myocardial infarction Diseases 0.000 description 2
- 239000008188 pellet Substances 0.000 description 2
- 238000005191 phase separation Methods 0.000 description 2
- 239000013612 plasmid Substances 0.000 description 2
- 229920002401 polyacrylamide Polymers 0.000 description 2
- 229920002223 polystyrene Polymers 0.000 description 2
- 230000002265 prevention Effects 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 108010029020 prolylglycine Proteins 0.000 description 2
- 239000012264 purified product Substances 0.000 description 2
- 239000012521 purified sample Substances 0.000 description 2
- 238000003127 radioimmunoassay Methods 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 206010039073 rheumatoid arthritis Diseases 0.000 description 2
- FSYKKLYZXJSNPZ-UHFFFAOYSA-N sarcosine Chemical compound C[NH2+]CC([O-])=O FSYKKLYZXJSNPZ-UHFFFAOYSA-N 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 238000001228 spectrum Methods 0.000 description 2
- 238000001370 static light scattering Methods 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- RWQNBRDOKXIBIV-UHFFFAOYSA-N thymine Chemical compound CC1=CNC(=O)NC1=O RWQNBRDOKXIBIV-UHFFFAOYSA-N 0.000 description 2
- 238000013518 transcription Methods 0.000 description 2
- 230000035897 transcription Effects 0.000 description 2
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 2
- 210000003462 vein Anatomy 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- 238000004260 weight control Methods 0.000 description 2
- JWZZKOKVBUJMES-UHFFFAOYSA-N (+-)-Isoprenaline Chemical compound CC(C)NCC(O)C1=CC=C(O)C(O)=C1 JWZZKOKVBUJMES-UHFFFAOYSA-N 0.000 description 1
- PSBDWGZCVUAZQS-UHFFFAOYSA-N (dimethylsulfonio)acetate Chemical compound C[S+](C)CC([O-])=O PSBDWGZCVUAZQS-UHFFFAOYSA-N 0.000 description 1
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 1
- XQCZBXHVTFVIFE-UHFFFAOYSA-N 2-amino-4-hydroxypyrimidine Chemical compound NC1=NC=CC(O)=N1 XQCZBXHVTFVIFE-UHFFFAOYSA-N 0.000 description 1
- ZEIHZWQYRTVVMA-UHFFFAOYSA-N 2-bromo-1-[6-(dimethylamino)naphthalen-2-yl]ethanone Chemical compound C1=C(C(=O)CBr)C=CC2=CC(N(C)C)=CC=C21 ZEIHZWQYRTVVMA-UHFFFAOYSA-N 0.000 description 1
- NLHHRLWOUZZQLW-UHFFFAOYSA-N Acrylonitrile Chemical group C=CC#N NLHHRLWOUZZQLW-UHFFFAOYSA-N 0.000 description 1
- 229930024421 Adenine Natural products 0.000 description 1
- GFFGJBXGBJISGV-UHFFFAOYSA-N Adenine Chemical compound NC1=NC=NC2=C1N=CN2 GFFGJBXGBJISGV-UHFFFAOYSA-N 0.000 description 1
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 1
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 1
- 206010002383 Angina Pectoris Diseases 0.000 description 1
- WSGVTKZFVJSJOG-RCOVLWMOSA-N Asp-Gly-Val Chemical compound [H]N[C@@H](CC(O)=O)C(=O)NCC(=O)N[C@@H](C(C)C)C(O)=O WSGVTKZFVJSJOG-RCOVLWMOSA-N 0.000 description 1
- 201000001320 Atherosclerosis Diseases 0.000 description 1
- 241000194110 Bacillus sp. (in: Bacteria) Species 0.000 description 1
- 244000063299 Bacillus subtilis Species 0.000 description 1
- 235000014469 Bacillus subtilis Nutrition 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 208000023328 Basedow disease Diseases 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 241001264766 Callistemon Species 0.000 description 1
- 241000282832 Camelidae Species 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 101710167800 Capsid assembly scaffolding protein Proteins 0.000 description 1
- 208000031229 Cardiomyopathies Diseases 0.000 description 1
- 241000700198 Cavia Species 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 206010008342 Cervix carcinoma Diseases 0.000 description 1
- 208000015943 Coeliac disease Diseases 0.000 description 1
- 206010009900 Colitis ulcerative Diseases 0.000 description 1
- 208000002330 Congenital Heart Defects Diseases 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- 208000011231 Crohn disease Diseases 0.000 description 1
- 102100027100 Echinoderm microtubule-associated protein-like 4 Human genes 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 208000001640 Fibromyalgia Diseases 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- 206010018364 Glomerulonephritis Diseases 0.000 description 1
- IDOGEHIWMJMAHT-BYPYZUCNSA-N Gly-Gly-Cys Chemical compound NCC(=O)NCC(=O)N[C@@H](CS)C(O)=O IDOGEHIWMJMAHT-BYPYZUCNSA-N 0.000 description 1
- 208000024869 Goodpasture syndrome Diseases 0.000 description 1
- 241000282575 Gorilla Species 0.000 description 1
- 208000015023 Graves' disease Diseases 0.000 description 1
- 208000035186 Hemolytic Autoimmune Anemia Diseases 0.000 description 1
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101001057929 Homo sapiens Echinoderm microtubule-associated protein-like 4 Proteins 0.000 description 1
- 101000610604 Homo sapiens Tumor necrosis factor receptor superfamily member 10B Proteins 0.000 description 1
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 1
- 241000282596 Hylobatidae Species 0.000 description 1
- 206010060378 Hyperinsulinaemia Diseases 0.000 description 1
- 208000031226 Hyperlipidaemia Diseases 0.000 description 1
- UGQMRVRMYYASKQ-UHFFFAOYSA-N Hypoxanthine nucleoside Natural products OC1C(O)C(CO)OC1N1C(NC=NC2=O)=C2N=C1 UGQMRVRMYYASKQ-UHFFFAOYSA-N 0.000 description 1
- 229930010555 Inosine Natural products 0.000 description 1
- UGQMRVRMYYASKQ-KQYNXXCUSA-N Inosine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C2=NC=NC(O)=C2N=C1 UGQMRVRMYYASKQ-KQYNXXCUSA-N 0.000 description 1
- 102000004877 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- 206010022489 Insulin Resistance Diseases 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical group C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- 208000009525 Myocarditis Diseases 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 241000283903 Ovis aries Species 0.000 description 1
- 241000282579 Pan Species 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- 208000005764 Peripheral Arterial Disease Diseases 0.000 description 1
- 208000030831 Peripheral arterial occlusive disease Diseases 0.000 description 1
- 229920001305 Poly(isodecyl(meth)acrylate) Polymers 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 229920002873 Polyethylenimine Polymers 0.000 description 1
- 239000004743 Polypropylene Substances 0.000 description 1
- 241000282405 Pongo abelii Species 0.000 description 1
- 101710130420 Probable capsid assembly scaffolding protein Proteins 0.000 description 1
- 206010036790 Productive cough Diseases 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 201000004681 Psoriasis Diseases 0.000 description 1
- 206010037660 Pyrexia Diseases 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 108091028664 Ribonucleotide Proteins 0.000 description 1
- 108010077895 Sarcosine Proteins 0.000 description 1
- 101710204410 Scaffold protein Proteins 0.000 description 1
- 101800001707 Spacer peptide Proteins 0.000 description 1
- 206010061372 Streptococcal infection Diseases 0.000 description 1
- 208000006011 Stroke Diseases 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 108700005078 Synthetic Genes Proteins 0.000 description 1
- 208000000491 Tendinopathy Diseases 0.000 description 1
- 206010043255 Tendonitis Diseases 0.000 description 1
- 208000031981 Thrombocytopenic Idiopathic Purpura Diseases 0.000 description 1
- 208000003721 Triple Negative Breast Neoplasms Diseases 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Chemical group C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- 102100040112 Tumor necrosis factor receptor superfamily member 10B Human genes 0.000 description 1
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 description 1
- 201000006704 Ulcerative Colitis Diseases 0.000 description 1
- BGXVHVMJZCSOCA-AVGNSLFASA-N Val-Pro-Lys Chemical compound CC(C)[C@@H](C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCCCN)C(=O)O)N BGXVHVMJZCSOCA-AVGNSLFASA-N 0.000 description 1
- 206010047249 Venous thrombosis Diseases 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 206010047700 Vomiting Diseases 0.000 description 1
- 208000027418 Wounds and injury Diseases 0.000 description 1
- DZBUGLKDJFMEHC-UHFFFAOYSA-N acridine Chemical class C1=CC=CC2=CC3=CC=CC=C3N=C21 DZBUGLKDJFMEHC-UHFFFAOYSA-N 0.000 description 1
- 150000003926 acrylamides Chemical class 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 230000006978 adaptation Effects 0.000 description 1
- 230000003044 adaptive effect Effects 0.000 description 1
- 229960000643 adenine Drugs 0.000 description 1
- 238000001042 affinity chromatography Methods 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- 125000002947 alkylene group Chemical group 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- 125000000129 anionic group Chemical group 0.000 description 1
- 208000007474 aortic aneurysm Diseases 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 206010003119 arrhythmia Diseases 0.000 description 1
- 201000000448 autoimmune hemolytic anemia Diseases 0.000 description 1
- 201000003710 autoimmune thrombocytopenic purpura Diseases 0.000 description 1
- 239000011324 bead Substances 0.000 description 1
- 229960003237 betaine Drugs 0.000 description 1
- 210000000941 bile Anatomy 0.000 description 1
- 102000023732 binding proteins Human genes 0.000 description 1
- 108091008324 binding proteins Proteins 0.000 description 1
- 229920001400 block copolymer Polymers 0.000 description 1
- 239000012503 blood component Substances 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- 210000004899 c-terminal region Anatomy 0.000 description 1
- 238000004422 calculation algorithm Methods 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 125000002091 cationic group Chemical group 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 1
- 201000010881 cervical cancer Diseases 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 125000003636 chemical group Chemical group 0.000 description 1
- 238000001311 chemical methods and process Methods 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 239000012504 chromatography matrix Substances 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 238000004040 coloring Methods 0.000 description 1
- 230000002860 competitive effect Effects 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 208000028831 congenital heart disease Diseases 0.000 description 1
- 239000000356 contaminant Substances 0.000 description 1
- 238000013270 controlled release Methods 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- 150000001945 cysteines Chemical class 0.000 description 1
- 210000005220 cytoplasmic tail Anatomy 0.000 description 1
- 229940104302 cytosine Drugs 0.000 description 1
- 231100000433 cytotoxic Toxicity 0.000 description 1
- 230000001472 cytotoxic effect Effects 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 239000000412 dendrimer Substances 0.000 description 1
- 229920000736 dendritic polymer Polymers 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000003795 desorption Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 230000001079 digestive effect Effects 0.000 description 1
- OVTCUIZCVUGJHS-UHFFFAOYSA-N dipyrrin Chemical compound C=1C=CNC=1C=C1C=CC=N1 OVTCUIZCVUGJHS-UHFFFAOYSA-N 0.000 description 1
- 238000004821 distillation Methods 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- 230000005518 electrochemistry Effects 0.000 description 1
- 238000004520 electroporation Methods 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 239000002158 endotoxin Substances 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 210000003414 extremity Anatomy 0.000 description 1
- 210000003608 fece Anatomy 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 238000000684 flow cytometry Methods 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 239000007850 fluorescent dye Substances 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 235000011389 fruit/vegetable juice Nutrition 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 238000010353 genetic engineering Methods 0.000 description 1
- 208000018914 glucose metabolism disease Diseases 0.000 description 1
- 108010037850 glycylvaline Proteins 0.000 description 1
- 229920000578 graft copolymer Polymers 0.000 description 1
- 229960002897 heparin Drugs 0.000 description 1
- 229920000669 heparin Polymers 0.000 description 1
- 229920000140 heteropolymer Polymers 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 1
- 230000033444 hydroxylation Effects 0.000 description 1
- 238000005805 hydroxylation reaction Methods 0.000 description 1
- 229920000587 hyperbranched polymer Polymers 0.000 description 1
- 201000001421 hyperglycemia Diseases 0.000 description 1
- 230000003451 hyperinsulinaemic effect Effects 0.000 description 1
- 201000008980 hyperinsulinism Diseases 0.000 description 1
- 208000015210 hypertensive heart disease Diseases 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 230000005918 in vitro anti-tumor Effects 0.000 description 1
- 230000002779 inactivation Effects 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 230000004968 inflammatory condition Effects 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 229960003786 inosine Drugs 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 239000002198 insoluble material Substances 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 238000001361 intraarterial administration Methods 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 230000002601 intratumoral effect Effects 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- 150000002540 isothiocyanates Chemical class 0.000 description 1
- 210000001503 joint Anatomy 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 229940040102 levulinic acid Drugs 0.000 description 1
- 210000003041 ligament Anatomy 0.000 description 1
- 238000004811 liquid chromatography Methods 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 210000001165 lymph node Anatomy 0.000 description 1
- 239000006166 lysate Substances 0.000 description 1
- 108010003700 lysyl aspartic acid Proteins 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 125000005439 maleimidyl group Chemical group C1(C=CC(N1*)=O)=O 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 238000000816 matrix-assisted laser desorption--ionisation Methods 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 125000000250 methylamino group Chemical group [H]N(*)C([H])([H])[H] 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 239000004005 microsphere Substances 0.000 description 1
- 230000009456 molecular mechanism Effects 0.000 description 1
- 201000006417 multiple sclerosis Diseases 0.000 description 1
- 206010028417 myasthenia gravis Diseases 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- QNILTEGFHQSKFF-UHFFFAOYSA-N n-propan-2-ylprop-2-enamide Chemical compound CC(C)NC(=O)C=C QNILTEGFHQSKFF-UHFFFAOYSA-N 0.000 description 1
- NXVAFMGGFXORAR-UHFFFAOYSA-N n-tert-butylprop-2-enamide;2-methylprop-2-enamide Chemical compound CC(=C)C(N)=O.CC(C)(C)NC(=O)C=C NXVAFMGGFXORAR-UHFFFAOYSA-N 0.000 description 1
- 238000001426 native polyacrylamide gel electrophoresis Methods 0.000 description 1
- 210000003739 neck Anatomy 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 208000015122 neurodegenerative disease Diseases 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- 208000008338 non-alcoholic fatty liver disease Diseases 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 210000002741 palatine tonsil Anatomy 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 1
- 230000002688 persistence Effects 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 230000010287 polarization Effects 0.000 description 1
- 229920003213 poly(N-isopropyl acrylamide) Polymers 0.000 description 1
- 229920001084 poly(chloroprene) Polymers 0.000 description 1
- 229920000212 poly(isobutyl acrylate) Polymers 0.000 description 1
- 229920000636 poly(norbornene) polymer Polymers 0.000 description 1
- 229920000184 poly(octadecyl acrylate) Polymers 0.000 description 1
- 238000002264 polyacrylamide gel electrophoresis Methods 0.000 description 1
- 229920000058 polyacrylate Polymers 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 229920000570 polyether Polymers 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 229920000197 polyisopropyl acrylate Polymers 0.000 description 1
- 239000000580 polymer-drug conjugate Substances 0.000 description 1
- 229920000193 polymethacrylate Polymers 0.000 description 1
- 229920000098 polyolefin Polymers 0.000 description 1
- 229920001451 polypropylene glycol Polymers 0.000 description 1
- 229920001296 polysiloxane Polymers 0.000 description 1
- 229920002635 polyurethane Polymers 0.000 description 1
- 239000004814 polyurethane Substances 0.000 description 1
- 229920002689 polyvinyl acetate Polymers 0.000 description 1
- 239000011118 polyvinyl acetate Substances 0.000 description 1
- 229920000915 polyvinyl chloride Polymers 0.000 description 1
- 239000004800 polyvinyl chloride Substances 0.000 description 1
- 229920001289 polyvinyl ether Polymers 0.000 description 1
- 229920001291 polyvinyl halide Polymers 0.000 description 1
- 239000011148 porous material Substances 0.000 description 1
- 230000002028 premature Effects 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 230000002062 proliferating effect Effects 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 125000001500 prolyl group Chemical group [H]N1C([H])(C(=O)[*])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 230000004952 protein activity Effects 0.000 description 1
- 238000000159 protein binding assay Methods 0.000 description 1
- 230000012846 protein folding Effects 0.000 description 1
- 230000004853 protein function Effects 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- 239000000376 reactant Substances 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 238000010188 recombinant method Methods 0.000 description 1
- 231100000812 repeated exposure Toxicity 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 230000001177 retroviral effect Effects 0.000 description 1
- 208000004124 rheumatic heart disease Diseases 0.000 description 1
- PYWVYCXTNDRMGF-UHFFFAOYSA-N rhodamine B Chemical compound [Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=CC=C1C(O)=O PYWVYCXTNDRMGF-UHFFFAOYSA-N 0.000 description 1
- 239000002336 ribonucleotide Substances 0.000 description 1
- 125000002652 ribonucleotide group Chemical group 0.000 description 1
- 229920002477 rna polymer Polymers 0.000 description 1
- 210000003296 saliva Anatomy 0.000 description 1
- 238000003118 sandwich ELISA Methods 0.000 description 1
- 229940043230 sarcosine Drugs 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- 238000001542 size-exclusion chromatography Methods 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 238000007614 solvation Methods 0.000 description 1
- 238000000527 sonication Methods 0.000 description 1
- 210000004989 spleen cell Anatomy 0.000 description 1
- 210000003802 sputum Anatomy 0.000 description 1
- 208000024794 sputum Diseases 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 230000003068 static effect Effects 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 229940117986 sulfobetaine Drugs 0.000 description 1
- 210000004243 sweat Anatomy 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- 210000001138 tear Anatomy 0.000 description 1
- 201000004415 tendinitis Diseases 0.000 description 1
- 210000002435 tendon Anatomy 0.000 description 1
- 229920001897 terpolymer Polymers 0.000 description 1
- 229940126585 therapeutic drug Drugs 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 125000003396 thiol group Chemical group [H]S* 0.000 description 1
- 229940113082 thymine Drugs 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 238000010361 transduction Methods 0.000 description 1
- 230000026683 transduction Effects 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 238000013519 translation Methods 0.000 description 1
- 230000014621 translational initiation Effects 0.000 description 1
- 235000011178 triphosphate Nutrition 0.000 description 1
- 239000001226 triphosphate Substances 0.000 description 1
- UNXRWKVEANCORM-UHFFFAOYSA-N triphosphoric acid Chemical compound OP(O)(=O)OP(O)(=O)OP(O)(O)=O UNXRWKVEANCORM-UHFFFAOYSA-N 0.000 description 1
- 208000022679 triple-negative breast carcinoma Diseases 0.000 description 1
- 210000004881 tumor cell Anatomy 0.000 description 1
- 208000035408 type 1 diabetes mellitus 1 Diseases 0.000 description 1
- 229940035893 uracil Drugs 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 230000035899 viability Effects 0.000 description 1
- 230000000007 visual effect Effects 0.000 description 1
- 230000008673 vomiting Effects 0.000 description 1
- 239000003643 water by type Substances 0.000 description 1
- 229920003176 water-insoluble polymer Polymers 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
- 210000000707 wrist Anatomy 0.000 description 1
- 229940075420 xanthine Drugs 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
- A61K47/64—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/337—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having four-membered rings, e.g. taxol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/10—Alcohols; Phenols; Salts thereof, e.g. glycerol; Polyethylene glycols [PEG]; Poloxamers; PEG/POE alkyl ethers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/56—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule
- A61K47/59—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyureas or polyurethanes
- A61K47/60—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyureas or polyurethanes the organic macromolecular compound being a polyoxyalkylene oligomer, polymer or dendrimer, e.g. PEG, PPG, PEO or polyglycerol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/04—Linear peptides containing only normal peptide links
- C07K7/06—Linear peptides containing only normal peptide links having 5 to 11 amino acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/70—Vectors or expression systems specially adapted for E. coli
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/60—Medicinal preparations containing antigens or antibodies characteristics by the carrier linked to the antigen
- A61K2039/6031—Proteins
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Epidemiology (AREA)
- Organic Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Microbiology (AREA)
- Immunology (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Mycology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Wood Science & Technology (AREA)
- Biomedical Technology (AREA)
- Biotechnology (AREA)
- General Engineering & Computer Science (AREA)
- Zoology (AREA)
- Physics & Mathematics (AREA)
- Plant Pathology (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Peptides Or Proteins (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Polyoxymethylene Polymers And Polymers With Carbon-To-Carbon Bonds (AREA)
- Other Resins Obtained By Reactions Not Involving Carbon-To-Carbon Unsaturated Bonds (AREA)
- Polyurethanes Or Polyureas (AREA)
Abstract
폴리펩타이드 및 하나 이상의 약물 분자를 포함하는 콘주게이트가 본원에서 제공된다. 폴리펩타이드에는 하나 이상의 하전된 모티프가 포함되며, 하나 이상의 하전되지 않는 모티프가 추가로 포함될 수 있다. 콘주게이트는 대상체에 약물 분자를 효과적으로 전달하기 위해 이용될 수 있다.
Description
관련 출원에 대한 교차-참조
본 출원은 2015년 8월 4일에 출원된 U.S. 특허 가출원 번호 62/200,726을 우선권으로 주장하며, 본원에 그 전문이 참조로 포함된다.
연방 지원 연구에 관한 진술
본 발명은 미국 국립 보건원에서 수여되는 연구비 5R01EB000188 R01 하에 정부 지원으로 수행되었다. 정부는 본 발명에 소정 권리를 갖는다.
기술분야
본 개시는 약물 전달 방법, 보다 구체적으로는 치료제에 콘주게이션된 쯔비터이온성 폴리펩타이드에 관한 것이다. 콘주게이트는 개선된 생체적합성 및 생분해성을 갖는다. 일부 구현예에서, 콘주게이트는 재조합적으로 발현될 수 있고, 이에 의해 정밀하게 설계되고 유전자 수준에서 조작될 수 있다.
도입
약물 또는 치료제, 예컨대 소분자, 펩타이드, 및 단백질의 원상태 형태로의 전달은 이의 불량한 안정성, 낮은 용해도, 및 짧은 생체내 순환에 의해 제한된다. 약물 전달에서의 이러한 난제는 감소된 치료 유효성 및 표적을 벗어난 독성의 증가된 위험으로 이어진다. 약물에 대한 거대분자 담체의 부착은 이의 용해도, 혈장 반감기, 종양-특이적 섭취, 및 이의 전반적 치료능을 개선할 수 있다. 다양한 물질, 주로 합성 중합체가 약물을 전달하기 위해 이전에 설계되었다. 이러한 합성 중합체의 하나는 폴리에틸렌 글리콜(PEG)이다. PEG는 약물 주위에 "물 우리(cage)"를 형성하는 친수성 및 흡습성 중합체이며, 이어서 혈액 성분으로부터의 입체 반발을 제공하고 그 옵소닌화 및 효소적 분해를 모두 방지한다. PEG의 이러한 "스텔스" 특성은 약물의 용해도 및 안정성을 개선하고, 대상체로부터 이의 조기 제거를 감소시켜서, PEG화 - PEG에 약물을 부착하는 공정 - 를 약학 산업에서 중요한 방법으로 만든다. 최근 수 년 간, 이의 단량체에 교대 양이온기 및 음이온기를 갖는 중합체인 새로운 클래스의 쯔비터이온성 합성 중합체는 유사한 스텔스 특성을 실증하였다. 그러나, 약물 전달 비히클로서 합성 중합체의 신뢰성을 손상시키는 3가지 주요 단점이 존재한다. 첫 번째로, PEG에 대한 반복된 노출은 유해한 면역 반응을 유발하는 PEG-특이적 항체를 생성할 수 있음이 잘 보고되어 있다. 두 번째로, 합성 중합체는 비-생분해성이며, 약물 전달 후 이의 생체내 효과는 잘 이해되어 있지 않다. 세 번째로, 합성 중합체는 각 배치가 상이한 분자량을 갖는 사슬로 이루어지는 다분산성이다. 합성 중합체에 내재적인 이러한 다분산성은 특히 반감기 및 면역원성에 관해, 상이한 생물학적 특성을 갖는 약물 콘주게이트 집단을 생성할 수 있다. 개선된 생체적합성, 용해도, 안정성 및 반감기와 감소된 독성을 갖는 효율적인 약물 전달에 대한 필요성이 당분야에 존재한다.
하나의 양태에서, (a) 하나 이상의 하전된 모티프를 포함하는 폴리펩타이드로서, 각각의 하전된 모티프는 독립적으로 SEQ ID NO: 1(VPX1X2G)로 구성되는 아미노산 서열을 가지며, 식 중 X1은 음으로 또는 양으로 하전된 아미노산이고, X2는 음으로 또는 양으로 하전된 다른 아미노산인 폴리펩타이드; 및 (b) 폴리펩타이드에 부착된 하나 이상의 약물 분자를 포함하는 콘주게이트가 본원에서 제공된다.
일부 구현예에서, 폴리펩타이드에는 복수의 하전된 모티프가 포함된다. 일부 구현예에서, 복수의 하전된 모티프는 일렬로 반복된다. 일부 구현예에서, 폴리펩타이드에는 하나 이상의 하전되지 않은 모티프가 추가로 포함되며, 각각의 하전되지 않은 모티프는 독립적으로 SEQ ID NO: 3(VPGXG)으로 구성되는 아미노산 서열을 갖고, 식 중 X는 프롤린을 제외한 임의의 아미노산이다. 일부 구현예에서, 폴리펩타이드에는 복수의 하전되지 않은 모티프가 포함된다. 일부 구현예에서, 복수의 하전되지 않은 모티프는 일렬로 반복된다. 일부 구현예에서, 하나 이상의 하전되지 않은 모티프는 폴리펩타이드의 적어도 2개의 인접한 하전된 모티프 사이에 배치된다.
일부 구현예에서, 폴리펩타이드에는 SEQ ID NO: 2(VPX1X2G)n의 아미노산 서열로서, 식 중 X1은 음으로 또는 양으로 하전된 아미노산이고, X2는 음으로 또는 양으로 하전된 다른 아미노산이고, n은 1 이상의 정수인 서열이 포함된다. 일부 구현예에서, 폴리펩타이드에는 SEQ ID NO: 4(VPGXG)n의 아미노산 서열로서, 식 중 X는 프롤린을 제외한 임의의 아미노산이고, n은 1 이상의 정수인 서열이 포함된다. 일부 구현예에서, 폴리펩타이드에는 SEQ ID NO: 5(VPX1X2G)n(VPGXG)m의 아미노산 서열로서, 식 중 X1은 음으로 또는 양으로 하전된 아미노산이고, X2는 음으로 또는 양으로 하전된 다른 아미노산이고, X는 프롤린을 제외한 임의의 아미노산이고, n 및 m은 독립적으로 1 이상의 정수인 서열이 포함된다. 일부 구현예에서, 폴리펩타이드에는 SEQ ID NO: 6(VPGXG)m(VPX1X2G)n의 아미노산 서열로서, 식 중 X1은 음으로 또는 양으로 하전된 아미노산이고, X2는 음으로 또는 양으로 하전된 다른 아미노산이고, X는 프롤린을 제외한 임의의 아미노산이고, n 및 m은 독립적으로 1 이상의 정수인 서열이 포함된다. 일부 구현예에서, 폴리펩타이드에는 SEQ ID NO: 7{(VPX1X2G)(VPGXG)}b의 아미노산 서열로서, 식 중 X1은 음으로 또는 양으로 하전된 아미노산이고, X2는 음으로 또는 양으로 하전된 다른 아미노산이고, X는 프롤린을 제외한 임의의 아미노산이고, b는 1 이상의 정수인 서열이 포함된다. 일부 구현예에서, X1은 음으로 하전된 아미노산이고, X2는 양으로 하전된 아미노산이다. 일부 구현예에서, X1은 양으로 하전된 아미노산이고, X2는 음으로 하전된 아미노산이다. 일부 구현예에서, 음으로 하전된 아미노산은 독립적으로 글루타메이트산 및 아스파르트산으로부터 선택된다. 일부 구현예에서, 양으로 하전된 아미노산은 독립적으로 라이신 및 아르기닌으로부터 선택된다. 일부 구현예에서, X는 프롤린을 제외한 임의의 아미노산이다. 일부 구현예에서, X는 아르기닌, 히스티딘, 라이신, 아스파르트산, 글루탐산, 세린, 트레오닌, 아스파라긴, 글루타민, 시스테인, 셀레노시스테인, 글리신, 알라닌, 발린, 류신, 이소류신, 메티오닌, 페닐알라닌, 티로신, 및 트립토판으로부터 선택된다. 일부 구현예에서, X는 글리신 및 발린으로부터 선택된다.
일부 구현예에서, 폴리펩타이드에는 링커가 추가로 포함된다. 일부 구현예에서, 링커에는 하나 이상의 시스테인이 포함된다. 일부 구현예에서, 링커에는 SEQ ID NO: (GGC), SEQ ID NO: ((GGC)8), SEQ ID NO: ((G4S)3), 및 SEQ ID NO: ((VPGXG)16, 식 중 X는 1:1의 비로 존재하는 발린 또는 시스테인임)으로부터 선택되는 아미노산 서열이 포함된다. 일부 구현예에서, 링커는 폴리펩타이드의 C-말단, N-말단, 또는 C- 및 N-말단 모두에 배치된다. 일부 구현예에서, 하나 이상의 약물 분자가 링커를 통해 폴리펩타이드에 부착된다. 일부 구현예에서, 약물 분자는 링커 내 티올 반응기를 통해 폴리펩타이드에 부착된다. 일부 구현예에서, 하나 이상의 약물 분자는 소분자, 뉴클레오타이드, 폴리뉴클레오타이드, 펩타이드, 단백질, 탄수화물, 및 이의 조합으로부터 선택된다. 일부 구현예에서, 약물 분자에는 소분자가 포함된다. 일부 구현예에서, 약물 분자에는 단백질이 포함된다. 일부 구현예에서, 약물 분자에는 암 치료제가 포함된다. 일부 구현예에서, 약물 분자에는 항체가 포함된다. 일부 구현예에서, 약물 분자에는 파클리탁셀이 포함된다. 일부 구현예에서, 약물 분자에는 Tn3(TRAIL 수퍼작용제)이 포함된다. 일부 구현예에서, 콘주게이트는 대상체에 대한 투여를 위해 제조된다. 일부 구현예에서, 콘주게이트의 폴리펩타이드는 재조합적으로 발현된다. 일부 구현예에서, 콘주게이트는 재조합적으로 발현된다.
또 다른 양태에서, 본원에 상세히 기재된 바와 같은 콘주게이트를 포함하는 조성물이 본원에서 제공된다.
또 다른 양태에서, 본원에 상세히 기재되는 바와 같은 폴리펩타이드를 인코딩하는 폴리뉴클레오타이드가 본원에서 제공된다. 또 다른 양태에서, 본원에 상세히 기재된 바와 같은 콘주게이트를 인코딩하는 폴리뉴클레오타이드가 본원에서 제공된다. 또 다른 양태에서, 폴리뉴클레오타이드를 포함하는 벡터가 본원에서 제공된다.
또 다른 양태에서, 대상체에 대한 약물 분자의 전달 방법이 본원에서 제공되며, 방법은 대상체에 본원에 상세히 기재된 바와 같은 콘주게이트를 투여하는 단계를 포함한다.
또 다른 양태에서, 질환 또는 장애를 갖는 대상체의 치료 방법이 본원에서 제공되며, 방법은 대상체에 본원에 상세히 기재된 바와 같은 콘주게이트를 투여하는 단계를 포함한다.
또 다른 양태에서, 샘플 내 표적의 존재 결정 방법이 본원에서 제공되며, 방법은 약물 분자 및 샘플 내 표적 간에 복합체가 형성될 수 있도록 하는 조건 하에 샘플을 본원에 상세히 기재된 바와 같은 콘주게이트와 접촉시키는 단계; 및 복합체의 존재를 검출하는 단계로서, 복합체의 존재는 샘플 내 표적을 시사하는 단계를 포함한다.
일부 구현예에서, 샘플이 대상체로부터 수득되며, 방법에는 대상체의 질환을 진단하는 단계, 예진하는 단계 또는 치료 유효성을 평가하는 단계가 추가로 포함된다. 일부 구현예에서, 방법에 대상체의 치료 유효성을 평가하는 단계가 추가로 포함되는 경우, 방법에는 유효성을 개선하기 위해 필요에 따라 대상체의 치료를 변경하는 단계가 추가로 포함된다. 또 다른 양태에서, 대상체에서 질환의 진단 방법이 본원에서 제공되며, 방법은 약물 분자 및 샘플 내 표적 간에 복합체가 형성될 수 있도록 하는 조건 하에 대상체로부터의 샘플을 본원에 상세히 기재된 바와 같은 콘주게이트와 접촉시키는 단계; 샘플 내 표적 수준을 결정하는 단계로서, 복합체 수준은 샘플 내 표적 수준을 시사하는 단계; 및 샘플 내 표적 수준을 표적의 대조군 수준과 비교하는 단계로서, 대조군 수준과 상이한 표적 수준은 대상체에서 질환을 시사하는 단계를 포함한다. 일부 구현예에서, 대조군 수준은 대상체가 치료를 시작한 기간 이전 또는 동안의 시점에 대상체에서의 수준에 해당하며, 샘플은 이후 시점에 대상체로부터 취해진다. 일부 구현예에서, 샘플은 대상체가 치료를 받고 있는 기간 동안의 시점에 대상체로부터 취해지며, 대조군 수준은 무질환 수준 또는 대상체가 치료를 시작한 기간 이전 시점에서의 수준에 해당한다. 일부 구현예에서, 방법에는 치료가 질환 치료에 비효과적인 것으로 결정되는 경우 대상체에 대한 치료를 변경하는 단계 또는 상이한 치료를 투여하는 단계가 추가로 포함된다. 일부 구현예에서, 콘주게이트는 리포터로 표지된다. 일부 구현예에서, 콘주게이트는 대상체에 정맥내, 동맥내, 복강내, 또는 종양내 투여된다. 일부 구현예에서, 콘주게이트는 폴리에틸렌 글리콜(PEG)에 콘주게이션된 약물 분자에 비해 감소된 항원성을 갖는다. 일부 구현예에서, 콘주게이트는 폴리에틸렌 글리콜(PEG)에 콘주게이션된 약물 분자에 비해 감소된 면역원성을 갖는다. 일부 구현예에서, 질환은 암, 대사 질환, 자가면역 질환, 심혈관 질환, 및 정형외과 장애로부터 선택된다. 일부 구현예에서, 질환에는 암이 포함된다. 일부 구현예에서, 암은 유방암, 결장직장암, 결장암, 폐암, 전립선암, 고환암, 뇌암, 피부암, 직장암, 위암, 식도암, 육종, 기관암, 두부경부암, 췌장암, 간암, 난소암, 림프모양 암, 자궁경부암, 외음부암, 흑색종, 중피종, 신장암, 방광암, 갑상선암, 뼈암, 암종, 육종, 및 연조직암으로부터 선택된다. 일부 구현예에서, 암에는 유방암이 포함된다.
도 1은 ZiPP의 가능한 구조 및 서열을 나타낸다. (A) 단독중합체. (B) 디블록 중합체. (C) 멀티블록 중합체. (D) 하전된 모티프의 가능한 서열.
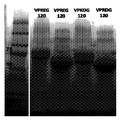
도 2는 ZiPP의 특성규명을 나타낸다. 이용된 ZiPP 구축물은 펜타펩타이드 쯔비터이온성 모티프의 120개 반복이다. (A) 정제된 ZiPP 구축물의 SDS PAGE 분석. (B) (VPKDG)120 및 (VPRDG)120에 대한 대표적 MALDI 스펙트럼으로 정제된 ZiPP 구축물의 MW를 확인하였다(각각 MW=60.5 kDa, MW=63.8 kDa). (C) 동적 광 산란을 이용해서 측정된 수력학적 반지름은 ELP 대조군에 비해 잘 수화된 ZiPP를 나타내었다. (D) ZiPP의 CD-스펙트럼은 저파장에서 음의 타원율 및 더 높은 파장에서 약간 양의 타원율을 나타내었으며, 이는 ELP와 같은 무질서화 구조에 전형적이다. (E) 원상태 PAGE 겔은 ZiPP가 알부민과 상호작용하지 않음을 나타내었다.
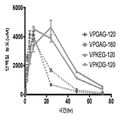
도 3은 정맥내 주사되는 경우, ELP(VPGAG) 및 ZiPP의 혈장 동역학을 나타낸다. (A) 실험 설계. (B) 주사 후 시간의 함수로서의 혈장 농도. (C) 각각의 콘주게이트에 대한 곡선 하 면적(AUC). (D) 각각의 콘주게이트에 대한 제거 반감기.
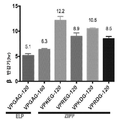
도 4는 피하 주사되는 경우, ELP(VPGAG) 및 ZiPP의 혈장 동역학을 나타낸다. (A) 실험 설계. (B) 주사 후 시간의 함수로서의 혈장 농도. (C) 각각의 콘주게이트에 대한 AUC.
도 5는 ZiPP-PTX 콘주게이트의 특성규명을 나타낸다. (A) ZiPP 파클리탁셀(PTX) 나노입자의 설계 도식. 파클리탁셀을 pH 감수성 링커를 통해 8개의 C-말단 잔기에 화학적으로 콘주게이션하였다. (B) PTX 콘주게이션 후 동적 및 정적 광 데이터는 ZiPP가 마이셀 당 26의 응집수로 58 ㎚ 반지름의 마이셀로 자가-어셈블리되었음을 나타낸다. 폼 팩터(form factor, ρ)-Rg/Rh로 계산됨-는 0.82였으며, 이는 구형 마이셀의 형성을 표시한다. ZiPP 및 ZiPP+PTX 콘주게이트의 MALDI-MS는 중합체 사슬 당 3.2~4개 약물이 존재함을 나타내었다. (C) 처리 72시간 후 MDA-MB-231 삼중 음성 유방암 세포주에서 ZiPP-PTX, ELP-PTX, 및 자유 PTX에 대한 세포 생활성.
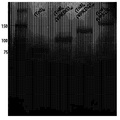
도 6은 Zipp화 단백질을 나타낸다. (A) (Tn3)6을 갖는 ZiPP 융합 단백질에 대한 설계 개요. (B) 대장균에서 재조합적으로 발현된 다양한 길이의 ZiPP를 갖는 (Tn3)6의 친화도 정제 샘플의 SDS-PAGE 분석. (C) Colo205(결장암 세포)에 대한 세포독성 검정 및 계산된 IC50값.
도 7은 ZiPP의 특성규명을 나타낸다. 이용된 ZiPP 구축물은 펜타펩타이드 쯔비터이온성 모티프의 80개 반복이다. (A) 정제 ZiPP 구축물의 SDS PAGE 분석. 50 kD 및 75 kD 래더(ladder)가 참조 분자량으로 표시되지만, SDS-PAGE에서 이용되는 래더는 구형 단백질의 것이므로, 구조화되지 않은 ZIPP와 직접 비교할 수 없다. (B) (VPREG)80 및 (VPKEG)80에 대한 대표적 MALDI 스펙트럼으로 정제 ZIPP 구축물의 분자량을 확인하였다(각각 MW=44.1 kDa, MW=41.8 kDa). (C) ZIPP의 CD-스펙트럼은 저파장에서 음의 타원율 및 더 높은 파장에서 약간 양의 타원율을 나타내었으며, 이는 ELP와 같은 무질서화 구조에 전형적이다.
도 2는 ZiPP의 특성규명을 나타낸다. 이용된 ZiPP 구축물은 펜타펩타이드 쯔비터이온성 모티프의 120개 반복이다. (A) 정제된 ZiPP 구축물의 SDS PAGE 분석. (B) (VPKDG)120 및 (VPRDG)120에 대한 대표적 MALDI 스펙트럼으로 정제된 ZiPP 구축물의 MW를 확인하였다(각각 MW=60.5 kDa, MW=63.8 kDa). (C) 동적 광 산란을 이용해서 측정된 수력학적 반지름은 ELP 대조군에 비해 잘 수화된 ZiPP를 나타내었다. (D) ZiPP의 CD-스펙트럼은 저파장에서 음의 타원율 및 더 높은 파장에서 약간 양의 타원율을 나타내었으며, 이는 ELP와 같은 무질서화 구조에 전형적이다. (E) 원상태 PAGE 겔은 ZiPP가 알부민과 상호작용하지 않음을 나타내었다.
도 3은 정맥내 주사되는 경우, ELP(VPGAG) 및 ZiPP의 혈장 동역학을 나타낸다. (A) 실험 설계. (B) 주사 후 시간의 함수로서의 혈장 농도. (C) 각각의 콘주게이트에 대한 곡선 하 면적(AUC). (D) 각각의 콘주게이트에 대한 제거 반감기.
도 4는 피하 주사되는 경우, ELP(VPGAG) 및 ZiPP의 혈장 동역학을 나타낸다. (A) 실험 설계. (B) 주사 후 시간의 함수로서의 혈장 농도. (C) 각각의 콘주게이트에 대한 AUC.
도 5는 ZiPP-PTX 콘주게이트의 특성규명을 나타낸다. (A) ZiPP 파클리탁셀(PTX) 나노입자의 설계 도식. 파클리탁셀을 pH 감수성 링커를 통해 8개의 C-말단 잔기에 화학적으로 콘주게이션하였다. (B) PTX 콘주게이션 후 동적 및 정적 광 데이터는 ZiPP가 마이셀 당 26의 응집수로 58 ㎚ 반지름의 마이셀로 자가-어셈블리되었음을 나타낸다. 폼 팩터(form factor, ρ)-Rg/Rh로 계산됨-는 0.82였으며, 이는 구형 마이셀의 형성을 표시한다. ZiPP 및 ZiPP+PTX 콘주게이트의 MALDI-MS는 중합체 사슬 당 3.2~4개 약물이 존재함을 나타내었다. (C) 처리 72시간 후 MDA-MB-231 삼중 음성 유방암 세포주에서 ZiPP-PTX, ELP-PTX, 및 자유 PTX에 대한 세포 생활성.
도 6은 Zipp화 단백질을 나타낸다. (A) (Tn3)6을 갖는 ZiPP 융합 단백질에 대한 설계 개요. (B) 대장균에서 재조합적으로 발현된 다양한 길이의 ZiPP를 갖는 (Tn3)6의 친화도 정제 샘플의 SDS-PAGE 분석. (C) Colo205(결장암 세포)에 대한 세포독성 검정 및 계산된 IC50값.
도 7은 ZiPP의 특성규명을 나타낸다. 이용된 ZiPP 구축물은 펜타펩타이드 쯔비터이온성 모티프의 80개 반복이다. (A) 정제 ZiPP 구축물의 SDS PAGE 분석. 50 kD 및 75 kD 래더(ladder)가 참조 분자량으로 표시되지만, SDS-PAGE에서 이용되는 래더는 구형 단백질의 것이므로, 구조화되지 않은 ZIPP와 직접 비교할 수 없다. (B) (VPREG)80 및 (VPKEG)80에 대한 대표적 MALDI 스펙트럼으로 정제 ZIPP 구축물의 분자량을 확인하였다(각각 MW=44.1 kDa, MW=41.8 kDa). (C) ZIPP의 CD-스펙트럼은 저파장에서 음의 타원율 및 더 높은 파장에서 약간 양의 타원율을 나타내었으며, 이는 ELP와 같은 무질서화 구조에 전형적이다.
대상체에 약물 분자를 전달하기 위한 조성물 및 방법이 본원에서 제공된다. 조성물 및 방법에는 폴리펩타이드 및 여기에 부착된 약물 분자를 포함하는 콘주게이트가 포함된다. 폴리펩타이드에는 양으로 및 음으로 하전된 아미노산이 모두 포함된다. 본원에 상세히 기재된 조성물 및 방법은 생체적합성, 용해도, 안정성 및 반감기, 면역원성, 및 항원성에 대한 제한을 포함하여, 약물 전달에서의 이전 난제를 극복할 수 있다. 본원에 상세히 기재된 구축물은 콘주게이트 주변에 "물 우리"를 제공하여 콘주게이트를 분해로부터 입체적으로 차폐하기 위해 친수성 원리를 이용할 수 있다. 이에 따라 콘주게이트는 콘주게이션된 치료제의 안정성 및 용해도를 증가시키고 이의 생체내 유효성을 개선한다. 콘주게이트는 질환을 치료하기 위한 약물을 효과적으로 전달함으로써 질환의 치료를 허용할 수 있다. 약물이 표적에 결합하는 일부 구현예에서, 콘주게이트는 또한 표적을 검출하고, 질환을 검출하거나 진단하고, 및/또는 치료 유효성을 결정하기 위해 이용될 수 있다. 본원에 상세히 기재된 콘주게이트는 또한 유전 조작에 의해 제조됨으로써 정밀도, 더 낮은 독성, 더 우수한 생체적합성, 및 개선된 생분해성을 가지고 이의 설계 및 조작을 촉진할 수 있다.
1. 정의
본원에서 이용되는 "포함한다", "포함된다", "가지는", "가진다", "할 수 있다", 함유한다"는 용어 및 이의 변형은 추가 행위 또는 구조의 가능성을 배제하지 않는, 개방형 말단의 접속 어구, 용어, 또는 단어인 것으로 의도된다. 단수 형태에는 문맥 상 명확히 달리 나타내지 않는 한, 복수의 참조물이 포함된다. 본 개시는 또한 명시적으로 나타내건 아니건, 본원에 나타낸 구현예 또는 성분을 "포함하는", "이로 구성되는" 및 "이로 본질적으로 구성되는" 다른 구현예를 포괄한다.
본원에서 수치 범위의 열거에 있어서, 동일한 정도의 정밀도로 이들 사이의 각각의 개재 수치가 명시적으로 포괄된다. 예를 들어, 6~9의 범위에 있어서, 6 및 9에 부가하여 수치 7 및 8이 포괄되며, 6.0~7.0의 범위에 있어서, 수치 6.0, 6.1, 6.2, 6.3, 6.4, 6.5, 6.6, 6.7, 6.8, 6.9, 및 7.0이 명시적으로 포괄된다.
달리 정의되지 않는 한, 본원에서 이용되는 모든 기술적 및 과학적 용어는 당업자에 의해 일반적으로 이해되는 바와 동일한 의미를 갖는다. 상충 시, 정의를 포함하여 본 문헌이 우선이 될 것이다. 바람직한 방법 및 물질이 아래에 기재되지만, 본원에 기재된 것과 유사하거나 균등한 방법 및 물질이 본 발명의 실시 또는 평가에서 이용될 수 있다. 본원에서 인용되는 모든 공보, 특허 출원, 특허 및 다른 참고문헌은 이의 전문이 참조로 포함된다. 본원에 개시된 물질, 방법, 및 실시예는 단지 예시적인 것이며 제한하려는 것이 아니다.
하나 이상의 관심 값에 적용되는 본원에서 이용되는 "약"이라는 용어는 언급된 참조값과 유사한 값을 나타낸다. 소정 양태에서, "약"이라는 용어는 달리 언급되거나 문맥으로부터 달리 자명하지 않은 한(이러한 수치가 가능한 값의 100%를 초과하는 경우를 제외하고), 언급된 참조값의 어느 방향으로든(초과이거나 미만으로) 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% 이하에 속하는 값의 범위를 나타낸다.
본원에서 이용되는 "아미노산"은 천연 발생 및 비-천연 합성 아미노산뿐만 아니라 천연 발생 아미노산과 유사한 방식으로 기능하는 아미노산 유사체 및 아미노산 모사체를 나타낸다. 천연 발생 아미노산은 유전 코드에 의해 인코딩되는 것이다. 아미노산은 이의 일반적으로 공지된 3글자 기호 또는 IUPAC-IUB 생화학 명명 위원회에서 권장되는 1글자 기호에 의해 본원에서 나타낼 수 있다. 아미노산에는 측쇄 및 폴리펩타이드 골격 부분이 포함된다.
본원에서 이용되는 "바이오마커"라는 용어는 질환 또는 상태의 확인 및/또는 분류에 유용한 다양한 농도로 대상체에 존재하는 천연 발생 생물학적 분자를 나타낸다. 바이오마커에는 질환에 대한 표시자 또는 마커로 이용되는 유전자, 단백질, 폴리뉴클레오타이드, 핵산, 리보핵산, 폴리펩타이드, 또는 다른 생물학적 분자가 포함될 수 있다. 일부 구현예에서, 바이오마커는 질환 마커를 포함한다. 예를 들어, 바이오마커는 질환을 갖는 대상체에서 상향조절되거나 하향조절되는 유전자일 수 있다. 또 다른 예로서, 바이오마커는 질환을 갖거나 질환이 발생할 위험이 있는 대상체에서 그 수준이 증가되거나 감소되는 폴리펩타이드일 수 있다. 일부 구현예에서, 바이오마커는 소분자를 포함한다. 일부 구현예에서, 바이오마커는 폴리펩타이드를 포함한다.
"대조군", "참조 수준" 및 "참조"라는 용어는 본원에서 상호 교환적으로 이용된다. 참조 수준은 소정 값 또는 범위일 수 있으며, 이는 측정된 결과를 평가하기 위한 벤치마크로 채택된다. 본원에서 이용되는 "대조군 그룹"은 대조군 대상체 그룹을 나타낸다. 소정 수준은 대조군 그룹으로부터의 컷오프값일 수 있다. 소정 수준은 대조군 그룹으로부터의 평균일 수 있다. 컷오프값(또는 소정 컷오프값)은 AIM(채택 지수 모델, Adaptive Index Model) 방법에 의해 결정될 수 있다. 컷오프값(또는 소정 컷오프값)은 환자 그룹의 생물학적 샘플로부터의 ROC(수신자 작동 곡선, receiver operating curve) 분석에 의해 결정될 수 있다. 생물학 분야에서 일반적으로 공지된 바와 같은 ROC 분석은 하나의 상태를 다른 상태와 구별하는, 예컨대 CRC를 갖는 환자의 확인에서 각 마커의 성능을 결정하는 평가 능력의 결정이다. ROC 분석의 설명은 문헌[P.J. Heagerty et al. (Biometrics 2000, 56, 337-44)]에 제공되며, 그 개시는 전문이 본원에 참조로 포함된다. 대안적으로, 컷오프값은 환자 그룹의 생물학적 샘플의 사분위 분석에 의해 결정될 수 있다. 예를 들어, 컷오프값은 25백분위수~75백분위수 범위의 임의의 값에 해당하는 값, 바람직하게는 25백분위수, 50백분위수 또는 75백분위수, 보다 바람직하게는 75백분위수에 해당하는 값을 선택함으로써 결정될 수 있다. 이러한 통계 분석은 당분야에 공지된 임의의 방법을 이용해서 수행될 수 있고, 임의의 수의 상업적으로 이용 가능한 소프트웨어 패키지(예컨대, Analyse-it Software Ltd., Leeds, UK; StataCorp LP, College Station, TX; SAS Institute Inc., Cary, NC.)를 통해 구현될 수 있다. 표적에 대한 또는 단백질 활성에 대한 건강한 또는 정상 수준 또는 범위는 표준 관례에 따라 정의될 수 있다. 대조군은 그 질환 상태가 알려져 있는 대상체, 또는 이로부터의 샘플일 수 있다. 대상체, 또는 이로부터의 샘플은 건강하거나, 질환이 있거나, 치료 전에 질환이 있거나, 치료 동안 질환이 있거나, 치료 후에 질환이 있거나, 이의 조합일 수 있다.
"발현 벡터"라는 용어는 원하는 단백질을 인코딩하는 핵산 서열이 삽입되거나 도입될 수 있는, 당분야에 공지된 플라스미드, 바이러스 또는 또 다른 매체를 시사한다.
"숙주 세포"라는 용어는 핵산 구축물 또는 발현 벡터를 이용한 형질전환, 전달감염, 형질도입, 콘주게이션 등에 감수성인 세포이다. 숙주 세포는 식물, 박테리아, 효모, 진균, 곤충, 동물 등으로부터 유래될 수 있다. 일부 구현예에서, 숙주 세포에는 대장균(Escherichia coli)이 포함된다.
"단분산성" 또는 "단분산"은 각각이 거의 동일한 분자량을 가지는, 복수의 콘주게이트, 또는 이의 폴리펩타이드의 특성을 나타낸다. 콘주게이트의 유전적으로 인코딩된 합성은 분자량의 정밀한 제어를 촉진할 수 있다. 분자량은 분자의 생체내 순환 시간, 또는 그 반감기에 영향을 미치는 요인이다.
"옵소닌화"는 분자, 미생물, 또는 아폽토시스 세포가 포식세포 및 자연 살해(NK) 세포 상의 세포 표면 수용체와 더 강한 상호작용을 갖기 위해 화학적으로 변경되는 분자 기전을 나타낸다. 분자, 미생물, 또는 아폽토시스 세포 상의 항원이 옵소닌에서 코팅된다. 옵소닌은 면역 세포, 예컨대 대식구 및 호중구에 대한 결합을 증강시킨다. 옵소닌화는 또한 세포 표면 수용체로부터의 신호 캐스케이드를 통해 포식작용을 매개한다.
"합성 중합체"는 화학적 공정에 의해 적어도 하나의 단량체로부터 제조되는 중합체를 나타낸다. 합성 중합체는 살아있는 유기체에 의해 직접 제조되지 않는다. 합성 중합체에는 단독중합체, 헤테로중합체, 블록 중합체, 공중합체, 삼원중합체 등, 및 이의 배합물, 조합물 및 혼합물이 포함된다. 합성 중합체의 예에는 비제한적으로 작용화된 중합체, 예컨대 5-비닐테트라졸 단량체 단위를 포함하며 2.0 미만의 분자량 분포를 갖는 중합체가 포함된다. 합성 중합체는 성상 블록 공중합체, 선형 중합체, 분기형 중합체, 과분기형 중합체, 수지상 중합체, 빗살형 중합체, 그래프트 중합체, 브러시 중합체, 보틀-브러시 공중합체 및 가교 구조, 예컨대 5-비닐테트라졸 단량체 단위 블록을 포함하는 블록 공중합체 중 하나 이상이거나 이를 함유할 수 있다. 합성 중합체에는 비제한적으로 폴리에스테르, 폴리(메트)아크릴아마이드, 폴리(메트)아크릴레이트, 폴리에테르, 폴리스티렌, 폴리노보넨 및 불포화 결합을 갖는 단량체가 포함된다. 예를 들어, 양친매성 빗살형 중합체는 U.S. 특허 출원 공개 번호 2007/0087114 및 U.S. 특허 번호 6,207,749(Mayes et al.)에 기재되며, 그 각각의 개시는 그 전문이 본원에 참조로 포함된다. 양친매성 빗살-유형 중합체는 소수성, 수불용성 중합체로 형성된 골격 및 짧은, 친수성 비-세포 결합 중합체로 형성된 측쇄를 함유하는 공중합체 형태로 존재할 수 있다. 다른 합성 중합체의 예에는 비제한적으로 폴리알킬렌, 예컨대 폴리에틸렌 및 폴리프로필렌 및 폴리에틸렌글리콜(PEG); 폴리클로로프렌; 폴리비닐 에테르; 예컨대 폴리(비닐 아세테이트); 폴리비닐 할라이드, 예컨대 폴리(비닐 클로라이드); 폴리실록산; 폴리스티렌; 폴리우레탄; 폴리아크릴레이트; 예컨대 폴리(메틸 (메트)아크릴레이트), 폴리(에틸 (메트)아크릴레이트), 폴리(n-부틸(메트)아크릴레이트), 폴리(이소부틸 (메트)아크릴레이트), 폴리(tert-부틸 (메트)아크릴레이트), 폴리(헥실(메트)아크릴레이트), 폴리(이소데실 (메트)아크릴레이트), 폴리(라우릴 (메트)아크릴레이트), 폴리(페닐 (메트)아크릴레이트), 폴리(메틸 아크릴레이트), 폴리(이소프로필 아크릴레이트), 폴리(이소부틸 아크릴레이트), 및 폴리(옥타데실 아크릴레이트); 폴리아크릴아마이드, 예컨대 폴리(아크릴아마이드), 폴리(메타크릴아마이드), 폴리(에틸 아크릴아마이드), 폴리(에틸 메타크릴아마이드), 폴리(N-이소프로필 아크릴아마이드), 폴리(n, 이소, 및 tert-부틸 아크릴아마이드); 및 이의 공중합체 및 혼합물이 포함된다. 이러한 합성 중합체에는 치환, 화학적 기, 예를 들어, 알킬기, 알킬렌기의 부가, 하이드록실화, 산화, 및 당업자에 의해 일상적으로 수행되는 다른 변경을 갖는 합성 중합체를 포함하는 유용한 유도체가 포함될 수 있다. 합성 중합체에는 쯔비터이온성 중합체, 예를 들어, 폴리포스포리콜린, 폴리카복시베타인, 및 폴리설포베타인이 포함될 수 있다. 합성 중합체는 베타인, 카복시베타인, 설포베타인, 올리고에틸렌 글리콜(OEG), 사르코신 또는 폴리에틸렌글리콜(PEG) 측쇄를 가질 수 있다.
본원에서 이용되는 "폴리뉴클레오타이드"는 단일 가닥이거나 이중 가닥일 수도 있고, 또는 이중 가닥 및 단일 가닥 서열 모두인 부분을 함유할 수도 있다. 폴리뉴클레오타이드는 핵산, 천연 또는 합성, DNA, 게놈 DNA, cDNA, RNA, 또는 폴리뉴클레오타이드가 데옥시리보- 및 리보-뉴클레오타이드의 조합을 함유할 수 있는 하이브리드, 및 우라실, 아데닌, 티민, 시토신, 구아닌, 이노신, 잔틴 하이포잔틴, 이소시토신, 및 이소구아닌을 포함하는 염기의 조합일 수 있다. 폴리뉴클레오타이드는 화학적 합성 방법에 의해 또는 재조합 방법에 의해 수득될 수 있다.
"펩타이드" 또는 "폴리펩타이드"는 펩타이드 결합에 의해 연결된 2개 이상의 아미노산의 연결된 서열이다. 폴리펩타이드는 천연, 합성, 또는 천연 및 합성의 변경 또는 조합일 수 있다. 펩타이드 및 폴리펩타이드에는 단백질, 예컨대 결합 단백질, 수용체, 및 항체가 포함된다. "폴리펩타이드", "단백질", 및 "펩타이드"라는 용어는 본원에서 상호 교환적으로 이용된다. "일차 구조"는 특정 펩타이드의 아미노산 서열을 나타낸다. "이차 구조"는 폴리펩타이드 내의 국소적으로 질서화된, 3차원 구조를 나타낸다. 이러한 구조는 일반적으로 도메인, 예컨대 효소 도메인, 세포외 도메인, 막통과 도메인, 포어 도메인, 및 세포질 꼬리 도메인으로 알려져 있다. 도메인은 폴리펩타이드의 조밀한 단위를 형성하며, 전형적으로 15 내지 350개 아미노산 길이인 폴리펩타이드 부분이다. 예시적인 도메인에는 효소 활성 또는 리간드 결합 활성을 갖는 도메인이 포함된다. 전형적인 도메인은 더 적은 조직화 섹션, 예컨대 베타-시트 연신물 및 알파-나선으로 만들어진다. "삼차 구조"는 폴리펩타이드 단량체의 완전한 3차원 구조를 나타낸다. "사차 구조"는 독립적인 삼차 단위의 비공유 연합에 의해 형성되는 3차원 구조를 나타낸다. "모티프"는 폴리펩타이드 서열 부분이며 적어도 2개의 아미노산이 포함된다. 모티프는 2 내지 20개, 2 내지 15개, 또는 2 내지 10개 아미노산 길이일 수 있다. 일부 구현예에서, 모티프에는 3, 4, 5, 6, 또는 7개의 순차적 아미노산이 포함된다.
본원에서 이용되는 "약동학"은 체내에서 약물의 순환 및 그 생체이용률, 분포, 및 배출을 나타낸다.
예컨대, 세포, 또는 핵산, 단백질, 또는 벡터에 대해 이용되는 경우 "재조합"은 세포, 핵산, 단백질, 또는 벡터가 이종성 핵산 또는 단백질의 도입 또는 원상태 핵산 또는 단백질의 변형에 의해 변경되었음을, 또는 세포가 이렇게 변경된 세포로부터 유래되었음을 시사한다. 따라서, 예를 들어, 재조합 세포는 세포의 원상태(비-재조합) 형태 내에서 확인되지 않는 유전자를 발현하거나 다른 경우 비정상적으로 발현되거나, 하향 발현되거나, 또는 전혀 발현되지 않는 원상태 유전자를 발현한다.
"리포터", "리포터 그룹", "표지", 및 "검출 가능한 표지"는 본원에서 상호 교환적으로 이용된다. 리포터는 검출 가능한 신호를 생성할 수 있다. 표지는 시각적 또는 기구적 수단에 의해 검출 가능한 신호를 생성할 수 있다. 리포터 그룹의 신호 전달의 물리적 성질(예컨대, 형광, 전기화학, 핵 자기 공명(NMR), 및 전자 상자성 공명(EPR)) 및 화학적 성질이 상이한 다양한 리포터 그룹이 이용될 수 있다. 다양한 리포터에는 신호-생성 물질, 예컨대 색원체, 형광 화합물, 화학발광 화합물, 방사활성 화합물 등이 포함된다. 일부 구현예에서, 리포터는 방사선 표지를 포함한다. 리포터에는 빛을 생성하는 모이어티, 예컨대 아크리디늄 화합물, 및 형광을 생성하는 모이어티, 예컨대 플루오레신이 포함될 수 있다. 일부 구현예에서, 리포터로부터의 신호는 형광 신호이다. 리포터는 형광단을 포함할 수 있다. 형광단의 예에는 비제한적으로 아크릴로단(6-아크릴로이 1-2-디메틸아미노나프탈렌), 바단(6-브로모-아세틸-2-디메틸아미노-나프탈렌), 로다민, 나프탈렌, 단질 아지리딘, 4-[N-[(2-요오도아세톡시)에틸]-N-메틸아미노]-7-니트로벤즈-2-옥사-1,3-디아졸 에스테르(IANBDE), 4-[N-[(2-요오도아세톡시)에틸]-N-메틸아미노-7-니트로벤즈-2-옥사-1,3-디아졸(IANBDA), 플루오레신, 디피로메텐보론 디플루오라이드(BODIPY), 4-니트로벤조[c][1,2,5]옥사디아졸(NBD), Alexa 형광 염료, 및 이의 유도체가 포함된다. 형광 유도체에는, 예를 들어 5-플루오레신, 6-카복시플루오레신, 3'6-카복시플루오레신, 5(6)-카복시플루오레신, 6-헥사클로로플루오레신, 6-테트라클로로플루오레신, 플루오레신, 및 이소티오시아네이트가 포함될 수 있다.
본원에서 이용되는 "샘플" 또는 "평가 샘플"은 표적의 존재 및/또는 수준이 검출되거나 결정될 임의의 샘플을 의미할 수 있다. 샘플에는 액체, 용액, 에멀젼, 또는 현탁액이 포함될 수 있다. 샘플에는 의학 샘플이 포함될 수 있다. 샘플에는 임의의 생물학적 유체 또는 조직, 예컨대 혈액, 전혈, 혈액의 분획, 예컨대 혈장 및 혈청, 근육, 장액, 땀, 타액, 소변, 눈물, 윤활액, 골수, 뇌척수액, 코 분비물, 가래, 양수, 기관지폐포 세척액, 위 세척액, 구토, 대변 물질, 폐 조직, 말초혈 단핵 세포, 전체 백혈구, 림프절 세포, 비장 세포, 편도 세포, 암 세포, 종양 세포, 담즙, 소화액, 피부, 또는 이의 조합이 포함될 수 있다. 일부 구현예에서, 샘플은 분취물을 포함한다. 다른 구현예에서, 샘플은 생물학적 유체를 포함한다. 샘플은 당분야에 공지된 임의의 수단에 의해 수득될 수 있다. 샘플은 환자로부터 수득된 대로 직접 이용될 수도 있고, 또는 예컨대 여과, 증류, 추출, 농축, 원심분리, 간섭 성분의 불활성화, 시약의 첨가 등에 의해 사전-처리되어 본원에서 논의된 바와 같은 일부 방식으로 또는 당분야에 공지된 바와 같은 다른 방식으로 샘플의 특징을 변경할 수 있다.
본원에서 이용되는 "감수성"이라는 용어는 진양성의 수 + 위음성의 수로 나눈 진양성의 수를 나타내며, 여기서 감수성("sens")은 0<sens<1의 범위 내일 수 있다. 이상적으로, 본원에서의 방법 구현예는 0과 같거나 0에 가까운 위음성의 수를 가져서, 대상체는 이들이 실제로 질환을 갖는 경우 질환을 갖지 않는 것으로 잘못 확인되지 않는다. 반대로, 평가는 종종 감수성에 대한 상보적 측정인, 정확히 음성을 분류하는 예측 알고리즘의 능력으로 수행된다.
본원에서 이용되는 "특이성"이라는 용어는 진음성의 수 + 위양성의 수로 나눈 진음성의 수를 나타내며, 여기서 특이성("spec")은 0<spec<1의 범위 내일 수 있다. 이상적으로, 본원에 기재된 방법은 0과 같거나 0에 가까운 위양성의 수를 가져서, 대상체는 이들이 실제로 질환을 갖지 않는 경우 질환을 갖는 것으로 잘못 확인되지 않는다. 따라서, 감수성 및 특이성이 모두 1, 또는 100%인 방법이 바람직하다.
"특이적으로 결합하는"이란, 일반적으로 폴리펩타이드가 무작위, 미관련 표적에 결합할 것보다 더 쉽게 해당 표적에 결합하는 경우, 이것이 표적에 결합함을 의미한다.
"스텔스" 또는 "스텔스 중합체"는 연장된 시기 동안 혈류에서 면역 세포에 의해 검출되지 않고 유지될 수 있는, 콘주게이트, 또는 이의 폴리펩타이드를 나타낸다. 스텔스 중합체는 면역계에서 외래 입자를 인식하기 위해 이용되는 일반적인 방법인, 프로테아제, 및 옵소닌화에 의한 것과 같은 콘주게이트, 또는 이의 폴리펩타이드의 효소적 분해에 적어도 부분적으로 내성이다. 따라서, 스텔스 중합체는 다른 중합체, 콘주게이트, 비-스텔스 중합체, 및/또는 비-스텔스 콘주게이트에 비해 감소된 항원성, 감소된 면역원성, 증가된 안정성, 증가된 반감기, 및 증가된 생체이용률 중 하나 이상을 가질 수 있다. 신체로부터 콘주게이트(또는 폴리펩타이드 또는 이의 약물 분자)의 옵소닌화, 면역계에 의한 인식, 또는 제거를 지연하거나, 감소시키거나, 방지하는 능력이 본원에서 스텔스 특성으로 언급될 수 있다.
본원에서 이용되는 "대상체"는 본원에 기재된 콘주게이트 또는 융합 단백질을 원하거나 필요로 하는 포유류를 의미할 수 있다. 대상체는 인간 또는 비-인간 동물일 수 있다. 대상체는 포유류일 수 있다. 포유류는 영장류 또는 비-영장류일 수 있다. 포유류는 영장류, 예컨대 인간; 비-영장류, 예컨대, 개, 고양이, 말, 소, 돼지, 마우스, 래트, 낙타, 라마, 염소, 토끼, 양, 햄스터, 및 기니아픽; 또는 비-인간 영장류, 예컨대, 원숭이, 침팬지, 고릴라, 오랑우탄, 및 긴팔원숭이일 수 있다. 대상체는 임의의 연령 또는 발달 단계, 예컨대, 성인기, 사춘기, 또는 유아기일 수 있다.
본원에서 이용되는 "표적"은 약물 분자가 결합하는 대상을 나타낼 수 있다. 표적에는, 예를 들어, 소분자, 단백질, 폴리펩타이드, 폴리뉴클레오타이드, 탄수화물, 또는 이의 조합이 포함될 수 있다.
"전이" 또는 "상 전이"는 열 반응성 폴리펩타이드의 응집을 나타낸다. 상 전이는 하한 임계 용액 온도(LCST) 또는 역 전이 온도(Tt)로 불리는 특정 온도에서 급격하게 그리고 가역적으로 일어난다. 전이 온도 미만에서, 열 반응성 폴리펩타이드(또는 열 반응성 폴리펩타이드를 포함하는 폴리펩타이드)는 매우 가용성이다. 전이 온도를 지나며 가열 시, 열 반응성 폴리펩타이드는 소수성으로 붕괴되고 응집하여, 별도의 겔-유사 상을 형성한다. "역 전이 사이클링"은 열 반응성 폴리펩타이드(또는 열 반응성 폴리펩타이드를 포함하는 폴리펩타이드)에 대한 단백질 정제 방법을 나타낸다. 단백질 정제 방법에는 가용상 및 불용상을 통해 용액을 사이클링하기 위해 열 반응성 폴리펩타이드의 가역적 상 전이 거동을 이용함으로써 오염물질을 제거하는 단계가 관여될 수 있다.
"치료" 또는 "치료하는"이란 질환으로부터 대상체의 보호를 나타내는 경우, 질환의 에방, 억제, 억압, 완화, 또는 완전 제거를 의미한다. 질환의 예방에는 질환의 개시 전에 대상체에 본 발명의 조성물을 투여하는 단계가 관여된다. 질환의 억제에는 질환의 유도 후에 그러나 그 임상적 출현 전에 대상체에 본 발명의 조성물을 투여하는 단계가 관여된다. 질환의 억압 또는 완화에는 질환의 임상적 출현 후에 대상체에 본 발명의 조성물을 투여하는 단계가 관여된다.
"실질적으로 동일한"은 첫 번째 및 두 번째 아미노산 서열이 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1100개 아미노산 영역에 걸쳐 적어도 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 또는 99%임을 나타낸다.
폴리뉴클레오타이드에 대해 본원에서 이용되는 "변이체"는 (i) 참조되는 뉴클레오타이드 서열의 일부 또는 단편; (ii) 참조되는 뉴클레오타이드 서열 또는 이의 일부의 상보체; (iii) 참조되는 폴리뉴클레오타이드 또는 이의 상보체와 실질적으로 동일한 폴리뉴클레오타이드; 또는 (iv) 참조되는 폴리뉴클레오타이드, 이의 상보체, 또는 이와 실질적으로 동일한 서열에 대해 엄격한 조건 하에 혼성화하는 폴리뉴클레오타이드를 의미한다.
"변이체"는 아미노산의 삽입, 결실 또는 보존적 치환에 의해 아미노산 서열이 상이하지만, 적어도 하나의 생물학적 활성을 보유하는 펩타이드 또는 폴리펩타이드로 추가 정의될 수 있다. "생물학적 활성"의 대표적 예에는 특정 항체 또는 폴리펩타이드에 의해 결합되거나 면역 반응을 촉진하는 능력이 포함된다. 변이체는 실질적으로 동일한 서열을 의미할 수 있다. 변이체는 이의 기능적 단편을 의미할 수 있다. 변이체는 또한 여러 카피의 폴리펩타이드를 의미할 수 있다. 여러 카피는 일렬로 있거나 링커에 의해 분리될 수 있다. 변이체는 또한 적어도 하나의 생물학적 활성을 보유하는 아미노산 서열을 갖는 참조되는 폴리펩타이드와 실질적으로 동일한 아미노산 서열을 갖는 폴리펩타이드를 의미할 수 있다. 아미노산의 보존적 치환, 즉 유사한 특성(예컨대, 친수성, 하전된 영역의 정도 및 분포)을 갖는 상이한 아미노산으로 아미노산의 대체는 당분야에서 전형적으로 소소한 변화가 관여되는 것으로 인식된다. 이러한 소소한 변화는 부분적으로, 아미노산의 수치(hydropathic) 지수를 고려하여 확인될 수 있다. 문헌[Kyte et al., J. Mol. Biol. 1982, 157, 105-132]를 참고한다. 아미노산의 수치 지수는 그 소수성 및 전하의 고려에 기반한다. 유사한 수치 지수의 아미노산이 치환되고 여전히 단백질 기능을 보유할 수 있음이 당분야에 공지되어 있다. 하나의 양태에서, ±2의 수치 지수를 갖는 아미노산이 치환된다. 아미노산의 소수성도 생물학적 기능을 보유하는 폴리펩타이드를 생성할 치환을 드러내기 위해 이용될 수 있다. 폴리펩타이드의 맥락에서 아미노산의 친수성 고려는 전체가 본원에 참조로 포함되는 U.S. 특허 번호 4,554,101에 논의된 바와 같이, 항원성 및 면역원성과 잘 연관되는 것으로 보고된 유용한 조치인, 해당 폴리펩타이드의 최대 국소 평균 친수성의 계산을 허용한다. 유사한 친수성값을 갖는 아미노산의 치환은 당분야에서 이해되는 바와 같이, 생물학적 활성, 예를 들어 면역원성을 보유하는 폴리펩타이드를 생성할 수 있다. 치환은 서로 ±2 내의 친수성값을 갖는 아미노산으로 수행될 수 있다. 아미노산의 소수성 지수 및 친수성값은 모두 해당 아미노산의 특정 측쇄에 의해 영향을 받는다. 이 관찰과 일치하게, 생물학적 기능과 상용성인 아미노산 치환은 소수성, 친수성, 전하, 크기, 및 다른 특성에 의해 드러나는, 아미노산의 상대적 유사성, 특히 아미노산의 측쇄에 의존하는 것으로 이해된다.
변이체는 전체 유전자 서열의 전장 또는 이의 단편에 걸쳐 실질적으로 동일한 폴리뉴클레오타이드 서열일 수 있다. 폴리뉴클레오타이드 서열은 유전자 서열의 전장 또는 이의 단편에 걸쳐 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 동일할 수 있다. 변이체는 아미노산 서열의 전장 또는 이의 단편에 걸쳐 실질적으로 동일한 아미노산 서열일 수 있다. 아미노산 서열은 아미노산 서열의 전장 또는 이의 단편에 걸쳐 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 동일할 수 있다.
"물 우리"는 분자를 둘러싸고 분자와 이온적으로 상호작용하는 물 분자를 나타낸다. 분자는, 예를 들어, 폴리펩타이드, ZiPP, 약물 분자, 또는 콘주게이트일 수 있다. 분자가, 예를 들어, 용액 중에 있는 경우, 분자는 물 우리가 그 주위에 형성되도록 주변 물 분자와 이온성 상호작용을 형성한다. 예를 들어, 폴리펩타이드의 양으로 및 음으로 하전된 아미노산은 용액 중 그 주위의 물 분자와 이온성 상호작용을 형성할 수 있다. 용액에는, 예를 들어, 대상체의 혈장 또는 혈액 또는 다른 체액이 포함될 수 있다. 이온성 상호작용은 수소 결합 또는 다른 분자간 인력보다 강하며, 교란되기 위해서는 더 많은 에너지가 필요하다. 일부 구현예에서, 물 우리는 분자(예를 들어, 폴리펩타이드, ZiPP, 약물 분자, 또는 콘주게이트)를 분해 또는 옵소닌화로부터 차폐할 수 있다. 물 우리는 분자에 스텔스 특성을 부여할 수 있다.
"쯔비터이온성" 또는 "쯔비터이온"은 전체 0의 전하를, 그러나 분자 내의 독립적인 개별 원자 상에 음전하 및 양전하를 포함하는 분자를 나타낸다. 하전된 원자는 하나 이상의 공유 결합에 의해 연결된다. 폴리펩타이드는 쯔비터이온성일 수 있다.
2. 콘주게이트
콘주게이트에는 폴리펩타이드 및 폴리펩타이드에 부착된 하나 이상의 약물 분자가 포함된다. 콘주게이트에는 적어도 하나의 링커가 추가로 포함될 수 있다. 콘주게이트는 약물 전달을 위해 고려되는 스텔스 중합체이다.
a.
폴리펩타이드
폴리펩타이드는 하나 이상의 하전된 모티프를 포함한다. 하전된 모티프에는 하나 이상의 양으로 하전된 아미노산 및 하나 이상의 음으로 하전된 아미노산이 포함되며, 여기서 양으로 하전된 아미노산 및 음으로 하전된 아미노산은 1:1의 비로 존재한다. 일부 구현예에서, 모티프의 전체 전하는 중성이다. 일부 구현예에서, 하전된 모티프는 쯔비터이온성 모티프이다. 하나의 모티프 내의 양으로 하전된 아미노산은 동일하거나 상이할 수 있다. 하나의 모티프 내의 음으로 하전된 아미노산은 동일하거나 상이할 수 있다. 본원에서 이용되는 아미노산의 (양 및/또는 음)전하는 아미노산 측쇄의 전하를 나타낸다. 하전된 아미노산은 중성 pH, 생리적 pH, 또는 단백질 폴딩 내의 국소 pH, 또는 이의 조합에서 양으로 및/또는 음으로 하전된다. 하전된 모티프에는 하나 이상의 하전되지 않은 아미노산이 추가로 포함될 수 있다. 일부 구현예에서, 하전된 모티프는 VPX1X2G(SEQ ID NO: 1)의 아미노산 서열로서, 식 중 X1은 음으로 또는 양으로 하전된 아미노산이며, X2는 음으로 또는 양으로 하전된 다른 아미노산인 서열을 갖는다. 하나 이상의 하전된 모티프를 포함하는 폴리펩타이드는 쯔비터이온성 폴리펩타이드(ZiPP)일 수 있다. ZiPP는 음전하를 갖는 아미노산 및 양전하를 갖는 아미노산이 모두 포함되는 전체 중성 폴리펩타이드이다.
일부 구현예에서, 폴리펩타이드는 복수의 하전된 모티프를 포함한다. 복수의 하전된 모티프는 반복될 수 있다. 일부 구현예에서, 폴리펩타이드는 (VPX1X2G)n(SEQ ID NO: 2)의 아미노산 서열로서, 식 중 X1은 음으로 또는 양으로 하전된 아미노산이며, X2는 음으로 또는 양으로 하전된 다른 아미노산이며, n은 1 이상의 정수인 서열을 포함한다. X1은 인접 모티프 간에 동일하거나 상이할 수 있다. X2는 인접 모티프 간에 동일하거나 상이할 수 있다. 일부 구현예에서, n은 약 100, 200, 300, 400, 또는 500 이하의 정수이다. 일부 구현예에서, n은 약 1, 10, 50, 100, 150, 또는 200 이상의 정수이다. 일부 구현예에서, n은 약 10 내지 약 500, 약 10 내지 약 200, 약 10 내지 약 100, 약 10 내지 약 50, 약 1 내지 약 500, 약 1 내지 약 200, 약 1 내지 약 100, 또는 약 1 내지 약 50의 정수이다. 일부 구현예에서, n은 약 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195, 200, 205, 210, 215, 220, 225, 230, 235, 240, 245, 250, 255, 260, 265, 270, 275, 280, 285, 290, 295, 300, 305, 310, 315, 320, 325, 330, 335, 340, 345, 350, 355, 360, 365, 370, 375, 380, 385, 390, 395, 400, 405, 410, 415, 420, 425, 430, 435, 440, 445, 450, 455, 460, 465, 470, 475, 480, 485, 490, 495, 또는 500의 정수이다. 일부 구현예에서, 아미노산 서열 (VPX1X2G)n(SEQ ID NO: 2)로서, 식 중 X1은 음으로 또는 양으로 하전된 아미노산이며, X2는 음으로 또는 양으로 하전된 다른 아미노산이며, n은 1 이상의 정수인 서열을 포함하는 폴리펩타이드는 단독중합체로 언급될 수 있다.
일부 구현예에서, 폴리펩타이드에는 하나 이상의 하전된 모티프에 부가하여 하나 이상의 하전되지 않은 모티프가 포함된다. 하전되지 않은 모티프에는 하전되지 않은 아미노산이 포함된다. 일부 구현예에서, 하전되지 않은 모티프에는 임의의 하전된 아미노산이 포함되지 않는다. 일부 구현예에서, 하전되지 않은 모티프는 VPGXG(SEQ ID NO: 3)로 구성되는 아미노산 서열로서, 식 중 X는 프롤린을 제외한 임의의 아미노산인 서열을 갖는다.
복수의 하전되지 않은 모티프는 일렬로 반복될 수 있다. 일부 구현예에서, 폴리펩타이드는 하나 이상의 하전된 모티프에 부가하여 (VPGXG)n(SEQ ID NO: 4)의 아미노산 서열로서, 식 중 X는 프롤린을 제외한 임의의 아미노산이고, n은 1 이상의 정수인 서열을 포함한다. 일부 구현예에서, n은 약 100, 200, 300, 400, 또는 500 이하의 정수이다. 일부 구현예에서, n은 약 1, 10, 50, 100, 150, 또는 200 이상의 정수이다. 일부 구현예에서, n은 약 10 내지 약 500, 약 10 내지 약 200, 약 10 내지 약 100, 약 10 내지 약 50, 약 1 내지 약 500, 약 1 내지 약 200, 약 1 내지 약 100, 또는 약 1 내지 약 50의 정수이다. 일부 구현예에서, n은 약 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195, 200, 205, 210, 215, 220, 225, 230, 235, 240, 245, 250, 255, 260, 265, 270, 275, 280, 285, 290, 295, 300, 305, 310, 315, 320, 325, 330, 335, 340, 345, 350, 355, 360, 365, 370, 375, 380, 385, 390, 395, 400, 405, 410, 415, 420, 425, 430, 435, 440, 445, 450, 455, 460, 465, 470, 475, 480, 485, 490, 495, 또는 500의 정수이다. 일부 구현예에서, 하나 이상의 하전된 모티프에 부가하여 (VPGXG)n(SEQ ID NO: 4)로 구성되는 아미노산 서열을 갖는 하전되지 않은 모티프를 포함하는 폴리펩타이드로서, 식 중 X는 프롤린을 제외한 임의의 아미노산이며, n은 1 이상의 정수인 폴리펩타이드는 엘라스틴-유사 폴리펩타이드(ELP)로 언급된다.
폴리펩타이드의 모티프는 임의의 수의 가능한 방식으로 배열될 수 있다. 가능한 배열 및 구조의 예를 도 1에 나타낸다. 도 1에서, 회색 블록은 양으로 하전된 아미노산을 표시하는 반면, 검은색 블록은 음으로 하전된 아미노산을 표시한다. 도 1a는 단독중합체의 일례를 나타내며, 여기서 각각의 단위는 펜타펩타이드 서열 VPX1X2G(SEQ ID NO: 1), 또는 하전된 모티프의 반복이다. 도 1d는 VPX1X2G(SEQ ID NO: 1)의 가능한 서열을 나타낸다. 도 1b는 디블록 중합체의 일례를 나타낸다. 디블록 구조에서, 중합체의 하나의 블록은 반복하는 하전된 모티프로 제조되는 반면, 다른 부분에는 반복하는 하전되지 않은 모티프가 포함된다. 도 1c는 멀티블록 중합체의 일례를 나타내며, 여기서 하전된 모티프 및 하전되지 않은 모티프는 상이한 부위에 배치되어 중합체의 다양성을 증가시킨다. 특정 수, 정체, 및 배열의 모티프가 최적 용매화 수준을 달성하고, 물 우리를 생성하고, 및/또는 자체 주위에 층을 생성하여 치료제 또는 약물 분자의 약동학 개선을 도울 수 있는 콘주게이트를 생성하도록 설계될 수 있다. 일부 구현예에서, 폴리펩타이드는 폴리펩타이드 또는 콘주게이트에 스텔스 특성을 부여하도록 배열된다. 일부 구현예에서, 하나 이상의 하전되지 않은 모티프는 폴리펩타이드의 적어도 2개의 인접한 하전된 모티프 사이에 배치된다. 일부 구현예에서, 폴리펩타이드에는 복수의 일렬로 반복된 하전된 모티프 및 복수의 일렬로 반복된 하전되지 않은 모티프가 포함된다. 일부 구현예에서, 복수의 일렬로 반복된 하전된 모티프는 복수의 일렬로 반복된 하전되지 않은 모티프에 C-말단에 배치된다. 일부 구현예에서, 복수의 일렬로 반복된 하전된 모티프는 복수의 일렬로 반복된 하전되지 않은 모티프에 N-말단에 배치된다.
일부 구현예에서, 폴리펩타이드는 (VPX1X2G)n(VPGXG)m(SEQ ID NO: 5)의 아미노산 서열로서, 식 중 X1은 음으로 또는 양으로 하전된 아미노산이고, X2는 음으로 또는 양으로 하전된 다른 아미노산이고, X는 프롤린을 제외한 임의의 아미노산이고, n 및 m은 독립적으로 1 이상의 정수인 서열을 포함한다. 일부 구현예에서, n은 약 100, 200, 300, 400, 또는 500 이하의 정수이다. 일부 구현예에서, n은 약 1, 10, 50, 100, 150, 또는 200 이상의 정수이다. 일부 구현예에서, n은 약 10 내지 약 500, 약 10 내지 약 200, 약 10 내지 약 100, 약 10 내지 약 50, 약 1 내지 약 500, 약 1 내지 약 200, 약 1 내지 약100, 또는 약 1 내지 약 50의 정수이다. 일부 구현예에서, n은 약 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195, 200, 205, 210, 215, 220, 225, 230, 235, 240, 245, 250, 255, 260, 265, 270, 275, 280, 285, 290, 295, 300, 305, 310, 315, 320, 325, 330, 335, 340, 345, 350, 355, 360, 365, 370, 375, 380, 385, 390, 395, 400, 405, 410, 415, 420, 425, 430, 435, 440, 445, 450, 455, 460, 465, 470, 475, 480, 485, 490, 495, 또는 500의 정수이다. 일부 구현예에서, m은 약 100, 200, 300, 400, 또는 500 이하의 정수이다. 일부 구현예에서, m은 약 1, 10, 50, 100, 150, 또는 200 이상의 정수이다. 일부 구현예에서, m은 약 10 내지 약 500, 약 10 내지 약 200, 약 10 내지 약100, 약 10 내지 약 50, 약 1 내지 약 500, 약 1 내지 약 200, 약 1 내지 약 100, 또는 약 1 내지 약 50의 정수이다. 일부 구현예에서, m은 약 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195, 200, 205, 210, 215, 220, 225, 230, 235, 240, 245, 250, 255, 260, 265, 270, 275, 280, 285, 290, 295, 300, 305, 310, 315, 320, 325, 330, 335, 340, 345, 350, 355, 360, 365, 370, 375, 380, 385, 390, 395, 400, 405, 410, 415, 420, 425, 430, 435, 440, 445, 450, 455, 460, 465, 470, 475, 480, 485, 490, 495, 또는 500의 정수이다. 일부 구현예에서, (VPX1X2G)n(VPGXG)m(SEQ ID NO: 5)의 아미노산 서열을 포함하는 폴리펩타이드로서, 식 중 X1은 음으로 또는 양으로 하전된 아미노산이며, X2는 음으로 또는 양으로 하전된 다른 아미노산이고, X는 프롤린을 제외한 임의의 아미노산이고, n 및 m은 독립적으로 1 이상의 정수인 폴리펩타이드는 디블록 중합체로 언급될 수 있다.
일부 구현예에서, 폴리펩타이드는 (VPGXG)m(VPX1X2G)n(SEQ ID NO: 6)의 아미노산 서열로서, 식 중 X1은 음으로 또는 양으로 하전된 아미노산이고, X2는 음으로 또는 양으로 하전된 다른 아미노산이고, X는 프롤린을 제외한 임의의 아미노산이고, n 및 m은 독립적으로 1 이상의 정수인 서열을 포함한다. 일부 구현예에서, n은 약 100, 200, 300, 400, 또는 500 이하의 정수이다. 일부 구현예에서, n은 약 1, 10, 50, 100, 150, 또는 200 이상의 정수이다. 일부 구현예에서, n은 약 10 내지 약 500, 약 10 내지 약 200, 약 10 내지 약 100, 약 10 내지 약 50, 약 1 내지 약 500, 약 1 내지 약 200, 약 1 내지 약100, 또는 약 1 내지 약 50의 정수이다. 일부 구현예에서, n은 약 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195, 200, 205, 210, 215, 220, 225, 230, 235, 240, 245, 250, 255, 260, 265, 270, 275, 280, 285, 290, 295, 300, 305, 310, 315, 320, 325, 330, 335, 340, 345, 350, 355, 360, 365, 370, 375, 380, 385, 390, 395, 400, 405, 410, 415, 420, 425, 430, 435, 440, 445, 450, 455, 460, 465, 470, 475, 480, 485, 490, 495, 또는 500의 정수이다. 일부 구현예에서, m은 약 100, 200, 300, 400, 또는 500 이하의 정수이다. 일부 구현예에서, m은 약 1, 10, 50, 100, 150, 또는 200 이상의 정수이다. 일부 구현예에서, m은 약 10 내지 약 500, 약 10 내지 약 200, 약 10 내지 약100, 약 10 내지 약 50, 약 1 내지 약 500, 약 1 내지 약 200, 약 1 내지 약 100, 또는 약 1 내지 약 50의 정수이다. 일부 구현예에서, m은 약 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195, 200, 205, 210, 215, 220, 225, 230, 235, 240, 245, 250, 255, 260, 265, 270, 275, 280, 285, 290, 295, 300, 305, 310, 315, 320, 325, 330, 335, 340, 345, 350, 355, 360, 365, 370, 375, 380, 385, 390, 395, 400, 405, 410, 415, 420, 425, 430, 435, 440, 445, 450, 455, 460, 465, 470, 475, 480, 485, 490, 495, 또는 500의 정수이다. 일부 구현예에서, (VPGXG)m(VPX1X2G)n(SEQ ID NO: 6)의 아미노산 서열을 포함하는 폴리펩타이드로서, 식 중 X1은 음으로 또는 양으로 하전된 아미노산이고, X2는 음으로 또는 양으로 하전된 다른 아미노산이며, X는 프롤린을 제외한 임의의 아미노산이고, n 및 m은 독립적으로 1 이상의 정수인 폴리펩타이드는 디블록 중합체로 언급될 수 있다.
일부 구현예에서, 폴리펩타이드는 {(VPX1X2G)(VPGXG)}b(SEQ ID NO: 7)의 아미노산 서열로서, 식 중 X1은 음으로 또는 양으로 하전된 아미노산이며, X2는 음으로 또는 양으로 하전된 다른 아미노산이며, X는 프롤린을 제외한 임의의 아미노산이고, b는 1 이상의 정수인 서열을 포함한다. 일부 구현예에서, b는 약 100, 200, 또는 300 이하의 정수이다. 일부 구현예에서, b는 약 1, 10, 50, 100, 150, 또는 200 이상의 정수이다. 일부 구현예에서, b는 약 10 내지 약 300, 약 10 내지 약 200, 약 10 내지 약 100, 약 10 내지 약 50, 약 1 내지 약 300, 약 1 내지 약 200, 약 1 내지 약 100, 또는 약 1 내지 약 50의 정수이다. 일부 구현예에서, b는 약 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195, 200, 205, 210, 215, 220, 225, 230, 235, 240, 245, 250, 255, 260, 265, 270, 275, 280, 285, 290, 295, 또는 300의 정수이다. 일부 구현예에서, {(VPX1X2G)(VPGXG)}b(SEQ ID NO: 7)의 아미노산 서열을 포함하는 폴리펩타이드로서, 식 중 X1은 음으로 또는 양으로 하전된 아미노산이며, X2는 음으로 또는 양으로 하전된 다른 아미노산이며, X는 프롤린을 제외한 임의의 아미노산이고, b는 1 이상의 정수인 폴리펩타이드는 멀티블록 중합체로 언급될 수 있다.
일부 구현예에서, X1은 음으로 하전된 아미노산이고, X2는 양으로 하전된 아미노산이다. 일부 구현예에서, X1은 양으로 하전된 아미노산이고, X2는 음으로 하전된 아미노산이다. 일부 구현예에서, 음으로 하전된 아미노산은 독립적으로 글루타메이트산 및 아스파르트산으로부터 선택된다. 일부 구현예에서, 양으로 하전된 아미노산은 독립적으로 라이신 및 아르기닌으로부터 선택된다. 일부 구현예에서, X는 아르기닌, 히스티딘, 라이신, 아스파르트산, 글루탐산, 세린, 트레오닌, 아스파라긴, 글루타민, 시스테인, 셀레노시스테인, 글리신, 알라닌, 발린, 류신, 이소류신, 메티오닌, 페닐알라닌, 티로신, 및 트립토판으로부터 선택된다. 일부 구현예에서, X는 글리신 및 발린으로부터 선택된다.
일부 구현예에서, 폴리펩타이드는 온도-감수성이며, 이는 또한 열 반응성으로 언급될 수 있다. 열 반응성 폴리펩타이드는 상 전이를 가질 수 있다. 열 반응성 폴리펩타이드는 폴리펩타이드 및/또는 콘주게이트에 상 전이 특징을 부여할 수 있다. 상 전이는 하한 임계 용액 온도(LCST) 또는 역 전이 온도(Tt)로 불리는 특정 온도에서 급격하게 그리고 가역적으로 일어난다. "상 전이" 또는 "전이"는 또한 열 반응성 폴리펩타이드의 응집을 나타낼 수 있다. 전이 온도(LCST 또는 Tt) 미만에서, 열 반응성 폴리펩타이드(또는 열 반응성 폴리펩타이드를 포함하는 폴리펩타이드)는 매우 가용성일 수 있다. 전이 온도를 초과하며 가열 시, 열 반응성 폴리펩타이드는 소수성으로 붕괴되고 응집하여, 별도의 겔-유사 상 또는 불용성 소수성 응집물을 형성할 수 있다. 폴리펩타이드의 열 반응성 특성은 "역 전이 사이클링으로 불리는 방법에 따라 폴리펩타이드 및/또는 콘주게이트의 정제에서 이용될 수 있다. 상 전이는 또한 예를 들어, 암모늄 설페이트와 같은 코스모트로픽(kosmotropic) 염을 이용해서 유발될 수 있다. 예를 들어, 나트륨 클로라이드가 코스모트로픽 염과 함께 이용될 수 있다. 코스모트로픽 염은 폴리펩타이드 및/또는 콘주게이트를 포함하는 용액에 첨가될 수 있고, 코스모트로픽 염은 폴리펩타이드 및/또는 콘주게이트가 응집물을 형성하거나 용액에서 침전되어 나올 때까지 첨가된다. 응집물은 원심분리에 의해 펠렛화되고 제2 용액 또는 완충액 중에 재현탁될 수 있다. 폴리펩타이드 및/또는 콘주게이트의 응집물은 이의 Tt 미만으로 냉각되면 또는 코스모트로픽 염이 용액으로부터 제거되면 용액 내로 재용해될 수 있다. 일부 구현예에서, 콘주게이트는 임의의 크로마토그래피 정제 없이 정제된다. 일부 구현예에서, 콘주게이트는 재조합적으로 생성되고 박테리아 배양, 예컨대 대장균으로부터 정제된다.
b.
약물 분자
콘주게이트에는 하나 이상의 약물 분자가 포함될 수 있다. 약물 분자는 치료제일 수 있다. 일부 구현예에서, 약물 분자는 소분자, 뉴클레오타이드, 폴리뉴클레오타이드, 단백질, 폴리펩타이드, 탄수화물, 및 이의 조합으로부터 선택된다. 일부 구현예에서, 약물 분자는 소분자를 포함한다. 일부 구현예에서, 약물 분자는 단백질을 포함한다. 일부 구현예에서, 약물 분자는 암 치료제를 포함한다. 일부 구현예에서, 약물 분자는 항체를 포함한다. 일부 구현예에서, 약물 분자는 Tn3(TRAIL 수퍼작용제)을 포함한다. 일부 구현예에서, 약물 분자는 콘주게이트의 폴리펩타이드의 시스테인에 부착된다.
콘주게이트에는 1, 2, 3, 4, 5, 6, 7, 8, 9, 또는 10개의 약물 분자가 포함될 수 있다. 콘주게이트에는 적어도 1개, 적어도 2개, 또는 적어도 약 3개의 약물 분자가 포함될 수 있다. 콘주게이트에는 약 10개 미만, 약 8개 미만, 또는 약 5개 미만의 약물 분자가 포함될 수 있다. 일부 구현예에서, 콘주게이트에는 1개의 약물 분자가 포함된다. 일부 구현예에서, 콘주게이트에는 콘주게이트의 폴리펩타이드 당 1개의 약물 분자가 포함된다. 일부 구현예에서, 콘주게이트에는 1~10개의 약물 분자가 포함된다. 일부 구현예에서, 콘주게이트에는 2~5개의 약물 분자가 포함된다.
c.
링커
일부 구현예에서, 콘주게이트에는 적어도 하나의 링커가 추가로 포함된다. 일부 구현예에서, 콘주게이트에는 하나를 초과하는 링커가 포함된다. 이러한 구현예에서, 링커는 서로 동일하거나 상이할 수 있다. 콘주게이트에는 적어도 1개, 적어도 2개, 적어도 3개, 적어도 4개, 적어도 5개, 적어도 6개, 적어도 7개, 적어도 8개, 적어도 9개, 또는 적어도 10개의 링커가 포함될 수 있다. 콘주게이트에는 20개 미만, 15개 미만, 10개 미만, 또는 5개 미만의 링커가 포함될 수 있다. 콘주게이트에는 1 내지 20개, 5 내지 15개, 또는 1 내지 5개 링커가 포함될 수 있다. 링커는 폴리펩타이드의 C-말단, 폴리펩타이드의 N-말단, 또는 폴리펩타이드의 N-말단 및 C-말단 모두에 배치될 수 있다. 일부 구현예에서, 링커는 폴리펩타이드 서열 내의 임의의 위치에 배치될 수 있다. 여러 링커가 서로 인접해서 배치될 수 있다.
링커는 임의의 아미노산 서열 및 길이의 폴리펩타이드일 수 있다. 링커는 스페이서 펩타이드로서 작용할 수 있다. 일부 구현예에서, 링커는 하전된 아미노산을 포함한다. 일부 구현예에서, 링커는 하전되지 않은 아미노산을 포함한다. 일부 구현예에서, 링커는 가요성이다. 일부 구현예에서, 링커는 하나 이상의 시스테인을 포함한다. 일부 구현예에서, 링커는 SEQ ID NO: 8(GGC), SEQ ID NO: 9((GGC)8), SEQ ID NO: 10((G4S)3), 및 SEQ ID NO: 11((VPGXG)16, 식 중 X는 1:1의 비로 존재하는 발린 또는 시스테인임)로부터 선택되는 아미노산 서열을 포함한다.
링커는 폴리펩타이드에 대한 약물 분자를 위한 부착 부위로서 작용할 수 있다. 약물 분자는 당분야에 공지된 임의의 적합한 수단에 의해 링커에 부착될 수 있다. 약물 분자는 티올 반응성 연결기를 통해 링커에 부착될 수 있다. 일부 구현예에서, 하나 이상의 약물 분자는 링커를 통해 폴리펩타이드에 부착된다. 일부 구현예에서, 약물 분자는 링커 내 티올 반응기를 통해 폴리펩타이드에 부착된다.
3.
폴리뉴클레오타이드
본원에 상세히 기재된 콘주게이트를 인코딩하는 폴리뉴클레오타이드가 추가로 제공된다. 벡터에는 본원에 상세히 기재된 콘주게이트를 인코딩하는 폴리뉴클레오타이드가 포함될 수 있다. 폴리펩타이드의 발현을 수득하기 위해, 전사를 지시하는 프로모터, 전사/번역 종결자, 그리고 단백질을 인코딩하는 핵산의 경우, 번역 개시를 위한 리보솜 결합 부위를 함유하는 발현 벡터 내로 폴리펩타이드를 인코딩하는 폴리뉴클레오타이드를 서브클로닝할 수 있다. 벡터의 일례는 pet24이다. 적합한 박테리아 프로모터는 당분야에 널리 공지되어 있다. 본원에 상세히 기재된 바와 같은 콘주게이트를 인코딩하는 폴리뉴클레오타이드를 포함하는 발현 벡터로 형질전환되거나 전달감염된 숙주 세포가 추가로 제공된다. 단백질을 발현하기 위한 박테리아 발현 시스템은, 예컨대 대장균(E. coli), 고초균(Bacillus sp .), 및 살모넬라(Salmonella)에서 이용 가능하다(Paiva et al., Gene 1983, 22, 229-235; Mosbach et al., Nature 1983, 302, 543-545). 이러한 발현 시스템을 위한 키트가 상업적으로 이용 가능하다. 포유류 세포, 효모, 및 곤충 세포를 위한 진핵생물 발현 시스템이 당분야에 널리 공지되어 있고, 또한 상업적으로 이용 가능하다. 레트로바이러스 발현 시스템이 본 발명에서 이용될 수 있다. 일부 구현예에서, 콘주게이트는 SEQ ID NO: 12의 아미노산 서열을 포함하는 폴리펩타이드를 포함한다. 일부 구현예에서, 콘주게이트는 SEQ ID NO: 13의 폴리뉴클레오타이드 서열에 의해 인코딩되는 폴리펩타이드를 포함한다.
콘주게이트는 당업자에 따라 숙주 세포에서 재조합적으로 발현될 수 있다. 콘주게이트는 당업자에게 공지된 임의의 수단에 의해 정제될 수 있다. 예를 들어, 콘주게이트는 크로마토그래피, 예컨대 액체 크로마토그래피, 크기 배제 크로마토그래피, 또는 친화도 크로마토그래피, 또는 이의 조합을 이용해서 정제될 수 있다. 일부 구현예에서, 콘주게이트는 크로마토그래피 없이 정제된다. 일부 구현예에서, 콘주게이트는 역 전이 사이클링을 이용해서 정제된다.
4.
투여
조성물은 콘주게이트를 포함할 수 있다. 상기에 상세히 기재된 바와 같은 콘주게이트는 약학 분야의 당업자에게 널리 공지된 표준 기법에 따라 조성물로 제형화될 수 있다. 조성물은 대상체에 대한 투여를 위해 제조될 수 있다. 콘주게이트를 포함하는 이러한 조성물은 특정 대상체의 연령, 성별, 체중 및 상태, 그리고 투여 경로와 같은 요인을 고려하여 의학 분야의 당업자에게 널리 공지된 투여량으로 및 기법에 의해 투여될 수 있다.
콘주게이트는 예방적으로 또는 치료적으로 투여될 수 있다. 예방적 투여에서, 콘주게이트는 반응을 유도하기 충분한 양으로 투여될 수 있다. 치료적 적용에서, 콘주게이트는 치료 효과를 야기하기 충분한 양으로 이를 필요로 하는 대상체에 투여된다. 이를 달성하기 적절한 양이 "치료적 유효 용량"으로 정의된다. 상기 이용을 위해 효과적인 양은, 예컨대, 투여되는 콘주게이트 요법의 특정 조성물, 투여 방식, 질환의 단계 및 중증도, 환자의 일반 건강 상태, 및 처방의의 판단에 의존할 것이다.
콘주게이트는 문헌[Donnelly 등(Ann. Rev. Immunol . 1997, 15, 617-648); Felgner 등(U.S. 특허 번호 5,580,859, 1996년 12월 3일에 허여됨); Felgner(U.S. 특허 번호 5,703,055, 1997년 12월 30일에 허여됨); 및 Carson 등(U.S. 특허 번호 5,679,647, 1997년 10월 21일에 허여됨)에 기재된 바와 같이 당분야에 널리 공지된 방법에 의해 투여될 수 있으며, 그 전체 내용은 이의 전문이 본원에 참조로 포함된다. 콘주게이트는, 예를 들어, 백신 건을 이용해서, 개체에 투여될 수 있는 입자 또는 비드에 복합화될 수 있다. 당업자는 생리적으로 허용 가능한 화합물을 포함하는 약학적으로 허용 가능한 담체의 선택이, 예를 들어, 투여 경로에 의존함을 인지할 것이다.
콘주게이트는 다양한 경로를 통해 전달될 수 있다. 전형적인 전달 경로에는 비경구 투여, 예컨대, 피내, 근육내 또는 피하 전달이 포함된다. 다른 경로에는 경구 투여, 비강내, 질내, 경피, 정맥내, 동맥내, 종양내, 복강내, 및 표피 경로가 포함된다. 일부 구현예에서, 콘주게이트는 대상체에 정맥내, 동맥내, 또는 복강내 투여된다.
콘주게이트는 액체 조제물, 예컨대 현탁액, 시럽, 또는 엘릭서일 수 있다. 콘주게이트는 리포좀, 마이크로스피어, 또는 다른 중합체 매트릭스 내에 포함될 수 있다(예컨대, 그 내용의 전문이 본원에 참조로 포함되는 문헌[Felgner et al., U.S. 특허 번호 5,703,055; Gregoriadis, Liposome Technology, Vols. I to III (2nd ed. 1993)]에 기재된 방법에 의해). 리포좀은 인지질 또는 다른 지질로 구성될 수 있으며, 제조하고 투여하기가 비교적 단순한 무독성의, 생리적으로 허용 가능하고 대사 가능한 담체일 수 있다.
콘주게이트는 백신으로 이용될 수 있다. 백신은 전기천공을 통해, 예컨대 그 내용이 본원에 참조로 포함되는 U.S. 특허 번호 7,664,545에 기재된 방법에 의해 투여될 수 있다. 전기천공은 그 내용의 전문이 본원에 참조로 포함되는 U.S. 특허 번호 6,302,874; 5,676,646; 6,241,701; 6,233,482; 6,216,034; 6,208,893; 6,192,270; 6,181,964; 6,150,148; 6,120,493; 6,096,020; 6,068,650; 및 5,702,359에 기재된 방법 및/또는 장치에 의할 수 있다. 전기천공은 최소 침습적 장치를 통해 수행될 수 있다.
일부 구현예에서, 콘주게이트는 제어 방출 제형으로 투여된다. 콘주게이트는, 예를 들어, 순환 또는 종양 내로 방출될 수 있다. 일부 구현예에서, 콘주게이트는 적어도 약 1일, 적어도 약 2일, 적어도 약 3일, 적어도 약 4일, 적어도 약 5일, 적어도 약 6일, 적어도 약 7일, 적어도 약 1주, 적어도 약 1.5주, 적어도 약 2주, 적어도 약 2.5주, 적어도 약 3.5주, 적어도 약 4주, 또는 적어도 약 1개월의 기간에 걸쳐 방출될 수 있다.
5.
검출
본원에서 이용되는 "검출하다" 또는 "존재를 결정하다"라는 용어는 표적에 결합된 하나 이상의 콘주게이트의 검출 불가능한, 낮은, 정상, 또는 높은 농도의 정성적 측정을 나타낸다. 일부 구현예에서, 표적은 바이오마커일 수 있다. 검출에는 시험관내, 생체외, 또는 생체내 검출이 포함될 수 있다. 검출에는 하나 이상의 콘주게이트 또는 표적의 부재 대비 하나 이상의 콘주게이트 또는 표적 존재의 검출이 포함될 수 있다. 검출에는 또한 하나 이상의 콘주게이트 또는 표적 수준 정량이 포함될 수 있다. "정량하다" 또는 "정량"이라는 용어는 상호 교환적으로 이용될 수 있고, 상대적이건 절대적이건, 물질(예컨대, 콘주게이트 또는 표적)의 양 또는 풍부도의 결정 방법을 나타낼 수 있다. 임의의 적합한 검출 방법이 본 개시의 일반 범위 내에 속한다. 일부 구현예에서, 콘주게이트는 검출을 위해 이에 부착된 리포터를 포함한다. 일부 구현예에서, 콘주게이트는 리포터로 표지된다. 일부 구현예에서, 표적에 결합된 콘주게이트의 검출은 비제한적으로 웨스턴 블롯 상의 밴드 세기, 유세포 측정, 방사선 표지 조영, 세포 결합 검정, 활성 검정, SPR, 면역검정, 또는 당분야에 공지된 다양한 다른 방법을 포함하는 방법에 의해 결정될 수 있다.
콘주게이트가 표적 결합 및/또는 검출을 위한 항체를 포함하는 경우를 포함하는 일부 구현예에서, 임의의 면역검정이 이용될 수 있다. 면역검정은, 예를 들어, 효소-연관 면역검정(ELISA), 방사선면역검정(RIA), 경쟁적 억제 검정, 예컨대 전방 또는 후방 경쟁적 억제 검정, 형광 분극 검정, 또는 경쟁적 결합 검정일 수 있다. ELISA는 샌드위치 ELISA일 수 있다. 표적에 대한 콘주게이트의 특이적인 면역학적 결합은 콘주게이트에 부착된 직접적 표지를 통해 또는 간접적 표지, 예컨대 알칼리성 포스파타제 또는 홀스래디쉬 퍼옥시다제를 통해 검출될 수 있다. 고정화된 콘주게이트의 이용이 면역검정 내로 포함될 수 있다. 콘주게이트는 다양한 지지체, 예컨대 자기 또는 크로마토그래피 매트릭스 입자, 검정 플레이트(예컨대 마이크로타이터 웰)의 표면, 고체 기재 물질의 절편 등 상에 고정화될 수 있다. 검정 스트립은 고체 지지체 상에 어레이로 콘주게이트 또는 복수의 콘주게이트를 코팅하여 제조될 수 있다. 이어서 상기 스트립은 평가 생물학적 샘플 내로 딥핑된 후 세척 및 검출 단계를 통해 신속히 처리되어 측정 가능한 신호, 예컨대 유색 스팟을 생성할 수 있다.
6. 방법
a. 약물 분자의 전달 방법
본 발명은 대상체에 대한 약물 분자의 전달 방법에 대한 것이다. 방법에는 대상체에 본원에 기재된 바와 같은 콘주게이트를 투여하는 단계가 포함될 수 있다. 일부 구현예에서, 콘주게이트는 약물 분자 단독 또는 합성 중합체, 예컨대 폴리에틸렌 글리콜(PEG)에 콘주게이션된 약물 분자에 비해 개선된 특성을 가지며, 개선된 특성은, 예를 들어, 스텔스, 생체적합성, 용해도, 안정성, 반감기, 혈장 중 체류, 항원성, 면역원성, 단분산, 또는 이의 조합으로부터 선택된다. 일부 구현예에서, 콘주게이트는 용이하게 합성된다. 일부 구현예에서, 콘주게이트는 용이하게 정제된다. 일부 구현예에서, 용이한 합성 및/또는 정제는 콘주게이트의 개선된 비용-효율성으로 이어질 수 있다. 일부 구현예에서, 콘주게이트, 또는 이의 폴리펩타이드는 유전적으로 인코딩되며, 이에 의해 정확한 분자량을 갖는 콘주게이트의 설계를 촉진한다. 일부 구현예에서, 콘주게이트의 분자량은 그 생체내 반감기를 결정하고/하거나 영향을 미친다. 콘주게이트의 분자량을 용이하고 정확하게 제어할 수 있는 것은 콘주게이트의 생체내 반감기 제어를 촉진할 수 있다. 대비되어, 합성 중합체, 예컨대 PEG의 분자량은 제어하기가 용이하지 않을 수 있다. 일부 구현예에서, 콘주게이트는 합성 중합체, 예컨대 폴리에틸렌 글리콜(PEG)에 콘주게이션된 약물 분자에 비해 감소된 항원성을 갖는다. 일부 구현예에서, 콘주게이트는 합성 중합체, 예컨대 폴리에틸렌 글리콜(PEG)에 콘주게이션된 약물 분자에 비해 감소된 면역원성을 갖는다.
b.
질환의 치료 방법
본 발명은 이를 필요로 하는 대상체에서 질환의 치료 방법에 대한 것이다. 방법은 본원에 기재된 바와 같은 콘주게이트의 유효량을 대상체에 투여하는 단계를 포함할 수 있다. 질환은, 예를 들어, 암, 대사 질환, 자가면역 질환, 심혈관 질환, 또는 정형외과 장애일 수 있다.
대사 질환은 체내의 비정상적 화학 반응이 정상 대사 과정을 변형시키는 경우 일어날 수 있다. 대사 질환에는, 예를 들어, 인슐린 내성, 비-알코올성 지방간 질환, 2형 당뇨병, 인슐린 내성 질환, 심혈관 질환, 죽상경화, 지질-관련 대사 장애, 고혈당증, 고인슐린혈증, 고지혈증, 및 글루코스 대사 장애가 포함될 수 있다.
자가면역 질환은 체내에 정상적으로 존재하는 물질 및 조직에 대한 신체의 비정상적 면역 반응으로부터 생긴다. 자가면역 질환에는, 비제한적으로, 루푸스, 류마티스성 관절염, 다발성 경화증, 인슐린 의존성 당뇨병, 중증 근무력증, 그레이브스병, 자가면역 용혈성 빈혈, 자가면역 혈소판감소성 자반증, 굿파스처 증후군, 보통 천포창, 급성 류마티스열, 연쇄구균 감염 후 사구체신염, 결절다발 동맥염, 심근염, 건선, 셀리악병, 크론병, 궤양성 장염, 및 섬유근통이 포함될 수 있다.
심혈관 질환은 심장 또는 혈관이 관여되는 질환 클래스이다. 심혈관 질환에는, 예를 들어, 관상 동맥 질환(CAD), 예컨대 협심증 및 심근경색(심장 마비), 뇌졸중, 고혈압성 심장병, 류마티스성 심장병, 심근병증, 심장 부정맥, 선천성 심장병, 판막성 심장병, 심장염, 대동맥류, 말초 동맥 질환, 및 정맥 혈전증이 포함될 수 있다.
정형외과 장애 또는 근골격 장애는 신체 관절, 인대, 근육, 신경, 힘줄, 및 사지, 목, 및 등을 지지하는 구조에서의 부상 또는 통증이다. 정형외과 장애에는 통증을 유발하고 정상 활동을 손상시키는 변성 질환 및 염증성 상태가 포함될 수 있다. 정형외과 장애에는, 예를 들어, 손목 터널 증후군, 위관절융기염, 및 힘줄염이 포함될 수 있다.
암에는 비제한적으로 유방암, 결장직장암, 결장암, 폐암, 전립선암, 고환암, 뇌암, 피부암, 직장암, 위암, 식도암, 육종, 기관암, 두부경부암, 췌장암, 간암, 난소암, 림프모양 암, 자궁경부암, 외음부암, 흑색종, 중피종, 신장암, 방광암, 갑상선암, 뼈암, 암종, 육종, 및 연조직암이 포함될 수 있다. 일부 구현예에서, 암은 유방암이다.
c.
질환의 진단 방법
질환의 진단 방법이 본원에서 제공된다. 방법에는 본원에 기재된 바와 같은 콘주게이트를 대상체에 투여하는 단계, 및 표적에 대한 콘주게이트의 결합을 검출하여 대상체에서 표적의 존재를 결정하는 단계가 포함될 수 있다. 표적의 존재 또는 부재는 대상체에서 질환을 시사할 수 있다. 다른 구현예에서, 방법에는 대상체로부터의 샘플을 본원에 기재된 바와 같은 콘주게이트와 접촉시키는 단계, 샘플 내 표적 수준을 결정하는 단계, 및 샘플 내 표적 수준을 표적의 대조군 수준과 비교하는 단계가 포함될 수 있고, 대조군 수준과 상이한 표적 수준은 대상체에서 질환을 시사한다. 일부 구현예에서, 대조군 미만인 표적의 검출된 수준은 질환을 시사할 수 있다. 일부 구현예에서, 대조군 초과인 표적의 검출된 수준은 질환을 시사할 수 있다. 일부 구현예에서, 질환은 상기에 상세히 기재된 바와 같이 암, 대사 질환, 자가면역 질환, 심혈관 질환, 및 정형외과 장애로부터 선택된다. 일부 구현예에서, 표적은 질환 마커 또는 바이오마커를 포함한다.
d.
표적 존재의 결정 방법
샘플 내 표적 존재의 결정 방법이 본원에서 제공된다. 방법에는 콘주게이트 및 샘플 내 표적 간에 복합체가 형성될 수 있도록 하는 조건 하에 샘플을 본원에 기재된 바와 같은 콘주게이트와 접촉시키는 단계, 및 복합체의 존재를 검출하는 단계가 포함될 수 있다. 복합체의 존재는 샘플 내 표적을 시사할 수 있다. 표적은, 예를 들어, 단백질 또는 핵산일 수 있다. 단백질은, 예를 들어, 수용체 또는 항원일 수 있다. 항원은, 예를 들어, 질환과 연관될 수 있다. 일부 구현예에서, 표적은 바이오마커를 포함한다. 일부 구현예에서, 콘주게이트는 검출을 위한 리포터로 표지된다.
일부 구현예에서, 샘플은 대상체로부터 수득되며, 방법에는 대상체의 치료 유효성을 진단하는 단계, 예진하는 단계, 또는 평가하는 단계가 추가로 포함된다. 방법에 대상체의 치료 유효성을 평가하는 단계가 포함되는 경우, 방법에는 유효성을 개선하기 위해 필요에 따라 대상체의 치료를 변경하는 단계가 추가로 포함될 수 있다.
e.
치료 효과의 결정 방법
이를 필요로 하는 대상체에서 질환에 대한 치료 효과의 결정 방법이 본원에서 제공된다. 방법에는 콘주게이트 및 샘플 내 표적 간에 복합체가 형성될 수 있도록 하는 조건 하에 대상체로부터의 샘플을 본원에 상세히 기재된 바와 같은 콘주게이트와 접촉시키는 단계, 샘플 내 복합체 수준을 결정하는 단계로서, 복합체 수준은 샘플 내 표적 수준을 시사하는 단계, 및 샘플 내 표적 수준을 표적의 대조군 수준과 비교하는 단계가 포함될 수 있고, 표적 수준이 대조군 수준과 상이한 경우, 치료는 질환 치료에서 효과적이거나 비효과적인 것으로 결정된다.
시점에는 질환의 개시 전, 치료법의 투여 전, 치료법 투여 동안의 다양한 시점, 및 치료법이 종결된 후, 또는 이의 조합이 포함될 수 있다. 대상체에 대한 콘주게이트의 투여 시, 콘주게이트는 표적에 결합할 수 있고, 표적의 존재 또는 부재는 다양한 시점에 대상체에서 질환의 존재를 시사한다. 일부 구현예에서, 표적은 질환 마커 또는 바이오마커를 포함한다. 다양한 시점에 표적에 대한 콘주게이트의 결합 비교는 질환이 진행했는지, 질환 단계가 진행했는지, 치료법이 질환을 치료하거나 예방하기 위해 작용하고 있는지, 또는 이의 조합을 시사할 수 있다.
일부 구현예에서, 대조군 수준은 대상체가 치료를 시작한 기간 이전 또는 동안의 시점에 대상체에서의 수준에 해당하며, 샘플은 이후 시점에 대상체로부터 취해진다. 일부 구현예에서, 샘플은 대상체가 치료를 받고 있는 기간 동안의 시점에 대상체로부터 취해지며, 대조군 수준은 무질환 수준 또는 대상체가 치료를 시작한 기간 이전 시점에서의 수준에 해당한다. 일부 구현예에서, 방법에는 치료가 질환 치료에 비효과적인 것으로 결정되는 경우 대상체에 대한 치료를 변경하는 단계 또는 상이한 치료를 투여하는 단계가 추가로 포함된다.
7.
실시예
실시예
1
물질 및 방법
클로닝 . ZiPP에 대한 합성 유전자를 화학적으로 합성된 올리고머로부터 어셈블리하였다(IDT Inc.; Coralville, IA). 올리고머를 플라스미드 재구성 재귀적 방향성 결찰(Pre-RDL) 기법(McDaniel, J.R., et al. Biomacromolecules, 2010, 11, 944-952)을 이용하여 대장균에서 pET 발현 벡터 내로 클로닝하였다.
역 전이 사이클링(ITC)에 의한 ZiPP의 발현 및 정제. ZiPP를 대장균에서 pET 발현 벡터로부터 발현시켰다. 수용액 중의 모든 ZiPP는 가역적인 역상 전이를 나타낸다. 이들은 이의 전이 온도(Tt)를 초과하여 가열되는 경우, 가용성 단백질에서 불용성 소수성 응집물로 진행한다. 동일한 현상(상 분리)이 또한 코스모트로픽 염을 이용하여 유발될 수 있다. ZiPP의 응집물은 이의 Tt 미만으로 냉각되면 또는 염이 용액으로부터 제거되는 경우 용액 내로 재용해시킬 수 있다. ZiPP의 이러한 열 반응성 특성은 단백질 정제를 위해 단순한 비-크로마토그래피 방법을 가능케 한다. 상기 정제 방법은 "역 전이 사이클링"(ITC)으로 불린다(Meyer, D.E. and A. Chilkoti. Nat. Biotech. 1999, 17, 1112-1115; MacEwan, S.R., et al. J. Vis . Exp. 2014, 88, e51583).
ITC에 의한 ZiPP의 전형적 정제에서, 1 L 배양물로부터의 대장균 세포를 원심분리에 의해 회수하고 저온 PBS 중에 재현탁한다. 이어서 세포를 4℃에서 초음파 분쇄에 의해 용해시킨다. 그 뒤 대장균 용해물을 15,000xg에서 원심분리하여 세포벽 및 다른 세포 파편을 제거한다. ZiPP는 세포 용해물의 가용성 분획(상청액)에 존재하는 가용성 단백질이다. 폴리에틸렌이민을 세포 용해물의 상청액에 첨가하고, 14,000xg에서 원심분리하여 DNA 및 임의의 잔여 박테리아 세포벽을 펠렛화한다. 이어서 ZiPP를 암모늄 설페이트 및 나트륨 클로라이드를 이용한 상 분리의 유발에 이어 4℃에서 15분 동안 15,000xg에서의 원심분리에 의해 상청액으로부터 정제한다. 이어서 펠렛을 저온 PBS 중에 재현탁하고, 임의의 불용성 물질을 10분 동안 4℃에서 원심분리 단계에 의해 제거한다. 이러한 단계를 균질해질 때까지 반복하고, 이는 SDS-PAGE 겔에서의 단일 밴드의 출현에 의해 확인한다. 분자량(MW)을 또한 Voyager DE-Pro MALDI-TOF(Applied Biosystems; Foster City, CA) 기기로 확인하였다. ZiPP의 구조화되지 않은 성질을 원형 이색성 기기(Aviv 202)로 확인하였다. 동물 실험을 위해, Detoxi-Gel(Thermo Scientific; Waltham, MA)을 이용하여 내독소를 제거한다.
생체내 약동학(PK) 연구. 상기 연구에서, ZiPP를 하전되지 않은 중합체 (VPGAG)120 및 (VPGAG)160와 비교하였다. 중합체를 N-말단에서 Alexa 488로 형광 표지하고, 꼬리 정맥 주사를 이용해서 Balb/c 마우스 내로 주사하였다. 유사한 성질을 갖지만 임의의 전하가 없는 생체중합체, VPGAG를 대조군으로 이용하여 나타난 약동학 파라미터에서의 임의의 변화가 VPX1X2G 모티프에 포함된 전하의 결과임을 나타낸다. 각각의 마우스는 i.v 또는 피하 주사된 단회 용량의 ZiPP 또는 대조군(150 mg/kg BW)을 수여받았다. 꼬리 정맥으로부터 주사 후 40초, 15분, 0.5, 2, 4, 8, 24, 48, 및 72시간에 혈액 샘플을 수집하였다(100 ㎕의 헤파린을 포함하는 튜브 내에 10 ㎕ 수집). 혈중 형광 표지된 중합체의 농도를 Alexa 488의 표준 곡선을 이용해서 계산하였다. 혈중 농도 시간-경과 데이터를 i.v. pk 데이터에 대해 표준 2구획 PK 모델로 분석하여 약동학 파라미터를 확인하였다.
파클리탁셀 ( PTX ) 콘주게이션 . 8개의 주기적으로 이격된 시스테인 잔기가 (VPGXG)16에 배열되고, x가 V 또는 C 1:1인 모티프를 ZiPP의 C-말단에 클로닝하였다. 약물 콘주게이션 절편은 여러 카피의 PTX가 콘주게이션되는 8개의 시스테인을 함유하였다. PTX의 첫 번째 2'OH를 레불린산으로 변경하였다(Etrych, T.S., et al. Molecular Pharmaceutics 2010, 7, 1015-1026). 상기 변경은 PTX의 세포독성을 보유한다. 이어서 활성화된 PTX를 ZiPP 상의 티올기와 반응하는 말단 말레이미드를 갖는 산-불안정형 하이드라지드 링커(N-ε-말레이미도카프로산 하이드라지드(EMCH) 링커)를 이용해서 자유 티올에 콘주게이션하여 안정한 탄소-황 결합을 형성하였다(Andrew MacKay, J., et al. Nat. Mater. 2009, 8, 993-999).
ZiPP - PTX 약물 콘주게이션의 특성규명. 약물 콘주게이션의 순도를 고성능 액체 크로마토그래피(HPLC)를 이용해서 평가하였다. HPLC 데이터를 PTX의 흡광도에 해당하는 228 ㎚의 흡광도에서의 피크 하 적분 면적을 이용해서 정량하였다. 약물 대 ZiPP의 콘주게이션 비를 질소 레이저(337 nm)가 장착된 Voyager DE-Pro MALDI-MS(Applied Biosystems; Foster City, CA) 기기의 매트릭스-보조 레이저 탈착/이온화 비행-시간 질량 분광측정(MALDI-TOF-MS)에 의해 결정하였다. 동적 광 산란(DLS) 기법을 수행하여 Dynapro 플레이트 판독기(Wyatt Technology; Santa Barbara, CA)를 이용해서 25℃ 및 25 μM 농도에서 ZiPP-PTX 나노입자의 수력학적 반지름(Rh)을 결정하였다. 데이터를 자동연관 함수의 정규 피팅으로 분석하고, 백분율 세기를 레일리(Raleigh) 구체 모델을 이용해서 질량 세기로 전환하였다. 이어서 정규 피팅을 이용해서 랜덤 코일에 대한 질량 백분율로 칭량되는 수력학적 반지름을 결정하였다. 회전 반지름을 PTX 콘주게이션 후 정적 광 산란(SLS)을 이용해서 계산하였다. 폼 팩터(ρ)를 Rg/Rh로 계산하였다.
ZiPP - PTX 콘주게이트의 시험관내 세포독성. 시험관내 세포독성을 MDA-MB-231 인간 삼중 음성 유방암 세포 상에서 수행하였다. Falcon™ 96-웰 세포 배양 플레이트(BD; Franklin Lakes, NJ)에서 배지 100 ㎕ 당 3x103 세포를 접종하였다. 세포가 16~18시간 동안 부착하도록 둔 후, 나노몰-미만 내지 높은-마이크로몰 범위 농도로 자유 PTX 및 ZiPP-PTX로 처리하였다. 72시간 약물 처리 후, 20 ㎕의 3-(4,5,-디메틸2-일)-5-(3-카복시메톡시페닐)-2-(4-설포페닐)-2H-테트라졸륨(MTS) 시약(CellTiter 96 AQueous™ Promega; Madison, WI)을 각각의 웰에 첨가하고 추가 2시간 동안 인큐베이션하였다. 자유 약물 및 ZiPP-약물 콘주게이트에 대한 용량-반응 곡선을 Victor3 마이크로플레이트 판독기(Perkin Elmer; Waltham, MA)로 490 ㎚에서 각각의 웰의 흡광도를 측정하여 구축하였다. 50% 억제 농도, IC50을 다음 공식(Andrew MacKay, J., et al. Nat. Mater. 2009, 8, 993-999)에 대해 데이터를 피팅하여 결정하였다:
식 중, V는 세포의 생활성이고, Ctreatment는 약물 농도이고, p는 용량 반응 곡선의 기울기이다. 상기 IC50값을 이용해서 콘주게이트의 효능을 평가한다.
실시예 2
ZiPP의
발현 및 정제
ZiPP의 열 반응성 특성은 ITC를 이용한 단순한 비-크로마토그래피 정제를 가능케 하였다. 구리 염색된 SDS-PAGE 겔에서 단일 밴드의 출현은 산물의 순도를 확인시켜 주었다(도 2a). 2개의 상이한 ZiPP, (VPKEG)80(MW=44 kDa) 및 (VPREG)80(MW=42 kDa)을 도 7a에서 정제된 산물의 대표로 나타낸다. 50 kDa 래더를 겔에서 참조 MW로 표시하지만, SDS 겔에서 이용된 래더는 구형 단백질의 것이며, 따라서 구조화되지 않은 ZiPP와 직접 비교할 수 없다. 순도 및 MW를 확인하기 위해, MALDI-TOF에 의해 정제된 산물을 분석하였다. MALDI 스펙트럼은 (VPKEG)80에 대해 21 kDa 및 42 kDa(피크 1 및 2)의 m/z값 및 (VPREG)80에 대해 22 kDa 및 44 kDa(피크 3 및 4)의 m/z값에서 이온의 존재를 나타내었다(도 7b). MALDI 스펙트럼은 (VPKDG)120에 대해 20 kDa, 30 kDa, 및 60.5 kDa의 m/z값 및 (VPRDG)120에 대해 21 kDa 및 32 kDa 및 63.8 kDa의 m/z값에서 이온의 존재를 나타내어(도 2b), 정제된 ZiPP 구축물의 분자량을 확인시켜 주었다(각각 MW=60.5 kDa, MW=63.8 kDa). 본 발명자들은 또한 CD-스펙트럼에 의해 ZiPP의 내재적인 무질서화 성질을 확인하였다. 도 2d 및 도 7c 의 CD-스펙트럼은 낮은 파장에서 음의 타원율을 그리고 더 높은 파장에서 약간 양의 타원율을 나타내었으며, 이는 랜덤-코일의 특징으로, ELP와 같은 무질서화 구조에 전형적이며, 중합체의 구조화되지 않은 성질을 확인시켜 주었다. 수력학적 반지름을 동적 광 산란을 이용해서 측정하였고 ELP 대조군에 비해 잘 수화된 ZiPP를 나타내었다(도 2c). 원상태 PAGE 겔은 ZIPP가 알부민과 상호작용하지 않음을 나타내었다(도 2e).
실시예 3
생체내
약동학 연구
ZiPP의 약동학 파라미터를 결정하기 위해, 혈장 농도를 꼬리 정맥 주사 또는 피하 주사를 통해 마우스에서의 전신 투여 후 72시간의 기간에 걸쳐 추적하였다. 매칭되는 아미노산 길이를 갖는 하전되지 않은 중합체를 대조군으로 이용하였다. 실험 설계를 도 3a 및 도 4a에 나타낸다. 중합체를 Alexa488로 형광 표지하고 마우스 내로 주사하였다. 혈액 샘플을 최대 72시간까지의 다양한 시점에 수집하였다. ELP120(VPGAG)120을 길이 대조군으로 이용한 반면, ELP160(VPGAG)160을 분자량 대조군으로 이용하였다. 도 3b 및 도 4b는 주사 후 시간의 함수로서의 혈장 중합체 농도를 나타내며, 이는 쯔비터이온성 모티프(구체적으로 각각 X1 및 X2에 있어서 K, D, 및 E 포함)의 도입이 스텔스 특성을 부여하며, 이는 다시 하전되지 않은 ELP에 비해 중합체의 순환 시간을 증가시킴을 나타내었다. 주사 후 시간의 함수로서의 혈장 농도는 ZIPP가 ELP보다 우수하게 작용함을 나타내었다. 이들 중합체는 2구획 모델을 따랐으며, 이에 따라 상기 모델을 이용하여 반감기 및 곡선 하 면적을 계산하였다. 2구획 모델을 혈장 중합체 농도에 피팅시켰고, 이는 약동학적 파라미터인 곡선 하 면적(AUC)(도 3c 및 도 4c) 및 제거 반감기(도 3d)를 산출하였다. AUC를 실험의 시간 경과에 걸쳐 총 중합체 노출의 척도로서 계산하였다. AUC는 VPKEG 및 VPKDG가 하전되지 않은 ELP 길이 대조군뿐만 아니라 분자량 대조군에 비해 유의미하게 더 우수하게 작용함을 나타내었다. 데이터는 도 3c에 대해 평균±SE, n=5를 나타내며, 데이터는 도 4c에 대해 평균±SE, n=3~4를 나타낸다. ZiPP의 최종 반감기는 VPGAG 구축물의 반감기에 비해 6시간 증가하였다(도 3d). 또한, 가장 서술적인 약동학적 파라미터인, ZiPP에 대해 혈장 농도 곡선 하 면적(AUC)에 의해 측정된 중합체의 총 누적 혈액 노출은 하전되지 않은 폴리펩타이드인 동일 사슬 길이의 VPGAG의 노출에 비해 약 3배 더 높았다(도 3c). 결과는 펩타이드 중합체 내로의 쯔비터이온성 모티프 및 보다 구체적으로 하전된 잔기의 도입이 중합체의 약동학 개선에서 중요한 역할을 담당함을 나타내었다.
실시예 4
파클리탁셀
-
ZiPP
콘주게이트의
특성규명
파클리탁셀(PTX)을 VPKEG 펜타펩타이드 단위의 120개 반복의 C-말단 트레일러에서 1:1의 비로 X-V 또는 C를 갖는 (VPGXG)16에 화학적으로 콘주게이션하였다. 파클리탁셀을 pH 감수성 링커를 통해 8개의 C-말단 잔기에 화학적으로 콘주게이션하였다. 설계를 도 5a에 나타낸다. 중합체 약물 콘주게이트를 Amicon Ultra-15 Centrifugal Filter Units(MWCO: 10kDa; Millipore; Billerica, MA)을 이용하여 정제하고, 정제된 산물을 HPLC 상에 걸어 미반응 자유 약물의 부재를 확인하였다. HPLC 크로마토그램은 무시할 만한 양의 자유 약물을 포함하는 중합체-약물 콘주게이트의 순도를 확인시켜 주었다. 정제된 ZiPP-PTX 콘주게이트는 MALDI-TOF 스펙트럼을 이용해서 모체 ZiPP 중합체 사슬 및 ZiPP-PTX 콘주게이트 간에 계산된 MW 차이로 확인된 바와 같이 중합체 사슬 당 3.2~4개의 약물을 가졌다(도 5b). 또한, 동적 광 산란 측정은 PTX 콘주게이션 후, ZiPP가 실제로 58 ㎚의 수력학적 반지름(Rh)의 나노입자로 자발적으로 자가-어셈블리함을 시사하였다. 이들은 마이셀 당 26의 응집수로 58 ㎚ 반지름의 마이셀로 자가-어셈블리되었다. 폼 팩터(form factor, ρ)-Rg/Rh로 계산됨-는 0.82였으며, 이는 구형 마이셀의 형성을 표시한다.
실시예 5
ZiPP
-
PTX
콘주게이트의
시험관내
항-종양 유효성
Zipp-PTX의 시험관내 세포독성을 시간의 함수로서 농도 범위에 걸쳐 세포 생활성을 확인함으로써 측정하였다. MDA-MB-231, 인간 삼중 음성 유방암 세포주를 모델로 이용하였다. 약물 처리 72시간 후, MDA-MB-231 세포의 증식이 대조군(약물 없음)에 비해 억제되었다(도 5c). 또한, 억제는 자유 약물의 억제와 필적하였다. 자유 약물에 대한 IC50값은 2 nM 근처였던 반면, ZiPP-PTX에 대한 값은 12.4 nM였다(약물 측면의 농도). ZiPP-PTX에 대한 IC50값은 자유 약물에 대한 값보다 6배 높았으나, 이러한 결과는 자유 약물이 약물 수송체를 통해 세포 안팎으로 쉽게 확산할 수 있는 반면, 약물-중합체 콘주게이트로부터의 PTX는 이것이 엔도솜 내부에 있는 경우에만 방출되는 시험관내 환경에서 예상된다. 나노입자는 세포내이입을 통해 섭취되고 약물은 pH가 낮은 후기 엔도솜으로 나노입자가 이동한 후 방출되므로, 상기 과정은 느리다. 이러한 낮은 pH는 ZiPP로부터 PTX의 방출을 유발한다. 이러한 결과는 PTX-중합체 콘주게이트가 생체내 플랫폼으로 취하기에 충분히 안정하고 강력함을 이들이 시사하므로 고무적이다. IC50값은 세포 생활성을 50% 감소시킨 약물의 농도를 나타내었다.
실시예 6
ZiPP
-
Tn3
콘주게이트
다가 스캐폴드 단백질(Tn3)은 TNF-관련 아폽토시스-포함 리간드 수용체 2(TRAIL2)의 수퍼작용제이며, ZiPP에 부착될 단백질로 선정되었다. 융합 단백질의 설계 개요를 도 6a에 나타낸다. TRAIL2의 수퍼작용제는 TRAILR2의 활성화가 다양한 인간 암에서 아폽토시스를 유도할 수 있고, 이에 따라 암 치료제를 위한 잠재력을 가지므로 선택되었다. (Tn3)6은 단량체 Tn3 단위의 6개 일렬로 반복을 나타내며, 이는 MedImmune에 의해 높은 친화도로 TRAIL2에 결합하도록 조작되었다. 다양한 길이의 ZiPP를 갖는 (Tn3)6을 대장균에서 재조합적으로 발현시켰다. 친화도 정제된 샘플의 SDS-PAGE 분석을 도 6b에 나타낸다. Colo205(결장암 세포)에 대한 세포독성 검정은 융합 단백질이 고도로 세포독성이며, 이의 효능이 도 6c에 나타낸 바와 같이, 자유 단백질(ZIPP가 부착되지 않은 (Tn3)6)에 필적함을 나타내었다. IC50값은 세포 생활성을 50% 감소시킨 약물의 농도를 나타내었다.
***
특정 양태의 상기 설명은 다른 이들이 당분야의 지식을 적용함으로써, 본 개시의 일반 개념에서 벗어나지 않고, 과도한 실험 없이, 이러한 구체 양태의 다양한 적용을 위해 쉽게 변경하고/하거나 적응할 수 있도록 본 발명의 일반 성질을 완전히 드러낼 것이다. 따라서, 이러한 적응 및 변경은 본원에 제시된 교시 및 지침에 기반하여, 개시된 양태의 의미 및 균등 범위 내인 것으로 의도된다. 본원에서의 어법 또는 용법은 본 명세서의 용법 또는 어법이 교시 및 지침의 견지에서 당업자에 의해 해석되도록 하는 설명의 목적을 위한 것이며 제한을 위한 것이 아님이 이해되어야 한다.
본 개시의 폭 및 범위는 임의의 상술된 예시적 양태에 의해 제한되어서는 안되며, 첨부되는 청구범위 및 이의 균등부에 따라서만 정의되어야 한다.
본 출원에서 인용된 모든 공보, 특허, 특허 출원, 및/또는 다른 문헌은 각각의 개별 공보, 특허, 특허 출원, 및/또는 다른 문헌이 모든 목적을 위한 참조로 포함됨을 개별적으로 나타낸 것과 동일한 정도로, 모든 목적을 위해 이의 전문이 참조로 포함된다.
완전성의 이유로, 본 발명의 다양한 양태를 다음의 번호를 매긴 항으로 나타낸다:
항 1. (a) 하나 이상의 하전된 모티프를 포함하는 폴리펩타이드로서, 각각의 하전된 모티프는 독립적으로 SEQ ID NO: 1(VPX1X2G)로 구성되는 아미노산 서열을 가지며, 식 중 X1은 음으로 또는 양으로 하전된 아미노산이며, X2는 음으로 또는 양으로 하전된 다른 아미노산인 폴리펩타이드; 및 (b) 폴리펩타이드에 부착된 하나 이상의 약물 분자를 포함하는 콘주게이트.
항 2. 제1항에 있어서, 폴리펩타이드가 복수의 하전된 모티프를 포함하는 콘주게이트.
항 3. 제2항에 있어서, 복수의 하전된 모티프가 일렬로 반복되는 콘주게이트.
항 4. 제1항 내지 제3항 중 어느 한 항에 있어서, 폴리펩타이드가 하나 이상의 하전되지 않은 모티프를 추가로 포함하며, 각각의 하전되지 않은 모티프는 독립적으로 SEQ ID NO: 3(VPGXG)으로 구성되고, 식 중 X는 프롤린을 제외한 임의의 아미노산인 아미노산 서열을 갖는 콘주게이트.
항 5. 제4항에 있어서, 폴리펩타이드가 복수의 하전되지 않은 모티프를 포함하는 콘주게이트.
항 6. 제5항에 있어서, 복수의 하전되지 않은 모티프가 일렬로 반복되는 콘주게이트.
항 7. 제4항 내지 제6항 중 어느 한 항에 있어서, 하나 이상의 하전되지 않은 모티프가 폴리펩타이드의 적어도 2개의 인접한 하전된 모티프 사이에 배치되는 콘주게이트.
항 8. 제1항에 있어서, 폴리펩타이드가 SEQ ID NO: 2(VPX1X2G)n의 아미노산 서열로서, 식 중 X1은 음으로 또는 양으로 하전된 아미노산이며, X2는 음으로 또는 양으로 하전된 다른 아미노산이고, n은 1 이상의 정수인 서열을 포함하는 콘주게이트.
항 9. 제4항에 있어서, 폴리펩타이드가 SEQ ID NO: 4(VPGXG)n의 아미노산 서열로서, 식 중 X는 프롤린을 제외한 임의의 아미노산이고, n은 1 이상의 정수인 서열을 포함하는 콘주게이트.
항 10. 제4항에 있어서, 폴리펩타이드가 SEQ ID NO: 5(VPX1X2G)n(VPGXG)m의 아미노산 서열로서, 식 중 X1은 음으로 또는 양으로 하전된 아미노산이며, X2는 음으로 또는 양으로 하전된 다른 아미노산이고, X는 프롤린을 제외한 임의의 아미노산이고, n 및 m은 독립적으로 1 이상의 정수인 서열을 포함하는 콘주게이트.
항 11. 제4항에 있어서, 폴리펩타이드가 SEQ ID NO: 6(VPGXG)m(VPX1X2G)n의 아미노산 서열로서, 식 중 X1은 음으로 또는 양으로 하전된 아미노산이며, X2는 음으로 또는 양으로 하전된 다른 아미노산이고, X는 프롤린을 제외한 임의의 아미노산이고, n 및 m은 독립적으로 1 이상의 정수인 서열을 포함하는 콘주게이트.
항 12. 제4항에 있어서, 폴리펩타이드가 SEQ ID NO: 7{(VPX1X2G)(VPGXG)}b의 아미노산 서열로서, 식 중 X1은 음으로 또는 양으로 하전된 아미노산이며, X2는 음으로 또는 양으로 하전된 다른 아미노산이고, X는 프롤린을 제외한 임의의 아미노산이고, b는 1 이상의 정수인 서열을 포함하는 콘주게이트.
항 13. 제1항 내지 제12항 중 어느 한 항에 있어서, X1이 음으로 하전된 아미노산이고, X2가 양으로 하전된 아미노산인 콘주게이트.
항 14. 제1항 내지 제12항 중 어느 한 항에 있어서, X1이 양으로 하전된 아미노산이고, X2가 음으로 하전된 아미노산인 콘주게이트.
항 15. 제1항 내지 제14항 중 어느 한 항에 있어서, 음으로 하전된 아미노산이 글루타메이트산 및 아스파르트산으로부터 독립적으로 선택되는 콘주게이트.
항 16. 제1항 내지 제15항 중 어느 한 항에 있어서, 양으로 하전된 아미노산이 라이신 및 아르기닌으로부터 독립적으로 선택되는 콘주게이트.
항 17. 제4항 내지 제16항 중 어느 한 항에 있어서, X가 프롤린을 제외한 임의의 아미노산인 콘주게이트.
항 18. 제17항에 있어서, X가 아르기닌, 히스티딘, 라이신, 아스파르트산, 글루탐산, 세린, 트레오닌, 아스파라긴, 글루타민, 시스테인, 셀레노시스테인, 글리신, 알라닌, 발린, 류신, 이소류신, 메티오닌, 페닐알라닌, 티로신, 및 트립토판으로부터 선택되는 콘주게이트.
항 19. 제18항에 있어서, X가 글리신 및 발린으로부터 선택되는 콘주게이트.
항 20. 제1항 내지 제19항 중 어느 한 항에 있어서, 폴리펩타이드가 링커를 추가로 포함하는 콘주게이트.
항 21. 제20항에 있어서, 링커가 하나 이상의 시스테인을 포함하는 콘주게이트.
항 22. 제20항 또는 제21항에 있어서, 링커가 SEQ ID NO: (GGC), SEQ ID NO: ((GGC)8), SEQ ID NO: ((G4S)3), 및 SEQ ID NO: ((VPGXG)16, 식 중 X는 1:1의 비로 존재하는 발린 또는 시스테인임)로부터 선택되는 아미노산 서열을 포함하는 콘주게이트.
항 23. 제20항 내지 제22항 중 어느 한 항에 있어서, 링커가 폴리펩타이드 의 C-말단, N-말단, 또는 C- 및 N-말단 모두에 배치되는 콘주게이트.
항 24. 제20항 내지 제23항 중 어느 한 항에 있어서, 하나 이상의 약물 분자가 링커를 통해 폴리펩타이드에 부착되는 콘주게이트.
항 25. 제20항 내지 제24항 중 어느 한 항에 있어서, 약물 분자가 링커 내의 티올 반응기를 통해 폴리펩타이드에 부착되는 콘주게이트.
항 26. 제1항 내지 제25항 중 어느 한 항에 있어서, 하나 이상의 약물 분자가 소분자, 뉴클레오타이드, 폴리뉴클레오타이드, 펩타이드, 단백질, 탄수화물, 및 이의 조합으로부터 선택되는 콘주게이트.
항 27. 제26항에 있어서, 약물 분자가 소분자를 포함하는 콘주게이트.
항 28. 제26항에 있어서, 약물 분자가 단백질을 포함하는 콘주게이트.
항 29. 제1항 내지 제25항 중 어느 한 항에 있어서, 약물 분자가 암 치료제를 포함하는 콘주게이트.
항 30. 제1항 내지 제25항 중 어느 한 항에 있어서, 약물 분자가 항체를 포함하는 콘주게이트.
항 31. 제1항 내지 제25항 중 어느 한 항에 있어서, 약물 분자가 파클리탁셀을 포함하는 콘주게이트.
항 32. 제1항 내지 제25항 중 어느 한 항에 있어서, 약물 분자가 Tn3(TRAIL 수퍼작용제)을 포함하는 콘주게이트.
항 33. 제1항 내지 제32항 중 어느 한 항에 있어서, 콘주게이트가 대상체에 대한 투여를 위해 제조되는 콘주게이트.
항 34. 제1항 내지 제33항 중 어느 한 항에 있어서, 콘주게이트의 폴리펩타이드가 재조합적으로 발현되는 콘주게이트.
항 35. 제28항에 있어서, 콘주게이트가 재조합적으로 발현되는 콘주게이트.
항 36. 제1항 내지 제35항 중 어느 한 항의 콘주게이트를 포함하는 조성물.
항 37. 제1항 내지 제35항 중 어느 한 항의 폴리펩타이드를 인코딩하는 폴리뉴클레오타이드.
항 38. 제28항의 콘주게이트를 인코딩하는 폴리뉴클레오타이드.
항 39. 제37항 또는 제38항의 폴리뉴클레오타이드를 포함하는 벡터.
항 40. 대상체에 대한 약물 분자의 전달 방법으로서, 대상체에 제1항 내지 제35항 중 어느 한 항의 콘주게이트를 투여하는 단계를 포함하는 방법.
항 41. 질환 또는 장애를 갖는 대상체의 치료 방법으로서, 대상체에 제1항 내지 제35항 중 어느 한 항의 콘주게이트를 투여하는 단계를 포함하는 방법.
항 42. 샘플 내 표적 존재의 결정 방법으로서, 약물 분자 및 샘플 내 표적 간에 복합체가 형성될 수 있도록 하는 조건 하에 샘플을 제1항 내지 제35항 중 어느 한 항의 콘주게이트와 접촉시키는 단계; 및 복합체의 존재를 검출하는 단계로서, 복합체의 존재는 샘플 내 표적을 시사하는 단계를 포함하는 방법.
항 43. 제42항에 있어서, 샘플이 대상체로부터 수득되며, 방법이 대상체의 질환을 진단하는 단계, 예진하는 단계, 또는 치료 유효성을 평가하는 단계를 추가로 포함하는 방법.
항 44. 제43항에 있어서, 방법이 대상체의 치료 유효성을 평가하는 단계를 추가로 포함하는 경우, 방법이 유효성을 개선하기 위해 필요에 따라 대상체의 치료를 변경하는 단계를 추가로 포함하는 방법.
항 45. 대상체에서 질환의 진단 방법으로서, 약물 분자 및 샘플 내 표적 간에 복합체가 형성될 수 있도록 하는 조건 하에 대상체로부터의 샘플을 제1항 내지 제35항 중 어느 한 항의 콘주게이트와 접촉시키는 단계; 샘플 내 표적 수준을 결정하는 단계로서, 복합체 수준은 샘플 내 표적 수준을 시사하는 단계; 및 샘플 내 표적 수준을 표적의 대조군 수준과 비교하는 단계로서, 대조군 수준과 상이한 표적 수준은 대상체에서 질환을 시사하는 단계를 포함하는 방법.
항 46. 제45항에 있어서, 대조군 수준은 대상체가 치료를 시작한 기간 이전 또는 동안의 시점에 대상체에서의 수준에 해당하며, 샘플은 이후 시점에 대상체로부터 취해지는 방법.
항 47. 제45항에 있어서, 샘플은 대상체가 치료를 받고 있는 기간 동안의 시점에 대상체로부터 취해지며, 대조군 수준은 무질환 수준 또는 대상체가 치료를 시작한 기간 이전 시점에서의 수준에 해당하는 방법.
항 48. 제45항 내지 제47항 중 어느 한 항에 있어서, 방법은 치료가 질환 치료에서 비효과적인 것으로 결정되는 경우, 대상체에 대한 치료를 변경하는 단계 또는 상이한 치료를 투여하는 단계를 추가로 포함하는 방법.
항 49. 제40항 내지 제48항 중 어느 한 항에 있어서, 콘주게이트가 리포터로 표지되는 방법.
항 50. 제40항 내지 제49항 중 어느 한 항에 있어서, 콘주게이트가 정맥내, 동맥내, 복강내, 또는 종양내로 대상체에 투여되는 방법.
항 51. 제40항 내지 제50항 중 어느 한 항에 있어서, 콘주게이트가 폴리에틸렌 글리콜(PEG)에 콘주게이션된 약물 분자에 비해 감소된 항원성을 갖는 방법.
항 52. 제40항 내지 제50항 중 어느 한 항에 있어서, 콘주게이트가 폴리에틸렌 글리콜(PEG)에 콘주게이션된 약물 분자에 비해 감소된 면역원성을 갖는 방법.
항 53. 제40항 내지 제52항 중 어느 한 항에 있어서, 질환이 암, 대사 질환, 자가면역 질환, 심혈관 질환, 및 정형외과 장애로부터 선택되는 방법.
항 54. 제53항에 있어서, 질환이 암을 포함하는 방법.
항 55. 제54항에 있어서, 암이 유방암, 결장직장암, 결장암, 폐암, 전립선암, 고환암, 뇌암, 피부암, 직장암, 위암, 식도암, 육종, 기관암, 두부경부암, 췌장암, 간암, 난소암, 림프모양 암, 자궁경부암, 외음부암, 흑색종, 중피종, 신장암, 방광암, 갑상선암, 뼈암, 암종, 육종, 및 연조직암으로부터 선택되는 방법.
항 56. 제55항에 있어서, 암이 유방암을 포함하는 방법.
서열
SEQ ID NO: 1
VPX1X2G, 식 중 X1은 음으로 또는 양으로 하전된 아미노산이며, X2는 음으로 또는 양으로 하전된 다른 아미노산이다.
SEQ ID NO: 2
(VPX1X2G)n, 식 중 X1은 음으로 또는 양으로 하전된 아미노산이며, X2는 음으로 또는 양으로 하전된 다른 아미노산이고, n은 1 이상의 정수이다.
SEQ ID NO: 3
VPGXG, 식 중 X는 프롤린을 제외한 임의의 아미노산이다.
SEQ ID NO: 4
(VPGXG)n, 식 중 X는 프롤린을 제외한 임의의 아미노산이고, n은 1 이상의 정수이다.
SEQ ID NO: 5
(VPX1X2G)n(VPGXG)m, 식 중 X1은 음으로 또는 양으로 하전된 아미노산이며, X2는 음으로 또는 양으로 하전된 다른 아미노산이고, X는 프롤린을 제외한 임의의 아미노산이고, n 및 m은 독립적으로 1 이상의 정수이다.
SEQ ID NO: 6
(VPGXG)m(VPX1X2G)n, 식 중 X1은 음으로 또는 양으로 하전된 아미노산이며, X2는 음으로 또는 양으로 하전된 다른 아미노산이고, X는 프롤린을 제외한 임의의 아미노산이고, n 및 m은 독립적으로 1 이상의 정수이다.
SEQ ID NO: 7
{(VPX1X2G)(VPGXG)}b, 식 중 X1은 음으로 또는 양으로 하전된 아미노산이며, X2는 음으로 또는 양으로 하전된 다른 아미노산이고, X는 프롤린을 제외한 임의의 아미노산이고, b는 1 이상의 정수이다.
SEQ ID NO: 8
GGC
SEQ ID NO: 9
(GGC)8
SEQ ID NO: 10
(G4S)3
SEQ ID NO: 11
((VPGXG)16, 식 중 X는 1:1의 비로 존재하는 발린 또는 시스테인이다.
SEQ ID NO: 12
예시적 폴리펩타이드
V P K D G V P K D G V P K D G V P K D G V P K D G
SEQ ID NO: 13
예시적 폴리펩타이드를 인코딩하는 폴리뉴클레오타이드
GTC CCG aaa gac GGT GTT CCG aag gac GGC GTG CCT aaa gat GGT GTT CCG aag gac GGG GTG CCA aaa gat GGG
SEQUENCE LISTING
<110> DUKE UNIVERSITY
<120> GENETICALLY ENCODED INTRINSICALLY DISORDERED STEALTH POLYMERS FOR
DELIVERY AND METHODS OF USING SAME
<130> 028193-9241-WO00
<140> PCT/US2016/045655
<141> 2016-08-04
<150> 62/200,726
<151> 2015-08-04
<160> 13
<170> PatentIn version 3.5
<210> 1
<211> 5
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<220>
<221> X
<222> (3)..(3)
<223> negatively or positively charged amino acid
<220>
<221> X
<222> (4)..(4)
<223> other negatively or positively charged amino acid
<400> 1
Val Pro Xaa Xaa Gly
1 5
<210> 2
<211> 5
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<220>
<221> X
<222> (3)..(3)
<223> negatively or positively charged amino acid
<220>
<221> X
<222> (4)..(4)
<223> other negatively or positively charged amino acid
<400> 2
Val Pro Xaa Xaa Gly
1 5
<210> 3
<211> 5
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<220>
<221> X
<222> (4)..(4)
<223> any amino acid except proline
<400> 3
Val Pro Gly Xaa Gly
1 5
<210> 4
<211> 5
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<220>
<221> X
<222> (4)..(4)
<223> any amino acid except proline
<400> 4
Val Pro Gly Xaa Gly
1 5
<210> 5
<211> 10
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<220>
<221> X
<222> (3)..(3)
<223> negatively or positively charged amino acid
<220>
<221> X
<222> (4)..(4)
<223> other negatively or positively charged amino acid
<220>
<221> X
<222> (9)..(9)
<223> any amino acid except proline
<400> 5
Val Pro Xaa Xaa Gly Val Pro Gly Xaa Gly
1 5 10
<210> 6
<211> 10
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<220>
<221> X
<222> (4)..(4)
<223> any amino acid except proline
<220>
<221> X
<222> (8)..(8)
<223> negatively or positively charged amino acid
<220>
<221> X
<222> (9)..(9)
<223> other negatively or positively charged amino acid
<400> 6
Val Pro Gly Xaa Gly Val Pro Xaa Xaa Gly
1 5 10
<210> 7
<211> 10
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<220>
<221> X
<222> (3)..(3)
<223> negatively or positively charged amino acid
<220>
<221> X
<222> (4)..(4)
<223> other negatively or positively charged amino acid
<220>
<221> X
<222> (9)..(9)
<223> any amino acid except proline
<400> 7
Val Pro Xaa Xaa Gly Val Pro Gly Xaa Gly
1 5 10
<210> 8
<211> 3
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<400> 8
Gly Gly Cys
1
<210> 9
<211> 24
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<400> 9
Gly Gly Cys Gly Gly Cys Gly Gly Cys Gly Gly Cys Gly Gly Cys Gly
1 5 10 15
Gly Cys Gly Gly Cys Gly Gly Cys
20
<210> 10
<211> 15
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<400> 10
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 11
<211> 5
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<220>
<221> X
<222> (4)..(4)
<223> valine or cysteine present in a ratio of 1:1
<400> 11
Val Pro Gly Xaa Gly
1 5
<210> 12
<211> 25
<212> PRT
<213> Artificial sequence
<220>
<223> Synthetic polypeptide
<400> 12
Val Pro Lys Asp Gly Val Pro Lys Asp Gly Val Pro Lys Asp Gly Val
1 5 10 15
Pro Lys Asp Gly Val Pro Lys Asp Gly
20 25
<210> 13
<211> 75
<212> DNA
<213> Artificial sequence
<220>
<223> Synthetic polynucleotide
<400> 13
gtcccgaaag acggtgttcc gaaggacggc gtgcctaaag atggtgttcc gaaggacggg 60
gtgccaaaag atggg 75
Claims (56)
- (a) 하나 이상의 하전된 모티프를 포함하는 폴리펩타이드로서, 각각의 하전된 모티프는 독립적으로 SEQ ID NO: 1(VPX1X2G)로 구성되는 아미노산 서열을 갖고, 식 중 X1은 음으로 또는 양으로 하전된 아미노산이며, X2는 음으로 또는 양으로 하전된 다른 아미노산인 폴리펩타이드; 및
(b) 리펩타이드에 부착된 하나 이상의 약물 분자를 포함하는 콘주게이트. - 제1항에 있어서,
폴리펩타이드가 복수의 하전된 모티프를 포함하는 콘주게이트. - 제2항에 있어서,
복수의 하전된 모티프가 일렬로 반복되는 콘주게이트. - 제1항 내지 제3항 중 어느 한 항에 있어서,
폴리펩타이드가 하나 이상의 하전되지 않은 모티프를 추가로 포함하며, 각각의 하전되지 않은 모티프는 독립적으로 SEQ ID NO: 3(VPGXG)으로 구성되는 아미노산 서열로서, 식 중 X는 프롤린을 제외한 임의의 아미노산인 서열을 갖는 콘주게이트. - 제4항에 있어서,
폴리펩타이드가 복수의 하전되지 않은 모티프를 포함하는 콘주게이트. - 제5항에 있어서,
복수의 하전되지 않은 모티프가 일렬로 반복되는 콘주게이트. - 제4항 내지 제6항 중 어느 한 항에 있어서,
하나 이상의 하전되지 않은 모티프가 폴리펩타이드의 적어도 2개의 인접한 하전된 모티프 사이에 배치되는 콘주게이트. - 제1항에 있어서,
폴리펩타이드가 SEQ ID NO: 2(VPX1X2G)n의 아미노산 서열로서, 식 중 X1은 음으로 또는 양으로 하전된 아미노산이며, X2는 음으로 또는 양으로 하전된 다른 아미노산이고, n은 1 이상의 정수인 서열을 포함하는 콘주게이트. - 제4항에 있어서,
폴리펩타이드가 SEQ ID NO: 4(VPGXG)n의 아미노산 서열로서, 식 중 X는 프롤린을 제외한 임의의 아미노산이고, n은 1 이상의 정수인 서열을 포함하는 콘주게이트. - 제4항에 있어서,
폴리펩타이드가 SEQ ID NO: 5(VPX1X2G)n(VPGXG)m의 아미노산 서열로서, 식 중 X1은 음으로 또는 양으로 하전된 아미노산이며, X2는 음으로 또는 양으로 하전된 다른 아미노산이고, X는 프롤린을 제외한 임의의 아미노산이고, n 및 m은 독립적으로 1 이상의 정수인 서열을 포함하는 콘주게이트. - 제4항에 있어서,
폴리펩타이드가 SEQ ID NO: 6(VPGXG)m(VPX1X2G)n의 아미노산 서열로서, 식 중 X1은 음으로 또는 양으로 하전된 아미노산이며, X2는 음으로 또는 양으로 하전된 다른 아미노산이고, X는 프롤린을 제외한 임의의 아미노산이고, n 및 m은 독립적으로 1 이상의 정수인 서열을 포함하는 콘주게이트. - 제4항에 있어서,
폴리펩타이드가 SEQ ID NO: 7{(VPX1X2G)(VPGXG)}b의 아미노산 서열로서, 식 중 X1은 음으로 또는 양으로 하전된 아미노산이며, X2는 음으로 또는 양으로 하전된 다른 아미노산이고, X는 프롤린을 제외한 임의의 아미노산이고, b는 1 이상의 정수인 서열을 포함하는 콘주게이트. - 제1항 내지 제12항 중 어느 한 항에 있어서,
X1이 음으로 하전된 아미노산이고, X2가 양으로 하전된 아미노산인 콘주게이트. - 제1항 내지 제12항 중 어느 한 항에 있어서,
X1이 양으로 하전된 아미노산이고, X2가 음으로 하전된 아미노산인 콘주게이트. - 제1항 내지 제14항 중 어느 한 항에 있어서,
음으로 하전된 아미노산이 독립적으로 글루타메이트산 및 아스파르트산으로부터 선택되는 콘주게이트. - 제1항 내지 제15항 중 어느 한 항에 있어서,
양으로 하전된 아미노산이 독립적으로 라이신 및 아르기닌으로부터 선택되는 콘주게이트. - 제4항 내지 제16항 중 어느 한 항에 있어서,
X가 프롤린을 제외한 임의의 아미노산인 콘주게이트. - 제17항에 있어서,
X가 아르기닌, 히스티딘, 라이신, 아스파르트산, 글루탐산, 세린, 트레오닌, 아스파라긴, 글루타민, 시스테인, 셀레노시스테인, 글리신, 알라닌, 발린, 류신, 이소류신, 메티오닌, 페닐알라닌, 티로신, 및 트립토판으로부터 선택되는 콘주게이트. - 제18항에 있어서,
X가 글리신 및 발린으로부터 선택되는 콘주게이트. - 제1항 내지 제19항 중 어느 한 항에 있어서,
폴리펩타이드가 링커를 추가로 포함하는 콘주게이트. - 제20항에 있어서,
링커가 하나 이상의 시스테인을 포함하는 콘주게이트. - 제20항 또는 제21항에 있어서,
링커가 SEQ ID NO: (GGC), SEQ ID NO: ((GGC)8), SEQ ID NO: ((G4S)3), 및 SEQ ID NO: ((VPGXG)16, 식 중 X는 1:1의 비로 존재하는 발린 또는 시스테인임)로부터 선택되는 아미노산 서열을 포함하는 콘주게이트. - 제20항 내지 제22항 중 어느 한 항에 있어서,
링커가 폴리펩타이드의 C-말단, N-말단, 또는 C- 및 N-말단 모두에 배치되는 콘주게이트. - 제20항 내지 제23항 중 어느 한 항에 있어서,
하나 이상의 약물 분자가 링커를 통해 폴리펩타이드에 부착되는 콘주게이트. - 제20항 내지 제24항 중 어느 한 항에 있어서,
약물 분자가 링커 내의 티올 반응기를 통해 폴리펩타이드에 부착되는 콘주게이트. - 제1항 내지 제25항 중 어느 한 항에 있어서,
하나 이상의 약물 분자가 소분자, 뉴클레오타이드, 폴리뉴클레오타이드, 펩타이드, 단백질, 탄수화물, 및 이의 조합으로부터 선택되는 콘주게이트. - 제26항에 있어서,
약물 분자가 소분자를 포함하는 콘주게이트. - 제26항에 있어서,
약물 분자가 단백질을 포함하는 콘주게이트. - 제1항 내지 제25항 중 어느 한 항에 있어서,
약물 분자가 암 치료제를 포함하는 콘주게이트. - 제1항 내지 제25항 중 어느 한 항에 있어서,
약물 분자가 항체를 포함하는 콘주게이트. - 제1항 내지 제25항 중 어느 한 항에 있어서,
약물 분자가 파클리탁셀을 포함하는 콘주게이트. - 제1항 내지 제25항 중 어느 한 항에 있어서,
약물 분자가 Tn3(TRAIL 수퍼작용제)을 포함하는 콘주게이트. - 제1항 내지 제32항 중 어느 한 항에 있어서,
콘주게이트가 대상체에 대한 투여를 위해 제조되는 콘주게이트. - 제1항 내지 제33항 중 어느 한 항에 있어서,
콘주게이트의 폴리펩타이드가 재조합적으로 발현되는 콘주게이트. - 제28항에 있어서,
콘주게이트가 재조합적으로 발현되는 콘주게이트. - 제1항 내지 제35항 중 어느 한 항의 콘주게이트를 포함하는 조성물.
- 제1항 내지 제35항 중 어느 한 항의 폴리펩타이드를 인코딩하는 폴리뉴클레오타이드.
- 제28항의 콘주게이트를 인코딩하는 폴리뉴클레오타이드.
- 제37항 또는 제38항의 폴리뉴클레오타이드를 포함하는 벡터.
- 대상체에 대한 약물 분자의 전달 방법으로서, 대상체에 제1항 내지 제35항 중 어느 한 항의 콘주게이트를 투여하는 단계를 포함하는 방법.
- 질환 또는 장애를 갖는 대상체의 치료 방법으로서, 대상체에 제1항 내지 제35항 중 어느 한 항의 콘주게이트를 투여하는 단계를 포함하는 방법.
- 샘플 내 표적 존재의 결정 방법으로서, 약물 분자 및 샘플 내 표적 간에 복합체가 형성될 수 있도록 하는 조건 하에 샘플을 제1항 내지 제35항 중 어느 한 항의 콘주게이트와 접촉시키는 단계; 및 복합체의 존재를 검출하는 단계로서, 복합체의 존재는 샘플 내 표적을 시사하는 단계를 포함하는 방법.
- 제42항에 있어서,
샘플이 대상체로부터 수득되며, 방법이 대상체의 질환을 진단하는 단계, 예진하는 단계 또는 치료 유효성을 평가하는 단계를 추가로 포함하는 방법. - 제43항에 있어서,
방법이 대상체의 치료 유효성을 평가하는 단계를 추가로 포함하는 경우, 방법이 유효성을 개선하기 위해 필요에 따라 대상체의 치료를 변경하는 단계를 추가로 포함하는 방법. - 대상체에서 질환의 진단 방법으로서, 약물 분자 및 샘플 내 표적 간에 복합체가 형성될 수 있도록 하는 조건 하에 대상체로부터의 샘플을 제1항 내지 제35항 중 어느 한 항의 콘주게이트와 접촉시키는 단계; 샘플 내 표적 수준을 결정하는 단계로서, 복합체 수준은 샘플 내 표적 수준을 시사하는 단계; 및 샘플 내 표적 수준을 표적의 대조군 수준과 비교하는 단계로서, 대조군 수준과 상이한 표적 수준은 대상체에서 질환을 시사하는 단계를 포함하는 방법.
- 제45항에 있어서,
대조군 수준은 대상체가 치료를 시작한 기간 이전 또는 동안의 시점에 대상체에서의 수준에 해당하며, 샘플은 이후 시점에 대상체로부터 취해지는 방법. - 제45항에 있어서,
샘플은 대상체가 치료를 받고 있는 기간 동안의 시점에 대상체로부터 취해지며, 대조군 수준은 무질환 수준 또는 대상체가 치료를 시작한 기간 이전 시점에서의 수준에 해당하는 방법. - 제45항 내지 제47항 중 어느 한 항에 있어서,
치료가 질환 치료에서 비효과적인 것으로 결정되는 경우, 방법이 대상체에 대한 치료를 변경하는 단계 또는 상이한 치료를 투여하는 단계를 추가로 포함하는 방법. - 제40항 내지 제48항 중 어느 한 항에 있어서,
콘주게이트가 리포터로 표지되는 방법. - 제40항 내지 제49항 중 어느 한 항에 있어서,
콘주게이트가 정맥내, 동맥내, 복강내, 또는 종양내로 대상체에 투여되는 방법. - 제40항 내지 제50항 중 어느 한 항에 있어서,
콘주게이트가 폴리에틸렌 글리콜(PEG)에 콘주게이션된 약물 분자에 비해 감소된 항원성을 갖는 방법. - 제40항 내지 제50항 중 어느 한 항에 있어서,
콘주게이트가 폴리에틸렌 글리콜(PEG)에 콘주게이션된 약물 분자에 비해 감소된 면역원성을 갖는 방법. - 제40항 내지 제52항 중 어느 한 항에 있어서,
질환이 암, 대사 질환, 자가면역 질환, 심혈관 질환, 및 정형외과 장애로부터 선택되는 방법. - 제53항에 있어서,
질환이 암을 포함하는 방법. - 제54항에 있어서,
암이 유방암, 결장직장암, 결장암, 폐암, 전립선암, 고환암, 뇌암, 피부암, 직장암, 위암, 식도암, 육종, 기관암, 두부경부암, 췌장암, 간암, 난소암, 림프모양 암, 자궁경부암, 외음부암, 흑색종, 중피종, 신장암, 방광암, 갑상선암, 뼈암, 암종, 육종, 및 연조직암으로부터 선택되는 방법. - 제55항에 있어서,
암이 유방암을 포함하는 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562200726P | 2015-08-04 | 2015-08-04 | |
| US62/200,726 | 2015-08-04 | ||
| PCT/US2016/045655 WO2017024182A1 (en) | 2015-08-04 | 2016-08-04 | Genetically encoded intrinsically disordered stealth polymers for delivery and methods of using same |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20180033586A true KR20180033586A (ko) | 2018-04-03 |
Family
ID=57943998
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020187006140A KR20180033586A (ko) | 2015-08-04 | 2016-08-04 | 전달을 위한 유전적으로 인코딩된 내재적으로 무질서화된 스텔스 중합체 및 이의 이용 방법 |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US11458205B2 (ko) |
| EP (1) | EP3331557B1 (ko) |
| JP (1) | JP6882782B2 (ko) |
| KR (1) | KR20180033586A (ko) |
| CN (1) | CN108463244B (ko) |
| AU (1) | AU2016301391B2 (ko) |
| BR (1) | BR112018002342A2 (ko) |
| CA (1) | CA2994279A1 (ko) |
| EA (1) | EA037478B1 (ko) |
| MX (1) | MX2018001511A (ko) |
| WO (1) | WO2017024182A1 (ko) |
| ZA (1) | ZA201800939B (ko) |
Families Citing this family (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10392611B2 (en) | 2013-05-30 | 2019-08-27 | Duke University | Polymer conjugates having reduced antigenicity and methods of using the same |
| US10364451B2 (en) | 2013-05-30 | 2019-07-30 | Duke University | Polymer conjugates having reduced antigenicity and methods of using the same |
| US10385115B2 (en) | 2015-03-26 | 2019-08-20 | Duke University | Fibronectin type III domain-based fusion proteins |
| WO2017024182A1 (en) | 2015-08-04 | 2017-02-09 | Duke University | Genetically encoded intrinsically disordered stealth polymers for delivery and methods of using same |
| US11752213B2 (en) | 2015-12-21 | 2023-09-12 | Duke University | Surfaces having reduced non-specific binding and antigenicity |
| US11467156B2 (en) | 2016-06-01 | 2022-10-11 | Duke University | Nonfouling biosensors |
| RU2019110848A (ru) | 2016-09-14 | 2020-10-15 | Дьюк Юниверсити | Наночастицы на основе триблочных полипептидов для доставки гидрофильных лекарственных средств |
| US11155584B2 (en) | 2016-09-23 | 2021-10-26 | Duke University | Unstructured non-repetitive polypeptides having LCST behavior |
| US11648200B2 (en) | 2017-01-12 | 2023-05-16 | Duke University | Genetically encoded lipid-polypeptide hybrid biomaterials that exhibit temperature triggered hierarchical self-assembly |
| US11554097B2 (en) | 2017-05-15 | 2023-01-17 | Duke University | Recombinant production of hybrid lipid-biopolymer materials that self-assemble and encapsulate agents |
| WO2019006374A1 (en) | 2017-06-30 | 2019-01-03 | Duke University | ORDER AND DISORDER AS A DESIGN PRINCIPLE FOR STIMULI-SENSITIVE BIOPOLYMER NETWORKS |
| WO2020028806A1 (en) | 2018-08-02 | 2020-02-06 | Duke University | Dual agonist fusion proteins |
| JP2022512661A (ja) * | 2018-10-10 | 2022-02-07 | ユニヴァーシティ オブ ワシントン | 混合荷電ペプチドを含む融合生成物およびバイオコンジュゲート |
| US11512314B2 (en) | 2019-07-12 | 2022-11-29 | Duke University | Amphiphilic polynucleotides |
| WO2021252391A1 (en) * | 2020-06-09 | 2021-12-16 | Academia Sinica | Methods and vectors for enhancing expression and/or inhibiting degradation of protein |
Family Cites Families (189)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4500707A (en) | 1980-02-29 | 1985-02-19 | University Patents, Inc. | Nucleosides useful in the preparation of polynucleotides |
| US4458066A (en) | 1980-02-29 | 1984-07-03 | University Patents, Inc. | Process for preparing polynucleotides |
| US4554101A (en) | 1981-01-09 | 1985-11-19 | New York Blood Center, Inc. | Identification and preparation of epitopes on antigens and allergens on the basis of hydrophilicity |
| US4668777A (en) | 1981-03-27 | 1987-05-26 | University Patents, Inc. | Phosphoramidite nucleoside compounds |
| US4973679A (en) | 1981-03-27 | 1990-11-27 | University Patents, Inc. | Process for oligonucleo tide synthesis using phosphormidite intermediates |
| US4415732A (en) | 1981-03-27 | 1983-11-15 | University Patents, Inc. | Phosphoramidite compounds and processes |
| US4976734A (en) | 1985-10-31 | 1990-12-11 | Uab Research Foundation | Stimulation of chemotaxis by chemotactic peptides |
| US5153319A (en) | 1986-03-31 | 1992-10-06 | University Patents, Inc. | Process for preparing polynucleotides |
| US5250516A (en) | 1986-04-17 | 1993-10-05 | Uab Research Foundation | Bioelastomeric materials suitable for the protection of burn areas or the protection of wound repair sites from the occurrence of adhesions |
| US5336256A (en) | 1986-04-17 | 1994-08-09 | Uab Research Foundation | Elastomeric polypeptides as vascular prosthetic materials |
| US5120643A (en) | 1987-07-13 | 1992-06-09 | Abbott Laboratories | Process for immunochromatography with colloidal particles |
| US5278302A (en) | 1988-05-26 | 1994-01-11 | University Patents, Inc. | Polynucleotide phosphorodithioates |
| US5602244A (en) | 1988-05-26 | 1997-02-11 | Competitive Technologies, Inc. | Polynucleotide phosphorodithioate compounds |
| US5703055A (en) | 1989-03-21 | 1997-12-30 | Wisconsin Alumni Research Foundation | Generation of antibodies through lipid mediated DNA delivery |
| US5362623A (en) | 1991-06-14 | 1994-11-08 | The John Hopkins University | Sequence specific DNA binding by p53 |
| WO1991019813A1 (en) | 1990-06-11 | 1991-12-26 | The University Of Colorado Foundation, Inc. | Nucleic acid ligands |
| US5545130A (en) | 1992-04-08 | 1996-08-13 | Genetronics, Inc. | Flow through electroporation method |
| CA2147605A1 (en) | 1992-10-23 | 1994-05-11 | Michael R. Green | Small molecule inhibition of rna/ligand binding |
| US5534408A (en) | 1993-09-24 | 1996-07-09 | University Of Massachusetts Medical Center | 2-deoxystreptamine aminoglycoside inhibition of HIV RRE/Rev binding |
| US5702359A (en) | 1995-06-06 | 1997-12-30 | Genetronics, Inc. | Needle electrodes for mediated delivery of drugs and genes |
| US5679647A (en) | 1993-08-26 | 1997-10-21 | The Regents Of The University Of California | Methods and devices for immunizing a host against tumor-associated antigens through administration of naked polynucleotides which encode tumor-associated antigenic peptides |
| US5919455A (en) | 1993-10-27 | 1999-07-06 | Enzon, Inc. | Non-antigenic branched polymer conjugates |
| US6933366B2 (en) | 1996-12-27 | 2005-08-23 | Tripep Ab | Specificity exchangers that redirect antibodies to bacterial adhesion receptors |
| US6541580B1 (en) | 1995-03-31 | 2003-04-01 | Carnegie Mellon University | Atom or group transfer radical polymerization |
| US5763548A (en) | 1995-03-31 | 1998-06-09 | Carnegie-Mellon University | (Co)polymers and a novel polymerization process based on atom (or group) transfer radical polymerization |
| US5869326A (en) | 1996-09-09 | 1999-02-09 | Genetronics, Inc. | Electroporation employing user-configured pulsing scheme |
| JP2001511162A (ja) | 1997-02-06 | 2001-08-07 | ノボ ノルディスク アクティーゼルスカブ | 付加され、そして/又は除去された付着基を有するポリペプチド−ポリマー結合体 |
| US6974669B2 (en) | 2000-03-28 | 2005-12-13 | Nanosphere, Inc. | Bio-barcodes based on oligonucleotide-modified nanoparticles |
| US6055453A (en) | 1997-08-01 | 2000-04-25 | Genetronics, Inc. | Apparatus for addressing needle array electrodes for electroporation therapy |
| US6241701B1 (en) | 1997-08-01 | 2001-06-05 | Genetronics, Inc. | Apparatus for electroporation mediated delivery of drugs and genes |
| US6216034B1 (en) | 1997-08-01 | 2001-04-10 | Genetronics, Inc. | Method of programming an array of needle electrodes for electroporation therapy of tissue |
| US6208893B1 (en) | 1998-01-27 | 2001-03-27 | Genetronics, Inc. | Electroporation apparatus with connective electrode template |
| US6120493A (en) | 1998-01-27 | 2000-09-19 | Genetronics, Inc. | Method for the introduction of therapeutic agents utilizing an electroporation apparatus |
| US7087244B2 (en) | 2000-09-28 | 2006-08-08 | Battelle Memorial Institute | Thermogelling oligopeptide polymers |
| US6841617B2 (en) | 2000-09-28 | 2005-01-11 | Battelle Memorial Institute | Thermogelling biodegradable aqueous polymer solution |
| US6296831B1 (en) | 1998-04-10 | 2001-10-02 | Battelle Memorial Institute | Stimulus sensitive gel with radioisotope and methods of making |
| WO1999052560A1 (en) | 1998-04-13 | 1999-10-21 | Massachusetts Institute Of Technology | Comb copolymers for regulating cell-surface interactions |
| US6153655A (en) | 1998-04-17 | 2000-11-28 | Enzon, Inc. | Terminally-branched polymeric linkers and polymeric conjugates containing the same |
| WO2000002620A1 (en) | 1998-07-13 | 2000-01-20 | Genetronics, Inc. | Method and apparatus for electrically assisted topical delivery of agents for cosmetic applications |
| US6192270B1 (en) | 1998-08-14 | 2001-02-20 | Genetronics, Inc. | Apparatus and method for the delivery of drugs and genes into tissue |
| US6150148A (en) | 1998-10-21 | 2000-11-21 | Genetronics, Inc. | Electroporation apparatus for control of temperature during the process |
| US6413587B1 (en) | 1999-03-02 | 2002-07-02 | International Business Machines Corporation | Method for forming polymer brush pattern on a substrate surface |
| WO2000056774A1 (en) | 1999-03-19 | 2000-09-28 | Duke University | Methods of using bioelastomers |
| US7163712B2 (en) | 2000-03-03 | 2007-01-16 | Duke University | Microstamping activated polymer surfaces |
| US20050255554A1 (en) | 2000-03-20 | 2005-11-17 | Ashutosh Chilkoti | Fusion peptides isolatable by phase transition |
| US6852834B2 (en) | 2000-03-20 | 2005-02-08 | Ashutosh Chilkoti | Fusion peptides isolatable by phase transition |
| US7351376B1 (en) | 2000-06-05 | 2008-04-01 | California Institute Of Technology | Integrated active flux microfluidic devices and methods |
| US6660247B1 (en) | 2000-06-23 | 2003-12-09 | Battelle Memorial Institute | Multiple stimulus reversible hydrogels |
| US6649138B2 (en) | 2000-10-13 | 2003-11-18 | Quantum Dot Corporation | Surface-modified semiconductive and metallic nanoparticles having enhanced dispersibility in aqueous media |
| ATE536187T1 (de) | 2000-10-19 | 2011-12-15 | Epimmune Inc | Hla-klasse-i- und -klasse-ii-bindende peptide und ihre verwendungen |
| US7320793B2 (en) | 2001-01-19 | 2008-01-22 | Cytos Biotechnology Ag | Molecular antigen array |
| US6528287B2 (en) | 2001-02-13 | 2003-03-04 | Nestor D. Tomycz | Recombinant human serum transferrins containing peptides for inducing apoptosis in HIV-1 infected cells |
| WO2002081729A2 (en) | 2001-04-06 | 2002-10-17 | California Institute Of Technology | Nucleic acid amplification utilizing microfluidic devices |
| WO2002081372A2 (en) | 2001-04-06 | 2002-10-17 | Carnegie Mellon University | A process for the preparation of nanostructured materials |
| US7300922B2 (en) | 2001-05-25 | 2007-11-27 | Duke University | Modulators of pharmacological agents |
| US20070117173A1 (en) | 2001-09-05 | 2007-05-24 | Levison Peter R | Stable storage of proteins |
| US7179785B2 (en) | 2001-11-21 | 2007-02-20 | The Trustees Of The University Of Pennsylvania | Compounds that bind to p185 and methods of using the same |
| EP1463796B1 (en) | 2001-11-30 | 2013-01-09 | Fluidigm Corporation | Microfluidic device and methods of using same |
| US7314974B2 (en) | 2002-02-21 | 2008-01-01 | Monsanto Technology, Llc | Expression of microbial proteins in plants for production of plants with improved properties |
| US7245963B2 (en) | 2002-03-07 | 2007-07-17 | Advisys, Inc. | Electrode assembly for constant-current electroporation and use |
| US20040101852A1 (en) | 2002-11-21 | 2004-05-27 | Isis Pharmaceuticals Inc. | Modulation of CGG triplet repeat binding protein 1 expression |
| US7491691B2 (en) | 2002-05-03 | 2009-02-17 | Sindrey Dennis R | Connective tissue stimulating peptides |
| CA2525994C (en) | 2002-06-24 | 2012-10-16 | Tufts University | Silk biomaterials and methods of use thereof |
| KR101857900B1 (ko) | 2002-09-06 | 2018-05-14 | 인설트 테라페틱스, 인코퍼레이티드 | 공유결합된 치료제 전달을 위한 사이클로덱스트린-기초 중합체 |
| US8129330B2 (en) | 2002-09-30 | 2012-03-06 | Mountain View Pharmaceuticals, Inc. | Polymer conjugates with decreased antigenicity, methods of preparation and uses thereof |
| US6918284B2 (en) | 2003-03-24 | 2005-07-19 | The United States Of America As Represented By The Secretary Of The Navy | Interconnected networks of single-walled carbon nanotubes |
| WO2004096124A2 (en) | 2003-04-01 | 2004-11-11 | Genentech, Inc. | Compositions and methods for the diagnosis and treatment of tumor |
| AU2004280149A1 (en) | 2003-09-17 | 2005-04-21 | Macropore Biosurgery Inc. | Methods of using regenerative cells in the treatment of peripheral vascular disease and related disorders |
| WO2005062977A2 (en) | 2003-12-23 | 2005-07-14 | The Regents Of The University Of California | Prostate cancer specific internalizing human antibodies |
| DK1745062T3 (da) | 2004-04-22 | 2014-08-11 | Regado Biosciences Inc | Forbedrede modulatorer af koagulationsfaktorer |
| WO2006004778A2 (en) | 2004-06-30 | 2006-01-12 | Dentsply International Inc. | Implant with a biofunctionalized surface and method for its production |
| US7884185B2 (en) | 2004-07-28 | 2011-02-08 | University Of Delaware | Hydrogels and uses thereof |
| CA2583700A1 (en) | 2004-08-11 | 2006-02-23 | Arqule, Inc. | Quinone prodrug compositions and methods of use |
| WO2006110292A2 (en) | 2005-03-25 | 2006-10-19 | The Regents Of The University Of California | Temperature-triggered immobilization and purification of antibodies |
| NZ590930A (en) | 2005-05-09 | 2012-11-30 | Theranos Inc | Improving the calibration accuracy of a fluidic system by comparing test readings with a calibration curve and then adjusting the signal output |
| KR101446503B1 (ko) * | 2005-06-24 | 2014-10-06 | 듀크 유니버시티 | 열 반응성 생중합체에 기초한 직접 약물 전달 시스템 |
| EP1924654B1 (en) | 2005-08-25 | 2020-05-06 | University of Washington | Super-low fouling sulfobetaine and carboxybetaine materials and related methods |
| WO2007035527A2 (en) | 2005-09-15 | 2007-03-29 | Duke University | Non-fouling polymeric surface modification and signal amplification method for biomolecular detection |
| US20130172274A1 (en) | 2005-12-20 | 2013-07-04 | Duke University | Methods and compositions for delivering active agents with enhanced pharmacological properties |
| US8178495B2 (en) | 2008-06-27 | 2012-05-15 | Duke University | Therapeutic agents comprising a GLP-1 receptor agonist and elastin-like peptide |
| CA2634034A1 (en) | 2005-12-20 | 2007-06-28 | Duke University | Methods and compositions for delivering active agents with enhanced pharmacological properties |
| US7709227B2 (en) | 2006-01-04 | 2010-05-04 | Phasebio Pharmaceuticals, Inc. | Multimeric ELP fusion constructs |
| US8841414B1 (en) | 2006-01-27 | 2014-09-23 | University Of Mississippi Medical Center | Targeted delivery of therapeutic peptides by thermally responsive biopolymers |
| WO2007108013A2 (en) | 2006-03-22 | 2007-09-27 | National Institute Of Immunology | Novel bioconjugates as therapeutic agent and synthesis thereof |
| US20100119529A1 (en) | 2006-05-12 | 2010-05-13 | Furgeson Darin Y | Elastin-like polymer delivery vehicles |
| CN101472944B (zh) | 2006-06-13 | 2014-05-28 | 赫里克斯生物医疗公司 | 用于诱导细胞外基质蛋白合成的肽片段 |
| DE602006018206D1 (de) | 2006-06-23 | 2010-12-23 | St Microelectronics Srl | Anordnung einer mikrofluidvorrichtung zur analyse von biologischem material |
| EP2041573B1 (en) | 2006-06-23 | 2019-09-04 | PerkinElmer Health Sciences, Inc. | Methods and devices for microfluidic point-of-care immunoassays |
| GB0614780D0 (en) | 2006-07-25 | 2006-09-06 | Ucb Sa | Biological products |
| US20110039776A1 (en) * | 2006-09-06 | 2011-02-17 | Ashutosh Chilkoti | Fusion peptide therapeutic compositions |
| US8846624B2 (en) | 2006-09-11 | 2014-09-30 | Emory University | Modified protein polymers |
| WO2008043041A1 (en) | 2006-10-04 | 2008-04-10 | University Of Washington | Method and device for rapid parallel microfluidic molecular affinity assays |
| CA2664033A1 (en) | 2006-11-08 | 2008-05-15 | Basf Se | Use of natural, recombinant and synthetic resilins in cosmetics |
| US20080276935A1 (en) | 2006-11-20 | 2008-11-13 | Lixiao Wang | Treatment of asthma and chronic obstructive pulmonary disease with anti-proliferate and anti-inflammatory drugs |
| CA2682580A1 (en) | 2007-03-30 | 2008-10-09 | Duke University | A method of modulating the activity of a nucleic acid molecule |
| JP5718638B2 (ja) | 2007-07-31 | 2015-05-13 | アフィボディ・アーベー | 新規な組成物、方法および使用 |
| WO2009026233A2 (en) | 2007-08-17 | 2009-02-26 | Northwestern University | Self assembling peptide systems and methods |
| US8366652B2 (en) | 2007-08-17 | 2013-02-05 | The Invention Science Fund I, Llc | Systems, devices, and methods including infection-fighting and monitoring shunts |
| ES2319061B1 (es) | 2007-09-11 | 2010-02-10 | Biomedal, S.L. | Metodo de conservacion de peptidos o proteinas. |
| ES2818194T3 (es) | 2007-10-02 | 2021-04-09 | Labrador Diagnostics Llc | Dispositivos modulares para puntos de atención y usos de los mismos |
| WO2009067584A1 (en) | 2007-11-20 | 2009-05-28 | Duke University | Methods and compositions for modulating drug-polymer architecture, pharmacokinetics and biodistribution |
| DE102007057802B3 (de) * | 2007-11-30 | 2009-06-10 | Geneart Ag | Steganographische Einbettung von Informationen in kodierenden Genen |
| AU2008338530A1 (en) | 2007-12-14 | 2009-06-25 | Minitube Of America, Inc. | Gender-specific separation of sperm cells and embryos |
| US8796184B2 (en) | 2008-03-28 | 2014-08-05 | Sentilus, Inc. | Detection assay devices and methods of making and using the same |
| KR101026468B1 (ko) | 2008-09-10 | 2011-04-01 | 한국전자통신연구원 | 생분자 검출 장치 및 검출 방법 |
| TW201029668A (en) | 2008-11-17 | 2010-08-16 | Enzon Pharmaceuticals Inc | Releasable conjugates for nucleic acids delivery systems |
| WO2010054699A1 (en) | 2008-11-17 | 2010-05-20 | Affibody Ab | Conjugates of albumin binding domain |
| BRPI0922790A2 (pt) | 2008-12-05 | 2018-11-06 | Abraxis Bioscience Llc | peptídeos de ligação sparc e usos dos mesmos |
| GB0913775D0 (en) | 2009-08-06 | 2009-09-16 | Medical Res Council | Multispecific peptides |
| WO2010096422A1 (en) | 2009-02-17 | 2010-08-26 | Duke University | Biomolecule polymer conjugates and methods for making the same |
| WO2010142665A1 (en) | 2009-06-11 | 2010-12-16 | Novo Nordisk A/S | Glp-1 and fgf21 combinations for treatment of diabetes type 2 |
| USPP21973P3 (en) | 2009-06-23 | 2011-06-14 | Cellfor Inc. | Loblolly pine tree named ‘CF LP1-7696’ |
| EP2287221A1 (en) | 2009-07-16 | 2011-02-23 | Stichting Katholieke Universiteit meer in het bijzonder Radboud Universiteit Nijmegen | Method for the preparation of high molecular weight oligo(alkylene glycol) functionalized polyisocyanopeptides |
| WO2011025572A1 (en) * | 2009-08-26 | 2011-03-03 | Immunotope, Inc. | Cytotoxic t-lymphocyte-inducing immunogens for prevention, treatment, and diagnosis of cancer |
| EP2481754B1 (en) | 2009-09-22 | 2014-06-18 | Shanghai Yijie Biotechnology Co., Ltd | Specific binding proteins and uses thereof |
| US8602051B2 (en) | 2009-12-10 | 2013-12-10 | Brent W. Proper | Trap-primer system for floor drains |
| CA2788972A1 (en) | 2010-02-12 | 2011-08-18 | University Of Rochester | Antigenic mimics of discontinuous epitopes of pathogen recognized by broadly neutralizing antibodies |
| US10706955B2 (en) * | 2010-03-23 | 2020-07-07 | Iogenetics, Llc | Bioinformatic processes for determination of peptide binding |
| WO2011123830A2 (en) | 2010-04-02 | 2011-10-06 | Amunix Operating Inc. | Alpha 1-antitrypsin compositions and methods of making and using same |
| WO2011123813A2 (en) * | 2010-04-02 | 2011-10-06 | Amunix Operating Inc. | Binding fusion proteins, binding fusion protein-drug conjugates, xten-drug conjugates and methods of making and using same |
| JP2011220803A (ja) | 2010-04-08 | 2011-11-04 | Mitsumi Electric Co Ltd | 電界効果トランジスタ素子を具備するバイオセンサ |
| CN102834114A (zh) | 2010-04-13 | 2012-12-19 | 米迪缪尼有限公司 | 基于纤连蛋白iii型结构域的多聚体支架 |
| CN103108587B (zh) | 2010-05-17 | 2016-09-21 | 申提留斯控股有限公司 | 检测装置和相关使用方法 |
| EP2418284A1 (en) | 2010-08-13 | 2012-02-15 | ERA Biotech, S.A. | Protein body-inducing polypeptide sequences |
| JP5870408B2 (ja) | 2010-06-10 | 2016-03-01 | 国立大学法人九州工業大学 | 可逆的な性質を示す温度応答性シートとそれを用いた細胞シートの製造方法 |
| EP2616797B1 (en) | 2010-09-15 | 2017-01-11 | MBIO Diagnostics Inc. | System and method for detecting multiple molecules in one assay |
| US8470967B2 (en) | 2010-09-24 | 2013-06-25 | Duke University | Phase transition biopolymers and methods of use |
| SG190088A1 (en) | 2010-11-01 | 2013-06-28 | Peptimed Inc | Compositions of a peptide targeting system for treating cancer |
| WO2012162426A1 (en) | 2011-05-23 | 2012-11-29 | The University Of North Carolina At Chapel Hill | Methods and compositions for heptameric targeting ligands |
| KR101357117B1 (ko) | 2011-06-28 | 2014-02-06 | 비앤엘델리팜 주식회사 | 폴리에틸렌글라이콜 또는 이의 유도체로 페길화된 엑센딘-4 유사체, 이의 제조방법 및 이를 유효성분으로 함유하는 당뇨병 예방 또는 치료용 약학적 조성물 |
| US9458214B2 (en) | 2011-09-26 | 2016-10-04 | Novartis Ag | Dual function fibroblast growth factor 21 proteins |
| US9775803B2 (en) | 2011-10-19 | 2017-10-03 | Samsung Electronics Co., Ltd. | Liposome comprising elastin-like polypeptide and tumor cell targeting material and use thereof |
| JP2014531031A (ja) | 2011-10-21 | 2014-11-20 | デシマドックス, エルエルシー | 小分析物の定量的検出のためのポイントオブケア免疫アッセイ |
| WO2013065009A1 (en) | 2011-11-01 | 2013-05-10 | National Institute Of Immunology | A sortase-click reaction suite for synthesis of multivalent dendrimeric protein assembly |
| SG11201402661TA (en) | 2011-11-28 | 2014-08-28 | Phasebio Pharmaceuticals Inc | Therapeutic agents comprising insulin amino acid sequences |
| EP2802308A1 (en) | 2012-01-13 | 2014-11-19 | Allergan, Inc. | Crosslinked hyaluronic acid-collagen gels for improving tissue graft viability and soft tissue augmentation |
| EP2623097B1 (en) | 2012-02-01 | 2015-07-15 | Samsung Electronics Co., Ltd | Solid lipid nanoparticles including elastin-like polypeptides and use thereof |
| EA201590525A1 (ru) | 2012-09-07 | 2015-07-30 | Санофи | Слитые белки для лечения метаболического синдрома |
| KR101993714B1 (ko) | 2013-01-30 | 2019-06-28 | 엔지엠 바이오파마슈티컬스, 아이엔씨. | 대사 장애를 치료하는데 이용하기 위한 조성물과 방법 |
| JP2014156428A (ja) | 2013-02-15 | 2014-08-28 | Univ Of Tokyo | 抗体結合タンパク質 |
| US8980864B2 (en) | 2013-03-15 | 2015-03-17 | Moderna Therapeutics, Inc. | Compositions and methods of altering cholesterol levels |
| KR102109188B1 (ko) | 2013-04-01 | 2020-05-11 | 삼성전자주식회사 | 양이온성 지질을 포함하는 온도민감성 리포좀 및 그의 용도 |
| WO2014194244A1 (en) | 2013-05-30 | 2014-12-04 | Duke University | Enzyme-catalyzed synthesis of site-specific and stoichiometric biomolecule-polymer conjugates |
| US10392611B2 (en) | 2013-05-30 | 2019-08-27 | Duke University | Polymer conjugates having reduced antigenicity and methods of using the same |
| US10364451B2 (en) | 2013-05-30 | 2019-07-30 | Duke University | Polymer conjugates having reduced antigenicity and methods of using the same |
| WO2015011231A1 (en) | 2013-07-25 | 2015-01-29 | Universitat Rovira I Virgili | Method and system for the multiplex identification of analytes in fluids |
| US9777041B2 (en) | 2013-09-09 | 2017-10-03 | New York University | Protein nanofibers from self-assembling pentamers |
| CA2926215A1 (en) | 2013-10-06 | 2015-04-09 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Modified pseudomonas exotoxin a |
| US9884026B2 (en) | 2013-11-01 | 2018-02-06 | Yale University | Modular particles for immunotherapy |
| US10449267B2 (en) | 2013-11-13 | 2019-10-22 | Massachusetts Institute Of Technology | Self-assembling underwater adhesives |
| WO2015120091A1 (en) | 2014-02-04 | 2015-08-13 | Duke University | Systems and devices for protease detection based on engineered polymers and biopolymers and methods of use |
| US10501734B2 (en) | 2014-02-06 | 2019-12-10 | Yale University | Compositions and methods of use thereof for making polypeptides with many instances of nonstandard amino acids |
| WO2015130846A2 (en) | 2014-02-25 | 2015-09-03 | Duke University | Compositions and methods for the site-specific modification of polypeptides |
| US10131690B2 (en) | 2014-04-25 | 2018-11-20 | Phi Pharma Sa | C6S specific transporter molecules |
| BR102014014502B1 (pt) | 2014-06-13 | 2020-09-15 | Ouro Fino Saúde Animal Ltda | Vetor de expressão |
| CN104725628B (zh) | 2014-10-01 | 2018-04-17 | 厦门赛诺邦格生物科技股份有限公司 | 一种含可降解基团的单一官能化支化聚乙二醇、制备方法及其生物相关物质 |
| CN104877127B (zh) | 2015-06-23 | 2017-11-10 | 厦门赛诺邦格生物科技股份有限公司 | 一种八臂聚乙二醇衍生物、制备方法及其修饰的生物相关物质 |
| WO2016065273A1 (en) | 2014-10-24 | 2016-04-28 | The University Of Chicago | Heat-inducible self-assembling protein domains |
| WO2016065300A1 (en) | 2014-10-24 | 2016-04-28 | Eshoo Mark W | Microfluidic cartridge |
| EP3227348A4 (en) | 2014-12-04 | 2018-07-18 | The Trustees of Columbia University in the City of New York | Biodegradable thermo-responsive polymers and uses thereof |
| US9702847B2 (en) | 2014-12-30 | 2017-07-11 | Avails Medical, Inc. | Systems and methods for detecting a substance in bodily fluid |
| US9804170B2 (en) | 2015-02-09 | 2017-10-31 | Bristol-Myers Squibb Company | Antibodies to polyethylene glycol |
| US9956300B2 (en) | 2015-03-18 | 2018-05-01 | Duke Univerity | Hydrogels formed from polypeptide micelles and methods of use thereof |
| US10385115B2 (en) | 2015-03-26 | 2019-08-20 | Duke University | Fibronectin type III domain-based fusion proteins |
| US10064954B2 (en) | 2015-06-23 | 2018-09-04 | Nian Wu | Polymer-cyclodextrin-lipid conjugates |
| WO2017004243A1 (en) | 2015-06-29 | 2017-01-05 | Caris Science, Inc. | Therapeutic oligonucleotides |
| EP3325966B1 (en) | 2015-07-20 | 2021-01-20 | Sentilus Holdco, LLC | Chips, detectors, and methods of making and using the same |
| WO2017024182A1 (en) | 2015-08-04 | 2017-02-09 | Duke University | Genetically encoded intrinsically disordered stealth polymers for delivery and methods of using same |
| GB2556582A (en) | 2015-08-07 | 2018-05-30 | Poc Medical Systems Inc | Microfluidic devices and methods of use thereof |
| US9678037B2 (en) | 2015-10-08 | 2017-06-13 | The Regents Of The University Of Michigan | Two-dimensional material-based field-effect transistor sensors |
| US10688175B2 (en) | 2015-10-13 | 2020-06-23 | Daniel C. Carter | NSP10 self-assembling fusion proteins for vaccines, therapeutics, diagnostics and other nanomaterial applications |
| EP3368507B1 (en) | 2015-10-28 | 2022-12-07 | Acuitas Therapeutics Inc. | Novel lipids and lipid nanoparticle formulations for delivery of nucleic acids |
| WO2017083423A1 (en) | 2015-11-10 | 2017-05-18 | The Board Of Trustees Of The Leland Stanford Junior University | Methods and compositions for modulating aav infection |
| US9496239B1 (en) | 2015-12-11 | 2016-11-15 | International Business Machines Corporation | Nitride-enriched oxide-to-oxide 3D wafer bonding |
| CN109152818B (zh) | 2015-12-21 | 2023-06-23 | 杜克大学 | 具有降低的抗原性的聚合物结合物及其使用方法 |
| WO2017171001A1 (ja) | 2016-03-31 | 2017-10-05 | 味の素株式会社 | フィブロイン様タンパク質改変体および細胞培養方法 |
| AU2017261216B2 (en) | 2016-05-06 | 2023-08-03 | Immunoforge Co., Ltd. | ELP fusion proteins for controlled and sustained release |
| MX2019004913A (es) | 2016-10-26 | 2019-09-16 | Curevac Ag | Vacunas de nanoparticulas lipidicas que comprenden acido ribonucleico mensajero (arnm). |
| WO2018115401A1 (en) | 2016-12-22 | 2018-06-28 | Sanofi | Fgf21 compound / glp-1r agonist combinations with optimized activity ratio |
| US11684584B2 (en) | 2016-12-30 | 2023-06-27 | Genevant Sciences Gmbh | Branched peg molecules and related compositions and methods |
| WO2018144854A1 (en) | 2017-02-02 | 2018-08-09 | Caris Science, Inc. | Targeted oligonucleotides |
| US11554097B2 (en) | 2017-05-15 | 2023-01-17 | Duke University | Recombinant production of hybrid lipid-biopolymer materials that self-assemble and encapsulate agents |
| EP3639003A4 (en) | 2017-06-14 | 2021-03-17 | Emulate, Inc. | EFFECTS OF SPACE TRAVEL ON HUMAN BRAIN CELLS |
| WO2019006374A1 (en) | 2017-06-30 | 2019-01-03 | Duke University | ORDER AND DISORDER AS A DESIGN PRINCIPLE FOR STIMULI-SENSITIVE BIOPOLYMER NETWORKS |
| US11235324B2 (en) | 2017-11-22 | 2022-02-01 | Hewlett-Packard Development Company, L.P. | Temperature-cycling microfluidic devices |
| WO2019147954A1 (en) | 2018-01-26 | 2019-08-01 | Duke University | Albumin binding peptide-drug (aibiped) conjugates and methods of making and using same |
| US20190292549A1 (en) | 2018-03-22 | 2019-09-26 | Northeastern University | Poly(ethylene glycol) brushes for efficient rna delivery |
| CA3109426A1 (en) | 2018-08-17 | 2020-02-20 | The Regents Of The University Of California | Particle-containing droplet systems with monodisperse fluid volumes |
| WO2020160472A1 (en) | 2019-02-01 | 2020-08-06 | Sentilus Holdco, Llc | High-sensitivity assay |
-
2016
- 2016-08-04 WO PCT/US2016/045655 patent/WO2017024182A1/en active Application Filing
- 2016-08-04 BR BR112018002342A patent/BR112018002342A2/pt not_active Application Discontinuation
- 2016-08-04 CA CA2994279A patent/CA2994279A1/en active Pending
- 2016-08-04 MX MX2018001511A patent/MX2018001511A/es unknown
- 2016-08-04 US US15/749,797 patent/US11458205B2/en active Active
- 2016-08-04 AU AU2016301391A patent/AU2016301391B2/en active Active
- 2016-08-04 KR KR1020187006140A patent/KR20180033586A/ko unknown
- 2016-08-04 CN CN201680058249.5A patent/CN108463244B/zh active Active
- 2016-08-04 EP EP16833900.0A patent/EP3331557B1/en active Active
- 2016-08-04 EA EA201890417A patent/EA037478B1/ru unknown
- 2016-08-04 JP JP2018506150A patent/JP6882782B2/ja active Active
-
2018
- 2018-02-12 ZA ZA2018/00939A patent/ZA201800939B/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| EP3331557B1 (en) | 2021-04-07 |
| CN108463244B (zh) | 2022-05-27 |
| BR112018002342A2 (pt) | 2018-12-11 |
| MX2018001511A (es) | 2018-08-01 |
| CN108463244A (zh) | 2018-08-28 |
| JP2018525989A (ja) | 2018-09-13 |
| US20180228908A1 (en) | 2018-08-16 |
| AU2016301391B2 (en) | 2022-07-28 |
| EP3331557A1 (en) | 2018-06-13 |
| EA037478B1 (ru) | 2021-04-01 |
| JP6882782B2 (ja) | 2021-06-02 |
| EA201890417A1 (ru) | 2018-08-31 |
| AU2016301391A1 (en) | 2018-02-22 |
| CA2994279A1 (en) | 2017-02-09 |
| ZA201800939B (en) | 2019-05-29 |
| EP3331557A4 (en) | 2019-03-13 |
| US11458205B2 (en) | 2022-10-04 |
| WO2017024182A1 (en) | 2017-02-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20180033586A (ko) | 전달을 위한 유전적으로 인코딩된 내재적으로 무질서화된 스텔스 중합체 및 이의 이용 방법 | |
| US10385115B2 (en) | Fibronectin type III domain-based fusion proteins | |
| ES2906795T3 (es) | Receptores de células T anti-KK-LC-1 | |
| CA2563754C (en) | Recombinant polypeptides of the members of the tnf ligand family and use thereof | |
| ES2352228T3 (es) | Procedimiento y composiciones para usar el polipéptido de cadena invariante de mhc de clase ii como receptor para el factor inhibidor de la migración de macrófagos. | |
| JP7164598B2 (ja) | トランスジェニックマクロファージ、キメラ抗原受容体、及び関連する方法 | |
| JP2022524018A (ja) | Il-10バリアント分子ならびに炎症性疾患および腫瘍を処置する方法 | |
| JP2011504369A (ja) | 改良されたサイトカインの設計 | |
| Herrmann et al. | An effective cell-penetrating antibody delivery platform | |
| JP2004533825A5 (ko) | ||
| EP4349856A1 (en) | Development and use of novel interleukin 15 mutant polypeptide | |
| ES2945008T3 (es) | Proteína que comprende NC-1 para el tratamiento de enfermedades relacionadas con la angiogénesis | |
| US20110293567A1 (en) | Use of bacteria for the sensing and killing of cancer cells | |
| US20230086188A1 (en) | Proteins with predictable liquid-liquid phase separation | |
| US20230093708A1 (en) | Protein nanoparticle design and application | |
| JP2023532278A (ja) | 抗原特異的t細胞受容体及びキメラ抗原受容体、並びにがん免疫療法のための免疫シグナル伝達モジュレーションにおける使用方法 | |
| AU2021296605A9 (en) | Cytokine conjugates | |
| ES2776243T3 (es) | Un polipéptido de dímero CCL20 bloqueado modificado por ingeniería | |
| CN116143902B (zh) | SIRPα变体及其应用 | |
| Moreno | Exploring the Interface Between Therapeutically Relevant Polymers | |
| US20210340205A1 (en) | Gfral extracellular domains and methods of use | |
| CN116143902A (zh) | SIRPα变体及其应用 | |
| GB2455634A (en) | Treatment of cancer |