KR20140146651A - 인간 호흡기 합포체 바이러스 공통 항원, 핵산 컨스트럭트 및 이들로부터 제조된 백신, 및 이들을 사용하는 방법 - Google Patents
인간 호흡기 합포체 바이러스 공통 항원, 핵산 컨스트럭트 및 이들로부터 제조된 백신, 및 이들을 사용하는 방법 Download PDFInfo
- Publication number
- KR20140146651A KR20140146651A KR1020147031459A KR20147031459A KR20140146651A KR 20140146651 A KR20140146651 A KR 20140146651A KR 1020147031459 A KR1020147031459 A KR 1020147031459A KR 20147031459 A KR20147031459 A KR 20147031459A KR 20140146651 A KR20140146651 A KR 20140146651A
- Authority
- KR
- South Korea
- Prior art keywords
- seq
- nucleic acid
- rsv
- coding sequence
- encoding
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/005—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
- A61K39/155—Paramyxoviridae, e.g. parainfluenza virus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/39—Medicinal preparations containing antigens or antibodies characterised by the immunostimulating additives, e.g. chemical adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/53—DNA (RNA) vaccination
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55522—Cytokines; Lymphokines; Interferons
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/57—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/70—Multivalent vaccine
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2760/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses negative-sense
- C12N2760/00011—Details
- C12N2760/18011—Paramyxoviridae
- C12N2760/18511—Pneumovirus, e.g. human respiratory syncytial virus
- C12N2760/18522—New viral proteins or individual genes, new structural or functional aspects of known viral proteins or genes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2760/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses negative-sense
- C12N2760/00011—Details
- C12N2760/18011—Paramyxoviridae
- C12N2760/18511—Pneumovirus, e.g. human respiratory syncytial virus
- C12N2760/18534—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Virology (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Epidemiology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Pulmonology (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Gastroenterology & Hepatology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
RSV 면역원을 인코딩하는 하나 이상의 핵산 서열을 포함하는 핵산 분자들 및 조성물들이 기재되어 있다. 공통 RSV F 단백질을 인코딩하는 서열 또는 이의 면역원성 단편, RSV G(A) 단백질을 인코딩하는 서열 또는 이의 면역원성 단편 및 RSV G(B) 단백질을 인코딩하는 서열 또는 이의 면역원성 단편을 포함하는 핵산이 기재되어 있다. 1개, 2개 또는 모든 3개 서열들의 조합을 포함하는 조성물들이 기재되어 있다. 코딩 서열들은 신호 펩타이드를 인코딩하는 작동적으로 연결된 코딩 서열을 임의로 포함한다. 케모킨 CC20 및/또는 공통 RSV M2-1 단백질 또는 이의 면역원성 단편을 포함하는 핵산 분자들 및 조성물들이 또한 기재되어 있다. 면역조절 방법들 및 RSV에 대한 면역 반응을 유도하는 방법들이 기재되어 있다. RSV 감염을 예방하는 방법 및 RSV로 감염된 개인을 치료하는 방법들이 기재되어 있다.
Description
본 발명은 공통 항원성 호흡기 합포체 바이러스 단백질 및 이를 인코딩하는 핵산 분자; 이러한 단백질 및/또는 핵산 분자를 포함하는 개선된 호흡기 합포체 바이러스 백신; 및 면역 반응을 유도하고 호흡기 합포체 바이러스 감염을 예방하고/하거나 호흡기 합포체 바이러스로 감염된 개인을 치료하기 위한 백신을 사용하는 방법에 관한 것이다.
본 출원은, 이의 전문이 본원에 참조로 통합된 미국 가특허원 제61/622,279호에 대한 우선권을 청구한다.
인간 호흡기 합포체 바이러스(RSV)는 영아 및 아동(특히 질환에 걸리기 쉬운 조산 영아) 중에서 상기도 및 하기도 감염의 가장 일반적인 원인이 된다. 세계적으로, RSV는 영아(특히 조기 태어나고 만성 폐 질환 또는 선천성 심장 질환을 가진 영아들 중에서) 및 전세계적인 아동에서 심각한 하기도 감염의 주된 원인이며, 입원한 어린이 중에서 폐렴의 경우의 20 내지 25% 및 세기관지염의 경우의 45 내지 50%를 포함하는, 각종 질병에 관여한다. 미국에서, RSV 발명은 매년 대략 120,000명의 입원 및 500+ 명의 사망을 초래한다. 1세 미만의 집단에서, RSV는 영아 바이러스 사망의 주된 원인이며 당해 집단 중에서 사망률은 인플루엔자 감염으로 인한 사망률보다 10배 더 높다. 세계적인 연간 이환율 및 사망률은 각각 6,400만 및 160,000명의 사망으로 추정되었다. RSV-관련 의약 비용은 >6억5천만 달러/년으로 추정되었다.
필수적으로 모든 어린이가 2세까지 감염을 경험하지만, 심각한 RSV 감염의 최대 연령은 2 내지 6개월이다. 감염의 대부분은 별탈 없이 해결된다. 그러나, 일부 어린이의 경우, 감염은 후에 어린이를 생애에서 천식 및 기도 과민반응성이 되도록할 수 있다. 천연의 RSV 감염은 생애 면역성을 부여하지 않으므로, 개인은 반복적으로 감염될 수 있다.
RSV 감염은 노인 및 다른 취약한 집단 중에서 유의적인 문제를 일으킨다. 노인 중에서, RSV는 바이러스 사망의 두 번째로 주된 원인이다. 이식 수용체 및 다른 면역약화된 집단(immunocompromised population) 및 또한 낭포성 섬유증으로 고생하는 개인은 감염으로 인하여 심각한 건강 결과로 취약해질 수 있다.
호흡기 합포체 바이러스(RSV)는 인플루엔자와 같은 일반적인 호흡기 바이러스 및 볼거리 및 홍역을 유발하는 것들을 포함하는 계열인, 파라믹소비리다에( Paramyxoviridae ) 계열의 엔벨로프된(enveloped), 네가티브-센스(negative-sense), 단일-가닥 RNA 바이러스이다. 전적으로, RSV는 11개의 상이한 단백질을 인코딩하는 10개의 유전자를 갖는다. 11개의 RSV 단백질은: 제I 형 인터페론 활성을 억제하는 단백질 1) 단백질 "NS1" 및 2) 단백질 "NS2"; 3) RNA를 형성하는 뉴클레오캡시드(nucleocapsid)와 연관된 뉴클레오캡시드 단백질인, 단백질 N; 4) 단백질 L에 대한 보조인자인 단백질 "P"; 5) 바이러스 조립에 요구되는 매트릭스 단백질인, 단백질 "M"; 6) 단백질 G 및 단백질 F와 함께 바이러스 외피를 형성하는 바이러스 표면에 발현되는, 단백질 "SH"; 7) 고도로 글리코실화되어 있고, 표면에서 발현되며, 바이러스 공격에 관여하여 글리코사미노글리칸들(GAGs)에 결합하는, 단백질 "G"; 8) 표면에서 발현되며, 바이러스 -세포막 융합 및 및 매개융합으로 바이러스가 세포 세포질내로 도입되도록 하는 단백질 "F"; 9) 매트릭스 단백질 및 연장 인자인 단백질 "M2-1"; 10) 매트릭스 단백질 및 전사 인자인, 단백질 "M2-2"; 및, 11) RNA 폴리머라제인 단백질 "L"을 포함한다. M2 유전자는 오우버랩된 개방 판독 프레임내에 단백질 M2-1 및 단백질 M2-2 둘 다를 인코딩한다. 일차 CD8 T 세포 에피토프는 M2 유전자에 의해 인코딩된다. 인간 RSV - A 및 B의 2개의 주요 아형이 존재한다. 2개의 아형 잔기 사이의 주요 차이는 G 단백질내에 존재한다.
RSV 감염은 흔히 면역 매개된 병리학 및 바이러스 매개된 병리학 둘 다를 생성한다. 주요 RSV 감염은 흔히 염증-유도된 기도 폐색을 초래하는 급성 세기관지염을 생성한다. RSV F 결합은 세포자멸사(apoptosis)를 유도하여 섬모 상피 세포의 붕괴, 약화된 폐 제거율(compromised pulmonary clearance), 및 후속적인 2차 감염을 생성하는 것으로 밝혀졌다.
불행히도, 막대한 노력에도 불구하고, RSV에 대해 이용가능한 효과적인 백신은 아직까지 존재하지 않는다. 1966년 내지 1967년에, 최초의 RSV 백신 후보물질인, 포르말린-불활성화된 명반-침전된 RSV 제제(FI-RSV 백신)이 후속적인 천연적인 감염 시 예방접종된 어린이에서 강화된 질환을 생성하였다. 예방접종 후 감염에 의해 유발된 강화된 질환으로 사망한 어린이의 폐의 조직학적 분석은 폐 호산구증가증을 포함하는 강력한 단핵 세포 침윤을 나타내었다. FI-RSV 백신은 변성된 F 단백질로 인하여 중화 활성없이 결합 항체만을 생성하였으며 CTL 활성을 유도하지 않았다.
후속적인 실험은, 이러한 강화된 폐 질환이 CD4 T 세포에 의한 과장된 Th2-형 사이토킨 반응, CD8 T 세포에 의한 불량한 세포분해 반응, 및 약한 중화 항체 반응과 연관되어 있음을 제안하여 왔다. FI-RSV 예방접종된 BALB/c 및 C57BL/6 마우스의 RSV 감염은 FI-RSV 예방접종된 어린이에서 관찰된 강화된 질환을 생성하였다. Th2-매개된 면역 반응의 특징은, 면역화된 어린이가 백신에 의한 Th2 면역 반응에 대해 준비시킴을 제안하였다. 증가된 수준의 Th2-연관된 사이토킨 IL-5, IL-4, 및 IL-13 및 Th1-연관된 사이토킨 IL-12가 감소된 케모키네오탁신이 나타났다. IL-4, IL-10, 또는 IL-13의 고갈은 RSV 챌린지 후 강화된 질환에서 유의적인 감소를 초래하였다.
생 약독화되고 불활성화된 전체 바이러스 백신은 또한 보호하는데 실패하여 왔다. 후보물 백신은 강화된 질환에 대해 불충분하게 약독화되거나 잠재력을 입증하였다. 1982년에, 생 약독화된 RSV 백신이 안전하지만 RSV 질병의 예방에 효과적이지 않음이 밝혀졌다.
1983년에, B형 연쇄상 구균 질환을 지니고 있지만 실제로는 RSV에 감염된 것으로 고려되었던, 북미 원주민 영아인, "베이비 무스(Baby Moose)"가 IGIV를 제공받은 경우 우연히도 개선되었다. 이러한 결과는 RSV 질환에 대한 IGIV의 연구를 촉진하였다. RSV 질병의 치료 및 예방을 위한 1980년대 중반에서부터 1990년대까지의 표준 IGIV의 연구는 RSV 질환을 예방하는데 있어서 항체의 역할을 입증하였다.
1990년대 초기에, RSV 백신 연구는 다양한 소단위 다양성을 사용하여 재-개시되었다. 이러한 시도는 질환으로부터 유의적인 보호를 나타내는데 실패하였다.
1990년대 중반으로부터 2002년 초기까지, RSV에 의해 유발된 심각한 기도 질환의 예방을 위한 팔리비주마브(RSV-F에 대해 특이적인 모노클로날 항체)의 임상 시험은 긍정의 결과를 생산하였다. 2003년 9월에, 팔리비주마브는 고-위험 어린이에서 RSV-연관된 질환의 예방용으로 승인되었다. 팔리비주마브의 예방학적 치료는 질환의 심각성을 감소시키는데 효과적이지만, 치료에 관련된 고비용으로 인하여 고-위험 환자용으로만 추천된다.
과거의 연구가 효과적인 RSV 백신을 수득하는데 실패하였다고 해도, 이들은 RSV 감염에 대한 완벽한 보호를 제공하는데 있어서 면역 반응의 중요성을 설득력있게 입증하여 왔다. 연구는 RSV-매개된 질환에 대한 보호시 체액성 반응 및 항체의 중요성을 지지하는 증거를 발견하여 왔다. 폐에서 IgG 항체의 존재는 감소된 바이러스 부하(viral load)와 연관되며 심각하지 않은 RSV 질환을 지닌 어린이는 흔히 감염 전에 유의적으로 보다 높은 항-RSV 항체 역가를 가진다. 융합 단백질에 대한 항체는 면역성과 중요한 관련성이 있다. RSV로 감염되지 않았던 영아는 감염된 영아보다 IgG의 더 높은 평균 역가를 가졌으며 감염되어 왔던 영아의 모친보다 유의적으로 더 높은 모계 RSV-특이적인 IgG 항체를 가졌던 모친에게서 태어났다. 보호를 매개하는데 있어서 항체의 중요성은, 조산 영아가 RSV 감염 후 심각한 질병에 대해 이러한 고 위험에 있는 이유를 설명하는데 도움을 준다. 모계 IgG는 임신 3개월까지 태아에 효율적으로 전달되지 않는다.
유사하게, RSV 감염에 대한 완전한 보호를 제공하는데 있어서 세포 면역 반응의 중요성이 또한 입증되어 왔다. T 세포 결핍증을 지닌 어린이는 바이러스를 제거하는데 어려움을 지니며 후속적인 RSV 감염에 더 민감할 수 있다. 동물 연구에서, 마우스에서 CD8 T 세포만의 결핍은 만성 감염을 초래하지는 않지만, 지연된 바이러스 제거를 초래한다. 제거는 지연된 바이러스 제거시 이들 결과들 중 어느 것에서 IFN-γ, FasL, TNF-α. 결핍을 필요로 한다. 또한, VV-G로 면역화된 C57BL/6 마우스는 RSV-관련된 강화된 질환으로 진행되지 않지만, 면역화 전에 CD8 T 세포의 고갈은 질환을 생성한다.
RSV에 대해 장기간 보호를 유도하는, 면역원성 항원을 포함하는, RSV 백신에 대한 요구가 존재한다. RSV에 대한 질량 예방학적 예방접종을 가능하도록 하는 비용-효율적인 전달 시스템에 대한 요구가 또한 존재한다. RSV로 감염된 개인을 치료하기 위한 추가의 치료제에 대한 요구가 또한 존재한다.
발명의 요약
하나 이상의 공통 RSV 면역원을 인코딩하는 하나 이상의 핵산 서열을 포함하는 핵산 분자가 제공된다. RSV 면역원은 공통 RSV F 면역원, 공통 RSV-G(A) 면역원, 및 공통 RSV G(B) 면역원을 포함한다.
RSV 면역원을 인코딩하는 하나 이상의 핵산 서열을 포함하는 조성물이 제공된다. 핵산은 a) RSV F 면역원을 인코딩하는 핵산 코딩 서열, b) RSV Ga 면역원을 인코딩하는 핵산 코딩 서열, 및 c) RSV Gb 면역원을 인코딩하는 핵산 코딩 서열로 이루어진 그룹 중에서 선택된다.
일부 구현예에서, RSV F 면역원을 인코딩하는 핵산 코딩 서열은 서열 번호: 2, 서열 번호: 2의 단편, 서열 번호: 2에 대해 적어도 98% 상동성인 단백질 및 서열 번호: 2에 대해 적어도 98% 상동성인 단백질의 단편으로 이루어진 그룹 중에서 선택된 RSV F 면역원을 인코딩한다. 각각의 예에서, RSV F 면역원을 인코딩하는 핵산 코딩 서열은 당해 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함할 수 있다.
일부 구현예에서, RSV Ga 면역원을 인코딩하는 핵산 코딩 서열은 서열 번호: 6, 서열 번호: 6의 단편, 서열 번호: 6에 대해 적어도 98% 상동성인 단백질 및 서열 번호: 6에 대해 적어도 98% 상동성인 단백질의 단편으로 이루어진 그룹 중에서 선택된 RSV Ga 면역원을 인코딩한다. 각각의 예에서, RSV Ga 면역원을 인코딩하는 핵산 코딩 서열은 당해 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함할 수 있다.
일부 구현예에서, RSV Gb 면역원을 인코딩하는 핵산 코딩 서열은 서열 번호: 8, 서열 번호: 8의 단편, 서열 번호: 8에 대해 적어도 98% 상동성인 단백질 및 서열 번호: 8에 대해 적어도 98% 상동성인 단백질의 단편으로 이루어진 그룹 중에서 선택된 RSV Gb 면역원을 인코딩한다. 각각의 예에서 RSV Gb 면역원을 인코딩하는 핵산 코딩 서열은 당해 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함할 수 있다.
일부 구현예에서, RSV F 면역원을 인코딩하는 핵산 코딩 서열은 서열 번호: 1을 포함하는 핵산 서열, 서열 번호: 1의 단편을 포함하는 핵산 서열, 서열 번호: 1에 대해 적어도 98% 상동성인 서열을 포함하는 핵산 서열, 및 서열 번호: 1에 대해 적어도 98% 상동성인 서열의 단편을 포함하는 핵산 서열로 이루어진 그룹 중에서 선택된다. 각각의 예에서, RSV F 면역원을 인코딩하는 핵산 코딩 서열은 당해 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함할 수 있다. 서열 번호: 1에 대해 적어도 98% 상동성인 서열을 포함하는 핵산 서열은 바람직하게는 서열 번호: 2에 대해 적어도 98% 상동성인 단백질을 인코딩한다. 서열 번호: 1에 대해 적어도 98% 상동성인 서열의 단편을 포함하는 핵산 서열은 서열 번호: 2에 대해 적어도 98% 상동성인 단백질의 단편을 바람직하게 암호화한다.
일부 구현예에서, RSV Ga 면역원을 인코딩하는 핵산 코딩 서열은 서열 번호: 5를 포함하는 핵산 서열, 서열 번호: 5의 단편을 포함하는 핵산 서열, 서열 번호: 5에 대해 적어도 98% 상동성인 서열을 포함하는 핵산 서열, 및 서열 번호: 5에 대해 적어도 98% 상동성인 서열의 단편을 포함하는 핵산 서열로 이루어진 그룹 중에서 선택된다. 각각의 예에서, RSV Ga 면역원을 인코딩하는 핵산 코딩 서열은 당해 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함할 수 있다. 서열 번호: 5에 대해 적어도 98% 상동성인 서열을 포함하는 핵산 서열은 서열 번호: 6에 대해 적어도 98% 상동성인 단백질을 바람직하게 암호화한다. 서열 번호: 5에 대해 적어도 98% 상동성인 서열의 단편을 포함하는 핵산 서열은 서열 번호: 6에 대해 적어도 98% 상동성인 단백질의 단편을 바람직하게 인코딩한다.
일부 구현예에서, RSV Gb 면역원을 인코딩하는 핵산 코딩 서열은 서열 번호: 7을 포함하는 핵산 서열, 서열 번호: 7의 단편을 포함하는 핵산 서열, 서열 번호: 7 에 대해 적어도 98% 상동성인 서열을 포함하는 핵산 서열, 및 서열 번호: 7에 대해 적어도 98% 상동성인 서열의 단편을 포함하는 핵산 서열로 이루어진 그룹 중에서 선택된다. 각각의 예에서 RSV Gb 면역원을 인코딩하는 핵산 코딩 서열은 당해 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함할 수 있다. 서열 번호: 7에 대해 적어도 98% 상동성인 서열을 포함하는 핵산 서열은 서열 번호: 8에 대해 적어도 98% 상동성인 단백질을 바람직하게 인코딩한다. 서열 번호: 7에 대해 적어도 98% 상동성인 서열의 단편을 포함하는 핵산 서열은 서열 번호: 8에 대해 적어도 98% 상동성인 단백질이 단편을 바람직하게 인코딩한다.
일부 구현예에서, 당해 조성물은: 서열 번호: 10을 인코딩하는 핵산 서열; 서열 번호: 14를 인코딩하는 핵산 서열; 및 서열 번호: 16을 인코딩하는 핵산 서열로 이루어진 그룹 중에서 선택된 하나 이상의 핵산 서열을 포함한다.
일부 구현예에서, 당해 조성물은: 서열 번호: 9를 포함하는 핵산 서열; 서열 번호: 13을 포함하는 핵산 서열; 및 서열 번호: 15를 포함하는 핵산 서열로 이루어진 그룹 중에서 선택된 하나 이상의 핵산 서열을 포함한다.
일부 구현예에서, 당해 조성물은 다음으로 이루어진 그룹 중에서 선택된 핵산 서열을 포함한다:
RSV F 면역원을 인코딩하는 핵산 코딩 서열,
RSV Ga 면역원을 인코딩하는 핵산 코딩 서열,
RSV Gb 면역원을 인코딩하는 핵산 코딩 서열,
RSV F 면역원을 인코딩하는 핵산 코딩 서열 및 RSV Ga 면역원을 인코딩하는 핵산 코딩 서열,
RSV F 면역원을 인코딩하는 핵산 코딩 서열 및 RSV Gb 면역원을 인코딩하는 핵산 코딩 서열,
RSV Ga 면역원을 인코딩하는 핵산 코딩 서열 및 RSV Gb 면역원을 인코딩하는 핵산 코딩 서열,
RSV F 면역원을 인코딩하는 핵산 코딩 서열, RSV Ga 면역원을 인코딩하는 핵산 코딩 서열 및 RSV Gb 면역원을 인코딩하는 핵산 코딩 서열,
당해 조성물은 CCL20을 인코딩하는 핵산 코딩 서열을 추가로 포함할 수 있고/있으며 전기천공을 사용하여 개인에게 전달하기 위해 제형화되고/되거나 IL-12, IL-15 및 IL-28로 이루어진 그룹 중에서 선택된 하나 이상의 단백질을 암호화하는 핵산 서열을 추가로 포함한다.
일부 구현예에서, 하나 이상의 핵산 코딩 서열은 하나 이상의 플라스미드의 부분이다. 일부 구현예에서, 하나 이상의 핵산 코딩 서열은 별개의 플라스미드내로 각각 혼입된다.
개인에서 면역 반응을 유도하는데 효과적인 양의 조성물을 상기 개인에게 투여함을 포함하여 RSV에 대한 면역 반응을 유도하는 방법이 제공된다.
치료학적 유효량의 조성물을 개인에게 투여함을 포함하여 RSV로 진단된 개인을 치료하는 방법이 제공된다.
예방학적 유효량의 조성물을 개인에게 투여함을 포함하여 RSV 감염을 예방하는 방법이 제공된다.
신규한 "RSV F 면역원", "RSV Ga 면역원", 및 "RSV Gb 면역원"가 제공된다. 일부 구현예에서, 서열 번호: 2; 서열 번호: 6; 서열 번호: 8; 서열 번호: 10; 서열 번호: 14; 및 서열 번호: 16으로 이루어진 그룹 중에서 선택된 단백질이 제공된다.
케모킨 CCL20을 인코딩하는 핵산 코딩 서열을 사용하여 면역 반응을 조절하는 방법이 또한 제공된다.
또한, 공통 RSV M2-1 면역원을 인코딩하는 핵산 코딩 서열이 본원에 제공된다. 일부 구현예에서, RSV M2-1 면역원을 인코딩하는 핵산 코딩 서열은 서열 번호: 4, 서열 번호: 4의 단편, 서열 번호: 4에 대해 적어도 98% 상동성인 단백질 및 서열 번호: 4 에 대해 적어도 98% 상동성인 단백질의 단편으로 이루어진 그룹 중에서 선택된 RSV M2-1 면역원을 인코딩한다. 각각의 예에서, RSV M2-1 면역원을 인코딩하는 핵산 코딩 서열은 당해 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 추가로 포함할 수 있다.
일부 구현예에서, RSV M2-1 면역원을 인코딩하는 핵산 코딩 서열은 서열 번호: 3을 포함하는 핵산 서열, 서열 번호: 3의 단편을 포함하는 핵산 서열, 서열 번호: 3 에 대해 적어도 98% 상동성인 서열을 포함하는 핵산 서열, 및 서열 번호: 3에 대해 적어도 98% 상동성인 서열의 단편을 포함하는 핵산 서열로 이루어진 그룹 중에서 선택된다. 각각의 예에서, RSV M2-1 면역원을 인코딩하는 핵산 코딩 서열은 당해 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 추가로 포함할 수 있다. 서열 번호: 3에 대해 적어도 98% 상동성인 서열을 포함하는 핵산 서열은 서열 번호: 4에 대해 적어도 98% 상동성인 단백질을 바람직하게 암호화한다. 서열 번호: 3에 대해 적어도 98% 상동성인 서열의 단편을 포함하는 핵산 서열은 서열 번호: 4에 대해 적어도 98% 상동성인 단백질의 단편을 바람직하게 암호화한다.
일부 구현예에서, 서열 번호: 12를 인코딩하는 핵산 서열을 포함하는 하나 이상의 핵산 서열을 포함하는 조성물이 제공된다.
일부 구현예에서, 서열 번호: 11을 포함하는 핵산 서열을 포함하는 하나 이상의 핵산 서열을 포함하는 조성물이 제공된다.
일부 구현예에서, 당해 조성물은: RSV M2-1 면역원을 인코딩하는 핵산 코딩 서열, RSV F 면역원을 인코딩하는 핵산 코딩 서열 및 RSV M2-1 면역원을 인코딩하는 핵산 코딩 서열, RSV M2-1 면역원을 인코딩하는 핵산 코딩 서열 및 RSV Ga 면역원을 인코딩하는 핵산 코딩 서열, RSV M2-1 면역원을 인코딩하는 핵산 코딩 서열 및 RSV Gb 면역원을 인코딩하는 핵산 코딩 서열, RSV F 면역원을 인코딩하는 핵산 코딩 서열, SV M2-1 면역원을 인코딩하는 핵산 코딩 서열 및 RSV Ga 면역원을 인코딩하는 핵산 코딩 서열, RSV F 면역원을 인코딩하는 핵산 코딩 서열, RSV M2-1 면역원을 인코딩하는 핵산 코딩 서열 및 RSV Gb 면역원을 인코딩하는 핵산 코딩 서열, RSV M2-1 면역원을 인코딩하는 핵산 코딩 서열, RSV Ga 면역원을 인코딩하는 핵산 코딩 서열 및 RSV Gb 면역원을 인코딩하는 핵산 코딩 서열, 및 RSV F 면역원을 인코딩하는 핵산 코딩 서열, RSV M2-1 면역원을 인코딩하는 핵산 코딩 서열, RSV Ga 면역원을 인코딩하는 핵산 코딩 서열 및 RSV Gb 면역원을 인코딩하는 핵산 코딩 서열로 이루어진 그룹 중에서 선택된 핵산 서열을 포함한다
신규한 "RSV M2-1 면역원"가 또한 제공된다. 일부 구현예에서, 서열 번호: 4 및 서열 번호: 12로 이루어진 그룹 중에서 선택된 단백질이 제공된다.
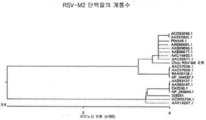
도 1은 RSV-F 단백질의 계통수를 나타내고, 공통 RSVF 단백질 아미노산 서열은 서열 번호: 2에 설정된다.
도 2는 RSV M2-1 단백질의 계통수를 나타내고, 공통 RSV M2-1 단백질 아미노산 서열은 서열 번호: 4에 설정된다.
도 3은 RSVF 백신을 사용한 면역화 후 각종 시점에서 항-RSV F 단백질 IgG가 생성됨을 나타낸다.
도 4는 RSV F 백신을 사용한 면역화 후 각종 시점에서 항-RSV F 단백질 IgA의 결과를 나타낸다.
도 5는 최종 면역화 후 대략 8주째에 RSV-F 백신의 상이한 용량에서 IFN-γ 생산의 비교로부터의 결과를 나타낸다.
도 6은 비장내에서 RSV-F +/- 케모킨 면역화 후 비장내 IFN-γ+ CD8 및 CD4 T 세포의 비교로부터의 결과를 나타낸다.
도 7은 폐에서 RSV-F +/- 케모킨 면역화 후 비장내에서 IFN-γ+ CD8 및 CD4 T 세포의 비교로부터의 결과를 나타낸다.
도 8은 혈청내 IgG 종점 역가 및 혈청내 IgG 아형(IgG1 대 IgG2a)의 비교로부터의 결과를 나타낸다.
도 9는 IgG2a/IgG1 비의 비교를 나타낸다.
도 10은 TZM-BL 세포 / "ON"에서 Env-슈도형 바이러스를 나타낸다.
도 11은 TZM-BL 세포 / "OFF"에서 Env-슈도형 바이러스를 나타낸다.
도 12는 293T 세포에서 RSV-융합 슈도 바이러스 생산을 나타낸다.
도 13은 검정을 사용한 RSV-F 중화 연구에 사용된 면역화 프로토콜을 나타낸다.
도 14는 상이한 표적 세포에서 RSV-F 매개된 감염의 정량화로부터의 데이터를 나타낸다.
도 15는 TZM-bl HeLa 세포에서 RSV-F 중화 활성의 정량화로부터의 데이터를 나타낸다.
도 16은 HeLa 세포내에서 RSV-F 슈도 바이러스에 의한 세포 사멸 활성의 정량화로부터의 데이터를 나타낸다.
도 17은 수행된 RSV-M2 용량 연구에 대한 면역화 스케쥴을 나타낸다.
도 18은 마지막 면역화 후 1주째에 상이한 용량의 RSV-M2 백신에서 IFN-g 생산의 비교를 포함하는 연구로부터 수집된 데이터를 나타낸다.
도 19는 CCL20을 사용한 RSV-F 백신의 조합의 평가를 위한 면역화 스케쥴을 나타낸다.
도 20은 마지막 면역화 후 1주째에 상이한 용량의 CCL20을 사용한 비장, 간 및 폐 각각에서 IFN-g의 비교로부터의 데이터를 포함하는 연구로부터의 데이터를 나타낸다.
도 21은 혈청에서 IgG 아형(IgG1 대 IgG2a)의 비교 데이터를 나타낸다.
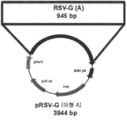
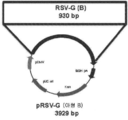
도 22a 내지 22c는 플라스미드 설계 및 RSV-F, RSV-G(A), 및 RSV-G(B) 컨스트럭트의 작제를 나타낸다. 도 22a는 플라스미드 설계 및 RSV-F 컨스트럭트의 작제를 나타낸다. 도 22b는 플라스미드 설계 및 RSV-G(A) 컨스트럭트의 작제를 나타낸다. 도 22c는 플라스미드 설계 및 RSV-G(B) 컨스트럭트의 작제를 나타낸다.
도 23은 RSV-F, RSV-G(A), 및 RSV-G(B) 컨스트럭트의 시험관내 발현을 확인하는 결과를 나타낸다.
도 24는 RSV-F 용량 연구를 위한 면역화 스케쥴을 나타낸다.
도 25는 RSV-F 용량 연구로부터의 IgG 데이터를 나타낸다.
도 26은 RSV-F 용량 연구로부터의 IFN-γ 데이터를 나타낸다.
도 27은 RSV-F PSEUDO 중화 연구를 위한 면역화 스케쥴을 나타낸다.
도 28는 RSV-F PSEUDO 중화 연구로부터의 데이터를 나타낸다.
도 29는 HeLa 세포에서 RSV-F 슈도바이러스에 의한 세포자멸사 세포 사멸 활성의 억제를 측정하기 위한 2개의 비교로부터의 데이터를 나타낸다.
도 30은 RSV-G(A) 및 RSV-(B) 용량 연구에 대한 면역화 스케쥴을 나타낸다.
도 31은 RSV-G(A) 및 RSV-(B) 용량 연구로부터 RSV-G(A)로부터의 IgG 데이터를 나타낸다.
도 32는 RSV-G(A) 및 RSV-(B) 용량 연구로부터 RSV-G(A)로부터의 IgG 데이터를 나타낸다.
도 33은 마우스 연구에서 모노 백신을 사용한 RSV 예비 중화 결과의 요약을 나타내는 챠트이다.
도 34는 수행된 RSV 토끼 연구 설계를 나타낸다.
도 35는 RSV-F에 대해 측정된 체액성 면역성의 RSV 토끼 연구로부터의 데이터를 나타낸다.
도 36은 RSV-G에 대해 측정된 체액성 면역성의 RSV 토끼 연구로부터의 데이터를 나타낸다.
도 37은 수행된 RSV 비-인간 영장류 연구 설계를 나타낸다.
도 38a 내지 도 38d는 RSV-F에 대해 측정된 체액성 면역성의 RSV 비-인간 영장류 연구로부터의 데이터를 나타낸다. 도 38a는 순수한 동물에서 RSV-F에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다. 도 38b는 1개 부위에 콕테일 백신을 근육내 제공받은 동물에서 RSV-F에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다. 도 38c는 1개 부위에 콕테일 백신과 rhMEC 컨스트럭트를 근육내 제공받은 동물에서 RSV-F에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다. 도 38d는 3개 부위에 콕테일 백신을 피내 제공받은 동물에서 RSV-F에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다.
도 39a 내지 도 39d는 RSV-G에 대해 측정된 체액성 면역성의 RSV 비-인간 영장류 연구로부터의 데이터를 나타낸다. 도 39a는 나이브 동물에서 RSV-G에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다. 도 39b는 1개 부위에 콕테일 백신을 근육내 제공받은 동물에서 RSV-G에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다. 도 39c는 1개 부위에 콕테일 백신과 rhMEC 컨스트럭트를 근육내 제공받은 동물에서 RSV-G에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다. 도 39d는 3개 부위에 콕테일 백신을 피내 제공받은 동물에서 RSV-F에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다.
도 40은 토끼 비-인간 영장류 연구에서 콕테일 백신을 사용한 RSV 예비 중화 결과의 요약을 나타내는 챠트이다.
바람직한 구현예의 상세한 설명
발명의 하나의 국면에서, 공통 항원이 다음 중의 하나 이상을 가짐을 포함하여, 개선된 전사 및 해독을 제공하는 것이 요구된다: 전사를 증가시키기 위한 GC 성분 리더 서열; mRNA 안전성 및 코돈 최적화; 시스-작용 서열 모티프(즉, 내부 TATA-박스)가 가능한 정도까지의 제거.
발명의 일부 국면에서, 다음 중의 하나 이상을 가짐을 포함하여, 다수의 균주에 걸쳐 광범위한 면역 반응을 생성하는 공통 항원을 생성하는 것이 요구된다: 모든 가능한 완전한 길이의 서열을 혼입하고; 컴퓨터는 각각의 위치에서 가장 일반적으로 존재하는 아미노산을 이용하는 서열을 생성하고; 균주들 사이의 교차-반응성을 증가시킨다.
첨부된 서열 목록은 다양한 RSV 서열 및 구현예인 서열 번호 1 내지 16을 포함한다.
서열 번호: 1은, 출발 코돈(ATG) 또는 신호 펩타이드가 없는 RSV F를 인코딩하는 뉴클레오타이드 서열을 나타낸다.
서열 번호: 2는, 출발 코돈(ATG) 또는 신호 펩타이드에 의해 인코딩된 Met가 없는 RSV F를 인코딩하는 아미노 서열을 나타낸다.
서열 번호: 3은, 출발 코돈(ATG) 또는 신호 펩타이드가 없는 RSV M2-1을 인코딩하는 뉴클레오타이드 서열을 나타낸다.
서열 번호: 4는, 출발 코돈(ATG) 또는 신호 펩타이드에 의해 암호화된 Met가 없는 RSV M2-1을 인코딩하는 아미노 서열을 나타낸다.
서열 번호: 5는, 출발 코돈(ATG) 또는 신호 펩타이드가 없는 RSV Ga를 인코딩하는 뉴클레오타이드 서열을 나타낸다.
서열 번호: 6은 출발 코돈(ATG) 또는 신호 펩타이드에 의해 인코딩된 Met가 없는 RSV Ga를 인코딩하는 아미노 서열을 나타낸다.
서열 번호: 7은, 출발 코돈(ATG) 또는 신호 펩타이드가 없는 RSV Gb를 인코딩하는 뉴클레오타이드 서열을 나타낸다.
서열 번호: 8은, 출발 코돈(ATG) 또는 신호 펩타이드에 의해 암호화된 Met가 없는 RSV Gb를 인코딩하는 아미노 서열을 나타낸다.
서열 번호: 9는, IgE 신호 펩타이드를 인코딩하는 출발 코돈(ATG)/서열을 포함하는 RSV F를 인코딩하는 뉴클레오타이드 서열을 나타낸다.
서열 번호: 10은 출발 코돈/IgE 신호 펩타이드에 의해 암호화된 Met가 있는 RSVF를 인코딩하는 아미노 서열을 나타낸다.
서열 번호: 11은 IgE 신호 펩타이드를 인코딩하는 출발 코돈(ATG)/서열을 포함하는 RSV M2-1을 인코딩하는 뉴클레오타이드 서열을 나타낸다.
서열 번호: 12는 출발 코돈/IgE 신호 펩타이드에 의해 인코딩된 Met가 있는 RSV M2-1을 인코딩하는 아미노 서열을 나타낸다.
서열 번호: 13은 IgE 신호 펩타이드를 인코딩하는 출발 코돈(ATG)/서열을 포함하는 RSV Ga를 인코딩하는 뉴클레오타이드 서열을 나타낸다.
서열 번호: 14는 출발 코돈/IgE 신호 펩타이드에 의해 암호화된 Met가 있는 RSV Ga를 인코딩하는 아미노 서열을 나타낸다.
서열 번호: 15는 IgE 신호 펩타이드를 인코딩하는 출발 코돈(ATG)/서열을 포함하는 RSV Gb를 인코딩하는 뉴클레오타이드 서열을 나타낸다.
서열 번호: 16은 출발 코돈/IgE 신호 펩타이드에 의해 암호화된 Met가 있는 RSV Gb를 인코딩하는 아미노 서열을 나타낸다.
첨부된 서열 목록은 IgE 신호 펩타이드의 아미노산 서열인 서열 번호: 17을 포함한다.
서열 번호: 17은 IgE 신호 펩타이드의 아미노산 서열을 나타낸다.
첨부된 서열 목록은 각종 CCL20 서열 및 구현예인 서열 번호:18 내지 21을 포함한다.
서열 번호: 18은, 출발 코돈(ATG) 또는 신호 펩타이드가 없는 CCL20을 인코딩하는 뉴클레오타이드 서열을 나타낸다.
서열 번호: 19는 출발 코돈(ATG) 또는 신호 펩타이드에 의해 인코딩된 Met가 없는 CCL20를 나타낸다.
서열 번호: 20은 출발 코돈(ATG)/IgE 신호 펩타이드를 인코딩하는 서열을 포함하는 CCL20을 인코딩하는 뉴클레오타이드 서열을 나타낸다.
서열 번호: 21은 출발 코돈/IgE 신호 펩타이드에 의해 인코딩된 Met가 있는 CCL20을 나타낸다.
첨부된 서열 목록은 RSV 면역원으로부터 기원한 아미노산 서열인 서열 번호: 22 내지31을 포함한다.
서열 번호: 22는 RSV F 면역원의 T 세포 에피토프이다.
서열 번호: 23은 RSV F 면역원의 T 세포 에피토프이다.
서열 번호: 24는 RSV F 면역원의 T 세포 에피토프이다.
서열 번호: 25는 RSV F 면역원의 T 세포 에피토프이다.
서열 번호: 26은 RSV F 면역원 프로테아제 절단 부위이다.
서열 번호: 27은 RSV F 면역원 프로테아제 절단 부위이다.
서열 번호: 28은 RSV F 면역원 융합 펩타이드이다.
서열 번호: 29는 팔리비주마브에 대한 RSV F 면역원 결합 부위이다.
서열 번호: 30은 RSV M2-1 면역우세 T 세포 에피토프이다.
서열 번호: 31은 RSV M2-1 서브우세(Subdominant) T 세포 에피토프이다.
본 발명의 일부 국면에서, RSV F 면역원 및 RSV F 면역원을 인코딩하는 서열이 제공된다. 본 발명의 일부 국면에서, RSV Ga 면역원 및 RSV Ga 면역원을 인코딩하는 서열이 제공된다. 본 발명의 일부 국면에서, RSV Gb 면역원 및 RSV Gb 면역원을 인코딩하는 서열이 제공된다. RSV F 면역원을 인코딩하는 서열, RSV Ga 면역원을 인코딩하는 서열 및 RSV Gb 면역원을 인코딩하는 서열 각각을 포함하는, RSV F 면역원을 인코딩하는 서열, RSV Ga 면역원을 인코딩하는 서열 및 RSV Gb 면역원을 인코딩하는 서열을 포함하는 조성물이 제공된다.
RSV M2-1 면역원 및 RSV M2-1 면역원을 인코딩하는 서열이 또한 제공되며 다른 단백질 및/또는 핵산 서열과 함께 또는 단독으로 사용될 수 있다.
1. 정의
본 원에서 사용된 용어는 단지 특정 구현예를 설명하기 위한 것이며 제한하고자 하는 것은 아니다. 명세서 및 첨부된 청구항에서 사용된 바와 같이, 단수 형태는 문맥이 달리 명확히 지시하지 않는 한 복수의 지시대상을 포함한다.
본원에서 수치적 범위의 설명을 위해, 동일한 정도의 정확성으로 이들 사이에 각각 개재하는 숫자가 명백하게 고려된다. 예를 들면, 6-9의 범위의 경우, 6 및 9 외에도 숫자 7 및 8이 고려되며, 범위 6.0-7.0의 경우, 숫자 6.0, 6.1, 6.2, 6.3, 6.4, 6.5, 6.6, 6.7, 6.8, 6,9, 및 7.0이 명백하게 고려된다.
a. 아쥬반트
본원에 사용된 것으로서 "아쥬반트"는 DNA 플라스미드에 의해 인코딩된 하나 이상의 호흡기 합포체 바이러스(RSV.) 항원의 항원성을 향상시키기 위해 본원에 기술된 DNA 플라스미드 백신에 가해지고 이후 기술된 핵산 서열을 인코딩하는 어떠한 분자도 의미할 수 있다.
b. 항체
"항체"는 Fab, F(ab')2, Fd, 및 단쇄 항체, 디아바디, 이중특이적 항체, 이작용기 항체 및 그의 유도체를 포함하는, 클래스 IgG, IgM, IgA, IgD 또는 IgE, 또는 단편의 항체, 이의 단편 또는 유도체를 의미할 수 있다. 상기 항체는 포유동물의 혈청 샘플로부터 분리된 항체, 폴리클로날 항체, 친화도 정제된 항체, 또는 원하는 에피토프 또는 이들로부터 유래된 서열에 대해 충분한 결합 특이성을 나타내는 그의 혼합물일 수 있다.
c. 코딩 서열
본원에서 사용된 바와 같은 "코딩 서열" 또는 "인코딩 핵산"는 단백질을 인코딩하는 뉴클레오타이드 서열을 포함하는 핵산 (RNA 또는 DNA 분자)을 지칭하는 것을 의미할 수 있다. 코딩 서열은, 핵산이 투여되는 개인 또는 포유동물의 세포내에서 발현을 지시할 수 있는 프로모터 및 폴리아데닐화 신호를 포함하는 조절 성분에 작동적으로 연결된 개시 및 종료 시스날을 추가로 포함할 수 있다.
일부 구현예에서, 서열 번호: 2에 설정된 공통 RSV F 면역원의 아미노산 서열에 대한 코딩 서열은 서열 번호: 1이다. 이러한 코딩 서열은 N 말단 메티오닌을 인코딩하는 출발 코돈 또는 IgE 또는 IgG 신호 펩타이드와 같은 신호 펩타이드를 임의로 추가로 포함할 수 있다. 서열 번호: 10은 IgE 신호 펩타이드(서열 번호: 17)를 갖는 서열 번호: 2에 상응한다. 서열 번호: 9는 서열 번호: 10을 암호화한다.
일부 구현예에서, 서열 번호: 6에 설정된 공통 RSV Ga 면역원의 아미노산 서열에 대한 코딩 서열은 서열 번호: 5이다. 이러한 코딩 서열은 N 말단 메티오닌을 인코딩하는 출발 코돈 또는 IgE 또는 IgG 신호 펩타이드와 같은 신호 펩타이드를 임의로 추가로 포함할 수 있다. 서열 번호: 14는 IgE 신호 펩타이드(서열 번호: 17)를 갖는 서열 번호: 6에 상응한다. 서열 번호: 13은 서열 번호: 14를 인코딩한다.
일부 구현예에서, 서열 번호: 8에 설정된 공통 RSV Gb 면역원의 아미노산 서열에 대한 코딩 서열은 서열 번호: 7이다. 이러한 코딩 서열은 N 말단 메티오닌을 인코딩하는 출발 코돈 또는 IgE 또는 IgG 신호 펩타이드와 같은 신호 펩타이드를 임의로 추가로 포함할 수 있다. 서열 번호: 16은 IgE 신호 펩타이드(서열 번호: 17)를 갖는 서열 번호: 8에 상응한다. 서열 번호: 15는 서열 번호: 16을 인코딩한다.
서열 번호: 4에 설정된 공통 RSV M2-1 면역원의 아미노산 서열을 인코딩하는 암호화 서열, 서열 번호: 3이 또한 제공된다. 이러한 코딩 서열은 N 말단 메티오닌을 인코딩하는 출발 코돈 또는 IgE 또는 IgG 신호 펩타이드와 같은 신호 펩타이드를 임의로 추가로 포함할 수 있다. 서열 번호: 12는 IgE 신호 펩타이드(서열 번호: 17)를 갖는 서열 번호: 4에 상응한다. 서열 번호: 11은 서열 번호: 12를 암호화한다.
d. 보체
본원에 사용된 것으로서 "보체" 또는 "상보성"는, 핵산이 왓슨-크릭(Watson-Crick)(예를들면 , A-T/U 및 C-G) 또는 핵산 분자의 뉴클레오타이드 또는 뉴클레오타이드 유사체 사이의 후그스텐 염기 쌍화(Hoogsteen base pairing)를 의미할 수 있음을 의미한다.
e. 공통 또는 공통 서열
본원에 사용된 것으로서 "공통" 또는 "공통 서열"는 특수한 RSV 항원의 다수의 아형 또는 혈청형에 대해 광범위한 면역성을 유도하는데 사용될 수 있는, 특수한 RSV 항원의 다수의 아형의 정렬의 분석을 기본으로 하여 작제된, 합성 핵산 서열, 또는 상응하는 폴리펩타이드 서열을 의미할 수 있다. 공통 RSV 항원은 단백질 F, 단백질 G 및 단백질 M2의 공통 아미노산 서열을 포함할 수 있다. 공통 아미노산 서열을 인코딩하는 뉴클레오타이드 서열이 또한 제공된다. 또한, 융합 단백질과 같은 합성 항원을 조작하여 공통 서열(또는 공통 항원)을 포함할 수 있다.
공통 RSV F 면역원의 아미노산 서열은 서열 번호: 2에 설정되어 있다. 이러한 서열은 N 말단 메티오닌 또는 IgE 또는 IgG 신호 펩타이드와 같은 신호 펩타이드를 임의로 포함할 수 있다. 서열 번호: 10은 IgE 신호 펩타이드(서열 번호: 17)를 갖는 서열 번호: 2에 상응한다.
공통 RSV Ga 면역원의 아미노산 서열은 서열 번호: 6에 설정되어 있다. 이러한 서열은 N 말단 메티오닌 또는 IgE 또는 IgG 신호 펩타이드와 같은 신호 펩타이드를 임의로 포함할 수 있다. 서열 번호: 14는 IgE 신호 펩타이드(서열 번호: 17)를 갖는 서열 번호: 6에 상응한다.
공통 RSV Gb 면역원의 아미노산 서열은 서열 번호: 8에 설정되어 있다. 이러한 서열은 N 말단 메티오닌 또는 IgE 또는 IgG 신호 펩타이드와 같은 신호 펩타이드를 임의로 포함할 수 있다. 서열 번호: 16은 IgE 신호 펩타이드(서열 번호: 17)를 갖는 서열 번호: 8에 상응한다.
서열 번호: 4에 설정된 공통 RSV M2-1 면역원의 아미노산 서열이 또한 제공된다. 이러한 서열은 N 말단 메티오닌 또는 IgE 또는 IgG 신호 펩타이드와 같은 신호 펩타이드를 임의로 포함할 수 있다. 서열 번호: 12는 IgE 신호 펩타이드(서열 번호: 17)를 갖는 서열 번호: 4에 상응한다.
f. 정전류
본원에서 사용된 바와 같이 "정전류"는 조직에 전달된 전기적 펄스의 지속시간 동안, 조직 또는 상기 조직을 한정하는 세포가 받거나 경험하는 전류를 정의한다. 상기 전기적 펄스는 본원에서 기재된 전기천공 장치로부터 전달된다. 본원에 제공된 전기천공 장치가 바람직하게는 즉각적인 피드백을 갖는 피드백 요소를 갖기 때문에, 이 전류는 전기적 펄스의 존재 동안 상기 조직에서 일정한 암페어수를 유지한다. 상기 피드백 요소는 펄스의 지속시간 내내 조직(또는 세포)의 저항성을 측정할 수 있고 전기천공 장치가 그의 전기적 에너지 출력을 변경하게 할 수 있어서 (예를 들면, 전압 증가), 동일한 조직 내의 전류는 전기 펄스 내내 (대략 마이크로초), 및 펄스 내내 일정하게 유지된다. 일부 구현예에서, 상기 피드백 요소는 컨트롤러를 포함한다.
g. 전류 피드백 또는 피드백
본원에서 사용된 바와 같이 "전류 피드백" 또는 "피드백"는 상호교환적으로 사용될 수 있고 제공된 전기천공 장치의 활성 반응을 의미할 수 있으며, 이는 전극 사이의 조직 내 전류를 측정하고, 전류를 일정한 수준으로 유지하기 위해 EP 장치에 의해 전달된 에너지 출력을 변경하는 것을 포함한다. 이 일정한 수준은 펄스 시퀀스 또는 전기적 처리의 개시 전에 사용자에 의해 미리 조정된다. 상기 피드백은, 내부의 전기적 회로가 전극 사이의 조직 내 전류를 지속적으로 모니터링하고 상기 모니터링된 전류 (또는 조직 내의 전류)를 미리 조정된 전류와 비교하고 상기 모니터링된 전류를 미리 조정된 수준으로 유지시키기 위해 에너지-출력을 지속적으로 조절하므로, 상기 피드백은 상기 전기천공 장치의 전기천공 성분, 예컨대 컨트롤러에 의해 달성될 수 있다. 상기 피드백 루프는, 아날로그 폐루프 피드백이므로, 즉각적일 수 있다.
h. 분산된 전류
본원에서 사용된 바와 같이 "분산된 전류"는 본원에서 기재된 전기천공 장치의 다양한 바늘 전극 어레이로부터 전달된 전기적 전류의 패턴을 의미할 수 있으며, 여기서 상기 패턴은 전기천공될 조직의 임의의 영역 상에서 전기천공 관련된 열 스트레스의 발생을 최소화하거나 바람직하게는 제거한다.
i. 전기천공
본원에서 상호교환적으로 사용되는 "전기천공," "전기-투과화," 또는 "전기-동력학 향상"("EP")은 바이오-막에 현미경적 경로 (기공)를 유도하기 위해 막통과 전기장을 사용하는 것을 지칭할 수 있으며, 이들의 존재는 플라스미드, 올리고뉴클레오타이드, siRNA, 약물, 이온, 및 물과 같은 생체분자가 세포성 막의 한쪽 면으로부터 다른 쪽 면으로 지나가게 한다.
j. 피드백 기전
본원에서 사용된 바와 같이 "피드백 기전"는 소프트웨어 또는 하드웨어 (또는 펌웨어)에 의해 수행되는 공정을 지칭할 수 있고, 이 공정은 원하는 조직의 임피던스를 받고, 이를 현재의 값, 바람직하게는 전류와 비교하고(에너지의 펄스의 전달 전, 동안, 및/또는 이후), 미리조정된 값을 달성하기 위해 전달된 에너지의 펄스를 조절한다. 피드백 기전은 아날로그 폐루프 회로에 의해 수행될 수 있다.
k. 단편
"단편"은 특수한 RSV 항원을 인식함으로써 RSV에 대해 포유동물내에서 면역 반응을 유발할 수 있는 RSV 면역원의 폴리펩타이드 단편을 의미할 수 있다. RSV 면역원은, 각각의 경우에, 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는, RSV F 면역원, RSV M2-1 면역원, RSV Ga 면역원, RSV Gb 면역원에 대해 본원에 설정된 공통 서열, 각각의 경우에, 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는, 본원에 설정된 공통 서열에 대해 98% 이상 상동성인 단백질, 본원에 설정된 공통 서열에 대해 99% 이상 상동성인 단백질, 및 본원에 설정된 공통 서열에 대해 100% 동일한 단백질을 말한다. 단편은 예를 들면 면역글로불린 신호 펩타이드, 예를 들면, IgE 신호 펩타이드(서열 번호: 17) 또는 IgG 신호 펩타이드와 같은 신호 펩타이드에 연결된 RSV 면역원의 단편을 포함하거나 포함하지 않을 수 있다.
RSV F 공통 면역원의 단편은 각 경우에 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는, 서열 번호: 2, 서열 번호: 10, 본원에 설정된 RSV F 공통 면역원 서열에 대해 98% 이상 상동성인 단백질, 본원에 설정된 RSV F 공통 면역원 서열에 대해 99% 이상 상동성인 단백질, 또는 본원에 설정된 RSV F 공통 면역원 서열에 대해 100% 동일한 단백질의 단편일 수 있다. 이러한 단편은 첨가된 어떠한 비-RSV 신호 펩타이드도 제외된, 본원에 설정된 특수한 완전한 길이의 RSV F 공통 면역원 서열의 길이의 20% 이상, 25% 이상, 30% 이상, 35% 이상, 40% 이상, 45% 이상, 50% 이상, 55% 이상, 60% 이상, 65% 이상, 70% 이상, 75% 이상, 80% 이상, 85% 이상, 90% 이상, 91% 이상, 92% 이상, 93% 이상, 94% 이상, 95% 이상, 96% 이상, 97% 이상, 98% 이상, 99% 이상을 포함할 수 있다 단편은, 각 경우에 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는, 본원에 설정된 RSV F 공통 면역원의 서열에 대해 98% 이상, 또는 99% 이상 상동성이고 이러한 서열에 대해 100% 동일한 폴리펩타이드의 단편을 말한다. 단편은 RSV F 공통 면역원에 대해 98% 이상 상동성이거나, 99% 이상 상동성이거나, 100% 동일하고 상동성 퍼센트을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함하는 폴리펩타이드의 단편을 포함할 수 있다. 일부 구현예에서, RSV F 면역원의 단편은 서열 번호: 2의 단편을 포함할 수 있다. 단편은 면역글로불린 신호 펩타이드, 예를 들면 IgE 신호 펩타이드(서열 번호: 17) 또는 IgG 신호 펩타이드와 같은 신호 펩타이드에 연결된 서열 번호: 2의 단편을 포함할 수 있다. 따라서 일부 구현예에서, 단편은 서열 번호: 17을 포함하는 서열 번호: 10의 단편이다. 단편은 N 말단 메티오닌에 연결된 서열 번호: 2의 단편을 포함할 수 있다. 단편은 또한 서열 번호: 2에 대해 98% 이상, 또는 99% 이상 상동성인 폴리펩타이드의 단편을 말한다. 당해 단편은 서열 번호: 2에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 2에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 2에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호: 2에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. RSV F 면역원은 575 아미노산이다. 일부 구현예에서, 이의 단편은, 길이가 115개 이상의 아미노산, 길이가 163개 이상, 230개 이상, 288개 이상, 345개 이상, 403개 이상, 460개 이상, 515개 이상, 520개 이상, 525개 이상, 530개 이상, 535개 이상, 540개 이상, 545개 이상, 550개 이상, 555개 이상, 560개 이상, 565개 이상, 570개 이상, 574개 이상일 수 있다. 폴리펩타이드 단편은, 길이가 140개 아미노산 이하, 190개 미만, 250개 미만, 283개 미만, 300개 미만, 365개 미만, 425개 미만, 495개 미만, 518개 미만, 523개 미만, 528개 미만, 533개 미만, 547개 미만, 552개 미만, 563개 미만, 또는 572개 미만일 수 있다. 단편은 면역글로불린 신호 펩타이드, 예를 들면 IgE 또는 IgG 신호 펩타이드와 같은 N 말단 메티오닌 및/또는 신호 펩타이드를 추가로 포함할 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 574개 아미노산 또는 보다 작은 이의 단편에 연결될 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 574개 아미노산에 대해 98% 상동성인 폴리펩타이드 또는 574개 아미노산 서열에 대해 98% 상동성인 폴리펩타이드의 보다 작은 단편에 연결시킬 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 574개 아미노산 서열에 대해 99% 상동성인 폴리펩타이드 또는 574 아미노산 서열에 대해 99% 상동성인 폴리펩타이드의 보다 작은 단편에 연결시킬 수 있다. 상동성 정도를 계산하는데 있어서, 폴리펩타이드는 서열 번호: 2 또는 이의 단편을 가지며, N 말단 메티오닌 및/또는 어떠한 신호 펩타이드도 이러한 계산에 포함되지 않는다. 신호 펩타이드의 서열은 상동성의 측정시 사용되지 않는다. 따라서, 예를 들어, 서열 번호: 10이 신호 펩타이드 서열 번호: 17에 작동적으로 연결된 서열 번호: 2를 포함한다고 해도, 서열 번호: 10은, 신호 펩타이드가 서열 번호: 2에 부재한다고 해도, 서열 번호: 2의 단편에 대해 100% 상동성인 서열 번호: 2의 단편을 포함한다. 따라서, 서열 번호: 2의 단편에 대해 적어도 98% 상동성인 폴리펩타이드의 단편을 포함하는 단백질은, 적어도 115개 아미노산이고 예를 들면, 신호 펩타이드에 임의로 연결될 수 있는 서열 번호: 2의 단편에 대해 적어도 98% 상동성인 폴리펩타이드의 단편인 단백질을 말하는 것으로 의도된다. 서열 번호: 22, 서열 번호: 23, 서열 번호: 24, 및 서열 번호: 25는 서열 번호: 2에 설정된 RSV F 면역원의 T 세포 에피토프에 상응한다. 일부 구현예에서, 단편은 이들 서열 또는 이에 대해 98% 이상 또는 99% 이상 상동성인 서열 중 하나 이상의 모두 또는 일부를 포함한다. 서열 번호: 26 및 서열 번호: 27은 RSV F 면역원 프로테아제 절단 부위이다. 서열 번호: 28은 RSV F 면역원 융합 펩타이드이다. 서열 번호: 29는 팔리비주마브에 대한 RSV F 면역원 결합 부위이다.
RSV Ga 공통 면역원의 단편은, 각각의 경우에 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는, 서열 번호: 6, 서열 번호: 14, 본원에 설정된 RSV Ga 공통 면역원 서열에 대해 98% 이상 상동성인 단백질, 본원에 설정된 RSV Ga 공통 면역원 서열에 대해 99% 이상 상동성인 단백질, 또는 본원에 설정된 공통 서열에 대해 100% 동일한 RSV Ga 공통 면역원의 단편일 수 있다. 이러한 단편은 첨가된 어떠한 비- RSV 신호 펩타이드를 배제하고, 본원에 설정된 특히 완전한 길이의 RSV Ga 공통 면역원 서열의 길이의 20% 이상, 25% 이상, 30% 이상, 35% 이상, 40% 이상, 45% 이상, 50% 이상, 55% 이상, 60% 이상, 65% 이상, 70% 이상, 75% 이상, 80% 이상, 85% 이상, 90% 이상, 91% 이상, 92% 이상, 93% 이상, 94% 이상, 95% 이상, 96% 이상, 97% 이상, 98% 이상, 99% 이상의 백분율을 포함할 수 있다. 단편은 각각의 경우에 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는, 본원에 설정된 RSV Ga 공통 면역원의 서열에 대해 98% 이상, 또는 99% 이상 상동성이고 이러한 서열에 대해 100% 동일한 폴리펩타이드의 단편을 말한다. 단편은 RSV Ga 공통 면역원에 대해 98% 이상 상동성이거나, 99% 이상 상동성이거나, 100% 동일한 폴리펩타이드의 단편을 포함할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 일부 구현예에서, RSV Ga 면역원의 단편은 서열 번호 6의 단편을 포함할 수 있다. 단편은 면역글로불린 신호 펩타이드, 예를 들면 IgE 신호 펩타이드(서열 번호 17) 또는 IgG 신호 펩타이드와 같은 신호 펩타이드에 연결된 서열 번호 6의 단편을 포함할 수 있다. 따라서, 일부 구현예에서, 단편은 서열 번호 17을 포함하는 서열 번호 14의 단편이다. 단편은 N 말단 메티오닌에 연결된 서열 번호 6의 단편을 포함할 수 있다. 단편은 또한 서열 번호 6에 대해 98% 이상, 또는 99% 이상 상동성인 폴리펩타이드의 단편을 말한다. 단편은 서열 번호 6에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호 6에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호 6에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호 6에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. RSV Ga 면역원은 N 말단 메티오닌 및/또는 신호 펩타이드를 제외한 297개 아미노산이다. 일부 구현예에서, 이의 단편은, 길이가 125개 이상의 아미노산, 길이가 130개 이상, 140개 이상, 150개 이상, 160개 이상, 170개 이상, 180개 이상, 190개 이상, 200개 이상, 210개 이상, 220개 이상, 230개 이상, 240개 이상, 250개 이상, 260개 이상, 270개 이상, 280개 이상, 285개 이상, 290개 이상, 295개 이상일 수 있다. 폴리펩타이드 단편은, 길이가 135개 미만의 아미노산, 145개 미만, 155개 미만, 165개 미만, 175개 미만, 185개 미만, 195개 미만, 205개 미만, 215개 미만, 225개 미만, 235개 미만, 245개 미만, 255개 미만, 265개 미만, 275개 미만, 285개 미만, 288개 미만, 292개 미만, 또는 296개 미만일 수 있다. 단편은 면역글로불린 신호 펩타이드, 예를 들면 IgE 또는 IgG 신호 펩타이드와 같은 N 말단 메티오닌 및/또는 신호 펩타이드를 추가로 포함할 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 296개의 아미노산 또는 이의 보다 작은 단편에 연결될 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 296개 아미노산에 대해 98% 상동성인 폴리펩타이드 또는 296개 아미노산 서열에 대해 98% 상동성인 폴리펩타이드의 보다 작은 단편에 연결될 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 296개 아미노산 서열에 대해 99% 상동성인 폴리펩타이드 또는 296개 아미노산 서열에 대해 99% 상동성인 폴리펩타이드의 보다 작은 단편에 연결될 수 있다. 상동성의 정도를 계산하는데 있어서, 폴리펩타이드는 서열 번호: 6 또는 이의 단편을 가지며, N 말단 메티오닌 및/또는 어떠한 신호 펩타이드도 이러한 계산에 포함되지 않는다. 신호 펩타이드의 서열은 상동성의 측정시 사용되지 않는다. 따라서, 예를 들면, 서열 번호: 14가 신호 펩타이드 서열 번호 17에 작동적으로 연결된 서열 번호 6을 포함한다고 해도, 서열 번호: 14는 서열 번호: 6의 단편에 대해 100% 상동성인 서열 번호 6의 단편을 포함하며, 그럼에도 불구하고 신호 펩타이드는 서열 번호: 6속에 존재하지 않는다. 따라서, 서열 번호: 6의 단편에 대해 적어도 98% 상동성인 폴리펩타이드의 단편을 포함하는 단백질은 적어도 125개 아미노산이고 예를 들면, 신호 펩타이드에 대해 임의로 연결될 수 있는 서열 번호 6의 단편에 대해 적어도 98% 상동성인 폴리펩타이드의 단편인 단백질을 말하는 것으로 의도된다.
각각의 경우에 1번 위치에 신호 펩타이드 및/또는 메티오닌이 존재하거나 존재하지 않는, 서열 번호: 8, 서열 번호: 16에 기재되어 있는 것과 같은 RSV Gb 공통 면역원, 본원에 설정된 RSV Gb 공통 면역원 서열에 대해 98% 이상 상동성인 단백질, 본원에 설정된 RSV Gb 공통 면역원 서열에 대해 99% 이상 상동성인 단백질, 및 본원에 설정된 공통 서열에 대해 100% 동일한 RSV Gb 공통 면역원의 단편은 첨가된 어떠한 비-RSV 신호 펩타이드를 제외하고, 본원에 설정된 특수한 완전한 길이의 RSV Gb 공통 면역원 서열의 20% 이상, 25% 이상, 30% 이상, 35% 이상, 40% 이상, 45% 이상, 50% 이상, 55% 이상, 60% 이상, 65% 이상, 70% 이상, 75% 이상, 80% 이상, 85% 이상, 90% 이상, 91% 이상, 92% 이상, 93% 이상, 94% 이상, 95% 이상, 96% 이상, 97% 이상, 98% 이상, 99% 이상의 퍼센트를 포함할 수 있다. 단편은, 각 경우에 1번 위치에 신호 펩타이드 및/또는 메티오닌이 존재하거나 존재하지 않는 본원에 설정된 RSV Gb 공통 면역원의 서열에 대해 98% 이상, 또는 99% 이상 상동성 및 이러한 서열에 대해 100% 동일한 폴리펩타이드의 단편을 말한다. 단편은 RSV Gb 공통 면역원에 대해 98% 이상 상동성, 99% 이상 상동성, 또는 100% 동일한 폴리펩타이드의 단편을 포함할 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 일부 구현예에서, RSV Gb 면역원의 단편은 서열 번호: 8의 단편을 포함할 수 있다. 단편은 면역글로불린 신호 펩타이드, 예를 들면 IgE 신호 펩타이드 (서열 번호: 17) 또는 IgG 신호 펩타이드와 같은 신호 펩타이드에 연결된 서열 번호 8의 단편을 포함할 수 있다. 따라서, 일부 구현예에서, 단편은 서열 번호: 17을 포함하는 서열 번호: 16의 단편이다. 단편은 N 말단 메티오닌에 연결된 서열 번호: 8의 단편을 포함할 수 있다. 단편은 또한 서열 번호: 8에 대해 98% 이상, 또는 99% 이상 상동성인 폴리펩타이드의 단편을 말한다. 단편은 서열 번호: 8에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 8에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드과 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 8에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있고 상동성 퍼센트를 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호; 8에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. RSV Gb 면역원은 N 말단 메티오닌 및/또는 신호 펩타이드를 제외한 291개 아미노산이다. 일부 구현예에서, 이의 단편은, 길이가 125개 이상 아미노산, 길이가 130개 이상, 140개 이상, 150개 이상, 160개 이상, 170개 이상, 180개 이상, 190개 이상, 200개 이상, 210개 이상, 220개 이상, 230개 이상, 240개 이상, 250개 이상, 260개 이상, 270개 이상, 280개 이상, 285개 이상, 288개 이상일 수 있다. 폴리펩타이드 단편은, 길이가 135개 미만의 아미노산, 145개 미만, 155개 미만, 165개 미만, 175개 미만, 185개 미만, 195개 미만, 205개 미만, 215개 미만, 225개 미만, 235개 미만, 245개 미만, 255개 미만, 265개 미만, 275개 미만, 285개 미만, 288개 미만, 290개 미만일 수 있다. 단편은 면역글로불린 신호 펩타이드, 예를 들면 IgE 또는 IgG 신호 펩타이드와 같은 N 말단 메티오닌 및/또는 신호 펩타이드를 추가로 포함할 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 290개 아미노산 또는 이의 보다 작은 단편에 연결될 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 290개 아미노산에 대해 98% 상동성인 폴리펩타이드 또는 290개 아미노산 서열에 대해 98% 상동성인 폴리펩타이드의 보다 작은 단편에 연결될 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 290개 아미노산 서열에 대해 99% 상동성인 폴리펩타이드 또는 290개 아미노산 서열에 대해 99% 상동성인 폴리펩타이드의 보다 작은 단편에 연결될 수 있다. 상동성의 정도를 계산하는데 있어서, 폴리펩타이드는 서열 번호: 6 또는 이의 단편을 가지며, N 말단 메티오닌 및/또는 어떠한 신호 펩타이드도 이러한 계산에 포함되지 않는다. 신호 펩타이드의 서열은 상동성의 측정시 사용되지 않는다. 따라서, 예를 들면, 서열 번호: 16의 신호 펩타이드가 서열 번호: 17에 작동적으로 연결된 서열 번호: 8을 포함하는 경우, 서열 번호: 16은 서열 번호: 8의 단편에 대해 100% 상동성인 서열 번호: 8의 단편을 포함하며, 그럼에도 불구하고 신호 펩타이드는 서열 번호: 8 속에 존재하지 않는다. 따라서, 서열 번호: 8의 단편에 대해 적어도 98% 상동성인 폴리펩타이드의 단편을 포함하는 단백질은, 적어도 125개 아미노산이고 예를 들면, 신호 펩타이드에 대해 임으로 연결될 수 있는 서열 번호: 8의 단편에 대해 적어도 98% 상동성인 폴리펩타이드의 단편인 단백질을 말하는 것으로 의도된다.
또한, RSV M2-1 공통 면역원의 단편은, 각각의 경우에 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는 서열 번호: 4, 서열 번호: 12, 본원에 설정된 RSV M2-1 공통 면역원 서열에 대해 98% 이상 상동성인 단백질, 본원에 설정된 RSV M2-1 공통 면역원 서열에 대해 99% 이상 상동성인 단백질, 또는 본원에 설정된 공통 서열에 대해 100% 동일한 RSV M2-1 공통 면역원의 단편일 수 있다. 이러한 단편은 첨가된 어떠한 비-RSV 신호 펩타이드를 제외하고, 본원에 설정된 특수한 완전한 길이의 RSV M2-1 공통 면역원 서열의 길이의 20% 이상, 25% 이상, 30% 이상, 35% 이상, 40% 이상, 45% 이상, 50% 이상, 55% 이상, 60% 이상, 65% 이상, 70% 이상, 75% 이상, 80% 이상, 85% 이상, 90% 이상, 91% 이상, 92% 이상, 93% 이상, 94% 이상, 95% 이상, 96% 이상, 97% 이상, 98% 이상, 99% 이상의 백분율을 포함할 수 있다. 단편은, 각각의 경우에 1번 위치에 신호 펩타이드 및/또는 메티오닌이 있거나 없는, 본원에 설정된 RSV M2-1 공통 면역원의 서열에 대해 98% 이상, 또는 99% 이상 상동성이고 이러한 서열에 대해 100% 동일한 폴리펩타이드의 단편을 말한다. 단편은 RSV M2-1 공통 면역원에 대해 98% 이상 상동성, 99% 이상 상동성이거나, 100% 동일한 폴리펩타이드의 단편을 포함할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 일부 구현예에서, RSV M2-1 면역원의 단편은 서열 번호: 4의 단편을 포함할 수 있다. 단편은 면역글로불린 신호 펩타이드, 예를 들면 IgE 신호 펩타이드 (서열 번호: 17) 또는 IgG 신호 펩타이드와 같은 신호 펩타이드에 연결된 서열 번호: 4의 단편을 포함할 수 있다. 따라서, 일부 구현예에서, 단편은 서열 번호: 17을 포함하는 서열 번호: 12의 단편이다. 단편은 N 말단 메티오닌에 연결된 서열 번호: 4의 단편을 포함할 수 있다. 단편은 또한 서열 번호: 4에 대해 98% 이상, 또는 99% 이상 상동성인 폴리펩타이드의 단편을 말한다. 단편은 서열 번호: 4에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 4에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있으며 상동성 백분율을 게산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 4에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호: 4에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있으며 상동성 백분율의 계산시 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. RSV M2-1 면역원은 195개 아미노산이다. 일부 구현예에서, 이의 단편은, 길이가 25개 이상의 아미노산, 길이가 30개 이상, 40개 이상, 50개 이상, 60개 이상, 70개 이상, 80개 이상, 90개 이상, 100개 이상, 110개 이상, 120개 이상, 130개 이상, 140개 이상, 150개 이상, 160개 이상, 170개 이상, 180개 이상, 184개 이상, 190개 이상, 193개 이상일 수 있다. 폴리펩타이드 단편은, 길이가 35개 미만의 아미노산, 45개 미만, 55개 미만, 65개 미만, 75개 미만, 85개 미만, 95개 미만, 105개 미만, 115개 미만, 125개 미만, 135개 미만, 145개 미만, 155개 미만, 165개 미만, 175개 미만, 185개 미만, 188개 미만, 192개 미만, 또는 194개 미만일 수 있다. 단편은 면역글로불린 신호 펩타이드, 예를 들면 IgE 또는 IgG 신호 펩타이드와 같은 N 말단 메티오닌 및/또는 신호 펩타이드를 추가로 포함할 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 194개 아미노산 또는 이의 보다 작은 단편에 연결될 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 194개 아미노산에 대해 98% 상동성인 폴리펩타이드 또는 194개 아미노산 서열에 대해 98% 상동성인 폴리펩타이드의 보다 작은 단편에 연결될 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 194개 아미노산 서열에 대해 99% 상동성인 폴리 펩타이드 또는 194개 아미노산 서열에 대해 99% 상동성인 폴리펩타이드의 보다 작은 단편일 수 있다. 상동성 정도의 계산시 폴리펩타이드는 서열 번호: 4 또는 이의 단편, 이러한 계산에 포함되지 않는 N 말단 메티오닌 및/또는 어떠한 신호 펩타이드도 갖는다. 신호 펩타이드의 서열은 상동성의 측정시 사용되지 않는다. 예를 들면, 서열 번호: 12가 신호 펩타이드 서열 번호: 17에 작동적으로 연결된 서열 번호: 4를 포함하지만, 서열 번호: 12는 서열 번호: 4의 단편에 대해 100% 상동성인 서열 번호 4의 단편을 포함하며, 그럼에도 불구하고 신호 펩타이드는 서열 번호: 4에 존재하지 않는다. 따라서, 서열 번호 4의 단편에 대해 적어도 98% 상동성인 폴리펩타이드의 단편을 포함하는 단백질은 적어도 25개 아미노산인 서열 번호: 4의 단편에 대해 적어도 98% 상동성이고 예를 들면, 신호 펩타이드에 대해 임의로 연결될 수 있는 단백질을 말하는 것으로 의도된다. 서열 번호: 30은 서열 번호: 4에 설정된 RSV M2-1 면역원의 면역우성 T 세포 에피토프에 상응한다. 서열 번호: 31은 서열 번호: 4에 설정된 RSV M2-1 면역원의 면역우성 T 세포 에피토프에 상응하는 아우성 T 세포 에피토프를 말한다. 일부 구현예에서, 단편은 이들 서열 또는 이에 대해 98% 이상 또는 99% 이상 상동성인 서열 중 하나 이상의 모두 또는 일부를 포함한다.
"단편"은, 각각의 경우에 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는, 위에서 설정된 RSV 면역원 단편, 즉, RSV F 면역원, RSV M2-1 면역원, RSV Ga 면역원, RSV Gb 면역원, 본원에 설정된 공통 서열에 대해 98% 이상 상동성인 단백질, 본원에 설정된 공통 서열에 대해 99% 이상 상동성인 단백질, 및 본원에 설정된 공통 서열에 대해 100% 동일한 단백질을 인코딩하는 핵산 단편을 또한 의미할 수 있다. 단편은 예를 들면, N 말단 메티오닌(즉, 출발 코돈)에 대한 코딩 서열 또는 면역글로불린 신호 펩타이드 예를 들면, IgE 신호 펩타이드(서열 번호: 17) 또는 IgG 신호 펩타이드와 같은 신호 펩타이드를 인코딩하는 코딩 서열에 연결된 RSV 면역원을 인코딩하는 핵산 서열의 단편을 포함한다. RSV 면역원을 인코딩하는 코딩 서열의 단편은 첨가된 비-RSV 신호 펩타이드를 인코딩하는 어떠한 코딩 서열을 제외하고는, 본원에 설정된 특수한 완전한 길이의 RSV 면역원 서열의 코딩 서열의 길이의 20% 이상, 25% 이상, 30% 이상, 35% 이상, 40% 이상, 45% 이상, 50% 이상, 55% 이상, 60% 이상, 65% 이상, 70% 이상, 75% 이상, 80% 이상, 85% 이상, 90% 이상, 91% 이상, 92% 이상, 93% 이상, 94% 이상, 95% 이상, 96% 이상, 97% 이상, 98% 이상, 99% 이상의 백분율을 포함할 수 있다. 단편은 또한 본원에 설정된 RSV 면역원의 서열에 대해 98% 이상, 또는 99% 이상 상동성인 폴리펩타이드를 인코딩하는 코딩 서열의 단편을 말한다. 단편은 이에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있으며 상동성 백분율의 계산시 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다.
일부 구현예에서, 단편은 서열 번호 1에 대해 98% 이상 상동성인 핵산 서열의 단편이다. 일부 구현예에서, 단편은 서열 번호: 1에 대해 99% 이상 상동성인 핵산 서열의 단편이다. 일부 구현예에서, 단편은 서열 번호: 1의 단편이다. 본원에 기술된 폴리펩타이드 단편을 인코딩하는 핵산 서열, 즉, 펩타이드 단편의 크기 및 상동성을 갖는 단백질을 인코딩하는 핵산 서열의 단편이 명확히 기재된 것으로 의도된다. 일부 구현예에서, 펩타이드 단편의 크기 및 상동성을 지닌 단백질을 인코딩하는 핵산 서열의 단편은 서열 번호: 1의 단편이다. 예를 들면, 서열 번호: 1 또는 서열 번호: 9와 같이, 각 경우에 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는, 서열 번호: 2, 서열 번호: 10에 기재된 것과 같은 RSV F 공통 면역원, 본원에 설정된 RSV F 공통 면역원 서열에 대해 98% 이상 상동성인 단백질, 본원에 설정된 RSV F 공통 면역원 서열에 대해 99% 상동성인 단백질, 본원에 설정된 공통 서열에 대해 100% 동일한 RSV F 공통 면역원을 인코딩하는 코딩 서열의 단편은 첨가된 어떠한 비-RSV 신호 펩타이드를 제외하고, 본원에 설정된 특수한 완전한 길이의 RSV F 공통 면역원 서열의 길이의 20% 이상, 25% 이상, 30% 이상, 35% 이상, 40% 이상, 45% 이상, 50% 이상, 55% 이상, 60% 이상, 65% 이상, 70% 이상, 75% 이상, 80% 이상, 85% 이상, 90% 이상, 91% 이상, 92% 이상, 93% 이상, 94% 이상, 95% 이상, 96% 이상, 97% 이상, 98% 이상, 99% 이상의 백분율을 포함할 수 있다. 단편은, 각 경우에 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는, 본원에 설정된 RSV F 공통 면역원의 서열에 대해 98% 이상, 또는 99% 이상 상동성이고 이러한 서열에 대해 100% 동일한 폴리펩타이드의 단편을 인코딩할 수 있다. 단편은 RSV F 공통 면역원에 대해 98% 이상 상동성, 99% 이상 상동성, 또는 100% 동일한 폴리펩타이드의 단편을 암호화할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 일부 구현예에서, RSV F 면역원을 인코딩하는 단편은 서열 번호: 2의 단편을 인코딩할 수 있고 서열 번호: 1의 단편을 포함할 수 있다. 단편은 면역글로불린 신호 펩타이드 예를 들면 IgE 신호 펩타이드 (서열 번호: 17) 또는 IgG 신호 펩타이드와 같은 신호 펩타이드에 연결된 서열 번호: 2의 단편을 인코딩할 수 있다. 따라서 일부 구현예에서, 단편은 서열 번호: 17을 포함하는 서열 번호: 10의 단편이고 서열 번호: 9에 의해 인코딩될 수 있다. 단편은 출발 코돈에 연결된 서열 번호: 1의 단편을 포함할 수 있다. 단편은 서열 번호: 2에 대해 98% 이상, 또는 99% 이상 상동성인 폴리펩타이드의 단편을 인코딩한다. 단편은 서열 번호: 2에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 2에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 2에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호: 2에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호: 1에 대해 98% 이상, 또는 99% 이상 상동성일 수 있다. 단편은 서열 번호: 1에 대해 98% 이상 상동성일 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 1에 대해 99% 이상 상동성일 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 1에 대해 98% 이상 상동성일 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호: 1에 대해 99% 이상 상동성일 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 각 경우에 출발 코돈 또는 신호 펩타이드를 인코딩하는 코딩 서열이 있거나 없는, 서열 번호: 1의 단편, 서열 번호: 1에 대해 98% 이상 상동성인 핵산 서열의 단편, 및 서열 번호: 1에 대해 99% 이상 상동성인 핵산 서열의 단편은, 길이가 115개 아미노산 이상일 수 있는 RSV F 면역원의 단편, 길이가 163개 이상, 230개 이상, 288개 이상, 345개 이상, 403개 이상, 460개 이상, 515개 이상, 520개 이상, 525개 이상, 530개 이상, 535개 이상, 540개 이상, 545개 이상, 550개 이상, 555개 이상, 560개 이상, 565개 이상, 570개 이상, 574개 이상일 수 있는 RSV F 면역원의 단편을 인코딩할 수 있다. 폴리펩타이드 단편은, 길이가 140개 아미노산 이하, 190개 미만, 250개 미만, 283개 미만, 300개 미만, 365개 미만, 425개 미만, 495개 미만, 518개 미만, 523개 미만, 528개 미만, 533개 미만, 547개 미만, 552개 미만, 563개 미만, 또는 572개 미만일 수 있다. 단편은 면역글로불린 신호 펩타이드, 예를 들면 IgE 또는 IgG 신호 펩타이드와 같은 N 말단 메티오닌 및/또는 신호 펩타이드를 추가로 인코딩할 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 574개 아미노산 또는 이의 보다 작은 단편을 인코딩하는 서열에 연결될 수 있다. 단편은 574개 아미노산에 대해 98% 상동성인 폴리펩타이드 또는 574개 아미노산 서열에 대해 98% 상동성인 폴리펩타이드의 보다 작은 단편에 연결된 N 말단 메티오닌 및/또는 신호 펩타이드를 인코딩할 수 있다. 단편은 574개 아미노산 서열에 대해 99% 상동성인 폴리펩타이드 또는 574개 아미노산 서열에 대해 99% 상동성인 폴리펩타이드의 보다 작은 단편에 연결된 N 말단 메티오닌 및/또는 신호 펩타이드를 인코딩할 수 있다. 상동성 정도를 계산하는데 있어서, 폴리펩타이드는 서열 번호: 2 또는 이의 단편을 가지며, N 말단 메티오닌 및/또는 어떠한 신호 펩타이드도 이러한 계산에 포함되지 않는다. 신호 펩타이드의 서열은 상동성의 측정시 사용되지 않는다. 따라서, 예를 들면, 서열 번호: 7이 신호 펩타이드 서열 번호: 17을 인코딩하는 코딩 서열에 작동적으로 연결된 서열 번호: 1을 포함한다고 해도, 서열 번호: 7은, 서열 번호: 1에 부재하는 신호 펩타이드 코딩 서열에도 불구하고 서열 번호: 1의 단편에 대해 100% 상동성인 서열 번호: 1의 단편을 포함한다. 서열 번호: 22, 서열 번호: 23, 서열 번호: 24, 및 서열 번호: 25는 서열 번호: 2에 설정된 RSV F 면역원의 T 세포 에피토프에 상응한다. 일부 구현예에서, 단편은 서열 번호: 1의 단편 또는 서열 번호: 1에 대해 98% 이상 또는 99% 이상 상동성인 서열을 포함하는, 하나 이상의 이들 서열 중의 모두 또는 일부 또는 이들에 대해 98% 이상 또는 99% 이상 상동성인 서열을 인코딩하는 코딩 서열을 포함한다.
일부 구현예에서, 단편은 서열 번호: 5에 대해 98% 이상 상동성인 핵산 서열의 단편이다. 일부 구현예에서, 단편은 서열 번호: 5에 대해 99% 이상 상동성인 핵산 서열의 단편이다. 일부 구현예에서, 단편은 서열 번호: 5의 단편이다. 본원에 기술된 폴리펩타이드 단편을 인코딩하는 핵산 서열, 즉, 펩타이드 단편의 크기 및 상동성을 갖는 단백질을 인코딩하는 핵산 서열의 단편이 명확히 기재된 것으로 의도된다. 일부 구현예에서, 펩타이드 단편의 크기 및 상동성을 갖는 단백질을 인코딩하는 핵산 서열의 단편은 서열 번호: 5의 단편이다. 예를 들면, 서열 번호: 5 또는 서열 번호: 13과 같이, 각 경우에 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는, 서열 번호: 6, 서열 번호: 14에 기재된 것과 같은 RSV Ga 공통 면역원, 본원에 설정된 RSV Ga 공통 면역원 서열에 대해 98% 이상 상동성인 단백질, 본원에 설정된 RSV Ga 공통 면역원 서열에 대해 99% 이상 상동성인 단백질, 및 본원에 설정된 공통 서열에 대해 100% 동일한 RSV Ga 공통 면역원을 인코딩하는 코딩 서열의 단편은 첨가된 어떠한 비-RSV 신호 펩타이드를 제외하고는, 본원에 설정된 특수한 완전한 길이의 RSV Ga 공통 면역원 서열의 길이의 20% 이상, 25% 이상, 30% 이상, 35% 이상, 40% 이상, 45% 이상, 50% 이상, 55% 이상, 60% 이상, 65% 이상, 70% 이상, 75% 이상, 80% 이상, 85% 이상, 90% 이상, 91% 이상, 92% 이상, 93% 이상, 94% 이상, 95% 이상, 96% 이상, 97% 이상, 98% 이상, 99% 이상을 포함할 수 있다. 단편은 각 경우에 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는, 본원에 설정된 RSV Ga 공통 면역원의 서열에 대해 98% 이상, 또는 99% 이상 상동성이거나 이러한 서열에 대해 100% 동일한 폴리펩타이드의 단편을 인코딩할 수 있다. 단편은 RSV Ga 공통 면역원에 대해 98% 이상 상동성, 99% 이상 상동성이거나, 100% 동일한 폴리펩타이드의 단편을 인코딩할 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 일부 구현예에서, RSV Ga 면역원을 인코딩하는 단편은 서열 번호: 6의 단편을 인코딩할 수 있고 서열 번호: 5의 단편을 포함할 수 있다. 단편은 면역글로불린 신호 펩타이드와 같은 신호 펩타이드, 예를 들면 IgE 신호 펩타이드(서열 번호: 17) 또는 IgG 신호 펩타이드에 연결된 서열 번호: 6의 단편을 인코딩할 수 있다. 따라서 일부 구현예에서, 단편은 서열 번호: 17을 포함하는 서열 번호: 14의 단편이고 서열 번호: 13에 의해 인코딩될 수 있다. 단편은 출발 코돈에 연결된 서열 번호: 5의 단편을 포함할 수 있다. 단편은 또한 서열 번호: 6에 대해 98% 이상, 또는 99% 이상 상동성인 폴리펩타이드의 단편을 인코딩한다. 단편은 서열 번호: 6에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 6에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 6에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호: 6에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호: 5에 대해 98% 이상, 또는 99% 이상 상동성일 수 있다. 단편은 서열 번호: 5에 대해 98% 이상 상동성일 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 5에 대해 99% 이상 상동성일 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호; 5에 대해 98% 이상 상동성일 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호: 5에 대해 99% 이상 상동성일 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 각각의 경우 출발 코돈 또는 신호 펩타이드를 인코딩하는 코딩 서열이 있거나 없는, 서열 번호: 5의 단편, 서열 번호: 5에 대해 98% 이상 상동성인 핵산 서열의 단편, 및 서열 번호: 5에 대해 99% 이상 상동성인 핵산 서열의 단편은 일부 구현예에서, 이의 단편일 수 있는 RSV Ga 면역원의 단편을 인코딩할 수 있으며, 길이가 125개 이상의 아미노산, 길이가 130개 이상, 140개 이상, 150개 이상, 160개 이상, 170개 이상, 180개 이상, 190개 이상, 200개 이상, 210개 이상, 220개 이상, 230개 이상, 240개 이상, 250개 이상, 260개 이상, 270개 이상, 280개 이상, 285개 이상, 290개 이상, 295개 이상일 수 있다. 폴리펩타이드 단편은, 길이가 135개 미만의 아미노산, 145개 미만, 155개 미만, 165개 미만, 175개 미만, 185개 미만, 195개 미만, 205개 미만, 215개 미만, 225개 미만, 235개 미만, 245개 미만, 255개 미만, 265개 미만, 275개 미만, 285개 미만, 288개 미만, 292개 미만, 또는 296개 미만일 수 있다. 단편은 면역글로불린 신호 펩타이드, 예를 들면 IgE 또는 IgG 신호 펩타이드와 같은 N 말단 메티오닌 및/또는 신호 펩타이드를 추가로 인코딩할 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 296개 아미노산 또는 이의 보다 작은 단편을 인코딩하는 서열에 연결될 수 있다. 단편은 296개 아미노산에 대해 98% 상동성인 폴리펩타이드 또는 296개 아미노산 서열에 대해 98% 상동성인 폴리펩타이드의 보다 작은 단편에 연결된 N 말단 메티오닌 및/또는 신호 펩타이드를 인코딩할 수 있다. 단편은 296개 아미노산에 대해 99% 상동성인 폴리펩타이드 또는 296개 아미노산 서열에 대해 99% 상동성인 폴리펩타이드의 보다 작은 단편에 연결된 N 말단 메티오닌 및/또는 신호 펩타이드를 인코딩할 수 있다. 상동성의 정도를 계산하는데 있어서, 폴리펩타이드는 서열 번호: 6 또는 이의 단편을 가지며, N 말단 메티오닌 및/또는 어떠한 신호 펩타이드도 이러한 계산에 포함되지 않는다. 신호 펩타이드의 서열은 상동성의 측정시 사용되지 않는다. 따라서, 예를 들면, 서열 번호: 13이 신호 펩타이드 서열 번호: 17을 인코딩하는 코딩 서열에 작동적으로 연결된 서열 번호: 5를 포함한다고 해도, 서열 번호: 13은, 서열 번호; 5에 부재하는 신호 펩타이드 코딩 서열에도 불구하고, 서열 번호; 5의 단편에 대해 100% 상동성인 서열 번호; 5의 단편을 포함한다.
일부 구현예에서, 단편은 서열 번호; 7에 대해 98% 이상 상동성인 핵산 서열의 단편이다. 일부 구현예에서, 단편은 서열 번호: 7에 대해 99% 이상 상동성인 핵산 서열의 단편이다. 일부 구현예에서, 단편은 서열 번호: 7의 단편이다. 본원에 기술된 폴리펩타이드 단편을 인코딩하는 핵산 서열, 즉, 펩타이드 단편의 크기 및 상동성을 갖는 단백질을 인코딩하는 핵산 서열의 단편이 명확히 기재된 것으로 의도된다. 일부 구현예에서, 펩타이드 단편의 크기 및 상동성을 지닌 단백질을 인코딩하는 핵산 서열의 단편은 서열 번호: 7의 단편이다. 예를 들면, 서열 번호: 7 또는 서열 번호: 15와 같이, 각 경우에 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는, 서열 번호: 8, 서열 번호: 16에 기재된 것과 같은 RSV Gb 공통 면역원, 본원에 설정된 RSV Gb 공통 면역원 서열에 대해 98% 이상 상동성인 단백질, 본원에 설정된 RSV Gb 공통 면역원 서열에 대해 99% 이상 상동성인 단백질, 및 본원에 설정된 공통 서열에 대해 100% 상동성인 RSV Gb 공통 면역원을 인코딩하는 코딩 서열의 단편은 첨가된 비-RSV 신호 펩타이드를 제외하고, 본원에 설정된 특수한 완전한 길이의 RSV Gb 공통 면역원 서열의 길이의 20% 이상, 25% 이상, 30% 이상, 35% 이상, 40% 이상, 45% 이상, 50% 이상, 55% 이상, 60% 이상, 65% 이상, 70% 이상, 75% 이상, 80% 이상, 85% 이상, 90% 이상, 91% 이상, 92% 이상, 93% 이상, 94% 이상, 95% 이상, 96% 이상, 97% 이상, 98% 이상, 99% 이상 백분율을 포함할 수 있다. 단편은 각각의 경우에 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는, 본원에 설정된 RSV Gb 공통 면역원의 서열에 대해 98% 이상, 또는 99% 이상 상동성이고 이러한 서열에 대해 100% 동일한 펩타이드의 단편을 인코딩할 수 있다. 단편은 RSV Gb 공통 면역원에 대해 98% 이상 상동성이거나, 99% 이상 상동성이거나, 100% 동일한 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율의 계산시 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 일부 구현예에서, RSV Gb 면역원을 인코딩하는 단편은 서열 번호: 8의 단편을 인코딩할 수 있고 서열 번호: 7의 단편을 포함할 수 있다. 단편은 면역글로불린 신호 펩타이드, 예를 들면, IgE 신호 펩타이드(서열 번호: 17) 또는 IgG 신호 펩타이드와 같은 신호 펩타이드에 연결된 서열 번호: 8의 단편을 인코딩할 수 있다. 따라서, 일부 구현예에서, 단편은 서열 번호; 17을 포함하는 서열 번호: 16의 단편이며 서열 번호: 15에 의해 인코딩될 수 있다. 단편은 또한 출발 코돈에 연결된 서열 번호: 7의 단편을 포함할 수 있다. 단편은 서열 번호; 8에 대해 98%이상, 또는 99% 이상 상동성인 폴리펩타이드의 단편을 인코딩한다. 단편은 서열 번호: 8에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율의 계산시 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 8에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율의 계산시 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 8에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율의 계산시 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호: 8에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율의 계산시 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호: 7에 대해 98% 이상, 또는 99% 이상 상동성일 수 있다. 단편은 서열 번호: 7에 대해 98% 이상 상동성일 수 있고 상동성 백분율의 계산시 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 7에 대해 99% 이상 상동성일 수 있고 상동성 백분율의 계산시 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 7에 대해 98% 이상 상동성일 수 있고 상동성 백분율의 계산시 포함되지 않는N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호: 7에 대해 99% 이상 상동성일 수 있고 상동성 백분율의 계산시 포함되지 않는N 말단 메티오닌을 추가로 포함할 수 있다. 각각의 경우에 출발 코돈 또는 신호 펩타이드를 인코딩하는 코딩 서열이 있거나 없는, 서열 번호: 7의 단편, 서열 번호: 7에 대해 98% 이상 상동성인 핵산 서열의 단편, 및 서열 번호: 7에 대해 99% 이상 상동성인 핵산 서열의 단편은 일부 구현예에서 있을 수 있는 RSV Gb의 단편을 인코딩할 수 있고, 그 단편은 길이가 125개 이상의 아미노산, 길이가 130개 이상, 140개 이상, 150개 이상, 160개 이상, 170개 이상, 180개 이상, 190개 이상, 200개 이상, 210개 이상, 220개 이상, 230개 이상, 240개 이상, 250개 이상, 260개 이상, 270개 이상, 280개 이상, 285개 이상, 288개 이상일 수 있다. 폴리펩타이드 단편은, 길이가 135개 미만의 아미노산, 145개 미만, 155개 미만, 165, 175개 미만, 185개 미만, 195개 미만, 205개 미만, 215개 미만, 225개 미만, 235개 미만, 245개 미만, 255개 미만, 265개 미만, 275개 미만, 285개 미만, 288개 미만, 290개 미만일 수 있다. 단편은 면역글로불린 신호 펩타이드, 예를 들면 IgE 또는 IgG 신호 펩타이드와 같은 N 말단 메티오닌 및/또는 신호 펩타이드를 추가로 인코딩할 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 290개 아미노산 또는 이의 보다 작은 단편을 인코딩하는 서열에 연결될 수 있다. 단편은 290개 아미노산에 대해 98% 상동성인 폴리펩타이드 또는 290개 아미노산 서열에 대해 98% 상동성인 폴리펩타이드의 보다 작은 단편에 연결된 N 말단 메티오닌 및/또는 신호 펩타이드를 인코딩할 수 있다. 단편은 290개 아미노산 서열에 대해 99% 상동성인 폴리펩타이드 또는 290개 아미노산 서열에 대해 99% 상동성인 보다 작은 단편에 연결된 N 말단 메티오닌 및/또는 신호 펩타이드를 인코딩할 수 있다. 상동성 정도의 계산 시 폴리펩타이드는 서열 번호: 8 또는 이의 단편을 가지며, N 말단 메티오닌 및/또는 어떠한 신호 펩타이드도 이러한 계산에 포함되지 않는다. 신호 펩타이드의 서열은 상동성의 측정시 사용되지 않는다. 따라서, 예를 들면, 서열 번호: 15가 신호 펩타이드 서열 번호: 17을 인코딩하는 코딩 서열에 작동적으로 연결된 서열 번호: 7을 포함한다고 해도, 서열 번호: 15는, 서열 번호: 7에 부재하는 신호 펩타이드 코딩 서열에도 불구하고, 서열 번호: 7의 단편에 대해 100% 상동성인 서열 번호: 7의 단편을 포함한다.
또한 서열 번호: 3에 대해 98% 이상 상동성인 핵산 서열의 단편을 포함하는 RSV M2-1과 관련된 서열이 제공된다. 일부 구현예에서, 단편은 서열 번호: 3에 대해 99% 이상 상동성인 핵산 서열의 단편이다. 일부 구현예에서, 단편은 서열 번호: 3의 단편이다. 본원에 기술된 폴리펩타이드 단편을 인코딩하는 핵산 서열, 즉, 펩타이드 단편의 크기 및 상동성을 갖는 단백질을 인코딩하는 핵산 서열의 단편이 명확히 기재된 것으로 의도된다. 일부 구현예에서, 펩타이드 단편의 크기 및 상동성을 갖는 단백질을 인코딩하는 핵산 서열의 단편은 서열 번호: 3의 단편이다. 예를 들면 서열 번호: 3 또는 서열 번호: 11에서와 같이, 각 경우에 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는, 서열 번호: 4, 서열 번호: 12에 기재된 것과 같은 RSV M2-1 공통 면역원, 본원에 설정된 RSV M2-1 공통 면역원 서열에 대해 98% 이상 상동성인 단백질, 본원에 설정된 RSV M2-1 공통 면역원 서열에 대해 99% 이상 상동성인 단백질, 및 본원에 설정된 공통 서열에 대해 100% 상동성인 RSV M2-1 공통 면역원을 인코딩하는 코딩 서열의 단편은 첨가된 어떠한 비-RSV 신호 펩타이드를 제외하고, 본원에 설정된 특수한 완전한 길이의 RSV M2-1 공통 면역원 서열의 길이의 20% 이상, 25% 이상, 30% 이상, 35% 이상, 40% 이상, 45% 이상, 50% 이상, 55% 이상, 60% 이상, 65% 이상, 70% 이상, 75% 이상, 80% 이상, 85% 이상, 90% 이상, 91% 이상, 92% 이상, 93% 이상, 94% 이상, 95% 이상, 96% 이상, 97% 이상, 98% 이상, 99% 이상 백분율을 포함할 수 있다. 단편은 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는, 본원에 설정된 RSV M2-1 공통 면역원의 서열에 대해 98% 이상, 또는 99% 이상 상동성이고 이러한 서열에 대해 100% 동일한 폴리펩타이드의 단편을 인코딩할 수 있다. 단편은 RSV M2-1 공통 면역원에 대해 98% 이상 상동성이거나, 99% 이상 상동성이거나, 100% 동일한 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 일부 구현예에서, RSV M2-1 면역원을 인코딩하는 단편은 서열 번호: 4의 단편을 인코딩할 수 있으며 서열 번호: 3의 단편을 포함할 수 있다. 단편은 면역글로불린 신호 펩타이드와 같은 신호 펩타이드, 예를 들면 IgE 신호 펩타이드 (서열 번호: 17) 또는 IgG 신호 펩타이드에 연결된 서열 번호: 4의 단편을 인코딩할 수 있다. 따라서, 일부 구현예에서, 단편은 서열 번호: 17을 포함하는 서열 번호: 12의 단평이고 서열 번호: 11에 의해 인코딩될 수 있다. 단편은 출발 코돈에 연결된 서열 번호: 3의 단편을 포함할 수 있다. 단편은 서열 번호: 4에 대해 98% 이상, 또는 99% 이상 상동성인 폴리펩타이드의 단편을 또한 인코딩한다. 단편은 서열 번호: 4에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 4에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 4에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호: 4에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호: 3에 대해 98% 이상, 또는 99% 이상 상동성일 수 있다. 단편은 서열 번호: 3에 대해 99% 이상 상동성일 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 3에 대해 99% 이상 상동성일 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 3에 대해 98% 이상 상동성일 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호: 3에 대해 99% 이상 상동성일 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 각각의 경우에 출발 코돈 또는 신호 펩타이드를 인코딩하는 코딩 서열이 있거나 없는, 서열 번호: 3의 단편, 서열 번호: 3에 대해 98% 이상 상동성인 핵산 서열의 단편, 및 서열 번호: 3에 대해 99% 이상 상동성인 핵산 서열의 단편은 일부 구현예에서, 이의 단편일 수 있는 RSV M2-1 면역글로불린의 단편을 인코딩할 수 있고 길이가 25개 이상의 아미노산, 30개 이상, 40개 이상, 50개 이상, 60개 이상, 70개 이상, 80개 이상, 90개 이상, 100개 이상, 110개 이상, 120개 이상, 130개 이상, 140개 이상, 150개 이상, 160개 이상, 170개 이상, 180개 이상, 184개 이상, 190개 이상, 또는 193개 이상일 수 있다. 폴리펩타이드 단편은, 길이가 35개 미만의 아미노산, 45개 미만, 55개 미만, 65개 미만, 75개 미만, 85개 미만, 95개 미만, 105개 미만, 115개 미만, 125개 미만, 135개 미만, 145개 미만, 155개 미만, 165개 미만, 175개 미만, 185개 미만, 188개 미만, 192개 미만, 또는 194개 미만일 수 있다. 단편은 면역글로불린 신호 펩타이드, 예를 들면 IgE 또는 IgG 신호 펩타이드와 같은 N 말단 메티오닌 및/또는 신호 펩타이드를 추가로 인코딩할 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 194개 아미노산 또는 이의 보다 작은 단편을 인코딩하는 서열에 연결될 수 있다. 단편은 194개 아미노산에 대해 98% 상동성인 폴리펩타이드 또는 194개 아미노산 서열에 대해 98% 상동성인 폴리펩타이드의 보다 작은 단편에 연결된 N 말단 메티오닌 및/또는 신호 펩타이드를 인코딩할 수 있다. 단편은 194개 아미노산에 대해 99% 상동성인 폴리펩타이드 또는 194개 아미노산 서열에 대해 99% 상동성인 폴리펩타이드의 보다 작은 단편에 연결된 N 말단 메티오닌 및/또는 신호 펩타이드를 인코딩할 수 있다. 상동성 정도의 계산시 폴리펩타이드는 서열 번호: 4 또는 이의 단편, 이러한 계산에 포함되지 않는 N 말단 메티오닌 및/또는 어떠한 신호 펩타이드도 갖는다. 신호 펩타이드의 서열은 상동성의 측정시 사용되지 않는다. 따라서, 예를 들면, 서열 번호: 9가 신호 펩타이드 서열 번호: 17을 인코딩하는 코딩 서열에 작동적으로 연결된 서열 번호: 3을 포함한다고 해도, 서열 번호: 9는, 서열 번호: 3에 부재하는 신호 펩타이드 코딩 서열에도 불구하고, 서열 번호: 3의 단편에 대해 100% 상동성인 서열 번호: 3의 단편을 포함한다. 서열 번호: 30은 서열 번호: 4에 설정된 RSV M2-1 면역원의 면역우성 T 세포 에피토프에 상응한다. 서열 번호: 31은 서열 번호: 4에 설정된 RSV M2-1 면역원의 면역우성 T 세포 에피토프에 상응하는 아우성 T 세포 에피토프를 말한다. 일부 구현예에서, 단편은 서열 번호; 3의 단편을 포함하는 이들 서열 또는 이들에 대해 98% 이상 또는 99% 이상 상동성인 서열의 하나 이상 또는 서열 번호: 3에 대해 98% 이상 또는 99% 이상 상동성인 서열 모두 또는 일부를 인코딩하는 코딩 서열을 포함한다.
l. 동일한
둘 이상의 핵산 또는 폴리펩타이드 서열의 문맥에서 본원에서 사용된 바와 같이, "동일한" 또는 "동일성"는 상기 서열이 지정된 영역에 대해 동일한 지정된 백분율의 잔기를 갖는다는 것을 의미할 수 있다. 상기 백분율은 두 서열을 최적으로 정렬하고, 지정된 영역에 대해 두 서열을 비교하고, 두 서열에서 동일한 잔기가 발생하는 위치의 수를 결정하여 일치된 위치의 수를 산출하고, 상기 일치된 위치의 수를 지정된 영역 내의 위치의 총 수로 나누고, 상기 결과에 100을 곱하여 서열 동일성의 백분율을 산출함으로써 계산될 수 있다. 두 서열이 상이한 길이이거나 상기 정렬이 하나 이상의 어긋난(staggered) 말단을 생성하고 비교하는 상기 지정된 영역이 단지 하나의 서열을 포함하는 경우, 하나의 서열의 잔기들이 분모에 포함되지만 계산의 분자에는 포함되지 않는다. DNA 및 RNA를 비교할 때, 티민 (T) 및 우라실 (U)은 동등한 것으로 간주될 수 있다. 동일성은 수작업으로 또는 BLAST 또는 BLAST 2.0과 같은 컴퓨터 서열 알고리즘을 이용하여 수행될 수 있다.
m. 임피던스
본원에서 사용된 바와 같이 "임피던스"는 피드백 기전을 논의할 때 사용될 수 있으며, 옴의 법칙에 따라 전류 값으로 변환될 수 있어서 미리 조정된 전류와 비교할 수 있다.
n. 면역 반응
본원에서 사용된 바와 같이 "면역 반응"은 제공된 DNA 플라스미드 백신을 통해 하나 이상의 RSV 공통 항원의 도입에 반응한, 숙주의 면역계의 활성화, 예컨대 포유동물의 면역계의 활성화를 의미할 수 있다. 상기 면역 반응은 세포성 또는 체액성 반응, 또는 둘 모두의 형태일 수 있다.
o. 핵산
본원에 사용된 바와 같이 "핵산" 또는 "올리고뉴클레오타이드" 또는 "폴리뉴클레오타이드"는 함께 공유결합된 적어도 2개의 뉴클레오타이드를 의미할 수 있다. 단일 가닥의 묘사는 또한 상보적 가닥의 서열을 정의한다. 따라서, 핵산은 또한 묘사된 단일 가닥의 상보적 가닥을 포함한다. 핵산의 많은 변이체들이 주어진 핵산과 동일한 목적을 위해 사용될 수 있다. 따라서, 핵산은 또한 실질적으로 동일한 핵산 및 이의 보체를 포함한다. 단일 가닥은 엄격한 혼성화 조건 하에서 표적 서열에 혼성화할 수 있는 프로브를 제공한다. 따라서, 핵산은 또한 엄격한 혼성화 조건 하에서 혼성화하는 프로브를 포함한다.
핵산은 단일가닥 또는 이중가닥일 수 있거나, 이중가닥 및 단일가닥 서열의 일부을 함유할 수 있다. 상기 핵산은 DNA, 게놈 및 cDNA 모두, RNA, 또는 하이브리드일 수 있으며, 여기서 핵산은 데옥시리보- 및 리보-뉴클레오타이드의 조합, 및 우라실, 아데닌, 티민, 시토신, 구아닌, 이노신, 잔틴 하이포잔틴, 이소시토신 및 이소구아닌을 포함하는 염기들의 조합을 함유할 수 있다. 핵산은 화학적 합성 방법 또는 재조합 방법에 의해 수득될 수 있다.
p. 작동적으로 연결된
본원에 사용된 것으로서 "작동적으로 연결된"는, 유전자의 발현이 이것이 공간적으로 연결된 프로모터의 조절하에 있음을 의미할 수 있다. 프로모터는 이의 조절하에서 유전자의 5'(상류) 또는 3'(하류)에 위치할 수 있다. 프로모터와 유전자 간의 거리는, 프로모터가 유도된 유전자 내에서 그것이 제어하는 프로모터와 유전자 간의 거리와 대략 동일할 수 있다. 당해 기술에 공지된 바와 같이, 이 거리의 변화는 프로모터 기능의 손실 없이 수용될 수 있다.
q. 프로모터
본원에서 사용된 바와 같이 "프로모터"는 세포에서 핵산의 발현을 부여하거나, 활성화하거나 향상시킬 수 있는 합성 또는 천연적으로-유도된 분자를 의미할 수 있다. 프로모터는 발현을 더 향상시키고/거나 이의 공간 발현 및/또는 일시적 발현을 변경하는 하나 이상의 특이적 전사 조절 서열을 포함할 수 있다. 프로모터는 또한 원위(distal) 인핸서 또는 억제자 요소를 포함할 수 있고, 이는 전사 개시 부위로부터 수천 염기쌍 정도에 위치할 수 있다. 프로모터는 바이러스, 박테리아, 진균, 식물, 곤충, 및 동물을 포함하는 공급원으로부터 유래될 수 있다. 프로모터는 발현이 일어나는 세포, 조직 또는 장기와 관련하여, 또는 발현이 일어나는 발달 단계와 관련하여, 또는 생리적 스트레스, 병원체, 금속 이온, 또는 유도제와 같은 외부 자극에 대한 반응으로, 항시적으로, 또는 차별적으로 유전자 구성요소의 발현을 조절할 수 있다. 프로모터의 대표적인 예는 박테리오파아지 T7 프로모터, 박테리오파아지 T3 프로모터, SP6 프로모터, lac 오퍼레이터-프로모터, tac 프로모터, SV40 후기 프로모터, SV40 초기 프로모터, RSV-LTR 프로모터, CMV IE 프로모터, SV40 초기 프로모터 또는 SV40 후기 프로모터 및 CMV IE 프로모터를 포함한다.
r. 엄격한 혼성화 조건
본원에서 사용된 바와 같이 "엄격한 혼성화 조건"는 핵산의 복합 혼합물에서와 같이, 제1 핵산 서열 (예를 들면, 프로브)이 제2 핵산 서열 (예를 들면, 표적)에 혼성화하게 될 조건을 의미할 수 있다. 엄격한 조건은 서열-의존적이며 상이한 상황에서 상이할 것이다. 엄격한 조건은 정의된 이온 강도 pH에서 명시된 서열에 대해 열 융점(Tm) 보다 약 5 내지 10℃ 더 낮도록 선택될 수 있다. Tm는, 표적에 대해 상보성인 프로브의 50%가 평형에서 표적 서열에 대해 하이브리드화하는(표적 서열은 과량으로 존재하므로, Tm에서, 프로브의 50%가 평형에 관여한다) 온도(정의된 이온 강도, pH, 및 핵산 농도)일 수 있다. 엄격한 조건은, 염 농도가 pH 7.0 내지 8.3에서 약 0.01 내지 1.0 M 나트륨 이온 농도(또는 다른 염)과 같은 약 1.0 M 미만의 나트륨 이온이고 온도가 짧은 프로브(예를 들면, 약 10 내지 50개 뉴클레오타이드)의 경우 적어도 약 30℃이고 긴 프로브(예를 들면, 약 50개 이상의 뉴클레오타이드)의 경우 적어도 약 60℃인 것일 수 있다. 엄격한 조건은 또한 포름아미드와 같은 탈안정화제의 첨가로 달성될 수 있다. 선택적 또는 특이적 혼성화를 위해, 양성 신호가 배경 혼성화의 적어도 2 내지 10배일 수 있다. 예시적인 엄격한 하이브리드화 조건은 다음을 포함한다: 50% 포름아미드, 5x SSC, 및 1% SDS, 42℃에서 항온처리, 또는, 5x SSC, 1% SDS, 65℃에서 항온처리와 함께, 65℃에서 0.2x SSC, 및 0.1% SDS 속에서 세척.
s. 실질적으로 상보적
본원에서 사용된 바와 같이 "실질적으로 상보적"는 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100 또는 그 이상의 뉴클레오타이드 또는 아미노산의 영역에 대해 제1 서열이 제2 서열의 보체에 적어도 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98% 또는 99% 동일하거나, 또는 상기 두 서열이 엄격한 혼성화 조건 하에서 혼성화하는 것을 의미할 수 있다.
t. 실질적으로 동일한
본원에서 사용된 바와 같이 "실질적으로 동일한"는, 만약 제1 서열이 제2 서열의 보체에 실질적으로 상보적이면, 제1 및 제2 서열이 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100 또는 그 이상의 뉴클레오타이드 또는 아미노산의 영역에 대해 또는 핵산에 대해, 적어도 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98% 또는 99% 동일하다는 것을 의미할 수 있다.
u. 변이체
핵산과 관련하여 본원에 사용된 "변이체"는 (i) 참조된 뉴클레오타이드 서열의 일부 또는 단편; (ii) 참조된 뉴클레오타이드 서열 또는 이의 일부의 보체; (iii) 참조된 핵산 또는 이의 보체와 실질적으로 동일한 핵산; 또는 (iv) 참조된 핵산, 이의 보체, 또는 이와 실질적으로 동일한 서열에 엄격한 조건 하에서 혼성화하는 핵산을 의미할 수 있다.
펩타이드 또는 폴리펩타이드에 대한 "변이체"는 아미노산의 삽입, 결실, 또는 보존적 치환에 의해 아미노산 서열이 상이하지만, 적어도 하나의 생물학적 활성을 유지한다. 변이체는 또한 적어도 하나의 생물학적 활성을 보유하는 아미노산 서열을 갖는 참조된 단백질과 실질적으로 동일한 아미노산 서열을 갖는 단백질을 의미할 수 있다. 아미노산의 보존적 치환, 즉, 아미노산을 유사한 특성(예를 들면, 친수성, 전하를 띠는 영역의 정도 및 분포)의 상이한 아미노산으로 치환하는 것은 전형적으로 미세한 변화를 수반하는 것으로 당해 기술분야에서 인식된다. 이들 미세한 변화는 당해 기술분야에서 이해되는 바와 같이, 아미노산의 수치요법 지수(hydropathic index)를 고려함으로써, 일부 확인될 수 있다(Kyte 등, J. Mol. Biol. 157:105-132 (1982)). 아미노산의 상기 수치요법 지수는 그의 소수성 및 전하의 고려에 기초한다. 유사한 수치요법 지수의 아미노산이 치환될 수 있고 여전히 단백질 기능을 보유한다는 것이 당해기술분야에 공지되어 있다. 일 측면에서, ±2의 수치요법 지수를 갖는 아미노산이 치환된다. 아미노산의 친수성은 또한 생물학적 기능을 보유하는 단백질을 야기할 치환을 밝히는데 사용될 수 있다. 펩타이드의 문맥에서 아미노산의 친수성의 고려는 항원성 및 면역원성과 밀접한 상관관련이 있다고 보고된 유용한 척도인 상기 펩타이드의 가장 큰 국소적 평균 친수성의 계산을 가능하게 한다. 본원에 전문이 참고로 통합된, 미국 특허 제4,554,101호. 유사한 소수성 값을 갖는 아미노산의 치환은 당해 분야에서 이해되는 바와 같이, 생물학적 활성, 예를 들면, 면역원성을 보유하는 펩타이드를 생성할 수 있다. 치환은 서로 ±2내의 친수성 값을 갖는 아미노산을 사용하여 수행할 수 있다. 아미노산의 소수성 지수 및 친수성 값 둘 다는 이러한 아미노산의 특수한 측쇄에 의해 영향받는다. 이러한 관찰과 일치하여, 생물학적 기능과 상용성인 아미노산 치환은 소수성, 친수성, 전하, 크기, 및 다른 특성에 의해 나타난 바와 같이, 아미노산의 상대적인 유사성, 및 특히 이들 아미노산의 측쇄에 의존하는 것으로 이해된다.
v. 벡터
본원에 사용된 "벡터"는 복제 기점을 함유하는 핵산 서열을 의미할 수 있다. 벡터는 플라스미드, 박테리오파아지, 박테리아 인공 염색체 또는 효모 인공 염색체일 수 있다. 벡터는 DNA 또는 RNA 벡터일 수 있다. 벡터는 자가-복제하는 염색체외 벡터 또는 숙주 게놈내로 통합되는 벡터일 수 있다.
2. RSV 단백질
본원에 "RSV 면역원"로 또한 언급된, RSV 단백질이 제공되며, 이는 RSV에 대해 면역 반응을 유발할 수 있는 공통 항원이다. 공통 RSV 면역원 중 3개는 RSV F 면역원, 및 RSV Ga 면역원 및 RSV Gb 면역원으로 본원에 언급된, 2개 형태의 RSV G 면역원이다. 2개의 RSV G 면역원 형태가 RSV G 단백질 중에서 전달성으로 인해 제공된다. 일부 구현예에서, RSV 면역원은 면역글로불린단백질, 예를 들면 IgE 신호 펩타이드(서열 번호: 17) 또는 IgG 신호 펩타이드와 같은 상이한 단백질로부터의 신호 펩타이드를 포함할 수 있다. RSV 면역원은 RSV F 면역원, RSV Ga 면역원 및 RSV Gb 면역원을 포함한다. RSV M2-1, 즉, 면역글로불린단백질, 예를 들면 IgE 신호 펩타이드(서열 번호: 17) 또는 IgG 신호 펩타이드와 같은 상이한 단백질로부터의 신호 펩타이드를 임의로 포함할 수 있는 RSV M2-1 면역원"에 대해 면역 반응을 유발할 수 있는 공통 항원인 "RSV 면역원"가 또한 본원에 제공된다.
"RSV F 면역원"은 서열 번호: 2에 대해 적어도 98% 상동성인 단백질의 면역원성 단편을 포함하는 단백질을 말한다. RSV F 면역원은 서열 번호: 2에 대해 적어도 99% 상동성인 단백질의 면역원성 단편을 포함할 수 있다. RSV F 면역원은 서열 번호; 2의 면역원성 단편을 포함할 수 있다. 각각의 예에서 면역원성 단편은 서열 번호: 17과 같은 신호 펩타이드를 임의로 추가로 포함할 수 있다. 서열 번호: 2 및 신호 펩타이드 서열 번호: 17의 면역원성 단편을 포함하는 RSV F 면역원은 서열 번호: 17을 포함하는 서열 번호: 10의 면역원성 단편일 수 있다. RSV F 면역원은 서열 번호: 2에 대해 적어도 98% 상동성인 단백질을 포함할 수 있으며, 일부 구현예에서 서열 번호: 2에 대해 적어도 99% 상동성인 단백질을 포함할 수 있다. RSV F 면역원은 서열 번호: 2를 포함할 수 있다. 각각의 예에서, RSV F 면역원은 서열 번호; 17과 같은 신호 펩타이드를 임의로 추가로 포함할 수 있다. 서열 번호: 2 및 신호 펩타이드 서열 번호; 17을 포함하는 RSV F 면역원은 서열 번호: 10을 포함할 수 있다.
"RSV Ga 면역원"은 서열 번호: 6에 대해 적어도 98% 상동성인 단백질의 면역원성 단편을 포함하는 단백질을 말한다. RSV Ga 면역원은 서열 번호: 6에 대해 적어도 99% 상동성인 단백질의 면역원성 단편일 수 있다. RSV Ga 면역원은 서열 번호: 6의 면역원성 단편을 포함할 수 있다. 각각의 예에서 면역원성 단편은 서열 번호: 17과 같은 신호 펩타이드를 임의로 추가로 포함할 수 있다. 서열 번호: 6의 면역원성 단편 및 신호 펩타이드 서열 번호: 17을 포함하는 RSV Ga 면역원은 서열 번호: 17을 포함하는 서열 번호: 14의 면역원성 단편일 수 있다. RSV Ga 면역원은 서열 번호: 6에 대해 적어도 98% 상동성인 단백질을 포함할 수 있으며 일부 구현예에서 서열 번호: 6에 대해 적어도 99% 상동성인 단백질을 포함할 수 있다. RSV Ga 면역원은 서열 번호: 6을 포함할 수 있다. 각각의 예에서 RSV Ga 면역원은 서열 번호: 17과 같은 신호 펩타이드를 임의로 추가로 포함할수 있다. 서열 번호: 6 및 신호 펩타이드 서열 번호: 17을 포함하는 RSV Ga 면역원은 서열 번호: 14를 포함할 수 있다.
"RSV Gb 면역원"은 서열 번호: 8에 대해 적어도 98% 상동성인 단백질의 면역원성 단편을 포함하는 단백질을 말한다. RSV Gb 면역원은 서열 번호: 8에 대해 적어도 99% 상동성인 단백질의 면역원성 단편을 포함할 수 있다. RSV Gb 면역원은 서열 번호: 8의 면역원성 단편을 포함할 수 있다. 각각의 예에서 면역원성 단편은 서열 번호: 17과 같은 신호 펩타이드를 임의로 추가로 포함할 수 있다. 서열 번호: 8의 면역원성 단편 및 신호 펩타이드 서열 번호: 17을 포함하는 RSV Gb 면역원은 서열 번호: 17을 포함하는 서열 번호: 16의 면역원성 단편일 수 있다. RSV Gb 면역원은 서열 번호: 8에 대해 적어도 98% 상동성인 단백질을 포함할 수 있으며, 일부구현예에서 서열 번호: 8에 대해 적어도 99% 상동성인 단백질을 포함할 수 있다. RSV Gb 면역원은 서열 번호: 8을 포함할 수 있다. 각각의 예에서 RSV Gb 면역원은 서열 번호: 17과 같은 신호 펩타이드를 임의로 추가로 포함할수 있다. 서열 번호: 8 및 신호 펩타이드 서열 번호: 17을 포함하는 RSV Gb 면역원은 서열 번호: 16을포함할 수 있다.
일부 구현예에서, 본원에 설정된 2개 이상의 RSV 단백질의 조합을 포함하는 융합 단백질이 제공된다. 예를 들면, 융합 단백질은 서열 번호: 2 또는 이의 면역원성 단편 및 서열 번호: 6 또는 이의 면역원성 단편; 서열 번호: 2 또는 이의 면역원성 단편 및 서열 번호: 8 또는 이의 면역원성 단편; 또는 서열 번호: 6 또는 이의 면역원성 단편 및 서열 번호: 8 또는 이의 면역원성 단편을 포함할 수 있다. 융합 단백질은 서열 번호: 2 또는 이의 면역원성 단편, 서열 번호: 6 또는 이의 면역원성 단편 및 서열 번호: 8 또는 이의 면역원성을 포함할 수 있다. 대안적으로, 상기 융합 단백질중 하나 이상은 서열 번호: 2 또는 면역원성 단편에 상응하는 위에서 기술된 융합 단백질의 일부 대신에 서열 번호: 2에 대해 적어도 98% 또는 적어도 99% 상동성인 서열 또는 이의 면역원성 단편을 포함할 수 있다. 유사하게, 상기 하나 이상의 융합 단백질은 서열 번호: 6 또는 면역원성 단편에 상응하는 위에서 기술된 융합 단백질 대신에 서열 번호: 6 또는 이의 면역원성 단편에 대해 적어도 98% 또는 적어도 99% 상동성인 서열을 포함할 수 있고/있거나; 상기 하나 이상의 융합 단백질은 서열 번호: 8 또는 면역원성 단편에 상응하는 위에서 기술된 융합 단백질의 일부 대신에 서열 번호: 8 또는 이의 면역원성 단편에 대해 적어도 98% 또는 적어도 99% 상동성인 서열을 포함할 수 있다. 융합 단백질은 공통 단백질 및/또는 공통 단백질의 단편 및/또는 공통 단백질의 변이체 및/또는 변이체 공통 단백질의 단편을 포함할 수 있다. 공통 단백질 및/또는 공통 단백질의 단편 및/또는 공통 단백질의 변이체 및/또는 변이체 공통 단백질의 단편은 서로 인접하게 직접 연결될 수 있거나 이들 사이에 스페이서 또는 하나 이상의 아미노산과 함께 연결될 수 있다. 일부 구현예에서, 스페이스는 단백질분해 절단 부위일 수 있다. 일부 구현예에서, 스페이스는, 백신이 투여되고/되거나 섭취되도록 의도된 세포내에서 발견된 프로테아제에 의해 인식된 단백질분해 절단 부위일 수 있다.
"RSV M2-1 면역원"은 서열 번호: 4에 대해 적어도 98% 상동성인 단백질의 면역원성 단편을 포함하는 단백질을 말한다. RSV M2-1 면역원은 서열 번호: 4에 대해 적어도 99% 상동성인 단백질의 면역원성 단편을 포함할 수 있다. RSV M2-1 면역원은 서열 번호: 4의 면역원성 단편을 포함할 수 있다. 각각의 예에서 면역원성 단편은 서열 번호: 17과 같은 신호 펩타이드를 임의로 추가로 포함할 수 있다. 서열 번호: 4의 면역원성 단편 및 신호 펩타이드 서열 번호: 17을 포함하는 RSV M2-1 면역원은 서열 번호: 17을 포함하는 서열 번호: 12의 면역원성 단편일 수 있다. RSV M2-1 면역원은 서열 번호; 4에 대해 적어도 98% 상동성인 단백질을 포함할 수 있으며, 일부 구현예에서 서열 번호: 4에 대해 적어도 99% 상동성인 단백질을 포함할 수 있다. RSV M2-1 면역원은 서열 번호: 4를 포함할 수 있다. 각각의 예에서 RSV M2-1 면역원은 서열 번호: 17과 같은 신호 펩타이드를 임의로 추가로 포함할 수 있다. 서열 번호: 4 및 신호 펩타이드 서열 번호: 17을 포함하는 RSV M2-1 면역원은 서열 번호: 12를 포함할 수 있다. 일부 구현예에서, RSV M2-1 및 본원에 설정된 다른 RSV 면역원 단백질의 조합을 포함하는 융합 단백질이 제공된다. 예를 들면, 융합 단백질은 서열 번호: 2 또는 이의 면역원성 단편 및 서열 번호: 4 또는 이의 면역원성 단편; 서열 번호: 4 또는 이의 면역원성 단편 및 서열 번호: 6 또는 이의 면역원성 단편, 서열 번호: 4 또는 이의 면역원성 단편 및 서열 번호: 8 또는 이의 면역원성 단편; 또는 서열 번호: 6 또는 이의 면역원성 단편 및 서열 번호: 8 또는 이의 면역원성 단편을 포함할 수 있다. 융합 단백질을 서열 번호: 4 또는 이의 면역원성 단편을 포함할 수 있다. 대안적으로, 상기 하나 이상의 융합 단백질은 서열 번호: 4 또는 면역원성 단편에 상응하는 상기 기술된 융합 단백질의 부위 대신에 서열 번호: 4에 대해 적어도 98% 또는 적어도 99% 상동성인 서열 또는 이의 면역원성 단편을 포함할 수 있다.
3. RSV 단백질을 인코딩하는 코딩 서열
본원에 설정된 "RSV 면역원"을 인코딩하는 핵산 서열이 본원에 제공된다. 세포가 취하거나 발현하는 핵산 서열을 포함하는 핵산 분자의 투여는 RSV에 대해 광범위한 면역 반응을 생성한다. RSV 면역원에 대한 코딩 서열, 즉, RSV F 면역원을 인코딩하는 핵산 서열, RSV Ga 면역원을 인코딩하는 핵산 서열 및 RSV Gb 면역원을 인코딩하는 핵산 서열 및 또한 RSV M2-1 면역원을 인코딩하는 핵산 서열에 대한 코딩 서열이 제공된다. 일부 구현예에서, RSV 면역원을 인코딩하는 핵산 서열은 면역글로불린단백질, 예를 들면 IgE 신호 펩타이드 (서열 번호: 17) 또는 IgG 신호 펩타이드와 같은 상이한 단백질로부터의 신호 펩타이드를 인코딩하는 핵산 서열을 포함할 수 있다.
RSV F 면역원을 인코딩하는 핵산 서열은 서열 번호: 2에 대해 적어도 98% 상동성인 단백질의 면역원성 단편을 포함하는 단백질을 인코딩할 수 있다. RSV F 면역원을 인코딩하는 핵산 서열은 서열 번호: 2에 대해 적어도 99% 상동성인 단백질의 면역원성 단편을 포함하는 단백질을 인코딩할 수 있다. RSV F 면역원을 인코딩하는 핵산 서열은 서열 번호: 2의 면역원성 단편을 포함하는 단백질을 인코딩할 수 있다. 각각의 예에서, 면역원성 단편을 포함하는 단백질을 인코딩하는 핵산 서열은 서열 번호: 17을 인코딩하는 핵산 서열과 같은 신호 펩타이드를 인코딩하는 핵산 서열을 임의로 추가로 포함할 수 있다. RSV F 면역원을 인코딩하는 핵산 서열은 서열 번호: 2의 면역원성 단편 및 신호 펩타이드 서열 번호: 17을 포함하는 단백질을 인코딩할 수 있다. RSV F 면역원을 인코딩하는 핵산 서열은 서열 번호: 17을 포함하는 서열 번호: 10의 면역원성 단편일 수 있는 단백질을 인코딩할 수 있다. RSV F 면역원을 인코딩하는 핵산 서열은 서열 번호: 2에 대해 적어도 98% 상동성인 단백질을 포함하는 단백질을 인코딩할 수 있으며, 일부 구현예에서 서열 번호; 2에 대해 적어도 99% 상동성인 단백질을 인코딩할 수 있다. RSV F 면역원을 인코딩하는 핵산 서열은 서열 번호; 2를 포함하는 단백질을 인코딩할 수 있다. 각각의 예에서, RSV F 면역원을 인코딩하는 핵산 서열은 서열 번호: 17과 같은 신호 펩타이드를 인코딩하는 핵산 서열을 임의로 추가로 포함할 수 있다. RSV F 면역원을 인코딩하는 핵산 서열은 서열 번호: 2 및 신호 펩타이드 서열 번호: 17을 포함하는 단백질을 인코딩할 수 있다. RSV F 면역원을 인코딩하는 핵산 서열은 서열 번호: 10을 포함하는 단백질을 인코딩할 수 있다.
RSV F 면역원을 인코딩하는 핵산 서열은 서열 번호; 1에 대해 적어도 98% 상동성인 핵산 서열의 단편을 포함할 수 있다. 서열 번호: 1에 대해 적어도 98% 상동성인인 핵산 서열은 서열 번호: 2에 대해 적어도 98% 상동성인 단백질을 인코딩한다. 단편은 서열 번호; 2에 대해 적어도 98% 상동성인 단백질의 면역원성 단편을 인코딩한다. 일부 구현예에서, RSV F 면역원을 인코딩하는 핵산 서열은 서열 번호; 1에 대해 적어도 98% 상동성인 핵산 서열의 단편을 포함할 수 있으며, 여기서 핵산 서열은 서열 번호: 2에 대해 적어도 99% 상동성인 단백질을 인코딩하고, 일부 구현예에서 핵산 서열은 서열 번호: 2를 포함하는 단백질을 인코딩하며, 핵산 서열의 단편은 면역원성 단편 서열 번호: 2와 같은 서열 번호: 2에 대해 적어도 99% 상동성인 단백질의 면역원성 단편을 인코딩한다. 일부 이러한 구현예에서, RSVF 면역원을 인코딩하는 핵산 서열은 서열 번호: 1에 대해 적어도 99% 상동성인 핵산 서열의 단편 및 일부 구현예에서, 서열 번호: 1의 단편을 포함할 수 있다. 일부 구현예에서, RSV F 면역원을 인코딩하는 핵산 서열은 서열 번호: 17과 같은 신호 펩타이드를 인코딩하는 핵산 서열을 임의로 추가로 포함할 수 있다. RSV F 면역원을 인코딩하는 핵산 서열은 서열 번호: 2의 단편 및 신호 펩타이드 서열 번호: 17을 인코딩하는 코딩 서열을 포함할 수 있다. RSV F 면역원을 인코딩하는 핵산 서열은 신호 펩타이드 서열 번호: 17을 인코딩하는 코딩 서열을 포함하는 서열 번호: 9의 단편을 포함할 수 있다.
RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호: 6에 대해 적어도 98% 상동성인 단백질의 면역원성 단편을 포함하는 단백질을 인코딩할 수 있다. RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호: 6에 대해 적어도 99% 상동성인 단백질의 면역원성 단편을 포함하는 단백질을 인코딩할 수 있다. RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호: 6의 면역원성 단편을 포함하는 단백질을 인코딩할 수 있다. 각각의 예에서, 면역원성 단편을 포함하는 단백질을 인코딩하는 핵산 서열은 서열 번호: 17을 인코딩하는 핵산 서열과 같은 신호 펩타이드를 인코딩하는 핵산 서열을 임의로 추가로 포함할 수 있다. RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 6의 면역원성 단편 및 신호 펩타이드 서열 번호: 17을 포함하는 단백질을 인코딩할 수 있다. RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 17을 포함하는 서열 번호: 14의 면역원성 단편일 수 있는 단백질을 인코딩할 수 있다. RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호: 6에 대해 적어도 98% 상동성인 단백질을 포함하는 단백질을 암호화할 수 있으며 일부 구현예에서 서열 번호: 6에 대해 적어도 99% 상동성인 단백질을 인코딩할 수 있다. RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호; 6을 포함하는 단백질을 인코딩할 수 있다. 각각의 예에서, RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호: 17과 같은 신호 펩타이드를 인코딩하는 핵산 서열을 임의로 추가로 포함할 수 있다. RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호: 6 및 신호 펩타이드 서열 번호: 17을 포함하는 단백질을 인코딩할 수 있다. RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호: 14를 포함하는 단백질을 인코딩할 수 있다.
RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호: 5에 대해 적어도 98% 상동성인 핵산 서열의 단편을 포함할 수 있다. 서열 번호; 5에 대해 적어도 98% 상동성인 핵산 서열은 서열 번호: 6에 대해 적어도 98% 상동성인 단백질을 인코딩한다. 단편은 서열 번호; 6에 대해 적어도 98% 상동성인 단백질의 면역원성 단편을 인코딩한다. 일부 구현예에서, RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호: 5에 대해 적어도 98% 상동성인 핵산 서열의 단편을 포함할 수 있으며 여기서 핵산 서열은 서열 번호: 6에 대해 적어도 99% 상동성인 단백질을 인코딩하고, 일부 구현예에서 핵산 서열은 서열 번호: 6을 포함하는 단백질, 및 면역원성 단편 서열 번호: 6과 같이 서열 번호: 6에 대해 적어도 99% 상동성인 단백질의 면역원성 단편을 인코딩한다. 일부 이러한 구현예에서, RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호: 5에 대해 적어도 99% 상동성인 핵산 서열의 단편 및 일부 구현예에서 서열 번호: 5의 단편을 포함할 수 있다. 일부 구현예에서, RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호; 17과 같은 신호 펩타이드를 인코딩하는 핵산 서열을 임의로 추가로 포함할 수 있다. RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호: 6의 단편 및 신호 펩타이드 서열 번호: 17을 인코딩하는 코딩 서열을 포함할 수 있다. RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호: 17의 신호 펩타이드를 인코딩하는 코딩 서열을 포함하는 서열 번호: 13의 단편을 포함할 수 있다.
RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 8에 대해 적어도 98% 상동성인 단백질의 면역원성 단편을 포함하는 단백질을 인코딩할 수 있다. RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 8에 대해 적어도 99% 상동성인 단백질의 면역원성 단편을 포함하는 단백질을 인코딩할 수 있다. RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 8의 면역원성 단편을 포함하는 단백질을 인코딩할 수 있다. 각각의 예에서, 면역원성 단편을 포함하는 단백질을 인코딩하는 핵산 서열은 서열 번호: 17을 인코딩하는 핵산 서열과 같은 신호 펩타이드를 인코딩하는 핵산 서열을 임의로 추가로 포함할 수 있다. RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호: 8의 면역원성 단편 및 서열 번호: 17의 신호 펩타이드를 포함하는 단백질을 인코딩할 수 있다. RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호: 17을 포함하는 서열 번호: 16의 면역원성 단편일 수 있는 단백질을 인코딩할 수 있다. RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 8에 대해 적어도 98% 상동성인 단백질을포함하는 단백질을 인코딩할 수 있고, 일부 구현예에서 서열 번호: 8에 대해 적어도 99% 상동성인 단백질을 인코딩할 수 있다. RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 8을 포함하는 단백질을 인코딩할 수 있다. 각각의 예에서, RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 17과 같은 신호 펩타이드를 인코딩하는 핵산 서열을 임의로 추가로 포함할 수 있다. RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 8 및 신호 펩타이드 서열 번호: 17를 포함하는 단백질을 인코딩할 수 있다. RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 16을 포함하는 단백질을 인코딩할 수 있다.
RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 7에 대해 적어도 98% 상동성인 핵산 서열의 단편을 포함할 수 있다. 서열 번호: 7에 대해 적어도 98% 상동성인 핵산 서열은 서열 번호: 8에 대해 적어도 98% 상동성인 단백질을 인코딩한다. 단편은 서열 번호: 8에 대해 적어도 98% 상동성인 단백질의 면역원성 단편을 인코딩한다. 일부 구현예에서, RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 7에 대해 적어도 98% 상동성인 핵산 서열의 단편을 포함할 수 있으며, 여기서 핵산 서열은 서열 번호: 8에 대해 적어도 99% 상동성인 단백질을 인코딩하고, 일부 구현예에서 핵산 서열은 서열 번호: 8을 포함하는 단백질을 인코딩하고, 핵산 서열의 단편은 면역원성 단편서열 번호: 8과 같은 서열 번호: 8에 대해 적어도 99% 상동성인 단백질의 면역원성 단편을 인코딩한다. 일부 이러한 구현예에서, RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 7 및 일부 구현예에서, 서열 번호: 7의 단편에 대해 적어도 99% 상동성인 핵산 서열의 단편을 포함할 수 있다. 일부 구현예에서, RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 17과 같은 신호 펩타이드를 인코딩하는 핵산 서열을 임의로 추가로 포함한다. RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 8의 단편 및 신호 펩타이드 서열 번호: 17을 인코딩하는 코딩 서열을 포함할 수 있다. RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 17의 신호 펩타이드를 인코딩하는 코딩서열을 포함하는 서열 번호: 15의 단편을 포함할 수 있다.
RSV M2-1 면역원을 인코딩하는 핵산 서열은 서열 번호: 4에 대해 적어도 98% 상동성인 단백질의 면역원성 단편을 포함하는 단백질을 인코딩할 수 있다. RSV M2-1 면역원을 인코딩하는 핵산 서열은 서열 번호: 4에 대해 적어도 99% 상동성인 단백질의 면역원성 단편을 포함하는 단백질을 인코딩할 수 있다. RSV M2-1 면역원을 인코딩하는 핵산 서열은 서열 번호: 4의 면역원성 단편을 포함하는 단백질을 인코딩할 수 있다. 각각의 예에서, 면역원성 단편을 포함하는 단백질을 인코딩하는 핵산 서열은 서열 번호: 17을 인코딩하는 핵산 서열과 같은 신호 펩타이드를 인코딩하는 핵산 서열을 임의로 추가로 포함할 수 있다. RSV M2-1 면역원을 인코딩하는 핵산 서열은 서열 번호: 4의 면역원성 단편 및 신호 펩타이드서열 번호: 17을 포함하는 단백질을 인코딩할 수 있다. RSV F 면역원을 인코딩하는 핵산 서열은 서열 번호: 17을 포함하는 서열 번호: 12의 면역원성 단편일 수 있는 단백질을 인코딩할 수 있다. RSV M2-1 면역원을 인코딩하는 핵산 서열은 서열 번호: 4에 대해 적어도 98% 상동성인 단백질을 포함하는 단백질을 인코딩할 수 있고, 일부 구현예에서 서열 번호: 4에 대해 적어도 99% 상동성인 단백질을 인코딩할 수 있다. RSV M2-1 면역원을 인코딩하는 핵산 서열은 서열 번호: 4를 포함하는 단백질을 인코딩할 수 있다. 각각의 예에서 RSV M2-1 면역원을 인코딩하는 핵산 서열은 서열 번호: 17과 같은 신호 펩타이드를 인코딩하는 핵산 서열을 임의로 추가로 포함할 수 있다. RSV M2-1 면역원을 인코딩하는 핵산 서열은 서열 번호: 4 및 신호 펩타이드 서열 번호: 17을 포함하는 단백질을 인코딩할 수 있다. RSV M2-1 면역원을 인코딩하는 핵산 서열은 서열 번호: 12를 포함하는 단백질을 인코딩할 수 있다.
RSV M2-1 면역원을 인코딩하는 핵산 서열은 서열 번호: 3에 대해 적어도 98% 상동성인 핵산 서열의 단편을 포함할 수 있다. 서열 번호: 3에 대해 적어도 98% 상동성인 핵산 서열은 서열 번호: 4에 대해 적어도 98% 상동성인 단백질을 인코딩한다. 단편은 서열 번호: 4에 대해 적어도 98% 상동성인 단백질의 면역원성 단편을 인코딩한다. 일부 구현예에서, RSV M2-1 면역원을 인코딩하는 핵산 서열은 서열 번호: 3에 대해 적어도 98% 상동성인 핵산 서열의 단편을 포함할 수 있으며, 여기서 핵산 서열은 서열 번호: 4에 대해 적어도 99% 상동성인 단백질을 인코딩하고, 일부 구현예에서 핵산 서열은 서열 번호: 4를 포함하는 단백질을 인코딩하고, 핵산 서열의 단편은 면역원성 단편 서열 번호: 4와 같은 서열 번호: 4에 대해 적어도 99% 상동성인 단백질의 면역원성 단편을 인코딩한다. 일부 이러한 구현예에서, RSV M2-1 면역원을 인코딩하는 핵산 서열은 서열 번호: 3 및 일부 구현예에서, 서열 번호: 3의 단편에 대해 적어도 99% 상동성인 핵산 서열의 단편을 포함할 수 있다. 일부 이러한 구현예에서, RSV M2-1 면역원을 인코딩하는 핵산 서열은 서열 번호: 17과 같은 신호 펩타이드를 인코딩하는 핵산 서열을 임의로 추가로 포함할 수 있다. RSV M2-1 면역원을 인코딩하는 핵산 서열은 서열 번호: 4의 단편 및 신호 펩타이드 서열 번호: 17을 인코딩하는 코딩 서열을 포함할 수 있다. RSV M2-1 면역원을 인코딩하는 핵산 서열은 신호 펩타이드 서열 번호: 17을 인코딩하는 코딩 서열을 포함하는 서열 번호: 11의 단편을 포함할 수 있다.
코딩 서열은 본원에 설정된 2개 이상의 RSV 단백질의 조합을 포함하는 융합 단백질을 인코딩할 수 있다. 코딩 서열은 공통 단백질 및/또는 공통 단백질의 단편 및/또는 공통 단백질의 변이체 및/또는 변이체 공통 단백질의 단편을 포함하는 융합 단백질을 인코딩할 수 있다. 공통 단백질 및/또는 공통 단백질의 단편 및/또는 공통 단백질의 변이체 및/또는 변이체 공통 단백질의 단편은 서로 인접하게 직접 연결될 수 있거나 이들 사이에 스페이서 또는 하나 이상의 아미노산과 함께 연결될 수 있다. 일부 구현예에서, 스페이스는 단백질분해 절단 부위일 수 있다. 일부 구현예에서, 스페이스는, 백신이 투여되고/되거나 섭취되도록 의도된 세포내에서 발견된 프로테아제에 의해 인식된 단백질분해 절단 부위일 수 있다.
일부 구현예에서, 코딩 서열은 본원에 설정된 2개 이상의 RSV 단백질의 조합을 포함하는 융합 단백질을 인코딩한다. 예를 들면, 코딩 서열은 서열 번호: 2 또는 이의 면역원성 단편 및 서열 번호: 4 또는 이의 면역원성 단편, 예를 들면, 서열 번호: 1 또는 이의 면역원성 단편을 인코딩하는 이의 단편 및 서열 번호: 3 또는 이의 면역원성 단편을 인코딩하는 이의 단편; 서열 번호: 2 또는 이의 면역원성 단편 및 서열 번호: 6 또는 이의 면역원성 단편, 예를 들면, 서열 번호: 1 또는 이의 면역원성 단편을 인코딩하는 이의 단편 및 서열 번호: 5 또는 이의 면역원성 단편을 인코딩하는 이의 단편; 서열 번호: 2 또는 이의 면역원성 단편 및 서열 번호: 8 또는 이의 면역원성 단편, 예를 들면, 서열 번호: 1 또는 이의 면역원성 단편을 인코딩하는 이의 단편 및 서열 번호: 7 또는 이의 면역원성 단편을 인코딩하는 이의 단편; 서열 번호: 4 또는 이의 면역원성 단편 및 서열 번호: 6 또는 이의 면역원성 단편, 예를 들면, 서열 번호: 3 또는 이의 면역원성 단편을 인코딩하는 이의 단편 및 서열 번호: 5 또는 이의 면역원성 단편을 인코딩하는 이의 단편; 서열 번호: 4 또는 이의 면역원성 단편 및 서열 번호: 8 또는 이의 면역원성 단편, 예를 들면, 서열 번호: 3 또는 이의 면역원성 단편을 인코딩하는 이의 단편 및 서열 번호: 5 또는 이의 면역원성 단편을 인코딩하는 이의 단편; 서열 번호: 6 또는 이의 면역원성 단편 및 서열 번호: 6 또는 이의 면역원성 단편 및 서열 번호: 8 또는 이의 면역원성 단편, 예를 들면, 서열 번호: 5 또는 이의 면역원성 단편을 인코딩하는 이의 단편 및 서열 번호: 7 또는 이의 면역원성 단편을 인코딩하는 이의 단편을 포함하는 융합 단백질을 인코딩할 수 있다. 코딩 서열은 본원에 설정된 3개의 RSV 단백질의 조합을 포함하는 융합 단백질을 인코딩할 수 있다. 예를 들면, 코딩 서열은 서열 번호: 2 또는 이의 면역원성 단편, 서열 번호: 4 또는 이의 면역원성 단편 및 서열 번호: 6 또는 이의 면역원성 단편, 예를 들면, 서열 번호: 1 또는 이의 면역원성 단편을 인코딩하는 이의 단편, 서열 번호: 3 또는 이의 면역원성 단편을 인코딩하는 이의 단편 및 서열 번호: 5 또는 이의 면역원성 단편을 인코딩하는 이의 단편; 서열 번호: 2 또는 이의 면역원성 단편, 서열 번호: 4 또는 이의 면역원성 단편 및 서열 번호: 8 또는 이의 면역원성 단편, 예를 들면, 서열 번호: 1 또는 이의 면역원성 단편을 인코딩하는 이의 단편, 서열 번호: 3 또는 이의 면역원성 단편을 인코딩하는 이의 단편 및 서열 번호; 7 또는 이의 면역원성 단편을 인코딩하는 이의 단편; 및 서열 번호: 4 또는 이의 면역원성 단편, 서열 번호: 6 또는 이의 면역원성 단편 및 서열 번호: 8 또는 이의 면역원성 단편, 예를 들면, 서열 번호: 3 또는 이의 면역원성 단편을 인코딩하는 이의 단편, 서열 번호: 5 또는 이의 면역원성 단편을 인코딩하는 이의 단편 및 서열 번호: 7 또는 이의 면역원성 단편을 인코딩하는 이의 단편을 포함하는 융합 단백질을 인코딩할 수 있다. 코딩 서열은 서열 번호: 2 또는 이의 면역원성 단편, 서열 번호: 4 또는 이의 면역원성 단편, 서열 번호: 6 또는 이의 면역원성 단편, 및 서열 번호: 8 또는 이의 면역원성 단편, 예를 들면, 예를 들면, 서열 번호: 1 또는 이의 면역원성 단편을 인코딩하는 이의 단편, 서열 번호: 3 또는 이의 면역원성 단편을 인코딩하는 이의 단편, 서열 번호: 5 또는 이의 면역원성 단편을 인코딩하는 이의 단편 및 서열 번호: 7 또는 이의 면역원성 단편을 인코딩하는 이의 단편을 인코딩하는 코딩 서열과 같은 본원에 설정된 4개의 RSV 단백질의 조합을 포함하는 융합 단백질을 인코딩할 수 있다. 달리는, 하나 이상의 상기 융합 단백질을 인코딩하는 코딩 서열은 서열 번호: 2 또는 면역원성 단편에 상응하는 상기 기술된 융합 단백질의 부위 대신에 서열 번호; 2 또는 이의 면역원성 단편에 대해 적어도 98% 또는 적어도 99% 상동성인 단백질을 인코딩하는 서열을 포함할 수 있다. 유사하게, 상기 하나 이상의 융합 단백질에 대한 코딩 서열은 서열 번호: 4 또는 면역원성 단편 일부 구현예에서, 상기 하나 이상의 융합 단백질을 인코딩하는 코딩 서열은 서열 번호: 2 또는 면역원성 단편을 인코딩하는 부위에 상응하는 상기 기술된 융합 단백질의 코딩 서열의 부위 대신에 서열 번호: 2의 면역원성 단편에 대해 적어도 98% 또는 적어도 99% 상동성인 서열 번호: 1 또는 이의 단편에 대해 적어도 98% 또는 적어도 99% 상동성인 서열을 포함할 수 있다. 하나 이상의 상기 융합 단백질을 인코딩하는 코딩 서열은 서열 번호: 4 또는 면역원성 단편을 인코딩하는 부위에 상응하는 상기 기술된 융합 단백질의 코딩 서열의 부위 대신에 서열 번호: 4의 면역원성 단편에 대해 적어도 98% 또는 적어도 99% 상동성인 서열 번호: 3 또는 이의 단편에 대해 적어도 98% 또는 적어도 99% 상동성인 서열을 포함할 수 있다. 하나 이상의 상기 융합 단백질을 인코딩하는 코딩 서열은 서열 번호: 6 또는 면역원성 단편을 인코딩하는 부위에 상응하는 상기 기술된 융합 단백질의 코딩 서열의 부위 대신에 서열 번호: 6의 면역원성 단편에 대해 적어도 98% 또는 적어도 99% 상동성인 서열 번호: 5 또는 이의 단편에 대해 적어도 98% 또는 적어도 99% 상동성인 서열을 포함할 수 있다. 상기 하나 이상의 융합 단백질을 인코딩하는 코딩 서열은 서열 번호: 8 또는 면역원성 단편을 인코딩하는 부위에 상응하는 상기 기술된 융합 단백질의 코딩 서열의 부위 대신에 서열 번호: 8의 면역원성 단편에 대해 적어도 98% 또는 적어도 99% 상동성인 서열 번호: 7 또는 이의 단편에 대해 적어도 98% 또는 적어도 99% 상동성인 서열을 포함할 수 있다. 융합 단백질은 공통 단백질 및/또는 공통 단백질의 단편 및/또는 공통 단백질의 변이체 및/또는 변이체 공통 단백질의 단편을 포함할 수 있다. 공통 단백질 및/또는 공통 단백질의 단편 및/또는 공통 단백질의 변이체 및/또는 변이체 공통 단백질의 단편은 서로 인접하게 직접 연결될 수 있거나 이들 사이에 스페이서 또는 하나 이상의 아미노산과 함께 연결될 수 있다. 일부 구현예에서, 스페이스는 단백질분해 절단 부위일 수 있다. 일부 구현예에서, 스페이스는, 백신이 투여되고/되거나 섭취되도록 의도된 세포내에서 발견된 프로테아제에 의해 인식된 단백질분해 절단 부위일 수 있다.
4. 플라스미드
포유동물에서 면역 반응을 유발하기에 효과적인 양으로 포유동물의 세포내에서 하나 이상의 RSV 단백질을 발현할 수 있는 벡터가 본원에 제공된다. 벡터는 하나 이상의 RSV 항원을 인코딩하는 이종 핵산을 포함할 수 있다. 벡터는 플라스미드일 수 있다. 플라스미드는 세포를 RSV 항원을 인코딩하는 핵산으로 형질감염시키는데 유용할 수 있으며, 형질전환된 숙주 세포는 RSV 항원의 발현이 일어나는 조건하에서 배양되고 유지된다.
플라스미드는 다음의 3개의 단백질: F, Ga 및 Gb, 이러한 단백질의 단편, 이러한 단백질의 변이체, 변이체의 단편 또는 공통 단백질 및/또는 공통 단백질의 단편 및/또는 공통 단백질의 변이체 및/또는 변이체 공통 단백질의 단편의 조합으로 제조된 융합 단백질 각각에 대해 제공된 RSV에 대해 면역 반응을 유발할 수 있는 합성의, 콘센수스 항원을 인코딩하는 코딩 서열을 포함하는 상기 기재된 다양한 RSV 단백질 중의 하나 이상을 인코딩하는 핵산 서열을 포함할 수 있다. 플라스미드는 RSV M2-1, 이러한 단백질의 단편, 이러한 단백질의 변이체, 변이체의 단편 또는 공통 단백질 및/또는 공통 단백질의 단편 및/또는 공통 단백질의 변이체 및/또는 변이체 공통 단백질의 단편의 조합으로 제조된 융합 단백질에 대해 면역 반응을 유발할 수 있는 합성의, 콘센수스 항원을 인코딩하는 코딩 서열을 포함하는 상기 기재된 RSV M2-1 단백질을 인코딩하는 핵산 서열을 포함할 수 있다.
단일의 플라스미드는 단일의 RSV 면역원에 대한 코딩 서열, 2개의 RSV 면역원에 대한 코딩 서열, 또는 3개의 RSV 면역원에 대한 코딩 서열을 함유할 수 있다. 일부 구현예에서, 제4의 RSV 면역원에 대한 코딩 서열이 제공될 수 있다. 단일의 플라스미드는 RSV F 면역원에 대한 코딩 서열을 함유할 수 있다. 단일의 플라스미드는 RSV Ga 면역원에 대한 코딩 서열을 함유할 수 있다. 단일의 플라스미드는 RSV Gb 면역원에 대한 코딩 서열을 함유할 수 있다. 단일의 플라스미드는 RSV F 면역원에 대한 코딩 서열 및 RSV Ga 면역원에 대한 코딩 서열을 함유할 수 있다. 단일의 플라스미드는 RSV F 면역원에 대한 코딩 서열 및 RSV Gb 면역원에 대한 코딩 서열을 함유할 수 있다. 단일의 플라스미드는 RSV Ga 면역원에 대한 코딩 서열 및 RSV Gb 면역원에 대한 코딩 서열을 함유할 수 있다. 단일의 플라스미드는 RSV F 면역원에 대한 코딩 서열, RSV Ga 면역원에 대한 코딩 서열 및 RSV Gb 면역원에 대한 코딩 서열을 함유할 수 있다.
RSV M2-1 코딩 서열이 제공되는 경우, 단일의 플라스미드는 RSV M2-1 면역원에 대한 코딩 서열을 함유할 수 있다. 단일의 플라스미드는 RSV F 면역원에 대한 코딩 서열 및 RSV M2-1 면역원에 대한 코딩 서열을 함유할 수 있다. 단일의 플라스미드는 RSV M2-1 면역원에 대한 코딩 서열 및 RSV Ga 면역원에 대한 코딩 서열을 함유할 수 있다. 단일의 플라스미드는 RSV M2-1 면역원에 대한 코딩 서열 및 RSV Gb 면역원에 대한 코딩 서열을 함유할 수 있다. 단일의 플라스미드는 RSV F 면역원에 대한 코딩 서열, RSV M2-1 면역원에 대한 코딩 서열 및 RSV Ga 면역원에 대한 코딩 서열을 함유할 수 있다. 단일의 플라스미드는 RSV F 면역원에 대한 코딩 서열, RSV M2-1 면역원에 대한 코딩 서열 및 RSV Gb 면역원에 대한 코딩 서열을 함유할 수 있다. 단일의 플라스미드는 RSV M2-1 면역원에 대한 코딩 서열, RSV Ga 면역원에 대한 코딩 서열 및 RSV Gb 면역원에 대한 코딩 서열을 함유할 수 있다. 단일의 플라스미드는 RSV F 면역원에 대한 코딩 서열, RSV M2-1 면역원에 대한 코딩 서열, RSV Ga 면역원에 대한 코딩 서열 및 RSV Gb 면역원에 대한 코딩 서열을 함유할 수 있다.
일부 구현예에서, 플라스미드는 CCR20 만을 인코딩하거나 당해 플라스미드의 일부로서 인코딩하는 코딩 서열을 포함할 수 있다. 유사하게, 플라스미드는 IL-12, IL-15 및/또는 IL-28에 대한 코딩 서열을 추가로 포함할 수 있다.
플라스미드는 코딩 서열의 상류에 존재할 수 있는 개시 코돈, 및 코딩 서열의 하류에 존재할 수 있는 종료 코돈을 추가로 포함할 수 있다. 상기 개시 및 종료 코돈은 코딩 서열와 틀이 맞을 수 있다.
상기 플라스미드는 또한 코딩 서열에 작동가능하게 연결된 프로모터를 포함할 수 있다. 코딩 서열에 작동가능하게 연결된 프로모터는 유인원 바이러스 40 (SV40), 마우스 유선 종양 바이러스 (MMTV) 프로모터, 인간 면역결핍 바이러스 (HIV) 프로모터 예컨대 소 면역결핍 바이러스 (BIV) 긴 말단 반복 (LTR) 프로모터, 몰로니 바이러스 프로모터, 조류 백혈증 바이러스 (ALV) 프로모터, 사이토메갈로바이러스 (CMV) 프로모터, 예컨대 CMV 전초기 프로모터, 엡슈타인 바르 바이러스 (EBV) 프로모터, 또는 루(Rous) 육종 바이러스 (RSV) 프로모터 유래의 프로모터일 수 있다. 상기 프로모터는 또한 인간 유전자, 예컨대 인간 액틴, 인간 미오신, 인간 헤모글로빈, 인간 근육 크레아틴, 또는 인간 메탈로티오네인 유래의 프로모터일 수 있다. 프로모터는 천연 또한 합성의 근육 또는 피부 특이적인 프로모터와 같은, 조직 특이적인 프로모터일 수 있다. 이러한 프로모터의 예는, 이의 전문이 본원에 통합된 미국 특허원 공보 제US20040175727호에 기술되어 있다.
플라스미드는 코딩 서열의 하류에 존재할 수 있는 폴리아데닐화 신호를 또한 포함할 수 있다. 상기 폴리아데닐화 신호는 SV40 폴리아데닐화 신호, LTR 폴리아데닐화 신호, 소 성장 호르몬 (bGH) 폴리아데닐화 신호, 인간 성장 호르몬 (hGH) 폴리아데닐화 신호, 또는 인간 β-글로빈 폴리아데닐화 신호일 수 있다. SV40 폴리아데닐화 신호는 pCEP4 플라스미드 (Invitrogen, San Diego, CA) 유래의 폴리아데닐화 신호일 수 있다.
상기 플라스미드는 또한 코딩 서열의 상류에 인핸서를 포함할 수 있다. 상기 인핸서는 인간 액틴, 인간 미오신, 인간 헤모글로빈, 인간 근육 크레아틴 또는 바이러스 인핸서, 예컨대 CMV, FMDV, RSV 또는 EBV일 수 있다. 폴리뉴클레오타이드 기능 향상제는 미국 특허 제5,593,972호, 제5,962,428호, 및 제WO94/016737호에 기술되어 있으며, 각각의 내용은 참조로 완전히 통합되어 있다.
플라스미드는 또한 포유동물 복제 기원을 포함함으로써 플라스미드를 염색체외적으로 유지하고 세포 내에서 플라스미드의 다수 카피를 생산할 수 있다. 상기 플라스미드는 Invitrogen (San Diego, CA)사의 pVAX1, pCEP4 또는 pREP4일 수 있으며, 이는 엡슈타인 바르 바이러스 복제 기점 및 핵 항원 EBNA-1 코딩 영역을 포함할 수 있고, 이는 통합 없이 높은 카피 에피솜 복제를 생산할 수 있다. 상기 플라스미드의 뼈대는 pAV0242일 수 있다. 상기 플라스미드는 복제 결함 아데노바이러스 유형 5 (Ad5) 플라스미드일 수 있다.
상기 플라스미드는 또한 조절 서열을 포함할 수 있으며, 이는 플라스미드가 투여되는 세포 내에서의 유전자 발현에 적합할 수 있다. 상기 코딩 서열은 숙주 세포에서 코딩 서열의 보다 효율적인 전사를 가능하게 할 수 있는 코돈을 포함할 수 있다.
상기 코딩 서열은 또한 Ig 선도 서열을 포함할 수 있다. 상기 선도 서열은 코딩 서열의 5'일 수 있다. 이 서열에 의해 인코딩된 공통 항원은 N-말단 Ig 리더 다음으로 공통 항원 단백질을 포함할 수 있다. 상기 N-말단 Ig 리더는 IgE 또는 IgG일 수 있다.
플라스미드는 에스케리키아 콜라이 (이. 콜라이) 속에서 단백질 생산을 위해 사용될 수 있는 pSE420 (Invitrogen, San Diego, Calif.)일 수 있다. 상기 플라스미드는 또한 효모의 사카로마이세스 세레비시애 균주에서의 단백질 생산에 사용될 수 있는, pYES2 (Invitrogen, San Diego, Calif.)일 수 있다. 상기 플라스미드는 또한 곤충 세포내에서 단백질 생산을 위해 사용될 수 있는, MAXBACTM 완전 바큘로바이러스 발현 시스템(Invitrogen, San Diego, Calif.)일 수 있다. 상기 플라스미드는 또한 차이니즈 햄스터 난소(CHO) 세포와 같은 포유동물 세포내에서 단백질 생산을 위해 사용될 수 있는 pcDNA I 또는 pcDNA3 (Invitrogen, San Diego, Calif.)일 수 있다.
5. 조성물
핵산 분자를 포함하는 조성물이 제공된다. 조성물은 이러한 단일의 플라스미드와 같은 단일의 핵산 분자, 2개 이상의 상이한 플라스미드와같은 2개 이상의 상이한 핵산 분자의 다수의 카피를 포함할 수 있다. 예를 들면, 조성물은 2, 3, 4, 5, 6, 7, 8, 9 또는 10개 이상의 상이한 핵산 분자 다수를 포함할 수있다. 이러한 조성물은 2, 3, 4, 5, 6, 7, 8, 9 또는 10개 이상의 상이한 플라스미드 다수를 포함할 수 있다.
조성물은 단일의 RSV 면역원에 대한 코딩 서열, 2개의 RSV 면역원에 대한 코딩 서열, 또는 3개의 RSV 면역원에 대한 코딩 서열과 같은 핵산 분자를 포함할 수 있다. 일부 예에서, 제4의 RSV 면역원에 대한 코딩 서열이 제공될 수 있다.
2개의 RSV 면역원의 코딩 서열을 포함하는 조성물은 단일의 플라스미드와 같은 단일의 핵산 분자 상에 존재할 수 있거나 조성물은 2개의 상이한 플라스미드와 같은 2개의 상이한 핵산 분자를 포함할 수 있으며, 여기서 하나의 핵산 분자는 코딩 서열 하나의 RSV 면역원을 포함하며 다른 핵산 분자는 코딩 서열 상이한 RSV 면역원을 포함한다. 유사하게, 코딩 서열 3개의 RSV 면역원을 포함하는 조성물은 단일의 플라스미드, 2개의 상이한 핵산 분자 또는 3개의 상이한 핵산 분자와 같은 단일의 핵산 분자를 포함할 수 있다. 유사하게, 코딩 서열 4개의 RSV 면역원을 포함하는 조성물은 단일의 플라스미드와 같은 단일의 핵산 분자, 2개의 상이한 핵산 분자, 3개의 상이한 핵산 분자 또는 4개의 상이한 핵산 분자를 포함할 수 있다.
일부 구현예에서, 조성물은 하나의 RSV 면역원, 예를 들면, RSV F 면역원, RSV Ga 면역원 또는 RSV Gb 면역원을 인코딩하는 다수의 단일 핵산 분자를 포함한다. 일부 구현예에서, 조성물은 다수의 단일의 핵산 분자, 예를 들면, 2개의 RSV 면역원, 예를 들면, RSV F 면역원 및 RSV Ga 면역원, RSV F 면역원 및 RSV Gb 면역원, 및 RSV Ga 면역원 및 RSV Gb 면역원을 포함한다. 일부 구현예에서, 조성물은 다수의 단일의 핵산 분자, 예를 들면, 3개의 RSV 면역원, 예를 들면, RSV Ga 면역원, RSV F 면역원 및 RSV Gb 면역원을 포함한다.
일부 구현예에서, 조성물은 다수의 2개의 상이한 핵산 분자, 예를 들면, 2개의 플라스미드를 포함하며, 각각의 상이한 핵산 분자는 상이한 RSV 면역원에 대한 단일의 상이한 코딩 서열을 포함하고, 여기서 상이한 핵산 분자의 쌍은 RSV F 면역원과 RSV Ga 면역원, RSV F 면역원과 RSV Gb 면역원, 및 RSV Ga 면역원과 RSV Gb 면역원을 포함한다.
일부 구현예에서, 조성물은 다수의 2개의 상이한 핵산 분자, 예를 들면, 2개의 플라스미드를 포함하며, 이는 3개의 상이한 RSV 면역원에 대한 코딩 서열을 총괄적으로 포함한다. 일부 구현예에서, 하나는 RSV F 면역원 및 RSV Ga 면역원을 인코딩하고, 두 번째는 RSV Gb 면역원을 인코딩한다. 일부 구현예에서, 하나는 RSV F 면역원 및 RSV Gb 면역원을 인코딩하고, 두 번째는 RSV Ga 면역원을 인코딩한다. 일부 구현예에서, 하나는 Ga 면역원 및 RSV Gb 면역원을 인코딩하고, 두 번째는 RSV F 면역원을 인코딩한다.
일부 구현예에서, 조성물은 RSV M2-1 면역원을 인코딩하는 다수의 단일의 핵산 분자를 포함한다.
RSV M2-1에 대한 코딩 서열이 제공되는 일부 구현예에서, 조성물은 다수의 단일의 핵산 분자, 예를 들면, 2개의 RSV 면역원, 예를 들면, RSV F 면역원과 RSV M2-1 면역원, RSV M2-1 면역원과 RSV Ga 면역원, 및 RSV M2-1 면역원과 RSV Gb 면역원을 인코딩하는 단일의 플라스미드를 포함한다.
RSV M2-1에 대한 코딩 서열이 제공되는 일부 구현예에서, 다수의 단일의 핵산 분자, 예를 들면, 단일의 플라스미드는 3개의 RSV 면역원, 예를 들면, RSV F 면역원, RSV M2-1 면역원 및 RSV Ga 면역원, RSV F 면역원, RSV M2-1 면역원 및 RSV Gb 면역원, RSV M2-1 면역원, RSV Ga 면역원 및 RSV Gb 면역원을 인코딩한다. 일부 구현예에서, 조성물은 다수의 단일의 핵산 분자, 예를 들면, 3개의 RSV 면역원, 예를 들면, RSV F 면역원, RSV M2-1 면역원, RSV Ga 면역원 및 RSV Gb 면역원을 인코딩하는 단일의 플라스미드를 포함한다.
RSV M2-1에 대한 코딩 서열이 제공되는 일부 구현예에서, 조성물은 다수의 2개의 상이한 핵산 분자, 예를 들면 2개의 플라스미드를 포함하며, 각각의 상이한 핵산 분자는 상이한 RSV 면역원에 대한 단일의 상이한 코딩 서열을 포함하고 여기서 상이한 핵산 분자의 쌍은 RSV F 면역원과 RSV M2-1 면역원, RSV M2-1 면역원과 RSV Ga 면역원, 및 RSV M2-1 면역원과 RSV Gb 면역원을 포함한다.
RSV M2-1에 대한 코딩 서열이 제공되는 일부 구현예에서, 조성물은 다수의 2개의 상이한 핵산 분자, 예를 들면, 2개의 플라스미드를 포함하고 이는 3개의 상이한 RSV 면역원에 대한 코딩 서열을 총괄적으로 포함하거나 어느 하나는 RSV M2-1이다. 구현예는 다음으로 이루어진 그룹 중에서 선택될 수 있다: 하나의 핵산 분자는 RSV F 면역원과 RSV M2-1 면역원을 인코딩하고 두 번째는 RSV Ga 면역원을 인코딩하며; 하나의 핵산 분자는 RSV F 면역원과 RSV M2-1 면역원을 인코딩하고 두 번째는 RSV Gb 면역원을 인코딩하며; 하나는 RSV F 면역원과 RSV Ga 면역원을 인코딩하고, 두 번째는 RSV M2-1 면역원을 인코딩하며; 하나는 RSV F 면역원과 RSV Gb 면역원을 인코딩하고, 두 번째는 RSV M2-1 면역원을 인코딩하며; 하나는 RSV M2-1 면역원과 RSV Ga 면역원을 인코딩하고, 두 번째는 RSV F 면역원을 인코딩하며; 하나는 RSV M2-1 면역원과 RSV Ga 면역원을 인코딩하고, 두 번째는 RSV Gb 면역원을 인코딩하며; 하나는 RSV M2-1 면역원과 RSV Gb 면역원을 인코딩하고, 두 번째는 RSV F 면역원을 인코딩하며; 하나는 RSV M2-1 면역원과 RSV Gb 면역원을 인코딩하고, 두 번째는 RSV Ga 면역원을 인코딩하며; 하나는 Ga 면역원과 RSV Gb 면역원을 인코딩하고, 두 번째는 RSV M2-1 면역원을 인코딩한다.
RSV M2-1에 대한 코딩 서열이 제공되는 일부 구현예에서, 조성물은 다수의 2개의 상이한 핵산 분자, 예를 들면, 2개의 플라스미드를 포함하며, 이는 4개의 상이한 RSV 면역원에 대한 코딩 서열을 총괄적으로 포함한다. 일부 구현예에서: 하나의 핵산 분자는 RSV F 면역원을 인코딩하고 두 번째는 RSV M2-1 면역원, RSV Ga 면역원 및 RSV Gb 면역원을 인코딩하며; 하나의 핵산 분자는 RSV M2-1 면역원을 인코딩하고 두 번째는 RSV F 면역원, RSV Ga 면역원 및 RSV Gb 면역원을 인코딩하며; 하나는 RSV Ga 면역원을 인코딩하고 두 번째는 RSV F 면역원, RSV M2-1 면역원 및 RSV Gb 면역원을 인코딩하며, 하나는 RSV Gb 면역원을 인코딩하고 두 번째는 RSV F 면역원, RSV M2-1 면역원 및 RSV Ga 면역원을 인코딩하며, 하나는 RSV F 및 RSV M2-1 면역원을 인코딩하고 두 번째는 RSV Ga 면역원 및 RSV Gb 면역원을 인코딩하며, 하나는 RSV F 및 RSV Ga 면역원을 인코딩하고 두 번째는 RSV M2-1 면역원 및 RSV Gb 면역원을 인코딩하고, 하나는 RSV F 및 RSV Gb 면역원을 인코딩하고 두 번째는 RSV M2-1 면역원 및 RSV Ga 면역원을 인코딩한다. 일부 구현예에서, 조성물은 3개의 상이한 RSV 면역원에 대한 코딩 서열을 총괄적으로 포함하는, 다수의 3개의 상이한 핵산 분자, 예를 들면, 3개의 플라스미드를 포함한다. 일부 구현예에서: 하나의 핵산 분자는 RSV F 면역원을 인코딩하고, 두 번째는 RSV M2-1 면역원 을 인코딩하며, 세 번째는 RSV Ga 면역원을 인코딩하고; 하나의 핵산 분자는 RSV F 면역원을 인코딩하고, 두 번째는 RSV M2-1 면역원을 인코딩하며 세 번째는 RSV Gb 면역원 면역원을 인코딩하며; 하나의 핵산 분자는 RSV F 면역원을 인코딩하고, 두 번째는 RSV Ga 면역원을 인코딩하며 세 번째는 RSV Gb 면역원을 인코딩하고; 하나의 핵산 분자는 RSV M2-1 면역원을 인코딩하고, 두 번째는 RSV Ga 면역원을 인코딩하며 세 번째는 RSV Gb 면역원을 인코딩한다. 일부 구현예에서, 조성물은 4개의 상이한 RSV 면역원에 대한 코딩 서열을 총괄적으로 포함하는, 다수의 3개의 상이한 핵산 분자, 예를 들면, 3개의 플라스미드를 포함한다. 일부 구현예에서: 하나의 핵산 분자는 RSV F 면역원을 인코딩하고, 두 번째는 RSV M2-1 면역원 을 인코딩하며, 세 번째는 RSV Ga 면역원 및 RSV Gb 면역원을 인코딩하고; 하나의 핵산 분자는 RSV F 면역원을 인코딩하고, 두 번째는 RSV Ga 면역원을 인코딩하며 세 번째는 RSV M2-1 면역원 및 RSV Gb 면역원을 인코딩하며; 하나의 핵산 분자는 RSV F 면역원을 인코딩하고, 두 번째는 RSV Gb 면역원을 인코딩하며 세 번째는 RSV M2-1 면역원 및 RSV Ga 면역원을 인코딩하고; 하나의 핵산 분자는 RSV M2-1 면역원을 인코딩하고, 두 번째는 RSV Ga 면역원을 인코딩하며 세 번째는 RSV F 면역원 및 RSV Gb 면역원을 인코딩하고; 하나의 핵산 분자는 RSV M2-1 면역원을 인코딩하며, 두 번째는 RSV Gb 면역원을 인코딩하고, 세 번째는 RSV F 면역원 및 RSV Ga 면역원을 인코딩하며; 하나는 RSV Ga 면역원을 인코딩하고, 두 번째는 RSV Gb 면역원을 인코딩하며, 세 번째는 RSV F 면역원 및 RSV M2-1을 인코딩한다. 일부 구현예에서, 조성물은 다수의 4개의 상이한 핵산 분자, 예를 들면 4개의 플라스미드를 포함하고, 이는 4개의 상이한 RSV 면역원에 대한 코딩 서열을 총괄적으로 포함하는데, 즉, 하나의 핵산 분자는 RSV F 면역원을 인코딩하고, 두 번째는 RSV M2-1 면역원을 인코딩하며, 세 번째는 RSV Ga 면역원을 인코딩하고 네 번째는 RSV Gb 면역원을 인코딩한다.
일부 구현예에서, 조성물은 케모킨 CCL20, IL-12, IL-15 및/또는 IL-28에 대한 코딩 서열을 추가로 포함한다. 케모킨 CCL20, IL-12, IL-15 및/또는 IL-28에 대한 코딩 서열은 하나 이상의 RSV 면역원에 대한 코딩 서열을 포함하는 하나 이상의 핵산 분자 위에 포함될 수 있다. 케모킨 CCL20, IL-12, IL-15 및/또는 IL-28에 대한 코딩 서열은 별도의 플라스미드와 같은 별도의 핵산위에 포함될 수 있다.
6. 백신
RSV에 대한 포유동물 면역 반응을 생성할 수 있는 백신이 본원에 제공된다. 상기 백신은 위에 논의된 바와 같은 각각의 플라스미드를 포함할 수 있다. 상기 백신은 복수의 플라스미드, 또는 이들의 조합을 포함할 수 있다. 상기 백신은 치료학적 또는 예방학적 면역 반응을 유도하도록 제공될 수 있다.
일부 구현예에서, 백신은 바람직하게는 선행의 Th2 관련된 발병에 관여하지 않도록 편향된 Th1이며 이는 중화 민감성 환경에서 기능할 수 있어야 한다. 바람직하게는, 이는 살아있지 않아야 한다.
백신은 F, Ga 및 Gb, 이러한 단백질의 단편, 이러한 단백질의 변이체, 변이체의 단편으로 이루어진 그룹 중에서 선택된 하나 이상의 면역원성 표적을 전달하는데 사용될 수 있다. 다수의 표적을 전달하는 경우에, 백신은 다수의 조성물 또는 단일의 조성물을 포함할 수 있다. 단일의 플라스미드 상에 다수의 단백질을 인코딩하는 플라스미드 또는 상이한 단백질을 인코딩하는 상이한 플라스미드를 포함하는 조성물이 사용될 수 있다. 일부 구현예에서, 백신은 M2, 이의 단편, M2-1의 변이체, 변이체의 단편을 단독으로 또는 F, Ga 및 Gb, 이러한 단백질의 단편, 이러한 단백질의 변이체, 변이체의 단편으로 이루어진 그룹 중에서 선택된 하나 이상의 면역원성 표적과 함께 전달하기 위해 사용될 수 있다. 다수의 표적을 전달하는 경우에, 백신은 다수의 조성물 또는 단일의 조성물을 포함할 수 있다. 단일의 플라스미드 상에 다수의 단백질을 인코딩하는 플라스미드 또는 상이한 단백질을 인코딩하는 상이한 플라스미드를 포함하는 조성물이 사용될 수 있다.
상기 백신은 약제학적으로 허용되는 부형제를 추가로 포함할 수 있다. 상기 약제학적으로 허용가능한 부형제는 비히클, 아쥬반트, 담체, 또는 희석제로서 기능적 분자일 수 있다. 상기 약제학적으로 허용가능한 부형제는 형질감염 촉진제일 수 있으며, 이는 계면 활성제, 예컨대 면역-자극 복합체 (ISCOMS), 프로인트 불완전한 아쥬반트, 모노포스포릴 지질 A를 포함하는 LPS 유사체, 뮤라밀 펩타이드, 퀴논 유사체, 소포 예컨대 스쿠알렌 및 스쿠알렌, 히알루론산, 지질, 리포좀, 칼슘 이온, 바이러스 단백질, 폴리음이온, 폴리양이온, 또는 나노입자, 또는 다른 공지된 형질감염 촉진제를 포함할 수 있다.
상기 형질감염 촉진제는 폴리음이온, 폴리-L-글루타메이트 (LGS)를 포함하는 폴리양이온, 또는 지질이다. 상기 형질감염 촉진제는 폴리-L-글루타메이트이며, 더욱 바람직하게는, 상기 폴리-L-글루타메이트는 6 mg/ml 미만의 농도로 백신 내에 존재한다. 상기 형질감염 촉진제는 또한 계면 활성제 예컨대 면역-자극 복합체 (ISCOMS), 프로인트 불완전한 아쥬반트, 모노포스포릴 지질 A를 포함하는 LPS 유사체, 뮤라밀 펩타이드, 퀴논 유사체 및 소포, 예컨대 스쿠알렌 및 스쿠알렌, 및 히알루론산을 포함할 수 있고, 히알루론산이 상기 유전적 컨스트럭트와 함께 투여되어 사용될 수 있다. 일부 구현예에서, DNA 플라스미드 백신은 또한 형질감염 촉진제, 예컨대 지질, DNA-리포좀 혼합물 (예를 들면 W09324640 참고)로서 레시틴 리포좀 또는 본 기술분야에 공지된 다른 리포좀을 포함하는 리포좀, 칼슘 이온, 바이러스 단백질, 다중음이온, 폴리양이온, 또는 나노입자, 또는 다른 공지된 형질감염 촉진제를 포함할 수 있다. 바람직하게는, 상기 형질감염 촉진제는 폴리음이온, 폴리-L-글루타메이트 (LGS)를 포함하는 폴리양이온, 또는 지질이다. 백신 속의 형질감염제의 농도는 4 mg/ml 미만, 2 mg/ml 미만, 1 mg/ml 미만, 0.750 mg/ml 미만, 0.500 mg/ml 미만, 0.250 mg/ml 미만, 0.100 mg/ml 미만, 0.050 mg/ml, 또는 0.010 mg/ml 미만이다.
상기 약제학적으로 허용되는 부형제는 하나 이상의 아쥬반트일 수 있다. 아쥬반트는 동일하거나 대체 플라스미드로부터 발현되거나 백신 속에 상기 플라스미드와 함께 단백질로서 전달되는 다른 유전자일 수 있다. 하나 이상의 아쥬반트는 CCL20, α-인터페론(IFN- α), β-인터페론(IFN-β), γ-인터페론, 혈소판 기원 성장 인자(PDGF), TNFα, TNFβ, GM-CSF, 상피 성장 인자(EGF), 피하 T 세포-유집 케모킨(CTACK), 상피 가슴샘-발현된 케모킨(TECK), 점막-관련된 상피 케모킨(MEC), IL-12, 신호 서열 또는 결실된 신호 서열을 인코딩하는 코딩 서열을 갖는 IL-15를 포함하고 IgE로부터의 것과 같은 상이한 신호 펩타이드 또는 IgE, IL-28, MHC, CD80, CD86, IL-1, IL-2, IL-4, IL-5, IL-6, IL-10, IL-18, MCP-1, MIP-lα, MIP-1β, IL-8, L-셀렉틴, P-셀렉틴, E-셀렉틴, CD34, GlyCAM-1, MadCAM-1, LFA-1, VLA-1, Mac-1, pl50.95, PECAM, ICAM-1, ICAM-2, ICAM-3, CD2, LFA-3, M-CSF, G-CSF, IL-18의 돌연변이체 형태, CD40, CD40L, 혈관 성장 인자, 섬유아세포 성장 인자, IL-7, 신경 성장 인자, 혈관 내피 성장 인자, Fas, TNF 수용체, Flt, Apo-1, p55, WSL-1, DR3, TRAMP, Apo-3, AIR, LARD, NGRF, DR4, DR5, KILLER, TRAIL-R2, TRICK2, DR6, 카스파제 ICE, Fos, c-jun, Sp-1, Ap-1, Ap-2, p38, p65Rel, MyD88, IRAK, TRAF6, IkB, 불활성 NIK, SAP K, SAP-1, JNK, 인터페론 반응 유전자, NFkB, Bax, TRAIL, TRAILrec, TRAILrecDRC5, TRAIL-R3, TRAIL-R4, RANK, RANK LIGAND, Ox40, Ox40 LIGAND, NKG2D, MICA, MICB, NKG2A, NKG2B, NKG2C, NKG2E, NKG2F, TAP1, TAP2 및 이의 기능성 단편, 또는 이의 조합으로부터의 것과 같은 상이한 신호 펩타이드를 임의로 포함하는 코딩 서열을 임의로 포함하는 IL-15로 이루어진 그룹 중에서 선택된 단백질을 인코딩하는 단백질 및/또는 핵산 분자일 수 있다. 일부 구현예에서, 아쥬반트는 하나 이상의 단백질 및/또는 CCL-20, IL-12, IL-15, IL-28, CTACK, TECK, MEC 또는 RANTES로 이루어진 그룹 중에서 선택된 단백질을 인코딩하는 핵산 분자일 수 있다. IL-12 컨스트럭트 및 서열의 예는 PCT 출원 제PCT/US1997/019502호 및 상응하는 미국 특허원 일련 번호 제08/956,865호, 및 2011년 12월 12일자로 출원된 미국 가특허원 일련번호 제 61/569600호에 기재되어 있으며, 이들은 각각 본원에 참조로 통합되어 있다. IL-15 컨스트럭트 및 서열은 PCT 출원 제PCT/US04/18962호 및 상응하는 미국 특허원 일련번호 제10/560,650호, 및 PCT 출원 제PCT/US07/00886호 및 상응하는 미국 특허원 일련 번호 제12/160,766호, 및 PCT 출원 제PCT/US10/048827호에 기재되어 있으며, 이는 각각 본원에 참조로 통합되어 있다. IL-28 컨스트럭트의 예는 PCT 출원 제PCT/US09/039648호 및 상응하는 미국 특허원 일련 번호 제12/936,192호에 기재되어 있으며, 이는 각각 본원에 참조로 통합되어 있다. RANTES 및 다른 컨스트럭트 및 서열의 예는 PCT 출원 제PCT/US1999/004332호 및 상응하는 미국 특허원 일련 번호 제09/622452호에 기재되어 있으며, 이는 각각 본원에 참조로 통합되어 있다. RANTES 컨스트럭트 및 서열의 다른 예는 본원에 참조로 통합된 PCT 출원 제PCT/US11/024098호에 기재되어 있다. RANTES 및 다른 컨스트럭트 및 서열의 예는 각각 본원에 참조로 통합된 PCT 출원 제 PCT/US1999/004332호 및 상응하는 미국 특허원 일련 번호 제09/622452호에 기재되어 있다. RANTES 컨스트럭트 및 서열의 다른 예는 본원에 참조로 통합된 PCT 출원 제PCT/US11/024098호에 기재되어 있다. 케모킨 CTACK, TECK 및 MEC 컨스트럭트 및 서열의 예는 각각 본원에 참조로 통합된 PCT 출원 제PCT/US2005/042231호 및 상응하는 미국 특허원 일련 번호 제11/719,646호에 기재되어 있다. OX40 및 다른 면역조절제의 예는 본원에 참조로 통합된 미국 특허원 일련 번호 제10/560,653호에 기재되어 있다. DR5 및 다른 면역조절제의 예는 본원에 참조로 통합된 미국 특허원 일련 번호 제09/622452호에 기재되어 있다.
백신은 참조로 완전히 통합된, 1994년 4월 1일자로 출원된 미국 일련 번호 제021,579호에 기술된 바와 같은 유전 백신 촉진제를 추가로 포함할 수 있다.
상기 백신은 약 1 나노그램 내지 100 밀리그램; 약 1 마이크로그램 내지 약 10 밀리그램; 또는 바람직하게는 약 0.1 마이크로그램 내지 약 10 밀리그램; 또는 더 바람직하게는 약 1 밀리그램 내지 약 2 밀리그램의 양의 공통 항원 및 플라스미드를 포함할 수 있다. 일부 바람직한 구현예에서, 본 발명에 따른 약제학적 조성물은 약 5 나노그램 내지 약 1000 마이크로그램의 DNA를 포함한다. 일부 바람직한 구현예에서, 상기 약제학적 조성물은 약 10 나노그램 내지 약 800 마이크로그램의 DNA를 함유한다. 일부 바람직한 구현예에서, 상기 약제학적 조성물은 약 0.1 내지 약 500 마이크로그램의 DNA를 함유한다. 일부 바람직한 구현예에서, 상기 약제학적 조성물은 약 1 내지 약 350 마이크로그램의 DNA를 함유한다. 일부 바람직한 구현예에서, 상기 약제학적 조성물은 약 25 내지 약 250 마이크로그램, 약 100 내지 약 200 마이크로그램, 약 1 나노그램 내지 100 밀리그램; 약 1 마이크로그램 내지 약 10 밀리그램; 약 0.1 마이크로그램 내지 약 10 밀리그램; 약 1 밀리그램 내지 약 2 밀리그램, 약 5 나노그램 내지 약 1000 마이크로그램, 약 10 나노그램 내지 약 800 마이크로그램, 약 0.1 내지 약 500 마이크로그램, 약 1 내지 약 350 마이크로그램, 약 25 내지 약 250 마이크로그램, 약 100 내지 약 200 마이크로그램의 이의 공통 항원 또는 플라스미드를 함유한다.
상기 백신은 사용될 투여 방식에 따라 제형화될 수 있다. 주사가능한 백신 약제학적 조성물은 멸균되고, 발열물질이 없고 미립자가 없을 수 있다. 등장성 제형 또는 용액이 사용될 수 있다. 등장성을 위한 첨가제는 염화나트륨, 덱스트로오스, 만니톨, 소르비톨, 및 락토오스를 포함할 수 있다. 상기 백신은 혈관수축제를 포함할 수 있다. 상기 등장성 용액은 인산염 완충 염수를 포함할 수 있다. 백신은 젤라틴 및 알부민을 포함하는 안정화제를 추가로 포함할 수 있다. LGS 또는 폴리양이온 또는 폴리음이온과 같은 안정화제는 상기 백신 제형에 대해 연장된 기간 동안 상온 또는 주위 온도에서 제형을 안정화시킬 수 있다.
7. 백신의 전달 방법
면역 반응이 유도될 수 있는 RSV의 면역원에 대해 특히 효과적이도록 하는 에피토프를 포함하는 공통 항원의 단백질 또는 유전 컨스트럭트를 제공하기 위한 백신을 전달하는 방법이 본원에 제공된다. 치료학적 및 예방학적 면역 반응을 유도할 수 있는 백신을 전달하는 방법 또는 예방접종이 제공될 수 있다. 상기 예방접종 공정은 포유동물 내에서 RSV에 대한 면역반응을 생성할 수 있다. 상기 백신은 포유동물의 면역계의 활성을 조절하고 면역 반응을 향상시키기 위해 개인에게 전달될 수 있다. 백신의 전달은, 면역 반응의 인식 시 세포내에서 발현되어 세포의 표면으로 전달되고 세포성, 체액성, 또는 세포 및 체액성 반응을 유도하는 핵산 분자와 같이 공통 항원의 형질감염일 수 있다. 상기 백신의 전달은 위에서 논의한 바와 같은 백신을 포유동물에게 투여함으로써 RSV에 대해 포유동물내에서 면역 반응을 유도하거나 유발시키는데 사용될 수 있다.
상기 포유동물의 세포내로 백신 및 플라스미드의 전달 시, 형질감염된 세포는 백신으로부터 주사된 플라스미드 각각에 대한 공통 항원을 발현하여 분비할 것이다. 이들 단백질은 면역계에 의해 외부인자로 인식될 것이고 항체가 이에 대해 제조될 것이다. 이들 항체는 면역계에 의해 유지되어 후속적인 RSV 감염에 대해 효과적인 반응이 일어나도록 할것이다.
상기 백신은 포유동물에게 투여되어 포유동물내에서 면역 반응을 유발할 수 있다. 상기 포유동물은 인간, 영장류, 비-인간 영장류, 젖소, 소, 양, 염소, 영양, 들소, 물소, 들소, 소과, 사슴, 헤지혹, 코끼리, 라마, 알파카, 마우스, 랫트, 및 닭일 수 있다.
a. 조합 치료요법
백신은 CCL20, α-인터페론, γ-인터페론, 혈소판 기원 성장 인자(PDGF), TNFα, TNFβ, GM-CSF, 상피 성장 인자(EGF), 피하 T 세포-유집 케모킨(CTACK), 상피 가슴샘-발현된 케모킨(TECK), 점막-관련된 상피 케모킨(MEC), IL-12, 결실된 신호 서열을 갖고 IgE 신호 펩타이드와 같은 상이한 신호 펩타이드, MHC, CD80, CD86, IL-28, IL-1, IL-2, IL-4, IL-5, IL-6, IL-10, IL-18, MCP-1, MIP-lα, MIP-1β, IL-8, RANTES, L-셀렉틴, P-셀렉틴, E-셀렉틴, CD34, GlyCAM-1, MadCAM-1, LFA-1, VLA-1, Mac-1, pl50.95, PECAM, ICAM-1, ICAM-2, ICAM-3, CD2, LFA-3, M-CSF, G-CSF, IL-18의 돌연변이체 형태, CD40, CD40L, 혈관 성장 인자, 섬유아세포 성장 인자, IL-7, 신경 성장 인자, 혈관 내피 성장 인자, Fas, TNF 수용체, Flt, Apo-1, p55, WSL-1, DR3, TRAMP, Apo-3, AIR, LARD, NGRF, DR4, DR5, KILLER, TRAIL-R2, TRICK2, DR6, 카스파제 ICE, Fos, c-jun, Sp-1, Ap-1, Ap-2, p38, p65Rel, MyD88, IRAK, TRAF6, IkB, 불활성 NIK, SAP K, SAP-1, JNK, 인터페론 반응 유전자, NFkB, Bax, TRAIL, TRAILrec, TRAILrecDRC5, TRAIL-R3, TRAIL-R4, RANK, RANK LIGAND, Ox40, Ox40 LIGAND, NKG2D, MICA, MICB, NKG2A, NKG2B, NKG2C, NKG2E, NKG2F, TAP1, TAP2 및 이의 기능성 단편, 또는 이의 조합으로부터의 것과 같은 상이한 신호 펩타이드를 임의로 포함하는 IL-15를 인코딩하는 기타 단백질 및/또는 유전자와 함께 투여될 수 있다. 일부 구현예에서, 백신은 다음의 핵산 분자 및/또는 단백질 중의 하나 이상과 함께 투여된다: 하나 이상의 CCL20, IL-12, IL-15, IL-28, CTACK, TECK, MEC 및 RANTES을 인코딩하는 코딩 서열을 포함하는 핵산 분자 또는 이의 기능성 단편으로 이루어진 그룹 중에서 선택된 핵산 분자, 및 CCL02, IL-12 단백질, IL-15 단백질, IL-28 단백질, CTACK 단백질, TECK 단백질, MEC 단백질 또는 RANTES 단백질로 이루어진 그룹 중에서 선택된 단백질 또는 이의 기능성 단편.
상기 백신은 경구, 비경구, 설하, 경피, 직장, 경점막, 국소, 흡입을 통해, 볼내 투여를 통해, 흉막내로, 정맥내, 동맥내, 복강내, 피하, 근육내, 비강내, 경막내, 및 동맥내, 또는 이의 조합을 포함하는 상이한 경로로 투여될 수 있다. 수의학적 용도를 위해, 상기 조성물은 일반적인 수의학적 관례에 따라 적합하게 허용가능한 제형으로서 투여될 수 있다. 수의사는 특정 동물에 가장 적절한 복용 요법 및 투여 경로를 쉽게 결정할 수 있다. 상기 백신은 전통적 주사기, 무바늘 주사 장치, "미세투사 충격 고운 건(microprojectile bombardment gone guns)", 또는 전기천공 ("EP"), "유체역학적 방법", 또는 초음파와 같은 다른 물리적 방법에 의해 투여될 수 있다.
상기 백신의 플라스미드는 생체내 전기천공을 이용하여 그리고 이를 이용하지 않고 DNA 주사 (또한 DNA 백신접종으로도 불림), 리포좀 매개된, 나노입자 촉진된, 재조합 벡터, 예컨대 재조합 아데노바이러스, 재조합 아데노바이러스 연관된 바이러스 및 재조합 우두를 포함하는 널리 공지된 몇 가지 기술에 의해 포유동물에게 전달될 수 있다. 공통 항원은 DNA 주사를 통해 그리고 생체내 전기천공과 함께 전달될 수 있다.
b. 전기천공
상기 백신의 플라스미드의 전기천공을 통한 백신의 투여는, 가역적 기공이 세포막에 형성되게 하는데 효과적인 에너지의 펄스를 포유동물의 원하는 조직에 전달하도록 구성될 수 있는 전기천공 장치를 이용하여 달성될 수 있고, 바람직한 에너지의 펄스는 사용자에 의해 입력된 미리 조정된 전류와 유사한 정전류다. 상기 전기천공 장치는 전기천공 구성요소 및 전극 어셈블리 또는 핸들 어셈블리를 포함할 수 있다. 전기천공 구성요소는 조절기, 정전류형 생성기, 임피던스 시험기, 파형 로거(waveform logger), 입력 요소, 상태 보고 요소, 통신 포트, 기억 구성요소, 파워력, 및 파워 스위치를 포함하는 전기천공 장치의 각종 요소 중 하나 이상을 포함하거나 통합할 수 있다. 전기천공은 생체내 전기천공 장치, 예를 들면, CELLECTRA EP 시스템(VGX Pharmaceuticals, Blue Bell, PA) 또는 엘겐 전기천공기(Genetronics, San Diego, CA)를 사용하여 플라스미드에 의한 세포의 형질감염을 촉진시킬 수 있다.
전기천공 구성요소는 전기천공 장치의 하나의 요소로서 기능할 수 있으며, 다른 요소는 전기천공구성요소와 통신하는 별개의 요소(또는 구성요소)이다. 상기 전기천공 구성요소는 전기천공 장치의 하나를 초과하는 요소로서 기능할 수 있고, 이는 상기 전기천공 구성요소와 구별되는 전기천공 장치의 또 다른 요소와 통신할 수 있다. 하나의 전기기계적 또는 기계적 장치의 일부로서 존재하는 전기천공 장치의 요소들은, 상기 요소들이 하나의 장치로서 또는 서로 통신하는 별개의 요소로서 기능할 수 있으므로, 제한되지 않을 수 있다. 상기 전기천공 구성요소는 원하는 조직에서 정전류를 생산하는 에너지의 펄스를 전달할 수 있으며, 피드백 기전을 포함한다. 전극 어셈블리는 공간 배열 내에 복수의 전극을 갖는 전극 어레이를 포함할 수 있으며, 여기서 상기 전극 어셈블리는 전기천공 구성요소로부터 에너지의 펄스를 받고 전극을 통해 원하는 조직에 이를 전달한다. 복수의 전극 중 적어도 하나는 에너지의 펄스가 전달되는 동안 중성이고, 원하는 조직에서 임피던스를 측정하고 전기천공 구성요소에 임피던스를 전달한다. 상기 피드백 기전은 측정된 임피던스를 받을 수 있고 전기천공 구성요소에 의해 전달된 에너지의 펄스가 정전류를 유지하도록 조절할 수 있다.
복수의 전극은 분산된 패턴으로 에너지의 펄스를 전달할 수 있다. 복수의 전극은 프로그램된 순서 하에 전극의 제어를 통해 분산된 패턴으로 에너지의 펄스를 전달할 수 있고, 상기 프로그램된 순서는 사용자에 의해 전기천공 구성요소에 입력된다. 상기 프로그램된 순서는 순서로 전달된 복수의 펄스를 포함할 수 있으며, 여기서 복수의 펄스 중 각각의 펄스는 임피던스를 측정하는 하나의 중성 전극을 갖는 적어도 2개의 활성 전극에 의해 전달되고, 여기서 복수의 펄스 중 차후의 펄스는 임피던스를 측정하는 하나의 중성 전극을 갖는 적어도 2개의 활성 전국 중 상이한 하나에 의해 전달된다.
상기 피드백 기전은 하드웨어 또는 소프트웨어 중 하나에 의해 수행될 수 있다. 상기 피드백 기전은 아날로그 폐-루프 회로에 의해 수행될 수 있다. 상기 피드백은 50 μs, 20 μs, 10 μs 또는 1 μs마다 일어나지만, 바람직하게는 실시간 피드백 또는 즉각적이다 (즉, 반응 시간을 결정하는 이용가능한 기술에 의해 결정된 바와 같이 실질적으로 즉각적임). 중성 전극은 원하는 조직 내의 임피던스를 측정할 수 있고, 상기 임피던스를 피드백 기전에 전달하고, 상기 피드백 기전은 임피던스에 반응하여 에너지의 펄스를 미리 조정된 전류와 유사한 값으로 정전류를 유지시킨다. 상기 피드백 기전은 에너지의 펄스의 전달 동안 연속적으로 그리고 즉각적으로 정전류를 유지할 수 있다.
본 발명의 DNA 백신의 전달을 촉진할 수 있는 전기천공 장치 및 전기천공 방법의 예는, 이들의 내용 전체가 본원에 참조로써 통합되어 있는, 미국 특허 제7,245,963호(Draghia-Akli, 등,), 미국 특허공개공보 제2005/0052630호 (Smith, 등에 의해 제출됨)에 기술된 것을 포함한다. DNA 백신의 전달을 촉진하는데 사용될 수 있는 다른 전기천공 장치 및 전기천공 방법은, 제60/852,149호(2006년 10월 17일 출원), 및 제60/978,982호(2007년 10월 10일 출원)에 대해 35 USC 119(e) 하에 우선권을 주장하는, 공동계류중이고 공동소유인 미국 특허 출원 제11/874072호(2007년 10월 17일 출원)에 제공된 것을 포함하며, 이들 모두는 그 전체가 참고로써 본원에 통합되어 있다.
미국 특허 제7,245,963호(Draghia-Akli, 등)는 몸 또는 식물에서 선택된 조직의 세포 내로 생체분자의 도입을 용이하게 하기 위한 모듈식 전극 시스템 및 그의 용도를 기술하고 있다. 상기 모듈식 전극 시스템은 복수의 바늘 전극; 피하 주사침; 프로그램가능한 정전류 펄스 컨트롤러로부터 복수의 바늘 전극까지 전도성 링크를 제공하는 전기적 커넥터; 및 전원을 포함할 수 있다. 작업자는 지지 구조 상에 올려진 복수의 바늘 전극을 붙잡아 몸 또는 식물에서 선택된 조직 내로 이들을 단단하게 삽입할 수 있다. 생체분자는 이후 선택된 조직 내로 피하 주사침을 통해 전달된다. 프로그램가능한 정전류 펄스 컨트롤러가 활성화되고 정전류 전기 펄스가 복수의 바늘 전극에 적용된다. 상기 적용된 정전류 전기 펄스는 복수의 전극 사이에 있는 세포 내로 생체분자의 도입을 용이하게 한다. 미국 특허 제7,245,963호의 전체 내용은 참고로 본원에 통합되어 있다.
미국 특허 공개공보 제2005/0052630호(Smith, 등에 의해 출원됨)는 몸 또는 식물에서 선택된 조직의 세포 내로 생체분자의 도입을 효과적으로 촉진하는데 사용될 수 있는 전기천공 장치를 기술한다. 상기 전기천공 장치는, 작업이 소프트웨어 또는 펌웨어에 의해 지정되는 전기-동력학 장치 ("EKD 장치")를 포함한다. EKD 장치는 사용자 제어 및 펄스 파라미터의 입력에 기초한 어레이 내의 전극 사이에 일련의 프로그램가능한 정전류 펄스 패턴을 생산하고, 전류 파형 데이타의 저장 및 취득을 허용한다. 전기천공 장치는 또한 바늘 전극, 주사 바늘용 중심 주사 통로, 및 제거가능한 가이드 디스크의 어레이를 갖는 교체가능한 전극 디스크를 포함한다. 미국 특허 공개공보 제2005/0052630호의 전체 내용은 참고로 본원에 통합되어 있다.
미국 특허 제7,245,963 및 미국 특허 공개공보 제2005/0052630호에 기재된 전극 어레이 및 방법은 근육과 같은 조직 뿐만 아니라 다른 조직 또는 기관 내로도 깊이 침투시키는데 조정될 수 있다. 전극 어레이의 배치 때문에, 주사 바늘 (선택한 생체분자를 전달함)은 또한 표적 장기 내로 완전히 삽입되며, 주사는 전극에 의해 미리 기술된 영역 내에서, 표적 조직에 수직으로 투여된다. 미국 특허 제7,245,963호 및 미국 특허 공개공보 2005/005263에 기술된 전극은 바람직하게는 20 mm 길이 및 21 게이지이다.
또한, 전기천공 장치 및 이의 용도를 포함하는 고려된 일부 구현예에서, 하기 특허들에 기재된 것들인 전기천공 장치가 고려된다: US 특허 제5,273,525호(1993년 12월 28일 발행), US 특허 제6,110,161호(2000년 8월 29일 발행), 제6,261,281호(2001년 7월 17일 발행), 및 제6,958,060호(2005년 10월 25일 발행), 및 US 특허 제6,939,862호(2005년 9월 6일 발행). 더욱이, 다양한 장치 중 어느 것을 사용한 DNA의 전달에 관한, 2004년 2월 24일자로 허여된 미국 특허 제6,697,669호에 제공된 주제에 관한 특허, 및 DNA의 주사 방법에 관한, 2008년 2월 5일자로 허여된 미국 특허 제7,328,064호가 본원에 고려된다. 상기-특허들은 그 전체가 참고로 본원에 통합되어 있다.
c. DNA 플라스미드를 제조하는 방법
본원에 논의된 DNA 백신을 포함하는 DNA 플라스미드를 제조하는 방법이 본원에 제공된다. DNA 플라스미드는, 포유동물 발현 플라스미드 내로의 최종 아클로닝 단계 후에, 당해 분야에 공지된 방법을 사용하여, 대규모 발효 탱크 속에 세포 배양물을 접종하는데 사용될 수 있다.
본 발명의 EP 장치를 사용하기 위한 DNA 플라스미드는 공지된 장치 및 기술의 조합을 이용하여 제형화되거나 제조될 수 있지만, 바람직하게는 이들은 라이센스된, 공동계류중인 미국 가출원 제60/939,792호(2007년 5월 23일 출원)에 기재된 최적화된 플라스미드 제조 기술을 이용하여 제조된다. 일부 예에서, 이들 연구에 사용된 DNA 플라스미드는 10 mg/mL 이상의 농도로 제형화될 수 있다. 제조 기술은 또한 라이센스된 특허, 미국 특허 제7,238,522호(2007년 7월 3일 발행)에 기재된 것을 포함하여, 미국 출원 제60/939792호에 기재된 것 이외에도, 당해분야의 숙련자에게 통상적으로 공지된 다양한 장치 및 프로토콜을 포함하거나 통합한다. 상기-참조된 출원 및 특허, US 출원 제60/939,792호 및 US 특허 제7,238,522호는 각각 그 전체가 참조로써 본원에 통합되어 있다.
실시예
본 발명은 하기 실시예에 더 예시된다. 이들 실시예는, 본 발명의 바람직한 구현예를 나타내긴 하지만, 단지 예시를 위해 제공되는 것으로 이해되어야 한다. 상기 논의 및 이들 실시예로부터, 당해 분야의 숙련가는 본 발명의 본질적인 특징을 확인할 수 있고, 이의 취지 및 범주로부터 벗어나지 않고, 그것을 다양한 용법 및 조건에 맞추기 위해 본 발명을 다양하게 변화 및 변형시킬 수 있다. 따라서, 본원에 제시되고 기술된 것 이외에 본 발명의 다양한 변형들은 전술한 설명으로부터 당해 분야의 숙련가에게 자명할 것이다. 그러한 변형은 또한 첨부된 청구항의 범주 내에 속하는 것으로 의도된다.
실시예 1
미래의 RSV 감염에 대해 고 위험인 개인(예를 들면, 영아 및 노인)의 수에 있어서 예측되는 지속된 증가로 인해, RSV 감염에 대해 효과적이고 최종적으로 관리가능한 치료의 개발에 대한 긴박한 필요성이 존재한다. DNA 백신, 면역화 시 목적한 인코딩된 단백질을 발현하도록 유전적으로 가공된 소 박테리아 플라스미드는 효과적인 RSV 백신을 설계하는데 있어서 관여된 많은 장애를 피하는데 도움이 될 수 있는 수개의 유의적인 장점을 제공한다. 예를 들어, 임상적으로 유의적인 질병 및 재-감염을 방지하기 위하여, 백신은 천연의 RSV 감염으로부터 발생하는 것보다 더 크고 더 오래 동안 지속되는 면역성을 부여할 수 있다. DNA 백신은 체액성(예를 들면, 중화 항체) 및 세포성(예를 들면, 세포독성 T 림프구) 면역 반응 둘다를 유발할 뿐 아니라, 많은 바이러스에 대해 평생 면역성을 유발할 수 있다. 또한, RSV 예방접종에 대한 주요 표적은 신생아 및 영아이다. 신생아 면역계는 기능적으로 미성숙되어 있으므로, 통상의 백신(예를 들면, 살아있는 약독화되거나 불활성화된 바이러스)에 대해 단지 약한 면역 반응을 발달시킨다. 한편, DNA 백신은 신생아 동물 모델에서 안전하고 면역원성인 것으로 밝혀졌다. 또한, 면역화 시기에 모계 항체의 존재는 다양한 통상의 백신에 대한 면역 반응을 제어하거나 억제하는 것으로 알려져 왔다. 그러나, DNA 백신을 사용하면, 면역화 단백질은 백신 제제 속에 존재하지 않으므로, 모계 항체에 의한 불활성화를 지시하는데 민감하지 않아야 한다.
현재, 임상 시험에서 조기 단계 또는 거의 조기 단계의 3개의 주요 RSV 백신이 존재한다: 1) 살아있는 약독화된 RSV(MedImmune, Philadelphia, PA); 2) RSV F 및/또는 G 단백질을 발현하는 센다이 바이러스(AmVac, Switzerland); 및 3) RSV의 G 단백질을 함유하는 바이러스-유사 입자(Novavax, Rockville, MD) (http://www.clinicaltrials.gov/ct2/results?term=RSV&pg=l). 비록 이들 시도가 RSV 감염의 예방에 있어 어느 정도의 효능을 나타낸다고 해도, 이러한 백신 설계와 관련된 다른 고유의 단점이 존재한다. 예를 들면, 살아있는 약독화된 바이러스를 사용한 최대 논쟁은 발병력으로의 복귀를 초래하는 약독화-하에 또는 돌연변이-하에 있으므로, 면역약화된 개인에게는 투여되지 않아야 한다. 모든 바이러스 벡터에 대한 일반적인 단점은, 바이러스 단백질의 인식이 후속적인 면역화 시 백신의 효능을 유의적으로 감소시킬 수 있는 중화 항체의 생성을 초래하므로 숙주 면역 반응이다. 마지막으로, RSV의 G 단백질은 RSV의 2개의 아형 사이에서 고도로 가변적이므로, G 단백질을 표적화하는 백신은 교차 보호를 제공하는 경향이 없다.
대조적으로, DNA 백신은 고도로 면역원성이며 위에서 기술한 백신 시도와 관련된 많은 단점을 결여하는 것으로 밝혀졌다. 전기천공을 통해 전달되는 경우, DNA 백신 면역원성이 추가로 개선된다. DNA 백신은 바이러스 구성 요소의 완전한 세트를 거의 함유하지 않으며 유사 단백질 소단위 백신은발병력 복귀에 대한 위험이 없거나 숙주의 감염을 영아 및 면역약화된 개인 둘 다에서 사용하기에 안전하도록 한다.
RSV의 아형 A 및 B 둘다의 공통 서열을 사용하는 것은 바이러스의 균주 둘다에 대한 보다광범위한 보호를 수득하기 위한 기준을 제공한다. 이러한 장점은, 공통 RSV DNA 백신을 과거에 제안된 어떠한 다른 시도보다 훨씬 더 유리하고 잠재적으로 보다 효율적이 되도록 한다.
주요 RSV 단백질 - 융합(F), 당단백질(Ga), 및 당단백질(Ga)을 신규 RSV 백신에 대한 표적으로서 선택하였다. 또한 제2의 매트릭스 단백질(M2)이 평가를 위해 선택되었다. 위에서 언급한 바와 같이, F 및 G 단백질은 표면에서 발현되며 중화 항체에 대한 이상적인 표적이다. M2 단백질은 주요 면역우성 CD8 T 세포 에피토프를 함유한다. 이들 RSV 단백질 각각의 경우, 단일의 공통 서열은 RSV의 아형 A 및 B 둘다에 대해 PUBMED에 의해 제공된 아미노산 서열을 기준으로 생성되었다(도 1은 RSV-F 단백질의 계통수를 나타내고, 공통 RSV F 단백질 아미노산 서열은 서열 번호: 2에 제시되어 있으며; 도 2는 RSV M2-1 단백질의 계통수를 나타내고, 공통 RSV M2-1 단백질 아미노산은 서열 번호: 4에 설정되어 있다). 바람직한 구현예에서, 공통 단백질 서열을 인코딩하는 코돈 및 RNA 최적화된 DNA 서열이 생산되어 전기천공을 사용하여 전달할 수 있는 DNA 백신을 제조하는데 사용된다.
실시예 2
RSV 공통 F 단백질의 성공적인 발현은 면역형광 현미경 및/또는 웨스턴 블롯 분석을 통해 확인되었다. 컨스트럭트는 면역화 연구에 사용되었다.
마우스를 다양한 용량의 상이한 RSV DNA 백신 컨스트럭트로 면역화시켰다. 하나의 그룹에는 대조군으로서 DNA 백신 뼈대 플라스미드 pVax를 제공하였다. 하나의 그룹에는 5 μg 투여량의 플라스미드 RSV-F를 제공하였고, 하나의 그룹에는 15 μg 투여량의 플라스미드 RSV-F를 제공하였으며; 하나의 그룹에는 30 μg 투여량의 플라스미드 RSV-F를 제공하였고; 하나의 그룹에는 60 μg 투여량의 플라스미드 RSV-F를 제공하였다.
마우스를 전기천공을 사용하여 근육내로 총 3회의 면역화(0, 2 및 4주째)를 위해 2주 간격으로 면역화하였다. 마우스를 각각의 면역화 후 2, 4, 6 및 12주째에 방혈하고 전체 RSV F 단백질 특이적인 IgG 및 IgA 항체를 혈청 속에서 측정하였다. 도 3은 면역화 1(즉, 0주째), 면역화 2(즉, 2주째) 및 면역화 3(즉, 4주째) 후에 항-RSV F 단백질 IgG를 나타낸다. 도 4는 면역화 1(즉, 0주째), 면역화 2(즉, 2주째) 및 면역화 3(즉, 4주째) 후에 항-RSV F 단백질 IgA를 나타낸다. 마우스는 12주째에 희생시켰다. 혈청 속에서 전체 IgG 및 혈청 속에서 전체 IgA의 비교 이외에, 최종 면역화 후대략 8주째에 상이한 투여량의 RSV-F 백신에서 IFN-γ 생산의 비교를 수행하였다.
RSV-F DNA 백신은 혈청 속에서 고 수준의 IgG 및 IgA 둘다를 유발하였다. 반응은 연구된 모든 용량에 대한 두 번째 면역화후 2주째로서 조기에 검출가능하였다. 유도된 항체 반응은 강하게 Thl 편향인 것으로 여겨지므로, RSV에 대한 Th2 면역 반응의 부작용의 앞서의 논쟁을 피하는 것으로 여겨진다. RSV-F 특이적인 CD8 T 세포는 마지막 면역화 후 심지어 8주 후에도 관찰되었다. 도 5는 마지막 면역화 후 대략 8주째까지 상이한 용량의 RSV-F 백신에서 IFN-γ 생산의 비교로부터의 결과를 나타낸다.
실시예 3
케모킨은 거의 반응성인 세포내에서 보다 높은 농도 구배에 대해 지시된 화학주성을 유도하는 능력을 지닌 세포에 의해 분비된 소 단백질의 계열이다. 각종 그룹이 면역 아쥬반트로서 케모킨 사용의 실행가능성을 연구하여 왔다.
CCR10에 결합하는 CCL28/MEC(점막-관련 상피 케모킨)은 위, 폐, 유방, 및 타액선 내에서 상피 세포에서 발현된다. 앞서의 연구에서 점막 케모킨의 사용은 전신계 면역화 후 점막 조직내에서 보다 우수한 면역 반응을 유도하는 면역 아쥬반트로서의 이들의 용도를 나타내었다.
실험을 수행하여 공통 RSV F 단백질 DNA 백신 컨스트럭트에 대한 아쥬반트로서 CCL28 유전 컨스트럭트의 용도를 시험하였다. 간 활성화 조절된 케모킨(LARC) 또는 대식구 염증성 단백질-3(MIP3A)으로 또한 언급된, CCL20을 인코딩하는 뉴클레오타이드 서열을 포함한 유전 컨스트럭트를 또한 공통 RSV F 단백질 DNA 백신 컨스트럭트에 대한 가능한 아쥬반트로서 시험하였다.
RSV-F에 대한 면역화 스케쥴 및 케모킨 실험은 3개 그룹의 마우스를 이용하였다: 하나에게 RSV-F 컨스트럭트만을 제공하고; 하나에게 RSV-F 컨스트럭트와 CCL20 컨스트럭트를 제공하며; 하나에게 RSV-F 컨스트럭트와 CCL28 컨스트럭트를 제공한다. 마우스를 0주, 2주 및 4주째에 총 3회 면역화하였다. 마우스를 2주, 4주 및 5주째에 방혈하였다. 5주 째에, 마우스를 질 세척하여 질 샘플을 수집하고 폐 및 비장을 수집한 후 희생시켰다.
비교는 비장에서 RSV-F +/- 케모킨 면역화 후 비장내에서(도 6) 및 RSV-F +/- 케모킨 면역화 후 폐(도 7)내에서 IFN-γ+ CD8 및 CD4 T 세포로 수행하였다.
혈청 속에서 IgG 종점 역가를 측정하고 혈청 속에서 IgG 아형(IgG1 대 IgG2a)을 비교하였다(도 8). IgG2a/IgG1 비의 비교를 또한 수행하였다(도 9).
CCL20 및 CCL28 케모킨은, 케모킨 컨스트럭트의 용량이 불충분한지의 여부가 명확하지 않다고해도, 비장 또는 폐(IFN- γ ICS를 기준으로 함)에서 RSV-F DNA 예방접종 후 CD8 및 CD4 T 세포 면역 반응을 향상시키는 것으로 여겨지지 않았다.
CCL20 면역 아쥬반트를 제공받은 동물은 RSV-F DNA 예방접종 후 Th1 면역 반응(주로 IgG2a)에 대해 중 편향(heavy bias)을 나타내었다. Th2로부터 Th1을 향한 면역 반응의 구동은 RSV 감염 후 백신-연관된 향상된 질환을 피하는데유용할 수 있다.
실시예 4
위에 나타낸 바와 같이, CCL20을 인코딩하는 코딩 서열의 투여는 우선적인 Th1 면역 반응을 초래하고 Th2 면역 반응은 초래하지 않는다. CCL20 투여의 이러한 특성은, Th1 면역 반응이 증가하고 Th2 면역 반응이 감소하는 이동이 바람직한 다른 표적에 대한 백신 아쥬반트 및 면역치료제 둘다의 측면에서 유용할 수 있다.
예를 들면, CCL20 또는, CCL20을 인코딩하는 핵산 분자의 투여는 Th2 면역반응에 의해 특징화되는 자가면역 질환 또는 염증 상태를 지닌 개인을 치료하는데 유용할 수 있다. 본원에 나타낸 바와 같이 Th2 면역 반응을 감소시키는 능력을 사용하여 실시예를 포함하는 특정의 자가면역 질환 또는 염증 상태와 연관된 Th2 면역 반응을 감소시킬 수 있다.
또한, CCL20을 본원에 기술된 바와 같은 백신 아쥬반트로서 다른 감염 질환 및 암을 표적화하는 백신과 함께 사용할 수 있다. 백신 아쥬반트로서 CCL20의 사용과 연관된 Th1 증가/Th2 감소 특성이 백신 속에서 유용할 수 있다. 서열 번호:18 및 서열 번호: 20은 IgE 신호 펩타이드를 인코딩하는 코딩 서열의 존재 및 부재하에서 CCL20에 대한 고 발현 코딩 서열을 함유한다. 일부 구현예에서, 서열 번호: 18은 출발 코돈을 추가로 포함한다. 서열 번호: 19 및 서열 번호: 21은 IgE 신호 펩타이드를 인코딩하는 코딩 서열의 존재 및 부재하에서 CCL20에 대한 공통 서열을 함유한다. 일부 구현예에서, 서열 번호: 19는 N 말단; 메티오닌을 추가로 포함한다.
실시예 5
TZM-bl 세포에서 루시퍼라제 리포터 유전자 검정은 분자적으로 클로닝된 Env-슈도형 바이러스를 사용한 1회-라운드 감염을 기본으로 한다. TZM-bl (JC53-bl)은 CD4, CXCR4 및 CCR5를 발현하며 Tat-유도성 Luc 및 β-Gal 리포터 유전자를 발현하는 유전적으로 가공된 HeLa 세포이다. 당해 검정은 1회 라운드 감염에서 높은 성공율, 증가된 검정 능력(2-일 검정), 증가된 정밀도(50% 중화를 정밀하게 측정), 개선된 표준화 수준(안정한 세포주), 및 최적의 및 입증된 검정 플랫폼을 제공한다. 본원에 참조로 통합된 문헌[참조: Montefiori, D.C. (2004) Current Protocols in Immunology, John Wiley & Sons, 12.11.1-12.11.15]은 당해 검정을 기술하였다.
도 10은 TZM-BL 세포 / "ON"에서 Env-슈도형 바이러스를 나타낸다.
도 11은 TZM-BL 세포 / "OFF"에서 Env-슈도형 바이러스를 나타낸다.
도 12는 293T에서 RSV-융합 슈도형 바이러스 생산을 나타낸다.
도 13은 검정을 사용한 RSV-F 중화 연구에 사용된 면역화 프로토콜을 나타낸다.
도 14는 상이한 표적 세포에서 RSV-F 매개된 감염의 정량화로부터의 데이터를 나타낸다. RSV-F 단백질을 지닌 슈도형의 감염성. 슈도형 바이러스를 펠렛화하고 입자 양은 HIV p24 항원을 정량화하여 평가하였다. 세포를 슈도형 바이러스 또는 10ng의 입자화된 HIV p24 항원을 함유하는 다양한 세포주의 패널을 지닌 비 엔벨로프(no envelope)로 감염시켰다. 72 h 감염 후에, 세포 상층액을 p24 항원에 대해 검정하였다. 값은 3개의 웰의 평균과 표준 편차이다.
도 15는 TZM-bl HeLa 세포에서 RSV-F 중화 활성의 정량화로부터의 데이터를 나타낸다. 데이터는, 표적 세포에 도입하여 이를 감염시키는 HIV-Luc/FMDV 슈도바이러스를 차단시킬 수 있는 DNA 예방접종된 동물로부터의 RSV-F 면역화된 혈청 샘플로부터의 루시퍼라제 검정을 사용하는 RSV-F에 대한 중화 능력의 비교 결과를 나타낸다. 역가는 바이러스의 50%를 억제하는 혈청의 상호간 희석으로 정의한다. 정상 마우스 혈청(NMS)에서 이러한 차단의 부재하에서 예방접종된 마우스로부터의 혈장 샘플의 HIV-1 Luc/RSV-F의 감염성을 중화시키고 차단하는 능력.
도 16은 HeLa 세포내에서 RSV-F 슈도 바이러스에 의한 세포 사멸 활성의 정량화로부터의 데이터를 나타낸다. 상기 결과는, 공통 RSV-F DNA 플라스미드가 전기천공을 사용한 3회의 예방접종 후 마우스내에서 강력한 체액성 및 세포 면역 반응을 유발함을 나타낸다. 혈청 중 고 수준의 RSV-F 특이적인 IgG가 바로 5 ug의 DNA를 사용한 2 번째 면역화 후 일찍 관찰되었다. 세포-매개된 면역 반응은 3 번째 면역화 후 8주로서 늦게 검출가능하였으며, 이는 RSV-F DNA 예방접종 후 면역 반응의 장기간 지속성을 제안한다. RSV-F DNA 농도에 있어서의 증가는 증가된 면역 반응을 생성하지 않았다. RSV-F DNA와 전치천공을 사용한 3회의 예방접종 후 생성된 항체는 슈도-바이러스 중화 검정에 의해 측정된 것으로서 감염을 중화시킬 수 있었다. 결과는 또한 표적 세포의 완화된 RSV-F 매개된 세포자멸사를 나타내었다.
실시예 6
도 17은 수행된 RSV-M2 용량 연구에 대한 면역화 스케쥴을 나타낸다. 그러한 연구로부터 수집된 데이터는 마지막 면역화 후 1주째에 상이한 용량의 RSV-M2 백신에서 IFN-g 생산의 비교를 포함한다(도 18). 당해 결과는, 공통-계 RSV-M2 DNA 플라스미드가 전기천공을 사용한 3회 예방접종 후 마우스에서 유의적인 세포 면역 반응을 유발하였음을 나타내었다. 비장 및 폐 둘다에서 RSV-M2의 면역우세 또는 아우성 에피토프에 대해 특이적인 고 수준의 IFN-g + T 세포를 관찰하였다. 최대 면역 반응이 60 ug의 DNA로 관찰되었다(그러나, 10 ug DNA로 관찰된 것보다 훨씬 더 크지 않은 반응).
실시예 7
추가의 연구를 수행하여 DNA 면역화 후 점막 면역 반응을 향상시키기 위한 강력한 면역 아쥬반트로서 CCL20을 평가하기 위해 수행하였다. CCL20(간 활성화 조절된 케모킨-LARC; 대식구 염증 단백질 3 - MIP3a)은 CCR6에 결합하여 림프절, 간, 맹장, 태아 폐에서 발현된다(가슴샘, 고환, 전립샘, 및 위에서 보다 낮은 수준).
도 19는 CCL20을 사용한 RSV-F 백신의 조합의 평가를 위한 면역화 스케쥴을 나타낸다.
도 20은 마지막 면역화 후 1주째에 상이한 용량의 CCL20을 사용한 비장, 간 및 폐 각각에서 IFN-g의 비교로부터의 데이터를 포함하는 연구로부터의 데이터를 나타낸다.
도 21은 혈청에서 IgG 아형(IgG1 대 IgG2a)의 비교 데이터를 나타낸다.
결과는, CCL20을 사용한 동시-면역화가 RSV-F DNA 면역화 후 폐 및 간 둘다에서 세포-매개된 반응을 향상시키지 않음을 나타낸다. CCL20은, RSV-F 특이적인 IgG 항체가 DNA 면역화 후 Th1-동형을 향해 편향됨을 나타내었다. RSV-F만으로의 면역화와 비교하여 CCL20 + RSV-F 동시-면역화 후 혈청 속에서 보다 적은 IgG1 및 보다 많은 IgG2a가 관찰되었다.
따라서, 면역원, 특히 점막 조직을 통해 숙주로 도입되는 병원체 및 다른 제제와 관련된 것에 대해개인을 예방학적으로 및/또는 치료학적으로 면역화시키고, 점막 면역 반응을 포함하는, 이러한 면역 반응을 유도하는 개선된 백신, 개선된 방법이 제공된다. 예를 들면, 감염제는 경구 점막 및 소화관의 다른 점막, 후각 및 결막 점막과 같은 호흡관, 유선 및 비뇨생식관과 같은 점막 조직을 가로질러 숙주내로 일반적으로 도입된다.
CCL20을 인코딩하는 핵산 서열 및 기능성 단편과 함께 면역원을 인코딩하는 핵산 서열을 포함하는 조성물이 제공된다. 상기 조성물은 면역원 및 CCL20과 이의 기능성 단편 둘 다를 인코딩하는 분리된 핵산 분자 및/또는 CCL20을 인코딩하는 분리된 핵산 및 이의 기능성 단편과 함께 면역원을 인코딩하는 분리된 핵산 분자를 포함하는 조성물을 포함할 수 있다. 이러한 조성물은 주사가능한 약제로서 제공될 수 있다.
상기 조성물은 이러한 조성물을 개인에게 투여함을 포함하여, 면역원에 대해 개인에서 면역 반응을 유도하는 방법에 사용될 수 있다.
조절 성분에 작동적으로 연결된 면역원을 인코딩하는 뉴클레오타이드 서열 및, CCL20 또는 이의 기능성 단편을 인코딩하는 뉴클레오타이드 서열을 포함하는 재조합체 백신이 이러한 재조합체 백신을 개인에게 투여함을 포함하여 면역원에 대해 개인에서 점막 면역 반응을 유도하는 방법을 포함하는, 면역 반응을 유도하는 방법과 같이 제공된다.
살아있는 약독화된 병원체를 개인에게 투여함을 포함하여 병원체에 대해 개인에서 점막 면역 반응을 유도하는 방법을 포함하여, 면역 반응을 유도하는 방법, 및 CCL20 또는 이의 기능성 단편을 인코딩하는 뉴클레오타이드 서열을 포함하는 살아있는 약독화된 병원체가 또한 제공된다.
상기 개인에게 CCL20 단백질 또는 이의 기능성 단편을 면역원을 인코딩하는 분리된 핵산 분자와 함께 투여함을 포함하여 면역원에 대해 개인에서 면역 반응을 유도하는 방법; 및/또는 면역원 및/또는 살아있는 약독화된 백신 및/또는 사멸된 백신을 포함하는 소단위 백신 및/또는 면역원을 인코딩하는 재조합체 백신. 면역원을 인코딩하는 하나 이상의 분리된 핵산 분자와 함께 CCL20 단백질 또는 이의 기능성 단편을 포함하는 조성물; 조절 성분에 작동적으로 연결된 면역원을 인코딩하는 뉴클레오타이드 서열을 포함하는 재조합체 백신; 살아있는 약독화된 병원체; 및 사멸된 병원체가 제공된다. 본원에 사용된 것으로서, "CCL20의 기능성 단편"은, 면역원과 함께 전달되는 경우, 면역원이 단편의 부재하에 전달되는 경우 유도된 면역 반응과 비교하여 변형된 면역 반응을 제공하는 iCCl20 단백질이 단편을 말함을 의미한다. 단편은 일반적으로, 길이가 10개 이상의 아미노산이다. 일부 구현예에서, CCL20의 기능성 단편은 특수한 완전한 길이의 CCL20 단백질의 길이의 20% 이상, 25% 이상, 30% 이상, 35% 이상, 40% 이상, 45% 이상, 50% 이상, 55% 이상, 60% 이상, 65% 이상, 70% 이상, 75% 이상, 80% 이상, 85% 이상, 90% 이상, 91% 이상, 92% 이상, 93% 이상, 94% 이상, 95% 이상, 96% 이상, 97% 이상, 98% 이상, 99% 이상을 포함할 수 있다.
면역원과 함께 전달되는 경우, CCL20 및 이의 기능성 단편, 및 이의 조합은 면역 반응을 조절한다. 따라서, 이들 단백질의 조합은 치료학적 또는 예방학적 면역 반응을 유도하기 위한 DNA 또는 단백질계 백신의 요소로서 또는 면역 반응을 유도하는데 유용한 조성물로 전달될 수 있다. 일부 구현예에서, 면역원을 전달하기 위한 수단은 DNA 백신, 재조합체 백신, 단백질 소단위 백신, 약독화된 백신 또는 사멸된 백신이다. 일부 구현예에서, 하나 이상의 CCL20 및 이의 기능성 단편을 전달하기 위한 수단은 DNA 백신, 재조합체 백신 또는 약독화된 백신 속에 포함된 코딩 서열의 발현에 의한다.
면역 반응은 항원 특이적인 항체 및/또는 항원 특이적인 T- 및 B-세포의 생산을 초래한다. 항원 특이적인 항체 및/또는 세포는 감염에 대해 보호하고, 존재하는 감염을 감소시키거나 제거하기 위한 수단을 제공한다. 이들은 또한 개인으로부터 분리되어 수동적 면역성 프로토콜, 면역컬럼과 같은 다른 적용에서 또는 시약으로서 사용될 수 있다.
일부 구현예에서, CCL20은, 조성물이 전신계로 전달되는 경우의 프로토콜에서조차, 점막 면역 반응, 특히 증거된 IgG2a 반응 및 감소된 IgG1 반응을 특징으로 하는 증가된 Th1 반응을 유도하는데 유용하다. DNA 백신 또는 다른 수단 플라스미드와 하나 이상의 이들 케모킨에 의한 것과 같은 면역원의 동시-면역화, 예를 들면, DNA 백신 또는 다른 유형의 백신의 코딩 서열의 일부는 유일한 아쥬반트 특성을 제공할 것이다.
CCL20 단백질 및 이를 인코딩하는 뉴클레오타이드는 천연 및 합성의 많은 공급원으로부터 수득될 수 있다. 단백질이 사용되는 일부 구현예에서, 예를 들면, 당해 분야의 통상의 기술자는 잘 공지된 기술을 사용하여 예를 들면, 단백질에 특이적으로 결합된 항체를 함유하는 면역 컬럼을 사용하여 천연 공급원으로부터 CCL20 단백질을 분리할 수 있다. 달리는, 단백질은 전기영동을 사용하여 분리하거나, 전기영동 매트릭스로부터 분리하여 예를들면, 투석으로 정제함으로써 필수적으로 순수한 단백질을 생성할 수 있다. 다른 잘 공지된 단백질 정제 기술을 사용하여 분리된, 필수적으로 순수한 단백질을 생산할 수 있다. 단백질이 사용된 일부 구현예에서, 예를 들면, 당해 분야의 통상의 기술자는, 잘 공지된 기술을 사용하여, CCL20 및 이의 기능성 단편을 인코딩하는 DNA 분자를 잘 공지된 발현 시스템에서 사용하기 위한 시판되는 발현 벡터내로 삽입할 수 있다. 천연 공급원으로부터 단백질을 분리하거나 재조합체 기술로 단백질을 생산하는 것 외에, 자동화된 펩타이드 합성기를 또한 사용하여 분리된, 필수적으로 순수한 단백질을 생산할 수 있다.
본 발명의 일부 국면에 따라서, 알레르겐, 병원체 또는 비정상의, 질환 관련 세포와 같은 면역원에 대해 개인을 예방학적으로 및/또는 치료학적으로 면역화하는 조성물 및 방법이 제공된다. 백신은 살아있는 약독화된 백신, 세포 백신, 재조합체 백신 또는 핵산 또는 DNA 백신과 같은 어떠한 유형의 백신일 수 있다. 면역원 및 하나 이상의 CL20 및 이의 기능성 단편을 인코딩하는 핵산 분자를 전달함으로써 백신에 의해 유도된 면역 반응을 조절할 수 있다.
면역원 및 CCL20을 전달하기 위한 조성물, 특히 조절 성분에 작동적으로 연결된 면역원을 인코딩하는 뉴클레오타이드 서열과 함께 조절 성분에 작동적으로 연결된 하나 이상의 CCL20 및 이의 기능성 단편을 인코딩하는 뉴클레오타이드 서열을 포함하는 하나 이상의 핵산 분자를 포함하는 것들이 제공된다. CCL20 및 면역원을 인코딩하는 핵산 서열은 동일한 분자 또는 별도의 분자 상의 것일 수 있다.
핵산 분자는 DNA 주사(또한 DNA 예방접종으로 언급됨), 재조합체 아데노바이러스, 재조합체 아데노바이러스 관련 바이러스 및 재조합체 박시니아와 같은 재조합체 벡터를 포함하는 수개의 잘 공지된 기술 중의 어느 것을 사용하여 전달할 수 있다. 일부 구현예에서, DNA 백신은 본원에 기술된 바와 같이 작제되며 본원에 기술된 바와 같이 전기천공을 사용하여 전달된다. 본원에 설정된 RSV 백신에 대한 설명은 다른 면역원과 함께 CCL20의 용도에 적용될 수 있다. DNA 백신은 미국 특허 제5,593,972호, 제5,739,118호, 제5,817,637호, 제5,830,876호, 제5,962,428호, 제5,981,505호, 제5,580,859호, 제5,703,055호, 제5,676,594호 및 여기에 언급된 우선권 출원에 기술되어 있으며, 이들 각각은 본원에 참조로 통합되어 있다. 상기 출원에 기술된 전달 프로토콜 외에, DNA를 전달하는 대안적 방법이 미국 특허 제4,945,050호 및 제5,036,006호에 기술되어 있으며, 이들 둘 다는 본원에 참조로 통합된다. 투여 경로는 근육내, 비강내, 복강내, 피내, 피하, 정맥내, 동맥내, 안내 및 경구, 및 또한 국소적으로, 경피적으로, 흡입에 의해 또는 좌제로 또는 질, 직장, 요도, 볼내 및 설하 조직과 같은 점막 조직으로를 포함하나, 이에 한정되지 않는다. 바람직한 투여 경로는 근육내, 복강내, 피내 및 피하 주사를 포함한다. 일부 구현예에서, CCL20을 인코딩하는 뉴클레오타이드 서열 또는 이의 기능성 단편은 IgE 신호 펩타이드에 연결될 수 있다. 일부 구현예에서, 면역원은 병원체 변역원, 암-관련 항원 또는 자가면역 질환과 연관된 세포에 연결된 항원이다. 본 발명은 바이러스, 원핵 및 병원성 진핵 유기체, 예를 들면, 단세포 병원성 유기체 및 다세포 기생충과 같은 모든 병원체에 대해 개인을 면역화하는데 사용될 수 있다. 본 발명은 세포를 감염시키고 바이러스, 및 임질, 리스테리아(listeria) 및 시겔라(shigella)와 같은 원핵 세포와 같이 봉입되지 않은 병원체에 대해 개인을 면역화시키는데 특히 유용하다. 또한, 본 발명은, 이들이 세포내 병원체인 생명 주기의 단계를 포함하는 원생생물 병원체에 대해개인을 면역화하는데 또한 유용하다. 병원체의 예는 다음을 포함한다: 리노바이러스(일반적인 감기의 -50% 경우에 관여), 에테로바이러스(필로바이러스, 콕사키에바이러스, 에코바이러스, 및 A형 간염 바이러스와 같은 인간 엔테로바이러스), 및 아프토바이러스(수의과; 표적 항원은 VP1, VP2, VP3, VP4, VPG를 포함한다)와 같은 피코르나바이러스 계열 속의 바이러스. 칼키바이러스(Calcivirus) 계열 속의 바이러스는 노르웍 그룹(Norwalk Group)의 바이러스(유행성위장염의 유발제)를 포함한다. 토가바이러스(Togavirus) 계열 속의 바이러스는 알파바이러스(Alphavirus): [예를 들면, 세닐리스바이러스(Senilis virus), 로쓰리버 바이러스(RossRiver virus) 및 이스턴 앤드 웨스턴(Eastern & Western), 마뇌염(Equine encephalitis)]을 포함한다. 레오바이러스(Reovirus)는 루벨라 바이러스(Rubella virus)를 포함한다. 플라리비리다에 계열 예는 뎅그열, 황열병, 일본 뇌염, 세인트 루이스 뇌염 및 진드기 기원 뇌염 바이러스를 포함한다. 웨스트 나일 바이러스(West Nile virus)[진뱅크(Genbank) NC001563, AF533540, AF404757, AF404756, AF404755, AF404754, AF404753, AF481864, M12294, AF317203, AF196835, AF260969, AF260968, AF260967, AF206518 및 AF202541) 대표적인 표적 항원: E NS5 C. C형 간염 바이러스. 코로나바이러스(Coronavirus) 계열은 감염성 기관지염 바이러스를 포함한다. 돼지 전파가능한 위장 바이러스, 돼지 헤모글루틴화 뇌척수염 바이러스, 고양이 전염성 복막염 바이러스, 고양이 장 코로나바이러스, 개 코로나바이러스, SARS 연관된 코로나바이러스, 인간 호흡기 코로나바이러스는 ~40개 경우의 일반적인 감기를 유발한다. 예 224E, OC43. 표적 항원: E1 - 또한 M 또는 매트릭스 단백질 E2로 명명됨 - 또한 S 또는 스파이크 단백질 E3로 명명됨 - 또한 BE 또는 헤마글루티닌- 엘테로즈 당단백질 N - 뉴클레오캡시드. 라브도바이러스 계열 속은 광견병과 같은 베실리오바이러스(Vesiliovirus), 리싸바이러스(Lyssavirus)를 포함한다. 표적 항원: G 단백질 N 단백질 필로비리다에 계열은 출혈열 바이러스, 예를 들면 (의학적) 마르부르그 및 에볼라 바이러스를 포함한다. 파라믹소바이러스 속은 파라믹소바이러스: 멈프스 바이러스(Mumps virus), 뉴 캐슬병 바이러스(New Castle disease virus), 모르빌리바이러스(Morbillivirus) 예를 들면, 홍역, 개홍역 바이러스, 뉴민바이러스(Pneuminvirus), 예를 들면, 호흡기 합포체 바이러스(Respiratory syncytial virus), 오르토믹소바이러스(Orthomyxovirus)를 포함한다. 인플루엔자 바이러스 계열은 분가바이러스(Bungavirus) 계열 속, 예를 들면, 분가바이러스, 캘리포니아 뇌염, LA 크로쎄(Crosse), 플레보바이러스(Phlebovirus), 예를 들면, 리프트 밸리열(Rift Valley Fever), 한타바이러스(Hantavirus), 예를 들면, 퓨레말라(puremala), 헤마하긴 열 바이러스(hemahagin fever), 나이르바이러스(Nairvirus), 지정되지 않은 분가바이러스 아레나바이러스 계열 LCM, 및 라씨열 바이러스(Lassi fever virus)를 포함한다. 레오바이러스(Reovirus) 계열 속은 레오바이러스, 로타바이러스, 오르비바이러스(Orbiviruses), 예를 들면, 콜로라도 진드기열(Colorado Tick fever), 레봄보(Lebombo), 마뇌염, 청설병(blue tongue)을 포함한다. 레트로바이러스 계열 아-계열은 온코르비리날(oncorivirinal), 예를 들면, 백혈병 바이러스, HTLVI 및 HTLVII, 렌티비리날(Lentivirinal), 예를 들면, HIV, 고양이 면역부전 바이러스, 말 감염, 및 빈혈증 바이러스를 포함한다. 스푸마비리날 파포바바이러스(Spumavirinal Papovavirus) 계열 아-계열은 폴리오마바이러스(Polyomaviruse), 예를 들면, BKU 및 JCU 바이러스, 아-계열 파필로마바이러스를 포함한다. 아드레노바이러스, 예를 들면, EX AD7, ARD., O.B., 275. 파르보바이러스(Parvovirus) 계열은 고양이 파르보바이러스, 고양이 파늘레코페니아바이러스(Feline panleucopeniavirus), 개 파르보바이러스, 돼지 파르보바이러스를 포함한다. 헤르페스바이러스 계열 아-계열은 알파-속 심플렉스바이러스 헤르페스비리두에(alpha-Genera Simplexvirus herpesviridue) HSVI(진뱅크 X14112, NC001806), HSVII (NC001798) 바리첼로비니스(Varicellovinis), 슈도라비스(pseudorabies), 바리셀라 조스터(varicella zoster)를 포함한다. 아-계열-베타 인코우데스 속 사이토메갈로바이러스, 예를 들면, 헤르페스비리두에 HCMV. 무로메갈로바이러스(Muromegalovirus) 아-계열은 림포크립토바이러스(Lymphocryptovirus), 감마-EBV-(부르키츠 림포(Burkitts lympho)), 헤프페스비리두에(herpesviridue) 속을 포함한다. 라디노바이러스 폭스바이러스 계열 아-계열 속 바리올라(Rhadinovirus Poxvirus Family Sub-Family Genera Variola)는 (스몰폭스(Smallpox)) 코르도폭스비리두에 박시니아(Chordopoxviridue Vaccinia)(카우폭스(Cowpox))(파라폭시바이러스(Parapoxivirus)) 아우이폭스바이러스(Auipoxvirus), 카프리폭스바이러스 레포리폭스바이러스(Capripoxvirus Leporipoxvirus)를 포함한다. 수이폭스바이러스(Suipoxvirus) 아-계열은 엔테모폭스비리두에 헤파드나바이러스(Entemopoxviridue Hepadnavirus)를 포함한다. B형 간염 바이러스 계열 분류되지 않은 간염 델타 바이러스. 세균 병원체는 병원성 그람-양성 콕키(pathogenic gram-positive cocci), 예를 들면, 뉴르노코칼(pneurnococcal); 스타필로코칼(staphylococcal); 및 스트렙토코칼(streptococcal)을 포함한다. 병원체 그람-음성 콕키는 메닌고코칼(meningococcal); 및 고노코칼(gonococcal)을 포함한다. 병원성 장 그람-음성 바실러스는 엔테로박테리아세아에(enterobacteriaceae); 슈도모나스(pseudomonas), 악시네토박테리아(acinetobacteria) 및 에이케넬라(eikenella), 멜리오이도시스(melioidosis); 사흐노넬라(sahnonella); 시겔로시스(shigellosis); 헤모필루스(hemophilus); 챤크로이드(chancroid); 브루셀로시스(brucellosis); 툴라레미아(tularemia); 예르시니아(yersinia)(파스테렐라(pasteurella)); 스트렙토바실루스 모르틸리포르미스(streptobacillus mortiliformis) 및 스피릴룸(spirillum); 리스테리아 모노사이토게네스(listeria monocytogenes); 에리시펠로트릭스 루시오파티아에(erysipelothrix rhusiopathiae); 디프테리아(diphtheria), 콜레라(cholera), 안트락스(anthrax); 도노바노시스(donovanosis)(그라눌로마 인구이날레(granuloma inguinale)); 및 바르토넬로시스(bartonellosis)를 포함한다. 병원성 혐기성 박테리아는 테타누스(tetanus); 보툴리즘(botulism); 다른 클로스트리디아(clostridia); 투베르쿨로시스(tuberculosis); 레프로시(leprosy); 및 다른 마이코박테리아(mycobacteria)를 포함한다. 병원성 스피로체타 질환은 매독; - 트레포네마병: 매종, 핀타(pinta) 및 풍토성 매독; 및 렙토스피라증을 포함한다. 고등 병원체 세균 및 병원성 진균에 의해 유발된 다른 감염은 방선균증; 노카르디아증; 효모균증, 분아균증, 히스토플라즈마증 및 콕시디오이데스증; 칸디다증, 아스페길루스증, 및 털공팡이증; 스포로트리코시스증; 파라콕시디오도마이코시스증(paracoccidiodomycosis), 페트리엘리디오시스증(petriellidiosis), 토롤롭시스증(torulopsosis), 균종(mycetoma), 및 색소효모균증; 및 피부사상균증(dermatophytosis)을 포함한다. 리케챠 감염은 리케챠(rickettsial) 및 리케챠증(rickettsioses)을 포함한다. 마이코플라즈마 및 클라린디아 감염의 예는 마이코플라즈마 뇌염; 림프 육아종; 앵무새병 및 출산전후 클라미디아 감염을 포함한다. 병원성 진핵세포 병원체 원생생물 및 연충류(helminthes) 및 이에 의한 감염은 아메바증(amebiasis); 말라리아; 리슈마니어증(leishmaniasis); 트리파노소마증(trypanosomiasis); 톡소플라즈마증(toxoplasmosis); 뉴모시스티스 카리니이증(pneurnocystis carinii); 바베시아증(babesiosis); 기아르디아시스(giardiasis); 선모충증(filariasis); 필라리아병(filariasis); 주혈흡충병(schistosomiasis); 선충; 디스토마류(trematodes 또는 flukes); 및 촌충류(cestode)(촌충(tapeworm)) 감염을 포함한다. 백신은 병원체 항원에 나타난 에피토프와 동일하거나 실질적으로 유사한 에피토프를 적어도 포함하는 펩타이드를 암호화하는 DNA 서열을 포함하는 DNA 컨스트럭트와 같이 제조될 수 있다. 일부 구현예에서, 병원체에 대해 개인을 면역화하는 방법은 RSV, HIV, HSV, HCV, WNV 또는 HBV에 대해 지시된다.
고증식 세포에 대해 보호성 면역 반응을 부여하는 방법은 고증식성 질환에서 특징적인 면역원 단백질로서 이용한다. 이들은 고증식성 질환으로 고생하는 개인을 치료하는 방법 및 백신에 유용하다. 고증식성 질환의 예는 모든 형태의 암 및 건선을 포함한다. 고증식성 질환에 대한 표적 단백질의 예는 myb, myc, fyn와 같은 종양유전자, 및 bcr/abl, ras, src, P53, neu, trk 및 EGRF와 같은 전좌 유전자에 의해 인코딩된 단백질인 것들을 포함한다. 표적 항원으로서 종양유전자 생성물 외에, 항암 치료 및 보호성 요법을 위한 표적 단백질은 B 세포 림프종에 의해 제조된 항체의 가변 영역 및 T 세포 림프종의 T 세포 수용체의 가변 영역을 포함하며, 이들 영역은, 일부 구현예에서 또한 자가면역 질환에 대한 표적 항원으로서 사용된다. 다른 종양-관련 단백질을 모노클로날 항체 17-IA에 의해 인식된 단백질 및 엽산 결합 단백질 또는 PSA를 포함하는 종양 세포내에서 높은 수준으로 발견되는 단백질과 같은 표적 단백질로서 사용될 수 있다. 세포 수용체 및 "자가"-지시된 항체를 생산하는 세포를 포함하는 자가면역성과 관련된 표적에 대해 광범위한 기본 보호성 면역 반응을 부여함으로써 자가면역 질환 또는 장애로 고생하는 개인을 치료하는 방법이 또한 제공된다. T 세포 매개된 자가면역 질환은 류마티스 관절염(RA), 다발 경화증(MS), 소그렌 증후군, 유육종증, 인슐린 의존성 진성 당뇨병(1DDM), 자가면역 갑상선염, 반응성 관절염, 강직성 척추염, 경피증, 다발근육염, 피부근염, 건선, 맥관염, 베게너 육아종증, 크론 질환 및 궤양성 대장염을 포함한다. 이들 질환 각각은 내인성 항원에 결합하여 자가면역 질환과 관련된 염증성 캐스캐이드를 개시하는 T 세포 수용체에 의해 특징화된다. T 세포의 가변 영역에 대한 백신접종은 CTL을 포함하는 면역반응을 유발하여 상기 T 세포를 제거할 것이다. RA에서, 질환에 관여하는 T 세포 수용체(TCR)의 특수한 가변 영역이 특성화되어 왔다. 이들 TCR들은 Vβ-3, Vβ-14, 20 Vβ-17 및 Vα-17을 포함한다. 따라서, 적어도 하나의 이들 단백질들을 인코딩하는 DNA 컨스트럭트를 사용한 예방접종은 RA에 관여된 T 세포를 표적화할 면역 반응을 유발할 것이다. 참조: Howell, M. D., 등, 1991 Proc. Nat. Acad. Sci. USA 88:10921-10925; Piliard, X., 등, 1991 Science 253:325-329; Williams, W. V., 등, 1992 J Clin. Invest. 90:326-333; 이들 각각은 본원에 참조로 통합된다. MS에서, 당해 질환에 관여하는 TCR의 수개의 특수 가변 영역은 특성화되어 있다. 이들 TCR들은 VfP 및 Vα-10을 포함한다. 따라서, 이들 단백질들 중 적어도 하나를 인코딩하는 DNA 컨스트럭트를 사용한 예방접종은 MS에 관여된 T 세포를 표적화할 면역 반응을 유발할 것이다. 각각이 참고로써 본원에 통합되어 있는 문헌[Wucherpfennig, K. W., 등, 1990 Science 248:1016-1019; Oksenberg, J. R., 등, 1990 Nature 345:344-346]을 참고한다. 경피증에서, 당해 질환에 관여된 TCR의 몇가지 특수 가변 영역은 특성화되어 있다. 이들 TCR들은 Vβ-6, Vβ-g, Vβ-14 및 Vα-16, Vα-3C, Vα-7, Vα14, Vα-15, Vα-16, Vα-28 및 Vα-12를 포함한다. 따라서, 이들 단백질들 중 적어도 하나를 인코딩하는 DNA 컨스트럭트를 사용한 예방접종은 경피증에 관여한 T 세포를 표적화할 면역 반응을 유발할 것이다. T 세포 매개된 자가면역 질환, 특히 TCR의 가변 영역이 아직 특성화되지 않은 질환으로부터 고통받는 환자를 치료하기 위해, 활막 생검이 수행될 수 있다. 존재하는 T 세포의 샘플을 취할 수 있고 상기 TCR의 가변 영역은 표준 기술을 이용하여 확인된다. 유전 백신은 당해 정보를 사용하여 제조할 수 있다. B 세포 매개된 자가면역 질환은 루푸스(SLE), 그레이브스병, 중증 근무력증, 자가면역성 용혈성 빈혈, 자가면역 저혈소판증, 천식, 크리오글로불리네이니아(cryoglobulineinia), 원발성 담즙 경화증(primary biliary sclerosis) 및 악성 빈혈을 포함한다. 당해 질환 각각은 내인성 항원에 결합하여 자가면역 질환과 관련된 염증성 캐스캐이드를 개시하는 항체에 의해 특징화된다. 항체의 가변 영역에 대한 백신접종은 CTL을 포함하는 면역 반응을 유발하여 상기 항체를 생산하는 B 세포를 제거할 것이다.
B 세포 매개된 자가면역 질환으로부터 고통받는 환자를 치료하기 위해, 자가면역 활성과 연관된항체의 가변 영역이 확인되어야만 한다. 생검을 수행할 수 있고 염증 부위에 존재하는 항체의 샘플을 취할 수 있다. 상기 항체의 가변 영역은 표준 기술을 이용하여 확인될 수 있다. 유전 백신은 당해 정보를 사용하여 제조할 수 있다. SLE의 경우에, 하나의 항원은 DNA인 것으로 여겨진다. 따라서, SLE에 대해 면역화될 환자에서, 그들의 혈청을 대상으로 항-DNA 항체가 스크리닝될 수 있고 혈청에서 발견된 상기 항-DNA 항체의 가변 영역을 인코딩하는 DNA 컨스트럭트를 포함하는 백신이 제조될 수 있다. TCR 및 항체 모두의 가변 영역 간의 공통된 구조적 특징들은 잘 알려져 있다. 특정 TCR 또는 항체를 인코딩하는 DNA 서열은 참고로써 본원에 통합되어 있는 문헌[Kabat, 등 1987 Sequence of Proteins of Immunological Interest U.S. Department of Health and Human Services, Bethesda Md.]에 기술된 것과 같은 잘 알려진 방법에 따라 일반적으로 발견될 수 있다. 또한, 항체로부터 기능적 가변 영역을 클로닝하는 일반적인 방법은 본원에 참고로 통합되어 있는 문헌 [Chaudhary, V. K., 등, 1990 Proc. Natl. Acad Sci. USA 87:1066, 이는 본원에 참조로 통합되어 있다]에서 찾을 수 있다.
CCL20 단백질 코딩 서열의 발현가능한 형태를 사용하여 DNA 백신을 개선시키는 것 외에, CCL20 단백질 또는 이의 기능성 단편 및/또는 CCL20 또는 이의 기능성 단편을 인코딩하는 코딩 서열을 포함하는 항원 및 소단위를 인코딩하는 외부 유전자를 전달하기 위해 재조합체 벡터를 사용하는 개선된 백신, 개선된 사멸 백신 및 개선된 약독화된 생 백신이 제공된다. 약독화된 생 백신, 재조합체 벡터를 사용하여 외부 항원을 전달하는 것, 소단위 백신 및 당단백질 백신의 예는 미국 특허 제4,510,245호; 제4,797,368호; 제4,722,848호; 제4,790,987호; 제4,920,209호; 제5,017,487호; 제5,077,044호; 제5,110,587호; 제5,112,749호; 제5,174,993호; 제5,223,424호; 제5,225,336호; 제5,240,703호; 제5,242,829호; 제5,294,441호; 제5,294,548호; 제5,310,668호; 제5,387,744호; 제5,389,368호; 제5,424,065호; 제5,451,499호; 제5,453,364호; 제5,462,734호; 제5,470,734호; 제5,474,935호; 제5,482,713호; 제5,591,439호; 제5,643,579호; 제5,650,309호; 제5,698,202호; 제5,955,088호; 제6,034,298호; 제6,042,836호; 제6,156,319호 및 제6,589,529호에 기술되어 있으며, 이들은 각각 본원에 참조로 통합되어 있다.
실시예 8
RSV 면역원 F, G(A) 및 G(B)의 공통 서열을 사용하여 중화 면역 반응을 수득하는 기준을 제공한다. 이러한 장점은, 공통 RSV DNA 백신을 과거에 제안된 어떠한 다른 시도보다 훨씬 더 유리하고 잠재적으로 보다 효율적이 되도록 한다.
주요 RSV 단백질 - 융합(F), 당단백질(Ga), 및 당단백질(Ga)을 신규 RSV 백신에 대한 표적으로서 선택하였다. 위에서 언급한 바와 같이, F 및 G 단백질은 표면에서 발현되며 중화 항체에 대한 이상적인 표적이다. 공통 RSV-F를 인코딩하여 이를 발현하는 서열을 갖는 플라스미드, 공통 RSV-G(A)를 인코딩하고 이를 발현하는 서열을 갖는 플라스미드 및 공통 RSV-G(B)를 인코딩하고 이를 발현하는 서열을 갖는 플라스미드를 포함하는 콕테일 DNA 백신이 제조되었다. 개개 플라스미드 및 콕테일이 연구에 사용되었다. 콕테일 백신은 토끼 및 비-인간 영장류를 사용한 연구에서 사용하였으며 이들 연구의 결과는, 고수준의 중화 면역 반응이 유도되며, 이는, 콕테일 백신이 RSV 감염에 대해 보호하는데 있어 특수한 값으로 예방학적 및 치료학적 적용 둘 다에서 사용될 수 있음을 나타낸다.
도 22a, 도 22b 및 도 22c에 나타낸 바와 같이, RSV-F, RSV-G(A), 및 RSV-G(B) 각각에 대한 단일의 삽입체 플라스미드는 pVAX 벡터를 사용하여 작제하였다. 각각의 개개 플라스미드에 대한 공통 서열은 pVAX 벡터내 BamHI와 XhoI 부위 사이에 클로닝하였다. 수득되는 플라스미드는: pVAX내로 클로닝되어 4812개 염기쌍을 생산하는 공통 RSV-F를 인코딩하는 1813개 염기쌍을 포함하는, pRSV-F; pVAX내로 클로닝되어 3944개 염기쌍을 생산하는 공통 RSV-G(A)를 인코딩하는 945개 염기쌍 삽입물을 포함하는, pRSV-G(A) 및 pVAX내로 클로닝되어 3929개 염기쌍을 갖는 플라스미드를 생산하는 공통 RSV-G(B)를 인코딩하는 930개 염기쌍 삽입물을 포함하는 pRSV-G(B)이다.
RSV-F, RSV-G(A), 및 RSV-G(B) 컨스트럭트의 발현을 확인하기 위해, RD 세포를 pRSV-F, pRSV-G(A) 및 pRSV-G(B) 각각으로 형질감염시켰다. 면역형광성 평가는 면역화되고, 혼주된 토끼 혈청을 사용하여 수행하였다. RSV 면역원은 플루오레세인 이소티오시아네이트(FITC)로 화학적으로 접합시킨 항-RSV 면역원을 결합시킴으로써 면역형광성으로 가시화하였다. DAPI는 핵 역염색으로 사용하였다. 도 23에서의 결과는, Pvax로 형질감염시킨 RD 세포가 FITC 표지된 항-RSV 면역원 항체에 의해면역염색되지 않음을 나타내었다.
RSV-F 용량 연구는 마우스를 사용하여 수행하였다. 면역화 스케쥴은 도 24에 나타낸다. 마우스의 5개 그룹을 사용하였다. 그룹 1은 pVAX를 주사한 대조군이었다. 그룹 2는 5μg의 pRSV-F 컨스트럭트로 주사하였다. 그룹 3은 15μg의 pRSV-F 컨스트럭트로 주사하였다. 그룹 4는 30μg의 pRSV-F 컨스트럭트로 주사하였다. 그룹 5는 60μg의 pRSV-F 컨스트럭트로 주사하였다. 동물을 전기천공을 사용하여 총 3회 면역화하였다: 0주째에 제1 면역화, 2주째에 제2 면역화 및 4주째에 제3 면역화. 혈청을 수집하고 IgG를 총 4회 측정하였다: 2주째에 제1 수집, 4주째에 제2 수집, 6주째에 제3 수집 및 12주째에 제4 수집. 동물을 12주째에 희생시키고, 비장을 수거하고 IFN-감마를 ELISPOT을 통해 측정하였다.
도 25는 혈청 속에서 전체 RSV-F IgG를 비교한 RSV-F로부터의 데이터를 나타낸다. 데이터는 면역화 #1 후, 면역화 #2 후, 및 면역화 #3 후 수집된 혈청으로부터 나타낸다. 항-RSV-F IgG는 10, 100, 1,000 및 10,000의 상호간 혈청 희석에서 측정하였다. 데이터는, pVAX가 어떠한 면역화 후에 항체를 유도하지 않았음을 나타낸다. 데이터는, pRSV-F작제물이 제1 면역화 후 항체를 유도하지 않았음을 나타낸다. 데이터는, pRSV-F작제물이 제2 및 제3의 면역화 후 항체를 유도하였음을 나타낸다.
도 26은 최종 면역화 후 대략 8주째에 RSV-F 예방접종에 의해 유도된 IFN-γ 생산을 비교하는 RSV-F 용량으로부터의 데이터를 나타낸다. 데이터는 pVAX 및 15 μg의 평균 투여량의 pRSV-F 작제물을 주사한 동물로부터의 IFN-γ 생산 (SFU/106개의 비장 세포)을 비교하여 나타낸다.
RSV-F PSEUDO 중화 연구는 마우스를 사용하여 수행하였다. 면역화 스케쥴은 도 27에 나타낸다. 마우스를 15μg의 pRSV-F 컨스트럭트로 면역화시켰다. 동물을 전기천공을 사용하여 총 3회 면역화하였다: 0주째에 제1 면역화, 2주째에 제2 면역화 및 4주째에 제3 면역화. 혈청을 수집하고 중화 검정을 5주째에 수행하였다.
RSV-F PSEUDO 중화 연구로부터의 데이터는 도 28에 나타낸다. TZM-bl HeLa 세포에서 RSV-F 슈도-형 중화 활성을 정량화였다. 표적 세포로 도입되어 이를 감염시키는 HIV-Luc/RSV-F 슈도바이러스를 차단할 수 있는 DNA 예방접종된 동물로부터의 RSV-F 면역화된 혈청 샘플로부터 루시퍼라제 검정을 사용한 RSV-F의 중화 능력의 비교. 역가는 바이러스의 50%를 억제하는 혈청의 상호간 희석으로 정의한다. 예방접종된 마우스로부터의 혈청 샘플이 정상 마우스 혈청(NMS)에서 이러한 차단 활성의 부재하에서 HIV-Luc/RSV-F의 감염성을 중화시키고 차단하는 능력에 주목한다.
도 29에 나타낸 바와 같이, 2개의 비교를 pRSV-F(RSV-F2 및 RSV-F5)로부터의 혈청 대 pVAX 예방접종된 동물로부터의 혈청을 사용하여 수행함으로써 HeLa 세포내에서 RSV-F 슈도바이러스에 의한 세포자멸사 세포 사멸 활성의 억제를 측정하였다. 각각의 비교를 위해, 혈청을 1:1, 1:10, 1:100 및 1:1000로 희석하였다. 백분율로서 표현된 세포 사멸의 수준을 측정하였으며 pRSV-F로 예방접종된 동물로부터의 혈청이 혈청의 존재하에서 RSV-F 슈도바이러스에 노출된 HeLa 세포의 세포자멸성 세포 사멸을 억제하였음을 나타낸다.
RSV-G(A) 및 RSV-(B) 용량 연구를 마우스를 사용하여 수행하였다. 면역화 스케쥴은 도 30에 나타낸다. 마우스 6개 그룹을 사용하였다. 그룹 1은 pVAX를 주사한 대조군이었다. 그룹 2는 1μg의 pRSV-G(A) 또는 pRSV-G(B) 컨스트럭트를 주사하였다. 그룹 3은 5μg의 pRSV-G(A) 또는 pRSV-G(B) 컨스트럭트를 주사하였다. 그룹 4는 10μg의 pRSV-G(A) 또는 pRSV-G(B) 컨스트럭트를 주사하였다. 그룹 5는 20μg의 pRSV-G(A) 또는 pRSV-G(B) 컨스트럭트를 주사하였다. 그룹 6은 40μg의 pRSV-G(A) 또는 pRSV-G(B) 컨스트럭트를 주사하였다. 동물을 전기천공을 사용하여 총 3회 면역화하였다: 0주째에 제1 면역화, 2주째에 제2 면역화 및 4주째에 제3 면역화. 혈청을 수집하고 IgG를 총 2회 측정하였다: 4주째에 제1 수집, 및 6주째에 제2 수집.
도 31은 RSV(A) 또는 RSV-G(B) 용량 연구에서 RSV-G(A) DNA 면역화 후 혈청 속의 IgG에 대한 데이터를 나타낸다. 혈청 속의 총 항-RSV-G(A) IgG를 용량 연구로부터 측정하였다. 데이터는 도 31에서 그래프의 x-축에 설정된 바와 같은 다양한 투여량에서 수집한 혈청으로부터나타낸다. 항 -RSV-G(A) IgG를 1:100의 혈청 희석에서 측정하였다.
도 32는 RSV(A) 또는 RSV-G(B) 용량 연구에서 RSV-G(B) DNA 면역화 후 혈청 속의 IgG 에대한 데이터를 나타낸다. 혈청 속의 전체 항 -RSV-G(B) IgG를 용량 연구로부터 측정하였다. 데이터는 도 31에서 그래프의 x-축에 설정된 바와 같은 다양한 투여량에서 수집한 혈청으로부터나타낸다. 항-RSV-G(B) IgG를 1:100의 혈청 희석에서 측정하였다.
도 33은 마우스 연구에서 모노 백신을 사용한 RSV 예비 중화 결과의 요약을 나타내는 챠트이다. 면역화 후 3일째에 수집한 혈청으로부터의 중화 역가를 측정하였다. 음성 혈청을 음성 대조군으로 사용하였다. 양성 대조군은 항-RSV 모노클로날 항체 및 항-RSV 폴리클로날 항체를 포함하였다. 중화 역가는 pRSV-F를 예방접종한 2마리의 마우스, pRSV-G(A)를 예방접종한 2마리의 마우스 및 pRSV-G(B)를 예방접종한 1마리의 마우스로부터의 혈청 및 대조군에 대해 측정하였다.
RSV 토끼 연구를 설계하고 수행하였다. RSV 토끼 연구 설계는 도 34에 나타낸다. 4마리의 암컷 뉴질랜트 백색(New Zealand white: NZW) 토끼를 pRSV-F, pRSV-G(A), 및 pRSV-G(B)를 함유하는 콕테일로 면역화시켰다. 각각의 동물에게 200 μg/플라스미드를 최종 100 μl의 용적으로 제공하였다. 동물을 근육내/전기천공 면역화를 사용하여 총 4회 면역화시켰다. 제1의 면역화는 0주째에 수행하고, 제2의 면역화는 3주째에 수행하며, 제3의 면역화는 6주째에 및 제4의 면역화는 9주째에 수행하였다. 혈액을 동물로부터 6회 수집하였다: -2주(방혈-전 - 제1의 면역화 2주 전), 0주째(제1 면역화 전방혈-전), 2주째, 5주째, 8주째 및 13주째. 혈액을 ELISA 및 바이러스 중화 검정을 사용하여 분석하였다.
토끼 연구로부터의 데이터는 도 35에 나타낸다. RSV-F에 대한 체액 면역성을 측정하였다. 방혈-전 샘플로부터의 항-RSV-F IgG는 -2주 및 0주째에 취하였고 샘플로부터의 항-RSV-F IgG는 2주째, 5주째, 8주째 및 13주째에 취하였다. 2주째에, 샘플을 수집한 동물을 1회 면역화시키고 샘플을 면역화 후 2주째에 수집하였다. 5주 째에, 샘플을 수집한 동물을 2회 면역화시키고 샘플을 제2 면역화 후 2주째에 수집하였다. 8주 째에, 샘플을 수집한 동물을 3회 면역화시키고 샘플을 제3 면역화 후 2주째에 수집하였다. 13주 째에, 샘플을 수집한 동물을 4회 면역화시키고 샘플을 제4 면역화 후 4주째에 수집하였다.
토끼 연구로부터의 데이터는 도 36에 나타낸다. RSV-G에 대한 체액 면역성을 측정하였다. 방혈-전 샘플로부터의 항-RSV-G IgG를 -2주 및 0주째에 취하고 샘플로부터의 항-RSV-G IgG를 2주째, 5주째, 8주째 및 13주째에 취하였다. 2주째에, 샘플을 수집한 동물을 1회 면역화시키고 샘플을 면역화 후 2주째에 수집하였다. 5주 째에, 샘플을 수집한 동물을 2회 면역화시키고 샘플을 제2 면역화 후 2주째에 수집하였다. 8주 째에, 샘플을 수집한 동물을 3회 면역화시키고 샘플을 제3 면역화 후 2주째에 수집하였다. 13주 째에, 샘플을 수집한 동물을 4회 면역화시키고 샘플을 제4 면역화 후 4주째에 수집하였다.
RSV 비-인간 영장류 연구를 수행하였다. 본 연구의 목적은 비-인간 영장류(NHP)에서 콕테일로 투여된 단일-삽입물 pDNA RSV 백신의 체액성 면역성을 평가하기 위한 것이다. 또한, 연구를 수행하여, 백신의 다중 부위 전달, 전기천공 방법, 및 아쥬반트를 사용한 전달과 같은 인자들이 체액성 반응의 폭을 증가시킬 수 있는지를 평가하였다. 실험을 수행하여, RSV-F, RSV-G(A), 및 RSV-G(B)에 대한 합성 DNA 백신이 고 역가의 항-RSV 항체를 자극하는지를 측정하고, RSV 콕테일로 예방접종된 동물에서 특이적인 면역 반응을 분석하며 생성된 면역 반응에서 아쥬반트 및/또는 다중 부위 전달의 효과를 평가하였다. RSV 비-인간 영장류 연구 설계는 도 37에 나타낸다. 사용된 비-인간 영장류는 히말라야 원숭이(Rhesus macaque)이었다. 당해 연구에서, 15마리의 희말라야 원숭이를 4개 그룹으로 나누었다: 3개 그룹은 각각 4마리의 동물을 포함하였고 하나의 그룹은 3마리의 동물을 포함하였다. n이 4인 그룹은 처리된 그룹이며, 즉, 이들은 예방접종되었다. n이 3인 그룹은 대조군으로서 제공된 비처리 그룹이었다. 그룹은 다음과 같이 처리하였다.
그룹 1 (n=4): 각각의 동물에게 1 mg의 RSV-F, 1 mg의 RSV-G(A), 1 mg의 RSV-G(B)의 콕테일을 투여하였으며, 혼합하여 1개 부위에 근육내 전달하였다.
그룹 2 (n=4): 각각의 동물에게 1 mg의 RSV-F, 1 mg의 RSV-G(A), 1 mg의 RSV-G(B), 1mg의 rhMEC의 콕테일을 투여하였으며, 혼합하여 1개 부위에 근육내 전달하였다.
그룹 3(n=4): 각각의 동물에게 1 mg의 RSV-F, 1 mg의 RSV-G(A), 1 mg의 RSV-G(B)의 콕테일을 투여하였으며, 1회 혼합하여 3개 부위에 피내 전달하였다.
그룹 4(n=3): 각각의 동물은 처리하지 않았다.
동물을 전기천공을 사용하여 총 3회 면역화하였다. 제1의 면역화를 1주째에 수행하였고, 제2의 면역화를 5주째에 수행하였으며 제3의 면역화를 13주째에 수행하였다. 혈액을 동물로부터 6회 수집하였다: 0주째(제1 면역화전 방혈-전), 3주째, 7주째, 15주째, 17주째 및 18주째. 혈액을 ELISA 및 바이러스 중화 검정을 사용하여 분석하였다.
도 38a 내지 도 38d는 RSV-F에 대해 측정된 체액성 면역성의 RSV 비-인간 영장류 연구로부터의 데이터를 나타낸다. 도 38a는 순수한 동물에서 RSV-F에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다. 도 38b는 1개 부위에 콕테일 백신을 근육내 제공받은 동물에서 RSV-G에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다. 도 38c는 1개 부위에 콕테일 백신과 rhMEC 컨스트럭트를 근육내 제공받은 동물에서 RSV-F에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다. 도 38d는 3개 부위에 콕테일 백신을 피내 제공받은 동물에서 RSV-F에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다. 방혈-전 샘플로부터의 항-RSV-F IgG를 0주째에 취하였고 샘플로부터의 항-RSV-F IgG는 3주째, 15주째 및 18주째에 샘플로부터 취하였다. 3주째에, 샘플을 수집한 동물을 1회 면역화하고 샘플을 면역화 후 2주째에 수집하였다. 15주째에, 샘플을 수집한 동물을 3회 면역화하고 샘플을 제3의 면역화 후 2주째에 수집하였다. 18주째에, 샘플을 수집한 동물을 3회 면역화하고 샘플을 제3의 면역화 후 5주째에 수집하였다.
도 39a 내지 도 39d는 RSV-G에 대해 측정된 체액성 면역성의 RSV 비-인간 영장류 연구로부터의 데이터를 나타낸다. 도 39a는 나이브 동물에서 RSV-G에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다. 도 39b는 1개 부위에 콕테일 백신을 근육내 제공받은 동물에서 RSV-G에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다. 도 39c는 1개 부위에 콕테일 백신과 rhMEC 컨스트럭트를 근육내 제공받은 동물에서 RSV-G에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다. 도 39d는 3개 부위에 콕테일 백신을 피내 제공받은 동물에서 RSV-F에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다. 방혈-전 샘플로부터의 항-RSV-G IgG를 0주째에 취하였고 샘플로부터의 항-RSV-G IgG는 3주째, 15주째 및 18주째에 샘플로부터 취하였다. 3주째에, 샘플을 수집한 동물을 1회 면역화하고 샘플을 면역화 후 2주째에 수집하였다. 15주째에, 샘플을 수집한 동물을 3회 면역화하고 샘플을 제3의 면역화 후 2주째에 수집하였다. 18주째에, 샘플을 수집한 동물을 3회 면역화하고 샘플을 제3의 면역화 후 5주째에 수집하였다.
도 40은 토끼 비-인간 영장류 연구에서 콕테일 백신을 사용한 RSV 예비 중화 결과의 요약을 나타내는 챠트이다. 면역화 후 3일째에 수집한 혈청으로부터의 중화 역가를 측정하였다. 음성 혈청을 음성 대조군으로 사용하였다. 양성 대조군은 항-RSV 모노클로날 항체 및 항-RSV 폴리클로날 항체를 포함하였다. 중화 역가를 대조군에 대해 및 콕테일 백신으로 예방접종된 2마리의 토끼 및 콕테일 백신으로 예방접종된 2마리의 비-인간 영장류로부터의 혈청에 대해 측정하였다. 방혈-전으로부터의 데이터는, 토끼 및 비-인간 영장류에서 중화 역가가 후 백신화를 생성하였음을 나타낸다.
도 2는 RSV M2-1 단백질의 계통수를 나타내고, 공통 RSV M2-1 단백질 아미노산 서열은 서열 번호: 4에 설정된다.
도 3은 RSVF 백신을 사용한 면역화 후 각종 시점에서 항-RSV F 단백질 IgG가 생성됨을 나타낸다.
도 4는 RSV F 백신을 사용한 면역화 후 각종 시점에서 항-RSV F 단백질 IgA의 결과를 나타낸다.
도 5는 최종 면역화 후 대략 8주째에 RSV-F 백신의 상이한 용량에서 IFN-γ 생산의 비교로부터의 결과를 나타낸다.
도 6은 비장내에서 RSV-F +/- 케모킨 면역화 후 비장내 IFN-γ+ CD8 및 CD4 T 세포의 비교로부터의 결과를 나타낸다.
도 7은 폐에서 RSV-F +/- 케모킨 면역화 후 비장내에서 IFN-γ+ CD8 및 CD4 T 세포의 비교로부터의 결과를 나타낸다.
도 8은 혈청내 IgG 종점 역가 및 혈청내 IgG 아형(IgG1 대 IgG2a)의 비교로부터의 결과를 나타낸다.
도 9는 IgG2a/IgG1 비의 비교를 나타낸다.
도 10은 TZM-BL 세포 / "ON"에서 Env-슈도형 바이러스를 나타낸다.
도 11은 TZM-BL 세포 / "OFF"에서 Env-슈도형 바이러스를 나타낸다.
도 12는 293T 세포에서 RSV-융합 슈도 바이러스 생산을 나타낸다.
도 13은 검정을 사용한 RSV-F 중화 연구에 사용된 면역화 프로토콜을 나타낸다.
도 14는 상이한 표적 세포에서 RSV-F 매개된 감염의 정량화로부터의 데이터를 나타낸다.
도 15는 TZM-bl HeLa 세포에서 RSV-F 중화 활성의 정량화로부터의 데이터를 나타낸다.
도 16은 HeLa 세포내에서 RSV-F 슈도 바이러스에 의한 세포 사멸 활성의 정량화로부터의 데이터를 나타낸다.
도 17은 수행된 RSV-M2 용량 연구에 대한 면역화 스케쥴을 나타낸다.
도 18은 마지막 면역화 후 1주째에 상이한 용량의 RSV-M2 백신에서 IFN-g 생산의 비교를 포함하는 연구로부터 수집된 데이터를 나타낸다.
도 19는 CCL20을 사용한 RSV-F 백신의 조합의 평가를 위한 면역화 스케쥴을 나타낸다.
도 20은 마지막 면역화 후 1주째에 상이한 용량의 CCL20을 사용한 비장, 간 및 폐 각각에서 IFN-g의 비교로부터의 데이터를 포함하는 연구로부터의 데이터를 나타낸다.
도 21은 혈청에서 IgG 아형(IgG1 대 IgG2a)의 비교 데이터를 나타낸다.
도 22a 내지 22c는 플라스미드 설계 및 RSV-F, RSV-G(A), 및 RSV-G(B) 컨스트럭트의 작제를 나타낸다. 도 22a는 플라스미드 설계 및 RSV-F 컨스트럭트의 작제를 나타낸다. 도 22b는 플라스미드 설계 및 RSV-G(A) 컨스트럭트의 작제를 나타낸다. 도 22c는 플라스미드 설계 및 RSV-G(B) 컨스트럭트의 작제를 나타낸다.
도 23은 RSV-F, RSV-G(A), 및 RSV-G(B) 컨스트럭트의 시험관내 발현을 확인하는 결과를 나타낸다.
도 24는 RSV-F 용량 연구를 위한 면역화 스케쥴을 나타낸다.
도 25는 RSV-F 용량 연구로부터의 IgG 데이터를 나타낸다.
도 26은 RSV-F 용량 연구로부터의 IFN-γ 데이터를 나타낸다.
도 27은 RSV-F PSEUDO 중화 연구를 위한 면역화 스케쥴을 나타낸다.
도 28는 RSV-F PSEUDO 중화 연구로부터의 데이터를 나타낸다.
도 29는 HeLa 세포에서 RSV-F 슈도바이러스에 의한 세포자멸사 세포 사멸 활성의 억제를 측정하기 위한 2개의 비교로부터의 데이터를 나타낸다.
도 30은 RSV-G(A) 및 RSV-(B) 용량 연구에 대한 면역화 스케쥴을 나타낸다.
도 31은 RSV-G(A) 및 RSV-(B) 용량 연구로부터 RSV-G(A)로부터의 IgG 데이터를 나타낸다.
도 32는 RSV-G(A) 및 RSV-(B) 용량 연구로부터 RSV-G(A)로부터의 IgG 데이터를 나타낸다.
도 33은 마우스 연구에서 모노 백신을 사용한 RSV 예비 중화 결과의 요약을 나타내는 챠트이다.
도 34는 수행된 RSV 토끼 연구 설계를 나타낸다.
도 35는 RSV-F에 대해 측정된 체액성 면역성의 RSV 토끼 연구로부터의 데이터를 나타낸다.
도 36은 RSV-G에 대해 측정된 체액성 면역성의 RSV 토끼 연구로부터의 데이터를 나타낸다.
도 37은 수행된 RSV 비-인간 영장류 연구 설계를 나타낸다.
도 38a 내지 도 38d는 RSV-F에 대해 측정된 체액성 면역성의 RSV 비-인간 영장류 연구로부터의 데이터를 나타낸다. 도 38a는 순수한 동물에서 RSV-F에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다. 도 38b는 1개 부위에 콕테일 백신을 근육내 제공받은 동물에서 RSV-F에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다. 도 38c는 1개 부위에 콕테일 백신과 rhMEC 컨스트럭트를 근육내 제공받은 동물에서 RSV-F에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다. 도 38d는 3개 부위에 콕테일 백신을 피내 제공받은 동물에서 RSV-F에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다.
도 39a 내지 도 39d는 RSV-G에 대해 측정된 체액성 면역성의 RSV 비-인간 영장류 연구로부터의 데이터를 나타낸다. 도 39a는 나이브 동물에서 RSV-G에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다. 도 39b는 1개 부위에 콕테일 백신을 근육내 제공받은 동물에서 RSV-G에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다. 도 39c는 1개 부위에 콕테일 백신과 rhMEC 컨스트럭트를 근육내 제공받은 동물에서 RSV-G에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다. 도 39d는 3개 부위에 콕테일 백신을 피내 제공받은 동물에서 RSV-F에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다.
도 40은 토끼 비-인간 영장류 연구에서 콕테일 백신을 사용한 RSV 예비 중화 결과의 요약을 나타내는 챠트이다.
바람직한 구현예의 상세한 설명
발명의 하나의 국면에서, 공통 항원이 다음 중의 하나 이상을 가짐을 포함하여, 개선된 전사 및 해독을 제공하는 것이 요구된다: 전사를 증가시키기 위한 GC 성분 리더 서열; mRNA 안전성 및 코돈 최적화; 시스-작용 서열 모티프(즉, 내부 TATA-박스)가 가능한 정도까지의 제거.
발명의 일부 국면에서, 다음 중의 하나 이상을 가짐을 포함하여, 다수의 균주에 걸쳐 광범위한 면역 반응을 생성하는 공통 항원을 생성하는 것이 요구된다: 모든 가능한 완전한 길이의 서열을 혼입하고; 컴퓨터는 각각의 위치에서 가장 일반적으로 존재하는 아미노산을 이용하는 서열을 생성하고; 균주들 사이의 교차-반응성을 증가시킨다.
첨부된 서열 목록은 다양한 RSV 서열 및 구현예인 서열 번호 1 내지 16을 포함한다.
서열 번호: 1은, 출발 코돈(ATG) 또는 신호 펩타이드가 없는 RSV F를 인코딩하는 뉴클레오타이드 서열을 나타낸다.
서열 번호: 2는, 출발 코돈(ATG) 또는 신호 펩타이드에 의해 인코딩된 Met가 없는 RSV F를 인코딩하는 아미노 서열을 나타낸다.
서열 번호: 3은, 출발 코돈(ATG) 또는 신호 펩타이드가 없는 RSV M2-1을 인코딩하는 뉴클레오타이드 서열을 나타낸다.
서열 번호: 4는, 출발 코돈(ATG) 또는 신호 펩타이드에 의해 암호화된 Met가 없는 RSV M2-1을 인코딩하는 아미노 서열을 나타낸다.
서열 번호: 5는, 출발 코돈(ATG) 또는 신호 펩타이드가 없는 RSV Ga를 인코딩하는 뉴클레오타이드 서열을 나타낸다.
서열 번호: 6은 출발 코돈(ATG) 또는 신호 펩타이드에 의해 인코딩된 Met가 없는 RSV Ga를 인코딩하는 아미노 서열을 나타낸다.
서열 번호: 7은, 출발 코돈(ATG) 또는 신호 펩타이드가 없는 RSV Gb를 인코딩하는 뉴클레오타이드 서열을 나타낸다.
서열 번호: 8은, 출발 코돈(ATG) 또는 신호 펩타이드에 의해 암호화된 Met가 없는 RSV Gb를 인코딩하는 아미노 서열을 나타낸다.
서열 번호: 9는, IgE 신호 펩타이드를 인코딩하는 출발 코돈(ATG)/서열을 포함하는 RSV F를 인코딩하는 뉴클레오타이드 서열을 나타낸다.
서열 번호: 10은 출발 코돈/IgE 신호 펩타이드에 의해 암호화된 Met가 있는 RSVF를 인코딩하는 아미노 서열을 나타낸다.
서열 번호: 11은 IgE 신호 펩타이드를 인코딩하는 출발 코돈(ATG)/서열을 포함하는 RSV M2-1을 인코딩하는 뉴클레오타이드 서열을 나타낸다.
서열 번호: 12는 출발 코돈/IgE 신호 펩타이드에 의해 인코딩된 Met가 있는 RSV M2-1을 인코딩하는 아미노 서열을 나타낸다.
서열 번호: 13은 IgE 신호 펩타이드를 인코딩하는 출발 코돈(ATG)/서열을 포함하는 RSV Ga를 인코딩하는 뉴클레오타이드 서열을 나타낸다.
서열 번호: 14는 출발 코돈/IgE 신호 펩타이드에 의해 암호화된 Met가 있는 RSV Ga를 인코딩하는 아미노 서열을 나타낸다.
서열 번호: 15는 IgE 신호 펩타이드를 인코딩하는 출발 코돈(ATG)/서열을 포함하는 RSV Gb를 인코딩하는 뉴클레오타이드 서열을 나타낸다.
서열 번호: 16은 출발 코돈/IgE 신호 펩타이드에 의해 암호화된 Met가 있는 RSV Gb를 인코딩하는 아미노 서열을 나타낸다.
첨부된 서열 목록은 IgE 신호 펩타이드의 아미노산 서열인 서열 번호: 17을 포함한다.
서열 번호: 17은 IgE 신호 펩타이드의 아미노산 서열을 나타낸다.
첨부된 서열 목록은 각종 CCL20 서열 및 구현예인 서열 번호:18 내지 21을 포함한다.
서열 번호: 18은, 출발 코돈(ATG) 또는 신호 펩타이드가 없는 CCL20을 인코딩하는 뉴클레오타이드 서열을 나타낸다.
서열 번호: 19는 출발 코돈(ATG) 또는 신호 펩타이드에 의해 인코딩된 Met가 없는 CCL20를 나타낸다.
서열 번호: 20은 출발 코돈(ATG)/IgE 신호 펩타이드를 인코딩하는 서열을 포함하는 CCL20을 인코딩하는 뉴클레오타이드 서열을 나타낸다.
서열 번호: 21은 출발 코돈/IgE 신호 펩타이드에 의해 인코딩된 Met가 있는 CCL20을 나타낸다.
첨부된 서열 목록은 RSV 면역원으로부터 기원한 아미노산 서열인 서열 번호: 22 내지31을 포함한다.
서열 번호: 22는 RSV F 면역원의 T 세포 에피토프이다.
서열 번호: 23은 RSV F 면역원의 T 세포 에피토프이다.
서열 번호: 24는 RSV F 면역원의 T 세포 에피토프이다.
서열 번호: 25는 RSV F 면역원의 T 세포 에피토프이다.
서열 번호: 26은 RSV F 면역원 프로테아제 절단 부위이다.
서열 번호: 27은 RSV F 면역원 프로테아제 절단 부위이다.
서열 번호: 28은 RSV F 면역원 융합 펩타이드이다.
서열 번호: 29는 팔리비주마브에 대한 RSV F 면역원 결합 부위이다.
서열 번호: 30은 RSV M2-1 면역우세 T 세포 에피토프이다.
서열 번호: 31은 RSV M2-1 서브우세(Subdominant) T 세포 에피토프이다.
본 발명의 일부 국면에서, RSV F 면역원 및 RSV F 면역원을 인코딩하는 서열이 제공된다. 본 발명의 일부 국면에서, RSV Ga 면역원 및 RSV Ga 면역원을 인코딩하는 서열이 제공된다. 본 발명의 일부 국면에서, RSV Gb 면역원 및 RSV Gb 면역원을 인코딩하는 서열이 제공된다. RSV F 면역원을 인코딩하는 서열, RSV Ga 면역원을 인코딩하는 서열 및 RSV Gb 면역원을 인코딩하는 서열 각각을 포함하는, RSV F 면역원을 인코딩하는 서열, RSV Ga 면역원을 인코딩하는 서열 및 RSV Gb 면역원을 인코딩하는 서열을 포함하는 조성물이 제공된다.
RSV M2-1 면역원 및 RSV M2-1 면역원을 인코딩하는 서열이 또한 제공되며 다른 단백질 및/또는 핵산 서열과 함께 또는 단독으로 사용될 수 있다.
1. 정의
본 원에서 사용된 용어는 단지 특정 구현예를 설명하기 위한 것이며 제한하고자 하는 것은 아니다. 명세서 및 첨부된 청구항에서 사용된 바와 같이, 단수 형태는 문맥이 달리 명확히 지시하지 않는 한 복수의 지시대상을 포함한다.
본원에서 수치적 범위의 설명을 위해, 동일한 정도의 정확성으로 이들 사이에 각각 개재하는 숫자가 명백하게 고려된다. 예를 들면, 6-9의 범위의 경우, 6 및 9 외에도 숫자 7 및 8이 고려되며, 범위 6.0-7.0의 경우, 숫자 6.0, 6.1, 6.2, 6.3, 6.4, 6.5, 6.6, 6.7, 6.8, 6,9, 및 7.0이 명백하게 고려된다.
a. 아쥬반트
본원에 사용된 것으로서 "아쥬반트"는 DNA 플라스미드에 의해 인코딩된 하나 이상의 호흡기 합포체 바이러스(RSV.) 항원의 항원성을 향상시키기 위해 본원에 기술된 DNA 플라스미드 백신에 가해지고 이후 기술된 핵산 서열을 인코딩하는 어떠한 분자도 의미할 수 있다.
b. 항체
"항체"는 Fab, F(ab')2, Fd, 및 단쇄 항체, 디아바디, 이중특이적 항체, 이작용기 항체 및 그의 유도체를 포함하는, 클래스 IgG, IgM, IgA, IgD 또는 IgE, 또는 단편의 항체, 이의 단편 또는 유도체를 의미할 수 있다. 상기 항체는 포유동물의 혈청 샘플로부터 분리된 항체, 폴리클로날 항체, 친화도 정제된 항체, 또는 원하는 에피토프 또는 이들로부터 유래된 서열에 대해 충분한 결합 특이성을 나타내는 그의 혼합물일 수 있다.
c. 코딩 서열
본원에서 사용된 바와 같은 "코딩 서열" 또는 "인코딩 핵산"는 단백질을 인코딩하는 뉴클레오타이드 서열을 포함하는 핵산 (RNA 또는 DNA 분자)을 지칭하는 것을 의미할 수 있다. 코딩 서열은, 핵산이 투여되는 개인 또는 포유동물의 세포내에서 발현을 지시할 수 있는 프로모터 및 폴리아데닐화 신호를 포함하는 조절 성분에 작동적으로 연결된 개시 및 종료 시스날을 추가로 포함할 수 있다.
일부 구현예에서, 서열 번호: 2에 설정된 공통 RSV F 면역원의 아미노산 서열에 대한 코딩 서열은 서열 번호: 1이다. 이러한 코딩 서열은 N 말단 메티오닌을 인코딩하는 출발 코돈 또는 IgE 또는 IgG 신호 펩타이드와 같은 신호 펩타이드를 임의로 추가로 포함할 수 있다. 서열 번호: 10은 IgE 신호 펩타이드(서열 번호: 17)를 갖는 서열 번호: 2에 상응한다. 서열 번호: 9는 서열 번호: 10을 암호화한다.
일부 구현예에서, 서열 번호: 6에 설정된 공통 RSV Ga 면역원의 아미노산 서열에 대한 코딩 서열은 서열 번호: 5이다. 이러한 코딩 서열은 N 말단 메티오닌을 인코딩하는 출발 코돈 또는 IgE 또는 IgG 신호 펩타이드와 같은 신호 펩타이드를 임의로 추가로 포함할 수 있다. 서열 번호: 14는 IgE 신호 펩타이드(서열 번호: 17)를 갖는 서열 번호: 6에 상응한다. 서열 번호: 13은 서열 번호: 14를 인코딩한다.
일부 구현예에서, 서열 번호: 8에 설정된 공통 RSV Gb 면역원의 아미노산 서열에 대한 코딩 서열은 서열 번호: 7이다. 이러한 코딩 서열은 N 말단 메티오닌을 인코딩하는 출발 코돈 또는 IgE 또는 IgG 신호 펩타이드와 같은 신호 펩타이드를 임의로 추가로 포함할 수 있다. 서열 번호: 16은 IgE 신호 펩타이드(서열 번호: 17)를 갖는 서열 번호: 8에 상응한다. 서열 번호: 15는 서열 번호: 16을 인코딩한다.
서열 번호: 4에 설정된 공통 RSV M2-1 면역원의 아미노산 서열을 인코딩하는 암호화 서열, 서열 번호: 3이 또한 제공된다. 이러한 코딩 서열은 N 말단 메티오닌을 인코딩하는 출발 코돈 또는 IgE 또는 IgG 신호 펩타이드와 같은 신호 펩타이드를 임의로 추가로 포함할 수 있다. 서열 번호: 12는 IgE 신호 펩타이드(서열 번호: 17)를 갖는 서열 번호: 4에 상응한다. 서열 번호: 11은 서열 번호: 12를 암호화한다.
d. 보체
본원에 사용된 것으로서 "보체" 또는 "상보성"는, 핵산이 왓슨-크릭(Watson-Crick)(예를들면 , A-T/U 및 C-G) 또는 핵산 분자의 뉴클레오타이드 또는 뉴클레오타이드 유사체 사이의 후그스텐 염기 쌍화(Hoogsteen base pairing)를 의미할 수 있음을 의미한다.
e. 공통 또는 공통 서열
본원에 사용된 것으로서 "공통" 또는 "공통 서열"는 특수한 RSV 항원의 다수의 아형 또는 혈청형에 대해 광범위한 면역성을 유도하는데 사용될 수 있는, 특수한 RSV 항원의 다수의 아형의 정렬의 분석을 기본으로 하여 작제된, 합성 핵산 서열, 또는 상응하는 폴리펩타이드 서열을 의미할 수 있다. 공통 RSV 항원은 단백질 F, 단백질 G 및 단백질 M2의 공통 아미노산 서열을 포함할 수 있다. 공통 아미노산 서열을 인코딩하는 뉴클레오타이드 서열이 또한 제공된다. 또한, 융합 단백질과 같은 합성 항원을 조작하여 공통 서열(또는 공통 항원)을 포함할 수 있다.
공통 RSV F 면역원의 아미노산 서열은 서열 번호: 2에 설정되어 있다. 이러한 서열은 N 말단 메티오닌 또는 IgE 또는 IgG 신호 펩타이드와 같은 신호 펩타이드를 임의로 포함할 수 있다. 서열 번호: 10은 IgE 신호 펩타이드(서열 번호: 17)를 갖는 서열 번호: 2에 상응한다.
공통 RSV Ga 면역원의 아미노산 서열은 서열 번호: 6에 설정되어 있다. 이러한 서열은 N 말단 메티오닌 또는 IgE 또는 IgG 신호 펩타이드와 같은 신호 펩타이드를 임의로 포함할 수 있다. 서열 번호: 14는 IgE 신호 펩타이드(서열 번호: 17)를 갖는 서열 번호: 6에 상응한다.
공통 RSV Gb 면역원의 아미노산 서열은 서열 번호: 8에 설정되어 있다. 이러한 서열은 N 말단 메티오닌 또는 IgE 또는 IgG 신호 펩타이드와 같은 신호 펩타이드를 임의로 포함할 수 있다. 서열 번호: 16은 IgE 신호 펩타이드(서열 번호: 17)를 갖는 서열 번호: 8에 상응한다.
서열 번호: 4에 설정된 공통 RSV M2-1 면역원의 아미노산 서열이 또한 제공된다. 이러한 서열은 N 말단 메티오닌 또는 IgE 또는 IgG 신호 펩타이드와 같은 신호 펩타이드를 임의로 포함할 수 있다. 서열 번호: 12는 IgE 신호 펩타이드(서열 번호: 17)를 갖는 서열 번호: 4에 상응한다.
f. 정전류
본원에서 사용된 바와 같이 "정전류"는 조직에 전달된 전기적 펄스의 지속시간 동안, 조직 또는 상기 조직을 한정하는 세포가 받거나 경험하는 전류를 정의한다. 상기 전기적 펄스는 본원에서 기재된 전기천공 장치로부터 전달된다. 본원에 제공된 전기천공 장치가 바람직하게는 즉각적인 피드백을 갖는 피드백 요소를 갖기 때문에, 이 전류는 전기적 펄스의 존재 동안 상기 조직에서 일정한 암페어수를 유지한다. 상기 피드백 요소는 펄스의 지속시간 내내 조직(또는 세포)의 저항성을 측정할 수 있고 전기천공 장치가 그의 전기적 에너지 출력을 변경하게 할 수 있어서 (예를 들면, 전압 증가), 동일한 조직 내의 전류는 전기 펄스 내내 (대략 마이크로초), 및 펄스 내내 일정하게 유지된다. 일부 구현예에서, 상기 피드백 요소는 컨트롤러를 포함한다.
g. 전류 피드백 또는 피드백
본원에서 사용된 바와 같이 "전류 피드백" 또는 "피드백"는 상호교환적으로 사용될 수 있고 제공된 전기천공 장치의 활성 반응을 의미할 수 있으며, 이는 전극 사이의 조직 내 전류를 측정하고, 전류를 일정한 수준으로 유지하기 위해 EP 장치에 의해 전달된 에너지 출력을 변경하는 것을 포함한다. 이 일정한 수준은 펄스 시퀀스 또는 전기적 처리의 개시 전에 사용자에 의해 미리 조정된다. 상기 피드백은, 내부의 전기적 회로가 전극 사이의 조직 내 전류를 지속적으로 모니터링하고 상기 모니터링된 전류 (또는 조직 내의 전류)를 미리 조정된 전류와 비교하고 상기 모니터링된 전류를 미리 조정된 수준으로 유지시키기 위해 에너지-출력을 지속적으로 조절하므로, 상기 피드백은 상기 전기천공 장치의 전기천공 성분, 예컨대 컨트롤러에 의해 달성될 수 있다. 상기 피드백 루프는, 아날로그 폐루프 피드백이므로, 즉각적일 수 있다.
h. 분산된 전류
본원에서 사용된 바와 같이 "분산된 전류"는 본원에서 기재된 전기천공 장치의 다양한 바늘 전극 어레이로부터 전달된 전기적 전류의 패턴을 의미할 수 있으며, 여기서 상기 패턴은 전기천공될 조직의 임의의 영역 상에서 전기천공 관련된 열 스트레스의 발생을 최소화하거나 바람직하게는 제거한다.
i. 전기천공
본원에서 상호교환적으로 사용되는 "전기천공," "전기-투과화," 또는 "전기-동력학 향상"("EP")은 바이오-막에 현미경적 경로 (기공)를 유도하기 위해 막통과 전기장을 사용하는 것을 지칭할 수 있으며, 이들의 존재는 플라스미드, 올리고뉴클레오타이드, siRNA, 약물, 이온, 및 물과 같은 생체분자가 세포성 막의 한쪽 면으로부터 다른 쪽 면으로 지나가게 한다.
j. 피드백 기전
본원에서 사용된 바와 같이 "피드백 기전"는 소프트웨어 또는 하드웨어 (또는 펌웨어)에 의해 수행되는 공정을 지칭할 수 있고, 이 공정은 원하는 조직의 임피던스를 받고, 이를 현재의 값, 바람직하게는 전류와 비교하고(에너지의 펄스의 전달 전, 동안, 및/또는 이후), 미리조정된 값을 달성하기 위해 전달된 에너지의 펄스를 조절한다. 피드백 기전은 아날로그 폐루프 회로에 의해 수행될 수 있다.
k. 단편
"단편"은 특수한 RSV 항원을 인식함으로써 RSV에 대해 포유동물내에서 면역 반응을 유발할 수 있는 RSV 면역원의 폴리펩타이드 단편을 의미할 수 있다. RSV 면역원은, 각각의 경우에, 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는, RSV F 면역원, RSV M2-1 면역원, RSV Ga 면역원, RSV Gb 면역원에 대해 본원에 설정된 공통 서열, 각각의 경우에, 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는, 본원에 설정된 공통 서열에 대해 98% 이상 상동성인 단백질, 본원에 설정된 공통 서열에 대해 99% 이상 상동성인 단백질, 및 본원에 설정된 공통 서열에 대해 100% 동일한 단백질을 말한다. 단편은 예를 들면 면역글로불린 신호 펩타이드, 예를 들면, IgE 신호 펩타이드(서열 번호: 17) 또는 IgG 신호 펩타이드와 같은 신호 펩타이드에 연결된 RSV 면역원의 단편을 포함하거나 포함하지 않을 수 있다.
RSV F 공통 면역원의 단편은 각 경우에 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는, 서열 번호: 2, 서열 번호: 10, 본원에 설정된 RSV F 공통 면역원 서열에 대해 98% 이상 상동성인 단백질, 본원에 설정된 RSV F 공통 면역원 서열에 대해 99% 이상 상동성인 단백질, 또는 본원에 설정된 RSV F 공통 면역원 서열에 대해 100% 동일한 단백질의 단편일 수 있다. 이러한 단편은 첨가된 어떠한 비-RSV 신호 펩타이드도 제외된, 본원에 설정된 특수한 완전한 길이의 RSV F 공통 면역원 서열의 길이의 20% 이상, 25% 이상, 30% 이상, 35% 이상, 40% 이상, 45% 이상, 50% 이상, 55% 이상, 60% 이상, 65% 이상, 70% 이상, 75% 이상, 80% 이상, 85% 이상, 90% 이상, 91% 이상, 92% 이상, 93% 이상, 94% 이상, 95% 이상, 96% 이상, 97% 이상, 98% 이상, 99% 이상을 포함할 수 있다 단편은, 각 경우에 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는, 본원에 설정된 RSV F 공통 면역원의 서열에 대해 98% 이상, 또는 99% 이상 상동성이고 이러한 서열에 대해 100% 동일한 폴리펩타이드의 단편을 말한다. 단편은 RSV F 공통 면역원에 대해 98% 이상 상동성이거나, 99% 이상 상동성이거나, 100% 동일하고 상동성 퍼센트을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함하는 폴리펩타이드의 단편을 포함할 수 있다. 일부 구현예에서, RSV F 면역원의 단편은 서열 번호: 2의 단편을 포함할 수 있다. 단편은 면역글로불린 신호 펩타이드, 예를 들면 IgE 신호 펩타이드(서열 번호: 17) 또는 IgG 신호 펩타이드와 같은 신호 펩타이드에 연결된 서열 번호: 2의 단편을 포함할 수 있다. 따라서 일부 구현예에서, 단편은 서열 번호: 17을 포함하는 서열 번호: 10의 단편이다. 단편은 N 말단 메티오닌에 연결된 서열 번호: 2의 단편을 포함할 수 있다. 단편은 또한 서열 번호: 2에 대해 98% 이상, 또는 99% 이상 상동성인 폴리펩타이드의 단편을 말한다. 당해 단편은 서열 번호: 2에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 2에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 2에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호: 2에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. RSV F 면역원은 575 아미노산이다. 일부 구현예에서, 이의 단편은, 길이가 115개 이상의 아미노산, 길이가 163개 이상, 230개 이상, 288개 이상, 345개 이상, 403개 이상, 460개 이상, 515개 이상, 520개 이상, 525개 이상, 530개 이상, 535개 이상, 540개 이상, 545개 이상, 550개 이상, 555개 이상, 560개 이상, 565개 이상, 570개 이상, 574개 이상일 수 있다. 폴리펩타이드 단편은, 길이가 140개 아미노산 이하, 190개 미만, 250개 미만, 283개 미만, 300개 미만, 365개 미만, 425개 미만, 495개 미만, 518개 미만, 523개 미만, 528개 미만, 533개 미만, 547개 미만, 552개 미만, 563개 미만, 또는 572개 미만일 수 있다. 단편은 면역글로불린 신호 펩타이드, 예를 들면 IgE 또는 IgG 신호 펩타이드와 같은 N 말단 메티오닌 및/또는 신호 펩타이드를 추가로 포함할 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 574개 아미노산 또는 보다 작은 이의 단편에 연결될 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 574개 아미노산에 대해 98% 상동성인 폴리펩타이드 또는 574개 아미노산 서열에 대해 98% 상동성인 폴리펩타이드의 보다 작은 단편에 연결시킬 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 574개 아미노산 서열에 대해 99% 상동성인 폴리펩타이드 또는 574 아미노산 서열에 대해 99% 상동성인 폴리펩타이드의 보다 작은 단편에 연결시킬 수 있다. 상동성 정도를 계산하는데 있어서, 폴리펩타이드는 서열 번호: 2 또는 이의 단편을 가지며, N 말단 메티오닌 및/또는 어떠한 신호 펩타이드도 이러한 계산에 포함되지 않는다. 신호 펩타이드의 서열은 상동성의 측정시 사용되지 않는다. 따라서, 예를 들어, 서열 번호: 10이 신호 펩타이드 서열 번호: 17에 작동적으로 연결된 서열 번호: 2를 포함한다고 해도, 서열 번호: 10은, 신호 펩타이드가 서열 번호: 2에 부재한다고 해도, 서열 번호: 2의 단편에 대해 100% 상동성인 서열 번호: 2의 단편을 포함한다. 따라서, 서열 번호: 2의 단편에 대해 적어도 98% 상동성인 폴리펩타이드의 단편을 포함하는 단백질은, 적어도 115개 아미노산이고 예를 들면, 신호 펩타이드에 임의로 연결될 수 있는 서열 번호: 2의 단편에 대해 적어도 98% 상동성인 폴리펩타이드의 단편인 단백질을 말하는 것으로 의도된다. 서열 번호: 22, 서열 번호: 23, 서열 번호: 24, 및 서열 번호: 25는 서열 번호: 2에 설정된 RSV F 면역원의 T 세포 에피토프에 상응한다. 일부 구현예에서, 단편은 이들 서열 또는 이에 대해 98% 이상 또는 99% 이상 상동성인 서열 중 하나 이상의 모두 또는 일부를 포함한다. 서열 번호: 26 및 서열 번호: 27은 RSV F 면역원 프로테아제 절단 부위이다. 서열 번호: 28은 RSV F 면역원 융합 펩타이드이다. 서열 번호: 29는 팔리비주마브에 대한 RSV F 면역원 결합 부위이다.
RSV Ga 공통 면역원의 단편은, 각각의 경우에 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는, 서열 번호: 6, 서열 번호: 14, 본원에 설정된 RSV Ga 공통 면역원 서열에 대해 98% 이상 상동성인 단백질, 본원에 설정된 RSV Ga 공통 면역원 서열에 대해 99% 이상 상동성인 단백질, 또는 본원에 설정된 공통 서열에 대해 100% 동일한 RSV Ga 공통 면역원의 단편일 수 있다. 이러한 단편은 첨가된 어떠한 비- RSV 신호 펩타이드를 배제하고, 본원에 설정된 특히 완전한 길이의 RSV Ga 공통 면역원 서열의 길이의 20% 이상, 25% 이상, 30% 이상, 35% 이상, 40% 이상, 45% 이상, 50% 이상, 55% 이상, 60% 이상, 65% 이상, 70% 이상, 75% 이상, 80% 이상, 85% 이상, 90% 이상, 91% 이상, 92% 이상, 93% 이상, 94% 이상, 95% 이상, 96% 이상, 97% 이상, 98% 이상, 99% 이상의 백분율을 포함할 수 있다. 단편은 각각의 경우에 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는, 본원에 설정된 RSV Ga 공통 면역원의 서열에 대해 98% 이상, 또는 99% 이상 상동성이고 이러한 서열에 대해 100% 동일한 폴리펩타이드의 단편을 말한다. 단편은 RSV Ga 공통 면역원에 대해 98% 이상 상동성이거나, 99% 이상 상동성이거나, 100% 동일한 폴리펩타이드의 단편을 포함할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 일부 구현예에서, RSV Ga 면역원의 단편은 서열 번호 6의 단편을 포함할 수 있다. 단편은 면역글로불린 신호 펩타이드, 예를 들면 IgE 신호 펩타이드(서열 번호 17) 또는 IgG 신호 펩타이드와 같은 신호 펩타이드에 연결된 서열 번호 6의 단편을 포함할 수 있다. 따라서, 일부 구현예에서, 단편은 서열 번호 17을 포함하는 서열 번호 14의 단편이다. 단편은 N 말단 메티오닌에 연결된 서열 번호 6의 단편을 포함할 수 있다. 단편은 또한 서열 번호 6에 대해 98% 이상, 또는 99% 이상 상동성인 폴리펩타이드의 단편을 말한다. 단편은 서열 번호 6에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호 6에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호 6에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호 6에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. RSV Ga 면역원은 N 말단 메티오닌 및/또는 신호 펩타이드를 제외한 297개 아미노산이다. 일부 구현예에서, 이의 단편은, 길이가 125개 이상의 아미노산, 길이가 130개 이상, 140개 이상, 150개 이상, 160개 이상, 170개 이상, 180개 이상, 190개 이상, 200개 이상, 210개 이상, 220개 이상, 230개 이상, 240개 이상, 250개 이상, 260개 이상, 270개 이상, 280개 이상, 285개 이상, 290개 이상, 295개 이상일 수 있다. 폴리펩타이드 단편은, 길이가 135개 미만의 아미노산, 145개 미만, 155개 미만, 165개 미만, 175개 미만, 185개 미만, 195개 미만, 205개 미만, 215개 미만, 225개 미만, 235개 미만, 245개 미만, 255개 미만, 265개 미만, 275개 미만, 285개 미만, 288개 미만, 292개 미만, 또는 296개 미만일 수 있다. 단편은 면역글로불린 신호 펩타이드, 예를 들면 IgE 또는 IgG 신호 펩타이드와 같은 N 말단 메티오닌 및/또는 신호 펩타이드를 추가로 포함할 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 296개의 아미노산 또는 이의 보다 작은 단편에 연결될 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 296개 아미노산에 대해 98% 상동성인 폴리펩타이드 또는 296개 아미노산 서열에 대해 98% 상동성인 폴리펩타이드의 보다 작은 단편에 연결될 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 296개 아미노산 서열에 대해 99% 상동성인 폴리펩타이드 또는 296개 아미노산 서열에 대해 99% 상동성인 폴리펩타이드의 보다 작은 단편에 연결될 수 있다. 상동성의 정도를 계산하는데 있어서, 폴리펩타이드는 서열 번호: 6 또는 이의 단편을 가지며, N 말단 메티오닌 및/또는 어떠한 신호 펩타이드도 이러한 계산에 포함되지 않는다. 신호 펩타이드의 서열은 상동성의 측정시 사용되지 않는다. 따라서, 예를 들면, 서열 번호: 14가 신호 펩타이드 서열 번호 17에 작동적으로 연결된 서열 번호 6을 포함한다고 해도, 서열 번호: 14는 서열 번호: 6의 단편에 대해 100% 상동성인 서열 번호 6의 단편을 포함하며, 그럼에도 불구하고 신호 펩타이드는 서열 번호: 6속에 존재하지 않는다. 따라서, 서열 번호: 6의 단편에 대해 적어도 98% 상동성인 폴리펩타이드의 단편을 포함하는 단백질은 적어도 125개 아미노산이고 예를 들면, 신호 펩타이드에 대해 임의로 연결될 수 있는 서열 번호 6의 단편에 대해 적어도 98% 상동성인 폴리펩타이드의 단편인 단백질을 말하는 것으로 의도된다.
각각의 경우에 1번 위치에 신호 펩타이드 및/또는 메티오닌이 존재하거나 존재하지 않는, 서열 번호: 8, 서열 번호: 16에 기재되어 있는 것과 같은 RSV Gb 공통 면역원, 본원에 설정된 RSV Gb 공통 면역원 서열에 대해 98% 이상 상동성인 단백질, 본원에 설정된 RSV Gb 공통 면역원 서열에 대해 99% 이상 상동성인 단백질, 및 본원에 설정된 공통 서열에 대해 100% 동일한 RSV Gb 공통 면역원의 단편은 첨가된 어떠한 비-RSV 신호 펩타이드를 제외하고, 본원에 설정된 특수한 완전한 길이의 RSV Gb 공통 면역원 서열의 20% 이상, 25% 이상, 30% 이상, 35% 이상, 40% 이상, 45% 이상, 50% 이상, 55% 이상, 60% 이상, 65% 이상, 70% 이상, 75% 이상, 80% 이상, 85% 이상, 90% 이상, 91% 이상, 92% 이상, 93% 이상, 94% 이상, 95% 이상, 96% 이상, 97% 이상, 98% 이상, 99% 이상의 퍼센트를 포함할 수 있다. 단편은, 각 경우에 1번 위치에 신호 펩타이드 및/또는 메티오닌이 존재하거나 존재하지 않는 본원에 설정된 RSV Gb 공통 면역원의 서열에 대해 98% 이상, 또는 99% 이상 상동성 및 이러한 서열에 대해 100% 동일한 폴리펩타이드의 단편을 말한다. 단편은 RSV Gb 공통 면역원에 대해 98% 이상 상동성, 99% 이상 상동성, 또는 100% 동일한 폴리펩타이드의 단편을 포함할 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 일부 구현예에서, RSV Gb 면역원의 단편은 서열 번호: 8의 단편을 포함할 수 있다. 단편은 면역글로불린 신호 펩타이드, 예를 들면 IgE 신호 펩타이드 (서열 번호: 17) 또는 IgG 신호 펩타이드와 같은 신호 펩타이드에 연결된 서열 번호 8의 단편을 포함할 수 있다. 따라서, 일부 구현예에서, 단편은 서열 번호: 17을 포함하는 서열 번호: 16의 단편이다. 단편은 N 말단 메티오닌에 연결된 서열 번호: 8의 단편을 포함할 수 있다. 단편은 또한 서열 번호: 8에 대해 98% 이상, 또는 99% 이상 상동성인 폴리펩타이드의 단편을 말한다. 단편은 서열 번호: 8에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 8에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드과 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 8에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있고 상동성 퍼센트를 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호; 8에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. RSV Gb 면역원은 N 말단 메티오닌 및/또는 신호 펩타이드를 제외한 291개 아미노산이다. 일부 구현예에서, 이의 단편은, 길이가 125개 이상 아미노산, 길이가 130개 이상, 140개 이상, 150개 이상, 160개 이상, 170개 이상, 180개 이상, 190개 이상, 200개 이상, 210개 이상, 220개 이상, 230개 이상, 240개 이상, 250개 이상, 260개 이상, 270개 이상, 280개 이상, 285개 이상, 288개 이상일 수 있다. 폴리펩타이드 단편은, 길이가 135개 미만의 아미노산, 145개 미만, 155개 미만, 165개 미만, 175개 미만, 185개 미만, 195개 미만, 205개 미만, 215개 미만, 225개 미만, 235개 미만, 245개 미만, 255개 미만, 265개 미만, 275개 미만, 285개 미만, 288개 미만, 290개 미만일 수 있다. 단편은 면역글로불린 신호 펩타이드, 예를 들면 IgE 또는 IgG 신호 펩타이드와 같은 N 말단 메티오닌 및/또는 신호 펩타이드를 추가로 포함할 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 290개 아미노산 또는 이의 보다 작은 단편에 연결될 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 290개 아미노산에 대해 98% 상동성인 폴리펩타이드 또는 290개 아미노산 서열에 대해 98% 상동성인 폴리펩타이드의 보다 작은 단편에 연결될 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 290개 아미노산 서열에 대해 99% 상동성인 폴리펩타이드 또는 290개 아미노산 서열에 대해 99% 상동성인 폴리펩타이드의 보다 작은 단편에 연결될 수 있다. 상동성의 정도를 계산하는데 있어서, 폴리펩타이드는 서열 번호: 6 또는 이의 단편을 가지며, N 말단 메티오닌 및/또는 어떠한 신호 펩타이드도 이러한 계산에 포함되지 않는다. 신호 펩타이드의 서열은 상동성의 측정시 사용되지 않는다. 따라서, 예를 들면, 서열 번호: 16의 신호 펩타이드가 서열 번호: 17에 작동적으로 연결된 서열 번호: 8을 포함하는 경우, 서열 번호: 16은 서열 번호: 8의 단편에 대해 100% 상동성인 서열 번호: 8의 단편을 포함하며, 그럼에도 불구하고 신호 펩타이드는 서열 번호: 8 속에 존재하지 않는다. 따라서, 서열 번호: 8의 단편에 대해 적어도 98% 상동성인 폴리펩타이드의 단편을 포함하는 단백질은, 적어도 125개 아미노산이고 예를 들면, 신호 펩타이드에 대해 임으로 연결될 수 있는 서열 번호: 8의 단편에 대해 적어도 98% 상동성인 폴리펩타이드의 단편인 단백질을 말하는 것으로 의도된다.
또한, RSV M2-1 공통 면역원의 단편은, 각각의 경우에 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는 서열 번호: 4, 서열 번호: 12, 본원에 설정된 RSV M2-1 공통 면역원 서열에 대해 98% 이상 상동성인 단백질, 본원에 설정된 RSV M2-1 공통 면역원 서열에 대해 99% 이상 상동성인 단백질, 또는 본원에 설정된 공통 서열에 대해 100% 동일한 RSV M2-1 공통 면역원의 단편일 수 있다. 이러한 단편은 첨가된 어떠한 비-RSV 신호 펩타이드를 제외하고, 본원에 설정된 특수한 완전한 길이의 RSV M2-1 공통 면역원 서열의 길이의 20% 이상, 25% 이상, 30% 이상, 35% 이상, 40% 이상, 45% 이상, 50% 이상, 55% 이상, 60% 이상, 65% 이상, 70% 이상, 75% 이상, 80% 이상, 85% 이상, 90% 이상, 91% 이상, 92% 이상, 93% 이상, 94% 이상, 95% 이상, 96% 이상, 97% 이상, 98% 이상, 99% 이상의 백분율을 포함할 수 있다. 단편은, 각각의 경우에 1번 위치에 신호 펩타이드 및/또는 메티오닌이 있거나 없는, 본원에 설정된 RSV M2-1 공통 면역원의 서열에 대해 98% 이상, 또는 99% 이상 상동성이고 이러한 서열에 대해 100% 동일한 폴리펩타이드의 단편을 말한다. 단편은 RSV M2-1 공통 면역원에 대해 98% 이상 상동성, 99% 이상 상동성이거나, 100% 동일한 폴리펩타이드의 단편을 포함할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 일부 구현예에서, RSV M2-1 면역원의 단편은 서열 번호: 4의 단편을 포함할 수 있다. 단편은 면역글로불린 신호 펩타이드, 예를 들면 IgE 신호 펩타이드 (서열 번호: 17) 또는 IgG 신호 펩타이드와 같은 신호 펩타이드에 연결된 서열 번호: 4의 단편을 포함할 수 있다. 따라서, 일부 구현예에서, 단편은 서열 번호: 17을 포함하는 서열 번호: 12의 단편이다. 단편은 N 말단 메티오닌에 연결된 서열 번호: 4의 단편을 포함할 수 있다. 단편은 또한 서열 번호: 4에 대해 98% 이상, 또는 99% 이상 상동성인 폴리펩타이드의 단편을 말한다. 단편은 서열 번호: 4에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 4에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있으며 상동성 백분율을 게산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 4에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호: 4에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있으며 상동성 백분율의 계산시 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. RSV M2-1 면역원은 195개 아미노산이다. 일부 구현예에서, 이의 단편은, 길이가 25개 이상의 아미노산, 길이가 30개 이상, 40개 이상, 50개 이상, 60개 이상, 70개 이상, 80개 이상, 90개 이상, 100개 이상, 110개 이상, 120개 이상, 130개 이상, 140개 이상, 150개 이상, 160개 이상, 170개 이상, 180개 이상, 184개 이상, 190개 이상, 193개 이상일 수 있다. 폴리펩타이드 단편은, 길이가 35개 미만의 아미노산, 45개 미만, 55개 미만, 65개 미만, 75개 미만, 85개 미만, 95개 미만, 105개 미만, 115개 미만, 125개 미만, 135개 미만, 145개 미만, 155개 미만, 165개 미만, 175개 미만, 185개 미만, 188개 미만, 192개 미만, 또는 194개 미만일 수 있다. 단편은 면역글로불린 신호 펩타이드, 예를 들면 IgE 또는 IgG 신호 펩타이드와 같은 N 말단 메티오닌 및/또는 신호 펩타이드를 추가로 포함할 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 194개 아미노산 또는 이의 보다 작은 단편에 연결될 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 194개 아미노산에 대해 98% 상동성인 폴리펩타이드 또는 194개 아미노산 서열에 대해 98% 상동성인 폴리펩타이드의 보다 작은 단편에 연결될 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 194개 아미노산 서열에 대해 99% 상동성인 폴리 펩타이드 또는 194개 아미노산 서열에 대해 99% 상동성인 폴리펩타이드의 보다 작은 단편일 수 있다. 상동성 정도의 계산시 폴리펩타이드는 서열 번호: 4 또는 이의 단편, 이러한 계산에 포함되지 않는 N 말단 메티오닌 및/또는 어떠한 신호 펩타이드도 갖는다. 신호 펩타이드의 서열은 상동성의 측정시 사용되지 않는다. 예를 들면, 서열 번호: 12가 신호 펩타이드 서열 번호: 17에 작동적으로 연결된 서열 번호: 4를 포함하지만, 서열 번호: 12는 서열 번호: 4의 단편에 대해 100% 상동성인 서열 번호 4의 단편을 포함하며, 그럼에도 불구하고 신호 펩타이드는 서열 번호: 4에 존재하지 않는다. 따라서, 서열 번호 4의 단편에 대해 적어도 98% 상동성인 폴리펩타이드의 단편을 포함하는 단백질은 적어도 25개 아미노산인 서열 번호: 4의 단편에 대해 적어도 98% 상동성이고 예를 들면, 신호 펩타이드에 대해 임의로 연결될 수 있는 단백질을 말하는 것으로 의도된다. 서열 번호: 30은 서열 번호: 4에 설정된 RSV M2-1 면역원의 면역우성 T 세포 에피토프에 상응한다. 서열 번호: 31은 서열 번호: 4에 설정된 RSV M2-1 면역원의 면역우성 T 세포 에피토프에 상응하는 아우성 T 세포 에피토프를 말한다. 일부 구현예에서, 단편은 이들 서열 또는 이에 대해 98% 이상 또는 99% 이상 상동성인 서열 중 하나 이상의 모두 또는 일부를 포함한다.
"단편"은, 각각의 경우에 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는, 위에서 설정된 RSV 면역원 단편, 즉, RSV F 면역원, RSV M2-1 면역원, RSV Ga 면역원, RSV Gb 면역원, 본원에 설정된 공통 서열에 대해 98% 이상 상동성인 단백질, 본원에 설정된 공통 서열에 대해 99% 이상 상동성인 단백질, 및 본원에 설정된 공통 서열에 대해 100% 동일한 단백질을 인코딩하는 핵산 단편을 또한 의미할 수 있다. 단편은 예를 들면, N 말단 메티오닌(즉, 출발 코돈)에 대한 코딩 서열 또는 면역글로불린 신호 펩타이드 예를 들면, IgE 신호 펩타이드(서열 번호: 17) 또는 IgG 신호 펩타이드와 같은 신호 펩타이드를 인코딩하는 코딩 서열에 연결된 RSV 면역원을 인코딩하는 핵산 서열의 단편을 포함한다. RSV 면역원을 인코딩하는 코딩 서열의 단편은 첨가된 비-RSV 신호 펩타이드를 인코딩하는 어떠한 코딩 서열을 제외하고는, 본원에 설정된 특수한 완전한 길이의 RSV 면역원 서열의 코딩 서열의 길이의 20% 이상, 25% 이상, 30% 이상, 35% 이상, 40% 이상, 45% 이상, 50% 이상, 55% 이상, 60% 이상, 65% 이상, 70% 이상, 75% 이상, 80% 이상, 85% 이상, 90% 이상, 91% 이상, 92% 이상, 93% 이상, 94% 이상, 95% 이상, 96% 이상, 97% 이상, 98% 이상, 99% 이상의 백분율을 포함할 수 있다. 단편은 또한 본원에 설정된 RSV 면역원의 서열에 대해 98% 이상, 또는 99% 이상 상동성인 폴리펩타이드를 인코딩하는 코딩 서열의 단편을 말한다. 단편은 이에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 포함할 수 있으며 상동성 백분율의 계산시 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다.
일부 구현예에서, 단편은 서열 번호 1에 대해 98% 이상 상동성인 핵산 서열의 단편이다. 일부 구현예에서, 단편은 서열 번호: 1에 대해 99% 이상 상동성인 핵산 서열의 단편이다. 일부 구현예에서, 단편은 서열 번호: 1의 단편이다. 본원에 기술된 폴리펩타이드 단편을 인코딩하는 핵산 서열, 즉, 펩타이드 단편의 크기 및 상동성을 갖는 단백질을 인코딩하는 핵산 서열의 단편이 명확히 기재된 것으로 의도된다. 일부 구현예에서, 펩타이드 단편의 크기 및 상동성을 지닌 단백질을 인코딩하는 핵산 서열의 단편은 서열 번호: 1의 단편이다. 예를 들면, 서열 번호: 1 또는 서열 번호: 9와 같이, 각 경우에 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는, 서열 번호: 2, 서열 번호: 10에 기재된 것과 같은 RSV F 공통 면역원, 본원에 설정된 RSV F 공통 면역원 서열에 대해 98% 이상 상동성인 단백질, 본원에 설정된 RSV F 공통 면역원 서열에 대해 99% 상동성인 단백질, 본원에 설정된 공통 서열에 대해 100% 동일한 RSV F 공통 면역원을 인코딩하는 코딩 서열의 단편은 첨가된 어떠한 비-RSV 신호 펩타이드를 제외하고, 본원에 설정된 특수한 완전한 길이의 RSV F 공통 면역원 서열의 길이의 20% 이상, 25% 이상, 30% 이상, 35% 이상, 40% 이상, 45% 이상, 50% 이상, 55% 이상, 60% 이상, 65% 이상, 70% 이상, 75% 이상, 80% 이상, 85% 이상, 90% 이상, 91% 이상, 92% 이상, 93% 이상, 94% 이상, 95% 이상, 96% 이상, 97% 이상, 98% 이상, 99% 이상의 백분율을 포함할 수 있다. 단편은, 각 경우에 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는, 본원에 설정된 RSV F 공통 면역원의 서열에 대해 98% 이상, 또는 99% 이상 상동성이고 이러한 서열에 대해 100% 동일한 폴리펩타이드의 단편을 인코딩할 수 있다. 단편은 RSV F 공통 면역원에 대해 98% 이상 상동성, 99% 이상 상동성, 또는 100% 동일한 폴리펩타이드의 단편을 암호화할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 일부 구현예에서, RSV F 면역원을 인코딩하는 단편은 서열 번호: 2의 단편을 인코딩할 수 있고 서열 번호: 1의 단편을 포함할 수 있다. 단편은 면역글로불린 신호 펩타이드 예를 들면 IgE 신호 펩타이드 (서열 번호: 17) 또는 IgG 신호 펩타이드와 같은 신호 펩타이드에 연결된 서열 번호: 2의 단편을 인코딩할 수 있다. 따라서 일부 구현예에서, 단편은 서열 번호: 17을 포함하는 서열 번호: 10의 단편이고 서열 번호: 9에 의해 인코딩될 수 있다. 단편은 출발 코돈에 연결된 서열 번호: 1의 단편을 포함할 수 있다. 단편은 서열 번호: 2에 대해 98% 이상, 또는 99% 이상 상동성인 폴리펩타이드의 단편을 인코딩한다. 단편은 서열 번호: 2에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 2에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 2에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호: 2에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호: 1에 대해 98% 이상, 또는 99% 이상 상동성일 수 있다. 단편은 서열 번호: 1에 대해 98% 이상 상동성일 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 1에 대해 99% 이상 상동성일 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 1에 대해 98% 이상 상동성일 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호: 1에 대해 99% 이상 상동성일 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 각 경우에 출발 코돈 또는 신호 펩타이드를 인코딩하는 코딩 서열이 있거나 없는, 서열 번호: 1의 단편, 서열 번호: 1에 대해 98% 이상 상동성인 핵산 서열의 단편, 및 서열 번호: 1에 대해 99% 이상 상동성인 핵산 서열의 단편은, 길이가 115개 아미노산 이상일 수 있는 RSV F 면역원의 단편, 길이가 163개 이상, 230개 이상, 288개 이상, 345개 이상, 403개 이상, 460개 이상, 515개 이상, 520개 이상, 525개 이상, 530개 이상, 535개 이상, 540개 이상, 545개 이상, 550개 이상, 555개 이상, 560개 이상, 565개 이상, 570개 이상, 574개 이상일 수 있는 RSV F 면역원의 단편을 인코딩할 수 있다. 폴리펩타이드 단편은, 길이가 140개 아미노산 이하, 190개 미만, 250개 미만, 283개 미만, 300개 미만, 365개 미만, 425개 미만, 495개 미만, 518개 미만, 523개 미만, 528개 미만, 533개 미만, 547개 미만, 552개 미만, 563개 미만, 또는 572개 미만일 수 있다. 단편은 면역글로불린 신호 펩타이드, 예를 들면 IgE 또는 IgG 신호 펩타이드와 같은 N 말단 메티오닌 및/또는 신호 펩타이드를 추가로 인코딩할 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 574개 아미노산 또는 이의 보다 작은 단편을 인코딩하는 서열에 연결될 수 있다. 단편은 574개 아미노산에 대해 98% 상동성인 폴리펩타이드 또는 574개 아미노산 서열에 대해 98% 상동성인 폴리펩타이드의 보다 작은 단편에 연결된 N 말단 메티오닌 및/또는 신호 펩타이드를 인코딩할 수 있다. 단편은 574개 아미노산 서열에 대해 99% 상동성인 폴리펩타이드 또는 574개 아미노산 서열에 대해 99% 상동성인 폴리펩타이드의 보다 작은 단편에 연결된 N 말단 메티오닌 및/또는 신호 펩타이드를 인코딩할 수 있다. 상동성 정도를 계산하는데 있어서, 폴리펩타이드는 서열 번호: 2 또는 이의 단편을 가지며, N 말단 메티오닌 및/또는 어떠한 신호 펩타이드도 이러한 계산에 포함되지 않는다. 신호 펩타이드의 서열은 상동성의 측정시 사용되지 않는다. 따라서, 예를 들면, 서열 번호: 7이 신호 펩타이드 서열 번호: 17을 인코딩하는 코딩 서열에 작동적으로 연결된 서열 번호: 1을 포함한다고 해도, 서열 번호: 7은, 서열 번호: 1에 부재하는 신호 펩타이드 코딩 서열에도 불구하고 서열 번호: 1의 단편에 대해 100% 상동성인 서열 번호: 1의 단편을 포함한다. 서열 번호: 22, 서열 번호: 23, 서열 번호: 24, 및 서열 번호: 25는 서열 번호: 2에 설정된 RSV F 면역원의 T 세포 에피토프에 상응한다. 일부 구현예에서, 단편은 서열 번호: 1의 단편 또는 서열 번호: 1에 대해 98% 이상 또는 99% 이상 상동성인 서열을 포함하는, 하나 이상의 이들 서열 중의 모두 또는 일부 또는 이들에 대해 98% 이상 또는 99% 이상 상동성인 서열을 인코딩하는 코딩 서열을 포함한다.
일부 구현예에서, 단편은 서열 번호: 5에 대해 98% 이상 상동성인 핵산 서열의 단편이다. 일부 구현예에서, 단편은 서열 번호: 5에 대해 99% 이상 상동성인 핵산 서열의 단편이다. 일부 구현예에서, 단편은 서열 번호: 5의 단편이다. 본원에 기술된 폴리펩타이드 단편을 인코딩하는 핵산 서열, 즉, 펩타이드 단편의 크기 및 상동성을 갖는 단백질을 인코딩하는 핵산 서열의 단편이 명확히 기재된 것으로 의도된다. 일부 구현예에서, 펩타이드 단편의 크기 및 상동성을 갖는 단백질을 인코딩하는 핵산 서열의 단편은 서열 번호: 5의 단편이다. 예를 들면, 서열 번호: 5 또는 서열 번호: 13과 같이, 각 경우에 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는, 서열 번호: 6, 서열 번호: 14에 기재된 것과 같은 RSV Ga 공통 면역원, 본원에 설정된 RSV Ga 공통 면역원 서열에 대해 98% 이상 상동성인 단백질, 본원에 설정된 RSV Ga 공통 면역원 서열에 대해 99% 이상 상동성인 단백질, 및 본원에 설정된 공통 서열에 대해 100% 동일한 RSV Ga 공통 면역원을 인코딩하는 코딩 서열의 단편은 첨가된 어떠한 비-RSV 신호 펩타이드를 제외하고는, 본원에 설정된 특수한 완전한 길이의 RSV Ga 공통 면역원 서열의 길이의 20% 이상, 25% 이상, 30% 이상, 35% 이상, 40% 이상, 45% 이상, 50% 이상, 55% 이상, 60% 이상, 65% 이상, 70% 이상, 75% 이상, 80% 이상, 85% 이상, 90% 이상, 91% 이상, 92% 이상, 93% 이상, 94% 이상, 95% 이상, 96% 이상, 97% 이상, 98% 이상, 99% 이상을 포함할 수 있다. 단편은 각 경우에 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는, 본원에 설정된 RSV Ga 공통 면역원의 서열에 대해 98% 이상, 또는 99% 이상 상동성이거나 이러한 서열에 대해 100% 동일한 폴리펩타이드의 단편을 인코딩할 수 있다. 단편은 RSV Ga 공통 면역원에 대해 98% 이상 상동성, 99% 이상 상동성이거나, 100% 동일한 폴리펩타이드의 단편을 인코딩할 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 일부 구현예에서, RSV Ga 면역원을 인코딩하는 단편은 서열 번호: 6의 단편을 인코딩할 수 있고 서열 번호: 5의 단편을 포함할 수 있다. 단편은 면역글로불린 신호 펩타이드와 같은 신호 펩타이드, 예를 들면 IgE 신호 펩타이드(서열 번호: 17) 또는 IgG 신호 펩타이드에 연결된 서열 번호: 6의 단편을 인코딩할 수 있다. 따라서 일부 구현예에서, 단편은 서열 번호: 17을 포함하는 서열 번호: 14의 단편이고 서열 번호: 13에 의해 인코딩될 수 있다. 단편은 출발 코돈에 연결된 서열 번호: 5의 단편을 포함할 수 있다. 단편은 또한 서열 번호: 6에 대해 98% 이상, 또는 99% 이상 상동성인 폴리펩타이드의 단편을 인코딩한다. 단편은 서열 번호: 6에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 6에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 6에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호: 6에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호: 5에 대해 98% 이상, 또는 99% 이상 상동성일 수 있다. 단편은 서열 번호: 5에 대해 98% 이상 상동성일 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 5에 대해 99% 이상 상동성일 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호; 5에 대해 98% 이상 상동성일 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호: 5에 대해 99% 이상 상동성일 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 각각의 경우 출발 코돈 또는 신호 펩타이드를 인코딩하는 코딩 서열이 있거나 없는, 서열 번호: 5의 단편, 서열 번호: 5에 대해 98% 이상 상동성인 핵산 서열의 단편, 및 서열 번호: 5에 대해 99% 이상 상동성인 핵산 서열의 단편은 일부 구현예에서, 이의 단편일 수 있는 RSV Ga 면역원의 단편을 인코딩할 수 있으며, 길이가 125개 이상의 아미노산, 길이가 130개 이상, 140개 이상, 150개 이상, 160개 이상, 170개 이상, 180개 이상, 190개 이상, 200개 이상, 210개 이상, 220개 이상, 230개 이상, 240개 이상, 250개 이상, 260개 이상, 270개 이상, 280개 이상, 285개 이상, 290개 이상, 295개 이상일 수 있다. 폴리펩타이드 단편은, 길이가 135개 미만의 아미노산, 145개 미만, 155개 미만, 165개 미만, 175개 미만, 185개 미만, 195개 미만, 205개 미만, 215개 미만, 225개 미만, 235개 미만, 245개 미만, 255개 미만, 265개 미만, 275개 미만, 285개 미만, 288개 미만, 292개 미만, 또는 296개 미만일 수 있다. 단편은 면역글로불린 신호 펩타이드, 예를 들면 IgE 또는 IgG 신호 펩타이드와 같은 N 말단 메티오닌 및/또는 신호 펩타이드를 추가로 인코딩할 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 296개 아미노산 또는 이의 보다 작은 단편을 인코딩하는 서열에 연결될 수 있다. 단편은 296개 아미노산에 대해 98% 상동성인 폴리펩타이드 또는 296개 아미노산 서열에 대해 98% 상동성인 폴리펩타이드의 보다 작은 단편에 연결된 N 말단 메티오닌 및/또는 신호 펩타이드를 인코딩할 수 있다. 단편은 296개 아미노산에 대해 99% 상동성인 폴리펩타이드 또는 296개 아미노산 서열에 대해 99% 상동성인 폴리펩타이드의 보다 작은 단편에 연결된 N 말단 메티오닌 및/또는 신호 펩타이드를 인코딩할 수 있다. 상동성의 정도를 계산하는데 있어서, 폴리펩타이드는 서열 번호: 6 또는 이의 단편을 가지며, N 말단 메티오닌 및/또는 어떠한 신호 펩타이드도 이러한 계산에 포함되지 않는다. 신호 펩타이드의 서열은 상동성의 측정시 사용되지 않는다. 따라서, 예를 들면, 서열 번호: 13이 신호 펩타이드 서열 번호: 17을 인코딩하는 코딩 서열에 작동적으로 연결된 서열 번호: 5를 포함한다고 해도, 서열 번호: 13은, 서열 번호; 5에 부재하는 신호 펩타이드 코딩 서열에도 불구하고, 서열 번호; 5의 단편에 대해 100% 상동성인 서열 번호; 5의 단편을 포함한다.
일부 구현예에서, 단편은 서열 번호; 7에 대해 98% 이상 상동성인 핵산 서열의 단편이다. 일부 구현예에서, 단편은 서열 번호: 7에 대해 99% 이상 상동성인 핵산 서열의 단편이다. 일부 구현예에서, 단편은 서열 번호: 7의 단편이다. 본원에 기술된 폴리펩타이드 단편을 인코딩하는 핵산 서열, 즉, 펩타이드 단편의 크기 및 상동성을 갖는 단백질을 인코딩하는 핵산 서열의 단편이 명확히 기재된 것으로 의도된다. 일부 구현예에서, 펩타이드 단편의 크기 및 상동성을 지닌 단백질을 인코딩하는 핵산 서열의 단편은 서열 번호: 7의 단편이다. 예를 들면, 서열 번호: 7 또는 서열 번호: 15와 같이, 각 경우에 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는, 서열 번호: 8, 서열 번호: 16에 기재된 것과 같은 RSV Gb 공통 면역원, 본원에 설정된 RSV Gb 공통 면역원 서열에 대해 98% 이상 상동성인 단백질, 본원에 설정된 RSV Gb 공통 면역원 서열에 대해 99% 이상 상동성인 단백질, 및 본원에 설정된 공통 서열에 대해 100% 상동성인 RSV Gb 공통 면역원을 인코딩하는 코딩 서열의 단편은 첨가된 비-RSV 신호 펩타이드를 제외하고, 본원에 설정된 특수한 완전한 길이의 RSV Gb 공통 면역원 서열의 길이의 20% 이상, 25% 이상, 30% 이상, 35% 이상, 40% 이상, 45% 이상, 50% 이상, 55% 이상, 60% 이상, 65% 이상, 70% 이상, 75% 이상, 80% 이상, 85% 이상, 90% 이상, 91% 이상, 92% 이상, 93% 이상, 94% 이상, 95% 이상, 96% 이상, 97% 이상, 98% 이상, 99% 이상 백분율을 포함할 수 있다. 단편은 각각의 경우에 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는, 본원에 설정된 RSV Gb 공통 면역원의 서열에 대해 98% 이상, 또는 99% 이상 상동성이고 이러한 서열에 대해 100% 동일한 펩타이드의 단편을 인코딩할 수 있다. 단편은 RSV Gb 공통 면역원에 대해 98% 이상 상동성이거나, 99% 이상 상동성이거나, 100% 동일한 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율의 계산시 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 일부 구현예에서, RSV Gb 면역원을 인코딩하는 단편은 서열 번호: 8의 단편을 인코딩할 수 있고 서열 번호: 7의 단편을 포함할 수 있다. 단편은 면역글로불린 신호 펩타이드, 예를 들면, IgE 신호 펩타이드(서열 번호: 17) 또는 IgG 신호 펩타이드와 같은 신호 펩타이드에 연결된 서열 번호: 8의 단편을 인코딩할 수 있다. 따라서, 일부 구현예에서, 단편은 서열 번호; 17을 포함하는 서열 번호: 16의 단편이며 서열 번호: 15에 의해 인코딩될 수 있다. 단편은 또한 출발 코돈에 연결된 서열 번호: 7의 단편을 포함할 수 있다. 단편은 서열 번호; 8에 대해 98%이상, 또는 99% 이상 상동성인 폴리펩타이드의 단편을 인코딩한다. 단편은 서열 번호: 8에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율의 계산시 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 8에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율의 계산시 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 8에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율의 계산시 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호: 8에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율의 계산시 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호: 7에 대해 98% 이상, 또는 99% 이상 상동성일 수 있다. 단편은 서열 번호: 7에 대해 98% 이상 상동성일 수 있고 상동성 백분율의 계산시 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 7에 대해 99% 이상 상동성일 수 있고 상동성 백분율의 계산시 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 7에 대해 98% 이상 상동성일 수 있고 상동성 백분율의 계산시 포함되지 않는N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호: 7에 대해 99% 이상 상동성일 수 있고 상동성 백분율의 계산시 포함되지 않는N 말단 메티오닌을 추가로 포함할 수 있다. 각각의 경우에 출발 코돈 또는 신호 펩타이드를 인코딩하는 코딩 서열이 있거나 없는, 서열 번호: 7의 단편, 서열 번호: 7에 대해 98% 이상 상동성인 핵산 서열의 단편, 및 서열 번호: 7에 대해 99% 이상 상동성인 핵산 서열의 단편은 일부 구현예에서 있을 수 있는 RSV Gb의 단편을 인코딩할 수 있고, 그 단편은 길이가 125개 이상의 아미노산, 길이가 130개 이상, 140개 이상, 150개 이상, 160개 이상, 170개 이상, 180개 이상, 190개 이상, 200개 이상, 210개 이상, 220개 이상, 230개 이상, 240개 이상, 250개 이상, 260개 이상, 270개 이상, 280개 이상, 285개 이상, 288개 이상일 수 있다. 폴리펩타이드 단편은, 길이가 135개 미만의 아미노산, 145개 미만, 155개 미만, 165, 175개 미만, 185개 미만, 195개 미만, 205개 미만, 215개 미만, 225개 미만, 235개 미만, 245개 미만, 255개 미만, 265개 미만, 275개 미만, 285개 미만, 288개 미만, 290개 미만일 수 있다. 단편은 면역글로불린 신호 펩타이드, 예를 들면 IgE 또는 IgG 신호 펩타이드와 같은 N 말단 메티오닌 및/또는 신호 펩타이드를 추가로 인코딩할 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 290개 아미노산 또는 이의 보다 작은 단편을 인코딩하는 서열에 연결될 수 있다. 단편은 290개 아미노산에 대해 98% 상동성인 폴리펩타이드 또는 290개 아미노산 서열에 대해 98% 상동성인 폴리펩타이드의 보다 작은 단편에 연결된 N 말단 메티오닌 및/또는 신호 펩타이드를 인코딩할 수 있다. 단편은 290개 아미노산 서열에 대해 99% 상동성인 폴리펩타이드 또는 290개 아미노산 서열에 대해 99% 상동성인 보다 작은 단편에 연결된 N 말단 메티오닌 및/또는 신호 펩타이드를 인코딩할 수 있다. 상동성 정도의 계산 시 폴리펩타이드는 서열 번호: 8 또는 이의 단편을 가지며, N 말단 메티오닌 및/또는 어떠한 신호 펩타이드도 이러한 계산에 포함되지 않는다. 신호 펩타이드의 서열은 상동성의 측정시 사용되지 않는다. 따라서, 예를 들면, 서열 번호: 15가 신호 펩타이드 서열 번호: 17을 인코딩하는 코딩 서열에 작동적으로 연결된 서열 번호: 7을 포함한다고 해도, 서열 번호: 15는, 서열 번호: 7에 부재하는 신호 펩타이드 코딩 서열에도 불구하고, 서열 번호: 7의 단편에 대해 100% 상동성인 서열 번호: 7의 단편을 포함한다.
또한 서열 번호: 3에 대해 98% 이상 상동성인 핵산 서열의 단편을 포함하는 RSV M2-1과 관련된 서열이 제공된다. 일부 구현예에서, 단편은 서열 번호: 3에 대해 99% 이상 상동성인 핵산 서열의 단편이다. 일부 구현예에서, 단편은 서열 번호: 3의 단편이다. 본원에 기술된 폴리펩타이드 단편을 인코딩하는 핵산 서열, 즉, 펩타이드 단편의 크기 및 상동성을 갖는 단백질을 인코딩하는 핵산 서열의 단편이 명확히 기재된 것으로 의도된다. 일부 구현예에서, 펩타이드 단편의 크기 및 상동성을 갖는 단백질을 인코딩하는 핵산 서열의 단편은 서열 번호: 3의 단편이다. 예를 들면 서열 번호: 3 또는 서열 번호: 11에서와 같이, 각 경우에 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는, 서열 번호: 4, 서열 번호: 12에 기재된 것과 같은 RSV M2-1 공통 면역원, 본원에 설정된 RSV M2-1 공통 면역원 서열에 대해 98% 이상 상동성인 단백질, 본원에 설정된 RSV M2-1 공통 면역원 서열에 대해 99% 이상 상동성인 단백질, 및 본원에 설정된 공통 서열에 대해 100% 상동성인 RSV M2-1 공통 면역원을 인코딩하는 코딩 서열의 단편은 첨가된 어떠한 비-RSV 신호 펩타이드를 제외하고, 본원에 설정된 특수한 완전한 길이의 RSV M2-1 공통 면역원 서열의 길이의 20% 이상, 25% 이상, 30% 이상, 35% 이상, 40% 이상, 45% 이상, 50% 이상, 55% 이상, 60% 이상, 65% 이상, 70% 이상, 75% 이상, 80% 이상, 85% 이상, 90% 이상, 91% 이상, 92% 이상, 93% 이상, 94% 이상, 95% 이상, 96% 이상, 97% 이상, 98% 이상, 99% 이상 백분율을 포함할 수 있다. 단편은 1번 위치에서 신호 펩타이드 및/또는 메티오닌이 있거나 없는, 본원에 설정된 RSV M2-1 공통 면역원의 서열에 대해 98% 이상, 또는 99% 이상 상동성이고 이러한 서열에 대해 100% 동일한 폴리펩타이드의 단편을 인코딩할 수 있다. 단편은 RSV M2-1 공통 면역원에 대해 98% 이상 상동성이거나, 99% 이상 상동성이거나, 100% 동일한 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 일부 구현예에서, RSV M2-1 면역원을 인코딩하는 단편은 서열 번호: 4의 단편을 인코딩할 수 있으며 서열 번호: 3의 단편을 포함할 수 있다. 단편은 면역글로불린 신호 펩타이드와 같은 신호 펩타이드, 예를 들면 IgE 신호 펩타이드 (서열 번호: 17) 또는 IgG 신호 펩타이드에 연결된 서열 번호: 4의 단편을 인코딩할 수 있다. 따라서, 일부 구현예에서, 단편은 서열 번호: 17을 포함하는 서열 번호: 12의 단평이고 서열 번호: 11에 의해 인코딩될 수 있다. 단편은 출발 코돈에 연결된 서열 번호: 3의 단편을 포함할 수 있다. 단편은 서열 번호: 4에 대해 98% 이상, 또는 99% 이상 상동성인 폴리펩타이드의 단편을 또한 인코딩한다. 단편은 서열 번호: 4에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 4에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 4에 대해 98% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호: 4에 대해 99% 이상 상동성인 폴리펩타이드의 단편을 인코딩할 수 있고 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호: 3에 대해 98% 이상, 또는 99% 이상 상동성일 수 있다. 단편은 서열 번호: 3에 대해 99% 이상 상동성일 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 3에 대해 99% 이상 상동성일 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 면역글로불린 신호 펩타이드와 같은 신호 펩타이드를 추가로 포함할 수 있다. 단편은 서열 번호: 3에 대해 98% 이상 상동성일 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 단편은 서열 번호: 3에 대해 99% 이상 상동성일 수 있으며 상동성 백분율을 계산하는 경우 포함되지 않는 N 말단 메티오닌을 추가로 포함할 수 있다. 각각의 경우에 출발 코돈 또는 신호 펩타이드를 인코딩하는 코딩 서열이 있거나 없는, 서열 번호: 3의 단편, 서열 번호: 3에 대해 98% 이상 상동성인 핵산 서열의 단편, 및 서열 번호: 3에 대해 99% 이상 상동성인 핵산 서열의 단편은 일부 구현예에서, 이의 단편일 수 있는 RSV M2-1 면역글로불린의 단편을 인코딩할 수 있고 길이가 25개 이상의 아미노산, 30개 이상, 40개 이상, 50개 이상, 60개 이상, 70개 이상, 80개 이상, 90개 이상, 100개 이상, 110개 이상, 120개 이상, 130개 이상, 140개 이상, 150개 이상, 160개 이상, 170개 이상, 180개 이상, 184개 이상, 190개 이상, 또는 193개 이상일 수 있다. 폴리펩타이드 단편은, 길이가 35개 미만의 아미노산, 45개 미만, 55개 미만, 65개 미만, 75개 미만, 85개 미만, 95개 미만, 105개 미만, 115개 미만, 125개 미만, 135개 미만, 145개 미만, 155개 미만, 165개 미만, 175개 미만, 185개 미만, 188개 미만, 192개 미만, 또는 194개 미만일 수 있다. 단편은 면역글로불린 신호 펩타이드, 예를 들면 IgE 또는 IgG 신호 펩타이드와 같은 N 말단 메티오닌 및/또는 신호 펩타이드를 추가로 인코딩할 수 있다. N 말단 메티오닌 및/또는 신호 펩타이드는 194개 아미노산 또는 이의 보다 작은 단편을 인코딩하는 서열에 연결될 수 있다. 단편은 194개 아미노산에 대해 98% 상동성인 폴리펩타이드 또는 194개 아미노산 서열에 대해 98% 상동성인 폴리펩타이드의 보다 작은 단편에 연결된 N 말단 메티오닌 및/또는 신호 펩타이드를 인코딩할 수 있다. 단편은 194개 아미노산에 대해 99% 상동성인 폴리펩타이드 또는 194개 아미노산 서열에 대해 99% 상동성인 폴리펩타이드의 보다 작은 단편에 연결된 N 말단 메티오닌 및/또는 신호 펩타이드를 인코딩할 수 있다. 상동성 정도의 계산시 폴리펩타이드는 서열 번호: 4 또는 이의 단편, 이러한 계산에 포함되지 않는 N 말단 메티오닌 및/또는 어떠한 신호 펩타이드도 갖는다. 신호 펩타이드의 서열은 상동성의 측정시 사용되지 않는다. 따라서, 예를 들면, 서열 번호: 9가 신호 펩타이드 서열 번호: 17을 인코딩하는 코딩 서열에 작동적으로 연결된 서열 번호: 3을 포함한다고 해도, 서열 번호: 9는, 서열 번호: 3에 부재하는 신호 펩타이드 코딩 서열에도 불구하고, 서열 번호: 3의 단편에 대해 100% 상동성인 서열 번호: 3의 단편을 포함한다. 서열 번호: 30은 서열 번호: 4에 설정된 RSV M2-1 면역원의 면역우성 T 세포 에피토프에 상응한다. 서열 번호: 31은 서열 번호: 4에 설정된 RSV M2-1 면역원의 면역우성 T 세포 에피토프에 상응하는 아우성 T 세포 에피토프를 말한다. 일부 구현예에서, 단편은 서열 번호; 3의 단편을 포함하는 이들 서열 또는 이들에 대해 98% 이상 또는 99% 이상 상동성인 서열의 하나 이상 또는 서열 번호: 3에 대해 98% 이상 또는 99% 이상 상동성인 서열 모두 또는 일부를 인코딩하는 코딩 서열을 포함한다.
l. 동일한
둘 이상의 핵산 또는 폴리펩타이드 서열의 문맥에서 본원에서 사용된 바와 같이, "동일한" 또는 "동일성"는 상기 서열이 지정된 영역에 대해 동일한 지정된 백분율의 잔기를 갖는다는 것을 의미할 수 있다. 상기 백분율은 두 서열을 최적으로 정렬하고, 지정된 영역에 대해 두 서열을 비교하고, 두 서열에서 동일한 잔기가 발생하는 위치의 수를 결정하여 일치된 위치의 수를 산출하고, 상기 일치된 위치의 수를 지정된 영역 내의 위치의 총 수로 나누고, 상기 결과에 100을 곱하여 서열 동일성의 백분율을 산출함으로써 계산될 수 있다. 두 서열이 상이한 길이이거나 상기 정렬이 하나 이상의 어긋난(staggered) 말단을 생성하고 비교하는 상기 지정된 영역이 단지 하나의 서열을 포함하는 경우, 하나의 서열의 잔기들이 분모에 포함되지만 계산의 분자에는 포함되지 않는다. DNA 및 RNA를 비교할 때, 티민 (T) 및 우라실 (U)은 동등한 것으로 간주될 수 있다. 동일성은 수작업으로 또는 BLAST 또는 BLAST 2.0과 같은 컴퓨터 서열 알고리즘을 이용하여 수행될 수 있다.
m. 임피던스
본원에서 사용된 바와 같이 "임피던스"는 피드백 기전을 논의할 때 사용될 수 있으며, 옴의 법칙에 따라 전류 값으로 변환될 수 있어서 미리 조정된 전류와 비교할 수 있다.
n. 면역 반응
본원에서 사용된 바와 같이 "면역 반응"은 제공된 DNA 플라스미드 백신을 통해 하나 이상의 RSV 공통 항원의 도입에 반응한, 숙주의 면역계의 활성화, 예컨대 포유동물의 면역계의 활성화를 의미할 수 있다. 상기 면역 반응은 세포성 또는 체액성 반응, 또는 둘 모두의 형태일 수 있다.
o. 핵산
본원에 사용된 바와 같이 "핵산" 또는 "올리고뉴클레오타이드" 또는 "폴리뉴클레오타이드"는 함께 공유결합된 적어도 2개의 뉴클레오타이드를 의미할 수 있다. 단일 가닥의 묘사는 또한 상보적 가닥의 서열을 정의한다. 따라서, 핵산은 또한 묘사된 단일 가닥의 상보적 가닥을 포함한다. 핵산의 많은 변이체들이 주어진 핵산과 동일한 목적을 위해 사용될 수 있다. 따라서, 핵산은 또한 실질적으로 동일한 핵산 및 이의 보체를 포함한다. 단일 가닥은 엄격한 혼성화 조건 하에서 표적 서열에 혼성화할 수 있는 프로브를 제공한다. 따라서, 핵산은 또한 엄격한 혼성화 조건 하에서 혼성화하는 프로브를 포함한다.
핵산은 단일가닥 또는 이중가닥일 수 있거나, 이중가닥 및 단일가닥 서열의 일부을 함유할 수 있다. 상기 핵산은 DNA, 게놈 및 cDNA 모두, RNA, 또는 하이브리드일 수 있으며, 여기서 핵산은 데옥시리보- 및 리보-뉴클레오타이드의 조합, 및 우라실, 아데닌, 티민, 시토신, 구아닌, 이노신, 잔틴 하이포잔틴, 이소시토신 및 이소구아닌을 포함하는 염기들의 조합을 함유할 수 있다. 핵산은 화학적 합성 방법 또는 재조합 방법에 의해 수득될 수 있다.
p. 작동적으로 연결된
본원에 사용된 것으로서 "작동적으로 연결된"는, 유전자의 발현이 이것이 공간적으로 연결된 프로모터의 조절하에 있음을 의미할 수 있다. 프로모터는 이의 조절하에서 유전자의 5'(상류) 또는 3'(하류)에 위치할 수 있다. 프로모터와 유전자 간의 거리는, 프로모터가 유도된 유전자 내에서 그것이 제어하는 프로모터와 유전자 간의 거리와 대략 동일할 수 있다. 당해 기술에 공지된 바와 같이, 이 거리의 변화는 프로모터 기능의 손실 없이 수용될 수 있다.
q. 프로모터
본원에서 사용된 바와 같이 "프로모터"는 세포에서 핵산의 발현을 부여하거나, 활성화하거나 향상시킬 수 있는 합성 또는 천연적으로-유도된 분자를 의미할 수 있다. 프로모터는 발현을 더 향상시키고/거나 이의 공간 발현 및/또는 일시적 발현을 변경하는 하나 이상의 특이적 전사 조절 서열을 포함할 수 있다. 프로모터는 또한 원위(distal) 인핸서 또는 억제자 요소를 포함할 수 있고, 이는 전사 개시 부위로부터 수천 염기쌍 정도에 위치할 수 있다. 프로모터는 바이러스, 박테리아, 진균, 식물, 곤충, 및 동물을 포함하는 공급원으로부터 유래될 수 있다. 프로모터는 발현이 일어나는 세포, 조직 또는 장기와 관련하여, 또는 발현이 일어나는 발달 단계와 관련하여, 또는 생리적 스트레스, 병원체, 금속 이온, 또는 유도제와 같은 외부 자극에 대한 반응으로, 항시적으로, 또는 차별적으로 유전자 구성요소의 발현을 조절할 수 있다. 프로모터의 대표적인 예는 박테리오파아지 T7 프로모터, 박테리오파아지 T3 프로모터, SP6 프로모터, lac 오퍼레이터-프로모터, tac 프로모터, SV40 후기 프로모터, SV40 초기 프로모터, RSV-LTR 프로모터, CMV IE 프로모터, SV40 초기 프로모터 또는 SV40 후기 프로모터 및 CMV IE 프로모터를 포함한다.
r. 엄격한 혼성화 조건
본원에서 사용된 바와 같이 "엄격한 혼성화 조건"는 핵산의 복합 혼합물에서와 같이, 제1 핵산 서열 (예를 들면, 프로브)이 제2 핵산 서열 (예를 들면, 표적)에 혼성화하게 될 조건을 의미할 수 있다. 엄격한 조건은 서열-의존적이며 상이한 상황에서 상이할 것이다. 엄격한 조건은 정의된 이온 강도 pH에서 명시된 서열에 대해 열 융점(Tm) 보다 약 5 내지 10℃ 더 낮도록 선택될 수 있다. Tm는, 표적에 대해 상보성인 프로브의 50%가 평형에서 표적 서열에 대해 하이브리드화하는(표적 서열은 과량으로 존재하므로, Tm에서, 프로브의 50%가 평형에 관여한다) 온도(정의된 이온 강도, pH, 및 핵산 농도)일 수 있다. 엄격한 조건은, 염 농도가 pH 7.0 내지 8.3에서 약 0.01 내지 1.0 M 나트륨 이온 농도(또는 다른 염)과 같은 약 1.0 M 미만의 나트륨 이온이고 온도가 짧은 프로브(예를 들면, 약 10 내지 50개 뉴클레오타이드)의 경우 적어도 약 30℃이고 긴 프로브(예를 들면, 약 50개 이상의 뉴클레오타이드)의 경우 적어도 약 60℃인 것일 수 있다. 엄격한 조건은 또한 포름아미드와 같은 탈안정화제의 첨가로 달성될 수 있다. 선택적 또는 특이적 혼성화를 위해, 양성 신호가 배경 혼성화의 적어도 2 내지 10배일 수 있다. 예시적인 엄격한 하이브리드화 조건은 다음을 포함한다: 50% 포름아미드, 5x SSC, 및 1% SDS, 42℃에서 항온처리, 또는, 5x SSC, 1% SDS, 65℃에서 항온처리와 함께, 65℃에서 0.2x SSC, 및 0.1% SDS 속에서 세척.
s. 실질적으로 상보적
본원에서 사용된 바와 같이 "실질적으로 상보적"는 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100 또는 그 이상의 뉴클레오타이드 또는 아미노산의 영역에 대해 제1 서열이 제2 서열의 보체에 적어도 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98% 또는 99% 동일하거나, 또는 상기 두 서열이 엄격한 혼성화 조건 하에서 혼성화하는 것을 의미할 수 있다.
t. 실질적으로 동일한
본원에서 사용된 바와 같이 "실질적으로 동일한"는, 만약 제1 서열이 제2 서열의 보체에 실질적으로 상보적이면, 제1 및 제2 서열이 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100 또는 그 이상의 뉴클레오타이드 또는 아미노산의 영역에 대해 또는 핵산에 대해, 적어도 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98% 또는 99% 동일하다는 것을 의미할 수 있다.
u. 변이체
핵산과 관련하여 본원에 사용된 "변이체"는 (i) 참조된 뉴클레오타이드 서열의 일부 또는 단편; (ii) 참조된 뉴클레오타이드 서열 또는 이의 일부의 보체; (iii) 참조된 핵산 또는 이의 보체와 실질적으로 동일한 핵산; 또는 (iv) 참조된 핵산, 이의 보체, 또는 이와 실질적으로 동일한 서열에 엄격한 조건 하에서 혼성화하는 핵산을 의미할 수 있다.
펩타이드 또는 폴리펩타이드에 대한 "변이체"는 아미노산의 삽입, 결실, 또는 보존적 치환에 의해 아미노산 서열이 상이하지만, 적어도 하나의 생물학적 활성을 유지한다. 변이체는 또한 적어도 하나의 생물학적 활성을 보유하는 아미노산 서열을 갖는 참조된 단백질과 실질적으로 동일한 아미노산 서열을 갖는 단백질을 의미할 수 있다. 아미노산의 보존적 치환, 즉, 아미노산을 유사한 특성(예를 들면, 친수성, 전하를 띠는 영역의 정도 및 분포)의 상이한 아미노산으로 치환하는 것은 전형적으로 미세한 변화를 수반하는 것으로 당해 기술분야에서 인식된다. 이들 미세한 변화는 당해 기술분야에서 이해되는 바와 같이, 아미노산의 수치요법 지수(hydropathic index)를 고려함으로써, 일부 확인될 수 있다(Kyte 등, J. Mol. Biol. 157:105-132 (1982)). 아미노산의 상기 수치요법 지수는 그의 소수성 및 전하의 고려에 기초한다. 유사한 수치요법 지수의 아미노산이 치환될 수 있고 여전히 단백질 기능을 보유한다는 것이 당해기술분야에 공지되어 있다. 일 측면에서, ±2의 수치요법 지수를 갖는 아미노산이 치환된다. 아미노산의 친수성은 또한 생물학적 기능을 보유하는 단백질을 야기할 치환을 밝히는데 사용될 수 있다. 펩타이드의 문맥에서 아미노산의 친수성의 고려는 항원성 및 면역원성과 밀접한 상관관련이 있다고 보고된 유용한 척도인 상기 펩타이드의 가장 큰 국소적 평균 친수성의 계산을 가능하게 한다. 본원에 전문이 참고로 통합된, 미국 특허 제4,554,101호. 유사한 소수성 값을 갖는 아미노산의 치환은 당해 분야에서 이해되는 바와 같이, 생물학적 활성, 예를 들면, 면역원성을 보유하는 펩타이드를 생성할 수 있다. 치환은 서로 ±2내의 친수성 값을 갖는 아미노산을 사용하여 수행할 수 있다. 아미노산의 소수성 지수 및 친수성 값 둘 다는 이러한 아미노산의 특수한 측쇄에 의해 영향받는다. 이러한 관찰과 일치하여, 생물학적 기능과 상용성인 아미노산 치환은 소수성, 친수성, 전하, 크기, 및 다른 특성에 의해 나타난 바와 같이, 아미노산의 상대적인 유사성, 및 특히 이들 아미노산의 측쇄에 의존하는 것으로 이해된다.
v. 벡터
본원에 사용된 "벡터"는 복제 기점을 함유하는 핵산 서열을 의미할 수 있다. 벡터는 플라스미드, 박테리오파아지, 박테리아 인공 염색체 또는 효모 인공 염색체일 수 있다. 벡터는 DNA 또는 RNA 벡터일 수 있다. 벡터는 자가-복제하는 염색체외 벡터 또는 숙주 게놈내로 통합되는 벡터일 수 있다.
2. RSV 단백질
본원에 "RSV 면역원"로 또한 언급된, RSV 단백질이 제공되며, 이는 RSV에 대해 면역 반응을 유발할 수 있는 공통 항원이다. 공통 RSV 면역원 중 3개는 RSV F 면역원, 및 RSV Ga 면역원 및 RSV Gb 면역원으로 본원에 언급된, 2개 형태의 RSV G 면역원이다. 2개의 RSV G 면역원 형태가 RSV G 단백질 중에서 전달성으로 인해 제공된다. 일부 구현예에서, RSV 면역원은 면역글로불린단백질, 예를 들면 IgE 신호 펩타이드(서열 번호: 17) 또는 IgG 신호 펩타이드와 같은 상이한 단백질로부터의 신호 펩타이드를 포함할 수 있다. RSV 면역원은 RSV F 면역원, RSV Ga 면역원 및 RSV Gb 면역원을 포함한다. RSV M2-1, 즉, 면역글로불린단백질, 예를 들면 IgE 신호 펩타이드(서열 번호: 17) 또는 IgG 신호 펩타이드와 같은 상이한 단백질로부터의 신호 펩타이드를 임의로 포함할 수 있는 RSV M2-1 면역원"에 대해 면역 반응을 유발할 수 있는 공통 항원인 "RSV 면역원"가 또한 본원에 제공된다.
"RSV F 면역원"은 서열 번호: 2에 대해 적어도 98% 상동성인 단백질의 면역원성 단편을 포함하는 단백질을 말한다. RSV F 면역원은 서열 번호: 2에 대해 적어도 99% 상동성인 단백질의 면역원성 단편을 포함할 수 있다. RSV F 면역원은 서열 번호; 2의 면역원성 단편을 포함할 수 있다. 각각의 예에서 면역원성 단편은 서열 번호: 17과 같은 신호 펩타이드를 임의로 추가로 포함할 수 있다. 서열 번호: 2 및 신호 펩타이드 서열 번호: 17의 면역원성 단편을 포함하는 RSV F 면역원은 서열 번호: 17을 포함하는 서열 번호: 10의 면역원성 단편일 수 있다. RSV F 면역원은 서열 번호: 2에 대해 적어도 98% 상동성인 단백질을 포함할 수 있으며, 일부 구현예에서 서열 번호: 2에 대해 적어도 99% 상동성인 단백질을 포함할 수 있다. RSV F 면역원은 서열 번호: 2를 포함할 수 있다. 각각의 예에서, RSV F 면역원은 서열 번호; 17과 같은 신호 펩타이드를 임의로 추가로 포함할 수 있다. 서열 번호: 2 및 신호 펩타이드 서열 번호; 17을 포함하는 RSV F 면역원은 서열 번호: 10을 포함할 수 있다.
"RSV Ga 면역원"은 서열 번호: 6에 대해 적어도 98% 상동성인 단백질의 면역원성 단편을 포함하는 단백질을 말한다. RSV Ga 면역원은 서열 번호: 6에 대해 적어도 99% 상동성인 단백질의 면역원성 단편일 수 있다. RSV Ga 면역원은 서열 번호: 6의 면역원성 단편을 포함할 수 있다. 각각의 예에서 면역원성 단편은 서열 번호: 17과 같은 신호 펩타이드를 임의로 추가로 포함할 수 있다. 서열 번호: 6의 면역원성 단편 및 신호 펩타이드 서열 번호: 17을 포함하는 RSV Ga 면역원은 서열 번호: 17을 포함하는 서열 번호: 14의 면역원성 단편일 수 있다. RSV Ga 면역원은 서열 번호: 6에 대해 적어도 98% 상동성인 단백질을 포함할 수 있으며 일부 구현예에서 서열 번호: 6에 대해 적어도 99% 상동성인 단백질을 포함할 수 있다. RSV Ga 면역원은 서열 번호: 6을 포함할 수 있다. 각각의 예에서 RSV Ga 면역원은 서열 번호: 17과 같은 신호 펩타이드를 임의로 추가로 포함할수 있다. 서열 번호: 6 및 신호 펩타이드 서열 번호: 17을 포함하는 RSV Ga 면역원은 서열 번호: 14를 포함할 수 있다.
"RSV Gb 면역원"은 서열 번호: 8에 대해 적어도 98% 상동성인 단백질의 면역원성 단편을 포함하는 단백질을 말한다. RSV Gb 면역원은 서열 번호: 8에 대해 적어도 99% 상동성인 단백질의 면역원성 단편을 포함할 수 있다. RSV Gb 면역원은 서열 번호: 8의 면역원성 단편을 포함할 수 있다. 각각의 예에서 면역원성 단편은 서열 번호: 17과 같은 신호 펩타이드를 임의로 추가로 포함할 수 있다. 서열 번호: 8의 면역원성 단편 및 신호 펩타이드 서열 번호: 17을 포함하는 RSV Gb 면역원은 서열 번호: 17을 포함하는 서열 번호: 16의 면역원성 단편일 수 있다. RSV Gb 면역원은 서열 번호: 8에 대해 적어도 98% 상동성인 단백질을 포함할 수 있으며, 일부구현예에서 서열 번호: 8에 대해 적어도 99% 상동성인 단백질을 포함할 수 있다. RSV Gb 면역원은 서열 번호: 8을 포함할 수 있다. 각각의 예에서 RSV Gb 면역원은 서열 번호: 17과 같은 신호 펩타이드를 임의로 추가로 포함할수 있다. 서열 번호: 8 및 신호 펩타이드 서열 번호: 17을 포함하는 RSV Gb 면역원은 서열 번호: 16을포함할 수 있다.
일부 구현예에서, 본원에 설정된 2개 이상의 RSV 단백질의 조합을 포함하는 융합 단백질이 제공된다. 예를 들면, 융합 단백질은 서열 번호: 2 또는 이의 면역원성 단편 및 서열 번호: 6 또는 이의 면역원성 단편; 서열 번호: 2 또는 이의 면역원성 단편 및 서열 번호: 8 또는 이의 면역원성 단편; 또는 서열 번호: 6 또는 이의 면역원성 단편 및 서열 번호: 8 또는 이의 면역원성 단편을 포함할 수 있다. 융합 단백질은 서열 번호: 2 또는 이의 면역원성 단편, 서열 번호: 6 또는 이의 면역원성 단편 및 서열 번호: 8 또는 이의 면역원성을 포함할 수 있다. 대안적으로, 상기 융합 단백질중 하나 이상은 서열 번호: 2 또는 면역원성 단편에 상응하는 위에서 기술된 융합 단백질의 일부 대신에 서열 번호: 2에 대해 적어도 98% 또는 적어도 99% 상동성인 서열 또는 이의 면역원성 단편을 포함할 수 있다. 유사하게, 상기 하나 이상의 융합 단백질은 서열 번호: 6 또는 면역원성 단편에 상응하는 위에서 기술된 융합 단백질 대신에 서열 번호: 6 또는 이의 면역원성 단편에 대해 적어도 98% 또는 적어도 99% 상동성인 서열을 포함할 수 있고/있거나; 상기 하나 이상의 융합 단백질은 서열 번호: 8 또는 면역원성 단편에 상응하는 위에서 기술된 융합 단백질의 일부 대신에 서열 번호: 8 또는 이의 면역원성 단편에 대해 적어도 98% 또는 적어도 99% 상동성인 서열을 포함할 수 있다. 융합 단백질은 공통 단백질 및/또는 공통 단백질의 단편 및/또는 공통 단백질의 변이체 및/또는 변이체 공통 단백질의 단편을 포함할 수 있다. 공통 단백질 및/또는 공통 단백질의 단편 및/또는 공통 단백질의 변이체 및/또는 변이체 공통 단백질의 단편은 서로 인접하게 직접 연결될 수 있거나 이들 사이에 스페이서 또는 하나 이상의 아미노산과 함께 연결될 수 있다. 일부 구현예에서, 스페이스는 단백질분해 절단 부위일 수 있다. 일부 구현예에서, 스페이스는, 백신이 투여되고/되거나 섭취되도록 의도된 세포내에서 발견된 프로테아제에 의해 인식된 단백질분해 절단 부위일 수 있다.
"RSV M2-1 면역원"은 서열 번호: 4에 대해 적어도 98% 상동성인 단백질의 면역원성 단편을 포함하는 단백질을 말한다. RSV M2-1 면역원은 서열 번호: 4에 대해 적어도 99% 상동성인 단백질의 면역원성 단편을 포함할 수 있다. RSV M2-1 면역원은 서열 번호: 4의 면역원성 단편을 포함할 수 있다. 각각의 예에서 면역원성 단편은 서열 번호: 17과 같은 신호 펩타이드를 임의로 추가로 포함할 수 있다. 서열 번호: 4의 면역원성 단편 및 신호 펩타이드 서열 번호: 17을 포함하는 RSV M2-1 면역원은 서열 번호: 17을 포함하는 서열 번호: 12의 면역원성 단편일 수 있다. RSV M2-1 면역원은 서열 번호; 4에 대해 적어도 98% 상동성인 단백질을 포함할 수 있으며, 일부 구현예에서 서열 번호: 4에 대해 적어도 99% 상동성인 단백질을 포함할 수 있다. RSV M2-1 면역원은 서열 번호: 4를 포함할 수 있다. 각각의 예에서 RSV M2-1 면역원은 서열 번호: 17과 같은 신호 펩타이드를 임의로 추가로 포함할 수 있다. 서열 번호: 4 및 신호 펩타이드 서열 번호: 17을 포함하는 RSV M2-1 면역원은 서열 번호: 12를 포함할 수 있다. 일부 구현예에서, RSV M2-1 및 본원에 설정된 다른 RSV 면역원 단백질의 조합을 포함하는 융합 단백질이 제공된다. 예를 들면, 융합 단백질은 서열 번호: 2 또는 이의 면역원성 단편 및 서열 번호: 4 또는 이의 면역원성 단편; 서열 번호: 4 또는 이의 면역원성 단편 및 서열 번호: 6 또는 이의 면역원성 단편, 서열 번호: 4 또는 이의 면역원성 단편 및 서열 번호: 8 또는 이의 면역원성 단편; 또는 서열 번호: 6 또는 이의 면역원성 단편 및 서열 번호: 8 또는 이의 면역원성 단편을 포함할 수 있다. 융합 단백질을 서열 번호: 4 또는 이의 면역원성 단편을 포함할 수 있다. 대안적으로, 상기 하나 이상의 융합 단백질은 서열 번호: 4 또는 면역원성 단편에 상응하는 상기 기술된 융합 단백질의 부위 대신에 서열 번호: 4에 대해 적어도 98% 또는 적어도 99% 상동성인 서열 또는 이의 면역원성 단편을 포함할 수 있다.
3. RSV 단백질을 인코딩하는 코딩 서열
본원에 설정된 "RSV 면역원"을 인코딩하는 핵산 서열이 본원에 제공된다. 세포가 취하거나 발현하는 핵산 서열을 포함하는 핵산 분자의 투여는 RSV에 대해 광범위한 면역 반응을 생성한다. RSV 면역원에 대한 코딩 서열, 즉, RSV F 면역원을 인코딩하는 핵산 서열, RSV Ga 면역원을 인코딩하는 핵산 서열 및 RSV Gb 면역원을 인코딩하는 핵산 서열 및 또한 RSV M2-1 면역원을 인코딩하는 핵산 서열에 대한 코딩 서열이 제공된다. 일부 구현예에서, RSV 면역원을 인코딩하는 핵산 서열은 면역글로불린단백질, 예를 들면 IgE 신호 펩타이드 (서열 번호: 17) 또는 IgG 신호 펩타이드와 같은 상이한 단백질로부터의 신호 펩타이드를 인코딩하는 핵산 서열을 포함할 수 있다.
RSV F 면역원을 인코딩하는 핵산 서열은 서열 번호: 2에 대해 적어도 98% 상동성인 단백질의 면역원성 단편을 포함하는 단백질을 인코딩할 수 있다. RSV F 면역원을 인코딩하는 핵산 서열은 서열 번호: 2에 대해 적어도 99% 상동성인 단백질의 면역원성 단편을 포함하는 단백질을 인코딩할 수 있다. RSV F 면역원을 인코딩하는 핵산 서열은 서열 번호: 2의 면역원성 단편을 포함하는 단백질을 인코딩할 수 있다. 각각의 예에서, 면역원성 단편을 포함하는 단백질을 인코딩하는 핵산 서열은 서열 번호: 17을 인코딩하는 핵산 서열과 같은 신호 펩타이드를 인코딩하는 핵산 서열을 임의로 추가로 포함할 수 있다. RSV F 면역원을 인코딩하는 핵산 서열은 서열 번호: 2의 면역원성 단편 및 신호 펩타이드 서열 번호: 17을 포함하는 단백질을 인코딩할 수 있다. RSV F 면역원을 인코딩하는 핵산 서열은 서열 번호: 17을 포함하는 서열 번호: 10의 면역원성 단편일 수 있는 단백질을 인코딩할 수 있다. RSV F 면역원을 인코딩하는 핵산 서열은 서열 번호: 2에 대해 적어도 98% 상동성인 단백질을 포함하는 단백질을 인코딩할 수 있으며, 일부 구현예에서 서열 번호; 2에 대해 적어도 99% 상동성인 단백질을 인코딩할 수 있다. RSV F 면역원을 인코딩하는 핵산 서열은 서열 번호; 2를 포함하는 단백질을 인코딩할 수 있다. 각각의 예에서, RSV F 면역원을 인코딩하는 핵산 서열은 서열 번호: 17과 같은 신호 펩타이드를 인코딩하는 핵산 서열을 임의로 추가로 포함할 수 있다. RSV F 면역원을 인코딩하는 핵산 서열은 서열 번호: 2 및 신호 펩타이드 서열 번호: 17을 포함하는 단백질을 인코딩할 수 있다. RSV F 면역원을 인코딩하는 핵산 서열은 서열 번호: 10을 포함하는 단백질을 인코딩할 수 있다.
RSV F 면역원을 인코딩하는 핵산 서열은 서열 번호; 1에 대해 적어도 98% 상동성인 핵산 서열의 단편을 포함할 수 있다. 서열 번호: 1에 대해 적어도 98% 상동성인인 핵산 서열은 서열 번호: 2에 대해 적어도 98% 상동성인 단백질을 인코딩한다. 단편은 서열 번호; 2에 대해 적어도 98% 상동성인 단백질의 면역원성 단편을 인코딩한다. 일부 구현예에서, RSV F 면역원을 인코딩하는 핵산 서열은 서열 번호; 1에 대해 적어도 98% 상동성인 핵산 서열의 단편을 포함할 수 있으며, 여기서 핵산 서열은 서열 번호: 2에 대해 적어도 99% 상동성인 단백질을 인코딩하고, 일부 구현예에서 핵산 서열은 서열 번호: 2를 포함하는 단백질을 인코딩하며, 핵산 서열의 단편은 면역원성 단편 서열 번호: 2와 같은 서열 번호: 2에 대해 적어도 99% 상동성인 단백질의 면역원성 단편을 인코딩한다. 일부 이러한 구현예에서, RSVF 면역원을 인코딩하는 핵산 서열은 서열 번호: 1에 대해 적어도 99% 상동성인 핵산 서열의 단편 및 일부 구현예에서, 서열 번호: 1의 단편을 포함할 수 있다. 일부 구현예에서, RSV F 면역원을 인코딩하는 핵산 서열은 서열 번호: 17과 같은 신호 펩타이드를 인코딩하는 핵산 서열을 임의로 추가로 포함할 수 있다. RSV F 면역원을 인코딩하는 핵산 서열은 서열 번호: 2의 단편 및 신호 펩타이드 서열 번호: 17을 인코딩하는 코딩 서열을 포함할 수 있다. RSV F 면역원을 인코딩하는 핵산 서열은 신호 펩타이드 서열 번호: 17을 인코딩하는 코딩 서열을 포함하는 서열 번호: 9의 단편을 포함할 수 있다.
RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호: 6에 대해 적어도 98% 상동성인 단백질의 면역원성 단편을 포함하는 단백질을 인코딩할 수 있다. RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호: 6에 대해 적어도 99% 상동성인 단백질의 면역원성 단편을 포함하는 단백질을 인코딩할 수 있다. RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호: 6의 면역원성 단편을 포함하는 단백질을 인코딩할 수 있다. 각각의 예에서, 면역원성 단편을 포함하는 단백질을 인코딩하는 핵산 서열은 서열 번호: 17을 인코딩하는 핵산 서열과 같은 신호 펩타이드를 인코딩하는 핵산 서열을 임의로 추가로 포함할 수 있다. RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 6의 면역원성 단편 및 신호 펩타이드 서열 번호: 17을 포함하는 단백질을 인코딩할 수 있다. RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 17을 포함하는 서열 번호: 14의 면역원성 단편일 수 있는 단백질을 인코딩할 수 있다. RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호: 6에 대해 적어도 98% 상동성인 단백질을 포함하는 단백질을 암호화할 수 있으며 일부 구현예에서 서열 번호: 6에 대해 적어도 99% 상동성인 단백질을 인코딩할 수 있다. RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호; 6을 포함하는 단백질을 인코딩할 수 있다. 각각의 예에서, RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호: 17과 같은 신호 펩타이드를 인코딩하는 핵산 서열을 임의로 추가로 포함할 수 있다. RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호: 6 및 신호 펩타이드 서열 번호: 17을 포함하는 단백질을 인코딩할 수 있다. RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호: 14를 포함하는 단백질을 인코딩할 수 있다.
RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호: 5에 대해 적어도 98% 상동성인 핵산 서열의 단편을 포함할 수 있다. 서열 번호; 5에 대해 적어도 98% 상동성인 핵산 서열은 서열 번호: 6에 대해 적어도 98% 상동성인 단백질을 인코딩한다. 단편은 서열 번호; 6에 대해 적어도 98% 상동성인 단백질의 면역원성 단편을 인코딩한다. 일부 구현예에서, RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호: 5에 대해 적어도 98% 상동성인 핵산 서열의 단편을 포함할 수 있으며 여기서 핵산 서열은 서열 번호: 6에 대해 적어도 99% 상동성인 단백질을 인코딩하고, 일부 구현예에서 핵산 서열은 서열 번호: 6을 포함하는 단백질, 및 면역원성 단편 서열 번호: 6과 같이 서열 번호: 6에 대해 적어도 99% 상동성인 단백질의 면역원성 단편을 인코딩한다. 일부 이러한 구현예에서, RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호: 5에 대해 적어도 99% 상동성인 핵산 서열의 단편 및 일부 구현예에서 서열 번호: 5의 단편을 포함할 수 있다. 일부 구현예에서, RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호; 17과 같은 신호 펩타이드를 인코딩하는 핵산 서열을 임의로 추가로 포함할 수 있다. RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호: 6의 단편 및 신호 펩타이드 서열 번호: 17을 인코딩하는 코딩 서열을 포함할 수 있다. RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호: 17의 신호 펩타이드를 인코딩하는 코딩 서열을 포함하는 서열 번호: 13의 단편을 포함할 수 있다.
RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 8에 대해 적어도 98% 상동성인 단백질의 면역원성 단편을 포함하는 단백질을 인코딩할 수 있다. RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 8에 대해 적어도 99% 상동성인 단백질의 면역원성 단편을 포함하는 단백질을 인코딩할 수 있다. RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 8의 면역원성 단편을 포함하는 단백질을 인코딩할 수 있다. 각각의 예에서, 면역원성 단편을 포함하는 단백질을 인코딩하는 핵산 서열은 서열 번호: 17을 인코딩하는 핵산 서열과 같은 신호 펩타이드를 인코딩하는 핵산 서열을 임의로 추가로 포함할 수 있다. RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호: 8의 면역원성 단편 및 서열 번호: 17의 신호 펩타이드를 포함하는 단백질을 인코딩할 수 있다. RSV Ga 면역원을 인코딩하는 핵산 서열은 서열 번호: 17을 포함하는 서열 번호: 16의 면역원성 단편일 수 있는 단백질을 인코딩할 수 있다. RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 8에 대해 적어도 98% 상동성인 단백질을포함하는 단백질을 인코딩할 수 있고, 일부 구현예에서 서열 번호: 8에 대해 적어도 99% 상동성인 단백질을 인코딩할 수 있다. RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 8을 포함하는 단백질을 인코딩할 수 있다. 각각의 예에서, RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 17과 같은 신호 펩타이드를 인코딩하는 핵산 서열을 임의로 추가로 포함할 수 있다. RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 8 및 신호 펩타이드 서열 번호: 17를 포함하는 단백질을 인코딩할 수 있다. RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 16을 포함하는 단백질을 인코딩할 수 있다.
RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 7에 대해 적어도 98% 상동성인 핵산 서열의 단편을 포함할 수 있다. 서열 번호: 7에 대해 적어도 98% 상동성인 핵산 서열은 서열 번호: 8에 대해 적어도 98% 상동성인 단백질을 인코딩한다. 단편은 서열 번호: 8에 대해 적어도 98% 상동성인 단백질의 면역원성 단편을 인코딩한다. 일부 구현예에서, RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 7에 대해 적어도 98% 상동성인 핵산 서열의 단편을 포함할 수 있으며, 여기서 핵산 서열은 서열 번호: 8에 대해 적어도 99% 상동성인 단백질을 인코딩하고, 일부 구현예에서 핵산 서열은 서열 번호: 8을 포함하는 단백질을 인코딩하고, 핵산 서열의 단편은 면역원성 단편서열 번호: 8과 같은 서열 번호: 8에 대해 적어도 99% 상동성인 단백질의 면역원성 단편을 인코딩한다. 일부 이러한 구현예에서, RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 7 및 일부 구현예에서, 서열 번호: 7의 단편에 대해 적어도 99% 상동성인 핵산 서열의 단편을 포함할 수 있다. 일부 구현예에서, RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 17과 같은 신호 펩타이드를 인코딩하는 핵산 서열을 임의로 추가로 포함한다. RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 8의 단편 및 신호 펩타이드 서열 번호: 17을 인코딩하는 코딩 서열을 포함할 수 있다. RSV Gb 면역원을 인코딩하는 핵산 서열은 서열 번호: 17의 신호 펩타이드를 인코딩하는 코딩서열을 포함하는 서열 번호: 15의 단편을 포함할 수 있다.
RSV M2-1 면역원을 인코딩하는 핵산 서열은 서열 번호: 4에 대해 적어도 98% 상동성인 단백질의 면역원성 단편을 포함하는 단백질을 인코딩할 수 있다. RSV M2-1 면역원을 인코딩하는 핵산 서열은 서열 번호: 4에 대해 적어도 99% 상동성인 단백질의 면역원성 단편을 포함하는 단백질을 인코딩할 수 있다. RSV M2-1 면역원을 인코딩하는 핵산 서열은 서열 번호: 4의 면역원성 단편을 포함하는 단백질을 인코딩할 수 있다. 각각의 예에서, 면역원성 단편을 포함하는 단백질을 인코딩하는 핵산 서열은 서열 번호: 17을 인코딩하는 핵산 서열과 같은 신호 펩타이드를 인코딩하는 핵산 서열을 임의로 추가로 포함할 수 있다. RSV M2-1 면역원을 인코딩하는 핵산 서열은 서열 번호: 4의 면역원성 단편 및 신호 펩타이드서열 번호: 17을 포함하는 단백질을 인코딩할 수 있다. RSV F 면역원을 인코딩하는 핵산 서열은 서열 번호: 17을 포함하는 서열 번호: 12의 면역원성 단편일 수 있는 단백질을 인코딩할 수 있다. RSV M2-1 면역원을 인코딩하는 핵산 서열은 서열 번호: 4에 대해 적어도 98% 상동성인 단백질을 포함하는 단백질을 인코딩할 수 있고, 일부 구현예에서 서열 번호: 4에 대해 적어도 99% 상동성인 단백질을 인코딩할 수 있다. RSV M2-1 면역원을 인코딩하는 핵산 서열은 서열 번호: 4를 포함하는 단백질을 인코딩할 수 있다. 각각의 예에서 RSV M2-1 면역원을 인코딩하는 핵산 서열은 서열 번호: 17과 같은 신호 펩타이드를 인코딩하는 핵산 서열을 임의로 추가로 포함할 수 있다. RSV M2-1 면역원을 인코딩하는 핵산 서열은 서열 번호: 4 및 신호 펩타이드 서열 번호: 17을 포함하는 단백질을 인코딩할 수 있다. RSV M2-1 면역원을 인코딩하는 핵산 서열은 서열 번호: 12를 포함하는 단백질을 인코딩할 수 있다.
RSV M2-1 면역원을 인코딩하는 핵산 서열은 서열 번호: 3에 대해 적어도 98% 상동성인 핵산 서열의 단편을 포함할 수 있다. 서열 번호: 3에 대해 적어도 98% 상동성인 핵산 서열은 서열 번호: 4에 대해 적어도 98% 상동성인 단백질을 인코딩한다. 단편은 서열 번호: 4에 대해 적어도 98% 상동성인 단백질의 면역원성 단편을 인코딩한다. 일부 구현예에서, RSV M2-1 면역원을 인코딩하는 핵산 서열은 서열 번호: 3에 대해 적어도 98% 상동성인 핵산 서열의 단편을 포함할 수 있으며, 여기서 핵산 서열은 서열 번호: 4에 대해 적어도 99% 상동성인 단백질을 인코딩하고, 일부 구현예에서 핵산 서열은 서열 번호: 4를 포함하는 단백질을 인코딩하고, 핵산 서열의 단편은 면역원성 단편 서열 번호: 4와 같은 서열 번호: 4에 대해 적어도 99% 상동성인 단백질의 면역원성 단편을 인코딩한다. 일부 이러한 구현예에서, RSV M2-1 면역원을 인코딩하는 핵산 서열은 서열 번호: 3 및 일부 구현예에서, 서열 번호: 3의 단편에 대해 적어도 99% 상동성인 핵산 서열의 단편을 포함할 수 있다. 일부 이러한 구현예에서, RSV M2-1 면역원을 인코딩하는 핵산 서열은 서열 번호: 17과 같은 신호 펩타이드를 인코딩하는 핵산 서열을 임의로 추가로 포함할 수 있다. RSV M2-1 면역원을 인코딩하는 핵산 서열은 서열 번호: 4의 단편 및 신호 펩타이드 서열 번호: 17을 인코딩하는 코딩 서열을 포함할 수 있다. RSV M2-1 면역원을 인코딩하는 핵산 서열은 신호 펩타이드 서열 번호: 17을 인코딩하는 코딩 서열을 포함하는 서열 번호: 11의 단편을 포함할 수 있다.
코딩 서열은 본원에 설정된 2개 이상의 RSV 단백질의 조합을 포함하는 융합 단백질을 인코딩할 수 있다. 코딩 서열은 공통 단백질 및/또는 공통 단백질의 단편 및/또는 공통 단백질의 변이체 및/또는 변이체 공통 단백질의 단편을 포함하는 융합 단백질을 인코딩할 수 있다. 공통 단백질 및/또는 공통 단백질의 단편 및/또는 공통 단백질의 변이체 및/또는 변이체 공통 단백질의 단편은 서로 인접하게 직접 연결될 수 있거나 이들 사이에 스페이서 또는 하나 이상의 아미노산과 함께 연결될 수 있다. 일부 구현예에서, 스페이스는 단백질분해 절단 부위일 수 있다. 일부 구현예에서, 스페이스는, 백신이 투여되고/되거나 섭취되도록 의도된 세포내에서 발견된 프로테아제에 의해 인식된 단백질분해 절단 부위일 수 있다.
일부 구현예에서, 코딩 서열은 본원에 설정된 2개 이상의 RSV 단백질의 조합을 포함하는 융합 단백질을 인코딩한다. 예를 들면, 코딩 서열은 서열 번호: 2 또는 이의 면역원성 단편 및 서열 번호: 4 또는 이의 면역원성 단편, 예를 들면, 서열 번호: 1 또는 이의 면역원성 단편을 인코딩하는 이의 단편 및 서열 번호: 3 또는 이의 면역원성 단편을 인코딩하는 이의 단편; 서열 번호: 2 또는 이의 면역원성 단편 및 서열 번호: 6 또는 이의 면역원성 단편, 예를 들면, 서열 번호: 1 또는 이의 면역원성 단편을 인코딩하는 이의 단편 및 서열 번호: 5 또는 이의 면역원성 단편을 인코딩하는 이의 단편; 서열 번호: 2 또는 이의 면역원성 단편 및 서열 번호: 8 또는 이의 면역원성 단편, 예를 들면, 서열 번호: 1 또는 이의 면역원성 단편을 인코딩하는 이의 단편 및 서열 번호: 7 또는 이의 면역원성 단편을 인코딩하는 이의 단편; 서열 번호: 4 또는 이의 면역원성 단편 및 서열 번호: 6 또는 이의 면역원성 단편, 예를 들면, 서열 번호: 3 또는 이의 면역원성 단편을 인코딩하는 이의 단편 및 서열 번호: 5 또는 이의 면역원성 단편을 인코딩하는 이의 단편; 서열 번호: 4 또는 이의 면역원성 단편 및 서열 번호: 8 또는 이의 면역원성 단편, 예를 들면, 서열 번호: 3 또는 이의 면역원성 단편을 인코딩하는 이의 단편 및 서열 번호: 5 또는 이의 면역원성 단편을 인코딩하는 이의 단편; 서열 번호: 6 또는 이의 면역원성 단편 및 서열 번호: 6 또는 이의 면역원성 단편 및 서열 번호: 8 또는 이의 면역원성 단편, 예를 들면, 서열 번호: 5 또는 이의 면역원성 단편을 인코딩하는 이의 단편 및 서열 번호: 7 또는 이의 면역원성 단편을 인코딩하는 이의 단편을 포함하는 융합 단백질을 인코딩할 수 있다. 코딩 서열은 본원에 설정된 3개의 RSV 단백질의 조합을 포함하는 융합 단백질을 인코딩할 수 있다. 예를 들면, 코딩 서열은 서열 번호: 2 또는 이의 면역원성 단편, 서열 번호: 4 또는 이의 면역원성 단편 및 서열 번호: 6 또는 이의 면역원성 단편, 예를 들면, 서열 번호: 1 또는 이의 면역원성 단편을 인코딩하는 이의 단편, 서열 번호: 3 또는 이의 면역원성 단편을 인코딩하는 이의 단편 및 서열 번호: 5 또는 이의 면역원성 단편을 인코딩하는 이의 단편; 서열 번호: 2 또는 이의 면역원성 단편, 서열 번호: 4 또는 이의 면역원성 단편 및 서열 번호: 8 또는 이의 면역원성 단편, 예를 들면, 서열 번호: 1 또는 이의 면역원성 단편을 인코딩하는 이의 단편, 서열 번호: 3 또는 이의 면역원성 단편을 인코딩하는 이의 단편 및 서열 번호; 7 또는 이의 면역원성 단편을 인코딩하는 이의 단편; 및 서열 번호: 4 또는 이의 면역원성 단편, 서열 번호: 6 또는 이의 면역원성 단편 및 서열 번호: 8 또는 이의 면역원성 단편, 예를 들면, 서열 번호: 3 또는 이의 면역원성 단편을 인코딩하는 이의 단편, 서열 번호: 5 또는 이의 면역원성 단편을 인코딩하는 이의 단편 및 서열 번호: 7 또는 이의 면역원성 단편을 인코딩하는 이의 단편을 포함하는 융합 단백질을 인코딩할 수 있다. 코딩 서열은 서열 번호: 2 또는 이의 면역원성 단편, 서열 번호: 4 또는 이의 면역원성 단편, 서열 번호: 6 또는 이의 면역원성 단편, 및 서열 번호: 8 또는 이의 면역원성 단편, 예를 들면, 예를 들면, 서열 번호: 1 또는 이의 면역원성 단편을 인코딩하는 이의 단편, 서열 번호: 3 또는 이의 면역원성 단편을 인코딩하는 이의 단편, 서열 번호: 5 또는 이의 면역원성 단편을 인코딩하는 이의 단편 및 서열 번호: 7 또는 이의 면역원성 단편을 인코딩하는 이의 단편을 인코딩하는 코딩 서열과 같은 본원에 설정된 4개의 RSV 단백질의 조합을 포함하는 융합 단백질을 인코딩할 수 있다. 달리는, 하나 이상의 상기 융합 단백질을 인코딩하는 코딩 서열은 서열 번호: 2 또는 면역원성 단편에 상응하는 상기 기술된 융합 단백질의 부위 대신에 서열 번호; 2 또는 이의 면역원성 단편에 대해 적어도 98% 또는 적어도 99% 상동성인 단백질을 인코딩하는 서열을 포함할 수 있다. 유사하게, 상기 하나 이상의 융합 단백질에 대한 코딩 서열은 서열 번호: 4 또는 면역원성 단편 일부 구현예에서, 상기 하나 이상의 융합 단백질을 인코딩하는 코딩 서열은 서열 번호: 2 또는 면역원성 단편을 인코딩하는 부위에 상응하는 상기 기술된 융합 단백질의 코딩 서열의 부위 대신에 서열 번호: 2의 면역원성 단편에 대해 적어도 98% 또는 적어도 99% 상동성인 서열 번호: 1 또는 이의 단편에 대해 적어도 98% 또는 적어도 99% 상동성인 서열을 포함할 수 있다. 하나 이상의 상기 융합 단백질을 인코딩하는 코딩 서열은 서열 번호: 4 또는 면역원성 단편을 인코딩하는 부위에 상응하는 상기 기술된 융합 단백질의 코딩 서열의 부위 대신에 서열 번호: 4의 면역원성 단편에 대해 적어도 98% 또는 적어도 99% 상동성인 서열 번호: 3 또는 이의 단편에 대해 적어도 98% 또는 적어도 99% 상동성인 서열을 포함할 수 있다. 하나 이상의 상기 융합 단백질을 인코딩하는 코딩 서열은 서열 번호: 6 또는 면역원성 단편을 인코딩하는 부위에 상응하는 상기 기술된 융합 단백질의 코딩 서열의 부위 대신에 서열 번호: 6의 면역원성 단편에 대해 적어도 98% 또는 적어도 99% 상동성인 서열 번호: 5 또는 이의 단편에 대해 적어도 98% 또는 적어도 99% 상동성인 서열을 포함할 수 있다. 상기 하나 이상의 융합 단백질을 인코딩하는 코딩 서열은 서열 번호: 8 또는 면역원성 단편을 인코딩하는 부위에 상응하는 상기 기술된 융합 단백질의 코딩 서열의 부위 대신에 서열 번호: 8의 면역원성 단편에 대해 적어도 98% 또는 적어도 99% 상동성인 서열 번호: 7 또는 이의 단편에 대해 적어도 98% 또는 적어도 99% 상동성인 서열을 포함할 수 있다. 융합 단백질은 공통 단백질 및/또는 공통 단백질의 단편 및/또는 공통 단백질의 변이체 및/또는 변이체 공통 단백질의 단편을 포함할 수 있다. 공통 단백질 및/또는 공통 단백질의 단편 및/또는 공통 단백질의 변이체 및/또는 변이체 공통 단백질의 단편은 서로 인접하게 직접 연결될 수 있거나 이들 사이에 스페이서 또는 하나 이상의 아미노산과 함께 연결될 수 있다. 일부 구현예에서, 스페이스는 단백질분해 절단 부위일 수 있다. 일부 구현예에서, 스페이스는, 백신이 투여되고/되거나 섭취되도록 의도된 세포내에서 발견된 프로테아제에 의해 인식된 단백질분해 절단 부위일 수 있다.
4. 플라스미드
포유동물에서 면역 반응을 유발하기에 효과적인 양으로 포유동물의 세포내에서 하나 이상의 RSV 단백질을 발현할 수 있는 벡터가 본원에 제공된다. 벡터는 하나 이상의 RSV 항원을 인코딩하는 이종 핵산을 포함할 수 있다. 벡터는 플라스미드일 수 있다. 플라스미드는 세포를 RSV 항원을 인코딩하는 핵산으로 형질감염시키는데 유용할 수 있으며, 형질전환된 숙주 세포는 RSV 항원의 발현이 일어나는 조건하에서 배양되고 유지된다.
플라스미드는 다음의 3개의 단백질: F, Ga 및 Gb, 이러한 단백질의 단편, 이러한 단백질의 변이체, 변이체의 단편 또는 공통 단백질 및/또는 공통 단백질의 단편 및/또는 공통 단백질의 변이체 및/또는 변이체 공통 단백질의 단편의 조합으로 제조된 융합 단백질 각각에 대해 제공된 RSV에 대해 면역 반응을 유발할 수 있는 합성의, 콘센수스 항원을 인코딩하는 코딩 서열을 포함하는 상기 기재된 다양한 RSV 단백질 중의 하나 이상을 인코딩하는 핵산 서열을 포함할 수 있다. 플라스미드는 RSV M2-1, 이러한 단백질의 단편, 이러한 단백질의 변이체, 변이체의 단편 또는 공통 단백질 및/또는 공통 단백질의 단편 및/또는 공통 단백질의 변이체 및/또는 변이체 공통 단백질의 단편의 조합으로 제조된 융합 단백질에 대해 면역 반응을 유발할 수 있는 합성의, 콘센수스 항원을 인코딩하는 코딩 서열을 포함하는 상기 기재된 RSV M2-1 단백질을 인코딩하는 핵산 서열을 포함할 수 있다.
단일의 플라스미드는 단일의 RSV 면역원에 대한 코딩 서열, 2개의 RSV 면역원에 대한 코딩 서열, 또는 3개의 RSV 면역원에 대한 코딩 서열을 함유할 수 있다. 일부 구현예에서, 제4의 RSV 면역원에 대한 코딩 서열이 제공될 수 있다. 단일의 플라스미드는 RSV F 면역원에 대한 코딩 서열을 함유할 수 있다. 단일의 플라스미드는 RSV Ga 면역원에 대한 코딩 서열을 함유할 수 있다. 단일의 플라스미드는 RSV Gb 면역원에 대한 코딩 서열을 함유할 수 있다. 단일의 플라스미드는 RSV F 면역원에 대한 코딩 서열 및 RSV Ga 면역원에 대한 코딩 서열을 함유할 수 있다. 단일의 플라스미드는 RSV F 면역원에 대한 코딩 서열 및 RSV Gb 면역원에 대한 코딩 서열을 함유할 수 있다. 단일의 플라스미드는 RSV Ga 면역원에 대한 코딩 서열 및 RSV Gb 면역원에 대한 코딩 서열을 함유할 수 있다. 단일의 플라스미드는 RSV F 면역원에 대한 코딩 서열, RSV Ga 면역원에 대한 코딩 서열 및 RSV Gb 면역원에 대한 코딩 서열을 함유할 수 있다.
RSV M2-1 코딩 서열이 제공되는 경우, 단일의 플라스미드는 RSV M2-1 면역원에 대한 코딩 서열을 함유할 수 있다. 단일의 플라스미드는 RSV F 면역원에 대한 코딩 서열 및 RSV M2-1 면역원에 대한 코딩 서열을 함유할 수 있다. 단일의 플라스미드는 RSV M2-1 면역원에 대한 코딩 서열 및 RSV Ga 면역원에 대한 코딩 서열을 함유할 수 있다. 단일의 플라스미드는 RSV M2-1 면역원에 대한 코딩 서열 및 RSV Gb 면역원에 대한 코딩 서열을 함유할 수 있다. 단일의 플라스미드는 RSV F 면역원에 대한 코딩 서열, RSV M2-1 면역원에 대한 코딩 서열 및 RSV Ga 면역원에 대한 코딩 서열을 함유할 수 있다. 단일의 플라스미드는 RSV F 면역원에 대한 코딩 서열, RSV M2-1 면역원에 대한 코딩 서열 및 RSV Gb 면역원에 대한 코딩 서열을 함유할 수 있다. 단일의 플라스미드는 RSV M2-1 면역원에 대한 코딩 서열, RSV Ga 면역원에 대한 코딩 서열 및 RSV Gb 면역원에 대한 코딩 서열을 함유할 수 있다. 단일의 플라스미드는 RSV F 면역원에 대한 코딩 서열, RSV M2-1 면역원에 대한 코딩 서열, RSV Ga 면역원에 대한 코딩 서열 및 RSV Gb 면역원에 대한 코딩 서열을 함유할 수 있다.
일부 구현예에서, 플라스미드는 CCR20 만을 인코딩하거나 당해 플라스미드의 일부로서 인코딩하는 코딩 서열을 포함할 수 있다. 유사하게, 플라스미드는 IL-12, IL-15 및/또는 IL-28에 대한 코딩 서열을 추가로 포함할 수 있다.
플라스미드는 코딩 서열의 상류에 존재할 수 있는 개시 코돈, 및 코딩 서열의 하류에 존재할 수 있는 종료 코돈을 추가로 포함할 수 있다. 상기 개시 및 종료 코돈은 코딩 서열와 틀이 맞을 수 있다.
상기 플라스미드는 또한 코딩 서열에 작동가능하게 연결된 프로모터를 포함할 수 있다. 코딩 서열에 작동가능하게 연결된 프로모터는 유인원 바이러스 40 (SV40), 마우스 유선 종양 바이러스 (MMTV) 프로모터, 인간 면역결핍 바이러스 (HIV) 프로모터 예컨대 소 면역결핍 바이러스 (BIV) 긴 말단 반복 (LTR) 프로모터, 몰로니 바이러스 프로모터, 조류 백혈증 바이러스 (ALV) 프로모터, 사이토메갈로바이러스 (CMV) 프로모터, 예컨대 CMV 전초기 프로모터, 엡슈타인 바르 바이러스 (EBV) 프로모터, 또는 루(Rous) 육종 바이러스 (RSV) 프로모터 유래의 프로모터일 수 있다. 상기 프로모터는 또한 인간 유전자, 예컨대 인간 액틴, 인간 미오신, 인간 헤모글로빈, 인간 근육 크레아틴, 또는 인간 메탈로티오네인 유래의 프로모터일 수 있다. 프로모터는 천연 또한 합성의 근육 또는 피부 특이적인 프로모터와 같은, 조직 특이적인 프로모터일 수 있다. 이러한 프로모터의 예는, 이의 전문이 본원에 통합된 미국 특허원 공보 제US20040175727호에 기술되어 있다.
플라스미드는 코딩 서열의 하류에 존재할 수 있는 폴리아데닐화 신호를 또한 포함할 수 있다. 상기 폴리아데닐화 신호는 SV40 폴리아데닐화 신호, LTR 폴리아데닐화 신호, 소 성장 호르몬 (bGH) 폴리아데닐화 신호, 인간 성장 호르몬 (hGH) 폴리아데닐화 신호, 또는 인간 β-글로빈 폴리아데닐화 신호일 수 있다. SV40 폴리아데닐화 신호는 pCEP4 플라스미드 (Invitrogen, San Diego, CA) 유래의 폴리아데닐화 신호일 수 있다.
상기 플라스미드는 또한 코딩 서열의 상류에 인핸서를 포함할 수 있다. 상기 인핸서는 인간 액틴, 인간 미오신, 인간 헤모글로빈, 인간 근육 크레아틴 또는 바이러스 인핸서, 예컨대 CMV, FMDV, RSV 또는 EBV일 수 있다. 폴리뉴클레오타이드 기능 향상제는 미국 특허 제5,593,972호, 제5,962,428호, 및 제WO94/016737호에 기술되어 있으며, 각각의 내용은 참조로 완전히 통합되어 있다.
플라스미드는 또한 포유동물 복제 기원을 포함함으로써 플라스미드를 염색체외적으로 유지하고 세포 내에서 플라스미드의 다수 카피를 생산할 수 있다. 상기 플라스미드는 Invitrogen (San Diego, CA)사의 pVAX1, pCEP4 또는 pREP4일 수 있으며, 이는 엡슈타인 바르 바이러스 복제 기점 및 핵 항원 EBNA-1 코딩 영역을 포함할 수 있고, 이는 통합 없이 높은 카피 에피솜 복제를 생산할 수 있다. 상기 플라스미드의 뼈대는 pAV0242일 수 있다. 상기 플라스미드는 복제 결함 아데노바이러스 유형 5 (Ad5) 플라스미드일 수 있다.
상기 플라스미드는 또한 조절 서열을 포함할 수 있으며, 이는 플라스미드가 투여되는 세포 내에서의 유전자 발현에 적합할 수 있다. 상기 코딩 서열은 숙주 세포에서 코딩 서열의 보다 효율적인 전사를 가능하게 할 수 있는 코돈을 포함할 수 있다.
상기 코딩 서열은 또한 Ig 선도 서열을 포함할 수 있다. 상기 선도 서열은 코딩 서열의 5'일 수 있다. 이 서열에 의해 인코딩된 공통 항원은 N-말단 Ig 리더 다음으로 공통 항원 단백질을 포함할 수 있다. 상기 N-말단 Ig 리더는 IgE 또는 IgG일 수 있다.
플라스미드는 에스케리키아 콜라이 (이. 콜라이) 속에서 단백질 생산을 위해 사용될 수 있는 pSE420 (Invitrogen, San Diego, Calif.)일 수 있다. 상기 플라스미드는 또한 효모의 사카로마이세스 세레비시애 균주에서의 단백질 생산에 사용될 수 있는, pYES2 (Invitrogen, San Diego, Calif.)일 수 있다. 상기 플라스미드는 또한 곤충 세포내에서 단백질 생산을 위해 사용될 수 있는, MAXBACTM 완전 바큘로바이러스 발현 시스템(Invitrogen, San Diego, Calif.)일 수 있다. 상기 플라스미드는 또한 차이니즈 햄스터 난소(CHO) 세포와 같은 포유동물 세포내에서 단백질 생산을 위해 사용될 수 있는 pcDNA I 또는 pcDNA3 (Invitrogen, San Diego, Calif.)일 수 있다.
5. 조성물
핵산 분자를 포함하는 조성물이 제공된다. 조성물은 이러한 단일의 플라스미드와 같은 단일의 핵산 분자, 2개 이상의 상이한 플라스미드와같은 2개 이상의 상이한 핵산 분자의 다수의 카피를 포함할 수 있다. 예를 들면, 조성물은 2, 3, 4, 5, 6, 7, 8, 9 또는 10개 이상의 상이한 핵산 분자 다수를 포함할 수있다. 이러한 조성물은 2, 3, 4, 5, 6, 7, 8, 9 또는 10개 이상의 상이한 플라스미드 다수를 포함할 수 있다.
조성물은 단일의 RSV 면역원에 대한 코딩 서열, 2개의 RSV 면역원에 대한 코딩 서열, 또는 3개의 RSV 면역원에 대한 코딩 서열과 같은 핵산 분자를 포함할 수 있다. 일부 예에서, 제4의 RSV 면역원에 대한 코딩 서열이 제공될 수 있다.
2개의 RSV 면역원의 코딩 서열을 포함하는 조성물은 단일의 플라스미드와 같은 단일의 핵산 분자 상에 존재할 수 있거나 조성물은 2개의 상이한 플라스미드와 같은 2개의 상이한 핵산 분자를 포함할 수 있으며, 여기서 하나의 핵산 분자는 코딩 서열 하나의 RSV 면역원을 포함하며 다른 핵산 분자는 코딩 서열 상이한 RSV 면역원을 포함한다. 유사하게, 코딩 서열 3개의 RSV 면역원을 포함하는 조성물은 단일의 플라스미드, 2개의 상이한 핵산 분자 또는 3개의 상이한 핵산 분자와 같은 단일의 핵산 분자를 포함할 수 있다. 유사하게, 코딩 서열 4개의 RSV 면역원을 포함하는 조성물은 단일의 플라스미드와 같은 단일의 핵산 분자, 2개의 상이한 핵산 분자, 3개의 상이한 핵산 분자 또는 4개의 상이한 핵산 분자를 포함할 수 있다.
일부 구현예에서, 조성물은 하나의 RSV 면역원, 예를 들면, RSV F 면역원, RSV Ga 면역원 또는 RSV Gb 면역원을 인코딩하는 다수의 단일 핵산 분자를 포함한다. 일부 구현예에서, 조성물은 다수의 단일의 핵산 분자, 예를 들면, 2개의 RSV 면역원, 예를 들면, RSV F 면역원 및 RSV Ga 면역원, RSV F 면역원 및 RSV Gb 면역원, 및 RSV Ga 면역원 및 RSV Gb 면역원을 포함한다. 일부 구현예에서, 조성물은 다수의 단일의 핵산 분자, 예를 들면, 3개의 RSV 면역원, 예를 들면, RSV Ga 면역원, RSV F 면역원 및 RSV Gb 면역원을 포함한다.
일부 구현예에서, 조성물은 다수의 2개의 상이한 핵산 분자, 예를 들면, 2개의 플라스미드를 포함하며, 각각의 상이한 핵산 분자는 상이한 RSV 면역원에 대한 단일의 상이한 코딩 서열을 포함하고, 여기서 상이한 핵산 분자의 쌍은 RSV F 면역원과 RSV Ga 면역원, RSV F 면역원과 RSV Gb 면역원, 및 RSV Ga 면역원과 RSV Gb 면역원을 포함한다.
일부 구현예에서, 조성물은 다수의 2개의 상이한 핵산 분자, 예를 들면, 2개의 플라스미드를 포함하며, 이는 3개의 상이한 RSV 면역원에 대한 코딩 서열을 총괄적으로 포함한다. 일부 구현예에서, 하나는 RSV F 면역원 및 RSV Ga 면역원을 인코딩하고, 두 번째는 RSV Gb 면역원을 인코딩한다. 일부 구현예에서, 하나는 RSV F 면역원 및 RSV Gb 면역원을 인코딩하고, 두 번째는 RSV Ga 면역원을 인코딩한다. 일부 구현예에서, 하나는 Ga 면역원 및 RSV Gb 면역원을 인코딩하고, 두 번째는 RSV F 면역원을 인코딩한다.
일부 구현예에서, 조성물은 RSV M2-1 면역원을 인코딩하는 다수의 단일의 핵산 분자를 포함한다.
RSV M2-1에 대한 코딩 서열이 제공되는 일부 구현예에서, 조성물은 다수의 단일의 핵산 분자, 예를 들면, 2개의 RSV 면역원, 예를 들면, RSV F 면역원과 RSV M2-1 면역원, RSV M2-1 면역원과 RSV Ga 면역원, 및 RSV M2-1 면역원과 RSV Gb 면역원을 인코딩하는 단일의 플라스미드를 포함한다.
RSV M2-1에 대한 코딩 서열이 제공되는 일부 구현예에서, 다수의 단일의 핵산 분자, 예를 들면, 단일의 플라스미드는 3개의 RSV 면역원, 예를 들면, RSV F 면역원, RSV M2-1 면역원 및 RSV Ga 면역원, RSV F 면역원, RSV M2-1 면역원 및 RSV Gb 면역원, RSV M2-1 면역원, RSV Ga 면역원 및 RSV Gb 면역원을 인코딩한다. 일부 구현예에서, 조성물은 다수의 단일의 핵산 분자, 예를 들면, 3개의 RSV 면역원, 예를 들면, RSV F 면역원, RSV M2-1 면역원, RSV Ga 면역원 및 RSV Gb 면역원을 인코딩하는 단일의 플라스미드를 포함한다.
RSV M2-1에 대한 코딩 서열이 제공되는 일부 구현예에서, 조성물은 다수의 2개의 상이한 핵산 분자, 예를 들면 2개의 플라스미드를 포함하며, 각각의 상이한 핵산 분자는 상이한 RSV 면역원에 대한 단일의 상이한 코딩 서열을 포함하고 여기서 상이한 핵산 분자의 쌍은 RSV F 면역원과 RSV M2-1 면역원, RSV M2-1 면역원과 RSV Ga 면역원, 및 RSV M2-1 면역원과 RSV Gb 면역원을 포함한다.
RSV M2-1에 대한 코딩 서열이 제공되는 일부 구현예에서, 조성물은 다수의 2개의 상이한 핵산 분자, 예를 들면, 2개의 플라스미드를 포함하고 이는 3개의 상이한 RSV 면역원에 대한 코딩 서열을 총괄적으로 포함하거나 어느 하나는 RSV M2-1이다. 구현예는 다음으로 이루어진 그룹 중에서 선택될 수 있다: 하나의 핵산 분자는 RSV F 면역원과 RSV M2-1 면역원을 인코딩하고 두 번째는 RSV Ga 면역원을 인코딩하며; 하나의 핵산 분자는 RSV F 면역원과 RSV M2-1 면역원을 인코딩하고 두 번째는 RSV Gb 면역원을 인코딩하며; 하나는 RSV F 면역원과 RSV Ga 면역원을 인코딩하고, 두 번째는 RSV M2-1 면역원을 인코딩하며; 하나는 RSV F 면역원과 RSV Gb 면역원을 인코딩하고, 두 번째는 RSV M2-1 면역원을 인코딩하며; 하나는 RSV M2-1 면역원과 RSV Ga 면역원을 인코딩하고, 두 번째는 RSV F 면역원을 인코딩하며; 하나는 RSV M2-1 면역원과 RSV Ga 면역원을 인코딩하고, 두 번째는 RSV Gb 면역원을 인코딩하며; 하나는 RSV M2-1 면역원과 RSV Gb 면역원을 인코딩하고, 두 번째는 RSV F 면역원을 인코딩하며; 하나는 RSV M2-1 면역원과 RSV Gb 면역원을 인코딩하고, 두 번째는 RSV Ga 면역원을 인코딩하며; 하나는 Ga 면역원과 RSV Gb 면역원을 인코딩하고, 두 번째는 RSV M2-1 면역원을 인코딩한다.
RSV M2-1에 대한 코딩 서열이 제공되는 일부 구현예에서, 조성물은 다수의 2개의 상이한 핵산 분자, 예를 들면, 2개의 플라스미드를 포함하며, 이는 4개의 상이한 RSV 면역원에 대한 코딩 서열을 총괄적으로 포함한다. 일부 구현예에서: 하나의 핵산 분자는 RSV F 면역원을 인코딩하고 두 번째는 RSV M2-1 면역원, RSV Ga 면역원 및 RSV Gb 면역원을 인코딩하며; 하나의 핵산 분자는 RSV M2-1 면역원을 인코딩하고 두 번째는 RSV F 면역원, RSV Ga 면역원 및 RSV Gb 면역원을 인코딩하며; 하나는 RSV Ga 면역원을 인코딩하고 두 번째는 RSV F 면역원, RSV M2-1 면역원 및 RSV Gb 면역원을 인코딩하며, 하나는 RSV Gb 면역원을 인코딩하고 두 번째는 RSV F 면역원, RSV M2-1 면역원 및 RSV Ga 면역원을 인코딩하며, 하나는 RSV F 및 RSV M2-1 면역원을 인코딩하고 두 번째는 RSV Ga 면역원 및 RSV Gb 면역원을 인코딩하며, 하나는 RSV F 및 RSV Ga 면역원을 인코딩하고 두 번째는 RSV M2-1 면역원 및 RSV Gb 면역원을 인코딩하고, 하나는 RSV F 및 RSV Gb 면역원을 인코딩하고 두 번째는 RSV M2-1 면역원 및 RSV Ga 면역원을 인코딩한다. 일부 구현예에서, 조성물은 3개의 상이한 RSV 면역원에 대한 코딩 서열을 총괄적으로 포함하는, 다수의 3개의 상이한 핵산 분자, 예를 들면, 3개의 플라스미드를 포함한다. 일부 구현예에서: 하나의 핵산 분자는 RSV F 면역원을 인코딩하고, 두 번째는 RSV M2-1 면역원 을 인코딩하며, 세 번째는 RSV Ga 면역원을 인코딩하고; 하나의 핵산 분자는 RSV F 면역원을 인코딩하고, 두 번째는 RSV M2-1 면역원을 인코딩하며 세 번째는 RSV Gb 면역원 면역원을 인코딩하며; 하나의 핵산 분자는 RSV F 면역원을 인코딩하고, 두 번째는 RSV Ga 면역원을 인코딩하며 세 번째는 RSV Gb 면역원을 인코딩하고; 하나의 핵산 분자는 RSV M2-1 면역원을 인코딩하고, 두 번째는 RSV Ga 면역원을 인코딩하며 세 번째는 RSV Gb 면역원을 인코딩한다. 일부 구현예에서, 조성물은 4개의 상이한 RSV 면역원에 대한 코딩 서열을 총괄적으로 포함하는, 다수의 3개의 상이한 핵산 분자, 예를 들면, 3개의 플라스미드를 포함한다. 일부 구현예에서: 하나의 핵산 분자는 RSV F 면역원을 인코딩하고, 두 번째는 RSV M2-1 면역원 을 인코딩하며, 세 번째는 RSV Ga 면역원 및 RSV Gb 면역원을 인코딩하고; 하나의 핵산 분자는 RSV F 면역원을 인코딩하고, 두 번째는 RSV Ga 면역원을 인코딩하며 세 번째는 RSV M2-1 면역원 및 RSV Gb 면역원을 인코딩하며; 하나의 핵산 분자는 RSV F 면역원을 인코딩하고, 두 번째는 RSV Gb 면역원을 인코딩하며 세 번째는 RSV M2-1 면역원 및 RSV Ga 면역원을 인코딩하고; 하나의 핵산 분자는 RSV M2-1 면역원을 인코딩하고, 두 번째는 RSV Ga 면역원을 인코딩하며 세 번째는 RSV F 면역원 및 RSV Gb 면역원을 인코딩하고; 하나의 핵산 분자는 RSV M2-1 면역원을 인코딩하며, 두 번째는 RSV Gb 면역원을 인코딩하고, 세 번째는 RSV F 면역원 및 RSV Ga 면역원을 인코딩하며; 하나는 RSV Ga 면역원을 인코딩하고, 두 번째는 RSV Gb 면역원을 인코딩하며, 세 번째는 RSV F 면역원 및 RSV M2-1을 인코딩한다. 일부 구현예에서, 조성물은 다수의 4개의 상이한 핵산 분자, 예를 들면 4개의 플라스미드를 포함하고, 이는 4개의 상이한 RSV 면역원에 대한 코딩 서열을 총괄적으로 포함하는데, 즉, 하나의 핵산 분자는 RSV F 면역원을 인코딩하고, 두 번째는 RSV M2-1 면역원을 인코딩하며, 세 번째는 RSV Ga 면역원을 인코딩하고 네 번째는 RSV Gb 면역원을 인코딩한다.
일부 구현예에서, 조성물은 케모킨 CCL20, IL-12, IL-15 및/또는 IL-28에 대한 코딩 서열을 추가로 포함한다. 케모킨 CCL20, IL-12, IL-15 및/또는 IL-28에 대한 코딩 서열은 하나 이상의 RSV 면역원에 대한 코딩 서열을 포함하는 하나 이상의 핵산 분자 위에 포함될 수 있다. 케모킨 CCL20, IL-12, IL-15 및/또는 IL-28에 대한 코딩 서열은 별도의 플라스미드와 같은 별도의 핵산위에 포함될 수 있다.
6. 백신
RSV에 대한 포유동물 면역 반응을 생성할 수 있는 백신이 본원에 제공된다. 상기 백신은 위에 논의된 바와 같은 각각의 플라스미드를 포함할 수 있다. 상기 백신은 복수의 플라스미드, 또는 이들의 조합을 포함할 수 있다. 상기 백신은 치료학적 또는 예방학적 면역 반응을 유도하도록 제공될 수 있다.
일부 구현예에서, 백신은 바람직하게는 선행의 Th2 관련된 발병에 관여하지 않도록 편향된 Th1이며 이는 중화 민감성 환경에서 기능할 수 있어야 한다. 바람직하게는, 이는 살아있지 않아야 한다.
백신은 F, Ga 및 Gb, 이러한 단백질의 단편, 이러한 단백질의 변이체, 변이체의 단편으로 이루어진 그룹 중에서 선택된 하나 이상의 면역원성 표적을 전달하는데 사용될 수 있다. 다수의 표적을 전달하는 경우에, 백신은 다수의 조성물 또는 단일의 조성물을 포함할 수 있다. 단일의 플라스미드 상에 다수의 단백질을 인코딩하는 플라스미드 또는 상이한 단백질을 인코딩하는 상이한 플라스미드를 포함하는 조성물이 사용될 수 있다. 일부 구현예에서, 백신은 M2, 이의 단편, M2-1의 변이체, 변이체의 단편을 단독으로 또는 F, Ga 및 Gb, 이러한 단백질의 단편, 이러한 단백질의 변이체, 변이체의 단편으로 이루어진 그룹 중에서 선택된 하나 이상의 면역원성 표적과 함께 전달하기 위해 사용될 수 있다. 다수의 표적을 전달하는 경우에, 백신은 다수의 조성물 또는 단일의 조성물을 포함할 수 있다. 단일의 플라스미드 상에 다수의 단백질을 인코딩하는 플라스미드 또는 상이한 단백질을 인코딩하는 상이한 플라스미드를 포함하는 조성물이 사용될 수 있다.
상기 백신은 약제학적으로 허용되는 부형제를 추가로 포함할 수 있다. 상기 약제학적으로 허용가능한 부형제는 비히클, 아쥬반트, 담체, 또는 희석제로서 기능적 분자일 수 있다. 상기 약제학적으로 허용가능한 부형제는 형질감염 촉진제일 수 있으며, 이는 계면 활성제, 예컨대 면역-자극 복합체 (ISCOMS), 프로인트 불완전한 아쥬반트, 모노포스포릴 지질 A를 포함하는 LPS 유사체, 뮤라밀 펩타이드, 퀴논 유사체, 소포 예컨대 스쿠알렌 및 스쿠알렌, 히알루론산, 지질, 리포좀, 칼슘 이온, 바이러스 단백질, 폴리음이온, 폴리양이온, 또는 나노입자, 또는 다른 공지된 형질감염 촉진제를 포함할 수 있다.
상기 형질감염 촉진제는 폴리음이온, 폴리-L-글루타메이트 (LGS)를 포함하는 폴리양이온, 또는 지질이다. 상기 형질감염 촉진제는 폴리-L-글루타메이트이며, 더욱 바람직하게는, 상기 폴리-L-글루타메이트는 6 mg/ml 미만의 농도로 백신 내에 존재한다. 상기 형질감염 촉진제는 또한 계면 활성제 예컨대 면역-자극 복합체 (ISCOMS), 프로인트 불완전한 아쥬반트, 모노포스포릴 지질 A를 포함하는 LPS 유사체, 뮤라밀 펩타이드, 퀴논 유사체 및 소포, 예컨대 스쿠알렌 및 스쿠알렌, 및 히알루론산을 포함할 수 있고, 히알루론산이 상기 유전적 컨스트럭트와 함께 투여되어 사용될 수 있다. 일부 구현예에서, DNA 플라스미드 백신은 또한 형질감염 촉진제, 예컨대 지질, DNA-리포좀 혼합물 (예를 들면 W09324640 참고)로서 레시틴 리포좀 또는 본 기술분야에 공지된 다른 리포좀을 포함하는 리포좀, 칼슘 이온, 바이러스 단백질, 다중음이온, 폴리양이온, 또는 나노입자, 또는 다른 공지된 형질감염 촉진제를 포함할 수 있다. 바람직하게는, 상기 형질감염 촉진제는 폴리음이온, 폴리-L-글루타메이트 (LGS)를 포함하는 폴리양이온, 또는 지질이다. 백신 속의 형질감염제의 농도는 4 mg/ml 미만, 2 mg/ml 미만, 1 mg/ml 미만, 0.750 mg/ml 미만, 0.500 mg/ml 미만, 0.250 mg/ml 미만, 0.100 mg/ml 미만, 0.050 mg/ml, 또는 0.010 mg/ml 미만이다.
상기 약제학적으로 허용되는 부형제는 하나 이상의 아쥬반트일 수 있다. 아쥬반트는 동일하거나 대체 플라스미드로부터 발현되거나 백신 속에 상기 플라스미드와 함께 단백질로서 전달되는 다른 유전자일 수 있다. 하나 이상의 아쥬반트는 CCL20, α-인터페론(IFN- α), β-인터페론(IFN-β), γ-인터페론, 혈소판 기원 성장 인자(PDGF), TNFα, TNFβ, GM-CSF, 상피 성장 인자(EGF), 피하 T 세포-유집 케모킨(CTACK), 상피 가슴샘-발현된 케모킨(TECK), 점막-관련된 상피 케모킨(MEC), IL-12, 신호 서열 또는 결실된 신호 서열을 인코딩하는 코딩 서열을 갖는 IL-15를 포함하고 IgE로부터의 것과 같은 상이한 신호 펩타이드 또는 IgE, IL-28, MHC, CD80, CD86, IL-1, IL-2, IL-4, IL-5, IL-6, IL-10, IL-18, MCP-1, MIP-lα, MIP-1β, IL-8, L-셀렉틴, P-셀렉틴, E-셀렉틴, CD34, GlyCAM-1, MadCAM-1, LFA-1, VLA-1, Mac-1, pl50.95, PECAM, ICAM-1, ICAM-2, ICAM-3, CD2, LFA-3, M-CSF, G-CSF, IL-18의 돌연변이체 형태, CD40, CD40L, 혈관 성장 인자, 섬유아세포 성장 인자, IL-7, 신경 성장 인자, 혈관 내피 성장 인자, Fas, TNF 수용체, Flt, Apo-1, p55, WSL-1, DR3, TRAMP, Apo-3, AIR, LARD, NGRF, DR4, DR5, KILLER, TRAIL-R2, TRICK2, DR6, 카스파제 ICE, Fos, c-jun, Sp-1, Ap-1, Ap-2, p38, p65Rel, MyD88, IRAK, TRAF6, IkB, 불활성 NIK, SAP K, SAP-1, JNK, 인터페론 반응 유전자, NFkB, Bax, TRAIL, TRAILrec, TRAILrecDRC5, TRAIL-R3, TRAIL-R4, RANK, RANK LIGAND, Ox40, Ox40 LIGAND, NKG2D, MICA, MICB, NKG2A, NKG2B, NKG2C, NKG2E, NKG2F, TAP1, TAP2 및 이의 기능성 단편, 또는 이의 조합으로부터의 것과 같은 상이한 신호 펩타이드를 임의로 포함하는 코딩 서열을 임의로 포함하는 IL-15로 이루어진 그룹 중에서 선택된 단백질을 인코딩하는 단백질 및/또는 핵산 분자일 수 있다. 일부 구현예에서, 아쥬반트는 하나 이상의 단백질 및/또는 CCL-20, IL-12, IL-15, IL-28, CTACK, TECK, MEC 또는 RANTES로 이루어진 그룹 중에서 선택된 단백질을 인코딩하는 핵산 분자일 수 있다. IL-12 컨스트럭트 및 서열의 예는 PCT 출원 제PCT/US1997/019502호 및 상응하는 미국 특허원 일련 번호 제08/956,865호, 및 2011년 12월 12일자로 출원된 미국 가특허원 일련번호 제 61/569600호에 기재되어 있으며, 이들은 각각 본원에 참조로 통합되어 있다. IL-15 컨스트럭트 및 서열은 PCT 출원 제PCT/US04/18962호 및 상응하는 미국 특허원 일련번호 제10/560,650호, 및 PCT 출원 제PCT/US07/00886호 및 상응하는 미국 특허원 일련 번호 제12/160,766호, 및 PCT 출원 제PCT/US10/048827호에 기재되어 있으며, 이는 각각 본원에 참조로 통합되어 있다. IL-28 컨스트럭트의 예는 PCT 출원 제PCT/US09/039648호 및 상응하는 미국 특허원 일련 번호 제12/936,192호에 기재되어 있으며, 이는 각각 본원에 참조로 통합되어 있다. RANTES 및 다른 컨스트럭트 및 서열의 예는 PCT 출원 제PCT/US1999/004332호 및 상응하는 미국 특허원 일련 번호 제09/622452호에 기재되어 있으며, 이는 각각 본원에 참조로 통합되어 있다. RANTES 컨스트럭트 및 서열의 다른 예는 본원에 참조로 통합된 PCT 출원 제PCT/US11/024098호에 기재되어 있다. RANTES 및 다른 컨스트럭트 및 서열의 예는 각각 본원에 참조로 통합된 PCT 출원 제 PCT/US1999/004332호 및 상응하는 미국 특허원 일련 번호 제09/622452호에 기재되어 있다. RANTES 컨스트럭트 및 서열의 다른 예는 본원에 참조로 통합된 PCT 출원 제PCT/US11/024098호에 기재되어 있다. 케모킨 CTACK, TECK 및 MEC 컨스트럭트 및 서열의 예는 각각 본원에 참조로 통합된 PCT 출원 제PCT/US2005/042231호 및 상응하는 미국 특허원 일련 번호 제11/719,646호에 기재되어 있다. OX40 및 다른 면역조절제의 예는 본원에 참조로 통합된 미국 특허원 일련 번호 제10/560,653호에 기재되어 있다. DR5 및 다른 면역조절제의 예는 본원에 참조로 통합된 미국 특허원 일련 번호 제09/622452호에 기재되어 있다.
백신은 참조로 완전히 통합된, 1994년 4월 1일자로 출원된 미국 일련 번호 제021,579호에 기술된 바와 같은 유전 백신 촉진제를 추가로 포함할 수 있다.
상기 백신은 약 1 나노그램 내지 100 밀리그램; 약 1 마이크로그램 내지 약 10 밀리그램; 또는 바람직하게는 약 0.1 마이크로그램 내지 약 10 밀리그램; 또는 더 바람직하게는 약 1 밀리그램 내지 약 2 밀리그램의 양의 공통 항원 및 플라스미드를 포함할 수 있다. 일부 바람직한 구현예에서, 본 발명에 따른 약제학적 조성물은 약 5 나노그램 내지 약 1000 마이크로그램의 DNA를 포함한다. 일부 바람직한 구현예에서, 상기 약제학적 조성물은 약 10 나노그램 내지 약 800 마이크로그램의 DNA를 함유한다. 일부 바람직한 구현예에서, 상기 약제학적 조성물은 약 0.1 내지 약 500 마이크로그램의 DNA를 함유한다. 일부 바람직한 구현예에서, 상기 약제학적 조성물은 약 1 내지 약 350 마이크로그램의 DNA를 함유한다. 일부 바람직한 구현예에서, 상기 약제학적 조성물은 약 25 내지 약 250 마이크로그램, 약 100 내지 약 200 마이크로그램, 약 1 나노그램 내지 100 밀리그램; 약 1 마이크로그램 내지 약 10 밀리그램; 약 0.1 마이크로그램 내지 약 10 밀리그램; 약 1 밀리그램 내지 약 2 밀리그램, 약 5 나노그램 내지 약 1000 마이크로그램, 약 10 나노그램 내지 약 800 마이크로그램, 약 0.1 내지 약 500 마이크로그램, 약 1 내지 약 350 마이크로그램, 약 25 내지 약 250 마이크로그램, 약 100 내지 약 200 마이크로그램의 이의 공통 항원 또는 플라스미드를 함유한다.
상기 백신은 사용될 투여 방식에 따라 제형화될 수 있다. 주사가능한 백신 약제학적 조성물은 멸균되고, 발열물질이 없고 미립자가 없을 수 있다. 등장성 제형 또는 용액이 사용될 수 있다. 등장성을 위한 첨가제는 염화나트륨, 덱스트로오스, 만니톨, 소르비톨, 및 락토오스를 포함할 수 있다. 상기 백신은 혈관수축제를 포함할 수 있다. 상기 등장성 용액은 인산염 완충 염수를 포함할 수 있다. 백신은 젤라틴 및 알부민을 포함하는 안정화제를 추가로 포함할 수 있다. LGS 또는 폴리양이온 또는 폴리음이온과 같은 안정화제는 상기 백신 제형에 대해 연장된 기간 동안 상온 또는 주위 온도에서 제형을 안정화시킬 수 있다.
7. 백신의 전달 방법
면역 반응이 유도될 수 있는 RSV의 면역원에 대해 특히 효과적이도록 하는 에피토프를 포함하는 공통 항원의 단백질 또는 유전 컨스트럭트를 제공하기 위한 백신을 전달하는 방법이 본원에 제공된다. 치료학적 및 예방학적 면역 반응을 유도할 수 있는 백신을 전달하는 방법 또는 예방접종이 제공될 수 있다. 상기 예방접종 공정은 포유동물 내에서 RSV에 대한 면역반응을 생성할 수 있다. 상기 백신은 포유동물의 면역계의 활성을 조절하고 면역 반응을 향상시키기 위해 개인에게 전달될 수 있다. 백신의 전달은, 면역 반응의 인식 시 세포내에서 발현되어 세포의 표면으로 전달되고 세포성, 체액성, 또는 세포 및 체액성 반응을 유도하는 핵산 분자와 같이 공통 항원의 형질감염일 수 있다. 상기 백신의 전달은 위에서 논의한 바와 같은 백신을 포유동물에게 투여함으로써 RSV에 대해 포유동물내에서 면역 반응을 유도하거나 유발시키는데 사용될 수 있다.
상기 포유동물의 세포내로 백신 및 플라스미드의 전달 시, 형질감염된 세포는 백신으로부터 주사된 플라스미드 각각에 대한 공통 항원을 발현하여 분비할 것이다. 이들 단백질은 면역계에 의해 외부인자로 인식될 것이고 항체가 이에 대해 제조될 것이다. 이들 항체는 면역계에 의해 유지되어 후속적인 RSV 감염에 대해 효과적인 반응이 일어나도록 할것이다.
상기 백신은 포유동물에게 투여되어 포유동물내에서 면역 반응을 유발할 수 있다. 상기 포유동물은 인간, 영장류, 비-인간 영장류, 젖소, 소, 양, 염소, 영양, 들소, 물소, 들소, 소과, 사슴, 헤지혹, 코끼리, 라마, 알파카, 마우스, 랫트, 및 닭일 수 있다.
a. 조합 치료요법
백신은 CCL20, α-인터페론, γ-인터페론, 혈소판 기원 성장 인자(PDGF), TNFα, TNFβ, GM-CSF, 상피 성장 인자(EGF), 피하 T 세포-유집 케모킨(CTACK), 상피 가슴샘-발현된 케모킨(TECK), 점막-관련된 상피 케모킨(MEC), IL-12, 결실된 신호 서열을 갖고 IgE 신호 펩타이드와 같은 상이한 신호 펩타이드, MHC, CD80, CD86, IL-28, IL-1, IL-2, IL-4, IL-5, IL-6, IL-10, IL-18, MCP-1, MIP-lα, MIP-1β, IL-8, RANTES, L-셀렉틴, P-셀렉틴, E-셀렉틴, CD34, GlyCAM-1, MadCAM-1, LFA-1, VLA-1, Mac-1, pl50.95, PECAM, ICAM-1, ICAM-2, ICAM-3, CD2, LFA-3, M-CSF, G-CSF, IL-18의 돌연변이체 형태, CD40, CD40L, 혈관 성장 인자, 섬유아세포 성장 인자, IL-7, 신경 성장 인자, 혈관 내피 성장 인자, Fas, TNF 수용체, Flt, Apo-1, p55, WSL-1, DR3, TRAMP, Apo-3, AIR, LARD, NGRF, DR4, DR5, KILLER, TRAIL-R2, TRICK2, DR6, 카스파제 ICE, Fos, c-jun, Sp-1, Ap-1, Ap-2, p38, p65Rel, MyD88, IRAK, TRAF6, IkB, 불활성 NIK, SAP K, SAP-1, JNK, 인터페론 반응 유전자, NFkB, Bax, TRAIL, TRAILrec, TRAILrecDRC5, TRAIL-R3, TRAIL-R4, RANK, RANK LIGAND, Ox40, Ox40 LIGAND, NKG2D, MICA, MICB, NKG2A, NKG2B, NKG2C, NKG2E, NKG2F, TAP1, TAP2 및 이의 기능성 단편, 또는 이의 조합으로부터의 것과 같은 상이한 신호 펩타이드를 임의로 포함하는 IL-15를 인코딩하는 기타 단백질 및/또는 유전자와 함께 투여될 수 있다. 일부 구현예에서, 백신은 다음의 핵산 분자 및/또는 단백질 중의 하나 이상과 함께 투여된다: 하나 이상의 CCL20, IL-12, IL-15, IL-28, CTACK, TECK, MEC 및 RANTES을 인코딩하는 코딩 서열을 포함하는 핵산 분자 또는 이의 기능성 단편으로 이루어진 그룹 중에서 선택된 핵산 분자, 및 CCL02, IL-12 단백질, IL-15 단백질, IL-28 단백질, CTACK 단백질, TECK 단백질, MEC 단백질 또는 RANTES 단백질로 이루어진 그룹 중에서 선택된 단백질 또는 이의 기능성 단편.
상기 백신은 경구, 비경구, 설하, 경피, 직장, 경점막, 국소, 흡입을 통해, 볼내 투여를 통해, 흉막내로, 정맥내, 동맥내, 복강내, 피하, 근육내, 비강내, 경막내, 및 동맥내, 또는 이의 조합을 포함하는 상이한 경로로 투여될 수 있다. 수의학적 용도를 위해, 상기 조성물은 일반적인 수의학적 관례에 따라 적합하게 허용가능한 제형으로서 투여될 수 있다. 수의사는 특정 동물에 가장 적절한 복용 요법 및 투여 경로를 쉽게 결정할 수 있다. 상기 백신은 전통적 주사기, 무바늘 주사 장치, "미세투사 충격 고운 건(microprojectile bombardment gone guns)", 또는 전기천공 ("EP"), "유체역학적 방법", 또는 초음파와 같은 다른 물리적 방법에 의해 투여될 수 있다.
상기 백신의 플라스미드는 생체내 전기천공을 이용하여 그리고 이를 이용하지 않고 DNA 주사 (또한 DNA 백신접종으로도 불림), 리포좀 매개된, 나노입자 촉진된, 재조합 벡터, 예컨대 재조합 아데노바이러스, 재조합 아데노바이러스 연관된 바이러스 및 재조합 우두를 포함하는 널리 공지된 몇 가지 기술에 의해 포유동물에게 전달될 수 있다. 공통 항원은 DNA 주사를 통해 그리고 생체내 전기천공과 함께 전달될 수 있다.
b. 전기천공
상기 백신의 플라스미드의 전기천공을 통한 백신의 투여는, 가역적 기공이 세포막에 형성되게 하는데 효과적인 에너지의 펄스를 포유동물의 원하는 조직에 전달하도록 구성될 수 있는 전기천공 장치를 이용하여 달성될 수 있고, 바람직한 에너지의 펄스는 사용자에 의해 입력된 미리 조정된 전류와 유사한 정전류다. 상기 전기천공 장치는 전기천공 구성요소 및 전극 어셈블리 또는 핸들 어셈블리를 포함할 수 있다. 전기천공 구성요소는 조절기, 정전류형 생성기, 임피던스 시험기, 파형 로거(waveform logger), 입력 요소, 상태 보고 요소, 통신 포트, 기억 구성요소, 파워력, 및 파워 스위치를 포함하는 전기천공 장치의 각종 요소 중 하나 이상을 포함하거나 통합할 수 있다. 전기천공은 생체내 전기천공 장치, 예를 들면, CELLECTRA EP 시스템(VGX Pharmaceuticals, Blue Bell, PA) 또는 엘겐 전기천공기(Genetronics, San Diego, CA)를 사용하여 플라스미드에 의한 세포의 형질감염을 촉진시킬 수 있다.
전기천공 구성요소는 전기천공 장치의 하나의 요소로서 기능할 수 있으며, 다른 요소는 전기천공구성요소와 통신하는 별개의 요소(또는 구성요소)이다. 상기 전기천공 구성요소는 전기천공 장치의 하나를 초과하는 요소로서 기능할 수 있고, 이는 상기 전기천공 구성요소와 구별되는 전기천공 장치의 또 다른 요소와 통신할 수 있다. 하나의 전기기계적 또는 기계적 장치의 일부로서 존재하는 전기천공 장치의 요소들은, 상기 요소들이 하나의 장치로서 또는 서로 통신하는 별개의 요소로서 기능할 수 있으므로, 제한되지 않을 수 있다. 상기 전기천공 구성요소는 원하는 조직에서 정전류를 생산하는 에너지의 펄스를 전달할 수 있으며, 피드백 기전을 포함한다. 전극 어셈블리는 공간 배열 내에 복수의 전극을 갖는 전극 어레이를 포함할 수 있으며, 여기서 상기 전극 어셈블리는 전기천공 구성요소로부터 에너지의 펄스를 받고 전극을 통해 원하는 조직에 이를 전달한다. 복수의 전극 중 적어도 하나는 에너지의 펄스가 전달되는 동안 중성이고, 원하는 조직에서 임피던스를 측정하고 전기천공 구성요소에 임피던스를 전달한다. 상기 피드백 기전은 측정된 임피던스를 받을 수 있고 전기천공 구성요소에 의해 전달된 에너지의 펄스가 정전류를 유지하도록 조절할 수 있다.
복수의 전극은 분산된 패턴으로 에너지의 펄스를 전달할 수 있다. 복수의 전극은 프로그램된 순서 하에 전극의 제어를 통해 분산된 패턴으로 에너지의 펄스를 전달할 수 있고, 상기 프로그램된 순서는 사용자에 의해 전기천공 구성요소에 입력된다. 상기 프로그램된 순서는 순서로 전달된 복수의 펄스를 포함할 수 있으며, 여기서 복수의 펄스 중 각각의 펄스는 임피던스를 측정하는 하나의 중성 전극을 갖는 적어도 2개의 활성 전극에 의해 전달되고, 여기서 복수의 펄스 중 차후의 펄스는 임피던스를 측정하는 하나의 중성 전극을 갖는 적어도 2개의 활성 전국 중 상이한 하나에 의해 전달된다.
상기 피드백 기전은 하드웨어 또는 소프트웨어 중 하나에 의해 수행될 수 있다. 상기 피드백 기전은 아날로그 폐-루프 회로에 의해 수행될 수 있다. 상기 피드백은 50 μs, 20 μs, 10 μs 또는 1 μs마다 일어나지만, 바람직하게는 실시간 피드백 또는 즉각적이다 (즉, 반응 시간을 결정하는 이용가능한 기술에 의해 결정된 바와 같이 실질적으로 즉각적임). 중성 전극은 원하는 조직 내의 임피던스를 측정할 수 있고, 상기 임피던스를 피드백 기전에 전달하고, 상기 피드백 기전은 임피던스에 반응하여 에너지의 펄스를 미리 조정된 전류와 유사한 값으로 정전류를 유지시킨다. 상기 피드백 기전은 에너지의 펄스의 전달 동안 연속적으로 그리고 즉각적으로 정전류를 유지할 수 있다.
본 발명의 DNA 백신의 전달을 촉진할 수 있는 전기천공 장치 및 전기천공 방법의 예는, 이들의 내용 전체가 본원에 참조로써 통합되어 있는, 미국 특허 제7,245,963호(Draghia-Akli, 등,), 미국 특허공개공보 제2005/0052630호 (Smith, 등에 의해 제출됨)에 기술된 것을 포함한다. DNA 백신의 전달을 촉진하는데 사용될 수 있는 다른 전기천공 장치 및 전기천공 방법은, 제60/852,149호(2006년 10월 17일 출원), 및 제60/978,982호(2007년 10월 10일 출원)에 대해 35 USC 119(e) 하에 우선권을 주장하는, 공동계류중이고 공동소유인 미국 특허 출원 제11/874072호(2007년 10월 17일 출원)에 제공된 것을 포함하며, 이들 모두는 그 전체가 참고로써 본원에 통합되어 있다.
미국 특허 제7,245,963호(Draghia-Akli, 등)는 몸 또는 식물에서 선택된 조직의 세포 내로 생체분자의 도입을 용이하게 하기 위한 모듈식 전극 시스템 및 그의 용도를 기술하고 있다. 상기 모듈식 전극 시스템은 복수의 바늘 전극; 피하 주사침; 프로그램가능한 정전류 펄스 컨트롤러로부터 복수의 바늘 전극까지 전도성 링크를 제공하는 전기적 커넥터; 및 전원을 포함할 수 있다. 작업자는 지지 구조 상에 올려진 복수의 바늘 전극을 붙잡아 몸 또는 식물에서 선택된 조직 내로 이들을 단단하게 삽입할 수 있다. 생체분자는 이후 선택된 조직 내로 피하 주사침을 통해 전달된다. 프로그램가능한 정전류 펄스 컨트롤러가 활성화되고 정전류 전기 펄스가 복수의 바늘 전극에 적용된다. 상기 적용된 정전류 전기 펄스는 복수의 전극 사이에 있는 세포 내로 생체분자의 도입을 용이하게 한다. 미국 특허 제7,245,963호의 전체 내용은 참고로 본원에 통합되어 있다.
미국 특허 공개공보 제2005/0052630호(Smith, 등에 의해 출원됨)는 몸 또는 식물에서 선택된 조직의 세포 내로 생체분자의 도입을 효과적으로 촉진하는데 사용될 수 있는 전기천공 장치를 기술한다. 상기 전기천공 장치는, 작업이 소프트웨어 또는 펌웨어에 의해 지정되는 전기-동력학 장치 ("EKD 장치")를 포함한다. EKD 장치는 사용자 제어 및 펄스 파라미터의 입력에 기초한 어레이 내의 전극 사이에 일련의 프로그램가능한 정전류 펄스 패턴을 생산하고, 전류 파형 데이타의 저장 및 취득을 허용한다. 전기천공 장치는 또한 바늘 전극, 주사 바늘용 중심 주사 통로, 및 제거가능한 가이드 디스크의 어레이를 갖는 교체가능한 전극 디스크를 포함한다. 미국 특허 공개공보 제2005/0052630호의 전체 내용은 참고로 본원에 통합되어 있다.
미국 특허 제7,245,963 및 미국 특허 공개공보 제2005/0052630호에 기재된 전극 어레이 및 방법은 근육과 같은 조직 뿐만 아니라 다른 조직 또는 기관 내로도 깊이 침투시키는데 조정될 수 있다. 전극 어레이의 배치 때문에, 주사 바늘 (선택한 생체분자를 전달함)은 또한 표적 장기 내로 완전히 삽입되며, 주사는 전극에 의해 미리 기술된 영역 내에서, 표적 조직에 수직으로 투여된다. 미국 특허 제7,245,963호 및 미국 특허 공개공보 2005/005263에 기술된 전극은 바람직하게는 20 mm 길이 및 21 게이지이다.
또한, 전기천공 장치 및 이의 용도를 포함하는 고려된 일부 구현예에서, 하기 특허들에 기재된 것들인 전기천공 장치가 고려된다: US 특허 제5,273,525호(1993년 12월 28일 발행), US 특허 제6,110,161호(2000년 8월 29일 발행), 제6,261,281호(2001년 7월 17일 발행), 및 제6,958,060호(2005년 10월 25일 발행), 및 US 특허 제6,939,862호(2005년 9월 6일 발행). 더욱이, 다양한 장치 중 어느 것을 사용한 DNA의 전달에 관한, 2004년 2월 24일자로 허여된 미국 특허 제6,697,669호에 제공된 주제에 관한 특허, 및 DNA의 주사 방법에 관한, 2008년 2월 5일자로 허여된 미국 특허 제7,328,064호가 본원에 고려된다. 상기-특허들은 그 전체가 참고로 본원에 통합되어 있다.
c. DNA 플라스미드를 제조하는 방법
본원에 논의된 DNA 백신을 포함하는 DNA 플라스미드를 제조하는 방법이 본원에 제공된다. DNA 플라스미드는, 포유동물 발현 플라스미드 내로의 최종 아클로닝 단계 후에, 당해 분야에 공지된 방법을 사용하여, 대규모 발효 탱크 속에 세포 배양물을 접종하는데 사용될 수 있다.
본 발명의 EP 장치를 사용하기 위한 DNA 플라스미드는 공지된 장치 및 기술의 조합을 이용하여 제형화되거나 제조될 수 있지만, 바람직하게는 이들은 라이센스된, 공동계류중인 미국 가출원 제60/939,792호(2007년 5월 23일 출원)에 기재된 최적화된 플라스미드 제조 기술을 이용하여 제조된다. 일부 예에서, 이들 연구에 사용된 DNA 플라스미드는 10 mg/mL 이상의 농도로 제형화될 수 있다. 제조 기술은 또한 라이센스된 특허, 미국 특허 제7,238,522호(2007년 7월 3일 발행)에 기재된 것을 포함하여, 미국 출원 제60/939792호에 기재된 것 이외에도, 당해분야의 숙련자에게 통상적으로 공지된 다양한 장치 및 프로토콜을 포함하거나 통합한다. 상기-참조된 출원 및 특허, US 출원 제60/939,792호 및 US 특허 제7,238,522호는 각각 그 전체가 참조로써 본원에 통합되어 있다.
실시예
본 발명은 하기 실시예에 더 예시된다. 이들 실시예는, 본 발명의 바람직한 구현예를 나타내긴 하지만, 단지 예시를 위해 제공되는 것으로 이해되어야 한다. 상기 논의 및 이들 실시예로부터, 당해 분야의 숙련가는 본 발명의 본질적인 특징을 확인할 수 있고, 이의 취지 및 범주로부터 벗어나지 않고, 그것을 다양한 용법 및 조건에 맞추기 위해 본 발명을 다양하게 변화 및 변형시킬 수 있다. 따라서, 본원에 제시되고 기술된 것 이외에 본 발명의 다양한 변형들은 전술한 설명으로부터 당해 분야의 숙련가에게 자명할 것이다. 그러한 변형은 또한 첨부된 청구항의 범주 내에 속하는 것으로 의도된다.
실시예 1
미래의 RSV 감염에 대해 고 위험인 개인(예를 들면, 영아 및 노인)의 수에 있어서 예측되는 지속된 증가로 인해, RSV 감염에 대해 효과적이고 최종적으로 관리가능한 치료의 개발에 대한 긴박한 필요성이 존재한다. DNA 백신, 면역화 시 목적한 인코딩된 단백질을 발현하도록 유전적으로 가공된 소 박테리아 플라스미드는 효과적인 RSV 백신을 설계하는데 있어서 관여된 많은 장애를 피하는데 도움이 될 수 있는 수개의 유의적인 장점을 제공한다. 예를 들어, 임상적으로 유의적인 질병 및 재-감염을 방지하기 위하여, 백신은 천연의 RSV 감염으로부터 발생하는 것보다 더 크고 더 오래 동안 지속되는 면역성을 부여할 수 있다. DNA 백신은 체액성(예를 들면, 중화 항체) 및 세포성(예를 들면, 세포독성 T 림프구) 면역 반응 둘다를 유발할 뿐 아니라, 많은 바이러스에 대해 평생 면역성을 유발할 수 있다. 또한, RSV 예방접종에 대한 주요 표적은 신생아 및 영아이다. 신생아 면역계는 기능적으로 미성숙되어 있으므로, 통상의 백신(예를 들면, 살아있는 약독화되거나 불활성화된 바이러스)에 대해 단지 약한 면역 반응을 발달시킨다. 한편, DNA 백신은 신생아 동물 모델에서 안전하고 면역원성인 것으로 밝혀졌다. 또한, 면역화 시기에 모계 항체의 존재는 다양한 통상의 백신에 대한 면역 반응을 제어하거나 억제하는 것으로 알려져 왔다. 그러나, DNA 백신을 사용하면, 면역화 단백질은 백신 제제 속에 존재하지 않으므로, 모계 항체에 의한 불활성화를 지시하는데 민감하지 않아야 한다.
현재, 임상 시험에서 조기 단계 또는 거의 조기 단계의 3개의 주요 RSV 백신이 존재한다: 1) 살아있는 약독화된 RSV(MedImmune, Philadelphia, PA); 2) RSV F 및/또는 G 단백질을 발현하는 센다이 바이러스(AmVac, Switzerland); 및 3) RSV의 G 단백질을 함유하는 바이러스-유사 입자(Novavax, Rockville, MD) (http://www.clinicaltrials.gov/ct2/results?term=RSV&pg=l). 비록 이들 시도가 RSV 감염의 예방에 있어 어느 정도의 효능을 나타낸다고 해도, 이러한 백신 설계와 관련된 다른 고유의 단점이 존재한다. 예를 들면, 살아있는 약독화된 바이러스를 사용한 최대 논쟁은 발병력으로의 복귀를 초래하는 약독화-하에 또는 돌연변이-하에 있으므로, 면역약화된 개인에게는 투여되지 않아야 한다. 모든 바이러스 벡터에 대한 일반적인 단점은, 바이러스 단백질의 인식이 후속적인 면역화 시 백신의 효능을 유의적으로 감소시킬 수 있는 중화 항체의 생성을 초래하므로 숙주 면역 반응이다. 마지막으로, RSV의 G 단백질은 RSV의 2개의 아형 사이에서 고도로 가변적이므로, G 단백질을 표적화하는 백신은 교차 보호를 제공하는 경향이 없다.
대조적으로, DNA 백신은 고도로 면역원성이며 위에서 기술한 백신 시도와 관련된 많은 단점을 결여하는 것으로 밝혀졌다. 전기천공을 통해 전달되는 경우, DNA 백신 면역원성이 추가로 개선된다. DNA 백신은 바이러스 구성 요소의 완전한 세트를 거의 함유하지 않으며 유사 단백질 소단위 백신은발병력 복귀에 대한 위험이 없거나 숙주의 감염을 영아 및 면역약화된 개인 둘 다에서 사용하기에 안전하도록 한다.
RSV의 아형 A 및 B 둘다의 공통 서열을 사용하는 것은 바이러스의 균주 둘다에 대한 보다광범위한 보호를 수득하기 위한 기준을 제공한다. 이러한 장점은, 공통 RSV DNA 백신을 과거에 제안된 어떠한 다른 시도보다 훨씬 더 유리하고 잠재적으로 보다 효율적이 되도록 한다.
주요 RSV 단백질 - 융합(F), 당단백질(Ga), 및 당단백질(Ga)을 신규 RSV 백신에 대한 표적으로서 선택하였다. 또한 제2의 매트릭스 단백질(M2)이 평가를 위해 선택되었다. 위에서 언급한 바와 같이, F 및 G 단백질은 표면에서 발현되며 중화 항체에 대한 이상적인 표적이다. M2 단백질은 주요 면역우성 CD8 T 세포 에피토프를 함유한다. 이들 RSV 단백질 각각의 경우, 단일의 공통 서열은 RSV의 아형 A 및 B 둘다에 대해 PUBMED에 의해 제공된 아미노산 서열을 기준으로 생성되었다(도 1은 RSV-F 단백질의 계통수를 나타내고, 공통 RSV F 단백질 아미노산 서열은 서열 번호: 2에 제시되어 있으며; 도 2는 RSV M2-1 단백질의 계통수를 나타내고, 공통 RSV M2-1 단백질 아미노산은 서열 번호: 4에 설정되어 있다). 바람직한 구현예에서, 공통 단백질 서열을 인코딩하는 코돈 및 RNA 최적화된 DNA 서열이 생산되어 전기천공을 사용하여 전달할 수 있는 DNA 백신을 제조하는데 사용된다.
실시예 2
RSV 공통 F 단백질의 성공적인 발현은 면역형광 현미경 및/또는 웨스턴 블롯 분석을 통해 확인되었다. 컨스트럭트는 면역화 연구에 사용되었다.
마우스를 다양한 용량의 상이한 RSV DNA 백신 컨스트럭트로 면역화시켰다. 하나의 그룹에는 대조군으로서 DNA 백신 뼈대 플라스미드 pVax를 제공하였다. 하나의 그룹에는 5 μg 투여량의 플라스미드 RSV-F를 제공하였고, 하나의 그룹에는 15 μg 투여량의 플라스미드 RSV-F를 제공하였으며; 하나의 그룹에는 30 μg 투여량의 플라스미드 RSV-F를 제공하였고; 하나의 그룹에는 60 μg 투여량의 플라스미드 RSV-F를 제공하였다.
마우스를 전기천공을 사용하여 근육내로 총 3회의 면역화(0, 2 및 4주째)를 위해 2주 간격으로 면역화하였다. 마우스를 각각의 면역화 후 2, 4, 6 및 12주째에 방혈하고 전체 RSV F 단백질 특이적인 IgG 및 IgA 항체를 혈청 속에서 측정하였다. 도 3은 면역화 1(즉, 0주째), 면역화 2(즉, 2주째) 및 면역화 3(즉, 4주째) 후에 항-RSV F 단백질 IgG를 나타낸다. 도 4는 면역화 1(즉, 0주째), 면역화 2(즉, 2주째) 및 면역화 3(즉, 4주째) 후에 항-RSV F 단백질 IgA를 나타낸다. 마우스는 12주째에 희생시켰다. 혈청 속에서 전체 IgG 및 혈청 속에서 전체 IgA의 비교 이외에, 최종 면역화 후대략 8주째에 상이한 투여량의 RSV-F 백신에서 IFN-γ 생산의 비교를 수행하였다.
RSV-F DNA 백신은 혈청 속에서 고 수준의 IgG 및 IgA 둘다를 유발하였다. 반응은 연구된 모든 용량에 대한 두 번째 면역화후 2주째로서 조기에 검출가능하였다. 유도된 항체 반응은 강하게 Thl 편향인 것으로 여겨지므로, RSV에 대한 Th2 면역 반응의 부작용의 앞서의 논쟁을 피하는 것으로 여겨진다. RSV-F 특이적인 CD8 T 세포는 마지막 면역화 후 심지어 8주 후에도 관찰되었다. 도 5는 마지막 면역화 후 대략 8주째까지 상이한 용량의 RSV-F 백신에서 IFN-γ 생산의 비교로부터의 결과를 나타낸다.
실시예 3
케모킨은 거의 반응성인 세포내에서 보다 높은 농도 구배에 대해 지시된 화학주성을 유도하는 능력을 지닌 세포에 의해 분비된 소 단백질의 계열이다. 각종 그룹이 면역 아쥬반트로서 케모킨 사용의 실행가능성을 연구하여 왔다.
CCR10에 결합하는 CCL28/MEC(점막-관련 상피 케모킨)은 위, 폐, 유방, 및 타액선 내에서 상피 세포에서 발현된다. 앞서의 연구에서 점막 케모킨의 사용은 전신계 면역화 후 점막 조직내에서 보다 우수한 면역 반응을 유도하는 면역 아쥬반트로서의 이들의 용도를 나타내었다.
실험을 수행하여 공통 RSV F 단백질 DNA 백신 컨스트럭트에 대한 아쥬반트로서 CCL28 유전 컨스트럭트의 용도를 시험하였다. 간 활성화 조절된 케모킨(LARC) 또는 대식구 염증성 단백질-3(MIP3A)으로 또한 언급된, CCL20을 인코딩하는 뉴클레오타이드 서열을 포함한 유전 컨스트럭트를 또한 공통 RSV F 단백질 DNA 백신 컨스트럭트에 대한 가능한 아쥬반트로서 시험하였다.
RSV-F에 대한 면역화 스케쥴 및 케모킨 실험은 3개 그룹의 마우스를 이용하였다: 하나에게 RSV-F 컨스트럭트만을 제공하고; 하나에게 RSV-F 컨스트럭트와 CCL20 컨스트럭트를 제공하며; 하나에게 RSV-F 컨스트럭트와 CCL28 컨스트럭트를 제공한다. 마우스를 0주, 2주 및 4주째에 총 3회 면역화하였다. 마우스를 2주, 4주 및 5주째에 방혈하였다. 5주 째에, 마우스를 질 세척하여 질 샘플을 수집하고 폐 및 비장을 수집한 후 희생시켰다.
비교는 비장에서 RSV-F +/- 케모킨 면역화 후 비장내에서(도 6) 및 RSV-F +/- 케모킨 면역화 후 폐(도 7)내에서 IFN-γ+ CD8 및 CD4 T 세포로 수행하였다.
혈청 속에서 IgG 종점 역가를 측정하고 혈청 속에서 IgG 아형(IgG1 대 IgG2a)을 비교하였다(도 8). IgG2a/IgG1 비의 비교를 또한 수행하였다(도 9).
CCL20 및 CCL28 케모킨은, 케모킨 컨스트럭트의 용량이 불충분한지의 여부가 명확하지 않다고해도, 비장 또는 폐(IFN- γ ICS를 기준으로 함)에서 RSV-F DNA 예방접종 후 CD8 및 CD4 T 세포 면역 반응을 향상시키는 것으로 여겨지지 않았다.
CCL20 면역 아쥬반트를 제공받은 동물은 RSV-F DNA 예방접종 후 Th1 면역 반응(주로 IgG2a)에 대해 중 편향(heavy bias)을 나타내었다. Th2로부터 Th1을 향한 면역 반응의 구동은 RSV 감염 후 백신-연관된 향상된 질환을 피하는데유용할 수 있다.
실시예 4
위에 나타낸 바와 같이, CCL20을 인코딩하는 코딩 서열의 투여는 우선적인 Th1 면역 반응을 초래하고 Th2 면역 반응은 초래하지 않는다. CCL20 투여의 이러한 특성은, Th1 면역 반응이 증가하고 Th2 면역 반응이 감소하는 이동이 바람직한 다른 표적에 대한 백신 아쥬반트 및 면역치료제 둘다의 측면에서 유용할 수 있다.
예를 들면, CCL20 또는, CCL20을 인코딩하는 핵산 분자의 투여는 Th2 면역반응에 의해 특징화되는 자가면역 질환 또는 염증 상태를 지닌 개인을 치료하는데 유용할 수 있다. 본원에 나타낸 바와 같이 Th2 면역 반응을 감소시키는 능력을 사용하여 실시예를 포함하는 특정의 자가면역 질환 또는 염증 상태와 연관된 Th2 면역 반응을 감소시킬 수 있다.
또한, CCL20을 본원에 기술된 바와 같은 백신 아쥬반트로서 다른 감염 질환 및 암을 표적화하는 백신과 함께 사용할 수 있다. 백신 아쥬반트로서 CCL20의 사용과 연관된 Th1 증가/Th2 감소 특성이 백신 속에서 유용할 수 있다. 서열 번호:18 및 서열 번호: 20은 IgE 신호 펩타이드를 인코딩하는 코딩 서열의 존재 및 부재하에서 CCL20에 대한 고 발현 코딩 서열을 함유한다. 일부 구현예에서, 서열 번호: 18은 출발 코돈을 추가로 포함한다. 서열 번호: 19 및 서열 번호: 21은 IgE 신호 펩타이드를 인코딩하는 코딩 서열의 존재 및 부재하에서 CCL20에 대한 공통 서열을 함유한다. 일부 구현예에서, 서열 번호: 19는 N 말단; 메티오닌을 추가로 포함한다.
실시예 5
TZM-bl 세포에서 루시퍼라제 리포터 유전자 검정은 분자적으로 클로닝된 Env-슈도형 바이러스를 사용한 1회-라운드 감염을 기본으로 한다. TZM-bl (JC53-bl)은 CD4, CXCR4 및 CCR5를 발현하며 Tat-유도성 Luc 및 β-Gal 리포터 유전자를 발현하는 유전적으로 가공된 HeLa 세포이다. 당해 검정은 1회 라운드 감염에서 높은 성공율, 증가된 검정 능력(2-일 검정), 증가된 정밀도(50% 중화를 정밀하게 측정), 개선된 표준화 수준(안정한 세포주), 및 최적의 및 입증된 검정 플랫폼을 제공한다. 본원에 참조로 통합된 문헌[참조: Montefiori, D.C. (2004) Current Protocols in Immunology, John Wiley & Sons, 12.11.1-12.11.15]은 당해 검정을 기술하였다.
도 10은 TZM-BL 세포 / "ON"에서 Env-슈도형 바이러스를 나타낸다.
도 11은 TZM-BL 세포 / "OFF"에서 Env-슈도형 바이러스를 나타낸다.
도 12는 293T에서 RSV-융합 슈도형 바이러스 생산을 나타낸다.
도 13은 검정을 사용한 RSV-F 중화 연구에 사용된 면역화 프로토콜을 나타낸다.
도 14는 상이한 표적 세포에서 RSV-F 매개된 감염의 정량화로부터의 데이터를 나타낸다. RSV-F 단백질을 지닌 슈도형의 감염성. 슈도형 바이러스를 펠렛화하고 입자 양은 HIV p24 항원을 정량화하여 평가하였다. 세포를 슈도형 바이러스 또는 10ng의 입자화된 HIV p24 항원을 함유하는 다양한 세포주의 패널을 지닌 비 엔벨로프(no envelope)로 감염시켰다. 72 h 감염 후에, 세포 상층액을 p24 항원에 대해 검정하였다. 값은 3개의 웰의 평균과 표준 편차이다.
도 15는 TZM-bl HeLa 세포에서 RSV-F 중화 활성의 정량화로부터의 데이터를 나타낸다. 데이터는, 표적 세포에 도입하여 이를 감염시키는 HIV-Luc/FMDV 슈도바이러스를 차단시킬 수 있는 DNA 예방접종된 동물로부터의 RSV-F 면역화된 혈청 샘플로부터의 루시퍼라제 검정을 사용하는 RSV-F에 대한 중화 능력의 비교 결과를 나타낸다. 역가는 바이러스의 50%를 억제하는 혈청의 상호간 희석으로 정의한다. 정상 마우스 혈청(NMS)에서 이러한 차단의 부재하에서 예방접종된 마우스로부터의 혈장 샘플의 HIV-1 Luc/RSV-F의 감염성을 중화시키고 차단하는 능력.
도 16은 HeLa 세포내에서 RSV-F 슈도 바이러스에 의한 세포 사멸 활성의 정량화로부터의 데이터를 나타낸다. 상기 결과는, 공통 RSV-F DNA 플라스미드가 전기천공을 사용한 3회의 예방접종 후 마우스내에서 강력한 체액성 및 세포 면역 반응을 유발함을 나타낸다. 혈청 중 고 수준의 RSV-F 특이적인 IgG가 바로 5 ug의 DNA를 사용한 2 번째 면역화 후 일찍 관찰되었다. 세포-매개된 면역 반응은 3 번째 면역화 후 8주로서 늦게 검출가능하였으며, 이는 RSV-F DNA 예방접종 후 면역 반응의 장기간 지속성을 제안한다. RSV-F DNA 농도에 있어서의 증가는 증가된 면역 반응을 생성하지 않았다. RSV-F DNA와 전치천공을 사용한 3회의 예방접종 후 생성된 항체는 슈도-바이러스 중화 검정에 의해 측정된 것으로서 감염을 중화시킬 수 있었다. 결과는 또한 표적 세포의 완화된 RSV-F 매개된 세포자멸사를 나타내었다.
실시예 6
도 17은 수행된 RSV-M2 용량 연구에 대한 면역화 스케쥴을 나타낸다. 그러한 연구로부터 수집된 데이터는 마지막 면역화 후 1주째에 상이한 용량의 RSV-M2 백신에서 IFN-g 생산의 비교를 포함한다(도 18). 당해 결과는, 공통-계 RSV-M2 DNA 플라스미드가 전기천공을 사용한 3회 예방접종 후 마우스에서 유의적인 세포 면역 반응을 유발하였음을 나타내었다. 비장 및 폐 둘다에서 RSV-M2의 면역우세 또는 아우성 에피토프에 대해 특이적인 고 수준의 IFN-g + T 세포를 관찰하였다. 최대 면역 반응이 60 ug의 DNA로 관찰되었다(그러나, 10 ug DNA로 관찰된 것보다 훨씬 더 크지 않은 반응).
실시예 7
추가의 연구를 수행하여 DNA 면역화 후 점막 면역 반응을 향상시키기 위한 강력한 면역 아쥬반트로서 CCL20을 평가하기 위해 수행하였다. CCL20(간 활성화 조절된 케모킨-LARC; 대식구 염증 단백질 3 - MIP3a)은 CCR6에 결합하여 림프절, 간, 맹장, 태아 폐에서 발현된다(가슴샘, 고환, 전립샘, 및 위에서 보다 낮은 수준).
도 19는 CCL20을 사용한 RSV-F 백신의 조합의 평가를 위한 면역화 스케쥴을 나타낸다.
도 20은 마지막 면역화 후 1주째에 상이한 용량의 CCL20을 사용한 비장, 간 및 폐 각각에서 IFN-g의 비교로부터의 데이터를 포함하는 연구로부터의 데이터를 나타낸다.
도 21은 혈청에서 IgG 아형(IgG1 대 IgG2a)의 비교 데이터를 나타낸다.
결과는, CCL20을 사용한 동시-면역화가 RSV-F DNA 면역화 후 폐 및 간 둘다에서 세포-매개된 반응을 향상시키지 않음을 나타낸다. CCL20은, RSV-F 특이적인 IgG 항체가 DNA 면역화 후 Th1-동형을 향해 편향됨을 나타내었다. RSV-F만으로의 면역화와 비교하여 CCL20 + RSV-F 동시-면역화 후 혈청 속에서 보다 적은 IgG1 및 보다 많은 IgG2a가 관찰되었다.
따라서, 면역원, 특히 점막 조직을 통해 숙주로 도입되는 병원체 및 다른 제제와 관련된 것에 대해개인을 예방학적으로 및/또는 치료학적으로 면역화시키고, 점막 면역 반응을 포함하는, 이러한 면역 반응을 유도하는 개선된 백신, 개선된 방법이 제공된다. 예를 들면, 감염제는 경구 점막 및 소화관의 다른 점막, 후각 및 결막 점막과 같은 호흡관, 유선 및 비뇨생식관과 같은 점막 조직을 가로질러 숙주내로 일반적으로 도입된다.
CCL20을 인코딩하는 핵산 서열 및 기능성 단편과 함께 면역원을 인코딩하는 핵산 서열을 포함하는 조성물이 제공된다. 상기 조성물은 면역원 및 CCL20과 이의 기능성 단편 둘 다를 인코딩하는 분리된 핵산 분자 및/또는 CCL20을 인코딩하는 분리된 핵산 및 이의 기능성 단편과 함께 면역원을 인코딩하는 분리된 핵산 분자를 포함하는 조성물을 포함할 수 있다. 이러한 조성물은 주사가능한 약제로서 제공될 수 있다.
상기 조성물은 이러한 조성물을 개인에게 투여함을 포함하여, 면역원에 대해 개인에서 면역 반응을 유도하는 방법에 사용될 수 있다.
조절 성분에 작동적으로 연결된 면역원을 인코딩하는 뉴클레오타이드 서열 및, CCL20 또는 이의 기능성 단편을 인코딩하는 뉴클레오타이드 서열을 포함하는 재조합체 백신이 이러한 재조합체 백신을 개인에게 투여함을 포함하여 면역원에 대해 개인에서 점막 면역 반응을 유도하는 방법을 포함하는, 면역 반응을 유도하는 방법과 같이 제공된다.
살아있는 약독화된 병원체를 개인에게 투여함을 포함하여 병원체에 대해 개인에서 점막 면역 반응을 유도하는 방법을 포함하여, 면역 반응을 유도하는 방법, 및 CCL20 또는 이의 기능성 단편을 인코딩하는 뉴클레오타이드 서열을 포함하는 살아있는 약독화된 병원체가 또한 제공된다.
상기 개인에게 CCL20 단백질 또는 이의 기능성 단편을 면역원을 인코딩하는 분리된 핵산 분자와 함께 투여함을 포함하여 면역원에 대해 개인에서 면역 반응을 유도하는 방법; 및/또는 면역원 및/또는 살아있는 약독화된 백신 및/또는 사멸된 백신을 포함하는 소단위 백신 및/또는 면역원을 인코딩하는 재조합체 백신. 면역원을 인코딩하는 하나 이상의 분리된 핵산 분자와 함께 CCL20 단백질 또는 이의 기능성 단편을 포함하는 조성물; 조절 성분에 작동적으로 연결된 면역원을 인코딩하는 뉴클레오타이드 서열을 포함하는 재조합체 백신; 살아있는 약독화된 병원체; 및 사멸된 병원체가 제공된다. 본원에 사용된 것으로서, "CCL20의 기능성 단편"은, 면역원과 함께 전달되는 경우, 면역원이 단편의 부재하에 전달되는 경우 유도된 면역 반응과 비교하여 변형된 면역 반응을 제공하는 iCCl20 단백질이 단편을 말함을 의미한다. 단편은 일반적으로, 길이가 10개 이상의 아미노산이다. 일부 구현예에서, CCL20의 기능성 단편은 특수한 완전한 길이의 CCL20 단백질의 길이의 20% 이상, 25% 이상, 30% 이상, 35% 이상, 40% 이상, 45% 이상, 50% 이상, 55% 이상, 60% 이상, 65% 이상, 70% 이상, 75% 이상, 80% 이상, 85% 이상, 90% 이상, 91% 이상, 92% 이상, 93% 이상, 94% 이상, 95% 이상, 96% 이상, 97% 이상, 98% 이상, 99% 이상을 포함할 수 있다.
면역원과 함께 전달되는 경우, CCL20 및 이의 기능성 단편, 및 이의 조합은 면역 반응을 조절한다. 따라서, 이들 단백질의 조합은 치료학적 또는 예방학적 면역 반응을 유도하기 위한 DNA 또는 단백질계 백신의 요소로서 또는 면역 반응을 유도하는데 유용한 조성물로 전달될 수 있다. 일부 구현예에서, 면역원을 전달하기 위한 수단은 DNA 백신, 재조합체 백신, 단백질 소단위 백신, 약독화된 백신 또는 사멸된 백신이다. 일부 구현예에서, 하나 이상의 CCL20 및 이의 기능성 단편을 전달하기 위한 수단은 DNA 백신, 재조합체 백신 또는 약독화된 백신 속에 포함된 코딩 서열의 발현에 의한다.
면역 반응은 항원 특이적인 항체 및/또는 항원 특이적인 T- 및 B-세포의 생산을 초래한다. 항원 특이적인 항체 및/또는 세포는 감염에 대해 보호하고, 존재하는 감염을 감소시키거나 제거하기 위한 수단을 제공한다. 이들은 또한 개인으로부터 분리되어 수동적 면역성 프로토콜, 면역컬럼과 같은 다른 적용에서 또는 시약으로서 사용될 수 있다.
일부 구현예에서, CCL20은, 조성물이 전신계로 전달되는 경우의 프로토콜에서조차, 점막 면역 반응, 특히 증거된 IgG2a 반응 및 감소된 IgG1 반응을 특징으로 하는 증가된 Th1 반응을 유도하는데 유용하다. DNA 백신 또는 다른 수단 플라스미드와 하나 이상의 이들 케모킨에 의한 것과 같은 면역원의 동시-면역화, 예를 들면, DNA 백신 또는 다른 유형의 백신의 코딩 서열의 일부는 유일한 아쥬반트 특성을 제공할 것이다.
CCL20 단백질 및 이를 인코딩하는 뉴클레오타이드는 천연 및 합성의 많은 공급원으로부터 수득될 수 있다. 단백질이 사용되는 일부 구현예에서, 예를 들면, 당해 분야의 통상의 기술자는 잘 공지된 기술을 사용하여 예를 들면, 단백질에 특이적으로 결합된 항체를 함유하는 면역 컬럼을 사용하여 천연 공급원으로부터 CCL20 단백질을 분리할 수 있다. 달리는, 단백질은 전기영동을 사용하여 분리하거나, 전기영동 매트릭스로부터 분리하여 예를들면, 투석으로 정제함으로써 필수적으로 순수한 단백질을 생성할 수 있다. 다른 잘 공지된 단백질 정제 기술을 사용하여 분리된, 필수적으로 순수한 단백질을 생산할 수 있다. 단백질이 사용된 일부 구현예에서, 예를 들면, 당해 분야의 통상의 기술자는, 잘 공지된 기술을 사용하여, CCL20 및 이의 기능성 단편을 인코딩하는 DNA 분자를 잘 공지된 발현 시스템에서 사용하기 위한 시판되는 발현 벡터내로 삽입할 수 있다. 천연 공급원으로부터 단백질을 분리하거나 재조합체 기술로 단백질을 생산하는 것 외에, 자동화된 펩타이드 합성기를 또한 사용하여 분리된, 필수적으로 순수한 단백질을 생산할 수 있다.
본 발명의 일부 국면에 따라서, 알레르겐, 병원체 또는 비정상의, 질환 관련 세포와 같은 면역원에 대해 개인을 예방학적으로 및/또는 치료학적으로 면역화하는 조성물 및 방법이 제공된다. 백신은 살아있는 약독화된 백신, 세포 백신, 재조합체 백신 또는 핵산 또는 DNA 백신과 같은 어떠한 유형의 백신일 수 있다. 면역원 및 하나 이상의 CL20 및 이의 기능성 단편을 인코딩하는 핵산 분자를 전달함으로써 백신에 의해 유도된 면역 반응을 조절할 수 있다.
면역원 및 CCL20을 전달하기 위한 조성물, 특히 조절 성분에 작동적으로 연결된 면역원을 인코딩하는 뉴클레오타이드 서열과 함께 조절 성분에 작동적으로 연결된 하나 이상의 CCL20 및 이의 기능성 단편을 인코딩하는 뉴클레오타이드 서열을 포함하는 하나 이상의 핵산 분자를 포함하는 것들이 제공된다. CCL20 및 면역원을 인코딩하는 핵산 서열은 동일한 분자 또는 별도의 분자 상의 것일 수 있다.
핵산 분자는 DNA 주사(또한 DNA 예방접종으로 언급됨), 재조합체 아데노바이러스, 재조합체 아데노바이러스 관련 바이러스 및 재조합체 박시니아와 같은 재조합체 벡터를 포함하는 수개의 잘 공지된 기술 중의 어느 것을 사용하여 전달할 수 있다. 일부 구현예에서, DNA 백신은 본원에 기술된 바와 같이 작제되며 본원에 기술된 바와 같이 전기천공을 사용하여 전달된다. 본원에 설정된 RSV 백신에 대한 설명은 다른 면역원과 함께 CCL20의 용도에 적용될 수 있다. DNA 백신은 미국 특허 제5,593,972호, 제5,739,118호, 제5,817,637호, 제5,830,876호, 제5,962,428호, 제5,981,505호, 제5,580,859호, 제5,703,055호, 제5,676,594호 및 여기에 언급된 우선권 출원에 기술되어 있으며, 이들 각각은 본원에 참조로 통합되어 있다. 상기 출원에 기술된 전달 프로토콜 외에, DNA를 전달하는 대안적 방법이 미국 특허 제4,945,050호 및 제5,036,006호에 기술되어 있으며, 이들 둘 다는 본원에 참조로 통합된다. 투여 경로는 근육내, 비강내, 복강내, 피내, 피하, 정맥내, 동맥내, 안내 및 경구, 및 또한 국소적으로, 경피적으로, 흡입에 의해 또는 좌제로 또는 질, 직장, 요도, 볼내 및 설하 조직과 같은 점막 조직으로를 포함하나, 이에 한정되지 않는다. 바람직한 투여 경로는 근육내, 복강내, 피내 및 피하 주사를 포함한다. 일부 구현예에서, CCL20을 인코딩하는 뉴클레오타이드 서열 또는 이의 기능성 단편은 IgE 신호 펩타이드에 연결될 수 있다. 일부 구현예에서, 면역원은 병원체 변역원, 암-관련 항원 또는 자가면역 질환과 연관된 세포에 연결된 항원이다. 본 발명은 바이러스, 원핵 및 병원성 진핵 유기체, 예를 들면, 단세포 병원성 유기체 및 다세포 기생충과 같은 모든 병원체에 대해 개인을 면역화하는데 사용될 수 있다. 본 발명은 세포를 감염시키고 바이러스, 및 임질, 리스테리아(listeria) 및 시겔라(shigella)와 같은 원핵 세포와 같이 봉입되지 않은 병원체에 대해 개인을 면역화시키는데 특히 유용하다. 또한, 본 발명은, 이들이 세포내 병원체인 생명 주기의 단계를 포함하는 원생생물 병원체에 대해개인을 면역화하는데 또한 유용하다. 병원체의 예는 다음을 포함한다: 리노바이러스(일반적인 감기의 -50% 경우에 관여), 에테로바이러스(필로바이러스, 콕사키에바이러스, 에코바이러스, 및 A형 간염 바이러스와 같은 인간 엔테로바이러스), 및 아프토바이러스(수의과; 표적 항원은 VP1, VP2, VP3, VP4, VPG를 포함한다)와 같은 피코르나바이러스 계열 속의 바이러스. 칼키바이러스(Calcivirus) 계열 속의 바이러스는 노르웍 그룹(Norwalk Group)의 바이러스(유행성위장염의 유발제)를 포함한다. 토가바이러스(Togavirus) 계열 속의 바이러스는 알파바이러스(Alphavirus): [예를 들면, 세닐리스바이러스(Senilis virus), 로쓰리버 바이러스(RossRiver virus) 및 이스턴 앤드 웨스턴(Eastern & Western), 마뇌염(Equine encephalitis)]을 포함한다. 레오바이러스(Reovirus)는 루벨라 바이러스(Rubella virus)를 포함한다. 플라리비리다에 계열 예는 뎅그열, 황열병, 일본 뇌염, 세인트 루이스 뇌염 및 진드기 기원 뇌염 바이러스를 포함한다. 웨스트 나일 바이러스(West Nile virus)[진뱅크(Genbank) NC001563, AF533540, AF404757, AF404756, AF404755, AF404754, AF404753, AF481864, M12294, AF317203, AF196835, AF260969, AF260968, AF260967, AF206518 및 AF202541) 대표적인 표적 항원: E NS5 C. C형 간염 바이러스. 코로나바이러스(Coronavirus) 계열은 감염성 기관지염 바이러스를 포함한다. 돼지 전파가능한 위장 바이러스, 돼지 헤모글루틴화 뇌척수염 바이러스, 고양이 전염성 복막염 바이러스, 고양이 장 코로나바이러스, 개 코로나바이러스, SARS 연관된 코로나바이러스, 인간 호흡기 코로나바이러스는 ~40개 경우의 일반적인 감기를 유발한다. 예 224E, OC43. 표적 항원: E1 - 또한 M 또는 매트릭스 단백질 E2로 명명됨 - 또한 S 또는 스파이크 단백질 E3로 명명됨 - 또한 BE 또는 헤마글루티닌- 엘테로즈 당단백질 N - 뉴클레오캡시드. 라브도바이러스 계열 속은 광견병과 같은 베실리오바이러스(Vesiliovirus), 리싸바이러스(Lyssavirus)를 포함한다. 표적 항원: G 단백질 N 단백질 필로비리다에 계열은 출혈열 바이러스, 예를 들면 (의학적) 마르부르그 및 에볼라 바이러스를 포함한다. 파라믹소바이러스 속은 파라믹소바이러스: 멈프스 바이러스(Mumps virus), 뉴 캐슬병 바이러스(New Castle disease virus), 모르빌리바이러스(Morbillivirus) 예를 들면, 홍역, 개홍역 바이러스, 뉴민바이러스(Pneuminvirus), 예를 들면, 호흡기 합포체 바이러스(Respiratory syncytial virus), 오르토믹소바이러스(Orthomyxovirus)를 포함한다. 인플루엔자 바이러스 계열은 분가바이러스(Bungavirus) 계열 속, 예를 들면, 분가바이러스, 캘리포니아 뇌염, LA 크로쎄(Crosse), 플레보바이러스(Phlebovirus), 예를 들면, 리프트 밸리열(Rift Valley Fever), 한타바이러스(Hantavirus), 예를 들면, 퓨레말라(puremala), 헤마하긴 열 바이러스(hemahagin fever), 나이르바이러스(Nairvirus), 지정되지 않은 분가바이러스 아레나바이러스 계열 LCM, 및 라씨열 바이러스(Lassi fever virus)를 포함한다. 레오바이러스(Reovirus) 계열 속은 레오바이러스, 로타바이러스, 오르비바이러스(Orbiviruses), 예를 들면, 콜로라도 진드기열(Colorado Tick fever), 레봄보(Lebombo), 마뇌염, 청설병(blue tongue)을 포함한다. 레트로바이러스 계열 아-계열은 온코르비리날(oncorivirinal), 예를 들면, 백혈병 바이러스, HTLVI 및 HTLVII, 렌티비리날(Lentivirinal), 예를 들면, HIV, 고양이 면역부전 바이러스, 말 감염, 및 빈혈증 바이러스를 포함한다. 스푸마비리날 파포바바이러스(Spumavirinal Papovavirus) 계열 아-계열은 폴리오마바이러스(Polyomaviruse), 예를 들면, BKU 및 JCU 바이러스, 아-계열 파필로마바이러스를 포함한다. 아드레노바이러스, 예를 들면, EX AD7, ARD., O.B., 275. 파르보바이러스(Parvovirus) 계열은 고양이 파르보바이러스, 고양이 파늘레코페니아바이러스(Feline panleucopeniavirus), 개 파르보바이러스, 돼지 파르보바이러스를 포함한다. 헤르페스바이러스 계열 아-계열은 알파-속 심플렉스바이러스 헤르페스비리두에(alpha-Genera Simplexvirus herpesviridue) HSVI(진뱅크 X14112, NC001806), HSVII (NC001798) 바리첼로비니스(Varicellovinis), 슈도라비스(pseudorabies), 바리셀라 조스터(varicella zoster)를 포함한다. 아-계열-베타 인코우데스 속 사이토메갈로바이러스, 예를 들면, 헤르페스비리두에 HCMV. 무로메갈로바이러스(Muromegalovirus) 아-계열은 림포크립토바이러스(Lymphocryptovirus), 감마-EBV-(부르키츠 림포(Burkitts lympho)), 헤프페스비리두에(herpesviridue) 속을 포함한다. 라디노바이러스 폭스바이러스 계열 아-계열 속 바리올라(Rhadinovirus Poxvirus Family Sub-Family Genera Variola)는 (스몰폭스(Smallpox)) 코르도폭스비리두에 박시니아(Chordopoxviridue Vaccinia)(카우폭스(Cowpox))(파라폭시바이러스(Parapoxivirus)) 아우이폭스바이러스(Auipoxvirus), 카프리폭스바이러스 레포리폭스바이러스(Capripoxvirus Leporipoxvirus)를 포함한다. 수이폭스바이러스(Suipoxvirus) 아-계열은 엔테모폭스비리두에 헤파드나바이러스(Entemopoxviridue Hepadnavirus)를 포함한다. B형 간염 바이러스 계열 분류되지 않은 간염 델타 바이러스. 세균 병원체는 병원성 그람-양성 콕키(pathogenic gram-positive cocci), 예를 들면, 뉴르노코칼(pneurnococcal); 스타필로코칼(staphylococcal); 및 스트렙토코칼(streptococcal)을 포함한다. 병원체 그람-음성 콕키는 메닌고코칼(meningococcal); 및 고노코칼(gonococcal)을 포함한다. 병원성 장 그람-음성 바실러스는 엔테로박테리아세아에(enterobacteriaceae); 슈도모나스(pseudomonas), 악시네토박테리아(acinetobacteria) 및 에이케넬라(eikenella), 멜리오이도시스(melioidosis); 사흐노넬라(sahnonella); 시겔로시스(shigellosis); 헤모필루스(hemophilus); 챤크로이드(chancroid); 브루셀로시스(brucellosis); 툴라레미아(tularemia); 예르시니아(yersinia)(파스테렐라(pasteurella)); 스트렙토바실루스 모르틸리포르미스(streptobacillus mortiliformis) 및 스피릴룸(spirillum); 리스테리아 모노사이토게네스(listeria monocytogenes); 에리시펠로트릭스 루시오파티아에(erysipelothrix rhusiopathiae); 디프테리아(diphtheria), 콜레라(cholera), 안트락스(anthrax); 도노바노시스(donovanosis)(그라눌로마 인구이날레(granuloma inguinale)); 및 바르토넬로시스(bartonellosis)를 포함한다. 병원성 혐기성 박테리아는 테타누스(tetanus); 보툴리즘(botulism); 다른 클로스트리디아(clostridia); 투베르쿨로시스(tuberculosis); 레프로시(leprosy); 및 다른 마이코박테리아(mycobacteria)를 포함한다. 병원성 스피로체타 질환은 매독; - 트레포네마병: 매종, 핀타(pinta) 및 풍토성 매독; 및 렙토스피라증을 포함한다. 고등 병원체 세균 및 병원성 진균에 의해 유발된 다른 감염은 방선균증; 노카르디아증; 효모균증, 분아균증, 히스토플라즈마증 및 콕시디오이데스증; 칸디다증, 아스페길루스증, 및 털공팡이증; 스포로트리코시스증; 파라콕시디오도마이코시스증(paracoccidiodomycosis), 페트리엘리디오시스증(petriellidiosis), 토롤롭시스증(torulopsosis), 균종(mycetoma), 및 색소효모균증; 및 피부사상균증(dermatophytosis)을 포함한다. 리케챠 감염은 리케챠(rickettsial) 및 리케챠증(rickettsioses)을 포함한다. 마이코플라즈마 및 클라린디아 감염의 예는 마이코플라즈마 뇌염; 림프 육아종; 앵무새병 및 출산전후 클라미디아 감염을 포함한다. 병원성 진핵세포 병원체 원생생물 및 연충류(helminthes) 및 이에 의한 감염은 아메바증(amebiasis); 말라리아; 리슈마니어증(leishmaniasis); 트리파노소마증(trypanosomiasis); 톡소플라즈마증(toxoplasmosis); 뉴모시스티스 카리니이증(pneurnocystis carinii); 바베시아증(babesiosis); 기아르디아시스(giardiasis); 선모충증(filariasis); 필라리아병(filariasis); 주혈흡충병(schistosomiasis); 선충; 디스토마류(trematodes 또는 flukes); 및 촌충류(cestode)(촌충(tapeworm)) 감염을 포함한다. 백신은 병원체 항원에 나타난 에피토프와 동일하거나 실질적으로 유사한 에피토프를 적어도 포함하는 펩타이드를 암호화하는 DNA 서열을 포함하는 DNA 컨스트럭트와 같이 제조될 수 있다. 일부 구현예에서, 병원체에 대해 개인을 면역화하는 방법은 RSV, HIV, HSV, HCV, WNV 또는 HBV에 대해 지시된다.
고증식 세포에 대해 보호성 면역 반응을 부여하는 방법은 고증식성 질환에서 특징적인 면역원 단백질로서 이용한다. 이들은 고증식성 질환으로 고생하는 개인을 치료하는 방법 및 백신에 유용하다. 고증식성 질환의 예는 모든 형태의 암 및 건선을 포함한다. 고증식성 질환에 대한 표적 단백질의 예는 myb, myc, fyn와 같은 종양유전자, 및 bcr/abl, ras, src, P53, neu, trk 및 EGRF와 같은 전좌 유전자에 의해 인코딩된 단백질인 것들을 포함한다. 표적 항원으로서 종양유전자 생성물 외에, 항암 치료 및 보호성 요법을 위한 표적 단백질은 B 세포 림프종에 의해 제조된 항체의 가변 영역 및 T 세포 림프종의 T 세포 수용체의 가변 영역을 포함하며, 이들 영역은, 일부 구현예에서 또한 자가면역 질환에 대한 표적 항원으로서 사용된다. 다른 종양-관련 단백질을 모노클로날 항체 17-IA에 의해 인식된 단백질 및 엽산 결합 단백질 또는 PSA를 포함하는 종양 세포내에서 높은 수준으로 발견되는 단백질과 같은 표적 단백질로서 사용될 수 있다. 세포 수용체 및 "자가"-지시된 항체를 생산하는 세포를 포함하는 자가면역성과 관련된 표적에 대해 광범위한 기본 보호성 면역 반응을 부여함으로써 자가면역 질환 또는 장애로 고생하는 개인을 치료하는 방법이 또한 제공된다. T 세포 매개된 자가면역 질환은 류마티스 관절염(RA), 다발 경화증(MS), 소그렌 증후군, 유육종증, 인슐린 의존성 진성 당뇨병(1DDM), 자가면역 갑상선염, 반응성 관절염, 강직성 척추염, 경피증, 다발근육염, 피부근염, 건선, 맥관염, 베게너 육아종증, 크론 질환 및 궤양성 대장염을 포함한다. 이들 질환 각각은 내인성 항원에 결합하여 자가면역 질환과 관련된 염증성 캐스캐이드를 개시하는 T 세포 수용체에 의해 특징화된다. T 세포의 가변 영역에 대한 백신접종은 CTL을 포함하는 면역반응을 유발하여 상기 T 세포를 제거할 것이다. RA에서, 질환에 관여하는 T 세포 수용체(TCR)의 특수한 가변 영역이 특성화되어 왔다. 이들 TCR들은 Vβ-3, Vβ-14, 20 Vβ-17 및 Vα-17을 포함한다. 따라서, 적어도 하나의 이들 단백질들을 인코딩하는 DNA 컨스트럭트를 사용한 예방접종은 RA에 관여된 T 세포를 표적화할 면역 반응을 유발할 것이다. 참조: Howell, M. D., 등, 1991 Proc. Nat. Acad. Sci. USA 88:10921-10925; Piliard, X., 등, 1991 Science 253:325-329; Williams, W. V., 등, 1992 J Clin. Invest. 90:326-333; 이들 각각은 본원에 참조로 통합된다. MS에서, 당해 질환에 관여하는 TCR의 수개의 특수 가변 영역은 특성화되어 있다. 이들 TCR들은 VfP 및 Vα-10을 포함한다. 따라서, 이들 단백질들 중 적어도 하나를 인코딩하는 DNA 컨스트럭트를 사용한 예방접종은 MS에 관여된 T 세포를 표적화할 면역 반응을 유발할 것이다. 각각이 참고로써 본원에 통합되어 있는 문헌[Wucherpfennig, K. W., 등, 1990 Science 248:1016-1019; Oksenberg, J. R., 등, 1990 Nature 345:344-346]을 참고한다. 경피증에서, 당해 질환에 관여된 TCR의 몇가지 특수 가변 영역은 특성화되어 있다. 이들 TCR들은 Vβ-6, Vβ-g, Vβ-14 및 Vα-16, Vα-3C, Vα-7, Vα14, Vα-15, Vα-16, Vα-28 및 Vα-12를 포함한다. 따라서, 이들 단백질들 중 적어도 하나를 인코딩하는 DNA 컨스트럭트를 사용한 예방접종은 경피증에 관여한 T 세포를 표적화할 면역 반응을 유발할 것이다. T 세포 매개된 자가면역 질환, 특히 TCR의 가변 영역이 아직 특성화되지 않은 질환으로부터 고통받는 환자를 치료하기 위해, 활막 생검이 수행될 수 있다. 존재하는 T 세포의 샘플을 취할 수 있고 상기 TCR의 가변 영역은 표준 기술을 이용하여 확인된다. 유전 백신은 당해 정보를 사용하여 제조할 수 있다. B 세포 매개된 자가면역 질환은 루푸스(SLE), 그레이브스병, 중증 근무력증, 자가면역성 용혈성 빈혈, 자가면역 저혈소판증, 천식, 크리오글로불리네이니아(cryoglobulineinia), 원발성 담즙 경화증(primary biliary sclerosis) 및 악성 빈혈을 포함한다. 당해 질환 각각은 내인성 항원에 결합하여 자가면역 질환과 관련된 염증성 캐스캐이드를 개시하는 항체에 의해 특징화된다. 항체의 가변 영역에 대한 백신접종은 CTL을 포함하는 면역 반응을 유발하여 상기 항체를 생산하는 B 세포를 제거할 것이다.
B 세포 매개된 자가면역 질환으로부터 고통받는 환자를 치료하기 위해, 자가면역 활성과 연관된항체의 가변 영역이 확인되어야만 한다. 생검을 수행할 수 있고 염증 부위에 존재하는 항체의 샘플을 취할 수 있다. 상기 항체의 가변 영역은 표준 기술을 이용하여 확인될 수 있다. 유전 백신은 당해 정보를 사용하여 제조할 수 있다. SLE의 경우에, 하나의 항원은 DNA인 것으로 여겨진다. 따라서, SLE에 대해 면역화될 환자에서, 그들의 혈청을 대상으로 항-DNA 항체가 스크리닝될 수 있고 혈청에서 발견된 상기 항-DNA 항체의 가변 영역을 인코딩하는 DNA 컨스트럭트를 포함하는 백신이 제조될 수 있다. TCR 및 항체 모두의 가변 영역 간의 공통된 구조적 특징들은 잘 알려져 있다. 특정 TCR 또는 항체를 인코딩하는 DNA 서열은 참고로써 본원에 통합되어 있는 문헌[Kabat, 등 1987 Sequence of Proteins of Immunological Interest U.S. Department of Health and Human Services, Bethesda Md.]에 기술된 것과 같은 잘 알려진 방법에 따라 일반적으로 발견될 수 있다. 또한, 항체로부터 기능적 가변 영역을 클로닝하는 일반적인 방법은 본원에 참고로 통합되어 있는 문헌 [Chaudhary, V. K., 등, 1990 Proc. Natl. Acad Sci. USA 87:1066, 이는 본원에 참조로 통합되어 있다]에서 찾을 수 있다.
CCL20 단백질 코딩 서열의 발현가능한 형태를 사용하여 DNA 백신을 개선시키는 것 외에, CCL20 단백질 또는 이의 기능성 단편 및/또는 CCL20 또는 이의 기능성 단편을 인코딩하는 코딩 서열을 포함하는 항원 및 소단위를 인코딩하는 외부 유전자를 전달하기 위해 재조합체 벡터를 사용하는 개선된 백신, 개선된 사멸 백신 및 개선된 약독화된 생 백신이 제공된다. 약독화된 생 백신, 재조합체 벡터를 사용하여 외부 항원을 전달하는 것, 소단위 백신 및 당단백질 백신의 예는 미국 특허 제4,510,245호; 제4,797,368호; 제4,722,848호; 제4,790,987호; 제4,920,209호; 제5,017,487호; 제5,077,044호; 제5,110,587호; 제5,112,749호; 제5,174,993호; 제5,223,424호; 제5,225,336호; 제5,240,703호; 제5,242,829호; 제5,294,441호; 제5,294,548호; 제5,310,668호; 제5,387,744호; 제5,389,368호; 제5,424,065호; 제5,451,499호; 제5,453,364호; 제5,462,734호; 제5,470,734호; 제5,474,935호; 제5,482,713호; 제5,591,439호; 제5,643,579호; 제5,650,309호; 제5,698,202호; 제5,955,088호; 제6,034,298호; 제6,042,836호; 제6,156,319호 및 제6,589,529호에 기술되어 있으며, 이들은 각각 본원에 참조로 통합되어 있다.
실시예 8
RSV 면역원 F, G(A) 및 G(B)의 공통 서열을 사용하여 중화 면역 반응을 수득하는 기준을 제공한다. 이러한 장점은, 공통 RSV DNA 백신을 과거에 제안된 어떠한 다른 시도보다 훨씬 더 유리하고 잠재적으로 보다 효율적이 되도록 한다.
주요 RSV 단백질 - 융합(F), 당단백질(Ga), 및 당단백질(Ga)을 신규 RSV 백신에 대한 표적으로서 선택하였다. 위에서 언급한 바와 같이, F 및 G 단백질은 표면에서 발현되며 중화 항체에 대한 이상적인 표적이다. 공통 RSV-F를 인코딩하여 이를 발현하는 서열을 갖는 플라스미드, 공통 RSV-G(A)를 인코딩하고 이를 발현하는 서열을 갖는 플라스미드 및 공통 RSV-G(B)를 인코딩하고 이를 발현하는 서열을 갖는 플라스미드를 포함하는 콕테일 DNA 백신이 제조되었다. 개개 플라스미드 및 콕테일이 연구에 사용되었다. 콕테일 백신은 토끼 및 비-인간 영장류를 사용한 연구에서 사용하였으며 이들 연구의 결과는, 고수준의 중화 면역 반응이 유도되며, 이는, 콕테일 백신이 RSV 감염에 대해 보호하는데 있어 특수한 값으로 예방학적 및 치료학적 적용 둘 다에서 사용될 수 있음을 나타낸다.
도 22a, 도 22b 및 도 22c에 나타낸 바와 같이, RSV-F, RSV-G(A), 및 RSV-G(B) 각각에 대한 단일의 삽입체 플라스미드는 pVAX 벡터를 사용하여 작제하였다. 각각의 개개 플라스미드에 대한 공통 서열은 pVAX 벡터내 BamHI와 XhoI 부위 사이에 클로닝하였다. 수득되는 플라스미드는: pVAX내로 클로닝되어 4812개 염기쌍을 생산하는 공통 RSV-F를 인코딩하는 1813개 염기쌍을 포함하는, pRSV-F; pVAX내로 클로닝되어 3944개 염기쌍을 생산하는 공통 RSV-G(A)를 인코딩하는 945개 염기쌍 삽입물을 포함하는, pRSV-G(A) 및 pVAX내로 클로닝되어 3929개 염기쌍을 갖는 플라스미드를 생산하는 공통 RSV-G(B)를 인코딩하는 930개 염기쌍 삽입물을 포함하는 pRSV-G(B)이다.
RSV-F, RSV-G(A), 및 RSV-G(B) 컨스트럭트의 발현을 확인하기 위해, RD 세포를 pRSV-F, pRSV-G(A) 및 pRSV-G(B) 각각으로 형질감염시켰다. 면역형광성 평가는 면역화되고, 혼주된 토끼 혈청을 사용하여 수행하였다. RSV 면역원은 플루오레세인 이소티오시아네이트(FITC)로 화학적으로 접합시킨 항-RSV 면역원을 결합시킴으로써 면역형광성으로 가시화하였다. DAPI는 핵 역염색으로 사용하였다. 도 23에서의 결과는, Pvax로 형질감염시킨 RD 세포가 FITC 표지된 항-RSV 면역원 항체에 의해면역염색되지 않음을 나타내었다.
RSV-F 용량 연구는 마우스를 사용하여 수행하였다. 면역화 스케쥴은 도 24에 나타낸다. 마우스의 5개 그룹을 사용하였다. 그룹 1은 pVAX를 주사한 대조군이었다. 그룹 2는 5μg의 pRSV-F 컨스트럭트로 주사하였다. 그룹 3은 15μg의 pRSV-F 컨스트럭트로 주사하였다. 그룹 4는 30μg의 pRSV-F 컨스트럭트로 주사하였다. 그룹 5는 60μg의 pRSV-F 컨스트럭트로 주사하였다. 동물을 전기천공을 사용하여 총 3회 면역화하였다: 0주째에 제1 면역화, 2주째에 제2 면역화 및 4주째에 제3 면역화. 혈청을 수집하고 IgG를 총 4회 측정하였다: 2주째에 제1 수집, 4주째에 제2 수집, 6주째에 제3 수집 및 12주째에 제4 수집. 동물을 12주째에 희생시키고, 비장을 수거하고 IFN-감마를 ELISPOT을 통해 측정하였다.
도 25는 혈청 속에서 전체 RSV-F IgG를 비교한 RSV-F로부터의 데이터를 나타낸다. 데이터는 면역화 #1 후, 면역화 #2 후, 및 면역화 #3 후 수집된 혈청으로부터 나타낸다. 항-RSV-F IgG는 10, 100, 1,000 및 10,000의 상호간 혈청 희석에서 측정하였다. 데이터는, pVAX가 어떠한 면역화 후에 항체를 유도하지 않았음을 나타낸다. 데이터는, pRSV-F작제물이 제1 면역화 후 항체를 유도하지 않았음을 나타낸다. 데이터는, pRSV-F작제물이 제2 및 제3의 면역화 후 항체를 유도하였음을 나타낸다.
도 26은 최종 면역화 후 대략 8주째에 RSV-F 예방접종에 의해 유도된 IFN-γ 생산을 비교하는 RSV-F 용량으로부터의 데이터를 나타낸다. 데이터는 pVAX 및 15 μg의 평균 투여량의 pRSV-F 작제물을 주사한 동물로부터의 IFN-γ 생산 (SFU/106개의 비장 세포)을 비교하여 나타낸다.
RSV-F PSEUDO 중화 연구는 마우스를 사용하여 수행하였다. 면역화 스케쥴은 도 27에 나타낸다. 마우스를 15μg의 pRSV-F 컨스트럭트로 면역화시켰다. 동물을 전기천공을 사용하여 총 3회 면역화하였다: 0주째에 제1 면역화, 2주째에 제2 면역화 및 4주째에 제3 면역화. 혈청을 수집하고 중화 검정을 5주째에 수행하였다.
RSV-F PSEUDO 중화 연구로부터의 데이터는 도 28에 나타낸다. TZM-bl HeLa 세포에서 RSV-F 슈도-형 중화 활성을 정량화였다. 표적 세포로 도입되어 이를 감염시키는 HIV-Luc/RSV-F 슈도바이러스를 차단할 수 있는 DNA 예방접종된 동물로부터의 RSV-F 면역화된 혈청 샘플로부터 루시퍼라제 검정을 사용한 RSV-F의 중화 능력의 비교. 역가는 바이러스의 50%를 억제하는 혈청의 상호간 희석으로 정의한다. 예방접종된 마우스로부터의 혈청 샘플이 정상 마우스 혈청(NMS)에서 이러한 차단 활성의 부재하에서 HIV-Luc/RSV-F의 감염성을 중화시키고 차단하는 능력에 주목한다.
도 29에 나타낸 바와 같이, 2개의 비교를 pRSV-F(RSV-F2 및 RSV-F5)로부터의 혈청 대 pVAX 예방접종된 동물로부터의 혈청을 사용하여 수행함으로써 HeLa 세포내에서 RSV-F 슈도바이러스에 의한 세포자멸사 세포 사멸 활성의 억제를 측정하였다. 각각의 비교를 위해, 혈청을 1:1, 1:10, 1:100 및 1:1000로 희석하였다. 백분율로서 표현된 세포 사멸의 수준을 측정하였으며 pRSV-F로 예방접종된 동물로부터의 혈청이 혈청의 존재하에서 RSV-F 슈도바이러스에 노출된 HeLa 세포의 세포자멸성 세포 사멸을 억제하였음을 나타낸다.
RSV-G(A) 및 RSV-(B) 용량 연구를 마우스를 사용하여 수행하였다. 면역화 스케쥴은 도 30에 나타낸다. 마우스 6개 그룹을 사용하였다. 그룹 1은 pVAX를 주사한 대조군이었다. 그룹 2는 1μg의 pRSV-G(A) 또는 pRSV-G(B) 컨스트럭트를 주사하였다. 그룹 3은 5μg의 pRSV-G(A) 또는 pRSV-G(B) 컨스트럭트를 주사하였다. 그룹 4는 10μg의 pRSV-G(A) 또는 pRSV-G(B) 컨스트럭트를 주사하였다. 그룹 5는 20μg의 pRSV-G(A) 또는 pRSV-G(B) 컨스트럭트를 주사하였다. 그룹 6은 40μg의 pRSV-G(A) 또는 pRSV-G(B) 컨스트럭트를 주사하였다. 동물을 전기천공을 사용하여 총 3회 면역화하였다: 0주째에 제1 면역화, 2주째에 제2 면역화 및 4주째에 제3 면역화. 혈청을 수집하고 IgG를 총 2회 측정하였다: 4주째에 제1 수집, 및 6주째에 제2 수집.
도 31은 RSV(A) 또는 RSV-G(B) 용량 연구에서 RSV-G(A) DNA 면역화 후 혈청 속의 IgG에 대한 데이터를 나타낸다. 혈청 속의 총 항-RSV-G(A) IgG를 용량 연구로부터 측정하였다. 데이터는 도 31에서 그래프의 x-축에 설정된 바와 같은 다양한 투여량에서 수집한 혈청으로부터나타낸다. 항 -RSV-G(A) IgG를 1:100의 혈청 희석에서 측정하였다.
도 32는 RSV(A) 또는 RSV-G(B) 용량 연구에서 RSV-G(B) DNA 면역화 후 혈청 속의 IgG 에대한 데이터를 나타낸다. 혈청 속의 전체 항 -RSV-G(B) IgG를 용량 연구로부터 측정하였다. 데이터는 도 31에서 그래프의 x-축에 설정된 바와 같은 다양한 투여량에서 수집한 혈청으로부터나타낸다. 항-RSV-G(B) IgG를 1:100의 혈청 희석에서 측정하였다.
도 33은 마우스 연구에서 모노 백신을 사용한 RSV 예비 중화 결과의 요약을 나타내는 챠트이다. 면역화 후 3일째에 수집한 혈청으로부터의 중화 역가를 측정하였다. 음성 혈청을 음성 대조군으로 사용하였다. 양성 대조군은 항-RSV 모노클로날 항체 및 항-RSV 폴리클로날 항체를 포함하였다. 중화 역가는 pRSV-F를 예방접종한 2마리의 마우스, pRSV-G(A)를 예방접종한 2마리의 마우스 및 pRSV-G(B)를 예방접종한 1마리의 마우스로부터의 혈청 및 대조군에 대해 측정하였다.
RSV 토끼 연구를 설계하고 수행하였다. RSV 토끼 연구 설계는 도 34에 나타낸다. 4마리의 암컷 뉴질랜트 백색(New Zealand white: NZW) 토끼를 pRSV-F, pRSV-G(A), 및 pRSV-G(B)를 함유하는 콕테일로 면역화시켰다. 각각의 동물에게 200 μg/플라스미드를 최종 100 μl의 용적으로 제공하였다. 동물을 근육내/전기천공 면역화를 사용하여 총 4회 면역화시켰다. 제1의 면역화는 0주째에 수행하고, 제2의 면역화는 3주째에 수행하며, 제3의 면역화는 6주째에 및 제4의 면역화는 9주째에 수행하였다. 혈액을 동물로부터 6회 수집하였다: -2주(방혈-전 - 제1의 면역화 2주 전), 0주째(제1 면역화 전방혈-전), 2주째, 5주째, 8주째 및 13주째. 혈액을 ELISA 및 바이러스 중화 검정을 사용하여 분석하였다.
토끼 연구로부터의 데이터는 도 35에 나타낸다. RSV-F에 대한 체액 면역성을 측정하였다. 방혈-전 샘플로부터의 항-RSV-F IgG는 -2주 및 0주째에 취하였고 샘플로부터의 항-RSV-F IgG는 2주째, 5주째, 8주째 및 13주째에 취하였다. 2주째에, 샘플을 수집한 동물을 1회 면역화시키고 샘플을 면역화 후 2주째에 수집하였다. 5주 째에, 샘플을 수집한 동물을 2회 면역화시키고 샘플을 제2 면역화 후 2주째에 수집하였다. 8주 째에, 샘플을 수집한 동물을 3회 면역화시키고 샘플을 제3 면역화 후 2주째에 수집하였다. 13주 째에, 샘플을 수집한 동물을 4회 면역화시키고 샘플을 제4 면역화 후 4주째에 수집하였다.
토끼 연구로부터의 데이터는 도 36에 나타낸다. RSV-G에 대한 체액 면역성을 측정하였다. 방혈-전 샘플로부터의 항-RSV-G IgG를 -2주 및 0주째에 취하고 샘플로부터의 항-RSV-G IgG를 2주째, 5주째, 8주째 및 13주째에 취하였다. 2주째에, 샘플을 수집한 동물을 1회 면역화시키고 샘플을 면역화 후 2주째에 수집하였다. 5주 째에, 샘플을 수집한 동물을 2회 면역화시키고 샘플을 제2 면역화 후 2주째에 수집하였다. 8주 째에, 샘플을 수집한 동물을 3회 면역화시키고 샘플을 제3 면역화 후 2주째에 수집하였다. 13주 째에, 샘플을 수집한 동물을 4회 면역화시키고 샘플을 제4 면역화 후 4주째에 수집하였다.
RSV 비-인간 영장류 연구를 수행하였다. 본 연구의 목적은 비-인간 영장류(NHP)에서 콕테일로 투여된 단일-삽입물 pDNA RSV 백신의 체액성 면역성을 평가하기 위한 것이다. 또한, 연구를 수행하여, 백신의 다중 부위 전달, 전기천공 방법, 및 아쥬반트를 사용한 전달과 같은 인자들이 체액성 반응의 폭을 증가시킬 수 있는지를 평가하였다. 실험을 수행하여, RSV-F, RSV-G(A), 및 RSV-G(B)에 대한 합성 DNA 백신이 고 역가의 항-RSV 항체를 자극하는지를 측정하고, RSV 콕테일로 예방접종된 동물에서 특이적인 면역 반응을 분석하며 생성된 면역 반응에서 아쥬반트 및/또는 다중 부위 전달의 효과를 평가하였다. RSV 비-인간 영장류 연구 설계는 도 37에 나타낸다. 사용된 비-인간 영장류는 히말라야 원숭이(Rhesus macaque)이었다. 당해 연구에서, 15마리의 희말라야 원숭이를 4개 그룹으로 나누었다: 3개 그룹은 각각 4마리의 동물을 포함하였고 하나의 그룹은 3마리의 동물을 포함하였다. n이 4인 그룹은 처리된 그룹이며, 즉, 이들은 예방접종되었다. n이 3인 그룹은 대조군으로서 제공된 비처리 그룹이었다. 그룹은 다음과 같이 처리하였다.
그룹 1 (n=4): 각각의 동물에게 1 mg의 RSV-F, 1 mg의 RSV-G(A), 1 mg의 RSV-G(B)의 콕테일을 투여하였으며, 혼합하여 1개 부위에 근육내 전달하였다.
그룹 2 (n=4): 각각의 동물에게 1 mg의 RSV-F, 1 mg의 RSV-G(A), 1 mg의 RSV-G(B), 1mg의 rhMEC의 콕테일을 투여하였으며, 혼합하여 1개 부위에 근육내 전달하였다.
그룹 3(n=4): 각각의 동물에게 1 mg의 RSV-F, 1 mg의 RSV-G(A), 1 mg의 RSV-G(B)의 콕테일을 투여하였으며, 1회 혼합하여 3개 부위에 피내 전달하였다.
그룹 4(n=3): 각각의 동물은 처리하지 않았다.
동물을 전기천공을 사용하여 총 3회 면역화하였다. 제1의 면역화를 1주째에 수행하였고, 제2의 면역화를 5주째에 수행하였으며 제3의 면역화를 13주째에 수행하였다. 혈액을 동물로부터 6회 수집하였다: 0주째(제1 면역화전 방혈-전), 3주째, 7주째, 15주째, 17주째 및 18주째. 혈액을 ELISA 및 바이러스 중화 검정을 사용하여 분석하였다.
도 38a 내지 도 38d는 RSV-F에 대해 측정된 체액성 면역성의 RSV 비-인간 영장류 연구로부터의 데이터를 나타낸다. 도 38a는 순수한 동물에서 RSV-F에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다. 도 38b는 1개 부위에 콕테일 백신을 근육내 제공받은 동물에서 RSV-G에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다. 도 38c는 1개 부위에 콕테일 백신과 rhMEC 컨스트럭트를 근육내 제공받은 동물에서 RSV-F에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다. 도 38d는 3개 부위에 콕테일 백신을 피내 제공받은 동물에서 RSV-F에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다. 방혈-전 샘플로부터의 항-RSV-F IgG를 0주째에 취하였고 샘플로부터의 항-RSV-F IgG는 3주째, 15주째 및 18주째에 샘플로부터 취하였다. 3주째에, 샘플을 수집한 동물을 1회 면역화하고 샘플을 면역화 후 2주째에 수집하였다. 15주째에, 샘플을 수집한 동물을 3회 면역화하고 샘플을 제3의 면역화 후 2주째에 수집하였다. 18주째에, 샘플을 수집한 동물을 3회 면역화하고 샘플을 제3의 면역화 후 5주째에 수집하였다.
도 39a 내지 도 39d는 RSV-G에 대해 측정된 체액성 면역성의 RSV 비-인간 영장류 연구로부터의 데이터를 나타낸다. 도 39a는 나이브 동물에서 RSV-G에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다. 도 39b는 1개 부위에 콕테일 백신을 근육내 제공받은 동물에서 RSV-G에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다. 도 39c는 1개 부위에 콕테일 백신과 rhMEC 컨스트럭트를 근육내 제공받은 동물에서 RSV-G에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다. 도 39d는 3개 부위에 콕테일 백신을 피내 제공받은 동물에서 RSV-F에 대해 측정된 체액성 면역성으로부터의 데이터를 나타낸다. 방혈-전 샘플로부터의 항-RSV-G IgG를 0주째에 취하였고 샘플로부터의 항-RSV-G IgG는 3주째, 15주째 및 18주째에 샘플로부터 취하였다. 3주째에, 샘플을 수집한 동물을 1회 면역화하고 샘플을 면역화 후 2주째에 수집하였다. 15주째에, 샘플을 수집한 동물을 3회 면역화하고 샘플을 제3의 면역화 후 2주째에 수집하였다. 18주째에, 샘플을 수집한 동물을 3회 면역화하고 샘플을 제3의 면역화 후 5주째에 수집하였다.
도 40은 토끼 비-인간 영장류 연구에서 콕테일 백신을 사용한 RSV 예비 중화 결과의 요약을 나타내는 챠트이다. 면역화 후 3일째에 수집한 혈청으로부터의 중화 역가를 측정하였다. 음성 혈청을 음성 대조군으로 사용하였다. 양성 대조군은 항-RSV 모노클로날 항체 및 항-RSV 폴리클로날 항체를 포함하였다. 중화 역가를 대조군에 대해 및 콕테일 백신으로 예방접종된 2마리의 토끼 및 콕테일 백신으로 예방접종된 2마리의 비-인간 영장류로부터의 혈청에 대해 측정하였다. 방혈-전으로부터의 데이터는, 토끼 및 비-인간 영장류에서 중화 역가가 후 백신화를 생성하였음을 나타낸다.
<110> The Trustees of the University of Pennsylvania
Weiner, David B.
Choo, Daniel
Muthumani, Karuppiah
Obeng-Adjei, Nyamekye
Scott, Veronica
<120> HUMAN RESPIRATORY SYNCTIAL VIRUS CONCENSUS ANTIGENS, NUCLEIC ACID
CONSTRUCTS AND VACCINES MADE THEREFROM, AND METHODS OF USING THE
SAME
<130> 133172.03902
<150> 61/622279
<151> 2012-04-10
<160> 31
<170> PatentIn version 3.5
<210> 1
<211> 1725
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Sequence
<400> 1
gagctgccca tcctgaaaac aaacgccatc accaccatcc tggccgccgt gaccctgtgc 60
ttcgccagca gccagaacat caccgaggaa ttctaccaga gcacctgtag cgccgtgtcc 120
aagggctacc tgtctgccct gcggaccggc tggtacacca gcgtgatcac catcgagctg 180
agcaacatca aagaaaacaa gtgcaacggc accgacgcca aagtgaagct gatcaagcag 240
gaactggaca agtacaagaa cgccgtgacc gagctgcagc tgctgatgca gagcacccct 300
gccgccaaca acagagccag acgcgagctg ccccggttca tgaactacac cctgaacaac 360
accaagaaca ccaacgtgac cctgagcaag aagcggaagc ggcggttcct gggattcctg 420
ctgggcgtgg gcagcgccat tgcctctgga atcgctgtgt ctaaggtgct gcacctggaa 480
ggcgaagtga acaagatcaa gtccgccctg ctgagcacca acaaggccgt ggtgtccctg 540
agcaacggcg tgtccgtgct gaccagcaag gtgctggatc tgaagaacta catcgacaag 600
cagctgctgc ctatcgtgaa caagcagagc tgcagcatca gcaacatcga gacagtgatc 660
gagttccagc agaagaacaa ccggctgctg gaaatcaccc gcgagttcag cgtgaacgcc 720
ggcgtgacca cccccgtgtc cacctacatg ctgaccaaca gcgagctgct gagcctgatc 780
aacgacatgc ccatcaccaa cgaccagaaa aagctgatga gcaacaacgt gcagatcgtg 840
cggcagcaga gctactccat catgtccatc atcaaagaag aggtgctggc ctacgtggtg 900
cagctgcccc tgtacggcgt gatcgacacc ccctgctgga agctgcacac cagccccctg 960
tgcaccacca acaccaaaga gggcagcaac atctgcctga cccggaccga ccggggctgg 1020
tactgcgata atgccggcag cgtgtcattc tttccacagg ccgagacatg caaggtgcag 1080
agcaaccggg tgttctgcga caccatgaac agcctgaccc tgccctccga agtgaacctg 1140
tgcaacatcg acatcttcaa ccctaagtac gactgcaaga tcatgacctc caagaccgac 1200
gtgtccagct ccgtgatcac ctccctgggc gccatcgtgt cctgctacgg caagaccaag 1260
tgcaccgcca gcaacaagaa ccggggcatc atcaagacct tcagcaacgg ctgcgactac 1320
gtgtccaaca agggggtgga caccgtgtcc gtgggcaaca ccctgtacta cgtgaacaaa 1380
caggaaggca agagcctgta cgtgaagggc gagcccatca tcaacttcta cgaccccctg 1440
gtgttcccca gcgacgagtt cgacgccagc atcagccagg tgaacgagaa gatcaaccag 1500
agcctggcct tcatcagaaa gagcgacgag ctgctgcaca atgtgaatgc cggcaagagc 1560
accaccaata tcatgatcac cacaatcatc atcgtgatca ttgtgatcct gctgtccctg 1620
atcgccgtgg gcctgctgct gtactgcaag gcccggtcca cccctgtgac cctgtccaag 1680
gaccagctga gcggaatcat caacaatatc gccttctcca actga 1725
<210> 2
<211> 574
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Sequence
<400> 2
Glu Leu Pro Ile Leu Lys Thr Asn Ala Ile Thr Thr Ile Leu Ala Ala
1 5 10 15
Val Thr Leu Cys Phe Ala Ser Ser Gln Asn Ile Thr Glu Glu Phe Tyr
20 25 30
Gln Ser Thr Cys Ser Ala Val Ser Lys Gly Tyr Leu Ser Ala Leu Arg
35 40 45
Thr Gly Trp Tyr Thr Ser Val Ile Thr Ile Glu Leu Ser Asn Ile Lys
50 55 60
Glu Asn Lys Cys Asn Gly Thr Asp Ala Lys Val Lys Leu Ile Lys Gln
65 70 75 80
Glu Leu Asp Lys Tyr Lys Asn Ala Val Thr Glu Leu Gln Leu Leu Met
85 90 95
Gln Ser Thr Pro Ala Ala Asn Asn Arg Ala Arg Arg Glu Leu Pro Arg
100 105 110
Phe Met Asn Tyr Thr Leu Asn Asn Thr Lys Asn Thr Asn Val Thr Leu
115 120 125
Ser Lys Lys Arg Lys Arg Arg Phe Leu Gly Phe Leu Leu Gly Val Gly
130 135 140
Ser Ala Ile Ala Ser Gly Ile Ala Val Ser Lys Val Leu His Leu Glu
145 150 155 160
Gly Glu Val Asn Lys Ile Lys Ser Ala Leu Leu Ser Thr Asn Lys Ala
165 170 175
Val Val Ser Leu Ser Asn Gly Val Ser Val Leu Thr Ser Lys Val Leu
180 185 190
Asp Leu Lys Asn Tyr Ile Asp Lys Gln Leu Leu Pro Ile Val Asn Lys
195 200 205
Gln Ser Cys Ser Ile Ser Asn Ile Glu Thr Val Ile Glu Phe Gln Gln
210 215 220
Lys Asn Asn Arg Leu Leu Glu Ile Thr Arg Glu Phe Ser Val Asn Ala
225 230 235 240
Gly Val Thr Thr Pro Val Ser Thr Tyr Met Leu Thr Asn Ser Glu Leu
245 250 255
Leu Ser Leu Ile Asn Asp Met Pro Ile Thr Asn Asp Gln Lys Lys Leu
260 265 270
Met Ser Asn Asn Val Gln Ile Val Arg Gln Gln Ser Tyr Ser Ile Met
275 280 285
Ser Ile Ile Lys Glu Glu Val Leu Ala Tyr Val Val Gln Leu Pro Leu
290 295 300
Tyr Gly Val Ile Asp Thr Pro Cys Trp Lys Leu His Thr Ser Pro Leu
305 310 315 320
Cys Thr Thr Asn Thr Lys Glu Gly Ser Asn Ile Cys Leu Thr Arg Thr
325 330 335
Asp Arg Gly Trp Tyr Cys Asp Asn Ala Gly Ser Val Ser Phe Phe Pro
340 345 350
Gln Ala Glu Thr Cys Lys Val Gln Ser Asn Arg Val Phe Cys Asp Thr
355 360 365
Met Asn Ser Leu Thr Leu Pro Ser Glu Val Asn Leu Cys Asn Ile Asp
370 375 380
Ile Phe Asn Pro Lys Tyr Asp Cys Lys Ile Met Thr Ser Lys Thr Asp
385 390 395 400
Val Ser Ser Ser Val Ile Thr Ser Leu Gly Ala Ile Val Ser Cys Tyr
405 410 415
Gly Lys Thr Lys Cys Thr Ala Ser Asn Lys Asn Arg Gly Ile Ile Lys
420 425 430
Thr Phe Ser Asn Gly Cys Asp Tyr Val Ser Asn Lys Gly Val Asp Thr
435 440 445
Val Ser Val Gly Asn Thr Leu Tyr Tyr Val Asn Lys Gln Glu Gly Lys
450 455 460
Ser Leu Tyr Val Lys Gly Glu Pro Ile Ile Asn Phe Tyr Asp Pro Leu
465 470 475 480
Val Phe Pro Ser Asp Glu Phe Asp Ala Ser Ile Ser Gln Val Asn Glu
485 490 495
Lys Ile Asn Gln Ser Leu Ala Phe Ile Arg Lys Ser Asp Glu Leu Leu
500 505 510
His Asn Val Asn Ala Gly Lys Ser Thr Thr Asn Ile Met Ile Thr Thr
515 520 525
Ile Ile Ile Val Ile Ile Val Ile Leu Leu Ser Leu Ile Ala Val Gly
530 535 540
Leu Leu Leu Tyr Cys Lys Ala Arg Ser Thr Pro Val Thr Leu Ser Lys
545 550 555 560
Asp Gln Leu Ser Gly Ile Ile Asn Asn Ile Ala Phe Ser Asn
565 570
<210> 3
<211> 577
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Sequence
<400> 3
agcagacgga acccctgcaa gttcgagatc cggggccact gcctgaacgg caagcggtgc 60
cacttcagcc acaactactt cgagtggccc cctcacgccc tgctggtgcg ccagaacttc 120
atgctgaaca gaatcctgaa gtccatggac aagagcatcg acaccctgag cgagatcagc 180
ggagccgccg agctggaccg gaccgaggaa tatgccctgg gcgtggtggg agtgctggaa 240
agctacatcg gcagcatcaa caacatcacc aagcagagcg cctgcgtggc catgagcaag 300
ctgctgaccg agctgaacag cgacgacatc aagaagctgc gggacaacga ggaacccaac 360
agccccaaga tccgggtgta caacaccgtg atcagctaca tcgagagcaa ccggaagaac 420
aacaagcaga ccatccatct gctgaagcgg ctgcccgccg acgtgctgaa gaaaaccatc 480
aagaacaccc tggacatcca caagtccatc accatcaaca accccaaaga aagcaccgtg 540
tccgacacca acgaccacgc caagaacaac gacacca 577
<210> 4
<211> 194
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Sequence
<400> 4
Ser Arg Arg Asn Pro Cys Lys Phe Glu Ile Arg Gly His Cys Leu Asn
1 5 10 15
Gly Lys Arg Cys His Phe Ser His Asn Tyr Phe Glu Trp Pro Pro His
20 25 30
Ala Leu Leu Val Arg Gln Asn Phe Met Leu Asn Arg Ile Leu Lys Ser
35 40 45
Met Asp Lys Ser Ile Asp Thr Leu Ser Glu Ile Ser Gly Ala Ala Glu
50 55 60
Leu Asp Arg Thr Glu Glu Tyr Ala Leu Gly Val Val Gly Val Leu Glu
65 70 75 80
Ser Tyr Ile Gly Ser Ile Asn Asn Ile Thr Lys Gln Ser Ala Cys Val
85 90 95
Ala Met Ser Lys Leu Leu Thr Glu Leu Asn Ser Asp Asp Ile Lys Lys
100 105 110
Leu Arg Asp Asn Glu Glu Pro Asn Ser Pro Lys Ile Arg Val Tyr Asn
115 120 125
Thr Val Ile Ser Tyr Ile Glu Ser Asn Arg Lys Asn Asn Lys Gln Thr
130 135 140
Ile His Leu Leu Lys Arg Leu Pro Ala Asp Val Leu Lys Lys Thr Ile
145 150 155 160
Lys Asn Thr Leu Asp Ile His Lys Ser Ile Thr Ile Asn Asn Pro Lys
165 170 175
Glu Ser Thr Val Ser Asp Thr Asn Asp His Ala Lys Asn Asn Asp Thr
180 185 190
Thr Gly
<210> 5
<211> 894
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Sequence
<400> 5
tccaagaata aggatcagag gaccgcgaaa acgcttgaga ggacgtggga cacgctgaac 60
cacctcctgt tcatctcctc gtgtctctac aagctcaacc ttaagtccat cgcgcagatc 120
accttgagca ttctcgccat gatcatctcc accagcctta tcattgccgc aatcatcttc 180
atcgcatccg ccaaccataa ggtgacattg actacagcga ttatccaaga cgctactagc 240
cagatcaaga ataccacgcc gacctatttg acgcaaaatc ctcagttggg aattagcttc 300
tcgaatctct cggaaaccac gtcgcagccg actacaattc ttgcgtcaac gactccatcg 360
gccaaatcaa caccacaatc gactaccgta aaaacgaaga acacgactac aacacagatt 420
cagccttcaa agcccacgac caaacagaga cagaataagc cgcccaacaa gcccaacaat 480
gattttcact tcgaggtgtt taacttcgtg ccctgttcga tttgcagcaa taaccccacg 540
tgctgggcga tttgcaagcg aatcccgaat aagaagcccg ggaaaaagac cacgacgaaa 600
ccgacaaaga agccgacaat caagacaacg aaaaaggatc ttaaacctca gacgacaaag 660
cctaaggaag tcttgacaac gaagcctacg gaaaaaccca ctatcaatac taccaagact 720
aacatccgga caacactgct gacgagcaat accacgggaa acccggagct cacatcgcag 780
aaagagacac tccattcgac atcctccgag ggtaaccctt cgcccagcca ggtgtatacg 840
acgtcagaat accctagcca accctcatcg ccctcaaata cgacccggca atga 894
<210> 6
<211> 297
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Sequence
<400> 6
Ser Lys Asn Lys Asp Gln Arg Thr Ala Lys Thr Leu Glu Arg Thr Trp
1 5 10 15
Asp Thr Leu Asn His Leu Leu Phe Ile Ser Ser Cys Leu Tyr Lys Leu
20 25 30
Asn Leu Lys Ser Ile Ala Gln Ile Thr Leu Ser Ile Leu Ala Met Ile
35 40 45
Ile Ser Thr Ser Leu Ile Ile Ala Ala Ile Ile Phe Ile Ala Ser Ala
50 55 60
Asn His Lys Val Thr Leu Thr Thr Ala Ile Ile Gln Asp Ala Thr Ser
65 70 75 80
Gln Ile Lys Asn Thr Thr Pro Thr Tyr Leu Thr Gln Asn Pro Gln Leu
85 90 95
Gly Ile Ser Phe Ser Asn Leu Ser Glu Thr Thr Ser Gln Pro Thr Thr
100 105 110
Ile Leu Ala Ser Thr Thr Pro Ser Ala Lys Ser Thr Pro Gln Ser Thr
115 120 125
Thr Val Lys Thr Lys Asn Thr Thr Thr Thr Gln Ile Gln Pro Ser Lys
130 135 140
Pro Thr Thr Lys Gln Arg Gln Asn Lys Pro Pro Asn Lys Pro Asn Asn
145 150 155 160
Asp Phe His Phe Glu Val Phe Asn Phe Val Pro Cys Ser Ile Cys Ser
165 170 175
Asn Asn Pro Thr Cys Trp Ala Ile Cys Lys Arg Ile Pro Asn Lys Lys
180 185 190
Pro Gly Lys Lys Thr Thr Thr Lys Pro Thr Lys Lys Pro Thr Ile Lys
195 200 205
Thr Thr Lys Lys Asp Leu Lys Pro Gln Thr Thr Lys Pro Lys Glu Val
210 215 220
Leu Thr Thr Lys Pro Thr Glu Lys Pro Thr Ile Asn Thr Thr Lys Thr
225 230 235 240
Asn Ile Arg Thr Thr Leu Leu Thr Ser Asn Thr Thr Gly Asn Pro Glu
245 250 255
Leu Thr Ser Gln Lys Glu Thr Leu His Ser Thr Ser Ser Glu Gly Asn
260 265 270
Pro Ser Pro Ser Gln Val Tyr Thr Thr Ser Glu Tyr Pro Ser Gln Pro
275 280 285
Ser Ser Pro Ser Asn Thr Thr Arg Gln
290 295
<210> 7
<211> 876
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Sequence
<400> 7
agcaaaaaca aaaaccaaag gacggctcgg acgcttgaga aaacatggga cacgcttaat 60
caccttattg tgatctcatc gtgtttgtac cggttgaatc tcaagagcat cgcccagatt 120
gcgctgtcag tcctggccat gattatctcg acatcactca tcatcgcagc catcatcttt 180
atcatttcag cgaatcacaa ggtaacgctt acaacagtca cggtgcagac catcaagaat 240
cataccgaaa agaatatcac aacctacctc acccaagtca gcccggagag agtaagcccc 300
tcaaaacagc ctactacgac acctcccatc cacacgaact cggcgaccat ctcaccgaat 360
accaaatcag aaacgcatca tacgaccgca cagacaaagg gacgaaccac tacacccaca 420
cagaacaaca aacccagcac caagccgagg ccaaagaatc cgcccaagaa gccgaaagat 480
gactatcact ttgaagtgtt caacttcgta ccgtgttcga tttgcgggaa taatcagttg 540
tgcaaatcca tttgcaagac gatcccatcc aacaaaccga agaagaaacc taccatcaag 600
cccacaaaca agccaacgac aaaaacaacg aacaagcgcg atcccaaaac gctcgcgaaa 660
acgttgaaga aggaaacgac gacaaaccct acgaagaaac ccacgcccaa gaccactgag 720
agagacacct ccacctcgca atcgacggta cttgacacga ctacgagcaa gcacactatc 780
cagcaacagt ccctgcactc aaccacgccc gagaatacac caaactcaac acagactccg 840
acagcttcag agccttccac ttcgaattcc acatga 876
<210> 8
<211> 291
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Sequence
<400> 8
Ser Lys Asn Lys Asn Gln Arg Thr Ala Arg Thr Leu Glu Lys Thr Trp
1 5 10 15
Asp Thr Leu Asn His Leu Ile Val Ile Ser Ser Cys Leu Tyr Arg Leu
20 25 30
Asn Leu Lys Ser Ile Ala Gln Ile Ala Leu Ser Val Leu Ala Met Ile
35 40 45
Ile Ser Thr Ser Leu Ile Ile Ala Ala Ile Ile Phe Ile Ile Ser Ala
50 55 60
Asn His Lys Val Thr Leu Thr Thr Val Thr Val Gln Thr Ile Lys Asn
65 70 75 80
His Thr Glu Lys Asn Ile Thr Thr Tyr Leu Thr Gln Val Ser Pro Glu
85 90 95
Arg Val Ser Pro Ser Lys Gln Pro Thr Thr Thr Pro Pro Ile His Thr
100 105 110
Asn Ser Ala Thr Ile Ser Pro Asn Thr Lys Ser Glu Thr His His Thr
115 120 125
Thr Ala Gln Thr Lys Gly Arg Thr Thr Thr Pro Thr Gln Asn Asn Lys
130 135 140
Pro Ser Thr Lys Pro Arg Pro Lys Asn Pro Pro Lys Lys Pro Lys Asp
145 150 155 160
Asp Tyr His Phe Glu Val Phe Asn Phe Val Pro Cys Ser Ile Cys Gly
165 170 175
Asn Asn Gln Leu Cys Lys Ser Ile Cys Lys Thr Ile Pro Ser Asn Lys
180 185 190
Pro Lys Lys Lys Pro Thr Ile Lys Pro Thr Asn Lys Pro Thr Thr Lys
195 200 205
Thr Thr Asn Lys Arg Asp Pro Lys Thr Leu Ala Lys Thr Leu Lys Lys
210 215 220
Glu Thr Thr Thr Asn Pro Thr Lys Lys Pro Thr Pro Lys Thr Thr Glu
225 230 235 240
Arg Asp Thr Ser Thr Ser Gln Ser Thr Val Leu Asp Thr Thr Thr Ser
245 250 255
Lys His Thr Ile Gln Gln Gln Ser Leu His Ser Thr Thr Pro Glu Asn
260 265 270
Thr Pro Asn Ser Thr Gln Thr Pro Thr Ala Ser Glu Pro Ser Thr Ser
275 280 285
Asn Ser Thr
290
<210> 9
<211> 840
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Sequence
<400> 9
ctggcctacg tggtgcagct gcccctgtac ggcgtgatcg acaccccctg ctggaagctg 60
cacaccagcc ccctgtgcac caccaacacc aaagagggca gcaacatctg cctgacccgg 120
accgaccggg gctggtactg cgataatgcc ggcagcgtgt cattctttcc acaggccgag 180
acatgcaagg tgcagagcaa ccgggtgttc tgcgacacca tgaacagcct gaccctgccc 240
tccgaagtga acctgtgcaa catcgacatc ttcaacccta agtacgactg caagatcatg 300
acctccaaga ccgacgtgtc cagctccgtg atcacctccc tgggcgccat cgtgtcctgc 360
tacggcaaga ccaagtgcac cgccagcaac aagaaccggg gcatcatcaa gaccttcagc 420
aacggctgcg actacgtgtc caacaagggg gtggacaccg tgtccgtggg caacaccctg 480
tactacgtga acaaacagga aggcaagagc ctgtacgtga agggcgagcc catcatcaac 540
ttctacgacc ccctggtgtt ccccagcgac gagttcgacg ccagcatcag ccaggtgaac 600
gagaagatca accagagcct ggccttcatc agaaagagcg acgagctgct gcacaatgtg 660
aatgccggca agagcaccac caatatcatg atcaccacaa tcatcatcgt gatcattgtg 720
atcctgctgt ccctgatcgc cgtgggcctg ctgctgtact gcaaggcccg gtccacccct 780
gtgaccctgt ccaaggacca gctgagcgga atcatcaaca atatcgcctt ctccaactga 840
840
<210> 10
<211> 592
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Sequence
<400> 10
Met Asp Trp Thr Trp Ile Leu Phe Leu Val Ala Ala Ala Thr Arg Val
1 5 10 15
His Ser Glu Leu Pro Ile Leu Lys Thr Asn Ala Ile Thr Thr Ile Leu
20 25 30
Ala Ala Val Thr Leu Cys Phe Ala Ser Ser Gln Asn Ile Thr Glu Glu
35 40 45
Phe Tyr Gln Ser Thr Cys Ser Ala Val Ser Lys Gly Tyr Leu Ser Ala
50 55 60
Leu Arg Thr Gly Trp Tyr Thr Ser Val Ile Thr Ile Glu Leu Ser Asn
65 70 75 80
Ile Lys Glu Asn Lys Cys Asn Gly Thr Asp Ala Lys Val Lys Leu Ile
85 90 95
Lys Gln Glu Leu Asp Lys Tyr Lys Asn Ala Val Thr Glu Leu Gln Leu
100 105 110
Leu Met Gln Ser Thr Pro Ala Ala Asn Asn Arg Ala Arg Arg Glu Leu
115 120 125
Pro Arg Phe Met Asn Tyr Thr Leu Asn Asn Thr Lys Asn Thr Asn Val
130 135 140
Thr Leu Ser Lys Lys Arg Lys Arg Arg Phe Leu Gly Phe Leu Leu Gly
145 150 155 160
Val Gly Ser Ala Ile Ala Ser Gly Ile Ala Val Ser Lys Val Leu His
165 170 175
Leu Glu Gly Glu Val Asn Lys Ile Lys Ser Ala Leu Leu Ser Thr Asn
180 185 190
Lys Ala Val Val Ser Leu Ser Asn Gly Val Ser Val Leu Thr Ser Lys
195 200 205
Val Leu Asp Leu Lys Asn Tyr Ile Asp Lys Gln Leu Leu Pro Ile Val
210 215 220
Asn Lys Gln Ser Cys Ser Ile Ser Asn Ile Glu Thr Val Ile Glu Phe
225 230 235 240
Gln Gln Lys Asn Asn Arg Leu Leu Glu Ile Thr Arg Glu Phe Ser Val
245 250 255
Asn Ala Gly Val Thr Thr Pro Val Ser Thr Tyr Met Leu Thr Asn Ser
260 265 270
Glu Leu Leu Ser Leu Ile Asn Asp Met Pro Ile Thr Asn Asp Gln Lys
275 280 285
Lys Leu Met Ser Asn Asn Val Gln Ile Val Arg Gln Gln Ser Tyr Ser
290 295 300
Ile Met Ser Ile Ile Lys Glu Glu Val Leu Ala Tyr Val Val Gln Leu
305 310 315 320
Pro Leu Tyr Gly Val Ile Asp Thr Pro Cys Trp Lys Leu His Thr Ser
325 330 335
Pro Leu Cys Thr Thr Asn Thr Lys Glu Gly Ser Asn Ile Cys Leu Thr
340 345 350
Arg Thr Asp Arg Gly Trp Tyr Cys Asp Asn Ala Gly Ser Val Ser Phe
355 360 365
Phe Pro Gln Ala Glu Thr Cys Lys Val Gln Ser Asn Arg Val Phe Cys
370 375 380
Asp Thr Met Asn Ser Leu Thr Leu Pro Ser Glu Val Asn Leu Cys Asn
385 390 395 400
Ile Asp Ile Phe Asn Pro Lys Tyr Asp Cys Lys Ile Met Thr Ser Lys
405 410 415
Thr Asp Val Ser Ser Ser Val Ile Thr Ser Leu Gly Ala Ile Val Ser
420 425 430
Cys Tyr Gly Lys Thr Lys Cys Thr Ala Ser Asn Lys Asn Arg Gly Ile
435 440 445
Ile Lys Thr Phe Ser Asn Gly Cys Asp Tyr Val Ser Asn Lys Gly Val
450 455 460
Asp Thr Val Ser Val Gly Asn Thr Leu Tyr Tyr Val Asn Lys Gln Glu
465 470 475 480
Gly Lys Ser Leu Tyr Val Lys Gly Glu Pro Ile Ile Asn Phe Tyr Asp
485 490 495
Pro Leu Val Phe Pro Ser Asp Glu Phe Asp Ala Ser Ile Ser Gln Val
500 505 510
Asn Glu Lys Ile Asn Gln Ser Leu Ala Phe Ile Arg Lys Ser Asp Glu
515 520 525
Leu Leu His Asn Val Asn Ala Gly Lys Ser Thr Thr Asn Ile Met Ile
530 535 540
Thr Thr Ile Ile Ile Val Ile Ile Val Ile Leu Leu Ser Leu Ile Ala
545 550 555 560
Val Gly Leu Leu Leu Tyr Cys Lys Ala Arg Ser Thr Pro Val Thr Leu
565 570 575
Ser Lys Asp Gln Leu Ser Gly Ile Ile Asn Asn Ile Ala Phe Ser Asn
580 585 590
<210> 11
<211> 631
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Sequence
<400> 11
atggactgga cctggattct gttcctggtg gccgctgcta cccgggtgca cagcagcaga 60
cggaacccct gcaagttcga gatccggggc cactgcctga acggcaagcg gtgccacttc 120
agccacaact acttcgagtg gccccctcac gccctgctgg tgcgccagaa cttcatgctg 180
aacagaatcc tgaagtccat ggacaagagc atcgacaccc tgagcgagat cagcggagcc 240
gccgagctgg accggaccga ggaatatgcc ctgggcgtgg tgggagtgct ggaaagctac 300
atcggcagca tcaacaacat caccaagcag agcgcctgcg tggccatgag caagctgctg 360
accgagctga acagcgacga catcaagaag ctgcgggaca acgaggaacc caacagcccc 420
aagatccggg tgtacaacac cgtgatcagc tacatcgaga gcaaccggaa gaacaacaag 480
cagaccatcc atctgctgaa gcggctgccc gccgacgtgc tgaagaaaac catcaagaac 540
accctggaca tccacaagtc catcaccatc aacaacccca aagaaagcac cgtgtccgac 600
accaacgacc acgccaagaa caacgacacc a 631
<210> 12
<211> 212
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Sequence
<400> 12
Met Asp Trp Thr Trp Ile Leu Phe Leu Val Ala Ala Ala Thr Arg Val
1 5 10 15
His Ser Ser Arg Arg Asn Pro Cys Lys Phe Glu Ile Arg Gly His Cys
20 25 30
Leu Asn Gly Lys Arg Cys His Phe Ser His Asn Tyr Phe Glu Trp Pro
35 40 45
Pro His Ala Leu Leu Val Arg Gln Asn Phe Met Leu Asn Arg Ile Leu
50 55 60
Lys Ser Met Asp Lys Ser Ile Asp Thr Leu Ser Glu Ile Ser Gly Ala
65 70 75 80
Ala Glu Leu Asp Arg Thr Glu Glu Tyr Ala Leu Gly Val Val Gly Val
85 90 95
Leu Glu Ser Tyr Ile Gly Ser Ile Asn Asn Ile Thr Lys Gln Ser Ala
100 105 110
Cys Val Ala Met Ser Lys Leu Leu Thr Glu Leu Asn Ser Asp Asp Ile
115 120 125
Lys Lys Leu Arg Asp Asn Glu Glu Pro Asn Ser Pro Lys Ile Arg Val
130 135 140
Tyr Asn Thr Val Ile Ser Tyr Ile Glu Ser Asn Arg Lys Asn Asn Lys
145 150 155 160
Gln Thr Ile His Leu Leu Lys Arg Leu Pro Ala Asp Val Leu Lys Lys
165 170 175
Thr Ile Lys Asn Thr Leu Asp Ile His Lys Ser Ile Thr Ile Asn Asn
180 185 190
Pro Lys Glu Ser Thr Val Ser Asp Thr Asn Asp His Ala Lys Asn Asn
195 200 205
Asp Thr Thr Gly
210
<210> 13
<211> 948
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Sequence
<400> 13
atggactgga catggatctt gtttcttgta gcggcagcaa cacgcgtcca ctcctccaag 60
aataaggatc agaggaccgc gaaaacgctt gagaggacgt gggacacgct gaaccacctc 120
ctgttcatct cctcgtgtct ctacaagctc aaccttaagt ccatcgcgca gatcaccttg 180
agcattctcg ccatgatcat ctccaccagc cttatcattg ccgcaatcat cttcatcgca 240
tccgccaacc ataaggtgac attgactaca gcgattatcc aagacgctac tagccagatc 300
aagaatacca cgccgaccta tttgacgcaa aatcctcagt tgggaattag cttctcgaat 360
ctctcggaaa ccacgtcgca gccgactaca attcttgcgt caacgactcc atcggccaaa 420
tcaacaccac aatcgactac cgtaaaaacg aagaacacga ctacaacaca gattcagcct 480
tcaaagccca cgaccaaaca gagacagaat aagccgccca acaagcccaa caatgatttt 540
cacttcgagg tgtttaactt cgtgccctgt tcgatttgca gcaataaccc cacgtgctgg 600
gcgatttgca agcgaatccc gaataagaag cccgggaaaa agaccacgac gaaaccgaca 660
aagaagccga caatcaagac aacgaaaaag gatcttaaac ctcagacgac aaagcctaag 720
gaagtcttga caacgaagcc tacggaaaaa cccactatca atactaccaa gactaacatc 780
cggacaacac tgctgacgag caataccacg ggaaacccgg agctcacatc gcagaaagag 840
acactccatt cgacatcctc cgagggtaac ccttcgccca gccaggtgta tacgacgtca 900
gaatacccta gccaaccctc atcgccctca aatacgaccc ggcaatga 948
<210> 14
<211> 315
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Sequence
<400> 14
Met Asp Trp Thr Trp Ile Leu Phe Leu Val Ala Ala Ala Thr Arg Val
1 5 10 15
His Ser Ser Lys Asn Lys Asp Gln Arg Thr Ala Lys Thr Leu Glu Arg
20 25 30
Thr Trp Asp Thr Leu Asn His Leu Leu Phe Ile Ser Ser Cys Leu Tyr
35 40 45
Lys Leu Asn Leu Lys Ser Ile Ala Gln Ile Thr Leu Ser Ile Leu Ala
50 55 60
Met Ile Ile Ser Thr Ser Leu Ile Ile Ala Ala Ile Ile Phe Ile Ala
65 70 75 80
Ser Ala Asn His Lys Val Thr Leu Thr Thr Ala Ile Ile Gln Asp Ala
85 90 95
Thr Ser Gln Ile Lys Asn Thr Thr Pro Thr Tyr Leu Thr Gln Asn Pro
100 105 110
Gln Leu Gly Ile Ser Phe Ser Asn Leu Ser Glu Thr Thr Ser Gln Pro
115 120 125
Thr Thr Ile Leu Ala Ser Thr Thr Pro Ser Ala Lys Ser Thr Pro Gln
130 135 140
Ser Thr Thr Val Lys Thr Lys Asn Thr Thr Thr Thr Gln Ile Gln Pro
145 150 155 160
Ser Lys Pro Thr Thr Lys Gln Arg Gln Asn Lys Pro Pro Asn Lys Pro
165 170 175
Asn Asn Asp Phe His Phe Glu Val Phe Asn Phe Val Pro Cys Ser Ile
180 185 190
Cys Ser Asn Asn Pro Thr Cys Trp Ala Ile Cys Lys Arg Ile Pro Asn
195 200 205
Lys Lys Pro Gly Lys Lys Thr Thr Thr Lys Pro Thr Lys Lys Pro Thr
210 215 220
Ile Lys Thr Thr Lys Lys Asp Leu Lys Pro Gln Thr Thr Lys Pro Lys
225 230 235 240
Glu Val Leu Thr Thr Lys Pro Thr Glu Lys Pro Thr Ile Asn Thr Thr
245 250 255
Lys Thr Asn Ile Arg Thr Thr Leu Leu Thr Ser Asn Thr Thr Gly Asn
260 265 270
Pro Glu Leu Thr Ser Gln Lys Glu Thr Leu His Ser Thr Ser Ser Glu
275 280 285
Gly Asn Pro Ser Pro Ser Gln Val Tyr Thr Thr Ser Glu Tyr Pro Ser
290 295 300
Gln Pro Ser Ser Pro Ser Asn Thr Thr Arg Gln
305 310 315
<210> 15
<211> 926
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Sequence
<400> 15
atggattgga cttggatttt gttcttggtg gcagcggcca ctcgcgtcca ttccagcaaa 60
aacaaaaacc aaaggacggc tcggacgctt gagaaaacat gggacacgct taatcacctt 120
attgtgatct catcgtgttt gtaccggttg aatctcaaga gcatcgccca gattgcgctg 180
tcagtcctgg ccatgattat ctcgacatca ctcatcatcg cagccatcat ctttatcatt 240
tcagcgaatc acaaggtaac gcttacaaca gtcacggtgc agaccatcaa gaatcatacc 300
aaaagaatat cacaacctac ctcacccaag tcagcccgga gagagtaagc ccctcaaaac 360
agcctactac gacacctccc atccacacga actcggcgac catctcaccg aataccaaac 420
agaaacgcat catacgaccg cacagacaaa gggacgaacc actacaccca cacagaacac 480
aaacccagca ccaagccgag gccaaagaat ccgcccaaga agccgaaaga tgactatcac 540
tttgaagtgt tcaacttcgt accgtgttcg atttgcggga ataatcagtt gtgcaaatcc 600
atttgcaaga cgatcccatc caacaaaccg aagaagaaac ctaccatcaa gcccacaaac 660
aagccaacga caaaaacaac gaacaagcgc gatcccaaaa cgctcgcgaa aacgttgaga 720
aggaaacgac gacaaaccct acgaagaaac ccacgcccaa gaccactgag agagacacct 780
ccacctcgca atcgacggta cttgacacga ctacgagcaa gcacactatc cagcaacagt 840
ccctgcactc aaccacgccc gagaatacac caaactcaac acagactccg acagcttcag 900
agccttccac ttcgaattcc acatga 926
<210> 16
<211> 309
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Sequence
<400> 16
Met Asp Trp Thr Trp Ile Leu Phe Leu Val Ala Ala Ala Thr Arg Val
1 5 10 15
His Ser Ser Lys Asn Lys Asn Gln Arg Thr Ala Arg Thr Leu Glu Lys
20 25 30
Thr Trp Asp Thr Leu Asn His Leu Ile Val Ile Ser Ser Cys Leu Tyr
35 40 45
Arg Leu Asn Leu Lys Ser Ile Ala Gln Ile Ala Leu Ser Val Leu Ala
50 55 60
Met Ile Ile Ser Thr Ser Leu Ile Ile Ala Ala Ile Ile Phe Ile Ile
65 70 75 80
Ser Ala Asn His Lys Val Thr Leu Thr Thr Val Thr Val Gln Thr Ile
85 90 95
Lys Asn His Thr Glu Lys Asn Ile Thr Thr Tyr Leu Thr Gln Val Ser
100 105 110
Pro Glu Arg Val Ser Pro Ser Lys Gln Pro Thr Thr Thr Pro Pro Ile
115 120 125
His Thr Asn Ser Ala Thr Ile Ser Pro Asn Thr Lys Ser Glu Thr His
130 135 140
His Thr Thr Ala Gln Thr Lys Gly Arg Thr Thr Thr Pro Thr Gln Asn
145 150 155 160
Asn Lys Pro Ser Thr Lys Pro Arg Pro Lys Asn Pro Pro Lys Lys Pro
165 170 175
Lys Asp Asp Tyr His Phe Glu Val Phe Asn Phe Val Pro Cys Ser Ile
180 185 190
Cys Gly Asn Asn Gln Leu Cys Lys Ser Ile Cys Lys Thr Ile Pro Ser
195 200 205
Asn Lys Pro Lys Lys Lys Pro Thr Ile Lys Pro Thr Asn Lys Pro Thr
210 215 220
Thr Lys Thr Thr Asn Lys Arg Asp Pro Lys Thr Leu Ala Lys Thr Leu
225 230 235 240
Lys Lys Glu Thr Thr Thr Asn Pro Thr Lys Lys Pro Thr Pro Lys Thr
245 250 255
Thr Glu Arg Asp Thr Ser Thr Ser Gln Ser Thr Val Leu Asp Thr Thr
260 265 270
Thr Ser Lys His Thr Ile Gln Gln Gln Ser Leu His Ser Thr Thr Pro
275 280 285
Glu Asn Thr Pro Asn Ser Thr Gln Thr Pro Thr Ala Ser Glu Pro Ser
290 295 300
Thr Ser Asn Ser Thr
305
<210> 17
<211> 18
<212> PRT
<213> Human
<400> 17
Met Asp Trp Thr Trp Ile Leu Phe Leu Val Ala Ala Ala Thr Arg Val
1 5 10 15
His Ser
<210> 18
<211> 291
<212> DNA
<213> Human
<400> 18
gcctgcggcg gcaagagact gctgttcctg gccctggcct gggtgctgct ggcccacctg 60
tgttctcagg ccgaggccag caactacgac tgctgcctga gctacatcca gacccccctg 120
cccagcagag ccatcgtggg cttcaccaga cagatggccg acgaggcctg cgacatcaac 180
gccatcatct tccacaccaa gaaacgcaag agcgtgtgcg ccgaccccaa gcagaactgg 240
gtcaagagag ccgtgaacct gctgagcctg agagtgaaga aaatgtgatg a 291
<210> 19
<211> 95
<212> PRT
<213> Human
<400> 19
Ala Cys Gly Gly Lys Arg Leu Leu Phe Leu Ala Leu Ala Trp Val Leu
1 5 10 15
Leu Ala His Leu Cys Ser Gln Ala Glu Ala Ser Asn Tyr Asp Cys Cys
20 25 30
Leu Ser Tyr Ile Gln Thr Pro Leu Pro Ser Arg Ala Ile Val Gly Phe
35 40 45
Thr Arg Gln Met Ala Asp Glu Ala Cys Asp Ile Asn Ala Ile Ile Phe
50 55 60
His Thr Lys Lys Arg Lys Ser Val Cys Ala Asp Pro Lys Gln Asn Trp
65 70 75 80
Val Lys Arg Ala Val Asn Leu Leu Ser Leu Arg Val Lys Lys Met
85 90 95
<210> 20
<211> 345
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Sequence
<400> 20
atggactgga cctggattct gttcctggtg gccgctgcta caagagtgca ctctgcctgc 60
ggcggcaaga gactgctgtt cctggccctg gcctgggtgc tgctggccca cctgtgttct 120
caggccgagg ccagcaacta cgactgctgc ctgagctaca tccagacccc cctgcccagc 180
agagccatcg tgggcttcac cagacagatg gccgacgagg cctgcgacat caacgccatc 240
atcttccaca ccaagaaacg caagagcgtg tgcgccgacc ccaagcagaa ctgggtcaag 300
agagccgtga acctgctgag cctgagagtg aagaaaatgt gatga 345
<210> 21
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Sequence
<400> 21
Met Asp Trp Thr Trp Ile Leu Phe Leu Val Ala Ala Ala Thr Arg Val
1 5 10 15
His Ser Ala Cys Gly Gly Lys Arg Leu Leu Phe Leu Ala Leu Ala Trp
20 25 30
Val Leu Leu Ala His Leu Cys Ser Gln Ala Glu Ala Ser Asn Tyr Asp
35 40 45
Cys Cys Leu Ser Tyr Ile Gln Thr Pro Leu Pro Ser Arg Ala Ile Val
50 55 60
Gly Phe Thr Arg Gln Met Ala Asp Glu Ala Cys Asp Ile Asn Ala Ile
65 70 75 80
Ile Phe His Thr Lys Lys Arg Lys Ser Val Cys Ala Asp Pro Lys Gln
85 90 95
Asn Trp Val Lys Arg Ala Val Asn Leu Leu Ser Leu Arg Val Lys Lys
100 105 110
Met
<210> 22
<211> 9
<212> PRT
<213> Respiratory Syncytial Virus
<400> 22
Lys Tyr Lys Asn Ala Val Thr Glu Leu
1 5
<210> 23
<211> 18
<212> PRT
<213> Respiratory Syncytial Virus
<400> 23
Ile Glu Thr Val Ile Glu Phe Gln Gln Lys Asn Asn Arg Leu Leu Glu
1 5 10 15
Ile Thr
<210> 24
<211> 9
<212> PRT
<213> Respiratory Syncytial Virus
<400> 24
Tyr Met Leu Thr Asn Ser Glu Leu Leu
1 5
<210> 25
<211> 70
<212> PRT
<213> Respiratory Syncytial Virus
<400> 25
Ser Val Gly Asn Thr Leu Tyr Tyr Val Asn Lys Gln Glu Gly Lys Ser
1 5 10 15
Leu Tyr Val Lys Gly Glu Pro Ile Ile Asn Phe Tyr Asp Pro Leu Val
20 25 30
Phe Pro Ser Asp Glu Phe Asp Ala Ser Ile Ser Gln Val Asn Glu Lys
35 40 45
Ile Asn Gln Ser Leu Ala Phe Ile Arg Lys Ser Asp Glu Leu Leu His
50 55 60
Asn Val Asn Ala Gly Lys
65 70
<210> 26
<211> 5
<212> PRT
<213> Respiratory Syncytial Virus
<400> 26
Arg Ala Arg Arg Glu
1 5
<210> 27
<211> 7
<212> PRT
<213> Respiratory Syncytial Virus
<400> 27
Lys Lys Arg Lys Arg Arg Phe
1 5
<210> 28
<211> 15
<212> PRT
<213> Respiratory Syncytial Virus
<400> 28
Leu Leu Gly Val Gly Ser Ala Ile Ala Ser Gly Ile Ala Val Ser
1 5 10 15
<210> 29
<211> 42
<212> PRT
<213> Respiratory Syncytial Virus
<400> 29
Ser Leu Ile Asn Asp Met Pro Ile Thr Asn Asp Gln Lys Lys Leu Met
1 5 10 15
Ser Asn Asn Val Gln Ile Val Arg Gln Gln Ser Tyr Ser Ile Met Ser
20 25 30
Ile Ile Lys Glu Glu Val Leu Ala Tyr Val
35 40
<210> 30
<211> 9
<212> PRT
<213> Respiratory Syncytial Virus
<400> 30
Ser Tyr Ile Gly Ser Ile Asn Asn Ile
1 5
<210> 31
<211> 9
<212> PRT
<213> Respiratory Syncytial Virus
<400> 31
Asn Tyr Phe Glu Trp Pro Pro His Ala
1 5
Claims (44)
- 하기 a) 내지 c)로 이루어진 그룹 중에서 선택된 RSV 면역원을 인코딩하는 하나 이상의 핵산 서열들을 포함하는 조성물:
a) RSV F 면역원을 인코딩하는 핵산 코딩 서열(여기서, RSV F 면역원을 인코딩하는 핵산 코딩 서열은,
서열 번호: 2를 인코딩하고 서열 번호: 2를 인코딩하는 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열;
적어도 115개 이상의 아미노산들인 서열 번호: 2의 단편을 인코딩하고 서열 번호: 2의 단편을 인코딩하는 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열;
서열 번호: 2에 대해 적어도 98% 상동성인 단백질을 인코딩하고 서열 번호: 2에 대해 적어도 98% 상동성인 단백질을 인코딩하는 코딩 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열; 및
적어도 115개 이상의 아미노산들인 서열 번호: 2에 대해 적어도 98% 상동성인 단백질의 단편을 인코딩하고 서열 번호: 2에 대해 적어도 98% 상동성인 단백질의 단편을 인코딩하는 서열에 대해 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열로 이루어진 그룹 중에서 선택된다);
b) RSV Ga 면역원을 인코딩하는 핵산 코딩 서열(여기서, RSV Ga 면역원을 인코딩하는 핵산 코딩서열은,
서열 번호: 6을 인코딩하고 서열 번호: 6을 인코딩하는 서열에 대해 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열;
적어도 125개 이상의 아미노산들인 서열 번호: 6의 단편을 인코딩하고 서열 번호: 6의 단편을 인코딩하는 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열;
서열 번호: 6에 대해 적어도 98% 상동성인 단백질을 인코딩하고 서열 번호: 6에 대해 적어도 98% 상동성인 단백질을 인코딩하는 코딩 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열; 및
적어도 125개 이상의 아미노산들인 서열 번호: 6에 대해 적어도 98% 상동성인 단백질의 단편을 인코딩하고 서열 번호: 6에 대해 적어도 98% 상동성인 단백질의 단편을 인코딩하는 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열로 이루어진 그룹 중에서 선택된다); 및
c) RSV Gb 면역원을 인코딩하는 핵산 코딩 서열(여기서, RSV Gb 면역원을 인코딩하는 핵산 코딩서열은,
서열 번호: 8을 인코딩하고 서열 번호: 8을 인코딩하는 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열;
적어도 125개 이상의 아미노산들인 서열 번호: 8의 단편을 인코딩하고 서열 번호: 8의 단편을 인코딩하는 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열;
서열 번호: 8에 대해 적어도 98% 상동성인 단백질을 인코딩하고 서열 번호: 8에 대해 적어도 98% 상동성인 단백질을 인코딩하는 코딩 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열; 및
적어도 125개 이상의 아미노산들이고 서열 번호: 8에 대해 적어도 98% 상동성인 단백질의 단편을 인코딩하고 서열 번호: 8에 대해 적어도 98% 상동성인 단백질의 단편을 인코딩하는 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열로 이루어진 그룹 중에서 선택된다). - 청구항 1에 있어서, 하기 a) 내지 c)로 이루어진 그룹 중에서 선택된 RSV 면역원을 인코딩하는 하나 이상의 핵산 서열들을 포함하는 조성물:
a) RSV F 면역원을 인코딩하는 핵산 코딩 서열(여기서, RSV F 면역원을 인코딩하는 핵산 코딩 서열은,
서열 번호: 1을 포함하고 서열 번호: 1에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열;
적어도 115개 이상의 아미노산들을 인코딩하는 서열 번호: 1의 단편을 포함하고 서열 번호: 1에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열;
서열 번호: 1에 대해 적어도 98% 상동성이고 서열 번호: 1에 대해 적어도 98% 상동성인 코딩 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열; 및
적어도 115개 이상의 아미노산을 인코딩하는 서열 번호: 1에 대해 적어도 98% 상동성이고 서열 번호: 1에 대해 적어도 98% 상동성인 핵산 서열의 단편의 코딩 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열의 단편으로 이루어진 그룹 중에서 선택된다);
b) RSV Ga 면역원을 인코딩하는 핵산 코딩 서열(여기서, RSV Ga 면역원을 인코딩하는 핵산 코딩서열은,
서열 번호: 5를 포함하고 서열 번호: 5에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열;
적어도 125개 이상의 아미노산들을 인코딩하는 서열 번호: 5의 단편을 포함하고 서열 번호: 5에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열;
서열 번호: 5에 대해 적어도 98% 상동성이고 서열 번호: 5에 대해 적어도 98% 상동성인 코딩 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열; 및
적어도 125개 이상의 아미노산들을 인코딩하는 서열 번호: 5에 대해 적어도 98% 상동성이고 서열 번호: 5에 대해 적어도 98% 상동성인 핵산 서열의 단편의 코딩 서열에 대해 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열로 이루어진 그룹 중에서 선택된다); 및
c) RSV Gb 면역원을 인코딩하는 핵산 코딩 서열(여기서, RSV Gb 면역원을 인코딩하는 핵산 코딩서열은,
서열 번호: 7을 포함하고 서열 번호: 7에 대해 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열;
적어도 125개 이상의 아미노산들을 인코딩하는 서열 번호: 7의 단편을 포함하고 서열 번호: 7에 대해 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열;
서열 번호: 7에 대해 적어도 98% 상동성이고 서열 번호: 7에 대해 적어도 98% 상동성인 코딩 서열에 대해 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열;
적어도 125개 이상의 아미노산들을 인코딩하는 서열 번호: 7에 대해 적어도 98% 상동성이고 서열 번호: 7에 대해 적어도 98% 상동성인 핵산 서열의 단편의 코딩 서열에 대해 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열의 단편으로 이루어진 그룹 중에서 선택된다). - 청구항 1에 있어서, 하기 a) 내지 c)로 이루어진 그룹 중에서 선택된 하나 이상의 핵산 서열들을 포함하는 조성물:
a) 서열 번호: 2를 포함하고 서열 번호: 2에 대해 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 RSV F 면역원을 인코딩하는 핵산 코딩 서열;
b) 서열 번호: 6를 포함하고 서열 번호: 6에 대해 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 RSV Ga 면역원을 인코딩하는 핵산 코딩 서열; 및
c) 서열 번호: 8을 포함하고 서열 번호: 8에 대해 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 RSV Gb 면역원을 인코딩하는 핵산 코딩 서열. - 청구항 3에 있어서, 하기 a) 내지 c)로 이루어진 그룹 중에서 선택된 하나 이상의 핵산 서열들을 포함하는 조성물:
a) 서열 번호: 1을 포함하고 서열 번호: 1에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는, RSV F 면역원을 인코딩하는 핵산 코딩 서열;
b) 서열 번호: 5를 포함하고 서열 번호: 5에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는, RSV Ga 면역원을 인코딩하는 핵산 코딩 서열; 및
c) 서열 번호: 7을 포함하고 서열 번호: 7에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는, RSV Gb 면역원을 인코딩하는 핵산 코딩 서열. - 청구항 3에 있어서, 하기 a) 내지 c)로 이루어진 그룹 중에서 선택된 하나 이상의 핵산 서열들을 포함하는 조성물:
a) 서열 번호: 10을 인코딩하는 핵산 서열;
b) 서열 번호: 14를 인코딩하는 핵산 서열; 및
c) 서열 번호: 16을 인코딩하는 핵산 서열. - 청구항 3에 있어서, 하기 a) 내지 c)로 이루어진 그룹 중에서 선택된 하나 이상의 핵산 서열들을 포함하는 조성물:
a) 서열 번호: 9를 포함하는 핵산 서열;
b) 서열 번호: 13을 포함하는 핵산 서열; 및
c) 서열 번호: 15를 포함하는 핵산 서열. - 청구항 1에 있어서, 하기 a) 내지 c)로 이루어진 그룹 중에서 선택된 하나 이상의 핵산 서열들을 포함하는 조성물:
a) 적어도 345개 이상의 아미노산들을 갖는 서열 번호: 2의 단편을 포함하고 서열 번호: 2에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 RSV F 면역원, 또는 적어도 345개 이상의 아미노산들을 갖는 서열 번호: 2에 대해 적어도 98% 상동성이고 서열 번호: 2에 대해 적어도 98% 상동성인 단백질을 인코딩하는 핵산 서열의 단편의 코딩 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 단백질의 단편을 인코딩하는 핵산 코딩 서열;
b) 적어도 200개 이상의 아미노산들을 갖는 서열 번호: 6의 단편을 포함하고 서열 번호: 6에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 RSV Ga 면역원, 또는 적어도 200개 이상의 아미노산들을 갖는 서열 번호: 6에 대해 적어도 98% 상동성이고 서열 번호: 6에 대해 적어도 98% 상동성인 단백질을 인코딩하는 핵산 서열의 단편의 코딩 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 단백질의 단편을 인코딩하는 핵산 코딩 서열; 및
c) 적어도 200개 이상의 아미노산들을 갖는 서열 번호: 8의 단편을 포함하고 서열 번호: 8에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 RSV Gb 면역원, 또는 적어도 200개 이상의 아미노산들을 갖는 서열 번호: 8에 대해 적어도 98% 상동성이고 서열 번호: 8에 대해 적어도 98% 상동성인 단백질을 인코딩하는 핵산 서열의 단편의 코딩 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 단백질의 단편을 인코딩하는 핵산 코딩 서열. - 청구항 7에 있어서, 하기 a) 내지 c)로 이루어진 그룹 중에서 선택된 하나 이상의 핵산 서열들을 포함하는 조성물:
a) 적어도 345개 이상의 아미노산들을 인코딩하는 서열 번호: 1의 단편을 포함하고 서열 번호: 1에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 RSV F 면역원, 또는 적어도 345개 이상의 아미노산들을 인코딩하는 서열 번호: 1에 대해 적어도 98% 상동성이고 서열 번호: 1에 대해 적어도 98% 상동성인 핵산 서열의 단편의 코딩 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열의 단편을 인코딩하는 핵산 코딩 서열;
b) 적어도 200개 이상의 아미노산들을 인코딩하는 서열 번호: 5의 단편을 포함하고 서열 번호: 5에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 RSV Ga 면역원, 또는 적어도 125개 이상의 아미노산들을 인코딩하는 서열 번호: 5에 대해 적어도 98% 상동성이고 서열 번호: 5에 대해 적어도 98% 상동성인 핵산 서열의 단편의 코딩 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열의 단편을 인코딩하는 핵산 코딩 서열; 및
c) 적어도 200개 이상의 아미노산들을 인코딩하는 서열 번호: 7의 단편을 포함하고 서열 번호: 7에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 RSV Gb 면역원, 또는 적어도 200개 이상의 아미노산들을 인코딩하는 서열 번호: 7에 대해 적어도 98% 상동성이고 서열 번호: 7에 대해 적어도 98% 상동성인 핵산 서열의 단편의 코딩 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열의 단편을 인코딩하는 핵산 코딩 서열. - 청구항 1에 있어서, 하기 a) 내지 c)로 이루어진 그룹 중에서 선택된 하나 이상의 핵산 서열들을 포함하는 조성물:
a) 적어도 550개 이상의 아미노산들을 갖는 서열 번호: 2의 단편을 포함하고 서열 번호: 2에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 RSV F 면역원, 또는 적어도 550개 이상의 아미노산들을 갖는 서열 번호: 2에 대해 적어도 98% 상동성이고 서열 번호: 2에 대해 적어도 98% 상동성인 단백질을 인코딩하는 핵산 서열의 단편의 코딩 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 단백질의 단편을 인코딩하는 핵산 코딩 서열;
b) 적어도 270개 이상의 아미노산들을 갖는 서열 번호: 6의 단편을 포함하고 서열 번호: 6에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 RSV Ga 면역원, 또는 적어도 270개 이상의 아미노산들을 갖는 서열 번호: 6에 대해 적어도 98% 상동성이고 서열 번호: 6에 대해 적어도 98% 상동성인 단백질을 인코딩하는 핵산 서열의 단편의 코딩 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 단백질의 단편을 인코딩하는 핵산 코딩 서열; 및
c) 적어도 270개 이상의 아미노산들을 갖는 서열 번호: 8의 단편을 포함하고 서열 번호: 8에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 RSV Gb 면역원, 또는 적어도 270개 이상의 아미노산들을 갖는 서열 번호: 8에 대해 적어도 98% 상동성이고 서열 번호: 8에 대해 적어도 98% 상동성인 단백질을 인코딩하는 핵산 서열의 단편의 코딩 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 단백질의 단편을 인코딩하는 핵산 코딩 서열. - 청구항 9에 있어서, 하기 a) 내지 c)로 이루어진 그룹 중에서 선택된 하나 이상의 핵산 서열들을 포함하는 조성물:
a) 적어도 550개 이상의 아미노산들을 인코딩하는 서열 번호: 1의 단편을 포함하고 서열 번호: 1에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 RSV F 면역원, 또는 적어도 550개 이상의 아미노산들을 인코딩하는 서열 번호: 1에 대해 적어도 98% 상동성이고 서열 번호: 1에 대해 적어도 98% 상동성인 핵산 서열의 단편의 코딩 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열의 단편을 인코딩하는 핵산 코딩 서열;
b) 적어도 270개 이상의 아미노산들을 인코딩하는 서열 번호: 5의 단편을 포함하고 서열 번호: 5에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 RSV Ga 면역원, 또는 적어도 270개 이상의 아미노산들을 인코딩하는 서열 번호: 5에 대해 적어도 98% 상동성이고 서열 번호: 5에 대해 적어도 98% 상동성인 핵산 서열의 단편의 코딩 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열의 단편을 인코딩하는 핵산 코딩 서열; 및
c) 적어도 270개 이상의 아미노산들을 인코딩하는 서열 번호: 7의 단편을 포함하고 서열 번호: 7에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 RSV Gb 면역원, 또는 적어도 270개 이상의 아미노산들을 인코딩하는 서열 번호: 7에 대해 적어도 98% 상동성이고 서열 번호: 7에 대해 적어도 98% 상동성인 핵산 서열의 단편의 코딩 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열의 단편을 인코딩하는 핵산 코딩 서열. - 청구항 1에 있어서, 하기 a) 내지 c)로 이루어진 그룹 중에서 선택된 하나 이상의 핵산 서열들을 포함하는 조성물:
a) 서열 번호: 2에 대해 적어도 99% 상동성인 RSV F 면역원을 인코딩하고 서열 번호: 2에 대해 적어도 99% 상동성인 코딩서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 코딩 서열;
b) 서열 번호: 6에 대해 적어도 99% 상동성인 RSV Ga 면역원을 인코딩하고 서열 번호: 6에 대해 적어도 99% 상동성인 코딩서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 코딩 서열; 및
c) 서열 번호: 8에 대해 적어도 99% 상동성인 RSV Gb 면역원을 인코딩하고 서열 번호: 8에 대해 적어도 98% 상동성인 코딩서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 코딩 서열. - 청구항 11에 있어서, 하기 a) 내지 c)로 이루어진 그룹 중에서 선택된 하나 이상의 핵산 서열을 포함하는 조성물:
a) 서열 번호: 1에 대해 적어도 99% 상동성이고 서열 번호: 1에 대해 적어도 99% 상동성인 코딩서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는, RSV F 면역원을 인코딩하는 핵산 코딩 서열;
b) 서열 번호: 5에 대해 적어도 99% 상동성이고 서열 번호: 5에 대해 적어도 98% 상동성인 코딩서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는, RSV Ga 면역원을 인코딩하는 핵산 코딩 서열; 및
c) 서열 번호: 7에 대해 적어도 99% 상동성이고 서열 번호: 7에 대해 적어도 98% 상동성인 코딩서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는, RSV Gb 면역원을 인코딩하는 핵산 코딩 서열. - 청구항 1에 있어서, 하기로 이루어진 그룹 중에서 선택된 핵산 서열들을 포함하는 조성물:
RSV F 면역원을 인코딩하는 핵산 코딩 서열,
RSV Ga 면역원을 인코딩하는 핵산 코딩 서열,
RSV Gb 면역원을 인코딩하는 핵산 코딩 서열,
RSV F 면역원을 인코딩하는 핵산 코딩 서열 및 RSV Ga 면역원을 인코딩하는 핵산 코딩 서열,
RSV F 면역원을 인코딩하는 핵산 코딩 서열 및 RSV Gb 면역원을 인코딩하는 핵산 코딩 서열,
RSV Ga 면역원을 인코딩하는 핵산 코딩 서열 및 RSV Gb 면역원을 인코딩하는 핵산 코딩 서열, 및
RSV F 면역원을 인코딩하는 핵산 코딩 서열, RSV Ga 면역원을 인코딩하는 핵산 코딩 서열 및 RSV Gb 면역원을 인코딩하는 핵산 코딩 서열. - 청구항 1 내지 청구항 13 중의 어느 한 항에 있어서, CCL20을 인코딩하는 핵산 코딩 서열을 추가로 포함하는 조성물.
- 청구항 1 내지 청구항 13 중의 어느 한 항에 있어서, 전기천공(electroporation)을 사용하여 개인에게 전달하기 위해 제형된 조성물.
- 청구항 1 내지 청구항 13 중의 어느 한 항에 있어서, IL-12, IL-15 및 IL-28로 이루어진 그룹 중에서 선택된 하나 이상의 단백질들을 인코딩하는 핵산 서열을 추가로 포함하는 조성물.
- 청구항 1 내지 청구항 13 중의 어느 한 항에 있어서, 상기 하나 이상의 핵산 코딩 서열들이 하나 이상의 플라스미드들 중의 일부인 조성물.
- 청구항 1 내지 청구항 13 중의 어느 한 항에 있어서, 각각의 하나 이상의 핵산 코딩 서열들이 별도의 플라스미드 내로 통합된 부분인 조성물.
- 청구항 1 내지 청구항 13 중의 어느 한 항에 따른 조성물을 개인에게 당해 개인에서 면역 반응을 유도하기에 효과적인 양으로 투여함을 포함하여, RSV에 대한 면역 반응을 유도하는 방법.
- 청구항 1 내지 청구항 13 중의 어느 한 항에 따른 조성물의 치료학적 유효량을 개인에게 투여함을 포함하여, RSV로 진단된 개인을 치료하는 방법.
- 청구항 1 내지 청구항 13 중의 어느 한 항에 따른 조성물의 예방학적 유효량을 개인에게 투여함을 포함하여, 개인에서 RSV 감염을 예방하는 방법.
- 서열 번호: 2; 서열 번호: 6; 서열 번호: 8; 서열 번호; 10; 서열 번호; 14; 및 서열 번호; 16으로 이루어진 그룹 중에서 선택된 단백질.
- RSV M2-1 면역원을 인코딩하는 핵산 코딩 서열을 포함하고, 상기 RSV M2-1 면역원을 인코딩하는 상기 핵산 코딩 서열은 하기로 이루어진 그룹 중에서 선택되는 조성물:
서열 번호: 4를 인코딩하고 서열 번호: 4를 인코딩하는 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열;
적어도 25개 이상의 아미노산들인 서열 번호: 4의 단편을 인코딩하고 서열 번호: 4의 단편을 인코딩하는 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열;
서열 번호: 4에 대해 적어도 98% 상동성인 단백질을 인코딩하고 서열 번호: 4에 대해 적어도 98% 상동성인 단백질을 인코딩하는 코딩 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열; 및
적어도 25개 이상의 아미노산인 서열 번호: 4에 대해 적어도 98% 상동성인 단백질의 단편을 인코딩하고 서열 번호: 4에 대해 적어도 98% 상동성인 단백질의 단편을 인코딩하는 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열. - 청구항 23에 있어서, RSV M2-1 면역원을 인코딩하는 핵산코딩 서열을 포함하고, 상기 RSV M2-1 면역원을 인코딩하는 상기 핵산코딩 서열은 하기로 이루어진 그룹 중에서 선택되는 조성물:
서열 번호: 3을 포함하고 서열 번호: 3에 대해 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열;
적어도 25개 이상의 아미노산들을 인코딩하는 서열 번호: 3을 포함하고 서열 번호: 3에 대해 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열;
서열 번호: 3에 대해 적어도 98% 상동성이고 서열 번호: 3에 대해 적어도 98% 상동성인 코딩 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열; 및
적어도 25개 이상의 아미노산을 인코딩하는 서열 번호: 3에 대해 적어도 98% 상동성이고 서열 번호: 3에 대해 적어도 98% 상동성인 핵산 서열의 단편의 코딩 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열의 단편. - 청구항 23에 있어서, 서열 번호: 4를 포함하고 서열 번호: 4에 대해 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 RSV M2-1 면역원을 인코딩하는 핵산 코딩 서열을 포함하는 조성물.
- 청구항 25에 있어서, 서열 번호: 3를 포함하고 서열 번호: 3에 대해 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는, RSV M2-1 면역원을 인코딩하는 핵산 코딩 서열을 포함하는 조성물.
- 청구항 25에 있어서, 서열 번호: 12를 인코딩하는 핵산 서열을 포함하는 조성물.
- 청구항 25에 있어서, 서열 번호: 11을 포함하는 핵산 서열을 포함하는 조성물.
- 청구항 23에 있어서, 적어도 130개 이상의 아미노산들을 갖는 서열 번호: 4의 단편을 포함하고 서열 번호: 4에 대해 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 RSV M2-1 면역원, 또는 적어도 130개 이상의 아미노산들을 갖는 서열 번호: 4에 대해 적어도 98% 상동성이고 서열 번호: 4에 대해 적어도 98% 상동성인 단백질을 인코딩하는 핵산 서열의 단편의 코딩 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 단백질의 단편을 인코딩하는 핵산 코딩 서열을 포함하는 조성물.
- 청구항 29에 있어서, 적어도 130개 이상의 아미노산들을 인코딩하는 서열 번호: 3의 단편 및 서열 번호: 3에 대해 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는, RSV M2-1 면역원, 또는 적어도 130개 이상의 아미노산들을 인코딩하는 서열 번호: 3에 대해 적어도 98% 상동성이고 서열 번호: 3에 대해 적어도 98% 상동성인 핵산 서열의 단편의 코딩 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열의 단편을 인코딩하는 핵산 코딩 서열을 포함하는 조성물.
- 청구항 23에 있어서, 적어도 165개 이상의 아미노산들을 갖는 서열 번호: 4의 단편을 포함하고 서열 번호: 4에 대해 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 RSV M2-1 면역원, 또는 적어도 165개 이상의 아미노산들을 갖는 서열 번호: 4에 대해 적어도 98% 상동성이고 서열 번호: 4에 대해 적어도 98% 상동성인 단백질을 인코딩하는 핵산 서열의 단편의 코딩 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 단백질의 단편을 인코딩하는 핵산 코딩 서열을 포함하는 조성물.
- 청구항 31에 있어서, 적어도 165개 이상의 아미노산들을 인코딩하는 서열 번호: 3의 단편을 포함하고 서열 번호: 3에 대해 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 RSV M2-1 면역원, 또는 적어도 165개 이상의 아미노산들을 인코딩하는 서열 번호: 3에 대해 적어도 98% 상동성이고 서열 번호: 3에 대해 적어도 98% 상동성인 핵산 서열의 단편의 코딩 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 서열의 단편을 인코딩하는 핵산 코딩 서열을 포함하는 조성물.
- 청구항 23에 있어서, 서열 번호: 4에 대해 적어도 99% 상동성인 RSV M2-1을 인코딩하고 서열 번호: 4에 대해 적어도 99% 상동성인 코딩 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 코딩 서열을 포함하는 조성물.
- 청구항 33에 있어서, 서열 번호: 3에 대해 적어도 99% 상동성인, RSV M2-1 면역원을 인코딩하고 서열 번호: 3에 대해 적어도 99% 상동성인 코딩 서열에 작동적으로 연결된 신호 펩타이드를 인코딩하는 코딩 서열을 임의로 추가로 포함하는 핵산 코딩 서열을 포함하는 조성물.
- 청구항 23에 있어서, 하기로 이루어진 그룹 중에서 선택된 핵산 서열을 포함하는 조성물:
RSV M2-1 면역원을 인코딩하는 핵산 코딩 서열,
RSV F 면역원을 인코딩하는 핵산 코딩 서열 및 RSV M2-1 면역원을 인코딩하는 핵산 코딩 서열,
RSV M2-1 면역원을 인코딩하는 핵산 코딩 서열 및 RSV Ga 면역원을 인코딩하는 핵산 코딩 서열,
RSV M2-1 면역원을 인코딩하는 핵산 코딩 서열 및 RSV Gb 면역원을 인코딩하는 핵산 코딩 서열,
RSV F 면역원을 인코딩하는 핵산 코딩 서열, RSV M2-1 면역원을 인코딩하는 핵산 코딩 서열 및 RSV Ga 면역원을 인코딩하는 핵산 코딩 서열,
RSV F 면역원을 인코딩하는 핵산 코딩 서열, RSV M2-1 면역원을 인코딩하는 핵산 코딩 서열 및 RSV Gb 면역원을 인코딩하는 핵산 코딩 서열,
RSV M2-1 면역원을 인코딩하는 핵산 코딩 서열, RSV Ga 면역원을 인코딩하는 핵산 코딩 서열 및 RSV Gb 면역원을 인코딩하는 핵산 코딩 서열, 및
RSV F 면역원을 인코딩하는 핵산 코딩 서열, RSV M2-1 면역원을 인코딩하는 핵산 코딩 서열, RSV Ga 면역원을 인코딩하는 핵산 코딩 서열 및 RSV Gb 면역원을 인코딩하는 핵산 코딩 서열. - 청구항 23 내지 청구항 35 중의 어느 한 항에 있어서, CCL20을 인코딩하는 핵산 코딩 서열을 추가로 포함하는 조성물.
- 청구항 23 내지 청구항 35 중의 어느 한 항에 있어서, 전기천공을 사용하여 개인에게 전달하기 위해 제형된 조성물.
- 청구항 23 내지 청구항 35 중의 어느 한 항에 있어서, IL-12, IL-15 및 IL-28로 이루어진 그룹 중에서 선택된 하나 이상의 단백질들을 인코딩하는 핵산 서열을 추가로 포함하는 조성물.
- 청구항 23 내지 청구항 35 중의 어느 한 항에 있어서, 상기 하나 이상의 핵산 코딩 서열들이 하나 이상의 플라스미드들 중의 일부인 조성물.
- 청구항 23 내지 청구항 35 중의 어느 한 항에 있어서, 각각의 하나 이상의 핵산 코딩 서열들이 별도의 플라스미드 내로 통합된 부분인 조성물.
- 청구항 23 내지 청구항 35 중의 어느 한 항에 따른 조성물을 개인에게 당해 개인에서 면역 반응을 유도하기에 효과적인 양으로 투여함을 포함하여, RSV에 대한 면역 반응을 유도하는 방법.
- 청구항 23 내지 청구항 35 중의 어느 한 항에 따른 조성물의 치료학적 유효량을 개인에게 투여함을 포함하여, RSV로 진단된 개인을 치료하는 방법.
- 청구항 23 내지 청구항 35 중의 어느 한 항에 따른 조성물의 예방학적 유효량을 개인에게 투여함을 포함하여, 개인에서 RSV 감염을 예방하는 방법.
- 서열 번호: 4 및 서열 번호: 12로 이루어진 그룹 중에서 선택된 단백질.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261622279P | 2012-04-10 | 2012-04-10 | |
| US61/622,279 | 2012-04-10 | ||
| PCT/US2013/036008 WO2013155205A1 (en) | 2012-04-10 | 2013-04-10 | Human respiratory syncytial virus concensus antigens, nucleic acid constructs and vaccines made thereform, and methods of using same |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140146651A true KR20140146651A (ko) | 2014-12-26 |
Family
ID=49328131
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020147031459A KR20140146651A (ko) | 2012-04-10 | 2013-04-10 | 인간 호흡기 합포체 바이러스 공통 항원, 핵산 컨스트럭트 및 이들로부터 제조된 백신, 및 이들을 사용하는 방법 |
Country Status (10)
| Country | Link |
|---|---|
| US (2) | US10040828B2 (ko) |
| EP (2) | EP3511337A1 (ko) |
| JP (3) | JP2015514132A (ko) |
| KR (1) | KR20140146651A (ko) |
| CN (1) | CN104619719A (ko) |
| AU (1) | AU2013245950B2 (ko) |
| CA (1) | CA2870182A1 (ko) |
| HK (1) | HK1210479A1 (ko) |
| MX (2) | MX363667B (ko) |
| WO (1) | WO2013155205A1 (ko) |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9630994B2 (en) | 2014-11-03 | 2017-04-25 | University Of Washington | Polypeptides for use in self-assembling protein nanostructures |
| CN106018780B (zh) * | 2016-05-17 | 2017-12-26 | 扬州大学 | 一种基于f1蛋白的检测4型禽腺病毒抗体的间接免疫荧光试剂盒 |
| EP3551193A4 (en) | 2016-12-08 | 2020-08-19 | Modernatx, Inc. | NUCLEIC ACID VACCINES AGAINST RESPIRATORY VIRUSES |
| WO2018170260A1 (en) | 2017-03-15 | 2018-09-20 | Modernatx, Inc. | Respiratory syncytial virus vaccine |
| WO2018170347A1 (en) | 2017-03-17 | 2018-09-20 | Modernatx, Inc. | Zoonotic disease rna vaccines |
| JP7168938B2 (ja) | 2017-04-04 | 2022-11-10 | ユニヴァーシティ オブ ワシントン | パラミクソウイルスおよび/またはニューモウイルスのfタンパク質を表示する自己アセンブリするタンパク質ナノ構造およびその使用 |
| WO2018232357A1 (en) | 2017-06-15 | 2018-12-20 | Modernatx, Inc. | Rna formulations |
| US11376317B2 (en) | 2017-08-30 | 2022-07-05 | University Of Maryland, College Park | FcRn-targeted mucosal vaccination against RSV |
| EP3675817A1 (en) | 2017-08-31 | 2020-07-08 | Modernatx, Inc. | Methods of making lipid nanoparticles |
| US11911453B2 (en) | 2018-01-29 | 2024-02-27 | Modernatx, Inc. | RSV RNA vaccines |
| US11771755B2 (en) | 2018-02-28 | 2023-10-03 | University Of Washington | Self-asssembling nanostructure vaccines |
| US11591371B2 (en) | 2018-04-02 | 2023-02-28 | University Of Maryland, College Park | FcRn-targeted mucosal vaccination against influenza infections |
Family Cites Families (77)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US21579A (en) | 1858-09-21 | Rotary valve fob steam-engines | ||
| US5077044A (en) | 1980-05-19 | 1991-12-31 | The Board Of Trustees Of The Leland Stanford Jr. University | Novel non-reverting shigella live vaccines |
| US4554101A (en) | 1981-01-09 | 1985-11-19 | New York Blood Center, Inc. | Identification and preparation of epitopes on antigens and allergens on the basis of hydrophilicity |
| US5338683A (en) | 1981-12-24 | 1994-08-16 | Health Research Incorporated | Vaccinia virus containing DNA sequences encoding herpesvirus glycoproteins |
| US4722848A (en) | 1982-12-08 | 1988-02-02 | Health Research, Incorporated | Method for immunizing animals with synthetically modified vaccinia virus |
| US5174993A (en) | 1981-12-24 | 1992-12-29 | Health Research Inc. | Recombinant avipox virus and immunological use thereof |
| US5110587A (en) | 1981-12-24 | 1992-05-05 | Health Research, Incorporated | Immunogenic composition comprising synthetically modified vaccinia virus |
| US4510245A (en) | 1982-11-18 | 1985-04-09 | Chiron Corporation | Adenovirus promoter system |
| US5643579A (en) | 1984-11-01 | 1997-07-01 | American Home Products Corporation | Oral vaccines |
| ZA858044B (en) | 1984-11-01 | 1987-05-27 | American Home Prod | Oral vaccines |
| US4945050A (en) | 1984-11-13 | 1990-07-31 | Cornell Research Foundation, Inc. | Method for transporting substances into living cells and tissues and apparatus therefor |
| US5036006A (en) | 1984-11-13 | 1991-07-30 | Cornell Research Foundation, Inc. | Method for transporting substances into living cells and tissues and apparatus therefor |
| US4797368A (en) | 1985-03-15 | 1989-01-10 | The United States Of America As Represented By The Department Of Health And Human Services | Adeno-associated virus as eukaryotic expression vector |
| GB8508845D0 (en) | 1985-04-04 | 1985-05-09 | Hoffmann La Roche | Vaccinia dna |
| US5223424A (en) | 1985-09-06 | 1993-06-29 | Prutech Research And Development | Attenuated herpesviruses and herpesviruses which include foreign DNA encoding an amino acid sequence |
| US4790987A (en) | 1985-11-15 | 1988-12-13 | Research Corporation | Viral glycoprotein subunit vaccine |
| US5310668A (en) | 1986-06-20 | 1994-05-10 | Merck & Co., Inc. | Varicella-zoster virus as a live recombinant vaccine |
| US5242829A (en) | 1986-09-23 | 1993-09-07 | Therion Biologics Corporation | Recombinant pseudorabies virus |
| IL86583A0 (en) | 1987-06-04 | 1988-11-15 | Molecular Eng Ass | Vaccine containing a derivative of a microbe and method for the production thereof |
| US5294441A (en) | 1987-06-04 | 1994-03-15 | Washington University | Avirulent microbes and uses therefor: salmonella typhi |
| US5387744A (en) | 1987-06-04 | 1995-02-07 | Washington University | Avirulent microbes and uses therefor: Salmonella typhi |
| US5112749A (en) | 1987-10-02 | 1992-05-12 | Praxis Biologics, Inc. | Vaccines for the malaria circumsporozoite protein |
| US5225336A (en) | 1989-03-08 | 1993-07-06 | Health Research Incorporated | Recombinant poxvirus host range selection system |
| WO1990010693A1 (en) | 1989-03-08 | 1990-09-20 | Health Research, Inc. | Recombinant poxvirus host selection system |
| US5703055A (en) | 1989-03-21 | 1997-12-30 | Wisconsin Alumni Research Foundation | Generation of antibodies through lipid mediated DNA delivery |
| US5591439A (en) | 1989-03-24 | 1997-01-07 | The Wistar Institute Of Anatomy And Biology | Recombinant cytomegalovirus vaccine |
| DE69027313T2 (de) | 1989-03-31 | 1997-01-23 | Univ Washington | Impfstoffe enthaltende avirulente phop-type mikroorganismen |
| EP0431668B1 (en) | 1989-12-04 | 1995-02-15 | Akzo Nobel N.V. | Recombinant herpesvirus of turkeys and live vector vaccines derived thereof |
| US5294548A (en) | 1990-04-02 | 1994-03-15 | American Biogenetic Sciences, Inc | Recombianant Hepatitis a virus |
| WO1991018088A1 (en) | 1990-05-23 | 1991-11-28 | The United States Of America, Represented By The Secretary, United States Department Of Commerce | Adeno-associated virus (aav)-based eucaryotic vectors |
| US5462734A (en) | 1990-11-02 | 1995-10-31 | Wisconsin Alumni Research Foundation | Bovine herpesvirus vaccine and method of using same |
| US5240703A (en) | 1991-03-01 | 1993-08-31 | Syntro Corporation | Attenuated, genetically-engineered pseudorabies virus s-prv-155 and uses thereof |
| US6034298A (en) | 1991-08-26 | 2000-03-07 | Prodigene, Inc. | Vaccines expressed in plants |
| US5955088A (en) | 1992-02-03 | 1999-09-21 | Cedars-Sinai Medical Center | Pharmaceutical compsition of herpes simplex virus type-1 (HSV-1), glycoproteins |
| CA2134773A1 (en) | 1992-06-04 | 1993-12-09 | Robert J. Debs | Methods and compositions for in vivo gene therapy |
| US5273525A (en) | 1992-08-13 | 1993-12-28 | Btx Inc. | Injection and electroporation apparatus for drug and gene delivery |
| DE69434469T2 (de) | 1993-01-26 | 2006-06-14 | Univ Pennsylvania | Zusammensetzungen und verfahren zur verabreichung von genetischem material |
| US5981505A (en) | 1993-01-26 | 1999-11-09 | The Trustees Of The University Of Pennsylvania | Compositions and methods for delivery of genetic material |
| US5593972A (en) | 1993-01-26 | 1997-01-14 | The Wistar Institute | Genetic immunization |
| US5864027A (en) | 1993-06-07 | 1999-01-26 | Genentech, Inc. | HIV envelope polypeptides |
| US5739118A (en) | 1994-04-01 | 1998-04-14 | Apollon, Inc. | Compositions and methods for delivery of genetic material |
| US6156319A (en) | 1994-07-25 | 2000-12-05 | The Trustees Of The University Of Pennsylvania | Soluble herpesvirus glycoprotein complex vaccine |
| NL9401820A (nl) | 1994-11-02 | 1996-06-03 | Meyn Maschf | Inrichting voor het bewerken van aan zijn poten opgehangen gevogelte. |
| US5962428A (en) | 1995-03-30 | 1999-10-05 | Apollon, Inc. | Compositions and methods for delivery of genetic material |
| US5650309A (en) | 1995-05-16 | 1997-07-22 | The Regents Of The University Of California | Viral vectors |
| US5698202A (en) | 1995-06-05 | 1997-12-16 | The Wistar Institute Of Anatomy & Biology | Replication-defective adenovirus human type 5 recombinant as a rabies vaccine carrier |
| US6261281B1 (en) | 1997-04-03 | 2001-07-17 | Electrofect As | Method for genetic immunization and introduction of molecules into skeletal muscle and immune cells |
| US6110161A (en) | 1997-04-03 | 2000-08-29 | Electrofect As | Method for introducing pharmaceutical drugs and nucleic acids into skeletal muscle |
| DE69826124T3 (de) | 1997-06-30 | 2007-10-11 | Institut Gustave Roussy | Verabreichung der nukleinsäure in den quergestreiften muskel |
| EP1100579B1 (en) | 1998-07-13 | 2015-09-02 | Inovio Pharmaceuticals, Inc. | Skin and muscle-targeted gene therapy by pulsed electrical field |
| US6270758B1 (en) | 1998-10-08 | 2001-08-07 | Duke University | Substantially non-toxic biologically active mucosal adjuvants in vertebrate subjects |
| US6589529B1 (en) | 1998-10-30 | 2003-07-08 | Children's Hospital Medical Center | Rotavirus subunit vaccine |
| JP2002212099A (ja) * | 2001-01-16 | 2002-07-31 | Inst Of Physical & Chemical Res | 腫瘍ワクチン |
| JP3543326B2 (ja) | 2001-08-30 | 2004-07-14 | ソニー株式会社 | 情報処理装置および方法、情報処理システム、情報配信装置、記録媒体、並びにプログラム |
| US7245963B2 (en) | 2002-03-07 | 2007-07-17 | Advisys, Inc. | Electrode assembly for constant-current electroporation and use |
| US8209006B2 (en) | 2002-03-07 | 2012-06-26 | Vgx Pharmaceuticals, Inc. | Constant current electroporation device and methods of use |
| US7328064B2 (en) | 2002-07-04 | 2008-02-05 | Inovio As | Electroporation device and injection apparatus |
| CA2494485A1 (en) | 2002-07-25 | 2004-02-05 | Medimmune, Inc. | Methods of treating and preventing rsv, hmpv, and piv using anti-rsv, anti-hmpv, and anti-piv antibodies |
| US20040175727A1 (en) | 2002-11-04 | 2004-09-09 | Advisys, Inc. | Synthetic muscle promoters with activities exceeding naturally occurring regulatory sequences in cardiac cells |
| WO2004108260A2 (en) | 2003-05-30 | 2004-12-16 | Advisys, Inc. | Devices and methods for biomaterial production |
| NZ570709A (en) * | 2003-06-13 | 2010-04-30 | Univ Pennsylvania | Nucleic acid sequences encoding and compositions comprising IgE signal peptide and/or IL-15 and methods for using the same |
| EP2099486A2 (en) * | 2006-11-30 | 2009-09-16 | Government Of The United States Of America, As Represented by the Secretary | Codon modified immunogenic compositions and methods of use |
| JP2010522540A (ja) | 2007-03-21 | 2010-07-08 | アイディー バイオメディカル コーポレイション オブ ケベック | キメラ抗原 |
| CL2007002710A1 (es) | 2007-09-20 | 2008-01-04 | Univ Pontificia Catolica Chile | Formulacion inmunogenica que confiere proteccion contra la infeccion o patologia causada por el virus respiratorio sincicial (vrs) que comprende una cepa recombinante atenuada de mycobacterium; y uso de la formulacion inmunogenica para preparar una vacuna para prevenir, tratar o atenuar infecciones del vrs. |
| US20090162395A1 (en) * | 2007-09-26 | 2009-06-25 | Crowe Jr James E | Vaccine for rsv and mpv |
| KR101255419B1 (ko) | 2007-11-12 | 2013-04-17 | 이노비오 파마수티컬즈, 인크. | 인플루엔자 바이러스의 다중 아형에 대한 신규 백신 |
| WO2010039224A2 (en) * | 2008-09-30 | 2010-04-08 | University Of Massachusetts Medical School | Respiratory syncytial virus (rsv) sequences for protein expression and vaccines |
| KR101609233B1 (ko) * | 2008-10-29 | 2016-04-05 | 더 트러스티스 오브 더 유니버시티 오브 펜실바니아 | 개량된 hcv 백신 및 이를 이용하는 방법 |
| CA2653478A1 (en) * | 2009-01-23 | 2010-07-23 | Gregg Martin | Automated wash system for industrial vehicles |
| PL3178490T3 (pl) | 2009-07-15 | 2022-08-01 | Glaxosmithkline Biologicals S.A. | Kompozycje białka f rsv i sposoby ich wytwarzania |
| US9095546B2 (en) * | 2009-07-20 | 2015-08-04 | National Health Research Institutes | Human respiratory syncytial virus (RSV) vaccine |
| US8298820B2 (en) * | 2010-01-26 | 2012-10-30 | The Trustees Of The University Of Pennsylvania | Influenza nucleic acid molecules and vaccines made therefrom |
| MX2013000164A (es) * | 2010-07-06 | 2013-03-05 | Novartis Ag | Liposomas con lipidos que tienen valor de pka ventajoso para suministro de arn. |
| WO2012021558A1 (en) | 2010-08-09 | 2012-02-16 | Richard Markham | Methods and compositions for preventing a condition |
| CN103239734B (zh) * | 2012-02-10 | 2016-02-24 | 北京艾棣维欣生物技术有限公司 | 用于预防和/或治疗呼吸道合胞病毒感染的疫苗 |
| GB2504774A (en) | 2012-08-10 | 2014-02-12 | Munster Simms Eng Ltd | Diaphragm pump with integral motor housing and rear pump housing |
| TWI548337B (zh) | 2015-10-16 | 2016-09-01 | 技嘉科技股份有限公司 | 散熱模組、顯示卡組件及電子裝置 |
-
2013
- 2013-04-10 AU AU2013245950A patent/AU2013245950B2/en not_active Ceased
- 2013-04-10 MX MX2014012234A patent/MX363667B/es unknown
- 2013-04-10 EP EP19153155.7A patent/EP3511337A1/en not_active Withdrawn
- 2013-04-10 EP EP13775839.7A patent/EP2836505B1/en active Active
- 2013-04-10 KR KR1020147031459A patent/KR20140146651A/ko not_active Application Discontinuation
- 2013-04-10 CN CN201380029394.7A patent/CN104619719A/zh active Pending
- 2013-04-10 US US14/391,921 patent/US10040828B2/en active Active
- 2013-04-10 WO PCT/US2013/036008 patent/WO2013155205A1/en active Application Filing
- 2013-04-10 JP JP2015505881A patent/JP2015514132A/ja active Pending
- 2013-04-10 CA CA2870182A patent/CA2870182A1/en not_active Abandoned
-
2014
- 2014-10-09 MX MX2019003682A patent/MX2019003682A/es unknown
-
2015
- 2015-11-12 HK HK15111189.1A patent/HK1210479A1/xx unknown
-
2017
- 2017-11-20 JP JP2017222722A patent/JP2018065824A/ja active Pending
-
2018
- 2018-08-06 US US16/055,425 patent/US11021520B2/en active Active
-
2019
- 2019-02-14 JP JP2019024615A patent/JP2019112414A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| US20180346522A1 (en) | 2018-12-06 |
| MX2014012234A (es) | 2014-12-05 |
| JP2015514132A (ja) | 2015-05-18 |
| EP3511337A1 (en) | 2019-07-17 |
| AU2013245950A1 (en) | 2014-10-30 |
| JP2018065824A (ja) | 2018-04-26 |
| WO2013155205A9 (en) | 2013-12-05 |
| HK1210479A1 (en) | 2016-04-22 |
| AU2013245950B2 (en) | 2016-04-21 |
| WO2013155205A1 (en) | 2013-10-17 |
| US11021520B2 (en) | 2021-06-01 |
| CN104619719A (zh) | 2015-05-13 |
| JP2019112414A (ja) | 2019-07-11 |
| MX363667B (es) | 2019-03-29 |
| US10040828B2 (en) | 2018-08-07 |
| US20150079121A1 (en) | 2015-03-19 |
| MX2019003682A (es) | 2019-07-18 |
| CA2870182A1 (en) | 2013-10-17 |
| EP2836505B1 (en) | 2019-01-23 |
| EP2836505A4 (en) | 2015-12-02 |
| EP2836505A1 (en) | 2015-02-18 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11021520B2 (en) | Human respiratory syncytial virus consensus antigens, nucleic acid constructs and vaccines made therefrom, and methods of using the same | |
| JP6549194B2 (ja) | インフルエンザウイルスの複数のサブタイプに対する新規ワクチン | |
| JP7129106B2 (ja) | 改善されたil-12遺伝子構築物を含む組成物、及びそれを用いたワクチン、免疫治療剤及び方法 | |
| AU2011209626B2 (en) | Influenza nucleic acid molecules and vaccines made therefrom | |
| KR102146904B1 (ko) | 필로바이러스 공통 항원, 이로부터 제조된 핵산 구조체 및 백신, 및 이를 사용하는 방법 | |
| JP2016517414A (ja) | インフルエンザ核酸分子及びそれから作製したワクチン | |
| US20230285549A1 (en) | Cd4+helper epitopes and uses to enhance antigen-specific immune responses | |
| AU2013201928B2 (en) | Influenza nucleic acid molecules and vaccines made therefrom | |
| AU2015202267A1 (en) | Influenza nucleic acid molecules and vaccines made therefrom |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |