本願が優先権を主張する、米国仮特許出願第62/424,693号の出願ファイルは、カラーで描かれた上記の図面のうちの少なくとも1つを含む。カラー図面のコピーは、要求および必要な料金の支払いの後に、米国特許商標庁により提供されるであろう。
詳細な説明
本明細書中記載の一部の実施形態は、動物(たとえば、ヒトまたは非ヒトの哺乳類を含む、ヒトまたは非ヒトの動物)に埋め込まれるまたは挿入される際に、動物の病変の診断および/または治療に役立ち得る侵襲的プローブを含む医療機器に関する。この病変は、正常な構造からの逸脱などの動物の生体構造の異常、および/または損傷、病状、もしくは疾患に関連する異常などの動物の一部の機能の異常であり得る。病変は、動物の異なる部分に現れてもよく、たとえば、動物の管の中に含まれていてもよい。管の病変は、たとえば、管を完全にまたは部分的に阻害する閉塞として作用し得る。管は、たとえば、動物の血管または他の管であり得るが、病変は、管における腫瘍、管における物質の蓄積、および/または他の病変の原因により、全体的または部分的に形成されていてもよい。侵襲的プローブは、病変の組成を検出することを含み得る、病変の特徴を検知するための1つ以上のセンサを含み得る。
一部の実施形態では、病変の組成を検出することは、病変に存在する1つ以上の細胞および/もしくは1つ以上の組織、ならびに/または病変に存在する1つ以上のプラーク状の物質を含む、病変の1つ以上の生体物質を同定することを含み得る。同定される病変の生体物質は、病変に存在する全ての生体物質であってもよく、または病変に存在する生体物質の一部のみであってもよい。生体物質の一部のみが同定されている場合、同定した物質は、単に、病変の組織/細胞などの特定の種類の物質のみ(プラーク状の物質などの他の物質と比較して)であってもよく、または特定の種類の組織/細胞(たとえば、病変に存在する赤血球、他の種類の細胞ではない)であってもよい。組成が決定されている場合および生体物質の1種またはいくつかの種類のみが同定されている場合、この組成を決定することは、病変において同定した物質の量を決定すること、たとえば、病変の全ての物質に対する1つ以上の同定した物質の比を計算することによることを含む、病変の全ての物質と比較して同定した物質の量を決定することを含み得る。
一部のこのような実施形態では、侵襲的プローブは、病変を同定および/または分類し得る。病変を同定または分類することは、一部の実施形態では、病変を診断することを含み得る。医療機器は、病変を解析し、解析に基づき臨床医に治療勧告を提供するように構成され得る。このような治療勧告は、病変を治療する方法、たとえば、どの治療または治療の組み合わせを病変を治療するために使用するかといった方法(たとえば、病変を除去すべき場合に、吸引カテーテルまたはステント型血栓回収器を使用するかどうか)、および/または治療装置を使用する方法(ステント型血栓回収器をどれくらい速く引き抜くか)を含み得る。一部のこのような実施形態では、侵襲的プローブは、病変の組成(たとえば、病変の1つ以上の生体物質の正体)、ならびに/または全体としての病変の1つ以上の他の特徴に少なくとも部分的に基づき、このような同定もしくは分類を行い、かつ/または当該治療勧告を作成し得る。たとえば、侵襲的プローブおよび/または以下に記載の他の関連する装置を含むシステムは、病変の生体物質を同定し得、同定した物質に基づき、病変の種類を同定するか、またはそうでなければ病変を分類し得る。病変の同定に基づき、システムは、特定の種類の病変の治療に関する勧告を作成し得る。別の例として、他の実施形態では、システムは、病変の生体物質を同定し得、同定した物質に基づき(単独、または病変の他の物質と比較して)、病変の治療に関する勧告を作成し得る。別の例として、他の実施形態では、システムは、病変の生体物質を特徴づける情報(たとえば、インピーダンススペクトル)に基づき、病変の治療に関する勧告を作成し得る。
さらにまたはあるいは、実施形態は、機械学習技術を使用して生体構造を同定および特徴づけるための技術に関する。これらの技術は、生体構造、たとえば、構造の中でも特に、動物(たとえば、ヒトまたは非ヒトの動物)における管(たとえば、血管系)の組織または病変であり得る生体構造において、特定の種類の組織および/または細胞(たとえば、血小板、平滑筋細胞、または内皮細胞)を機械が同定できるように使用され得る。機械学習技術は、生のインピーダンス分光法の測定データを、この生データから派生した値に加えて、使用し得る。さらに、機械学習技術は、インピーダンスを測定する周波数を選択して、確実な区別を可能にする周波数の小さなセットに到達するために、使用され得る。
一部の実施形態では、侵襲的プローブは、1つ以上のセンサを含んでもよく、これは、病変のインピーダンスを測定するためのセンサを含み得る。センサは、特定の周波数を有する電気信号を病変に適用する際に、病変のインピーダンスを測定し得る。医療機器は、このインピーダンスの値に基づき、病変の組成および/または病変の1つ以上の特徴を決定するように構成され得る。たとえば、各センサは、一部の実施形態では、侵襲的プローブの異なるセンサが病変の異なる生体物質に関する異なるインピーダンススペクトルを同時に生成し得るように、センサと接触する生体物質のインピーダンススペクトルを検出するように作動し得る。よって、医療機器は、決定した組成に部分的に基づき、治療勧告を作成し得る。上述のように、組成を決定することは、病変の中の1つ以上の生体物質の量を同定することを含んでもよく、この量は、病変の全ての物質よりも少なくてよい。たとえば、一部の実施形態では、赤血球で構成されている病変の量が決定される。
本明細書中記載の様々な例は、血管系の病変に関連した医療機器および血管系の病変を治療する方法を論述する。しかしながら、実施形態はこれに限定されないことを理解すべきである。病変の特徴を検知するためおよび治療勧告を作成するための本明細書中記載の技術は、動物の身体構造上の管のいずれかの適切な病変または動物の身体構造の中の他の位置に生じ得る病変を含む、任意の適切な病変で使用され得る。病変が管の病変である場合、このような管は、たとえば、血管系の管および消化系の管を含み得る。当業者は、身体構造上の管が、解剖学的な空洞と異なることを理解するものである。たとえば、管は、1つの次元(たとえば、幅)において別の次元(たとえば、長さ)よりも有意に小さくてもよい。
よって、一部の実施形態では、侵襲的プローブは、血管系の病変の診断および/または治療のための医療機器の構成要素であり得る。たとえば、医療機器は、血栓除去装置であってもよく、侵襲的プローブは、血栓除去装置の構成要素であり得る。したがって、侵襲的プローブは、ガイドワイヤ、吸引カテーテル、マイクロカテーテル、ステント型血栓回収器(stent-retriever)、および/または別の血栓除去装置の構成要素であり得る。一部の実施形態では、医療機器は、ガイドワイヤ、吸引カテーテル、およびステント型血栓回収器のうちの2つ以上を含んでもよく、侵襲的装置が、これらのうちの1つ以上(これらの全てを含む)の構成要素であってもよい。
本発明者らは、病変の電気的測定に基づく、管の病変の種類を同定することを含む、病変の同定に関する従来の一般的な技術が、医療機関で有効に使用されるには十分な正確性または信頼性を有していないことを認識および理解していた。一部のこのような従来技術は、様々な種類の病変のそれぞれに関する、病変全体に関する多数のインピーダンススペクトルの作成、ならびに病変の各種類に関する「平均」インピーダンススペクトルを作成することを含む。しかしながら、病変は、人によって、または同じ人物の中であっても大きく異なり、全体としての病変に関する正確なまたは代表的な「平均」または「標準」のインピーダンススペクトルを作成することを実現することを困難にしている。他のこのような従来の技術は、厳格な測定プロセスを強いることにより、「標準」スペクトルの決定の間の各測定に関する病変と接触するセンサの精確な配置およびその後の患者での使用の間の同じ測定位置を要求することにより、信頼性を改善しようとしている。このような精確な配置は、実務で反復および再現することがほぼ不可能であり、未だ、患者での使用で有用であるよう十分な度合の正確性でこれらの技術を使用できるポイントまで信頼性を改善させていない。たとえば、患者での使用の間、患者の病変のインピーダンススペクトルの測定を行う必要があり、測定を、病変の各種類に関する複数の「標準」スペクトルに対して比較する必要があり、コンピュータを駆使した統計解析を、病変の種類を同定するための行う必要がある。しかしながら、典型的な従来の技術では、これらの複合手的な解析でも、最良でわずか50%超の確実性の度合を伴う結果となる。
本明細書中記載の一部の実施形態は、病変の種類を同定する方法を目的とし、この方法は、全体としての病変に関する「標準」インピーダンススペクトルのデータベースの使用、またはこのような全体の病変のインピーダンススペクトルを比較するための統計解析を含まない。これらの実施形態の一部は、病変に存在する生体物質の一部または全ての種類および数などの病変の組成を同定することにより、病変を特徴づけるように構成されている。このことは、病変の1つ以上の組織および/もしくは細胞、ならびに/または病変に存在する1つ以上のプラーク状の物質を同定することを含む。よって、一部のこのような実施形態では、病変の組成は、高い度合の確実性で病変の特徴を同定するように解析され得る。このような病変の特徴は、病変の種類を含んでもよく、実施形態は病変を診断することを含み得る。一部の実施形態では、病変の組成は、特定の種類の病変が特定の組成(たとえば、生体物質の特定のセット、または生体物質の特定の相対量)に関連していることを同定する条件などの、病変の種類に関連する1つ以上の条件と比較され得る。特定の組成が、ある病変の種類に関連する条件を満たすことにより当該病変の種類に一致していると決定されると、この組成を有する病変は、当該種類の病変であると同定され得る。病変の生体物質の同定に基づく病変の同定は、高い信頼性(たとえば、90%超)を有し得る。
さらに本発明者らは、従来の血栓除去装置を含む従来の医療機器が、血管を含む血管系の病変の特徴に関する情報を提供しないこと、および従来の医療機器が、病変の治療の状態に関する情報を提供しないことを認識および理解している。さらに本発明者らは、この情報の欠損が、病変の治療が困難である原因であることを認識および理解している。たとえば、病変の組成に関する情報を用いない場合、臨床医は、利用可能な治療の選択肢の中から選択することが困難である場合があり、これは、各治療の選択肢が、異なる組成の病変で最良に働く場合があるからである。さらに、病変の治療の状態に関する情報を用いない場合、臨床医は、治療が成功して行われたかまたは行われていないかどうかに気づかない場合がある。この情報の欠損のため、複数の治療が、病変を正確に治療するために必要であり得る。このような治療は、それぞれ、患者への損傷のリスクを上げ、より重大なことには、一部の病変では、病変の持続期間を増大させる。血管が、病変により部分的または完全に阻害されている場合、血流の減少が、動物の組織への損傷を引き起こし得る。
したがって、本明細書中記載の実施形態では、医療機器は、病変の特徴を決定し得、治療の性能をモニタリングし得、かつ、治療の前および/または間で病変を治療する方法に関する勧告を作成し得る。このさらなる情報は、病変を1つのみの治療で除去することおよびその後の治療が同じ病変に必要ではないことを確実にしようとするため、または少なくともその機会を増やそうとするために、病変を治療する方法を仮決定する際および治療を行う際に、臨床医を支援し得る。医療機器は、たとえば、医療機器と病変との間の相互作用に関するリアルタイムの情報を臨床医に提供することにより、医療行為の間にリアルタイムで臨床医に情報を提供し得る。リアルタイムは、一部の実施形態では、医療機器により検知される対応するデータの情報をある時間以内に臨床医に提供することを含み、ここでの時間は、5秒未満、10秒未満、30秒未満、1分未満、または5分未満であってもよく、これは、勧告を作成するためにデータで行われる解析の必要要件に依存し得る。
一部の実施形態では、技術および装置の信頼性および有効性は、初期化および設定を介して改善することができ、これは、生体構造の物質もしくは構造自体を特徴づける際、および/または治療勧告を作成する際に使用される生体構造に関して回収、作成、および/または使用されるデータポイントの選択に対する特定の手法を使用してシステムを設定することによる改善を含む。このような回収されるデータポイントの決定は、生体物質のインピーダンススペクトルを測定する周波数の決定を含み得る。さらにまたはあるいは、この決定は、周波数に関するインピーダンス値(たとえば、周波数の範囲、または選択した周波数のいずれかのセット)を回収した後に、これらのインピーダンス値の特性の何を、その後の解析に使用すべきかを決定することを含み、これは、その後の解析で使用するために、インピーダンス値のセットの中の明確なデータ値のどれを使用すべきか、または、何の値がデータ値の解析から派生されるべきかを同定することを含む。一部の実施形態は、機械学習解析を使用して、このような周波数および/または特性を同定することを含み得る。
実施形態が作動し得る特性は、データまたはデータのセットのディスクリプタまたはアトリビュートを含み、これは、インピーダンス測定のセットのディスクリプタまたはアトリビュートを含む。測定または測定のセットのディスクリプタまたはアトリビュートは、データセットのデータポイントまたはデータのセットを特徴づけてもよい。特性は、数値などの値を有し得る。特性を使用して異なる測定または測定のデータセットを特徴づける場合、特性は、異なる測定/セットで同じディスクリプタまたはアトリビュートであってもよく、よって、同じまたは類似の方法で測定/セットを特徴づけてもよいが、これらの異なる測定/セットのデータポイントに対応する異なる値を有してもよい。
本明細書中記載の種類の特性は、インピーダンス測定またはインピーダンス測定のセット(たとえば、電気的インピーダンス分光法の測定)に存在する特性、および/またはインピーダンス測定またはセットから生じる特性を含み得る。インピーダンス測定に存在するまたはインピーダンス測定由来の特性は、測定または測定のデータセットの中に明らかに設定されている数値を含み得る。このような特性の例として、インピーダンス測定の大きさもしくは位相、またはインピーダンス測定のセットの中の、セットの最小値もしくは最大値の数値(ここで最小値/最大値は、絶対値および/もしくは相対値であり得る)が挙げられる。最小値または最大値のデータ値は、値の比較などのいくつかの解析を必要とし得るが、最小値/最大値の値自体は、データセットの中で見いだされた値である。派生した特性は、測定またはセットを説明し得るが、測定/セットで見いだされていない値を含み得る。代わりに、派生した特性の値は、測定/セットから生じてもよく、たとえば、測定/セットで1つ以上のコンピュータ処理を行うことを介して得られてもよい。派生した特性の例として、中でも、EIS測定の平均値、EIS測定の位相最大周波数(phase maximum frequency)、EIS測定のn分位数、EIS測定の1次導関数、およびEIS測定の2次導関数が挙げられる。
一部の実施形態では、初期化および設定は、特定の種類の組織または特定の種類の病変などの目的の生体構造、および他の生体構造に関連するインピーダンス測定および/または特性の間を区別するためにフィルタをトレーニングすることを含み得る。一部のシナリオでは、インピーダンス測定を、特定の種類の病変、組織、または他の生体構造に関して回収する場合、回収されたインピーダンス測定のうちの1つ以上が、別の生体構造に対応していてもよい。たとえば、血餅または他の血管の病変に関するインピーダンス測定を回収するために使用されるプローブは、場合により、血餅のみと接触しない場合があるだけでなく、血管壁などの血餅に近位の他の組織と接触する場合がある。これらの、他の組織または生体構造に関するインピーダンス測定は、適切な血餅の解析を妨害する可能性がある。本発明者らは、目的の生体構造に関するインピーダンス測定と、他の生体構造を反映しているかまたはデータ回収の誤差を反映しているインピーダンス測定との間を区別するために、1つ以上の機械学習技術を使用してモデルをトレーニングする利点を認識および理解している。システムが、動物の身体の一部における病変(または他の目的の生体構造)の特徴を認識するためにトレーニングされている場合、身体の当該一部で見いだされ得るか、または病変の近位にあったであろう1つ以上の他の生体構造を、同定し得る。インピーダンス測定は、これらの他の生体構造に関して回収され得る。回収された後、このインピーダンス測定を、病変(または他の目的の生体構造)に関する他のインピーダンス測定と並行して使用して、病変(または他の目的の生体構造)または他の構造に関するインピーダンス測定間を区別するようにモデルをトレーニングし得る。トレーニングした後に、このモデルは、入力したインピーダンス測定をフィルタリングし、病変に関するインピーダンス測定の解析を妨害する別の生体構造に関するインピーダンス測定の可能性を防止または軽減するために、使用され得る。
全ての病変が管の中に形成されていないこと、および一部の実施形態は管以外の身体の領域にある病変で作動し得ることを理解すべきである。たとえば、一部の癌性細胞は、動物(たとえば、ヒト)の身体の他の部分に形成されていてもよい。本明細書中記載の一部の実施形態は、通常は管の中に見いだされない、癌性細胞などの病変の診断および/または治療に関する。しかしながら、一部の癌性細胞は管の中に見出すことができ、本明細書中記載の他の実施形態は、当該癌性細胞の診断および/または治療に関連することを理解すべきである。
また、以下に記載の一部の例は病変に関連しているが、実施形態は、病変で作動することに限定されず、いずれかの適切な生体物質の組成を有するいずれかの目的の生体構造で作動し得ることも理解すべきである。
技術の全般的な論述
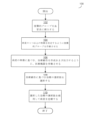
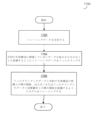
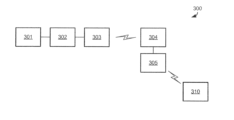
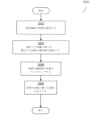
図1は、本明細書中記載の一部の実施形態により作動する医療機器の例示的な構成要素の論述に関する状況を提供するために、当該医療機器を作動するために臨床医がたどり得るプロセスのフローチャートである。図2~図3は、医療機器の例を例示しており、以下の他の図面は、機器の他の構成要素および当該機器が作動し得る方法を詳述している。
プロセス100は、動物である対象の病変を診断および/または治療するために使用され得る。動物は、たとえば、ヒトまたは非ヒトの哺乳類を含む、ヒトまたは非ヒトの動物であり得る。病変は、管の中、たとえば、動物の静脈または動脈のような血管の中の病変であり得る。管の病変は、この管を完全にまたは部分的に阻害している可能性がある。本明細書中記載の実施形態は、
血管系における、病変の部位で形成されるか、もしくは身体の他の場所で形成され、病変の部位で固着する血餅(赤血球、白血球、フィブリン、血栓、塞栓、および/もしくは血小板を含む);
管壁から管の中心へ向かう腫瘍、たとえば、病変の部位での内皮細胞に対する損傷後の瘢痕組織の腫瘍もしくは他の腫瘍;
当該部位の管に関して解剖学的に「正常」もしくは「健常」ではない、管壁から管の中心へと別の形で延びる組織(たとえば、平滑筋細胞、弾性線維、外弾性板、内弾性板、疎性結合組織、および/もしくは内皮細胞);
動物の管を介して流れる体液の中で見出され得るコレステロール、カルシウム、脂肪性の物質、細胞の老廃物、フィブリン、および/もしくは他の物質(たとえば、血管系病変の場合では、動物の血管内で見いだされる物質)の蓄積を含む、病変の部位にあるプラーク状の物質の蓄積;
転移および/もしくはリンパ腫などの管で見いだされる癌性細胞;ならびに/または
動物の管の病変を引き起こし得る他のいずれかの組織および/もしくは生体物質
などの、異なる特徴の病変で作動し得る。
異なる特徴の病変は、管の外側で形成され得る。これらの病変として、癌性細胞、たとえば、細胞腫、骨髄腫、白血病、リンパ腫、メラノーマ、新生物、混合型および/または肉腫が挙げられる。
一部の実施形態では、病変の組織像(たとえば、上述の生体物質のうちどれを病変が有しているか)を、病変に関する複数のインピーダンススペクトル、病変の組成(この組成は、病変に存在する生体物質を表し得る)に基づき同定して決定し得る。このような生体組織の同定は、病変に存在する組織および/もしくは細胞、ならびに/または病変に存在するプラーク状の物質、ならびに/または病変における当該組織、細胞、もしくはプラーク状の物質の相対量を同定することを含み得る。一部の実施形態では、病変に存在する生体物質を同定することは、組織/細胞が健常か健常ではないかに関わらず、たとえば、組織/細胞に関して各生体物質の状態を同定することを含み得る。細胞の健常ではない状態は、たとえば、細胞が炎症状態にあるか、疾患状態にあるか、癌性であるか、または他の異常な状態にあるかどうかを含み得る。
実施形態が、対象の身体構造の中のいずれかの特定の形もしくは組成の病変、またはいずれかの特定の位置の病変で作動することに限定されないことを、理解すべきである。上述のように、説明を簡単にするため、管が動物の血管系である様々な例を、以下に提供する。
図1のプロセス100を開始する前に、対象は、血管系の病変の症状を呈していてもよい。たとえば、血管造影のようなイメージング技術を使用した、病変および病変の潜在的な位置が存在するかどうかの仮決定を、臨床医が行ってもよい。症状および病変の位置の仮決定に基づき、臨床医は、この病変をさらに診断および/または治療するために、対象の血管系に侵襲的装置を挿入することを選択し得る。臨床医は、たとえば、医師(たとえば、内科医もしくは外科医)であってもよく、または(恐らくは医師の監視の下で)医療機器を作動する看護師もしくは医療技術者などの他の医療の専門家であってもよい。一部の実施形態では、臨床医は、対象と同じ部屋に位置していてもよく、これは対象の隣であることを含み、また他の実施形態では、臨床医は、対象とは離れた位置(たとえば、患者と同じビルディングの異なる部屋、または患者とは地理的に離れた位置)にいて、インターネットまたは他の広域ネットワーク(WAN)を含む1つ以上の有線および/または無線のネットワークを介して医療機器を制御するユーザインターフェースを作動していてもよい。
プロセス100は、ブロック102で開始し、ここで臨床医は、侵襲的プローブを対象の血管系に挿入する。ブロック102で臨床医により挿入された侵襲的プローブは、医療機器用のガイドワイヤの遠位端に位置していてもよく、血管系に挿入するための形状、大きさ、または構成であり得る。さらに、ブロック102において、臨床医は、侵襲的プローブが病変の近位に配置されるまで、対象の血管系を介して侵襲的プローブを搬送し得る。これを行うために、臨床医は、イメージング技術、たとえば血管造影技術を使用して、対象の中の侵襲的プローブの位置をモニタリングし得る。ブロック102における侵襲的プローブの挿入および搬送は、既知の技術を使用することを含む、血管系への装置の挿入のための適切な技術を使用して行ってもよく、実施形態はこの方法に限定されない。
ブロック104では、臨床医は、病変の1つ以上の特徴を決定するように侵襲的プローブを作動させる。特徴は、病変のような生体構造の表現型および/または遺伝子型を含んでもよく、これは、生体構造間を区別するか、または生体構造の表現型の間を区別する性質を含む。特徴は、病変(または他の生体構造)の治療に影響を与える性質であってもよく、この性質を有する病変は、この性質を有さない病変から処置されてもよく、この性質に関して異なる値を有する病変は、異なって処置されてもよい。このような性質は、病変の身体構造に関連して組織学的なものであってもよく、および/またはどのように病変が動物の身体に位置しているか、または動物の身体と相互作用するかに関連した身体構造的なものであり得る。よって、特徴は、病変を説明し得る。例示的な特徴として、病変の位置、病変の大きさ(たとえば、長さ)、病変の組成、または以下に詳細に論述した他の特徴が挙げられる。特徴を決定するために、侵襲的プローブの1つ以上のセンサが、病変の組織および/もしくは他の生体物質、ならびに/または病変の近くに位置する健常な組織などの病変の部位の別の組織/物質の1つ以上の測定を行ってもよい。
一部の実施形態では、病変の1つ以上の特徴を決定することは、たとえば、病変に存在する異なる種類の細胞または組織の量を同定することにより、病変の組成を同定することを含み得る。一例として、調査した病変が、50%の赤血球、30%のフィブリン、および20%の血小板から構成されていることが同定され得る。
センサおよび測定の例を、以下に詳細に説明する。ブロック104で侵襲的プローブを作動させるために、臨床医は、侵襲的プローブの1つ以上のセンサと病変を接触させ、および/または医療機器のユーザインターフェースを作動して、病変の特徴を検出するようにセンサを使用するために、侵襲的プローブを始動し得る。
ブロック106では、臨床医は、決定した病変の特徴に基づき、病変に関する治療勧告を作成および出力するように、医療機器を作動させる。以下に詳細に論述するように、病変の特徴に基づき医療機器により作成された治療勧告は、病変を治療する方法、たとえば、どの治療装置を、病変を治療するために使用するかといった方法(たとえば、病変の物質を対象から除去すべき場合に、吸引カテーテルまたはステント型血栓回収器を使用するかどうか)、および/または治療装置を使用する方法(ステント型血栓回収器をどれくらい速く引き抜くか)に関する勧告を含み得る。同様に以下に詳述されるように、医療機器は、たとえば、複数の異なる治療の選択肢のそれぞれに関連する条件と病変の特徴を比較し、病変の特徴が治療の選択肢に関して対応する条件を満たす場合に、治療の選択肢の勧告を出力することによるなどの様々な解析に基づき、治療勧告を作成し得る。医療機器による出力は、いずれかの適切な形態のユーザのインタラクションを介してもよく、これは、ユーザインターフェースを介した臨床医への視覚的、聴覚的、および/または触覚的なフィードバックを含む。一部の実施形態では、医療機器は、ブロック106において自動的に、ユーザのさらなる介入を伴うことなく、ブロック104で決定した病変の特徴を解析し、治療勧告を作成/出力し得る。他の実施形態では、臨床医は、解析および/または治療勧告の作成/出力をリクエストするために、医療機器のユーザインターフェースを作動し得る。
ブロック108では、臨床医は、医療機器の治療勧告を考察し、治療の選択肢を選択し、ブロック110において、選択した治療の選択肢を使用して病変を治療する。
一部の実施形態では、選択した治療の選択肢は、対象の血管系への追加的な侵襲的な医療上の構成要素の挿入を含み得る。ブロック102で挿入された侵襲的プローブがガイドワイヤの構成要素であった場合、たとえば、追加的な治療装置は、このガイドワイヤに沿って挿入され得る。このような場合の特定の例として、医療機器が、ステント型血栓回収器を使用した病変の完全なまたは部分的な除去を勧告する場合、ステント型血栓回収器が、血管系に挿入され得る。別の例として、医療機器が、代わりに吸引カテーテルでの除去を勧告する場合、臨床医は、吸引カテーテルを血管系に挿入し得る。さらなる例として、医療機器が、ステントの埋め込みを勧告する場合、ステント埋め込み装置(implanter)が、血管系に挿入され得る。
他の実施形態では、治療は、別の装置の挿入を必要としていなくてもよい。たとえば、ブロック102で挿入された侵襲的プローブは、ガイドワイヤの構成要素でなくてもよいが、代わりに、ステント型血栓回収器などの治療装置の構成要素であってもよい。このような場合、ブロック110の治療は、ブロック102で挿入された治療装置を使用して行われ得る。たとえば、ブロック102で挿入された侵襲的プローブがステント型血栓回収器の構成要素である場合、ブロック106の治療勧告は、ステントを膨張させる量、血餅をステントと合体させるために待機する時間の量、ならびに/またはステントおよび血餅を回収するための力もしくは速度などの、ステント型血栓回収器を作動する方法に特有であり得る。このような実施形態では、ブロック110において、臨床医は、ブロック106で医療機器が勧告するようにステント型血栓回収器を作動させることにより、病変を治療し得る。
一部の実施形態では、病変を治療せず、むしろ病変を未処置のままにする方法で対象を処置することを含む治療勧告が、作成され得る。たとえば、血管の病変の一部の種類は、有効に治療することが困難である場合があり、病変により閉塞されている血管の再開通を阻んでいる。たとえば、頭蓋内動脈硬化性疾患を反映する病変(ICAD病変)は、現在利用可能な所定の治療を除外することが困難である場合がある。よって、一部の実施形態では、ICAD病変が検出された場合、有効なICADの治療が利用可能となるまで、医療機器は、この病変を治療しない治療勧告を作成し得る。ICAD病変は、その組成、特に病変の中の生体物質の位置によって同定され得る。たとえば、医療機器が、本明細書中記載の技術を介して、血管の病変が、侵襲的プローブの内腔側にある血餅、およびプローブの内腔とは反対側にアテローム性動脈硬化のプラーク状の物質(たとえば、脂質のまたは石灰化した構成要素、平滑筋細胞、内皮の不存在)を含むと決定する場合、医療機器は、この病変がICAD病変であると決定し得る。
病変がブロック110で治療された後、プロセス100は終了する。一部の実施形態で行われ得る病変の治療後の追加的な行為を、以下に記載する。
医療機器の例
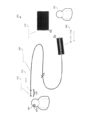
上述のように、図1は、医療機器が、動物の血管系における病変を診断および/または治療するために本明細書中記載の一部の実施形態により医療機器が作動し得る方法の全般的な論述を提供した。図2~図3は、当該診断および/または治療の一部として、血管系に挿入され得る侵襲的プローブを含む医療機器の一部の実施形態の例を提供する。
図2は、対象204の病状を診断および/または治療するために、臨床医202が作動し得る医療機器200を例示する。動物204(たとえば、ヒト)の病状は、虚血性脳卒中を引き起こし得るヒトの頭部の血管内の病変として図2の例に例示された、血管系の病変204Aであり得る。上述されるように、病変204Aは、血餅、プラーク状の物質の蓄積、平滑筋組織の過剰な増殖、および/または他の血管の病変であり得る。
図2に例示される医療機器200は、ガイドワイヤ206、ハンドル208、および侵襲的プローブ210を含む。侵襲的プローブ210およびガイドワイヤ206の少なくとも一部は、侵襲的プローブ210が病変204Aの近位に位置するまで対象204の血管系に挿入され得る。よって、侵襲的プローブ210は、血管系(または他の管)へ挿入するような形状および構成であり得る。一部の実施形態では、侵襲的プローブ210は、約300マイクロメートルであるガイドワイヤ、または直径約3~10フレンチであるマイクロカテーテル、または動物の管への挿入に適した直径を有する別の装置に取り付けられる。このような装置は、一部のこのような実施形態では、約1または2メートルの長さであり得、ここで侵襲的プローブ210は、たとえば、装置の終わりの5センチメートル内で、ガイドワイヤ/装置の一端に位置している。
対象204に挿入される侵襲的プローブ210は、1つ以上のセンサ212および測定部214を含み得る。一部の実施形態では、センサ212は、病変204Aの1つ以上の電気的な特徴を測定してもよく、これは病変204Aの組織および/または生体物質の1つ以上の電気的な特徴を測定することによる測定を含む。測定部214は、センサ212により作成されたデータを受信してもよく、一部の実施形態では、1つ以上の電気的な特徴を測定することの一部として、病変204Aへ適用される1つ以上の電気信号を作成し得る。
センサ212の例を、以下で詳細に説明する。具体的な1つの例として、センサ212は、インピーダンスセンサであり得、測定部214は、センサ212に、病変204Aの電気的インピーダンス分光法(EIS)を行わせ得る。たとえば、測定部214は、以下に詳細に論述するように、病変204Aの組成の同定に役立つように、異なる組織および/または異なる生体物質の間を区別するために選択される特定の周波数であり得る(および測定部214の発振器が生成するように構成されている)1つ以上の周波数の電気信号を生成するための1つ以上の発振器を含み得る。複数の周波数を使用して組織/物質を試験するように構成された実施形態では、測定部214は、1つの発振器が、試験する各周波数に特有であり、この周波数の信号を生成するように構成されている、複数の発振器を含み得る。
測定部214が病変204Aに適用する電気信号を生成する一部の実施形態では、測定部214が、侵襲的プローブ210の中に含まれており、対象204の血管系の中に挿入されることが好適であり得る。これは、センサ212および病変204Aにかなり接近させて測定部214を配置してもよく、病変204Aに適用した電気信号のノイズを制限し得る。たとえば、測定部214をハンドル208に配置させた場合、測定部214により生成された電気信号は、ガイドワイヤ206の端から端まで移動した後に、侵襲的プローブ210により出力され、病変204Aに適用される。信号がガイドワイヤ206の端から端まで移動した場合、電気的ノイズは、信号の質に影響を与える場合がある。侵襲的プローブ210の中に測定部214を配置することにより、この信号のノイズは制限され得る。測定部214が侵襲的プローブ210の中に配置されている場合、侵襲的プローブ210の管腔の中に配置されていてもよく、侵襲的プローブ210の表面(内部または外部)に配置されていてもよく、または、侵襲的プローブ210の表面(内部または外部)に付着したフィルムに埋め込まれていてもよい。
測定部214は、一部の実施形態では、特定用途向け集積回路(ASIC)として構成されていてもよい。一部のこのような実施形態では、ASICは、シリコン基板層を低減するパッケージングプロセスを使用して製造されていてもよい。たとえば、製造の間、集積回路は、能動素子を含まないシリコン基板層の上部に機能的な構成要素を含む「能動」シリコン層で、製造されていてもよい。この基板層は、層のスタックの最も下の層であってもよく、場合により最も厚い層であってもよい。従来では、基板層は、集積回路に構造上の安定性を与えるために、製造後は未処理のままである。一部の実施形態では、測定回路214は、能動層の製造後およびパッケージングの前に、シリコン基板層を除去することを含むプロセスを使用して、製造され得る。この製造プロセスは、能動素子を製造した側面とは反対側の側面であり得る、ウェハの底面から基板を除去することを含み得る。一部の実施形態では、シリコン基板の全てが除去され得る。他の実施形態では、実質的に全てのシリコン基板を除去してもよく、ここで「実質的に」除去することは、構造支持のためだけにシリコン基板を残すことなく、能動層の構成要素の適切な電気的機能を確保するために十分なシリコン基板のみを残すことを含む。シリコン基板を除去した後に、集積回路を、パッケージング材料で包んでもよい。
一部の実施形態では、センサ212および病変204Aにごく接近して測定部214を配置することは、電気信号が伝わる距離を制限することにより、信号減衰を低減させ得る。電線は低域周波数の応答を呈する傾向があるため、この信号減衰の低減は、高い周波数で特に有意であり得る。信号が伝わる距離を低減させることにより、信号源と病変との間の電気経路のカットオフ周波数を増大させることにより、診断または治療に使用できる周波数の範囲が増大し得る。結果として、組織または細胞の種類を区別するための特性を有意に高めることができる。センサ212および病変204Aにごく接近して測定部214を配置することは、カットオフ周波数を、一部の実施形態では最大1MHzに、他の実施形態では最大10MHzに、さらに他の実施形態では最大25MHzに増加させ得る。比較のため、測定部214をハンドル208に配置した場合では、カットオフ周波数は、500kHz未満に限定され得る。
実施形態は、センサ212がEISセンサであるか、EIS工程を行うために駆動されるかに限定されないことを理解すべきである。一部の実施形態では、センサ212は、1つ以上の電気的センサ、機械的センサ、光学的センサ、生体センサ、または化学的センサであってもよく、またはこれらを含み得る。このようなセンサの具体的な例として、インダクタンスセンサ、キャパシタンスセンサ、インピーダンスセンサ、EISセンサ、電気インピーダンス・トモグラフィ(EIT)センサ、圧力センサ、フローセンサ、せん断応力センサ、機械的応力センサ、変形センサ、温度センサ、pHセンサ、化学組成物センサ、(たとえば、O2イオン、バイオマーカー、または他の組成物)、加速度センサ、および運動センサ、が挙げられる。これらのセンサは、既知の市販のセンサを含み得る。
一部の実施形態では、侵襲的装置210に含まれている測定部214は、センサ212を駆動し、および/またはセンサからの結果を処理してデータを作成し、ガイドワイヤ206に沿ってハンドル208へデータを送り返すように構成され得る。これは、たとえば、治療勧告が、医療機器200により作成される実施形態の場合であり得る。病変204Aの特徴を表すデータは、ガイドワイヤ206の端から端に沿って伝送され得る。このような伝送の間のノイズの作用を制限するために、一部の実施形態において、測定部214は、ガイドワイヤ206を介して実行する通信チャネル(たとえば、1つ以上のワイヤ)を介した伝送のためのデジタルデータを作成するために、アナログ-デジタル変換回路(ADC)または他の構成要素を含み得る。
本明細書中記載の実施形態により、臨床医202は、医療機器200により作成された1つ以上の治療勧告により、病変204Aを治療し得る。図2に例示されてはいないが、医療機器200は、病変204Aの治療のための当該治療勧告を作成および出力するための制御装置を含み得る。制御装置は、一部の実施形態では、医療機器200の少なくとも1つのプロセッサにより実行される実行可能なコードとして実施される、病変解析設備として実施され得る。病変解析設備は、1つ以上の治療勧告に関して設定された情報と関連させて、医療機器200により(たとえば、侵襲的プローブ210により)決定される病変204Aの特徴を解析し得る。具体的な1つの例として、以下に詳細に論述されるように、病変解析設備は、病変204Aの特徴を、様々な治療勧告に関連した条件と比較し得、この特徴がある治療勧告の条件を満たす場合に、当該治療勧告を出力し得る。
一部の実施形態では、病変解析設備を実行するためのプロセッサおよび病変解析設備を保存する記憶媒体(たとえば、メモリ)、および治療勧告に関して設定された情報は、ハンドル208の中に配置されていてもよい。よって、ハンドル208におけるプロセッサで実行した病変解析設備は、ガイドワイヤ206の通信チャネルを介して、病変204Aの1つ以上の特徴を表すデータを、測定部214から受信し得る。
他の実施形態では、しかしながら、病変解析設備を実行するためのプロセッサおよび病変解析設備を保存する記憶媒体(たとえば、メモリ)、および治療勧告に関して設定された情報は、たとえば、別のコンピュータ装置に配置することにより、ガイドワイヤ206およびハンドル208から離間して配置されていてもよい。このコンピュータ装置は、たとえば、同じ部屋に位置することにより、ガイドワイヤ206およびハンドル208の近位に配置されていてもよい。あるいはコンピュータ装置は、たとえば、同じビルディングの異なる部屋に配置されることによりガイドワイヤ206およびハンドル208と離れて配置されていてもよく、またはガイドワイヤ206およびハンドル208と地理的に離れていてもよい。プロセッサ/媒体がガイドワイヤ206およびハンドル208と離間している実施形態では、コンピュータ装置は、ハンドル208からコンピュータ装置への直接的なワイヤ、ハンドル208とコンピュータ装置との間のワイヤレス・パーソナル・エリア・ネットワーク(WPAN)、ハンドル208とコンピュータ装置との間の無線ローカルエリアネットワーク(WLAN)、ハンドル208とコンピュータ装置との間の無線広域ネットワーク(WWAN)、および/またはインターネットを含む1つ以上の有線および/または無線の通信ネットワークを介して、病変204Aの1つ以上の特徴を表すデータを受信し得る。よって、一部の実施形態では、ハンドル208は、1つ以上のネットワークを介して通信するための1つ以上のネットワークアダプタを含み得る。
治療勧告が医療機器200により作成される場合、治療勧告は、臨床医202および/または他のいずれかのユーザに提示するために、医療機器により出力され得る。この出力は、1つ以上のネットワークを介した、別の装置および/または1つ以上のディスプレイ、たとえば、ディスプレイ216、または他の形態のユーザインターフェースに対する出力であり得る。図2の例では、病変解析設備は、ハンドル208の中に配置されたプロセッサで実行してもよく、治療勧告を作成してもよく、この勧告は、臨床医202へ提示するためのディスプレイ216に対する、ハンドル208の無線ネットワークアダプタを介した出力であり得る。実施形態はこの形態に限定されないため、他の形態のユーザインターフェースを使用してもよい。いずれかの適切な視覚的、聴覚的、および/または触覚的なフィードバックを使用してもよい。たとえば、治療勧告が、吸引カテーテルまたはステント型血栓回収器のいずれかを使用した病変の除去の間に勧告される場合、ハンドル208は、各選択肢のための発光ダイオード(LED)または他の視覚的な部品を含んでもよく、適切なLEDを明るくすることにより治療勧告を提示し得る。別の例として、治療勧告が、ステント型血栓回収器を作動させる方法に関連し、特に待機時間後にいつ抜き取りを開始するかの勧告に関連する場合、抜き取りを開始するための信号は、ハンドル208に組み込まれたバイブレーション部を介して提供される触覚的な信号を使用した出力であり得る。当業者は、上述のコンピュータ装置と同様に、ユーザインターフェースの部品が、ハンドル208の中に配置されてもよく、またはハンドル208と離間していてもよい(またはさらには遠く離れていてもよい)ことを理解するものである。
電力が、ガイドワイヤ206の端から端に沿って延びる電力ケーブルを介して侵襲的プローブ210に提供され得る。電力ケーブルは、ハンドル208の電力供給装置に接続してもよく、これは、バッテリー、エナジーハーベスタ、電力供給系統(grid power supply)への接続、または他のエネルギー供給源であり得るが、実施形態はこの形態に限定されない。
一部の実施形態では、ハンドル208は、図2には例示されていない、1つ以上のセンサを含み得る。ハンドル208に組み込まれたセンサは、臨床医202が治療を行った方法を伝えるために、医療機器200の作動をモニタリングし得る。たとえば、加速度計または他の運動センサが、ガイドワイヤ206および侵襲的プローブ210の移動を統括するハンドル208の移動を検出するために、ハンドル208に配置されていてもよい。たとえば、加速度計をモニタリングすることにより、臨床医202が、病変を除去するために複数の治療(たとえば、吸引カテーテルもしくはステント型血栓回収器を用いた複数の通過)を行ったか、または1つの通過のみで病変を回収できたかどうかの決定がなされ得る。
一部の実施形態では、ハンドル208は、ガイドワイヤ206から取り外し可能であってもよく、作動ごとに再利用できてもよい。よって、侵襲的プローブ210および/またはガイドワイヤ206は、再利用できないように構成されていてもよく、代わりに、衛生的な理由のため廃棄できるように構成されていてもよく、また、ハンドル208は、ガイドワイヤ206に取り外し可能に取り付けられており、他のガイドワイヤ206および侵襲的プローブ210を用いて再利用されるように構成されていてもよい。たとえば、ガイドワイヤ206およびハンドル208は、ハンドル208が、ガイドワイヤ206と接続し、ガイドワイヤ206の構成要素(たとえば、通信チャネル、電力ケーブル)および侵襲的プローブと連動できるような補足的な接合部分を有し得る。
臨床医202は、ディスプレイ216を含み、ハンドル208の中に少なくとも部分的に配置され得る医療機器のユーザインターフェースを介して、医療機器200を作動し得る。たとえば、ハンドル208により、臨床医202はガイドワイヤ206および侵襲的プローブ210を、血管系の中を進むまたは戻るように移動でき、かつ/または侵襲的プローブ210の作動をもたらすことができる。
侵襲的プローブ210の作動は、侵襲的プローブ210の構成要素に依存し得る。たとえば、侵襲的プローブ210は、病変204Aの1つ以上の特徴を検知するためのセンサ212を含み得る。さらに、侵襲的プローブ210は、たとえば、1つ以上のセンサを作動させて病変204Aに電気信号を適用し、電気信号の適用の間および/または後に病変204Aの1つ以上の測定を行うことにより、1つ以上の特徴を検出するようにセンサを作動させるための測定部214を含み得る。一部の実施形態では、侵襲的プローブ210は、ステントを埋め込むことによる治療、および/または病変204Aを除去することによる治療を含む、病変204Aを治療するための1つ以上の構成要素を含み得る。病変除去の構成要素は、病変の除去に適したいずれかの技術に関連する構成要素を含み得るが、実施形態はこの形態に限定されない。一部の実施形態では、たとえば、侵襲的プローブ210は、ステントを使用した病変の回収を行うためのステント型血栓回収器の構成要素(たとえば、バルーン)、および/またはカテーテルの中へ病変を吸引するための吸引カテーテルの構成要素を含み得る。さらに侵襲的プローブ210は、たとえば、光干渉断層法(OCT)センサといった、図2に示されていない他のセンサを含み得る。
医療機器のユーザインターフェースは、ハンドル208の全体または一部に組み込まれていてもよく、よって、臨床医202は、侵襲プローブ210を用いて多くの異なる作動を行うことが可能となる。たとえば、ハンドル208のユーザインターフェースにより、臨床医202は、センサ212および測定部214に電気信号を適用し得、および/または病変204Aの測定を行うことが可能となり、および/または病変204Aを治療するための1つ以上の治療を行うことが可能となる。
医療機器200が、病変204Aを治療するための1つ以上の作動を行うための治療の構成要素を含み得る例を説明してきたが、実施形態はこれによって限定されないことを理解すべきである。一部の実施形態では、医療機器200は、病変204Aの近位に配置しており、病変204Aを治療するために、ガイドワイヤに沿って挿入される追加的な治療装置のためのガイドワイヤであり得る。たとえば、侵襲的プローブ210およびガイドワイヤ206の挿入の後に、臨床医202は、ガイドワイヤの長さに沿って別の装置を挿入してもよく、またはガイドワイヤ206および侵襲的プローブ210を除去し、次に新規の装置を挿入し得る。新規に挿入された装置は、たとえば、病変204Aを治療するための、ステント埋め込み装置(implanter)、吸引カテーテル、ステント型血栓回収器、または他の装置であり得る。追加的な装置が挿入される一部の実施形態では、ハンドル208は、追加的な装置およびハンドル208が、互換性のあるインターフェースを有し得、ハンドル208のユーザインターフェースを使用して追加的な装置を作動し得るように、追加的な装置と互換性があり得る。
さらに、臨床医202が治療勧告にしたがって医療機器200を手動で作動する例を提供してきたが、実施形態はこれに限定されない。代替的な実施形態では、医療機器200は、センサ212からの入力に基づき、自動的に病変を治療し得る。たとえば、上記の簡潔な論述および以下の詳細な論述から明らかであるように、医療機器200は、病変204Aを治療する方法に関する治療勧告を作成し得る。一部の実施形態では、医療機器200は、治療勧告に従い、ユーザが介入することなく(しかしながら一部の実施形態では、臨床医202の監督の下で)、病変204Aを治療するための吸引カテーテル、ステント型血栓回収器、ステント埋め込み装置、または他の装置を、治療勧告にしたがい挿入および/または作動する。
実施形態は、動物の体内に挿入される侵襲的である医療機器または侵襲的な構成要素を含む医療機器での作動に限定されないことを、理解すべきである。たとえば、非侵襲的プローブは、本明細書中記載の選択された周波数または特性を使用して作動すること、または本明細書中記載されるようにトレーニングされたモデルを使用することを含み、本明細書中記載されるように作動する測定部および/またはセンサ(EISセンサなど)を有し得る。このような非侵襲的な装置は、たとえば、皮膚の病変の診断および/または治療に使用され得る。
また、本明細書中記載の技術は、挿入され次に除去され得るが、同様に埋め込み可能な装置で使用され得るガイドワイヤまたは他のツールなどの挿入可能な装置を伴う使用に限定されないことを、理解すべきである。たとえば、本明細書中記載の種類の測定部およびセンサは、ステント、たとえば、センサがステントに直接配置されているステント、と共に使用され得る。この方法では、ステントが配置されている領域の組織のモニタリングが、ステントが配置された直後および後に行われ得る。センサは、ステントが配置されている領域の組織の1つ以上の特徴(たとえば、組成)を検知し得る。検知された特徴を使用して、ステントが接触した1つ以上の生体構造の特徴を推測し、1つ以上の生体構造に関する決定を行ってもよい。たとえば、このシステムは、ステントが接触している組織が健常であるかどうか、または瘢痕組織もしくは他の健常ではない組織が形成しているかどうか、もしくは閉塞が形成されているかどうかを決定するために、使用され得る。
図3は、一部の実施形態が作動し得る侵襲的プローブ210の例を例示する。図3の例の侵襲的プローブ210は、ステントと同様に構成されているメッシュ300を含む。侵襲的プローブ210は、一部の実施形態では、ステント型血栓回収器として作動可能であり得る。他の実施形態では、侵襲的プローブ210は、ステント型血栓回収器として作動可能ではないが、恐らくは1つのセンサのみを使用する場合よりも良好な正確性で病変の特徴を検出するために、センサと病変との間に複数の接触ポイントを提供するためのメッシュ300または別の構造を含み得る。
よって、一部の実施形態(図3の実施形態ではない)では、侵襲的プローブ210は、たとえば、侵襲的プローブ210の遠位端に位置し得る、1つのセンサのみを含み得ることを理解すべきである。このようなセンサは、2つの電極として実施されてもよく、このうちの1つは、病変に電気信号を適用してもよく、このうちの1つは、適用した信号を受信し得る。受信した信号と適用した信号の比較に基づき、以下に詳細に論述するように、1つ以上の決定がなされ得る。
しかしながら、本発明者らは、侵襲的なプローブ210に追加的なセンサを含むことにより、より詳細な情報を決定することが可能であり得ることを認識および理解している。たとえば、侵襲的プローブ210に追加的なセンサを含むことは、1つのセンサのみと比較してより高い精度で病変の組成に関する情報を作成することが可能となり得る。このような追加的なセンサは、たとえば、場合により異なるインピーダンススペクトルが同じ病変の異なる位置で決定され得るように、侵襲的プローブに沿って複数の位置のそれぞれで、インピーダンススペクトルを決定することが可能になり得る。このことは、たとえば、各センサを使用してインピーダンススペクトルを決定することを含み得る。この場合の各インピーダンススペクトルは、センサ(その2つの電極を伴う)が接触する、病変の生体物質のインピーダンススペクトルであろう。一部の病変は、複数の異なる生体物質(たとえば、異なる組織もしくは細胞、または異なるプラーク状の物質)を含み得る。侵襲的プローブの各センサが異なる生体物質と接触する場合、各センサは、それぞれの異なる生体物質に関する異なるインピーダンススペクトルを決定し得る。しかしながら、これは、一部の病変では、侵襲的プローブの2つ以上のセンサが同じ生体物質と接触し得る場合であってもよく、このような場合は、同じまたは実質的に同じインピーダンススペクトルを作成し得る。よって、一部の実施形態では、侵襲的プローブは、病変の生体物質に関するインピーダンススペクトルを作成するように各センサを作動し得る。病変の複数の生体物質のそれぞれに関するインピーダンススペクトル(すなわち各病変に関する複数のインピーダンススペクトル)を作成することは、全体としての病変に関する1つのインピーダンスを決定することと対比をなしている。EISを行うことを介するものを含む、複数のセンサを使用して病変の組成を決定するための技術は、以下に論述されている。
よって、図3は、プローブ210の外面および/または内面に沿って配置された複数のセンサを有する侵襲的プローブ210の例を例示する。センサ302(センサ302A、302B、302C、302D、本明細書中では総称的または集合的にセンサ302と呼ばれている)は、構造300に沿って配置され得る。一部の実施形態では、各センサは、電気信号を適用するため、および/または適用した電気信号を検出するための1つ以上の電極であり得、または当該1つ以上の電極を含み得る。
一部の実施形態では、図3に例示されてはいないが、侵襲的プローブ210は、膨張する際に構造300を外側へ広げ、病変と良好に接触させるためのバルーンを含み得る。使用の最中に、たとえば、構造300は、たとえば、センサ302が複数のポイントでの接触を検出するまでバルーンを使用して構造300を膨張させた後に、構造300の遠位端に位置するセンサが、これらが病変の裏側(far side)を通ることを検出するまで、病変に全体または部分的に挿入され得る。構造300の膨張は、侵襲的プローブ210の制御装置(たとえば、測定部304)により制御されてもよく、または医療機器の他の場所に配置された病変解析設備により、および/もしくは医療機器のユーザインターフェースを介して臨床医により制御されてもよい。
一部の実施形態では、測定部304は、たとえば、病変に適用するための1つ以上の電気信号を作成し、センサ302により作成されたデータを解析することによることを含む、1つ以上の測定を行うようにセンサ302を作動し得る。センサ302により作成されたデータの解析は、上述の病変解析設備またはユーザインターフェースなどの、患者の外側へとガイドワイヤに沿って伝送されるデータのアナログ-デジタル変換を行うことを含み得る。
センサ302が電気的なセンサである例を提供してきたが、実施形態はこれらに限定されないことを理解すべきべきである。たとえば、センサ302は、1つ以上の電気的センサ、機械的センサ、光学的センサ、生体センサ、または化学的センサであってもよく、または当該センサを含み得る。このようなセンサの具体的な例として、インダクタンスセンサ、キャパシタンスセンサ、インピーダンスセンサ、EISセンサ、電気インピーダンス・トモグラフィ(EIT)センサ、圧力センサ、フローセンサ、せん断応力センサ、機械的応力センサ、変形センサ、温度センサ、pHセンサ、化学組成物センサ、(たとえば、O2イオン、バイオマーカー、または他の組成物)、加速度センサ、および運動センサ、が挙げられる。
センサおよび検知技術の例
上述のように、一部の実施形態では、侵襲的プローブの測定部は、電気的インピーダンス分光法(EIS)を行うように侵襲的プローブのセンサを作動し得る。図4~図11は、このようなセンサおよび測定部が配置され得る方法の例を記載し、当該センサおよび測定部の作動に関する技術の例を記載している。しかしながら、実施形態は、このセクションに記載のEISに関する例による作動に限定されないことを理解すべきである。
図4~図11に関してこのセクションに記載されている技術は、ヒトなどの哺乳類を含む動物の管の病変の組織および/または生体物質の区別を可能にする。本明細書中「区別」は、たとえば、病変の1つ以上の種類の細胞(たとえば、赤血球および/もしくは白血球、もしくは異なる種類もしくは状態の内皮細胞)、ならびに/または病変の1つ以上の種類の他の生体物質(たとえば、コレステロールなどのプラーク状の物質)を決定することにより、異なる組成の病変間を区別する、この方法により提供される可能性を意味することを、理解すべきである。より大まかには、恐らくはこのセクションに記載の技術によりなされる区別は、試験した病変に関連する情報の少なくとも1つの項目を決定することを含む。これらの技術を介して決定され得る情報の例を、以下に提供する。
図4に概略的に例示されている細胞区別法10は、試験する病変のインピーダンスの周波数スペクトルを決定する第1のステップ12を含む。
本明細書中、スペクトルは、病変のインピーダンスの対の値のセットを意味すると理解すべきであり、後者は複素数とすることができ、対応する周波数の値である。よってこのスペクトルは、離散していてもよく、有限数の対のみを含み得る。これらの対は、特に、数Hz、さらには数十のHzにより、さらには数百のHzで、分けられていてもよい。しかしながら、他の実施形態では、このステップで決定したスペクトルは、周波数バンドにわたり、連続であるか、偽連続であるか、または離散している。偽連続は、スペクトルが、100Hz以下、好ましくは10Hz以下、さらに好ましくは1Hz以下で分けられた、連続した周波数で決定されることを意味すると理解すべきである。組織のインピーダンスが決定される周波数バンドは、たとえば、10kHzから、好ましくは100kHzから拡張する。実際に、低い周波数では、病変の組織/物質の膜は、電気絶縁体として作用し、これにより、インピーダンスは、非常に高く、とりわけ、ほとんど変動しない。さらに、病変の組織/物質のインピーダンスが決定される周波数バンドは、たとえば、最大100MHz、好ましくは1MHzにまで拡張する。実際に、高い周波数では、病変を構成する組織/物質の壁は、電気的観点から透過性となる。よって、測定したインピーダンスは、もはや生体物質を表すものではない。このスペクトルは、病変の複素インピーダンスの、実数部および/または虚数部および/または絶対値および/または位相の周波数スペクトルであり得る。
病変のインピーダンスの周波数スペクトルを決定する第1のステップ12は、特に、図5と関連させて本明細書中以下に記載するように行われ得る。
第1に、ステップ14の間に、2つ、好ましくは3つ、さらにより好ましくは4つの電極を、試験する病変と接触させて配置する。これらの電極は、交流発電機と接続している。試験する病変に電流を通すために2つの電極を用いること、および他の2つの電極間の電位差を測定することが可能となるため、4つの電極を用いた測定が好ましい。このことにより、測定の正確性を改善することが可能となる。次に、ステップ16の間に、交流電流を、病変に接触した電極間に印加する。次に、ステップ18の間に、印加した電流の周波数を変えることにより、対応する電圧を、異なる周波数に関して電極の末端で測定する。最後に、ステップ20の間に、測定した電圧と印加した電流との間の比を、測定を行った各周波数で計算した。この比は、測定周波数の関数として、試験した病変のインピーダンスを提供する。計算した比により、病変のインピーダンスの周波数スペクトルを定義することが可能となる。
スペクトルが連続または偽連続である場合、これは、図6に例示されるように、この特定の場合では周波数の関数として病変のインピーダンスの絶対値を提供する曲線の形態で表されてもよく、後者は、対数の尺度によりプロットされている。ここでは対数の尺度がx軸で使用されていることに留意されたい。
図4の区別法10のステップ22では、次に、病変のインピーダンスの異なるモデル、すなわち、病変をモデル化し得る異なる電気回路を選択する。ここでは、定位相要素を含むが、キャパシタンスを含まないモデルを選択する。実際に、定位相要素モデルは、キャパシタンスよりも病変の事象を実数で(realistically)モデル化することが見いだされている。
定位相要素(またはCPE)は、インピーダンスZ
CPEの形態:
(式中、
jは、-1の平方根(j
2=-1)であり;
ωは、電流の特定のパルスであり(ω=2πf(fは電流の周波数である));
Q
0は、定位相要素の実パラメータであり;
αは、0~1の間にある定位相要素の別の実パラメータであり、これにより、定位相要素の相φ
CPEは、-απ/2に相当する)
を有する。
以下の記載では、インピーダンスが上記の式[1]により提供される定位相要素が、例として選択されている。
病変のインピーダンスのモデルは、特に、図7~図10に関する本明細書中以下に記載のものから選択され得る。明らかに、モデルが単純であるほど、計算は単純である。しかしながら、複素数のモデルが、測定により得られるインピーダンスのスペクトルとより良好に相関してもよく、よってより正確な結果をもたらし得る。
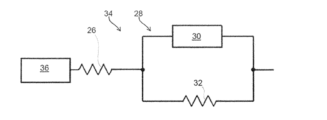
図7に例示された第1のモデル24では、病変のインピーダンスが、定位相要素30および第2の抵抗32の並列接続28と直列に取り付けられた第1の抵抗26によりモデル化されている。
この場合、病変の総抵抗Z
totは、
(式中、
Z
totは、病変を表す第1のモデル24の総インピーダンスであり;
R1およびR2は、第1の抵抗26および第2の抵抗32の抵抗値である)
の形態である。
このようなモデルは、個々の並列の取り付けのセットのように、測定電極を覆う病変を特に良好に説明しており、各個々の取り付けは、個々の抵抗および個々のキャパシタンスの並列の取り付けと直列にある個々の抵抗から構成されている。このような取り付けにより、パラメータが異なり得る並列の異なる回路によって測定電極の表面の全てにわたる時定数の分布の時定数をモデル化することが可能となる。ここで、これらの並列の回路はそれぞれ、病変の異なる組織/物質を表す。よって、病変の組織/物質が、異なる電気的性質、特に異なる抵抗および/またはキャパシタンスを呈し得るとの事実が、モデル化される。
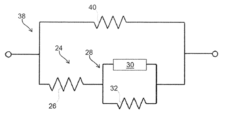
図8Aに例示されている第2のモデル34は、第2の定位相要素36の直列の取り付けにより、図7のモデル24を補完している。この第2の定位相要素36のインピーダンスZ
CPE,2は、同様に、
(式中、
βは、この第2の定位相要素の定位相が-βπ/2に相当するような、0~1の間にある実パラメータであり;
Q
1は、定位相要素の実パラメータである)
の形態であるように選択され得る。
よって、この第2のモデル34に係る病変の総インピーダンスZ
totは、以下の式:
により提供される。
第2のモデル34の変形34’が、図8Bに示されており、高い周波数でのインピーダンス曲線の良好な適合のための、図8Aの回路と並列にあるキャパシタンスCの追加により、図8Aのモデルと異なっている。
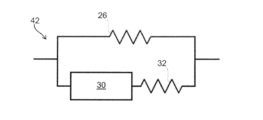
図9に例示した第3のモデル38は、抵抗R
3の第3の抵抗40と並列に取り付けられている図7のモデルに対応している。この場合、病変の総インピーダンスZ
totは、式:
により提供される。
最後に、第4の例示的なモデル42を、図10に例示する。このモデル42は、例示されるように、定位相要素30および第2の抵抗32の直列の取り付けと並列に取り付けられた第1の抵抗26を含む。
このモデル42に関する病変の総インピーダンスZ
totは、式:
により提供される。
次に、区別法は、ステップ22で選択された各モデルで、病変のインピーダンスのモデルと、ステップ12で決定したスペクトルとの間の相関を最適化する定位相要素30のインピーダンスを決定するステップ44を続行する。
この、病変のインピーダンスのモデルと、ステップ12で決定したスペクトルとの間の相関を最適化するステップは、当業者に知られているいずれかの最適化方法により実施され得る。例として、最小二乗法を実施してもよく、これにより、このステップ44を実際に比較的単純に実施することを可能にする。
実際に、定位相要素のインピーダンスのパラメータ以外の、異なるモデルの他のパラメータもまた、このステップ44の間に決定される。これらの要素はまた、試験される病変、および/または構成される組織/物質に関する情報を得るために有用であり得る。
次に、区別法10の中間のステップ46が提供され得る。このステップ46は、病変のインピーダンスの測定したスペクトルと最良に相関するように思われるモデルを決定することを含む。この最良のモデルは、たとえば、測定したスペクトルでの標準偏差を最小限にするモデルであり得る。本明細書中の以下の説明では、モデル24が病変のインピーダンスの測定したスペクトルに最良に相関したモデルとして保持されている場合が、想定されている。
ステップ48の間に、病変の実効キャパシタンス(または見かけのキャパシタンス)を、定位相要素のインピーダンスのパラメータおよび対応するモデルから推定する。
理論的には、この実効キャパシタンスは、細胞構造の要素の個々のキャパシタンスのセットを表す。実効キャパシタンスは、細胞構造の要素の分散型のローカルキャパシタンス(distributed local capacitance)を表す。これらの細胞構造の要素は、特に、細胞構造の細胞の核、また、ゴルジ体、ベシクル、ミトコンドリア、リソソーム、および膜の相互作用で役割を果たし得る他の要素などの細胞の他の部分のうちの全てまたは一部であり得る。また、実効キャパシタンスは、細胞の幾何学的形状および細胞間の空間に影響され得る。実効キャパシタンスは、病変の一部または全ての電気的な膜の事象を表すことが可能であるモデルである。このモデルにより、病変の組織/物質を関連させて(relevantly)区別することが可能となる。
より実質的には、実効キャパシタンスは、個々の並列の取り付けを含むモデルで病変のインピーダンスを同定することにより決定され、ここでの個々の並列の取り付けは、それぞれ、少なくとも1つの個々の抵抗および1つの個々のキャパシタンスを含む。それぞれの取り付けは、特に、第2の個々の抵抗と個々のキャパシタンスの並列の取り付けと直列にある第1の個々の抵抗を含んでもよく、好ましくはこれらからなり得る。これらの個々の取り付けは、病変の各組織/物質の事象をモデル化することを目的とする。よって、実効キャパシタンスは、病変において、全ての個々のキャパシタンスの存在からもたらされる、キャパシタンスである。
モデル24(または34または34’)の場合、実効キャパシタンスの決定は、特に以下のように行うことができる。定位相要素を伴うモデル24のインピーダンスは、定位相要素が実効キャパシタンスにより置き換えられている、均等または同一のモデルのインピーダンスと比較される。次に、計算、厳密に述べると実効キャパシタンスの計算が、定位相要素が実効キャパシタンスにより置き換えられている同一のモデルと、定位相要素を伴う病変に関して選択されたモデルのインピーダンスの実数部および/または虚数部および/または位相および/または絶対値を比較することにより、行われ得る。
モデル24(または34または34’)の場合、たとえば、時定数
を、式[3]から直接推定したモデル24のアドミッタンスの式に導入することにより、以下の式[8]を得る。
ここから、実効キャパシタンスに関する式は、
の形態と推定され得る。
定位相要素を伴う病変のインピーダンスの別のモデルを選択する場合、実効キャパシタンスの対応する式を決定することが可能である。これを行うためには、病変のインピーダンスのモデルに電気的に相当するモデル24または34または34’に関して、選択したモデルのパラメータの関数として、モデル24または34または34’のインピーダンスR1、R2、ZCPE、およびZCPE,2を適宜計算することで十分である。よって、実効キャパシタンスは、選択したモデルのパラメータの関数として表されている対応する値と、R1、R2、Z0、およびαを置き換えることにより、計算され得る。
次に、細胞区別法10は、あらかじめ決定された実効キャパシタンスから、病変の組織/物質に関する情報の項目を推測するステップ66を続行する。
この推測は、特に、あらかじめ確立した値とステップ48で決定された実効キャパシタンスの値を比較することにより行われ得る。あらかじめ確立した値は、特に、既知の培地における既知の組成の組織に関して既知の試験条件で行われた試験の間に得られてもよい。あらかじめ確立した値は、異なる種類の細胞および/または異なる細胞の異なる条件および/または異なる試験条件で測定された実効キャパシタンスをまとめた、実効キャパシタンスの値のデータベースにまとめられてもよい。実効キャパシタンスの値は、本発明の測定で見いだされやすい細胞種および条件の実効キャパシタンスのデータベースと比較され得る。この比較では、実効キャパシタンスCeffは、他のパラメータとまとめて使用され得る。この比較は、正確な一致でなくてもよく、実効キャパシタンスの値があらかじめ決定した範囲内であるか範囲外であるかの決定を含み得る。
よって、病変の組織/物質を区別すること、すなわち、以下の情報の項目:
病変における組織および/または他の生体物質の種類;
特に後者が異なる種類の生体物質、または異なる状態の組織/細胞/他の生体物質から構成される場合の、病変の組成;
病変が組織から構成される場合の、組織に含まれている細胞の種類および/または組織に存在する細胞の層の数;
病変が、プラーク状の物質などの他の生体物質から構成されている場合の、病変に含まれている物質の種類;ならびに/または
特に細胞が健常な状態、炎症状態、変性した状態、特に1つ以上の癌性細胞がある場合の変性した状態、感染した状態にある場合の、病変の組織に含まれている細胞の状態
のうちの少なくとも1つを決定することが、可能である。
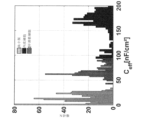
例として、図18は、以前に記載した方法により行った試験に関連して決定した実効キャパシタンス68、70、72、74を、図表形式で表す。
試験の状況下で、細胞を、細胞のコンフルエンスを得るまで培養した。行った例示的な試験の場合では、コンフルエンスとなるまでの、試験する組織を得るために、5%CO2下、37℃のインキュベータにおける2日間の培養が必要であった。試験する異なる組織のインピーダンスのスペクトルの決定を、インピーダンス分光法システムを使用して行った。試験する細胞を電気的に励起しない程度にかなり低いが、正確に測定を行うには十分であると推定された交流電圧を印加することにより、スペクトルを、1kHz~10MHzと決定した。行った試験の例では、20mVの交流電圧の振幅が保持された。
実効キャパシタンス68は、試験培地のうち、唯一静的であるキャパシタンスである。この試験培地は、細胞培養培地である。実効キャパシタンス70は、ウシの大動脈内皮細胞(BAEC)のキャパシタンスである。実効キャパシタンス72は、ウシの大動脈平滑筋細胞(BAOSMC)のキャパシタンスである。最後に、実効キャパシタンス74は、血小板(blood plateletsまたはthrombocyte)のキャパシタンスである。この図が示すように、異なる種類の細胞の実効キャパシタンスは、互いに明らかに異なった値を呈しており、混同するリスクを伴うことなく、正確に、異なる種類の細胞間を有効に区別することが可能である。
よって、記載の区別法の1つの利点は、電極と接触する病変における組織/物質の区別を、試験する病変のインピーダンスの周波数スペクトルの単純な測定から可能にすることである。得られた結果は正確である。測定したインピーダンスの正規化を行う必要はなく、また試験するいずれかの試料の非存在下での参照の測定を行う必要もない。よって本方法は、試験する細胞または細胞構造をあらかじめサンプリングすることを必要とせずに行うことができ、一部の実施形態では、in vivoで実施され得る。
実効キャパシタンスを決定する場合において、この単一の値が、多くの場合、病変の組織/物質を区別するために十分であることに留意すべきである。また、試験する病変のインピーダンスの選択したモデルのパラメータは、実効キャパシタンスの比較の結果を特定するために、あらかじめ確立した値と比較され得る。たとえば、組織の細胞が炎症状態にある場合、細胞間のジャンクションはゆるくなっている。低い周波数の抵抗、すなわち、例としてモデル24の抵抗32は、健常な細胞と比較して低い。よって、健常な炎症性ではない細胞に関してあらかじめ確立された値と、この抵抗の値の比較により、これらの細胞の炎症状態を決定することが可能となり得る。
また、モデルの他のパラメータが、病変の組織/物質を区別するとみなされ得ることに留意すべきである。しかしながら、これらの他のパラメータにより、試験される病変に関する情報の追加的な項目を決定することも可能であり得る。よって、たとえば、モデル24の抵抗26、32のR2または合計R1+R2は、病変が組織を含む場合に、細胞構造の厚さを決定するとみなされ得る。これを行うために、値R2、および恐らくはR1は、特に、定位相要素のインピーダンスの決定と同時に、測定したインピーダンススペクトルとモデル24の相関を最適化するために決定される。次に、値R2、または合計R1+R2が、たとえば、in vitroにおいて、既知の条件であらかじめ決定された対応する値と比較され得る。これらの所定の値は、特にデータストアに保存されていてもよい。
上述のように、本方法は、動物の対象に挿入され得る、たとえば、ヒトの対象の血管系に挿入され得る装置に関連して、容易に実施することが可能である。
例として、図11は、上述の方法を実施するためのシステムの例100を例示する。
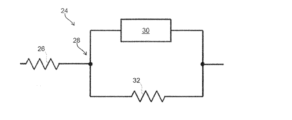
システム100は、病変104、ここでは、たとえば、血液の、培地105に浸されたコンフルエントな細胞の単一層の組織のインピーダンスを測定するための手段102と、本方法を実施するためおよび測定したインピーダンスの関数として病変104の組織を区別するための、測定手段102に接続した電子制御部106とを、本質的に含む。
ここで、測定手段102は、病変104と接触した2つの電極110、112に接続した交流電流の発電機108を含む。また、測定手段102は、病変104と接触した2つの電極116、118により病変104に接続した、病変104を通る強度を決定するための装置114を含む。電子制御部106は、たとえば、電極110、112、116、118の末端の電圧および強度の測定から、病変104のインピーダンスを決定することができるように、発電機108および強度測定装置114に接続している。
電極110、112、116、118は、たとえば、金などの導電性物質からなる。
ここで好適には、測定手段102は、動物の対象に挿入され得る医療機器120、ここでは侵襲的プローブ120をさらに含む。この場合、電極110、112、116、118、交流電圧発電機、および強度測定装置は、この医療機器に固定されていてもよい。この医療機器は、たとえば、その内容全体、特に測定装置を含む埋め込み可能な医療機器の論述が本明細書中参照として援用されている2014年10月3日出願の仏国特許公開公報第3026631号(MEDICAL DEVICE PROVIDED WITH SENSORS HAVING VARIABLE IMPEDANCE)に記載されている通りである。
この場合、交流発電機108は、ステント120の外にある監視部(interrogation unit)が発する電磁場の作用の下で電流を流すように構成されている、電機子、たとえば、医療機器の本体、および医療機器の本体から電気的に絶縁しているアンテナを含み得る。よって、電極は、様々なインピーダンスを伴うセンサを形成し得、このインピーダンスは、これらをカバーする細胞構造の関数として変動する。最後に、電子制御部は、特に埋め込み可能な医療機器120の本体に固定されたアンテナによる磁場が発せられることにより、電極間のインピーダンスに関連する情報の項目を受信し得る。
よって、ステント120により、ステント120が適合した後に、内皮の治癒の正確な進行を確認することが可能となり得る。実際に、当該ステント120は、電子制御部と協同して、内皮の表面に形成された細胞構造が、健常な内皮細胞、炎症性の内皮細胞、平滑筋細胞、および/または血小板を本質的に含むかどうかを、図4の方法を実施することにより、決定することを可能にする。
本発明は、本明細書中の上述の例に限定されるものではなく、添付の特許請求の範囲により提供される定義の範囲内にある限り、多くの変形が可能である。
よって、たとえば、ステップ22で、病変のインピーダンスの1つのモデルを選択することが可能である。この場合、多くのモデルに関する最適化を行う必要がない。よって、本方法は、この場合ではより単純になり、実施することが速くなる。特に、あるモデルがより関連性があるとみなされる場合、この方法で進めることが可能である。
さらに、記載される一部の例では、組織/物質の区別は、計算した実効キャパシタンスと、あらかじめ確立した値との上記キャパシタンスとの比較に本質的に基づく。しかしながら、変形として、病変のインピーダンスの選択したモデルのパラメータと、組織/物質の区別を行うことが可能である。しかしながら、実効キャパシタンスの値の正確な比較は、単純であり、かつ組織/物質の信頼性のある区別を可能にする。
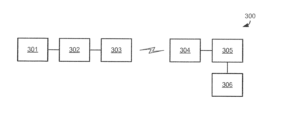
図19は、本開示の態様により作成されたシステム300の例を示す。本システムは、測定モジュール301を含み、これは埋め込まれた装置、たとえば、ステントの一部であってもよく、または細胞のin vitroでの培養のための装置の一部であり得る。
測定モジュールは、少なくとも2つの電極を含み、図11に準拠して上述された通りであり得る。
またシステム300は、たとえば、測定モジュール由来のデータからインピーダンススペクトルを作成するように構成されている内部処理部302を含む。
システム300は、測定がin vivoで行われる場合に身体の外にあり得る、レシーバー304に、データ(測定モジュール301からのデータおよび/または内部処理部302により決定されるインピーダンススペクトル)を無線で伝送するためのエミッタ303を含み得る。この伝送は、任意の無線プロトコル、たとえば、特に無線または赤外線の、RFID、NFC、Bluetooth(登録商標)、WiFiの下で行われ得る。一部の実施形態では、この伝送は、1つ以上の有線および/または無線のローカルネットワークおよび/またはインターネットを含む広域ネットワークを介した伝送を含み得る。
システム300は、インピーダンススペクトル(エミッタ303から、測定モジュール301からのデータを受信する場合)、および/または受信したデータに基づく様々なパラメータおよび実効キャパシタンスCeffをコンピュータ処理するための外部処理部305と、参照データとCeffを表す値の比較に基づき決定された細胞の種類および/もしくは条件に関連する情報を表示させるためのLCDスクリーンなどの表示手段306とを含み得る。様々なパラメータおよび実効キャパシタンスを決定するために、外部処理部305は、インピーダンスに関する1つ以上の等価回路モデルに関する情報を伴い構成されてもよく、上述の方法などの、モデルの少なくとも1つのパラメータを決定し得る。また、外部処理部305は、上述のように実効キャパシタンスを決定するモデルとしての、モデルのパラメータの決定後に、モデルの1つを選択するように構成され得る。外部処理部は、等価回路モデルとインピーダンススペクトルとの間の適合の度合に基づく選択を行ってもよい。本システムは、これによって同定された細胞の少なくとも1つの種類および/または条件に基づき、治癒プロセスの展開を表す情報、たとえば、ある手法(ステントなどのインプラントの位置決めを含む)が行われ、かつ/または治癒応答もしくは瘢痕化応答などのある領域(たとえば、組織)における手法に対する応答を反映し得る当該領域の状態の経時的な変化に関する情報を提供する、当該領域の現在の状態に関する情報を提供し得る。
外部処理部は、上述の外部処理部の作動を行うように特に構成された、ASIC、EEPROM、または他の構成要素などの専用のハードウェアを含む特定用途の装置であり得る。他の実施形態では、外部処理部は、ラップトップ型もしくはデスクトップ型のパーソナルコンピュータ、サーバ、スマートフォン/携帯電話、個人情報端末、タブレットコンピュータ、またはモバイルコンピュータ装置を含む他のコンピュータ装置などの汎用装置であり得る。外部処理部が汎用装置を伴い実施される場合、汎用装置は、1つ以上のプロセッサ、およびプロセッサにより実行するための符号化された命令を有する非一過性のコンピュータ可読記憶媒体(たとえば、命令レジスタ、オンチップキャッシュ、メモリ、ハードドライブ、光学媒体などのリムーバブルメディア)を含んでもよく、この命令は、プロセッサに、外部処理部で実行される上述の作動を行わせる。内部処理部は、一部の実施形態では、処理機能を伴う任意の適切なICチップまたは他のハードウェアの構成要素であり得る。外部処理部および内部処理部は、たとえば、外部処理部がサーバで実施され、データを1つ以上のネットワークまたはインターネットを介して伝送する場合に、互いに近位(たとえば、同じ部屋の中または5フィート以内)に配置されていてもよく、または離れて(たとえば、ビルディングもしくは複合ビルディングの異なる部分に)配置されていてもよく、または互いに地理的に遠くに(たとえば、数マイル離れて)配置されていてもよい。
変形として、図20に示されるように、処理の一部は、データを、たとえば、インターネットを介して伝送する遠くのサーバ310で、行われる。
例
図25Aは、3つの細胞の種類、すなわち血小板、平滑筋細胞、および内皮細胞をそれぞれ含む細胞構造に関して測定されたインピーダンススペクトルの振幅および位相の集合を示す。
比較の例
第1に、R0Cmix(Cmixキャパシタンスと並列なR0抵抗)と直列な溶液抵抗と直列な二重層のキャパシタンスCdlからなる、CPEを用いない等価回路モデルを使用する。
次に、複素インピーダンスに関する細胞層の影響を説明するCmixパラメータをコンピュータ処理する。
2つの細胞種に関するCmixの分布の結果を図26Aに示す。2つの細胞種間を区別することが可能である。第3の細胞種を加える場合、3つの細胞種は、図26Bに示すように、これ以上区別することができない。
より洗練された手法を使用し、CPE要素を等価回路モデルに組み入れ、たとえば、図8Aに示されるモデル34を使用する場合、本システムを説明する6つのパラメータ、すなわち、R0、Rinf、Q0、β、Qdl、およびαが存在する。
これらのパラメータは、等価回路モデルのインピーダンスが、図25Aにおける実験上のインピーダンススペクトル曲線に最良に適合するように、コンピュータ処理することができる。
次に、図27Aから図27Fに示すように、3つの細胞種に関するこのパラメータ分布を、各パラメータに関して表示することができる。
各パラメータに関して、3つの細胞種を明確に区別できず、これらのパラメータの線形的な組み合わせが、探索している細胞の区別を提供できないことがわかる。
本発明に係る例
図28は、上記の式[8]に基づき決定された、3つの細胞種に関する実効キャパシタンスCeffを表す値の分布を示す。
3つの細胞種間の全てを明確に区別することが可能であることがわかる。この精度は、90%超である。細胞間の区別は、図27A~図27Fと比較して、有意に改善している。
等価回路が図8Bの1つの34’である場合、図29のCeff分布を得る。
R0-Rinfを、Rinfと比較して大きいとみなす場合、式[8]は、Ceff=(1-α)/αとして単純にすることができる
結果得られるCeffの分布を、図30に示す。3つの細胞種が、未だ約85%の精度で区別できることがわかる。
図28~図30に示されている分布は、細胞種の決定に関する参照データとして作用し得る。
たとえば、インピーダンススペクトルは、図25Aのインピーダンススペクトルと同様の条件で測定されてもよく、このスペクトルに基づき、パラメータR0、Rinf、Q0、β、Qdl、およびαの値が決定される。この決定は、図8の等価回路モデル34と、振幅および位相のインピーダンス曲線の最小二乗法での適合に基づく決定であり得る。
次に、パラメータの値R0、Rinf、Q0、およびαが公知である場合、実効キャパシタンスCeffをコンピュータ処理し、この値を図28の分布と比較して、何の細胞種が対応しているかを決定することができる。たとえば、低い値のCeff(nF/cm2)は、細胞が第1の種類であることを表し;約50~約100の値は、細胞がタイプ3であることを表し、約100超の値は、細胞がタイプ2であることを表す。
生体構造解析技術の例
上述のように、細胞、組織、ならびに/または病変(細胞および/もしくは他の物質を含む病変を含む)を含む生体構造の実効キャパシタンスは、捕捉したインピーダンス測定に基づき決定されてもよく、生体構造(たとえば、病変の細胞および/または組織)の組成を同定するために使用され得る。しかしながら、本発明者らは、病変の組成を同定するため、または別の方法で病変を特徴づけるために実効キャパシタンスを使用することは、全ての条件下で最も有効な選択肢ではない場合があることを理解している。
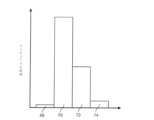
たとえば、病変において異なる細胞種間を区別するために実効キャパシタンスを使用することは、非常に有効であり得(たとえば、95%の正確性を達成し得る)、ここで各細胞種の測定は、制御した条件下(たとえば、同じ温度条件、同じ流れの条件など)で捕捉されている。制御した条件下の血小板、平滑筋細胞、および内皮細胞について決定された実効キャパシタンスの分布を、図21Aにおいてヒストグラムにより例示する。示されているように、血小板、平滑筋細胞、および内皮細胞の実効キャパシタンスは、重複がほとんどない。特に、血小板の実効キャパシタンスは、通常、平方センチメートルあたり約40ナノファラド未満であり、平滑筋細胞の実効キャパシタンスは、通常、平方センチメートルあたり40~90ナノファラドであり、内皮細胞の実効キャパシタンスは、通常、平方センチメートルあたり90ナノファラド超である。ほとんど重複がないため、実効キャパシタンスを使用して、これらの異なる生体構造間を確実に区別することが可能である。
しかしながら、実効キャパシタンスは、あまり制御されていない条件下または非制御の条件下で異なる生体構造間を区別する場合には、信頼性が少なくなる場合がある。これは、様々な温度条件、様々な流れの条件、または他の変化を含み得る。このような変形は、in vivoでの測定の間に存在し得る。非制御の条件下で血小板、平滑筋細胞、および内皮細胞に関して決定された実効キャパシタンスの分布を、図21Bのヒストグラムに例示する。示されているように、血小板の実効キャパシタンスは、平滑筋細胞の実効キャパシタンスと実質的に重複する。さらに、平滑筋細胞の実効キャパシタンスは、内皮細胞の実効キャパシタンスと実質的に重複する。異なる細胞種の実効キャパシタンス間の重複は、細胞の実効キャパシタンスを使用する細胞区別技術の性能を低減する。
本発明者らは、組織の種類および/もしくは組成、ならびに/または細胞の種類および/もしくは組成などの生体構造の特徴(たとえば、種類および/または状態)を高い信頼性で同定するための技術を開発した。このような技術は、機械学習を利用し得る。たとえば、機械学習は、動物の組織、細胞の集団、病変、または生体物質の他の構造もしくは集合などの生体構造の組成を同定するため、EIS測定を解釈および分類するために使用され得る。生体構造の特徴を同定するために機械学習技術を使用することは、従来の手法と比較して多くの利点を提供する。本明細書中開示の機械学習技術は、いくつかの非制御の条件下で決定した実効キャパシタンスの使用を介した見込みのある結果よりも正確な結果を提供し得る。たとえば、本明細書中記載の機械学習技術を使用して開発した、トレーニングを受けたモデルの一部は、99%の正確性で、一部の生体構造の組成を同定し得る。さらに、生体構造の特徴を同定するためにトレーニングを受けたモデルを使用することは、他の解析技術よりもコンピュータへの負荷を少なくし得る。たとえば、生体構造の組成を同定するためにトレーニングを受けたモデルを使用することは、モデルのトレーニングの間に作成された重み値または他の値を含む、一連の操作および作動の合算(summation)を行うための装置のみを必要とし得る。対照的に、病変の実効キャパシタンスに基づき生体構造の組成を同定することは、インピーダンス測定にモデルを適合させることを含む、インピーダンス測定からの実効キャパシタンスを導くためのコンピュータに負荷をかける処理を行うための装置を必要とし得る。
一部の実施形態では、機械学習技術は、病変(たとえば、血餅)に存在する異なる種類の細胞または組織の相対的な存在量または濃度を同定するために、使用され得る。この方法では、同じ種類ではあるが、相対量または濃度が異なる特定の種類の細胞または物質、たとえば、異なる相対量または濃度の赤血球の血餅を、互いに区別することが可能である。よって、一部の実施形態では、生体構造における特定の生体物質(赤血球などの特定の種類の細胞)の量を同定するために、モデルをトレーニングし得る。同定される物質の量は、物質の特定の体積もしくは質量、または物質の量を表す他の値などの絶対量であり得る。他の実施形態では、同定される物質の量は、生体構造中の他の物質の全体量と比較した量を含む、1つ以上の他の物質の量と比較した量などの、相対量であり得る。たとえば、病変の全体と比較した病変における生体物質(たとえば、赤血球)の量を同定する比が、決定され得る。この比は、体積による比、質量による比、または病変におけるある種の生体物質の量を反映する他の適切な値による比であり得る。
一部の実施形態では、本明細書中記載の機械学習技術は、病変または他の組織を構成するか、またはその一部である異なる種類の細胞または組織の相対量または濃度を定量化するために、使用され得る。たとえば、一実施形態では、血餅が50%の赤血球、30%のフィブリン、および20%の血小板を含むことが、機械学習技術を使用して決定され得る。別の例として、一実施形態は、たとえば、病変の50%が赤血球から構成されているが、病変の他の50%の物質を具体的に同定することはないといった、1種類の物質のみに関する物質の相対量を決定し得る。
さらに本発明者らは、組織および/または細胞の分類に機械学習技術を直接適用することが、不十分な結果をもたらす場合があることを理解しており、機械学習技術を利用する特定の方法の価値を理解している。たとえば、EIS測定のみを伴う機械学習技術を使用してモデルを直接トレーニングすることは、一部の環境では不本意に低くなり得る正確性(たとえば、80%未満の正確性)で、組織または他の生体構造を分類するトレーニングを受けたモデルをもたらし得る。本発明者らは、この不本意に低い正確性は、モデルをトレーニングするために生のEIS測定のみを使用した場合に起こり得、通常の機械学習技術が受信した特性が無関係(たとえば、相関していない)と想定していながら、相関しているEIS測定の振幅および位相のポイントが原因であり得ることを理解している。
本発明者らは、機械学習技術を使用してモデルをトレーニングするために、生のEIS測定に加え派生した特性を使用することが、結果得られるモデルの性能を改善し得ることを理解している。派生した特性は、生のEIS測定の解析(生のEIS測定で行ったコンピュータ処理を含む)から作成された値を含む。このような派生した特性は、たとえば、回収した周波数ポイントのセットの隣接する周波数間といった、周波数間のEIS測定の変化を表す値を含み得る。あるいはまたはさらに、派生した特性は、生のEIS測定上の1つ以上の統計的なコンピュータ処理の性能から生じ得る。使用され得る例となる派生した特性として、EIS測定の位相最大周波数(phase maximum frequency)、EIS測定のn分位数、EIS測定の1次導関数、およびEIS測定の2次導関数が挙げられる。
EIS測定に存在する特性(たとえば、EIS測定から生じる値とは対照的な、EIS測定のセットに含まれており、特性として使用され得るデータ値)に加え、派生した特性を含む特性のセットを使用してモデルをトレーニングすることは、たとえば、最大99%の正確性で、病変における特定の種類の組織を同定できるトレーニングを受けたモデルをもたらし得る。
また本発明者らは、EIS測定データを伴う機械学習の使用が、EIS測定をもたらし得る一部の医療機器の資源の制約により阻まれ得ることを認識している。たとえば、一部の実施形態では、埋め込み可能な医療機器および/または挿入可能な医療機器(本明細書中、他に記載の装置を含む)は、様々な設計の制約のため限定された数のEIS試料(たとえば、10個の試料)で、生体構造の1つ以上の特徴を同定する必要があり得る。このような医療機器は、損傷を引き起こすことのない限定した量の時間でのみ動物の管に留まり、測定が作成され得る時間を限定することにより回収できる試料の数を限定し得る侵襲的プローブ(たとえば、侵襲的プローブ210)を含み得る。さらにまたはあるいは、このような医療機器は、限定した数のEIS測定のみを処理できる限定した処理能力を有するか、または通信測定の帯域幅が限定されるか、または測定の維持のための記憶が限定されるか、または他の資源の制約を受けている場合がある。回収でき、かつ、トレーニングを受けたモデルに提供できるか、またはモデルをトレーニングするために使用できるデータの量に関するこれらの制約は、機械学習技術の有効性を弱体化させ得る。
この困難を認識しているため、本発明者らは、限定した数の試料(たとえば、10個のEIS試料)のみである場合に生体構造の特徴を正確に同定できる機械学習モデルをトレーニングするためのプロセスの価値を理解している。このようなモデルトレーニングプロセスの例を、図22のプロセス2200により示す。モデルトレーニングプロセス2200は、それぞれが多くの試料を含むEIS測定(たとえば、1セットあたり5、10、20、50、100、500、1000個の測定、または1000超の測定)の複数のセット(たとえば、5セット、10セット、15セット、20セット、50セット、100セット、500セット、1000セット、または1000超のセット)を含むトレーニングデータを使用し得る。ここで各試料は、適用した電気信号の特定の周波数でのインピーダンスの関連試料である。EIS測定のセットは、それぞれ、特定の条件のセットの下で、特定の生体試料を特徴づけてもよく、一部の実施形態では、異なるトレーニングセットは、異なる生体構造に対応し得る。トレーニングプロセス2200は、同定した生体試料の特定の特徴の最良の指標を提供し、かつ/または異なる生体構造を最良に区別するデータを提供する、EIS測定の複数のセットにおける特定の周波数を同定しようとし得る。よって、トレーニングプロセス2200は、周波数の特定のセット(たとえば、10個の周波数のセット)に対応するトレーニングデータのサブセットを選択し、トレーニングデータのサブセットを使用してモデルを構築し、トレーニングを受けたモデルの性能を解析して、性能が十分であるかを決定するために、使用され得る。トレーニングを受けたモデルの性能が不十分である場合、新規の、周波数の異なるセットに対応するトレーニングデータのサブセットが選択されてもよく、プロセスが反復され得る。周波数の適切な組み合わせが同定され、対応するトレーニングを受けたモデルが作成された後に、医療機器は、周波数の組み合わせ(たとえば、10個の周波数のセット)に関連するEIS測定を捕捉し、トレーニングを受けたモデルに捕捉したEIS測定を適用するか、または生体構造を区別するために使用し得るトレーニングを受けたモデルから生じる係数(たとえば、重み値)もしくはルールを使用してEIS測定を解釈することにより、1つ以上の特徴を同定し得る。
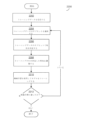
上述のように、図22は、少数の試料(たとえば、10個のEIS試料)に基づき、組織および/または細胞の1つ以上の特徴を同定するためにモデルをトレーニングし得る例となるトレーニングプロセス2200を示す。このモデル作成プロセス2200は、医療機器により行われてもよく、ならびに/または、結果得られるトレーニングを受けたモデルおよび/もしくはトレーニングを受けたモデルから生じる係数もしくはルールを医療機器に対して提供する、医療機器と通信するコンピュータシステムにより行われてもよい。図22に示されているように、トレーニングプロセス2200は、トレーニングデータを受信するブロック2200、トレーニングデータのサブセットを選択するブロック2204、トレーニングデータのサブセットの特性を同定するブロック2206、トレーニングのため同定した特性を調製するブロック2208、機械学習を使用してモデルをトレーニングするブロック2210、および性能目標が達成されたかどうかを決定するブロック2212を含む。
ブロック2202において、システムは、トレーニングデータを受信し得る。トレーニングデータの特定の組成は、同定される所望の特徴に応じて変化し得る。たとえば、モデルは、病変における異なる種類の組織および/または細胞間を区別するためにトレーニングされ得る。この例では、トレーニングデータは、EIS試料(たとえば、1セットあたり100個の試料)の複数のセット(たとえば、20セット)を含み得る。EIS試料のセットは、それぞれ、特定の条件下で、同定される特定の種類の組織および/または細胞(たとえば、血小板、平滑筋細胞、および内皮細胞)に関連し得る。各セットの中のEIS試料は、特定の適用した周波数での、生体構造のインピーダンスの大きさおよび/または位相を表し得る。
ブロック2204において、システムは、トレーニングを1回反復する間にモデルをトレーニングするために使用するトレーニングデータのサブセットを選択し得る。トレーニングデータのサブセットは、EIS測定の複数のセットを含み得、より具体的には、各セットで、本来入力したセットと比較されるEIS測定のサブセットを含み得る。これらのサブセットは、たとえば、適用した信号の特定の周波数のみに関するEIS測定を含み得る。
その後、同定したトレーニングデータのサブセットは、ブロック2206~ブロック2210においてモデルをトレーニングするために使用され得る。結果得られるトレーニングを受けたモデルの性能が適切な性能目標と一致しない場合、システムは、ブロック2204に戻り、以前に決定したトレーニングデータのサブセットとは異なる新規のトレーニングデータのサブセットを決定し得る。たとえば、トレーニングデータの第1のサブセットは、周波数f1、f2、およびf3に対応する試料のセットのそれぞれからのEIS測定を含み得る。この例では、その後、システムは、このトレーニングデータのサブセットを使用してトレーニングされたモデルの性能が不十分であったことを決定し得る。よって、システムは、ブロック2204に戻り、周波数f1、f3、およびf5に対応する試料のセットのそれぞれからのEIS測定を含み得るトレーニングデータの第2のサブセットを選択し得る。
少なくとも一部の状況では、測定データは、ノイズの存在により少なくとも部分的に歪み得ることを理解すべきである。よって、データに及ぼすノイズの作用を統計的に軽減するために、生体物質は、センサを使用して何度もサンプリングされ得る。たとえば、生体物質は、少なくとも3つのスペクトルが3秒未満で得られるか、少なくとも5つのスペクトルが3秒未満で得られるか、または少なくとも10のスペクトルが3秒未満で得られるように、サンプリングされ得る。複数のスペクトルを使用することにより、モデルの確実性の度合が上がり得る。
また、システムが、トレーニングデータのサブセットを同定するための様々な技術のいずれかを使用し得ることを理解すべきである。一部の実施形態では、システムは、無作為に、トレーニングデータのサブセットを選択し得る。たとえば、システムは、周波数のセットを無作為に決定し、無作為な周波数のセットに対応するトレーニングデータから測定を選択し得る。他の実施形態では、システムは、遺伝的アルゴリズムを使用してトレーニングデータのサブセットを知的に選択し得る。遺伝的アルゴリズムは、たとえば、以前の反復における以前のトレーニングデータのサブセットを使用した、トレーニングを受けたモデルの性能を考慮してもよく、性能目標を達成しなかったとシステムがブロック2212で決定する場合に適用され得る。
ブロック2206では、システムは、モデルをトレーニングする際に使用するためのトレーニングデータのサブセットにおける特定の特性を同定し得る。システムは、たとえば、特性としてトレーニングデータのサブセットにおけるEIS測定を同定し得る。またシステムは、EIS測定から生じる1つ以上の派生した特性を決定し得る。たとえば、システムは、トレーニングデータのサブセットにおけるEIS測定の1次導関数および/または2次導関数を決定し得る。1次導関数および2次導関数は、各測定のセットに関してサブセットの中で計算されてもよく、特定のセットの中で、EIS測定に基づく導関数として計算され得る。たとえば、測定セットが10個の試料を含む場合、システムは、測定セットにおいて隣接している周波数間の振幅または位相(または別個の値としてその両方)の変化としての、値の各対に関する1次導関数を計算し得る。この場合、2次導関数が、1次導関数のセットの隣接した値の間の(1次導関数の性質に応じた、振幅または位相の)変化として計算され得る。別の例として、システムは、トレーニングデータのサブセットにおけるEIS測定の位相最大周波数および/またはn分位数を決定し得る。n分位数は、曲線下面積をn等分(またはほぼn等分)のサブセットに分ける値であり得る。たとえば、ある周波数範囲にわたりインピーダンスの大きさを定義する曲線を、n等分(またはほぼn等分)のセクションに分けてもよく、セクション間の区分を示す特定の周波数を、派生した特性として使用してもよい。
ブロック2208では、システムは、モデルをトレーニングする際に使用するための同定した特性を調製し得る。データを調製することは、ノイズを除去すること、冗長な情報を除去すること、および/またはデータをフォーマットすることなどの、様々な機能を含み得る。たとえば、システムは、同定した特性を正規化してもよく、および/または主成分分析(PCA)を使用して同定した特性の主成分を同定してもよい。
ブロック2210では、システムは、少なくとも1つの機械学習技術を使用して、同定した特性を伴いモデルをトレーニングし得る。たとえば、サポートベクターマシン(SVM)技術、人工ニューラルネットワーク(ANN)技術、k近傍法(kNN)技術、または決定木学習技術を含む様々な機械学習技術のいずれかが、使用され得る。
ブロック2212では、システムは、ブロック2210で作成したトレーニングを受けたモデルが1つ以上の性能目標に一致するかどうかを決定し得る。たとえば、システムは、機械学習モデルの性能を評価するために、トレーニングデータおよび/または試験データを使用して機械学習モデルを試験し得る。性能を評価することは、たとえば、既知の種類の病変と、病変に関するEIS測定のセットに基づく病変の診断を比較することなどの、所定の入力のセットに関して作成された出力を、これらの入力に関して予測された出力と比較することを含み得る。このような比較は、トレーニングの反復を1回または複数回行い、反復して作成されたモデルに基づき、トレーニングを受けたモデルの正確性を表す値を作成し得る。性能目標は、たとえば、正確性の値の最小値を含み得る。トレーニングを受けたモデルが性能目標と一致しないかまたは性能目標を超えない場合、システムは、ブロック2204に戻り、新規のトレーニングデータのサブセットを選択し得る。上述のように、一部の実施形態では、性能目標が一致しない場合、新規のサブセットを選択し作成する特定の測定を決定するためにブロック2204に戻る際に、システムは、ブロック2204で作成される周波数の選択を経時的に学習するために、遺伝的アルゴリズムを使用し得る。たとえば、システムは、複数の、特定の測定の見込みのある組み合わせと共に開始し、特定の測定の各組み合わせの性能を評価し得る。この例では、特定の測定のうち最も悪く行われた組み合わせを、考察から除外してもよく、特定の測定のうち最良にランク付けされた組み合わせをまとめて、新規の特定の測定の組み合わせを形成してもよい。この、特定の測定の組み合わせの性能を試験するプロセスは、特定の測定のうち最も悪く行われる組み合わせを除外し、上位で行われた特定の組み合わせをまとめることが、適切な特定の測定が同定されるまで反復され得る。しかしながら、他の実施形態では、無作為の選択プロセスが、ブロック2204で使用され得る。
また他方で、性能目標と一致するかまたはこれを超えている場合、システムは、モデルのトレーニングが成功していると決定し、プロセス2200が終了する。
プロセス2200の後に、生体構造間の適切な区別を提供するEIS測定のため使用する周波数の特定のセットが同定され、これらの周波数を使用して生体構造を区別するために、モデルがトレーニングされた。この周波数およびモデルは、プロセス2200の後に保存され得る。さらに、医療機器(本明細書中、他に記載の埋め込み可能な装置および/または挿入可能な装置を含む)は、これらの周波数での生体構造のインピーダンスを測定するように構成されてもよく、システム(医療機器自体、または図2に関連して上述されたものなどの別のコンピューティング装置と組み合わせた医療機器)は、同定または特徴づけを行うためにEIS測定を解析するように使用され得るトレーニングを受けたモデルおよび/またはトレーニングを受けたモデルから生じる係数もしくはルールを使用して、生体構造を同定するか、生体構造の組成を同定するか、またはあるいは生体構造を特徴づけるように構成され得る。
当業者は、モデルをトレーニングするための一部の技術において、モデルは、入力から特定の出力をもたらすコンピュータ処理に使用するための様々な重み値または他の値(係数とも呼ばれ得る)を学習することを理解するであろう。このような場合、これらの重み値のセットは、重み値を使用した入力で行われるコンピュータ処理に関する情報と共に、モデルを表すと言うことができる。よって、一部の実施形態では、図22のプロセス(またはトレーニングを受けたモデルをもたらす本明細書中記載の他のプロセス)の結果として、装置によるその後の使用のために装置を設定するために使用できる重み値のセットが作成される。たとえば、図22のプロセス2200の結果としてトレーニングを受けたモデルは、病変に関するEIS測定から決定された入力した特性に基づき、病変(または他の目的の生体構造)を同定および/または分類することを可能にするモデルをもたらし得る。このモデルは、特性から病変の1つ以上の特徴を同定することを可能にする重み値のセットとして表され得る。これらの重み値を使用してコンピュータ処理を行うように装置を設定することにより、当該装置は、たとえば、EIS測定および重み値から数値を作成し、この数値が特定の特徴または特徴のセットと一致すると決定することにより、入力した特性に基づき特徴を作成することができる。このようなコンピュータ処理を行うことは、特徴を作成するために入力した特性で行われ得る他の形態の解析よりもコンピュータに負荷をかけなくてもよく、よって、代替策よりも時間または処理するリソースの要求を少なくし得る。
プロセス2200に代わる様々な代替策を、本開示の範囲から逸脱することなく作成し得ることを理解すべきである。上述のプロセス2200では、ブロック2206において、特性の同じセットを、選択したトレーニングデータのサブセットに基づき、各反復で選択した。一部の場合で、この特性のセットは、どのトレーニングデータのサブセットを選択するかに関わらず性能目標に達するには不適切である場合があり、またはより正確な解析を提供し得る特性のセットが存在し得る。一部の実施形態では、プロセス2200は、モデルをトレーニングするために使用されるトレーニングデータの特定の部分を最適化または改善することに加え、モデルをトレーニングするために使用される特定の特性を最適化またはあるいは改善し得る。たとえば、システムが、トレーニングを受けたモデルが行為2212で性能目標に一致しないと決定した後、またはシステムが、トレーニングを受けたモデルが性能目標に一致しないかまたはこれを超えない性能プラトーに達した(または性能が目標に一致またはこれを超える場合であっても性能プラトーに達した)と決定する場合、システムは、トレーニングデータのサブセットを変えることに加え(またはこの代わりに)、ブロック2210においてモデルをトレーニングするために使用される特定の特性を変化させ得る。特性の選択は、測定の値の選択に関連して上述したように、同様の遺伝的アルゴリズムにより駆動され得る。よって、システムは、所望の性能をもたらす特性の組み合わせが同定されるまで、複数の、異なる特性の組み合わせを介して反復し得る。
10個のEIS測定に基づき様々な細胞種間を区別するトレーニングを受けたモデルを作成するために、プロセス2200を使用することから得た例となる結果を、図23および図24の混同行列により示す。これらの混同行列は、試料の特定のクラスに適用したモデルの結果を直接視覚化できる表である。行列の各行は、予測したクラスの例を表し、各列は、実際のクラスの例を表す。対角線の値は、モデルが、標識したクラスを正確に予測する場合を表している。対角線で示された値は、対応する標識したクラスが正確に予測される確率を表している。非対角の値は、モデルが互いにクラスを混同する場合を、対応する確率と共に表している。このモデルは、以下の5つのクラス:1-ウシの大動脈内皮細胞(BAEC)、2-ウシの大動脈平滑筋細胞(BAOSMC)、3-血小板、4-空、5-中間物質の間を区別するためにトレーニングされた。図23は、トレーニングデータのトレーニングを受けたモデルへの適用からの結果を示しており、図24は、試験データのトレーニングしたデータへの適用の結果を示している。
一部の実施形態では、図4の細胞区別法10は、スペクトルを通した連続または偽連続の測定を行うよりも、EIS測定を行う特定の周波数で構成され得る。この特定の周波数は、解析する際に、異なる生体物質間で最も明確な区別を提供するインピーダンス値を作成する周波数であり得る。一部の実施形態では、最も明確な区別は、スペクトル間でほとんど重複しないインピーダンススペクトルであってもよく、他の実施形態では、最も明確な区別は、生体物質を同定するために使用され得る値または値の範囲における最小の重複または類似性であり得る。たとえば、実効キャパシタンスを決定し、生体物質を同定するかまたは生体物質の1つ以上の特徴を決定するために使用する一部の実施形態では、最も明確な区別は、異なる種類の生体物質に関連する実効キャパシタンスに関する値または値の範囲における最小の重複または類似性であり得る。
図24Aは、真の標識が行として示されており、予測した標識が列として示されている別の混同行列を例示する。この場合、4つのクラス:「empty」、「mix」、「red」、および「white」を考慮した。各クラスは、異なる種類の血餅を表している。たとえば、クラス「red」は、赤血球の多い血餅の一種を表しており、クラス「white」は、フィブリンの多い血餅の一種を表しており、クラス「mix」は、フィブリンおよび赤血球の多い血餅の一種を表しており、クラス「empty」は、血餅が存在していない場合を表す。3000個のEIS測定に基づき作成された行列で示す場合、クラス「red」の血餅は、100%の確率でトレーニングを受けたモデルにより予測され、クラス「white」は、94.5%の確率などで予測された。対照的に、「white」と標識された血餅は、10.5%の確率で、「mix」と誤って予測され、「mix」と標識された血餅は、5.5%の確率で「white」と誤って予測された。図24Aの行列を作成するために使用されたEIS測定のデータセットを、図25Bに示す。上部のチャートは、異なるクラスに関するインピーダンスの振幅vs周波数を表すデータポイントを例示する。下部のチャートは、異なるクラスに関するインピーダンスの位相vs周波数を表すデータポイントを例示する。
図22を、入力したインピーダンス測定に基づき生体構造の特徴を決定するため、および/またはこの特徴を決定するための学習の一部として周波数/特性を決定するためにモデルをトレーニングする手法と関連して説明したが、実施形態は、インピーダンス測定と生体構造の1つ以上の特徴との間の関係を学習するための図22のプロセスの使用に限定されると理解すべきではない。たとえば、図15Cと関連して以下でさらに論述するように、一部の実施形態では、生体構造に関するインピーダンス測定と、生体構造に関して勧告される治療(たとえば、生体構造が病変である場合の病変に関する治療)との間の関係を学習するために、モデルをトレーニングし得る。一部のこのような実施形態では、図15Cと関連して論述するように、システムは、生体構造を同定または特徴づける中間のステップを行うことなく、装置により検知された生体構造に関する治療勧告を決定するために、本明細書中記載される装置により回収されたインピーダンス測定を使用し得る。このような実施形態では、インピーダンス測定と治療勧告との間の関係を学習するためにモデルをトレーニングすることは、図22により論述されるように、周波数および/または特性を同定することを含み得る。さらに、本明細書中、他で論述されるように、インピーダンス測定に基づき治療勧告を作成するこのような実施形態は、勧告の種類の中でも特に、治療の選択肢のセットのうち使用する治療の選択肢(たとえば、使用する異なるツール)の勧告、この治療の選択肢を行う方法(たとえば、治療の実行の前および/または間に作成される、ツールを作動させる方法)の勧告、または治療しない勧告である治療勧告を作成し得る。
医療機器を作動させる方法
医療機器、センサ、および病変の組織/物質を検知する方法の例を、図2~図11に関して上記により詳細に記載している。このような医療機器により実施され得、および/または医療機器を作動させて行うことのできる技術の例を、図12~図16に関連させて以下に記載する。
図12は、たとえば、本明細書中記載の一部の技術にしたがい作動する医療機器により行われ得るプロセス1200を例示する。図12の例の医療機器は、侵襲的プローブが、1つまたは2つの電極を含み得る1つのセンサのみを含み得る医療機器であり得る。上記の論述から明らかであるように、病変に関する限定した量の情報が、(図3の例における)侵襲的プローブに沿って配置した複数のセンサと比較する場合に、1つのセンサから決定され得る。図12の例では、侵襲的プローブのセンサは、治療装置、たとえば、吸引カテーテルおよびステント型血栓回収器、および/または吸引カテーテルもしくはステント型血栓回収器の挿入前に挿入されるガイドワイヤなどの治療装置に、配置され得る。医療機器は、センサを使用して決定した病変の特徴に基づき治療勧告を作成し得る。
プロセス1200はブロック1202で開始し、ここでガイドワイヤに取り付けられたセンサは、センサに近位の病変の1つ以上の特徴を検出するように作動する。プロセス1200の開始の前に、センサが一部であるガイドワイヤの侵襲的プローブを、動物の血管系に挿入し、予測した病変の位置の近位に移動させてもよい。次に、いつセンサが病変と接触するかを検出するように、センサを作動させる。病変の接触は、センサにより出力された値の経時的な変化を評価することにより、決定され得る。たとえば、センサは、血液と接触する際の1つの値を出力してもよく、これはセンサが病変により阻害されていない領域の血管の中央に配置されている場合であり得る。侵襲的プローブが病変と接触するまで前に移動する場合、センサにより出力された値は、接触がなされた後に変化し得る。この方法では、病変の位置は、1つのセンサを使用して決定され得る。さらに、場合により、センサは、たとえば、センサがもはや病変と接触しなくなり、出力した値が接触した血液に関連した値に戻るまで侵襲的プローブを進め続けることにより、病変の長さを決定するように作動し得る。
図12の例では、1つのセンサのみを使用すると、医療機器は、病変の組成に気づかない場合があり、どの治療の選択肢が特定の病変を治療するために最良であり得るかに関する治療勧告を作成できない場合がある。しかしながら、この医療機器は、治療の進行または成功に関する情報をもたらすことが可能であってもよく、選択した治療の選択肢が成功理に行われたかどうかを決定するために使用され得る。この情報に基づき、医療機器は、行われている治療を別の治療に変えるべきかどうかに関する治療勧告を作成し得る。
図12などの実施形態で実施され得る1つの治療プロトコルでは、吸引カテーテルを、病変の治療に関する第1の選択肢として使用し得る。よって、ブロック1204では、吸引カテーテルが、ガイドワイヤの侵襲的プローブの近位に位置し、よって、病変の近位に位置するまで、血管系に挿入される。一部の実施形態では、ガイドワイヤは、最初に挿入されなくてもよく、むしろ、吸引カテーテルが、ブロック1202で、病変の近位に配置されるまで挿入され得る。このような場合、センサは、吸引カテーテルの構成要素であり得る。実施形態はこの形態に限定されるものではない。
ブロック1204において、病変の近位に吸引カテーテルを配置した後に、吸引カテーテルを作動して、カテーテルに病変を吸引しようと試みる。一定時間の後、ガイドワイヤおよび/または吸引カテーテルのセンサを、吸引カテーテルが病変に効果を有しているかどうかを決定するために作動させてもよい。硬質の病変などの一部の病変は、吸引カテーテルを使用して吸引できない場合がある。これらの病変のため、他の介入(ステント型血栓回収器など)を使用し得る。よって、ブロック1204では、吸引する試みのための吸引カテーテルの作動に加えて、センサを、病変に変化がみられたかどうかどうかを決定するために作動させてもよい。これは、たとえば、吸引開始前にセンサを病変の中、たとえば、吸引カテーテルに最も近い病変の一部などにセンサを配置し、一定時間の後に、センサが出力した値が、センサがもはや病変と接触していない(むしろ、たとえば、血液と接触している)ことを表すかどうかを決定することにより、行われ得る。
吸引カテーテルの作動の間(および恐らくは当該作動の結果として)、センサが病変ともはや接触していない場合、病変を吸引しているとの決定が、ブロック1206で行われ得る。この場合、吸引カテーテルが病変の治療を成功させていると思われること、および吸引カテーテルの連続した作動が勧告されることを表す治療勧告が、作成および出力され得る。図12の例では、その後プロセス1200が終了する。しかしながら、一部の実施形態では、適宜変更が勧告され得るように、吸引カテーテルが病変を成功して治療し続けているかどうかに関する連続的な決定が経時的に行われ得ること、またはいつ病変が完全に吸引されたかの決定が行われ得ることを、理解すべきである。
しかしながら、センサにより出力された値が、吸引の間変化しておらず、吸引が病変に関する効果を有していないことを表す場合に、吸引カテーテルがもはや勧告されず、代わりに、別の治療の選択肢が勧告される治療勧告が作成および出力され得る。図12の例では、病変の治療に関する第2の選択肢は、ステント型血栓回収器であり得る。よって、ブロック1208では、ステント型血栓回収器を使用する勧告が出力され得る。ブロック1210では、ステント型血栓回収器は、ステント型血栓回収器で病変を除去することにより当該病変を治療するように、作動し得る。たとえば、ステント型血栓回収器は、病変の近位に位置するまで挿入され得る。一部の実施形態では、上述のように、検出が行われるセンサは、ガイドワイヤの構成要素であってもよく、治療装置と離間していてもよい。このような場合、ステント型血栓回収器は、吸引カテーテルの除去の後に、ステント型血栓回収器が病変の近位に配置されるまで、ガイドワイヤに沿って挿入され得る(またはガイドワイヤの除去の後に、ガイドワイヤに沿って挿入されたマクロカテーテルに沿って挿入され得る)。別の例として、センサは、ステント型血栓回収器と一体化していてもよく、いつステント型血栓回収器が病変の近位に配置されるかを検出し得る。医療機器は、センサを使用してもたらされる値を介して、病変を除去するためのステント型血栓回収器の配置に関する治療勧告を作成し得る。たとえば、センサは、上述のように、いつ侵襲的プローブが病変を通過したか、および侵襲的プローブの遠位端が病変の裏側に配置されたかを検出するために、使用され得る。ステントを用いて病変を完全に捕捉したことの確実性を支援するために、ステントの一端が病変を越えて突き出るように、病変を横断してステント型血栓回収器のステントを配置することが最良であり得る。よって、病変の裏側を検出するようにセンサを作動させ、ステントまたはセンサが病変に及ぶまでステント型血栓回収器を挿入すると勧告することにより、ステントの適切な配置に関する治療勧告が作成され得る。
ステント型血栓回収器を、ブロック1210で病変を除去するように作動させた後、プロセス1200は終了する。
図13は、別の実施形態に係る、病変に関する治療勧告を作成するために医療機器を作動させる方法の例を例示する。図13の実施形態では、侵襲的プローブは、上述の図3の例などの、プローブの外側に沿って配置された複数のセンサを含み得る。上記から当然理解されるように、このようなセンサの配置を用いて、病変の組成を含む、病変のいくつかの異なる特徴が決定され得る。病変の組成は、異なる組織もしくは細胞などの病変に存在する異なる生体物質、またはプラーク状の物質などの他の生体物質を表し得る。一部のこのような実施形態では、たとえば、各センサ(たとえば、各センサの2つの電極)は、病変の生体物質と接触してもよく、ここで一部のセンサは、他のセンサよりも病変の異なる生体物質と接触している。次に、各センサは、本明細書中記載の技術にしたがい、センサが接触した生体物質のインピーダンススペクトルを決定するように、作動され得る。次に、このインピーダンススペクトルのセットを使用して、たとえば、病変に存在する異なる生体物質を同定することにより、病変の組成が決定され得る。この組成の情報は、病変に関して組織学的検査を行うことから決定され得る情報と類似していてもよい。病変に関する異なるインピーダンススペクトルおよび/または病変に存在する異なる生体物質(たとえば、異なる組織もしくはプラーク状の物質)の同定から、全体としての病変の特徴が、たとえば、病変の種類を同定(たとえば、診断)することにより、決定され得る。
たとえば、病変の異なる生体物質に関するEISプロセスを行うことにより、以下の細胞または組織:血小板、フィブリン、血栓、赤血球、白血球、平滑筋細胞、弾性線維、外弾性板、内弾性板、疎性結合組織、内皮細胞、または他のいずれかの組織の内膜、中膜、もしくは外膜のいずれかが病変に存在するかどうかが、決定され得る。さらに、病変にEISプロセスを行うことにより、存在する細胞または組織のそれぞれの相対的な量が決定され得る。単純な例として、病変が、50%の赤血球、30%のフィブリン、および20%の血小板から構成されていることが決定され得る。この情報から、病変は、たとえば、この病変を他の種類の病変ではない病変の1種と診断することにより、病変のセットから、1つの特定の種類の病変と分類され得る。
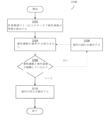
図13のプロセス1300は、ブロック1302で開始し、ここで医療機器の侵襲的プローブが動物の対象の血管系に挿入され、病変の組成を含む病変の1つ以上の特徴を検出するように作動する。この組成を含む特徴に基づき、医療機器は、ブロック1304において、勧告する治療の選択肢を選択する。医療機器は、図14~図15Bに関連して後述された技術によるものを含む、任意の適切な方法で治療の選択肢を選択し得る。
選択される治療の選択肢は、病変の組成に基づき選択され得る。たとえば、病変の組成が、血栓よりもむしろ平滑筋組織から構成されていることを表す場合、医療機器は、ステントの埋め込みが、勧告されるべき治療であることを決定し得る。これは、病変が、抽出され得る細胞/物質から構成されておらず、代わりに、血管の中の腫瘍であるためであり得る。別の例として、病変の組成が、軟質の病変、たとえば、新鮮な状態で形成された血栓から作成された軟質の病変であることを表す場合、医療機器は、吸引カテーテルを勧告し得る。これは、軟質の病変は吸引できるためであり得る。さらなる例として、病変の組成が、硬質の病変、たとえば、硬質の血餅であることを表す場合、硬質の病変の吸引の成功の可能性は低いため、医療機器は、ステント型血栓回収器を勧告し得る。
治療がブロック1304で勧告されると、医療機器は、ブロック1306において選択される治療の選択肢の性能をモニタリングし得る。医療機器は、1つ以上のセンサ、たとえば、特徴をブロック1302で決定した1つ以上のセンサ、または治療を行うように作動する治療装置の1つ以上のセンサを使用して、治療をモニタリングし得る。たとえば、一部の実施形態では、ブロック1304の勧告の後に、臨床医は、別の装置を対象の血管系に挿入し得(たとえば、必要に応じて吸引カテーテル、ステント型血栓回収器など)、この他の装置は、本明細書中記載のセンサの配置を有する侵襲的プローブを含み得る。このような実施形態では、医療機器は、他の装置の侵襲的プローブのセンサを使用して、治療の性能をモニタリングし得る。
ブロック1306における治療のモニタリングは、治療の状態および/または進行に関する情報をもたらし得る。たとえば、治療を、吸引カテーテルを用いて行う場合、モニタリングは、病変が吸引された度合、および/または吸引される病変の残存量に関する情報をもたらし得る。この進行は、たとえば、センサと病変の残りの部分を接触させて、残存する病変の度合を決定するために、ある構造(たとえば、図3のステント様メッシュ)を定期的または場合により膨張させる医療機器により、モニタリングされ得る。決定がなされた後に、この構造を取り除き、病変の吸引が続行されてもよい。他方で、治療を、ステント型血栓回収器を用いて行う場合、モニタリングは、ステントが、ステントの膨張の間に病変と合体した度合に関する情報をもたらし得る。たとえば、ステントの外側に沿ってセンサをモニタリングすることにより(たとえば、図3の例のように、ステント上のセンサの配置を用いる)、各センサに対応するステントの各部分が、病変の中で完全に膨張しているかどうかの決定が、行われ得る。この決定は、各センサによりもたらされる値の経時的な変化をモニタリングし、各センサに関する値がいつ変化することを止めたかを決定することによることを含む、任意の適切な方法で行われ得る。各センサが値を変化させることを止めた場合、このことは、病変とステントの間の相互作用がさらに変化することはなく、よって、ステントが病変の中で完全に膨張し、病変がステント周辺で合体していることを表し得る。
このような決定を行うことは、病変の治療の性能に役立ち得る。よって、ブロック1308において、治療の状態に関する情報が、臨床医に提示するため、ユーザインターフェースを介して医療機器により出力される。さらに、ブロック1310において、医療機器は、治療を行う方法に関する1つ以上の治療勧告を作成し得る。たとえば、医療機器が、病変が上述のようにステント型血栓回収器の作動の間にステントと完全に合体したと決定する場合に、医療機器は、ステントの抜き取りを開始する治療勧告を出力し得る。
治療が成功して行われた後、プロセス1300は終了する。
治療をモニタリングする一例を、治療勧告を作成する状況下で提供しているが、同様の技術を使用して、治療の状態に関して臨床医にエラーメッセージまたは他のメッセージをもたらし得ることを理解すべきである。たとえば、治療装置のセンサが、センサがもはや病変を検出しなくなった後の時間に病変の存在を表した場合、医療機器は、治療装置が不適切に配置されていること、または病変が消失したことを決定し得る。これは、装置が再度配置される必要があるか、または恐らくはより問題を生じるように病変が塞栓症となったことを表し得る。ユーザインターフェースを介した臨床医へのメッセージは、このような潜在的な問題を表し得る。
さらに、図13の例は、最初の治療の選択に関連し、かつその後の当該治療を行う方法に関連する治療勧告を提供するために医療機器を作動させる方法を記載したが、実施形態がこれに限定されないことは、上記から理解すべきである。たとえば、一部の実施形態では、医療機器は、本明細書中記載の1つ以上のセンサを含んでもよく、この装置を使用するための最初の勧告を作成することなく、当該装置の作動方法に関する治療勧告をもたらすように作動し得る。たとえば、ステント型血栓回収器または吸引カテーテルは、上述のように、治療の状態または性能に関するデータを作成するための1つ以上のセンサを含んでもよく、治療勧告を作成し得る。別の例として、慢性完全閉塞病変(CTO)の治療のためのガイドワイヤは、センサが接触した組織/物質に関する情報を作成してもよく、治療勧告を作成してもよい。CTOの手法では、ガイドワイヤは、固化した血栓が穿刺できない場合に、血管の平滑筋組織またはプラークを介して挿入され得る。センサが接触した組織/物質の検知した特徴に基づき、いつガイドワイヤが、平滑筋組織に接触して配置されたか、および前進できるか、ならびにいつガイドワイヤが内皮組織を通り前進し、病変の裏側の血管内に再度戻るかの治療勧告が、作成され得る。さらに、一部の実施形態では、ガイドワイヤが組織を介して進むよりは、組織を突き刺すリスクに有用であり得る、血管壁の平滑筋組織の厚さまたは他の特徴の1つ以上の測定を行ってもよい。たとえば、測定が、ガイドワイヤの侵襲的プローブの片側にある平滑筋組織の厚さを表す場合、これは、侵襲的プローブが血管壁を突き刺すリスクがあることを表し得る。ガイドワイヤをよりゆっくりと進めるおよび/もしくはガイドワイヤを回収する治療勧告が作成されてもよく、または別の勧告が作成され得る。
当業者は、医療機器が、病変の特徴および/または治療の状態に基づき治療勧告を作成するように構成され得る様々な方法が存在することを、本明細書中の論述から理解するであろう。図14~図15Bは、治療勧告を作成するために使用され得る技術の一例を例示する。
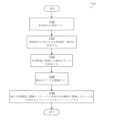
図14は、治療勧告を作成するための一部の実施形態における医療機器により実施され得るプロセス1400を例示する。
プロセス1400は、ブロック1402で開始し、ここで医療機器が病変の1つ以上の特徴を受信する。医療機器は、たとえば、医療機器の侵襲的プローブに含まれる1つ以上のセンサを使用して、および/またはこのセンサによりもたらされるデータに基づき特徴を作成する別の構成要素(たとえば、病変解析設備)により特徴を決定する場合において、医療機器の構成要素から特徴を受信し得る。この特徴は、一部の実施形態では、病変の組成を含み得る。さらにまたはあるいは、特徴は、身体の中の病変の位置、病変の1つ以上の次元(たとえば、長さ、厚さなど)、病変の温度、または上述のセンサの種類に基づき決定され得る他の情報を含み得る。
ブロック1404では、医療機器は、1つ以上の治療の選択肢に関する1つ以上の条件と、ブロック1402で受信した特徴を比較する。医療機器は、複数の異なる利用可能な治療の選択肢に関する情報を伴い構成されてもよく、これらの選択肢は、それぞれ、病変の1つ以上の特徴に関連する1つ以上の条件に関連し得る。たとえば、医療機器は、ステントの埋め込みによる病変の治療のための1つ以上の条件、吸引カテーテルを使用するための1つ以上の異なる条件、およびステント型血栓回収器を使用するためのさらなる1つ以上の異なる条件を伴い構成され得る。病変の組成に関連したこのような条件の例は、図13に関連して上述されている。
医療機器は、どの条件が一致するかを決定するために、複数の条件と病変の特徴を比較し得る。一部の実施形態では、治療の選択肢に関する条件のセットは、1つの病変が条件の1つのセットのみと一致し得、よって、1つの治療の選択肢のみが選択され得るように、相互排他的であり得る。他の実施形態では、条件のセットは相互排他的でなくてもよく、医療機器は、最も対応する条件と一致している選択肢、または対応する条件が最も密接に一致している選択肢(たとえば、条件がある範囲の値に関連している場合、値が、たとえば、当該範囲の中央にあることにより当該範囲に最も密接に一致する条件)を同定することにより、どの治療の選択肢を勧告するかを決定し得る。
ブロック1406において、この比較に基づき、医療機器は、医療機器のユーザインターフェースを介して治療の選択肢の勧告を出力し得、プロセス1400は終了する。
プロセス1400は、病変の特徴に基づき病変の治療に関する最初の治療勧告の作成に関連して記載されているが、当業者は、ブロック1310に関連して上述されるように、治療の性能の間の治療勧告の作成までこの技術を拡張する方法を理解するであろう。たとえば、一部の実施形態では、ステント型血栓回収器のステントを引き抜くための速度などの、治療の特定のパラメータに関する1つ以上の条件と、病変の特徴(たとえば、病変の組成)の比較に基づき、医療機器は、当該パラメータに関する勧告を出力し得る。
当業者は、図14のプロセス1400のようなプロセスに関連して使用され得る治療の選択肢に関する条件を設定する多くの方法が存在することを、理解するものである。たとえば、条件として使用する病変の特徴に関する値は、これらの値、病変の種類、および様々な治療の選択肢での治療の成功の間の対応を決定するために、少なくとも一部の実験の後に医療機器の中へハード・コード化され得る。しかしながら本発明者らは、情報の中でも特に、病変の特徴および病変の治療の成功に関する情報に基づき当該関係および条件を学習するシステムの利点を、認識および理解している。たとえば、機械学習プロセス、たとえば、特性抽出および/または分類を含み得る機械学習プロセスが、一部の実施形態で実施され得る。
図15Aから図15Bは、一部の実施形態で行われ得る機械学習プロセスの例である。図15Aは、医療機器により実施され得るプロセスを例示しており、図15Bは、複数の異なる医療機器と通信するコンピュータ装置(たとえば、サーバ)により実施され得るプロセスを例示する。
図15Aのプロセス1500は、ブロック1502で開始し、ここで医療機器は、病変の特徴に関する情報を作成する。ブロック1504およびブロック1506において、医療機器は、治療の選択肢に関する条件と病変の特徴の比較に基づき治療の選択肢に関する勧告を作成してもよく、治療の進行をモニタリングしてもよく、治療を通して状態の情報を作成してもよい。ブロック1502~ブロック1506のこれらの作動は、図13~図14に関連して上述された方法と同様に実施されてもよく、よって、簡潔にするために、さらに記載することはない。さらに、ブロック1506において、医療機器は、治療の予後に関する情報を作成し得る。治療の予後は、病変の治療が成功したかどうか、病変が対象の身体の中で除去および取り除かれたかどうか、複数の治療が必要であったかどうか、また予後を表す他の情報を表し得る。予後を表す情報は、上記から明らかであるように、医療機器のセンサを使用して作成され得る。たとえば、医療機器のハンドルの加速度計により作成されたデータを使用して、医療機器は、病変を除去するように複数回作動したかどうかを決定し得る。別の例として、上述のように、センサが病変を検出し、その後病変の検出を止めた場合、このことは、病変が除去され塞栓症となったことを含む、病変が対象で移動したことの指標であり得る。
ブロック1508において、ブロック1502~ブロック1506で作成された情報は、インターネットを含む1つ以上の有線および/または無線の通信接続および/またはネットワークを介して、医療機器からコンピュータ装置へ伝送される。コンピュータ装置は、一部の実施形態では、医療機器から地理的に離れていてもよい。ブロック1508では、ブロック1506の伝送の後に、医療機器は、コンピュータ装置から(たとえば、情報がブロック1508で伝送されたネットワークを介して)、治療の選択肢に関して更新された1つ以上の条件を受信する。更新された条件は、病変の特徴に関して条件を評価するための新規の値を同定し得る。医療機器は、それ自体が、たとえば、図14に関連した上述されたもののようなプロセスの状況下での1つ以上の更新された条件の考察を介して、治療勧告の作成のための1つ以上の更新された条件を適用するように設定され得る。医療機器が更新された条件を伴い設定された後、プロセス1500は終了する。
図15Bは、たとえば、図14に関連して上述するようなプロセスを介して、治療勧告の選択に使用するための条件を作成するために、病変の治療に関するレポートの学習プロセスを行うようにコンピュータ装置が実施し得るプロセスを例示する。具体的には、図15Bの例では、コンピュータ装置は、これらの病変の特徴に関する情報に関連して、病変の治療に関するレポートを解析して、治療の成功(および/または失敗)と病変の特徴との間の関係を同定する。このような関係の同定を介して、どの治療の選択肢が特定の種類の病変に最良であるかについての結論を導きだしてもよく、この結論に基づき、治療勧告が、図14の例のように、特定の病変の特徴に基づきこの病変の治療に関して、作成され得る。同様に、上述のように、治療の状態または性能に関する情報に基づき、治療を行う方法(たとえば、ステントの回収の間のステントを引き抜く時間または速度)に関する勧告が決定され得る。図15Bの例は、病変の特徴に基づき病変に使用する治療の選択肢の最初の選択に関する条件を作成する状況下で記載されているが、当業者は、治療を行う方法に関する勧告を作成しながら使用する技術を拡張する方法を、以下の記載から理解するであろう。
本発明者らは、このような条件の作成、および治療の成功/失敗と病変の特徴との間の関係の同定が、好適には、機械学習プロセスを使用して決定され得ることを認識および理解している。様々な機械学習アルゴリズムが、当該分野で公知であり、この状況での使用に適合し得る。一部の機械学習アルゴリズムは、特性抽出および分類技術に基づき作動してもよく、ここで複数のユニットに関するグループ分け(分類)を同定し、ユニットの性質の解析を行い、どの性質および/またはこれらの性質の値が、最も密接に対応しているか、またはグループにおける正確なメンバーシップを予測するかを決定する。これらの同定した性質に基づき、当該性質を有するその後受信した未分類のユニットを、各グループに関する性質/値と、未分類のユニットの性質および/または性質の値の比較に基づき、グループ/分類のうちの1つに「分類」することができる。一部の機械学習の適用では、グループ/分類は、機械学習プロセスの設定の間に手動で同定され得る。さらにまたはその他では、グループ/分類は、たとえば、機械学習プロセスが新規のグループ分けが一部のユニットを良好に特徴づけ得ることをこの解析を介して気づいた場合の新規のグループ/分類の作成を介して、機械学習プロセスにより経時的に決定または調節され得る。機械学習の完全な論述は、本文書の範囲外にあり、本明細書中の技術の理解に必要ではない。当業者は、本明細書中記載の情報および目的で使用するための機械学習技術を実施する方法を理解するものである。
ここで、グループは、治療の選択肢または治療の予後として定義されてもよく、図15Bの例は、この文脈で記載されるものである。この場合、グループは、病変の特徴および/または治療の状態により定義され得る。この場合、病変の特徴および/または治療の状態が、グループの特徴と一致する場合、対応する治療の選択肢が、出力のため選択され得る。さらにまたはあるいは、一部の実施形態では、グループは、異なる種類の病変(各種類は、他の種類とは異なる1つ以上の特徴または特徴の範囲を有する)、ならびに/または治療の状態に関連していてもよく、よって、これらの異なるグループは、特定の治療の選択肢、または治療装置を作動させる方法に関連し得る。この後者の場合、特定の病変または治療の状態に関する特徴があるグループと一致する場合、対応する当該グループの治療勧告が、出力のため選択され得る。
図15Bのプロセス1520は、ブロック1522で開始し、ここで、1つ以上のコンピュータ装置を実施する学習設備が、経時的に、医療機器による病変の治療に関する複数のレポートを受信する。医療機器は、上述の実施形態により作動する医療機器であり得る。レポートは、治療した病変、たとえば、1つ以上の病変の特徴に関する情報を含み得る。またレポートは、病変を治療した方法、たとえば、病変を治療するために作動した1つ以上の治療装置およびこれらの病変を治療した方法に関する情報を含み得る。また、治療の予後に関する情報、たとえば、治療が成功したかどうか、複数の治療が必要であったか、病変が除去され塞栓症となったかどうか、または他の予後といった情報も、レポートに含まれ得る。
このレポートは、上述のセンサの例および情報の種類を含む、医療機器の1つ以上のセンサにより決定される情報を含み得る。上述のように、1つ以上の電気的センサ、機械的センサ、光学的センサ、生体センサ、または化学的センサを含む様々な種類のセンサが、実施形態に含まれ得る。このようなセンサの具体的な例として、インダクタンスセンサ、キャパシタンスセンサ、インピーダンスセンサ、EISセンサ、電気インピーダンス・トモグラフィ(EIT)センサ、圧力センサ、フローセンサ、せん断応力センサ、機械的応力センサ、変形センサ、温度センサ、pHセンサ、化学組成物センサ、(たとえば、O2イオン、バイオマーカー、または他の組成物)、加速度センサ、および運動センサ、が挙げられる。これらのセンサから、様々な種類の特徴または他の情報が作成され得ることを理解すべきである。この情報のいずれかが、治療勧告に関連する条件を作成するため、レポートに含まれていてもよく、プロセス1520で使用され得る。たとえば、上述のように、医療機器のハンドルの中に配置された加速度計が、医療機器の動きを追跡してもよく、複数の治療が血餅を治療するために行われたかどうかを決定するために使用され得る。別の例として、力学的センサ(force sensor)は、ステント型血栓回収器が抜き取られる力を表してもよく、またはインピーダンスセンサのセットが、ステント型血栓回収器のステントの1つ以上のセンサで検出されたインピーダンスが抜き取りの間経時的に変動するかどうかに基づき、病変が、回収の間にステントから部分的または完全に離れたかどうかを決定し得る。当業者は、上記の論述から、このようなレポートに含むための、医療機器のセンサにより作成され得る異なる種類のデータを理解するものである。
また、レポートは、臨床医が入力し得る情報、または医療機器が同時に使用し得る別のシステムから回収され得る情報を含み得る。たとえば、レポートは、病変が、頭蓋動脈、大腿動脈、肺静脈、総胆管、または他の管にあるかどうかなどの、対象の身体構造の中の病変の位置に関する情報を含み得る。この情報は、ユーザインターフェースを介して臨床医が入力してもよく、または、たとえば、血管造影デバイスなどの別のシステムから回収してもよい。
任意選択で、レポートは、年齢、病歴、および人口統計などの、患者についての情報を含み得る。
ブロック1522で受信されたレポートは、地理的に分布していてもよい複数の医療機器から経時的に受信され得る。これらのレポートおよびこれらのレポートの中身を受信することにより、推奨のまたは最良の実務を定義する条件および治療勧告の経時的なセットが作成され得る。
よって、ブロック1524では、学習設備は、病変の特徴(および/または治療装置を作動させる方法)、これらの特徴を有する病変を治療するための選択肢、および治療の成功の間の関係を同定するために、レポートの情報を解析する。この解析に基づき、学習設備は、これらの情報の断片間の関係を学習し得る。このような関係は、いつ特定の治療の選択肢が成功もしくは失敗であったか、またはどの種類の病変に関して異なる治療の選択肢が成功もしくは失敗であるかを表し得る。患者についての情報が得られる実施形態の少なくとも一部では、学習設備は、病変の特徴、これらの特徴を有する病変を治療するための選択肢、および患者の情報に基づく治療の成功の間の関係を学習し得る。このモデルは、患者について得られた全ての情報のうちどの特定の情報の断片が、治療の成功の確率に影響する可能性があるかを学習するように、トレーニングされ得る。たとえば、トレーニングを受けたモデルは、特定の治療が、病変の特徴の全てが等しい場合であっても、患者の年齢に応じて成功の確率が異なる可能性があることを同定し得る。よって、同一の病変を有するが年齢が異なる2人の患者について、異なる治療勧告が提供され得る。別の例として、トレーニングを受けたモデルは、一部の治療が、過去に特定の症状を罹患した対象に適用される場合に、病変の種類が同一である場合であっても、当該症状を罹患していない対象と比較して成功する可能性が低いことを学習し得る。
1524におけるこの解析に基づき、学習設備は(機械学習プロセスの特性抽出および分類のプロセスを介して)、ブロック1526で、治療の選択肢のそれぞれに関する条件を作成する。この条件は、各治療の選択肢で治療が成功し得る病変に関する異なる特徴または特徴の範囲を表すように、病変の特徴に関連し得る。たとえば、1つの範囲の粘弾性が吸引カテーテルを使用した治療に関連し得、かつ別の範囲の粘弾性がステント型血栓回収器を使用した治療に関連し得るように、条件が、病変の粘弾性に関する値の範囲に関連し得る。この方法では、特定の粘弾性を有する病変が検出される場合、これらの条件との比較を使用して(図14のプロセスのように)、どの治療の選択肢が特定の病変に関して勧告されるかを決定し得る。
ブロック1528では、条件がブロック1526で作成される場合、この条件は、医療機器が図15Aと関連して上述のように治療勧告を作成するためにこれらの条件を使用するよう構成され得るように、当該医療機器に分配され得る。条件が分配されると、プロセス1520は終了する。
プロセス1520は、別のプロセスとして図15Bで論述されているが、一部の実施形態では、レポートの受信および条件の決定は、連続的または離散間隔なものを含む、経時的に反復しているプロセスであり得ることを理解すべきである。よって、一部の実施形態では、プロセス1520は、複数回行われてもよく、またはブロック1528での条件の分配の後に、学習設備は、追加的なレポートを受信し学習プロセスを続行するためにブロック1522に戻り得る。
一部の代わりの実施形態では、治療勧告の作成は、上述の種類の1つ以上のセンサから得られた測定データに直接基づき、機械学習技術を使用して行われてもよい。測定データに直接基づき、治療勧告を作成することは、病変または病変の種類を最初に特徴づけるかまたは同定する必要なく、行われ得る。測定データを使用して病変の性質(種類または組成など)を同定し、その後適切な治療勧告を同定する他の手法と比較して、この手法は、病変を特徴づける中間のステップを省略することを可能にする。このことは、治療勧告を作成するために必要とされる時間および計算資源を低減し得る。
図15Cは、治療勧告の選択に使用するための条件を作成するための病変の治療に関するレポートの学習プロセスを行うように、コンピュータ装置により実施され得るプロセスを例示する。この条件は、EIS測定、および/またはEIS測定から決定した特性(たとえば、測定に存在する特性および/または派生した特性)に関連し得る。図15Cのプロセスは、EISの測定または特性と、測定/特性が関連する病変に関する治療との間の1つ以上の関係を同定するようにモデルをトレーニングするために、使用され得る。測定/特性と治療との間の関係を伴い、この方法でモデルをトレーニングすることにより、病変を診断または同定することを必要とせずに、病変に関する治療勧告の作成が可能となり得る。
図15Cのプロセス1540は、ブロック1542で開始し、ここで1つ以上のコンピュータ装置で実行する学習設備は、本明細書中記載の技術を使用して得た測定データを含むレポートを経時的に受信する。測定データの例として、限定するものではないが、EIS測定が挙げられる。各データのセットは、任意の適切な数のEIS試料を含んでもよく、このうちそれぞれが、特定の周波数で得たインピーダンスの情報を表し得る。よって、測定の各セットは、特定の種類の病変のスペクトル応答として解釈され得る。特定の場合では、インピーダンスセンサ以外のセンサを介して得た測定データが、プロセス1540で使用され得る。このようなセンサの例として、インダクタンスセンサ、キャパシタンスセンサ、電気インピーダンス・トモグラフィ(EIT)センサ、圧力センサ、フローセンサ、せん断応力センサ、機械的応力センサ、変形センサ、温度センサ、pHセンサ、化学組成物センサ、(たとえば、O2イオン、バイオマーカー、または他の組成物)、加速度センサ、および運動センサ、が挙げられる。
レポートで受信された測定は、センサが最初に病変と接触した際、または測定を病変に関して回収している際の診断もしくは治療の段階の間に取られた測定を含み得る。このような測定は、病変を同定または診断するために、本明細書中、他で記載の技術により、使用され得る。さらにまたはあるいは、この測定は、治療の間、たとえば、ステント型血栓回収器を使用した病変の抜き取りの間または別の手法の間に回収された測定を含み得る。
また、レポートは、病変を治療した方法、たとえば、病変を治療するために作動した1つ以上の治療装置およびこれらの病変を治療した方法に関する情報を含み得る。また、治療の予後に関する情報、たとえば、治療が成功したかどうか、複数の治療が必要であったか、病変が除去され塞栓症となったかどうか、または他の予後といった情報も、レポートに含まれ得る。
ブロック1542で受信されるレポートは、地理的に分布していてもよい複数の医療機器から経時的に受信され得る。これらのレポートおよびこれらのレポートの中身を受信することにより、推奨のまたは最良の実務を定義する条件および治療勧告の経時的なセットが作成され得る。
よって、ブロック1544において、学習設備は、測定データ、測定データに提示される特徴を呈する病変を治療するための選択肢、および治療の成功の間の関係を同定するために、レポートの情報を解析する。この解析に基づき、学習設備は、これらの情報の断片の間の関係を学習し得る。このような関係は、いつ特定の治療の選択肢が成功もしくは失敗したか、またはどの種類の病変に関して異なる治療の選択が成功もしくは失敗したかを表し得る。
ブロック1544におけるこの解析に基づき、学習設備は(機械学習プロセスの特性抽出および分類のプロセスを介して)、ブロック1546で治療の選択肢のそれぞれに関する条件を作成する。ブロック1546およびブロック1548は、実質的に、図15Bのブロック1526およびブロック1528と同じ方法で作動し得る。
本明細書中、他で論述されるように、図15Cにしたがいインピーダンス測定に基づき治療勧告を作成する一実施形態が、勧告の種類の中でも特に、治療の選択肢のセットの中の使用する治療の選択肢(たとえば、使用する異なるツール)の勧告、この治療の選択肢を行う方法(たとえば、治療の実行の前および/または間に作成される、ツールを作動させる方法)の勧告、または治療しない勧告である治療勧告を作成し得る。
診断および/または治療の間に治療勧告を提供することを含む、病変の診断および/または治療の間に臨床医へフィードバックを提供するための装置およびプロセスの例が、上記に提供されている。一部の実施形態では、このような診断および/または治療の間にフィードバックを提供することに加え、または当該フィードバックの代わりとして、医療機器は、診断/治療における医療機器の作動の後に、診断および/または治療に関する情報を臨床医へ提示するように構成され得る。図16は、このようなプロセスの例を例示する。
プロセス1600は、ブロック1602、ブロック1604で開始し、ここで医療機器は、病変の特徴および治療の性能に関する情報、ならびに治療を行う方法に関する勧告を作成するように、作動する。ブロック1602、ブロック1604の作動は、上述のデータ作成の例と同様であり得る。
ブロック1606では、治療の後に、ブロック1602、ブロック1604で作成された情報は、治療のクロニクルを作成するためにクロニクル作成設備により使用される。治療のクロニクルは、装置がどのように経時的に作動したか、病変の特徴の何が検出されたか、何の勧告が医療機器により作成されたか、およびこれらの勧告に臨床医が従ったかどうかに関する情報を含み得る。たとえば、塞栓症の形成またはその後の治療の必要性をもたらす病変の一部または全体が消失するなどのエラーが治療で検出された場合、クロニクル作成設備は、このエラーを解析してエラーの原因を決定し得る。たとえば、病変の一部がステント型血栓回収器から離れた時間にセンサが、および直前の時間で別のセンサが、ステント型血栓回収器への突発的な力の適用に気づいた場合、クロニクル作成設備は、クロニクルにこのことを指摘する。ステント型血栓回収器へ適用された力が、医療機器からの勧告された力の最大値の勧告(maximum force recommendation)を超えたか、または医療機器が治療勧告と一致しない他のいずれかの方法で作動した場合に、このことが、クロニクルに指摘され得る。このような情報がクロニクルに含まれる場合、将来の手法においてこのエラーを回避する方法に関する勧告が、臨床医に対して作成され得る。
さらに、一部の実施形態では、クロニクル作成設備は、病変の診断において臨床医を支援するために、病変および病変の潜在的な原因に関する詳細な情報をクロニクルに含み得る。たとえば、一部の実施形態では、治療の間、病変の簡潔な特徴が出力され得る(たとえば、病変は粘性である)が、クロニクルにおいて、組成に関するより詳細な情報が出力され得る(たとえば、病変は、主にコレステロールから構成されている)。さらに、クロニクル作成設備は、病変が、たとえば、損傷の結果、病変の部位で発達した血栓、または病変の部位で固着した塞栓症であったかどうかを決定するために、対象の病変の位置の観点から組成を解析し得る。たとえば、病変が、主に平滑筋細胞またはアテロームのような組織から構成されている場合、病変は損傷後にその部位で腫瘍となっている場合がある。別の例では、病変の組成が、高いせん断応力を有する身体構造の領域で形成されたことを表したが、病変が低いせん断応力を有する身体構造の領域に位置している場合、このことは、病変がこの部位に固着した塞栓症であったことを表し得る。
クロニクルがブロック1606で作成されると、クロニクルは、ユーザに提示するために出力され(たとえばディスプレイを介して出力されるか、またはメモリに保存されるか、またはネットワークを介して伝送され)、プロセス1600が終了する。
さらに本発明者らは、本明細書中記載の技術の正確性、たとえば、診断の正確性および/または治療が特定の種類の病変の介入に関して勧告される際の確実性の度合が、モデルのトレーニングに使用されるデータおよび病変で回収され病変の診断または病変を治療する方法の決定に使用されるデータが、病変に対応し他の組織または生体構造に対応しない確実性が増すにつれて、増大することを理解している。
さらに本発明者らは、多くの場合、挿入可能な装置または埋め込み可能な装置が、測定の回収の間に、正しい目的の病変または他の生体構造以外の構造に多く接触し得ることを認識および理解している。さもなければ、これは、多くの場合、1つ以上のセンサを含むプローブが目的の生体構造に隣接または近位に位置している他の生体構造と完全にまたは部分的に接触し得る場合であり得る。たとえば、挿入可能な装置が、血管の病変と接触し、次に当該病変の測定を回収するように作動するまで動物の血管系を介して操作される場合、プローブのセンサが、病変との接触に加え、血管壁と接触し得る可能性が恐らく確実にある。特定の例として、病変を穿刺するかまたは別の方法で病変とのみ接触するよりは、挿入可能な装置は、場合により、センサが病変と接触するものもあり血管壁と接触するものもあるように、病変と血管壁との間に配置され得る。
測定が、目的の生体構造に加え、1つ以上の他の生体構造に関して回収された場合、このような測定は、生体構造を同定もしくは特徴づけるため、または生体構造に関して適切な治療を決定するための、本明細書中記載の技術の正確性に影響を与える場合がある。
よって、本発明者らは、目的の病変または他の生体構造に関連しない測定を除去するために、本明細書中記載の方法により回収されたEIS測定をフィルタリングするための手法を開発した。より具体的には、本発明者らは、病変に関連しない測定を除去または少なくとも測定の数を減らすために回収したデータをフィルタリングすることは、病変の特徴を正確に特徴づけ、および/または病変の治療に関する適切な勧告を提供するモデルの特性を有意に増大させ得る。(他の構造に対応する測定を減らすことなく、または減らして)フィルタリングしたデータはまた、上述の方法のいずれかでモデルをトレーニングするために使用され得る。
さらに本発明者らは、無関係な値または外れ値を除去するようにデータをフィルタリングするための様々な手法が存在することを認識および理解しており、フィルタリングを行うために機械学習を利用する技術により提供される利点を認識および理解している。このような機械学習プロセスでは、モデルが測定を「パス」する生体構造に関するEIS測定、ならびに目的の生体構造が位置し得、モデルが測定を「フィルタリング」する、動物の身体の領域に位置し得る1つ以上の他の生体構造に関するEIS測定で、モデルがトレーニングされ得る。1つ以上の他の生体構造は、調査される領域、たとえば、病変が見いだされるまたは調査されると予測された領域における様々な動物の身体の中の予測された(expectedまたはpredicted)身体構造に基づき、同定され得る。たとえば、動物の身体の領域が同定され、測定または治療すべき生体構造が同定されると、設定段階の間に、動物の身体の当該領域で見出され得、目的の生体構造に隣接または近位であり得る1つ以上の他の生体構造が同定される。次に、in vitroにおいて目的の生体構造(たとえば、特定の種類の病変、たとえば、ある範囲の特徴/組成を伴うある範囲の病変種)、および/または1つ以上の他の生体構造に関して、測定が回収され得る。次に、動物の身体のこの領域に関して、目的の生体構造と1つ以上の他の生体構造との間を区別するための測定に基づき、モデルがトレーニングされ得る。
図17Aは、病変以外の生体構造に関する測定のフィルタリングを介して、病変を特徴づけるためにモデルをトレーニングするため、ならびに/または改善した度合の確実性もしくは正確性を伴う治療勧告を提供するためのプロセスを例示するフローチャートである。プロセス1700は、ブロック1702で開始し、ここでトレーニングデータが受信される。トレーニングデータは、上述の種類のセンサを使用して生体物質をサンプリングすることにより得られた測定を含み得る。トレーニングデータは、in vitroまたはin vivoにおける技術を使用して得られてもよい。トレーニングデータは、治療する病変に関連した測定、および他の生体構造に関連した測定を含み得る。また、測定が対応する構造の正体が、目的の生体構造に対応する測定と他の測定との間を区別するための学習においてモデルを支援するために、トレーニングで入力され得る。
ブロック1702のトレーニングは、目的の生体構造(たとえば、特定の種類の病変)に関するEIS測定と、この生体構造に関するものではないEIS測定との間を区別するように、モデルをトレーニングするために行われ得る。よって、このようなモデルは、これらのEIS測定を、2つのカテゴリ:目的の生体構造に「関する」カテゴリおよび目的の生体構造に「関するものではない」カテゴリのうちの1つに分け得る。他の実施形態では、これらの2つのカテゴリの間を区別するようにのみモデルをトレーニングするよりは、モデルは、複数の異なる生体構造のそれぞれに関するEIS測定でトレーニングされてもよく、入力されたEIS測定をこれらのカテゴリのうちの1つに分類して各EIS測定が最も確実に対応する生体構造を同定するように、トレーニングされ得る。
このモデルは、それぞれの特定のEIS測定に関して、EIS測定が目的の生体構造および/またはEIS測定が対応する構造に対応するかどうかを同定するように、ブロック1702でトレーニングされ得る。よって、ブロック1702のモデルは、EIS測定のセットに関する同定またはフィルタリングを行うようにはトレーニングされなくてもよく、むしろ、このセットの中の個々のEIS測定をフィルタリングするようにEIS測定のセットを処理し得る。このようなEIS測定のセットは、埋め込み可能な装置または挿入可能な装置の複数のセンサを使用する時間でのEIS測定の回収などの、特定の時間での挿入可能な装置または埋め込み可能な装置の作動からの測定を含み得る。この方法で測定間を区別することは、目的の病変または他の生体構造と接触したセンサにより、特定の時間または特定の時間間隔にわたり回収したEIS測定と、病変/構造と接触していないが代わりに別の生体構造と接触している装置の別のセンサにより回収したEIS測定との間を区別することを可能にし得る。
モデルがこの方法でフィルタリングを行うようにトレーニングされると、このフィルタは、EIS測定に基づき生体構造(たとえば、病変)を同定および/または分類するようにモデルをトレーニングするためのプロセスの一部としてトレーニングデータで使用され得る。より具体的には、ブロック1704で、トレーニングデータは、特定の種類の病変などの目的の生体構造に関連していないデータを除去または少なくとも低減するようにフィルタリングされる。ブロック1708で、フィルタリングしたトレーニングデータを使用して、(たとえば、図15Aから図15Bに関連した上述の実施形態により)フィルタリングしたデータと病変の特徴との間の関係を認識するか、または(たとえば、図15Cに関連した上述の一部の実施形態により)フィルタリングしたデータと治療勧告との間の関係を直接認識するように、モデルをトレーニングし得る。ブロック1708は、上述のプロセスのいずれかを使用して実施され得る。
ブロック1704のフィルタを、どのデータのサブセットが病変に対応するか、およびどのデータが対応しないかを学習するようにトレーニングする実施形態では、プロセス1700は、複数のステップのトレーニングモデルを含み得、第1のトレーニングステップはブロック1704で行われ、第2のトレーニングステップはブロック1706で行われることを理解すべきである。一部の実施形態では、ブロック1704のフィルタおよびブロック1706のモデルは、同時に、すなわち、1つ多変数の問題として、同じデータを使用してトレーニングされる。しかしながら、他の実施形態では、ブロック1704のフィルタおよびブロック1706のモデルは、別のデータを使用してかつ/または異なる時間でトレーニングされる。
一部の実施形態では、図17Aのトレーニングは、図22に関連した上述の技術により、行われ得る。上記から明らかであるように、図22のプロセスは、1つ以上のモデルをトレーニングし、および/または当該モデルに関連してデータを解析して組織間を区別する際に使用するため、EIS測定およびEIS測定から抽出する特性を回収する時点の周波数の同定に対する反復の手法を含む。反復の手法の各反復において、異なる周波数/異なる特性が、この入力でトレーニングを受けたモデルが1つ以上の性能目標を満たし得るかどうかを決定するようにモデルをトレーニングする際に使用するために、選択され得る。一部の実施形態では、このような反復プロセスはまた、目的の生体構造に対応しないEIS測定をフィルタリングするためにフィルタモデルをトレーニングするため、ならびに目的の生体構造を同定および/または特徴づけるためにモデルをトレーニングするために、使用され得る。一部のこのような実施形態では、EIS測定は、目的の生体構造(たとえば、特定の種類の病変)および/または目的の生体構造に隣接もしくは近位である動物の身体の領域で見出され得る他の生体構造に関して、in vitroおよび/またはin vivoで回収され得る。EIS測定は、広範囲の周波数に関わり得る。図22および図17Aに係るプロセスをトレーニングする間、反復プロセスが使用され、ここで各反復の間に、周波数のサブセットが選択され、これらの周波数に関するEIS測定が、2つのモデル(フィルタモデルおよび生体構造を同定/特徴づけるためのモデル)のトレーニングに使用される。さらにまたはあるいは、図22に関連して論述するように、各反復において、特性のセットが選択されてもよく、これはEIS測定に存在する特性および/またはEIS測定から生じる特性を含み得る。反復プロセスは、各反復において、生体構造を同定および/または特徴づけるためのプロセスが1つ以上の性能目標を満たすまで、周波数および/または特性の選択、ならびに選択した周波数および/または特性に基づくトレーニングを、続行し得る。このような性能目標は、図22に関連して論述されるように、生体構造の同定または特徴づけにおいて望ましい正確性に達することまたは当該正確性を超えることであり得る。
このようなトレーニングの後に、挿入可能な装置および/または埋め込み可能な装置は、同定した周波数でEIS測定を回収するように構成されてもよく、EIS測定をフィルタリングして目的の生体構造に対応しない測定を除去するように、およびフィルタリングしたEIS測定を使用して生体構造を同定/特徴づけるように、トレーニングを受けたモデルを適用するように構成され得る。上述のように、当業者は、トレーニングを受けたモデルを適用することが、トレーニングの間に作成された重み値または他の値を使用してコンピュータ処理を行うことを含み得ることを理解するものである。よって、挿入可能な装置および/または埋め込み可能な装置はまた、装置がトレーニングを受けたモデルを適用し得るように、トレーニングで決定した値を伴い構成され得る。
一部の実施形態では、異なるフィルタが、動物の身体(たとえば、ヒトまたは非ヒトの身体を含む哺乳類の身体)の異なる部分に関して作成され得る。たとえば、1つのフィルタは、心臓の組織(冠動脈壁など)と心臓の病変(冠動脈の血餅など)との間を区別するように作成されてもよく、別のフィルタが、脳の組織(大脳静脈の内壁など)と脳で見出され得る病変との間を区別するように作成されてもよい。また異なるモデルが、異なる種類の病変などの、異なる目的の生体構造に関してトレーニングされ得る。よって、異なるモデルは、目的の特定の生体構造に関して、および目的の生体構造が位置し、測定される動物の身体の特定の領域に関してトレーニングされるモデルを含み得る。本発明者らは、異なる身体の部分および/または異なる目的の生体構造に関して異なるフィルタを有することが、身体全体に関する1つのフィルタよりも、各フィルタをトレーニングするデータの量を実質的に限定し、よって学習プロセスに関与するコンピュータ処理を低減し得ることを、理解している。また、異なるモデルは、フィルタの正確性を改善し得る。しかしながら、一部の状況では、複数の身体の部分または身体全体に関して、目的の生体構造に関する1つのフィルタが使用され得るため、全ての実施形態が異なる身体の部分に関して複数のフィルタを利用する必要があるわけではないことに留意すべきである。
図17Bは、図17Aのブロック1704で使用するためのフィルタを作成するために使用され得るプロセスを例示する。プロセス1720は、ブロック1722で開始し、ここで、身体部分が同定される。身体部分の例として、限定するものではないが、心臓またはその特定の部分、脳またはその特定の部分、肝臓またはその特定の部分、腎臓またはその特定の部分、肢の静脈などが挙げられる。身体部分が同定された後、身体部分の1つ以上の生体物質(組織および/または病変を含む)が、ブロック1724で同定され得る。たとえば、心臓がブロック1722で同定される場合、冠動脈の特定の組織(たとえば、平滑筋細胞、弾性線維、外弾性板、内弾性板、疎性結合組織、および/または内皮細胞)、ならびに/または一般に冠動脈の内側で見出され得る血餅が、ブロック1724で同定され得る。
ブロック1726で、ブロック1724で同定した生体物質に関連したデータが、回収され得る。このデータは、生体物質をサンプリングすることにより得た測定を表してもよく、これは一部の実施形態では侵襲的プローブに搭載されたセンサを使用して行われる。一部の実施形態では、このデータは、身体部分の特定の生体物質に関連した、異なる周波数で得たEIS試料の集合などのスペクトルの測定を含み得る。
ブロック1728では、回収したデータは、データが対応する特定の組織または病変を表すように標識される。たとえば、冠動脈の内皮細胞から得た測定に対応するデータは、「冠動脈 内皮細胞」と標識されてもよく;冠動脈の弾性線維から得た測定に対応するデータは、「冠動脈 弾性線維」と標識されてもよく;冠動脈で見いだされた血栓から得た測定に対応するデータは、「冠動脈中の血栓」と標識されてもよく;冠動脈で見いだされたフィブリンから得た測定に対応するデータは、「冠動脈中のフィブリン」と標識されるなどしてもよい。
ブロック1730では、フィルタは、この標識したデータを使用してトレーニングされ得る。具体的には、フィルタは、病変(たとえば、血栓、フィブリン、または他の種類の血餅)、および組織(内皮細胞、弾性線維、疎性結合組織など)に関連するデータ間を区別するようにトレーニングされ得る。
図17Aから図17Bの技術を、他の生体構造に関する測定のフィルタリングに関連させて上述したが、フィルタリングの技術はこれらに限定されないことを理解すべきである。他の実施形態では、図17A~図17Bに関連して記載されたフィルタリング技術は、さらにまたはあるいは、誤りのある測定を同定またはフィルタリングするために使用され得る。誤りのある測定は、何等かの潜在的なエラー源からもたらされてもよく、不正確である大きさおよび/または位相の値を伴うEIS測定を含み得る。誤りのある測定は、他の生体構造に対応する測定と同じまたは同様の方法の正確性に影響を与える場合がある。よって、誤りのある測定と誤りのない測定との間を区別するようにモデルをトレーニングするために、公知の誤りのある測定が、測定が誤りである指標と共に、誤りではない測定と併せて、入力されるトレーニングプロセスが実行され得る。次に、トレーニングを受けたモデル(さらに、目的の生体構造に関する測定と他の生体構造に関する測定との間を区別するようにトレーニングされ得る)は、測定をフィルタリングするために、装置により使用され得る。
本発明者らは、動物の身体における病変に対する挿入可能な装置の位置を同定するための従来の技術が、多くの場合不十分であることを理解している。たとえば、血管系の中の血餅を位置づけるための従来の技術の1つは、x線のリフレクションプローブ(x-ray reflective probes)に関連したx線画像の使用を含む。具体的には、x線に反射している部分を有する侵襲的プローブが、動物の管に挿入されると、プローブの位置が、x線のイメージングを使用してモニタリングできる。残念なことに、通常、血餅はx線に反射せず;よって、x線像は、血餅の位置決めに関する指標を提供しない。結果として、これを用いた侵襲的プローブと血餅を接触させるプロセスは、多くの場合厄介であり、必然的に多大な努力を含む。このプロセスは、操作期間を不必要に増大させる場合があり、またはさらに悪いことには、臨床医が繰り返し血餅の探索でプローブを操作するため、管の内壁に損傷をもたらす場合がある。
これに関して、本発明者らは、プローブが病変と接触しているかどうかを決定するための技術の利点を認識している。よって、一部の実施形態は、調査される生体構造が病変のような目的の生体構造(たとえば、血餅)、または病変が形成される組織のような別の生体構造(たとえば、管の内壁)であるかどうかを同定するための技術を目的とする。一部の実施形態では、機械学習技術が、生体構造が目的の生体構造であるかどうかを同定するために使用され得る。よって、異なる生体構造に関連する測定を同定する公知のデータを使用して、モデルがトレーニングされ得る。トレーニングした後、このモデルは、生体構造間を区別できてもよい。一部の実施形態では、図17Bのプロセスは、モデルをトレーニングするために使用されているが、代替的なプロセスも可能である。
図17Cは、侵襲的プローブを誘導する際に臨床医を支援するために使用され得るプロセスを例示する。プロセス1740は、ブロック1742で開始し、ここで、たとえば、医療機器のプロセッサで、動物(たとえば、動物の血管系)に挿入された侵襲的プローブに搭載した1つ以上のセンサから、データが受信される。受信されたデータは、少なくとも一部の実施形態では、動物の1つ以上の生体構造に関連するインピーダンス測定を含み得る。
一部の実施形態では、ブロック1742で受信したデータは、一定の期間にわたり回収された、センサの読み取りの複数のセットであり得る。この期間の間、挿入可能な装置または埋め込み可能な装置は、場合によっては、装置のセンサの全てが測定のセットにわたり同じ物質と接触しているように移動されなくてもよい。このような場合の複数の測定は、装置のセンサが接触した生体構造の同定または特徴づけにおける確実性の高い結果の作成を支援し得る。一部の実施形態では、たとえば、生体構造を同定または特徴づけるためのトレーニングを受けたモデルは、センサの読み取りが特定の生体構造または生体構造の特定の特徴(たとえば、組成)に対応するモデルの確実性を表す値を作成し得る。このモデルは、入力として追加的なデータを受け取ってもよく、これにより、確実性を高くまたは低く調節し得る。よって、一定の期間にわたり複数のデータを回収することは、生体構造が目的の生体構造であるかそうではないかという結果を高い確実性でもたらすことを支援し得る。一部のこのような実施形態では、たとえば、装置が接触した生体構造は、少なくとも3つのスペクトルが3秒未満で得られるか、少なくとも5つのスペクトルが3秒未満で得られるか、または少なくとも10のスペクトルが3秒未満で得られるように、サンプリングされ得る。
ブロック1744で、測定が特定の種類の病変などの目的の生体構造に対応するかどうかが決定され得る。一部の実施形態では、この決定は、プロセス1720(図17B)によりトレーニングされた機械学習フィルタを使用して部分的に行われてもよく、これにより、生体構造間を区別するようにトレーニングされ得る。
EIS測定が、目的の構造ではない別の生体構造に対応すると決定された場合、次に、ブロック1746において、情報がユーザに出力され、プローブが目的の生体構造と未だ接触していないことをユーザに通知し得る。この情報は、たとえば、ディスプレイまたは音響装置を使用する任意の適切な方法で、出力され得る。この情報に基づき、臨床医は、動物の中の侵襲的プローブの誘導の続行を決定してもよく、プロセス1740は、ブロック1742、ブロック1744、およびブロック1746を介して反復し得る。
一部の実施形態では、ブロック1744の決定ステップは、特定の時間でまたは特定の時間期間にわたり装置により回収された全てのEIS測定が、目的の生体構造に対応するかどうかに関連し得る。たとえば、この決定は、装置が目的の構造(たとえば、病変)に完全に接触しているかどうか、または1つ以上のセンサが別の生体物質と接触しているかどうかであり得る。全てのセンサが、目的の構造と接触していると決定されない場合、次に、ブロック1746において、装置が目的の生体構造(たとえば、病変)と完全に接触していないことを表す情報が出力され得る。他の実施形態では、ブロック1744の決定ステップは、(存在する場合)どの装置のセンサが、当該センサが目的の生体構造と接触していることを表す読み取りを生成しているかを同定するために、行われ得る。この方法でセンサ間を区別することは、目的の生体構造と適切かつ完全に接触するため、装置の操作において臨床医を支援し得る。たとえば、センサが、挿入可能な装置の長さに沿って長手方向に配置され、よって、その後装置が目的の生体構造に接近し、次に目的の生体構造と接触する場合、センサは、望ましい構造と接触しないことを表す値を経時的に生成してもよく、その後遠位端にあるセンサが当該構造と接触していることを表す値を生成してもよく、その後装置が適切に配置された後に全てのセンサが当該構造と接触していることを表す値を生成してもよい。臨床医が装置を遠くに移動させすぎる場合、遠位のセンサは、センサが望ましい構造と接触していないことを表す値を生成し得る。
調査した生体物質が目的の生体構造であることが決定された場合、次に、ブロック1750において、この効果に対する情報が出力され得る。その後、臨床医は、以下のステップ:病変の1つ以上の特徴を決定するような侵襲的プローブの作動(図1のブロック104に関連して記載);病変の特徴に基づき治療勧告を作成および出力するような医療機器の作動(図1のブロック106に関連して記載);治療勧告に基づく治療の選択肢の選択(図1のブロック108に関連して記載);および/または選択した治療の選択肢を使用した病変の治療(図1のブロック110に関連して記載)のうちのいずれかを行ってもよい。
実施例
以下に、医療機器および技術を使用し得る様々なシナリオの例を記載する。しかしながら、実施形態は、これらの実施例のいずれか1つに係る作動に限定されないことを理解すべきである。
実施例1
本明細書中記載の技術を使用し得る方法の一例は、侵襲的なスマート型のガイドワイヤ(smart guide wire)を用いる。この侵襲的なガイドワイヤは、血管系の操作に使用され得る。本明細書中記載のセンサおよび解析技術を使用して、侵襲的なガイドワイヤは、ガイドワイヤと接触する組織/物質を特徴づけ、この組織/物質の特徴を臨床医へ伝達し得る。また、侵襲的ガイドワイヤは、追加的な装置が患者内の介入部位に達することを支援し得る。
この実施例では、ガイドワイヤは、センサ(好ましくはEISセンサ)、インピーダンススペクトロメーター、およびハンドルを含む。また、ガイドワイヤは、使用の間、その長さに沿って挿入され得る追加的な構成要素を含み得る。センサは、センサと接触する組織/物質の性質を検知および特徴づけるために、使用され得る。たとえば、センサは、高い周波数のインピーダンス測定を行うためインピーダンススペクトロメーターと共に使用する場合、組織/物質の組成を決定するために使用され得る。センサおよびインピーダンススペクトロメーターの両方が、ガイドワイヤの侵襲的な先端に優先的に位置することにより、この先端に隣接した組織を、インピーダンススペクトロメーターにセンサを接続する長い電線を必要とすることなく特徴づけることができる。この設計は、インピーダンススペクトロメーターが対象の外側に位置した場合に他の方法で電気信号に挿入され得る電気的ノイズを低減し得る。
ハンドルは、追加的な構成要素、たとえば、ユーザとの通信、外科手術の間および後でのデータの記録および伝送、データの処理、ならびに装置の電力供給のための構成要素を含み得る。このような構成要素の例は、ユーザにより読み取り可能なディスプレイまたはインジケータ光などのフィードバック部、無線によりまたはケーブルを介してデータを伝送するための部品、データベース、プロセッサ、およびバッテリーを含む。ハンドルは、他の装置の構成要素から取り外すことができ、また、ガイドワイヤ自体の回路に取り外し可能に接続することもできる。
実施例2
実施例1に記載のガイドワイヤは、阻害された動脈を有する患者にとって最適な治療戦略を決定するために、臨床医により使用され得る。臨床医は、ガイドワイヤを使用して、この動脈を阻害している組織/物質を特徴づけ、次にこの情報に基づき、異なる見込みのある治療の中から選択することができる。一部の実施形態では、ガイドワイヤは、あらかじめ行われた1つ以上の特徴づけに基づき、および任意選択でこのガイドワイヤにより行われた以前の治療からのデータに基づき、臨床医に治療勧告を提供し得る。
この実施例では、臨床医は、ガイドワイヤを使用して動脈の病変を評価および治療することができる。臨床医は、任意選択でハンドルを使用して血栓の部位へとガイドワイヤを操作し、次に血栓を突き刺すことにより、開始することができる。次に、臨床医は、動脈を阻害している血栓および/または組織/物質の組成の測定を行うために、ガイドワイヤを使用し得る。次に、臨床医は、この測定結果に基づき、阻害された動脈にとって最適な治療を決定することができる。たとえば、臨床医は、阻害している組織が患者の動脈壁由来の細胞から構成されている場合、ステント装置を使用することを決定し得る。阻害している組織が血栓である場合、臨床医は、代わりに、その粘弾性の性質を測定することを決定し、次に、この情報に基づき血餅を除去するため吸引カテーテルまたはステントを使用すべきかどうかを決定することができる。
一部の実施形態では、臨床医はまた、ガイドワイヤから治療勧告を受信し得る。治療勧告は、動脈の病変に関してガイドワイヤにより行われた特徴づけに基づきことができ、かつ/または以前のガイドワイヤの使用の間に回収されたデータに基づくことができる。
治療の終了後、臨床医は、ガイドワイヤからハンドルを取り外し、ガイドワイヤにより適切な介入装置を挿入し得る。
実施例3
本明細書中記載の技術にしたがい使用され得る装置のさらなる例として、スマート型のステント型血栓回収器(smart stent-retriever)がある。このステント型血栓回収器は、患者から血餅を回収するために使用され得る。本明細書中記載のセンサおよび解析技術を使用することにより、侵襲的ステント型血栓回収器は、接触している血餅を特徴づけ、この組織/物質の特徴を臨床医に伝達し得る。
この実施例では、ステント型血栓回収器は、少なくとも1つのセンサ(好ましくは少なくとも1つのEISセンサおよび/またはEITセンサ)、測定部、およびハンドルを含む。ステント型血栓回収器は、接触する血餅に関する情報を血餅の中の複数の位置から得ることができるように、複数の戦略的な位置で複数のセンサを含み得る。ステント型血栓回収器が2つ以上のセンサを含む場合、センサは、接触する血餅の異なる性質を検知することができてもよい。たとえば、ステント型血栓回収器は、ステント型血栓回収器と血餅の統合を検知できる1つ以上のセンサ、時間の関数としてステント型血栓回収器の位置を検出できる1つ以上のセンサ、および/または血餅に適用される力を検知できる1つ以上のセンサを含み得る。血餅とステント型血栓回収器の統合は、時間の関数としてステントのインダクタンスおよび/またはEIT信号を検知することにより、決定され得る。ステントのインダクタンスおよびEITの値は、ステントの広がりおよび周辺の環境で変動するため、これらの性質の一定した値は、ステントが最大の広がりおよび血餅への統合に達したことを表すであろう。運動センサは、時間の関数としてステント型血栓回収器の位置を検知するために使用され得る。この特性により、臨床医は、患者の中のステント型血栓回収器の動きを理解でき、血餅の回収の間にステント型血栓回収器が行った通過回数を決定することができる。また、血餅または組織/物質に対してステント型血栓回収器により適用される力を測定するために、応力センサが含まれ得る。
ステント型血栓回収器の測定部は、インピーダンススペクトロメーターおよび/またはトモグラフィー部であり得る。この部品は、ステント型血栓回収器の先端の近くに優先的に配置されており、これにより、ステント型血栓回収器に隣接する血餅を、測定部にセンサを接続する長い電線を必要とすることなく特徴づけることができる。この設計は、インピーダンススペクトロメーターが対象の外側に位置した場合に他の方法で電気信号に挿入され得る電気的ノイズを低減し得る。
ハンドルは、実施例1に記載の追加的な構成要素を含み得る。またこれは、正確かつ自動化された血餅の回収を可能にするためのロボットによる引き抜き(robotized pulling)機構を含むことができる。
実施例4
実施例1に記載のガイドワイヤおよび実施例3に記載のステント型血栓回収器は、阻害された動脈を有する患者に対し最適な治療戦略を決定および実行するために、臨床医によって協同して使用され得る。臨床医は、動脈を阻害している組織/物質を特徴づけるためにガイドワイヤを使用し、次に、血餅および/または血栓を回収するためにステント型血栓回収器を使用することができる。任意選択で、データは、血餅回収間に回収でき、その後の解析のためデータベースにアップロードすることができる。
この実施例では、臨床医は、阻害された動脈を有する患者を治療するために、スマート型の装置の組み合わせを使用することができる。臨床医は、シースを伴うガイドワイヤを挿入し、ガイドワイヤを(上述の侵襲的プローブと共に)使用することにより、実施例2に記載の病変の評価を開始し得る。臨床医が、ガイドワイヤにより提供される情報および/または勧告に基づき、次にステント型血栓回収器を使用することを決定する場合、臨床医は、ガイドワイヤを除去し、シースを所定の位置に残し、シースに沿ってステント型血栓回収器を挿入し、血餅および/または血栓に血栓回収器を誘導する。ステントが血餅および/または血栓を突き刺した後、ステント型血栓回収器に組み込まれたセンサは、血餅および/または血栓の態様を検知することができ、この情報を時間の関数として臨床医へ(たとえば、外部のディスプレイ上に)提供することができる。たとえば、EISセンサおよび/またはEITセンサは、血餅および/もしくは血栓とステントの統合、ならびに血餅および/または血栓の形状および組成を特徴づけることができる。ステント型血栓回収器はまた、治療勧告を臨床医へ提供するために、以前の血餅および/または血栓の回収由来のデータを使用し得る。治療勧告は、たとえば、血餅および/もしくは血栓とステント型血栓回収器の統合が最適であることの信号、ならびに/または血餅および/もしくは血栓を引き抜くための適切な速度および力に関する勧告を含むことができる。
この時点で、臨床医は、血餅および/または血栓を回収するためにステント型血栓回収器(stent-retrieve)により提供される情報および/または勧告に基づき行動し得る。臨床医は、血餅を回収するためにステント型血栓回収器に組み込まれた自動的な引き抜き機構を使用することを決定し得る。次に、自動的な引き抜き機構は、以前の血餅および/または血栓の回収のデータベースから受信したデータに基づきステント型血栓回収器により決定された速度および力を使用して、ある速度で血餅および/または血栓を引き抜き得る。血餅および/または血栓が、ステント型血栓回収器から離れた場合、ステント型血栓回収器は、アラームを使用して臨床医へ信号で伝達し得る。次に、臨床医は、再度血餅および/または血栓を突き刺し、回収プロセスを再度開始し得る。
血餅および/または血栓の回収の終了時に、介入の間に回収された全てのデータを、後の解析のためデータベースに伝送することができる。
実施例5
本明細書中記載の技術にしたがい使用され得る装置の別の例として、スマート型の吸引カテーテルがある。この吸引カテーテルは、患者から血餅を回収するために使用され得る。本明細書中記載のセンサおよび解析技術を使用することにより、侵襲的吸引カテーテルは、接触している血餅を特徴づけ、この組織/物質の特徴を臨床医に伝達し得る。
この実施例では、吸引カテーテルは、少なくとも1つのセンサ(好ましくは少なくとも1つのEISセンサおよび/またはEITセンサ)、測定部、およびハンドルを含む。実施例3のように、吸引カテーテルは、接触する血餅に関する情報を血餅の中の複数の位置から得ることができるように、複数の戦略的な位置で複数のセンサを含み得る。吸引カテーテルが2つ以上のセンサを含む場合、センサは、接触する血餅の異なる性質を検知することができてもよい。たとえば、吸引カテーテルは、実施例3に記載の1つ以上のセンサ(すなわち、吸引カテーテルと血餅の統合を検知できる1つ以上のセンサ、時間の関数として吸引カテーテルの位置を検出できる1つ以上のセンサ、および/または血餅に適用される力を検知できる1つ以上のセンサ)を含み得る。また、吸引カテーテルは、吸引カテーテルの中の血流をモニタリングできる追加的なセンサを含み得る。
吸引カテーテルの測定部およびハンドルは、実施例3に記載のステント型血栓回収器の測定部およびハンドルと同一である。
実施例6
実施例1に記載のガイドワイヤおよび実施例5に記載の吸引カテーテルは、阻害された動脈を有する患者にとって最適な治療戦略を決定および実行するために、臨床医によって協同して使用され得る。臨床医は、動脈を阻害している組織/物質を特徴づけるためにガイドワイヤを使用し、次に、血餅および/または血栓を回収するために吸引カテーテルを使用することができる。任意選択で、データは、血餅回収間に回収でき、その後の解析のためデータベースにアップロードすることができる。
この実施例では、臨床医は、阻害された動脈を有する患者を治療するために、スマート型の装置の組み合わせを使用することができる。臨床医は、ガイドワイヤを挿入し、ガイドワイヤを使用することにより、実施例2に記載のように病変の評価を開始し得る。臨床医が、ガイドワイヤにより提供される情報および/または勧告に基づき次に吸引カテーテルを使用することを決定する場合、臨床医は、次に、ガイドワイヤに沿って吸引カテーテルを挿入し、これを血餅および/または血栓に誘導し、吸引プロセスを開始する。血餅および/または血栓の吸引の間、外部のディスプレイは、除去の進行、EISセンサおよび/またEITセンサにより検知される血餅および/または血栓の形状および組成、ならびに吸引カテーテルを介した血餅および/または血栓の通過に関する情報を、臨床医に提供する。スマート型の吸引カテーテルはまた、血餅と吸引カテーテルの統合に基づき血餅および/または血栓の除去を開始するための最適な時間を決定し、この条件を臨床医に信号で伝達し得る。次に、臨床医は、血餅および/または血栓の除去を開始し得る。血餅および/または血栓が、吸引カテーテルから離れている場合、吸引カテーテルは、アラームを使用して臨床医へ信号で伝達し得る。次に、臨床医は、再度血餅および/または血栓を突き刺し、回収プロセスを再度開始し得る。センサが、完全に血栓が吸引され、吸入装置のチューブに沿って通過したことを検出する場合、除去の成功を表す別のメッセージが作成され、出力され得る。
血餅および/または血栓の回収の終了時に、介入の間に回収された全てのデータを、後の解析のためデータベースに伝送することができる。
実施例7
実施例1に記載のガイドワイヤは、慢性完全閉塞病変(CTO)を有する患者を治療するために使用され得る。この場合、患者の動脈は、臨床医にとって血流を再度確立するように突き刺すことが困難であり得る、古く硬い血栓により阻害されている。臨床医は、病変の位置を検知し、病変を通るスマート型のガイドワイヤを使用し得る。操作の間、このガイドワイヤは、臨床医に、いつ病変の穿刺が開始されるか、およびいつガイドワイヤが病変を介して動脈の管腔に移動するかに関する情報を提供することができる。血栓が突き刺すには硬すぎる場合、臨床医は、代わりに、病変に隣接した動脈壁を介してガイドワイヤを通すことができる。この場合、ガイドワイヤは、アテローム/プラークの中のその位置に関する連続した情報を臨床医に提供することができる。このことは、血管の穿刺を回避するように臨床医を支援し得る。
実施例8
実施例1に記載のガイドワイヤは、末梢の病状の診断および/または治療において、臨床医により使用され得る。末梢の病状の例として、深部の静脈または動脈で形成された血栓、または人工の静脈または動脈で形成された血栓が挙げられる。ガイドワイヤは、末梢の病状を有する患者にとって最適な治療戦略を決定するために、使用され得る。臨床医は、ガイドワイヤを使用して、管を阻害している組織/物質を特徴づけ、次に、この情報に基づき異なる見込みのある治療の中から選択することができる。一部の実施形態では、ガイドワイヤは、ガイドワイヤが行った1つ以上の特徴づけに基づき、および任意選択で、ガイドワイヤにより行われた以前の治療からのデータに基づき、臨床医に治療勧告を提供し得る。
実施例9
さらなる実施例として、上記の侵襲的プローブのいずれか1つは、血餅(たとえば、血栓)の年齢(age)を推定するために、使用され得る。血餅の年齢(すなわち、形成されてからの血餅の時間)は、血餅の組成などの血餅の1つ以上の特徴に基づき、決定され得る。異なる治療または治療の組み合わせは、これらの特徴から決定される場合の血餅の年齢に基づき提供され得る。たとえば、血餅が14日未満である場合、1つの治療が勧告されてもよく、血餅が14日超である場合、これと異なる治療が勧告されてもよい。
さらにまたはあるいは、本明細書中記載の装置および技術の少なくとも一部は、生体構造が健常な組織であるかどうかを同定するために、使用され得る。たとえば、この装置/技術は、血管壁が健常であるかどうか、またはアテローム性のプラークもしくは石灰化が血管壁に形成されているかどうかを決定するために、使用され得る。このような場合、本明細書中記載の装置のうちの1つが接触している生体構造は、血管壁またはアテローム性のプラーク(または他の病変)であり得、本明細書中記載の技術を使用して、これらの生体構造のうちの1つであるかどうかが決定され得る。この同定に基づき、異なる治療勧告が提供され得る。
オンコロジーに使用するために医療機器を作動させる方法
本発明者らは、潜在的に癌性細胞の試験のための従来の技術が、多くの場合不十分であることを認識および理解している。たとえば、潜在的に癌性細胞を試験するための従来の技術のうちの1つは、組織試料を除去するために針を使用する。針の挿入の操作において臨床医を支援するために、x線、超音波、または核磁気共鳴画像法(MRI)などの従来のイメージング技術が使用されている。しかしながら、これらの技術を使用して作成された画像は、多くの場合、不正確またはぼやけており、よって、臨床医が、目的の細胞または組織に針が接触しているかどうかを決定することを困難なものにしている。結果として、このような技術を使用した癌性細胞の診断および/または治療は、多くの場合、不正確である。結果として、特定の病変が癌性であるかどうかを決定しようとする場合に、潜在的に癌性病変を試験するよう意図された針が病変と実際には接触せず、代わりに、近くの健常な組織と接触する有意なリスクがあり、不正確な試料および不正確な医療上の結論をもたらすこととなる。同様に、癌性細胞を除去しようとする際に、2つの望ましくない状況:健常な組織が癌性細胞と共に除去され得ること、または一部の癌性細胞が除去されないままとなることが、起こり得る。
よって、本明細書中記載の一部の実施形態により、医療機器は、癌性の細胞/組織の存在、癌性の細胞/組織の特徴、および/または癌性の細胞/組織の種類(たとえば、細胞腫、リンパ腫、骨髄腫、新生物、メラノーマ、転移、または肉腫)を決定するために、使用され得る。たとえば、上述の機械学習技術は、癌性の細胞/組織と非癌性の生体物質との間を区別するため、および/または癌性の細胞/組織を特徴づけるために、使用され得る。さらに、本明細書中記載の種類の技術(機械学習技術を含む)は、癌性の細胞/組織の特徴に少なくとも部分的に基づき、癌性の細胞/組織を治療する方法に関する勧告を提供し得る。たとえば、癌性の細胞/組織の焼灼または除去、および焼灼または除去する方法が、一部の状況において勧告され得る。
癌性細胞の組織/物質を検知する医療機器、センサ、および方法の例は、図2~図11に関して上記に詳述されている。図31~図33に関連して、当該医療機器が実施し得る技術および/または医療機器が行うように作動され得る技術の例を、以下に記載する。
図31は、本明細書中記載の一部の技術により作動する医療機器により行われ得る例示的なプロセス3100を例示する。図31の例では、センサは、針、焼灼カテーテル、高周波プローブ、ロボットプローブ(robotic probe)、腹腔鏡、または切断装置などの診断装置および/または治療装置に、配置され得る。一部の実施形態では、センサは、医療機器の遠位端近くに配置されている。医療機器は、センサを使用して決定された癌性細胞の特徴に基づき、治療勧告を作成し得る。本明細書中記載のプロセスは、侵襲的プローブを伴う使用に限定されないことを理解すべきである。一部の実施形態では、本明細書中記載の技術は、動物の身体内での使用のためもしくは動物の身体内での使用のためにのみ設計されていなくてもよく、さらにまたはあるいは、動物の身体の外側にある組織を含む生体構造で使用するために設計され得る非侵襲的プローブを含むシステムおよび装置を伴い、使用され得る。たとえば、一部の実施形態では、本明細書中記載の装置、システム、および技術は、皮膚癌または他の皮膚の症状などの表面の病変の診断および/または治療のために使用され得る。
プロセス3100は、ブロック3102で開始し、ここで医療機器の侵襲的プローブは、癌性の組織または細胞であり得る、センサに近位の病変の1つ以上の特徴(たとえば、大きさおよび/または組成)を検出するように、作動する。プロセス3100の開始の前に、侵襲的プローブは、動物の身体内に挿入されてもよく、予測した病変の位置の近位に移動させてもよい。次に、医療機器を、いつセンサが病変と接触するかを検出するように作動させる。潜在的に癌性であると知られているかまたは潜在的に癌性である病変または組織の接触は、センサにより出力された値の経時的な変化(たとえば、インピーダンスの変化)を評価することにより、または図17Cに関連して記載された機械学習技術を使用することにより、決定され得る。たとえば、医療機器は、侵襲的プローブのセンサが、癌性の組織/細胞と接触していないか、または病変がその一部であると知られている種類の組織と接触していない場合に、(たとえば、ユーザへ、ユーザインターフェースを介して)1つの結果を出力し得る。
たとえば、侵襲的プローブを病変へ向かうように動物を介して移動させて、病変を調査する場合、医療機器は、接触している組織を表す値を出力し得る。この値は、一部の実施形態では、定量的な値であってもよく、これは、侵襲的プローブが病変と接触しているかどうかを表すための、はい/いいえまたは真/偽などの二元的な値を含む。
医療機器は、侵襲的プローブが接触した組織を含む侵襲的プローブが接触した生体物質を解析して、侵襲的プローブが「異常」であり、よって病変の一部であり得るいずれかの生体物質と接触しているかどうかを決定することにより、侵襲的プローブが病変と接触しているかどうかを決定し得る。医療機器は、一部の実施形態では、動物の中の侵襲的プローブの位置を評価することにより、プローブが接触した生体物質が「異常」であるかどうかを決定し得、これは、侵襲的プローブが接触すると予測され得る生体物質を表し得る。
さらにまたはあるいは、医療機器は、予備的診断の結果として臨床医により入力され得る、病変についての予測に基づき、侵襲的プローブが病変と接触しているかどうかを決定し得る。たとえば、臨床医は、病変を予備的に特徴づける情報、たとえば、病変が血管系であるかもしくは臓器の病変であるかどうか、または臓器の病変である場合に何の臓器であるか、病変の組成の予測、または病変の組織もしくは細胞の状態(たとえば、健常ではない、炎症性、癌性、疾患状態にあるなど)の予測を、入力し得る。このような情報が入力される実施形態では、臨床医は、個々に病変を予備的に特徴づける情報を入力してもよく、または、このような病変を予備的に特徴づける情報に関連し得る病変の予備的診断の選択を行ってもよい(たとえば、特定の分類のアテロームを選択することにより、予測したアテロームの組成、および血管系にそれが位置していることなどの他の情報が、同様に選択され得る)。侵襲的プローブが動物を介して移動する場合、医療機器は、侵襲的プローブが接触した生体物質を病変の予備的な特徴づけと比較して、侵襲的プローブが病変と接触しているかどうかを決定し得る。たとえば、病変が、脳腫瘍であり得る脳の病変と予備的に診断されている場合、医療機器は、侵襲的プローブが異常な脳組織と接触したかどうか、および/または侵襲的プローブが癌性の脳組織と接触しているかどうかを決定し、この結果を出力し得る。
他の実施形態では、侵襲的プローブが病変と接触しているかどうかを表す二元的な値を単に提供するよりは、医療機器は、たとえば、プローブが身体を介して移動するにつれて変動し得る、侵襲的プローブのセンサが接触している一つの生体物質または複数の生体物質の正体、量、および/または相対的な存在量を表す値を出力し得る。その一つまたは複数の物質を表す値は、本明細書中記載の技術(上述の機械学習技術を含む)を使用して決定されるインピーダンススペクトルから同定された物質の列挙などの、物質の識別であり得る。この値は、他の実施形態では、センサにより検出された値(たとえば、インピーダンスの値もしくはインピーダンススペクトル)または他の値などの数値であり得る。
プローブおよびそのセンサは、病変と接触するまで移動されてもよく、この時点で医療機器により出力された結果は、接触が行われた後に変化し得る。この方法で、病変の位置が、侵襲的プローブを使用して決定されもよく、侵襲的プローブが病変と接触しているとの決定が行われ得る
侵襲的プローブは、さらに、場合によって、病変の幾何学的形状を決定するように作動され得る。たとえば、癌性組織(たとえば、腫瘍)を潜在的に含む病変の幾何学的形状は、一部の実施形態では、病変の近位で侵襲的プローブを移動させ、いつ侵襲的プローブのセンサが病変と接触しているかまたは接触していないかを同定することにより、決定され得る。たとえば、侵襲的プローブが出力した値の解析が、病変が癌性組織を含むことを決定する場合、侵襲的プローブは移動されてもよく、経時的に異なるセンサで、個々のセンサが癌性組織と接触しているかどうかの決定が行われ得る。次に、侵襲的プローブの移動量(たとえば、上述のように加速度計を使用して測定)および侵襲的プローブ上のセンサの位置が、医療機器により解析され、癌性組織の1つ以上の次元を含む、動物内の癌性組織の幾何学的形状が決定され得る。
一部のこのような実施形態では、医療機器は、病変の幾何学的形状に基づき病変に関す1つ以上の治療勧告を決定し得る。
図31に例示したものなどの実施形態で実施され得る1つの治療プロトコルにおいて、焼灼が、癌性組織の治療の第1の選択肢として使用され得る。よって、ブロック3104において、針または高周波プローブなどの焼灼装置(ablative device)が、動物の中に挿入される。一部の実施形態では、焼灼装置は、本明細書中記載の種類のセンサを含む侵襲的プローブを含み得る。焼灼装置は、焼灼装置が癌性の細胞または組織との接触が形成されたと決定するまで、移動され得る(しかしながら、実施形態は、侵襲的プローブを含む焼灼装置を用いた作動に限定されないことを理解すべきである。他の実施形態では、侵襲的プローブは、別の医療機器の一部であり、侵襲的プローブの配置の後に、焼灼装置は、侵襲的プローブの近位に配置され、よって癌性の細胞/組織の近位に配置されるまで移動される)。
ブロック3104において、癌性の細胞/組織の近位に焼灼装置を配置した後に、焼灼装置は、癌性の細胞/組織を焼灼するように作動する。治療時間の後に、焼灼装置は、焼灼装置が、癌性の細胞/組織に効果を有しているかどうかを決定するように作動し得る。たとえば、一部の実施形態では、焼灼が有効であるかどうかおよび焼灼を続行すべきかどうかを含む、焼灼を行う際に臨床医を誘導する治療勧告が、作成され得る。よって、ブロック3106では、センサは、焼灼装置が未だ癌性細胞または癌性組織と接触しているかどうかを表す情報を提供し得る。この決定は、本明細書中記載の技術(上述の機械学習技術を含む)を使用してなされ得る。この情報は、焼灼を停止するかどうかまたは焼灼を続行するかどうかなどの治療勧告を提供するため、または焼灼を停止するかどうか決定する前に侵襲的プローブの配置を確認するために、処理および使用され得る。
一部の実施形態では、焼灼装置は、異なる位置に配置された異なる電極などの、焼灼するために用いられる複数の異なる電極を含み得、この異なる電極は、一部が焼灼するように作動し得、同時にその他が焼灼するように作動しないように、個別に作動可能であり得る。一部の実施形態では、各焼灼電極は、検知電極の近くに配置されてもよく、ここで検知電極は、検知電極が接触した生体物質を決定するように本明細書中記載の技術により作動する。焼灼装置は、検知電極を使用して、焼灼装置の特定の部分が、癌性の組織/細胞または非癌性の組織/細胞と接触しているかどうかを決定し得る。一部のこのような実施形態では、焼灼装置の一部が非癌性組織と接触しているとの決定に応答して、焼灼装置は、焼灼を癌性組織のみに限定し、非癌性組織に対して行われ得る損傷を最小限にするために、焼灼装置の一部の焼灼電極(ablative electrode)の作動を停止または防止し得る。
この方法で、臨床医は、この治療が無効である場合に焼灼を中止し得、臨床医は、焼灼装置が癌性の細胞/組織と接触している間のみ焼灼を続行することにより、癌性組織のみを焼灼し得る。よって、臨床医は、治療が成功したかどうか、およびこれが成功していた場合に癌性組織/細胞の全てが焼灼されていることに、治療終了時に、より確信を持ち得る。この方法では、健常な組織を焼灼するリスクおよび/または癌性細胞を焼灼しないままにするリスクが、軽減される。
よって、図31に例示するように、焼灼装置が、未だ癌性の細胞/組織と接触していると決定された場合、プロセス3100はブロック3108に進み、ここで、焼灼を続行するとの勧告が提供され、ブロック3104へと反復する。他方で、焼灼プローブがもはや癌性の細胞/組織と接触していないと決定された場合、焼灼を停止する勧告がブロック3110で提供される。このプロセスは、焼灼装置を再配置することにより、反復され得る。焼灼装置を何回か再配置しようとした後であっても、病変との接触がこれ以上形成できない場合に、プロセス3100は終了する。
図32は、別の実施形態に係る癌性の細胞/組織に関する治療勧告を作成するように医療機器を作動させる方法の例を例示する。図32の実施形態では、医療機器は、たとえば、上述の図3の例における、プローブの外側に沿って配置された複数のセンサを含み得る。上記から明らかであるように、このようなセンサの配置を用いて、癌性病変の組成を含む癌性病変のいくつかの異なる特徴が決定され得る。たとえば、癌性病変でEISプロセスを行うことにより、癌性病変の組成が、上述のように決定され得る。一部の実施形態では、上述のトレーニングを受けた機械学習モデルが、癌性病変の組成または他の特徴を決定するために使用され得る。
図32のプロセス3200は、ブロック3202で開始し、ここで、医療機器は、動物の対象の身体内に挿入され、癌性病変の1つ以上の特徴、たとえば、癌性病変の組成を検出するように作動する。この組成を含む特徴に基づき、医療機器は、ブロック3204において、勧告する治療の選択肢を選択し得る。この組成に基づき、プロセス3200は、調査された癌性病変の種類を決定してもよく、適切な治療勧告が提供され得る。医療機器は、上述の他の実施形態などのように、生体物質がインピーダンススペクトルを使用して同定され得、病変が生体物質に基づき同定され得るように、異なる生体物質に関するインピーダンススペクトルおよび他の電気的な特徴(たとえば、実効キャパシタンス)に関する情報、ならびに異なる病変の組成に関する情報を伴い、構成され得る。さらに医療機器は、異なる種類の癌性病変などの異なる種類の病変に関する異なる治療勧告を伴い、構成され得る。一例では、病変の異なる生体物質に関するインピーダンススペクトルを使用して、癌性病変が細胞腫であるかその一部であることが決定された場合、癌性病変を除去するとの勧告が提供され得る。別の例では、癌性病変がメラノーマの一部であると決定された場合、高周波の焼灼が勧告され得る。医療機器は、任意の適切な方法で治療の選択肢を選択し得る。
ブロック3204において治療が勧告された後、医療機器は、ブロック3206で、選択した治療選択肢の性能をモニタリングし得る。医療機器は、1つ以上のセンサ、たとえば、ブロック3202で特徴を決定した1つ以上のセンサ、または治療を行うように作動する治療装置の1つ以上のセンサを使用して、治療をモニタリングし得る。たとえば、焼灼がブロック3204で勧告された場合、臨床医は、焼灼装置を挿入し得る。焼灼装置は、焼灼が行われている際の癌性病変の状態を検知するためのセンサ、たとえば、温度センサを有し得る。このセンサは、癌性病変が焼灼または凍結されたかどうかを決定することにより、焼灼が成功したかどうかを決定し得る。
ブロック3028において、治療の状態に関する情報が、臨床医へ提示するため、ユーザインターフェースを介して医療機器により出力される。その後、プロセス3200は終了する。
治療をモニタリングする一例が、治療勧告を作成する観点から提供されているが、同様の技術を使用して、治療の状態に関して臨床医にエラーメッセージまたは他のメッセージを作成し得ることを理解すべきである。たとえば、治療装置上のセンサが、ある時間に癌性病変の存在を表し、この後にセンサが癌性病変をもはや検出しない場合、医療機器は、治療装置が不適切に配置されている、または癌性病変が消失したと、決定し得る。これは、この装置を再度配置する必要があること、または癌性病変が移動したことのいずれかを表し得る。ユーザインターフェースを介した臨床医へのメッセージは、このような潜在的な問題を表し得る。
さらに、図32の例は、最初の治療の選択に関連し、かつ当該治療を行うその後の方法に関連した治療勧告を提供するように医療機器を作動させる方法を記載したが、実施形態はこれに限定されないことを上記から理解すべきである。たとえば、一部の実施形態では、医療機器は、本明細書中記載の1つ以上のセンサを含んでもよく、当該装置を使用する最初の勧告を作成することなく、当該装置の作動の方法に関する治療勧告をもたらすように作動され得る。たとえば、針または高周波プローブは、上述のように、治療の状態または性能に関するデータを作成するための1つ以上のセンサを含み得、治療勧告を作成し得る。
図33は、治療勧告を作成するための一部の実施形態の医療機器により実施され得るプロセス3300を例示する。
プロセス3300は、ブロック3302で開始し、ここで医療機器は、本明細書中の技術を使用して、癌性病変の1つ以上の特徴(たとえば、大きさおよび/または組成)を決定するように作動する。医療機器は、医療機器の構成要素から、一つまたは複数の特徴を受信し得る。たとえば、医療機器に含まれている1つ以上のセンサ、および/またセンサにより生成したデータに基づき特徴を作成する別の構成要素がある。この特徴は、一部の実施形態では、癌性病変の組成を含み得る。さらにまたはあるいは、この特徴は、身体内の癌性病変の位置、癌性病変の凝集体の1つ以上の次元(たとえば、長さ、厚さなど)、癌性病変の温度、または上述のセンサの種類に基づき決定され得る他の情報を含み得る。
ブロック3304では、医療機器は、1つ以上の治療選択肢に関する1つ以上の条件と、ブロック3302で受信した特徴を比較する。医療機器は、複数の異なる利用可能な治療の選択肢に関する情報を伴い構成されてもよく、この選択肢のそれぞれは、癌性病変の1つ以上の特徴に関連する1つ以上の条件に関連し得る。治療の選択肢は、焼灼、除去、および生検を含み得る。癌性病変の組成に関連したこのような条件の例は、図32に関連して上述されている。たとえば、図15Bに関連して記載されているトレーニングを受けた機械学習モデルが、癌性病変の特徴と治療の成功に関する選択肢との間の関係を決定するために使用され得る。
医療機器は、どの条件が一致するかを決定するために、1つ以上の治療の選択肢に関する条件と、癌性病変の特徴を比較し得る。一部の実施形態では、治療の選択肢に関する条件のセットは、癌性病変が条件のうちの1セットのみと一致し得、よって、1つの治療の選択肢のみが選択され得るように、相互排他的であり得る。他の実施形態では、条件のセットは、相互排他的ではなくてもよく、よって、医療機器は、最も対応する条件が一致する選択肢また対応する条件が最も密接に一致している選択肢を同定することにより、どの治療の選択肢を勧告するかを決定し得る。たとえば、異なる条件が、インピーダンススペクトルの範囲などの異なる範囲の値に関連している場合、条件は、病変に関する値が最も密接に一致する範囲を同定することにより決定され得る。最も密接な一致は、たとえば、病変のインピーダンススペクトルまたは他の値が、当該範囲に関する境界値の中にあるかもしくはこの値から最も離れているか、または当該範囲と最も多くの重複を有する範囲であり得る。
ブロック3306では、上記比較に基づき、医療機器は、医療機器のユーザインターフェースを介して治療の選択肢の勧告を出力してもよく、プロセス3300は終了する。
当業者は、図33のプロセス3300のようなプロセスに関連して使用され得る、治療の選択肢に関する条件を設定する多くの方法が存在することを理解するものである。たとえば、治療の選択肢の選択に関する条件として使用するための癌性病変の特徴に関する値は、この値、癌性の細胞/組織の種類、および様々な治療の選択肢での治療の成功の間の対応を決定するための少なくとも一部の実験の後に、医療機器の中へハード・コード化され得る。しかしながら、本発明者らは、情報の中でも特に、癌性の細胞/組織の特徴、および癌性の細胞/組織の治療の成功に関する情報に基づき、このような関係および条件を学習するためのシステムの利点を認識および理解している。たとえば、機械学習プロセス、たとえば、特性の抽出および/または分類を含み得る機械学習プロセスが、一部の実施形態で実施され得る。
コンピュータの実施
本明細書中記載の原則により作動する技術は、任意の適切な方法で実施され得る。病変の治療のために、管の病変を特徴づけ、および/または1つ以上の治療勧告を作成する様々なプロセスのステップおよび行為を示している一連のフローチャートが、上記の論述に含まれている。上記のフローチャートのプロセスおよび決定のブロックは、これらの様々なプロセスを行うアルゴリズムに含まれ得るステップおよび行為を表す。これらのプロセスから生じるアルゴリズムは、1つ以上の単一目的もしくは多目的のプロセッサと統合しており、当該プロセッサの作動を指向しているソフトウェアとして実施されてもよく、デジタル信号処理(DSP)回路もしくは特定用途向け集積回路(ASIC)などの機能上等価の回路として実施されてもよく、または、他のいずれかの適切な方法で実施されてもよい。本明細書中含まれているフローチャートは、いずれかの特定の回路もしくはいずれかの特定のプログラミング言語のシンタックスもしくは作動、またはプログラミング言語の種類を表すものではないことを理解すべきである。むしろ、これらのフローチャートは、当業者が、本明細書中記載の種類の技術を行った特定の装置の処理を行うように、回路を組み立てるため、またはコンピュータソフトウェアのアルゴリズムを実施するために使用し得る機能的な情報を例示する。また、特段本明細書中で他の記載がない限り、各フローチャートに記載のステップおよび/または行為の特定の順序は、単に、実施され得るアルゴリズムの例であり、本明細書中記載の原則の実施および実施形態で変動し得る。
よって、一部の実施形態では、本明細書中記載の技術は、アプリケーションソフトウェア、システムソフトウェア、ファームウェア、ミドルウェア、埋め込みコード、または他のいずれかの種類の適切なコンピュータコードを含むソフトウェアとして実施されるコンピュータで実行可能な命令に具現化され得る。このようなコンピュータで実行可能な命令は、多くの適切なプログラミング言語および/またはプログラミングツールもしくはスクリプトツールのいずれかを使用して書かれてもよく、また、フレームワークまたは仮想機械で実行される、実行可能な機械言語コードまたは中間コードとしてコンパイルされ得る。
本明細書中記載の技術は、コンピュータで実行可能な命令として具現化する場合、これらのコンピュータで実行可能な命令は、それぞれがこれらの技術により作動するアルゴリズムの実行を完了するための1つ以上の作動を提供する多くの機能設備を含む、任意の適切な方法で行われ得る。しかしながら、例示した「機能設備」は、1つ以上のコンピュータと統合し、このコンピュータにより実行される場合に、1つ以上のコンピュータに特定の作動上の役割を行わせるコンピュータシステムの構造上の構成要素である。機能設備は、ソフトウェアエレメントの一部または全体であり得る。たとえば、機能設備は、プロセスの機能として、または別のプロセスとして、または他のいずれかの適切なプロセシングのユニットとして、実施され得る。本明細書中記載の技術が複数の機能設備として実施される場合、各機能設備は、独自の方法で実施されてもよく、全てを同じ方法で実施する必要はない。さらに、これらの機能設備は、必要に応じて、並列および/または直列で実行されてもよく、メッセージパッシングプロトコルまたは他のいずれかの適切な方法を使用して、実行しているコンピュータ上の共有メモリを使用して、互いの間で情報を通し得る。
一般的に、機能設備は、特定のタスクを行うか、または特定のアブストラクトデータ種を実施するルーチン、プログラム、オブジェクト、コンポーネント、データ構造などを含む。通常、機能設備の機能は、これらが作動するシステムで望まれるように、組み合わせてもよく、または分布されてもよい。一部の実施では、本明細書中記載の技術を行う1つ以上の機能設備は、完全なソフトウェアパッケージを共に形成し得る。これらの機能設備は、代替的な実施形態では、ソフトウェアプログラムのアプリケーションを実施するために、他の関連しない機能設備および/またはプロセスと相互作用するように構成され得る。
一部の例示的な機能設備は、1つ以上のタスクを行うために、本明細書中記載されている。しかしながら、記載の機能設備およびタスクの分割は、単に、本明細書中記載の例示的な技術を実施し得る機能設備の種類の例であること、および実施形態は、機能設備のいずれかの特定の数、分割、または種類で実施されることに限定されないことを理解すべきである。一部の実施では、全ての機能は、1つの機能設備で実施され得る。また、一部の実施では、本明細書中記載の機能設備の一部は、他と共にまたは他とは別に(すなわち1つのユニットまたは別のユニットとして)実施されてもよく、またはこれらの機能設備の一部が実施されなくてもよいことを理解すべきである。
本明細書中記載の技術を実施するコンピュータで実行可能な命令(1つ以上の機能設備または他のいずれかの方法として実施される場合)は、一部の実施形態では、媒体に機能を提供するために1つ以上のコンピュータ可読媒体で符号化され得る。コンピュータ可読媒体として、磁気媒体、たとえば、ハードディスクドライブ、光学媒体、たとえば、コンパクトディスク(CD)もしくはデジタル・バーサタイル・ディスク(DVD)、ブルーレイディスク、永続型もしくは非永続型のソリッドステートメモリ(たとえば、フラッシュメモリ、磁気RAMなど)、または他のいずれかの適切な記憶媒体が挙げられる。このようなコンピュータ可読媒体は、任意の適切な方法、たとえば、以下に記載の図34のコンピュータ可読記憶媒体3406として(すなわち、コンピュータ装置3400の一部として)、または単独の別の記憶媒体として、実施され得る。本明細書中使用する場合、「コンピュータ可読媒体」(「コンピュータ可読記憶媒体」とも呼ばれる)は、有形の記憶媒体を表す。有形の記憶媒体は、非一過的であり、少なくとも1つの物理的な構造上の構成要素を有する。本明細書中使用する場合の「コンピュータ可読媒体」では、少なくとも1つの物理的な構造上の構成要素は、埋め込まれた情報で媒体を作成するプロセス、それに情報を記録するプロセス、または情報で媒体を符号化する他のいずれかのプロセスの間に、何等かの方法で変更され得る少なくとも1つの物理的な特性を有する。たとえば、コンピュータ可読媒体の物理的な構造の一部の磁性の状態は、記録プロセスの間に、変更され得る。
この技術を、コンピュータで実行可能な命令として具現化し得る実施の一部(全てではない)において、これらの命令を任意の適切なコンピュータシステムで作動する1つ以上の適切なコンピュータ装置で実行してもよく、または1つ以上のコンピュータ装置(もしくは1つ以上のコンピュータ装置の1つ以上のプロセッサ)は、コンピュータで実行可能な命令を実行するようにプログラムされていてもよい。コンピュータ装置またはプロセッサは、命令がデータストア(たとえば、オンチップキャッシュまたは命令レジスタ、バスを介してアクセス可能なコンピュータ可読記憶媒体など)などの、コンピュータ装置またはプロセッサにアクセス可能な方法で保存されている場合に、命令を実行するようにプログラムされていてもよい。これらのコンピュータで実行可能な命令を含む機能設備は、1つの多目的のプログラム可能なデジタルコンピューティング装置、処理電力を共有し本明細書中記載の技術を共に行う2つ以上の多目的のコンピューティング装置の協調したシステム、本明細書中記載の技術の実行に特化した1つのコンピュータ装置またはコンピュータ装置の協調したシステム(同一場所に配置または地理的に分布)、本明細書中記載の技術を行うための1つ以上のFPGA(現場でプログラム可能なゲートアレイ)、または他のいずれかの適切な技術と統合されてもよく、これらの作動を管理してもよい。
図34は、他を行うことが可能ではあるが、本明細書中記載の技術を実施するシステムで使用され得るコンピュータ装置3400の形態のコンピュータ装置の例示的な実施の1つを例示する。図34は、本明細書中記載の原則にしたがい作動するようにコンピュータ装置に必要な構成要素を表すようには意図されておらず、包括的な記載とも意図されていないことを理解すべきである。
コンピュータ装置3400は、少なくとも1つのプロセッサ3402、ネットワークアダプタ3404、およびコンピュータ可読記憶媒体3410を含む。コンピュータ装置3400は、たとえば、上述の医療機器、デスクトップもしくはラップトプ型のパーソナルコンピュータ、携帯情報端末(PDA)、スマートモバイルフォン(smart mobile phone)、サーバ、または他のいずれかの適切なコンピュータ装置であり得る。ネットワークアダプタ3404は、任意の適切なコンピュータネットワーク上で他のいずれかの適切なコンピュータ装置とコンピュータ装置3400の有線および/または無線での通信を可能にする任意の適切なハードウェアおよび/またはソルトウェアであり得る。コンピュータネットワークは、ワイヤレスアクセスポイント、スイッチ、ルータ、ゲートウェイ、および/もしくは他のネットワーク機器、ならびに、インターネットを含む、2つ以上のコンピュータ間でデータ交換するためのいずれかの適切な有線および/または無線の通信媒体を含み得る。コンピュータ可読媒体3410は、プロセッサ3402により処理されるデータおよび/または実行される命令を保存するように構成され得る。プロセッサ3402は、データの処理および命令の実行を可能にする。このデータおよび命令は、コンピュータ可読記憶媒体3410に保存され得る。
装置3400が本明細書中記載の医療機器である実施形態では、装置3400は、対象を診断および/または治療するために対象の体内に挿入される侵襲的医療機器3406を含み得る。装置3406は、上述の侵襲的プローブ3408を含む。
コンピュータ可読記憶媒体3410で保存されたデータおよび命令は、本明細書中記載の原則にしたがい作動する技術を実施する、コンピュータで実行可能な命令を含み得る。図34の例では、コンピュータ可読記憶媒体3410は、上述のように様々な設備を実施し、様々な情報を保存するコンピュータで実行可能な命令を保存する。コンピュータ可読記録媒体3410は、病変の組成を含む病変の1つ以上の特徴を解析するため、および/またはこの解析に基づき治療勧告を決定するために、病変解析設備3412を保存し得る。コンピュータ可読記憶媒体3410は、さらに、設備3412により使用され得る治療の選択肢に関する条件3414を保存し得る。また、コンピュータ可読記憶媒体3410は、学習設備3416およびクロニクル作成設備3418を保存し得る。
図34に例示されてはいないが、コンピュータ装置は、入力デバイスおよび出力デバイスを含む1つ以上の構成要素および周辺機器をさらに有し得る。これらのデバイスは、特に、ユーザインターフェースを提示するために使用することができる。ユーザインターフェースを提供するために使用できる出力デバイスの例として、出力を視覚的に提示するためのプリンターまたはディスプレイスクリーン、および出力を聴覚的に提示するためのスピーカーまたは他の音響発生装置が挙げられる。ユーザインターフェースに使用できる入力デバイスの例として、キーボード、およびポインティングデバイス、たとえば、マウス、タッチパッド、およびデジタルタブレットが挙げられる。別の例として、コンピュータ装置は、音声認識を介するかまたは他の音響上の形式で入力された情報を受信し得る。
本技術を回路および/またはコンピュータで実行可能な命令で実施する実施形態を記載してきた。一部の実施形態は、少なくとも1つの例が提供されている方法の形態であり得ることを理解すべきである。この方法の一部として行われた行為は、任意の適切な方法で順序づけられてもよい。よって。例示されたものと異なる順序で行為を行う実施形態を構築してもよく、これは、例示の実施形態における一連の行為として示されたものであっても、同時にいくつかの行為を行うことを含み得る。
上述の実施形態の様々な態様は、単独で使用してもよく、組み合わせて使用してもよく、または上述の実施形態に具体的に論述されていない様々な構成で使用されてもよく、よって、上記の説明に記載されているかまたは図面に例示されている構成要素の詳細および構成に当該態様を適用することに限定されるものではない。たとえば、一実施形態に記載の態様は、他の実施形態の態様と何らかの方法で組み合わせてもよい。
特許請求の範囲の要素を修正するための、特許請求の範囲における「第1の」、「第2の」、「第3の」などの順序の用語の使用は、それ自体が、1つの特許請求の範囲の、別の特許請求の範囲よりも優れた何らかの優先事項、優位性、もしくは順序、またはある方法の行為を行う時間上の順序を暗示するものではなく、単に、特許請求の範囲の要素を区別するために、特定の名称を有する1つの特許請求項の範囲の要素を、同じ名称を有する別の要素と区別するための標識として(しかしながら本来の用語の使用のために)使用する。
また、本明細書中使用される文言および用語は、説明のためのものであり、限定されるとみなすべきではない。本明細書中の「含む」、「備える」、「有する」、「包含する」、「伴う」、およびその変形は、その後に列挙される項目およびその均等物、ならびに追加的な項目を含むことを意味している。
用語「例示的な」は、例、実例、または例示として作用することを意味するように本明細書中使用されている。よって、例としての、本明細書中記載のいずれかの実施形態、実施、プロセス、特性などは、例示的な例と理解すべきであり、特段他の記載がない限り好ましい例または好適な例と理解すべきではない。
よって、少なくとも1つの実施形態のいくつかの態様を記載してきたが、様々な変更、修正、および改善が、当業者に容易に想起されるであろうことを理解すべきである。このような変更、修正、および改善は、本開示の一部と意図されており、本明細書中記載の原則の趣旨および範囲内にあると意図されている。よって、上記の説明および図面は、単なる例である。