JP5646337B2 - 被分析物の濃度を決定するための光学センサ - Google Patents
被分析物の濃度を決定するための光学センサ Download PDFInfo
- Publication number
- JP5646337B2 JP5646337B2 JP2010533075A JP2010533075A JP5646337B2 JP 5646337 B2 JP5646337 B2 JP 5646337B2 JP 2010533075 A JP2010533075 A JP 2010533075A JP 2010533075 A JP2010533075 A JP 2010533075A JP 5646337 B2 JP5646337 B2 JP 5646337B2
- Authority
- JP
- Japan
- Prior art keywords
- radiation
- radiation beam
- analyte
- concentration
- emitting
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/17—Systems in which incident light is modified in accordance with the properties of the material investigated
- G01N21/47—Scattering, i.e. diffuse reflection
- G01N21/49—Scattering, i.e. diffuse reflection within a body or fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/0059—Measuring for diagnostic purposes; Identification of persons using light, e.g. diagnosis by transillumination, diascopy, fluorescence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/145—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue
- A61B5/14532—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue for measuring glucose, e.g. by tissue impedance measurement
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/145—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue
- A61B5/1455—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue using optical sensors, e.g. spectral photometrical oximeters
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/17—Systems in which incident light is modified in accordance with the properties of the material investigated
- G01N21/1717—Systems in which incident light is modified in accordance with the properties of the material investigated with a modulation of one or more physical properties of the sample during the optical investigation, e.g. electro-reflectance
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/72—Signal processing specially adapted for physiological signals or for diagnostic purposes
- A61B5/7235—Details of waveform analysis
- A61B5/7239—Details of waveform analysis using differentiation including higher order derivatives
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/17—Systems in which incident light is modified in accordance with the properties of the material investigated
- G01N21/1717—Systems in which incident light is modified in accordance with the properties of the material investigated with a modulation of one or more physical properties of the sample during the optical investigation, e.g. electro-reflectance
- G01N2021/1725—Modulation of properties by light, e.g. photoreflectance
Description
Claims (72)
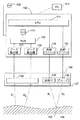
- 第1の放射ビーム及び少なくとも1つの第2の放射ビームを放射する働きをする、少なくとも1つの放射源であり、前記第1の放射ビームは、組織の実験領域を照射して、第1の散乱放射を引き起こし、前記少なくとも1つの第2の放射ビームは、前記第1の放射ビームより低い強度を有し、かつ、周期的に前記実験領域を照射して、周期的な第2の散乱放射を引き起こす少なくとも1つの放射源と、
前記第1の散乱放射及び前記第2の散乱放射を検出し、検出された前記散乱放射を電気信号に変換する少なくとも1つの検出器であり、前記実験領域から異なる距離に配置される2つの受光センサを備える、少なくとも1つの検出器と、
前記電気信号に基づいて被分析物の濃度を決定するためのプロセッサと、を備える、組織内の被分析物の濃度を決定するための装置。 - 前記第1の放射ビーム及び前記第2の放射ビームは、所定の媒質内の前記被分析物の特性吸収帯から選択される所定の波長を有する、請求項1に記載の装置。
- 前記第1の放射ビーム及び前記第2の放射ビームは、所定の波長を有し、
前記第1の放射ビームの前記所定の波長は、所定の媒質内の前記被分析物の吸収帯のピークに対応し、
前記第1の放射ビームは、前記組織と相互作用して、少なくとも1つの過渡プロセスに前記被分析物の前記濃度に依存させる、請求項1に記載の装置。 - 前記第1の放射ビーム及び前記第2の放射ビームは、同一の波長を有する、請求項1に記載の装置。
- 前記第1の放射ビーム及び前記第2の放射ビームは、異なる波長を有する、請求項1に記載の装置。
- 前記第1の放射ビーム及び前記第2の放射ビームのうちの1つは、各々所定の媒質内の前記被分析物の吸収帯のピークより大きい波長を有し、
前記第1の放射ビーム及び前記第2の放射ビームのうちの1つは、所定の媒質内の前記被分析物の前記吸収帯のピークより小さい波長を有する、請求項5に記載の装置。 - 前記第1の放射ビームは、前記組織内に少なくとも1つの周期的な又は非周期的な過渡プロセスを励起し、
前記第1の散乱放射及び前記第2の散乱放射のうちの少なくとも1つは、少なくとも1つの前記過渡プロセスにより、少なくとも部分的に変調される、請求項1に記載の装置。 - 前記少なくとも1つの過渡プロセスは、光音響振動を含む、請求項7に記載の装置。
- 前記電気信号は、前記少なくとも1つの過渡プロセスの振幅、周波数又は減衰期間のうちの少なくとも1つを表わす、請求項7に記載の装置。
- 前記第1の放射ビーム及び前記第2の放射ビームは、パルス間に遅れを有する単パルスを備える、請求項1に記載の装置。
- 前記第2の放射ビームは、可変繰り返し率を有する準連続波(QCW)の実質的に等しい間隔の短パルスを備える、請求項1に記載の装置。
- 前記第2の放射ビームは、可変周波数、可変パルス電力、可変パルス持続時間及び可変パルス数を有するパルス列を備える、請求項1に記載の装置。
- 前記第1の放射ビーム及び前記第2の放射ビームは、前記実験領域の実質的に同一点に合焦される、請求項1に記載の装置。
- 前記第1の放射ビームは、約1〜10Wの電力を有する、請求項1に記載の装置。
- 前記第1の放射ビームは、約5Wの電力を有する、請求項1に記載の装置。
- 前記第1の放射ビームは、約1550nmの波長を有する、請求項1に記載の装置。
- 前記第2の放射ビームは、約0.1〜1Wの電力を有する、請求項1に記載の装置。
- 前記第2の放射ビームは、約0.25〜0.5Wの電力を有する、請求項1に記載の装置。
- 前記第2の放射ビームは、約1610nm〜1690nmの波長を有する、請求項1に記載の装置。
- 前記少なくとも1つの放射源は、パルスレーザーダイオードを備える、請求項1に記載の装置。
- 前記少なくとも1つの放射源は、ファイバー結合ダイオードレーザーアレイを備える、請求項1に記載の装置。
- 前記少なくとも1つの放射源は、パルス光ファイバーレーザーを備える、請求項1に記載の装置。
- 前記少なくとも1つの放射源は、ダイオードレーザーにより励起されたエルビウム(Er)ガラスロッド若しくはスラブレーザ又は閃光電球を備える、請求項1に記載の装置。
- 前記少なくとも1つの放射源は、波長可変なCo:MgF2レーザを備える、請求項1に記載の装置。
- 前記少なくとも1つの放射源は、ネオジム含有の光学媒質Q−スイッチレーザーを備え、可変持続時間、可変周波数、可変数及び可変電力を有する等間隔の短パルスを与える準連続波発生をもたらす、請求項1に記載の装置。
- 前記第1の放射ビーム及び前記第2の放射ビームのうちの少なくとも1つの波長を変換するための光変換器を、さらに備える、請求項1に記載の装置。
- 前記第1の放射ビーム及び前記第2の放射ビームのうちの少なくとも1つの出力を増大するための光ファイバー増幅器を、さらに備える、請求項1に記載の装置。
- 前記少なくとも1つの検出器は、フォトダイオードを備える、請求項1に記載の装置。
- 光学部品筐体及び電子機器筐体をさらに備え、
前記少なくとも1つの放射源及び前記少なくとも1つの検出器は、前記光学部品筐体に含まれ、
前記プロセッサは、前記電子機器筐体に含まれ、
前記光学部品筐体は前記電子機器筐体に動作可能に接続される、請求項1に記載の装置。 - 前記光学部品筐体は光ファイバープローブを備える、請求項29に記載の装置。
- 前記光ファイバープローブは、束にした複数の光ファイバーを備え、
少なくとも1つの前記光ファイバーは、前記少なくとも1つの放射源を備え、
少なくとも1つの前記光ファイバーは、前記少なくとも1つの検出器を備える、請求項29に記載の装置。 - 前記装置は、携帯用、ハンドヘルドの又はデスクトップの機器に含まれる、請求項1に記載の装置。
- 前記携帯用機器は、無線通信デバイスを備える、請求項32に記載の装置。
- 前記少なくとも1つの放射源及び前記少なくとも1つの検出器を収容する、光学部品筐体をさらに備える、請求項1に記載の装置。
- 前記光学部品筐体は、プローブを備える、請求項34に記載の装置。
- 前記プローブは、前記プローブに取り付けた接触センサをさらに備え、
該接触センサは、前記プローブと前記実験領域との間の係合の検出を可能にし、
係合が検出されなければ、前記第1の放射源及び前記第2の放射源は、前記第1の放射ビーム及び前記第2の放射ビームを放射しない、請求項35に記載の装置。 - 前記プローブは、前記プローブに取り付けた圧力センサをさらに備え、
該圧力センサは、前記プローブと前記実験領域との間の圧力の検出を可能にし、
検出された前記圧力が所定の圧力に等しくなければ、前記第1の放射源及び前記第2の放射源は、前記第1の放射ビーム及び前記第2の放射ビームを放射しない、請求項35に記載の装置。 - 前記第1の放射ビーム及び前記第2の放射ビームが所定の位置に入射することを確保するために、前記実験領域をモニタするための画像解析ハードウェア又は画像解析ソフトウェアのうちの少なくとも1つをさらに備える、請求項1に記載の装置。
- 画像解析ハードウェア又は画像解析ソフトウェアのうちの前記少なくとも1つは、携帯用ビデオカメラ及び撮像ソフトウェアを備える、請求項36に記載の装置。
- 前記被分析物はグルコースである、請求項1に記載の装置。
- 最初の後方散乱放射を引き起こす第1の放射ビームと、実験領域を周期的に照射して周期的な後方散乱放射を引き起こす第2の放射ビームを放射する、少なくとも1つの放射源を用いて、組織の前記実験領域を照射するステップと、
前記最初の後方散乱放射及び前記周期的な後方散乱放射を検出するステップであり、それぞれが前記実験領域から異なる距離に配置される2つの受光センサを提供するステップを含む、前記後方散乱放射を検出するステップと、
検出された前記最初の後方散乱放射及び前記周期的な後方散乱放射を電気信号に変換するステップと、
前記電気信号に応じて被分析物の濃度を決定するステップと、を有する、組織内の被分析物の濃度を決定するための方法。 - 前記実験領域を照射するステップは、
媒質内の前記被分析物の吸収帯の範囲内の所定の波長を有する第1の放射ビーム及び第2の放射ビームで前記実験領域を照射するステップを有し、
前記被分析物による前記ビームの吸収は過渡プロセスを引き起こす、請求項41に記載の方法。 - 前記実験領域を照射するステップは、
前記被分析物の吸収帯のピークに対応する所定の波長を有する第1の放射ビーム及び第2の放射ビームで前記実験領域を照射するステップを有し、
前記被分析物以外の成分による前記ビームの吸収は、前記被分析物の前記濃度に依存する過渡プロセスを引き起こす、請求項41に記載の方法。 - 前記実験領域を照射するステップは、
同一の波長を有する第1の放射ビーム及び第2の放射ビームで前記実験領域を照射するステップを有する、請求項41に記載の方法。 - 前記第1の放射ビーム及び前記第2の放射ビームは、異なる波長を有する、請求項41に記載の方法。
- 前記第1の放射ビーム及び前記第2の放射ビームのうちの1つは、前記被分析物の吸収帯のピークより大きい波長を有し、
前記第1の放射ビーム及び前記第2の放射ビームのうちの1つは、前記被分析物の前記吸収帯のピークより小さい波長を有するように、前記実験領域を照射するステップを、さらに有する、請求項45に記載の方法。 - 前記実験領域を照射するステップは、
前記組織内に少なくとも1つの周期的な又は非周期的な過渡プロセスを励起するために、前記第1の放射ビームを放射するステップを有し、
前記後方散乱のうちの少なくとも1つは、少なくとも1つの前記過渡プロセスにより、少なくとも部分的に変調される、請求項41に記載の方法。 - 前記少なくとも1つの過渡プロセスは、光音響振動を含む、請求項47に記載の方法。
- 検出された前記後方散乱放射を電気信号に変換するステップは、
検出された前記後方散乱放射を、前記過渡プロセスの振幅、周波数又は減衰期間のうちの1つに対応する電気信号に変換するステップを有する、請求項47に記載の方法。 - 前記第1の放射ビーム及び前記第2の放射ビームを放射するステップは、
パルス間に可変時間遅れを有する短い単パルスを放射するステップを有する、請求項41に記載の方法。 - 前記第1の放射ビーム及び前記第2の放射ビームを放射するステップは、
可変繰り返し率を有する準連続波(QCW)光の等距離の短パルスを放射するステップを有する、請求項41に記載の方法。 - 前記第1の放射ビーム及び前記第2の放射ビームを放射するステップは、
等距離の短パルスのパルス列を放射するステップを有し、
周波数、パルス電力、パルス持続時間及びパルスの数のうちの少なくとも1つが可変である、請求項41に記載の方法。 - 前記実験領域を照射するステップは、
前記実験領域から所定の距離の共用点に、前記第1の放射ビーム及び前記第2の放射ビームを合焦するステップを有する、請求項41に記載の方法。 - 前記第1の放射ビームを放射するステップは、
約1〜10Wの電力で前記第1の放射ビームを放射するステップを有する、請求項41に記載の方法。 - 前記第1の放射ビームを放射するステップは、
約5Wの電力で前記第1の放射ビームを放射するステップを有する、請求項41に記載の方法。 - 前記第1の放射ビームを放射するステップは、
約1550nmの波長で前記第1の放射ビームを放射するステップを有する、請求項41に記載の方法。 - 前記第2の放射ビームを放射するステップは、
約0.1〜1Wの電力で前記第2の放射ビームを放射するステップを有する、請求項41に記載の方法。 - 前記第2の放射ビームを放射するステップは、
約0.25〜0.5Wの電力で前記第2の放射ビームを放射するステップを有する、請求項41に記載の方法。 - 前記第2の放射ビームを放射するステップは、
約1610nm〜1690nmの波長で前記第2の放射ビームを放射するステップを有する、請求項41に記載の方法。 - 前記第1の放射ビーム及び前記第2の放射ビームの電力を増幅するステップを、さらに有する、請求項41に記載の方法。
- 関心領域を照射するためのプローブと前記関心領域との間の圧力を検出するステップをさらに有し、
検出された前記圧力が所定の圧力に等しくなければ、前記第1の放射ビーム及び前記第2の放射ビームが放射されない、請求項41に記載の方法。 - 前記被分析物はグルコースを含む、請求項41に記載の方法。
- 較正するステップをさらに有し、
較正するステップは、
被分析物を含む流体サンプルを得るステップと、
流体ベースの装置を用いて前記被分析物の基準濃度を決定するステップと、
決定された濃度が前記基準濃度に等しいかどうかを決定し、前記決定された濃度が前記基準濃度に等しくなければ、前記決定された濃度が前記基準濃度に等しくなるように、検出された前記電気信号のオフセット較正をするステップと、を有する、請求項41に記載の方法。 - 前記決定された濃度が前記基準濃度に等しくなるまで、複数回、前記ステップを繰り返すステップをさらに有する、請求項63に記載の方法。
- 決定された前記濃度を表示するステップをさらに有する、請求項41に記載の方法。
- 画像解析ハードウェア又は画像解析ソフトウェアのうちの少なくとも1つを用いて、前記第1の放射ビーム及び前記第2の放射ビームの照射位置をモニタするステップをさらに有する、請求項41に記載の方法。
- 被検者のグルコースの濃度を決定するための光学装置の中で用いられるプローブヘッドであって、
第1の放射ビーム及び少なくとも1つの第2の放射ビームを放射する働きをする少なくとも1つの放射源に結合された複数の光ファイバーであって、前記第1の放射ビームは組織の実験領域を照射して第1の散乱放射を引き起こし、前記少なくとも1つの第2の放射ビームは周期的に前記実験領域を照射して周期的な第2の散乱放射を引き起こすものである、前記複数の光ファイバと、
前記第1及び第2の散乱放射を検出し、検出された前記散乱放射を電気信号に変換する少なくとも1つの検出器であり、前記実験領域から異なる距離に配置される2つの受光センサを備える、少なくとも1つの検出器と、
前記少なくとも1つの放射源へ電気信号を送信し、前記少なくとも1つの検出器からの電気信号を送信するための入力/出力インターフェースと、を備えるプローブヘッド。 - 前記少なくとも1つの放射源に結合された光ファイバーが、前記少なくとも1つの検出器に結合された光ファイバーにより包囲されるように、前記複数の光ファイバーが配置される、請求項67に記載のプローブヘッド。
- 前記プローブヘッドの部分に取り付けた圧力センサをさらに備え、
該圧力センサは、前記プローブヘッドと前記プローブヘッドに接触する表面との間の圧力を検出し、
検出された前記圧力が所定の圧力に等しくなければ、前記光学装置は被検者の前記グルコースの濃度を決定しない、請求項67に記載のプローブヘッド。 - 前記プローブヘッドは、携帯用及びハンドヘルドである、請求項67に記載のプローブヘッド。
- 光学的励起及び光学的検出を用いて、被検者内のグルコースの濃度を非侵襲的に決定するための装置であって、
前記被検者の組織の一部を照射する励起ビームを放射して、前記組織の一部に物理的及び化学的変化の少なくとも1つを引き起こし、最初の後方散乱放射を引き起こす、第1の放射源と、
前記組織の一部を照射するプローブビームを周期的に放射して、周期的な後方散乱放射を引き起こす、第2の放射源と、
前記最初の後方散乱放射及び前記周期的な後方散乱放射を検出し、検出された前記後方散乱放射を前記物理的及び化学的変化の振幅、周波数及び減衰期間のうちの少なくとも1つの電気信号に変換するための少なくとも1つの検出器であり、前記後方散乱放射は、前記物理的及び化学的変化により変調されるものである、前記少なくとも1つの検出器であり、前記実験領域から異なる距離に配置される2つの受光センサを備える、少なくとも1つの検出器と、
前記物理的及び化学的変化の振幅、周波数及び減衰期間のうちの少なくとも1つを時間にわたって微分することにより、グルコースの前記濃度を決定するためのプロセッサと
を備える装置。 - 光学的励起及び光学的検出を用いて、被検者内のグルコースの濃度を非侵襲的に決定するための方法であって、
前記被検者の組織の一部を照射する励起ビームを放射して、表面に物理的及び化学的変化を引き起こし、最初の後方散乱光を引き起こすステップと、
前記組織の一部を照射するプローブビームを周期的に放射して、周期的な後方散乱光を引き起こすステップと、
前記実験領域から異なる距離に配置される2つの受光センサを使用して、前記最初の後方散乱光及び前記周期的な後方散乱光を検出し、検出された前記後方散乱光を前記物理的及び化学的変化の振幅、周波数及び減衰期間のうちの少なくとも1つの電気信号に変換するステップであり、前記後方散乱光は、前記物理的及び化学的変化により変調されるステップと、
前記物理的及び化学的変化の振幅、周波数及び減衰期間のうちの少なくとも1つを時間にわたって微分することにより、グルコースの前記濃度を決定するステップと
を備える方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US196007P | 2007-11-05 | 2007-11-05 | |
| US61/001,960 | 2007-11-05 | ||
| PCT/US2008/012349 WO2009061367A2 (en) | 2007-11-05 | 2008-10-31 | Optical sensor for determining the concentration of an analyte |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2011502627A JP2011502627A (ja) | 2011-01-27 |
| JP2011502627A5 JP2011502627A5 (ja) | 2011-05-19 |
| JP5646337B2 true JP5646337B2 (ja) | 2014-12-24 |
Family
ID=40292516
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010533075A Expired - Fee Related JP5646337B2 (ja) | 2007-11-05 | 2008-10-31 | 被分析物の濃度を決定するための光学センサ |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US9915608B2 (ja) |
| EP (1) | EP2207474B1 (ja) |
| JP (1) | JP5646337B2 (ja) |
| CN (2) | CN101917899B (ja) |
| AU (1) | AU2008325237B2 (ja) |
| CA (1) | CA2704789C (ja) |
| HK (2) | HK1151958A1 (ja) |
| IL (1) | IL205499A (ja) |
| TW (1) | TWI468688B (ja) |
| WO (1) | WO2009061367A2 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101746352B1 (ko) | 2016-04-29 | 2017-06-12 | 다담마이크로 주식회사 | 광반사 측정법을 이용한 비침습식 혈당 측정 방법 및 장치 |
Families Citing this family (31)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10413188B2 (en) * | 2004-11-17 | 2019-09-17 | Lawrence Livermore National Security, Llc | Assessment of tissue or lesion depth using temporally resolved light scattering spectroscopy |
| US9451884B2 (en) | 2007-12-13 | 2016-09-27 | Board Of Trustees Of The University Of Arkansas | Device and method for in vivo detection of clots within circulatory vessels |
| US20090156932A1 (en) * | 2007-12-13 | 2009-06-18 | Board Of Trustees Of The University Of Arkansas | Device and method for in vivo flow cytometry using the detection of photoacoustic waves |
| EP2525194A1 (en) * | 2011-05-16 | 2012-11-21 | Knowles Electronics Asia PTE. Ltd. | Optical sensor |
| CN104053402B (zh) * | 2012-01-18 | 2017-04-19 | 佳能株式会社 | 被检体信息获得设备和关于被检体的信息的获得方法 |
| EP2967454B1 (en) * | 2013-03-14 | 2020-04-22 | Profusa, Inc. | Method and device for correcting optical signals |
| US10219729B2 (en) * | 2013-06-06 | 2019-03-05 | Profusa, Inc. | Apparatus and methods for detecting optical signals from implanted sensors |
| US20150051473A1 (en) * | 2013-08-15 | 2015-02-19 | Covidien Lp | Systems and methods for photoacoustic spectroscopy |
| KR102270798B1 (ko) | 2013-12-16 | 2021-06-30 | 삼성메디슨 주식회사 | 광음향 프로브 및 광음향 진단 장치 |
| KR102143632B1 (ko) | 2013-12-30 | 2020-08-11 | 삼성메디슨 주식회사 | 광음향 프로브 및 광음향 진단장치 |
| CN104000599B (zh) * | 2014-05-07 | 2016-06-01 | 辛勤 | 一种测量血糖浓度的方法及便携式设备 |
| DE102014108424B3 (de) * | 2014-06-16 | 2015-06-11 | Johann Wolfgang Goethe-Universität | Nicht-invasive Stoffanalyse |
| KR102244992B1 (ko) | 2014-10-17 | 2021-04-28 | 삼성전자주식회사 | 부하 전류 정보를 제공하는 전력관리 집적회로 및 그것을 포함하는 전자 장치 |
| KR102390874B1 (ko) * | 2014-10-29 | 2022-04-26 | 삼성전자주식회사 | 혈당 측정기 및 그에 따른 혈당 측정 방법 |
| CN104490403B (zh) * | 2014-12-06 | 2016-08-17 | 深圳市贝沃德克生物技术研究院有限公司 | 基于光谱技术的无创血糖测量系统及其测量方法 |
| CN104586370B (zh) * | 2014-12-31 | 2018-01-30 | 歌尔股份有限公司 | 一种光电式脉搏信号测量方法、装置及测量设备 |
| DK3106086T3 (da) | 2014-12-31 | 2020-01-06 | Goertek Inc | Fremgangsmåde til måling af impulssignal af fotoelektrisk type og måleindretning |
| EP3240472B1 (en) | 2014-12-31 | 2023-07-26 | Bioventures, LLC. | Devices and methods for fractionated photoacoustic flow cytometry |
| US10267956B2 (en) | 2015-04-14 | 2019-04-23 | California Institute Of Technology | Multi-wavelength optical dielectric metasurfaces |
| FR3035716B1 (fr) * | 2015-04-30 | 2019-06-21 | Biomerieux | Machine et procede pour la detection automatisee in vitro d'analytes mettant en oeuvre une decomposition spectrale chromatique d'une reponse optique |
| US9696259B2 (en) * | 2015-08-18 | 2017-07-04 | Lumasense Technologies Holdings, Inc. | Optode sensor with integrated reference |
| WO2017034995A1 (en) * | 2015-08-21 | 2017-03-02 | California Institute Of Technology | Planar diffractive device with matching diffraction spectrum |
| EP3524962A1 (de) | 2015-12-09 | 2019-08-14 | Diamontech GmbH | Vorrichtung und verfahren zum analysieren eines stoffs |
| EP3495800B1 (de) | 2015-12-09 | 2023-09-20 | DiaMonTech AG | Vorrichtung und verfahren zum analysieren eines stoffs |
| US10670782B2 (en) | 2016-01-22 | 2020-06-02 | California Institute Of Technology | Dispersionless and dispersion-controlled optical dielectric metasurfaces |
| EP3315069A1 (en) | 2016-10-25 | 2018-05-02 | Roche Diabetes Care GmbH | Method for determination of an analyte concentration in a body fluid and analyte concentration measurement device |
| GB2557311B (en) * | 2016-12-06 | 2021-05-12 | Rsp Systems As | Analyte Detection apparatus and method of detecting an analyte |
| US10666321B2 (en) * | 2016-12-29 | 2020-05-26 | Tektronix, Inc. | Sampling gate for broadband frequency reconstruction |
| US10488651B2 (en) | 2017-04-10 | 2019-11-26 | California Institute Of Technology | Tunable elastic dielectric metasurface lenses |
| KR102597283B1 (ko) * | 2017-05-22 | 2023-11-01 | 브로리스 센서 테크놀로지, 유에이비 | 혈액 구성성분 농도 레벨의 실시간 모니터링을 위한 튜닝가능형 하이브리드 iii-v/iv 레이저 센서 시스템 온 칩 |
| CN107997769A (zh) * | 2017-11-24 | 2018-05-08 | 天津大学 | 一种基于耳垂血液层的微波时延无创血糖浓度检测法 |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4573761A (en) * | 1983-09-14 | 1986-03-04 | The Dow Chemical Company | Fiber-optic probe for sensitive Raman analysis |
| US5119815A (en) * | 1988-12-21 | 1992-06-09 | Nim, Incorporated | Apparatus for determining the concentration of a tissue pigment of known absorbance, in vivo, using the decay characteristics of scintered electromagnetic radiation |
| US5657754A (en) | 1995-07-10 | 1997-08-19 | Rosencwaig; Allan | Apparatus for non-invasive analyses of biological compounds |
| JP4120684B2 (ja) * | 1996-11-26 | 2008-07-16 | 松下電工株式会社 | 分光分析法による血液成分濃度の分析装置 |
| JP4212007B2 (ja) | 1996-11-26 | 2009-01-21 | パナソニック電工株式会社 | 血液成分濃度の分析装置 |
| US5941821A (en) * | 1997-11-25 | 1999-08-24 | Trw Inc. | Method and apparatus for noninvasive measurement of blood glucose by photoacoustics |
| US6097975A (en) * | 1998-05-13 | 2000-08-01 | Biosensor, Inc. | Apparatus and method for noninvasive glucose measurement |
| US7133710B2 (en) * | 2002-03-08 | 2006-11-07 | Sensys Medical, Inc. | Compact apparatus for noninvasive measurement of glucose through near-infrared spectroscopy |
| US6889075B2 (en) * | 2000-05-03 | 2005-05-03 | Rocky Mountain Biosystems, Inc. | Optical imaging of subsurface anatomical structures and biomolecules |
| US6635491B1 (en) * | 2000-07-28 | 2003-10-21 | Abbott Labortories | Method for non-invasively determining the concentration of an analyte by compensating for the effect of tissue hydration |
| WO2002016905A2 (en) * | 2000-08-21 | 2002-02-28 | Euro-Celtique, S.A. | Near infrared blood glucose monitoring system |
| JP3590047B1 (ja) | 2003-09-24 | 2004-11-17 | 株式会社日立製作所 | 光学測定装置及びそれを用いた血糖値測定装置 |
| US20050277872A1 (en) * | 2004-05-24 | 2005-12-15 | Colby John E Jr | Apparatus and method for mobile medical services |
| BRPI0616167A2 (pt) * | 2005-09-15 | 2011-06-07 | Palomar Medical Tech Inc | dispositivo de caracterização ótica da pele |
-
2008
- 2008-10-31 CN CN200880124606.9A patent/CN101917899B/zh not_active Expired - Fee Related
- 2008-10-31 CN CN201110391618.1A patent/CN102512175B/zh not_active Expired - Fee Related
- 2008-10-31 JP JP2010533075A patent/JP5646337B2/ja not_active Expired - Fee Related
- 2008-10-31 WO PCT/US2008/012349 patent/WO2009061367A2/en active Application Filing
- 2008-10-31 AU AU2008325237A patent/AU2008325237B2/en not_active Ceased
- 2008-10-31 EP EP08846768.3A patent/EP2207474B1/en not_active Not-in-force
- 2008-10-31 US US12/741,350 patent/US9915608B2/en not_active Expired - Fee Related
- 2008-10-31 CA CA2704789A patent/CA2704789C/en not_active Expired - Fee Related
- 2008-11-04 TW TW97142521A patent/TWI468688B/zh not_active IP Right Cessation
-
2010
- 2010-05-02 IL IL205499A patent/IL205499A/en not_active IP Right Cessation
-
2011
- 2011-06-14 HK HK11106057.4A patent/HK1151958A1/xx not_active IP Right Cessation
-
2012
- 2012-12-21 HK HK12113268.4A patent/HK1172229A1/zh not_active IP Right Cessation
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101746352B1 (ko) | 2016-04-29 | 2017-06-12 | 다담마이크로 주식회사 | 광반사 측정법을 이용한 비침습식 혈당 측정 방법 및 장치 |
| WO2017188675A1 (ko) * | 2016-04-29 | 2017-11-02 | 다담마이크로 주식회사 | 광반사 측정법을 이용한 비침습식 혈당 측정 방법 및 장치 |
| US10779755B2 (en) | 2016-04-29 | 2020-09-22 | Dadam Micro Inc. | Non-invasive blood sugar measurement method and device using optical reflectometry |
Also Published As
| Publication number | Publication date |
|---|---|
| CN101917899B (zh) | 2014-03-12 |
| WO2009061367A3 (en) | 2009-08-13 |
| AU2008325237A1 (en) | 2009-05-14 |
| US9915608B2 (en) | 2018-03-13 |
| CN102512175A (zh) | 2012-06-27 |
| WO2009061367A2 (en) | 2009-05-14 |
| AU2008325237B2 (en) | 2014-05-01 |
| EP2207474B1 (en) | 2018-08-22 |
| HK1172229A1 (zh) | 2013-04-19 |
| EP2207474A2 (en) | 2010-07-21 |
| TW200935054A (en) | 2009-08-16 |
| TWI468688B (zh) | 2015-01-11 |
| CN102512175B (zh) | 2015-12-02 |
| IL205499A0 (en) | 2010-12-30 |
| JP2011502627A (ja) | 2011-01-27 |
| CA2704789A1 (en) | 2009-05-14 |
| IL205499A (en) | 2013-03-24 |
| CN101917899A (zh) | 2010-12-15 |
| US20110105867A1 (en) | 2011-05-05 |
| CA2704789C (en) | 2018-07-24 |
| HK1151958A1 (en) | 2012-02-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5646337B2 (ja) | 被分析物の濃度を決定するための光学センサ | |
| JP5541662B2 (ja) | 被検体情報取得装置およびその制御方法 | |
| US10413193B2 (en) | Photoacoustic apparatus | |
| JP5235586B2 (ja) | 生体情報処理装置及び生体情報処理方法 | |
| CN101346097B (zh) | 血糖浓度的无创测量系统 | |
| JP5837115B2 (ja) | 被検体情報取得装置 | |
| US20100087733A1 (en) | Biological information processing apparatus and biological information processing method | |
| JP2006516207A (ja) | 光音響分析方法及び装置 | |
| JP2010088627A5 (ja) | ||
| KR20030075779A (ko) | 광음향분광학을 이용한 비침습적 생체성분 측정장치 및 그측정방법 | |
| JP4751271B2 (ja) | 被検体組織内の被分析物の濃度測定のための光音響分析方法及び光音響分析装置 | |
| WO2011152747A1 (en) | Photoacoustic material analysis | |
| CN104856728B (zh) | 光声装置 | |
| US9566006B2 (en) | Object information acquisition apparatus | |
| RU2435514C1 (ru) | Способ фотоакустического анализа материалов и устройство для его реализации | |
| JP5575293B2 (ja) | 被検体情報取得装置及び被検体情報取得方法 | |
| US20230293055A1 (en) | Smart-Tooth Blood Glucose Measurement Device |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| RD01 | Notification of change of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7426 Effective date: 20101202 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20101202 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110404 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20110913 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130716 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20131011 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20131203 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20140225 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20140304 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140515 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20141007 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20141105 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5646337 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |