JP5320692B2 - Yeast and method for producing L-lactic acid - Google Patents
Yeast and method for producing L-lactic acid Download PDFInfo
- Publication number
- JP5320692B2 JP5320692B2 JP2007163859A JP2007163859A JP5320692B2 JP 5320692 B2 JP5320692 B2 JP 5320692B2 JP 2007163859 A JP2007163859 A JP 2007163859A JP 2007163859 A JP2007163859 A JP 2007163859A JP 5320692 B2 JP5320692 B2 JP 5320692B2
- Authority
- JP
- Japan
- Prior art keywords
- gene
- yeast
- derived
- lactic acid
- xenopus laevis
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Landscapes
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
Abstract
Description
本発明は、L−乳酸脱水素酵素をコードする遺伝子が導入された酵母及び該酵母を培養することを含むL−乳酸の製造方法に関するものである。 The present invention relates to a yeast into which a gene encoding L-lactate dehydrogenase has been introduced and a method for producing L-lactic acid comprising culturing the yeast.
最近、資源循環型社会の構築に向け、植物を原料としたポリマーに注目が集まっている。その中でも、ポリ乳酸(以下、PLAと略すことがある。)が、植物原料のポリマーとして優れた性質を有することが明らかになってきている。 Recently, attention has been focused on polymers made from plant materials for the establishment of a resource recycling society. Among them, it has become clear that polylactic acid (hereinafter sometimes abbreviated as PLA) has excellent properties as a plant raw material polymer.
PLAの原料である乳酸は、従来ラクトバチラス(Lactobacillus)属やラクトコッカス(Lactococcus)属に代表される、いわゆる乳酸菌と総称される微生物を培養することにより製造されている。これらの乳酸菌は、糖からの乳酸の収率には優れているものの酸に対する耐性が低いことから、酸性物質である乳酸を多量に蓄積させるためには、炭酸カルシウムや水酸化アンモニウム、あるいは水酸化ナトリウムなどのアルカリで中和をしながら、培養を行わなければならない。 Lactic acid, which is a raw material for PLA, has been conventionally produced by culturing microorganisms collectively called so-called lactic acid bacteria represented by the genus Lactobacillus and the genus Lactococcus. These lactic acid bacteria are excellent in the yield of lactic acid from sugar, but have low resistance to acid. Therefore, in order to accumulate a large amount of lactic acid, which is an acidic substance, calcium carbonate, ammonium hydroxide, or hydroxide Cultivation must be performed while neutralizing with an alkali such as sodium.
しかしながら、この手段ではアルカリによる中和操作により、乳酸ナトリウムや乳酸カルシウムなどの乳酸塩が生じるため、その後の精製工程において乳酸塩を乳酸に戻す操作が必要になり、その処理にコストがかかっている。 However, in this means, a lactate such as sodium lactate or calcium lactate is generated by the neutralization operation with an alkali, so that an operation for returning the lactate to lactic acid is necessary in the subsequent purification process, and the treatment is costly. .
そこで中和コスト低減を目的として、酸に耐性のある酵母に乳酸を生産させる試みが報告されている(特許文献1〜5、非特許文献1〜3)。酵母は本来乳酸生産能を持たないことから、酵母による乳酸生産を可能にするためには、ピルビン酸をL−乳酸に変換する酵素であるL−乳酸脱水素酵素をコードする遺伝子(以下、L−ldh遺伝子と略すことがある。)を遺伝子組み換え技術を用い酵母に導入しなければならない。 In order to reduce the neutralization cost, attempts to produce lactic acid in an acid-resistant yeast have been reported (Patent Documents 1 to 5, Non-Patent Documents 1 to 3). Since yeast originally has no ability to produce lactic acid, in order to enable lactic acid production by yeast, a gene encoding L-lactic acid dehydrogenase (hereinafter referred to as L-lactic acid dehydrogenase), which is an enzyme that converts pyruvate into L-lactic acid. -May be abbreviated as ldh gene)) must be introduced into yeast using genetic recombination techniques.
酵母に導入するL−ldh遺伝子としては、従来よりウシ由来のL−ldh遺伝子が検討されており(特許文献3、特許文献5及び非特許文献1〜3)、乳酸菌由来のL−ldh遺伝子よりも適していることが報告されている(非特許文献3)。
従来のウシ由来L−ldh遺伝子が導入された酵母を培養することによるL−乳酸の製造においては、例えばグルコースなどの原料糖からL−乳酸への変換効率、例えば対糖収率は、乳酸菌を培養して得られるL−乳酸の対糖収率よりも低く、低コストでL−乳酸を製造可能にするためには対糖収率を上昇させる必要があった。 In the production of L-lactic acid by culturing a yeast introduced with a conventional bovine-derived L-ldh gene, for example, the conversion efficiency from a raw sugar such as glucose to L-lactic acid, for example, the yield relative to sugar, In order to be able to produce L-lactic acid at a low cost, it was necessary to increase the yield relative to sugar.
上記課題を解決するために、本発明者らが鋭意検討した結果、ゼノプス・レービス(Xenopus laevis)由来のL−乳酸脱水素酵素をコードする遺伝子が導入された酵母を培養することにより、従来のウシ由来のL−乳酸脱水素酵素をコードする遺伝子が導入された酵母を培養することよりも高い対糖収率でL−乳酸を製造できることを見出し、本発明を完成させるに至った。
In order to solve the above-mentioned problems, the present inventors have intensively studied. As a result, by culturing yeast introduced with a gene encoding L-lactate dehydrogenase derived from Xenopus laevis , The inventors have found that L-lactic acid can be produced at a higher sugar yield than culturing yeast in which a gene encoding a bovine-derived L-lactic acid dehydrogenase has been introduced, and the present invention has been completed.
すなわち、本発明は、ゼノプス・レービス(Xenopus laevis)由来のL−乳酸脱水素酵素をコードする遺伝子が導入された酵母を提供するものである。ゼノプス・レービス(Xenopus laevis)由来のL−乳酸脱水素酵素をコードする遺伝子が導入された酵母は、好ましくは、配列番号1に示す核酸配列を有する遺伝子が導入された酵母である。
That is, the present invention provides a yeast into which a gene encoding L-lactate dehydrogenase derived from Xenopus laevis has been introduced . Ze Nopusu-Rebisu (Xenopus laevis) gene encoding the origin of L- lactate dehydrogenase has been introduced yeast is preferably a yeast gene having a nucleic acid sequence shown in SEQ ID NO: 1 has been introduced.
本発明の別の好ましい態様によれば、ゼノプス・レービス(Xenopus laevis)由来のL−乳酸脱水素酵素をコードする遺伝子が導入された酵母は、サッカロミセス(Saccharomyces)属に属する酵母であり、さらに好ましくはサッカロミセス・セレビセ(Saccharomyces cerevisiae)である。
According to another preferred embodiment of the present invention, the yeast introduced with a gene encoding L-lactate dehydrogenase derived from Xenopus laevis is a yeast belonging to the genus Saccharomyces, more preferably. Is Saccharomyces cerevisiae.
本発明の別の好ましい態様によれば、ゼノプス・レービス(Xenopus laevis)由来のL−乳酸脱水素酵素をコードする遺伝子が染色体上のピルビン酸脱炭酸酵素1遺伝子(PDC1遺伝子)のプロモーターの下流に発現可能な状態で導入された酵母である。
According to another preferred embodiment of the present invention, a gene encoding L-lactate dehydrogenase derived from Xenopus laevis is located downstream of the pyruvate decarboxylase 1 gene (PDC1 gene) promoter on the chromosome. Yeast introduced in an expressible state.
また、本発明は、上記ゼノプス・レービス(Xenopus laevis)由来のL−乳酸脱水素酵素が導入された酵母を培養することを含む、L−乳酸の製造方法を提供するものである。
The present invention also provides a method for producing L-lactic acid, comprising culturing yeast introduced with the L-lactic acid dehydrogenase derived from Xenopus laevis .
本発明によれば、カエル由来のL−乳酸脱水素酵素をコードする遺伝子が導入された酵母を培養することにより、従来のウシ由来のL−乳酸脱水素酵素をコードする遺伝子が導入された酵母を培養することよりも高い対糖収率でL−乳酸を製造することができる。 According to the present invention, a yeast into which a gene encoding a conventional bovine-derived L-lactate dehydrogenase has been introduced by culturing a yeast into which a gene encoding a frog-derived L-lactate dehydrogenase has been introduced. L-lactic acid can be produced with a higher yield to sugar than by culturing the.
本発明のカエル由来のL−ldh遺伝子が導入された酵母を既知の方法により改良し、該酵母を培養することにより更に高い対糖収率でL−乳酸を製造することが可能である。 L-lactic acid can be produced at a higher sugar yield by improving the yeast introduced with the frog-derived L-ldh gene of the present invention by a known method and culturing the yeast.
本発明は、カエル由来のL−乳酸脱水素酵素をコードする遺伝子(L−ldh遺伝子)が導入された酵母である。 The present invention is a yeast into which a gene encoding a frog-derived L-lactate dehydrogenase (L-ldh gene) has been introduced.
本発明において、L−ldh遺伝子とは、還元型ニコチンアミドアデニンジヌクレオチド(NADH)とピルビン酸をL−乳酸と酸化型ニコチンアミドアデニンジヌクレオチド(NAD+)に変換する活性を持つL−乳酸脱水素酵素をコードしている遺伝子である。 In the present invention, L-ldh gene means L-lactic acid dehydrogenation having an activity of converting reduced nicotinamide adenine dinucleotide (NADH) and pyruvate into L-lactic acid and oxidized nicotinamide adenine dinucleotide (NAD +). A gene encoding an enzyme.
本発明で使用するゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子は、好ましくは、配列番号1に示す核酸配列を有するL−ldh遺伝子である。
The L-ldh gene derived from Xenopus laevis used in the present invention is preferably an L-ldh gene having the nucleic acid sequence shown in SEQ ID NO: 1.
本発明で使用するゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子には、遺伝的多型性や、変異誘発などによる変異型の遺伝子も含まれる。ここでいう遺伝的多型性とは、遺伝子上の自然突然変異により遺伝子の塩基配列が一部変化しているものである。また、変異誘発とは、人工的に遺伝子に変異を導入することをいい、例えば、部位特異的変異導入用キット(Mutan-K(タカラバイオ社製))を用いる方法や、ランダム変異導入用キット(BD Diversify PCR Random Mutagenesis(CLONTECH社製))を用いる方法などがある。
The L-ldh gene derived from Xenopus laevis used in the present invention includes genetic polymorphisms and mutated genes due to mutagenesis. Here, the genetic polymorphism means that the base sequence of a gene is partially changed due to a natural mutation on the gene. Mutagenesis refers to artificially introducing a mutation into a gene. For example, a method using a site-specific mutagenesis kit (Mutan-K (manufactured by Takara Bio Inc.)) or a random mutagenesis kit. (BD Diversify PCR Random Mutagenesis (manufactured by CLONTECH)).
本発明で使用する酵母は、ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子を導入しうる酵母であれば制限はないが、サッカロミセス(Saccharomyces)属、シゾサッカロミセス(Schizosaccharomyces)属、クリベロミセス(Kluyveromyces)属又はカンジダ(Candida)属に属する酵母が挙げられる。好ましくは、サッカロミセス・セレビセ(Saccharomyces cerevisiae)であって、具体的には、NBRC10505株、NBRC10506株が好ましい。
The yeast to be used in the present invention is not limited as long as it can introduce an L-ldh gene derived from Xenopus laevis, but is not limited thereto. Examples include yeast belonging to the genus Kluyveromyces) or Candida. Saccharomyces cerevisiae is preferable, and specifically, NBRC10505 strain and NBRC10506 strain are preferable.
本発明のゼノプス・レービス(Xenopus laevis)由来のL−乳酸脱水素酵素をコードする遺伝子を酵母に導入する方法としては、例えば、ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子をクローニングし、クローニングした該遺伝子を組み込んだ発現ベクターを酵母に形質転換する方法、クローニングした該遺伝子を染色体上の目的箇所に相同組換えで挿入する方法等が挙げられるが、これらに限られるものではない。
As a method for introducing a gene encoding L-lactate dehydrogenase derived from Xenopus laevis of the present invention into yeast, for example, an L-ldh gene derived from Xenopus laevis is cloned, Examples include, but are not limited to, a method of transforming an expression vector incorporating the cloned gene into yeast, a method of inserting the cloned gene into a target site on a chromosome by homologous recombination, and the like.
本発明で使用するゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子をクローニングする方法としては特に制限はなく、既知の手法を用いることができる。例えば、既知の遺伝子情報に基づき、PCR(Polymerase Chain Reaction)法を用いて必要な遺伝領域を増幅取得する方法や、ゲノムライブラリーやcDNAライブラリーより相同性や酵素活性を指標としてクローニングする方法などが挙げられる。また、既知のタンパク質情報に基づき化学合成的又は遺伝子工学的に合成する方法も可能である。
The method for cloning the L-ldh gene derived from Xenopus laevis used in the present invention is not particularly limited, and a known method can be used. For example, based on known gene information, a method for amplifying and obtaining a necessary genetic region using PCR (Polymerase Chain Reaction) method, a method for cloning from a genomic library or cDNA library using homology or enzyme activity as an index, etc. Is mentioned. A method of chemical synthesis or genetic engineering based on known protein information is also possible.
クローニングしたゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子を組み込む発現ベクターとしては、酵母で汎用的に利用される発現ベクターを用いることができる。酵母で汎用的に利用される発現ベクターとは、酵母細胞内での自立的複製に必要な配列、大腸菌細胞内での自立的複製に必要な配列、酵母選択マーカー及び大腸菌選択マーカーを有しており、また、組み込んだゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子を発現させるために、その発現を調節するオペレーター、プロモーター、ターミネーター又はエンハンサー等のいわゆる調節配列をも有していることが望ましい。
As an expression vector into which the cloned L-ldh gene derived from Xenopus laevis is incorporated, an expression vector generally used in yeast can be used. An expression vector widely used in yeast has a sequence necessary for autonomous replication in yeast cells, a sequence necessary for autonomous replication in E. coli cells, a yeast selection marker, and an E. coli selection marker. In addition, in order to express the L-ldh gene derived from Xenopus laevis , it may also have a so-called regulatory sequence such as an operator, promoter, terminator or enhancer that regulates its expression. desirable.
ここで、酵母細胞内での自立的複製に必要な配列とは、例えば、酵母の自立複製開始点(ARS1)とセントロメア配列の対もしくは酵母の2μmプラスミドの複製開始点であり、大腸菌内での自立的複製に必要な配列とは、例えば、大腸菌のColE1複製開始点である。また、酵母選択マーカーとしては、URA3又はTRP1等の栄養要求性相補的遺伝子もしくはG418耐性遺伝子又はネオマイシン耐性遺伝子等の薬剤耐性遺伝子が挙げられ、大腸菌の選択マーカーとしては、アンピシリン耐性遺伝子又はカナマイシン耐性遺伝子等の抗生物質耐性遺伝子が挙げられる。 Here, the sequence necessary for autonomous replication in yeast cells is, for example, a yeast autonomous replication origin (ARS1) and a centromere sequence pair or the replication origin of a yeast 2 μm plasmid. The sequence necessary for autonomous replication is, for example, the ColE1 replication origin of Escherichia coli. Examples of yeast selection markers include auxotrophic complementary genes such as URA3 or TRP1, or drug resistance genes such as G418 resistance gene or neomycin resistance gene. Examples of selection markers for Escherichia coli include ampicillin resistance gene or kanamycin resistance gene. And antibiotic resistance genes such as
調節配列としては、ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子を発現可能なものであれば特に制限はないが、一例として酸性フォスファターゼ遺伝子(PHO5)、グリセルアルデヒド−3−リン酸デヒドロゲナーゼ遺伝子(TDH1,2,3)、アルコールデヒドロゲナーゼ遺伝子(ADH1,2,3,4,5,6,7)遺伝子、ガラクトース代謝系遺伝子(GAL1,7,10)、シトクロムc遺伝子(CYC1)、トリオースリン酸イソメラーゼ遺伝子(TPI1)、ホスホグリセレートキナーゼ遺伝子(PGK1)、ホスホフルクトースキナーゼ遺伝子(PFK1)、ピルビンデカルボキシラーゼ遺伝子(PDC1,5,6)などのプロモーター配列及びTDH3遺伝子などのターミネーター配列が挙げられる。
The regulatory sequence is not particularly limited as long as it can express the L-ldh gene derived from Xenopus laevis, but examples include acid phosphatase gene (PHO5), glyceraldehyde-3-phosphate dehydrogenase. Gene (TDH1,2,3), alcohol dehydrogenase gene (ADH1,2,3,4,5,6,7) gene, galactose metabolic gene (GAL1,7,10), cytochrome c gene (CYC1), triose phosphate Promoter sequences such as isomerase gene (TPI1), phosphoglycerate kinase gene (PGK1), phosphofructose kinase gene (PFK1), pyruvine decarboxylase gene (PDC1, 5, 6) and terminator sequences such as TDH3 gene Is mentioned.
上記発現ベクターのプロモーター下流にゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子を導入することにより、該遺伝子を発現可能なベクターが得られる。得られたゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子発現ベクターを、後述する方法により酵母に形質転換することにより、ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子を酵母に導入することができる。
By introducing an L-ldh gene derived from Xenopus laevis downstream of the promoter of the above expression vector, a vector capable of expressing the gene can be obtained. The resulting L-ldh gene expression vector derived from Xenopus laevis is transformed into yeast by the method described later, thereby introducing the L-ldh gene derived from Xenopus laevis into the yeast. be able to.
また、ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子を染色体上に挿入することで、ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子を酵母に導入することができる。ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子を染色体中に挿入する方法に特に制限はないが、ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子を含むDNAを後述する方法により酵母に形質転換し、ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子を非相同組み換えによって染色体中のランダムな位置に挿入する方法や、ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子を含むDNAを相同組み換えにより目的とする箇所に挿入する方法などを用いることができる。好ましくは、相同組み換えによる方法である。
Moreover, the L-ldh gene derived from Xenopus laevis can be introduced into yeast by inserting the L-ldh gene derived from Xenopus laevis onto the chromosome. There is no particular limitation on the method of inserting into the chromosome of the Xenopus Rebisu (Xenopus laevis) L-ldh gene from yeast by the method described below a DNA containing the L-ldh gene from Xenopus Rebisu (Xenopus laevis) transformed, Xenopus Rebisu (Xenopus laevis) and how to insert the L-ldh gene derived from a random position in the chromosome by non-homologous recombination, Xenopus Rebisu (Xenopus laevis) DNA containing the L-ldh gene from Or the like can be used by homologous recombination. A method by homologous recombination is preferable.
ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子を含むDNAを染色体中の目的箇所に、好ましくはPDC1遺伝子のプロモーターの下流に相同組み換えで挿入する方法としては、ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子を含むDNAの上流及び下流に、導入目的箇所に相同的な部分を付加するようにデザインしたプライマーを用いてPCRを行い、得られたPCR断片を後述する方法により酵母に形質転換する方法が挙げられるが、これに限定されるものではない。また、形質転換株の選択を容易にするために、上記PCR断片には酵母選択マーカーが含まれることが好ましい。
As a method of inserting DNA containing the L-ldh gene derived from Xenopus laevis into the target site in the chromosome, preferably downstream of the promoter of the PDC1 gene, by homologous recombination, derived from Xenopus laevis PCR was performed using primers designed to add a homologous portion to the target site upstream and downstream of the DNA containing the L-ldh gene, and the obtained PCR fragment was transformed into yeast by the method described below. Although the method of converting is mentioned, It is not limited to this. In order to facilitate selection of transformants, the PCR fragment preferably contains a yeast selection marker.
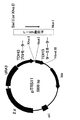
ここで用いるPCR断片の調製は、例えば、下記(1)〜(3)のステップ1〜3の工程により行うことができる。その概略を図1に示す。 The PCR fragment used here can be prepared, for example, by the steps 1 to 3 in the following (1) to (3). The outline is shown in FIG.
(1)ステップ1:ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子の下流にターミネーターがつながったプラスミドを鋳型とし、プライマー1,2をセットとしてゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子及びターミネーターを含む断片をPCRで増幅する。プライマー1は、導入目的箇所の上流側に相同的な配列40bp以上を付加するようデザインし、プライマー2は、ターミネーターより下流のプラスミド由来の配列をもとにデザインする。好ましくは、プライマー1に付加する導入目的箇所の上流側に相当する配列は、ピルビン酸脱炭酸酵素1遺伝子(PDC1遺伝子)の上流に相当する配列である。
(1) Step 1: L-ldh derived from Xenopus laevis using as a template a plasmid with a terminator connected downstream of the L-ldh gene derived from Xenopus laevis A fragment containing the gene and terminator is amplified by PCR. Primer 1 is designed so as to add a homologous sequence of 40 bp or more upstream of the target introduction site, and primer 2 is designed based on a sequence derived from a plasmid downstream from the terminator. Preferably, the sequence corresponding to the upstream side of the introduction target site added to the primer 1 is a sequence corresponding to the upstream of the pyruvate decarboxylase 1 gene (PDC1 gene).
(2)ステップ2:酵母選択マーカーを持つプラスミド、例えばpRS424、pRS426等を鋳型として、プライマー3,4をセットとして酵母選択マーカーを含む断片をPCRで増幅する。プライマー3は、ステップ1のPCR断片のターミネーターより下流の配列と相同性のある配列が30bp以上を付加するようにデザインし、プライマー4には、導入目的箇所の下流側に相当する配列40bp以上を付加するようデザインする。好ましくは、プライマー4に付加する導入目的箇所の下流側に相当する配列は、PDC1遺伝子の下流に相当する配列である。 (2) Step 2: A fragment containing a yeast selection marker is amplified by PCR using a plasmid having a yeast selection marker, for example, pRS424, pRS426, etc. as a template and primers 3 and 4 as a set. Primer 3 is designed so that a sequence homologous to the sequence downstream of the terminator of the PCR fragment of Step 1 adds 30 bp or more, and primer 4 has a sequence of 40 bp or more corresponding to the downstream side of the introduction target site. Design to add. Preferably, the sequence corresponding to the downstream side of the target introduction site added to the primer 4 is a sequence corresponding to the downstream side of the PDC1 gene.
(3)ステップ3:ステップ1,2で得られたPCR断片を混合したものを鋳型とし、プライマー1,4をセットとしてPCRを行うことにより、両末端に導入目的箇所の上流側及び下流側に相当する配列が付加された、カエル由来L−ldh遺伝子、ターミネーター及び酵母選択マーカーを含むPCR断片が得られる。好ましくは、前記PCR断片は、両末端にPDC1遺伝子の上流及び下流に相当する配列が付加された、カエル由来のL−ldh遺伝子、ターミネーター及びマーカー遺伝子を含むPCR断片である。 (3) Step 3: PCR is carried out using the mixture of the PCR fragments obtained in Steps 1 and 2 as a template and Primers 1 and 4 as a set, so that both ends are upstream and downstream of the introduction target site. A PCR fragment containing a frog-derived L-ldh gene, a terminator and a yeast selection marker, to which the corresponding sequence has been added, is obtained. Preferably, the PCR fragment is a PCR fragment containing a frog-derived L-ldh gene, a terminator, and a marker gene with sequences corresponding to upstream and downstream of the PDC1 gene added to both ends.
上記で得られたゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子発現ベクターまたはPCR断片を酵母に導入するには、形質転換、形質導入、トランスフェクション、コトランスフェクションまたはエレクトロポレーション等の方法を用いることができる。具体的には、例えば、酢酸リチウムを用いる方法やプロトプラスト法等がある。
In order to introduce the L-ldh gene expression vector or PCR fragment derived from Xenopus laevis obtained above into yeast, a method such as transformation, transduction, transfection, cotransfection or electroporation Can be used. Specific examples include a method using lithium acetate and a protoplast method.
得られた形質転換株の培養方法としては、例えば、「M.D. Rose et al.,"Methods In Yeast Genetics", Cold Spring Harbor Laboratory Press (1990)」等に記載されている既知の方法を用いることができる。カエル由来のL−ldh遺伝子発現ベクター又はPCR断片が導入された酵母は、発現ベクター又はPCR断片が有する酵母選択マーカーによって、栄養非添加培地又は薬剤添加培地で培養することにより選択することができる。 As a method for culturing the obtained transformant, for example, a known method described in “MD Rose et al.,“ Methods In Yeast Genetics ”, Cold Spring Harbor Laboratory Press (1990)” may be used. it can. Yeast into which a frog-derived L-ldh gene expression vector or PCR fragment has been introduced can be selected by culturing in a nutrient-free medium or a drug-added medium according to the yeast selection marker of the expression vector or PCR fragment.
本発明のゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子が導入された酵母を培養することにより、培地中にL−乳酸を製造することができる。
L-lactic acid can be produced in the medium by culturing the yeast introduced with the L-ldh gene derived from Xenopus laevis of the present invention.
本発明のL−乳酸の製造方法で使用する乳酸生産培地は、酵母が資化し得る炭素源、窒素源および無機塩類等を含有し、酵母の培養を効率的に行うことができる培地であれば、天然培地および合成培地のいずれを用いても良い。 The lactic acid production medium used in the method for producing L-lactic acid according to the present invention contains a carbon source, a nitrogen source, inorganic salts, and the like that can be assimilated by yeast, and can be used to efficiently culture yeast. Any of a natural medium and a synthetic medium may be used.
培地に含有される炭素源は、シュクロース、フラクトース、グルコース、ガラクトース、ラクトース、マルトース等の糖類、これら糖類を含有するデンプン、及び、デンプン加水分解物、甘藷糖蜜、甜菜糖蜜、ハイテストモラセス、ケーンジュース、ケーンジュース抽出物または濃縮液、ケーンジュースからの精製または結晶化された原料糖、ケーンジュースからの精製または結晶化された精製糖、更には酢酸等の有機酸、エタノールなどのアルコール類、グリセリン等の糖の原料、またはこれらから選ばれる少なくとも1種類を含むものが好ましい。 The carbon source contained in the medium is saccharides such as sucrose, fructose, glucose, galactose, lactose, maltose, starch containing these saccharides, starch hydrolysate, sweet potato molasses, sugar beet molasses, high test molasses, cane Juice, cane juice extract or concentrate, raw sugar refined or crystallized from cane juice, refined sugar crystallized or crystallized from cane juice, organic acids such as acetic acid, alcohols such as ethanol, A raw material of sugar such as glycerin, or one containing at least one selected from these is preferable.
前記の炭素源は、培養開始時に一括して添加してもよいし、培養中分割してあるいは連続的に添加することもできる。 The carbon source may be added all at once at the start of culture, or may be added in portions during culture or continuously.
本発明のL−乳酸の製造方法において、炭素源の濃度は、好ましくは、1L培養液に10g以上1000g以下であり、より好ましくは、1L培養液に50g以上300g以下であり、特に好ましくは、1L培養液に50g以上200g以下である。炭素源の濃度が、1L培養液に10g以上1000g以下であると、乳酸合成能力を有する酵母が正常に生育し、酵母の乳酸生産が効率的であるので、好ましい。 In the method for producing L-lactic acid of the present invention, the concentration of the carbon source is preferably 10 g or more and 1000 g or less, more preferably 50 g or more and 300 g or less, and particularly preferably 1 L culture solution. It is 50g or more and 200g or less in 1L culture solution. It is preferable that the concentration of the carbon source is 10 g or more and 1000 g or less in a 1 L culture solution because yeast having lactic acid synthesis ability grows normally and the lactic acid production of the yeast is efficient.
本発明のL−乳酸の製造方法では、使用する乳酸生産培地が、シュクロース、フラクトース、グルコース、ガラクトース、ラクトース、マルトースから選ばれる少なくとも1種類を含む乳酸生産培地であることが、より好ましい。また、乳酸の製造方法で使用する乳酸生産培地が、デンプン、及び、デンプン加水分解物、甘藷糖蜜、甜菜糖蜜、ハイテストモラセス、ケーンジュース、ケーンジュース抽出物または濃縮液、ケーンジュースからの精製または結晶化された原料糖、ケーンジュースからの精製または結晶化された精製糖、酢酸等の有機酸、エタノールなどのアルコール類、グリセリンから選ばれる少なくとも1種類を含む乳酸生産培地であることが、より好ましい。本発明では、これら発酵原料を必要に応じて希釈して用いることができる。 In the method for producing L-lactic acid of the present invention, the lactic acid production medium to be used is more preferably a lactic acid production medium containing at least one selected from sucrose, fructose, glucose, galactose, lactose, and maltose. The lactic acid production medium used in the method for producing lactic acid is starch, starch hydrolyzate, sweet potato molasses, sugar beet molasses, high test molasses, cane juice, cane juice extract or concentrate, purified from cane juice or It is a lactic acid production medium containing at least one selected from crystallized raw sugar, refined sugar from cane juice or crystallized purified sugar, organic acids such as acetic acid, alcohols such as ethanol, and glycerin, preferable. In the present invention, these fermentation raw materials can be diluted as necessary.
また、発酵原料に含有される窒素源は、アンモニアガス、アンモニア水、アンモニウム塩類、尿素、硝酸塩類、その他補助的に使用される有機窒素源、例えば油粕類、大豆加水分解液、カゼイン分解物、その他のアミノ酸、ビタミン類、コーンスティープリカー、酵母または酵母エキス、肉エキス、ペプトン等のペプチド類、各種発酵菌体およびその加水分解物などが好ましく使用される。 The nitrogen source contained in the fermentation raw material is ammonia gas, aqueous ammonia, ammonium salts, urea, nitrates, and other auxiliary organic nitrogen sources such as oil cakes, soybean hydrolysates, casein decomposition products, Other amino acids, vitamins, corn steep liquor, yeast or yeast extract, meat extract, peptides such as peptone, various fermented cells and hydrolysates thereof are preferably used.
また、発酵原料に含有される無機塩として、リン酸塩、マグネシウム塩、カルシウム塩、鉄塩、マンガン塩等を適宜添加することができる。 Moreover, phosphate, magnesium salt, calcium salt, iron salt, manganese salt etc. can be added suitably as inorganic salt contained in a fermentation raw material.
本発明のL−乳酸の製造方法で使用する乳酸生産培地は、必要に応じて、ポリエーテル系、アルコール系又はシリコン系等の消泡剤を使用することができる。 The lactic acid production medium used in the method for producing L-lactic acid of the present invention can use an antifoaming agent such as polyether, alcohol or silicon as required.
導入する発現ベクターを酵母内に保持させるのであれば、選択マーカーによる選択圧をかけた培地を用いることが好ましい。培地としては、例えば、ベクターの持つ選択マーカーに符号するアミノ酸を除去した合成培地などが挙げられる。特に好ましい培地は、炭素源としてグルコースを1〜10%、窒素源として「Yeast Nitrogen Base without amino acid」(DIFCO社製)を0.67%含有し、適切なアミノ酸を添加した合成培地である。 If the expression vector to be introduced is to be retained in yeast, it is preferable to use a medium to which a selective pressure is applied by a selection marker. Examples of the medium include a synthetic medium in which an amino acid encoded by a selection marker possessed by a vector is removed. A particularly preferable medium is a synthetic medium containing 1 to 10% of glucose as a carbon source and 0.67% of “Yeast Nitrogen Base without amino acid” (manufactured by DIFCO) as a nitrogen source, to which an appropriate amino acid is added.
L−乳酸の製造に際しては、まず、本発明の酵母を前培養し、前培養液を新しい培地に移して本培養することにより、培養液中にL−乳酸を製造することができる。培養温度は、菌株の増殖が実質的に阻害されず乳酸を生産し得る範囲であれば特に制限されるものでないが、好ましくは20〜40℃の範囲の温度であり、より好ましくは25〜35℃の範囲の温度であり、さらに好ましくは30℃である。培養には、静置、撹拌または振とうのいずれの方法も採用し得る。 In the production of L-lactic acid, first, the yeast of the present invention is pre-cultured, and the pre-culture liquid is transferred to a new medium and main culture is performed, whereby L-lactic acid can be produced in the culture liquid. The culture temperature is not particularly limited as long as the growth of the strain is not substantially inhibited and can produce lactic acid, but is preferably a temperature in the range of 20 to 40 ° C., more preferably 25 to 35. The temperature is in the range of ° C, more preferably 30 ° C. Any method of standing, stirring or shaking can be employed for the culture.
上記のような条件で本発明の酵母を培養することにより、培養液中にL−乳酸が得られる。得られたL−乳酸の測定法に特に制限はないが、例えば、HPLCを用いる方法や、F−キット(ロシュ社製)を用いる方法などがある。 By culturing the yeast of the present invention under the above conditions, L-lactic acid is obtained in the culture solution. Although there is no restriction | limiting in particular in the measuring method of obtained L-lactic acid, For example, there exist the method using HPLC, the method using F-kit (made by Roche), etc.
本発明において、L−乳酸脱水素酵素活性とは、ピルビン酸とNADHをL−乳酸とNAD+に変換する活性を示す。また限定されるわけではないが、L−乳酸脱水素酵素活性は比活性を指標として比較できる。すなわち、L−ldh遺伝子導入方法及び遺伝的バックグラウンドが同じ酵母を同条件で培養し、培養菌体から抽出したタンパク質を用いてNADHの減少に伴う340nmにおける吸光度の変化を測定する。その際に、室温において1分間当たりに1μmolのNADHを減少させる酵素量を1単位(Unit)と定義する事により、L−乳酸脱水素酵素の比活性は式(1)であらわせる。ここで、Δ340は1分間あたりの340nmの吸光度の減少量、6.22はNADHのミリモル分子吸光係数である。 In the present invention, the L-lactic acid dehydrogenase activity indicates the activity of converting pyruvic acid and NADH into L-lactic acid and NAD +. Moreover, although not necessarily limited, L-lactate dehydrogenase activity can be compared using specific activity as an index. That is, yeast having the same L-ldh gene introduction method and genetic background is cultured under the same conditions, and the change in absorbance at 340 nm accompanying NADH reduction is measured using a protein extracted from the cultured cells. At that time, the specific activity of L-lactate dehydrogenase is expressed by the formula (1) by defining the amount of enzyme that decreases 1 μmol of NADH per minute at room temperature as 1 unit (Unit). Here, Δ340 is the decrease in absorbance at 340 nm per minute, and 6.22 is the mmol molecular extinction coefficient of NADH.
以下、実施例をもって本発明の実施の態様を説明するが、これらは例示であり、本発明を何等制限するものではない。 Hereinafter, although an embodiment of the present invention is described with an example, these are illustrations and do not limit the present invention at all.
(実施例1:ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子発現ベクターの作製)
ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子として、配列番号1に示す核酸配列を有するL−ldh遺伝子を使用した。ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子のクローニングはPCR法により行った。PCRには、ゼノプス・レービスの腎臓由来cDNAライブラリー(STRATAGENE社製)より付属のプロトコールに従い調製したファージミドDNAを鋳型とした。
(Example 1: Preparation of L-ldh gene expression vector derived from Xenopus laevis )
As Xenopus Rebisu (Xenopus laevis) L-ldh gene from using L-LDH gene that have a nucleic acid sequence shown in SEQ ID NO: 1. Cloning of the L-ldh gene derived from Xenopus laevis was performed by PCR. For PCR, phagemid DNA prepared from a Xenopus laevis kidney-derived cDNA library (manufactured by STRATAGENE) according to the attached protocol was used as a template.
PCR増幅反応には、KOD-Plus polymerase(東洋紡社製)を用い、反応バッファー、dNTPmixなどは付属のものを使用した。上記のように付属のプロトコールに従い調整したファージミドDNAを50ng/サンプル、プライマーを50pmol/サンプル、及びKOD-Plus polymeraseを1ユニット/サンプルになるように50μlの反応系に調製した。反応溶液をPCR増幅装置iCycler(BIO−RAD社製)により94℃の温度で5分熱変成させた後、94℃(熱変成):30秒、55℃(プライマーのアニール):30秒、68℃(相補鎖の伸張):1分を1サイクルとして30サイクル行い、その後4℃の温度に冷却した。なお、遺伝子増幅用プライマー(配列番号3,4)には、5末端側にはSalI認識配列、3末端側にはNotI認識配列がそれぞれ付加されるようにして作製した。 For the PCR amplification reaction, KOD-Plus polymerase (manufactured by Toyobo Co., Ltd.) was used, and the attached reaction buffer, dNTPmix, etc. were used. A 50 μl reaction system was prepared so that the phagemid DNA prepared as described above was 50 ng / sample, the primer was 50 pmol / sample, and the KOD-Plus polymerase was 1 unit / sample. The reaction solution was thermally denatured at 94 ° C. for 5 minutes with a PCR amplification apparatus iCycler (manufactured by BIO-RAD), then 94 ° C. (thermal denature): 30 seconds, 55 ° C. (primer annealing): 30 seconds, 68 C. (Complementary strand extension): One cycle was performed for 30 cycles, and then cooled to a temperature of 4.degree. The gene amplification primers (SEQ ID NOs: 3 and 4) were prepared such that a SalI recognition sequence was added to the 5 terminal side and a NotI recognition sequence was added to the 3 terminal side.
PCR増幅断片を精製し、末端をT4 polynucleotide Kinase(タカラバイオ社製)によりリン酸化後、pUC118ベクター(制限酵素HincIIで切断し、切断面を脱リン酸化処理したもの)にライゲーションした。ライゲーションは、DNA Ligation Kit Ver.2(タカラバイオ社製)を用いて行った。ライゲーション溶液を大腸菌DH5αのコンピテント細胞(タカラバイオ社製)に形質転換し、抗生物質アンピシリンを50μg/mLを含むLBプレートに蒔いて一晩培養した。生育したコロニーについて、ミニプレップでプラスミドDNAを回収し、制限酵素SalI及びNotIで切断し、カエル由来のL−ldh遺伝子が挿入されているプラスミドを選抜した。これら一連の操作は、全て付属のプロトコールに従い行った。 The PCR amplified fragment was purified, the end was phosphorylated with T4 polynucleotide Kinase (manufactured by Takara Bio Inc.), and then ligated to the pUC118 vector (cut with the restriction enzyme HincII and the cut surface was dephosphorylated). Ligation was performed using DNA Ligation Kit Ver.2 (Takara Bio Inc.). The ligation solution was transformed into competent cells of Escherichia coli DH5α (manufactured by Takara Bio Inc.) and plated on an LB plate containing 50 μg / mL of the antibiotic ampicillin and cultured overnight. For the grown colonies, plasmid DNA was collected with a miniprep, cut with restriction enzymes SalI and NotI, and a plasmid into which the frog-derived L-ldh gene was inserted was selected. All of these series of operations were performed according to the attached protocol.
上記ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子が挿入されたpUC118ベクターを制限酵素SalI及びNotIで切断し、DNA断片を1%アガロースゲル電気泳動により分離、定法に従いゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子を含む断片を精製した。得られたL−ldh遺伝子を含む断片を、図2に示す発現ベクターpTRS11のXhoI/NotI切断部位にライゲーションし、上記と同様な方法でプラスミドDNAを回収し、制限酵素XhoI及びNotIで切断することにより、ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子が挿入された発現ベクターを選抜した。以後、このようにして作製したゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子を組み込んだ発現ベクターをpTRS102とする。
The pUC118 vector inserted with the L-ldh gene derived from Xenopus laevis is cleaved with restriction enzymes SalI and NotI, and the DNA fragments are separated by 1% agarose gel electrophoresis. According to a conventional method, Xenopus laevis. The fragment containing the L-ldh gene derived from ) was purified. The obtained fragment containing the L-ldh gene is ligated to the XhoI / NotI cleavage site of the expression vector pTRS11 shown in FIG. Was used to select an expression vector into which the L-ldh gene derived from Xenopus laevis was inserted. Hereinafter, an expression vector incorporating the L-ldh gene derived from Xenopus laevis thus prepared will be referred to as pTRS102.
(比較例1: ウシ由来L−ldh遺伝子発現ベクターの作製)
比較例として、ウシ由来のL−ldh遺伝子が導入された酵母を作成した。
(Comparative Example 1: Preparation of bovine-derived L-ldh gene expression vector)
As a comparative example, a yeast into which a bovine-derived L-ldh gene was introduced was prepared.
ウシ由来L−ldh遺伝子(配列番号2)のクローニングはPCR法にて行った。PCRには、ウシの骨格筋由来cDNAライブラリー(STRATAGENE社製)より付属のプロトコールに従い調製したファージミドDNAを鋳型とし、実施例1と同条件の増幅反応を行った。なお、遺伝子増幅用プライマー(配列番号5,6)には、5末端側にはXhoI認識配列、3末端側にはNotI認識配列がそれぞれ付加されるようにして作製した。 The bovine L-ldh gene (SEQ ID NO: 2) was cloned by PCR. For PCR, amplification reaction under the same conditions as in Example 1 was carried out using phagemid DNA prepared from a bovine skeletal muscle-derived cDNA library (manufactured by STRATAGENE) according to the attached protocol as a template. The gene amplification primers (SEQ ID NOs: 5 and 6) were prepared such that an XhoI recognition sequence was added to the 5 terminal side and a NotI recognition sequence was added to the 3 terminal side.
以下、実施例1で制限酵素SalIを用いる箇所において制限酵素XhoIを用いることを除き、実施例1と同様な方法でウシ由来のL−ldh遺伝子が挿入された発現ベクターを作製した。以後、このようにして作製したウシ由来のL−ldh遺伝子を組み込んだ発現ベクターをpTRS49とする。 Hereinafter, an expression vector into which a bovine-derived L-ldh gene was inserted was prepared in the same manner as in Example 1 except that the restriction enzyme XhoI was used in the place where the restriction enzyme SalI was used in Example 1. Hereinafter, an expression vector incorporating the bovine-derived L-ldh gene prepared in this manner is referred to as pTRS49.
(実施例2:ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子発現ベクターの酵母への導入)
実施例1のようにして得られたpTRS102を酵母サッカロミセス・セレビセNBRC10505株のpdc1遺伝子を破壊した株(以下、29−1B株と示す。)に形質転換した。形質転換は、YEASTMAKER YEAST Transformation System(CLONTECH社製)を用いた酢酸リチウム法により行い、詳細は付属のプロトコールに従った。宿主とする29−1B株はウラシル合成能を欠損した株であり、pTRS102の持つURA3遺伝子の働きにより、ウラシル非添加培地上でpTRS102の導入された形質転換株の選択が可能である。このようにして得られた形質転換株へのゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子発現ベクター導入の確認は、形質転換株から、ゲノムDNA抽出キットGenとるくん(タカラバイオ社製)によりプラスミドDNAを含むゲノムDNAを抽出し、これを鋳型としてPremix Taq(タカラバイオ社製)を用いたPCRにより行った。確認用プライマーには、ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子をクローニングした際に用いたプライマー(配列番号3,4)を使用した。その結果、pTRS102を形質転換した株において、ゼノプス・レービス(Xenopus laevis)由来L−ldh遺伝子が導入されていることを確認した。以下、上記pTRS102が導入された形質転換株を29−1B/pTRS102株とする。
(Example 2: Introduction of L-ldh gene expression vector derived from Xenopus laevis into yeast)
PTRS102 obtained as in Example 1 was transformed into a strain (hereinafter referred to as 29-1B strain) in which the pdc1 gene of yeast Saccharomyces cerevisiae NBRC10505 was disrupted. Transformation was performed by the lithium acetate method using YEASTMAKER YEAST Transformation System (manufactured by CLONTECH), and the details followed the attached protocol. The 29-1B strain used as a host is a strain lacking the ability to synthesize uracil. By the action of the URA3 gene of pTRS102, it is possible to select a transformant introduced with pTRS102 on a medium without uracil. Confirmation of introduction of the L-ldh gene expression vector derived from Xenopus laevis to the transformant thus obtained was carried out by using Genomic DNA Extraction Kit Gen Toru-kun (manufactured by Takara Bio Inc.) from the transformant. Then, genomic DNA containing plasmid DNA was extracted, and this was performed by PCR using Premix Taq (manufactured by Takara Bio Inc.) as a template. As the confirmation primer, the primer (SEQ ID NOs: 3 and 4) used when cloning the L-ldh gene derived from Xenopus laevis was used. As a result, it was confirmed that the L-ldh gene derived from Xenopus laevis was introduced into the strain transformed with pTRS102 . Hereinafter, the transformed strain into which pTRS102 has been introduced is referred to as 29-1B / pTRS102 strain.
(比較例2:ウシ由来のL−ldh遺伝子発現ベクターの酵母への導入)
比較例1のようにして得られたpTRS49を、実施例2と同様な方法で29−1Bに形質転換した。また、ウシ由来のL−ldh遺伝子導入の確認も実施例2と同様な方法で行い、プライマーとして配列番号5,6に示すオリゴヌクレオチドを用いた。以下、上記pTRS49が導入された形質転換株を29−1B/pTRS49株とする。
(Comparative Example 2: Introduction of L-ldh gene expression vector derived from bovine into yeast)
PTRS49 obtained as in Comparative Example 1 was transformed into 29-1B in the same manner as in Example 2. Further, the introduction of bovine-derived L-ldh gene was also confirmed by the same method as in Example 2, and the oligonucleotides shown in SEQ ID NOs: 5 and 6 were used as primers. Hereinafter, the transformed strain into which pTRS49 is introduced is referred to as 29-1B / pTRS49 strain.
(実施例3:ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子のPDC1遺伝子座への導入)
実施例1で得られたpTRS102を増幅鋳型とし、オリゴヌクレオチド(配列番号7,8)をプライマーセットとしたPCRにより、ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子及びTDH3ターミネーター配列を含む1.3kbのPCR断片を増幅した(図1のステップ1に相当)。ここで配列番号7は、PDC1遺伝子の開始コドンから上流65bpに相当する配列が付加されるようデザインした。
(Example 3: Introduction of L-ldh gene derived from Xenopus laevis into PDC1 locus)
1 containing an L-ldh gene derived from Xenopus laevis and a TDH3 terminator sequence by PCR using pTRS102 obtained in Example 1 as an amplification template and oligonucleotides (SEQ ID NOs: 7 and 8) as primer sets A .3 kb PCR fragment was amplified (corresponding to step 1 in FIG. 1). Here, SEQ ID NO: 7 was designed such that a sequence corresponding to 65 bp upstream from the start codon of the PDC1 gene was added.
次に、プラスミドpRS424を増幅鋳型とし、オリゴヌクレオチド(配列番号10,11)をプライマーセットとしたPCRにより、酵母選択マーカーであるTRP1遺伝子を含む1.2kbのPCR断片を増幅した(図1のステップ2に相当)。ここで、配列番号11は、PDC1遺伝子の終始コドンから下流65bpに相当する配列が付加されるようデザインした。 Next, a 1.2 kb PCR fragment containing the TRP1 gene, which is a yeast selection marker, was amplified by PCR using plasmid pRS424 as an amplification template and oligonucleotides (SEQ ID NOs: 10 and 11) as primer sets (step of FIG. 1). 2). Here, SEQ ID NO: 11 was designed such that a sequence corresponding to 65 bp downstream from the stop codon of the PDC1 gene was added.
それぞれのDNA断片を1%アガロースゲル電気泳動により分離、常法に従い精製した。ここで得られた各1.3kb断片、1.2kb断片を混合したものを増幅鋳型とし、オリゴヌクレオチド(配列番号7,11)をプライマーセットとしたPCR法によって、カエル由来のL−ldh遺伝子、TDH3ターミネーター及びTRP1遺伝子が連結された約2.5kbのPCR断片を増幅した(図1のステップ3に相当)。 Each DNA fragment was separated by 1% agarose gel electrophoresis and purified according to a conventional method. The frog-derived L-ldh gene was obtained by PCR using a mixture of each 1.3 kb fragment and 1.2 kb fragment obtained here as an amplification template and oligonucleotides (SEQ ID NOs: 7 and 11) as primer sets, An approximately 2.5 kb PCR fragment to which the TDH3 terminator and TRP1 gene were linked was amplified (corresponding to step 3 in FIG. 1).
上記のPCR断片を1%アガロースゲル電気泳動により分離、常法に従い精製後、酵母サッカロミセス・セレビセNBRC10505株に形質転換し、トリプトファン非添加培地で培養することにより、カエル由来のL−ldh遺伝子が染色体上のPDC1遺伝子プロモーターの下流に導入されている形質転換株を選択した。 The above PCR fragment was separated by 1% agarose gel electrophoresis, purified according to a conventional method, transformed into the yeast Saccharomyces cerevisiae NBRC10505, and cultured in a medium lacking tryptophan, whereby the frog-derived L-ldh gene was A transformant introduced downstream of the above PDC1 gene promoter was selected.
上記のようにして得られた形質転換株が、ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子が染色体上のPDC1遺伝子プロモーターの下流に導入されている酵母であることの確認は下記のように行った。まず、形質転換株のゲノムDNAをゲノムDNA抽出キットGenとるくん(タカラバイオ社製)により調製し、これを増幅鋳型とし、オリゴヌクレオチド(配列番号11,12)をプライマーセットとしたPCRにより、約2.8kbの増幅DNA断片が得られることで確認した。なお、非形質転換株では、上記PCRによって約2.1kbの増幅DNA断片が得られる。以下、上記ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子が染色体上のPDC1遺伝子プロモーターの下流に導入された形質転換株を、B2株とする。なお、PDC1遺伝子の上流及び下流配列は、Saccharomyces Genome Database(URL: http://www.yeastgenome.org/)より取得することができる。
Confirmation that the transformant obtained as described above is a yeast in which the L-ldh gene derived from Xenopus laevis has been introduced downstream of the PDC1 gene promoter on the chromosome is as follows. Went to. First, genomic DNA of a transformant was prepared by a genomic DNA extraction kit Gen Toru-kun (manufactured by Takara Bio Inc.). This was confirmed by obtaining an amplified DNA fragment of 2.8 kb. For non-transformed strains, an amplified DNA fragment of about 2.1 kb can be obtained by the PCR. Hereinafter, a transformant in which the L-ldh gene derived from Xenopus laevis is introduced downstream of the PDC1 gene promoter on the chromosome is referred to as B2 strain. The upstream and downstream sequences of the PDC1 gene can be obtained from Saccharomyces Genome Database (URL: http://www.yeastgenome.org/).
(比較例3:ウシ由来L−ldh遺伝子のPDC1遺伝子座への導入)
比較例1で得られたpTRS49を増幅鋳型とし、オリゴヌクレオチド(配列番号8,9)をプライマーセットとしたPCRにより、ウシ由来のL−ldh遺伝子及びTDH3ターミネーターを含む1.3kbのPCR断片を増幅した。ここで配列番号9は、配列番号7と同様にPDC1遺伝子の開始コドンから上流65bpに相当する配列が付加されるようデザインした。
(Comparative Example 3: Introduction of L-ldh gene derived from bovine into PDC1 locus)
A PCR fragment of 1.3 kb containing a bovine L-ldh gene and a TDH3 terminator was amplified by PCR using pTRS49 obtained in Comparative Example 1 as an amplification template and oligonucleotides (SEQ ID NOs: 8 and 9) as a primer set. did. Here, SEQ ID NO: 9 was designed so that a sequence corresponding to 65 bp upstream from the start codon of the PDC1 gene was added in the same manner as SEQ ID NO: 7.
上記のPCR断片を1%アガロースゲル電気泳動により分離、常法に従い精製し、実施例3で得られたTRP1遺伝子を含む1.2kbのPCR断片と混合し、オリゴヌクレオチド(配列番号9,11)をプライマーセットとしたPCR法によって、ウシ由来のL−ldh遺伝子、TDH3ターミネーター及びTRP1遺伝子が連結された約2.5kbのPCR断片を増幅した。 The above PCR fragment was separated by 1% agarose gel electrophoresis, purified according to a conventional method, mixed with the 1.2 kb PCR fragment containing the TRP1 gene obtained in Example 3, and oligonucleotide (SEQ ID NOs: 9 and 11). The PCR fragment using as a primer set was used to amplify an approximately 2.5 kb PCR fragment in which the bovine L-ldh gene, TDH3 terminator and TRP1 gene were linked.
上記のPCR断片を実施例3と同様な方法でNBRC10505株に形質転換し、トリプトファン非添加培地で培養することにより、ウシ由来L−ldh遺伝子が染色体上のPDC1遺伝子プロモーターの下流に導入されている形質転換株を選択した。 The above PCR fragment was transformed into NBRC10505 strain in the same manner as in Example 3, and cultured in a medium not containing tryptophan, so that the bovine L-ldh gene was introduced downstream of the PDC1 gene promoter on the chromosome. Transformants were selected.
上記のようにして得られた形質転換株が、ウシ由来のL−ldh遺伝子が染色体上のPDC1遺伝子プロモーターの下流に導入されている酵母であることの確認は、実施例3と同様の方法で行った。以下、上記ウシ由来のL−ldh遺伝子が染色体上のPDC1遺伝子プロモーターの下流に導入された形質転換株を、L5株とする。 Confirmation that the transformant obtained as described above is a yeast in which the bovine-derived L-ldh gene has been introduced downstream of the PDC1 gene promoter on the chromosome is the same as in Example 3. went. Hereinafter, the transformed strain in which the bovine-derived L-ldh gene is introduced downstream of the PDC1 gene promoter on the chromosome is referred to as L5 strain.
(実施例4、比較例4:L−乳酸生産性テスト1)
実施例2、比較例2のようにして得られた29−1B/pTRS102株及び29−1B/pTRS49株を用いてL−乳酸生産性テストを行った。
(Example 4, comparative example 4: L-lactic acid productivity test 1)
L-lactic acid productivity test was performed using 29-1B / pTRS102 strain and 29-1B / pTRS49 strain obtained as in Example 2 and Comparative Example 2.
表1に示した組成の培地(以下、SC3−Ura培地と略す。)10mLを試験管に取り、そこに少量の29−1B/pTRS102株及び29−1B/pTRS49株を植菌し、30℃で一晩培養した(前々培養)。次に、SC3−Ura培地100mLを500ml容三角フラスコにいれ、各前々培養液をそれぞれ全量植菌し、30℃で24時間振とう培養した(前培養)。続いて、SC3−Ura培地を1L投入したミニジャーファメンター(丸菱バイオエンジ社製、容量5L)に、前培養開始から24時間後の前培養液をそれぞれ全量植菌し、攪拌速度(120rpm)、通気量(0.1L/min)、温度(30℃)、pH(pH5)を一定にして培養を行った(本培養)。本培養開始後40時間の培養液を遠心分離し、得られた上清を膜濾過した後、下記に示す条件でHPLCによりL−乳酸量を測定した。 10 mL of a medium having the composition shown in Table 1 (hereinafter abbreviated as SC3-Ura medium) is placed in a test tube, and a small amount of 29-1B / pTRS102 strain and 29-1B / pTRS49 strain are inoculated therein, and 30 ° C. Overnight culture (pre-culture). Next, 100 mL of SC3-Ura medium was placed in a 500 ml Erlenmeyer flask, and each pre-culture solution was inoculated in its entirety and cultured with shaking at 30 ° C. for 24 hours (pre-culture). Subsequently, a pre-culture solution 24 hours after the start of pre-culture was inoculated in a mini jar fermenter (manufactured by Maruhishi Bio-Engineering Co., Ltd., volume 5 L) into which 1 L of SC3-Ura medium was added, and the stirring speed (120 rpm ), Aeration (0.1 L / min), temperature (30 ° C.), and pH (pH 5) were kept constant (main culture). The culture solution for 40 hours after the start of the main culture was centrifuged, the obtained supernatant was subjected to membrane filtration, and the amount of L-lactic acid was measured by HPLC under the conditions shown below.
カラム:Shim−Pack SPR−H(島津社製)
移動相:5mM p−トルエンスルホン酸(流速0.8mL/min)
反応液:5mM p−トルエンスルホン酸、20mM ビストリス、0.1mM EDTA・2Na(流速0.8mL/min)
検出方法:電気伝導度
温度:45℃。
Column: Shim-Pack SPR-H (manufactured by Shimadzu Corporation)
Mobile phase: 5 mM p-toluenesulfonic acid (flow rate 0.8 mL / min)
Reaction solution: 5 mM p-toluenesulfonic acid, 20 mM Bistris, 0.1 mM EDTA · 2Na (flow rate 0.8 mL / min)
Detection method: electrical conductivity Temperature: 45 ° C.
測定結果から算出したL−乳酸の対糖収率を表2に示す。 Table 2 shows the sugar yield of L-lactic acid calculated from the measurement results.
(実施例5、比較例5:L−乳酸生産性テスト2)
実施例3、比較例3のようにして得られたB2株及びL5株を用いて、実施例4と同様な方法でL−乳酸生産性テストを行った。培地として、表1に示したものに152mg/Lのウラシルを追加した培地(以下、SC3培地と略す。)を用いた。
(Example 5, Comparative Example 5: L-lactic acid productivity test 2)
Using the B2 strain and the L5 strain obtained as in Example 3 and Comparative Example 3, an L-lactic acid productivity test was performed in the same manner as in Example 4. As a medium, a medium obtained by adding 152 mg / L uracil to the one shown in Table 1 (hereinafter abbreviated as SC3 medium) was used.
SC3培地10mLを試験管に取り、そこに少量のB2株及びL5株を植菌し、30℃で一晩培養した(前々培養)。次に、SC3培地100mLを500ml容三角フラスコにいれ、各前々培養液を全量植菌し、30℃で24時間振とう培養した(前培養)。続いて、SC3培地を1L投入したミニジャーファメンター(丸菱バイオエンジ社製、容量5L)に、前培養開始から24時間後の前培養液を全量植菌し、攪拌速度(120rpm)、通気量(0.1L/min)、温度(30℃)、pH(pH5)を一定にして培養を行った(本培養)。本培養開始後30時間の培養液を遠心分離し、得られた上清を膜濾過した後、実施例4と同様な条件でHPLCによりL−乳酸量を測定した。測定結果から算出したL−乳酸の対糖収率を表3に示す。 A small amount of B2 and L5 strains were inoculated into 10 mL of SC3 medium in a test tube, and cultured overnight at 30 ° C. (pre-culture). Next, 100 mL of SC3 medium was placed in a 500-mL Erlenmeyer flask, and the entire culture solution was inoculated before shaking and cultured with shaking at 30 ° C. for 24 hours (preculture). Subsequently, a pre-culture solution 24 hours after the start of the pre-culture was inoculated in a mini jar fermenter (manufactured by Maruhishi Bio-Engineering Co., Ltd., volume 5 L) into which 1 L of SC3 medium was added, and the stirring speed (120 rpm) and aeration were performed. The culture was carried out with the amount (0.1 L / min), temperature (30 ° C.), and pH (pH 5) being constant (main culture). The culture solution for 30 hours after the start of the main culture was centrifuged, the obtained supernatant was subjected to membrane filtration, and the amount of L-lactic acid was measured by HPLC under the same conditions as in Example 4. Table 3 shows the sugar yield of L-lactic acid calculated from the measurement results.
表2及び表3の結果から、ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子が導入された酵母を培養することにより、ウシ由来のL−ldh遺伝子が導入された酵母を培養することよりも高い対糖収率でL−乳酸を製造することができた。
From the results of Table 2 and Table 3, by cultivating the yeast introduced with the L-ldh gene derived from Xenopus laevis , culturing the yeast introduced with the L-ldh gene derived from bovine. In addition, L-lactic acid could be produced with a high yield to sugar.
(実施例6:ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子のTDH3遺伝子座への導入)
染色体中に挿入するゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子をTDH3プロモーターの下流に導入することで乳酸生産性の向上が可能であるか検討を行った。
(Example 6: Introduction of L-ldh gene derived from Xenopus laevis into TDH3 locus)
It was examined whether lactic acid productivity could be improved by introducing an L-ldh gene derived from Xenopus laevis inserted into the chromosome downstream of the TDH3 promoter.
実施例3と同様な方法でゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子をTDH3遺伝子座に導入するために、pTRS102のTDH3ターミネーターをADH1ターミネーターに変更したプラスミドを作製した。
In order to introduce the L-ldh gene derived from Xenopus laevis into the TDH3 locus in the same manner as in Example 3, a plasmid was prepared in which the TDH3 terminator of pTRS102 was changed to an ADH1 terminator.
まず、NBRC10505株からゲノムDNA抽出キットGenとるくん(タカラバイオ社製)によりゲノムDNAを抽出し、抽出したゲノムDNAを鋳型として、ADH1ターミネーターのクローニングをPCR法により行った。PCR増幅反応には、KOD-Plus polymerase(東洋紡社製)を用い、反応バッファー、dNTPmixなどは付属のものを使用した。上記のように付属のプロトコールに従い調整したゲノムDNAを50ng/サンプル、プライマーを50pmol/サンプル、及びKOD-Plus polymeraseを1ユニット/サンプルになるように50μlの反応系に調製した。反応溶液をPCR増幅装置iCycler(BIO−RAD社製)により94℃の温度で5分熱変成させた後、94℃(熱変成):30秒、60℃(プライマーのアニール):30秒、68℃(相補鎖の伸張):1分を1サイクルとして30サイクル行い、その後4℃の温度に冷却した。なお、遺伝子増幅用プライマー(配列番号13,14)には、5末端側にはNotI認識配列、3末端側にはHindIII認識配列がそれぞれ付加されるようにして作製した。 First, genomic DNA was extracted from the NBRC10505 strain using a genomic DNA extraction kit Gen Toru-kun (manufactured by Takara Bio Inc.), and the ADH1 terminator was cloned by PCR using the extracted genomic DNA as a template. For the PCR amplification reaction, KOD-Plus polymerase (manufactured by Toyobo Co., Ltd.) was used, and the attached reaction buffer, dNTPmix, etc. were used. A 50 μl reaction system was prepared so that the genomic DNA prepared as described above was 50 ng / sample, the primer was 50 pmol / sample, and the KOD-Plus polymerase was 1 unit / sample. The reaction solution was thermally denatured at 94 ° C. for 5 minutes with a PCR amplification device iCycler (manufactured by BIO-RAD), then 94 ° C. (thermal denature): 30 seconds, 60 ° C. (primer annealing): 30 seconds, 68 C. (Complementary strand extension): One cycle was performed for 30 cycles, and then cooled to a temperature of 4.degree. The gene amplification primers (SEQ ID NOs: 13 and 14) were prepared such that a NotI recognition sequence was added to the 5 terminal side and a HindIII recognition sequence was added to the 3 terminal side.
PCR増幅断片を精製し、末端をT4 polynucleotide Kinase(タカラバイオ社製)によりリン酸化後、pUC118ベクター(制限酵素HincIIで切断し、切断面を脱リン酸化処理したもの)にライゲーションした。ライゲーションは、DNA Ligation Kit Ver.2(タカラバイオ社製)を用いて行った。ライゲーション溶液を大腸菌DH5αのコンピテント細胞(タカラバイオ社製)に形質転換し、抗生物質アンピシリンを50μg/mLを含むLBプレートに蒔いて一晩培養した。生育したコロニーについて、ミニプレップでプラスミドDNAを回収し、制限酵素NotI及びHindIIIで切断し、ADH1ターミネーターが挿入されているプラスミドを選抜した。これら一連の操作は、全て付属のプロトコールに従い行った。作製したプラスミドをpUC118−ADH1tとする。 The PCR amplified fragment was purified, the end was phosphorylated with T4 polynucleotide Kinase (manufactured by Takara Bio Inc.), and then ligated to the pUC118 vector (cut with the restriction enzyme HincII and the cut surface was dephosphorylated). Ligation was performed using DNA Ligation Kit Ver.2 (Takara Bio Inc.). The ligation solution was transformed into competent cells of Escherichia coli DH5α (manufactured by Takara Bio Inc.) and plated on an LB plate containing 50 μg / mL of the antibiotic ampicillin and cultured overnight. For the grown colonies, plasmid DNA was collected with a miniprep, cut with restriction enzymes NotI and HindIII, and a plasmid in which the ADH1 terminator was inserted was selected. All of these series of operations were performed according to the attached protocol. The prepared plasmid is designated as pUC118-ADH1t.
次にpUC118−ADH1tを制限酵素NotI及びHindIIIで切断し、DNA断片を1%アガロースゲル電気泳動により分離、定法に従いADH1ターミネーターを含む断片を精製した。得られたADH1ターミネーターを含む断片を、pTRS102のNotI/HindIII切断部位にライゲーションし、上記と同様な方法でプラスミドDNAを回収し、制限酵素NotI及びHindIIIで切断することにより、TDH3ターミネーターがADH1ターミネーターに変更されたプラスミドを選抜した。以後、このようにして作製したプラスミドをpTRS150とする。 Next, pUC118-ADH1t was cleaved with restriction enzymes NotI and HindIII, DNA fragments were separated by 1% agarose gel electrophoresis, and a fragment containing ADH1 terminator was purified according to a conventional method. The obtained fragment containing the ADH1 terminator was ligated to the NotI / HindIII cleavage site of pTRS102, and plasmid DNA was recovered by the same method as described above, and then cleaved with the restriction enzymes NotI and HindIII. Modified plasmids were selected. Hereinafter, the plasmid thus prepared is designated as pTRS150.
このpTRS150を鋳型とし、オリゴヌクレオチド(配列番号8,15)をプライマーセットとしたPCRにより、ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子及びADH1ターミネーター配列を含む1.3kbのPCR断片を増幅した。ここで配列番号15のプライマーは、TDH3遺伝子の開始コドンから上流60bpに相当する配列が付加されるようデザインした。
A 1.3 kb PCR fragment containing the L-ldh gene derived from Xenopus laevis and the ADH1 terminator sequence was amplified by PCR using this pTRS150 as a template and oligonucleotides (SEQ ID NOs: 8, 15) as a primer set. did. Here, the primer of SEQ ID NO: 15 was designed such that a sequence corresponding to 60 bp upstream from the start codon of the TDH3 gene was added.
次に、プラスミドpRS426を増幅鋳型とし、オリゴヌクレオチド(配列番号10,16)をプライマーセットとしたPCRにより、酵母選択マーカーであるURA3遺伝子を含む1.2kbのPCR断片を増幅した。ここで、配列番号16のプライマーは、TDH3遺伝子の終始コドンから下流60bpに相当する配列が付加されるようデザインした。 Next, a 1.2 kb PCR fragment containing the URA3 gene as a yeast selection marker was amplified by PCR using plasmid pRS426 as an amplification template and oligonucleotides (SEQ ID NOs: 10 and 16) as primer sets. Here, the primer of SEQ ID NO: 16 was designed such that a sequence corresponding to 60 bp downstream from the stop codon of the TDH3 gene was added.
それぞれのPCR断片を1%アガロースゲル電気泳動により分離、常法に従い精製した。ここで得られた各1.3kb断片、1.2kb断片を混合したものを増幅鋳型とし、オリゴヌクレオチド(配列番号15,16)をプライマーセットとしたPCR法によって、ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子、ADH1ターミネーター及びURA3遺伝子が連結された約2.5kbのPCR断片を増幅した。
Each PCR fragment was separated by 1% agarose gel electrophoresis and purified according to a conventional method. A mixture of each 1.3 kb fragment and 1.2 kb fragment obtained here was used as an amplification template, and derived from Xenopus laevis by a PCR method using oligonucleotides (SEQ ID NOs: 15 and 16) as primer sets. A PCR fragment of about 2.5 kb to which the L-ldh gene, ADH1 terminator and URA3 gene were ligated was amplified.
上記のPCR断片を1%アガロースゲル電気泳動により分離、常法に従い精製後、ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子がpdc1遺伝子座に導入されたB2株に形質転換し、ウラシル非添加培地で培養することにより、ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子が染色体上のTDH3遺伝子プロモーターの下流に導入されている形質転換株を選択した。
The above PCR fragment was separated by 1% agarose gel electrophoresis, purified according to a conventional method, transformed into the B2 strain into which the L-ldh gene derived from Xenopus laevis was introduced at the pdc1 locus, and uracil-free. By culturing in an additional medium, a transformant in which the L-ldh gene derived from Xenopus laevis was introduced downstream of the TDH3 gene promoter on the chromosome was selected.
上記のようにして得られた形質転換株が、ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子が染色体上のTDH3遺伝子プロモーターの下流に導入されている酵母であることの確認は下記のように行った。まず、形質転換株のゲノムDNAをゲノムDNA抽出キットGenとるくん(タカラバイオ社製)により調製し、これを増幅鋳型とし、オリゴヌクレオチド(配列番号17,18)をプライマーセットとしたPCRにより、約2.8kbの増幅DNA断片が得られることで確認した。なお、非形質転換株では、上記PCRによって約2.1kbの増幅DNA断片が得られる。以下、上記ゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子が染色体上のTDH3遺伝子プロモーターの下流に導入された形質転換株をB3株とする。なお、TDH3遺伝子座の上流及び下流配列は、Saccharomyces Genome Database(URL:http://www.yeastgenome.org/)より取得することができる。
Confirmation that the transformant obtained as described above is a yeast in which the L-ldh gene derived from Xenopus laevis is introduced downstream of the TDH3 gene promoter on the chromosome is as follows. Went to. First, the genomic DNA of the transformant was prepared using a genomic DNA extraction kit Gen Toru-kun (manufactured by Takara Bio Inc.). This was confirmed by obtaining an amplified DNA fragment of 2.8 kb. For non-transformed strains, an amplified DNA fragment of about 2.1 kb can be obtained by the PCR. Hereinafter, a transformant in which the L-ldh gene derived from Xenopus laevis is introduced downstream of the TDH3 gene promoter on the chromosome is referred to as B3 strain. The upstream and downstream sequences of the TDH3 locus can be obtained from Saccharomyces Genome Database (URL: http://www.yeastgenome.org/).
(実施例7:L−乳酸生産性テスト3)
実施例6のようにして得られたB3株を用いて、実施例4,5と同様な方法でL−乳酸生産性テストを行った。培地として、実施例5と同様SC3培地を用いた。
(Example 7: L-lactic acid productivity test 3)
Using the B3 strain obtained as in Example 6, an L-lactic acid productivity test was conducted in the same manner as in Examples 4 and 5. As the medium, SC3 medium was used as in Example 5.
SC3培地10mLを試験管に取り、そこに少量のB3株を植菌し、30℃で一晩培養した(前々培養)。次に、SC3培地100mLを500ml容三角フラスコにいれ、各前々培養液を全量植菌し、30℃で24時間振とう培養した(前培養)。続いて、SC3培地を1L投入したミニジャーファメンター(丸菱バイオエンジ社製、容量5L)に、前培養開始から24時間後の前培養液を全量植菌し、攪拌速度(120rpm)、通気量(0.1L/min)、温度(30℃)、pH(pH5)を一定にして培養を行った(本培養)。本培養開始後30時間の培養液を遠心分離し、得られた上清を膜濾過した後、実施例4と同様な条件でHPLCによりL−乳酸量を測定した。測定結果から算出したL−乳酸の対糖収率及び実施例5で得られたB2株の対糖収率を表4に示す。 10 mL of SC3 medium was taken in a test tube, a small amount of B3 strain was inoculated therein, and cultured overnight at 30 ° C. (pre-culture). Next, 100 mL of SC3 medium was placed in a 500-mL Erlenmeyer flask, and the entire culture solution was inoculated before shaking and cultured with shaking at 30 ° C. for 24 hours (preculture). Subsequently, a pre-culture solution 24 hours after the start of the pre-culture was inoculated in a mini jar fermenter (manufactured by Maruhishi Bio-Engineering Co., Ltd., volume 5 L) into which 1 L of SC3 medium was added, and the stirring speed (120 rpm) and aeration were performed. The culture was carried out with the amount (0.1 L / min), temperature (30 ° C.), and pH (pH 5) being constant (main culture). The culture solution for 30 hours after the start of the main culture was centrifuged, the obtained supernatant was subjected to membrane filtration, and the amount of L-lactic acid was measured by HPLC under the same conditions as in Example 4. Table 4 shows the sugar yield of L-lactic acid calculated from the measurement results and the sugar yield of the B2 strain obtained in Example 5.
表4の結果から、ゼノプス・レービス(Xenopus laevis)由来のL−乳酸脱水素酵素をコードする遺伝子が染色体上のPDC1遺伝子のプロモーターの下流に発現可能な状態で導入された酵母を改良することにより、より高い対糖収率でL−乳酸を製造可能な酵母が作出できた。
From the results of Table 4, by improving the yeast in which the gene encoding L-lactate dehydrogenase derived from Xenopus laevis was introduced in a state that can be expressed downstream of the promoter of the PDC1 gene on the chromosome A yeast capable of producing L-lactic acid with a higher yield to sugar could be produced.
また、本発明のゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子が導入された酵母を既知の方法で更に改良し、該酵母を培養することでより高い対糖収率でL−乳酸を製造することが可能である。
Furthermore, the yeast in which the L-ldh gene derived from Xenopus laevis of the present invention has been introduced is further improved by a known method, and the yeast is cultured to obtain L-lactic acid at a higher sugar yield. It is possible to manufacture.
(実施例8、比較例6:L−乳酸脱水素酵素の活性)
実施例2、比較例2で得られた29−1B/pTRS102株及び29−1B/pTRS49株を用いて、pH5〜7におけるゼノプス・レービス(Xenopus laevis)由来のL−乳酸脱水素酵素活性及びウシ由来のL−乳酸脱水素酵素活性を比較した。
(Example 8, Comparative Example 6: Activity of L-lactate dehydrogenase)
Using the 29-1B / pTRS102 and 29-1B / pTRS49 strains obtained in Example 2 and Comparative Example 2, the L-lactate dehydrogenase activity derived from Xenopus laevis at pH 5 to 7 and bovine The derived L-lactate dehydrogenase activities were compared.
(a)菌体からのタンパク質抽出
SC−Ura培地10mLを試験管に入れ、そこに少量の29−1B/pTRS102株及び29−1B/pTRS49株を植菌し、30℃で一晩培養した(前培養)。次に、SC−Ura培地20mLを100mL容坂口フラスコに入れ、そこに前培養液を2%植菌し、24時間振とう培養した(本培養)。本培養液10mLを遠心により集菌、10mLのリン酸バッファーで洗浄後、1mLのリン酸バッファーに懸濁した。上記菌体懸濁液をエッペンドルフチューブに移し、さらに等量のガラスビーズ(SIGMA社製、直径0.6mm)を加え、Micro Tube Mixer(TOMY社製)を用い4℃で菌体を破砕した。上記のようにして菌体を破砕した後、遠心して得られる上清をL−乳酸脱水素酵素液(以下、L−LDH酵素液と略す。)とした。
(A) Protein extraction from bacterial cells 10 mL of SC-Ura medium was put into a test tube, and a small amount of 29-1B / pTRS102 strain and 29-1B / pTRS49 strain were inoculated therein and cultured at 30 ° C. overnight ( Pre-culture). Next, 20 mL of SC-Ura medium was placed in a 100 mL Sakaguchi flask, and 2% of the preculture was inoculated there, followed by shaking culture for 24 hours (main culture). 10 mL of the main culture was collected by centrifugation, washed with 10 mL of phosphate buffer, and then suspended in 1 mL of phosphate buffer. The bacterial cell suspension was transferred to an Eppendorf tube, an equal amount of glass beads (SIGMA, 0.6 mm in diameter) was added, and the bacterial cells were crushed at 4 ° C. using a Micro Tube Mixer (TOMY). After disrupting the cells as described above, the supernatant obtained by centrifugation was used as an L-lactic acid dehydrogenase solution (hereinafter abbreviated as L-LDH enzyme solution).
(b)L−乳酸脱水素酵素活性測定
(a)で得られたL−LDH酵素液の濃度を、ウシIgG(1.38mg/mL、BIO−RAD社製)をスタンダードとして作製した検量線をもとにBCA Protein Assay Kit(PIERCE社製)により測定し、各L−LDH酵素液が0.5mg/mLになるように滅菌水で希釈した。次に、表5に示した割合の6水準の混合液(L−LDH酵素液及びNADHを除く)をセミミクロキュベットに分注し、測定を始める直前にL−LDH酵素液及びNADHを加え混合した。ここで、2xBRバッファーとは、0.08M酢酸、リン酸、ホウ酸溶液を5NNaOHでpH5,6,7にそれぞれ調節した緩衝バッファーである。
(B) Measurement of L-lactate dehydrogenase activity A calibration curve prepared using bovine IgG (1.38 mg / mL, manufactured by BIO-RAD) as a standard for the concentration of the L-LDH enzyme solution obtained in (a). It was originally measured by BCA Protein Assay Kit (manufactured by PIERCE), and diluted with sterilized water so that each L-LDH enzyme solution was 0.5 mg / mL. Next, a 6-level mixed solution (excluding L-LDH enzyme solution and NADH) at the ratio shown in Table 5 was dispensed into a semi-micro cuvette, and the L-LDH enzyme solution and NADH were added and mixed immediately before the start of measurement. . Here, the 2 × BR buffer is a buffer buffer in which 0.08M acetic acid, phosphoric acid, and boric acid solutions are adjusted to pH 5, 6, and 7 with 5N NaOH, respectively.
各水準での340nmにおける吸光度の減少を分光光度計(Ultrospec3300Pro アマシャム社製)で測定し、得られたΔ340の値を式(1)にあてはめ、それぞれ比活性を算出した。測定はpH5,6,7の3水準で行った。上記測定において、比較対象とするL−乳酸脱水素酵素の比活性がウシ由来のL−乳酸脱水素酵素の比活性よりも、pH3水準のうち2水準以上で高い場合、その比較対象とするL−乳酸脱水素酵素は、pH5〜7においてウシ由来のL−乳酸脱水素酵素活性よりも高い活性を持つとする。算出結果を表6に示す。 The decrease in absorbance at 340 nm at each level was measured with a spectrophotometer (Ultrospec 3300Pro Amersham), and the obtained Δ340 value was applied to equation (1) to calculate the specific activity. The measurement was performed at three levels of pH 5, 6, and 7. In the above measurement, when the specific activity of L-lactate dehydrogenase to be compared is higher than the specific activity of bovine-derived L-lactate dehydrogenase at two or more of the three pH levels, the L to be compared -Lactate dehydrogenase has higher activity than bovine-derived L-lactate dehydrogenase at pH 5-7. Table 6 shows the calculation results.
この結果から、pH5〜7において、ゼノプス・レービス(Xenopus laevis)由来のL−乳酸脱水素酵素活性は、ウシ由来のL−乳酸脱水素酵素の活性よりも高いことがわかった。また、表2及び表3の結果から、本発明のゼノプス・レービス(Xenopus laevis)由来のL−ldh遺伝子が導入された酵母を培養することにより、ウシ由来のL−ldh遺伝子が導入された酵母を培養することよりも高い対糖収率でL−乳酸を製造することができることがわかった。 From this result, it was found that at pH 5 to 7, the L-lactate dehydrogenase activity derived from Xenopus laevis was higher than the activity of the L-lactate dehydrogenase derived from bovine. Further, from the results of Tables 2 and 3, by culturing the yeast into which the L-ldh gene derived from Xenopus laevis of the present invention was introduced, the yeast into which the bovine-derived L-ldh gene was introduced It was found that L-lactic acid can be produced at a higher sugar yield than that obtained by culturing.
表2、表3及び表6に示す結果から、pH5〜7におけるL−乳酸脱水素酵素活性がウシ由来のL−乳酸脱水素酵素活性よりも高いL−乳酸脱水素酵素をコードする遺伝子が導入された酵母を培養することにより、ウシ由来のL−ldh遺伝子が導入された酵母を培養することよりも高い対糖収率でL−乳酸を製造することができる。 From the results shown in Table 2, Table 3 and Table 6, a gene encoding L-lactate dehydrogenase having an L-lactate dehydrogenase activity at pH 5 to 7 higher than that of bovine L-lactate dehydrogenase was introduced. By culturing the yeast thus produced, L-lactic acid can be produced at a higher sugar yield than by culturing yeast introduced with a bovine-derived L-ldh gene.
Claims (7)
A method for producing L-lactic acid, comprising culturing the yeast according to any one of claims 1 to 6 .
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2007163859A JP5320692B2 (en) | 2006-06-28 | 2007-06-21 | Yeast and method for producing L-lactic acid |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2006178048 | 2006-06-28 | ||
| JP2006178048 | 2006-06-28 | ||
| JP2007163859A JP5320692B2 (en) | 2006-06-28 | 2007-06-21 | Yeast and method for producing L-lactic acid |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2008029329A JP2008029329A (en) | 2008-02-14 |
| JP2008029329A5 JP2008029329A5 (en) | 2010-07-22 |
| JP5320692B2 true JP5320692B2 (en) | 2013-10-23 |
Family
ID=39119381
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2007163859A Expired - Fee Related JP5320692B2 (en) | 2006-06-28 | 2007-06-21 | Yeast and method for producing L-lactic acid |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP5320692B2 (en) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1975232A4 (en) * | 2005-10-14 | 2009-07-29 | Toray Industries | Yeast and method of producing l-lactic acid |
| JP5992135B2 (en) | 2008-02-04 | 2016-09-14 | 東レ株式会社 | Process for producing lactic acid by continuous fermentation |
| CN105294424A (en) | 2008-12-26 | 2016-02-03 | 东丽株式会社 | Method for producing lactic acid and method for producing polylactic acid |
| KR20120027354A (en) | 2009-06-03 | 2012-03-21 | 도레이 카부시키가이샤 | Polypeptide having d-lactate dehydrogenase activity, polynucleotide encoding the polypeptide, and process for production of d-lactic acid |
| US9217165B2 (en) | 2011-04-28 | 2015-12-22 | Toray Industries, Inc. | Mutant strain of lactic acid producing yeast and process for producing lactic acid |
| US9150835B2 (en) | 2011-06-24 | 2015-10-06 | Samsung Electronics Co., Ltd. | Modified microorganism for highly efficient production of lactic acid |
| JPWO2013015212A1 (en) | 2011-07-22 | 2015-02-23 | 東レ株式会社 | Method for producing organic acid |
| US9593350B2 (en) | 2014-02-14 | 2017-03-14 | Samsung Electronics Co., Ltd. | Lactate dehydrogenase mutant, polynucleotide coding for the mutant, yeast cell including the polynucleotide, method of preparing the mutant, and method of producing the lactate using the same |
| CN113430127B (en) * | 2021-07-07 | 2024-01-12 | 江南大学 | Recombinant bacterium for producing L-lactic acid and application thereof |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IT1294728B1 (en) * | 1997-09-12 | 1999-04-12 | Biopolo S C A R L | YEAST STRAWS FOR THE REPRODUCTION OF LACTIC ACID |
| JP2003259878A (en) * | 2002-03-11 | 2003-09-16 | Toyota Central Res & Dev Lab Inc | Dna encoding lactate dehydrogenase and utilization of the same |
| EP1513940A4 (en) * | 2002-05-30 | 2006-10-25 | Cargill Dow Llc | Methods and materials for the production of lactic acid in yeast |
-
2007
- 2007-06-21 JP JP2007163859A patent/JP5320692B2/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| JP2008029329A (en) | 2008-02-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5320692B2 (en) | Yeast and method for producing L-lactic acid | |
| AU748462B2 (en) | Yeast strains for the production of lactic acid | |
| AU2006300688B2 (en) | Yeast and method of producing L-lactic acid | |
| EP2313489B1 (en) | Production method | |
| EP2439271B1 (en) | Polypeptide having d-lactate dehydrogenase activity, polynucleotide encoding the polypeptide, and process for production of d-lactic acid | |
| US7964382B2 (en) | DNA encoding a protein having D-lactate dehydrogenase activity and uses thereof | |
| JP7034088B2 (en) | Lactic acid production method | |
| JP2015505471A (en) | Recombinant microorganism and method of use thereof | |
| WO2005106005A1 (en) | Process for producing hydroxycarboxylic acid | |
| EP3877525A2 (en) | Co-production pathway for 3-hp and acetyl-coa derivatives from malonate semialdehyde | |
| JP5142268B2 (en) | Improved gallic acid synthase and method for producing gallic acid | |
| JP2008283917A (en) | Method for producing lactic acid | |
| US10059926B2 (en) | Mutant lactate dehydrogenase | |
| JP2006006271A (en) | Lactic acid-producing yeast and lactic acid producing method | |
| JP2008301766A (en) | Culture medium for producing lactic acid, and method for producing lactic acid | |
| EP3625337B1 (en) | Process for producing an organic compound | |
| JP2006296377A (en) | Transformant for producing organic acid | |
| JP2008043325A (en) | Yeast having temperature-sensitive alcoholdehydrogenase, and method for producing organic acid | |
| JP2006280368A (en) | Method for producing organic acid | |
| WO2005123921A1 (en) | Novel glycerol dehydrogenase, gene therefor, and method of utilizing the same | |
| JP2003093060A (en) | Method for producing organic acid and alcohol using acid- resistant microorganism | |
| JP2006246701A (en) | Acetic acid bacterium having enhanced enzyme activity of central metabolic system and method for producing vinegar using the acetic acid bacterium | |
| JP2007174947A (en) | Yeast strain and method for producing lactic acid |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100608 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20100608 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120814 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20130618 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20130701 |
|
| R151 | Written notification of patent or utility model registration |
Ref document number: 5320692 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R151 |
|
| LAPS | Cancellation because of no payment of annual fees |