JP4896015B2 - Real-time measurement of ventricular stroke volume variance by continuous arterial pulse contour analysis - Google Patents
Real-time measurement of ventricular stroke volume variance by continuous arterial pulse contour analysis Download PDFInfo
- Publication number
- JP4896015B2 JP4896015B2 JP2007521682A JP2007521682A JP4896015B2 JP 4896015 B2 JP4896015 B2 JP 4896015B2 JP 2007521682 A JP2007521682 A JP 2007521682A JP 2007521682 A JP2007521682 A JP 2007521682A JP 4896015 B2 JP4896015 B2 JP 4896015B2
- Authority
- JP
- Japan
- Prior art keywords
- standard deviation
- value
- calculating
- svv
- function
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 238000005259 measurement Methods 0.000 title claims description 56
- 230000002861 ventricular Effects 0.000 title claims description 19
- 238000004458 analytical method Methods 0.000 title description 4
- 238000004364 calculation method Methods 0.000 claims description 101
- 238000000034 method Methods 0.000 claims description 75
- 230000000747 cardiac effect Effects 0.000 claims description 67
- 230000000241 respiratory effect Effects 0.000 claims description 47
- 238000012545 processing Methods 0.000 claims description 41
- 238000005070 sampling Methods 0.000 claims description 35
- 230000004872 arterial blood pressure Effects 0.000 claims description 24
- 230000036772 blood pressure Effects 0.000 claims description 23
- 238000001914 filtration Methods 0.000 claims description 16
- 230000000004 hemodynamic effect Effects 0.000 claims description 15
- 238000007781 pre-processing Methods 0.000 claims description 11
- 238000004590 computer program Methods 0.000 claims description 10
- 230000003205 diastolic effect Effects 0.000 claims description 10
- 239000006185 dispersion Substances 0.000 claims description 10
- 230000029058 respiratory gaseous exchange Effects 0.000 claims description 10
- 230000035488 systolic blood pressure Effects 0.000 claims description 9
- 230000035485 pulse pressure Effects 0.000 claims description 8
- 238000001514 detection method Methods 0.000 claims description 6
- 238000006243 chemical reaction Methods 0.000 claims description 4
- 230000007246 mechanism Effects 0.000 claims description 2
- 238000009530 blood pressure measurement Methods 0.000 claims 2
- 230000006870 function Effects 0.000 description 32
- 238000012544 monitoring process Methods 0.000 description 14
- 239000012530 fluid Substances 0.000 description 13
- 230000004043 responsiveness Effects 0.000 description 7
- 238000012360 testing method Methods 0.000 description 7
- 241001465754 Metazoa Species 0.000 description 6
- 239000008280 blood Substances 0.000 description 6
- 210000004369 blood Anatomy 0.000 description 6
- 238000004422 calculation algorithm Methods 0.000 description 6
- 230000000875 corresponding effect Effects 0.000 description 6
- 238000009499 grossing Methods 0.000 description 5
- 238000005399 mechanical ventilation Methods 0.000 description 5
- 210000001367 artery Anatomy 0.000 description 4
- 238000002474 experimental method Methods 0.000 description 4
- 230000036316 preload Effects 0.000 description 4
- 210000001147 pulmonary artery Anatomy 0.000 description 4
- 238000012952 Resampling Methods 0.000 description 3
- 230000003750 conditioning effect Effects 0.000 description 3
- 230000007812 deficiency Effects 0.000 description 3
- 210000001105 femoral artery Anatomy 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- 238000012806 monitoring device Methods 0.000 description 3
- 230000036581 peripheral resistance Effects 0.000 description 3
- 230000000541 pulsatile effect Effects 0.000 description 3
- 206010047139 Vasoconstriction Diseases 0.000 description 2
- 210000000709 aorta Anatomy 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 230000035487 diastolic blood pressure Effects 0.000 description 2
- 230000000694 effects Effects 0.000 description 2
- 238000000605 extraction Methods 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 210000004072 lung Anatomy 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 239000000523 sample Substances 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- 230000001960 triggered effect Effects 0.000 description 2
- 230000025033 vasoconstriction Effects 0.000 description 2
- 230000024883 vasodilation Effects 0.000 description 2
- 238000012935 Averaging Methods 0.000 description 1
- 206010016803 Fluid overload Diseases 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 206010053159 Organ failure Diseases 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 208000008784 apnea Diseases 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- 230000017531 blood circulation Effects 0.000 description 1
- 210000002302 brachial artery Anatomy 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000002131 composite material Substances 0.000 description 1
- 230000001143 conditioned effect Effects 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 210000000624 ear auricle Anatomy 0.000 description 1
- 238000002592 echocardiography Methods 0.000 description 1
- 230000002526 effect on cardiovascular system Effects 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 230000005986 heart dysfunction Effects 0.000 description 1
- 208000011316 hemodynamic instability Diseases 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 238000011221 initial treatment Methods 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 238000012886 linear function Methods 0.000 description 1
- 230000005980 lung dysfunction Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 238000006213 oxygenation reaction Methods 0.000 description 1
- 230000010412 perfusion Effects 0.000 description 1
- 230000000737 periodic effect Effects 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 210000002321 radial artery Anatomy 0.000 description 1
- 238000012892 rational function Methods 0.000 description 1
- 230000011514 reflex Effects 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 210000005245 right atrium Anatomy 0.000 description 1
- 239000004071 soot Substances 0.000 description 1
- 230000003068 static effect Effects 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 230000004873 systolic arterial blood pressure Effects 0.000 description 1
- 230000000451 tissue damage Effects 0.000 description 1
- 231100000827 tissue damage Toxicity 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 238000002604 ultrasonography Methods 0.000 description 1
- 238000009827 uniform distribution Methods 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 238000009423 ventilation Methods 0.000 description 1
- 210000000707 wrist Anatomy 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/02—Detecting, measuring or recording pulse, heart rate, blood pressure or blood flow; Combined pulse/heart-rate/blood pressure determination; Evaluating a cardiovascular condition not otherwise provided for, e.g. using combinations of techniques provided for in this group with electrocardiography or electroauscultation; Heart catheters for measuring blood pressure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/02—Detecting, measuring or recording pulse, heart rate, blood pressure or blood flow; Combined pulse/heart-rate/blood pressure determination; Evaluating a cardiovascular condition not otherwise provided for, e.g. using combinations of techniques provided for in this group with electrocardiography or electroauscultation; Heart catheters for measuring blood pressure
- A61B5/02028—Determining haemodynamic parameters not otherwise provided for, e.g. cardiac contractility or left ventricular ejection fraction
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/02—Detecting, measuring or recording pulse, heart rate, blood pressure or blood flow; Combined pulse/heart-rate/blood pressure determination; Evaluating a cardiovascular condition not otherwise provided for, e.g. using combinations of techniques provided for in this group with electrocardiography or electroauscultation; Heart catheters for measuring blood pressure
- A61B5/0205—Simultaneously evaluating both cardiovascular conditions and different types of body conditions, e.g. heart and respiratory condition
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/02—Detecting, measuring or recording pulse, heart rate, blood pressure or blood flow; Combined pulse/heart-rate/blood pressure determination; Evaluating a cardiovascular condition not otherwise provided for, e.g. using combinations of techniques provided for in this group with electrocardiography or electroauscultation; Heart catheters for measuring blood pressure
- A61B5/021—Measuring pressure in heart or blood vessels
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/02—Detecting, measuring or recording pulse, heart rate, blood pressure or blood flow; Combined pulse/heart-rate/blood pressure determination; Evaluating a cardiovascular condition not otherwise provided for, e.g. using combinations of techniques provided for in this group with electrocardiography or electroauscultation; Heart catheters for measuring blood pressure
- A61B5/021—Measuring pressure in heart or blood vessels
- A61B5/02108—Measuring pressure in heart or blood vessels from analysis of pulse wave characteristics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/02—Detecting, measuring or recording pulse, heart rate, blood pressure or blood flow; Combined pulse/heart-rate/blood pressure determination; Evaluating a cardiovascular condition not otherwise provided for, e.g. using combinations of techniques provided for in this group with electrocardiography or electroauscultation; Heart catheters for measuring blood pressure
- A61B5/026—Measuring blood flow
- A61B5/029—Measuring or recording blood output from the heart, e.g. minute volume
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/02—Detecting, measuring or recording pulse, heart rate, blood pressure or blood flow; Combined pulse/heart-rate/blood pressure determination; Evaluating a cardiovascular condition not otherwise provided for, e.g. using combinations of techniques provided for in this group with electrocardiography or electroauscultation; Heart catheters for measuring blood pressure
- A61B5/021—Measuring pressure in heart or blood vessels
- A61B5/0215—Measuring pressure in heart or blood vessels by means inserted into the body
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/08—Detecting, measuring or recording devices for evaluating the respiratory organs
- A61B5/0816—Measuring devices for examining respiratory frequency
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/24—Detecting, measuring or recording bioelectric or biomagnetic signals of the body or parts thereof
- A61B5/316—Modalities, i.e. specific diagnostic methods
- A61B5/318—Heart-related electrical modalities, e.g. electrocardiography [ECG]
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Molecular Biology (AREA)
- Physiology (AREA)
- Biophysics (AREA)
- Pathology (AREA)
- Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- Veterinary Medicine (AREA)
- Medical Informatics (AREA)
- Physics & Mathematics (AREA)
- Surgery (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Vascular Medicine (AREA)
- Hematology (AREA)
- Pulmonology (AREA)
- Measuring Pulse, Heart Rate, Blood Pressure Or Blood Flow (AREA)
- Measurement Of The Respiration, Hearing Ability, Form, And Blood Characteristics Of Living Organisms (AREA)
Description
(関連出願に対する相互参照)
本出願は、同時係属中の2003年12月5日に出願された米国特許出願番号第10/728,705号、および2004年7月14日に出願された同第10/890,887号の一部継続出願であり、それらに対する優先権を主張し、そしてそれらは参考として援用される。
(Cross-reference to related applications)
No. 10 / 728,705 filed on Dec. 5, 2003, and 10 / 890,887 filed Jul. 14, 2004, which are co-pending. Some continuation applications claim priority to them, and they are incorporated by reference.
(発明の背景)
(発明の分野)
本発明は、一般に心臓モニタリングに関し、そして特に心室一回拍出量分散(SVV)の推定およびこの方法を実行するシステムに関する。
(Background of the Invention)
(Field of Invention)
The present invention relates generally to cardiac monitoring, and in particular to ventricular stroke volume variance (SVV) estimation and a system for performing this method.
(背景技術)
一回拍出量(SV)、心拍出量(CO)などは、疾患の診断のためのみならず、患者を含むヒト被験体および動物被験体の両方の状態の「リアルタイム」モニタリングのためにもまた重要な指標である。従って、これらの心臓パラメーターの1つ以上をモニターするための装置のない病院はほとんどない。多くの技法−侵襲的および非侵襲的、ならびに両者の組み合わせ−が使用され、そして文献ではなおより多くが提案されている。
(Background technology)
Stroke volume (SV), cardiac output (CO), etc. are not only for disease diagnosis, but also for “real time” monitoring of the status of both human and animal subjects, including patients. Is also an important indicator. Thus, few hospitals lack a device for monitoring one or more of these cardiac parameters. Many techniques are used-invasive and non-invasive, and a combination of both-and even more are proposed in the literature.
SVを測定するために用いられる技法の大部分は、通常、同様にCOの推定を提供するように容易に適合され得る。なぜなら、COは、一般に、モニタリング装置に通常利用可能である心拍数HRのSV倍として規定されるからである。逆に、COを推定する大部分の装置はまた、サブステップとしてSVを推定する。 Most of the techniques used to measure SV can usually be easily adapted to provide an estimate of CO as well. This is because CO is generally defined as SV times the heart rate HR normally available to monitoring devices. Conversely, most devices that estimate CO also estimate SV as a substep.
以下にさらに詳細に説明されるように、臨床的に重要な情報を提供するために有望であるなお別の心臓パラメーターは、一回拍出量分散SVVである。SVVを推定する1つの方法は、単に複数のSV値を収集し、そして測定間隔から測定間隔までの差異を算出することである。 As will be explained in more detail below, yet another cardiac parameter that is promising for providing clinically relevant information is stroke volume variance SVV. One way to estimate SVV is to simply collect multiple SV values and calculate the difference from measurement interval to measurement interval.
SVまたはCOを測定するための1つの一般的方法は、特定の流れ測定デバイスをカテーテル上に取り付けること、そして次にこのカテーテルを被験体に通すこと、およびそれを、このデバイスが被験体の心臓中またはその近傍にあるように操縦することである。いくつかのこのようなデバイスは、右心房のような、上流位置で材料またはエネルギー(通常熱)いずれかを大量瞬時(bolus)注入し、そして肺動脈のような、下流位置で注入された材料またはエネルギーの特徴に基づく流れを決定する。このような侵襲的技法(特に、熱希釈)の履行を開示する特許は:米国特許番号第4,236,527号(Newbowerら、1980年12月2日)(特許文献1);米国特許番号第4,507,974号(Yelderman、1985年4月2日)(特許文献2);米国特許番号第5,146,414号(McKownら、1992年9月8日)(特許文献3);および米国特許番号第5,687,733(McKownら、1997年11月18日)(特許文献4)を含む。 One common method for measuring SV or CO is to attach a specific flow measurement device onto the catheter, and then pass the catheter through the subject, and that device is the subject's heart. Maneuver to be in or near. Some such devices have a bolus injection of either material or energy (usually heat) at the upstream location, such as the right atrium, and material injected at the downstream location, such as the pulmonary artery or Determine flow based on energy characteristics. Patents disclosing implementation of such invasive techniques (especially thermodilution) are: US Pat. No. 4,236,527 (Newbower et al., December 2, 1980); US Pat. No. 4,507,974 (Yelderman, April 2, 1985) (Patent Document 2); US Pat. No. 5,146,414 (McKown et al., September 8, 1992) (Patent Document 3); And US Pat. No. 5,687,733 (McKown et al., November 18, 1997) (Patent Document 4).
なおその他の侵襲的デバイスは、公知のFick技法に基づき、これによれば、COは、動脈性および混合された静脈血の酸素添加の関数として算出される。 Still other invasive devices are based on the well-known Fick technique, whereby CO is calculated as a function of arterial and mixed venous blood oxygenation.
侵襲的技法は明らかな欠点を有し、その主要な1つは、もちろん、心臓のカテーテル処置は、特に、それが実施される患者(特に集中治療患者)が、特定の実際に、または潜在的に重篤な症状のためにしばしばすでに入院中であることを考慮すれば、潜在的に危険であることである。侵襲的方法はまた、より明らかはない欠点を有している:熱希釈のようないくつかの技法は、それらが如何に良好に満足されるかに依存して測定の正確さに影響する注入された熱の均一な分散のような仮定に依存する。さらに、機器の血流中へのまさに導入がこの器具が測定する値(例えば、流速)に影響し得る。 Invasive techniques have obvious drawbacks, one of which is, of course, cardiac catheterization, especially for the patient (especially intensive care patient) in which it is performed, with certain actual or potential Considering that they are often already in hospital because of severe symptoms, they are potentially dangerous. Invasive methods also have a less obvious drawback: some techniques, such as thermodilution, affect the accuracy of the measurement depending on how well they are satisfied. Depends on assumptions such as a uniform distribution of the generated heat. Furthermore, the very introduction of the device into the bloodstream can affect the value (eg, flow rate) that the instrument measures.
侵襲的および非侵襲的トランスデューサを用いるドップラー技法がまた、流れを測定するため、ならびに流れ測定からSVおよびCOを算出するために用いられる。これらシステムは、代表的には、高価であるのみならず、それらの正確さは、流れチャネルの直径および全体幾何学的形状の正確な知識に依存する。このような正確な知識は、しかし、特に、リアルタイムモニタリングが所望される条件下では、めったに可能ではない。 Doppler techniques using invasive and non-invasive transducers are also used to measure flow and to calculate SV and CO from flow measurements. Not only are these systems typically expensive, their accuracy depends on accurate knowledge of the flow channel diameter and overall geometry. Such accurate knowledge, however, is rarely possible, especially under conditions where real-time monitoring is desired.
従って、非侵襲的であるか、またはせいぜい最小侵襲的であり、かつ正確である両方の、SV、SVVなどのような心臓パラメーターを決定する特定の方法に対する長年に渡る必要性が存在している。最小侵襲または侵襲なくして、このようなパラメーターを正確に決定するための特に有望であることが証明されている1つの血液特徴は血圧である。 Thus, there is a longstanding need for specific methods of determining cardiac parameters such as SV, SVV, etc. that are both non-invasive or at best minimally invasive and accurate. . One blood feature that has proven particularly promising for accurately determining such parameters, with minimal or no invasiveness, is blood pressure.
最も知られた血圧を基にするシステムは、いわゆる脈拍輪郭法(PCM)に依存し、これは、拍動から拍動まで(beat−to−beat)の圧力波形の特徴から目的の心臓パラメーター(単数または複数)の推定値を算出する。PCMでは、代表的には、「Windkessel」(「空気チャンバーのドイツ語」)パラメーター(特徴的な大動脈のインピーダンス、コンプライアンス、および合計末梢抵抗)を用いて、大動脈の線形または非線形血行力学モデルを構築する。基本的に、血液流れは、インピーダンスが、並列に接続された抵抗および静電容量(コンプライアンス)の直列である回路における電流の流れに類推される。このモデルの3つの必要なパラメーターは、通常、複雑な較正プロセスにより実験的に、または編集された「人体計測」データ、すなわち、その他の患者または試験被験体の年齢、性別、身長、体重などについてのデータからのいずれかで決定される。米国特許番号第5,400,793号(Wesseling、1995年3月28日)(特許文献5)および米国特許番号第5,535,753号(Petrucelliら、1996年7月16日)(特許文献6)は、COを決定するために、Windkessel回路モデルに依存するシステムの代表である。 Most known blood pressure-based systems rely on so-called pulse contouring (PCM), which is characterized by the beat-to-beat pressure waveform characteristics and the desired cardiac parameters ( Calculate one or more estimates. PCM typically builds a linear or non-linear hemodynamic model of the aorta using “Windkessel” (“Air Chamber German”) parameters (characteristic aortic impedance, compliance, and total peripheral resistance) To do. Basically, blood flow is analogous to current flow in a circuit where the impedance is in series with a resistance and capacitance (compliance) connected in parallel. The three required parameters of this model are usually “anthropometric” data, experimentally or edited by a complex calibration process, ie about the age, gender, height, weight, etc. of other patients or test subjects. Determined from any of the data. US Patent No. 5,400,793 (Wesseling, March 28, 1995) (Patent Document 5) and US Patent No. 5,535,753 (Petlucelli et al., July 16, 1996) (Patent Document) 6) is representative of a system that relies on the Windkessel circuit model to determine CO.
PCMを基礎にするシステムは、SV由来の心臓パラメーターを、患者中にカテーテルを残す(通常、右心に)必要性なく、多かれ少なかれ連続的にモニターし得る。実際、幾つかのPCMシステムは、指カフを用いてとられた血圧パラメーター測定値を用いて作動する。PCMの1つの欠点は、しかし、それが由来するむしろ簡単な3パラメーターモデルよりも正確でないことである:一般に、例えば、動脈分岐によって引き起こされる複数のインピーダンスミスマッチに起因する圧力波反射の複雑なパターンのようなその他の現象を忠実に説明するためには、かなりより高い次数のモデルが必要とされ得る。上記基礎的モデルの正確さは、通常、十分に良好でないので、変化する程度の複雑さで、多くの改良が提案されている。 PCM-based systems can monitor SV-derived cardiac parameters more or less continuously without the need to leave a catheter in the patient (usually in the right heart). In fact, some PCM systems operate using blood pressure parameter measurements taken using a finger cuff. One drawback of PCM, however, is that it is less accurate than the rather simple three-parameter model from which it is derived: in general, the complex pattern of pressure wave reflections due to multiple impedance mismatches caused by, for example, arterial bifurcations A much higher order model may be required to faithfully explain other phenomena such as Since the accuracy of the basic model is usually not good enough, many improvements have been proposed with varying complexity.
公開された米国特許出願番号第20020022785A1(特許文献7)においてSalvatore Romanoによって開示された「心拍拍出量を測定する方法および装置」(2002年2月21日「心拍拍出量を測定する方法および装置」)は、全体圧力曲線の下の領域と、インピーダンスの種々の構成要素の線形組み合わせとの間の比の関数として、侵襲的または非侵襲的いずれかでSVを推定することにより、PCM技法に対し改良する異なる試みを提示している。圧力反射を説明するための試みにおいて、Romanoのシステムは、この圧力関数の固有にノイズのある派生物の正確な推定に依存するのみならず、一連の実験的に決定された平均圧力値に対する数値調節にもまた依存する。 "Method and apparatus for measuring cardiac output" disclosed by Salvatore Romano in published US Patent Application No. 2002022785A1 (February 21, 2002, "Method and apparatus for measuring cardiac output" The device ") is a PCM technique that estimates SV either invasively or non-invasively as a function of the ratio between the area under the overall pressure curve and the linear combination of the various components of impedance. Presents different attempts to improve In an attempt to account for pressure reflexes, the Romano system not only relies on an accurate estimate of the inherently noisy derivative of this pressure function, but also a numerical value for a series of experimentally determined average pressure values. It also depends on the adjustment.
血行力学的に不安定な患者における流体投与は、それが、SV、CO、またはその他の血行力学的パラメーターをリアルタイムに測定することになるとき、しばしば、主要な挑戦である。初期治療戦略として流体救急蘇生法をとる決定のような、血液量不足症の正確な臨床的評価は困難である。具体的には、血行力学的に不安定な患者が一回拍出量および心拍拍出量における増加をともなって流体治療に応答するか否かを予測することは非常に困難である。さらに、流体過剰負荷は、有意な肺または心臓機能不全を引き起こし得、その一方、流体不足は、致命的な器官不全を生じる組織損傷を引き起こし得る。患者の流体応答性は、流体救急蘇生法治療の適切性を評価するため、および最適心臓性能および器官灌流を確実にするための主要かつ最も重要な決定因子である。 Fluid administration in hemodynamically unstable patients is often a major challenge when it comes to measuring SV, CO, or other hemodynamic parameters in real time. Accurate clinical assessment of blood volume deficiencies, such as the decision to take fluid emergency resuscitation as an initial treatment strategy, is difficult. Specifically, it is very difficult to predict whether a hemodynamically unstable patient will respond to fluid therapy with an increase in stroke volume and cardiac output. Furthermore, fluid overload can cause significant lung or heart dysfunction, while fluid deficiency can cause tissue damage resulting in fatal organ failure. Patient fluid responsiveness is the primary and most important determinant for assessing the suitability of fluid emergency resuscitation therapy and for ensuring optimal cardiac performance and organ perfusion.
心室前負荷の多くのベッドサイド指標は、流体応答性の予測指標として用いられている。右動脈圧(RAP)および肺動脈閉塞圧(PAOP)は、集中治療ユニット(ICU)で、流体を投与することを決定するとき、最も共通して用いられる。その他の心室前負荷のベッドサイド指標は、経食道的に心エコー検査法で測定された、右心室端部拡張期容量(RVEDV)および左心室端部拡張期容量(LVEDA)を含む。いくつかの研究および事例報告は、しかし、これらの心臓充填圧力を基礎にするこれらの静的指標値は乏しい予測値を有し、そしてしばしば、流体応答性について適切な情報を与えないことを示した。 Many bedside indicators of ventricular preload are used as predictors of fluid responsiveness. Right arterial pressure (RAP) and pulmonary artery occlusion pressure (PAOP) are most commonly used in an intensive care unit (ICU) when deciding to administer fluid. Other bedside indicators of ventricular preload include right ventricular end diastolic volume (RVE V) and left ventricular end diastolic volume (LVEDA) measured transesophageally by echocardiography. Some studies and case reports, however, show that these static index values based on these heart filling pressures have poor predictors and often do not give adequate information about fluid responsiveness It was.
最近、いくつかの研究が、機械的人工呼吸の下で、心臓血管系と肺との相互作用から生じる、左心室一回拍出量で観察された分散をモニターすることの臨床的重要性を確認した。これらの一回拍出量分散(SVV)は、機械的人工呼吸に起因する胸腔内圧力における周期的増加および減少によって引き起こされ、これは、心臓前負荷および後負荷における分散に至る。SVVは、最近、広範に調査され、そしていくつかの研究は、種々の臨床状況において流体応答性の予測因子としてSVVを用いることの有用性を示している。SVVに基づくいくつかのその他のパラメーターが同様に有用であることが見出されている。特に、収縮期圧力分散(SPV)がそのデルタ−上昇(Δ上昇)およびデルタ−下降(Δ下降)構成要素が流体応答性の非常に有用な予測因子であることが見出されている。SPVは、一回拍出量における呼吸誘導分散に起因する動脈拍圧力における変化に基づく。最近調査されて、かつ流体応答性の有効な指標であることが示されたなお別のパラメーターは、脈圧分散(PPV)である。 Recently, several studies have shown the clinical importance of monitoring the variance observed in left ventricular stroke volume resulting from cardiovascular and lung interactions under mechanical ventilation. confirmed. These stroke volume variances (SVV) are caused by periodic increases and decreases in intrathoracic pressure due to mechanical ventilation, which leads to variance in cardiac preload and afterload. SVV has recently been extensively investigated, and several studies have shown the utility of using SVV as a predictor of fluid responsiveness in a variety of clinical situations. Several other parameters based on SVV have been found to be useful as well. In particular, it has been found that systolic pressure dispersion (SPV) has its delta-rise (Δrise) and delta-fall (Δfall) components very useful predictors of fluid responsiveness. SPV is based on changes in arterial pulse pressure due to respiratory-induced dispersion in stroke volume. Yet another parameter that has been recently investigated and shown to be an effective indicator of fluid responsiveness is pulse pressure dispersion (PPV).
動脈拍動輪郭分析法における最近の発展は、より少ない侵襲性の、連続的でかつリアルタイムのSVVの推定のために特有の機会を開いた。これは、臨床医が、救命救急患者の血行力学状態のそれらの評価において、SVおよびCOとともにSVVを慣用的に用いることを可能にする。 Recent developments in arterial pulsatile contour analysis have opened unique opportunities for less invasive, continuous and real-time SVV estimation. This allows clinicians to routinely use SVV in conjunction with SV and CO in their assessment of the critical care patient's hemodynamic status.
動脈拍圧における呼吸で誘導される変化に基づく流体応答性を測定するための現存するシステムは、ほとんどすべて2〜3の方法のみの1つに基づく。文献中に記載された幾つかの方法は、脈拍圧分散(PPV)、収縮期圧力分散(SPV)および一回拍出量分散(SVV)の以下の測定を含む。 Existing systems for measuring fluid responsiveness based on respiration-induced changes in arterial pulse pressure are almost all based on one of only a few methods. Some methods described in the literature include the following measurements of pulse pressure variance (PPV), systolic pressure variance (SPV) and stroke volume variance (SVV).
PPV推定は、以下の等式1の特定のバージョンに基づく:
PPV=100・[PPmax−PPmin]/[1/2(PPmax+PPmin)](等式1)
ここで、PPは測定された脈拍圧力、PPmaxおよびPPminは、それぞれ、1回の呼吸(吸息−呼息)周期の間の脈拍圧力の最大および最小のピークからピークまでの値である。
PPV estimation is based on a specific version of
PPV = 100 · [PPmax−PPmin] / [1/2 (PPmax + PPmin)] (Equation 1)
Where PP is the measured pulse pressure, and PPmax and PPmin are the maximum and minimum peak-to-peak values of the pulse pressure during one breath (inspiration-expiration) cycle, respectively.
SPV推定は、以下の等式2の特定のバージョンに基づく:
SPV=100・[SPmax−SPmin]/[1/2(SPmax+SPmin)](等式2)
ここで、SPは測定された収縮期圧力、SPmaxおよびSPminは、それぞれ、1つの呼吸周期の間の収縮期圧力の最大値および最小値である。
SPV estimation is based on a specific version of Equation 2 below:
SPV = 100 · [SPmax−SPmin] / [1/2 (SPmax + SPmin)] (Equation 2)
Where SP is the measured systolic pressure and SPmax and SPmin are the maximum and minimum values of systolic pressure during one respiratory cycle, respectively.
同様に、SVV推定は、以下の等式3の特定のバージョンに基づく:
SVV=100・[SVmax−SVmin]/[1/2(SVmax+SVmin)](等式3)
ここで、SVは一回拍出量、SVmaxおよびSVminは、それぞれ、1つの呼吸周期の間の一回拍出量の最大値および最小値である。
Similarly, SVV estimation is based on a specific version of Equation 3 below:
SVV = 100 · [SVmax−SVmin] / [1/2 (SVmax + SVmin)] (Equation 3)
Here, SV is the stroke volume, and SVmax and SVmin are the maximum value and the minimum value of the stroke volume during one respiratory cycle, respectively.
等式1、2、および3において、支配因子は、それぞれ、PP、SPおよびSVの最大値および最小値の平均である。換言すれば、2つの測定点のみであるにもかかわらず、これら支配因子は平均値である。この単純な極限値を平均することは、最も共通してこれら算出を単純にし、これらは、代表的には、手動で実施されている。しかし、より信頼性のある値は、測定間隔に亘るすべての測定値の平均、すなわち、PP、SP、およびSVの第1の統計的積率を用いることにより得られ得る。
In
従って、PPV、SPVおよびSVVの各々について、上記個々の分散値式は、極限値(最大および最小)値の平均に対して所定範囲の値(最大−最小)の大きさを示す。 Therefore, for each of PPV, SPV and SVV, the individual dispersion value formulas indicate the magnitude of a predetermined range of values (maximum-minimum) relative to the average of the extreme values (maximum and minimum).
SVVの詳細なモニタリングは、特有の困難性および利点の両方を有する。生理学的には、SVVは、心臓−呼吸相互作用のいくつかの複雑な機構に基づく。簡単には:機械的人工呼吸は左心室前負荷に変化を引き起こし、これは、左心室一回拍出量および収縮期動脈圧における明確な分散に至る。SVVのモニタリングは、容量投与に対する左心室応答の予測を可能にし、血液量不足症の正確な評価とともに、そして、多くの重要な状況で容量救急蘇生を行うための引き続く決定を支援する。 Detailed monitoring of SVV has both unique difficulties and advantages. Physiologically, SVV is based on several complex mechanisms of heart-respiration interaction. Briefly: Mechanical ventilation causes changes in the left ventricular preload, which leads to a clear distribution in left ventricular stroke volume and systolic arterial pressure. SVV monitoring allows for the prediction of left ventricular response to volume dosing, along with an accurate assessment of blood volume deficiencies, and supports subsequent decisions to perform volume emergency resuscitation in many important situations.
上記に列挙した3つの方法に加え、一般に、「呼吸収縮期分散試験」と呼ばれるPerel法として知られる第4の方法がある。この方法は、短い無呼吸期間によって先行される変化する大きさの換気量を誘導することのような、気道圧力操縦を含む。米国特許番号第5,769,082号(Perel)は、この方法を記載している。圧力操縦の必要性のため、この方法は、リアルタイムモニタリングには適切ではない。 In addition to the three methods listed above, there is a fourth method, commonly known as the Perel method, called the “Respiratory Systolic Dispersion Test”. This method includes airway pressure maneuvers, such as inducing variable magnitude ventilation preceded by a short apnea period. US Pat. No. 5,769,082 (Perel) describes this method. This method is not suitable for real-time monitoring due to the need for pressure steering.
上記に列挙した方法は、LiDCO Ltdの心臓モニターおよびPulsion Medical SystemsのPiCCOシステムのような特定のCOモニタリング機器で実施され(例えば、米国特許番号第6,315,735号(特許文献8)−−Joekenら、を参照のこと)、その両方は、等式3に依存する。しかし、本発明者らによる試験は、これらの方法はノイズが多く、それらが動脈拍圧力における呼吸誘導変化の正確なリアルタイムモニタニングを可能にしないことを示す。これら機器におけるSVV推定におけるこのノイズ問題の主要な理由は、SVが算出される方法である。例えば、上記PiCCOシステムは、重拍脈ノッチのような、血圧波形における特定点の決定を含む脈拍輪郭アルゴリズムに基づく拍動から拍動への一回拍出量推定法を用いる。血圧信号中の重拍脈ノッチおよびその他の点の正確な検出は、しかし、血圧波形およびその不安定な性質の不定に起因して困難である。
従って、必要なのは、せいぜい最小侵襲的技法を用い、現在可能なよりも、より正確にかつ頑健にリアルタイムでSVVを推定するための操作のシステムおよび方法である。本発明は、この必要性に合致する。 Therefore, what is needed is an operational system and method for estimating SVV in real time using, at best, minimally invasive techniques and more accurately and robustly than is currently possible. The present invention meets this need.
(発明の要旨)
本発明は、心臓一回拍出量分散(SVV)に等しいか、または誘導可能な心臓パラメーターを決定するための方法および関連システム履行を提供し:侵襲的または非侵襲的のいずれかで決定される、動脈血圧に対応する波形データセットが、決定され、そして少なくとも2つの心臓周期を含む算出間隔に亘り処理システムに入力され;この波形データのセットに対する標準偏差値が次いで各心臓周期に亘って算出され;そして上記SVVの推定値がこの標準偏差値の関数として算出される。
(Summary of the Invention)
The present invention provides a method and associated system implementation for determining cardiac parameters that are equal to or can be induced by cardiac stroke variance (SVV): determined either invasively or non-invasively. A waveform data set corresponding to the arterial blood pressure is determined and input to the processing system over a calculation interval including at least two cardiac cycles; a standard deviation value for the waveform data set is then passed over each cardiac cycle. And an estimate of the SVV is calculated as a function of this standard deviation value.
異なる方法が、このSVV推定で用いられる値を算出するために用いられ得る。例えば、上記算出間隔に亘る最大標準偏差値および最小標準偏差値が決定され得、そして上記SVVの推定値が次いでこの最大標準偏差値および最小標準偏差値の関数として算出され得る。平均標準偏差値がまた、好ましくは、上記算出間隔に亘って算出され、そして上記SVVの推定値が次いで上記平均標準偏差値に対する最大標準偏差値と最小標準偏差値との間の差異に比例して算出され得る。1つの代替物として、上記処理システムは、上記算出間隔に亘る上記標準偏差値の標準偏差を算出し得、そして次にこの標準偏差値の標準偏差と、標準偏差値の平均との間の比に比例するとして上記SVVを推定する。 Different methods can be used to calculate the values used in this SVV estimation. For example, a maximum standard deviation value and a minimum standard deviation value over the calculation interval can be determined, and an estimate of the SVV can then be calculated as a function of the maximum standard deviation value and the minimum standard deviation value. An average standard deviation value is also preferably calculated over the calculation interval, and the SVV estimate is then proportional to the difference between the maximum standard deviation value and the minimum standard deviation value relative to the average standard deviation value. Can be calculated. As an alternative, the processing system may calculate the standard deviation of the standard deviation value over the calculation interval, and then the ratio between the standard deviation of the standard deviation value and the average of the standard deviation values. The SVV is estimated as being proportional to.
血圧は、侵襲的または非侵襲的いずれかで、例えば、カテーテルに取り付けられた圧力トランスデューサまたは指カフを用いることにより測定され得る。この測定された動脈圧は、次いで、波形データセットに変換される。 Blood pressure can be measured either invasively or non-invasively, for example by using a pressure transducer or finger cuff attached to the catheter. This measured arterial pressure is then converted into a waveform data set.
本発明者らは、本発明による上記に記載の方法がまた、上記心臓一回拍出量分散の算出された推定値に反比例する、右心室端部拡張期容量の推定値を算出するために用いられ得ることを見出した。 In order to calculate an estimate of right ventricular end diastolic volume, the method described above according to the invention is also inversely proportional to the calculated estimate of the cardiac stroke volume variance. It has been found that it can be used.
有利であることが見出された本発明の1つの特徴によれば、少なくとも1つの算出間隔に亘って所定の測定基準に従って、上記算出された標準偏差値に最良に一致する近似関数が算出される。この近似関数は、次いで、間隔特異的なサンプリング速度でサンプリングされ、サンプリングされた近似値のセットを生成し、これは、次いで、それから上記SVVの推定値が算出される前にローパスフィルタ処理される。 According to one feature of the invention found to be advantageous, an approximation function that best matches the calculated standard deviation value is calculated according to a predetermined metric over at least one calculation interval. The This approximation function is then sampled at an interval-specific sampling rate to produce a set of sampled approximations, which are then low pass filtered before the SVV estimate is calculated. .
調節可能な速度で近似し、再サンプリングし、およびローパスフィルタ処理するこの方法は、SVV以外のその他の心臓または血行力学パラメーター、例えば、収縮期圧力分散、脈拍圧力分散などを推定することにおける使用にために拡張され得る。この場合、波形データセットが生成され、そして処理システムに入力され、いかなる測定パラメーターが選択されようとも対応する。一連の測定値が、次いで、この波形データセットから生成され;所定の計測基準に従って、これら測定値に最良に一致する近似関数(またはその特定の関数)が算出され;少なくとも1つの算出間隔の各々に亘り、サンプリングされた近似値のセットが、次いで、この近似関数を間隔特異的なサンプリング速度でサンプリングすることにより生成され;このサンプリングされた近似値は、次いで、ローパスフィルタ処理され;そして拍出量の推定値が、低パス処理され、サンプリングされた近似値の関数として算出される。 This method of approximating, resampling, and low-pass filtering at an adjustable rate is suitable for use in estimating other cardiac or hemodynamic parameters other than SVV, such as systolic pressure variance, pulse pressure variance, etc. Can be extended for. In this case, a waveform data set is generated and input to the processing system, corresponding to whatever measurement parameter is selected. A series of measurements is then generated from the waveform data set; an approximate function (or a specific function thereof) that best matches these measurements is calculated according to a predetermined metric; each of at least one calculation interval A set of sampled approximations is then generated by sampling the approximation function at interval-specific sampling rates; the sampled approximations are then low-pass filtered ; and An estimate of the quantity is low pass processed and calculated as a function of the sampled approximation.
(詳細な説明)
(序論)
最も広い意味で、本発明は、複数の心臓周期に亘る血圧波形の標準偏差の関数として脈拍から脈拍の一回拍出量分散SVVを含む。勿論、本発明は、SVVから派生し得る任意のその他の心臓パラメーターを決定するために用いられ得る。
(Detailed explanation)
(Introduction)
In its broadest sense, the present invention includes the pulse-to-pulse stroke volume variance SVV as a function of the standard deviation of the blood pressure waveform over multiple cardiac cycles. Of course, the present invention can be used to determine any other cardiac parameters that can be derived from SVV.
本発明は、ヒトまたは動物にかかわらず、任意のタイプの被験体とともに有利に用いられ得る。本発明の最も一般的使用は、診断設定におけるヒトに対してであることが予期されるので、本発明は、「患者」との使用において以下に主に説明される。しかしこれは、例示のみにより、−−用語「患者」は、設定にかかわらず、ヒトおよび動物両方のすべての被験体を包含すべきことが意図される。 The present invention can be advantageously used with any type of subject, whether human or animal. Since the most common use of the present invention is expected to be for humans in a diagnostic setting, the present invention is primarily described below in use with “patients”. However, this is by way of example only—the term “patient” is intended to encompass all human and animal subjects, regardless of setting.
その臨床的重要性のため、本発明の大部分の履行は、全身の動脈血圧の測定に基づくSVV推定値を生成することが予期される。しかし、右側の肺動脈におけるような、いずれの場所でとられる血圧(このような部位は、侵襲的心臓内測定必要とし得るけれども)の測定値を用いることも可能であり得る。 Because of its clinical importance, most implementations of the present invention are expected to generate SVV estimates based on measurements of systemic arterial blood pressure. However, it may be possible to use measurements of blood pressure taken anywhere, such as in the right pulmonary artery (although such sites may require invasive intracardiac measurements).
(圧力波形)
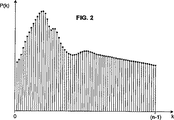
図1は、ここでは、時間tdia0における拡張期圧力Pdiaの点から、収縮期圧力Psys圧力の時間tsysを通り、血圧がもう一度Pdiaに到達する時間tdia1までの単一の心臓周期に亘ってとられた動脈圧の波形P(t)の例を示す。
(Pressure waveform)
FIG. 1 shows here a single heart from the point of diastolic pressure P dia at time t dia0 through time t sys of systolic pressure P sys pressure until time t dia1 when blood pressure once again reaches P dia. An example of an arterial pressure waveform P (t) taken over a period is shown.
本発明によれば、P(t)、またはP(t)に比例する任意の信号は、動脈樹における任意の点で侵襲的または非侵襲的に測定され得る。侵襲的機器、特にカテーテルに取り付けられた圧力トランスデューサが用いられるならば、任意の動脈が測定点として用いられ得る。非侵襲的トランスデューサの配置は、代表的には、機器それ自身によって指示される−指カフ、上腕圧力カフ、および耳たぶクランプの配置は明らかである。機器にかかわらず、最終的には、P(t)に対応(例えば、比例)する電気信号が生成されるか、または生成するようにされる。 According to the present invention, P (t), or any signal proportional to P (t), can be measured invasively or non-invasively at any point in the arterial tree. If an invasive device, in particular a pressure transducer attached to a catheter, is used, any artery can be used as a measurement point. Non-invasive transducer placement is typically dictated by the instrument itself—finger cuff, brachial pressure cuff, and earlobe clamp placement is obvious. Regardless of the device, ultimately, an electrical signal corresponding to (eg, proportional to) P (t) is generated or is generated.
動脈血圧を直接測定するよりむしろ、血圧に比例している任意のその他の入力信号が用いられ得る。任意の必要なスケーリングまたは変換が、次いで、以下に説明される算出におけるいくつかの点の任意またはすべてで行われ得る。例えば、動脈血圧自身以外の特定の信号が入力として用いられるならば、その値が以下に説明される算出で用いられ前に、それは血圧に対して較正され得る。要するに、本発明が、いくつかの場合には、動脈血圧の直接測定とは異なる入力信号を用い得るという事実は、正確なSVV推定値を生成するその能力を制限しない。本発明に唯一必要なのは、目的の間隔(連続的を含む)に亘る患者の血圧に等しいか、または(比例しているような)少なくとも既知の関係を有する信号またはデータセットが、以下に説明される信号条件づけおよび種々の算出を実施する処理システム(以下を参照のこと)に利用可能にされなければならないということである。 Rather than directly measuring arterial blood pressure, any other input signal that is proportional to blood pressure can be used. Any necessary scaling or transformation may then be performed at any or all of several points in the calculations described below. For example, if a particular signal other than the arterial blood pressure itself is used as input, it can be calibrated to blood pressure before that value is used in the calculations described below. In short, the fact that the present invention may use an input signal different from direct measurement of arterial blood pressure in some cases does not limit its ability to generate accurate SVV estimates. The only requirement for the present invention is that a signal or data set having a known relationship equal to (or proportional to) the patient's blood pressure over the interval of interest (including continuous) is described below. This means that it must be made available to processing systems (see below) that perform signal conditioning and various calculations.
周知であるように、そして図2に示されるように、P(t)のようなアナログ信号は、任意の標準的なアナログ−デジタルコンバーター(ADC)を用いてデジタル値のシークエンスにデジタル化され得る。換言すれば、P(t)、t0≦t≦tfは、公知の方法および回路を用いて、デジタル形態P(k)、k=0、n−1、ここでt0およびtfは、それぞれ、算出間隔の初期時間および最終時間であり、そしてnは、通常、算出間隔に亘って均一に分布された、算出に含められ得るP(t)のサンプルの数である。 As is well known and as shown in FIG. 2, an analog signal such as P (t) can be digitized into a sequence of digital values using any standard analog-to-digital converter (ADC). . In other words, P (t), t0 ≦ t ≦ tf are calculated using known methods and circuits, digital form P (k), k = 0, n−1, where t0 and tf are respectively calculated. The initial and final time of the interval, and n is the number of samples of P (t) that can be included in the calculation, usually distributed uniformly over the calculation interval.
(標準偏差)
連続的または別個の関数またはデータセットfの平均および標準偏差の算出は、非常に周知な手順であり、そして、通常、それぞれギリシャ文字μおよびσによって、または、大部分のプログラミング言語では、meanおよびstdのような関数名によって参照されて示される。従って、μ(f)およびmean(f)は、特定の間隔に亘る関数またはデータセットfの平均を表し、そしてσ(f)およびstd(f)は、その標準偏差を表す。
(standard deviation)
The calculation of the mean and standard deviation of a continuous or separate function or data set f is a very well-known procedure, and usually by the Greek letters μ and σ, respectively, or in most programming languages, mean and It is referred to by a function name such as std. Thus, μ (f) and mean (f) represent the average of a function or data set f over a particular interval, and σ (f) and std (f) represent its standard deviation.
ここで、k=1、・・・、nのような特定の間隔に亘る一連の血圧値P=P(k)の平均および標準偏差の算出を考える。平均μ(P)および標準偏差σ(P)を算出するための最も一般的な方法は、統計学の入門コースさえ知っているすべての者が知っているアルゴリズムを用いることであり:
μ(P)=mean(P)=1/m*SUM[P(k)]
(等式4)
σ(P)=std(P)=sqrt{1/(m−1)*SUM[P(i)−μ(P)]2}
(等式5)
ここで、sqrtは平方根を示し、そしてSUMは、i=0、・・・、(m−1)の間隔に亘る総和を示す。通常、周知の統計学的理由のため、1/mの代わりに1/(m−1)の倍率をかける分散(標準偏差の平方)に対する別個の値式に注意のこと。
Consider the calculation of the mean and standard deviation of a series of blood pressure values P = P (k) over a specific interval such as k = 1,..., N. The most common way to calculate the mean μ (P) and standard deviation σ (P) is to use an algorithm known to everyone who knows even an introductory course in statistics:
μ (P) = mean (P) = 1 / m * SUM [P (k)]
(Equation 4)
σ (P) = std (P) = sqrt {1 / (m−1) * SUM [P (i) −μ (P)] 2 }
(Equation 5)
Here, sqrt represents the square root, and SUM represents the sum over the interval of i = 0,..., (M−1). Note the separate value formula for the variance (square of the standard deviation), which is usually multiplied by a factor of 1 / (m-1) instead of 1 / m for well-known statistical reasons.
以下からより明瞭になるように、本発明は、好ましくはいくつかの心臓周期に亘る圧力波形の標準偏差の算出から、リアルタイムでSVVの頑健な推定値を生成する。標準偏差の標準的な「教科書」の式(等式5)が周知の統計学的理由のために好ましいが、標準偏差の受容可能に正確な値、またはそれに対応する値を提供する任意の式またはアルゴリズムがその代わりに本発明では用いられ得る。例えば、少なくとも血圧に基づく測定の文脈では、σ(P)に対する粗い近似は、最大測定圧力値と最小測定圧力値との差異を3で割ることにより算出され得る。さらに、時間に対するP(t)の一次微分の最大値、または最小値の絶対値は、σ(P)にほぼ比例する。 As will become clearer from the following, the present invention generates a robust estimate of SVV in real time, preferably from the calculation of the standard deviation of the pressure waveform over several cardiac cycles. The standard "textbook" formula for standard deviation (Equation 5) is preferred for well-known statistical reasons, but any formula that provides an acceptable accurate value for standard deviation, or a corresponding value. Alternatively, an algorithm can be used in the present invention instead. For example, at least in the context of measurement based on blood pressure, a rough approximation to σ (P) can be calculated by dividing the difference between the maximum and minimum measured pressure values by three. Furthermore, the absolute value of the maximum or minimum value of the first derivative of P (t) with respect to time is substantially proportional to σ (P).
本発明のこの論議では、「圧力」値および「標準偏差」値を用いる算出へのいくつかの参照がある。本発明の好ましい実施形態では、これらは、実際、血圧、特に動脈血圧の直接測定、および、等式5として上記で与えられた最も一般的な式を用いて算出されるような標準偏差である。しかし、「圧力」は、間接的測定値、または圧力に相関または対応またはそうでなければ関連し得る特定の生理学的特徴の測定値に等しく言及し得ることが理解されるべきである。同様に、「標準偏差」はまた、通常の式によって与えられ得るこの値に近似することが知られる任意の値に言及し得る;このような代替物の例は、先の段落に与えられている。 In this discussion of the invention, there are several references to calculations using “pressure” and “standard deviation” values. In the preferred embodiment of the present invention, these are in fact standard deviations as calculated using the direct measurement of blood pressure, in particular arterial blood pressure, and the most general formula given above as equation 5. . However, it should be understood that “pressure” may equally refer to indirect measurements, or measurements of specific physiological characteristics that may be correlated or corresponding to or otherwise related to pressure. Similarly, “standard deviation” can also refer to any value known to approximate this value that can be given by the usual formula; examples of such alternatives are given in the previous paragraph. Yes.
(SVV算出)
心臓拍出量(CO)を算出するための標準的な式は、CO=SV・HRであり、これは、単に、心臓が1分あたりポンプ輸送する血液の量が、それが1周期あたりポンプ輸送する量(SV)に1分間の周期の数を乗じたものに等しいという関係を表しているに過ぎない。HRが与えられれば、問題は、勿論、一定値のSV、または平均SVの知識を想定していることである。圧力波形の拍動性が動脈樹中への心臓の一回拍出量によって生成されるという観察に基づけば、本発明者らの一人は、先に、SVが、動脈圧波形P(t)、またはそれ自身がP(t)に比例している特定のその他の信号の標準偏差に比例しているとして近似され得ることを発見した。従って、SVを推定する1つの方法は、以下の関係を適用することであり
SV=K・σ(P)=K・std(P)
(等式6)
ここで、Kは較正定数であって、そしてこれから、以下が導かれる:
CO=K・σ(P)・HR=K・std(P)・HR
(等式7)
式6を式3に代入して、std(P)の関数であるSVVのための式が得られる:
SVV=100・[std(P)max−std(P)min]/[1/2(std(P)max+std(P)min)]
(等式8)
ここで、std(P)maxおよびstd(P)minは、それぞれ、算出間隔に亘る圧力波形の標準偏差の最大値および最小値である。本発明の好ましい実施形態では、この算出間隔は呼吸サイクルである。
(SVV calculation)
The standard formula for calculating cardiac output (CO) is CO = SV · HR, which is simply the amount of blood that the heart pumps per minute, which is pumped per cycle. It merely represents a relationship that is equal to the amount transported (SV) multiplied by the number of cycles per minute. Given HR, the problem is, of course, assuming knowledge of a constant value SV or average SV. Based on the observation that the pulsatile nature of the pressure waveform is generated by the stroke volume of the heart into the arterial tree, one of the inventors has previously stated that SV is the arterial pressure waveform P (t). Or it can be approximated as being proportional to the standard deviation of certain other signals that are themselves proportional to P (t). Therefore, one way to estimate SV is to apply the following relationship: SV = K · σ (P) = K · std (P)
(Equation 6)
Where K is a calibration constant and from this the following is derived:
CO = K.sigma (P) .HR = K.std (P) .HR
(Equation 7)
Substituting Equation 6 into Equation 3 yields an equation for SVV that is a function of std (P):
SVV = 100 · [std (P) max−std (P) min] / [1/2 (std (P) max + std (P) min)]
(Equation 8)
Here, std (P) max and std (P) min are the maximum value and the minimum value of the standard deviation of the pressure waveform over the calculation interval, respectively. In a preferred embodiment of the invention, this calculation interval is a respiratory cycle.
上記で述べたように、測定間隔に亘る分母で圧力−mean(P)の統計学的平均を用いることは、一般に、最大値および最小値のみの平均を用いることより正確かつ頑健な推定値を提供するが、本発明は、この分母にいずれの平均をも用い得る。従って、式8の好ましい形態は:
SVV=100・[std(P)max−std(P)min]/mean(std(P))
(等式9)であり、ここで、mean(std(P))は、圧力波形それ自身の平均μ(P)ではなく、圧力波形の標準偏差の平均であるが、このパラメーターは、任意のstd(P)値の算出に含められ得る。また、測定された圧力信号P(t)を条件付けるため、そして次にそれを別個の形態に変換するために用いられる信号条件付け、および変換方法のタイプに依存して(以下を参照のこと)、等式9に倍率をかけることが必要であり得るか、または所望され得る。倍率をかけるか否か、およびそれをどのようにするかは当業者のシステム設計者には自明であり:その理由のため、任意の倍率因子は等式9には示されないが、推定され得る。
As noted above, using a statistical mean of pressure-mean (P) in the denominator over the measurement interval generally provides a more accurate and robust estimate than using the average of only the maximum and minimum values. Although provided, the present invention may use any average for this denominator. Thus, the preferred form of Formula 8 is:
SVV = 100 · [std (P) max−std (P) min] / mean (std (P))
Where mean (std (P)) is not the mean μ (P) of the pressure waveform itself, but the mean of the standard deviation of the pressure waveform, but this parameter is arbitrary It can be included in the calculation of the std (P) value. Also, depending on the type of signal conditioning and conversion method used to condition the measured pressure signal P (t) and then convert it to a separate form (see below) , It may be necessary or desirable to scale equation 9. Whether or not to multiply and how to do it is obvious to those skilled in the art: for that reason, any scaling factor is not shown in Equation 9 but can be estimated .
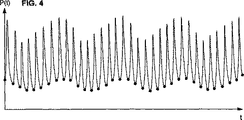
図3は、ほぼ3つの呼吸サイクルに亘って測定され、またはそうでなければ獲得された動脈圧波形のシークエンスを示す。実際、このシークエンスは、動脈圧P(t)のサンプリングされた測定から由来するデータセットP(k)である。上記で述べたように、このP(k)値は、直接に、侵襲的または非侵襲的測定により得られ得るか、または遠隔モニターまたは予め記録されたデータセットからでさえ(この後者の可能性は、勿論、リアルタイムニモタリングは提供せず、そして大部分の場合、主に、比較または実験が請われ得る)、特定のその他の供給源からの入力であり得る。 FIG. 3 shows a sequence of arterial pressure waveforms measured or otherwise acquired over approximately three respiratory cycles. In fact, this sequence is a data set P (k) derived from a sampled measurement of arterial pressure P (t). As mentioned above, this P (k) value can be obtained directly by invasive or non-invasive measurements, or even from a remote monitor or pre-recorded data set (possibility of this latter Of course, it does not provide real-time mottling and, in most cases, may be primarily input from certain other sources, which may be subject to comparison or experimentation).
図4には、図3の波形に点が含められ、示される算出間隔に亘る各心臓周期(すなわち、各「拍動」)の開始を示す。各心臓周期の開始は、心拍数モニターであるか、またはそれを含む任意の公知のシステムを用いる任意の数の公知の方法で決定され得る。例えば、よくあることであるが、患者の心臓の電気的活動度はまた、心電図システム(EKG)によってモニターされている場合、各心臓手記の開始は、各R波の直後のサンプリングされた圧力値で生じると決定され得る。圧力を基にした脈拍数モニターがまた用いられ得、そして実際好ましい。なぜなら、それらは、次に、例えば、EKG信号より、血圧信号とより良好に同調され得るからである。 FIG. 4 includes points in the waveform of FIG. 3 to indicate the start of each cardiac cycle (ie, each “beat”) over the indicated calculation interval. The start of each cardiac cycle can be determined in any number of known ways using any known system that is or includes a heart rate monitor. For example, as is often the case, when the electrical activity of a patient's heart is also monitored by an electrocardiogram system (EKG), the start of each heart note is a sampled pressure value immediately after each R wave. Can occur. A pressure-based pulse rate monitor can also be used and is preferred in practice. Because they can then be better tuned with the blood pressure signal than, for example, the EKG signal.
そのような外部デバイスが存在しないならば、各心臓周期の開始はまた、例えば、各拍動は、単に、最小(拡張期)圧力Pdia(図1を参照のこと)の時間で開始すると仮定することにより、またはフーリエ変換もしくは微分分析を用いることにより、圧力波形P(k)自身からソフトウェア単独を用いて決定され得る。これらの場合には、心拍数「モニター」は、ソフトウェア構築物である。このような場合には、公知に技法を用いて、局所的圧力最小は、呼吸自身によって引き起こされず、実際に拡張期時間であることを確実にすることに注意を払うべきである。 If no such external device is present, the start of each cardiac cycle is also assumed, for example, that each beat simply starts at the time of minimum (diastolic) pressure P dia (see FIG. 1). Or by using the Fourier transform or differential analysis from the pressure waveform P (k) itself using software alone. In these cases, the heart rate “monitor” is a software construct. In such cases, using known techniques, care should be taken to ensure that the local pressure minimum is not caused by breathing itself, but is actually a diastolic time.
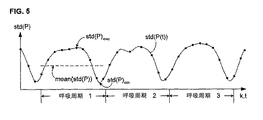
P(k、i)を、算出間隔中で第i番目の拍動−拍動動脈圧信号とする。標準偏差std(P(k、i))が、次いで、上記に記載のように算出され得、そして信号値(スカララー)結果を得る。上記算出間隔中の拍動−拍動動脈圧信号の各々に対する標準偏差値が同様に算出され得る。図5では、標準偏差曲線std(P(t))上の各点は、1つの拍動−拍動動脈圧信号に対する算出された標準偏差値を示す。 Let P (k, i) be the i-th beat-beat arterial pressure signal in the calculation interval. A standard deviation std (P (k, i)) can then be calculated as described above and a signal value (scalar) result is obtained. The standard deviation value for each of the pulsation-pulsatile arterial pressure signals during the calculation interval can be similarly calculated. In FIG. 5, each point on the standard deviation curve std (P (t)) indicates a calculated standard deviation value for one pulsation-pulsation arterial pressure signal.
等式9に従うSVVの算出は、各算出間隔について、std(P(k、i))の最大値、最小値および平均値を必要とする。所定の呼吸周期(図5には、ほぼ3つの呼吸周期が示されている)についてstd(P)maxおよびstd(P)minを得る1つの方法は、単に、この周期中で最大および最小の別個のstd(P(k、i))値をとることである。これらは、これら算出された値を単に走査することにより迅速に識別され得る。 Calculation of SVV according to Equation 9 requires the maximum, minimum and average values of std (P (k, i)) for each calculation interval. One way to obtain std (P) max and std (P) min for a given breathing cycle (FIG. 5 shows approximately three breathing cycles) is simply the maximum and minimum in this cycle. Taking a separate std (P (k, i)) value. These can be quickly identified by simply scanning these calculated values.
実際のモニタリングの間に、ノイズおよびその他の因子は、1つ以上のstd(P(k、i))値の信頼性を損なう。逸脱値および潜在的に信頼性のないstd(P(k、i))値は、パターンマッチングに基づくような公知のアルゴリズムを用いて検出され得る。次いで、内挿を用いて、この排除された値(単数または複数)について置換値を決定し得る。SVV以外のその他の心臓パラメーターおよび血行力学パラメーターの決定においてさえ適用可能な、信頼性を増加するために測定された値を平滑およびフィルター処理するための好ましい方法は以下に説明される。 During actual monitoring, noise and other factors impair the reliability of one or more std (P (k, i)) values. Deviance values and potentially unreliable std (P (k, i)) values can be detected using known algorithms such as those based on pattern matching. Interpolation may then be used to determine a replacement value for this excluded value (s). A preferred method for smoothing and filtering measured values to increase reliability, applicable even in the determination of other cardiac and hemodynamic parameters other than SVV, is described below.
任意の標準的なアルゴリズムを用いて、std(P(k、i))からstd(P)maxおよびstd(P)minを識別し得る。最も単純な方法は、最も大きい値、および最も小さな値をとることである。あるいは、これら測定されたstd(P(k、i))点は、近似または平滑化関数を決定するための基礎として用いられ得(例えば、スプライン関数または多項式を用いて);これは、多くの場合において、図5に示されるstd(P)minのような、算出値間にあるstd(P(t))の極値の識別を可能にする。これら値のmean(std(P(k、i))=mean(std(P))は、標準的な統計学的式を用いて算出され得る(等式4を参照のこと)。図5はまた、第1の呼吸周期についてmean(std(P))の値を示す。一旦、std(P)maxおよびstd(P)minが所定の呼吸周期について決定されると、次いで、その呼吸周期に対するSVV値が、式8または式9のいずれかに従って容易に算出され得る。mean(std(P(k)))がまた算出される好ましい事例を仮定すると、式9を用いてより正確および頑健なSVVが算出され得る。SVVの算出された値(単数または複数)は、次いで、使用者のために表示され、記憶され、伝達され、そして/または任意の所望の方法でさらなる算出において用いられ得る。 Any standard algorithm can be used to distinguish std (P) max and std (P) min from std (P (k, i)). The simplest method is to take the largest value and the smallest value. Alternatively, these measured std (P (k, i)) points can be used as a basis for determining an approximation or smoothing function (eg, using a spline function or polynomial); In some cases, extreme values of std (P (t)) between calculated values, such as std (P) min shown in FIG. 5, can be identified. The mean (std (P (k, i)) = mean (std (P)) of these values can be calculated using standard statistical equations (see equation 4). It also shows the value of mean (std (P)) for the first respiratory cycle, once std (P) max and std (P) min are determined for a given respiratory cycle, then for that respiratory cycle SVV values can be easily calculated according to either Equation 8 or Equation 9. Assuming the preferred case where mean (std (P (k))) is also calculated, using Equation 9 is more accurate and robust SVV can be calculated, and the calculated value (s) of SVV can then be displayed, stored, communicated and / or used in further calculations in any desired manner for the user. .
上記で述べたように、好ましい算出間隔は1つの呼吸周期である。これら周期の開始時間および終了時間は、任意の公知のデバイスを用いて検出され得る。本発明を必要とし得る多くの患者はまた人工呼吸され得、その場合には、この人工呼吸器自体が、異なる呼吸周期を分離するために本発明に必要なタイミング信号を提供し得ることに注目のこと。 As stated above, the preferred calculation interval is one respiratory cycle. The start time and end time of these cycles can be detected using any known device. Note that many patients who may need the present invention can also be ventilated, in which case the ventilator itself can provide the timing signals necessary for the present invention to separate different respiratory cycles. That.
しかし、図3および4に示されるように、獲得された圧力波形それ自身のスートを分析することにより呼吸周期の境界を検出することもまた可能であり得:最も少ない拡張期圧力(圧力波形の「エンベロープ」の局所的最小値)の時間はまた、通常、呼吸周期の開始の印である。いくつかの状況では、しかし、このようなソフトウェアを基礎にした検出方法は、特に患者の呼吸が弱い場合、呼吸モニタリングを特に含む別のシステムからの信号を単に受容するより正確ではないかも知れない。 However, as shown in FIGS. 3 and 4, it may also be possible to detect respiratory cycle boundaries by analyzing the soot of the acquired pressure waveform itself: the least diastolic pressure (pressure waveform The “environment” local minimum) time is also usually a sign of the start of the respiratory cycle. In some situations, however, such software-based detection methods may not be more accurate than simply accepting signals from another system, especially including respiratory monitoring, especially if the patient's breathing is weak .
(算出間隔−代替のSVV算出)
上記では、SVV値が各呼吸周期について推定されると仮定した。これは必ずしも必要ではない。むしろ、1つの呼吸周期より大きい算出間隔に亘って(モニタリングセッションの全体時間に亘ってでさえ)、単一のSVV値を算出するために、上記に記載された同じ方法論および等式を用いることが可能であり得る。これは、勿論、周期−周期SVV傾向を示さないが、各モニタリングセッションについてより正確な結果、そしてそれ故、より長い期間(セッション−セッションまたは日−日のような)の傾向のより良好な指標を提供し得る。しかし、常に、「極度」の間隔に亘って算出することは必要ではない。むしろ、SVV値は、1(上記に記載された場合)から上方の範囲にわたるnで任意のn周期時間について算出され得る。
(Calculation interval-Alternative SVV calculation)
In the above, it was assumed that the SVV value was estimated for each respiratory cycle. This is not always necessary. Rather, using the same methodology and equations described above to calculate a single SVV value over a calculation interval greater than one respiratory cycle (even over the entire time of the monitoring session). May be possible. This, of course, does not show a period-period SVV trend, but a more accurate result for each monitoring session, and therefore a better indicator of the trend for longer periods (such as session-session or day-day) Can provide. However, it is not always necessary to calculate over "extreme" intervals. Rather, the SVV value can be calculated for any n period time with n ranging from 1 (as described above) to the upper range.
例えば、算出時間が1つの呼吸周期より大きいと仮定する。例示のために、図5に示される3つすべての呼吸周期が、単一の組み合わされた算出間隔を構成すると仮定する。この場合でさえ、算出されたstd(P(k))値(曲線上の「点」)のセットstd(P(k、i))、実際は、なお多い値が存在する。これらの標準偏差値は、それら自身標準偏差および平均(極値間の中央点)を有している。1つより多い呼吸周期に亘る算出間隔のために有用な本発明の代替の実施形態によれば、SVVは、従って、以下のように推定される:
SVV=C・100・std(std(P(k、i))/mean(std(P(k、i)) (等式10)
ここで、Cは、実験的に決定されたスケーリング定数である。本発明の1つの試験では、本発明者らは、この算出間隔に含まれる呼吸周期の数にかかわらず、Cが約2.7であることを決定した;通常の実験方法を用いて、本発明の任意の所定の履行においてCを決定し得る。
For example, assume that the calculation time is greater than one respiratory cycle. For purposes of illustration, assume that all three respiratory cycles shown in FIG. 5 constitute a single combined calculation interval. Even in this case, a set std (P (k, i)) of calculated std (P (k)) values (“points” on the curve), in fact, there are still many values. These standard deviation values have their own standard deviation and average (the center point between extreme values). According to an alternative embodiment of the invention, useful for calculation intervals over more than one respiratory cycle, SVV is therefore estimated as follows:
SVV = C · 100 · std (std (P (k, i)) / mean (std (P (k, i)) (Equation 10)
Here, C is a scaling constant determined experimentally. In one test of the present invention, the inventors determined that C was approximately 2.7, regardless of the number of respiratory cycles included in this calculation interval; C may be determined at any given implementation of the invention.
この代替の複数周期の方法は、任意のstd(P)max値またはstd(P)min値を決定するためのシステムを必要としない。結果として、算出間隔に亘ってstd(P(k))値の内挿する近似関数を決定することは、なお有利ではない。 This alternative multi-period method does not require a system to determine any std (P) max value or std (P) min value. As a result, it is still not advantageous to determine an approximation function that interpolates std (P (k)) values over the calculation interval.
(必要に応じた平滑化、再サンプリングおよびフィルター処理)
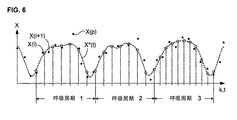
図6を参照して、そこでは、心臓または血行力学値Xの測定値X(k)のシークエンスが点としてプロットされている。上記に記載の本発明の実施形態では、X(k)は、std(P(k))で、心臓周期あたり1つの測定値である。しかし、ここで説明される必要に応じたデジタル前処理はまた、収縮期圧力または拍動圧のような任意のその他の心臓または血行力学値、またはドップラー超音波走査から得られる血液速度測定のような非圧力関連パラメーターにさえに適用可能である。
(Smoothing, resampling and filtering as needed)
Referring to FIG. 6, where the sequence of measurements X (k) of heart or hemodynamic value X is plotted as a point. In the embodiment of the invention described above, X (k) is std (P (k)), one measurement per cardiac cycle. However, the optional digital preprocessing described here can also be any other cardiac or hemodynamic value such as systolic pressure or pulsatile pressure, or blood velocity measurements obtained from Doppler ultrasound scans. Applicable to even non-pressure related parameters.
これら測定値は、良好に規定されたプロフィールにきちんと納まることはほとんどない。なぜなら、基礎となるパラメーターは、ノイズのみならず、一定でない心拍数、異なる呼吸パターンなどのような元来の不規則性によって影響されるからである。多くの場合、この測定システムは、それ自身、信頼性のない測定値を警告、識別および排除可能であり得る。例えば、信号強度が所定の最小値未満に低下するならば、このような時間の間に測定されたパラメーターの値は、タグを付けられるか、または排除され得る。その他の場合には、信頼性のない値は、さらなる分析なしに検出不能であり得る。図6では、例えば、X(p)とマークされた測定点は、それは合理的に信頼性がないと推定され得る、明らかなパターンからかなり逸脱している。 These measurements rarely fit into a well-defined profile. This is because the underlying parameters are influenced not only by noise, but also by inherent irregularities such as non-constant heart rate, different breathing patterns, etc. In many cases, the measurement system may itself be able to alert, identify and eliminate unreliable measurements. For example, if the signal strength falls below a predetermined minimum value, the value of the parameter measured during such a time can be tagged or eliminated. In other cases, unreliable values may not be detectable without further analysis. In FIG. 6, for example, a measurement point marked X (p) deviates significantly from an obvious pattern that can be assumed to be reasonably unreliable.
上記のように、逸脱した値を識別する1つの方法は、測定された点が、患者集団について実施されたコントロール研究、または同じ患者で測定された単に確認されたプロフィールから得られた、1つ以上の予め記憶されたテンプレートと比較されるパターン一致を用いることによる。任意の公知の様式で測定された、このテンプレート(単数または複数)から、特定の閾値量だけ逸脱する任意の点は、次いで排除され得る。 As noted above, one method of identifying deviating values is one in which the measured points were obtained from a control study performed on a patient population, or simply a confirmed profile measured in the same patient. By using a pattern match compared with the previously stored template. Any point that deviates from this template (s), measured in any known manner, by a certain threshold amount can then be eliminated.
本発明の好ましい実施形態では、各算出間隔について、任意の公知の測定基準、すなわち、任意の公知の意味で、最小2乗などに従って、測定点に最良に一致する間隔プロフィールを生成するように、近似関数(これは、1つより多い部分関数の連結または組み合わせであり得る)が生成される。例えば、スプライン関数(2つの例:Bスプライン関数およびBezier曲線)、減少構成要素フーリエ表示などのような多項式関数が、迅速に算出され得て、適切な近似関数を生成する。図6では、第1の呼吸間隔に対する近似関数は標識されたX*(t)である。 In a preferred embodiment of the invention, for each calculated interval, according to any known metric, i.e., in any known sense, according to least squares, etc., to generate an interval profile that best matches the measurement point, An approximate function (which can be a concatenation or combination of more than one partial function) is generated. For example, polynomial functions such as spline functions (two examples: B-spline functions and Bezier curves), reduced component Fourier representations, etc. can be quickly calculated to generate a suitable approximation function. In FIG. 6, the approximate function for the first breath interval is labeled X * (t).
示された例では、算出間隔は呼吸周期である。その他の間隔が、目的のパラメーターに依存して選択され得、そして上記呼吸サイクルに関連する必要は全くない。それを行う場合でさえ、測定間隔が単一周期、または複数の単一周期の全体である必要はなく、これは、一般に、目的のパラメーターが呼吸によって影響される場合、大部分が意味あるものであるが、そしてまた一般に算出を単純にする。 In the example shown, the calculation interval is the respiratory cycle. Other intervals can be selected depending on the parameters of interest and need not be related to the respiratory cycle. Even when doing so, the measurement interval need not be a single period, or the whole of a plurality of single periods, which is generally meaningful if the parameters of interest are generally affected by respiration. But also generally simplify the calculation.
一旦、近似関数が算出されると、本発明の好ましい実施形態は、算出間隔あたりの値をローパスフィルタ処理する。デジタルローパスフィルタの理論および履行は周知である。サンプリングされた値のいくつかのセットが、入力として、それらの特定の重み付けされた線形または有理関数を算出するアルゴリズムに用いられ、変換されたフィルター処理された拍出量値のセットを生成する。代表的なデジタルフィルターは、一般に、サンプル間で一定の「距離」をとると仮定されるが、大部分のそのようなフィルターはまた、固定された係数を有する。 Once the approximate function is calculated, the preferred embodiment of the present invention low-pass filters the values per calculation interval. The theory and implementation of digital low-pass filters is well known. Several sets of sampled values are used as input to an algorithm that calculates their particular weighted linear or rational function to generate a set of transformed filtered stroke volume values. A typical digital filter is generally assumed to take a certain “distance” between samples, but most such filters also have a fixed coefficient.
しかし、本発明のこの局面によれば、このローパスフィルタへの入力値は、近似関数をサンプリングすることによって−おそらく(必ずしもそうではないが)実際の測定値が得られた速度よりなお高い速度で−得られる。図6では、これらサンプリング点は、近似曲線X*(t)上で白丸によって示されている。近似曲線X*(t)のサンプリング点は、次いで、デジタルローパスフィルタに入力され、このカットオフ周波数は、任意の公知の様式で選択され得、そして推定されるべき血行力学または心臓パラメーターの、および測定値X(k)の既知の性質に依存し得る。一旦、所望のカットオフ周波数が決定されるならば、適切なローパスフィルタの係数が任意の公知の様式で決定され得る。 However, according to this aspect of the present invention, the input value to this low pass filter can be obtained by sampling an approximate function-perhaps (although not necessarily) at a rate that is still higher than the rate at which the actual measurement was obtained. -Obtained. In FIG. 6, these sampling points are indicated by white circles on the approximate curve X * (t). The sampling points of the approximate curve X * (t) are then input into a digital low pass filter , which cut-off frequency can be selected in any known manner and of the hemodynamic or cardiac parameter to be estimated, and It may depend on the known nature of the measured value X (k). Once the desired cutoff frequency is determined, the appropriate low-pass filter coefficients can be determined in any known manner.
この手順は、たとえ、例えば、変化する心拍数のため、実際の測定された値が均一に間隔を置かれていないかも知れなくとも、これらサンプル点の均一なスペーシングを可能にすることに注目のこと。さらに、呼吸周期(ここでは、算出間隔として選択される)3に対するサンプリング速度は、周期1および2に対するそれより大きいことに留意すること。各所定の算出間隔に対するサンプリング速度を選択する1つの方法は、上記算出間隔に存在する実際の測定値と同じ数の近似曲線X*(t)の間隔を置いたサンプルを選択することである。これは必ずしも必要ではないが、むしろこのサンプリング速度は、例えば、Nyquist基準を満足するよう、所望のように選択され得、そして用いられるデジタルローパスフィルタのタイプについてエイリアジング効果を低減する。
Note that this procedure allows for uniform spacing of these sample points even though the actual measured values may not be evenly spaced, for example due to changing heart rate. That. Furthermore, note that the sampling rate for the respiratory cycle (here selected as the calculation interval) 3 is greater than that for
本発明者らによる試験は、(近似関数を経由する)平滑化、再サンプリング(すなわち、アナログ−デジタル変換のために実施されたサンプリング後にあるサンプリング)、および調節可能係数のローパスフィルタ処理のこれら工程が、本発明のノイズを拒否し、そしてより信頼性のあるSVV値を生成する能力を改善することを示した。上記で述べたように、この手順はまた、SVV以外のその他の推定されたパラメーターについて用いられ得る。 The tests by the inventors have shown that these steps of smoothing (via approximation functions), resampling (ie sampling after sampling performed for analog-to-digital conversion), and low-pass filtering of adjustable coefficients Have shown to reject the noise of the present invention and improve the ability to generate more reliable SVV values. As stated above, this procedure can also be used for other estimated parameters other than SVV.
(システム構成要素)
図7は、本発明に従って、圧力を感知し、そしてSVVを算出するための上記の方法を履行するシステムの主要な構成要素を示す。本発明は、現存する患者モニタリングデバイス内に含められ得るか、または専用のモニターとして履行され得る。上記に述べられたように、圧力、または圧力に比例する特定のその他の入力信号が、2つの方法:侵襲的および非侵襲的のいずれか、または、実際に、両方で感知され得る。単に、本発明の最も一般的な履行であることが予期されるので、このシステムは、圧力に転換される特定のその他の入力信号に対向して動脈血圧を測定するとして説明される。
(System components)
FIG. 7 shows the major components of a system that implements the above method for sensing pressure and calculating SVV in accordance with the present invention. The present invention can be included within existing patient monitoring devices or implemented as a dedicated monitor. As mentioned above, pressure, or certain other input signals proportional to pressure, can be sensed in two ways: either invasive and non-invasive, or indeed both. Simply because it is expected to be the most common implementation of the present invention, the system is described as measuring arterial blood pressure against a specific other input signal that is converted to pressure.
図7は、簡潔さのために両方のタイプの圧力感知を示し:本発明の大部分の実際の適用では、いずれか1つ、またはいくつかの改変例が代表的には履行される。本発明の侵襲的適用では、従来の圧力センサー100が、カテーテル110上に取り付けられ、これは、ヒトまたは動物患者の身体の部分130の動脈120中に挿入される。このような動脈は、上行大動脈、または肺動脈であり得るか、または、侵襲性のレベルを低減するために、この動脈120は、大腿動脈、橈骨動脈または上腕動脈のような末梢であり得る。本発明の非侵襲的適用では、光容積脈波血圧プローブのような、従来の圧力センサー200が、任意の従来様式、例えば、指230の周りのカフまたは患者の手首上に取り付けられたトランスデューサを用いて外部に取り付けられる。図3は、両方のタイプを概略的に示す。
FIG. 7 shows both types of pressure sensing for the sake of simplicity: In most practical applications of the present invention, any one or several modifications are typically implemented. In the invasive application of the present invention, a
センサー100、200からの信号は、任意の公知のコネクターを経由して、処理システム300への入力として通過され、このシステムは、1つ以上のプロセッサーおよびメモリ301のようなその他の支援ハードウェア、および通常信号を処理し、そしてコードを実行するシステムソフトウェア(図示せず)を含む。本発明は、改変された標準的なパーソナルコンピューターを用いて履行され得るか、またはそれは、より大きな専用のモニタリングシステム中に取り込まれ得る。本発明では、処理システム300はまた、必要に応じて、増幅、フィルター処理、レンジングなどのような通常の信号処理タスクを実施する条件付け回路302を含み得るか、またはそれに連結される。
Signals from
条件付けられ、感知された入力圧力信号P(t)は、次いで、従来のアナログ−デジタルコンバーターADC304によってデジタル形態に転換され、これは、クロック回路305を有するか、またはそれから時間参照をとる。良好に理解されるように、このADC304のサンプリング周波数は、圧力信号のエイリアジングを避けるように、Nyquist基準に対して選択されるべきであり;この手順は、デジタル信号処理の技術分野では非常に周知である。ADC304からの出力は、個別の圧力信号P(k)であり、その値は、従来のメモリ回路(図示せず)中に記憶され得る。
The conditioned and sensed input pressure signal P (t) is then converted to digital form by a conventional analog-to-
信号前処理モジュール306が、好ましくは、慣用的に含められ、運動アーチファクト拒絶、パルスビート検出(必要であれば)のため、悪い拍動の拒絶のため、など、全般的(間隔−間隔に対して)ノイズ除去のためのデジタルフィルター処理のような公知の前処理を提供する。このモジュールはまた、全体に、または部分的にハードウェアで実施され得る。上記で述べたように、公知の回路が含められ得、例えば、信号強度が低すぎ、しかも送達された測定値に信頼性がないことを示す。従って、このモジュール306はまた、このADC304の前で、機能的に、全体的または部分的に配置され得る。
A
値P(k)は、心臓周期のような算出間隔に亘りP(k)の標準偏差を算出するためのコンピューターが実行可能なコードを含むソウトウェアモジュール310に(通常、それによりメモリからアクセスされる)渡され、これは、心拍数を検出するか、または少なくとも心臓周期の開始の信号を送る任意の公知のデバイスまたはソフトウェアルーチン315によってトリガーされ得る。中程度の技量のプログラマーでさえ、このソフトウェアモジュール310を設計する方法を知っている。
The value P (k) is (usually accessed from memory thereby) the
上記が好ましいと説明されるが、必要に応じて、近似関数を生成する工程(図6中のX*(t)および関連する論議を参照のこと)、この生成された関数をサンプリングする工程、そして次にこのサンプリングされた値をローパスフィルタ処理する工程がある。ソフトウェアモジュール312、313、314が含められ、これらの機能を実施し、そして公知の技法を用いてプログラムされ得る。勿論、これらモジュールの任意またはすべては、単一本体のコードに組み合わせられ得:これらは、明瞭さのために別個に示されている。また、近似関数のための基礎として用いられる測定値または算出値がstd(P(k))でないならば、このモジュール310は、必要に応じて、置換されるか、再プログラムされるか、または省略され、適切な値を提供する。
While the above is described as preferred, if necessary, generating an approximate function (see X * (t) and related discussion in FIG. 6), sampling the generated function, Then there is a step of low-pass filtering the sampled value.
これらstd(P(k))値は、代表的にはメモリ301中に記憶されるが、次いで、各所定の算出/測定間隔について、最大、最小std(P(t))値であるstd(P)maxおよびstd(P)minを検出するため、および平均std(P(t))値であるmean(std(P(k))を算出するためのコンピューター実行可能なコードを含むソフトウェアモジュール320に渡され、これは、上記に記載のように、人工呼吸器のような呼吸デバイス325によってトリガーされ得るか、またはソフトウェアモジュールによって検出され得る。再び、中程度の技量のプログラマーでさえ、上記の説明が与えられれば、ソフトウェアモジュール320を設計する方法を知っている。また、上記に記載したように、上記算出間隔が1より多い呼吸周期に亘り拡大するよう選択されるならば、このモジュール320が省略され得るか、または少なくとも呼ばれないように、最大および最小std(P(t))値、std(P)maxおよびstd(P)minを算出することは必ずしも必要ではない。
These std (P (k)) values are typically stored in the
これら値std(P)max、std(P)minおよびmean(std(P(k))は、次いで、SVV算出モジュール330に渡され、これは、等式8または9に従って、選択された間隔についてSVVの推定値を算出する。複数周期間隔が設定されるならば、このSVV算出モジュール320は、モジュール310によって提供される上記std(P(k))値に対して直接操作し得、等式10に従って、SVVの推定値を算出する。
These values std (P) max , std (P) min and mean (std (P (k))) are then passed to the SVV calculation module 330, which is for the selected interval according to Equation 8 or 9. Calculate SVV estimates: If multiple period intervals are set, this
図7に示されるように、任意またはすべてのソフトウェアモジュール306、310、312〜314、320、および330は、単一の推定ソフトウェア構成要素370内のルーチンとして単に実行され得、これは、勿論、所望により、処理システム300のその他のソフトウェア構成要素と組み合わせられ得る。
As shown in FIG. 7, any or all of the
本発明は、さらに、本発明の方法を実行するために、コンピューターユニットまたは処理システム300中にロード可能なコンピュータープログラムに関する。さらに、本発明に従って、上記種々の算出を実施し、そして関連する方法の工程を実施するために用いられる、種々のソフトウェアモジュール310、312〜314、315(ソフトウェア中で実行される場合)、320、330、または一般に370はまた、本発明が異なる処理システムにロードされ、およびそれによって実行されることを可能にするためにコンピューター読み取り可能な媒体上のコンピューター実行可能な指令として記憶され得る。
The present invention further relates to a computer program that can be loaded into a computer unit or
一旦、SVV(またはその他の心臓または血行力学)推定値が算出されると、それは、使用者が見ることができるモニターのような任意に所望の出力デバイス500に渡され、そして任意の選択されたフォーマットで、表示され、記憶され、または伝達される。入力デバイス400がまた、好ましくは含められ、使用者が、例えば、管理および患者特有の情報を入力し、ディスプレイを調節し、算出間隔を選択するなどを可能にする。使用者が上記算出間隔を変更することが可能とされるならば、対応する情報が、推定ソフトウェア構成要素370に利用可能とされなければならず、その結果、等式8もしくは9、または等式10いずれかに従ってSVVを算出するとき、それは、このSVV推定モジュールが、必要な入力値を選択するよう指令し得る。
Once the SVV (or other cardiac or hemodynamic) estimate is calculated, it is passed to any desired
(試験結果)
std(P(k))値からSVVを算出するための2つの異なる、しかし関連する方法が上記で説明される−1つは、SVVが単一の呼吸周期に亘って算出され、そしてもう1つは、1より多い呼吸周期に亘る算出間隔について単一のSVV値を算出するために用いられ得る。本発明者らは、動物の大腿動脈および橈骨血圧データに対し本発明の両方のこれらの実施形態を試験した。このデータは、いくつかのブタ実験から収集され、これらは実験室で実施された。実験の間に、左心室容量でいくつかの変化(容量注入または容量抽出)が誘導された。末梢抵抗(血管拡張または血管収縮)の分散が同様に誘導された。本発明の両方の実施形態は、類似のSVV推定値を提供することが見出されたのみならず、これらの推定値が比較のための先行技術の方法を用いて得た推定値に対し優れていることが見出された。
(Test results)
Two different but related methods for calculating SVV from the std (P (k)) value are described above—one is that SVV is calculated over a single respiratory cycle, and another One can be used to calculate a single SVV value for a calculation interval over more than one respiratory cycle. We tested both these embodiments of the present invention against femoral artery and radial blood pressure data of animals. This data was collected from several pig experiments and these were performed in the laboratory. During the experiment, several changes (volume injection or volume extraction) were induced in the left ventricular volume. Dispersion of peripheral resistance (vasodilation or vasoconstriction) was similarly induced. Both embodiments of the present invention were found not only to provide similar SVV estimates, but these estimates were superior to the estimates obtained using prior art methods for comparison. It was found that
(試験結果)
std(P(k))値からSVVを算出するための2つの異なる、しかし関連する方法が上記で説明される−1つは、SVVが単一の呼吸周期に亘って算出され、そしてもう1つは、1より多い呼吸周期に亘る算出間隔について単一のSVV値を算出するために用いられ得る。本発明者らは、動物の大腿動脈および橈骨血圧データに対し本発明の両方のこれらの実施形態を試験した。このデータは、いくつかのブタ実験から収集され、これらは実験室で実施された。実験の間に、左心室容量でいくつかの変化(容量注入または容量抽出)が誘導された。末梢抵抗(血管拡張または血管収縮)の分散が同様に誘導された。本発明の両方の実施形態は、類似のSVV推定値を提供することが見出されたのみならず、これらの推定値が比較のための先行技術の方法を用いて得た推定値に対し優れていることが見出された。
(Test results)
Two different but related methods for calculating SVV from the std (P (k)) value are described above—one is that SVV is calculated over a single respiratory cycle, and another One can be used to calculate a single SVV value for a calculation interval over more than one respiratory cycle. We tested both these embodiments of the present invention against femoral artery and radial blood pressure data of animals. This data was collected from several pig experiments and these were performed in the laboratory. During the experiment, several changes (volume injection or volume extraction) were induced in the left ventricular volume. Dispersion of peripheral resistance (vasodilation or vasoconstriction) was similarly induced. Both embodiments of the present invention were found not only to provide similar SVV estimates, but these estimates were superior to the estimates obtained using prior art methods for comparison. It was found that
(さらなる出力)
上記で述べたように、本発明は、SVVのみならず、SVVから誘導され得る任意の心臓パラメーターを推定するために用いられ得る。本発明者らは、試験において、例えば、一定の人工呼吸速度および一定の一回呼吸量の機械的人工呼吸の間に、右心室端部拡張期容量(EDV)がSVVに反比例することを発見した。従って:
EDV=c/SVV
(等式11)
ここで、cは、一定であり得る較正係数である。本発明によって提供されるSVV推定値は、従って、EDV、血管充填の程度に比例することが知られている拍出フラクションまたはその他の値を推定するための間接方法として用いられ得る。
(More output)
As stated above, the present invention can be used to estimate any cardiac parameter that can be derived from SVV, as well as SVV. In the study, we found that right ventricular end diastolic volume (EDV) is inversely proportional to SVV, for example, during constant mechanical ventilation and constant tidal volume mechanical ventilation. did. Therefore:
EDV = c / SVV
(Equation 11)
Where c is a calibration factor that may be constant. The SVV estimates provided by the present invention can therefore be used as an indirect method for estimating EDV, stroke fraction or other values known to be proportional to the degree of vascular filling.
等式11における較正係数cは、心室収縮性および心室伸展性(コンプライアンス)のようないくつかのパラメーターに依存する。一般に、cは、患者の血行力学状態に依存する。従って、再較正が、患者の血行力学状態が変化する毎に、または血行力学不安定の期間の間に実施されなければならない。 The calibration factor c in Equation 11 depends on several parameters such as ventricular contractility and ventricular extensibility (compliance). In general, c depends on the patient's hemodynamic state. Therefore, recalibration must be performed every time the patient's hemodynamic state changes or during periods of hemodynamic instability.
Claims (44)
該方法は、
該処理手段が、少なくとも2つの心臓周期を含む算出間隔に亘る動脈血圧の測定値から波形データセットを生成することと、
該標準偏差算出モジュールが、各心臓周期に亘る該波形データセットについて標準偏差値を算出することと、
該SVV算出モジュールが、該標準偏差値の関数として該SVVの推定値を算出することと
を包含する、方法。A method of operating an apparatus for determining a cardiac parameter equal to or derivable from a cardiac stroke volume variance (SVV) by a processing means including a standard deviation calculation module and an SVV calculation module comprising:
The method
And that said processing means, for generating a waveform data set from measurements of arterial blood pressure over a computation interval that includes at least two cardiac cycles,
And that said standard deviation calculation module calculates the standard deviation value for the waveform data set over each cardiac cycle,
The SVV calculation module comprises and calculating the estimated value of the SVV as a function of the standard deviation method.
前記SVV算出モジュールが、前記SVVの推定値を、該最大標準偏差値および該最小標準偏差値の関数として算出することと
をさらに包含する、請求項1に記載の方法。And that the scope value determination module, over the calculated distance, determines the maximum standard deviation value and the minimum standard deviation value,
The SVV calculation module, an estimate of the SVV, outermost further encompasses and calculating as a function of the large standard deviation value and said minimum standard deviation value, The method of claim 1.
前記SVV算出モジュールが、該平均標準偏差値に対し、前記最大標準偏差値と前記最小標準偏差値との間の差異に比例しているSVVの推定値を算出することと
をさらに包含する、請求項2に記載の方法。And the average value calculation module, over the calculated distance, to calculate the average standard deviation value,
The SVV calculation module, to the average standard deviation value, further comprising the calculating the estimated value of SVV which is proportional to the difference between the maximum standard deviation value and the minimum standard deviation value, wherein Item 3. The method according to Item 2.
該呼吸デバイスが、前記算出間隔を少なくとも1つの呼吸周期に設定することと
をさらに包含する、請求項1に記載の方法。And the breathing device, detects the boundaries of the respiratory cycle,
The respiratory device further comprises a setting at least one respiratory cycle the calculation interval A method according to claim 1.
平均値算出モジュールが、該算出間隔に亘る該標準偏差値の平均を算出することと、
前記SVV算出モジュールが、該標準偏差値の標準偏差と該標準偏差の平均との比に比例するSVVの推定値を算出することと
をさらに包含する、請求項4に記載の方法。And said standard deviation calculation module calculates the standard deviation of the standard deviation values over the computation interval,
And the average value calculating module calculates the average of the standard deviation values over the calculated out interval,
The SVV calculation module, the standard deviation further comprising the calculating the estimated value of the SVV proportional to the average the ratio of the standard deviation and the standard deviation of the values, according to claim 4 method.
該近似関数算出モジュールが、間隔に特異的なサンプリング速度で該近似関数をサンプリングすることによって、サンプリングされた近似値のセットを生成することと、
ローパスフィルタモジュールが、該サンプリングされた近似値をローパスフィルタ処理することと、
前記SVV算出モジュールが、前記SVVの推定値を、該ローパスフィルタ処理されたサンプリングされた近似値の関数として算出することと
をさらに包含する、請求項1に記載の方法。And that the approximation function calculating module, which according to a predetermined metric over at least one of the calculated distance, to calculate an approximate function that best matches the standard deviation value the calculated,
The approximate function calculation module, by sampling the approximate function with specific sampling rate intervals, and generating a set of sampled approximations,
And the low-pass filter module and low-pass filtering the sampled approximation,
The SVV calculation module, an estimate of the SVV, said further encompasses and calculating as a function of the low-pass filtered sampled approximation method of claim 1.
少なくとも2つの心臓周期を含む算出間隔に亘り動脈血圧に対応する波形データセットを決定および入力する配列と、
処理システムと
を備え、
前記処理システムは、
各心臓周期に亘り該波形データセットについて標準偏差値を算出することと、
該標準偏差値の関数として該SVVの推定値を算出することと
を行う、システム。A system for determining a cardiac parameter equal to or derivable from a cardiac stroke variance (SVV) comprising:
An array for determining and inputting a waveform data set corresponding to arterial blood pressure over a calculated interval comprising at least two cardiac cycles;
A processing system and
The processing system includes:
Calculating a standard deviation value for the waveform data set over each cardiac cycle;
Calculating an estimate of the SVV as a function of the standard deviation value.
前記算出間隔に亘り、最大標準偏差値および最小標準偏差値を決定することと、
前記SVVの推定値を、該最大標準偏差値および該最小標準偏差値の関数として算出することと
を行うようにさらに構成されている、請求項8に記載のシステム。The processing system includes:
Determining a maximum standard deviation value and a minimum standard deviation value over the calculation interval;
The system of claim 8, further configured to: calculate the SVV estimate as a function of the maximum standard deviation value and the minimum standard deviation value.
前記算出間隔に亘り、平均標準偏差値を算出することと、
該平均標準偏差値に対し、前記最大標準偏差値と前記最小標準偏差値との間の差異に比例しているSVVの推定値を算出することと
を行うようにさらに構成されている、請求項9に記載のシステム。The processing system includes:
Calculating an average standard deviation value over the calculation interval;
The system further comprises: calculating an SVV estimate that is proportional to the difference between the maximum standard deviation value and the minimum standard deviation value for the average standard deviation value. 10. The system according to 9.
前記算出間隔に亘る前記標準偏差値の標準偏差を算出することと、
該算出間隔に亘る該標準偏差値の平均を算出することと、
該標準偏差値の標準偏差と該標準偏差の平均との比に比例するSVVの推定値を算出することと
を行うようにさらに構成されている、請求項11に記載のシステム。The processing system includes:
Calculating a standard deviation of the standard deviation value over the calculation interval;
Calculating an average of the standard deviation values over the calculation interval;
The system of claim 11, further comprising: calculating an estimate of SVV that is proportional to a ratio of a standard deviation of the standard deviation value and an average of the standard deviation values.
該測定された動脈圧を前記波形データセットに変換する変換回路と
をさらに備える、請求項8に記載のシステム。A pressure transducer attached to a catheter for measuring arterial pressure;
9. The system of claim 8, further comprising: a conversion circuit that converts the measured arterial pressure into the waveform data set.
測定された動脈圧を前記波形データセットに変換する変換回路と
をさらに備える、請求項8に記載のシステム。A non-invasive arterial pressure measuring device;
9. The system of claim 8, further comprising: a conversion circuit that converts measured arterial pressure into the waveform data set.
右心室端部拡張期容量の推定値を、前記心臓一回拍出量分散の算出された推定値に反比例するものとして算出するようにさらに構成されている、請求項8に記載のシステム。The processing system includes:
9. The system of claim 8, further configured to calculate an estimate of right ventricular end diastolic volume as being inversely proportional to a calculated estimate of the cardiac stroke volume variance.
該処理システムは、
前記算出間隔の少なくとも1つに亘る所定の測定基準に従って、前記算出された標準偏差値に最も一致する近似関数を算出することと、
間隔に特異的なサンプリング速度で該近似関数をサンプリングすることによって、サンプリングされた近似値のセットを生成することと、
前記SVVの推定値を、該ローパスフィルタによってフィルター処理された、ローパスフィルタ処理されたサンプリングされた近似値の関数として算出することと
を行うようにさらに構成されている、請求項8に記載のシステム。The processing system further includes a low pass filter,
The processing system comprises:
Calculating an approximate function that most closely matches the calculated standard deviation value according to a predetermined metric over at least one of the calculation intervals;
Generating a set of sampled approximations by sampling the approximation function at an interval specific sampling rate;
9. The system of claim 8, further comprising: calculating the SVV estimate as a function of a low pass filtered sampled approximation filtered by the low pass filter. .
該方法は、
該処理手段が、測定パラメーターの血圧測定値に対応する波形データセットを受信することと、
該測定値生成手段が、該波形データセットから一連の測定値を生成することと、
該処理手段が、個々の算出間隔に亘る該波形データセットの標準偏差の関数として、少なくとも2つの心臓周期を含む少なくとも1つの算出間隔に亘り、該一連の測定値の各測定値を算出することと、
該近似関数算出モジュールが、所定の測定基準に従って該測定値に最も一致する近似関数を算出することと、
該近似関数算出モジュールが、間隔に特異的なサンプリング速度で該近似関数をサンプリングすることによって、サンプリングされた近似値のセットを生成することと、
該ローパスフィルタモジュールが、該サンプリングされた近似値をローパスフィルタ処理することと、
該処理手段が、該ローパスフィルタ処理されたサンプリングされた近似値の関数として該拍出量値の推定値を算出することと
を包含する、方法。And processing means, the measured value generating means, an approximate function calculation module, a low-pass filter module, according to an output unit, a method of operating apparatus for determining cardiac or hemodynamic stroke volume values,
The method
The processing means receives a waveform data set corresponding to a blood pressure measurement of the measurement parameter;
And the measured value generating means for generating a series of measurements from the waveform data sets,
The processing means, as a function of the standard deviation of the waveform data set over each calculation interval, for at least one calculated distance comprises at least two cardiac cycles, calculating the respective measurements of the series of measurements When,
And that the approximation function calculating module calculates an approximate function that best matches the measured value according to a predetermined metric,
The approximate function calculation module, by sampling the approximate function with specific sampling rate intervals, and generating a set of sampled approximations,
And that said low-pass filter module and low-pass filtering the sampled approximation,
Encompasses and that said processing means calculates an estimated value of該拍output quantity value as a function of the low-pass filtered sampled approximation method.
前記方法は、
呼吸デバイスが、複数の呼吸周期を識別することと、
心臓周期検出器が、心臓周期を検出することと、
該呼吸デバイスが、前記算出間隔を呼吸周期に設定することと
をさらに包含する、請求項17に記載の方法。The stroke volume value has a low frequency component corresponding to respiratory-induced dispersion;
The method
And the breathing device, identifying a plurality of respiratory cycles,
And the cardiac cycle detector detects a cardiac cycle,
The respiratory device further includes and setting the calculated distance to the respiratory cycle, The method of claim 17.
予備処理することは、ノイズ除去のためのデジタルフィルター処理、運動アーチファクト拒絶、パルスビート検出、悪い拍動の拒絶のうちのいずれかを実行することを含む、請求項17に記載の方法。Generating the series of measurements includes pre-processing the waveform data set;
The method of claim 17, wherein the preprocessing includes performing any of digital filtering for noise removal, motion artifact rejection, pulse beat detection, bad beat rejection.
血圧測定値に対応する波形データセットを決定および入力する配列と、
処理システムと
を備え、
該処理システムは、
該波形データセットから一連の測定値を生成することと、
少なくとも2つの心臓周期を含む少なくとも1つの算出間隔に亘り、処理手段を用いて、個々の算出間隔に亘る該波形データセットの標準偏差の関数として該一連の測定値の各測定値を算出することと、
所定の測定基準に従って該測定値に最も一致する近似関数を算出することと、
間隔に特異的なサンプリング速度で該近似関数をサンプリングすることによって、サンプリングされた近似値のセットを生成することと、
該サンプリングされた近似値の関数として該拍出量値の推定値を算出することと
を行う、システム。A system for determining a cardiac or hemodynamic stroke value,
An array for determining and entering a waveform data set corresponding to blood pressure measurements;
A processing system and
The processing system comprises:
Generating a series of measurements from the waveform data set;
Calculating each measurement of the series of measurements as a function of the standard deviation of the waveform data set over individual calculation intervals using processing means over at least one calculation interval including at least two cardiac cycles; When,
Calculating an approximate function that most closely matches the measured value according to a predetermined metric;
Generating a set of sampled approximations by sampling the approximation function at an interval specific sampling rate;
Calculating an estimate of the stroke volume value as a function of the sampled approximation.
前記システムは、
複数の呼吸周期を識別する配列と、
心臓周期を検出する配列と
をさらに備え、
該処理システムが、
前記算出間隔を呼吸周期に設定すること
を行うようにさらに構成されている、請求項22に記載のシステム。The stroke volume value has a low frequency component corresponding to respiratory-induced dispersion;
The system
An array identifying multiple respiratory cycles;
An array for detecting a cardiac cycle, and
The processing system is
23. The system of claim 22, further configured to set the calculated interval to a respiratory cycle.
各心臓周期に亘る該入力された波形データセットについて標準偏差値を算出することと、
該標準偏差値の関数として心臓一回拍出量分散(SVV)の推定値を算出することと
を処理システムに実行させることによって、該処理システムに、該SVVに等しいか、または該SVVから導出可能な心臓パラメーターを決定させるコンピュータプログラム。Inputting a waveform data set corresponding to measured arterial blood pressure over a calculated interval including at least two cardiac cycles;
Calculating a standard deviation value for the input waveform data set over each cardiac cycle;
Calculating an estimate of cardiac stroke volume variance (SVV) as a function of the standard deviation value, causing the processing system to equal to or derive from the SVV. A computer program that determines possible cardiac parameters.
前記SVVの推定値を、該最大標準偏差値および該最小標準偏差値の関数として算出することと
を前記処理システムにさらに実行させる、請求項31に記載のコンピュータプログラム。Determining a maximum standard deviation value and a minimum standard deviation value over the calculation interval;
32. The computer program according to claim 31, further causing the processing system to calculate the estimated value of the SVV as a function of the maximum standard deviation value and the minimum standard deviation value.
該平均標準偏差値に対し、前記最大標準偏差値と前記最小標準偏差値との間の差異に比例しているSVVの推定値を算出することと
を前記処理システムにさらに実行させる、請求項32に記載のコンピュータプログラム。Calculating an average standard deviation value over the calculation interval;
33. causing the processing system to further execute, for the average standard deviation value, calculating an estimated value of SVV that is proportional to a difference between the maximum standard deviation value and the minimum standard deviation value. A computer program described in 1.
該算出間隔に亘る該標準偏差値の平均を算出することと、
該標準偏差値の標準偏差と該標準偏差の平均との比に比例するSVVの推定値を算出することと
を前記処理システムにさらに実行させる、請求項31に記載のコンピュータプログラム。Calculating a standard deviation of the standard deviation value over the calculation interval set in at least one respiratory cycle;
Calculating an average of the standard deviation values over the calculation interval;
32. The computer program according to claim 31, further causing the processing system to calculate an estimated value of SVV that is proportional to a ratio of a standard deviation of the standard deviation value and an average of the standard deviation values.
間隔に特異的なサンプリング速度で該近似関数をサンプリングすることによって、サンプリングされた近似値のセットを生成することと、
該サンプリングされた近似値をローパスフィルタ処理することと、
前記SVVの推定値を、該ローパスフィルタ処理されたサンプリングされた近似値の関数として算出することと
を前記処理システムにさらに実行させる、請求項31に記載のコンピュータプログラム。Calculating an approximate function that most closely matches the calculated standard deviation value according to a predetermined metric over at least one of the calculation intervals;
Generating a set of sampled approximations by sampling the approximation function at an interval specific sampling rate;
Low-pass filtering the sampled approximation;
32. The computer program of claim 31 further causing the processing system to calculate the SVV estimate as a function of the low-pass filtered sampled approximation.
所定の測定基準に従って該波形データセットの該測定値に最も一致する近似関数を算出することと、
間隔に特異的なサンプリング速度で該近似関数をサンプリングすることによって、サンプリングされた近似値のセットを生成することと、
該サンプリングされた近似値をローパスフィルタ処理することと、
該ローパスフィルタ処理されたサンプリングされた近似値の関数として心臓または血行力学拍出量値の推定値を算出することと
を処理システムに実行させることによって、該処理システムに、該拍出量値を決定させるコンピュータプログラム。Calculating each measurement of a series of measurements as a function of the standard deviation of the waveform data set over the individual calculation intervals over at least one calculation interval including at least two cardiac cycles, the waveform data set Corresponds to blood pressure, and
Calculating an approximate function that most closely matches the measured values of the waveform data set according to a predetermined metric;
Generating a set of sampled approximations by sampling the approximation function at an interval specific sampling rate;
Low-pass filtering the sampled approximation;
Causing the processing system to calculate the cardiac output value by calculating an estimate of a cardiac or hemodynamic stroke value as a function of the low-pass filtered sampled approximation. A computer program to be determined.
該標準偏差値の関数としてSVVの推定値を算出するSVV算出モジュールと
を備える、処理装置。A standard deviation calculation module for calculating a standard deviation value for the waveform data set over each cardiac cycle;
And a SVV calculation module that calculates an estimated value of SVV as a function of the standard deviation value.
少なくとも2つの心臓周期を含む少なくとも1つの算出間隔に亘り、個々の算出間隔に亘る波形データセットの標準偏差の関数として一連の測定値の各測定値を算出する標準偏差算出モジュールと、
所定の測定基準に従って、該測定値に最も一致する近似関数を算出する近似関数算出モジュールと、
間隔に特異的なサンプリング速度で該近似関数をサンプリングすることによって、サンプリングされた近似値のセットを生成するサンプリング手段と、
該サンプリングされた近似値の関数として拍出量値の推定値を算出する拍出量値算出モジュールと
を備える、処理装置。A measurement value generating means for generating a series of measurement values from the waveform data set;
A standard deviation calculation module for calculating each measurement of a series of measurements as a function of the standard deviation of the waveform data set over the individual calculation intervals over at least one calculation interval including at least two cardiac cycles ;
An approximate function calculation module for calculating an approximate function that most closely matches the measured value according to a predetermined measurement standard;
Sampling means for generating a set of sampled approximations by sampling the approximation function at an interval specific sampling rate;
A stroke volume value calculation module that calculates an estimated value of a stroke volume value as a function of the sampled approximate value.
をさらに含む、請求項18に記載の方法。Sampling means, for each calculated distance, set the specific sampling rate to satisfy the Nyquist criterion to said interval, or, the number of samples is equal to the number of cardiac cycles in the individual respiratory cycle The method of claim 18, further comprising: setting.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US10/890,887 | 2004-07-14 | ||
| US10/890,887 US7452333B2 (en) | 2003-12-05 | 2004-07-14 | Arterial pressure-based, automatic determination of a cardiovascular parameter |
| US11/085,957 US7422562B2 (en) | 2003-12-05 | 2005-03-22 | Real-time measurement of ventricular stroke volume variations by continuous arterial pulse contour analysis |
| US11/085,957 | 2005-03-22 | ||
| PCT/US2005/025177 WO2006020037A1 (en) | 2004-07-14 | 2005-07-13 | Real-time measurement of ventricular stroke volume variations by continuous arterial pulse contour analysis |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011196457A Division JP2012011218A (en) | 2004-07-14 | 2011-09-08 | Real-time measurement of ventricular stroke volume variation by continuous arterial pulse contour analysis |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2008506472A JP2008506472A (en) | 2008-03-06 |
| JP2008506472A5 JP2008506472A5 (en) | 2008-08-28 |
| JP4896015B2 true JP4896015B2 (en) | 2012-03-14 |
Family
ID=43993174
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2007521682A Active JP4896015B2 (en) | 2004-07-14 | 2005-07-13 | Real-time measurement of ventricular stroke volume variance by continuous arterial pulse contour analysis |
| JP2011196457A Pending JP2012011218A (en) | 2004-07-14 | 2011-09-08 | Real-time measurement of ventricular stroke volume variation by continuous arterial pulse contour analysis |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011196457A Pending JP2012011218A (en) | 2004-07-14 | 2011-09-08 | Real-time measurement of ventricular stroke volume variation by continuous arterial pulse contour analysis |
Country Status (2)
| Country | Link |
|---|---|
| JP (2) | JP4896015B2 (en) |
| DE (1) | DE602005027843D1 (en) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2528499B1 (en) * | 2010-01-29 | 2020-01-01 | Edwards Lifesciences Corporation | Elimination of the effects of irregular cardiac cycles in the determination of cardiovascular parameters |
| JPWO2013140583A1 (en) * | 2012-03-22 | 2015-08-03 | パイオニア株式会社 | Fluid evaluation apparatus and method |
| WO2013140583A1 (en) * | 2012-03-22 | 2013-09-26 | パイオニア株式会社 | Fluid evaluation device and method |
| JP5985355B2 (en) * | 2012-10-30 | 2016-09-06 | 日本光電工業株式会社 | Blood volume measuring method and measuring apparatus |
| EP2759257B1 (en) * | 2013-01-25 | 2016-09-14 | UP-MED GmbH | Method, logic unit and system for determining a parameter representative for the patient's volume responsiveness |
| GB2557199B (en) | 2016-11-30 | 2020-11-04 | Lidco Group Plc | Haemodynamic monitor with improved filtering |
| US20180214033A1 (en) * | 2017-02-02 | 2018-08-02 | Edwards Lifesciences Corporation | Hemodynamic monitor providing enhanced cardiac output measurements |
| KR102377609B1 (en) * | 2020-02-25 | 2022-03-23 | 서울대학교병원 | Apparatus and method for calculating cardiac output using AI |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH0889485A (en) * | 1994-07-26 | 1996-04-09 | Nippon Koden Corp | Blood pressure meter |
| JP2002541961A (en) * | 1999-04-27 | 2002-12-10 | ロマーノ、サルバトーレ | Cardiac output measuring method and measuring device |
| JP2004105682A (en) * | 2002-09-19 | 2004-04-08 | Yoshihisa Fujita | Automatic pulse wave fluctuation measuring instrument |
| EP1434141A2 (en) * | 2002-12-23 | 2004-06-30 | Pulsion Medical Systems AG | Apparatus for determining cardiovascular parameters |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH08140687A (en) * | 1994-09-22 | 1996-06-04 | Japan Found Cancer Res | Rpdl protein and dna encoding for the same |
| WO1997009927A2 (en) * | 1995-09-11 | 1997-03-20 | Nolan James A | Method and apparatus for continuous, non-invasive monitoring of blood pressure parameters |
-
2005
- 2005-07-13 JP JP2007521682A patent/JP4896015B2/en active Active
- 2005-07-13 DE DE602005027843T patent/DE602005027843D1/en active Active
-
2011
- 2011-09-08 JP JP2011196457A patent/JP2012011218A/en active Pending
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH0889485A (en) * | 1994-07-26 | 1996-04-09 | Nippon Koden Corp | Blood pressure meter |
| JP2002541961A (en) * | 1999-04-27 | 2002-12-10 | ロマーノ、サルバトーレ | Cardiac output measuring method and measuring device |
| JP2004105682A (en) * | 2002-09-19 | 2004-04-08 | Yoshihisa Fujita | Automatic pulse wave fluctuation measuring instrument |
| EP1434141A2 (en) * | 2002-12-23 | 2004-06-30 | Pulsion Medical Systems AG | Apparatus for determining cardiovascular parameters |
| JP2004202250A (en) * | 2002-12-23 | 2004-07-22 | Pulsion Medical Systems Ag | Measuring apparatus for cardiovascular parameters |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2012011218A (en) | 2012-01-19 |
| DE602005027843D1 (en) | 2011-06-16 |
| JP2008506472A (en) | 2008-03-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US7422562B2 (en) | Real-time measurement of ventricular stroke volume variations by continuous arterial pulse contour analysis | |
| US20080300494A1 (en) | Real-time measurement of ventricular stroke volume variations by continuous arterial pulse contour analysis | |
| JP5850861B2 (en) | Eliminating the effects of irregular cardiac cycles in determining cardiovascular parameters | |
| US7651466B2 (en) | Pulse contour method and apparatus for continuous assessment of a cardiovascular parameter | |
| US7666144B2 (en) | Methods and apparatus for determining cardiac output and left atrial pressure | |
| US7452333B2 (en) | Arterial pressure-based, automatic determination of a cardiovascular parameter | |
| JP2012011218A (en) | Real-time measurement of ventricular stroke volume variation by continuous arterial pulse contour analysis | |
| US20090048527A1 (en) | Assessment of preload dependence and fluid responsiveness |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080711 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20080711 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20110526 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20110824 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20110831 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110908 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20110930 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20111007 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20111202 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20111219 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20111220 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4896015 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20150106 Year of fee payment: 3 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |