JP2007530431A - Compositions and methods for treating pancreatic cancer - Google Patents
Compositions and methods for treating pancreatic cancer Download PDFInfo
- Publication number
- JP2007530431A JP2007530431A JP2006525966A JP2006525966A JP2007530431A JP 2007530431 A JP2007530431 A JP 2007530431A JP 2006525966 A JP2006525966 A JP 2006525966A JP 2006525966 A JP2006525966 A JP 2006525966A JP 2007530431 A JP2007530431 A JP 2007530431A
- Authority
- JP
- Japan
- Prior art keywords
- sequence
- sirna
- cdh3
- pcdh1
- gpr107
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
- C12N15/1138—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing against receptors or cell surface proteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering N.A.
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/50—Physical structure
- C12N2310/53—Physical structure partially self-complementary or closed
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Chemical & Material Sciences (AREA)
- Biomedical Technology (AREA)
- Organic Chemistry (AREA)
- Wood Science & Technology (AREA)
- General Engineering & Computer Science (AREA)
- Biotechnology (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Zoology (AREA)
- Pharmacology & Pharmacy (AREA)
- Plant Pathology (AREA)
- Public Health (AREA)
- Physics & Mathematics (AREA)
- Biophysics (AREA)
- Animal Behavior & Ethology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Microbiology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Biochemistry (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
本発明は、癌細胞とPCDH1、CDH3、またはGPR107の発現を阻害するsiRNA組成物を接触させることによって癌細胞の増殖を阻害する方法を特徴とする。癌を治療する方法も本発明の範囲内である。本発明はまた、提供される方法において有用な、核酸配列およびベクターなどの生成物ならびにこれらを含む組成物を特徴とする。本発明はまた、例えば、膵臓癌細胞、特に膵管腺癌(PDACa)といった腫瘍細胞を阻害する方法を提供する。
The invention features a method of inhibiting cancer cell growth by contacting a cancer cell with an siRNA composition that inhibits expression of PCDH1, CDH3, or GPR107. Methods for treating cancer are also within the scope of the present invention. The invention also features products, such as nucleic acid sequences and vectors, and compositions containing them useful in the provided methods. The invention also provides a method of inhibiting tumor cells such as, for example, pancreatic cancer cells, particularly pancreatic ductal adenocarcinoma (PDACa).
Description
技術分野
本発明は、生物科学の分野、より具体的には癌研究の分野に関する。特に、本発明は、PCDH1、CDH3、またはGPR107をコードする遺伝子の発現を阻害することができる核酸を含む組成物に関する。ある態様においては、前記化合物は、これらの遺伝子に由来するサブシーケンス(subsequence)に対応する低分子干渉RNA(siRNA)である。なお、本願は、2004年3月24日に出願された米国特許仮出願第60/555,809号の恩典を主張し、米国特許仮出願第60/555,809号の内容はその全体が参照として本明細書に組み入れられる。
TECHNICAL FIELD The present invention relates to the field of biological science, more specifically to the field of cancer research. In particular, the present invention relates to a composition comprising a nucleic acid capable of inhibiting the expression of a gene encoding PCDH1, CDH3, or GPR107. In certain embodiments, the compound is a small interfering RNA (siRNA) corresponding to a subsequence derived from these genes. This application claims the benefit of US Provisional Patent Application No. 60 / 555,809 filed on March 24, 2004, the contents of which are hereby incorporated by reference in their entirety. Is incorporated into.
背景技術
膵管腺癌(PDACa)は西側世界において第5位の癌死因であり、任意の悪性腫瘍の中でも最も高い死亡率を有するものの一つであり、5年生存率は4%しかない。米国では、毎年、推定30,700人の患者が膵臓癌と診断され、ほぼ30,000人がこれらの疾患で死亡する。大多数の患者は疾患が進行期で診断され、この段階では、疾患は現行の治療に反応せず、患者は数ヶ月しか生存することができない。外科切除でしか治癒する見込みがないが、治癒の可能性のある切除をPDACa患者の10〜20%しか受けることができず、手術を受けても患者の80〜90%は再発し、この疾患で死亡する。ゲムシタビンを含む化学療法および/または放射線も受けた患者においては手術結果または生活の質がある程度改善されるが、PDACaのあらゆる治療に対しての強力な耐性のために、長期生存への影響は極めてわずかなものであった。現在、大部分の患者の治療技術は一時的緩和に的を絞っている。
BACKGROUND ART Pancreatic ductal adenocarcinoma (PDACa) is the fifth leading cause of cancer death in the western world, and has one of the highest mortality rates of any malignant tumor, with a 5 year survival rate of only 4%. In the United States, an estimated 30,700 patients are diagnosed with pancreatic cancer each year and nearly 30,000 die from these diseases. The majority of patients are diagnosed with an advanced stage of disease, at which stage the disease does not respond to current treatment and patients can only survive for months. Although only surgical resection is expected to cure, only 10-20% of PDACa patients can undergo resection with a curative cure, and 80-90% of patients will recur even after surgery. To die. Surgical results or quality of life improve somewhat in patients who have also received chemotherapy and / or radiation, including gemcitabine, but the impact on long-term survival is extremely high because of the strong tolerance to any treatment with PDACa It was slight. Currently, treatment techniques for most patients are focused on temporary relief.
従って、新規のPDACa分子療法の確立、PDACa治療の新規分子標的を同定することが、現在、膵臓癌治療にとって急を要する問題である。 Therefore, the establishment of a novel PDACa molecular therapy and the identification of a novel molecular target for PDACa treatment are currently urgent issues for pancreatic cancer treatment.
発明の開示
本発明は、PCDH1、CDH3、またはGPR107の発現阻害がPDACaに関与する癌細胞を含む様々な癌細胞の細胞増殖の阻害に有効であるという驚くべき発見に基づいている。本出願において記載される本発明はこの発見に一部基づいている。
DISCLOSURE OF THE INVENTION The present invention is based on the surprising discovery that inhibition of PCDH1, CDH3, or GPR107 expression is effective in inhibiting cell proliferation of various cancer cells, including cancer cells involved in PDACa. The invention described in this application is based in part on this discovery.
本発明は、細胞増殖を阻害する方法を提供する。提供される方法の中には、細胞とPCDH1、CDH3、またはGPR107の発現を阻害する低分子干渉RNA(siRNA)を含む組成物を接触させる段階を含む方法がある。本発明はまた、被験体における腫瘍細胞増殖を阻害する方法を提供する。このような方法は、PCDH1、CDH3、またはGPR107由来の配列に特異的にハイブリダイズする低分子干渉RNA(siRNA)を含む組成物を被験体に投与する段階を含む。本発明の別の局面は、生物学的試料の細胞におけるPCDH1遺伝子、CDH3遺伝子、またはGPR107遺伝子の発現を阻害する方法を提供する。遺伝子の発現は、PCDH1遺伝子、CDH3遺伝子、またはGPR107遺伝子の発現を阻害するのに十分な量の二本鎖リボ核酸(RNA)分子を細胞に導入することによって阻害されてもよい。本発明の別の局面は、例えば、提供される方法において有用な、核酸配列およびベクターを含む生成物ならびにこれらを含む組成物に関する。提供される生成物の中には、PCDH1遺伝子、CDH3遺伝子、またはGPR107遺伝子を発現している細胞に導入されるとPCDH1遺伝子、CDH3遺伝子、またはGPR107遺伝子の発現を阻害する特性を有するsiRNA分子がある。このような分子の中には、センス鎖およびアンチセンス鎖を含み、センス鎖がPCDH1、CDH3、またはGPR107標的配列に対応するリボヌクレオチド配列を含み、かつアンチセンス鎖がセンス鎖に相補的なリボヌクレオチド配列を含む分子がある。分子のセンス鎖およびアンチセンス鎖は互いにハイブリダイズして、二本鎖分子を形成する。 The present invention provides a method of inhibiting cell proliferation. Among the methods provided are methods comprising contacting a cell with a composition comprising a small interfering RNA (siRNA) that inhibits expression of PCDH1, CDH3, or GPR107. The present invention also provides a method of inhibiting tumor cell growth in a subject. Such a method comprises administering to a subject a composition comprising a small interfering RNA (siRNA) that specifically hybridizes to a sequence derived from PCDH1, CDH3, or GPR107. Another aspect of the present invention provides a method of inhibiting the expression of a PCDH1 gene, a CDH3 gene, or a GPR107 gene in a cell of a biological sample. Gene expression may be inhibited by introducing a sufficient amount of a double-stranded ribonucleic acid (RNA) molecule into the cell to inhibit expression of the PCDH1 gene, CDH3 gene, or GPR107 gene. Another aspect of the present invention relates to products comprising nucleic acid sequences and vectors and compositions comprising them, for example, useful in the provided methods. Among the products provided are siRNA molecules that have the property of inhibiting the expression of the PCDH1 gene, CDH3 gene, or GPR107 gene when introduced into cells that express the PCDH1 gene, CDH3 gene, or GPR107 gene. is there. Some such molecules include a sense strand and an antisense strand, the sense strand contains a ribonucleotide sequence corresponding to a PCDH1, CDH3, or GPR107 target sequence, and the antisense strand is complementary to the sense strand. There are molecules that contain nucleotide sequences. The sense and antisense strands of the molecule hybridize to each other to form a double stranded molecule.
本明細書で使用する用語「生物」は、少なくとも1つの細胞からなる任意の生き物を意味する。生物は、例えば、真核単細胞のような単純なものでもよく、ヒトを含む哺乳動物のような複雑なものでもよい。 As used herein, the term “organism” means any living organism that consists of at least one cell. The organism may be as simple as eukaryotic single cells, or as complex as mammals including humans.
本明細書で使用する用語「生物学的試料」は、生物全体、またはその組織、細胞、もしくは構成部分の一部(例えば、体液(血液、粘液、リンパ液、滑液、脳脊髄液、唾液、羊水、臍帯血(amniotic cord blood)、尿、膣液、および精液が挙げられるが、これに限定されない))を意味する。「生物学的試料」は、さらに、生物全体またはその細胞、組織、もしくは構成部分のサブセットから調製されたホモジネート、溶解産物、抽出物、細胞培養物、または組織培養物、あるいはその画分または一部を意味する。最後に、「生物学的試料」は、タンパク質または核酸分子などの細胞成分を含む、生物を増殖させた栄養培地またはゲルなどの培地を意味する。 As used herein, the term `` biological sample '' refers to an entire organism, or a portion of a tissue, cell, or component thereof (e.g., body fluid (blood, mucus, lymph, synovial fluid, cerebrospinal fluid, saliva, Amniotic fluid, amniotic cord blood, urine, vaginal fluid, and semen)). A “biological sample” further refers to a homogenate, lysate, extract, cell culture, or tissue culture, or a fraction or one thereof, prepared from the entire organism or a subset of its cells, tissues, or components. Part. Finally, “biological sample” means a medium such as a nutrient medium or gel in which an organism has been grown, containing cellular components such as proteins or nucleic acid molecules.
本発明は、細胞増殖を阻害する方法を特徴とする。細胞増殖は、細胞とPCDH1、CDH3、またはGPR107の低分子干渉RNA(siRNA)の組成物を接触させることによって阻害される。さらに、細胞はトランスフェクション促進剤と接触させられる。細胞は、インビトロ、インビボ、またはエクスビボで提供される。被験体は、哺乳動物であり、例えば、ヒト、非ヒト霊長類、マウス、ラット、イヌ、ネコ、ウマ、またはウシである。細胞は膵管細胞である。または、細胞は、癌腫細胞または腺癌細胞などの腫瘍細胞(すなわち、癌細胞)である。例えば、細胞は、膵管腺癌細胞である。細胞増殖の阻害とは、処置された細胞が未処置細胞より低速で増殖するか、または生存率が低下することを意味する。細胞増殖は、当技術分野において周知の増殖アッセイによって測定される。 The invention features a method of inhibiting cell proliferation. Cell proliferation is inhibited by contacting the cells with a composition of PCDH1, CDH3, or GPR107 small interfering RNA (siRNA). In addition, the cells are contacted with a transfection facilitating agent. The cells are provided in vitro, in vivo, or ex vivo. The subject is a mammal, for example, a human, non-human primate, mouse, rat, dog, cat, horse, or cow. The cell is a pancreatic duct cell. Alternatively, the cell is a tumor cell (ie, a cancer cell) such as a carcinoma cell or an adenocarcinoma cell. For example, the cell is a pancreatic ductal adenocarcinoma cell. Inhibition of cell growth means that treated cells grow slower than untreated cells or that viability is reduced. Cell proliferation is measured by proliferation assays well known in the art.
用語「siRNA」は、標的mRNAの翻訳を阻止する二本鎖RNA分子を意味する。RNAを転写する鋳型がDNAである技法を含め、細胞にsiRNAを導入する標準的な技法が用いられる。siRNAは、PCDH1センス核酸配列、CDH3センス核酸配列、もしくはGPR107センス核酸配列、PCDH1アンチセンス核酸配列、CDH3アンチセンス核酸配列、もしくはGPR107アンチセンス核酸配列、またはその両方を含む。siRNAは、二種類の相補的な分子を含む場合があり、または1つの転写物が、標的遺伝子に由来するセンス配列および相補的アンチセンス配列の両方を有するように構築される場合もあり、例えば、ヘアピンで、ある態様において、それはマイクロRNA(miRNA)を産生する。 The term “siRNA” refers to a double-stranded RNA molecule that prevents translation of a target mRNA. Standard techniques for introducing siRNA into cells are used, including techniques where the template for transcription of RNA is DNA. The siRNA comprises a PCDH1 sense nucleic acid sequence, a CDH3 sense nucleic acid sequence, or a GPR107 sense nucleic acid sequence, a PCDH1 antisense nucleic acid sequence, a CDH3 antisense nucleic acid sequence, or a GPR107 antisense nucleic acid sequence, or both. siRNAs may contain two types of complementary molecules, or one transcript may be constructed to have both sense and complementary antisense sequences from the target gene, for example A hairpin, in certain embodiments, it produces microRNA (miRNA).
前記方法は、例えば、細胞の悪性形質転換の結果として、PCDH1、CDH3、またはGPR107の発現がアップレギュレートされている細胞の遺伝子発現を変化させるために用いられる。標的細胞においてsiRNAとPCDH1転写物、CDH3転写物、またはGPR107転写物が結合すると、細胞によるPCDH1、CDH3、またはGPR107の産生が低下する。オリゴヌクレオチドの長さは少なくとも約10ヌクレオチドであり、天然に生じるPCDH1転写物、CDH3転写物、またはGPR107転写物と同じくらいの長さでもよい。好ましくは、オリゴヌクレオチドの長さは約19〜約25ヌクレオチドである。最も好ましくは、オリゴヌクレオチドの長さは約75ヌクレオチド未満、約50ヌクレオチド未満、または約25ヌクレオチド未満である。哺乳動物細胞のPCDH1、CDH3、またはGPR107の発現を阻害するPCDH1 siRNA、CDH3 siRNA、またはGPR107 siRNAオリゴヌクレオチドの例として、標的配列、例えば、配列番号:22、23、または24のヌクレオチドをそれぞれ含むオリゴヌクレオチドが挙げられる。 The method is used, for example, to alter gene expression in cells that are upregulated in expression of PCDH1, CDH3, or GPR107 as a result of malignant transformation of the cells. Binding of siRNA and PCDH1 transcript, CDH3 transcript, or GPR107 transcript in the target cell decreases the production of PCDH1, CDH3, or GPR107 by the cell. The length of the oligonucleotide is at least about 10 nucleotides and may be as long as a naturally occurring PCDH1 transcript, CDH3 transcript, or GPR107 transcript. Preferably, the length of the oligonucleotide is about 19 to about 25 nucleotides. Most preferably, the length of the oligonucleotide is less than about 75 nucleotides, less than about 50 nucleotides, or less than about 25 nucleotides. Examples of PCDH1 siRNA, CDH3 siRNA, or GPR107 siRNA oligonucleotides that inhibit the expression of PCDH1, CDH3, or GPR107 in mammalian cells include oligos that include target sequences, eg, nucleotides of SEQ ID NOs: 22, 23, or 24, respectively Nucleotides are mentioned.
標的細胞における遺伝子発現を阻害する能力を有する二本鎖RNAを設計する方法は周知である。(例えば、全体が参照として本明細書に組み入れられる、米国特許第6,506,559号を参照のこと)。例えば、siRNAを設計するコンピュータプログラムをAmbionのウェブサイト(http://www.ambion.com/techlib/misc/siRNA_finder.html)から入手することができる。Ambion社により利用可能なこのコンピュータプログラムは、以下のプロトコールに基づいてsiRNA合成のためのヌクレオチド配列を選択する。 Methods for designing double stranded RNA having the ability to inhibit gene expression in target cells are well known. (See, eg, US Pat. No. 6,506,559, which is incorporated herein by reference in its entirety). For example, a computer program for designing siRNA can be obtained from the Ambion website (http://www.ambion.com/techlib/misc/siRNA_finder.html). This computer program, available by Ambion, selects nucleotide sequences for siRNA synthesis based on the following protocol.
siRNA標的部位の選択
1.転写物の開始コドンAUGから開始して、下流にあるAAジヌクレオチド配列をスキャンする。siRNA標的候補部位として、AAおよび3'側隣接19ヌクレオチドの各々の出現を記録する。Tuschlら、Targeted mRNA degradation by double-stranded RNA in vitro. Genes Dev 13(24):3191-7(1999)、 は、5'および3'非翻訳領域(UTR)ならびに開始コドン付近の(75塩基以内の)領域は調節タンパク質結合部位を多く含んでいる可能性があるので、これらに対するsiRNAを設計しないように勧めている。UTR結合タンパク質および/または翻訳開始複合体は、siRNAエンドヌクレアーゼ複合体の結合を妨げる可能性がある。
siRNA target site selection
1. Scan downstream AA dinucleotide sequence starting from transcript start codon AUG. Record the occurrence of AA and 3 ′ adjacent 19 nucleotides as siRNA target candidate sites. Tuschl et al., Targeted mRNA degradation by double-stranded RNA in vitro. Genes Dev 13 (24): 3191-7 (1999), 5 'and 3' untranslated regions (UTR) and near the start codon (within 75 bases) It is recommended not to design siRNAs for these regions, as these regions may contain many regulatory protein binding sites. UTR binding proteins and / or translation initiation complexes may interfere with the binding of the siRNA endonuclease complex.
2.標的候補部位と適切なゲノムデータベース(ヒト、マウス、ラットなど)を比較し、他のコード配列と有意な相同性を有する全ての標的配列を検討から除外する。www.ncbi.nlm.nih.gov/BLAST/のNCBIサーバーに見出されるBLASTを使用することを提唱する。 2. Compare the target candidate site with the appropriate genomic database (human, mouse, rat, etc.) and exclude all target sequences with significant homology with other coding sequences from consideration. We propose to use BLAST found on the NCBI server at www.ncbi.nlm.nih.gov/BLAST/.
3.合成に適した標的配列を選択する。遺伝子の長さに応じていくつかの標的配列を選択して評価することが典型的である。 3. Select a target sequence suitable for synthesis. It is typical to select and evaluate several target sequences depending on the length of the gene.
標的配列 、例えば、配列番号:22、23、および24のヌクレオチド核酸配列を含む単離された核酸分子、または配列番号22、23、および24のヌクレオチドの核酸配列に相補的な核酸分子も本発明に含まれる。本明細書で使用する「単離された核酸」は、元々の環境(例えば、天然のものであれば自然環境)から取り出された核酸、従って、その天然の状態から人工的に変化させられた核酸である。本発明において、単離された核酸は、DNA、RNA、およびその誘導体を含む。単離された核酸がRNAまたはその誘導体である場合、ヌクレオチド配列内の塩基「t」は「u」に置換されなければならない。本明細書で使用する用語「相補的な」は、核酸分子のヌクレオチド単位間のワトソン-クリック型塩基対またはフーグスティーン型塩基対を意味し、用語「結合する」は、2つの核酸もしくは化合物、または関連する核酸もしくは化合物、またはその組み合わせの間の物理的相互作用または化学的相互作用を意味する。相補的な核酸配列は適切な条件下でハイブリダイズして、ミスマッチをほとんどまたは全く含まない、安定した二重鎖を形成する。本発明の目的に対して、5またはそれ以下のミスマッチを持つ二つの配列は相補的と考えられる。さらに、本発明の単離されたヌクレオチドのセンス鎖およびアンチセンス鎖は、ハイブリダイゼーションによって二本鎖ヌクレオチドまたはヘアピンループ構造を形成することができる。好ましい態様において、このような二重鎖が含むミスマッチは10マッチあたり1以下である。特に好ましい態様において、二重鎖の鎖が完全に相補的な場合、このような二重鎖はミスマッチを含まない。PCDH1、CDH3、またはGPR107に対して核酸分子は長さがそれぞれ3851、3205、または6840ヌクレオチド未満である。例えば、核酸分子は長さが約500ヌクレオチド未満、約200ヌクレオチド未満、または約75ヌクレオチド未満である。本明細書に記載の核酸の1つまたは複数を含むベクターおよびベクターを含む細胞も本発明に含まれる。本発明の単離された核酸は、PCDH1、CDH3、またはGPR107に対するsiRNAまたはsiRNAをコードするDNAに有用である。核酸がsiRNAまたはそのコードDNAに用いられる場合、センス鎖は、好ましくは約19ヌクレオチドより長く、より好ましくは21ヌクレオチドより長い。 An isolated nucleic acid molecule comprising a target sequence, eg, the nucleotide nucleic acid sequence of SEQ ID NO: 22, 23, and 24, or a nucleic acid molecule that is complementary to the nucleotide sequence of SEQ ID NO: 22, 23, and 24 nucleotides include. As used herein, an “isolated nucleic acid” is a nucleic acid that has been removed from its original environment (eg, the natural environment if it is naturally occurring), and thus has been artificially altered from its natural state. It is a nucleic acid. In the present invention, isolated nucleic acid includes DNA, RNA, and derivatives thereof. If the isolated nucleic acid is RNA or a derivative thereof, the base “t” in the nucleotide sequence must be replaced with “u”. As used herein, the term “complementary” refers to Watson-Crick base pairs or Hoogsteen base pairs between nucleotide units of a nucleic acid molecule, and the term “binds” refers to two nucleic acids or compounds. Or a physical or chemical interaction between related nucleic acids or compounds, or a combination thereof. Complementary nucleic acid sequences hybridize under appropriate conditions to form stable duplexes with little or no mismatch. For the purposes of the present invention, two sequences with 5 or fewer mismatches are considered complementary. Furthermore, the sense and antisense strands of the isolated nucleotides of the present invention can form double stranded nucleotides or hairpin loop structures by hybridization. In a preferred embodiment, such duplexes contain no more than 1 mismatch per 10 matches. In particularly preferred embodiments, such duplexes do not contain mismatches when the strands of the duplex are perfectly complementary. For PCDH1, CDH3, or GPR107, the nucleic acid molecule is less than 3851, 3205, or 6840 nucleotides in length, respectively. For example, the nucleic acid molecule is less than about 500 nucleotides, less than about 200 nucleotides, or less than about 75 nucleotides in length. Also encompassed by the invention are vectors containing one or more of the nucleic acids described herein and cells containing the vectors. The isolated nucleic acids of the invention are useful for siRNA or DNA encoding siRNA against PCDH1, CDH3, or GPR107. When the nucleic acid is used for siRNA or its coding DNA, the sense strand is preferably longer than about 19 nucleotides, more preferably longer than 21 nucleotides.
本発明は、PCDH1、CDH3、またはGPR107をコードする遺伝子が非癌性膵臓組織と比較して膵管腺癌(PDACa)において過剰発現しているという発見に一部基づいている。PCDH1のcDNAは3851ヌクレオチド長であり、CDH3のcDNAは3205ヌクレオチド長であり、GPR107のcDNAは6840ヌクレオチド長である。PCDH1、CDH3、またはGPR107の核酸配列およびポリペプチド配列は、それぞれ、配列番号:1および2、3および4、または5および6に示した。配列データも以下のアクセッション番号を介して入手可能である。
PCDH1(CFUPC): L11370, NM_002587
CDH3: X63629, NM_001793
GPR107: NM_032925, NM_020960, (KIAA1624: R39794) AB046844
The present invention is based in part on the discovery that genes encoding PCDH1, CDH3, or GPR107 are overexpressed in pancreatic ductal adenocarcinoma (PDACa) compared to non-cancerous pancreatic tissue. The PCDH1 cDNA is 3851 nucleotides long, the CDH3 cDNA is 3205 nucleotides long, and the GPR107 cDNA is 6840 nucleotides long. The nucleic acid and polypeptide sequences of PCDH1, CDH3, or GPR107 are shown in SEQ ID NOs: 1 and 2, 3 and 4, or 5 and 6, respectively. Sequence data is also available via the following accession numbers.
PCDH1 (CFUPC): L11370, NM_002587
CDH3: X63629, NM_001793
GPR107: NM_032925, NM_020960, (KIAA1624: R39794) AB046844
配列番号:22、23、および24を含むsiRNAのトランスフェクションによって、PDACa細胞株の増殖の阻害がもたらされた。PCDH1(CFUPC)は、カルシウム依存性細胞間接着分子であるカドヘリンスーパーファミリーの中で最大のサブグループである、プロトカドヘリンファミリーに属する。プロトカドヘリンの多くは中枢神経系において高発現しており、かつ神経回路の発達およびシナプス伝達の調節において役割を果たしている可能性が高い(Sano K, Tanihara H, Heimark RL, Obata S, Davidson M, St John T, Taketani S, Suzuki S. Protocadherins: a large family of cadherin-related molecules in central nervous system. EMBO J., 12:2249-56, 1993.Frank M, and Kemler R. Protocadherins. Curr Opin Cell Biol., 14:557-62, 2002)。しかしながら、PCDH1は膵臓癌細胞において豊富にあるが、中枢神経系には存在せず(図3A)、その機能はいまだにわかっていない。 Transfection of siRNA containing SEQ ID NOs: 22, 23, and 24 resulted in inhibition of growth of the PDACa cell line. PCDH1 (CFUPC) belongs to the protocadherin family, the largest subgroup of the cadherin superfamily, which is a calcium-dependent intercellular adhesion molecule. Many protocadherins are highly expressed in the central nervous system and likely play a role in the regulation of neural circuit development and synaptic transmission (Sano K, Tanihara H, Heimark RL, Obata S, Davidson M, St John T, Taketani S, Suzuki S. Protocadherins: a large family of cadherin-related molecules in central nervous system.EMBO J., 12: 2249-56, 1993.Frank M, and Kemler R. Protocadherins. Curr Opin Cell Biol ., 14: 557-62, 2002). However, although PCDH1 is abundant in pancreatic cancer cells, it is not present in the central nervous system (FIG. 3A) and its function is still unknown.
CDH3もまたカドヘリンファミリーの古典的な一員であり(Shimoyama Y, Yoshida T, Terada M, Shimosato Y, Abe O, Hirohashi S. Molecular cloning of a human Ca2+-dependent cell-cell adhesion molecule homologous to mouse placental cadherin: its low expression in human placental tissues. J Cell Biol., 109:1787-94. 1989)、カドヘリンは、その保存された細胞内ドメインを介してカテニンおよび細胞骨格と結合し、それによって細胞極性、分化、運動、および細胞増殖を制御するシグナル伝達を媒介する(Christofori G. Changing neighbors, changing behavior: cell adhesion molecules-mediated signaling during tumor progression. EMBO J., 22, 2318-2323, 2003)。しかしながら、E-カドヘリンともN-カドヘリンとも異なり、CDH3の機能はいまだにわかっていない。その発現は乳腺および卵巣において観察され、乳癌および前立腺癌においては発現が消失することが報告されたが、乳癌におけるP-カドヘリンの発現は予後の不良と相関している(Peralta Soler A, Knudsen KA, Salazar H, Han AC, Keshgegian AA. P-cadherin expression in breast carcinoma indicates poor survival. Cancer, 86:1263-1272. 1999)。 CDH3 is also a classic member of the cadherin family (Shimoyama Y, Yoshida T, Terada M, Shimosato Y, Abe O, Hirohashi S. Molecular cloning of a human Ca2 + -dependent cell-cell adhesion molecule homologous to mouse placental cadherin: its low expression in human placental tissues. J Cell Biol., 109: 1787-94. 1989), cadherin binds to catenin and cytoskeleton through its conserved intracellular domain, thereby cell polarity, differentiation, It mediates signal transduction that controls movement and cell proliferation (Christofori G. Changing neighbors, changing behavior: cell adhesion molecules-mediated signaling during tumor progression. EMBO J., 22, 2318-2323, 2003). However, unlike E-cadherin and N-cadherin, the function of CDH3 is still unknown. Its expression was observed in the mammary gland and ovary and was reported to disappear in breast and prostate cancer, but P-cadherin expression in breast cancer correlates with poor prognosis (Peralta Soler A, Knudsen KA , Salazar H, Han AC, Keshgegian AA. P-cadherin expression in breast carcinoma indicates poor survival. Cancer, 86: 1263-1272. 1999).
GPR107(KIAA1624)は、7回膜貫通Gタンパク質共役受容体(GPCR)の1つである。今日の指示薬のかなり多くの割合は1種類またはそれ以上のGPCRsを標的としており、最も主用な治療分野は、数種類のGPCRベースの薬物によって、ある程度満たされている。明らかに、GPCRsは、創薬の可能性という点において最も高い位置にある。GPR107は、ノーザンブロット分析(図3C)において示したように、正常な心臓、胎盤、骨格筋、前立腺、精巣、卵巣、脊髄において無制限に発現している。主要な必須臓器における発現は豊富ではなく、このことは、これらの分子を標的とすることにより人体にはほとんど毒性を示さないことを示唆している。 GPR107 (KIAA1624) is one of seven transmembrane G protein coupled receptors (GPCR). A significant proportion of today's indicators target one or more GPCRs, and the most main therapeutic areas are met to some extent by several GPCR-based drugs. Clearly, GPCRs are in the highest position in terms of drug discovery potential. GPR107 is expressed indefinitely in normal heart, placenta, skeletal muscle, prostate, testis, ovary, spinal cord, as shown in Northern blot analysis (FIG. 3C). Expression in major essential organs is not abundant, suggesting that targeting these molecules shows little toxicity to the human body.
細胞増殖を阻害する方法
本発明は、細胞増殖を阻害すること、すなわち、PCDH1、CDH3、またはGPR107の発現を阻害することによって、癌細胞の増殖を阻害することに関する。PCDH1、CDH3、またはGPR107の発現は、例えば、特異的に、PCDH1、CDH3、またはGPR107遺伝子を標的とする低分子干渉RNA(siRNA)によって阻害される。PCDH1、CDH3、またはGPR107標的としては、例えば、配列番号22、23、および24のヌクレオチドが含まれる。
Methods of Inhibiting Cell Growth The present invention relates to inhibiting cell growth, ie inhibiting cancer cell growth by inhibiting the expression of PCDH1, CDH3, or GPR107. The expression of PCDH1, CDH3, or GPR107 is, for example, specifically inhibited by small interfering RNA (siRNA) that targets the PCDH1, CDH3, or GPR107 gene. PCDH1, CDH3, or GPR107 targets include, for example, the nucleotides of SEQ ID NOs: 22, 23, and 24.
非哺乳動物細胞では、二本鎖RNA(dsRNA)は遺伝子発現に対して強力かつ特異的なサイレンシング効果を及ぼすことが示されており、これはRNA干渉(RNAi)と呼ばれる(Sharp PA. RNAi and double-strand RNA. Genes Dev. 1999 Jan 15;13(2):139-41.)。dsRNAは、RNaseIIIモチーフを含む酵素によって、低分子干渉RNA(siRNA)と呼ばれる20〜30ヌクレオチドのdsRNAに処理される。siRNAは、多成分ヌクレアーゼ複合体と共に相補的mRNAを特異的に標的とする(Hammond SM, Bernstein E, Beach D, Hannon GJ. An RNA-directed nuclease mediates post-transcriptional gene silencing in Drosophila cells. Nature. 2000 Mar 16;404(6775):293-6; Hannon GJ. RNA interference. Nature. 2002 Jul 11;418(6894):244-51.)。哺乳動物細胞において、19個の相補的ヌクレオチドとチミジンまたはウリジンの3'末端非相補的二量体を有する、20または21量体のdsRNAで構成されるsiRNAは、遺伝子発現の全体的な変化を誘導することなく、遺伝子特異的ノックダウン効果を有することが示されている(Elbashir SM, Harborth J, Lendeckel W, Yalcin A, Weber K, Tuschl T. Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature. 2001 May 24;411(6836):494-8.)。さらに、核内低分子RNA(snRNA)U6またはポリメラーゼIII H1-RNAプロモーターを含むプラスミドは、RNAポリメラーゼIIIのIII型クラスを動員してこのような短いRNAを効果的に生成し、従って、その標的mRNAを構成的に抑制することができる(Miyagishi M, Taira K. U6 promoter-driven siRNAs with four uridine 3' overhangs efficiently suppress targeted gene expression in mammalian cells.Nat Biotechnol. 2002 May;20(5):497-500.; Brummelkamp TR, Bernards R, Agami R. A System for Stable Expression of Short Interfering RNAs in Mammalian Cells Science. 296(5567):550-553, April 19, 2002.)。 In non-mammalian cells, double-stranded RNA (dsRNA) has been shown to have a powerful and specific silencing effect on gene expression, called RNA interference (RNAi) (Sharp PA. RNAi and double-strand RNA. Genes Dev. 1999 Jan 15; 13 (2): 139-41.). dsRNA is processed into 20-30 nucleotide dsRNA called small interfering RNA (siRNA) by an enzyme containing RNaseIII motif. siRNAs specifically target complementary mRNAs with multi-component nuclease complexes (Hammond SM, Bernstein E, Beach D, Hannon GJ. An RNA-directed nuclease mediates post-transcriptional gene silencing in Drosophila cells.Nature. 2000 Mar 16; 404 (6775): 293-6; Hannon GJ. RNA interference. Nature. 2002 Jul 11; 418 (6894): 244-51.). In mammalian cells, siRNAs composed of 20 or 21-mer dsRNAs with 19 complementary nucleotides and a 3'-terminal non-complementary dimer of thymidine or uridine can alter the overall gene expression. It has been shown to have a gene-specific knockdown effect without induction (Elbashir SM, Harborth J, Lendeckel W, Yalcin A, Weber K, Tuschl T. Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammal cells. Nature. 2001 May 24; 411 (6836): 494-8.). In addition, plasmids containing nuclear small RNA (snRNA) U6 or polymerase III H1-RNA promoters mobilize the type III class of RNA polymerase III to effectively produce such short RNAs, and therefore their targets mRNA can be constitutively suppressed (Miyagishi M, Taira K. U6 promoter-driven siRNAs with four uridine 3 'overhangs efficiently suppress targeted gene expression in mammalian cells.Nat Biotechnol. 2002 May; 20 (5): 497- 500 .; Brummelkamp TR, Bernards R, Agami R. A System for Stable Expression of Short Interfering RNAs in Mammalian Cells Science. 296 (5567): 550-553, April 19, 2002.).
細胞増殖は、細胞と、PCDH1のsiRNA、CDH3のsiRNA、またはGPR107のsiRNAを含む組成物を接触させることによって阻害される。細胞は、さらに、トランスフェクション剤と接触させられる。適切なトランスフェクション剤は当技術分野において周知である。細胞増殖の阻害とは、組成物に曝露されていない細胞と比較して、細胞が低速で増殖するか、または生存率が低下することを意味する。細胞増殖は、当技術分野において周知の方法(例えば、MTT細胞増殖アッセイ)によって測定される。 Cell proliferation is inhibited by contacting the cell with a composition comprising a PCDH1 siRNA, a CDH3 siRNA, or a GPR107 siRNA. The cell is further contacted with a transfection agent. Suitable transfection agents are well known in the art. Inhibition of cell growth means that the cells grow at a slower rate or have a reduced survival rate compared to cells that have not been exposed to the composition. Cell proliferation is measured by methods well known in the art (eg, MTT cell proliferation assay).
PCDH1 siRNA、CDH3 siRNA、またはGPR107 siRNAは、単一の標的PCDH1遺伝子配列、標的CDH3遺伝子配列、または標的GPR107遺伝子配列に向けられる。または、siRNAは、複数の標的PCDH1遺伝子配列、標的CDH3遺伝子配列、または標的GPR107遺伝子配列に向けられる。例えば、組成物は、2、3、4、もしくは5種類、またはそれ以上のPCDH1標的配列、CDH3標的配列、またはGPR107標的配列に対するPCDH1 siRNA、CDH3 siRNA、またはGPR107 siRNAを含む。PCDH1、CDH3、またはGPR107によって、標的配列とは、PCDH1遺伝子、CDH3遺伝子、またはGPR107遺伝子の一部と同一のヌクレオチド配列を意味する。標的配列は、ヒトPCDH1遺伝子、CDH3遺伝子、またはGPR107遺伝子の5'非翻訳(UT)領域、オープンリーディングフレーム(ORF)、または3'非翻訳領域を含んでもよい。または、siRNAは、PCDH1遺伝子、CDH3遺伝子、またはGPR107遺伝子の発現の上流モジュレーターまたは下流モジュレーターに相補的な核酸配列である。上流モジュレーターまたは下流モジュレーターの例として、PCDH1遺伝子プロモーター、CDH3遺伝子プロモーター、またはGPR107遺伝子プロモーターに結合する転写因子、PCDH1ポリペプチド、CDH3ポリペプチド、またはGPR107ポリペプチドと相互作用するキナーゼまたはホスファターゼ、PCDH1プロモーター、CDH3プロモーター、またはGPR107プロモーターまたはエンハンサーが挙げられる。標的mRNAにハイブリダイズするPCDH1 siRNA、CDH3 siRNA、またはGPR107 siRNAは通常、一本鎖mRNA転写物に結合し、それによってタンパク質の翻訳を妨げ、従って、発現を妨げることによって、PCDH1遺伝子、CDH3遺伝子、またはGPR107遺伝子によりコードされるPCDH1ポリペプチド、CDH3ポリペプチド、またはGPR107ポリペプチド生成物の産生を減少または阻害する。従って、本発明のsiRNA分子は、ストリンジェントな条件下で、PCDH1、CDH3、またはGPR107遺伝子に由来するmRNAまたはcDNAと特異的にハイブリダイズする能力によって定義することができる。本発明の目的で、用語「ハイブリダイズする」または「特異的にハイブリダイズする」は、2つの核酸分子が「ストリンジェントなハイブリダイゼーション条件」の下でハイブリダイズする能力をいうために用いられる。句「ストリンジェントなハイブリダイゼーション条件」は、一般的に、複雑な核酸混合物中で、核酸分子がその標的配列とハイブリダイズするが、他の配列とは検出可能にハイブリダイズしない条件を意味する。ストリンジェントな条件は配列依存的であり、様々な状況において異なる。配列が長いほど、高い温度で特異的にハイブリダイズする。核酸ハイブリダイゼーションの広範囲にわたる指針は、Tijssen, Techniques in Biochemistry and Molecular Biology--Hybridization with Nucleic Probes,「Overview of principles of hybridization and the strategy of nucleic acid assays」(1993)に記載されている。一般的に、ストリンジェントな条件は、定義されたイオン強度、pHで特定の配列の融点(Tm)より約5〜10℃低くなるように選択される。Tmは、(定義されたイオン強度、pH、および核酸濃度の下で)、標的に相補的なプローブの50%が標的配列に平衡状態でハイブリダイズする温度である(Tmで、標的配列が過剰に存在する時、プローブの50%が平衡状態で占有される)。ストリンジェントな条件はまた、ホルムアミドなどの不安定化剤を添加することによって達成してもよい。選択的または特異的ハイブリダイゼーションのために、陽性シグナルはバックグラウンドの少なくとも2倍、好ましくはバックグラウンドハイブリダイゼーションの10倍である。例示的なストリンジェントなハイブリダイゼーション条件は以下のようなものでもよい:50%ホルムアミド、5xSSC、および1%SDS、42℃でのインキュベーション、または5xSSC、1%SDS、65℃でのインキュベーション、0.2xSSC、および0.1%SDS、50℃での洗浄。 The PCDH1 siRNA, CDH3 siRNA, or GPR107 siRNA is directed to a single target PCDH1 gene sequence, target CDH3 gene sequence, or target GPR107 gene sequence. Alternatively, the siRNA is directed to multiple target PCDH1 gene sequences, target CDH3 gene sequences, or target GPR107 gene sequences. For example, the composition comprises 2, 3, 4, or 5 or more PCDH1 target sequences, CDH3 target sequences, or PCDH1 siRNA, CDH3 siRNA, or GPR107 siRNA against a GPR107 target sequence. By PCDH1, CDH3 or GPR107, the target sequence means a nucleotide sequence identical to a part of the PCDH1 gene, CDH3 gene or GPR107 gene. The target sequence may include a 5 ′ untranslated (UT) region, an open reading frame (ORF), or a 3 ′ untranslated region of the human PCDH1 gene, CDH3 gene, or GPR107 gene. Alternatively, the siRNA is a nucleic acid sequence that is complementary to an upstream or downstream modulator of expression of the PCDH1 gene, CDH3 gene, or GPR107 gene. Examples of upstream modulators or downstream modulators include PCDH1 gene promoter, CDH3 gene promoter, or transcription factor that binds to GPR107 gene promoter, PCDH1 polypeptide, CDH3 polypeptide, or kinase or phosphatase that interacts with GPR107 polypeptide, PCDH1 promoter, A CDH3 promoter, or a GPR107 promoter or enhancer. PCDH1 siRNA, CDH3 siRNA, or GPR107 siRNA that hybridizes to the target mRNA usually binds to single-stranded mRNA transcripts, thereby preventing protein translation and thus preventing expression, thereby preventing PCDH1 gene, CDH3 gene, Or reduces or inhibits the production of PCDH1 polypeptide, CDH3 polypeptide, or GPR107 polypeptide product encoded by the GPR107 gene. Thus, siRNA molecules of the invention can be defined by their ability to specifically hybridize with mRNA or cDNA derived from PCDH1, CDH3, or GPR107 genes under stringent conditions. For the purposes of the present invention, the terms “hybridize” or “specifically hybridize” are used to refer to the ability of two nucleic acid molecules to hybridize under “stringent hybridization conditions”. The phrase “stringent hybridization conditions” generally refers to conditions in a complex nucleic acid mixture where a nucleic acid molecule hybridizes to its target sequence but does not detectably hybridize to other sequences. Stringent conditions are sequence-dependent and will be different in different circumstances. Longer sequences hybridize specifically at higher temperatures. Extensive guidelines for nucleic acid hybridization are described in Tijssen, Techniques in Biochemistry and Molecular Biology--Hybridization with Nucleic Probes, "Overview of principles of hybridization and the strategy of nucleic acid assays" (1993). Generally, stringent conditions are selected to be about 5-10 ° C. lower than the melting point (T m ) for the specific sequence at a defined ionic strength, pH. T m is the temperature (under defined ionic strength, pH, and nucleic acid concentration) at which 50% of the probe complementary to the target hybridizes in equilibrium to the target sequence (at T m , the target sequence When 50% is present in excess, 50% of the probe is occupied in equilibrium). Stringent conditions may also be achieved with the addition of destabilizing agents such as formamide. For selective or specific hybridization, a positive signal is at least twice background, preferably 10 times background hybridization. Exemplary stringent hybridization conditions may be as follows: 50% formamide, 5xSSC, and 1% SDS, 42 ° C incubation, or 5xSSC, 1% SDS, 65 ° C incubation, 0.2xSSC , And 0.1% SDS, 50 ° C wash.
本発明のsiRNAは、長さが約500ヌクレオチド未満、約200ヌクレオチド未満、約100ヌクレオチド未満、約50ヌクレオチド未満、または約25ヌクレオチド未満である。好ましくは、siRNAは長さが約19〜約25ヌクレオチドである。PCDH1 siRNA、CDH3 siRNA、またはGPR107 siRNAを生成するための核酸配列の例は、それぞれ標的配列である配列番号:22、23、または24のヌクレオチド配列を含む。さらに、siRNAの阻害活性を増強するために、標的配列のアンチセンス鎖の3'末端にヌクレオチド「u」を付加することができる。付加される「u」の数は少なくとも約2個であり、一般的に約2個から約10個であり、好ましくは約2個から約5個である。付加された「u」は、siRNAのアンチセンス鎖の3'末端で一本鎖を形成する。 The siRNA of the invention is less than about 500 nucleotides, less than about 200 nucleotides, less than about 100 nucleotides, less than about 50 nucleotides, or less than about 25 nucleotides in length. Preferably, the siRNA is about 19 to about 25 nucleotides in length. Examples of nucleic acid sequences for generating PCDH1 siRNA, CDH3 siRNA, or GPR107 siRNA include the nucleotide sequences of SEQ ID NO: 22, 23, or 24, respectively, which are target sequences. Furthermore, in order to enhance the inhibitory activity of siRNA, nucleotide “u” can be added to the 3 ′ end of the antisense strand of the target sequence. The number of “u” added is at least about 2, generally from about 2 to about 10, and preferably from about 2 to about 5. The added “u” forms a single strand at the 3 ′ end of the antisense strand of the siRNA.
細胞は、PCDH1、CDH3、またはGPR107を発現または過剰発現する任意の細胞である。細胞は、例えば、膵管細胞のような上皮細胞である。または、細胞は、癌腫、腺癌、芽腫、白血病、骨髄腫、または肉腫などの腫瘍細胞である。細胞は膵管腺癌である。 The cell is any cell that expresses or overexpresses PCDH1, CDH3, or GPR107. The cell is an epithelial cell such as a pancreatic duct cell. Alternatively, the cell is a tumor cell such as a carcinoma, adenocarcinoma, blastoma, leukemia, myeloma, or sarcoma. The cell is pancreatic ductal adenocarcinoma.
PCDH1 siRNA、CDH3 siRNA、またはGPR107 siRNAは、mRNA転写物に結合可能な形で細胞に直接導入される。または、PCDH1 siRNA、CDH3 siRNA、またはGPR107 siRNAをコードするDNAはベクターの中にある。 PCDH1 siRNA, CDH3 siRNA, or GPR107 siRNA is introduced directly into the cell in a form that can bind to the mRNA transcript. Alternatively, the DNA encoding PCDH1 siRNA, CDH3 siRNA, or GPR107 siRNA is in a vector.
ベクターは、例えば、両方の鎖の(DNA分子の転写による)発現が可能なように、作動可能に連結された調節配列にPCDH1配列、CDH3配列、またはGPR107配列が隣接するように発現ベクターにPCDH1標的配列、CDH3標的配列、またはGPR107標的配列をクローニングすることによって作成される(Lee,N.S.,Dohjima,T.,Bauer,G.,Li,H.,Li,M.-J.,Ehsani,A.,Salvaterra,P.,and Rossi,J.(2002)Expression of small interfering RNAs targeted against HIV-1 rev transcripts in human cells. Nature Biotechnology 20:500-505.)。PCDH1 mRNA、CDH3 mRNA、またはGPR107 mRNAに対するアンチセンスであるRNA分子は第1のプロモーター(例えば、クローニングされたDNAの3'側にあるプロモーター配列)によって転写され、PCDH1 mRNA、CDH3 mRNA、またはGPR107 mRNAのセンス鎖であるRNA分子は第2のプロモーター(例えば、クローニングされたDNAの5'側にあるプロモーター配列)によって転写される。センス鎖およびアンチセンス鎖はインビボでハイブリダイズして、PCDH1遺伝子、CDH3遺伝子、またはGPR107遺伝子のサイレンシングのためのsiRNA構築物を生じる。または、siRNA構築物のセンス鎖およびアンチセンス鎖を生成するために、2種類の構築物が用いられる。クローニングされたPCDH1、CDH3、またはGPR107は、二次構造、例えば、ヘアピンを有する構築物をコードしてもよく、この場合、1つの転写物が、標的遺伝子からのセンス配列と相補的アンチセンス配列の両方を有する。 The vector may be, for example, PCDH1 to the expression vector so that the operably linked regulatory sequences are flanked by PCDH1, CDH3, or GPR107 sequences so that expression of both strands (by transcription of the DNA molecule) is possible. Created by cloning a target sequence, CDH3 target sequence, or GPR107 target sequence (Lee, NS, Dohjima, T., Bauer, G., Li, H., Li, M.-J., Ehsani, A Salvaterra, P., and Rossi, J. (2002) Expression of small interfering RNAs targeted against HIV-1 rev transcripts in human cells. Nature Biotechnology 20: 500-505.). An RNA molecule that is antisense to PCDH1 mRNA, CDH3 mRNA, or GPR107 mRNA is transcribed by a first promoter (e.g., a promoter sequence that is 3 'to the cloned DNA), and PCDH1 mRNA, CDH3 mRNA, or GPR107 mRNA The RNA molecule which is the sense strand of is transcribed by a second promoter (for example, a promoter sequence on the 5 ′ side of the cloned DNA). The sense and antisense strands hybridize in vivo to yield siRNA constructs for silencing the PCDH1 gene, CDH3 gene, or GPR107 gene. Alternatively, two types of constructs are used to generate the sense and antisense strands of the siRNA construct. The cloned PCDH1, CDH3, or GPR107 may encode a construct having a secondary structure, for example, a hairpin, in which one transcript contains an antisense sequence complementary to the sense sequence from the target gene. Have both.
ヘアピンループ構造を形成するために、任意のヌクレオチド配列からなるループ配列をセンス配列とアンチセンス配列の間に配置してもよい。従って、本発明はまた、一般式5'-[A]-[B]-[A']-3'を有するsiRNAも提供し、式中、[A]は、PCDH1、CDH3、またはGPR107由来のmRNAまたはcDNAに特異的にハイブリダイズする配列に対応するリボヌクレオチド配列である。より好ましい態様においては、[A]は配列番号:22、23、および24のヌクレオチドからなる群より選択される配列に対応するリボヌクレオチド配列であり、
[B]は、3個から23個のヌクレオチドからなるリボヌクレオチド配列であり、ならびに
[A']は、[A]の相補配列からなるリボヌクレオチド配列である。
In order to form a hairpin loop structure, a loop sequence consisting of an arbitrary nucleotide sequence may be arranged between the sense sequence and the antisense sequence. Accordingly, the present invention also provides siRNA having the general formula 5 ′-[A]-[B]-[A ′]-3 ′, wherein [A] is derived from PCDH1, CDH3, or GPR107. A ribonucleotide sequence corresponding to a sequence that specifically hybridizes to mRNA or cDNA. In a more preferred embodiment, [A] is a ribonucleotide sequence corresponding to a sequence selected from the group consisting of the nucleotides of SEQ ID NOs: 22, 23, and 24;
[B] is a ribonucleotide sequence consisting of 3 to 23 nucleotides, and
[A ′] is a ribonucleotide sequence consisting of the complementary sequence of [A].
領域[A]は[A']にハイブリダイズし、次いで、領域[B]からなるループが形成される。ループ配列は、好ましくは、長さが約3個から約23個のヌクレオチドであってよい。ループ配列は、例えば、以下の配列からなる群より選択することができる(http://www.ambion.com/techlib/tb/tb_506.html)。さらに、23個のヌクレオチドからなるループ配列から活性型siRNAが得られる(Jacque,J.-M., Triques,K., and Stevenson,M.(2002) Modulation of HIV-1 replication by RNA interference.Nature 418:435-438)。 Region [A] hybridizes to [A ′], and then a loop consisting of region [B] is formed. The loop sequence may preferably be about 3 to about 23 nucleotides in length. The loop sequence can be selected, for example, from the group consisting of the following sequences (http://www.ambion.com/techlib/tb/tb_506.html). Furthermore, an active siRNA is obtained from a loop sequence consisting of 23 nucleotides (Jacque, J.-M., Triques, K., and Stevenson, M. (2002) Modulation of HIV-1 replication by RNA interference. 418: 435-438).
CCC、CCACC、またはCCACACC:Jacque, J. M., Triques, K., and Stevenson, M(2002) Modulation of HIV-1 replication by RNA interference. Nature, Vol. 418:435-438. CCC, CCACC, or CCACACC: Jacque, J. M., Triques, K., and Stevenson, M (2002) Modulation of HIV-1 replication by RNA interference.Nature, Vol. 418: 435-438.
UUCG:Lee,N.S., Dohjima,T., Bauer,G., Li,H., Li,M.-J., Ehsani,A., Salvaterra,P., and Rossi,J.(2002) Expression of small interfering RNAs targeted against HIV-1 rev transcripts in human cells. Nature Biotechnology 20:500-505. Fruscoloni, P., Zamboni, M., and Tocchini-Valentini, G.P.(2003) Exonucleolytic degradation of double-stranded RNA by an activity in Xenopus laevis germinal vesicles. Proc. Natl. Acad. Sci. USA 100(4): 1639-1644. UUCG: Lee, NS, Dohjima, T., Bauer, G., Li, H., Li, M.-J., Ehsani, A., Salvaterra, P., and Rossi, J. (2002) Expression of small interfering RNAs targeted against HIV-1 rev transcripts in human cells.Nature Biotechnology 20: 500-505.Fruscoloni, P., Zamboni, M., and Tocchini-Valentini, GP (2003) Exonucleolytic degradation of double-stranded RNA by an activity in Xenopus laevis germinal vesicles. Proc. Natl. Acad. Sci. USA 100 (4): 1639-1644.
UUCAAGAGA: Dykxhoorn, D. M., Novina, C. D., and Sharp, P. A. (2002) Killing the messenger: Short RNAs that silence gene expression. Nature Reviews Molecular Cell Biology 4: 457-467. UUCAAGAGA: Dykxhoorn, D. M., Novina, C. D., and Sharp, P. A. (2002) Killing the messenger: Short RNAs that silence gene expression.Nature Reviews Molecular Cell Biology 4: 457-467.
例えば、本発明のヘアピンループ構造を有する好ましいsiRNAを以下に示す。以下の構造において、ループ配列は、CCC、UUCG、CCACC、CCACACC、およびUUCAAGAGAからなる群より選択することができる。好ましいループ配列はUUCAAGAGA(DNAでは「ttcaagaga」(配列番号:35))である。
GACAUCAAUGACAACACAC-[B]-GUGUGUUGUCAUUGAUGUC(配列番号:22の標的配列の場合)
GGAGACAGGCUGGUUGUUG-[B]-CAACAACCAGCCUGUCUCC(配列番号:23の標的配列の場合)
GUGGCUCUACCAGCUCCUG-[B]-CAGGAGCUGGUAGAGCCAC(配列番号:24の標的配列の場合)
For example, preferable siRNAs having the hairpin loop structure of the present invention are shown below. In the following structure, the loop sequence can be selected from the group consisting of CCC, UUCG, CCACC, CCACACC, and UUCAAGAGA. A preferred loop sequence is UUCAAGAGA ("ttcaagaga" (SEQ ID NO: 35) for DNA).
GACAUCAAUGACAACACAC- [B] -GUGUGUUGUCAUUGAUGUC (for the target sequence of SEQ ID NO: 22)
GGAGACAGGCUGGUUGUUG- [B] -CAACAACCAGCCUGUCUCC (when the target sequence is SEQ ID NO: 23)
GUGGCUCUACCAGCUCCUG- [B] -CAGGAGCUGGUAGAGCCAC (when the target sequence is SEQ ID NO: 24)
PCDH1、CDH3、またはGPR107の発現を独立して調節できるように、または時間的もしくは空間的に調節できるように、PCDH1配列、CDH3配列、またはGPR107配列に隣接する調節配列は同一であるか、または異なる。siRNAは、PCDH1遺伝子、CDH3遺伝子、またはGPR107遺伝子の鋳型を、例えば、核内低分子RNA(snRNA)U6に由来するRNAポリメラーゼIII転写単位またはヒトH1 RNAプロモーターを含むベクターにクローニングすることによって細胞内で転写される。ベクターを細胞に導入するために、トランスフェクション促進剤を使用することができる。FuGENE(Roche Diagnostics)、Lipofectamine 2000(Invitrogen)、Oligofectamine(Invitrogen)、およびNucleofector(和光純薬工業)がトランスフェクション促進剤として有用である。 The regulatory sequences flanking the PCDH1, CDH3, or GPR107 sequence are identical, so that the expression of PCDH1, CDH3, or GPR107 can be independently regulated, or can be temporally or spatially regulated, or Different. siRNA is produced by cloning a template of the PCDH1 gene, CDH3 gene, or GPR107 gene into a vector containing, for example, an RNA polymerase III transcription unit derived from a nuclear small RNA (snRNA) U6 or a human H1 RNA promoter. It is transcribed with. A transfection facilitating agent can be used to introduce the vector into the cell. FuGENE (Roche Diagnostics), Lipofectamine 2000 (Invitrogen), Oligofectamine (Invitrogen), and Nucleofector (Wako Pure Chemical Industries) are useful as transfection promoters.
オリゴヌクレオチド、およびPCDH1 mRNA、CDH3 mRNA、またはGPR107 mRNAの様々な部分に相補的なオリゴヌクレオチドを、腫瘍細胞(例えば、膵管腺癌(PDACa)細胞株といった膵臓細胞株を使用する)のPCDH1、CDH3、またはGPR107の産生を減少させる能力について、標準的な方法に従ってインビトロで試験した。候補組成物の非存在下で培養した細胞と比較して、候補siRNA組成物と接触させた細胞ではPCDH1遺伝子、CDH3遺伝子、またはGPR107遺伝子産物が減少することを、PCDH1特異的抗体、CDH3特異的抗体、もしくはGPR107特異的抗体または他の検出法を用いて検出する。次いで、インビトロ細胞アッセイまたは無細胞アッセイにおいてPCDH1、CDH3、またはGPR107の産生を減少させる配列を、細胞増殖に対する阻害作用について試験する。悪性新生物を有する動物におけるPCDH1、CDH3、またはGPR107産生の減少および腫瘍細胞増殖の低下を確かめるために、インビトロ細胞アッセイにおいて細胞増殖を阻害する配列をラットまたはマウスにおいてインビボで試験する。 Oligonucleotides and oligonucleotides complementary to various portions of PCDH1 mRNA, CDH3 mRNA, or GPR107 mRNA are used in tumor cells (eg, using pancreatic cell lines such as pancreatic ductal adenocarcinoma (PDACa) cell lines), PCDH1, CDH3 Or the ability to reduce the production of GPR107 was tested in vitro according to standard methods. PCDH1-specific antibodies, CDH3-specific, decrease in PCDH1 gene, CDH3 gene, or GPR107 gene product in cells contacted with the candidate siRNA composition compared to cells cultured in the absence of the candidate composition Detection is performed using antibodies, or GPR107 specific antibodies or other detection methods. Sequences that reduce the production of PCDH1, CDH3, or GPR107 in an in vitro or cell-free assay are then tested for inhibitory effects on cell proliferation. To ascertain a decrease in PCDH1, CDH3, or GPR107 production and a decrease in tumor cell proliferation in animals with malignant neoplasms, sequences that inhibit cell proliferation are tested in vivo in rats or mice in an in vitro cell assay.
悪性腫瘍を治療する方法
PCDH1、CDH3、またはGPR107の過剰発現を特徴とする腫瘍を有する患者は、PCDH1 siRNA、CDH3 siRNA、またはGPR107 siRNAの投与によって治療される。siRNA療法は、例えば、膵管腺癌(PDACa)を罹患しているか、または発症する危険性のある患者におけるPCDH1、CDH3、またはGPR107の発現を阻害するために用いられる。このような患者は、特定の腫瘍型の標準的な方法によって特定される。膵管腺癌(PDACa)は、例えば、CT、MRI、ERCP、MRCP、コンピューター断層撮影、または超音波によって診断される。被験体におけるPCDH1、CDH3、またはGPR107の発現の低下、または腫瘍のサイズ、罹患率、もしくは転移可能性の減少などの臨床上の利益につながれば、治療は有効である。治療が予防目的で用いられる場合、「有効な」は、治療が腫瘍の形成を遅延もしくは阻止するか、または腫瘍の臨床症状を阻止もしくは緩和することを意味する。有効性は、特定の腫瘍型を診断または治療する任意の既知の方法と共同して確かめられる。
How to treat malignant tumors
Patients with tumors characterized by overexpression of PCDH1, CDH3, or GPR107 are treated by administration of PCDH1 siRNA, CDH3 siRNA, or GPR107 siRNA. siRNA therapy is used, for example, to inhibit the expression of PCDH1, CDH3, or GPR107 in patients suffering from or at risk of developing pancreatic ductal adenocarcinoma (PDACa). Such patients are identified by standard methods for specific tumor types. Pancreatic ductal adenocarcinoma (PDACa) is diagnosed by, for example, CT, MRI, ERCP, MRCP, computed tomography, or ultrasound. Treatment is effective if it leads to a clinical benefit, such as decreased expression of PCDH1, CDH3, or GPR107 in the subject, or a decrease in tumor size, morbidity, or metastatic potential. “Effective” when the treatment is used for prophylactic purposes means that the treatment delays or prevents the formation of the tumor or prevents or alleviates the clinical symptoms of the tumor. Efficacy is verified in conjunction with any known method for diagnosing or treating a particular tumor type.
siRNA療法は、本発明のsiRNAをコードする標準的なベクターおよび/または、合成siRNA分子を送達することによるなどの遺伝子送達システムによってsiRNAを患者に投与することによって実施される。一般的に、合成siRNA分子は、インビボでヌクレアーゼ分解を阻止するために化学的に安定化される。化学的に安定化されたRNA分子を調製する方法は当技術分野において周知である。一般的に、このような分子は、リボヌクレアーゼの働きを阻止するために、修飾されたバックボーンおよびヌクレオチドを含む。他の修飾も可能であり、例えば、コレステロール結合型siRNAは、改善された薬理学的特性を示している(Song et al. Nature Med. 9:347-351 (2003))。適切な遺伝子送達システムとして、リポソーム、受容体媒介送達システム、またはウイルスベクター(例えば、特に、ヘルペスウイルス、レトロウイルス、アデノウイルス、およびアデノ随伴ウイルス)を挙げることができる。治療用核酸組成物は薬学的に許容される担体中に製剤化される。治療用組成物は前記の遺伝子送達システムを含んでも良い。薬学的に許容される担体は、動物への投与に適した生物学的に適合する賦形剤(vehicle)(例えば、生理食塩水)である。化合物の治療有効量は、医学的に望ましい結果(例えば、治療された動物におけるPCDH1遺伝子産物、CDH3遺伝子産物、またはGPR107遺伝子産物の産生の低下、細胞成長(例えば、増殖の低下、または腫瘍増殖の低下)を生じることが可能な量である。 siRNA therapy is performed by administering the siRNA to the patient by a gene delivery system, such as by delivering a standard vector encoding the siRNA of the invention and / or a synthetic siRNA molecule. In general, synthetic siRNA molecules are chemically stabilized to prevent nuclease degradation in vivo. Methods for preparing chemically stabilized RNA molecules are well known in the art. In general, such molecules contain a modified backbone and nucleotides to block the function of ribonucleases. Other modifications are possible, for example, cholesterol-binding siRNA has shown improved pharmacological properties (Song et al. Nature Med. 9: 347-351 (2003)). Suitable gene delivery systems can include liposomes, receptor-mediated delivery systems, or viral vectors (eg, particularly herpes viruses, retroviruses, adenoviruses, and adeno-associated viruses). The therapeutic nucleic acid composition is formulated in a pharmaceutically acceptable carrier. The therapeutic composition may comprise the gene delivery system described above. A pharmaceutically acceptable carrier is a biologically compatible vehicle (eg, saline) suitable for administration to animals. A therapeutically effective amount of the compound is determined from a medically desirable outcome (e.g., decreased production of PCDHl gene product, CDH3 gene product, or GPR107 gene product, cell growth (e.g., decreased proliferation, or tumor growth in the treated animal) This is the amount that can cause a decrease.
PCDH1 siRNA、CDH3 siRNA、またはGPR107 siRNA組成物を送達するために、静脈内送達経路、皮下送達経路、筋肉内送達経路、および腹腔内送達経路などの非経口投与を使用することができる。膵臓腫瘍の治療には、腹腔動脈、脾動脈、または総肝動脈への直接注入が有用である。 Parenteral administration, such as intravenous, subcutaneous, intramuscular, and intraperitoneal delivery routes, can be used to deliver PCDH1 siRNA, CDH3 siRNA, or GPR107 siRNA compositions. For the treatment of pancreatic tumors, direct injection into the celiac, splenic, or common hepatic artery is useful.
任意の患者への投与量は、患者の大きさ、体表面積、年齢、投与しようとする特定の核酸、性別、投与時間および経路、身体全体の健康、ならびに同時に投与されている他の薬物などの多くの要因に左右される。核酸を静脈内投与する場合の投与量は、約106コピーから1022コピーの核酸分子である。 Dosage to any patient is such as patient size, body surface area, age, specific nucleic acid to be administered, sex, administration time and route, overall health, and other drugs being administered at the same time It depends on many factors. When the nucleic acid is administered intravenously, the dose is about 10 6 to 10 22 copies of the nucleic acid molecule.
ポリヌクレオチドは、標準的な方法(例えば、筋肉もしくは皮膚などの組織の間隙への注射、循環もしくは体腔への導入、または吸入もしくは吹送(insufflation))によって投与される。ポリヌクレオチドは、薬学的に許容される液体担体(例えば、水溶性または部分的に水溶性の液体担体)と共に動物に注射されるか、または別の方法で送達される。ポリヌクレオチドは、リポソーム(例えば、カチオン性リポソームまたはアニオン性リポソーム)と結合される。ポリヌクレオチドは、標的細胞による発現に必要な遺伝情報(例えば、プロモーター)を含む。 Polynucleotides are administered by standard methods (eg, injection into gaps in tissues such as muscle or skin, introduction into the circulation or body cavities, or inhalation or insufflation). The polynucleotide is injected into the animal together with a pharmaceutically acceptable liquid carrier (eg, a water-soluble or partially water-soluble liquid carrier) or otherwise delivered. The polynucleotide is associated with a liposome (eg, a cationic liposome or an anionic liposome). The polynucleotide contains genetic information (eg, a promoter) necessary for expression by the target cell.
特に定義しない限り、本明細書で使用する全ての技術用語および科学用語は、本発明が属する技術分野の当業者に一般的に理解されるものと同じ意味を有する。本発明の実施または試験において、本明細書に記載のものと同様のまたは等価な方法および材料を使用することができるが、適切な方法および材料を以下で説明する。本明細書で述べた全ての刊行物、特許出願、特許、および他の参考文献は、その全体が参照として本明細書に組み入れられる。抵触する場合、定義を含め、本明細書が優先する。さらに、材料、方法、および実施例は例示にすぎず、限定を目的としない。 Unless defined otherwise, all technical and scientific terms used herein have the same meaning as commonly understood by one of ordinary skill in the art to which this invention belongs. Although methods and materials similar or equivalent to those described herein can be used in the practice or testing of the present invention, suitable methods and materials are described below. All publications, patent applications, patents, and other references mentioned herein are hereby incorporated by reference in their entirety. In case of conflict, the present specification, including definitions, will control. In addition, the materials, methods, and examples are illustrative only and not intended to be limiting.
発明を実施するための最良の形態
本発明を以下の実施例においてさらに説明する。以下の実施例は、特許請求の範囲に記載の本発明の範囲を限定しない。
BEST MODE FOR CARRYING OUT THE INVENTION The present invention is further described in the following examples. The following examples do not limit the scope of the invention described in the claims.
[実施例1] 一般的方法
細胞株および組織標本
ヒト膵臓細胞株PK45P、KLM1、およびMIA-PaCa2(ATCC番号:CRL-1420)を、東北大学加齢医学研究所、付属医用細胞資源センターから入手した。これらの細胞は全て公的に入手することができる。
[Example 1] General method
Cell Lines and Tissue Samples Human pancreatic cell lines PK45P, KLM1, and MIA-PaCa2 (ATCC number: CRL-1420) were obtained from Tohoku University Institute of Aging Medicine, Attached Medical Cell Resource Center. All of these cells are publicly available.
cDNAマイクロアレイを用いたPDACa細胞における過剰発現遺伝子の単離
cDNAマイクロアレイスライドの製作はすでに報告されている(Ono K, Tanaka T, Tsunoda T, Kitahara O, Kihara C, Okamoto A, Ochiai K, Takagi T, and Nakamura Y. Cancer Res., 60: 5007-5011, 2000)。各発現プロファイル分析について、実験的変動を減らすために、約23,040個のDNAスポットを含むcDNAマイクロアレイスライド二組を調製した。簡単に述べると、18例の膵臓癌組織からマイクロダイセクションしたPDACa細胞および正常膵管上皮から、総RNAを精製した。T7-based RNA増幅を行って、マイクロアレイ実験に十分なRNAを得た。PDACa細胞および正常管上皮からの増幅RNAアリコートを、逆転写によって、それぞれCy5-dCTPおよびCy3-dCTPで標識した(Amersham Biosciences)。ハイブリダイゼーション、洗浄、および検出は以前に記載されたように行った(Ono K, Tanaka T, Tsunoda T, Kitahara O, Kihara C, Okamoto A, Ochiai K, Takagi T, and Nakamura Y. Cancer Res., 60: 5007-5011, 2000)。次に、アップレギュレートしている遺伝子のうち、3種類の遺伝子PCDH1、CDH3、およびGPR107に的を絞ったが、それは50%を超える参考となる癌においてその発現比が5.0を超え、29の正常なヒト組織における本発明者らの以前の遺伝子発現データによると、主要な正常必須臓器におけるそれらの発現レベルが比較的低かったからである。(Saito-Hisaminato A, Katagiri T, Kakiuchi S, Nakamura T, Tsunoda T, Nakamura Y. Genome-wide profiling of gene expression in 29 normal human tissues with a cDNA microarray. DNA Res., 9: 35-45, 2002)。
Isolation of overexpressed genes in PDACa cells using cDNA microarray
Production of cDNA microarray slides has already been reported (Ono K, Tanaka T, Tsunoda T, Kitahara O, Kihara C, Okamoto A, Ochiai K, Takagi T, and Nakamura Y. Cancer Res., 60: 5007-5011, 2000). For each expression profile analysis, two sets of cDNA microarray slides containing about 23,040 DNA spots were prepared to reduce experimental variability. Briefly, total RNA was purified from PDACa cells and normal pancreatic ductal epithelium microdissected from 18 pancreatic cancer tissues. T7-based RNA amplification was performed to obtain sufficient RNA for microarray experiments. Amplified RNA aliquots from PDACa cells and normal ductal epithelium were labeled with Cy5-dCTP and Cy3-dCTP, respectively, by reverse transcription (Amersham Biosciences). Hybridization, washing, and detection were performed as previously described (Ono K, Tanaka T, Tsunoda T, Kitahara O, Kihara C, Okamoto A, Ochiai K, Takagi T, and Nakamura Y. Cancer Res., 60: 5007-5011, 2000). Next, among the up-regulated genes, we focused on three genes, PCDH1, CDH3, and GPR107, which had an expression ratio of more than 5.0 in more than 50% of the reference cancers, 29 This is because, according to our previous gene expression data in normal human tissues, their expression levels in major normal essential organs were relatively low. (Saito-Hisaminato A, Katagiri T, Kakiuchi S, Nakamura T, Tsunoda T, Nakamura Y. Genome-wide profiling of gene expression in 29 normal human tissues with a cDNA microarray.DNA Res., 9: 35-45, 2002) .
PCDH1およびCDH3の半定量RT-PCR
マイクロダイセクションしたPDACa細胞および正常膵管上皮細胞からのRNAを、T7-basedインビトロ転写(Epicentre Technologies)による2ラウンドの増幅にかけ、一本鎖cDNAに合成した。次のPCR増幅のために、それぞれの一本鎖cDNAの適切な希釈液を、定量対照としてβ-アクチン(ACTB)をモニタリングすることで調製した。本発明者らが使用したプライマー配列は、
PCDH1については、
5’-AGAAGGAGACCAAGGACCTGTAT-3’ (配列番号:7) および
5’-AGAACTTTATTGTCAGGGTCAAGG-3’ (配列番号:8)
CDH3については、
5’-CTGAAGGCGGCTAACACAGAC-3’ (配列番号:9) および
5’-TACACGATTGTCCTCACCCTTC-3’ (配列番号:10)
ACTBについては、
5’-CATCCACGAAACTACCTTCAACT-3’ (配列番号:11) および
5’-TCTCCTTAGAGAGAAGTGGGGTG-3’ (配列番号:12)
を使用した。全ての反応に、94℃2分間の初回変性、それに続く、94℃30秒間、58℃30秒間、および72℃1分間の21サイクル(ACTBの場合)または28〜32サイクル(PCDH1およびCDH3の場合)を、GeneAmp PCR system 9700 (PE Applied Biosystems)において行った。
Semi-quantitative RT-PCR of PCDH1 and CDH3
RNA from microdissected PDACa cells and normal pancreatic ductal epithelial cells was subjected to two rounds of amplification by T7-based in vitro transcription (Epicentre Technologies) and synthesized into single stranded cDNA. For subsequent PCR amplification, appropriate dilutions of each single stranded cDNA were prepared by monitoring β-actin (ACTB) as a quantitative control. The primer sequences used by the inventors are:
For PCDH1,
5'-AGAAGGAGACCAAGGACCTGTAT-3 '(SEQ ID NO: 7) and
5'-AGAACTTTATTGTCAGGGTCAAGG-3 '(SEQ ID NO: 8)
For CDH3,
5'-CTGAAGGCGGCTAACACAGAC-3 '(SEQ ID NO: 9) and
5'-TACACGATTGTCCTCACCCTTC-3 '(SEQ ID NO: 10)
About ACTB
5'-CATCCACGAAACTACCTTCAACT-3 '(SEQ ID NO: 11) and
5'-TCTCCTTAGAGAGAAGTGGGGTG-3 '(SEQ ID NO: 12)
It was used. All reactions include initial denaturation at 94 ° C for 2 minutes followed by 21 cycles at 94 ° C for 30 seconds, 58 ° C for 30 seconds, and 72 ° C for 1 minute (for ACTB) or 28-32 cycles (for PCDH1 and CDH3) ) Was performed on a GeneAmp PCR system 9700 (PE Applied Biosystems).
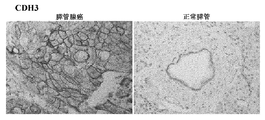
免疫組織化学
ホルマリンで固定し、パラフィンで包埋したPDACa切片を、CDH3発現用のマウス抗CDH3モノクローナル抗体(BD Transduction Laboratories)を用いて免疫染色した。抗原の回復のために、脱パラフィン組織切片を10mMクエン酸塩緩衝液,pH6.0に入れ、オートクレーブ内で15分間、108℃に加熱した。切片を、CDH3用一次抗体の1:10希釈液または1:100希釈液とそれぞれ、加湿チャンバー内で室温で1時間インキュベートし、ペルオキシダーゼ標識デキストランポリマーを使用し、次にジアミノベンジジン(DAKO Envision Plus System; DAKO Corporation, Carpinteria, CA)によって発色させた。切片をヘマトキシリンで対比染色した。負の対照のために、一次抗体を除いた。
Immunohistochemistry PDACa sections fixed in formalin and embedded in paraffin were immunostained using a mouse anti-CDH3 monoclonal antibody (BD Transduction Laboratories) for CDH3 expression. For antigen recovery, deparaffinized tissue sections were placed in 10 mM citrate buffer, pH 6.0 and heated to 108 ° C. for 15 minutes in an autoclave. Sections were incubated with a 1:10 or 1: 100 dilution of the primary antibody for CDH3 for 1 hour at room temperature in a humidified chamber, using peroxidase-labeled dextran polymer, then diaminobenzidine (DAKO Envision Plus System Developed by DAKO Corporation, Carpinteria, CA). Sections were counterstained with hematoxylin. For negative controls, primary antibody was omitted.
ノーザンブロット分析
前記のプライマーによって増幅された[α32P]dCTP標識PCR産物と、Human multiple-tissue Northern blots(Clontech)をハイブリダイズさせた。プレハイブリダイゼーション、ハイブリダイゼーション、および洗浄は製造業者の推奨に従って行った。増感スクリーンを用いて、ブロットを-80℃で5日間オートラジオグラフにかけた。
Northern blot analysis [α 32 P] dCTP-labeled PCR product amplified with the above primers was hybridized with Human multiple-tissue Northern blots (Clontech). Prehybridization, hybridization, and washing were performed according to the manufacturer's recommendations. Blots were autoradiographed at −80 ° C. for 5 days using an intensifying screen.
psiU6BXプラスミドの構築
siRNAをコードするDNA断片を、以下のプラスミド配列(配列番号:26)の(-)で示されたヌクレオチド485〜490のギャップに挿入した。
GACGGATCGGGAGATCTCCCGATCCCCTATGGTGCACTCTCAGTACAATCTGCTCTGGAT
CCACTAGTAACGGCCGCCAGTGTGCTGGAATTCGGCTTGGGGATCAGCGTTTGAGTAAGA
GCCCGCGTCTGAACCCTCCGCGCCGCCCCGGCCCCAGTGGAAAGACGCGCAGGCAAAACG
CACCACGTGACGGAGCGTGACCGCGCGCCGAGCGCGCGCCAAGGTCGGGCAGGAAGAGGG
CCTATTTCCCATGATTCCTTCATATTTGCATATACGATACAAGGCTGTTAGAGAGATAAT
TAGAATTAATTTGACTGTAAACACAAAGATATTAGTACAAAATACGTGACGTAGAAAGTA
ATAATTTCTTGGGTAGTTTGCAGTTTTAAAATTATGTTTTAAAATGGACTATCATATGCT
TACCGTAACTTGAAAGTATTTCGATTTCTTGGCTTTATATATCTTGTGGAAAGGACGAAA
CACC------TTTTTACATCAGGTTGTTTTTCTGTTTGGTTTTTTTTTTACACCACGTTT
ATACGCCGGTGCACGGTTTACCACTGAAAACACCTTTCATCTACAGGTGATATCTTTTAA
CACAAATAAAATGTAGTAGTCCTAGGAGACGGAATAGAAGGAGGTGGGGCCTAAAGCCGA
ATTCTGCAGATATCCATCACACTGGCGGCCGCTCGAGTGAGGCGGAAAGAACCAGCTGGG
GCTCTAGGGGGTATCCCCACGCGCCCTGTAGCGGCGCATTAAGCGCGGCGGGTGTGGTGG
TTACGCGCAGCGTGACCGCTACACTTGCCAGCGCCCTAGCGCCCGCTCCTTTCGCTTTCT
TCCCTTCCTTTCTCGCCACGTTCGCCGGCTTTCCCCGTCAAGCTCTAAATCGGGGGCTCC
CTTTAGGGTTCCGATTTAGTGCTTTACGGCACCTCGACCCCAAAAAACTTGATTAGGGTG
ATGGTTCACGTAGTGGGCCATCGCCCTGATAGACGGTTTTTCGCCCTTTGACGTTGGAGT
CCACGTTCTTTAATAGTGGACTCTTGTTCCAAACTGGAACAACACTCAACCCTATCTCGG
TCTATTCTTTTGATTTATAAGGGATTTTGCCGATTTCGGCCTATTGGTTAAAAAATGAGC
TGATTTAACAAAAATTTAACGCGAATTAATTCTGTGGAATGTGTGTCAGTTAGGGTGTGG
AAAGTCCCCAGGCTCCCCAGCAGGCAGAAGTATGCAAAGCATGCATCTCAATTAGTCAGC
AACCAGGTGTGGAAAGTCCCCAGGCTCCCCAGCAGGCAGAAGTATGCAAAGCATGCATCT
CAATTAGTCAGCAACCATAGTCCCGCCCCTAACTCCGCCCATCCCGCCCCTAACTCCGCC
CAGTTCCGCCCATTCTCCGCCCCATGGCTGACTAATTTTTTTTATTTATGCAGAGGCCGA
GGCCGCCTCTGCCTCTGAGCTATTCCAGAAGTAGTGAGGAGGCTTTTTTGGAGGCCTAGG
CTTTTGCAAAAAGCTCCCGGGAGCTTGTATATCCATTTTCGGATCTGATCAAGAGACAGG
ATGAGGATCGTTTCGCATGATTGAACAAGATGGATTGCACGCAGGTTCTCCGGCCGCTTG
GGTGGAGAGGCTATTCGGCTATGACTGGGCACAACAGACAATCGGCTGCTCTGATGCCGC
CGTGTTCCGGCTGTCAGCGCAGGGGCGCCCGGTTCTTTTTGTCAAGACCGACCTGTCCGG
TGCCCTGAATGAACTGCAGGACGAGGCAGCGCGGCTATCGTGGCTGGCCACGACGGGCGT
TCCTTGCGCAGCTGTGCTCGACGTTGTCACTGAAGCGGGAAGGGACTGGCTGCTATTGGG
CGAAGTGCCGGGGCAGGATCTCCTGTCATCTCACCTTGCTCCTGCCGAGAAAGTATCCAT
CATGGCTGATGCAATGCGGCGGCTGCATACGCTTGATCCGGCTACCTGCCCATTCGACCA
CCAAGCGAAACATCGCATCGAGCGAGCACGTACTCGGATGGAAGCCGGTCTTGTCGATCA
GGATGATCTGGACGAAGAGCATCAGGGGCTCGCGCCAGCCGAACTGTTCGCCAGGCTCAA
GGCGCGCATGCCCGACGGCGAGGATCTCGTCGTGACCCATGGCGATGCCTGCTTGCCGAA
TATCATGGTGGAAAATGGCCGCTTTTCTGGATTCATCGACTGTGGCCGGCTGGGTGTGGC
GGACCGCTATCAGGACATAGCGTTGGCTACCCGTGATATTGCTGAAGAGCTTGGCGGCGA
ATGGGCTGACCGCTTCCTCGTGCTTTACGGTATCGCCGCTCCCGATTCGCAGCGCATCGC
CTTCTATCGCCTTCTTGACGAGTTCTTCTGAGCGGGACTCTGGGGTTCGAAATGACCGAC
CAAGCGACGCCCAACCTGCCATCACGAGATTTCGATTCCACCGCCGCCTTCTATGAAAGG
TTGGGCTTCGGAATCGTTTTCCGGGACGCCGGCTGGATGATCCTCCAGCGCGGGGATCTC
ATGCTGGAGTTCTTCGCCCACCCCAACTTGTTTATTGCAGCTTATAATGGTTACAAATAA
AGCAATAGCATCACAAATTTCACAAATAAAGCATTTTTTTCACTGCATTCTAGTTGTGGT
TTGTCCAAACTCATCAATGTATCTTATCATGTCTGTATACCGTCGACCTCTAGCTAGAGC
TTGGCGTAATCATGGTCATAGCTGTTTCCTGTGTGAAATTGTTATCCGCTCACAATTCCA
CACAACATACGAGCCGGAAGCATAAAGTGTAAAGCCTGGGGTGCCTAATGAGTGAGCTAA
CTCACATTAATTGCGTTGCGCTCACTGCCCGCTTTCCAGTCGGGAAACCTGTCGTGCCAG
CTGCATTAATGAATCGGCCAACGCGCGGGGAGAGGCGGTTTGCGTATTGGGCGCTCTTCC
GCTTCCTCGCTCACTGACTCGCTGCGCTCGGTCGTTCGGCTGCGGCGAGCGGTATCAGCT
CACTCAAAGGCGGTAATACGGTTATCCACAGAATCAGGGGATAACGCAGGAAAGAACATG
TGAGCAAAAGGCCAGCAAAAGGCCAGGAACCGTAAAAAGGCCGCGTTGCTGGCGTTTTTC
CATAGGCTCCGCCCCCCTGACGAGCATCACAAAAATCGACGCTCAAGTCAGAGGTGGCGA
AACCCGACAGGACTATAAAGATACCAGGCGTTTCCCCCTGGAAGCTCCCTCGTGCGCTCT
CCTGTTCCGACCCTGCCGCTTACCGGATACCTGTCCGCCTTTCTCCCTTCGGGAAGCGTG
GCGCTTTCTCATAGCTCACGCTGTAGGTATCTCAGTTCGGTGTAGGTCGTTCGCTCCAAG
CTGGGCTGTGTGCACGAACCCCCCGTTCAGCCCGACCGCTGCGCCTTATCCGGTAACTAT
CGTCTTGAGTCCAACCCGGTAAGACACGACTTATCGCCACTGGCAGCAGCCACTGGTAAC
AGGATTAGCAGAGCGAGGTATGTAGGCGGTGCTACAGAGTTCTTGAAGTGGTGGCCTAAC
TACGGCTACACTAGAAGAACAGTATTTGGTATCTGCGCTCTGCTGAAGCCAGTTACCTTC
GGAAAAAGAGTTGGTAGCTCTTGATCCGGCAAACAAACCACCGCTGGTAGCGGTTTTTTT
GTTTGCAAGCAGCAGATTACGCGCAGAAAAAAAGGATCTCAAGAAGATCCTTTGATCTTT
TCTACGGGGTCTGACGCTCAGTGGAACGAAAACTCACGTTAAGGGATTTTGGTCATGAGA
TTATCAAAAAGGATCTTCACCTAGATCCTTTTAAATTAAAAATGAAGTTTTAAATCAATC
TAAAGTATATATGAGTAAACTTGGTCTGACAGTTACCAATGCTTAATCAGTGAGGCACCT
ATCTCAGCGATCTGTCTATTTCGTTCATCCATAGTTGCCTGACTCCCCGTCGTGTAGATA
ACTACGATACGGGAGGGCTTACCATCTGGCCCCAGTGCTGCAATGATACCGCGAGACCCA
CGCTCACCGGCTCCAGATTTATCAGCAATAAACCAGCCAGCCGGAAGGGCCGAGCGCAGA
AGTGGTCCTGCAACTTTATCCGCCTCCATCCAGTCTATTAATTGTTGCCGGGAAGCTAGA
GTAAGTAGTTCGCCAGTTAATAGTTTGCGCAACGTTGTTGCCATTGCTACAGGCATCGTG
GTGTCACGCTCGTCGTTTGGTATGGCTTCATTCAGCTCCGGTTCCCAACGATCAAGGCGA
GTTACATGATCCCCCATGTTGTGCAAAAAAGCGGTTAGCTCCTTCGGTCCTCCGATCGTT
GTCAGAAGTAAGTTGGCCGCAGTGTTATCACTCATGGTTATGGCAGCACTGCATAATTCT
CTTACTGTCATGCCATCCGTAAGATGCTTTTCTGTGACTGGTGAGTACTCAACCAAGTCA
TTCTGAGAATAGTGTATGCGGCGACCGAGTTGCTCTTGCCCGGCGTCAATACGGGATAAT
ACCGCGCCACATAGCAGAACTTTAAAAGTGCTCATCATTGGAAAACGTTCTTCGGGGCGA
AAACTCTCAAGGATCTTACCGCTGTTGAGATCCAGTTCGATGTAACCCACTCGTGCACCC
AACTGATCTTCAGCATCTTTTACTTTCACCAGCGTTTCTGGGTGAGCAAAAACAGGAAGG
CAAAATGCCGCAAAAAAGGGAATAAGGGCGACACGGAAATGTTGAATACTCATACTCTTC
CTTTTTCAATATTATTGAAGCATTTATCAGGGTTATTGTCTCATGAGCGGATACATATTT
GAATGTATTTAGAAAAATAAACAAATAGGGGTTCCGCGCACATTTCCCCGAAAAGTGCCA
CCTGACGTC
Construction of psiU6BX plasmid
A DNA fragment encoding siRNA was inserted into the gap of nucleotides 485 to 490 indicated by (−) in the following plasmid sequence (SEQ ID NO: 26).
GACGGATCGGGAGATCTCCCGATCCCCTATGGTGCACTCTCAGTACAATCTGCTCTGGAT
CCACTAGTAACGGCCGCCAGTGTGCTGGAATTCGGCTTGGGGATCAGCGTTTGAGTAAGA
GCCCGCGTCTGAACCCTCCGCGCCGCCCCGGCCCCAGTGGAAAGACGCGCAGGCAAAACG
CACCACGTGACGGAGCGTGACCGCGCGCCGAGCGCGCGCCAAGGTCGGGCAGGAAGAGGG
CCTATTTCCCATGATTCCTTCATATTTGCATATACGATACAAGGCTGTTAGAGAGATAAT
TAGAATTAATTTGACTGTAAACACAAAGATATTAGTACAAAATACGTGACGTAGAAAGTA
ATAATTTCTTGGGTAGTTTGCAGTTTTAAAATTATGTTTTAAAATGGACTATCATATGCT
TACCGTAACTTGAAAGTATTTCGATTTCTTGGCTTTATATATCTTGTGGAAAGGACGAAA
CACC ------ TTTTTACATCAGGTTGTTTTTCTGTTTGGTTTTTTTTTTACACCACGTTT
ATACGCCGGTGCACGGTTTACCACTGAAAACACCTTTCATCTACAGGTGATATCTTTTAA
CACAAATAAAATGTAGTAGTCCTAGGAGACGGAATAGAAGGAGGTGGGGCCTAAAGCCGA
ATTCTGCAGATATCCATCACACTGGCGGCCGCTCGAGTGAGGCGGAAAGAACCAGCTGGG
GCTCTAGGGGGTATCCCCACGCGCCCTGTAGCGGCGCATTAAGCGCGGCGGGTGTGGTGG
TTACGCGCAGCGTGACCGCTACACTTGCCAGCGCCCTAGCGCCCGCTCCTTTCGCTTTCT
TCCCTTCCTTTCTCGCCACGTTCGCCGGCTTTCCCCGTCAAGCTCTAAATCGGGGGCTCC
CTTTAGGGTTCCGATTTAGTGCTTTACGGCACCTCGACCCCAAAAAACTTGATTAGGGTG
ATGGTTCACGTAGTGGGCCATCGCCCTGATAGACGGTTTTTCGCCCTTTGACGTTGGAGT
CCACGTTCTTTAATAGTGGACTCTTGTTCCAAACTGGAACAACACTCAACCCTATCTCGG
TCTATTCTTTTGATTTATAAGGGATTTTGCCGATTTCGGCCTATTGGTTAAAAAATGAGC
TGATTTAACAAAAATTTAACGCGAATTAATTCTGTGGAATGTGTGTCAGTTAGGGTGTGG
AAAGTCCCCAGGCTCCCCAGCAGGCAGAAGTATGCAAAGCATGCATCTCAATTAGTCAGC
AACCAGGTGTGGAAAGTCCCCAGGCTCCCCAGCAGGCAGAAGTATGCAAAGCATGCATCT
CAATTAGTCAGCAACCATAGTCCCGCCCCTAACTCCGCCCATCCCGCCCCTAACTCCGCC
CAGTTCCGCCCATTCTCCGCCCCATGGCTGACTAATTTTTTTTATTTATGCAGAGGCCGA
GGCCGCCTCTGCCTCTGAGCTATTCCAGAAGTAGTGAGGAGGCTTTTTTGGAGGCCTAGG
CTTTTGCAAAAAGCTCCCGGGAGCTTGTATATCCATTTTCGGATCTGATCAAGAGACAGG
ATGAGGATCGTTTCGCATGATTGAACAAGATGGATTGCACGCAGGTTCTCCGGCCGCTTG
GGTGGAGAGGCTATTCGGCTATGACTGGGCACAACAGACAATCGGCTGCTCTGATGCCGC
CGTGTTCCGGCTGTCAGCGCAGGGGCGCCCGGTTCTTTTTGTCAAGACCGACCTGTCCGG
TGCCCTGAATGAACTGCAGGACGAGGCAGCGCGGCTATCGTGGCTGGCCACGACGGGCGT
TCCTTGCGCAGCTGTGCTCGACGTTGTCACTGAAGCGGGAAGGGACTGGCTGCTATTGGG
CGAAGTGCCGGGGCAGGATCTCCTGTCATCTCACCTTGCTCCTGCCGAGAAAGTATCCAT
CATGGCTGATGCAATGCGGCGGCTGCATACGCTTGATCCGGCTACCTGCCCATTCGACCA
CCAAGCGAAACATCGCATCGAGCGAGCACGTACTCGGATGGAAGCCGGTCTTGTCGATCA
GGATGATCTGGACGAAGAGCATCAGGGGCTCGCGCCAGCCGAACTGTTCGCCAGGCTCAA
GGCGCGCATGCCCGACGGCGAGGATCTCGTCGTGACCCATGGCGATGCCTGCTTGCCGAA
TATCATGGTGGAAAATGGCCGCTTTTCTGGATTCATCGACTGTGGCCGGCTGGGTGTGGC
GGACCGCTATCAGGACATAGCGTTGGCTACCCGTGATATTGCTGAAGAGCTTGGCGGCGA
ATGGGCTGACCGCTTCCTCGTGCTTTACGGTATCGCCGCTCCCGATTCGCAGCGCATCGC
CTTCTATCGCCTTCTTGACGAGTTCTTCTGAGCGGGACTCTGGGGTTCGAAATGACCGAC
CAAGCGACGCCCAACCTGCCATCACGAGATTTCGATTCCACCGCCGCCTTCTATGAAAGG
TTGGGCTTCGGAATCGTTTTCCGGGACGCCGGCTGGATGATCCTCCAGCGCGGGGATCTC
ATGCTGGAGTTCTTCGCCCACCCCAACTTGTTTATTGCAGCTTATAATGGTTACAAATAA
AGCAATAGCATCACAAATTTCACAAATAAAGCATTTTTTTCACTGCATTCTAGTTGTGGT
TTGTCCAAACTCATCAATGTATCTTATCATGTCTGTATACCGTCGACCTCTAGCTAGAGC
TTGGCGTAATCATGGTCATAGCTGTTTCCTGTGTGAAATTGTTATCCGCTCACAATTCCA
CACAACATACGAGCCGGAAGCATAAAGTGTAAAGCCTGGGGTGCCTAATGAGTGAGCTAA
CTCACATTAATTGCGTTGCGCTCACTGCCCGCTTTCCAGTCGGGAAACCTGTCGTGCCAG
CTGCATTAATGAATCGGCCAACGCGCGGGGAGAGGCGGTTTGCGTATTGGGCGCTCTTCC
GCTTCCTCGCTCACTGACTCGCTGCGCTCGGTCGTTCGGCTGCGGCGAGCGGTATCAGCT
CACTCAAAGGCGGTAATACGGTTATCCACAGAATCAGGGGATAACGCAGGAAAGAACATG
TGAGCAAAAGGCCAGCAAAAGGCCAGGAACCGTAAAAAGGCCGCGTTGCTGGCGTTTTTC
CATAGGCTCCGCCCCCCTGACGAGCATCACAAAAATCGACGCTCAAGTCAGAGGTGGCGA
AACCCGACAGGACTATAAAGATACCAGGCGTTTCCCCCTGGAAGCTCCCTCGTGCGCTCT
CCTGTTCCGACCCTGCCGCTTACCGGATACCTGTCCGCCTTTCTCCCTTCGGGAAGCGTG
GCGCTTTCTCATAGCTCACGCTGTAGGTATCTCAGTTCGGTGTAGGTCGTTCGCTCCAAG
CTGGGCTGTGTGCACGAACCCCCCGTTCAGCCCGACCGCTGCGCCTTATCCGGTAACTAT
CGTCTTGAGTCCAACCCGGTAAGACACGACTTATCGCCACTGGCAGCAGCCACTGGTAAC
AGGATTAGCAGAGCGAGGTATGTAGGCGGTGCTACAGAGTTCTTGAAGTGGTGGCCTAAC
TACGGCTACACTAGAAGAACAGTATTTGGTATCTGCGCTCTGCTGAAGCCAGTTACCTTC
GGAAAAAGAGTTGGTAGCTCTTGATCCGGCAAACAAACCACCGCTGGTAGCGGTTTTTTT
GTTTGCAAGCAGCAGATTACGCGCAGAAAAAAAGGATCTCAAGAAGATCCTTTGATCTTT
TCTACGGGGTCTGACGCTCAGTGGAACGAAAACTCACGTTAAGGGATTTTGGTCATGAGA
TTATCAAAAAGGATCTTCACCTAGATCCTTTTAAATTAAAAATGAAGTTTTAAATCAATC
TAAAGTATATATGAGTAAACTTGGTCTGACAGTTACCAATGCTTAATCAGTGAGGCACCT
ATCTCAGCGATCTGTCTATTTCGTTCATCCATAGTTGCCTGACTCCCCGTCGTGTAGATA
ACTACGATACGGGAGGGCTTACCATCTGGCCCCAGTGCTGCAATGATACCGCGAGACCCA
CGCTCACCGGCTCCAGATTTATCAGCAATAAACCAGCCAGCCGGAAGGGCCGAGCGCAGA
AGTGGTCCTGCAACTTTATCCGCCTCCATCCAGTCTATTAATTGTTGCCGGGAAGCTAGA
GTAAGTAGTTCGCCAGTTAATAGTTTGCGCAACGTTGTTGCCATTGCTACAGGCATCGTG
GTGTCACGCTCGTCGTTTGGTATGGCTTCATTCAGCTCCGGTTCCCAACGATCCAAGGCGA
GTTACATGATCCCCCATGTTGTGCAAAAAAGCGGTTAGCTCCTTCGGTCCTCCGATCGTT
GTCAGAAGTAAGTTGGCCGCAGTGTTATCACTCATGGTTATGGCAGCACTGCATAATTCT
CTTACTGTCATGCCATCCGTAAGATGCTTTTCTGTGACTGGTGAGTACTCAACCAAGTCA
TTCTGAGAATAGTGTATGCGGCGACCGAGTTGCTCTTGCCCGGCGTCAATACGGGATAAT
ACCGCGCCACATAGCAGAACTTTAAAAGTGCTCATCATTGGAAAACGTTCTTCGGGGCGA
AAACTCTCAAGGATCTTACCGCTGTTGAGATCCAGTTCGATGTAACCCACTCGTGCACCC
AACTGATCTTCAGCATCTTTTACTTTCACCAGCGTTTCTGGGTGAGCAAAAACAGGAAGG
CAAAATGCCGCAAAAAAGGGAATAAGGGCGACACGGAAATGTTGAATACTCATACTCTTC
CTTTTTCAATATTATTGAAGCATTTATCAGGGTTATTGTCTCATGAGCGGATACATATTT
GAATGTATTTAGAAAAATAAACAAATAGGGGTTCCGCGCACATTTCCCCGAAAAGTGCCA
CCTGACGTC
snRNA U6遺伝子はRNAポリメラーゼIIIによって転写され、3'末端にウリジンを有する短い転写物を生じることが報告されている。プロモーター領域を含むsnRNA U6遺伝子のゲノム断片を、一組のプライマー:
5'-GGGGATCAGCGTTTGAGTAA-3' (配列番号:27)、および
5'-TAGGCCCCACCTCCTTCTAT-3' (配列番号:28)
ならびに鋳型としてヒト胎盤DNAを用いてPCR増幅した。産物を精製し、TAクローニングキットを供給業者(Invitrogen)のプロトコールに従って使用し、pCRプラスミドベクターにクローニングした。一組のプライマー:
5'-TGCGGATCCAGAGCAGATTGTACTGAGAGT-3' (配列番号:29)および
5'-CTCTATCTCGAGTGAGGCGGAAAGAACCA-3' (配列番号:30)
を用いてPCR増幅したsnRNA U6遺伝子を含むBamHI,XhoI断片を精製し、pcDNA3.1(+)プラスミドのヌクレオチド1257位から56位の断片にクローニングした。連結されたDNAを、プライマー:
5'-TTTAAGCTTGAAGACTATTTTTACATCAGGTTGTTTTTCT-3' (配列番号:31)および
5'-TTTAAGCTTGAAGACACGGTGTTTCGTCCTTTCCACA-3' (配列番号:32)
を使用するPCRの鋳型として使用した。産物をHindIIIで消化し、その後に自己連結させて、psiU6BXベクタープラスミドを生成した。対照として、
5'-CACCGAAGCAGCACGACTTCTTCTTCAAGAGAGAAGAAGTCGTGCTGCTTC-3'(配列番号:33)および
5'-AAAAGAAGCAGCACGACTTCTTCTCTCTTGAAGAAGAAGTCGTGCTGCTTC-3'(配列番号:34)
からなる二本鎖オリゴヌクレオチドをpsiU6BXベクターのBbsI部位にクローニングすることによって、psiU6BX-EGFPを調製した。
The snRNA U6 gene has been reported to be transcribed by RNA polymerase III, resulting in a short transcript with a uridine at the 3 'end. A set of primers comprising a genomic fragment of the snRNA U6 gene containing the promoter region:
5'-GGGGATCAGCGTTTGAGTAA-3 '(SEQ ID NO: 27), and
5'-TAGGCCCCACCTCCTTCTAT-3 '(SEQ ID NO: 28)
PCR amplification was also performed using human placental DNA as a template. The product was purified and cloned into a pCR plasmid vector using a TA cloning kit according to the supplier's (Invitrogen) protocol. A set of primers:
5'-TGCGGATCCAGAGCAGATTGTACTGAGAGT-3 '(SEQ ID NO: 29) and
5'-CTCTATCTCGAGTGAGGCGGAAAGAACCA-3 '(SEQ ID NO: 30)
A BamHI, XhoI fragment containing the snRNA U6 gene amplified by PCR was purified and cloned into a fragment from nucleotide positions 1257 to 56 of pcDNA3.1 (+) plasmid. Ligated DNA, primer:
5'-TTTAAGCTTGAAGACTATTTTTACATCAGGTTGTTTTTCT-3 '(SEQ ID NO: 31) and
5'-TTTAAGCTTGAAGACACGGTGTTTCGTCCTTTCCACA-3 '(SEQ ID NO: 32)
Was used as a template for PCR. The product was digested with HindIII and then self-ligated to generate the psiU6BX vector plasmid. As a control,
5'-CACCGAAGCAGCACGACTTCTTCTTCAAGAGAGAAGAAGTCGTGCTGCTTC-3 '(SEQ ID NO: 33) and
5'-AAAAGAAGCAGCACGACTTCTTCTCTCTTGAAGAAGAAGTCGTGCTGCTTC-3 '(SEQ ID NO: 34)
The psiU6BX-EGFP was prepared by cloning the double stranded oligonucleotide consisting of into the BbsI site of the psiU6BX vector.
siRNA発現構築物
siRNAのヌクレオチド配列は、Ambionのウェブサイト(http://www.ambion.com/techlib/misc/siRNA_finder.html)から入手可能なsiRNA設計コンピュータプログラムを用いて設計した。簡単に述べると、siRNA合成用のヌクレオチド配列は、以下のプロトコールを用いて選択される。
siRNA expression constructs
The nucleotide sequence of siRNA was designed using the siRNA design computer program available from the Ambion website (http://www.ambion.com/techlib/misc/siRNA_finder.html). Briefly, the nucleotide sequence for siRNA synthesis is selected using the following protocol.
siRNA標的部位の選択:
1.各遺伝子の転写物の開始コドンAUGから開始して、下流にあるAAジヌクレオチド配列をスキャンする。siRNA標的候補部位として、AAおよび3'側隣接19ヌクレオチドの各々の出現を記録する。Tuschlらは、5'および3'非翻訳領域(UTR)ならびに開始コドン付近の(75塩基以内の)領域は調節タンパク質結合部位を多く含んでいる可能性があるので、これらに対するsiRNAを設計しないように勧めていない。UTR結合タンパク質および/または翻訳開始複合体はsiRNAエンドヌクレアーゼ複合体の結合を妨げる可能性がある。
siRNA target site selection:
1. Scan downstream AA dinucleotide sequences starting from the start codon AUG of each gene transcript. Record the occurrence of AA and 3 ′ adjacent 19 nucleotides as siRNA target candidate sites. Tuschl et al. Do not design siRNAs for the 5 'and 3' untranslated regions (UTR) and the region near the start codon (within 75 bases), which may contain many regulatory protein binding sites. Not recommended for. UTR binding proteins and / or translation initiation complexes may interfere with the binding of the siRNA endonuclease complex.
2.標的候補部位と適切なゲノムデータベース(ヒト、マウス、ラットなど)を比較して、他のコード配列と有意な相同性を有する標的配列を除く。 2. Compare target candidate sites with appropriate genomic databases (human, mouse, rat, etc.) and remove target sequences that have significant homology with other coding sequences.
3.合成に適した標的配列を選択する。遺伝子の長さに応じていくつかの標的配列を評価のために選択する。PCDH1 siRNA、CDH3 siRNA、またはGPR107 siRNAに用いられるオリゴヌクレオチドを以下に示す。それぞれのオリゴヌクレオチドは、この標的配列のセンスヌクレオチド配列とアンチセンスヌクレオチド配列との組み合わせである。ヘアピンループ構造および標的配列のヌクレオチド配列を、それぞれ、配列番号:19から配列番号:21、および配列番号:22から配列番号:24に示した(それぞれのヘアピンループ構造配列からエンドヌクレアーゼ認識部位を除いた)。 3. Select a target sequence suitable for synthesis. Depending on the length of the gene, several target sequences are selected for evaluation. The oligonucleotides used for PCDH1 siRNA, CDH3 siRNA, or GPR107 siRNA are shown below. Each oligonucleotide is a combination of a sense nucleotide sequence and an antisense nucleotide sequence of this target sequence. The nucleotide sequences of the hairpin loop structure and the target sequence are shown in SEQ ID NO: 19 to SEQ ID NO: 21, and SEQ ID NO: 22 to SEQ ID NO: 24, respectively (excluding the endonuclease recognition site from each hairpin loop structure sequence. )
PCDH1用のsiRNA発現ベクターの挿入配列
410si:
5’-CACCGACATCAATGACAACACACTTCAAGAGAGTGTGTTGTCATTGATGTC-3’ (配列番号: 13) および
5’-AAAAGACATCAATGACAACACACTCTCTTGAAGTGTGTTGTCATTGATGTC-3’ (配列番号: 14)
CDH3用のsiRNA発現ベクターの挿入配列
si24:
5’-CACCGGAGACAGGCTGGTTGTTGTTCAAGAGACAACAACCAGCCTGTCTCC-3’ (配列番号: 15) および
5’-AAAAGGAGACAGGCTGGTTGTTGTCTCTTGAACAACAACCAGCCTGTCTCC-3’ (配列番号: 16)
GPR107用のsiRNA発現ベクターの挿入配列
1003si:
5’-CACCGTGGCTCTACCAGCTCCTGTTCAAGAGACAGGAGCTGGTAGAGCCAC-3’ (配列番号: 17) および
5’-AAAAGTGGCTCTACCAGCTCCTGTCTCTTGAACAGGAGCTGGTAGAGCCAC-3’ (配列番号: 18)
対照用のsiRNA発現ベクターの挿入配列
EGFPsi: (対照)
5’- CACCGAAGCAGCACGACTTCTTCTTCAAGAGAGAAGAAGTCGTGCTGCTTC -3’ (配列番号: 33) および
5’-AAAAGAAGCAGCACGACTTCTTCTCTCTTGAAGAAGAAGTCGTGCTGCTTC-3’ (配列番号: 34)
Insertion sequence of siRNA expression vector for PCDH1
410si:
5'-CACCGACATCAATGACAACACACTTCAAGAGAGTGTGTTGTCATTGATGTC-3 '(SEQ ID NO: 13) and
5'-AAAAGACATCAATGACAACACACTCTCTTGAAGTGTGTTGTCATTGATGTC-3 '(SEQ ID NO: 14)
Insertion sequence of siRNA expression vector for CDH3
si24:
5'-CACCGGAGACAGGCTGGTTGTTGTTCAAGAGACAACAACCAGCCTGTCTCC-3 '(SEQ ID NO: 15) and
5'-AAAAGGAGACAGGCTGGTTGTTGTCTCTTGAACAACAACCAGCCTGTCTCC-3 '(SEQ ID NO: 16)
Insertion sequence of siRNA expression vector for GPR107
1003si:
5'-CACCGTGGCTCTACCAGCTCCTGTTCAAGAGACAGGAGCTGGTAGAGCCAC-3 '(SEQ ID NO: 17) and
5'-AAAAGTGGCTCTACCAGCTCCTGTCTCTTGAACAGGAGCTGGTAGAGCCAC-3 '(SEQ ID NO: 18)
Insertion sequence of control siRNA expression vector
EGFPsi: (control)
5'- CACCGAAGCAGCACGACTTCTTCTTCAAGAGAGAAGAAGTCGTGCTGCTTC -3 '(SEQ ID NO: 33) and
5'-AAAAGAAGCAGCACGACTTCTTCTCTCTTGAAGAAGAAGTCGTGCTGCTTC-3 '(SEQ ID NO: 34)
それぞれの配列の配列番号を表1に列挙した。
コロニー形成/MTTアッセイ
ヒトPDACa細胞株PK45P、KLM1、およびMIA-PaCa2を10cmディッシュ(5X105細胞/ディッシュ)にプレートし、Lipofectamine 2000(Invitrogen)またはFuGENE6(Roche)を使用し、製造業者の説明書に従って、EGFP標的配列(EGFP)を含むpsiU6BXおよび標的配列を含むpsiU6BXでトランスフェクトした。細胞を500mg/mlジェネティシンで1週間選択し、予備の細胞をトランスフェクションの48時間後に採取し、PCDH1、CDH3、およびGPR107に及ぼすノックダウン効果を確認するためにRT-PCRで分析した。RT-PCRのプライマーは前記で述べたものと同じであった。これらの細胞もそれぞれ、コロニー形成を評価するためにギムザ液で染色し、細胞数を評価するためにMTTアッセイを行った。
Colony formation / MTT assay Human PDACa cell lines PK45P, KLM1, and MIA-PaCa2 are plated into 10cm dishes (5X10 5 cells / dish), using Lipofectamine 2000 (Invitrogen) or FuGENE6 (Roche), manufacturer's instructions And psiU6BX containing the EGFP target sequence (EGFP) and psiU6BX containing the target sequence. Cells were selected with 500 mg / ml geneticin for 1 week and spare cells were harvested 48 hours after transfection and analyzed by RT-PCR to confirm knockdown effects on PCDH1, CDH3, and GPR107. RT-PCR primers were the same as described above. Each of these cells was also stained with Giemsa solution to assess colony formation, and an MTT assay was performed to assess cell number.
[実施例2]
siRNAによるPCDH1、CDH3、またはGPR107遺伝子の発現低下および癌細胞の増殖抑制
これまでの研究において、レーザーマイクロダイセクションと、27,000の遺伝子がスポットされているゲノムワイドcDNAマイクロアレイを組み合わせることによって、PDACaの正確な発現プロファイルが作成された。本発明者らは、PDACaの起源と考えられた正常膵管上皮の発現パターンと比較して、PDACa細胞においてアップレギュレートしている遺伝子として、200を超える遺伝子を同定した(Nakamura T, Furukawa Y, Nakagawa H, Tsunoda T, Ohigashi H, Murata K, Ishikawa O, Ohgaki, Kashimura N, Miyamoto M, Hirano S, Kondo S, Katoh H, Nakamura Y, and Katagiri T. Genome-wide cDNA microarray analysis of gene-expression profiles in pancreatic cancers using populations of tumor cells and normal ductal epithelium cells selected for purity by laser microdissection. Oncogene, 2004 Feb 9, Epub ahead of print)。これらのPDACa細胞発現プロファイルに基づいて、本発明者らは3種類の過剰発現遺伝子を選択し、マイクロダイセクションされたPDACa細胞からのcDNAを用いたRT-PCR(図1A,B)または免疫組織化学(図2)によって、PCDH1およびCDH3はPDACaにおいて過剰発現していることが確認された。
[Example 2]
Reduced expression of PCDH1, CDH3, or GPR107 gene and suppression of cancer cell growth by siRNA In previous studies, the accuracy of PDACa was determined by combining laser microdissection with a genome-wide cDNA microarray spotted with 27,000 genes. An expression profile was created. The present inventors identified more than 200 genes as up-regulated genes in PDACa cells as compared to the expression pattern of normal pancreatic duct epithelium thought to be the origin of PDACa (Nakamura T, Furukawa Y, Nakagawa H, Tsunoda T, Ohigashi H, Murata K, Ishikawa O, Ohgaki, Kashimura N, Miyamoto M, Hirano S, Kondo S, Katoh H, Nakamura Y, and Katagiri T. Genome-wide cDNA microarray analysis of gene-expression profiles in pancreatic cancers using populations of tumor cells and normal ductal epithelium cells selected for purity by laser microdissection. Oncogene, 2004 Feb 9, Epub ahead of print). Based on these PDACa cell expression profiles, we selected three overexpressed genes, RT-PCR using cDNA from microdissectioned PDACa cells (Figure 1A, B) or immune tissue Chemistry (Figure 2) confirmed that PCDH1 and CDH3 were overexpressed in PDACa.
(1)PCDH1(プロトカドヘリン1)(GenBankアクセッション番号NM_002587;配列番号1、2)
PDACa細胞に及ぼすPCDH1の増殖効果または生存効果を調べるために、本発明者らは、哺乳動物ベクターをベースとするRNA干渉(RNAi)法によって、PDACa細胞株におけるPCDH1の内因性発現を特異的にノックダウンした。PCDH1は、ノーザンブロット分析(図3A)において示したように、正常な心臓、胎盤、前立腺において無制限に発現している。主要な必須臓器における発現は豊富でなく、このことは、これらの分子を標的とすることにより人体にはほとんど毒性を示さないことを示唆している。
(1) PCDH1 (protocadherin 1) (GenBank accession number NM_002587; SEQ ID NOs: 1 and 2)
In order to investigate the proliferation or survival effect of PCDH1 on PDACa cells, we specifically investigated endogenous expression of PCDH1 in PDACa cell lines by mammalian vector-based RNA interference (RNAi) method. Knocked down. PCDH1 is expressed indefinitely in normal heart, placenta, and prostate as shown in Northern blot analysis (FIG. 3A). Expression in the major essential organs is not abundant, suggesting that targeting these molecules shows little toxicity to the human body.
siRNA産生ベクターのトランスフェクションによって、PCDH1用に設計されたsiRNA、410siにおいて、内因性発現が明らかに低下した(図4A)。siRNAによる、PCDH1 mRNAに及ぼす、このノックダウン効果は、コロニー形成アッセイ(図4B)およびMTTアッセイ(図4C)における著しい増殖抑制をもたらした。これらの発見から、PDACa細胞におけるPCDH1の過剰発現は癌細胞生存能と関連していることが強く示唆された。PCDH1および他のプロトカドヘリンは、そのカドヘリンドメインによって細胞表面上での同種親和性の相互作用を有し、細胞骨格コンホメーション、細胞運動、または細胞増殖のための細胞間シグナル伝達を調節することが裏付けられている(Sano K, Tanihara H, Heimark RL, Obata S, Davidson M, St John T, Taketani S, Suzuki S. Protocadherins: a large family of cadherin-related molecules in central nervous system. EMBO J., 12:2249-56, 1993, Frank M, and Kemler R. Protocadherins. Curr Opin Cell Biol., 14:557-62, 2002.)。本発明者らのデータによれば、PCDH1は、細胞間接着におけるその同種親和性の相互作用を介して、膵臓癌細胞増殖の正のシグナルを調節している可能性が高い。 Transfection of the siRNA production vector clearly reduced the endogenous expression in the siRNA designed for PCDH1, 410si (FIG. 4A). This knock-down effect on PCDH1 mRNA by siRNA resulted in significant growth inhibition in colony formation assay (FIG. 4B) and MTT assay (FIG. 4C). These findings strongly suggested that overexpression of PCDH1 in PDACa cells is associated with cancer cell viability. PCDH1 and other protocadherins have homophilic interactions on the cell surface through their cadherin domains and regulate intercellular signaling for cytoskeletal conformation, cell motility, or cell proliferation (Sano K, Tanihara H, Heimark RL, Obata S, Davidson M, St John T, Taketani S, Suzuki S. Protocadherins: a large family of cadherin-related molecules in central nervous system.EMBO J., 12: 2249-56, 1993, Frank M, and Kemler R. Protocadherins. Curr Opin Cell Biol., 14: 557-62, 2002.). According to our data, PCDH1 is likely to regulate the positive signal of pancreatic cancer cell growth through its allophilic interaction in cell-cell adhesion.
(2)CDH3(P-カドヘリン)(GenBankアクセッション番号NM_001793;配列番号3,4)
本発明者らは、RT-PCR(図1B)および免疫組織化学(図2)によってPDACa細胞におけるCDH3過剰発現を確認し、またマイクロアレイデータおよびRT-PCR(図1B)によれば、CDH3の過剰発現は、本発明者らのPDACaプロファイルにおける200を超えるアップレギュレート遺伝子の中で最も優勢なパターンの1つであった。CDH3は、ノーザンブロット分析(図3B)に示されたように、正常な胸腺、前立腺、卵巣、気管において無制限に発現している。これは主要な必須臓器における発現は豊富ではなく、このことは、これらの分子の標的化がヒト身体での毒性につながらないと予想されることを示唆している。
(2) CDH3 (P-cadherin) (GenBank accession number NM_001793; SEQ ID NOs: 3, 4)
We confirmed CDH3 overexpression in PDACa cells by RT-PCR (Figure 1B) and immunohistochemistry (Figure 2), and according to microarray data and RT-PCR (Figure 1B), CDH3 overexpression. Expression was one of the most prevalent patterns among over 200 up-regulated genes in our PDACa profile. CDH3 is expressed indefinitely in normal thymus, prostate, ovary, and trachea, as shown by Northern blot analysis (FIG. 3B). This is not rich in expression in major essential organs, suggesting that targeting these molecules is not expected to lead to toxicity in the human body.
PDACa細胞に及ぼすCDH3の増殖効果または生存効果を調べるために、本発明者らは、哺乳動物ベクターをベースとするRNA干渉(RNAi)法によって、PDACa細胞株におけるCDH3の内因性発現を特異的にノックダウンした。siRNA産生ベクターのトランスフェクションによって、CDH3用に設計されたsiRNA、si24において、内因性発現が明らかに低下した(図5A)。siRNAによる、CDH3 mRNAに及ぼす、このノックダウン効果は、コロニー形成アッセイ(図5B)およびMTTアッセイ(図5C)における著しい増殖抑制をもたらした。これらの発見から、PDACa細胞におけるCDH3の過剰発現は癌細胞生存能ならびに細胞間相互作用と関連し、この分子は、細胞間相互作用からのシグナル伝達に関与している可能性があることが強く示唆された。PDACaは悪性度が極めて高く、PDACaにおけるCDH3の高発現は、その悪性度および転移能とも関連している可能性がある。 In order to investigate the proliferative or survival effect of CDH3 on PDACa cells, we specifically investigated the endogenous expression of CDH3 in PDACa cell lines by a mammalian vector-based RNA interference (RNAi) method. Knocked down. Transfection of the siRNA production vector clearly reduced endogenous expression in the siRNA designed for CDH3, si24 (FIG. 5A). This knockdown effect on CDH3 mRNA by siRNA resulted in significant growth inhibition in colony formation assay (FIG. 5B) and MTT assay (FIG. 5C). These findings indicate that CDH3 overexpression in PDACa cells is associated with cancer cell viability and cell-cell interactions, and this molecule is strongly likely to be involved in signal transduction from cell-cell interactions. It was suggested. PDACa is extremely malignant, and high expression of CDH3 in PDACa may be related to its malignancy and metastatic potential.
(3)GPR107(Gタンパク質共役受容体107)(GenBankアクセッション番号AB046844;配列番号5,6)
本発明者らは、機能とリガンドが未知のこのオーファンGPCRを膵臓癌の標的として同定した。GPR107は、ノーザンブロット分析(図3C)において示されたように、正常な心臓、胎盤、骨格筋、精巣、卵巣、脊髄において無制限に発現している。PDACa細胞に及ぼすGPR107の増殖効果または生存効果を調べるために、本発明者らは、siRNAによって、PDACa細胞株におけるGPR107の内因性発現を特異的にノックダウンした。siRNA産生ベクターのトランスフェクションによって、GPR107用に設計されたsiRNA、1003siにおいて内因性発現が明らかに低下した(図6A)。siRNAによる、GPR107 mRNAに及ぼすこのノックダウン効果は、コロニー形成アッセイ(図6B)およびMTTアッセイ(図6C)における増殖抑制をもたらした。これらの発見から、PDACa細胞におけるGPR107の過剰発現は癌細胞生存能と関連していることが強く示唆された。
(3) GPR107 (G protein coupled receptor 107) (GenBank accession number AB046844; SEQ ID NOs: 5 and 6)
The inventors have identified this orphan GPCR with unknown function and ligand as a target for pancreatic cancer. GPR107 is expressed indefinitely in normal heart, placenta, skeletal muscle, testis, ovary, spinal cord, as shown in Northern blot analysis (FIG. 3C). In order to examine the proliferative or survival effects of GPR107 on PDACa cells, we specifically knocked down endogenous expression of GPR107 in PDACa cell lines by siRNA. Transfection of the siRNA production vector clearly reduced endogenous expression in the siRNA designed for GPR107, 1003si (FIG. 6A). This knockdown effect on GPR107 mRNA by siRNA resulted in growth inhibition in colony formation assay (FIG. 6B) and MTT assay (FIG. 6C). These findings strongly suggested that overexpression of GPR107 in PDACa cells is associated with cancer cell viability.
結論として、本発明者らは、PDACa細胞において過剰発現する3種類の膜型分子を同定し、これらの分子は全て癌細胞増殖に関連している可能性が高く、このことは、これらの膜型分子が致命的な膵臓癌の治療に理想的な標的分子であることを示唆した。 In conclusion, we have identified three membrane-type molecules that are overexpressed in PDACa cells, all of which are likely to be associated with cancer cell growth, which means that these membranes This suggests that the type molecule is an ideal target molecule for the treatment of fatal pancreatic cancer.
産業上の利用可能性
本発明者らは、PCDH1遺伝子、CDH3遺伝子、またはGPR107遺伝子を特異的標的とする低分子干渉RNA(siRNA)によって細胞増殖が抑制されることを示した。従って、この新規siRNAは抗癌剤を開発するための有用な標的である。例えば、PCDH1、CDH3、またはGPR107の発現を遮断するか、またはそれらの活性を阻止する薬剤は、抗癌剤として、例えば、膵管腺癌(PDACa)といった膵臓癌を特に治療するための抗癌剤として治療上有用性を見出しうる。
Industrial Applicability The present inventors have shown that cell proliferation is suppressed by small interfering RNA (siRNA) that specifically targets the PCDH1 gene, CDH3 gene, or GPR107 gene. Therefore, this novel siRNA is a useful target for developing anticancer agents. For example, agents that block expression of PCDH1, CDH3, or GPR107 or block their activity are therapeutically useful as anticancer agents, for example, anticancer agents, particularly for treating pancreatic cancer such as pancreatic ductal adenocarcinoma (PDACa) Sex can be found.
本発明を、詳細にかつ本発明の特定の態様を参照して説明してきたが、本発明の精神および範囲から逸脱することなく、本発明に様々な変更および改変を加えることができることは当業者に明らかであろう。 Although the invention has been described in detail and with reference to certain embodiments of the invention, it will be appreciated by those skilled in the art that various changes and modifications can be made to the invention without departing from the spirit and scope of the invention. It will be obvious.
Claims (23)
5'-[A]-[B]-[A']-3'
を有し、式中、[A]が、配列番号:22、23、および24のヌクレオチド配列であり、[B]が、3〜23個のヌクレオチドからなるヌクレオチド配列であり、[A']が、[A]に相補的なヌクレオチド配列である、請求項19記載のベクター。 Polynucleotide is general formula
5 '-[A]-[B]-[A']-3 '
Wherein [A] is the nucleotide sequence of SEQ ID NOs: 22, 23, and 24, [B] is a nucleotide sequence consisting of 3 to 23 nucleotides, and [A ′] is 20. The vector according to claim 19, which is a nucleotide sequence complementary to [A].
5'-[A]-[B]-[A']-3'
を有し、式中、[A]が、配列番号:22、23、および24のヌクレオチド配列に対応するリボヌクレオチド配列であり、[B]が、3〜23個のヌクレオチドからなるリボヌクレオチド配列であり、[A']が、[A]に相補的なリボヌクレオチド配列である、請求項22記載の組成物。 siRNA is a general formula
5 '-[A]-[B]-[A']-3 '
Wherein [A] is a ribonucleotide sequence corresponding to the nucleotide sequences of SEQ ID NOs: 22, 23, and 24, and [B] is a ribonucleotide sequence consisting of 3 to 23 nucleotides. 23. The composition of claim 22, wherein [A '] is a ribonucleotide sequence complementary to [A].
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US55580904P | 2004-03-24 | 2004-03-24 | |
| PCT/JP2005/005619 WO2005090572A2 (en) | 2004-03-24 | 2005-03-18 | Compositions and methods for treating pancreatic cancer |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2007530431A true JP2007530431A (en) | 2007-11-01 |
| JP2007530431A5 JP2007530431A5 (en) | 2008-02-14 |
Family
ID=34961863
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006525966A Withdrawn JP2007530431A (en) | 2004-03-24 | 2005-03-18 | Compositions and methods for treating pancreatic cancer |
Country Status (4)
| Country | Link |
|---|---|
| EP (1) | EP1735442A2 (en) |
| JP (1) | JP2007530431A (en) |
| CN (1) | CN1977044A (en) |
| WO (1) | WO2005090572A2 (en) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9017669B2 (en) | 2009-12-28 | 2015-04-28 | Oncotherapy Science, Inc. | Anti-CDH3 antibodies and uses thereof |
| JP2019511216A (en) * | 2016-03-01 | 2019-04-25 | ユニバーシティ オブ フロリダ リサーチ ファンデーション インコーポレーティッド | AAV vector for treatment of dominant retinitis pigmentosa |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| TW200908998A (en) * | 2007-06-27 | 2009-03-01 | Oncotherapy Science Inc | Compositions and methods of treating cancer |
| RU2483078C2 (en) | 2007-08-20 | 2013-05-27 | Онкотерапи Сайенс, Инк. | Cdh3-peptide and drug preparation containing it |
| WO2010001585A1 (en) | 2008-06-30 | 2010-01-07 | Oncotherapy Science, Inc. | Anti-cdh3 antibodies labeled with radioisotope label and uses thereof |
| TW201008574A (en) | 2008-08-19 | 2010-03-01 | Oncotherapy Science Inc | INHBB epitope peptides and vaccines containing the same |
| SI2535358T1 (en) | 2010-02-10 | 2018-03-30 | Fujifilm Ri Pharma Co., Ltd. | Radioactive metal-labeled anti-cadherin antibody |
| CN101825799A (en) * | 2010-05-26 | 2010-09-08 | 福州华映视讯有限公司 | Method for assembling naked-eye stereoscopic display |
| PE20170912A1 (en) | 2014-11-14 | 2017-07-12 | Novartis Ag | ANTIBODY-DRUG CONJUGATES |
| CN108866058B (en) * | 2018-07-12 | 2021-09-10 | 苏州吉玛基因股份有限公司 | KRAS-targeted siRNA and application thereof in preparation of pancreatic cancer treatment drug |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1432724A4 (en) * | 2002-02-20 | 2006-02-01 | Sirna Therapeutics Inc | Rna interference mediated inhibition of map kinase genes |
-
2005
- 2005-03-18 WO PCT/JP2005/005619 patent/WO2005090572A2/en active Application Filing
- 2005-03-18 CN CNA2005800166735A patent/CN1977044A/en active Pending
- 2005-03-18 JP JP2006525966A patent/JP2007530431A/en not_active Withdrawn
- 2005-03-18 EP EP05721546A patent/EP1735442A2/en not_active Withdrawn
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9017669B2 (en) | 2009-12-28 | 2015-04-28 | Oncotherapy Science, Inc. | Anti-CDH3 antibodies and uses thereof |
| JP2019511216A (en) * | 2016-03-01 | 2019-04-25 | ユニバーシティ オブ フロリダ リサーチ ファンデーション インコーポレーティッド | AAV vector for treatment of dominant retinitis pigmentosa |
| US11118185B2 (en) | 2016-03-01 | 2021-09-14 | University Of Florida Research Foundation, Incorporated | AAV vectors for treatment of dominant retinitis pigmentosa |
| JP7272795B2 (en) | 2016-03-01 | 2023-05-12 | ユニバーシティ オブ フロリダ リサーチ ファンデーション インコーポレーティッド | AAV vectors for the treatment of dominant retinitis pigmentosa |
Also Published As
| Publication number | Publication date |
|---|---|
| EP1735442A2 (en) | 2006-12-27 |
| CN1977044A (en) | 2007-06-06 |
| WO2005090572A3 (en) | 2006-04-13 |
| WO2005090572A2 (en) | 2005-09-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4658936B2 (en) | Compositions and methods for treating lung cancer | |
| JP2007530431A (en) | Compositions and methods for treating pancreatic cancer | |
| Zhang et al. | MicroRNA‐146a targets PRKCE to modulate papillary thyroid tumor development | |
| US20100086526A1 (en) | Nucleic acid constructs and methods for specific silencing of h19 | |
| JP2010531133A (en) | Cancer therapeutic composition and method | |
| TW200538739A (en) | EphA4 as therapeutic target of PRC and PDACa | |
| JP4467559B2 (en) | Compositions and methods for inhibiting cell proliferation | |
| JP2006500916A (en) | Methods and compositions for treating neoplasia associated with hnRNPA1 and A2 nucleic acid molecules | |
| Zhang et al. | RNA interference, A potential strategy for isoform-specific phosphatidylinositol 3-kinase targeted therapy in ovarian cancer | |
| US11319541B2 (en) | Anticancer therapeutic intervention | |
| EP1924691A1 (en) | Gene silencing of protease activated receptor 1 (par1) | |
| US20060003956A1 (en) | Materials and methods for the derepression of the E-cadherin promoter | |
| US20110110896A1 (en) | Modulating levels of RNA-binding proteins for the treatment of breast cancer | |
| JP2013039036A (en) | NUCLEIC ACID INHIBITING EXPRESSION OF HIF-2α | |
| US20220259596A1 (en) | Inhibitors of microRNA 451a for Treatment of Endometriosis | |
| KR20230045386A (en) | COMPOSITION FOR ENHANCING SENSITIVITY TO ANTI-CANCER AGENT COMPRISING OF miR-4487 AS AN ACTIVE INGREDIENT | |
| JP5263730B2 (en) | Preventive and therapeutic agent for feline infectious peritonitis virus (FIPV) | |
| KR100986465B1 (en) | Novel use of OIP5 gene | |
| Pu et al. | Suppression of EGFR Expression by Antisense RNA and RNAi | |
| TW201718854A (en) | RNA interference agents for p21 gene modulation |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20071218 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20071218 |
|
| A761 | Written withdrawal of application |
Free format text: JAPANESE INTERMEDIATE CODE: A761 Effective date: 20100528 |