EP0723959A1 - Heterocyclic compounds as tachykinin receptor antagonists, process for their preparation and pharmaceuticals containing them - Google Patents
Heterocyclic compounds as tachykinin receptor antagonists, process for their preparation and pharmaceuticals containing them Download PDFInfo
- Publication number
- EP0723959A1 EP0723959A1 EP96400202A EP96400202A EP0723959A1 EP 0723959 A1 EP0723959 A1 EP 0723959A1 EP 96400202 A EP96400202 A EP 96400202A EP 96400202 A EP96400202 A EP 96400202A EP 0723959 A1 EP0723959 A1 EP 0723959A1
- Authority
- EP
- European Patent Office
- Prior art keywords
- formula
- compound
- trifluoromethyl
- les
- group
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- 0 *c1cc(C(F)(F)F)cc(C(F)(F)F)c1 Chemical compound *c1cc(C(F)(F)F)cc(C(F)(F)F)c1 0.000 description 1
- URIBTJSYNRSWTA-UHFFFAOYSA-N C[N](CC1)(CC2)CCC12c1ccccc1 Chemical compound C[N](CC1)(CC2)CCC12c1ccccc1 URIBTJSYNRSWTA-UHFFFAOYSA-N 0.000 description 1
- WGUXTQDCAZNJIF-UHFFFAOYSA-N Cc1cc(C(F)(F)F)cc(C(F)(F)F)c1 Chemical compound Cc1cc(C(F)(F)F)cc(C(F)(F)F)c1 WGUXTQDCAZNJIF-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/68—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having one double bond between ring members or between a ring member and a non-ring member
- C07D211/72—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having one double bond between ring members or between a ring member and a non-ring member with hetero atoms or with carbon atoms having three bonds to hetero atoms, with at the most one bond to halogen, directly attached to ring carbon atoms
- C07D211/74—Oxygen atoms
- C07D211/76—Oxygen atoms attached in position 2 or 6
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/08—Drugs for disorders of the alimentary tract or the digestive system for nausea, cinetosis or vertigo; Antiemetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/02—Drugs for disorders of the urinary system of urine or of the urinary tract, e.g. urine acidifiers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/06—Antimigraine agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/20—Hypnotics; Sedatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/24—Antidepressants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/26—Psychostimulants, e.g. nicotine, cocaine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/06—Antiarrhythmics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/08—Vasodilators for multiple indications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D453/00—Heterocyclic compounds containing quinuclidine or iso-quinuclidine ring systems, e.g. quinine alkaloids
- C07D453/02—Heterocyclic compounds containing quinuclidine or iso-quinuclidine ring systems, e.g. quinine alkaloids containing not further condensed quinuclidine ring systems
Definitions
- the present invention relates to new heterocyclic compounds, a process for their preparation and the pharmaceutical compositions containing them as active ingredient.
- the present invention relates to a new class of aromatic compounds for therapeutic use, in pathological phenomena which involve the tachykinin system such as for example in a nonlimiting and exclusive manner: pain (D. Regoli et al., Life Sciences, 1987, 40 , 109-117), allergy and inflammation (JE Morlay et al., Life Sciences, 1987, 41 , 527-544), circulatory failure (J. Losay et al., 1977, Substance P, Von Euler, IS and Pernow ed., 287-293, Raven Press, New York), gastrointestinal disorders (D. Regoli et al., Trends Pharmacol. Sci., 1985, 6 , 481-484), respiratory disorders (J. Mizrahi et al., Pharmacology, 1982, 25, 39-50) neurological disorders, neuropsychiatric disorders.
- pain D. Regoli et al., Life Sciences, 1987, 40 , 109-117
- allergy and inflammation JE Morlay et al., Life Sciences, 1987, 41
- Tachykinins are distributed in both the central nervous system and the peripheral nervous system. Tachykinin receptors have been recognized and are classified into three types: NK 1 , NK 2 , NK 3 .
- Substance P is the endogenous ligand for NK 1 receptors, neurokinin A (NK A ) for NK 2 receptors and neurokinin B (NK B ) for NK 3 receptors.
- NK 1 , NK 2 , NK 3 receptors have been demonstrated in different species.
- a review by CA Maggi et al. takes stock of tachykinin receptors and their antagonists and describes pharmacological studies and applications in human therapy (J. Autonomic Pharmacol., 1993, 13 , 23-93).
- CP-96345 J. Med. Chem., 1992, 35 , 2591-2600
- RP-68651 Proc. Natl. Acad. Sci. USA , 1991, 88 , 10208-10212
- SR 140333 Rel. J. Pharmacol., 1993, 250, 403-413
- non-peptide compounds which have a very high affinity for the NK 1 receptor and a high specificity for said receptor. These compounds can be used for the preparation of medicaments useful in the treatment of any P-dependent substance pathology.
- NK 1 receptor By very strong affinity for the human NK 1 receptor is meant an affinity characterized by an inhibition constant Ki of less than 5.10 -9 M.
- Ki IC 50 1 + L Kd [L]: concentration of ligand, Kd: ligand dissociation constant, IC 50 : concentration which inhibits 50% of ligand binding.
- the inhibition constant (Ki) for the human NK 1 receptor is at least 100 times lower than the inhibition constant (Ki) for the NK 2 receptor or that for the NK 3 receiver.
- the product (34.6 g) obtained in the previous step is dissolved in 500 ml of EtOH 95. 5 g of solid KHCO 3 are added, then Raney® nickel. Hydrogenation is carried out at 60 ° C. under 20.4 bars. After 4 hours, filter through Celite® and evaporate the solvent. It is taken up in water, extracted with AcOEt, washed twice with water and with a saturated solution of sodium chloride. The organic phase is dried over MgSO 4 and concentrated in vacuo. 32 g of the expected product are obtained.
- the product obtained in the previous step (15.4 g) is dissolved in 200 ml of MeOH, 25 ml of a saturated solution of ammonia in MeOH are added, then hydrogenation is carried out at 40 ° C under atmospheric pressure. presence of Raney® nickel.
- the catalyst is filtered, evaporated to dryness and the residue is taken up in ether. Washed with water, with a saturated solution of sodium chloride, dried over MgSO 4 and concentrated in vacuo to obtain 12.8 g of the expected product.
- a mixture of 11 g of the compound obtained in the preceding step, 1 g of Raney® nickel and 0.77 g of NaHCO 3 in 120 ml of EtOH 95 is hydrogenated at 40 ° C. and at 10.2 bars. filters the catalyst on Celite® and concentrates the filtrate under vacuum. The residue is extracted with DCM, the organic phase is washed with water and with saturated sodium chloride solution, dried over MgSO 4 and the solvent is evaporated under vacuum. The residue is chromatographed on silica, eluting with a DCM / MeOH mixture (97/3; v / v). 6.8 g of the expected product are obtained.
- a solution of 4 g of the compound obtained in the preceding step in 50 ml of DCM is prepared, 1 g of triethylamine is added, then it is cooled in an ice bath and 1.04 g of methanesulfonyl chloride are added dropwise in 20 ml of DCM. Evaporated, taken up in water and extracted with AcOEt, then washed successively with water, a 2N HCl solution, water, a 5% NaHCO 3 solution, water, a saturated solution of sodium chloride. It is dried over MgSO 4 and the solvent is evaporated under vacuum. 4.7 g of the expected product are obtained.
- a mixture containing 1 g of 4- (3,4-dichlorophenyl) -1- [3,5-bis (trifluoromethyl) benzy] -4- [2- (mesyloxy) ethyl] pyrrolidin-2 is prepared in 2 ml of DMF one obtained in Example 9, step B, 0.875 g of 4-hydroxy-4-phenylpiperidine and 0.483 g of potassium carbonate and the mixture is heated at 80 ° C. for 3 hours. The mixture is allowed to cool and then ice, water and ethyl acetate are added. Extraction is carried out with AcOEt, washing with water and then with a sodium chloride solution.
- the pure product is obtained by chromatography on silica, eluting with a DCM-MeOH mixture (100/3; v / v).
- the hydrochloride is then prepared by the action of hydrochloric acid in DCM.
- a solution of 8.8 g of the compound obtained in the preceding step and 2.51 g of triethylamine in 100 ml of DCM is cooled in an ice bath, a solution of 2.09 g of methanesulfonyl chloride in dropwise added 20 ml of DCM and leaves for 10 minutes with stirring. It is concentrated under vacuum, the residue is extracted with AcOEt, the organic phase is washed with water, with a saturated NaCl solution, dried over MgSO 4 and the solvent is evaporated under vacuum. 8.5 g of the expected product are obtained.
Abstract
Description
La présente invention a pour objet de nouveaux composés hétérocycliques, un procédé pour leur préparation et les compositions pharmaceutiques en contenant en tant que principe actif.The present invention relates to new heterocyclic compounds, a process for their preparation and the pharmaceutical compositions containing them as active ingredient.
Plus particulièrement, la présente invention concerne une nouvelle classe de composés aromatiques à usage thérapeutique, dans les phénomènes pathologiques qui impliquent le système des tachykinines comme par exemple de manière non limitative et exclusive : la douleur (D. Regoli et al., Life Sciences, 1987, 40, 109-117),l'allergie et l'inflammation (J.E. Morlay et al., Life Sciences, 1987, 41, 527-544), l'insuffisance circulatoire (J. Losay et al., 1977, Substance P, Von Euler, I.S. and Pernow ed., 287-293, Raven Press, New York), les troubles gastro-intestinaux (D. Regoli et al., Trends Pharmacol. Sci., 1985, 6, 481-484), les troubles respiratoires (J. Mizrahi et al., Pharmacology, 1982, 25, 39-50) les troubles neurologiques, les troubles neuropsychiatriques.More particularly, the present invention relates to a new class of aromatic compounds for therapeutic use, in pathological phenomena which involve the tachykinin system such as for example in a nonlimiting and exclusive manner: pain (D. Regoli et al., Life Sciences, 1987, 40 , 109-117), allergy and inflammation (JE Morlay et al., Life Sciences, 1987, 41 , 527-544), circulatory failure (J. Losay et al., 1977, Substance P, Von Euler, IS and Pernow ed., 287-293, Raven Press, New York), gastrointestinal disorders (D. Regoli et al., Trends Pharmacol. Sci., 1985, 6 , 481-484), respiratory disorders (J. Mizrahi et al., Pharmacology, 1982, 25, 39-50) neurological disorders, neuropsychiatric disorders.
Dans les années récentes de nombreux travaux de recherche ont été effectués sur les tachykinines et leurs récepteurs. Les tachykinines sont distribuées à la fois dans le système nerveux central et dans le système nerveux périphérique. Les récepteurs aux tachykinines ont été reconnus et sont classés en trois types : NK1, NK2, NK3. La substance P (SP) est le ligand endogène des récepteurs NK1, la neurokinine A (NKA) celui des récepteurs NK2 et la neurokinine B (NKB), celui des récepteurs NK3.In recent years, much research has been done on tachykinins and their receptors. Tachykinins are distributed in both the central nervous system and the peripheral nervous system. Tachykinin receptors have been recognized and are classified into three types: NK 1 , NK 2 , NK 3 . Substance P (SP) is the endogenous ligand for NK 1 receptors, neurokinin A (NK A ) for NK 2 receptors and neurokinin B (NK B ) for NK 3 receptors.
Les récepteurs NK1, NK2, NK3 ont été mis en évidence chez différentes espèces. Une revue de C.A. Maggi et al. fait le point sur les récepteurs aux tachykinines et leurs antagonistes et expose les études pharmacologiques et les applications en thérapeutique humaine (J. Autonomic Pharmacol., 1993, 13, 23-93).The NK 1 , NK 2 , NK 3 receptors have been demonstrated in different species. A review by CA Maggi et al. takes stock of tachykinin receptors and their antagonists and describes pharmacological studies and applications in human therapy (J. Autonomic Pharmacol., 1993, 13 , 23-93).
Parmi les antagonistes spécifiques du récepteur NK1 on peut citer les composés non peptidiques suivants : CP-96345 (J. Med. Chem., 1992, 35, 2591-2600), RP-68651 (Proc. Natl. Acad. Sci. USA, 1991, 88, 10208-10212), SR 140333 (Curr. J. Pharmacol., 1993, 250, 403-413).Among the specific antagonists of the NK 1 receptor, the following non-peptide compounds may be mentioned: CP-96345 (J. Med. Chem., 1992, 35 , 2591-2600), RP-68651 (Proc. Natl. Acad. Sci. USA , 1991, 88 , 10208-10212), SR 140333 (Curr. J. Pharmacol., 1993, 250, 403-413).
De nombreux brevets ou demandes de brevets décrivent des composés actifs sur les récepteurs de tachykinines. Ainsi la demande de brevet européenne 0 512 901 concerne des composés de formule :
- Q' représente un atome d'oxygène ou deux atomes d'hydrogène,
- T' = -C(O)- ou -CH2-, et
- Y peut représenter un groupe
- Ar' représente un phényle éventuellement substitué,
- x'= 0 ou 1 et
- X' représente l'hydrogène, un groupe hydroxyle ou un autre radical monovalent, ainsi que les sels d'ammonium quaternaire avec l'azote de la pipéridine.
- Q 'represents an oxygen atom or two hydrogen atoms,
- T '= -C (O) - or -CH 2 -, and
- Y can represent a group
- Ar 'represents an optionally substituted phenyl,
- x '= 0 or 1 and
- X 'represents hydrogen, a hydroxyl group or another monovalent radical, as well as the quaternary ammonium salts with the nitrogen of piperidine.
La demande de brevet européenne 0 591 040 concerne des composés de formule :
- Ar1 représente un groupe aromatique ou hétéroaromatique mono-, di- ou tricyclique éventuellement substitué;
- T1 représente une liaison directe, un groupe hydroxyméthylène, alcoxyméthylène ou alkylène ;
- Ar'1 représente un phényle non substitué ou substitué ; un thiényle ; un benzothiényle; un naphtyle ou un indolyle ;
- Am⊕ 1 représente le radical
- R'1 a différentes significations ou représente l'hydrogène ;
- Q'1 représente l'hydrogène ou
- Q'1 et R'1 ensemble forment un groupe 1,2-éthylène, 1,3-propylène ou 1,4-butylène.
- Ar 1 represents an optionally substituted mono-, di- or tricyclic aromatic or heteroaromatic group;
- T 1 represents a direct bond, a hydroxymethylene, alkoxymethylene or alkylene group;
- Ar ' 1 represents an unsubstituted or substituted phenyl; thienyl; benzothienyl; naphthyl or indolyl;
- Am ⊕ 1 represents the radical
- R ' 1 has different meanings or represents hydrogen;
- Q ' 1 represents hydrogen or
- Q ' 1 and R' 1 together form a 1,2-ethylene, 1,3-propylene or 1,4-butylene group.
On a maintenant trouvé des composés non peptidiques qui présentent une très forte affinité pour le récepteur NK1 et une grande spécificité pour ledit récepteur. Ces composés peuvent être utilisés pour la préparation de médicaments utiles dans le traitement de toute pathologie substance P-dépendante.We have now found non-peptide compounds which have a very high affinity for the NK 1 receptor and a high specificity for said receptor. These compounds can be used for the preparation of medicaments useful in the treatment of any P-dependent substance pathology.
Par très forte affinité pour le récepteur NK1 humain on entend une affinité caractérisée par une constante d'inhibition Ki inférieure à 5.10-9M.By very strong affinity for the human NK 1 receptor is meant an affinity characterized by an inhibition constant Ki of less than 5.10 -9 M.
Dans les études de fixation d'un ligand, la constante d'inhibition Ki est définie par la relation de Cheng-Prusoff (in Receptor Binding in Drug Research, eds. R.A. O'Brien, Marcel Dekker, New York, 1986) :
Kd : constante de dissociation du ligand,
IC50 : concentration qui inhibe 50 % de la fixation du ligand.In ligand binding studies, the inhibition constant Ki is defined by the Cheng-Prusoff relationship (in Receptor Binding in Drug Research, eds. RA O'Brien, Marcel Dekker, New York, 1986):
Kd: ligand dissociation constant,
IC 50 : concentration which inhibits 50% of ligand binding.
Par grande spécificité pour le récepteur NK1 humain, on entend que la constante d'inhibition (Ki) pour le récepteur NK1 humain est au moins 100 fois inférieure à la constante d'inhibition (Ki) pour le récepteur NK2 ou à celle pour le récepteur NK3.By high specificity for the human NK 1 receptor, it is meant that the inhibition constant (Ki) for the human NK 1 receptor is at least 100 times lower than the inhibition constant (Ki) for the NK 2 receptor or that for the NK 3 receiver.
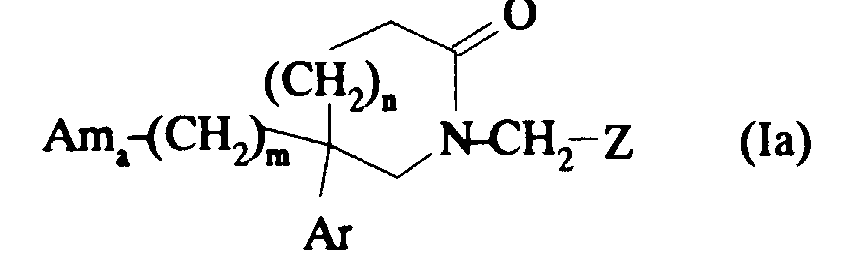
Ainsi selon un de ses aspects, la présente invention concerne des composés de formule :
- m est deux ou trois ;
- n est 0, 1 ou 2 ;
- Am représente un groupe choisi parmi :
- a)
- c)
- R1 représente un (C1-C4)alkyle ou un benzyle ;
- R2 représente un phényle non substitué ou substitué une ou plusieurs fois par un atome d'halogène, un hydroxyle, un (C1-C4)alcoxy, un (C1-C4)alkyle, un trifluorométhyle, lesdits substituants étant identiques ou différents ;
- X représente un atome d'hydrogène ou un groupe hydroxyle ;
- x est zéro ou un ;
- Ar représente un phényle non substitué ou substitué une ou plusieurs fois par un atome d'halogène ; un naphtyle ou un indolyle ;
- Z représente un phényle substitué une ou plusieurs fois par un atome d'halogène, un (C1-C4) alkyle, un trifluorométhyle ;
- A⊖ représente un anion ;
Les composés de formule (I) selon l'invention comprennent aussi bien les isomères optiquement purs que les racémiques ainsi que les isomères axiaux et équatoriaux lorsque Am a la valeur a).
Lorsque Am représente c), on peut former des sels des composés de formule (I). Ces sels comprennent aussi bien ceux des acides minéraux ou organiques qui permettent une séparation ou une cristallisation convenable des composés de formule (I), tels que l'acide picrique oxalique ou un acide optiquement actif, par exemple un acide mandélique ou camphosulfonique, que ceux qui forment des sels pharmaceutiquement acceptables tels que le chlorhydrate, le bromhydrate, le sulfate, l'hydrogénosulfate, le dihydrogénophosphate, le méthanesulfonate, le méthylsulfate, le maléate, le fumarate, le 2-naphtalènesulfonate, le benzènesulfonate, le gluconate, le citrate, l'iséthionate, le p-toluènesulfonate.
Les anions sont ceux normalement utilisés pour salifier les ions d'ammonium quaternaires, de préférence les ions chlorure, bromure, iodure, acétate, hydrogénosulfate, méthanesulfonate, paratoluènesulfonate, benzènesulfonate.
Préférentiellement, on utilise les anions pharmaceutiquement acceptables par exemple le chlorure, le méthanesulfonate, le paratoluènesulfonate, le benzènesulfonate.
Dans la présente description les groupes alkyles ou les groupes alcoxy sont droits ou ramifiés ; par atome d'halogène on entend un atome de chlore, de brome, de fluor ou d'iode.
Avantageusement, la présente invention concerne les composés de formule (I) dans laquelle m = 2.
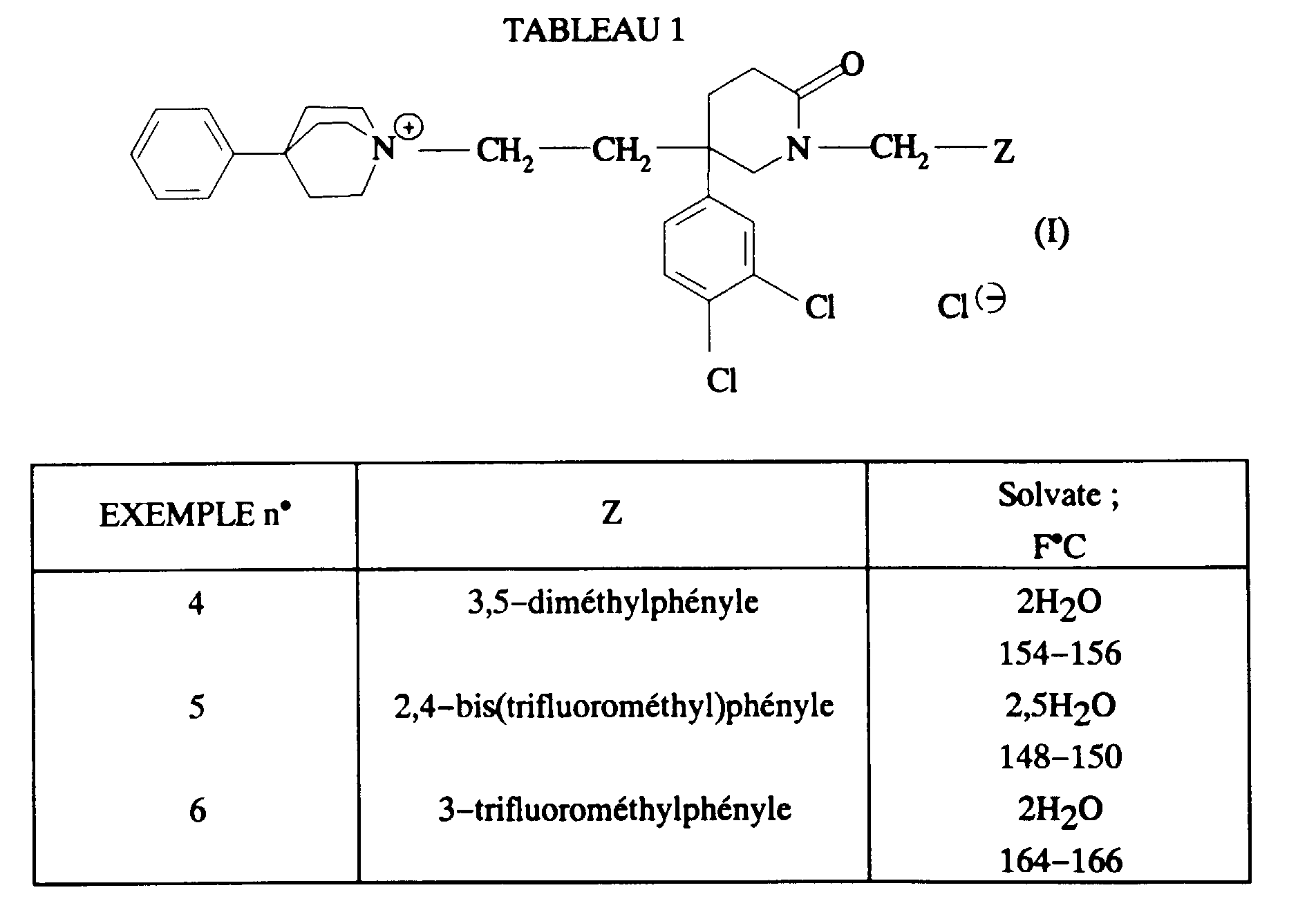
Les composés de formule (I) dans lesquels Z est un groupe choisi parmi diméthylphényle, trifluorométhylphényle et bistrifluorométhylphényle sont des composés préférés selon l'invention.
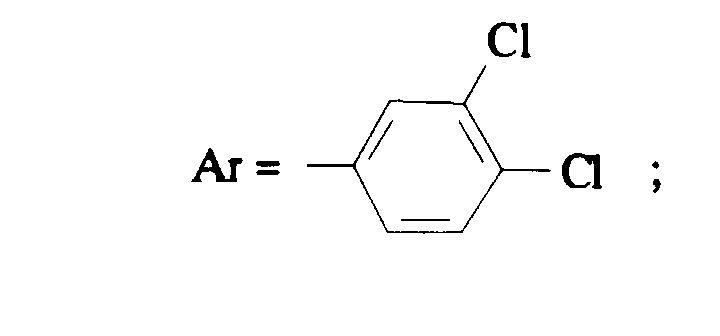
Selon la présente invention, on préfère les composés de formule (I) dans laquelle- Ar représente un 3,4-dichlorophényle ou un 3,4-difluorophényle ;
- Z représente un 3,5-diméthylphényle, un 3,5-bis(trifluorométhyl)phényle ou un 2,4-bis(trifluorométhyl)phényle ;
- et soit n = 0, 1 ou 2 et Am représente a) ou b), - soit n = 0 et Am représente c) ;
- A⊖ représente un anion pharmaceutiquement acceptable.
Selon la présente invention, on préfère également les composés de formule :
Tout particulièrement, on préfère les sels pharmaceutiquement acceptables des composés de formule :
et leurs solvates éventuels.
Selon un autre de ses aspects, la présente invention concerne un procédé pour la préparation des composés de formule (I) caractérisé en ce que :- 1) on traite un composé de formule :
avec un dérivé halogéné de formule :
Hal-CH2-Z (III)
dans laquelle Z est tel que défini pour (I) et Hal représente un atome d'halogène, préférentiellement le brome ou le chlore ; - 2) on transforme le groupe O-protecteur en groupe hydroxyle par action d'un acide ou d'une base ;
- 3) on traite l'alcool ainsi obtenu de formule :
- 4) on fait réagir le composé ainsi obtenu de formule :
avec une amine secondaire ou tertiaire AmH ou Am dans un solvant organique, à une température comprise entre la température ambiante et 120°C ; - 5) on isole le produit ainsi obtenu et, éventuellement, on échange l'anion sulfonate avec un autre anion, et, éventuellement, on transforme le produit ainsi obtenu en un de ses sels.
A l'étape 2, la déprotection est effectuée en milieu acide, par exemple en présence d'acide chlorhydrique lorsque E représente un tétrahydropyran-2-yle ou en milieu basique, par exemple en présence de soude ou d'hydroxyde de lithium lorsque E représente un benzoyle ou un acyle en C1-C4.
A la dernière étape l'anion sulfonate peut être échangé, in situ ou après isolement du composé de formule (I) dans laquelle A⊖ est l'ion sulfonate, par un autre anion A⊖, selon les méthodes conventionnelles, par exemple par échange en solution avec une solution saturée de chlorure de sodium ou, avec une solution d'acide chlorhydrique lorsque A⊖ représente un anion chlorure, ou par échange de l'anion par élution du composé (I) sur une résine échangeuse d'ion, par exemple l'Amberlite IRA68 ou Duolite A375.
Lorsque Am représente un groupe a), les sels d'ammonium quaternaires formés avec l'azote de la pipéridine sont préparés par réaction des bases libres des composés de formule (I) avec un excès d'agent alkylant de formule : A-R1 dans lequel A est tel que défini précédemment pour (I), de préférence un chlorure ou un iodure et R1 est tel que défini précédemment pour (I) et on chauffe le mélange réactionnel dans un solvant, par exemple le dichlorométhane, le chloroforme, l'acétone ou l'acétonitrile, à une température comprise entre la température ambiante et le reflux, pendant une à plusieurs heures, pour obtenir après traitement selon les méthodes habituelles un mélange des isomères axiaux et équatoriaux des sels d'ammonium quaternaires. De préférence, A⊖ représente un iodure qui peut être échangé par un autre anion ou par un anion pharmaceutiquement acceptable, par exemple par élution du composé (I) sur une résine échangeuse d'ion, telle l'Amberlite IRA68 ou Duolite A375. Les isomères sont séparés selon les méthodes habituelles, par exemple par chromatographie ou par recristallisation.
La résolution des mélanges racémiques de composés (I) ou d'intermédiaires tels que (IV) permet d'isoler les énantiomères en utilisant des méthodes connues de l'homme de l'art.
La préparation des composés de formule (II) est effectuée selon les procédés décrits dans EP-A-0 512 901.
Les dérivés halogénés de formule (III) sont connus ou préparés par des méthodes connues.
La 4-phénylpipéridine, la 4-benzylpipéridine, la 4-hydroxy-4-phénylpipéridine et la 4-hydroxy-4-benzylpipéridine sont commerciales.
La 4-phényl-1-wabicyclo[2.2.2]octane, ou 4-phénylquinuclidine et la 4-benzyl-1-azabicyclo[2.2.2]octane ou 4-benzylquinuclidine sont préparées selon T. Perrine, J. Org. Chem., 1957, 22, 1484-1489.
Les composés de formule (I) ci-dessus comprennent également ceux dans lesquels un ou plusieurs atomes d'hydrogène, de carbone, de fluor ou d'iode ont été remplacés par leur isotope radioactif par exemple le tritium, le carbone-14, le fluor-19 ou l'iode 125. De tels composés marqués sont utiles dans des travaux de recherche, de métabolisme, de pharmacocinétique ou dans des essais biochimiques en tant que ligands de récepteurs et peuvent être utilisés comme outils pharmacologiques chez l'homme ou chez l'animal.
Les composés selon l'invention ont fait l'objet d'essais biochimiques.
L'affinité des composés de formule (I) pour les récepteurs aux tachykinines a été évaluée in vitro par plusieurs essais biochimiques utilisant des radioligands :- 1°) La liaison de [125I]BH-SP (Substance P marquée à l'iode 125 à l'aide du réactif de Bolton-Hunter) aux récepteurs NK1 des cellules lymphoblastiques humaines.
- 2°) La liaison [125I]His-NKA aux récepteurs NK2 du duodénum ou de la vessie de rat.
- 3°) La liaison [125I]His[MePhe7]NKB aux récepteurs NK3 du cortex cérébral de rat, du cortex cérébral de cobaye et du cortex cérébral de gerbille ainsi qu'aux récepteurs clones NK3 humains exprimés par des cellules CHO (Buell et al., FEBS Letters, 1992, 299, 90-95).
Les essais ont été effectués selon X. Emonds-Alt et al. (Eur. J. Pharmacol., 1993, 250, 403-413).
Les composés selon l'invention inhibent fortement la liaison aux récepteurs NK1 des cellules lymphoblastiques humaines IM9. la constante d'inhibition Ki pour les récepteurs des cellules lymphoblastiques est inférieure à 5.10-9M. Pour les mêmes composés on a constaté que la constante d'inhibition (Ki) pour les récepteurs NK3 clonés humains est supérieure ou égale à 10-7M et que la constante d'inhibition (Ki) pour le récepteur NK2 du duodénum ou de la vessie de rat est supérieure ou égale à 10-7M.
L'activité des composés selon la présente invention comme inhibiteurs de la liaison aux récepteurs NK1 est nettement supérieure à celle de composés voisins décrits dans l'art antérieur.
Ainsi, l'isomère axial de l'iodure de 1-méthyl-1-[2-[1-[3,5-bis(trifluorométhyl) benzyl]-5-(3,4-dichlorophényl)-2-oxopipérid-5-yl]éthyl]-4-phénylpipéridinium présente une constante d'inhibition Ki de la substance P au récepteur lymphoblastique humain de l'ordre de 0,1.10-9M alors que le chlorhydrate de 5-[2-(4-benzyl-1-pipérid-1-yl)éthyl]-5-(3,4-dichlorophényl)-1-benzylpipérid-2-one décrit dans la demande EP-0 512 901 à l'exemple 1 (composé non substitué sur le benzyle) présente une constante d'inhibition Ki de l'ordre de 10-6M mesurée dans les mêmes conditions.
De même le chlorhydrate de 4-(3,4-dichlorophényl)-4-[2-(4-hydroxy-4-phénylpipérid-1-yl)éthyl]-1-[3,5-bis(trifluorométhyl)benzyl]pyrrolidin-2-one présente une constante d'inhibition Ki de la substance P au récepteur lymphoblastique humain de l'ordre de 0,1.10-9M alors que le chlorhydrate de 1-benzyl-4-(3,4-dichlorophényl)-4-[2-(4-hydroxy-4-phénylpipérid-1-yl)éthyl]pipérid-2-one décrit dans la demande EP-0 512 901 à l'exemple 3 présente un Ki de l'ordre de 10-6M mesuré dans les mêmes conditions.
Les composés de la présente invention sont notamment des principes actifs de compositions pharmaceutiques, dont la toxicité est compatible avec leur utilisation en tant que médicaments.
Les composés de formule (I) ci-dessus peuvent être utilisés à des doses journalières de 0,01 à 100 mg par kilo de poids corporel du mammifère à traiter, de préférence à des doses journalières de 0,1 à 50 mg/kg. Chez l'être humain, la dose peut varier de préférence de 0,5 à 4000 mg par jour, plus particulièrement de 2,5 à 1000 mg par jour selon l'âge du sujet à traiter ou le type de traitement : prophylactique ou curatif.
Pour leur utilisation comme médicaments, les composés de formule (I) sont généralement administrés en unités de dosage. Lesdites unités de dosage sont de préférence formulées dans des compositions pharmaceutiques dans lesquelles le principe actif est mélangé avec un excipient pharmaceutique.
Ainsi, selon un autre de ses aspects, la présente invention concerne des compositions pharmaceutiques renfermant, en tant que principe actif, un composé de formule (I).
Dans les compositions pharmaceutiques de la présente invention pour l'administration par voie orale, sublinguale, inhalée, sous-cutanée, intramusculaire, intraveineuse, transdermique, locale ou rectale, les principes actifs peuvent être administrés sous formes unitaires d'administration, en mélange avec des supports pharmaceutiques classiques, aux animaux et aux êtres humains. Les formes unitaires d'administration appropriées comprennent les formes par voie orale telles que les comprimés, les gélules, les poudres, les granules et les solutions ou suspensions orales, les formes d'administration sublinguale et buccale, les aérosols, les implants, les formes d'administration sous-cutanée, intramusculaire, intraveineuse, intranasale ou intraoculaire et les formes d'administration rectale.
Lorsque l'on prépare une composition solide sous forme de comprimés, on mélange le principe actif principal avec un véhicule pharmaceutique tel que la silice, la gélatine, l'amidon, le lactose, le stéarate de magnésium, le talc, la gomme arabique ou analogues. On peut enrober les comprimés de saccharose de divers polymères, ou d'autres matières appropriées ou encore les traiter de telle sorte qu'ils aient une activité prolongée ou retardée et qu'ils libèrent d'une façon continue une quantité prédéterminée de principe actif.
On obtient une préparation en gélules en mélangeant le principe actif avec un diluant tel qu'un glycol ou un ester de glycérol et en incorporant le mélange obtenu dans des gélules molles ou dures.
Une préparation sous forme de sirop ou d'élixir peut contenir le principe actif conjointement avec un édulcorant, acalorique de préférence, du méthylparaben et du propylparaben comme antiseptique, ainsi qu'un agent donnant du goût et un colorant approprié.
Les poudres ou les granules dispersibles dans l'eau peuvent contenir le principe actif en mélange avec des agents de dispersion ou des agents mouillants, ou des agents de mise en suspension, comme la polyvinylpyrrolidone, de même qu'avec des édulcorants ou des correcteurs du goût.
Pour une administration rectale, on recourt à des suppositoires qui sont préparés avec des liants fondant à la température rectale, par exemple du beurre de cacao ou des polyéthylèneglycols.
Pour une administration parentérale, intranasale ou intraoculaire, on utilise des suspensions aqueuses, des solutions salines isotoniques ou des solutions stériles et injectables qui contiennent des agents de dispersion et/ou des agents mouillants pharmacologiquement compatibles, par exemple le propylèneglycol ou le butylèneglycol.
Pour une administration par inhalation, on utilise un aérosol contenant par exemple du trioléate de sorbitane ou de l'acide oléique ainsi que du trichlorofluorométhane, du dichlorofluorométhane, du dichlorotétrafluoroéthane ou tout autre gaz propulseur biologiquement compatible ; on peut également utiliser un système comprenant le principe actif, seul ou associé à un excipient, sous forme de poudre.
Le principe actif peut être formulé également sous forme de microcapsules, éventuellement avec un ou plusieurs supports ou additifs.
Dans chaque unité de dosage le principe actif de formule (I) est présent dans les quantités adaptées aux doses journalières envisagées. En général chaque unité de dosage est convenablement ajustée selon le dosage et le type d'administration prévu, par exemple comprimés, gélules et similaires, sachets, ampoules, sirops et similaires, gouttes de façon à ce qu'une telle unité de dosage contienne de 0,5 à 1000 mg de principe actif, de préférence de 2,5 à 250 mg, devant être administrée une a quatre fois par jour.
Selon un autre de ses aspects, la présente invention concerne l'utilisation des produits de formule (I) pour la préparation de médicaments destinés à traiter des troubles physiologiques associés à un excès de tachykinines, notamment de Substance P et toutes les pathologies Substance-P-dépendantes du système respiratoire, gastro-intestinal, urinaire, immunitaire, cardiovasculaire et du système nerveux central ainsi que la douleur et la migraine.
Par exemple et de manière non limitative :- douleurs aigües et chroniques liées par exemple à la migraine, aux douleurs du cancéreux et de l'angineux, aux processus inflammatoires chroniques tels que l'ostéoarthrite et l'arthrite rhumatoïde,
- les inflammations telles que les maladies respiratoires chroniques obstructives, l'asthme, les allergies, les rhinites, les toux, les bronchites, l'hypersensibilité par exemple aux pollens et aux acariens, les arthrites rhumatoïdes, les ostéoarthrites, le psoriasis, les colites ulcératives, la maladie de Crohn, l'inflammation des intestins (colon irritable), la prostatite, la vessie neurologique, la cystite, l'urétrite, la néphrite,
- les maladies du système immunitaire liées à la suppression ou à la stimulation des fonctions des cellules immunes par exemple l'arthrite rhumatoïde, le psoriasis, la maladie de Crohn, la diabète, le lupus,
- les maladies du système nerveux central du type neuropsychiatrique ou neurologique telles que l'anxiété, la dépression, la psychose, la schizophrénie, la manie, la démence, l'épilepsie, la maladie de Parkinson, la maladie d'Alzheimer, la drogue-dépendance, le syndrome de Down et la chorée d'Huntington ainsi que les maladies neurodégénératives,
- les maladies du système gastro-intestinal telles que nausées, vomissement, colon irritable, ulcères gastriques et duodénaux, diarrhées, hypersécrétions,
- les maladies du système cardiovasculaire telles que les l'hypertension, les aspects vasculaires de la migraine, oedèmes, thrombose, l'angine de poitrine et les spasmes vasculaires,
- les troubles de la fréquence et du rythme cardiaques, en particulier ceux qui sont occasionnés par la douleur ou le stress.
La présente invention inclut aussi une méthode pour traiter lesdites affections aux doses indiquées ci-dessus.
Dans les Préparations et dans les exemples on utilise les abréviations suivantes :
EtOH : éthanol
MeOH : méthanol
Ether : éther diéthylique
Ether iso : éther diisopropylique
DMF : diméthylformamide
AcOEt : acétate d'éthyle
DCM : dichlorométhane
THF: tétrahydrofurane
NaOH : soude
KHCO3 : hydrogénocarbonate de potassium
NaHCO3 : hydrogénocarbonate de sodium
NaCl : chlorure de sodium
Triton B : solution à 40 % d'hydroxyde de N-benzyltriméthylammonium dans le MeOH.
Na2SO4 : sulfate de sodium
MgSO4 : sulfate de magnésium
iPr: isopropyle
TA : température ambiante
F : point de fusion
RMN : résonnance magnétique nucléaire.
s : singulet
sd : singulet dédoublé
d : doublet
sept : septuplet
m : massif
mult : multiplet - a)
- m is two or three;
- n is 0, 1 or 2;
- Am represents a group chosen from:
- at)
- vs)
- R 1 represents a (C 1 -C 4 ) alkyl or a benzyl;
- R 2 represents a phenyl which is unsubstituted or substituted one or more times by a halogen atom, a hydroxyl, a (C 1 -C 4 ) alkoxy, a (C 1 -C 4 ) alkyl, a trifluoromethyl, said substituents being identical or different;
- X represents a hydrogen atom or a hydroxyl group;
- x is zero or one;
- Ar represents phenyl which is unsubstituted or substituted one or more times by a halogen atom; naphthyl or indolyl;
- Z represents a phenyl substituted one or more times by a halogen atom, a (C 1 -C 4 ) alkyl, a trifluoromethyl;
- A ⊖ represents an anion;
The compounds of formula (I) according to the invention include both the optically pure isomers and the racemates as well as the axial and equatorial isomers when Am has the value a).
When Am represents c), salts of the compounds of formula (I) can be formed. These salts include both those of mineral or organic acids which allow suitable separation or crystallization of the compounds of formula (I), such as picric oxalic acid or an optically active acid, for example a mandelic or camphosulfonic acid, as those which form pharmaceutically acceptable salts such as the hydrochloride, the hydrobromide, the sulfate, the hydrogen sulfate, the dihydrogen phosphate, the methanesulfonate, the methyl sulfate, the maleate, the fumarate, the 2-naphthalenesulfonate, the benzenesulfonate, the gluconate, the citrate, isethionate, p -toluenesulfonate.
The anions are those normally used to salify the quaternary ammonium ions, preferably the chloride, bromide, iodide, acetate, hydrogen sulfate, methanesulfonate, paratoluenesulfonate, benzenesulfonate ions.
Preferably, the pharmaceutically acceptable anions are used, for example chloride, methanesulfonate, paratoluenesulfonate, benzenesulfonate.
In the present description, the alkyl groups or the alkoxy groups are straight or branched; halogen atom means a chlorine, bromine, fluorine or iodine atom.
Advantageously, the present invention relates to the compounds of formula (I) in which m = 2.
The compounds of formula (I) in which Z is a group chosen from dimethylphenyl, trifluoromethylphenyl and bistrifluoromethylphenyl are preferred compounds according to the invention.
According to the present invention, the compounds of formula (I) are preferred in which- Ar represents 3,4-dichlorophenyl or 3,4-difluorophenyl;
- Z represents 3,5-dimethylphenyl, 3,5-bis (trifluoromethyl) phenyl or 2,4-bis (trifluoromethyl) phenyl;
- and either n = 0, 1 or 2 and Am represents a) or b), - or n = 0 and Am represents c);
- A ⊖ represents a pharmaceutically acceptable anion.
According to the present invention, the compounds of formula:
Most particularly, the pharmaceutically acceptable salts of the compounds of formula:
and their possible solvates.
According to another of its aspects, the present invention relates to a process for the preparation of the compounds of formula (I) characterized in that:- 1) a compound of formula is treated:
with a halogenated derivative of formula:
Hal-CH 2 -Z (III)
wherein Z is as defined for (I) and Hal represents a halogen atom, preferably bromine or chlorine; - 2) the O-protecting group is transformed into a hydroxyl group by the action of an acid or a base;
- 3) the alcohol thus obtained is treated with the formula:
- 4) reacting the compound thus obtained of formula:
with a secondary or tertiary amine AmH or Am in an organic solvent, at a temperature between room temperature and 120 ° C; - 5) the product thus obtained is isolated and, optionally, the sulfonate anion is exchanged with another anion, and, optionally, the product thus obtained is transformed into one of its salts.
In step 2, the deprotection is carried out in an acid medium, for example in the presence of hydrochloric acid when E represents a tetrahydropyran-2-yl or in a basic medium, for example in the presence of sodium hydroxide or hydroxide when E represents a benzoyl or a C 1 -C 4 acyl.
At the last step the sulfonate anion can be exchanged, in situ or after isolation of the compound of formula (I) in which A ⊖ is the sulfonate ion, by another anion A ⊖ , according to conventional methods, for example by exchange in solution with a saturated solution of sodium chloride or, with a hydrochloric acid solution when A ⊖ represents a chloride anion, or by exchange of the anion by elution of the compound (I) on an ion exchange resin, by example the Amberlite IRA68 or Duolite A375.
When Am represents a group a), the quaternary ammonium salts formed with the piperidine nitrogen are prepared by reaction of the free bases of the compounds of formula (I) with an excess of alkylating agent of formula: AR 1 in which A is as defined above for (I), preferably a chloride or an iodide and R 1 is as defined above for (I) and the reaction mixture is heated in a solvent, for example dichloromethane, chloroform, acetone or acetonitrile, at a temperature between room temperature and reflux, for one to several hours, to obtain, after treatment according to the usual methods, a mixture of the axial and equatorial isomers of the quaternary ammonium salts. Preferably, A ⊖ represents an iodide which can be exchanged with another anion or with a pharmaceutically acceptable anion, for example by elution of the compound (I) on an ion exchange resin, such as Amberlite IRA68 or Duolite A375. The isomers are separated according to the usual methods, for example by chromatography or by recrystallization.
The resolution of racemic mixtures of compounds (I) or intermediates such as (IV) makes it possible to isolate the enantiomers using methods known to those skilled in the art.
The preparation of the compounds of formula (II) is carried out according to the methods described in EP-A-0 512 901.
The halogenated derivatives of formula (III) are known or are prepared by known methods.
4-phenylpiperidine, 4-benzylpiperidine, 4-hydroxy-4-phenylpiperidine and 4-hydroxy-4-benzylpiperidine are commercially available.
4-phenyl-1-wabicyclo [2.2.2] octane, or 4-phenylquinuclidine and 4-benzyl-1-azabicyclo [2.2.2] octane or 4-benzylquinuclidine are prepared according to T. Perrine, J. Org. Chem., 1957, 22 , 1484-1489.
The compounds of formula (I) above also include those in which one or more atoms of hydrogen, carbon, fluorine or iodine have been replaced by their radioactive isotope for example tritium, carbon-14, fluor-19 or iodine 125. Such labeled compounds are useful in research, metabolism, pharmacokinetics or in biochemical tests as receptor ligands and can be used as pharmacological tools in humans or animals.
The compounds according to the invention have been the subject of biochemical tests.
The affinity of the compounds of formula (I) for the tachykinin receptors was evaluated in vitro by several biochemical tests using radioligands:- 1) The binding of [ 125 I] BH-SP (P substance labeled with iodine 125 using the Bolton-Hunter reagent) to the NK 1 receptors of human lymphoblastic cells.
- 2) The [ 125 I] His-NK A binding to the NK 2 receptors of the duodenum or of the rat bladder.
- 3 °) [ 125 I] His [MePhe 7 ] NK B binding to the NK 3 receptors of the rat cerebral cortex, of the guinea pig cerebral cortex and of the gerbil cerebral cortex as well as to the human NK 3 clone receptors expressed by cells CHO (Buell et al., FEBS Letters, 1992, 299 , 90-95).
The tests were carried out according to X. Emonds-Alt et al. (Eur. J. Pharmacol., 1993, 250 , 403-413).
The compounds according to the invention strongly inhibit the binding to the NK 1 receptors of IM9 human lymphoblastic cells. the inhibition constant Ki for lymphoblastic cell receptors is less than 5.10 -9 M. For the same compounds it has been found that the inhibition constant (Ki) for human cloned NK 3 receptors is greater than or equal to 10 - 7 M and that the inhibition constant (Ki) for the duodenum or rat bladder NK 2 receptor is greater than or equal to 10 -7 M.
The activity of the compounds according to the present invention as inhibitors of binding to NK 1 receptors is clearly greater than that of neighboring compounds described in the prior art.
Thus, the axial isomer of 1-methyl-1- [2- [1- [3,5-bis (trifluoromethyl) benzyl] -5- (3,4-dichlorophenyl) -2-oxopiperid-5 iodide -yl] ethyl] -4-phenylpiperidinium has a Ki inhibition constant for substance P at the human lymphoblastic receptor of the order of 0.1.10 -9 M whereas 5- [2- (4-benzyl- 1-piperid-1-yl) ethyl] -5- (3,4-dichlorophenyl) -1-benzylpiperid-2-one described in application EP-0 512 901 in Example 1 (compound unsubstituted on benzyl) exhibits an inhibition constant Ki of the order of 10 -6 M measured under the same conditions.
Similarly 4- (3,4-dichlorophenyl) -4- [2- (4-hydroxy-4-phenylpiperid-1-yl) ethyl] -1- [3,5-bis (trifluoromethyl) benzyl] pyrrolidin hydrochloride -2-one has an inhibition constant Ki of substance P at the human lymphoblastic receptor of the order of 0.1.10 -9 M while 1-benzyl-4- (3,4-dichlorophenyl) -4 hydrochloride - [2- (4-hydroxy-4-phenylpiperid-1-yl) ethyl] piperid-2-one described in application EP-0 512 901 in Example 3 has a Ki of the order of 10 -6 M measured under the same conditions.
The compounds of the present invention are in particular active principles of pharmaceutical compositions, the toxicity of which is compatible with their use as medicaments.
The compounds of formula (I) above can be used in daily doses of 0.01 to 100 mg per kg of body weight of the mammal to be treated, preferably in daily doses of 0.1 to 50 mg / kg. In humans, the dose may preferably vary from 0.5 to 4000 mg per day, more particularly from 2.5 to 1000 mg per day depending on the age of the subject to be treated or the type of treatment: prophylactic or curative .
For their use as medicaments, the compounds of formula (I) are generally administered in dosage units. Said dosage units are preferably formulated in pharmaceutical compositions in which the active principle is mixed with a pharmaceutical excipient.
Thus, according to another of its aspects, the present invention relates to pharmaceutical compositions containing, as active principle, a compound of formula (I).
In the pharmaceutical compositions of the present invention for oral, sublingual, inhaled, subcutaneous, intramuscular, intravenous, transdermal, local or rectal administration, the active ingredients can be administered in unit administration forms, in admixture with conventional pharmaceutical carriers, animals and humans. Suitable unit administration forms include oral forms such as tablets, capsules, powders, granules and oral solutions or suspensions, sublingual and oral administration forms, aerosols, implants, forms subcutaneous, intramuscular, intravenous, intranasal or intraocular administration and forms of rectal administration.
When preparing a solid composition in the form of tablets, the main active principle is mixed with a pharmaceutical vehicle such as silica, gelatin, starch, lactose, magnesium stearate, talc, gum arabic or the like. The sucrose tablets can be coated with various polymers, or other suitable materials, or else they can be treated so that they have a prolonged or delayed activity and that they continuously release a predetermined quantity of active principle.
A preparation in capsules is obtained by mixing the active principle with a diluent such as a glycol or a glycerol ester and by incorporating the mixture obtained in soft or hard capsules.
A preparation in the form of a syrup or elixir may contain the active principle together with a sweetener, preferably calorie-free, methylparaben and propylparaben as an antiseptic, as well as a flavoring agent and an appropriate color.
The water-dispersible powders or granules may contain the active principle in admixture with dispersing agents or wetting agents, or suspending agents, such as polyvinylpyrrolidone, as well as with sweeteners or taste.
Suppositories are used for rectal administration which are prepared with binders that melt at rectal temperature, for example cocoa butter or polyethylene glycols.
For parenteral, intranasal or intraocular administration, aqueous suspensions, isotonic saline solutions or sterile and injectable solutions are used which contain pharmacologically compatible dispersing agents and / or wetting agents, for example propylene glycol or butylene glycol.
For administration by inhalation, an aerosol is used containing for example sorbitan trioleate or oleic acid as well as trichlorofluoromethane, dichlorofluoromethane, dichlorotetrafluoroethane or any other biologically compatible propellant; one can also use a system comprising the active principle, alone or associated with an excipient, in powder form.
The active principle can also be formulated in the form of microcapsules, optionally with one or more carriers or additives.
In each dosage unit the active principle of formula (I) is present in the quantities adapted to the daily doses envisaged. In general each dosage unit is suitably adjusted according to the dosage and the type of administration intended, for example tablets, capsules and the like, sachets, ampoules, syrups and the like, drops so that such a dosage unit contains 0.5 to 1000 mg of active ingredient, preferably 2.5 to 250 mg, to be administered one to four times a day.
According to another of its aspects, the present invention relates to the use of the products of formula (I) for the preparation of medicaments intended to treat physiological disorders associated with an excess of tachykinins, in particular of Substance P and all Substance-P pathologies -dependent on the respiratory, gastrointestinal, urinary, immune, cardiovascular and central nervous systems as well as pain and migraine.
For example and without limitation:- acute and chronic pain related for example to migraine, pain of cancer and angina, chronic inflammatory processes such as osteoarthritis and rheumatoid arthritis,
- inflammations such as chronic obstructive respiratory diseases, asthma, allergies, rhinitis, coughs, bronchitis, hypersensitivity for example to pollens and mites, rheumatoid arthritis, osteoarthritis, psoriasis, ulcerative colitis , Crohn's disease, inflammation of the intestines (irritable colon), prostatitis, neurological bladder, cystitis, urethritis, nephritis,
- immune system diseases linked to the suppression or stimulation of immune cell functions, for example rheumatoid arthritis, psoriasis, Crohn's disease, diabetes, lupus,
- diseases of the central nervous system of the neuropsychiatric or neurological type such as anxiety, depression, psychosis, schizophrenia, mania, dementia, epilepsy, Parkinson's disease, Alzheimer's disease, drugs- addiction, Down syndrome and Huntington's chorea as well as neurodegenerative diseases,
- diseases of the gastrointestinal system such as nausea, vomiting, irritable colon, gastric and duodenal ulcers, diarrhea, hypersecretions,
- diseases of the cardiovascular system such as hypertension, vascular aspects of migraine, edema, thrombosis, angina and vascular spasms,
- heart rate and rhythm disorders, especially those caused by pain or stress.
The present invention also includes a method for treating said conditions at the doses indicated above.
In the Preparations and in the examples the following abbreviations are used:
EtOH: ethanol
MeOH: methanol
Ether: diethyl ether
Iso ether: diisopropyl ether
DMF: dimethylformamide
AcOEt: ethyl acetate
DCM: dichloromethane
THF: tetrahydrofuran
NaOH: soda
KHCO 3 : potassium hydrogen carbonate
NaHCO 3 : sodium hydrogen carbonate
NaCl: sodium chloride
Triton B: 40% solution of N-benzyltrimethylammonium hydroxide in MeOH.
Na 2 SO 4 : sodium sulfate
MgSO 4 : magnesium sulfate
iPr: isopropyl
RT: room temperature
F: melting point
NMR: nuclear magnetic resonance.
s: singlet
sd: split singlet
d: doublet
sept: septuplet
m: massive
mult: multiplet - at)
20 g d'hydrure de sodium à 55-60 % dans l'huile sont mis en suspension dans 200 ml de tétrahydrofurane sec. On ajoute goutte à goutte à 20°C, en 30 minutes, une solution de 85 g de 3,4-dichlorophénylacétonitrile dans 500 ml de THF puis on agite le mélange réactionnel à TA pendant 2 heures. Le mélange est refroidi à -20°C et on ajoute une solution de 98 g de 2-(2-bromoéthoxy)tétrahydropyrane dans 100 ml de THF, on laisse revenir le mélange à TA et après 2 heures on ajoute une solution de 50 g de chlorure d'ammonium dans 3 litres d'eau. On extrait avec 1,5 litres d'éther, lave avec une solution saturée de chlorure de sodium, décante, sèche sur MgSO4 et concentre sous vide.20 g of 55-60% sodium hydride in oil are suspended in 200 ml of dry tetrahydrofuran. A solution of 85 g of 3,4-dichlorophenylacetonitrile in 500 ml of THF is added dropwise at 20 ° C over 30 minutes, then the reaction mixture is stirred at RT for 2 hours. The mixture is cooled to -20 ° C. and a solution of 98 g of 2- (2-bromoethoxy) tetrahydropyran in 100 ml of THF is added, the mixture is allowed to return to RT and after 2 hours a solution of 50 g is added of ammonium chloride in 3 liters of water. Extracted with 1.5 liters of ether, washed with a saturated solution of sodium chloride, decanted, dried over MgSO 4 and concentrated in vacuo.
Le résidu est chromatographié sur gel de silice, éluant : dichlorométhane. Les fractions de produit pur sont concentrées sous vide pour fournir 83,6 g d'une huile.The residue is chromatographed on silica gel, eluent: dichloromethane. The pure product fractions are concentrated in vacuo to provide 83.6 g of an oil.
21 g du nitrile préparé précédemment selon A) sont mis en solution dans 100 ml de THF, puis on ajoute goutte à goutte et à température ambiante une solution de 0,067 mole de diisopropylamidure de lithium dans 100 ml de THF et agite le mélange réactionnel pendant une heure à TA. On ajoute alors 12 g de 3-bromopropionate d'éthyle et chauffe à 50°C pendant deux heures. Le mélange est refroidi on le verse dans une solution saturée de chlorure d'ammonium et extrait à l'éther, puis on lave à l'eau, sépare la phase éthérée par décantation, la sèche sur Na2SO4 et concentre sous vide. Le résidu est purifié par chromatographie sur gel de silice, éluant : dichlorométhane/acétate d'éthyle 100/1 (v/v). La concentration des fractions pures fournit 13 g du composé attendu.21 g of the nitrile previously prepared according to A) are dissolved in 100 ml of THF, then a solution of 0.067 mole of lithium diisopropylamide in 100 ml of THF is added dropwise and at ambient temperature and the reaction mixture is stirred for hour at TA. 12 g of ethyl 3-bromopropionate are then added and the mixture is heated at 50 ° C. for two hours. The mixture is cooled, poured into a saturated solution of ammonium chloride and extracted with ether, then washed with water, the ethereal phase is separated by decantation, dried over Na 2 SO 4 and concentrated in vacuo. The residue is purified by chromatography on silica gel, eluent: dichloromethane / ethyl acetate 100/1 (v / v). The concentration of the pure fractions provides 13 g of the expected compound.
13 g du composé préparé précédemment sont mis en solution dans 250 ml d'éthanol et 40 ml d'ammoniaque et sont hydrogénés à température ambiante et pression atmosphérique en présence de nickel de Raney®. Lorsque le volume théorique d'hydrogène est absorbé, on filtre le mélange sur Célite® et on concentre le filtrat sous vide. Le résidu est repris dans l'eau, extrait à l'éther, puis on lave la phase éthérée à l'eau, la sèche sur MgSO4 et concentre sous vide pour obtenir 9 g du produit attendu.13 g of the compound prepared above are dissolved in 250 ml of ethanol and 40 ml of ammonia and are hydrogenated at room temperature and atmospheric pressure in the presence of Raney® nickel. When the theoretical volume of hydrogen is absorbed, the mixture is filtered on Celite® and the filtrate is concentrated under vacuum. The residue is taken up in water, extracted with ether, then the ethereal phase is washed with water, dried over MgSO 4 and concentrated in vacuo to obtain 9 g of the expected product.
14,4 g d'hydrure de sodium à 60 % dans l'huile sont mis en suspension dans 250 ml de THF et refroidis dans un bain d'eau. On ajoute goutte à goutte une solution de 50 g de 3,4-difluorophénylacétonitrile dans 50 ml de THF puis on laisse 3 heures à TA et on ajoute goutte à goutte une solution de 68,16 g de 2-(2-bromoéthoxy)tétrahydropyrane dans 100 ml de THF. Après une nuit à TA, on acidifie avec un tampon pH2, évapore le THF, reprend par de l'eau et extrait à l'éther. On lave 2 fois avec une solution tampon pH4, puis on lave à l'eau et par une solution saturée de chlorure de sodium. On décante, sèche la phase organique sur MgSO4 et concentre sous vide. Le résidu est chromatographié sur silice en éluant par du toluène pur puis contenant jusqu'à 3 % d'AcOEt. On obtient 49,5 g du produit attendu.14.4 g of 60% sodium hydride in oil are suspended in 250 ml of THF and cooled in a water bath. A solution of 50 g of 3,4-difluorophenylacetonitrile in 50 ml of THF is added dropwise, then the mixture is left at RT for 3 hours and a solution of 68.16 g of 2- (2-bromoethoxy) tetrahydropyran is added dropwise in 100 ml of THF. After one night at RT, acidified with a pH2 buffer, the THF is evaporated, taken up in water and extracted with ether. Wash 2 times with a pH4 buffer solution, then wash with water and with a saturated solution of sodium chloride. Decanted, dried the organic phase on MgSO 4 and concentrated under vacuum. The residue is chromatographed on silica eluting with pure toluene then containing up to 3% AcOEt. 49.5 g of the expected product are obtained.
Le produit obtenu à l'étape précédente (28,12 g) est placé dans 100 ml de THF, on ajoute 1 ml de Triton B et on chauffe à reflux puis on ajoute goutte à goutte 9,46 g d'acrylate de méthyle. On laisse revenir à TA, évapore le solvant, reprend par de l'eau et extrait à l'éther. On lave 2 fois par de l'eau, 2 fois par une solution tampon à pH4, par de l'eau puis par une solution saturée de chlorure de sodium. On décante, sèche la phase organique sur MgSO4 et concentre sous vide pour obtenir 34,6 g du produit attendu.The product obtained in the previous step (28.12 g) is placed in 100 ml of THF, 1 ml of Triton B is added and the mixture is heated to reflux and then 9.46 g of methyl acrylate are added dropwise. The mixture is left to return to RT, the solvent is evaporated, taken up in water and extracted with ether. Wash twice with water, twice with a pH4 buffer solution, with water and then with a saturated solution of sodium chloride. Decanted, dried the organic phase over MgSO 4 and concentrated in vacuo to obtain 34.6 g of the expected product.
Le produit (34,6 g) obtenu à l'étape précédente est mis en solution dans 500 ml d'EtOH 95. On ajoute 5 g de KHCO3 solide puis du nickel de Raney®. On hydrogène à 60°C sous 20,4 bars. Après 4 heures, on filtre sur Célite® et évapore le solvant. On reprend par de l'eau, extrait par AcOEt, lave 2 fois à l'eau et par une solution saturée de chlorure de sodium. On sèche la phase organique sur MgSO4 et concentre sous vide. On obtient 32 g du produit attendu.The product (34.6 g) obtained in the previous step is dissolved in 500 ml of EtOH 95. 5 g of solid KHCO 3 are added, then Raney® nickel. Hydrogenation is carried out at 60 ° C. under 20.4 bars. After 4 hours, filter through Celite® and evaporate the solvent. It is taken up in water, extracted with AcOEt, washed twice with water and with a saturated solution of sodium chloride. The organic phase is dried over MgSO 4 and concentrated in vacuo. 32 g of the expected product are obtained.
5,9 g d'hydrure de sodium à 55 % dans l'huile sont mis en suspension dans 50 ml de THF ; on refroidit dans un bain de glace et on ajoute goutte à goutte 25 g de 3,4-dichlorophénylacétonitrile dans 25 ml de THF; on refroidit à nouveau dans un bain de glace et on ajoute goutte à goutte 26,21 g de 4-bromobutanoate d'éthyle en solution dans 25 ml de THF. Après une nuit à TA, on évapore à sec puis on reprend par une solution d'acide chlorhydrique 2N et extrait à l'éther. On lave par une solution d'acide chlorhydrique 2N puis par une solution saturée de chlorure de sodium. On sèche la phase organique sur MgSO4 puis concentre sous vide et on chromatographie le résidu sur silice en éluant par du toluène pur jusqu'à un mélange toluène/AcOEt (100/3 ; v/v). On obtient 17 g du produit attendu.5.9 g of 55% sodium hydride in oil are suspended in 50 ml of THF; cooled in an ice bath and 25 g of 3,4-dichlorophenylacetonitrile in 25 ml of THF are added dropwise; again cooled in an ice bath and 26.21 g of ethyl 4-bromobutanoate dissolved in 25 ml of THF are added dropwise. After one night at RT, evaporated to dryness and then taken up in a 2N hydrochloric acid solution and extracted with ether. Washing is carried out with a 2N hydrochloric acid solution and then with a saturated sodium chloride solution. The organic phase is dried over MgSO 4 then concentrated under vacuum and the residue is chromatographed on silica eluting with pure toluene until a toluene / AcOEt mixture (100/3; v / v). 17 g of the expected product are obtained.
2,5 g d'hydrure de sodium à 55 % dans l'huile sont mis en suspension dans 50 ml de DMF, on refroidit à -20°C et on ajoute goutte à goutte un mélange de 11,8 g de 2-(2-bromoéthoxy)tétrahydropyrane et 17 g du composé obtenu à l'étape précédente dans 50 ml de DMF. Après une nuit à TA, on évapore à sec, reprend par une solution tampon pH4 puis extrait par AcOEt. On lave avec une solution tampon pH4, lave à l'eau puis par une solution saturée de chlorure de sodium. La phase organique est séchée sur MgSO4 puis concentrée et le résidu est chromatographié sur silice en éluant par du toluène pur jusqu'à un mélange toluène/AcOEt (100/10 ; v/v). On obtient 15,4 g du produit attendu.2.5 g of 55% sodium hydride in oil are suspended in 50 ml of DMF, the mixture is cooled to -20 ° C. and a mixture of 11.8 g of 2- ( 2-bromoethoxy) tetrahydropyran and 17 g of the compound obtained in the previous step in 50 ml of DMF. After overnight at RT, evaporated to dryness, taken up in a pH4 buffer solution and then extracted with AcOEt. Washing is carried out with a pH4 buffer solution, washing with water and then with a saturated solution of sodium chloride. The organic phase is dried over MgSO 4 then concentrated and the residue is chromatographed on silica, eluting with pure toluene until a toluene / AcOEt mixture (100/10; v / v). 15.4 g of the expected product are obtained.
Le produit obtenu à l'étape précédente (15,4 g) est mis en solution dans 200 ml de MeOH, on ajoute 25 ml d'une solution saturée d'ammoniac dans le MeOH puis on hydrogène à 40°C sous pression atmosphérique en présence de nickel de Raney®. On filtre le catalyseur, évapore à sec et reprend le résidu par de l'éther. On lave à l'eau, par une solution saturée de chlorure de sodium, sèche sur MgSO4 et concentre sous vide pour obtenir 12,8 g du produit attendu.The product obtained in the previous step (15.4 g) is dissolved in 200 ml of MeOH, 25 ml of a saturated solution of ammonia in MeOH are added, then hydrogenation is carried out at 40 ° C under atmospheric pressure. presence of Raney® nickel. The catalyst is filtered, evaporated to dryness and the residue is taken up in ether. Washed with water, with a saturated solution of sodium chloride, dried over MgSO 4 and concentrated in vacuo to obtain 12.8 g of the expected product.
Le produit obtenu à l'étape précédente (12,8 g) est mis en solution dans 200 ml de xylène et chauffé à reflux pendant 48 heures. On évapore à sec puis on chromatographie le résidu sur silice en éluant par DCM pur jusqu'à un mélange DCM/MeOH (98/2 ; v/v). On obtient 10,1 g du produit attendu.The product obtained in the previous step (12.8 g) is dissolved in 200 ml of xylene and heated at reflux for 48 hours. Evaporated to dryness and then the residue is chromatographed on silica, eluting with pure DCM until a DCM / MeOH mixture (98/2; v / v). 10.1 g of the expected product are obtained.
Ce composé est préparé à la Préparation 1, étape A.This compound is prepared in Preparation 1, step A.
57 g du composé de l'étape A sont mis en solution dans 150 ml de DMF. On ajoute par petites fractions 7,85 g d'hydrure de sodium à 55 % dans l'huile. Après 1 heure de chauffage à 60°C, on refroidit à TA et ajoute goutte à goutte 30,8 g de bromoacétate d'éthyle dans 50 ml de DMF. Après 2 heures sous agitation à TA, on évapore le DMF sous pression réduite, on extrait à l'éther puis lave à l'eau jusqu'à pH neutre. Après séchage sur MgSO4 et évaporation des solvants, le résidu est chromatographié sur silice en éluant par un mélange DCM/AcOEt (95/5 ; v/v). On obtient 29 g du composé attendu.57 g of the compound from step A are dissolved in 150 ml of DMF. 7.85 g of 55% sodium hydride in oil are added in small portions. After 1 hour of heating to 60 ° C., the mixture is cooled to RT and 30.8 g of ethyl bromoacetate in 50 ml of DMF are added dropwise. After 2 hours with stirring at RT, the DMF is evaporated under reduced pressure, extracted with ether and then washed with water until neutral pH. After drying over MgSO 4 and evaporation of the solvents, the residue is chromatographed on silica, eluting with a DCM / AcOEt mixture (95/5; v / v). 29 g of the expected compound are obtained.
On hydrogène à pression atmosphérique et TA 8 g du composé obtenu à l'étape B en solution dans 100 ml d'EtOH 100, 5 ml d'eau et 0,6 g de NaHCO3. On filtre le catalyseur et évapore sous vide le filtrat. On extrait le résidu au DCM, lave à l'eau, sèche sur MgSO4 et évapore sous vide le solvant. On obtient 6 g du produit attendu.Hydrogenation is carried out at atmospheric pressure and TA 8 g of the compound obtained in step B in solution in 100 ml of EtOH 100, 5 ml of water and 0.6 g of NaHCO 3 . The catalyst is filtered and the filtrate is evaporated under vacuum. The residue is extracted with DCM, washed with water, dried over MgSO 4 and the solvent is evaporated under vacuum. 6 g of the expected product are obtained.
A 10 g de 3,4-dichlorophénylacétonitrile en solution dans 50 ml de THF, on ajoute 4,3 g d'hydrure de sodium à 60 % dans l'huile et on laisse sous agitation jusqu'à la fin du dégagement d'hydrogène. On refroidit à 0°C et ajoute goutte à goutte 18 g de bromoacétate d'éthyle en solution dans 50 ml de THF. On laisse revenir à TA et laisse une nuit sous agitation. On évapore à sec, reprend à l'éther, lave avec une solution tampon à pH = 2 et sèche sur MgSO4. On chromatographie le résidu sur silice en éluant par un mélange DCM/AcOEt (80/20 ; v/v). On obtient 15 g du composé attendu.To 10 g of 3,4-dichlorophenylacetonitrile dissolved in 50 ml of THF, 4.3 g of 60% sodium hydride in oil is added and the mixture is stirred until the evolution of hydrogen is complete. . The mixture is cooled to 0 ° C. and 18 g of ethyl bromoacetate dissolved in 50 ml of THF are added dropwise. It is left to return to RT and left to stir overnight. Evaporated to dryness, taken up in ether, washed with a buffer solution at pH = 2 and dried over MgSO 4 . The residue is chromatographed on silica, eluting with a DCM / AcOEt mixture (80/20; v / v). 15 g of the expected compound are obtained.
15 g du composé obtenu à l'étape précédente sont mis en solution dans 100 ml d'éthanol et hydrogénés à TA et à pression atmosphérique en présence de nickel de Raney®. Quand le volume théorique d'hydrogène à consommer est atteint, on filtre le catalyseur, évapore à sec, reprend à l'éther, lave à l'eau et sèche sur MgSO4 . On obtient 12 g du composé attendu.15 g of the compound obtained in the previous step are dissolved in 100 ml of ethanol and hydrogenated at AT and at atmospheric pressure in the presence of Raney® nickel. When the theoretical volume of hydrogen to be consumed is reached, the catalyst is filtered, evaporated to dryness, taken up in ether, washed with water and dried over MgSO 4 . 12 g of the expected compound are obtained.
12 g du produit obtenu à l'étape précédente et 6 g de borohydrure de calcium sont mis en solution dans 50 ml de THF. Après 2 heures sous agitation à 0°C, on laisse revenir à TA puis on verse le milieu réactionnel sur de l'eau et acidifie à pH 1 par addition d'une solution concentrée d'acide chlorhydrique. On extrait à l'acétate d'éthyle, lave à l'eau et sèche sur MgSO4. Le résidu est chromatographié sur silice en éluant par le mélange DCM/MeOH (100/5 ; v/v). On obtient 10 g du composé attendu.12 g of the product obtained in the previous step and 6 g of calcium borohydride are dissolved in 50 ml of THF. After 2 hours with stirring at 0 ° C., the mixture is allowed to return to RT then the reaction medium is poured onto water and acidified to pH 1 by addition of a concentrated solution of hydrochloric acid. Extraction is carried out with ethyl acetate, washing with water and drying over MgSO 4 . The residue is chromatographed on silica, eluting with a DCM / MeOH mixture (100/5; v / v). 10 g of the expected compound are obtained.
A 10 g du produit obtenu à l'étape précédente, en solution dans 50 ml de DCM avec 0,1 g d'acide paratoluènesulfonique, on ajoute goutte à goutte à 0°C 3 g de 3,4-dihydro-2H-pyrane en solution dans 10 ml de THF. On laisse ensuite une nuit à TA, évapore à sec, reprend par de l'éther, lave à l'eau, par une solution de NaHCO3 saturée et sèche sur MgSO4. Le résidu est chromatographié sur silice en éluant par un mélange DCM/MeOH (100/5 ; v/v). On obtient 12 g du composé attendu.To 10 g of the product obtained in the previous step, dissolved in 50 ml of DCM with 0.1 g of paratoluenesulfonic acid, 3 g of 3,4-dihydro-2H-pyrane are added dropwise at 0 ° C in solution in 10 ml of THF. Then left overnight at RT, evaporated to dryness, taken up in ether, washed with water, with a saturated NaHCO 3 solution and dried over MgSO 4 . The residue is chromatographed on silica, eluting with a DCM / MeOH mixture (100/5; v / v). 12 g of the expected compound are obtained.
A une solution de 13,35 g de 3,4-dichlorophénylacétonitrile dans 100 ml de THF, on ajoute à TA et par petites fractions 2,8 g d'hydrure de sodium à 60 % dans l'huile et laisse 3 heures sous agitation à TA. On refroidit à -20°C le mélange réactionnel, ajoute goutte à goutte une solution de 16 g de 2-(3-bromopropoxy)tétrahydropyrane dans 30 ml de THF et laisse 3 heures sous agitation en laissant remonter la température à TA. On concentre sous vide le mélange réactionnel, extrait le résidu à l'éther, lave la phase organique à l'eau, par une solution tampon pH = 4, à l'eau, sèche sur MgSO4 et évapore sous vide le solvant. On chromatographie le résidu sur silice en éluant par le mélange toluène/AcOEt (100/3 ; v/v). On obtient 11 g du produit attendu.To a solution of 13.35 g of 3,4-dichlorophenylacetonitrile in 100 ml of THF, 2.8 g of 60% sodium hydride in oil are added at RT and in small portions and the mixture is left stirring for 3 hours. at TA. The reaction mixture is cooled to -20 ° C., a solution of 16 g of 2- (3-bromopropoxy) tetrahydropyran in 30 ml of THF is added dropwise and the mixture is left stirring for 3 hours while allowing the temperature to rise to RT. The reaction mixture is concentrated under vacuum, the residue is extracted with ether, the organic phase is washed with water, with a buffer solution pH = 4, with water, dried over MgSO 4 and the solvent is evaporated under vacuum. The residue is chromatographed on silica, eluting with a toluene / AcOEt mixture (100/3; v / v). 11 g of the expected product are obtained.
A une solution de 11 g du composé obtenu à l'étape précédente et 1 ml de Triton B dans 25 ml de dioxane on ajoute à TA et goutte à goutte 3,3 g d'acrylate d'éthyle puis laisse 1 heure sous agitation à TA. On dilue le mélange réactionnel par ajout de 200 ml d'éther, lave quatre fois la phase organique à l'eau, par une solution saturée de chlorure de sodium, sèche sur MgSO4 et évapore sous vide le solvant. On obtient 11 g du produit attendu.To a solution of 11 g of the compound obtained in the preceding step and 1 ml of Triton B in 25 ml of dioxane, 3.3 g of ethyl acrylate is added at RT and drop by drop, then the mixture is left stirring for 1 hour at YOUR. The reaction mixture is diluted by adding 200 ml of ether, the organic phase is washed four times with water, with a saturated solution of sodium chloride, dried over MgSO 4 and the solvent is evaporated under vacuum. 11 g of the expected product are obtained.
On hydrogène à 40°C et sous 10,2 bars un mélange de 11 g du composé obtenu à l'étape précédente, 1 g de nickel de Raney® et 0,77 g de NaHCO3 dans 120 ml d'EtOH 95. On filtre le catalyseur sur Célite® et concentre sous vide le filtrat. On extrait le résidu au DCM, lave la phase organique à l'eau, par une solution saturée de chlorure de sodium, sèche sur MgSO4 et évapore sous vide le solvant. On chromatographie le résidu sur silice en éluant par le mélange DCM/MeOH (97/3 ; v/v). On obtient 6,8 g du produit attendu.A mixture of 11 g of the compound obtained in the preceding step, 1 g of Raney® nickel and 0.77 g of NaHCO 3 in 120 ml of EtOH 95 is hydrogenated at 40 ° C. and at 10.2 bars. filters the catalyst on Celite® and concentrates the filtrate under vacuum. The residue is extracted with DCM, the organic phase is washed with water and with saturated sodium chloride solution, dried over MgSO 4 and the solvent is evaporated under vacuum. The residue is chromatographed on silica, eluting with a DCM / MeOH mixture (97/3; v / v). 6.8 g of the expected product are obtained.
On agite une heure à TA, 1,86 g du composé obtenu à la PRÉPARATION 1 et 0,61 g du tert-butylate de potassium dans 30 ml de THF ; on ajoute 1,54 g de bromure de 3,5-bis(trifluorométhyl)benzyle et on chauffe à 50°C pendant 2 heures. On évapore à sec le milieu réactionnel. On reprend par 25 ml de méthanol, refroidit à 0°C, ajoute de l'éther chlorhydrique jusquà pH = 1 puis évapore à sec. On reprend le résidu obtenu par de l'acétate d'éthyle, lave 3 fois par de l'eau, sèche sur MgSO4, évapore sous vide le solvant et l'on obtient 2,6 g du produit attendu.One hour stirred at RT, 1.86 g of the compound obtained in PREPARATION 1 and 0.61 g of potassium tert- butoxide in 30 ml of THF; 1.54 g of 3,5-bis (trifluoromethyl) benzyl bromide are added and the mixture is heated at 50 ° C. for 2 hours. The reaction medium is evaporated to dryness. The residue is taken up in 25 ml of methanol, cooled to 0 ° C., hydrochloric ether is added to pH = 1 and then evaporated to dryness. The residue obtained is taken up in ethyl acetate, washed 3 times with water, dried over MgSO 4 , the solvent is evaporated under vacuum and 2.6 g of the expected product are obtained.
On refroidit à 0°C un mélange du produit obtenu à l'étape précédente (2,6 g) et 0,66 g de triéthylamine dans 30 ml de DCM. Puis on ajoute 0,63 g de chlorure de méthanesulfonyle dans 10 ml de DCM. Après 15 minutes, on évapore à sec puis on extrait à l'éther, lave à l'eau puis par une solution saturée de chlorure de sodium, sèche sur MgSO4, évapore sous vide le solvant et l'on obtient 2,95 g du produit attendu.A mixture of the product obtained in the previous step (2.6 g) and 0.66 g of triethylamine in 30 ml of DCM is cooled to 0 ° C. Then 0.63 g of methanesulfonyl chloride is added in 10 ml of DCM. After 15 minutes, evaporated to dryness then extracted with ether, washed with water and then with saturated sodium chloride solution, dried over MgSO 4 , the solvent evaporated under vacuum and 2.95 g is obtained of the expected product.
On chauffe à 80°C pendant 3 heures un mélange contenant le mésylate obtenu à l'étape précédente (2,95 g) et 1,41 g de 4-phénylquinuclidine dans 1,2 ml de DMF. Après évaporation à sec, on reprend par du DCM puis on lave deux fois par une solution d'acide chlorhydrique 2N puis par de l'eau. On sèche sur MgSO4, concentre sous vide puis on chromatographie sur silice en éluant par un mélange DCM/MeOH (95/5 ; v/v). On obtient 0,64 g du produit attendu après cristallisation dans le pentane, F =158-160°C.A mixture containing the mesylate obtained in the previous step (2.95 g) and 1.41 g of 4-phenylquinuclidine in 1.2 ml of DMF is heated at 80 ° C. for 3 hours. After evaporation to dryness, the residue is taken up in DCM and then washed twice with a 2N hydrochloric acid solution and then with water. It is dried over MgSO 4 , concentrated under vacuum and then chromatographed on silica, eluting with a DCM / MeOH mixture (95/5; v / v). 0.64 g of the expected product is obtained after crystallization from pentane, mp 158-160 ° C.
5 g du composé obtenu à la PRÉPARATION 2 sont mis en solution dans 90 ml de THF, on ajoute 1,89 g du tert-butylate de potassium et on laisse une heure à TA. Puis on ajoute goutte à goutte une solution de 4,75 g de bromure de 3,5-bis(trifluorométhyl)benzyle dans 30 ml de THF et laisse une nuit sous agitation à TA. On évapore, reprend par de l'eau, extrait par AcOEt puis on lave 2 fois à l'eau puis par une solution saturée de chlorure de sodium, sèche sur MgSO4 et évapore sous vide le solvant. On obtient 8,4 g du produit attendu.5 g of the compound obtained in PREPARATION 2 are dissolved in 90 ml of THF, 1.89 g of potassium tert- butoxide is added and the mixture is left at RT for one hour. Then a solution of 4.75 g of 3,5-bis (trifluoromethyl) benzyl bromide in 30 ml of THF is added dropwise and the mixture is left stirring at RT overnight. It is evaporated, taken up in water, extracted with AcOEt and then washed twice with water then with a saturated solution of sodium chloride, dried over MgSO 4 and the solvent evaporated under vacuum. 8.4 g of the expected product are obtained.
On met en solution dans 70 ml de méthanol le produit obtenu à l'étape précédente (8,4 g) et l'on ajoute une solution d'éther chlorhydrique jusqu'à obtenir un pH inférieur à 1. Après 15 minutes, on évapore, reprend le résidu par une solution saturée d'HCl gaz dans le MeOH et concentre sous vide le solvant. On reprend par DCM et lave par une solution à 5 % de NaHCO3 puis par une solution saturée de chlorure de sodium, sèche sur MgSO4 et évapore sous vide le solvant. On obtient 5,1 g du produit attendu qui cristallise dans l'éther. F = 120°C.The product obtained in the preceding step (8.4 g) is dissolved in 70 ml of methanol and a solution of hydrochloric ether is added until a pH below 1 is obtained. After 15 minutes, the product is evaporated. , takes up the residue in a saturated solution of HCl gas in MeOH and concentrates the solvent under vacuum. The residue is taken up in DCM and washed with a 5% NaHCO 3 solution and then with a saturated sodium chloride solution, dried over MgSO 4 and the solvent evaporated under vacuum. 5.1 g of the expected product are obtained, which crystallizes from ether. M = 120 ° C.
On prépare une solution de 4 g du composé obtenu à l'étape précédente dans 50 ml de DCM, on ajoute 1 g du triéthylamine puis on refroidit dans un bain de glace et on ajoute goutte à goutte 1,04 g de chlorure de méthanesulfonyle dans 20 ml de DCM. On évapore, reprend par de l'eau et extrait par AcOEt puis on lave successivement par de l'eau, une solution HCl 2N, de l'eau, une solution NaHCO3 à 5 %, de l'eau, une solution saturée de chlorure de sodium. On sèche sur MgSO4 et évapore sous vide le solvant. On obtient 4,7 g du produit attendu.A solution of 4 g of the compound obtained in the preceding step in 50 ml of DCM is prepared, 1 g of triethylamine is added, then it is cooled in an ice bath and 1.04 g of methanesulfonyl chloride are added dropwise in 20 ml of DCM. Evaporated, taken up in water and extracted with AcOEt, then washed successively with water, a 2N HCl solution, water, a 5% NaHCO 3 solution, water, a saturated solution of sodium chloride. It is dried over MgSO 4 and the solvent is evaporated under vacuum. 4.7 g of the expected product are obtained.
On mélange 0,60 g de 4-phénylquinuclidine et 1,5 g du produit obtenu à l'étape précédente dans le minimum de DMF et on chauffe à 100°C pendant 3 heures. On laisse revenir à TA, évapore, reprend au DCM puis on lave successivement par de l'eau, une solution HCl 2N (3 fois), de l'eau, une solution saturée de chlorure de sodium, sèche sur MgSO4 et évapore sous vide le solvant. On obtient 1 g du produit attendu après trituration dans l'éther, puis essorage. F = 125°C.0.60 g of 4-phenylquinuclidine and 1.5 g of the product obtained in the preceding step are mixed in the minimum of DMF and the mixture is heated at 100 ° C. for 3 hours. We leaves to return to RT, evaporates, resumes with DCM then washed successively with water, a 2N HCl solution (3 times), water, a saturated solution of sodium chloride, dried over MgSO 4 and evaporated under vacuum the solvent. 1 g of the expected product is obtained after trituration in ether, then wringing. Mp 125 ° C.
1 g du composé obtenu à la PREPARATION 3 est mis en solution dans 15 ml de THF, on ajoute 0,33 g de tert-butylate de potassium et on laisse 1 heure à TA puis on ajoute goutte à goutte 0,71 g de chlorure de 3,5-bis(trifluorométhyl)benzyle dans 5 ml de THF. Après 2 heures, on évapore, reprend par de l'eau et extrait par AcOEt puis on lave par de l'eau et une solution saturée de chlorure de sodium. On sèche sur MgSO4 et évapore sous vide le solvant. On obtient 1,5 g du produit attendu.1 g of the compound obtained in PREPARATION 3 is dissolved in 15 ml of THF, 0.33 g of potassium tert- butoxide is added and the mixture is left at RT for 1 hour and then 0.71 g of chloride is added dropwise of 3,5-bis (trifluoromethyl) benzyl in 5 ml of THF. After 2 hours, the mixture is evaporated, taken up in water and extracted with AcOEt, then washed with water and a saturated solution of sodium chloride. It is dried over MgSO 4 and the solvent is evaporated under vacuum. 1.5 g of the expected product are obtained.
1,5 g du produit obtenu à l'étape précédente sont mis en solution dans 20 ml de méthanol, on ajoute de l'éther chlorhydrique jusqu'à atteindre un pH inférieur à 1. Après 15 minutes, on évapore, reprend 2 fois par du méthanol chlorhydrique et évapore à sec pour obtenir 1,4 g du produit attendu.1.5 g of the product obtained in the previous step are dissolved in 20 ml of methanol, hydrochloric ether is added until a pH below 1 is reached. After 15 minutes, the mixture is evaporated and taken up twice. hydrochloric methanol and evaporated to dryness to obtain 1.4 g of the expected product.
On met en solution dans 15 ml de DCM, 1,4 g du produit obtenu à l'étape précédente, on ajoute 0,32 g de triéthylamine et on refroidit le milieu par un bain de glace. On ajoute goutte à goutte 0,33 g de chlorure de méthanesulfonyle dans 5 ml de DCM et on laisse revenir à TA. On évapore, reprend par de l'eau et extrait par AcOEt puis on lave à l'eau et par une solution saturée de chlorure de sodium. On sèche sur MgSO4, évapore le solvant, puis on chromatographie sur silice en éluant par DCM puis un mélange DCM/MeOH (99/1 ; v/v). On obtient 1,3 g du produit attendu.1.4 g of the product obtained in the preceding step are dissolved in 15 ml of DCM, 0.32 g of triethylamine is added and the medium is cooled by an ice bath. 0.33 g of methanesulfonyl chloride is added dropwise in 5 ml of DCM and let return to TA. Evaporated, taken up in water and extracted with AcOEt, then washed with water and with a saturated solution of sodium chloride. It is dried over MgSO 4 , the solvent is evaporated, then chromatography on silica eluting with DCM and then a DCM / MeOH mixture (99/1; v / v). 1.3 g of the expected product are obtained.
On mélange 0,48 g de 4-phénylquinuclidine et 1,3 g du produit obtenu à l'étape précédente dans un minimum de DMF et on chauffe à 100°C pendant 5 heures. Puis on ajoute 0,63 g d'iodure de sodium et on maintient le chauffage pendant 1 heure. On laisse revenir à TA, évapore le solvant puis reprend par de l'eau et extrait au DCM. On lave à l'eau, par une solution saturée de chlorure de sodium, sèche sur MgSO4 et évapore le solvant. On reprend par de l'éthanol puis on passe le milieu sur une résine chlorhydrique IRA68. On évapore, reprend au DCM et lave 3 fois par de l'eau, 2 fois par une solution HCl 2N, à nouveau 2 fois par de l'eau puis par une solution saturée en chlorure de sodium. On sèche sur MgSO4 et évapore le solvant. Le produit attendu est trituré dans l'éther puis essoré; on obtient 0,8 g, F = 157°C.0.48 g of 4-phenylquinuclidine and 1.3 g of the product obtained in the preceding step are mixed in a minimum of DMF and the mixture is heated at 100 ° C. for 5 hours. Then 0.63 g of sodium iodide is added and the heating is maintained for 1 hour. The mixture is allowed to return to AT, the solvent is evaporated and then taken up in water and extracted with DCM. Washed with water, with a saturated solution of sodium chloride, dried over MgSO 4 and the solvent evaporated. It is taken up in ethanol and then the medium is passed over an IRA68 hydrochloric resin. Evaporated, taken up in DCM and washed 3 times with water, 2 times with a 2N HCl solution, again 2 times with water and then with a saturated solution of sodium chloride. It is dried over MgSO 4 and the solvent is evaporated. The expected product is triturated in ether and then drained; 0.8 g is obtained, mp = 157 ° C.
En procédant comme à l'EXEMPLE 1, on a également préparé les composés décrits dans le tableau 1 ci-dessous.
Iodure de 1-méthyl-1-[2-[1-[3,5-bis(trifluorométhyl)benzyl]-5-(3,4-dichlorophényl)-2-oxopipérid-5-yl]éthyl]-4-phénylpipéridinium (isomère axial et isomère équatorial).1-methyl-1- [2- [1- [3,5-bis (trifluoromethyl) benzyl] -5- (3,4-dichlorophenyl) -2-oxopiperid-5-yl] ethyl] -4-phenylpiperidinium iodide (axial isomer and equatorial isomer).
On mélange 2,79 g de 5-(2-mésyloxyéthyl)-5-(3,4-dichlorophényl)-1-[3,5-bis(trifluorométhyl)benzyl]pipérid-2-one préparé à l'exemple 1, étape B, 1,95 g de K2CO3 et 0,91 g de 4-phénylpipéridine dans 6 ml d'acétonitrile et 6 ml de DMF et on chauffe à 80°C pendant 4 heures. Après évaporation des solvants, on extrait à l'acétate d'éthyle, lave à l'eau puis par une solution saturée de NaCl. On sèche sur MgSO4, concentre puis on chromatographie sur silice en éluant par DCM/MeOH (100/1 ; v/v). On reprend un échantillon du produit obtenu dans une solution d'éther chlorhydrique et évapore le solvant. On obtient 0,365 g du produit attendu qui cristallise dans le mélange pentane/éther, F = 170°C2.79 g of 5- (2-mesyloxyethyl) -5- (3,4-dichlorophenyl) -1- [3,5-bis (trifluoromethyl) benzyl] piperid-2-one prepared in Example 1 are mixed, step B, 1.95 g of K 2 CO 3 and 0.91 g of 4-phenylpiperidine in 6 ml of acetonitrile and 6 ml of DMF and the mixture is heated at 80 ° C. for 4 hours. After evaporation of the solvents, extraction is carried out with ethyl acetate, washing with water and then with a saturated NaCl solution. It is dried over MgSO 4 , concentrated and then chromatographed on silica, eluting with DCM / MeOH (100/1; v / v). A sample of the product obtained is taken up in a hydrochloric ether solution and the solvent is evaporated. 0.365 g of the expected product is obtained, which crystallizes from a pentane / ether mixture, mp = 170 ° C.
On laisse sous agitation pendant 18 heures à TA un mélange comprenant 1,1 g du composé préparé à l'étape précédente sous forme de base dans 10 ml d'iodure de méthyle. On évapore l'iodure de méthyle en excès, reprend à l'éther, filtre puis on reprend par du DCM et évapore. Le résidu est chromatographié sur silice. En éluant par un mélange DCM-MeOH (100/3 ; v/v), on obtient le composé le moins polaire dans lequel le méthyle est en position axiale sur l'azote de la pipéridine, F = 128°C. En éluant par un mélange DCM-MeOH (100/15 ; v/v), on obtient le composé le plus polaire sur lequel le méthyle est en position équatoriale sur l'azote de la pipéridine, F =166°C.A mixture comprising 1.1 g of the compound prepared in the preceding step in the form of a base in 10 ml of iodide is left stirring for 18 hours at RT. methyl. Evaporate the excess methyl iodide, take up in ether, filter, then take up in DCM and evaporate. The residue is chromatographed on silica. By eluting with a DCM-MeOH mixture (100/3; v / v), the least polar compound is obtained in which the methyl is in the axial position on the nitrogen of the piperidine, M = 128 ° C. By eluting with a DCM-MeOH mixture (100/15; v / v), the most polar compound is obtained on which the methyl is in the equatorial position on the nitrogen of the piperidine, M = 166 ° C.
On agite pendant 1 heure à TA un mélange contenant 3 g du composé obtenu à la Préparation 4 et 0,959 g de tert-butylate de potassium dans 80 ml de THF, puis on ajoute 2,24 g de chlorure de 3,5-bis(trifluorométhyl)benzyle et on chauffe à 50°C pendant 3 heures. On refroidit à TA, évapore les solvants puis on extrait par AcOEt, lave à l'eau, par une solution saturée de chlorure de sodium. La phase organique est séchée sur MgSO4 puis concentrée et le résidu est chromatographié sur silice en éluant par DCM/MeOH (100/1 ; v/v). On obtient 2,3 g du produit attendu.A mixture containing 3 g of the compound obtained in Preparation 4 and 0.959 g of potassium tert- butoxide in 80 ml of THF is stirred for 1 hour at RT, then 2.24 g of 3.5-bis chloride ( trifluoromethyl) benzyl and heated to 50 ° C for 3 hours. Cooled to RT, the solvents are evaporated and then extracted with AcOEt, washed with water, with a saturated solution of sodium chloride. The organic phase is dried over MgSO 4 then concentrated and the residue is chromatographed on silica eluting with DCM / MeOH (100/1; v / v). 2.3 g of the expected product are obtained.
On dissout 2,3 g du composé obtenu à l'étape précédente dans 100 ml de méthanol et l'on ajoute de l'éther chlorhydrique jusqu'à pH inférieur à 1. On agite 15 minutes, évapore, reprend par AcOEt, lave à l'eau puis par une solution saturée de chlorure de sodium. On sèche sur Na2SO4 et évapore. 2 g de l'alcool ainsi obtenu sont placés dans 50 ml de DCM en présence de 0,61 g de triéthylamine et l'on ajoute goutte à goutte à froid une solution contenant 0,51 g de chlorure de méthanesulfonyle et 10 ml de DCM puis on agite à TA pendant 15 minutes. On évapore le milieu réactionnel, extrait à l'AcOEt, lave à l'eau, puis par une solution saturée de chlorure de sodium. Aprés séchage sur Na2SO4 et évaporation du solvant, on obtient 2 g du produit attendu.2.3 g of the compound obtained in the preceding step are dissolved in 100 ml of methanol and hydrochloric ether is added to a pH below 1. It is stirred for 15 minutes, evaporated, taken up in AcOEt, washed with water then with a saturated solution of sodium chloride. It is dried over Na 2 SO 4 and evaporated. 2 g of the alcohol thus obtained are placed in 50 ml of DCM in the presence of 0.61 g of triethylamine and a solution containing 0.51 g of methanesulfonyl chloride and 10 ml of DCM is added dropwise cold then stirred at RT for 15 minutes. The reaction medium is evaporated, extracted with AcOEt, washed with water, then with a saturated solution of sodium chloride. After drying over Na 2 SO 4 and evaporation of the solvent, 2 g of the expected product are obtained.
On chauffe à 80°C pendant 4 heures un mélange contenant 1,12 g du composé obtenu à l'étape précédente et 0,544 g de 4-phénylquinuclidine dans 2 ml de DMF. On refroidit à TA puis on ajoute de la glace et de l'eau. Le milieu réactionnel est extrait au DCM puis on lave 6 fois par HCl 2N, puis par de l'eau et par une solution saturée de chlorure de sodium. On sèche sur Na2SO4 et évapore sous vide le solvant. On obtient 0,78 g du produit attendu, F = 120-122°C.A mixture containing 1.12 g of the compound obtained in the preceding step and 0.544 g of 4-phenylquinuclidine in 2 ml of DMF is heated at 80 ° C. for 4 hours. Cool to RT then add ice and water. The reaction medium is extracted with DCM and then washed 6 times with 2N HCl, then with water and with a saturated solution of sodium chloride. It is dried over Na 2 SO 4 and the solvent is evaporated under vacuum. 0.78 g of the expected product is obtained, mp = 120-122 ° C.
Dans 2 ml de DMF on prépare un mélange contenant 1 g de 4-(3,4-dichlorophényl)-1-[3,5-bis(trifluorométhyl)benzy]-4-[2-(mésyloxy)éthyl] pyrrolidin-2-one obtenu à l'exemple 9, étape B, 0,875 g de 4-hydroxy-4-phénylpipéridine et 0,483 g de carbonate de potassium et on chauffe à 80°C pendant 3 heures. On laisse refroidir puis on ajoute de la glace, de l'eau et de l'acétate d'éthyle. On extrait par AcOEt, lave à l'eau puis par une solution de chlorure de sodium. Le produit pur est obtenu par chromatographie sur silice en éluant par un mélange DCM-MeOH (100/3 ; v/v). On prépare ensuite le chlorhydrate par action de l'acide chlorhydrique dans DCM. Le produit attendu cristallise dans un mélange pentane-éther, m = 0,555 g, F = 136-138C.A mixture containing 1 g of 4- (3,4-dichlorophenyl) -1- [3,5-bis (trifluoromethyl) benzy] -4- [2- (mesyloxy) ethyl] pyrrolidin-2 is prepared in 2 ml of DMF one obtained in Example 9, step B, 0.875 g of 4-hydroxy-4-phenylpiperidine and 0.483 g of potassium carbonate and the mixture is heated at 80 ° C. for 3 hours. The mixture is allowed to cool and then ice, water and ethyl acetate are added. Extraction is carried out with AcOEt, washing with water and then with a sodium chloride solution. The pure product is obtained by chromatography on silica, eluting with a DCM-MeOH mixture (100/3; v / v). The hydrochloride is then prepared by the action of hydrochloric acid in DCM. The expected product crystallizes from a pentane-ether mixture, m = 0.555 g, F = 136-138C.
On chauffe à 80°C pendant 4 heures un mélange de 2 g du composé obtenu à l'étape B de l'EXEMPLE 9, 0,67 g de 4-phénylpipéridine, 1,43 g de carbonate de potassium dans 6 ml d'acétonitrile et 6 ml de DMF. On concentre sous vide le mélange réactionnel, extrait le résidu à l'AcOEt, lave trois fois la phase organique à l'eau, par une solution saturée de chlorure de sodium, sèche sur Na2SO4 et évapore sous vide le solvant. On chromatographie le résidu sur silice en éluant par le mélange DCM/MeOH de (100/1; v/v) à (100/3 ; v/v). on dissout le produit obtenu dans du DCM, acidifie à pH = 1 par ajout d'une solution saturée d'HCl gaz dans l'éther et concentre sous vide. On obtient 0,39 g du produit attendu après cristallisation dans le pentane, F = 126-130°C.A mixture of 2 g of the compound obtained in step B of EXAMPLE 9, 0.67 g of 4-phenylpiperidine, 1.43 g of potassium carbonate in 6 ml of is heated at 80 ° C. for 4 hours. acetonitrile and 6 ml of DMF. The reaction mixture is concentrated under vacuum, the residue is extracted with AcOEt, the organic phase is washed three times with water and with saturated sodium chloride solution, dried over Na 2 SO 4 and the solvent is evaporated under vacuum. The residue is chromatographed on silica, eluting with a DCM / MeOH mixture from (100/1; v / v) to (100/3; v / v). the product obtained is dissolved in DCM, acidified to pH = 1 by adding a saturated solution of HCl gas in ether and concentrated in vacuo. 0.39 g of the expected product is obtained after crystallization from pentane, mp 126-130 ° C.
A une solution de 6,8 g du composé obtenu à la PREPARATION 5 dans 100 ml de THF, on ajoute 1,98 g de tert-butylate de potassium et laisse 1 heure sous agitation à TA. Puis on ajoute 4,62 g de chlorure de 3,5-bis(trifluorométhyl)benzyle et chauffe à 50'C pendant 2 heures le mélange réactionnel. On concentre sous vide, extrait le résidu à l'AcOEt, lave la phase organique à l'eau, par une solution saturée de NaCl, sèche sur MgSO4 et évapore sous vide le solvant. On chromatographie le résidu sur silice en éluant par le mélange DCM/MeOH (100/1 ; v/v). On obtient 10 g du produit attendu.To a solution of 6.8 g of the compound obtained in PREPARATION 5 in 100 ml of THF, 1.98 g of potassium tert- butoxide is added and the mixture is left stirring for 1 hour at RT. Then 4.62 g of 3,5-bis (trifluoromethyl) benzyl chloride is added and the reaction mixture is heated at 50 ° C. for 2 hours. It is concentrated under vacuum, the residue is extracted with AcOEt, the organic phase is washed with water, with a saturated NaCl solution, dried over MgSO 4 and the solvent is evaporated under vacuum. The residue is chromatographed on silica, eluting with a DCM / MeOH mixture (100/1; v / v). 10 g of the expected product are obtained.
A une solution de 10 g du composé obtenu à l'étape précédente dans 150 ml de MeOH, on ajoute jusqu'à pH < 1 une solution saturée d'HCl gaz dans l'éther et laisse 10 minutes sous agitation à TA. On concentre sous vide, extrait le résidu au DCM, lave la phase organique à l'eau, par une solution à 5 % de NaHCO3, par une solution saturée de NaCl, sèche sur MgSO4 et évapore sous vide le solvant. On obtient 8,8 g du produit attendu sous forme d'huile.To a solution of 10 g of the compound obtained in the preceding step in 150 ml of MeOH, a saturated solution of HCl gas in ether is added until pH <1 and the mixture is left stirring for 10 minutes at RT. It is concentrated under vacuum, the residue is extracted with DCM, the organic phase is washed with water, with a 5% NaHCO 3 solution, with a saturated NaCl solution, dried over MgSO 4 and the solvent evaporated under vacuum. 8.8 g of the expected product are obtained in the form of an oil.
On refroidit au bain de glace une solution de 8,8 g du composé obtenu à l'étape précédente et 2,51 g de triéthylamine dans 100 ml de DCM, ajoute goutte à goutte une solution de 2,09 g de chlorure de méthanesulfonyle dans 20 ml de DCM et laisse 10 minutes sous agitation. On concentre sous vide, extrait le résidu à l'AcOEt, lave la phase organique à l'eau, par une solution saturée de NaCl, sèche sur MgSO4 et évapore sous vide le solvant. On obtient 8,5 g du produit attendu.A solution of 8.8 g of the compound obtained in the preceding step and 2.51 g of triethylamine in 100 ml of DCM is cooled in an ice bath, a solution of 2.09 g of methanesulfonyl chloride in dropwise added 20 ml of DCM and leaves for 10 minutes with stirring. It is concentrated under vacuum, the residue is extracted with AcOEt, the organic phase is washed with water, with a saturated NaCl solution, dried over MgSO 4 and the solvent is evaporated under vacuum. 8.5 g of the expected product are obtained.
On chauffe à 80°C pendant 4 heures un mélange de 2,41 g du composé obtenu à l'étape précédente et 0,996 g de 4-phénylquinuclidine dans 4 ml de DMF. Après refroidissement à TA, on verse le mélange réactionnel dans un mélange eau/glace, extrait au DCM, lave la phase organique à l'eau, quatre fois par une solution d'HCl 2N, trois fois par une solution saturée de NaCl, sèche sur MgSO4 et évapore sous vide le solvant. On obtient 1,45 g du produit attendu après trituration dans le mélange pentane/éther puis essorage, F = 132-134°C.A mixture of 2.41 g of the compound obtained in the preceding step and 0.996 g of 4-phenylquinuclidine in 4 ml of DMF is heated at 80 ° C. for 4 hours. After cooling to RT, the reaction mixture is poured into a water / ice mixture, extracted with DCM, the organic phase is washed with water, four times with a 2N HCl solution, three times with a saturated NaCl solution, dry on MgSO 4 and evaporate the solvent under vacuum. 1.45 g of the expected product are obtained after trituration in the pentane / ether mixture and then wringing, M = 132-134 ° C.
Claims (10)
et ses solvates éventuels.A compound according to claim 1 of formula:
and its possible solvates.
avec un dérivé halogéné de formule :
Hal-CH2-Z (III)
dans laquelle Z est tel que défini pour (I) dans la revendication 1 et Hal représente un atome d'halogène, préférentiellement le brome ou le chlore ;
avec le chlorure de méthanesulfonyle, le chlorure de benzènesulfonyle, le chlorure de paratoluènesulfonyle ou le chlorure de trifluorométhanesulfonyle ; 4) on fait réagir le composé ainsi obtenu de formule :
avec une amine secondaire ou tertiaire AmH ou Am ;
with a halogenated derivative of formula:
Hal-CH 2 -Z (III)
wherein Z is as defined for (I) in claim 1 and Hal represents a halogen atom, preferably bromine or chlorine;
with methanesulfonyl chloride, benzenesulfonyl chloride, paratoluenesulfonyl chloride or trifluoromethanesulfonyl chloride; 4) reacting the compound thus obtained of formula:
with a secondary or tertiary amine AmH or Am;
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP01100819A EP1101757A1 (en) | 1995-01-30 | 1996-01-29 | Heterocyclic compounds as tachykinin receptor antagonists |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR9501015 | 1995-01-30 | ||
| FR9501015A FR2729951B1 (en) | 1995-01-30 | 1995-01-30 | NOVEL HETEROCYCLIC COMPOUNDS, PROCESS FOR THEIR PREPARATION AND PHARMACEUTICAL COMPOSITIONS CONTAINING THE SAME |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| EP0723959A1 true EP0723959A1 (en) | 1996-07-31 |
Family
ID=9475612
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP96400202A Withdrawn EP0723959A1 (en) | 1995-01-30 | 1996-01-29 | Heterocyclic compounds as tachykinin receptor antagonists, process for their preparation and pharmaceuticals containing them |
| EP01100819A Withdrawn EP1101757A1 (en) | 1995-01-30 | 1996-01-29 | Heterocyclic compounds as tachykinin receptor antagonists |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP01100819A Withdrawn EP1101757A1 (en) | 1995-01-30 | 1996-01-29 | Heterocyclic compounds as tachykinin receptor antagonists |
Country Status (5)
| Country | Link |
|---|---|
| US (2) | US5656639A (en) |
| EP (2) | EP0723959A1 (en) |
| JP (1) | JPH08245622A (en) |
| FR (1) | FR2729951B1 (en) |
| HU (1) | HUP9600211A3 (en) |
Cited By (41)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1997027185A1 (en) * | 1996-01-22 | 1997-07-31 | Pfizer Research And Development Company, N.V./S.A. | Piperidone tachykinin antagonists |
| FR2755133A1 (en) * | 1996-10-31 | 1998-04-30 | Sanofi Sa | NEW DERIVATIVES OF VARIOUSLY SUBSTITUTED CYCLIC AMIDS SELECTIVE ANTAGONISTS OF THE HUMAN NK3 RECEIVER, PROCESS FOR THEIR OBTAINING AND PHARMACEUTICAL COMPOSITIONS CONTAINING THEM |
| WO1998035663A1 (en) * | 1997-02-17 | 1998-08-20 | Sanofi-Synthelabo | Pharmaceutical formulations in dry form for the oral administration of a cyclic quaternary ammonium compound |
| WO1998035662A1 (en) * | 1997-02-17 | 1998-08-20 | Sanofi-Synthelabo | Pharmaceutical composition for oral administration of heterocyclic compounds in the form of quaternary ammonium |
| US5807865A (en) * | 1995-10-24 | 1998-09-15 | Merck Sharp & Dohme Limited | 3,3-disubstituted piperidine derivatives and their use as therapeutic agents |
| WO1999001451A1 (en) * | 1997-07-04 | 1999-01-14 | Pfizer Limited | Azetidinylpropylpiperidine derivatives, intermediates and use as tachykinin antagonists |
| US6579885B2 (en) | 1999-11-03 | 2003-06-17 | Albany Molecular Research, Inc. | Aryl and heteroaryl substituted tetrahydroisoquinolines and use thereof |
| US7084152B2 (en) | 2000-07-11 | 2006-08-01 | Amr Technology, Inc. | 4-phenyl substituted tetrahydroisoquinolines therapeutic use thereof |
| WO2006123182A2 (en) | 2005-05-17 | 2006-11-23 | Merck Sharp & Dohme Limited | Cyclohexyl sulphones for treatment of cancer |
| US7163949B1 (en) | 1999-11-03 | 2007-01-16 | Amr Technology, Inc. | 4-phenyl substituted tetrahydroisoquinolines and use thereof |
| WO2007011820A2 (en) | 2005-07-15 | 2007-01-25 | Amr Technology, Inc. | Aryl-and heteroaryl-substituted tetrahydrobenzazepines and use thereof to block reuptake of norepinephrine, dopamine, and serotonin |
| WO2007093827A1 (en) | 2006-02-15 | 2007-08-23 | Istituto Di Ricerche Di Biologia Molecolare P. Angeletti Spa | Thiophene and thiazole substituted trifluoroethanone derivatives as histone deacetylase (hdac) inhibitors |
| WO2009002495A1 (en) | 2007-06-27 | 2008-12-31 | Merck & Co., Inc. | 4-carboxybenzylamino derivatives as histone deacetylase inhibitors |
| US7541357B2 (en) | 2004-07-15 | 2009-06-02 | Amr Technology, Inc. | Aryl- and heteroaryl-substituted tetrahydroisoquinolines and use thereof to block reuptake of norepinephrine, dopamine, and serotonin |
| WO2010114780A1 (en) | 2009-04-01 | 2010-10-07 | Merck Sharp & Dohme Corp. | Inhibitors of akt activity |
| WO2010132442A1 (en) | 2009-05-12 | 2010-11-18 | Albany Molecular Reserch, Inc. | 7-([1,2,4,]triazolo[1,5,-a]pyridin-6-yl)-4-(3,4-dichlorophenyl)-1,2,3,4- tetrahydroisoquinoline and use thereof |
| WO2010132487A1 (en) | 2009-05-12 | 2010-11-18 | Bristol-Myers Squibb Company | CRYSTALLINE FORMS OF (S)-7-([1,2,4]TRIAZOLO[1,5-a]PYRIDIN-6-YL)-4-(3,4-DICHLOROHPHENYL)-1,2,3,4-TETRAHYDROISOQUINOLINE AND USE THEREOF |
| WO2011046771A1 (en) | 2009-10-14 | 2011-04-21 | Schering Corporation | SUBSTITUTED PIPERIDINES THAT INCREASE p53 ACTIVITY AND THE USES THEREOF |
| EP2336120A1 (en) | 2007-01-10 | 2011-06-22 | Istituto di ricerche di Biologia Molecolare P. Angeletti S.R.L. | Combinations containing amide substituted indazoles as poly(ADP-ribose)polymerase (PARP) inhibitors |
| WO2012018754A2 (en) | 2010-08-02 | 2012-02-09 | Merck Sharp & Dohme Corp. | RNA INTERFERENCE MEDIATED INHIBITION OF CATENIN (CADHERIN-ASSOCIATED PROTEIN), BETA 1 (CTNNB1) GENE EXPRESSION USING SHORT INTERFERING NUCLEIC ACID (siNA) |
| WO2012027236A1 (en) | 2010-08-23 | 2012-03-01 | Schering Corporation | NOVEL PYRAZOLO[1,5-a]PYRIMIDINE DERIVATIVES AS mTOR INHIBITORS |
| WO2012030685A2 (en) | 2010-09-01 | 2012-03-08 | Schering Corporation | Indazole derivatives useful as erk inhibitors |
| WO2012036997A1 (en) | 2010-09-16 | 2012-03-22 | Schering Corporation | Fused pyrazole derivatives as novel erk inhibitors |
| WO2012058210A1 (en) | 2010-10-29 | 2012-05-03 | Merck Sharp & Dohme Corp. | RNA INTERFERENCE MEDIATED INHIBITION OF GENE EXPRESSION USING SHORT INTERFERING NUCLEIC ACIDS (siNA) |
| WO2012087772A1 (en) | 2010-12-21 | 2012-06-28 | Schering Corporation | Indazole derivatives useful as erk inhibitors |
| WO2012145471A1 (en) | 2011-04-21 | 2012-10-26 | Merck Sharp & Dohme Corp. | Insulin-like growth factor-1 receptor inhibitors |
| US8420811B2 (en) | 2008-06-04 | 2013-04-16 | Bristol-Myers Squibb Company | Tetrahydroisoquinolines and intermediates therefor |
| WO2013063214A1 (en) | 2011-10-27 | 2013-05-02 | Merck Sharp & Dohme Corp. | Novel compounds that are erk inhibitors |
| WO2013165816A2 (en) | 2012-05-02 | 2013-11-07 | Merck Sharp & Dohme Corp. | SHORT INTERFERING NUCLEIC ACID (siNA) COMPOSITIONS |
| WO2014052563A2 (en) | 2012-09-28 | 2014-04-03 | Merck Sharp & Dohme Corp. | Novel compounds that are erk inhibitors |
| WO2014085216A1 (en) | 2012-11-28 | 2014-06-05 | Merck Sharp & Dohme Corp. | Compositions and methods for treating cancer |
| WO2014100065A1 (en) | 2012-12-20 | 2014-06-26 | Merck Sharp & Dohme Corp. | Substituted imidazopyridines as hdm2 inhibitors |
| WO2014120748A1 (en) | 2013-01-30 | 2014-08-07 | Merck Sharp & Dohme Corp. | 2,6,7,8 substituted purines as hdm2 inhibitors |
| WO2015034925A1 (en) | 2013-09-03 | 2015-03-12 | Moderna Therapeutics, Inc. | Circular polynucleotides |
| US9034899B2 (en) | 2009-05-12 | 2015-05-19 | Albany Molecular Research, Inc. | Aryl, heteroaryl, and heterocycle substituted tetrahydroisoquinolines and use thereof |
| US9156812B2 (en) | 2008-06-04 | 2015-10-13 | Bristol-Myers Squibb Company | Crystalline form of 6-[(4S)-2-methyl-4-(2-naphthyl)-1,2,3,4-tetrahydroisoquinolin-7-yl]pyridazin-3-amine |
| WO2019094311A1 (en) | 2017-11-08 | 2019-05-16 | Merck Sharp & Dohme Corp. | Prmt5 inhibitors |
| WO2020033282A1 (en) | 2018-08-07 | 2020-02-13 | Merck Sharp & Dohme Corp. | Prmt5 inhibitors |
| WO2020033284A1 (en) | 2018-08-07 | 2020-02-13 | Merck Sharp & Dohme Corp. | Prmt5 inhibitors |
| US11096950B2 (en) | 2006-11-01 | 2021-08-24 | Barbara Brooke Jennings | Compounds, methods, and treatments for abnormal signaling pathways for prenatal and postnatal development |
| EP4079856A1 (en) | 2010-08-17 | 2022-10-26 | Sirna Therapeutics, Inc. | Rna interference mediated inhibition of hepatitis b virus (hbv) gene expression using short interfering nucleic acid (sina) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5780466A (en) * | 1995-01-30 | 1998-07-14 | Sanofi | Substituted heterocyclic compounds method of preparing them and pharmaceutical compositions in which they are present |
| HU224225B1 (en) | 1995-12-01 | 2005-06-28 | Sankyo Co. Ltd. | Heterocyclic compounds having tachykinin receptor antagonist activity, their preparation, and their use for the preparation of pharmaceutical compositions |
| WO2000057868A2 (en) * | 1999-03-31 | 2000-10-05 | The Procter & Gamble Company | Use of carbamamic acid derivatives for the treatment of viral infections |
| CN100398106C (en) * | 2001-04-23 | 2008-07-02 | 弗·哈夫曼-拉罗切有限公司 | Use of nk-1 receptor antagonists against benign prostatic hyperplasia |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0512901A1 (en) * | 1991-05-03 | 1992-11-11 | Sanofi | Aminated polycyclic compounds and their enantiomers, process for their preparation and pharmaceutical compositions containing them |
| EP0591040A1 (en) * | 1992-09-30 | 1994-04-06 | Sanofi | Quaternary basic amides as tachykinines antagonists |
-
1995
- 1995-01-30 FR FR9501015A patent/FR2729951B1/en not_active Expired - Fee Related
-
1996
- 1996-01-29 EP EP96400202A patent/EP0723959A1/en not_active Withdrawn
- 1996-01-29 EP EP01100819A patent/EP1101757A1/en not_active Withdrawn
- 1996-01-30 JP JP8014703A patent/JPH08245622A/en active Pending
- 1996-01-30 US US08/593,929 patent/US5656639A/en not_active Expired - Fee Related
- 1996-01-30 HU HU9600211A patent/HUP9600211A3/en unknown
-
1997
- 1997-01-23 US US08/787,910 patent/US5859029A/en not_active Expired - Fee Related
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0512901A1 (en) * | 1991-05-03 | 1992-11-11 | Sanofi | Aminated polycyclic compounds and their enantiomers, process for their preparation and pharmaceutical compositions containing them |
| EP0591040A1 (en) * | 1992-09-30 | 1994-04-06 | Sanofi | Quaternary basic amides as tachykinines antagonists |
Cited By (71)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5807865A (en) * | 1995-10-24 | 1998-09-15 | Merck Sharp & Dohme Limited | 3,3-disubstituted piperidine derivatives and their use as therapeutic agents |
| WO1997027185A1 (en) * | 1996-01-22 | 1997-07-31 | Pfizer Research And Development Company, N.V./S.A. | Piperidone tachykinin antagonists |
| US6262075B1 (en) | 1996-01-22 | 2001-07-17 | Pfizer Inc | Piperidone tachykinin antagonists |
| FR2755133A1 (en) * | 1996-10-31 | 1998-04-30 | Sanofi Sa | NEW DERIVATIVES OF VARIOUSLY SUBSTITUTED CYCLIC AMIDS SELECTIVE ANTAGONISTS OF THE HUMAN NK3 RECEIVER, PROCESS FOR THEIR OBTAINING AND PHARMACEUTICAL COMPOSITIONS CONTAINING THEM |
| WO1998018762A1 (en) * | 1996-10-31 | 1998-05-07 | Sanofi | New derivatives of diversely substituted cyclical amide selective antagonists of the human receptor nk3, process for obtaining them, and pharmaceutical compositions containing them |
| US6303626B1 (en) | 1997-02-17 | 2001-10-16 | Sanofi-Synthelabo | Pharmaceutical formulations in dry form for the oral administration of a cyclic quaternary ammonium compound |
| WO1998035663A1 (en) * | 1997-02-17 | 1998-08-20 | Sanofi-Synthelabo | Pharmaceutical formulations in dry form for the oral administration of a cyclic quaternary ammonium compound |
| WO1998035662A1 (en) * | 1997-02-17 | 1998-08-20 | Sanofi-Synthelabo | Pharmaceutical composition for oral administration of heterocyclic compounds in the form of quaternary ammonium |
| FR2759585A1 (en) * | 1997-02-17 | 1998-08-21 | Sanofi Sa | PHARMACEUTICAL FORMULATIONS PRESENTED IN DRY FORM FOR ORAL ADMINISTRATION OF A CYCLIC QUATERNARY AMMONIUM COMPOUND |
| FR2759584A1 (en) * | 1997-02-17 | 1998-08-21 | Sanofi Sa | PHARMACEUTICAL COMPOSITION FOR THE ORAL ADMINISTRATION OF HETEROCYCLIC COMPOUNDS IN QUATERNARY AMMONIUM FORM |
| WO1999001451A1 (en) * | 1997-07-04 | 1999-01-14 | Pfizer Limited | Azetidinylpropylpiperidine derivatives, intermediates and use as tachykinin antagonists |
| AP1110A (en) * | 1997-07-04 | 2002-10-10 | Pfizer | Azetidinylpropylpiperidine derivatives and use as tachykinin antagonist. |
| US6579885B2 (en) | 1999-11-03 | 2003-06-17 | Albany Molecular Research, Inc. | Aryl and heteroaryl substituted tetrahydroisoquinolines and use thereof |
| US7265116B2 (en) | 1999-11-03 | 2007-09-04 | Arm Technology, Inc. | Aryl and heteroaryl substituted tetrahydroisoquinolines and use thereof |
| US7612090B2 (en) | 1999-11-03 | 2009-11-03 | Albany Molecular Research, Inc. | Aryl and heteroaryl substituted tetrahydroisoquinolines and use thereof |
| US7163949B1 (en) | 1999-11-03 | 2007-01-16 | Amr Technology, Inc. | 4-phenyl substituted tetrahydroisoquinolines and use thereof |
| US7419985B2 (en) | 2000-07-11 | 2008-09-02 | Amr Technology, Inc. | 4-Phenyl substituted tetrahydroisoquinolines and therapeutic use thereof |
| US7309789B2 (en) | 2000-07-11 | 2007-12-18 | Amr Technology, Inc. | 4-phenyl substituted tetrahydroisoquinolines and therapeutic use thereof |
| US7084152B2 (en) | 2000-07-11 | 2006-08-01 | Amr Technology, Inc. | 4-phenyl substituted tetrahydroisoquinolines therapeutic use thereof |
| US9499531B2 (en) | 2004-07-15 | 2016-11-22 | Albany Molecular Research, Inc. | Aryl- and heteroaryl-substituted tetrahydroisoquinolines and use thereof to block reuptake of norepinephrine, dopamine, and serotonin |
| US8741901B2 (en) | 2004-07-15 | 2014-06-03 | Albany Molecular Research, Inc. | Aryl- and heteroaryl-substituted tetrahydroisoquinolines and use thereof to block reuptake of norepinephrine, dopamine, and serotonin |
| US8236796B2 (en) | 2004-07-15 | 2012-08-07 | Albany Molecular Research, Inc. | Aryl- and heteroaryl-substituted tetrahydroisoquinolines and use thereof to block reuptake of norepinephrine, dopamine, and serotonin |
| US8227486B2 (en) | 2004-07-15 | 2012-07-24 | Albany Molecular Research, Inc. | Aryl- and heteroaryl-substituted tetrahydroisoquinolines and use thereof to block reuptake of norepinephrine, dopamine, and serotonin |
| US7541357B2 (en) | 2004-07-15 | 2009-06-02 | Amr Technology, Inc. | Aryl- and heteroaryl-substituted tetrahydroisoquinolines and use thereof to block reuptake of norepinephrine, dopamine, and serotonin |
| US9085531B2 (en) | 2004-07-15 | 2015-07-21 | Albany Molecular Research, Inc. | Aryl- and heteroaryl-substituted tetrahydroisoquinolines and use thereof to block reuptake of norepinephrine, dopamine, and serotonin |
| WO2006123182A2 (en) | 2005-05-17 | 2006-11-23 | Merck Sharp & Dohme Limited | Cyclohexyl sulphones for treatment of cancer |
| US7956050B2 (en) | 2005-07-15 | 2011-06-07 | Albany Molecular Research, Inc. | Aryl- and heteroaryl-substituted tetrahydrobenzazepines and use thereof to block reuptake of norepinephrine, dopamine, and serotonin |
| WO2007011820A2 (en) | 2005-07-15 | 2007-01-25 | Amr Technology, Inc. | Aryl-and heteroaryl-substituted tetrahydrobenzazepines and use thereof to block reuptake of norepinephrine, dopamine, and serotonin |
| US8791101B2 (en) | 2005-07-15 | 2014-07-29 | Albany Molecular Research, Inc. | Aryl- and heteroaryl-substituted tetrahydrobenzazepines and use thereof to block reuptake of norepinephrine, dopamine, and serotonin |
| US9403776B2 (en) | 2005-07-15 | 2016-08-02 | Albany Molecular Research, Inc. | Aryl- and heteroaryl-substituted tetrahydrobenzazepines and use thereof to block reuptake of norepinephrine, dopamine, and serotonin |
| WO2007093827A1 (en) | 2006-02-15 | 2007-08-23 | Istituto Di Ricerche Di Biologia Molecolare P. Angeletti Spa | Thiophene and thiazole substituted trifluoroethanone derivatives as histone deacetylase (hdac) inhibitors |
| US11096950B2 (en) | 2006-11-01 | 2021-08-24 | Barbara Brooke Jennings | Compounds, methods, and treatments for abnormal signaling pathways for prenatal and postnatal development |
| EP2336120A1 (en) | 2007-01-10 | 2011-06-22 | Istituto di ricerche di Biologia Molecolare P. Angeletti S.R.L. | Combinations containing amide substituted indazoles as poly(ADP-ribose)polymerase (PARP) inhibitors |
| EP2805945A1 (en) | 2007-01-10 | 2014-11-26 | MSD Italia S.r.l. | Amide substituted indazoles as poly(ADP-ribose)polymerase (PARP) inhibitors |
| WO2009002495A1 (en) | 2007-06-27 | 2008-12-31 | Merck & Co., Inc. | 4-carboxybenzylamino derivatives as histone deacetylase inhibitors |
| EP3103791A1 (en) | 2007-06-27 | 2016-12-14 | Merck Sharp & Dohme Corp. | 4-carboxybenzylamino derivatives as histone deacetylase inhibitors |
| US9156812B2 (en) | 2008-06-04 | 2015-10-13 | Bristol-Myers Squibb Company | Crystalline form of 6-[(4S)-2-methyl-4-(2-naphthyl)-1,2,3,4-tetrahydroisoquinolin-7-yl]pyridazin-3-amine |
| US8445494B2 (en) | 2008-06-04 | 2013-05-21 | Bristol-Myers Squibb Company | Crystalline form of 6-[(4S)-2-methyl-4-(2-naphthyl)-1,2,3,4-tetrahydroisoquinolin-7-yl]pyridazin-3-amine |
| US9498476B2 (en) | 2008-06-04 | 2016-11-22 | Albany Molecular Research, Inc. | Crystalline form of 6-[(4S)-2-methyl-4-(2-naphthyl)-1,2,3,4-tetrahydroisoquinolin-7-yl]pyridazin-3-amine |
| US8420811B2 (en) | 2008-06-04 | 2013-04-16 | Bristol-Myers Squibb Company | Tetrahydroisoquinolines and intermediates therefor |
| WO2010114780A1 (en) | 2009-04-01 | 2010-10-07 | Merck Sharp & Dohme Corp. | Inhibitors of akt activity |
| US8815894B2 (en) | 2009-05-12 | 2014-08-26 | Bristol-Myers Squibb Company | Crystalline forms of (S)-7-([1,2,4]triazolo[1,5-a]pyridin-6-yl)-4-(3,4-dichlorophenyl)-1,2,3,4-tetrahydroisoquinoline and use thereof |
| US9173879B2 (en) | 2009-05-12 | 2015-11-03 | Bristol-Myers Squibb Company | Crystalline forms of (S)-7-([1,2,4]triazolo[1,5-a ]pyridin-6-yl)-4-(3,4-dichlorophenyl)-1,2,3,4-tetrahydroisoquinoline and use thereof |
| WO2010132442A1 (en) | 2009-05-12 | 2010-11-18 | Albany Molecular Reserch, Inc. | 7-([1,2,4,]triazolo[1,5,-a]pyridin-6-yl)-4-(3,4-dichlorophenyl)-1,2,3,4- tetrahydroisoquinoline and use thereof |
| US9604960B2 (en) | 2009-05-12 | 2017-03-28 | Albany Molecular Research, Inc. | Aryl, heteroaryl, and heterocycle substituted tetrahydroisoquinolines and use thereof |
| WO2010132487A1 (en) | 2009-05-12 | 2010-11-18 | Bristol-Myers Squibb Company | CRYSTALLINE FORMS OF (S)-7-([1,2,4]TRIAZOLO[1,5-a]PYRIDIN-6-YL)-4-(3,4-DICHLOROHPHENYL)-1,2,3,4-TETRAHYDROISOQUINOLINE AND USE THEREOF |
| US9034899B2 (en) | 2009-05-12 | 2015-05-19 | Albany Molecular Research, Inc. | Aryl, heteroaryl, and heterocycle substituted tetrahydroisoquinolines and use thereof |
| US8802696B2 (en) | 2009-05-12 | 2014-08-12 | Albany Molecular Research, Inc. | 7-([1,2,4]triazolo[1,5-a]pyridin-6-yl)-4-(3,4-dichlorophenyl)-1,2,3,4-tetrahydroisoqu inoli and use thereof |
| WO2011046771A1 (en) | 2009-10-14 | 2011-04-21 | Schering Corporation | SUBSTITUTED PIPERIDINES THAT INCREASE p53 ACTIVITY AND THE USES THEREOF |
| EP3330377A1 (en) | 2010-08-02 | 2018-06-06 | Sirna Therapeutics, Inc. | Rna interference mediated inhibition of catenin (cadherin-associated protein), beta 1 (ctnnb1) gene expression using short interfering nucleic acid (sina) |
| WO2012018754A2 (en) | 2010-08-02 | 2012-02-09 | Merck Sharp & Dohme Corp. | RNA INTERFERENCE MEDIATED INHIBITION OF CATENIN (CADHERIN-ASSOCIATED PROTEIN), BETA 1 (CTNNB1) GENE EXPRESSION USING SHORT INTERFERING NUCLEIC ACID (siNA) |
| EP4079856A1 (en) | 2010-08-17 | 2022-10-26 | Sirna Therapeutics, Inc. | Rna interference mediated inhibition of hepatitis b virus (hbv) gene expression using short interfering nucleic acid (sina) |
| WO2012027236A1 (en) | 2010-08-23 | 2012-03-01 | Schering Corporation | NOVEL PYRAZOLO[1,5-a]PYRIMIDINE DERIVATIVES AS mTOR INHIBITORS |
| WO2012030685A2 (en) | 2010-09-01 | 2012-03-08 | Schering Corporation | Indazole derivatives useful as erk inhibitors |
| WO2012036997A1 (en) | 2010-09-16 | 2012-03-22 | Schering Corporation | Fused pyrazole derivatives as novel erk inhibitors |
| WO2012058210A1 (en) | 2010-10-29 | 2012-05-03 | Merck Sharp & Dohme Corp. | RNA INTERFERENCE MEDIATED INHIBITION OF GENE EXPRESSION USING SHORT INTERFERING NUCLEIC ACIDS (siNA) |
| EP3766975A1 (en) | 2010-10-29 | 2021-01-20 | Sirna Therapeutics, Inc. | Rna interference mediated inhibition of gene expression using short interfering nucleic acid (sina) |
| EP3327125A1 (en) | 2010-10-29 | 2018-05-30 | Sirna Therapeutics, Inc. | Rna interference mediated inhibition of gene expression using short interfering nucleic acids (sina) |
| WO2012087772A1 (en) | 2010-12-21 | 2012-06-28 | Schering Corporation | Indazole derivatives useful as erk inhibitors |
| WO2012145471A1 (en) | 2011-04-21 | 2012-10-26 | Merck Sharp & Dohme Corp. | Insulin-like growth factor-1 receptor inhibitors |
| WO2013063214A1 (en) | 2011-10-27 | 2013-05-02 | Merck Sharp & Dohme Corp. | Novel compounds that are erk inhibitors |
| WO2013165816A2 (en) | 2012-05-02 | 2013-11-07 | Merck Sharp & Dohme Corp. | SHORT INTERFERING NUCLEIC ACID (siNA) COMPOSITIONS |
| EP3919620A1 (en) | 2012-05-02 | 2021-12-08 | Sirna Therapeutics, Inc. | Short interfering nucleic acid (sina) compositions |
| WO2014052563A2 (en) | 2012-09-28 | 2014-04-03 | Merck Sharp & Dohme Corp. | Novel compounds that are erk inhibitors |
| WO2014085216A1 (en) | 2012-11-28 | 2014-06-05 | Merck Sharp & Dohme Corp. | Compositions and methods for treating cancer |
| WO2014100065A1 (en) | 2012-12-20 | 2014-06-26 | Merck Sharp & Dohme Corp. | Substituted imidazopyridines as hdm2 inhibitors |
| WO2014120748A1 (en) | 2013-01-30 | 2014-08-07 | Merck Sharp & Dohme Corp. | 2,6,7,8 substituted purines as hdm2 inhibitors |
| WO2015034925A1 (en) | 2013-09-03 | 2015-03-12 | Moderna Therapeutics, Inc. | Circular polynucleotides |
| WO2019094311A1 (en) | 2017-11-08 | 2019-05-16 | Merck Sharp & Dohme Corp. | Prmt5 inhibitors |
| WO2020033284A1 (en) | 2018-08-07 | 2020-02-13 | Merck Sharp & Dohme Corp. | Prmt5 inhibitors |
| WO2020033282A1 (en) | 2018-08-07 | 2020-02-13 | Merck Sharp & Dohme Corp. | Prmt5 inhibitors |
Also Published As
| Publication number | Publication date |
|---|---|
| US5656639A (en) | 1997-08-12 |
| FR2729951A1 (en) | 1996-08-02 |
| FR2729951B1 (en) | 1997-04-18 |
| EP1101757A1 (en) | 2001-05-23 |
| HUP9600211A2 (en) | 1998-09-28 |
| JPH08245622A (en) | 1996-09-24 |
| HUP9600211A3 (en) | 2000-04-28 |
| US5859029A (en) | 1999-01-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP0723959A1 (en) | Heterocyclic compounds as tachykinin receptor antagonists, process for their preparation and pharmaceuticals containing them | |
| EP0591040B1 (en) | Quaternary basic amides as tachykinines antagonists | |
| EP0807111B1 (en) | Substituted heterocyclic compounds, preparation method therefor and pharmaceutical compositions containing same | |
| EP0559538B1 (en) | Quaternary salts of 4-substituted piperidines, their preparation and pharmaceutical compositions containing them | |
| EP0512901B1 (en) | Aminated polycyclic compounds and their enantiomers, process for their preparation and pharmaceutical compositions containing them | |
| EP0673928B1 (en) | Novel N-(3,4-dichlorophenyl-propyl)-piperidine derivatives as selective human NK3-receptor antagonists | |
| EP0515240B1 (en) | N-(aminoalkyl)piperidine compounds and their enantiomers as neurokinines receptors antagonists, processes for their preparation and pharmaceutical compositions containing them | |
| EP1527048B1 (en) | N-[phenyl(piperidin-2-yl)methyl]benzamide derivatives, preparation thereof, and use thereof in therapy | |
| EP1019373B1 (en) | 1-acyl-3-phenyl-3-(3-piperidinopropyl)piperidine derivatives as human nk3 receptor selective antagonists | |
| FR2718136A1 (en) | Amino aromatic compounds, process for their preparation and pharmaceutical compositions containing them | |
| CH690437A5 (en) | piperidine derivatives, process for their preparation and pharmaceutical compositions containing them. | |
| EP0429344A1 (en) | Pyridazine derivatives, process for their preparation and pharmaceutical compositions containing them | |
| FR2717802A1 (en) | Novel aromatic compounds, process for their preparation and pharmaceutical compositions containing them | |
| EP1150970B1 (en) | (1-phenacy-3-phenyl-3-piperidylethyl)piperidine derivatives, method for the production thereof and pharmaceutical compositions containing the same | |
| US4920117A (en) | 4,5,5a,6-tetrahydro-3H-isoxazolo(5,4,3-kl)acridines, pharmaceutical compositions and use | |
| WO1995026339A1 (en) | Salts of substituted heteroaromatic nitrogen compounds, method for their preparation and pharmaceutical compounds containing same | |
| EP0915882A1 (en) | 1-azoniabicyclo[2.2.1]heptane derivatives and pharmaceutical compositions containing them | |
| FR2729952A1 (en) | New substd heterocycle(s) useful as neurokinin receptor antagonists | |
| FR2688218A1 (en) | Quaternary ammonium salts of aromatic amino compounds, their preparation and pharmaceutical compositions containing them |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PUAI | Public reference made under article 153(3) epc to a published international application that has entered the european phase |
Free format text: ORIGINAL CODE: 0009012 |
|
| AK | Designated contracting states |
Kind code of ref document: A1 Designated state(s): AT BE CH DE DK ES FR GB GR IE IT LI LU MC NL PT SE |
|
| AX | Request for extension of the european patent |
Free format text: LT PAYMENT 960202;LV PAYMENT 960202;SI PAYMENT 960202 |
|
| RAX | Requested extension states of the european patent have changed |
Free format text: LT PAYMENT 960202;LV PAYMENT 960202;SI PAYMENT 960202 |
|
| 17P | Request for examination filed |
Effective date: 19960911 |
|
| RAP1 | Party data changed (applicant data changed or rights of an application transferred) |
Owner name: SANOFI |
|
| 17Q | First examination report despatched |
Effective date: 19990317 |
|
| RAP1 | Party data changed (applicant data changed or rights of an application transferred) |
Owner name: SANOFI-SYNTHELABO |
|
| GRAG | Despatch of communication of intention to grant |
Free format text: ORIGINAL CODE: EPIDOS AGRA |
|
| GRAG | Despatch of communication of intention to grant |
Free format text: ORIGINAL CODE: EPIDOS AGRA |
|
| GRAG | Despatch of communication of intention to grant |
Free format text: ORIGINAL CODE: EPIDOS AGRA |
|
| GRAH | Despatch of communication of intention to grant a patent |
Free format text: ORIGINAL CODE: EPIDOS IGRA |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: THE APPLICATION IS DEEMED TO BE WITHDRAWN |
|
| 18D | Application deemed to be withdrawn |
Effective date: 20010511 |