WO2022014512A1 - ケトーシス罹患判定方法及び装置 - Google Patents
ケトーシス罹患判定方法及び装置 Download PDFInfo
- Publication number
- WO2022014512A1 WO2022014512A1 PCT/JP2021/026065 JP2021026065W WO2022014512A1 WO 2022014512 A1 WO2022014512 A1 WO 2022014512A1 JP 2021026065 W JP2021026065 W JP 2021026065W WO 2022014512 A1 WO2022014512 A1 WO 2022014512A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- gas
- ketosis
- morbidity
- surface stress
- sample
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Ceased
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/483—Physical analysis of biological material
- G01N33/487—Physical analysis of biological material of liquid biological material
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/483—Physical analysis of biological material
- G01N33/487—Physical analysis of biological material of liquid biological material
- G01N33/493—Physical analysis of biological material of liquid biological material urine
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/04—Endocrine or metabolic disorders
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/64—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving ketones
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/98—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving alcohol, e.g. ethanol in breath
Definitions
- the present invention relates to the determination of ketosis morbidity in animals, specifically, to the determination of ketosis morbidity based on the composition of gas generated from milk milked by animals and other body fluids collected from animals.
- Ketosis is a state in which a large amount of ketone bodies are accumulated in animal tissues and body fluids by mainly increasing the production of ketone bodies and exceeding their utilization.
- a state in which the amount of ketone bodies in blood is increased is also called ketonemia
- a state in which the amount of ketone bodies in urine is increased is called ketone urine disease
- a state in which the amount of ketone bodies in milk is increased is also called ketone milk disease.
- the body includes acetoacetic acid, ⁇ -hydroxybutyric acid (also referred to as 3-hydroxybutyric acid), acetone and the like.
- ketosis occurs when ketone bodies gradually exceed the limit of tissue processing capacity and accumulate in the blood during sugar utilization disorders due to diabetes, fasting, starvation, and the like.
- ketosis occurs when glucose utilization in tissues is impaired (diabetes, etc.), when sugar supply is inadequate (fasting, starvation, etc.), as well as obstruction of pregnancy, vomiting, and diarrhea. , Dehydration, hyperfat diet, thyroid poisoning, digestive and absorption disorders, childhood self-poisoning, glycogenic disease, etc.
- ruminants produce ⁇ -hydroxybutyric acid from butyric acid, which is a fermentation product in the gastrointestinal tract
- the blood ketone body concentration is higher than that of non-ruminants even in the physiological state, and ketosis is more likely to occur.
- DMI dry matter intake
- NEB balance
- Dairy cows with ketosis show clinical symptoms such as decreased DMI and decreased lactation, but there is also an increasing tendency for latent ketosis with increased ketone bodies in the body without obvious clinical symptoms. Has the problem of affecting milk production and the development of other metabolic disorders.
- Non-Patent Document 1 the concentration of ⁇ -hydroxybutyric acid (BHBA) in blood has been used for determining latent ketosis in dairy cows. This is because ⁇ -hydroxybutyric acid is more stable than other ketone bodies such as acetone and acetoacetic acid, and specific reference values are latent ketosis and subsequent disease occurrence and productivity decline. Based on the relevance, the range from 1.0 mmol / L to 1.4 mmol / L is shown. In addition to blood, latent ketosis has been determined using milk and urine, and semi-quantitative methods using test strips have been developed so far. Please refer to Non-Patent Document 1 as necessary for the diagnosis of latent ketosis of dairy cows.
- BHBA ⁇ -hydroxybutyric acid
- Diagnosis using blood as described above is objective and excellent in accuracy, but there is a problem that the cost tends to be high for the small throughput and it is difficult to measure at the breeding site. Recently, a small device that can measure in the field has been developed, but since the ⁇ -hydroxybutyric acid concentration in the blood rises after feeding, the sampling timing is limited to ensure the test accuracy.
- the test using urine is non-invasive, the semi-quantitative method using the test paper, which has reached the practical level at present, is inferior in accuracy to the blood test.
- Patent Document 2 proposes a system for automating feeding, milking, ketosis diagnosis from milk of dairy cows and the like.
- the system is configured here based on the technical idea of analyzing liquid milk as it is, the flow path for inspection is complicated (addition of reagent flow path for inspection, etc.) and inspection. There was a problem such as an increase in the cost of consumables such as reagents.
- the present inventors have focused on the type of sample, that is, the point that all the samples used in the conventional test method are liquids.
- Non-Patent Document 3 discloses that the acetone concentration in milk is similar to the blood acetone concentration and has a high correlation, but on the other hand, due to the difference in the feed to be fed, humans. It is known that the aroma and flavor of milk are so different that they can be clearly distinguished by the sense of smell and taste. In other words, the aroma and flavor of milk, which can be identified by the human sense of smell and taste, are greatly affected by the difference in feed. This suggests that even milk that belongs to one category, which is from healthy cows, has a large variation in the composition of its volatile / evaporative components, so that the volatilization / evaporation of milk from diseased cows. When comparing the components, it may be difficult to distinguish between the two. In addition to the fact that practical olfactory sensors were scarcely available in the past, it is thought that this possibility was also the cause. As far as the inventors know, little knowledge has been obtained.
- the present inventors used the gas generated from milk under the hypothesis that a certain correlation can be established between the gas generated from milk and the disease without being bound by the conventional wisdom.
- the idea was to use the response of gas detection means to gas to determine the prevalence of a particular disease.
- the gist of the present invention is the following [1] to [22].
- the gas generated from the body fluid collected from an animal (excluding humans) is given to the gas detecting means, and the response of the gas detecting means to the gas generated from the body fluid is used to obtain the gas generated from the body fluid.
- a method for determining ketosis morbidity which determines the morbidity of ketosis in the animal based on the composition.
- the gas generated from the body fluid is at least one of ketones, alcohols, aldehydes, nitriles, organic acids, water (water vapor), nitrogen, oxygen, and carbon dioxide, [1] or [2]. ].
- the method for determining the morbidity of ketosis [4]
- the gas generated from the body fluid is at least one of ketones and alcohols, the ketones are acetone, and the alcohols are at least selected from the group consisting of methanol, ethanol, propanol and butanol.
- [6] The method for determining ketosis morbidity according to [5], wherein the determination of ketosis morbidity is performed based on the pattern of time change of the signal.
- the gas obtained by passing a gas containing substantially no component affecting the determination of ketosis morbidity through the container containing the body fluid is used as a gas generated from the body fluid in the surface stress sensor.
- the method for determining ketosis morbidity according to [7] which is supplied.
- ketosis morbidity The method for determining ketosis morbidity according to [7] or [8], wherein the ketosis morbidity is determined using the signal after the gas generated from the body fluid is started to be supplied to the surface stress sensor.
- the method for determining ketosis prevalence according to any one of [7] to [10], wherein at least one selected from the group consisting of group-modified silica / titania composite nanoparticles and Polystyrene is used.
- As the surface stress sensor a first surface stress sensor using one material selected from the above group as a sensitive film and a second surface stress sensor using another material selected from the above group as a sensitive film.
- the gas generated from the body fluid and the purge gas are alternately applied to the surface stress sensor, and the signal corresponding to the gas generated from the body fluid and the signal corresponding to the purge gas are used to cause the ketosis.
- the method for determining ketosis morbidity according to any one of [7] to [12], wherein the determination is made.
- [14] In addition to a time interval in which the gas generated from the body fluid is supplied to the surface stress sensor and a time interval in which the purge gas is applied to the surface stress sensor, a time interval in which a predetermined standard gas is applied to the surface stress sensor is provided.
- Standard gas and purge gas are alternately applied to the surface stress sensor, and digital data corresponding to the standard gas based on the signal corresponding to the standard gas and the signal corresponding to the purge gas and generated from the body fluid.
- the gas and the purge gas were alternately applied to the surface stress sensor, and digital data corresponding to the body fluid to be measured based on the signal corresponding to the gas generated from the body fluid and the signal corresponding to the purge gas was prepared.
- the method for determining the morbidity of ketosis according to [13], wherein the determination of the morbidity of ketosis is performed based on the digital data corresponding to the standard gas and the digital data corresponding to the body fluid to be measured.
- At least one surface stress sensor for supplying a sample gas generated from a body fluid to be inspected collected from an animal, and a second for supplying a purge gas containing no gas component to be measured.
- the sample gas supplied from the first gas flow path and the purge gas supplied from the second gas flow path are alternately switched and supplied to the at least one surface stress sensor.
- a ketosis morbidity determination device for determining chemosis morbidity of the animal based on the composition of the sample gas generated from the body fluid by generating a signal from the at least one surface stress sensor.
- An additional gas sensor and an additional gas flow path for supplying the sample gas to the additional gas sensor are provided, based on the signal from the at least one surface stress sensor and the signal from the additional gas sensor.
- the ketosis morbidity determination device according to [19], which determines the morbidity of ketosis.
- a gas flow path and a third gas flow path for supplying a predetermined standard gas are provided, and a sample gas supplied from the first gas flow path and a purge gas supplied from the second gas flow path are provided.
- the standard gas supplied from the third gas flow path is switched in a predetermined order and supplied to the at least one surface stress sensor to generate a signal from the at least one surface stress sensor, whereby the body fluid is used.
- a ketosis morbidity determination device for determining the chemosis morbidity of the animal based on the composition of the generated sample gas.
- An additional gas sensor and an additional gas flow path for supplying the sample gas to the additional gas sensor are provided, based on the signal from the at least one surface stress sensor and the signal from the additional gas sensor.
- the ketosis morbidity determination device according to [21], which determines the morbidity of ketosis.
- a body fluid such as milk produced by an animal is targeted for inspection, and it is possible to determine whether the animal is suffering from ketosis based on the composition of the gas generated from the milk or the like. Therefore, according to the present invention, in many cases, the presence or absence of ketosis and / or the possibility of ketosis in the animal can be easily determined in the field or the like by a method in which the load and stress applied to the animal at the time of sample collection are small. It is possible to provide a method capable of making a determination with high throughput and low cost. Further, according to the present invention, it is also possible to provide an apparatus for making the determination.
- the figure which shows the measurement result of the concentration of acetone and 2-butanone by PTR-TOF-MS in the milk and urine of the ketosis-affected cow, and the milk and urine of a healthy cow in Test 5 of an Example Among the measurement results shown in FIG. 17A, the figure showing the measurement result of the concentration of acetone. Of the measurement results shown in FIG. 17A, the figure showing the measurement results of the concentration of 2-butanone.
- the gas generated from the blood should be used as a sample to be tested for determining the morbidity of ketosis. Is considered to be even more useful.
- urine in recent years, there has been increasing interest in suppressing the generation (volatilization) of ammonia from the barn where dairy cows are raised, and a device for collecting urine has been developed from the viewpoint of more appropriate manure treatment. Attempts have also been made to utilize the collected urine as a substitute for chemical fertilizers. Therefore, it is possible to avoid giving an additional burden to the animal by diverting a part of the urine.
- a gas generated from a milk to be tested milked by an animal is given to a gas detecting means, and the gas is supplied from the milk.
- the response of the gas detecting means to the generated gas is used to determine the animal's ketosis morbidity based on the composition of the gas generated from the milk.
- the method of this embodiment is applied to an animal that secretes milk.
- the animal include, but are not limited to, dairy cows (dairy cows), beef cattle (beef cattle), goats, sheep, buffalo (buffalo), yaks, horses and other livestock (industrial animals).
- the method of the present embodiment is used for diagnosing ketosis morbidity or as a diagnostic aid in animals fed to produce milk.
- the method of the present embodiment can also be applied as a diagnostic aid for diseases associated with ketosis in humans.
- the "gas generated from milk” refers to a gas component that has volatilized / evaporated from milk under a certain environment, that is, a volatile component / evaporation component of milk.
- the volatile component / evaporation component includes both an aroma component perceived by the human sense of smell and a non-aroma component not perceived by the human sense of smell.
- the human sense of smell varies greatly from person to person, and the perceivable components also differ greatly from person to person. Therefore, it is intended to classify the gas generated from the milk to be inspected by the method of the present embodiment according to the presence or absence of aroma. It should be noted that it is not intended to be limited to any of them.
- the gas generated from the body fluid is intended to replace "milk" in the above definition with the body fluid.
- ketones such as acetone
- alcohols such as methanol, ethanol, propanol and butanol
- aldehydes such as formaldehyde and acetaldehyde
- nitriles such as acetonitrile
- formic acid and acetic acid for example, ketones such as acetone; alcohols such as methanol, ethanol, propanol and butanol
- aldehydes such as formaldehyde and acetaldehyde
- nitriles such as acetonitrile
- formic acid and acetic acid formic acid and acetic acid.
- Organic acids such as propionic acid and formic acid
- water (steam) nitrogen, oxygen, carbon dioxide and the like.
- Ketone bodies contained in milk include acetoacetic acid, ⁇ -hydroxybutyric acid, acetone, etc., but since acetone is extremely volatile, it has not been measured in conventional liquid-based tests. , ⁇ -Hydroxybutyric acid and / or acetoacetic acid are used. On the other hand, in the method of the present embodiment, since the gas generated from the milk is used as a sample, the ketone body to be measured is not limited to ⁇ -hydroxybutyric acid and acetoacetic acid, and acetone can also be included.
- ⁇ -hydroxybutyric acid and acetoacetic acid are precursors of acetone, and there is a correlation between the concentrations of ⁇ -hydroxybutyric acid, acetoacetic acid, and acetone in the sample. Also rises. Therefore, in the method of the present embodiment, it is possible to determine the morbidity of ketosis by using the acetone concentration in the gas generated from the milk as an index.
- the gas detecting means is not particularly limited, and any gas sensor, gas chromatograph, gas analysis test strip, or the like that can detect gas generated from milk may be used.
- the gas detecting means is a gas sensor, and the response of the gas detecting means is a signal output from the gas sensor.
- the determination of ketosis morbidity is based on the pattern of time variation of the signal.
- the gas sensor is preferably a surface stress sensor, and more preferably the surface stress sensor is a membrane type surface stress sensor (MSS).
- MSS membrane type surface stress sensor
- the surface stress sensor can obtain response signals (also called signals) from one sensitive film to a plurality of target substances in a form in which they are superimposed by selecting an appropriate sensitive film material. That is, by appropriately selecting the sensitive film material for many target substances, it is possible to make the amplitudes and response waveforms of the response of the surface stress sensor to each target substance different from each other. Therefore, by combining a plurality of surface stress sensor outputs, it is possible to obtain a measured value in which parameters corresponding to a plurality of target substances are appropriately combined. At this time, by performing pattern matching and machine learning of the output of the surface stress sensor, features can be appropriately extracted from these outputs, and only a relatively small number of surface stress sensors can be used, rather than the number of surface stress sensors.
- Ketosis morbidity determination based on a large number of parameters can be realized.
- other types of gas sensors that are particularly convenient for detecting specific components that are present in the gas generated from the measurement target and are useful for determining the morbidity of ketosis can be used.
- such a gas sensor can be used in combination with the surface stress sensor, if necessary.
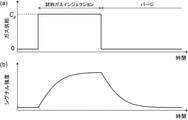
- FIG. 1 is a diagram showing a schematic configuration of a measurement system that can be used in the method of the present embodiment. Note that FIG. 1 shows a configuration in which a film-type surface stress sensor (MSS) is used as the surface stress sensor, but of course, this does not lose its generality.
- MSS film-type surface stress sensor
- the two gas flow paths are not the gas components to be measured, as shown by the white arrows from the left side of the figure, respectively, and do not affect the measurement of the gas components as much as possible.
- It supplies an inert gas (also called a purge gas or a reference gas).
- a purge gas for example, nitrogen gas or the atmosphere can be used, and in the examples described later, nitrogen gas is used as the purge gas.
- nitrogen gas is used as the purge gas.
- a small amount of gas that may affect the determination of ketosis morbidity, such as organic acids and ammonia generated from feed is mixed in the atmosphere at the measurement site (farm, etc.). It may be.
- the flow rate of such two gas flows is controlled by a mass flow controller (MFC) provided for each gas flow path.
- MFC mass flow controller
- the gas flows in the two gas flow paths are alternately switched at desired time intervals, and the gas flow rate is controlled to be constant on the time axis.
- the control of the gas flow is not limited to the MFC, and a system in which various pumps, valves, etc. are combined may be used.
- the positions where the pumps and valves are installed may be upstream or downstream of the sample, respectively, and may be configured in any order including the positions of the sample and the sensor. There is no such thing.
- the gas flow path shown on the upper side gives the MSS a purge gas that does not contain a gas component to be measured, thereby desorbing various gases diffused in the sensitive membrane coated on the surface of the MSS. Perform a purge process to initialize the MSS.
- the gas flow passing through the gas flow path on the lower side of FIG. 1 is supplied to the MSS in a state containing the gas component volatilized and evaporated from the sample in the vial placed immediately after the MFC.
- a configuration that does not use a vial can be adopted.
- the gas streams from the two gas channels merge in separate vials and then supplied to the MSS.
- the entire measurement system may be housed in a constant temperature bath, an incubator, or the like, or the MSS and its peripheral parts (hereinafter, these are also referred to as "sensor modules” or simply “modules”). Is housed in an incubator or the like, and the vial containing the sample may be installed outside the incubator or the like to maintain the temperature of the measurement system at a desired value.
- the vial bottle when measuring a plurality of samples, the vial bottle can be replaced outside the incubator or the like containing the sensor module. Therefore, the measurement system (particularly, the sensor module) is compared with the former configuration. ) Has the advantage that it is relatively easy to maintain and manage the temperature.
- the former configuration is more suitable for measuring a single sample
- the latter configuration hereinafter, also referred to as "open system" is more suitable for measuring a plurality of samples.
- the entire measurement system is housed in an incubator and measurement is performed, and an example in which the measurement system is an open system.
- the temperature of the vial containing the sample in FIG. 1 may be the same as or different from the temperature of the measurement system described above.
- the set value of the temperature of the vial bottle includes, but is not limited to, 5 ° C., 10 ° C., 20 ° C., 25 ° C., 30 ° C., 40 ° C., and 50 ° C.
- the system also includes interfaces and communication equipment for exchanging information, commands, etc. with processing equipment and external equipment, but the illustration is omitted.
- FIG. 2 shows an example of an optical micrograph of MSS.
- the MSS shown in FIG. 2 is formed from a silicon wafer used in the field of semiconductor device technology, which is cut out from a silicon single crystal, and a circular portion in the center (may be another shape such as a square) is around the silicon wafer. It is connected and fixed to the frame-shaped portion of the circular portion at four places on the top, bottom, left and right of the circular portion.
- the gas component given to the MSS is adsorbed and desorbed on the sensitive film applied to the surface of the circular portion, so that the surface stress applied to the MSS is concentrated in these four fixed regions and is provided in these fixed regions.
- the change in the electrical resistance of the piezo resistance element is brought about.
- piezo resistance elements are interconnected by a conductive region (shown as a grain-shaped region in FIG. 2) provided in the frame-shaped portion to form a Wheatstone bridge.
- a voltage is applied between the two opposing nodes of the Wheatstone bridge, and the voltage appearing between the remaining two nodes is taken out of the MSS as a signal output from the MSS to perform the required analysis.
- the structure and operation of such an MSS are described in detail in, for example, Patent Document 1.
- the sensitive film is widely applied not only to the circular portion of the MSS but also to the surface of the MSS chip including the frame-shaped portion. This is a state seen when the sensitive film is applied by spray coating, but since the sensitive film applied to the frame-shaped part etc.
- FIG. 3 shows a conceptual diagram of the time change of the signal intensity when a sample gas is applied to a surface stress sensor such as MSS.
- FIG. 3A shows on the time axis whether the gas given to the MSS is a sample gas or a purge gas.
- the concentration of the measurement target gas in the gas given to the MSS is a concentration Cg larger than 0 during the sample gas injection period in which the sample gas is given, and the gas flow path on the downstream side is given by giving the purge gas.
- the sample gas concentration becomes 0 during the purging period in which the sample gas inside is flushed away and the sample gas component adsorbed on the sensitive film of the MSS (and the tube wall of the gas flow path, etc.) is desorbed.
- FIG. 3B shows the intensity of the signal from the MSS when the gas type shown in FIG. 3A is switched, with the time axis aligned with that of FIG. 3A.
- the signal intensity is dominated by many factors, but basically between the gas and the sensitive membrane caused by the difference between the concentration of the component in the gas near the sensitive film on the MSS and the concentration of the same component on the surface of the sensitive film.
- the speed of adsorption / desorption of the relevant component is the main factor. Therefore, the signal intensity starts immediately after the gas is switched as shown in FIG. 3A, and becomes close to a curve that asymptotically approaches toward the upper and lower saturation values.
- FIG. 3B shows the curve in an ideal case.
- the actual shape of the curve, the maximum value of the curve, etc. may vary considerably depending on the rate of adsorption / desorption to the sensitive membrane and the type of component adsorbed / desorbed to the sensitive membrane, and the range of change in the signal may also differ significantly. many. Furthermore, the signal may show more complicated changes over time due to the viscoelastic properties of the sensitive membrane, the diffusion of the gas to be measured into the sensitive membrane, or the physicochemical interaction between the sensitive membrane material and the gas to be measured. be. In this way, it is possible to obtain the amount / concentration of each principal component in the sample, the ratio between the plurality of components, and the like based on the change over time and the amplitude of the signal from the MSS.
- a surface stress sensor coated with an appropriately selected material from these materials can be used alone to measure the gas generated from milk, or multiple types of surface stress sensors coated with different materials can be used in the same manner. By measuring the above, it is possible to make a determination based on the composition of the gas generated from the milk.
- the adsorption / desorption characteristics of the material forming the sensitive film are various, and there are also sensitive film materials that show a response that deviates from the above-mentioned simplified model.
- it can be said that it is useful in many cases to make the first examination using the above model.
- the sample gas injection period and the purge period are often the same length, but of course, the sample gas injection period. And the purge period may have different time lengths.
- the gas generated from the milk to be inspected is a trace component in the milk, so until an effective signal value is obtained from each sensor signal generated by adsorption and desorption of the gas component to the sensor. May take a relatively long time.
- it may be effective to set the sample gas injection period and the purge period in one measurement cycle to different lengths, and it is sufficient time to obtain a signal value effective as the sample gas injection period. It is preferable to make the purging period longer than the sample gas injection period.
- the sample gas injection period is 120 seconds
- the purge period is twice that, 240 seconds.
- a measurement sequence of "purge period-sample gas injection period-purge period” when performing multiple measurements, it is substantially before the second and subsequent sample gas injections. It is also effective to perform the purge twice.
- a purge period of 480 seconds (240 seconds + 240 seconds) from the end of the latest sample gas injection is secured before the second and subsequent sample gas injections. There is.
- the components adsorbed on the sensitive membrane on the MSS can be sufficiently desorbed during the sample gas injection, and the baseline becomes more stable. Therefore, it is particularly effective for ensuring the determination accuracy when the measurement is repeated a plurality of times.
- the purge period is shorter than the sample gas injection period, the judgment accuracy may be adversely affected.
- the long measurement time not only has the inconvenience of reducing the measurement throughput itself, but also causes various parameters (flow velocity, gas pressure, temperature, etc.) of the environment inside and outside the measurement system to be used for a long time. There are problems that it is often difficult to stabilize, and that the measurement system becomes large and expensive. Further, since the measurement system usually includes active parts such as a pump, a long-term temperature change due to heat generation from these parts may also adversely affect the determination accuracy.
- the time allocation of the measurement cycle is allocated as short as possible within the range in which an effective signal value can be obtained during the sample gas injection period (sampling time), and the purge period (purge time) is set. It is desirable to make it as long as possible.
- prepare reference milk (details will be described later) in which the amount of the component that can affect the judgment accuracy is a predetermined value, and refer to each measurement. It is also possible to eliminate or mitigate the adverse effects of short-term purging by measuring the gas generated from the milk and performing calibration.
- the gas flows in the two gas flow paths are usually switched alternately at desired time intervals, and the gas flow rate is on the time axis. It is controlled by the MFC (or pump, etc.) so that it becomes constant, but depending on the configuration of the measurement system and the specifications of the gas detection means (MSS in FIG. 1), the gas flow rate during the purge period may be the gas flow rate during the sample gas injection period. It may be possible to make the baseline more stable by increasing the flow rate.
- the measurement result of the time change of the signal intensity as shown in FIG. 3 obtained by applying the sample gas to the surface stress sensor such as MSS (hereinafter, also simply referred to as “measurement result”) is used.
- the disease of ketosis in animals is determined based on the composition of the gas generated from the milk.
- the measurement result may be used as it is, or the measurement result may be subjected to arbitrary data analysis processing.
- a time point arbitrarily selected from the time range of the measurement cycle is used as a reference point, and offset processing is performed with this time point as a reference point.
- the presence or absence of ketosis and / or the possibility of ketosis can be determined by obtaining the feature amount from the determination point or the value in the vicinity of the determination point with another arbitrary time point as the determination point from the above time range.
- the feature amount may be, for example, the signal intensity after offset processing at the determination point, the slope of the signal graph at the determination point, the average inclination or curvature of the signal graph near the determination point, or the like.
- the raw signal that has not been offset processed contains unique information such as the long-term changes over time of the sensor and the current state as the absolute value of the sensor signal, so offset processing is not performed.
- the value of the raw signal may be used as it is, or an arbitrary feature amount may be extracted from the raw signal for analysis.
- the reference point may be, for example, immediately before the start of the sample gas injection period (that is, the end of the purge period), immediately before the start of the purge period (that is, the end of the sample gas injection period), but any other time point. It may be a time point. However, since the gas given to the surface stress sensor is switched at the time of switching between purging and injection, the signal from the surface stress sensor may be disturbed in the vicinity of this boundary point. In addition, even if switching is performed, there may be a non-negligible time delay until the gas around the surface stress sensor located at a position passing through a gas flow path of a certain length from the switching mechanism such as a valve is actually switched. .. If the influence of instability such as signal disturbance or time delay can be a problem, a time point slightly shifted in time from the time point of this switching may be adopted as a reference point.
- the time point arbitrarily selected from the time range of the measurement cycle is used as the reference point, and the offset processing is performed based on the selected time point.
- the presence or absence of ketosis and / or the possibility of ketosis is determined by obtaining the feature amount from the judgment point or the value in the vicinity of the judgment point with another arbitrary time point within the above time range as the judgment point. Can be done.
- the feature amount may be, for example, the signal intensity after offset processing at the determination point, the slope of the signal graph at the determination point, the average inclination or curvature of the signal graph near the determination point, or the like. If the offset amount of the signal is sufficiently small, or the feature amount obtained from the signal intensity before offset is sufficiently large, the offset processing may be omitted.
- the determination points that satisfy these conditions are not only the time length of the measurement cycle, the time length of the sample gas injection period and the purge period, but also the configuration of the measurement system (gas flow path, gas supply form to the measurement system, etc.). Gas flow rate, etc.), measurement conditions, and if the gas detection means is a surface stress sensor (more specifically, MSS), it may differ depending on the type of sensitive film material, etc., so use reference milk in advance. It is desirable to confirm the combination of the reference point and the determination point at which the feature amount effective for determining the onset of ketosis can be extracted for each sensitive film material.
- the purging period by lengthening the purging period, the gas is sufficiently desorbed from the sensitive membrane, so that the state before the sample gas injection can be returned to the same state every time. That is, lengthening the purge period is useful for sufficiently resetting the measurement system.
- the time point at which this sufficient reset is performed is the time point immediately before the sample gas injection, and by using this as the reference point for the offset, signal reproducibility is ensured, and as a result, high-precision judgment becomes easy.
- the offset processing is performed with reference to the purge signal immediately before the start of sample gas injection, and the determination point is set at a time slightly after the end of the injection period to determine the signal intensity at the determination point. Fluctuations are more likely to be clear, and features that are effective in determining ketosis morbidity are likely to be obtained. In the experiment shown in the examples, the visual judgment became the easiest by observing the change in the signal intensity at the time point after several seconds to several tens of seconds from the end of the injection period or in the vicinity of the time point.
- the measurement is performed based on the measurement sequence of switching between the sample gas and the purge gas, but the present invention is not limited to this.
- switching between three types of gas by inserting a measurement for another gas (standard gas) containing a component contained in the sample gas whose concentration may affect the determination of ketosis morbidity into the measurement sequence.
- Ketosis morbidity can be determined based on the signal from the measurement.
- milk obtained from a healthy animal suspected of suffering from ketosis may be used as reference milk, and a gas having the same composition as the sample gas component generated from the reference milk may be used as standard gas.
- reference milk may be, for example, milk obtained from an animal belonging to the same breeding environment as the animal to be inspected (hereinafter, also referred to as “animals of the same group”), and in this case, the milk may be.
- Solid milk milk obtained from a single individual; preferably milk obtained from an animal of the same group known to be healthy
- combined milk milking tank, etc.
- It may be a milk in which a plurality of individual milks are mixed. It may also be called bulk milk).
- a gas having the same composition for some components of the sample gas assumed as such for example, a component for which a slight difference in the amount of components is desired to be measured with particularly high accuracy
- Various compositions can be set according to the above. Then, these three types of gas supply sequences are appropriately set in consideration of various measurement requirements and constraint conditions. For example, a measurement sequence involving repetition of gas supply time intervals such as: A. Supply purge gas ⁇ [Supply one of sample gas and standard gas ⁇ Supply purge gas ⁇ Supply the other of sample gas and standard gas ⁇ Supply purge gas] (or repeat in []) B.
- Supply purge gas ⁇ [Supply sample gas and standard gas alternately ⁇ Supply purge gas] (or repeat in [])
- Supply purge gas ⁇ [Repeat alternating supply of sample gas and standard gas and purge gas ⁇
- Supply purge gas ⁇ Repeat alternate supply of sample gas and standard gas and purge gas] (or repeat in [] )
- various gas supply sequences in the gas supply time section can be considered. In any gas supply sequence, it is considered that the measurement conditions such as temperature, gas pressure / flow rate, and changes in sensor characteristics over time do not change significantly within the sequence during the series of measurement sequences. It is also possible to accurately measure a slight difference in composition between the two gases, and to reduce the influence of disturbance on the measurement result, thereby improving the stability of the measurement.
- the standard gas may be prepared in a gaseous state from the beginning, or may be introduced into the gas supply system by evaporating from a liquid or a solid.
- another gas such as a purge gas may be mixed with the gas generated from the initially prepared gas or liquid / solid.
- the three flow paths may be merged at one place, or a part of the upstream side of the sample gas flow path may be merged.
- a configuration is also conceivable in which a standard gas flow path is configured, and after the standard gas is introduced into the standard gas flow path, both gas flow paths are merged before the confluence point with the purge gas.
- the measurement reproducibility is high as long as the required determination accuracy can be achieved and the variation between the sensor chip and the measuring device can be calibrated
- the measurement of the sample gas and the measurement of the standard gas are independent of each other. It is also possible to construct a measurement procedure and a measurement system for that purpose, which are performed at different convenient points. For example, the standard gas measurement and the sample gas measurement are not performed simultaneously or sequentially in a series of measurement sequences, but separately, and the standard gas measurement data and the sample gas measurement data obtained from these measurements are obtained. You may compare.
- the condition of the heading that is, the condition that the measurement reproducibility is high as long as the required determination accuracy can be realized and the variation between the sensor chip and the measuring device can be calibrated
- the sample gas is used.
- the sensor chip or measuring device used for measurement and the sensor chip or measuring device used for measuring standard gas may be the same individual, or a sensor different from the one used for one measurement. Chips and measuring devices may be used. Further, the measurement may be performed using only the sample gas and the standard gas without using the purge gas. In this case, the standard gas may be used as the purge gas for measurement. Furthermore, measurement using only the sample gas or only the standard gas is possible. In this case, by exposing the sample gas or the standard gas to the sensor for a sufficiently long time, each gas may be sufficiently adsorbed and diffused to the sensitive membrane, and the sensor may wait until it shows a constant signal value. The absolute value of this signal may be used as it is as a feature amount, or the signal when exposed to the atmosphere or the like for a sufficiently long time may be measured before measurement and used as a reference point.
- the past milk itself or the volatile / evaporated components from the past milk itself should not be altered. It is not realistic to save. Therefore, if the gas obtained from the milk at the time when it is already known to be healthy in the past is measured and stored as standard gas data, it can be obtained from this milk from the same animal. As long as the reproducibility of measurement and the calibability of various variations can be ensured by converting the obtained gas into data as a sample gas, the above-mentioned gas in a fresh state for each milk to be measured. Can be compared.
- the data conversion of the measurement results of each gas is not particularly limited.
- the output from the sensor when alternating between each gas and purge gas may be digitized as it is, or the sensor output for other types of measurement may be digitized. This may be done, or the digital value as a result of digitization as described above may be further processed into data.
- Materials for the sensitive film of the surface stress sensor include Poly (4-methylstyrene) (poly (4-methylstyrene)) and Poly (2,6-diphenyl-p-phenylene oxide) (poly (2,6-diphenyl-p).
- the gas generated from milk is used as the sample to be inspected
- Poly (4-methylstyrene), Poly (2,6-diphenyl-p-phenylene oxide), Poly (vinylidene fluoride) ), Cellulose Acetate Butyrate and Poly (ethyleneimine) at least one selected from the group can be used.
- At least one selected from the group consisting of Poly (2,6-diphenyl-p-phenylene oxide) is more preferred.
- Poly (4-methylstyrene), Poly (2,6-diphenyl-p-phenylene oxide) and Poly (vinylidene fluoride) are used for multiple types of test subjects including milk and urine. It can be said that it is a sensitive film material that can be suitably used, and in that sense, it is a more versatile sensitive film material. A specific measurement example using the sensitive film material exemplified above will be described later.
- Poly (2,6-diphenyl-p-phenylene oxide) (poly (2,6-diphenyl-p-phenylene oxide)) is a material also known as "Tenax” or “Tenax” (registered trademark).
- Tenax TA and Tenax GR (Tenax GR is a mixture of 23% graphite carbon during Tenax polymerization) with a suffix added after Tenax, and any of these is used in the method of this embodiment. be able to.
- Tenax is provided with various particle size distributions, and the range of particle size is represented by a mesh such as Tenax TA 20/35.
- Tenax TA60 / 80 (obtained from GL Sciences Co., Ltd.) was used as Poly (2,6-diphenyl-p-phenylene oxide).
- MSS using Poly (4-methylstyrene) is "ChA”
- MSS using Poly (2,6-diphenyl-p-phenylene oxide) is “ChB”
- Poly ( MSS using vinylidene fluoride) is “ChC”
- MSS using Cellulose Acetate Butyrate is "ChD”
- MSS using Poly (ethyleneimine) is "ChE”
- phenyl group modified silica / titania composite nanoparticles (Phenyl-STNPs) ) Will be described as “ChF”
- MSS using Polystyrene will be described as “ChG”.
- ⁇ Test 1 Measurement of gas generated from milk of healthy cows in different breeding environments> At the Hokkaido Agricultural Research Center, National Research and Development Corporation, Agricultural and Food Industry Technology Research Center, 10 mL (sample 1) of milk (sample 1) of dairy cows (grazing cows) bred by feeding raw grass by grazing, and silage by grazing 10 mL (Sample 2) of milk from the dairy cows (house cows) raised in the above was placed in vials and measured. The milks of Sample 1 and Sample 2 were so different in aroma that they could be discriminated by the human sense of smell, and the flavor by the human sense of taste was also significantly different.
- the temperature of the incubator containing the measurement system was set to 30 ° C.
- the flow rate of the sample gas and the purge gas was 10 sccm, and the sampling time (time for injecting the sample gas in each measurement cycle) was 120 seconds.
- the measurement was performed with the ratio of the sampling time to the purge time (the time when the purge gas is given to the MSS and the purge is performed in each measurement cycle) to be 1: 4.
- the measurement sequence in each measurement cycle was configured such that the purge gas was first flowed for 240 seconds, then the sample gas was flowed for 120 seconds, and then the purge gas was flown again for 240 seconds.
- the purge time is the sum of the above two purge times, and the ratio of the sampling time to the purge time is substantially 1: 4. It should be noted that these measurement conditions can be appropriately adjusted according to the configuration of the measurement system.
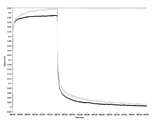
- FIG. 4 is a diagram showing a time change (unit: seconds) of a signal (unit: mV) from MSS of ChA.
- the measurement result of the sample 1 is shown in light gray
- the measurement result of the sample 2 is shown in dark black.
- the start time of the sample gas injection period (that is, the end time of the first purge period) of the above measurement sequence was set as the starting point of the offset, and the same sample was measured a plurality of times.
- typical results are plotted. The same applies to FIGS. 5 to 14 and FIGS. 18 to 22, which will be described later.
- ⁇ Test 2 Measurement of gas generated from milk imitating the milk of cows suffering from ketosis>
- the milk acetone concentration of healthy cows is less than 0.7 mmol / L, while the milk acetone of hyperketonaemia-affected cows in which a decrease in milk yield is clearly observed.
- the concentration is said to exceed 1.4 mmol / L (see Table 1). Therefore, it is assumed that the milk acetone concentration of sample 2 (milk of the house cow) used in the above test 1 is 0.7 mmol / L, and the acetone concentration of 70 mmol / L is added to 10 mL of the same milk of the house cow.
- sample 3 was prepared by adding 0.1 mL of an aqueous solution so that the concentration of acetone in the milk was close to 1.4 mmol / L, and this was used as a milk imitating the milk of a cow suffering from ketosis.
- sample 4 was prepared by adding 0.1 mL of distilled water to 10 mL of the same cow milk used in Test 1, and the Samples 3 and 4 were placed in vials, respectively. And the measurement was performed.
- the measurement conditions such as the temperature of the incubator containing the measurement system were the same as in Test 1.
- FIG. 5 is a diagram showing a time change (unit: seconds) of a signal (unit: mV) from MSS of ChA.
- the measurement result of the sample 3 is shown in light gray, and the measurement result of the sample 4 is shown in dark black.
- ⁇ Test 3 Measurement of gas generated from milk of cows suffering from ketosis (1)> 10 mL of milk (Sample 5) determined to be strongly positive (BHBA concentration 1000 ⁇ M) by a test using a product (Sanket Paper, Sanwa Chemical Laboratory Co., Ltd.) that semi-quantifies ⁇ -hydroxybutyric acid in milk, and 10 mL (Sample 6) of milk determined to be negative (BHBA concentration 50 ⁇ M) was placed in a vial and measured. The measurement of the sample 5 and the sample 6 was carried out using a sample which had been allowed to stand at room temperature for about 24 hours after collecting the milk.
- the vial was placed in a room temperature (about 25 ° C.) environment, and the measurement system was an open system. During the measurement, the temperature of the sensor module was stable at about 36.5 ° C. Other measurement conditions such as the flow rate of the sample gas and the purge gas were the same as in Test 1.
- FIG. 6 is a diagram showing a time change (unit: seconds) of a signal (unit: mV) from MSS of ChA.
- FIG. 7 is a diagram showing the time change (unit: seconds) of the signal (unit: mV) from the MSS of ChB.
- FIG. 8 is a diagram showing the time change (unit: seconds) of the signal (unit: mV) from the MSS of ChD.
- FIG. 9 is a diagram showing the time change (unit: seconds) of the signal (unit: mV) from the MSS of ChE.
- the measurement result of the sample 5 is shown in light gray
- the measurement result of the sample 6 is shown in dark black.
- the samples 5 and 6 have.
- a sharp drop in signal intensity occurs, but in sample 5, the signal intensity value gradually converges toward the baseline from a higher signal intensity value than in sample 6, and in sample 6, the signal intensity increases in a shorter time. It has converged and returned to the baseline.
- the determination of ketosis morbidity from the single measurement result can be determined as in the MSS using the ChA, ChB, ChD, and ChE sensitive film materials. Results showing that it is possible were obtained, but it was suggested that it is more preferable to combine multiple measurement results.
- the MSS using the ChC sensitive film material is the same as the MSS using the ChA, ChB, ChD, ChE sensitive film material (or other gas detecting means including a surface stress sensor of a different type from the MSS). It was suggested that the judgment based on the combination was more suitable.
- ⁇ Test 4 Measurement of gas generated from milk of cows suffering from ketosis (2)> 10 mL of milk (sample) judged to be false positive to positive (BHBA concentration 100 to 200 ⁇ M) by a test using a product (Sanket Paper, Sanwa Chemical Laboratory Co., Ltd.) that semi-quantifies ⁇ -hydroxybutyric acid in milk. 7) and 10 mL (Sample 8) of milk judged to be negative (BHBA concentration 0 to 50 ⁇ M) were placed in vials, and the following two types of measurements with different temperature conditions were performed. In addition, the measurement of the sample 7 and the sample 8 was performed using the one refrigerated immediately after the milk collection.
- Measurement a In measurement a, the vial was placed in a normal temperature (about 20 ° C) environment, and the measurement system was an open system. During the measurement, the temperature of the sensor module was stable at about 36.5 ° C. Other than the temperature condition of the vial, other measurement conditions such as the flow rate of the sample gas and the purge gas were the same as in Test 1.
- Measurement b In the measurement b, the vial was placed in a hot water bath set at about 30 ° C., and the measurement system was an open system. During the measurement, the temperature of the sensor module was stable at about 36.5 ° C. Other than the temperature condition of the vial, other measurement conditions such as the flow rate of the sample gas and the purge gas were the same as in Test 1.
- FIG. 10 is a diagram showing a time change (unit: seconds) of a signal (unit: mV) of ChA from MSS in measurement a.
- FIG. 11 is a diagram showing a time change (unit: seconds) of a signal (unit: mV) of ChD from MSS in measurement a.
- FIG. 12 is a diagram showing a time change (unit: seconds) of a signal (unit: mV) of ChA from MSS in measurement b.
- FIG. 13 is a diagram showing a time change (unit: seconds) of a signal (unit: mV) of ChD from MSS in measurement b.
- FIG. 10 is a diagram showing a time change (unit: seconds) of a signal (unit: mV) of ChA from MSS in measurement a.
- FIG. 11 is a diagram showing a time change (unit: seconds) of a signal (unit: mV) of ChD from MSS in measurement
- FIGS. 10 to 14 is a diagram showing a time change (unit: seconds) of a signal (unit: mV) of ChE from MSS in measurement b.
- the measurement result of the sample 7 is shown in light gray
- the measurement result of the sample 8 is shown in dark black.
- FIG. 12 which shows the results when the ChA sensitive film material is used in the measurement b
- the change over time of the signal of the sample 7 is significantly different from that of the sample 8 as compared with the result shown in FIG.
- the measurement b was higher than the result obtained in the measurement a.
- the signal intensity value at the sharp fall of the signal intensity immediately after switching from the sample gas injection period to the purge period is high, and the value gradually converges toward the baseline.
- the difference in the decrease behavior of the signal intensity during the purge period is more clear between the sample 7 and the sample 8.
- ⁇ Test 5 Measurement of gas generated from urine of cattle suffering from ketosis> [Proton transfer reaction time-of-flight mass spectrometry using milk and urine] In the measurement of the sample using the measurement system, milk and urine collected from Ketosis-affected cows and healthy cows were measured by proton transfer reaction time-of-flight mass spectrometry (PTR-TOF-MS).
- 15A and 15B are diagrams showing mass spectra of milk of a cow suffering from ketosis and milk of a healthy cow, respectively, obtained by PTR-TOF-MS.
- cows suffering from ketosis are positive to strongly positive (BHBA concentration 200 to 1000 ⁇ M) by a test using a product (Sanket Paper, Sanwa Chemical Laboratory Co., Ltd.) that semi-quantifies ⁇ -hydroxybutyric acid in milk.
- the healthy cow is a dairy cow judged to be negative (BHBA concentration 0 to 50 ⁇ M) by the above test.
- the amount of the milk sample used for the measurement was 2 mL, and the dilution ratio of the gas was 100 times. The same applies to the measurement of the urine sample described later (FIGS. 16A and 16B).
- the peak positions are highly similar, but the m / z values are about 50 to 80.
- the peak intensities in the range showed a significant difference between ketosis-affected cattle and healthy cattle, and as a result of analysis, peaks derived from acetone and 2-butanone were included as shown by arrows in each figure. It was confirmed that.
- 16A and 16B are diagrams showing mass spectra of ketosis-affected cow urine and healthy cow urine obtained by PTR-TOF-MS, respectively.
- FIG. 17A, 17B and 17C are diagrams showing the measurement results of the concentrations of acetone and 2-butanone by PTR-TOF-MS in the milk and urine of ketosis-affected cows and the milk and urine of healthy cows.
- FIG. 17A is a diagram showing the measurement results of the concentrations of acetone and 2-butanone together, in which the solid line is acetone and the broken line is 2-butanone.
- 17B and 17C are views showing the measurement results of the concentrations of acetone and 2-butanone shown in FIG. 17A separately.
- FIG. 17B is acetone and FIG. 17C is 2-butanone.
- FIGS. 15A and 15B, FIGS. 16A and 16B, and FIGS. 17A-17C show that even with different types of body fluids, dairy cow's milk and urine. It shows that there is a common correlation between the presence or absence of ketosis and the content (concentration) of specific components (eg, acetone and 2-butanone) in the composition of the gas generated from those body fluids.
- specific components eg, acetone and 2-butanone
- sample 9 and sample 10 In the measurement of sample 9 and sample 10, the vial was placed in a normal temperature (about 25 ° C.) environment, and the measurement system was an open system. During the measurement, the temperature of the sensor module was stable at about 36.5 ° C. Other measurement conditions such as the flow rate of the sample gas and the purge gas were the same as in Test 1.
- FIG. 18 is a diagram showing a time change (unit: seconds) of a signal (unit: mV) from MSS of ChA.
- FIG. 19 is a diagram showing a time change (unit: seconds) of a signal (unit: mV) from the MSS of ChB.
- FIG. 20 is a diagram showing a time change (unit: seconds) of a signal (unit: mV) from MSS of ChC.
- FIG. 21 is a diagram showing a time change (unit: seconds) of a signal (unit: mV) from the MSS of ChF.
- FIG. 22 is a diagram showing the time change (unit: seconds) of the signal (unit: mV) from the MSS of ChG.
- the measurement result of the sample 9 is shown in light gray, and the measurement result of the sample 10 is shown in dark black.
- MSS using a ChA sensitive membrane material is used alone. It can be used to measure gas generated from milk and gas generated from urine, and based on the results, a determination of ketosis morbidity can be made.
- a measurement system including an aggregate of MSS coated with each of the ChA to ChG sensitive film materials is configured, and ChA, ChB and ChC sensitive film materials are used.
- MSS gas generated from the milk and the gas generated from the urine were measured, and in the MSS using the ChD and ChE sensitive membrane materials, the gas generated from the milk was measured, and the ChF and ChG sensitive membrane materials were used.
- MSS gas generated from urine can be measured, and by combining these results, it is possible to determine the morbidity of ketosis.
- the present invention is typically suitable for dairy cows when milk is used as the body fluid to be tested.
- dairy cows it is also suitable for application to animals bred for producing milk as an industry, such as goats, sheep, buffalo (buffalo), bovids such as yaks, and horses.
- the present invention preliminarily extracts individuals with ketosis and / or individuals suspected of having ketosis in animals such as dairy cows that are multi-headed to produce milk (screening). ) Is particularly suitable.
- body fluids other than milk can be used as appropriate depending on the situation, although the ease of collection and the certainty of whether or not they can be obtained at the required time differ depending on the type of body fluid, the type of animal, and the collection method. Can be tested for various body fluids.
Landscapes
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Life Sciences & Earth Sciences (AREA)
- Biomedical Technology (AREA)
- Physics & Mathematics (AREA)
- Chemical & Material Sciences (AREA)
- Urology & Nephrology (AREA)
- Molecular Biology (AREA)
- Hematology (AREA)
- Biophysics (AREA)
- Food Science & Technology (AREA)
- Medicinal Chemistry (AREA)
- Analytical Chemistry (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- General Physics & Mathematics (AREA)
- Immunology (AREA)
- Pathology (AREA)
- Investigating Or Analysing Biological Materials (AREA)
Abstract
本発明は、動物のケトーシス罹患及び/またはケトーシス罹患の可能性の有無を、現場等で簡便に判定できるようにすることを課題とする。また、本発明は、当該判定を行うための装置を提供することも課題とする。 本発明の一実施形態に係るケトーシス罹患判定方法は、動物(ヒトを除く。)から採取した体液から発生したガスをガス検出手段に与え、前記体液から発生したガスに対する前記ガス検出手段の応答を使用して、前記体液から発生したガスの組成に基づく前記動物のケトーシス罹患の判定を行う。
Description
本発明は、動物のケトーシス罹患判定に関し、具体的には動物が泌乳した乳汁、その他動物から採取した体液から発生したガスの組成に基づくケトーシス罹患判定に関する。
ケトーシスとは、主としてケトン体の産生が亢進し、その利用能を上回ることにより、大量のケトン体が動物の組織、体液中に蓄積している状態である。例えば、血中のケトン体が増量した状態はケトン血症、尿中のケトン体が増量した状態はケトン尿症、乳中のケトン体が増量した状態はケトン乳症とも呼ばれる。ケトン体は、脂肪の合成や分解における中間代謝産物であり、カルボニル基(>C=O)と2個の炭化水素(R-)が結合した化合物の総称であり、動物の体内に存在するケトン体としては、アセト酢酸、β-ヒドロキシ酪酸(3-ヒドロキシ酪酸とも呼ばれる。)、及びアセトンなどがある。
脂肪酸は、肝臓でアセト酢酸を経てアセトンまたはβ-ヒドロキシ酪酸に分解され、最終的には組織で酸化を受け二酸化炭素と水に代謝される。糖質の代謝が障害されると、血中グルコースの代わりに、生体内のエネルギー源として貯蔵されていた脂肪が使用され、肝臓では脂肪分解に伴うケトン体の産生が亢進する。そのため、糖尿病による糖利用障害や、絶食・飢餓状態などの際に、徐々に組織の処理能力の限界を超えてケトン体が血中に蓄積すると、ケトーシス(ケトン血症)となる。
ケトーシスになると、吐き気や嘔吐、腹痛などの消化器症状が現れる。ケトン体は酸性物質であるため、ケトン体の量がさらに増え、血液が酸性に傾くと、ケトーシスからケトアシドーシス(アシドーシス状態)に進行する。このケトアシドーシスが続くと、意識障害や昏睡状態(例えば糖尿病性昏睡)に至り、最悪の場合は死に至る可能性があることが知られている。従って、ケトーシス(またはケトアシドーシス)は、組織におけるグルコースの利用が障害されたとき(糖尿病等)や、糖質供給が不十分のとき(絶食・飢餓状態等)をはじめ、妊娠悪阻、嘔吐、下痢、脱水、過脂肪食、甲状腺中毒症、消化吸収障害、小児自家中毒、糖原病等により発症する。
また、反芻動物は、消化管内発酵産物である酪酸からのβ-ヒドロキシ酪酸の生成があるため、生理的状態においても血中ケトン体濃度は非反芻動物に比べて高く、ケトーシスの発症も多いことで知られている。とりわけ乳牛においては、分娩前後に大きなエネルギー変化が生じ、分娩後の泌乳開始に伴って多くのエネルギーを必要とするが、乾物摂取量(DMI)が十分に増加していない時期には負のエネルギーバランス(NEB)となる。このNEBに対して乳牛は体内に貯蔵されている糖質、タンパク質、脂質を使って適応しようとするが、それが十分に達成されなかった場合にはケトーシスに陥る。ケトーシスに罹患した乳牛は、DMIの低下や泌乳量の減少等の臨床症状を示す一方、明らかな臨床症状を伴わず、体内のケトン体が増加している潜在性ケトーシスも増加傾向にあり、それが泌乳量や他の代謝性疾患の発症に影響を与えるという問題がある。
従来、乳牛の潜在性ケトーシスの判定には、血液中のβ-ヒドロキシ酪酸(BHBA)濃度が使用されている(非特許文献1参照)。これは、β-ヒドロキシ酪酸が他のケトン体であるアセトンやアセト酢酸よりも安定しているからであり、具体的な基準値としては、潜在性ケトーシスとその後の疾病発生や生産性低下との関連性に基づき、1.0mmol/L~1.4mmol/Lの範囲が示されている。また、血液以外にも、乳汁や尿を用いた潜在性ケトーシスの判定が行われており、これまでに、試験紙を用いた半定量法が開発されている。なお、乳牛の潜在性ケトーシスの診断等に関しては、必要に応じて非特許文献1を参照されたい。
及川伸、「潜在性ケトーシスに関する最近の研究動向」、日獣会誌 68 33-42(2015).(http://nichiju.lin.gr.jp/mag/06801/b1.pdf)
A. H. Gustafsson and U. Emanuelson, "Milk acetone concentration as an indicator of hyperketonaemia in dairy cows: The critical value revised", Animal Science 1996, 63: 183-188.
F. Enjalbert, M. C. Nicot, C. Bayourthe, and R. Moncoulon, "Ketone Bodies in Milk and Blood of Dairy Cows: Relationship between Concentrations and Utilization for Detection of Subclinical Ketosis", Journal of Dairy Science Vol. 84, No. 3, 2001.
近年の農場の大規模化を背景に、乳牛をはじめとする家畜(産業動物)の飼養管理システムが個体管理から群管理に変遷する中で、周産期病であるケトーシス及び潜在性ケトーシスを早期に発見することに対するニーズが存在している。
上述したような血液を用いる診断は客観的でありかつ正確性には優れるが、スループットが小さい割には費用が高額になりやすく、また、飼育現場での測定が難しいという問題がある。最近、現場での測定が可能な小型の装置が開発されたが、血液中のβ-ヒドロキシ酪酸濃度は採食後に上昇するため、検査精度を確保するにはサンプリングのタイミングが制限される。
尿を用いた検査は非侵襲的ではあるが、現在実用レベルに達している試験紙を用いた半定量法では、血液検査と比べて正確性に劣る。また、動物によっては尿検体の採取が容易ではない場合や、尿検体が採取できるタイミングに制約があるため、診断のための試料としては利用しにくい場合がある。
乳汁を用いた検査でも、試験紙を用いた半定量法の有用性は確認されているものの、血液検査と比べると、感度及び特異度には改善の余地がある。なお、乳牛などの給餌・搾乳・乳汁からのケトーシス診断等を自動化するシステムが特許文献2で提案されている。しかし、ここでは液体の乳汁をそのままの形で分析するという技術思想に基づいてシステムが構成されているため、検査のための流路などの複雑化(検査用試薬流路の追加等)、検査用試薬などの消耗品費用の増大等の問題があった。
そこで、本発明は、動物のケトーシス罹患及び/またはケトーシス罹患の可能性の有無を、現場等で簡便に判定できるようにすることを課題とする。
また、本発明は、当該判定を行うための装置を提供することも課題とする。
また、本発明は、当該判定を行うための装置を提供することも課題とする。
上記課題の解決のために、本発明者らは、検体の種類、すなわち、従来の検査方法で用いられる検体がいずれも液体である点に着目した。
例えば、乳牛においては、非特許文献3に乳汁中のアセトン濃度は血中アセトン濃度と同程度であり、高い相関があることが開示されているが、他方では給与される飼料の違いによって、ヒトの嗅覚や味覚ではっきりと識別できるほどに乳汁の香りや風味が異なることが知られている。言い換えると、ヒトの嗅覚や味覚で識別できる乳汁の香りや風味は、飼料の違いに大きく影響を受ける。これが示唆していることは、健常な牛からのものであるという一つのカテゴリに属する乳汁であってもその揮発・蒸発成分の組成が大きくばらつくため、疾患を有する牛からの乳汁の揮発・蒸発成分との比較を行う際に、両者の識別が困難である可能性があることである。従来、実用的な嗅覚センサがほとんど入手できなかったことに加えて、このような可能性も原因であったと考えられるが、これまで、乳汁から発生したガスと疾患との関連性については、本発明者らが知る限りにおいて、ほとんど知見は得られていなかった。
しかしながら、後述する実施例で示すように、ガス検出手段として表面応力センサを用いた測定では、特定の感応膜材料を用いた場合に、飼料の異なる健常な乳牛から得た2種類の乳汁について、これらの乳汁から発生したガスの組成に起因するような顕著な差は確認されなかった。
このことから、本発明者らは、従来の常識にとらわれず、乳汁から発生したガスと疾患との間に一定の相関関係が成り立ち得るとの仮説の下、乳汁から発生したガスを用い、当該ガスに対するガス検出手段の応答を使用して特定の疾患の罹患判定を行うことを着想した。さらには、動物から採取される乳汁以外の体液、例えば血液、尿、唾液、汗も、そこから発生するガスを用いることでこの種の罹患判定を行うことが可能であるという着想を得た。
そして、本発明者らは、鋭意検討を行なった結果、動物の乳汁等の体液から発生したガスの組成に基づいて当該動物のケトーシス罹患の判定が可能であることを見出し、本発明を完成するに至った。
すなわち、本発明は、以下の[1]~[22]を要旨とする。
[1] 動物(ヒトを除く。)から採取した体液から発生したガスをガス検出手段に与え、前記体液から発生したガスに対する前記ガス検出手段の応答を使用して、前記体液から発生したガスの組成に基づく前記動物のケトーシス罹患の判定を行う、ケトーシス罹患判定方法。
[2] 前記体液は乳汁、血液、尿、唾液、汗からなる群から選択される、[1]に記載のケトーシス罹患判定方法。
[3] 前記体液から発生したガスは、ケトン類、アルコール類、アルデヒド類、ニトリル類、有機酸、水(水蒸気)、窒素、酸素、二酸化炭素の少なくとも一つである、[1]または[2]に記載のケトーシス罹患判定方法。
[4] 前記体液から発生したガスはケトン類及びアルコール類の少なくとも一つであり、前記ケトン類はアセトンであり、前記アルコール類は、メタノール、エタノール、プロパノール及びブタノールからなる群から選択された少なくとも一つである、[3]に記載のケトーシス罹患判定方法。
[5] 前記ガス検出手段はガスセンサであり、前記ガス検出手段の応答はガスセンサから出力されるシグナルである、[1]から[4]の何れかに記載のケトーシス罹患判定方法。
[6] 前記ケトーシス罹患の判定は、前記シグナルの時間変化のパターンに基づいて行う、[5]に記載のケトーシス罹患判定方法。
[7] 前記ガスセンサは表面応力センサである、[5]または[6]に記載のケトーシス罹患判定方法。
[8] 前記体液を収容した容器に、ケトーシス罹患の判定に影響を与える成分を実質的に含有していないガスを通すことにより得られたガスを前記体液から発生したガスとして前記表面応力センサに供給する、[7]に記載のケトーシス罹患判定方法。
[9] 前記表面応力センサに前記体液から発生したガスの供給を開始した以降の前記シグナルを使用して前記ケトーシス罹患の判定を行う、[7]または[8]に記載のケトーシス罹患判定方法。
[10] 前記表面応力センサは膜型表面応力センサである、[7]から[9]の何れかに記載のケトーシス罹患判定方法。
[11] 前記表面応力センサの感応膜の材料としてPoly(4-methylstyrene)、Poly(2,6-diphenyl-p-phenylene oxide)、Poly(vinylidene fluoride)、Cellulose Acetate Butyrate、Poly(ethyleneimine)、フェニル基修飾シリカ/チタニア複合ナノ粒子及びPolystyreneからなる群から選択された少なくとも一を使用する、[7]から[10]の何れかに記載のケトーシス罹患判定方法。
[12] 前記表面応力センサとして、前記群から選択された一の材料を感応膜に使用した第1の表面応力センサと、前記群から選択された他の材料を感応膜として使用した第2の表面応力センサとを少なくとも使用する[11]に記載のケトーシス罹患判定方法。
[13] 前記体液から発生したガスとパージガスとを前記表面応力センサに交互に与え、前記体液から発生したガスに対応する前記シグナルと前記パージガスに対応する前記シグナルとを使用して前記ケトーシス罹患の判定を行う、[7]から[12]の何れかに記載のケトーシス罹患判定方法。
[14] 前記体液から発生したガスを前記表面応力センサに供給する時間区間と前記パージガスを前記表面応力センサに与える時間区間とに加えて、所定の標準ガスを前記表面応力センサに与える時間区間を設け、前記ケトーシス罹患の判定にあたって前記標準ガスに対応する前記シグナルを更に使用する、[13]に記載のケトーシス罹患判定方法。
[15] 標準ガスとパージガスとを前記表面応力センサに交互に与え、前記標準ガスに対応する前記シグナルと前記パージガスに対応する前記シグナルとに基づいた標準ガス対応のディジタルデータと、前記体液から発生したガスとパージガスとを前記表面応力センサに交互に与え、前記体液から発生したガスに対応する前記シグナルと前記パージガスに対応する前記シグナルとに基づいた測定対象体液対応のディジタルデータとを準備し、前記ケトーシス罹患の判定は、前記標準ガス対応のディジタルデータと前記測定対象体液対応のディジタルデータとに基づいてケトーシス罹患判定を行う、[13]に記載のケトーシス罹患判定方法。
[16] 前記標準ガスとパージガスとが交互に与えられる前記表面応力センサと前記体液から発生したガスとパージガスとが交互に与えられる前記表面応力センサとは同一の個体である表面応力センサであるか、または互いに別の個体である表面応力センサである、[15]に記載のケトーシス罹患判定方法。
[17] 前記標準ガスは参照体液から発生するガスである、[14]から[16]の何れかに記載のケトーシス罹患判定方法。
[18] 前記体液から発生したガスを追加のガスセンサに供給し、前記表面応力センサからのシグナルと前記追加のガスセンサからのシグナルとに基づいて前記ケトーシス罹患の判定を行う、[7]から[17]の何れかに記載のケトーシス罹患判定方法。
[19] 少なくとも一つの表面応力センサと、動物から採取された検査対象の体液から発生した試料ガスを供給する第1のガス流路と、測定すべきガス成分を含有しないパージガスを供給する第2のガス流路とを設け、前記第1のガス流路から供給される試料ガスと前記第2のガス流路から供給されるパージガスとを交互に切り替えて前記少なくとも一つの表面応力センサに供給して前記少なくとも一つの表面応力センサからシグナルを発生させることにより、前記体液から発生した試料ガスの組成に基づく前記動物のケトーシス罹患の判定を行う、ケトーシス罹患判定装置。
[20] 追加のガスセンサと前記試料ガスを前記追加のガスセンサに供給する追加のガス流路とを設け、前記少なくとも一つの表面応力センサからの前記シグナルと前記追加のガスセンサからのシグナルとに基づいて前記ケトーシス罹患の判定を行う、[19]に記載のケトーシス罹患判定装置。
[21] 少なくとも一つの表面応力センサと、動物から採取された検査対象の体液から発生した試料ガスを供給する第1のガス流路と、測定すべきガス成分を含有しないパージガスを供給する第2のガス流路と、所定の標準ガスを供給する第3のガス流路とを設け、前記第1のガス流路から供給される試料ガスと前記第2のガス流路から供給されるパージガスと前記第3のガス流路から供給される標準ガスとを所定の順序で切り替えて前記少なくとも一つの表面応力センサに供給して前記少なくとも一つの表面応力センサからシグナルを発生させることにより、前記体液から発生した試料ガスの組成に基づく前記動物のケトーシス罹患の判定を行う、ケトーシス罹患判定装置。
[22] 追加のガスセンサと前記試料ガスを前記追加のガスセンサに供給する追加のガス流路とを設け、前記少なくとも一つの表面応力センサからの前記シグナルと前記追加のガスセンサからのシグナルとに基づいて前記ケトーシス罹患の判定を行う、[21]に記載のケトーシス罹患判定装置。
[2] 前記体液は乳汁、血液、尿、唾液、汗からなる群から選択される、[1]に記載のケトーシス罹患判定方法。
[3] 前記体液から発生したガスは、ケトン類、アルコール類、アルデヒド類、ニトリル類、有機酸、水(水蒸気)、窒素、酸素、二酸化炭素の少なくとも一つである、[1]または[2]に記載のケトーシス罹患判定方法。
[4] 前記体液から発生したガスはケトン類及びアルコール類の少なくとも一つであり、前記ケトン類はアセトンであり、前記アルコール類は、メタノール、エタノール、プロパノール及びブタノールからなる群から選択された少なくとも一つである、[3]に記載のケトーシス罹患判定方法。
[5] 前記ガス検出手段はガスセンサであり、前記ガス検出手段の応答はガスセンサから出力されるシグナルである、[1]から[4]の何れかに記載のケトーシス罹患判定方法。
[6] 前記ケトーシス罹患の判定は、前記シグナルの時間変化のパターンに基づいて行う、[5]に記載のケトーシス罹患判定方法。
[7] 前記ガスセンサは表面応力センサである、[5]または[6]に記載のケトーシス罹患判定方法。
[8] 前記体液を収容した容器に、ケトーシス罹患の判定に影響を与える成分を実質的に含有していないガスを通すことにより得られたガスを前記体液から発生したガスとして前記表面応力センサに供給する、[7]に記載のケトーシス罹患判定方法。
[9] 前記表面応力センサに前記体液から発生したガスの供給を開始した以降の前記シグナルを使用して前記ケトーシス罹患の判定を行う、[7]または[8]に記載のケトーシス罹患判定方法。
[10] 前記表面応力センサは膜型表面応力センサである、[7]から[9]の何れかに記載のケトーシス罹患判定方法。
[11] 前記表面応力センサの感応膜の材料としてPoly(4-methylstyrene)、Poly(2,6-diphenyl-p-phenylene oxide)、Poly(vinylidene fluoride)、Cellulose Acetate Butyrate、Poly(ethyleneimine)、フェニル基修飾シリカ/チタニア複合ナノ粒子及びPolystyreneからなる群から選択された少なくとも一を使用する、[7]から[10]の何れかに記載のケトーシス罹患判定方法。
[12] 前記表面応力センサとして、前記群から選択された一の材料を感応膜に使用した第1の表面応力センサと、前記群から選択された他の材料を感応膜として使用した第2の表面応力センサとを少なくとも使用する[11]に記載のケトーシス罹患判定方法。
[13] 前記体液から発生したガスとパージガスとを前記表面応力センサに交互に与え、前記体液から発生したガスに対応する前記シグナルと前記パージガスに対応する前記シグナルとを使用して前記ケトーシス罹患の判定を行う、[7]から[12]の何れかに記載のケトーシス罹患判定方法。
[14] 前記体液から発生したガスを前記表面応力センサに供給する時間区間と前記パージガスを前記表面応力センサに与える時間区間とに加えて、所定の標準ガスを前記表面応力センサに与える時間区間を設け、前記ケトーシス罹患の判定にあたって前記標準ガスに対応する前記シグナルを更に使用する、[13]に記載のケトーシス罹患判定方法。
[15] 標準ガスとパージガスとを前記表面応力センサに交互に与え、前記標準ガスに対応する前記シグナルと前記パージガスに対応する前記シグナルとに基づいた標準ガス対応のディジタルデータと、前記体液から発生したガスとパージガスとを前記表面応力センサに交互に与え、前記体液から発生したガスに対応する前記シグナルと前記パージガスに対応する前記シグナルとに基づいた測定対象体液対応のディジタルデータとを準備し、前記ケトーシス罹患の判定は、前記標準ガス対応のディジタルデータと前記測定対象体液対応のディジタルデータとに基づいてケトーシス罹患判定を行う、[13]に記載のケトーシス罹患判定方法。
[16] 前記標準ガスとパージガスとが交互に与えられる前記表面応力センサと前記体液から発生したガスとパージガスとが交互に与えられる前記表面応力センサとは同一の個体である表面応力センサであるか、または互いに別の個体である表面応力センサである、[15]に記載のケトーシス罹患判定方法。
[17] 前記標準ガスは参照体液から発生するガスである、[14]から[16]の何れかに記載のケトーシス罹患判定方法。
[18] 前記体液から発生したガスを追加のガスセンサに供給し、前記表面応力センサからのシグナルと前記追加のガスセンサからのシグナルとに基づいて前記ケトーシス罹患の判定を行う、[7]から[17]の何れかに記載のケトーシス罹患判定方法。
[19] 少なくとも一つの表面応力センサと、動物から採取された検査対象の体液から発生した試料ガスを供給する第1のガス流路と、測定すべきガス成分を含有しないパージガスを供給する第2のガス流路とを設け、前記第1のガス流路から供給される試料ガスと前記第2のガス流路から供給されるパージガスとを交互に切り替えて前記少なくとも一つの表面応力センサに供給して前記少なくとも一つの表面応力センサからシグナルを発生させることにより、前記体液から発生した試料ガスの組成に基づく前記動物のケトーシス罹患の判定を行う、ケトーシス罹患判定装置。
[20] 追加のガスセンサと前記試料ガスを前記追加のガスセンサに供給する追加のガス流路とを設け、前記少なくとも一つの表面応力センサからの前記シグナルと前記追加のガスセンサからのシグナルとに基づいて前記ケトーシス罹患の判定を行う、[19]に記載のケトーシス罹患判定装置。
[21] 少なくとも一つの表面応力センサと、動物から採取された検査対象の体液から発生した試料ガスを供給する第1のガス流路と、測定すべきガス成分を含有しないパージガスを供給する第2のガス流路と、所定の標準ガスを供給する第3のガス流路とを設け、前記第1のガス流路から供給される試料ガスと前記第2のガス流路から供給されるパージガスと前記第3のガス流路から供給される標準ガスとを所定の順序で切り替えて前記少なくとも一つの表面応力センサに供給して前記少なくとも一つの表面応力センサからシグナルを発生させることにより、前記体液から発生した試料ガスの組成に基づく前記動物のケトーシス罹患の判定を行う、ケトーシス罹患判定装置。
[22] 追加のガスセンサと前記試料ガスを前記追加のガスセンサに供給する追加のガス流路とを設け、前記少なくとも一つの表面応力センサからの前記シグナルと前記追加のガスセンサからのシグナルとに基づいて前記ケトーシス罹患の判定を行う、[21]に記載のケトーシス罹患判定装置。
本発明によれば、動物が泌乳した乳汁等の体液を検査対象とし、当該乳汁等から発生したガスの組成に基づいて当該動物のケトーシス罹患の判定を行うことができる。
このため、本発明によれば、多くの場合に検体採取の際に動物に与える負荷及びストレスが小さい手法により、当該動物のケトーシス罹患及び/またはケトーシス罹患の可能性の有無を、現場等で簡便に、高スループットかつ低コストで判定することができる方法を提供することができる。
また、本発明によれば、当該判定を行うための装置を提供することもできる。
このため、本発明によれば、多くの場合に検体採取の際に動物に与える負荷及びストレスが小さい手法により、当該動物のケトーシス罹患及び/またはケトーシス罹患の可能性の有無を、現場等で簡便に、高スループットかつ低コストで判定することができる方法を提供することができる。
また、本発明によれば、当該判定を行うための装置を提供することもできる。
以下、本発明の実施の形態について詳細に説明する。
以下に記載する構成要件の説明は、本発明の代表的な実施形態に基づいてなされることがあるが、本発明はそのような実施形態に制限されるものではない。また、以下では検査対象としてもっぱら乳汁を使用する場合を説明するが、動物から採取された他の体液、例えば血液、あるいは血液中の成分の変化が反映される唾液、尿、汗などの他の体液が検査に好都合な態様で得られる場合には、これらの体液を使用することもできる。なお、血液については、他の検査などの目的で血液を採取する必要がある際に、その血液の一部を流用することで動物に追加の負担を与えないようにすることが可能である。さらには、動物から簡単かつ苦痛が非常に少ない態様で血液を採取できる機器、採取手法が確立された場合には、ケトーシス罹患判定のための検査対象の試料として血液から発生するガスを利用することの有用性がさらに高くなると考えられる。また、尿については、近年、乳牛等を飼養する畜舎からのアンモニアの発生(揮散)を抑制することに対する関心が高まっており、より適切なふん尿処理を行う観点から尿を回収する装置が開発され、回収された尿を化学肥料の代替物として活用する試みもなされている。そのため、その尿の一部を流用することで動物に追加の負担を与えないようにすることが可能である。
以下に記載する構成要件の説明は、本発明の代表的な実施形態に基づいてなされることがあるが、本発明はそのような実施形態に制限されるものではない。また、以下では検査対象としてもっぱら乳汁を使用する場合を説明するが、動物から採取された他の体液、例えば血液、あるいは血液中の成分の変化が反映される唾液、尿、汗などの他の体液が検査に好都合な態様で得られる場合には、これらの体液を使用することもできる。なお、血液については、他の検査などの目的で血液を採取する必要がある際に、その血液の一部を流用することで動物に追加の負担を与えないようにすることが可能である。さらには、動物から簡単かつ苦痛が非常に少ない態様で血液を採取できる機器、採取手法が確立された場合には、ケトーシス罹患判定のための検査対象の試料として血液から発生するガスを利用することの有用性がさらに高くなると考えられる。また、尿については、近年、乳牛等を飼養する畜舎からのアンモニアの発生(揮散)を抑制することに対する関心が高まっており、より適切なふん尿処理を行う観点から尿を回収する装置が開発され、回収された尿を化学肥料の代替物として活用する試みもなされている。そのため、その尿の一部を流用することで動物に追加の負担を与えないようにすることが可能である。
本発明の一実施形態に係るケトーシス罹患判定方法(以下、「本実施形態の方法」ともいう。)は、動物が泌乳した検査対象の乳汁から発生したガスをガス検出手段に与え、前記乳汁から発生したガスに対する前記ガス検出手段の応答を使用して、前記乳汁から発生したガスの組成に基づく前記動物のケトーシス罹患の判定を行う。
本実施形態の方法は、乳汁を分泌する動物に対して適用される。当該動物としては、例えば、乳牛(乳用牛)、肉牛(肉用牛)、山羊、羊、スイギュウ(水牛)、ヤク、馬などの家畜(産業動物)が挙げられるが、これらに限定されない。より好ましくは、本実施形態の方法は、乳汁を生産させるために飼養される動物の、ケトーシス罹患の診断のため、あるいは、診断補助として使用される。また、本実施形態の方法は、ヒトにおいて、ケトーシスと関連性のある疾患の診断補助として適用することもできる。
本明細書において、「乳汁から発生したガス」とは、ある環境下で乳汁から揮発・蒸発した気体成分、すなわち、乳汁の揮発成分・蒸発成分を指す。当該揮発成分・蒸発成分は、ヒトの嗅覚によって感知される香気成分、及び、ヒトの嗅覚によって感知されない非香気成分の両方を包含する。なお、ヒトの嗅覚は個人差が極めて大きく、感知可能な成分もヒト毎に大きく異なるので、本実施形態の方法で検査対象とする乳汁から発生したガスを香気の有無によって分類することは意図されず、また、そのいずれかに限定することも意図されない点に留意されたい。また、検査対象として乳汁以外の体液を使用する場合、当該体液から発生したガスは、上記定義における「乳汁」を当該体液に置き換えたものを意図するものとする。
具体的には、乳汁から発生したガスとしては、例えば、アセトンなどのケトン類;メタノール、エタノール、プロパノール、ブタノールなどのアルコール類;ホルムアルデヒドやアセトアルデヒドなどのアルデヒド類;アセトニトリルなどのニトリル類;ギ酸、酢酸、プロピオン酸、酪酸などの有機酸;及び、水(水蒸気)、窒素、酸素、二酸化炭素などが挙げられる。また、本発明者らの予備実験によれば、健康牛及びケトーシス罹患牛の乳汁のプロトン移動反応飛行時間型質量分析(PTR-TOF-MS)の結果から、乳汁から発生したガスには、上記物質の他に、2-Butanone(2-ブタノン)、Butanal(ブタナール)、2-Methoxy-1-Propene(2-メトキシ-1-プロペン)、2-Methyl-Propanal(2-メチル-プロパナール)なども含まれる可能性がある。
乳汁に含まれるケトン体としてはアセト酢酸、β-ヒドロキシ酪酸、アセトンなどが含まれるが、アセトンは揮発性が非常に高いため、従来の液体を検体とする検査では測定対象とはされておらず、β-ヒドロキシ酪酸及び/またはアセト酢酸が用いられている。これに対して、本実施形態の方法では、乳汁から発生したガスを検体とするため、測定対象のケトン体としてはβ-ヒドロキシ酪酸、アセト酢酸に限定されず、アセトンも含めることができる。また、β-ヒドロキシ酪酸やアセト酢酸はアセトンの前駆体であり、試料中のβ-ヒドロキシ酪酸、アセト酢酸、アセトンの濃度には相関関係があることから、ケトーシスに罹患した動物では、いずれの濃度も上昇する。そのため、本実施形態の方法では、乳汁から発生したガス中のアセトン濃度を指標として用い、ケトーシス罹患の判定を行うことが可能である。
本実施形態の方法において、ガス検出手段としては特に限定されず、ガスセンサ、ガスクロマトグラフ、ガス分析用試験紙等、乳汁から発生したガスを検知可能なものであればよい。本実施形態の方法の一態様において、上記ガス検出手段はガスセンサであり、上記ガス検出手段の応答は、当該ガスセンサから出力されるシグナルである。当該態様において、ケトーシス罹患の判定は、当該シグナルの時間変化のパターンに基づいて行われる。また、当該態様において、好ましくは、上記ガスセンサは表面応力センサであり、より好ましくは、当該表面応力センサは膜型表面応力センサ(MSS)である。なお、以下では、本発明の理解を容易にするために、上記ガス検出手段がガスセンサである態様のうち、当該ガスセンサが表面応力センサである態様を例に挙げて説明する。
表面応力センサは、適切な感応膜材料を選択することで、一つの感応膜から複数の対象物質に対する応答信号(シグナルとも呼ぶ)を、それらが重畳した形で得ることができる。つまり、多くの対象物質について、感応膜材料を適切に選択することで、それぞれの対象物質に対する表面応力センサの応答においてその振幅や応答波形が互いに異なるようにすることができる。従って、複数の表面応力センサ出力を組み合わせることにより、複数の対象物質に対応するパラメータを適宜組み合わせた測定値を求めることが可能となる。この際、表面応力センサの出力のパターンマッチングや機械学習を行うことで、これらの出力から適切に特徴を抽出して、比較的少数の表面応力センサを使用するだけで表面応力センサの個数よりも多数のパラメータに基づくケトーシス罹患判定を実現できる。もちろん、これに限るものではないが、測定対象から発生するガス中に存在している成分であってケトーシス罹患判定に有用である特定の成分の検出に特に好都合な他の種類のガスセンサが使用可能である等の場合には、必要に応じて表面応力センサに加えてそのようなガスセンサを併用することもできる。
図1は、本実施形態の方法において使用可能な測定システムの概略構成を示す図である。なお、図1では、表面応力センサとして膜型表面応力センサ(MSS)を使用する構成を示すが、もちろんこれにより一般性を失うものではない。
図1に示される概略構成では、2本のガス流路へ、それぞれ図の左側から白抜き矢印で示すように、測定すべきガス成分ではなく、また当該ガス成分の測定に影響をできるだけ与えない不活性のガス(パージガス、基準ガスとも呼ばれる)を供給する。パージガスとしては、例えば、窒素ガスや大気を使用することができ、後述する実施例では、パージガスとして窒素ガスを使用している。なお、パージガスとして大気などを使用して簡便な測定を行う場合、測定現場(農場等)の大気に、飼料から発生した有機酸やアンモニアなどのケトーシス罹患判定に影響を与え得るガスがわずかに混入している可能性がある。このような場合、このようなガスの混入濃度が罹患判定結果に与える影響が意図した測定精度の実現に悪影響を与えない程度のものであれば(このような場合を、「ケトーシス罹患判定に影響を与える成分を実質的に含まない」と称する)、そのようなガスの混入は無視することができる。このような2系統のガス流はガス流路ごとに設けられているマスフローコントローラ(MFC)によりその流量を制御される。具体的には2本のガス流路中のガス流を所望の時間間隔で交互に切り替えるとともに、ガス流量を時間軸上で一定になるように制御している。なお当然のことであるが、ガス流の制御は、MFCに限らず、様々なポンプやバルブなどを組み合わせた系などを使用しても良い。この際、ポンプやバルブを設置する位置は、それぞれサンプルの上流であっても下流であっても良く、サンプルやセンサの位置を含め、どのような順序で構成されていても良いことは言うまでも無い。
図1において、上側に示すガス流路は測定すべきガス成分を含有しないパージガスをMSSに与えることで、MSSの表面に塗布されている感応膜中に拡散している各種のガスを脱着させてMSSを初期化するパージ処理を行う。一方、図1の下側にあるガス流路を通るガス流はMFCの直後に設置されたバイアル瓶中の試料から揮発・蒸発したガス成分を含んだ状態でMSSに供給される。もちろん、試料が最初からガス状である場合や液体状態の試料から揮発・蒸発したガスが測定系に対して与えられる場合には、バイアル瓶を使用しない構成を採用することができる。2本のガス流路からのガス流は別のバイアル瓶において合流した後、MSSに供給される。
また、MSS表面の感応膜によるガスの吸着・脱着の速度は温度の影響を受けるため、図1に示した測定系の温度を所望の値に維持するのが好ましい。そのための手段としては、例えば、測定システム全体を恒温槽、インキュベータ等に収容してもよいし、あるいは、MSS及びその周辺部品(以下、これらを「センサモジュール」もしくは単に「モジュール」とも称する。)はインキュベータ等に収容し、試料を収容したバイアル瓶は当該インキュベータ等の外側に設置した状態で、測定系の温度を所望の値に維持する構成としてもよい。後者の構成では、複数の試料を測定する場合に、センサモジュールを収容したインキュベータ等の外側でバイアル瓶の交換作業等を行うことができるため、前者の構成に比べて測定系(特に、センサモジュール)の温度の維持管理が比較的容易であるというメリットがある。言い換えると、前者の構成は、単独の試料を測定する場合により適しており、後者の構成(以下、「開放系」とも称する。)は、複数の試料を測定する場合により適している。なお、以下で説明する実施例では、測定システム全体をインキュベータ内に収容して測定を行った例と、開放系とした例がある。
また、図1において試料を収容したバイアル瓶の温度を所望の値に維持することも好ましい。これにより、試料から揮発・蒸発するガス成分濃度のバラツキを低減することができ、測定精度をより向上させることができる。この場合において、バイアル瓶の温度は、上述した測定系の温度と同じであってもよく、異なっていてもよい。具体的には、バイアル瓶の温度の設定値としては、例えば、5℃、10℃、20℃、25℃、30℃、40℃、50℃が挙げられるが、これらに限定されない。
また、MFCなどのシステム内の各種の機器の動作を制御し、また表面応力センサからのシグナルを取り込んで記録し解析する等の各種の処理を行うことによって以下で説明する評価方法を実現する情報処理装置、更に外部の機器等との間で情報や指令等の交換を行うためのインターフェースや通信機器も本システムに含まれるが、図示は省略した。
MSSの光学顕微鏡写真の例を図2に示す。図2に示されるMSSはシリコン単結晶から切り出される、半導体素子技術分野で使用されるシリコンウエハから形成されたものであり、その中央の円形部分(正方形等の他の形状でもよい)がその周囲の枠状部に当該円形部分の上下左右4か所で接続され固定されている。MSSに与えられたガス成分が円形部分の表面に塗布された感応膜に吸着・脱着することでMSSに印加された表面応力がこれら4か所の固定領域に集中し、これら固定領域に設けられているピエゾ抵抗素子の電気抵抗変化がもたらされる。これらのピエゾ抵抗素子は枠状部に設けられた導電領域(図2では砂目状の領域として示される)によって相互接続されてホイートストンブリッジが形成される。このホイートストンブリッジの対向する2つの節点間に電圧を印加し、残りの2つの節点間に現れる電圧をMSSから出力されるシグナルとしてMSSの外部に取り出して所要の解析を行う。このようなMSSの構造や動作については例えば特許文献1に詳述されている。なお図2では、感応膜は、MSSの円形部分だけで無く、枠状部も含めMSSチップ表面に広く塗布されている。これは感応膜をスプレーコーティングによって塗布した場合に見られる状態であるが、枠状部などに塗布された感応膜は実質的にセンサ出力信号に寄与しないため、このように塗布した場合でも問題なくセンサとして使用することが可能である。もちろん、インクジェットやディスペンサーなどによって、円形部分だけに感応膜が塗布されたMSSを使用する事も可能である。
図3に、MSSなどの表面応力センサに試料ガスを与えたときのシグナル強度の時間変化の概念図を示す。図3(a)にはMSSに与えるガスが試料ガスであるのかそれともパージガスであるのかを時間軸上で示す。具体的には、MSSに与えられるガス中の測定対象ガスの濃度が試料ガスを与えている試料ガスインジェクション期間中は0よりも大きな濃度Cgであり、パージガスを与えることで下流側のガス流路中の試料ガスを流し去るとともにMSSの感応膜(及び、ガス流路の管壁等)に吸着されている試料ガス成分を脱着するパージ動作を行うパージ期間中は試料ガス濃度が0となっている。図3(b)は図3(a)に示すガスの種類の切り替えを行った際のMSSからのシグナルの強度を、図3(a)と時間軸を揃えて示す。シグナル強度は多くの要因に支配されるが、基本的にはMSS上の感応膜近傍のガス中の成分濃度と感応膜表面の同じ成分の濃度との差により引き起こされるガスと感応膜との間の当該成分の吸着・脱着の速度が主要な要因となる。そのため、シグナル強度は図3(a)に示されるガスの切り替え直後から始まり、上下の飽和値へ向かって指数関数的に漸近する曲線に近いものとなる。図3(b)は理想的な場合の当該曲線を示す。実際の当該曲線の形状や曲線の最大値等は、感応膜への吸着・脱着速度や感応膜に吸着・脱着される成分の種類によりかなり変化し、またシグナルの変化範囲も大きく相違することが多い。さらに、感応膜の粘弾性特性や、測定対象ガスの感応膜への拡散、あるいは感応膜材料と測定対象ガスとの物理化学的な相互作用などによって、シグナルはより複雑な経時変化を示す事もある。このように、MSSからのシグナルの経時変化や振幅等に基づいて試料中の各主成分の量・濃度や複数成分間の比率等を求めることが可能となる。具体的に言えば、乳汁から発生したガスのうち、ケトン類の測定に適したシグナルを与える感応膜材料が存在し、またアルコール類の測定に適したシグナルを与える感応膜材料も存在する。従って、これらの材料から適宜選択されたものを塗布した表面応力センサを単独で使用して乳汁から発生したガスを測定し、あるいは異なる材料をそれぞれ塗布した複数種類の表面応力センサを使用して同様の測定を行うことによって、乳汁から発生したガスの組成に基づいた判定を行うことができる。
ここで感応膜を形成する材料の吸着・脱着特性は多様であって、上述の単純化したモデルから逸脱した応答を示す感応膜材料も存在する。しかしながら、表面応力センサの応答を解析等する場合、上記モデルを用いて最初の検討を行うのは多くの場合に有益であるということができる。
なお、図3ではMSSに試料ガスを1回だけ与えるように図示されているが、MSSなどの表面応力センサを使用した測定においては、試料ガスとパージガスとを交互に切り替えて供給することにより、図3に示したような測定を複数回繰り返すのが通常である。以下では、試料ガスインジェクションと当該インジェクションに関連付けられているパージとの組を測定サイクルと呼ぶ(詳細は後述)。また、試料ガス中のある成分の吸着速度と脱着速度とが大きく異なるなどの事情がない限り、試料ガスインジェクション期間とパージ期間とは同じ時間長とする場合が多いが、もちろん、試料ガスインジェクション期間とパージ期間とを異なる時間長としてもよい。
通常、検査対象の乳汁から発生するガスは、乳汁中の微量成分であるため、ガス成分のセンサへの吸着及び脱離に伴って生じるそれぞれのセンサシグナルのうち、有効なシグナル値が得られるまでに比較的長い時間がかかる事がある。また、脱離しにくい成分がセンサに残存している場合、次に測定する試料ガスのシグナル値の再現性が下がってしまうこともある。そのため、本態様では、1回の測定サイクルにおける試料ガスインジェクション期間とパージ期間とを異なる長さとすることも有効となる場合があり、試料ガスインジェクション期間として有効なシグナル値を得るのに十分な時間を確保した上で、パージ期間を試料ガスインジェクション期間よりも長くすることが好ましい。具体的には、後述する実施例では、試料ガスインジェクション期間を120秒とし、パージ期間をその2倍の240秒としている。また、1回の測定サイクルを、「パージ期間-試料ガスインジェクション期間-パージ期間」の測定シーケンスとすることで、複数回の測定を行う場合に、2回目以降の試料ガスインジェクションの前に実質的に2度パージを行うようにすることも有効である。後述する実施例においても、この測定シーケンスを採用することで、2回目以降の試料ガスインジェクションの前に、直近の試料ガスインジェクションの終了から480秒(240秒+240秒)のパージ期間を確保している。このように、試料ガスインジェクション期間に対してパージ期間を長くすることによって、試料ガスインジェクション中にMSS上の感応膜に吸着された成分の脱着が十分に行われやすくなり、ベースラインをより安定させることができるため、測定を複数回繰り返す場合において判定精度を確保するのに特に有効である。
言い換えると、試料ガスインジェクション期間に対してパージ期間が短い場合には、判定精度に悪影響が出る可能性がある。現実の測定では測定時間が長くなることは、それ自体測定のスループットを低下させるなどの不都合があるだけではなく、測定系内外の環境の各種のパラメータ(流速、ガス圧力、温度等)を長時間安定させることがしばしば困難であったり、測定系の大型化、高価格化を招いたりといった問題がある。さらに、測定系は通常はポンプ等の能動部品を含むことから、これらの部品からの発熱による長時間にわたる温度変化も、判定精度に悪影響を与える恐れがある。従って、本態様においては、測定サイクルの時間の配分を、試料ガスインジェクション期間(サンプリング時間)には有効なシグナル値を得ることが可能な範囲内で極力短く配分し、パージ期間(パージ時間)をできるだけ長くすることが望ましい。あるいは、ベースライン変動が問題となる場合の対策として、判定精度に影響を与え得る成分の量があらかじめ規定された値である参照乳(詳細は後述する)を準備しておき、測定毎に参照乳から発生するガスを測定してキャリブレーションを行う等により、短時間のパージによる悪影響を除去あるいは軽減することもできる。
なお、上述したように、図1に示される概略構成を有する測定システムでは、通常、2本のガス流路中のガス流は、所望の時間間隔で交互に切り替えられ、ガス流量が時間軸上で一定になるようにMFC(もしくはポンプ等)で制御されるが、測定システムの構成やガス検出手段(図1ではMSS)の仕様等によっては、パージ期間のガス流量を試料ガスインジェクション期間のガス流量よりも多くすることで、ベースラインをより安定させることが可能な場合もある。
本態様では、MSSなどの表面応力センサに試料ガスを与えることで得られる、図3に示すようなシグナル強度の時間変化の測定結果(以下、単に「測定結果」ともいう。)を使用して、乳汁から発生したガスの組成に基づく動物のケトーシス罹患の判定を行う。
具体的には、測定結果をそのまま使用してもよいし、あるいは、測定結果に対して任意のデータ分析処理を施してもよい。例えば、測定サイクルの時間範囲から任意に選択した時点を基準点とし、この時点を基準にオフセット処理を行う。その後、上記時間範囲から別の任意の時点を判定点として、判定点または判定点の近傍の値から特徴量を求めることによって、ケトーシス罹患及び/またはケトーシス罹患の可能性の有無を判定することができる。この特徴量としては、例えば判定点におけるオフセット処理後のシグナル強度、判定点におけるシグナルのグラフの傾き、判定点近傍におけるシグナルのグラフの平均傾斜や曲率等でよい。なお、シグナルのオフセット処理を行っていない生シグナルは、センサの長期的な経時変化や、センサシグナルの絶対値としての現在の状態など、独特の情報が含まれているため、オフセット処理を行わず、生シグナルの値をそのまま利用したり、あるいは生シグナルから任意の特徴量を抽出したりして解析を行っても良い。
なお、ここでオフセット処理とは、基準点t0におけるシグナル強度S(t0)が0(一般的には任意の定数)になるように、シグナル強度のグラフをその強度軸方向に平行移動することで、オフセット処理後のシグナル強度S’(t)=S(t)-S(t0)を求める処理である。
基準点としては、例えば、試料ガスインジェクション期間の開始直前(つまりパージ期間の終了)の時点、パージ期間の開始直前(つまり試料ガスインジェクション期間の終了)の時点が挙げられるが、これら以外の任意の時点であってもよい。ただし、パージとインジェクションとの切り替えを行う時点で表面応力センサに与えるガスを切り替えるため、この境界点の近傍では表面応力センサからのシグナルが乱れることがある。また、切り替えを行っても、バルブ等の切り替え機構からある程度の長さのガス流路を経た位置にある表面応力センサの周囲のガスが実際に切り替わるまでには無視できない時間遅れが生じる場合がある。このシグナルの乱れなどの不安定性や時間遅れの影響が問題となり得るのであれば、基準点としてはこの切り替えの時点から時間的にわずかにずらした時点を採用してもよい。
また、測定サイクルの時間範囲から任意に選択した時点を基準点とし、当該選択した時点を基準にオフセット処理を行う。その後、上記時間範囲内の別の任意の時点を判定点として、判定点または判定点の近傍の値から特徴量を求めることによって、ケトーシス罹患及び/またはケトーシス罹患の可能性の有無を判定することができる。この特徴量としては、例えば判定点におけるオフセット処理後のシグナル強度、判定点におけるシグナルのグラフの傾き、判定点近傍におけるシグナルのグラフの平均傾斜や曲率等でよい。なお、シグナルのオフセット量が十分小さい、あるいはオフセット前のシグナル強度から求められた特徴量が十分大きい場合には、オフセット処理を省略してもよい。ただし、このような条件を満たす判定点は、測定サイクルの時間長や、試料ガスインジェクション期間及びパージ期間の時間長だけでなく、測定システムの構成(ガス流路、測定系へのガス供給形態、ガス流量等)や測定条件、さらには、ガス検出手段が表面応力センサ(より具体的にはMSS)である場合には感応膜材料の種類などによっても異なり得るため、予め参照乳などを用いて感応膜材料毎にケトーシス罹患の判定に有効な特徴量が抽出できる基準点と判定点の組み合わせを確認しておくことが望ましい。
なお、上述したように、本態様では、測定サイクルの時間の配分や、測定シーケンスの構成を適切に設定することによってベースラインの変動を抑制し、ベースラインを安定させることができるため、抽出される特徴量の差異が微小な場合であっても判定精度を確保することができる。具体的には、パージ期間を長くすることによって感応膜から十分にガスが脱離するため、試料ガスインジェクション前の状態を毎回同じような状態に戻すことが可能となる。すなわち、パージ期間を長くすることは、測定系のリセットを十分に行うために有用である。この十分にリセットが行われた時点が試料ガスインジェクション直前の時点であり、ここをオフセットの基準点とすることでシグナル再現性が確保され、結果的に高精度の判定が容易になる。また、特に、試料ガスインジェクション開始直前のパージ時シグナルを基準としてオフセット処理を行うとともに、インジェクション期間の終了からわずかに時間が経過した時点に判定点を設定することで、当該判定点におけるシグナル強度の変動がより明りょうになりやすく、ケトーシス罹患の判定に有効な特徴量が得られやすい。実施例に示す実験では、インジェクション期間終了から数秒~数十秒経過の時点のシグナル強度あるいは当該時点近傍でのシグナル強度の変化を観測することで、目視による判定が最も容易になった。
なお、上の説明では試料ガスとパージガスとを切り替える測定シーケンスに基づく測定を行ったが、本発明はそれに限られるものではない。例えば、試料ガスに含有されてその濃度がケトーシス罹患の判定に影響を与える可能性のある成分を含む別のガス(標準ガス)についての測定を測定シーケンスに挿入して、3種類のガスの切り替え測定からのシグナルに基づいてケトーシス罹患の判定を行うことができる。
このような標準ガスとしては、ケトーシス罹患の疑いの無い健常な動物から得られた乳汁を参照乳とし、当該参照乳から発生する試料ガス成分と同じ成分組成を有するガスを標準ガスとしてよい。このような参照乳としては、例えば、検査対象の動物と同じ飼育環境に属する動物(以下、「同一群の動物」ともいう。)から得られた乳汁であってよく、この場合、当該乳汁は、個体乳(単一の個体から得られた乳汁。同一群の動物のうち健常であることが判っている動物から得られた乳汁が好ましい。)であってもよく、合乳(搾乳タンク等で複数の個体乳が混合された乳汁。バルク乳とも呼ばれる。)であってもよい。
あるいは、そのように想定される試料ガスの一部の成分(例えば、成分量のわずかな違いを特に高精度で測定したい成分等)についての組成を同じにしたガスを標準ガスとするなど、必要に応じて各種の組成に設定することができる。そして、測定上の各種の要請や制約条件なども勘案してこれら3種類のガスの供給シーケンスを適宜設定する。例えば、以下のようなガス供給時間区間の繰り返しを含む測定シーケンスが考えられる:
A.パージガスを供給する→[試料ガスと標準ガスの一方を供給する→パージガスを供給する→試料ガスと標準ガスの他方を供給する→パージガスを供給する](あるいは[]内を繰り返す)
B.パージガスを供給する→[試料ガスと標準ガスを交互に供給する→パージガスを供給する](あるいは[]内を繰り返す)
C.パージガスを供給する→[試料ガスと標準ガスの一方とパージガスとの交互供給を繰り返す→パージガスを供給する→試料ガスと標準ガスの他方とパージガスとの交互供給を繰り返す](あるいは[]内を繰り返す)
これ以外にもガス供給時間区間の各種のガス供給シーケンスが考えられる。何れのガス供給シーケンスでも、一連の測定シーケンス中は温度、ガス圧力・流量、センサ特性の経時変化などの測定条件はシーケンス内で大きく変化しないと考えられるので、試料ガスと標準ガスとの比較により、両ガス間の微量な組成の違いを精密に測定でき、また測定結果への外乱の影響が低減できるなど、測定の安定性の向上を図ることもできる。
A.パージガスを供給する→[試料ガスと標準ガスの一方を供給する→パージガスを供給する→試料ガスと標準ガスの他方を供給する→パージガスを供給する](あるいは[]内を繰り返す)
B.パージガスを供給する→[試料ガスと標準ガスを交互に供給する→パージガスを供給する](あるいは[]内を繰り返す)
C.パージガスを供給する→[試料ガスと標準ガスの一方とパージガスとの交互供給を繰り返す→パージガスを供給する→試料ガスと標準ガスの他方とパージガスとの交互供給を繰り返す](あるいは[]内を繰り返す)
これ以外にもガス供給時間区間の各種のガス供給シーケンスが考えられる。何れのガス供給シーケンスでも、一連の測定シーケンス中は温度、ガス圧力・流量、センサ特性の経時変化などの測定条件はシーケンス内で大きく変化しないと考えられるので、試料ガスと標準ガスとの比較により、両ガス間の微量な組成の違いを精密に測定でき、また測定結果への外乱の影響が低減できるなど、測定の安定性の向上を図ることもできる。
なお、標準ガスまで使用する場合には測定装置のガス供給系に標準ガス用のガス流路を追加することになるが、これはガス供給系についての各種の既存技術を利用して容易に実現できる。たとえば、標準ガスは最初から気体の状態で準備しておくこともできるし、あるいは液体や固体から蒸発させることでガス供給系に導入してもよい。また、標準ガスを提供する際に、当初準備しておいた気体や液体・固体から発生する気体にパージガスなどの別の気体を混合させてもよい。また、これら3系統のガス流路は最終的には合流させる必要があるが、3つの流路を一か所で合流させてもよいし、あるいは試料ガス流路の上流側を一部分流させて標準ガス流路を構成し、そこに標準ガスが導入された後、両ガス流路をパージガスとの合流点の手前で合流させるなどの構成も考えられる。
さらには、求められる判定精度が実現できる限りにおいて測定の再現性が高くかつセンサチップや測定装置間のバラツキなども較正可能である場合には、試料ガスの測定と標準ガスの測定とを互いに独立させ、別々の好都合な時点で行う測定手順やそのための測定系の構築も可能である。例えば標準ガスの測定と試料ガスの測定とを同時にあるいは一連の測定シーケンス中で相次いで行うのではなく、それぞれ別個に行い、これらの測定から得られた標準ガス測定データと試料ガス測定データとを比較してもよい。ここで、頭書の条件、すなわち求められる判定精度が実現できる限りにおいて測定の再現性が高くかつセンサチップや測定装置間のバラツキなども較正可能であるという条件、が満足される限り、試料ガスの測定に使用されるセンサチップや測定装置と標準ガスの測定に使用されるセンサチップや測定装置とは互いに同一の個体であってもよいし、一方の測定に使用されるものとは別のセンサチップや測定装置を使用してもよい。また、パージガスを利用すること無く、試料ガスと標準ガスのみを使用して測定しても良い。この場合は、標準ガスをパージガスとして利用して測定を行っても良い。さらには、試料ガスのみ、あるいは標準ガスのみを使用した測定も可能である。この場合、試料ガス、あるいは標準ガスを、十分に長い時間センサに曝露することにより、それぞれのガスが感応膜に十分に吸着・拡散し、センサが一定のシグナル値を示すまで待っても良い。このシグナルの絶対値をそのまま特徴量として利用しても良いし、測定前に大気などに十分に長い時間曝した場合のシグナルを測定しておき、それを基準点として利用しても良い。
これに限定されるものではないが、例えば、同じ動物からの過去の乳汁と今回の搾乳結果の乳汁とを比較する場合、過去の乳汁自体あるいはそこからの揮発成分・蒸発成分を変質しないように保存しておくのは現実的ではない。そこで、過去の健常であることがすでに判っている時点での乳汁から得られたガスを測定してこれを標準ガスのデータとして蓄積しておけば、同一の動物からの今回の乳汁から得られたガスを試料ガスとして同様にデータ化することで、測定の再現性や各種のバラツキの較正可能性が担保できさえすれば、それぞれの測定の対象の乳汁がいずれも新鮮な状態での上記ガスの比較が実現できる。なお、ここで各ガスの測定結果のデータ化は特に限定しない。非限定的な例を挙げれば、各ガスとパージガスとの交互切り替えを行った時のセンサからの出力をそのままディジタル化するだけでもよいし、その他の形式の測定の際のセンサ出力のディジタル化をおこなってもよいし、その他例えば上述のようなディジタル化の結果のディジタル値を更にデータ処理するなどしてよい。
表面応力センサの感応膜の材料としては、Poly(4-methylstyrene)(ポリ(4-メチルスチレン))、Poly(2,6-diphenyl-p-phenylene oxide)(ポリ(2,6-ジフェニル-p-フェニレンオキシド))、Poly(vinylidene fluoride)(ポリ(フッ化ビニリデン))、Cellulose Acetate Butyrate(酢酸酪酸セルロース)、Poly(ethyleneimine)(ポリ(エチレンイミン))、フェニル基修飾シリカ/チタニア複合ナノ粒子(以下、「Phenyl-STNPs」とも称する。)及びPolystyrene(ポリスチレン)が挙げられるが、これらに限定されない。これらの感応膜材料は、一種を単独で用いてもよく、複数種を組み合わせて用いてもよい。
例えば、検査対象の試料として乳汁から発生したガスを使用する態様では、上記感応膜材料のうち、Poly(4-methylstyrene)、Poly(2,6-diphenyl-p-phenylene oxide)、Poly(vinylidene fluoride)、Cellulose Acetate Butyrate及びPoly(ethyleneimine)からなる群から選択された少なくとも一を使用することができる。中でも、Poly(4-methylstyrene)、Poly(2,6-diphenyl-p-phenylene oxide)、Cellulose Acetate Butyrate及びPoly(ethyleneimine)からなる群から選択された少なくとも一を使用することが好ましい。
また、検査対象の試料として尿から発生したガスを使用する態様では、上記感応膜材料のうち、Poly(4-methylstyrene)、Poly(2,6-diphenyl-p-phenylene oxide)、Poly(vinylidene fluoride)、Phenyl-STNPs及びPolystyreneからなる群から選択された少なくとも一を使用することができる。中でも、Poly(4-methylstyrene)、Poly(2,6-diphenyl-p-phenylene oxide)及びPoly(vinylidene fluoride)からなる群から選択された少なくとも一を使用することが好ましく、Poly(4-methylstyrene)及びPoly(2,6-diphenyl-p-phenylene oxide)からなる群から選択された少なくとも一を使用することがより好ましい。
言い換えると、上記感応膜材料のうち、Poly(4-methylstyrene)、Poly(2,6-diphenyl-p-phenylene oxide)及びPoly(vinylidene fluoride)は、乳汁及び尿を含む複数種類の検査対象に対して好適に使用され得る感応膜材料であり、その意味において、より汎用性に優れた感応膜材料であると言える。
上で例示した感応膜材料を用いた具体的な測定例については後述する。
また、検査対象の試料として尿から発生したガスを使用する態様では、上記感応膜材料のうち、Poly(4-methylstyrene)、Poly(2,6-diphenyl-p-phenylene oxide)、Poly(vinylidene fluoride)、Phenyl-STNPs及びPolystyreneからなる群から選択された少なくとも一を使用することができる。中でも、Poly(4-methylstyrene)、Poly(2,6-diphenyl-p-phenylene oxide)及びPoly(vinylidene fluoride)からなる群から選択された少なくとも一を使用することが好ましく、Poly(4-methylstyrene)及びPoly(2,6-diphenyl-p-phenylene oxide)からなる群から選択された少なくとも一を使用することがより好ましい。
言い換えると、上記感応膜材料のうち、Poly(4-methylstyrene)、Poly(2,6-diphenyl-p-phenylene oxide)及びPoly(vinylidene fluoride)は、乳汁及び尿を含む複数種類の検査対象に対して好適に使用され得る感応膜材料であり、その意味において、より汎用性に優れた感応膜材料であると言える。
上で例示した感応膜材料を用いた具体的な測定例については後述する。
なお、Poly(2,6-diphenyl-p-phenylene oxide)(ポリ(2,6-ジフェニル-p-フェニレンオキシド))は、「テナックス」あるいは「Tenax」(登録商標)という名称でも知られる材料であり、その純度や添加物により数種類のものが市販されている。例えば、Tenaxの後ろにサフィックスを付加してTenax TAやTenax GR(Tenax GRはTenax重合時に23%のグラファイトカーボンを配合したもの)などが挙げられ、本実施形態の方法では、これらのいずれも用いることができる。また、Tenaxは各種の粒度分布のものが提供されており、粒度の範囲は、例えばTenax TA 20/35というようにメッシュで表記される。なお、後述する実施例では、Poly(2,6-diphenyl-p-phenylene oxide)としてTenax TA 60/80(ジーエルサイエンス株式会社より入手)を使用した。
以下、実施例により本発明をより詳細に説明する。なお、以下の実施例は本発明を限定するものではなく、その理解を助けるためのものであることに留意されたい。
本実施例では、図1に概略の構成を示した測定システムを使用した。
使用したMSSは、それぞれ異なる感応膜材料を塗布した複数個のMSSからなる集合体であった。以下では、それらの感応膜材料のうち、Poly(4-methylstyrene)を使用したMSSを「ChA」、Poly(2,6-diphenyl-p-phenylene oxide)を使用したMSSを「ChB」、Poly(vinylidene fluoride)を使用したMSSを「ChC」、Cellulose Acetate Butyrateを使用したMSSを「ChD」、Poly(ethyleneimine)を使用したMSSを「ChE」、フェニル基修飾シリカ/チタニア複合ナノ粒子(Phenyl-STNPs)を使用したMSSを「ChF」、Polystyreneを使用したMSSを「ChG」として説明する。
使用したMSSは、それぞれ異なる感応膜材料を塗布した複数個のMSSからなる集合体であった。以下では、それらの感応膜材料のうち、Poly(4-methylstyrene)を使用したMSSを「ChA」、Poly(2,6-diphenyl-p-phenylene oxide)を使用したMSSを「ChB」、Poly(vinylidene fluoride)を使用したMSSを「ChC」、Cellulose Acetate Butyrateを使用したMSSを「ChD」、Poly(ethyleneimine)を使用したMSSを「ChE」、フェニル基修飾シリカ/チタニア複合ナノ粒子(Phenyl-STNPs)を使用したMSSを「ChF」、Polystyreneを使用したMSSを「ChG」として説明する。
<試験1:飼育環境の異なる健康牛の乳汁から発生したガスの測定>
国立研究開発法人農業・食品産業技術総合研究機構 北海道農業研究センターにおいて、放牧により生牧草を給与して飼養された乳牛(放牧牛)の乳汁10mL(試料1)、及び、舎飼いによりサイレージを給与して飼養された乳牛(舎飼牛)の乳汁10mL(試料2)を、それぞれバイアル瓶に収容して測定を行った。
なお、試料1及び試料2の乳汁は、ヒトの嗅覚で判別が可能であるほど香りが異なっており、ヒトの味覚による風味も大きく異なっていた。
国立研究開発法人農業・食品産業技術総合研究機構 北海道農業研究センターにおいて、放牧により生牧草を給与して飼養された乳牛(放牧牛)の乳汁10mL(試料1)、及び、舎飼いによりサイレージを給与して飼養された乳牛(舎飼牛)の乳汁10mL(試料2)を、それぞれバイアル瓶に収容して測定を行った。
なお、試料1及び試料2の乳汁は、ヒトの嗅覚で判別が可能であるほど香りが異なっており、ヒトの味覚による風味も大きく異なっていた。
測定システムを収容したインキュベータの温度は30℃に設定した。試料ガス及びパージガスの流量は10sccmとし、サンプリング時間(各測定サイクルにおいて試料ガスインジェクションを行う時間)は120秒とした。また、サンプリング時間とパージ時間(各測定サイクルにおいてパージガスをMSSに与えてそのパージを行う時間)との比を1:4として測定を行った。具体的には、各測定サイクルでの測定シーケンスは、先ずパージガスを240秒間流し、次に試料ガスを120秒間流し、その後、再度パージガスを240秒間流す、という構成とした。つまり、各測定を連続的に実施したため、試料ガスを流した後に流すパージガスと、次の試料ガスを流す前に流すパージガスとは、途切れることなく連続的に流れることになった。従って、パージ時間は上記2つのパージ時間の合計となり、サンプリング時間とパージ時間との比は実質的に1:4となるのである。なお、これらの測定条件は、測定システムの構成に応じて適宜調整することができる点に留意されたい。
上記測定シーケンスを行っている間に試料の切り替え(別の乳汁への切り替えなど)を行う手順についてここで説明する。サンプリング時間終了後、試料が入っているバイアル瓶を切り替えバルブによってガス流路から切り離す。これにより、測定対象の試料を、測定に影響を与えることなく任意のタイミングで次の試料に切り替えることができる。
測定試料の交換作業(バイアル瓶の付け替え等)は数十秒を要し、また試料交換を行ったことを測定システムのデータ設定等に反映させる入力作業等が必要となるので、互いに異なる試料を測定する2つの測定の間にはセンサモジュールが停止する時間が必要となる。ところが、センサモジュールの停止によりモジュール温度が低下するため、ベースラインが変動する。このベースラインの変動は微細なシグナル差を測定する上では大きなノイズになるため、測定間のモジュール停止は1秒以内に抑えるのが理想的である。ここで、上述したようにサンプリング時間終了後に試料を収容しているバイアル瓶(もちろん、他の種類の試料収容容器等でも同様である)をガス流路から切り離すことで、切り離されている間にパイアル瓶の交換及びこの交換に伴うその他の作業を行うことができる。従って、このような手法では試料の切り替えをパージ処理と並行して行うことで、試料の切り替え時間を測定シーケンス上に実質的に現れないようにできる。
結果を図4に示す。
図4は、ChAのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。図4では、試料1の測定結果を淡灰色で示し、試料2の測定結果を濃黒色で示した。
なお、図4に示す結果は、上記測定シーケンスの試料ガスインジェクション期間の開始時点(すなわち、最初のパージ期間の終了時点)をオフセットの起点に設定し、同一の試料について複数回の測定を行った結果のうち、典型的な結果をプロットしている。後述する図5~図14、及び、図18~図22についても同様である。
図4は、ChAのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。図4では、試料1の測定結果を淡灰色で示し、試料2の測定結果を濃黒色で示した。
なお、図4に示す結果は、上記測定シーケンスの試料ガスインジェクション期間の開始時点(すなわち、最初のパージ期間の終了時点)をオフセットの起点に設定し、同一の試料について複数回の測定を行った結果のうち、典型的な結果をプロットしている。後述する図5~図14、及び、図18~図22についても同様である。
図4からわかるように、ChAの感応膜材料を用いた場合には、試料ガスインジェクション期間の開始直後にシグナル強度が鋭く立ち上がった後、飽和値へ向かって漸近する挙動において、放牧牛に比べて舎飼牛のシグナル強度が若干高い時間区間(約270秒から325秒までの範囲)が見られるものの、何らかの特徴量を抽出して有意な差が得られるほどの差はなく、当該時間区間以外のシグナルの時間経過はほぼ一致している。言い換えると、ChAの感応膜材料を用いた場合には、ヒトの嗅覚や味覚ではっきりと識別できるほどに香りや風味が異なる乳汁であっても、MSSで検知されるガス成分に対するシグナルとしては明確な差が見られなかった。このことから、ChAのMSSからのシグナルの経時変化においてこれとは異なる傾向が見られる場合には、乳牛の疾患に起因するものである可能性が高いことが示唆された。
<試験2:ケトーシス罹患牛の乳汁を模した乳汁から発生したガスの測定>
非特許文献2によれば、健康牛の乳中アセトン濃度は0.7mmol/L未満であるのに対し、乳量の低下が明確に見られる高ケトン血症(hyperketonaemia)罹患牛の乳中アセトン濃度は1.4mmol/Lを上回るとされている(表1参照)。
そこで、上記試験1で用いた試料2(舎飼牛の乳汁)の乳中アセトン濃度が0.7mmol/Lであると仮定し、これと同じ舎飼牛の乳汁10mLにアセトン濃度70mmol/Lの水溶液を0.1mL添加して、乳中アセトン濃度が1.4mmol/Lに近似するようにした試料(試料3)を調製し、これをケトーシス罹患牛の乳汁を模した乳汁とした。また、比較のために、試験1で用いたのと同じ舎飼牛の乳汁10mLに蒸留水を0.1mL添加した試料(試料4)を調製し、試料3及び試料4をそれぞれバイアル瓶に収容して測定を行った。
非特許文献2によれば、健康牛の乳中アセトン濃度は0.7mmol/L未満であるのに対し、乳量の低下が明確に見られる高ケトン血症(hyperketonaemia)罹患牛の乳中アセトン濃度は1.4mmol/Lを上回るとされている(表1参照)。
そこで、上記試験1で用いた試料2(舎飼牛の乳汁)の乳中アセトン濃度が0.7mmol/Lであると仮定し、これと同じ舎飼牛の乳汁10mLにアセトン濃度70mmol/Lの水溶液を0.1mL添加して、乳中アセトン濃度が1.4mmol/Lに近似するようにした試料(試料3)を調製し、これをケトーシス罹患牛の乳汁を模した乳汁とした。また、比較のために、試験1で用いたのと同じ舎飼牛の乳汁10mLに蒸留水を0.1mL添加した試料(試料4)を調製し、試料3及び試料4をそれぞれバイアル瓶に収容して測定を行った。
測定システムを収容したインキュベータの温度等の測定条件は、試験1と同様とした。
結果を図5に示す。
図5は、ChAのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。図5では、試料3の測定結果を淡灰色で示し、試料4の測定結果を濃黒色で示した。
図5は、ChAのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。図5では、試料3の測定結果を淡灰色で示し、試料4の測定結果を濃黒色で示した。
図5からわかるように、ChAの感応膜材料を用いた場合には、試料3と試料4との間にシグナルの経時変化の違いが確認された。具体的には、試料ガスインジェクション期間の開始直後にシグナル強度が鋭く立ち上がった後、飽和値へ向かって漸近する挙動が異なる。また、試料ガスインジェクション期間からパージ期間に切り換えた直後のシグナル強度の鋭い立ち下りからベースラインに収束(復帰)するまでの挙動(シグナル強度が減少する傾向)にも違いが見られる。さらに、シグナル強度の飽和値にも違いが見られる。なお、パージ期間の開始時点をオフセットの起点に設定した場合と比較すると、図5に示す結果の方が試料3と試料4との測定結果の違いがより明りょうであった。
一方、ChB、ChD、ChEの感応膜材料を用いた場合にも試料3と試料4との間にシグナルの経時変化の違いが確認されたが、ChAの場合と比較するとそれほど明りょうではなかった(データ示さず)。このことは、ChB、ChDまたはChEのMSSによる測定結果単独での判定は困難である可能性を示唆するものであるとも言えるが、ChAやそれ以外の感応膜材料を用いたMSS(あるいはMSSとは異なるタイプの表面応力センサを含む他のガス検出手段)との組み合わせによる判定が可能である可能性を否定するものではない。
<試験3:ケトーシス罹患牛の乳汁から発生したガスの測定(1)>
乳中のβ-ヒドロキシ酪酸を半定量する製品(サンケトペーパー、(株)三和化学研究所)を用いた試験により強陽性(BHBA濃度1000μM)と判定された乳汁10mL(試料5)、及び、陰性(BHBA濃度50μM)と判定された乳汁10mL(試料6)を、それぞれバイアル瓶に収容して測定を行った。
なお、試料5及び試料6の測定は、乳汁採取後、約24時間常温に静置されたものを用いて行った。
乳中のβ-ヒドロキシ酪酸を半定量する製品(サンケトペーパー、(株)三和化学研究所)を用いた試験により強陽性(BHBA濃度1000μM)と判定された乳汁10mL(試料5)、及び、陰性(BHBA濃度50μM)と判定された乳汁10mL(試料6)を、それぞれバイアル瓶に収容して測定を行った。
なお、試料5及び試料6の測定は、乳汁採取後、約24時間常温に静置されたものを用いて行った。
試料5及び試料6の測定では、常温(約25℃)環境にバイアル瓶を置き、測定システムは開放系とした。測定中、センサモジュールの温度は約36.5℃で安定していた。
試料ガス及びパージガスの流量等、その他の測定条件は試験1と同様とした。
試料ガス及びパージガスの流量等、その他の測定条件は試験1と同様とした。
なお、試料5及び試料6を採取した乳牛がそれぞれケトーシス罹患牛及び健康牛であることは、上記製品を用いた乳汁試料の試験結果に加え、PTR-TOF-MSによる乳汁試料及び尿試料の質量スペクトルにおけるアセトンに由来するピーク強度を総合的に分析して判定している。後述する試験4及び試験5についても同様である。
結果を図6~図9に示す。
図6は、ChAのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。
図7は、ChBのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。
図8は、ChDのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。
図9は、ChEのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。
図6~図9では、試料5の測定結果を淡灰色で示し、試料6の測定結果を濃黒色で示した。
図6は、ChAのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。
図7は、ChBのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。
図8は、ChDのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。
図9は、ChEのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。
図6~図9では、試料5の測定結果を淡灰色で示し、試料6の測定結果を濃黒色で示した。
図6からわかるように、ChAの感応膜材料を用いた場合には、試料5のシグナルの経時変化は、試料6のそれとは大きく異なっていた。具体的には、試料5では、試料ガスインジェクション期間の開始直後にシグナル強度が鋭く立ち上がった後、さらにシグナル強度が増加しながら飽和値へ向かって漸近するのに対して、試料6では、試料ガスインジェクション期間の開始直後にシグナル強度が鋭く立ち上がった際のシグナル強度は試料5よりも小さく、また、飽和値へ向かって漸近する際のシグナル強度の変化量は約0.1mVの範囲内に収まっている。結果的に、試料5と試料6とでは、シグナル強度の飽和値に有意な差が生じている。また、試料ガスインジェクション期間からパージ期間に切り換えた直後のシグナル強度の鋭い立ち下りからベースラインに収束(復帰)するまでの挙動(シグナル強度が減少する傾向)について見ると、試料5及び試料6のいずれもシグナル強度の鋭い立ち下りが生じているが、試料5では、試料6よりも高いシグナル強度値からベースラインに向けて緩やかに収束しており、試料6では、より短時間でシグナル強度が収束し、ベースラインへ復帰している。
また、図6に示したChAの感応膜材料を用いた場合と同様の測定結果は、図7~図9に示すChB、ChD、ChEの感応膜材料を用いた場合にも得られた。
これらの結果から、ChA、ChB、ChD、ChEの感応膜材料を用いたMSSにより、各々単独の測定結果から、ケトーシス罹患の判定が可能であることがわかった。より具体的には、測定結果に対して適切なオフセット処理を施すことによって、上述した試験紙を用いた半定量法により陰性と判定された乳汁と強陽性と判定された乳汁との違いを明確に識別できることがわかった。また、これらのMSSを使用して得られた複数の測定結果を組み合わせることによって、ケトーシス罹患の判定精度をより高めることができることが示唆された。
なお、図示はしていないが、ChCの感応膜材料を用いたMSSでは、ChA、ChB、ChD、ChEの感応膜材料を用いたMSSと同様に、単独の測定結果からのケトーシス罹患の判定が可能であることを示す結果が得られたが、複数の測定結果を組み合わせることがより好ましいことが示唆された。言い換えると、ChCの感応膜材料を用いたMSSは、ChA、ChB、ChD、ChEの感応膜材料を用いたMSS(あるいはMSSとは異なるタイプの表面応力センサを含む他のガス検出手段)との組み合わせによる判定により適していることが示唆された。
<試験4:ケトーシス罹患牛の乳汁から発生したガスの測定(2)>
乳中のβ-ヒドロキシ酪酸を半定量する製品(サンケトペーパー、(株)三和化学研究所)を用いた試験により偽陽性~陽性(BHBA濃度100~200μM)と判定された乳汁10mL(試料7)、及び、陰性(BHBA濃度0~50μM)と判定された乳汁10mL(試料8)を、それぞれバイアル瓶に収容して、温度条件の異なる以下の2種類の測定を行った。
なお、試料7及び試料8の測定は、乳汁採取直後に冷蔵されたものを用いて行った。
乳中のβ-ヒドロキシ酪酸を半定量する製品(サンケトペーパー、(株)三和化学研究所)を用いた試験により偽陽性~陽性(BHBA濃度100~200μM)と判定された乳汁10mL(試料7)、及び、陰性(BHBA濃度0~50μM)と判定された乳汁10mL(試料8)を、それぞれバイアル瓶に収容して、温度条件の異なる以下の2種類の測定を行った。
なお、試料7及び試料8の測定は、乳汁採取直後に冷蔵されたものを用いて行った。
[測定a]
測定aでは、常温(約20℃)環境にバイアル瓶を置き、測定システムは開放系とした。測定中、センサモジュールの温度は約36.5℃で安定していた。
バイアル瓶の温度条件以外の、試料ガス及びパージガスの流量等、その他の測定条件は試験1と同様とした。
測定aでは、常温(約20℃)環境にバイアル瓶を置き、測定システムは開放系とした。測定中、センサモジュールの温度は約36.5℃で安定していた。
バイアル瓶の温度条件以外の、試料ガス及びパージガスの流量等、その他の測定条件は試験1と同様とした。
[測定b]
測定bでは、約30℃に設定した湯浴中にバイアル瓶を設置し、測定システムは開放系とした。測定中、センサモジュールの温度は約36.5℃で安定していた。
バイアル瓶の温度条件以外の、試料ガス及びパージガスの流量等、その他の測定条件は試験1と同様とした。
測定bでは、約30℃に設定した湯浴中にバイアル瓶を設置し、測定システムは開放系とした。測定中、センサモジュールの温度は約36.5℃で安定していた。
バイアル瓶の温度条件以外の、試料ガス及びパージガスの流量等、その他の測定条件は試験1と同様とした。
測定a及び測定bの結果を、それぞれ、図10~図11、及び、図12~図14に示す。
図10は、測定aでのChAのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。
図11は、測定aでのChDのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。
図12は、測定bでのChAのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。
図13は、測定bでのChDのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。
図14は、測定bでのChEのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。
図10~図14では、試料7の測定結果を淡灰色で示し、試料8の測定結果を濃黒色で示した。
図10は、測定aでのChAのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。
図11は、測定aでのChDのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。
図12は、測定bでのChAのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。
図13は、測定bでのChDのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。
図14は、測定bでのChEのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。
図10~図14では、試料7の測定結果を淡灰色で示し、試料8の測定結果を濃黒色で示した。
図10からわかるように、測定aにおいて、ChAの感応膜材料を用いた場合には、試料7と試料8との間にシグナルの経時変化の違いが確認された。具体的には、試料ガスインジェクション期間の開始直後にシグナル強度が鋭く立ち上がった後、飽和値へ向かって漸近する挙動が異なる。また、試料ガスインジェクション期間からパージ期間に切り換えた直後のシグナル強度の鋭い立ち下りからベースラインに収束(復帰)するまでの挙動(シグナル強度が減少する傾向)にも違いが見られる。さらに、シグナル強度の飽和値にも違いが見られる。
ここで、測定bにおいてChAの感応膜材料を用いた場合の結果を示す図12を参照すると、図10に示す結果よりも、試料7のシグナルの経時変化は、試料8のそれとは大きく異なっていることがわかる。具体的には、試料8では、測定aで得られた結果と測定bで得られた結果とに特に違いは見られなかったが、試料7では、測定aで得られた結果よりも測定bで得られた結果において、試料ガスインジェクション期間からパージ期間に切り換えた直後のシグナル強度の鋭い立ち下り時のシグナル強度値が高く、その値からベースラインに向けて緩やかに収束している。その結果、図12に示す測定bの結果では、試料7と試料8との間で、パージ期間におけるシグナル強度の減少挙動の違いがより明りょうである。
これらの結果から、MSSの感応膜材料として適切な材料を選択することに加えて、試料を収容したバイアル瓶の温度を適切に制御することによって、試料(乳汁)から発生したガスの測定精度をより向上させることができ、ひいてはケトーシス罹患及び/またはケトーシス罹患の可能性の有無の判定精度をより向上させることができることが示唆された。
また、図10及び図12に示したChAの感応膜材料を用いた場合と同様の特徴を有する測定結果は、図11及び図13に示すChDの感応膜材料を用いた場合にも得られた。
なお、図示はしていないが、ChBの感応膜材料を用いた場合にも、ChA、ChDの感応膜材料を用いた場合と同様の特徴を有する測定結果が得られたが、バイアル瓶の温度条件の違いと測定結果との相関関係は、ChA、ChDの感応膜材料を用いた場合の方がより顕著であった。
さらに、ChEの感応膜材料を用いた場合には、測定aにおいては試料7及び試料8との間の、シグナルの経時変化の違いが明りょうではなかったのに対して、測定bにおいては、図14に示すように、ChA、ChDの感応膜材料を用いた場合(図12、図13)に匹敵するほど、試料7のシグナルの経時変化が、試料8のそれとは異なっていた。
これらの結果から、ChA、ChDの感応膜材料を用いたMSSによる測定において、試料を収容したバイアル瓶の温度を任意の値に維持することで、各々単独の測定結果から、ケトーシス罹患の可能性がある段階での判定が可能であることがわかった。より具体的には、測定結果に対して適切なオフセット処理を施すことによって、上述した試験紙を用いた半定量法により偽陽性~陽性と判定された乳汁と陰性と判定された乳汁との違いを明確に識別できることがわかった。また、当該バイアル瓶の温度を適切な値に設定することで、判定精度をより向上させることができることがわかった。これらの知見は、ChBの感応膜材料を用いたMSSについても同様に当てはまる。さらに、試料を収容したバイアル瓶の温度と、MSSの感応膜材料の組み合わせによっては、単独の測定結果からのケトーシス罹患の判定が可能になる場合や、他の感応膜材料を用いたMSS(あるいはMSSとは異なるタイプの表面応力センサを含む他のガス検出手段)との組み合わせによる判定に有用な測定結果が得られる場合があることが示唆された。
<試験5:ケトーシス罹患牛の尿から発生したガスの測定>
[乳汁及び尿を用いたプロトン移動反応飛行時間型質量分析]
測定システムを用いた試料の測定にあたり、プロトン移動反応飛行時間型質量分析(PTR-TOF-MS)により、ケトーシス罹患牛及び健康牛から採取した乳汁及び尿の測定を行った。
[乳汁及び尿を用いたプロトン移動反応飛行時間型質量分析]
測定システムを用いた試料の測定にあたり、プロトン移動反応飛行時間型質量分析(PTR-TOF-MS)により、ケトーシス罹患牛及び健康牛から採取した乳汁及び尿の測定を行った。
図15A及び図15Bは、それぞれ、ケトーシス罹患牛の乳汁、及び、健康牛の乳汁の、PTR-TOF-MSで得られた質量スペクトルを示す図である。
ここで、ケトーシス罹患牛は、乳中のβ-ヒドロキシ酪酸を半定量する製品(サンケトペーパー、(株)三和化学研究所)を用いた試験により陽性~強陽性(BHBA濃度200~1000μM)と判定された乳牛であり、健康牛は、上記試験により陰性(BHBA濃度0~50μM)と判定された乳牛である。測定に用いた乳汁試料の量は2mLであり、ガスの希釈倍率は100倍とした。後述する尿試料の測定(図16A及び図16B)についても同様である。
ここで、ケトーシス罹患牛は、乳中のβ-ヒドロキシ酪酸を半定量する製品(サンケトペーパー、(株)三和化学研究所)を用いた試験により陽性~強陽性(BHBA濃度200~1000μM)と判定された乳牛であり、健康牛は、上記試験により陰性(BHBA濃度0~50μM)と判定された乳牛である。測定に用いた乳汁試料の量は2mLであり、ガスの希釈倍率は100倍とした。後述する尿試料の測定(図16A及び図16B)についても同様である。
図15A及び図15Bからわかるように、ケトーシス罹患牛の乳汁と健康牛の乳汁の質量スペクトルにおいて、ピーク位置(m/z値)は類似性が高いが、m/z値が約50~80の範囲にあるピーク強度は、ケトーシス罹患牛と健康牛とで有意な差が見られ、分析の結果、各図中に矢印で示すように、アセトン及び2-ブタノンに由来するピークが含まれていることが確認された。
図16A及び図16Bは、それぞれ、ケトーシス罹患牛の尿、及び、健康牛の尿の、PTR-TOF-MSで得られた質量スペクトルを示す図である。
図16A及び図16Bの質量スペクトルにおいても、上述した乳汁試料と同様の結果が得られた。すなわち、ケトーシス罹患牛の尿と健康牛の尿の質量スペクトルにおいて、ピーク位置(m/z値)は類似性が高いが、m/z値が約50~80の範囲にあるピーク強度は、ケトーシス罹患牛と健康牛とで有意な差が見られ、分析の結果、各図中に矢印で示すように、アセトン及び2-ブタノンに由来するピークが含まれていることが確認された。
さらに、興味深いことに、図15Aと図16A、及び、図15Bと図16Bを対比すると、ケトーシス罹患牛の乳汁と尿の質量スペクトル、及び、健康牛の乳汁と尿の質量スペクトルは、全体のピークプロファイルがほぼ一致していることがわかる。そこで、これらの試料における特徴的な成分であるアセトン及び2-ブタノンの濃度について、さらに分析を行った。
図17A、図17B及び図17Cは、ケトーシス罹患牛の乳汁及び尿、並びに、健康牛の乳汁及び尿中の、PTR-TOF-MSによる、アセトン及び2-ブタノンの濃度の測定結果を示す図である。図17Aは、アセトン及び2-ブタノンの濃度の測定結果を一緒に示した図であり、実線がアセトン、破線が2-ブタノンである。図17B及び図17Cは、図17Aに示したアセトン及び2-ブタノンの濃度の測定結果を別々に示した図であり、図17Bがアセトン、図17Cが2-ブタノンである。
図17A~図17Cに示した測定結果から、本試験において、ケトーシス罹患牛及び健康牛から採取された乳汁及び尿における特徴的な成分であるアセトン及び2-ブタノンの濃度は、ケトーシス罹患牛の乳汁と尿、及び、健康牛の乳汁と尿の間で、非常に近しい値であること、さらに言えば、その差はわずかであり、ほぼ一致しているとみなせる程度であることがわかった。
このように、図15A及び図15B、図16A及び図16B、並びに、図17A~図17Cに示したPTR-TOF-MSの結果は、乳牛の乳汁と尿という異なる種類の体液であっても、ケトーシス罹患の有無と、それらの体液から発生するガスの組成における特定の成分(例えば、アセトン及び2-ブタノン)の含有量(濃度)との間の相関関係は共通していることを示しており、ひいては、上記試験1~4での測定に用いた乳汁のみならず、動物から採取される乳汁以外の体液、例えば血液、尿、唾液、汗も、そこから発生するガスを用いることでケトーシス罹患の判定を行うことが可能であることを示唆している。
[尿試料の測定]
次に、上述した知見を基に、ケトーシス罹患牛の尿2mL(試料9)、及び、健康牛の尿2mL(試料10)を、それぞれバイアル瓶に収容して測定を行った。
次に、上述した知見を基に、ケトーシス罹患牛の尿2mL(試料9)、及び、健康牛の尿2mL(試料10)を、それぞれバイアル瓶に収容して測定を行った。
試料9及び試料10の測定では、常温(約25℃)環境にバイアル瓶を置き、測定システムは開放系とした。測定中、センサモジュールの温度は約36.5℃で安定していた。
試料ガス及びパージガスの流量等、その他の測定条件は試験1と同様とした。
試料ガス及びパージガスの流量等、その他の測定条件は試験1と同様とした。
結果を図18~図22に示す。
図18は、ChAのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。
図19は、ChBのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。
図20、ChCのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。
図21は、ChFのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。
図22は、ChGのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。
図18~図22では、試料9の測定結果を淡灰色で示し、試料10の測定結果を濃黒色で示した。
図18は、ChAのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。
図19は、ChBのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。
図20、ChCのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。
図21は、ChFのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。
図22は、ChGのMSSからのシグナル(単位はmV)の時間変化(単位は秒)を示す図である。
図18~図22では、試料9の測定結果を淡灰色で示し、試料10の測定結果を濃黒色で示した。
図18からわかるように、ChAの感応膜材料を用いた場合には、試料9と試料10との間にシグナルの経時変化の違いが確認された。具体的には、試料ガスインジェクション期間の開始直後にシグナル強度が鋭く立ち上がった後、飽和値へ向かって漸近する挙動が異なる。また、試料ガスインジェクション期間からパージ期間に切り換えた直後のシグナル強度の鋭い立ち下りからベースラインに収束(復帰)するまでの挙動(シグナル強度が減少する傾向)にも違いが見られる。さらに、シグナル強度の飽和値にも違いが見られる。
また、図18に示したChAの感応膜材料を用いた場合と同様の測定結果は、図19~図22に示すChB、ChC、ChF、ChGの感応膜材料を用いた場合にも得られた。
これらの結果から、ChA、ChB、ChC、ChF、ChGの感応膜材料を用いたMSSにより、各々単独の測定結果から、ケトーシス罹患の判定が可能であることがわかった。より具体的には、測定結果に対して適切なオフセット処理を施すことによって、上述した試験紙を用いた半定量法により陰性と判定された乳牛の尿と陽性~強陽性と判定された乳牛の尿との違いを明確に識別できることがわかった。また、これらのMSSを使用して得られた複数の測定結果を組み合わせることによって、ケトーシス罹患の判定精度をより高めることができることが示唆された。
例えば、検査対象の試料として乳汁と尿の両方を比較的容易に(動物に追加の負担を与えないように)取得できる場合の測定系としては、ChAの感応膜材料を用いたMSSを単独で使用して、乳汁から発生したガスと尿からから発生したガスを測定し、その結果に基づいてケトーシス罹患の判定を行うことができる。
また、複数の感応膜材料を用いる場合の例としては、ChA~ChGの感応膜材料をそれぞれ塗布したMSSの集合体を備えた測定システムを構成し、ChA、ChB及びChCの感応膜材料を用いたMSSでは乳汁から発生したガスと尿からから発生したガスを測定し、ChD及びChEの感応膜材料を用いたMSSでは乳汁から発生したガスを測定し、ChF及びChGの感応膜材料を用いたMSSでは尿からから発生したガスを測定し、これらの結果を組み合わせることによって、ケトーシス罹患の判定を行うこともできる。
また、複数の感応膜材料を用いる場合の例としては、ChA~ChGの感応膜材料をそれぞれ塗布したMSSの集合体を備えた測定システムを構成し、ChA、ChB及びChCの感応膜材料を用いたMSSでは乳汁から発生したガスと尿からから発生したガスを測定し、ChD及びChEの感応膜材料を用いたMSSでは乳汁から発生したガスを測定し、ChF及びChGの感応膜材料を用いたMSSでは尿からから発生したガスを測定し、これらの結果を組み合わせることによって、ケトーシス罹患の判定を行うこともできる。
本発明は、検査対象の体液として乳汁を使用する場合、典型的には、乳牛に適用して好適である。また、乳牛のほかに産業として乳汁を生産するために飼育される動物、例えば、山羊、羊、スイギュウ(水牛)、ヤク等のウシ科の動物、馬などに適用しても好適である。より具体的には、本発明は、乳牛等、乳汁を生産するために多頭飼育される動物において、ケトーシス罹患の個体、及び/又は、ケトーシス罹患の疑いのある個体を予備的に抽出する(スクリーニングする)のに特に好適である。また、乳汁以外の体液も、体液の種類や動物の種類、また採取手法によりその採取の容易性や、必要な時点に得られるかどうかの確実性などが異なるが、状況に応じて適宜利用可能な体液を検査対象とすることができる。
近年、乳牛等の飼養管理システムにおいて、モーションセンサ等を活用することによる、疾患や体調変化の兆候等の早期発見の取り組みがなされている。本発明をそのような飼養管理システムと組み合わせることで、動物の健康管理をより簡便かつ効率的に行うことが可能となり、生産性の向上あるいは維持に資することが期待される。
Claims (22)
- 動物(ヒトを除く。)から採取した体液から発生したガスをガス検出手段に与え、
前記体液から発生したガスに対する前記ガス検出手段の応答を使用して、前記体液から発生したガスの組成に基づく前記動物のケトーシス罹患の判定を行う、
ケトーシス罹患判定方法。 - 前記体液は乳汁、血液、尿、唾液、汗からなる群から選択される、請求項1に記載のケトーシス罹患判定方法。
- 前記体液から発生したガスは、ケトン類、アルコール類、アルデヒド類、ニトリル類、有機酸、水(水蒸気)、窒素、酸素、二酸化炭素の少なくとも一つである、請求項1または2に記載のケトーシス罹患判定方法。
- 前記体液から発生したガスはケトン類及びアルコール類の少なくとも一つであり、前記ケトン類はアセトンであり、前記アルコール類は、メタノール、エタノール、プロパノール及びブタノールからなる群から選択された少なくとも一つである、請求項3に記載のケトーシス罹患判定方法。
- 前記ガス検出手段はガスセンサであり、前記ガス検出手段の応答はガスセンサから出力されるシグナルである、請求項1から4の何れかに記載のケトーシス罹患判定方法。
- 前記ケトーシス罹患の判定は、前記シグナルの時間変化のパターンに基づいて行う、請求項5に記載のケトーシス罹患判定方法。
- 前記ガスセンサは表面応力センサである、請求項5または6に記載のケトーシス罹患判定方法。
- 前記体液を収容した容器に、ケトーシス罹患の判定に影響を与える成分を実質的に含有していないガスを通すことにより得られたガスを前記体液から発生したガスとして前記表面応力センサに供給する、請求項7に記載のケトーシス罹患判定方法。
- 前記表面応力センサに前記体液から発生したガスの供給を開始した以降の前記シグナルを使用して前記ケトーシス罹患の判定を行う、請求項7または8に記載のケトーシス罹患判定方法。
- 前記表面応力センサは膜型表面応力センサである、請求項7から9の何れかに記載のケトーシス罹患判定方法。
- 前記表面応力センサの感応膜の材料としてPoly(4-methylstyrene)、Poly(2,6-diphenyl-p-phenylene oxide)、Poly(vinylidene fluoride)、Cellulose Acetate Butyrate、Poly(ethyleneimine)、フェニル基修飾シリカ/チタニア複合ナノ粒子及びPolystyreneからなる群から選択された少なくとも一を使用する、請求項7から10の何れかに記載のケトーシス罹患判定方法。
- 前記表面応力センサとして、前記群から選択された一の材料を感応膜に使用した第1の表面応力センサと、前記群から選択された他の材料を感応膜として使用した第2の表面応力センサとを少なくとも使用する、請求項11に記載のケトーシス罹患判定方法。
- 前記体液から発生したガスとパージガスとを前記表面応力センサに交互に与え、前記体液から発生したガスに対応する前記シグナルと前記パージガスに対応する前記シグナルとを使用して前記ケトーシス罹患の判定を行う、請求項7から12の何れかに記載のケトーシス罹患判定方法。
- 前記体液から発生したガスを前記表面応力センサに供給する時間区間と前記パージガスを前記表面応力センサに与える時間区間とに加えて、所定の標準ガスを前記表面応力センサに与える時間区間を設け、前記ケトーシス罹患の判定にあたって前記標準ガスに対応する前記シグナルを更に使用する、請求項13に記載のケトーシス罹患判定方法。
- 標準ガスとパージガスとを前記表面応力センサに交互に与え、前記標準ガスに対応する前記シグナルと前記パージガスに対応する前記シグナルとに基づいた標準ガス対応のディジタルデータと、
前記体液から発生したガスとパージガスとを前記表面応力センサに交互に与え、前記体液から発生したガスに対応する前記シグナルと前記パージガスに対応する前記シグナルとに基づいた測定対象体液対応のディジタルデータと
を準備し、
前記ケトーシス罹患の判定は、前記標準ガス対応のディジタルデータと前記測定対象体液対応のディジタルデータとに基づいてケトーシス罹患判定を行う、
請求項13に記載のケトーシス罹患判定方法。 - 前記標準ガスとパージガスとが交互に与えられる前記表面応力センサと前記体液から発生したガスとパージガスとが交互に与えられる前記表面応力センサとは同一の個体である表面応力センサであるか、または互いに別の個体である表面応力センサである、請求項15に記載のケトーシス罹患判定方法。
- 前記標準ガスは参照体液から発生するガスである、請求項14から16の何れかに記載のケトーシス罹患判定方法。
- 前記体液から発生したガスを追加のガスセンサに供給し、前記表面応力センサからのシグナルと前記追加のガスセンサからのシグナルとに基づいて前記ケトーシス罹患の判定を行う、請求項7から17の何れかに記載のケトーシス罹患判定方法。
- 少なくとも一つの表面応力センサと、
動物から採取された検査対象の体液から発生した試料ガスを供給する第1のガス流路と、
測定すべきガス成分を含有しないパージガスを供給する第2のガス流路と
を設け、
前記第1のガス流路から供給される試料ガスと前記第2のガス流路から供給されるパージガスとを交互に切り替えて前記少なくとも一つの表面応力センサに供給して前記少なくとも一つの表面応力センサからシグナルを発生させることにより、前記体液から発生した試料ガスの組成に基づく前記動物のケトーシス罹患の判定を行う、ケトーシス罹患判定装置。 - 追加のガスセンサと前記試料ガスを前記追加のガスセンサに供給する追加のガス流路とを設け、
前記少なくとも一つの表面応力センサからの前記シグナルと前記追加のガスセンサからのシグナルとに基づいて前記ケトーシス罹患の判定を行う、請求項19に記載のケトーシス罹患判定装置。 - 少なくとも一つの表面応力センサと、
動物から採取された検査対象の体液から発生した試料ガスを供給する第1のガス流路と、
測定すべきガス成分を含有しないパージガスを供給する第2のガス流路と、
所定の標準ガスを供給する第3のガス流路と
を設け、
前記第1のガス流路から供給される試料ガスと前記第2のガス流路から供給されるパージガスと前記第3のガス流路から供給される標準ガスとを所定の順序で切り替えて前記少なくとも一つの表面応力センサに供給して前記少なくとも一つの表面応力センサからシグナルを発生させることにより、前記体液から発生した試料ガスの組成に基づく前記動物のケトーシス罹患の判定を行う、ケトーシス罹患判定装置。 - 追加のガスセンサと前記試料ガスを前記追加のガスセンサに供給する追加のガス流路とを設け、
前記少なくとも一つの表面応力センサからの前記シグナルと前記追加のガスセンサからのシグナルとに基づいて前記ケトーシス罹患の判定を行う、請求項21に記載のケトーシス罹患判定装置。
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2022536337A JP7617586B2 (ja) | 2020-07-17 | 2021-07-12 | ケトーシス罹患判定方法及び装置 |
| EP21841598.2A EP4184146A4 (en) | 2020-07-17 | 2021-07-12 | Method and device for determining ketosis morbidity |
| US18/015,792 US20230273183A1 (en) | 2020-07-17 | 2021-07-12 | Method and apparatus for determining ketosis |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2020-122610 | 2020-07-17 | ||
| JP2020122610 | 2020-07-17 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2022014512A1 true WO2022014512A1 (ja) | 2022-01-20 |
Family
ID=79555473
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2021/026065 Ceased WO2022014512A1 (ja) | 2020-07-17 | 2021-07-12 | ケトーシス罹患判定方法及び装置 |
Country Status (4)
| Country | Link |
|---|---|
| US (1) | US20230273183A1 (ja) |
| EP (1) | EP4184146A4 (ja) |
| JP (1) | JP7617586B2 (ja) |
| WO (1) | WO2022014512A1 (ja) |
Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS49151B1 (ja) * | 1969-05-08 | 1974-01-05 | ||
| JPS62135771A (ja) * | 1985-12-10 | 1987-06-18 | Sanwa Kagaku Kenkyusho:Kk | 獣乳の品質検査と乳獣の健康診断とを同時に行う方法 |
| WO2011148774A1 (ja) | 2010-05-24 | 2011-12-01 | 独立行政法人物質・材料研究機構 | 表面応力センサ |
| JP5535636B2 (ja) | 2006-10-20 | 2014-07-02 | デラヴァル ホルディング アーベー | 乳生成動物によって消費される消費可能な物質の供給を管理するためのシステム |
| JP2017167036A (ja) * | 2016-03-17 | 2017-09-21 | 国立研究開発法人物質・材料研究機構 | ポリアリルアミン塩酸塩を受容体として用いたナノメカニカルセンサ並びにアセトン濃度測定装置 |
| JP2017207424A (ja) * | 2016-05-20 | 2017-11-24 | 株式会社Nttドコモ | 判定装置 |
| WO2018123296A1 (ja) * | 2016-12-26 | 2018-07-05 | 太陽誘電株式会社 | 生体モニタ装置及び尿の分析方法 |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS517464B2 (ja) * | 1972-04-21 | 1976-03-08 | ||
| US8293187B2 (en) * | 2009-04-06 | 2012-10-23 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Device and method for direct measurement of isotopes of expired gases |
| JP6663151B2 (ja) * | 2016-11-29 | 2020-03-11 | 国立研究開発法人物質・材料研究機構 | 試料に対応付けられた推定対象値を推定する方法及び装置 |
| EP3889577B1 (en) * | 2018-11-26 | 2024-01-03 | National Institute for Materials Science | Liquid sample analysis method |
-
2021
- 2021-07-12 WO PCT/JP2021/026065 patent/WO2022014512A1/ja not_active Ceased
- 2021-07-12 JP JP2022536337A patent/JP7617586B2/ja active Active
- 2021-07-12 US US18/015,792 patent/US20230273183A1/en active Pending
- 2021-07-12 EP EP21841598.2A patent/EP4184146A4/en active Pending
Patent Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS49151B1 (ja) * | 1969-05-08 | 1974-01-05 | ||
| JPS62135771A (ja) * | 1985-12-10 | 1987-06-18 | Sanwa Kagaku Kenkyusho:Kk | 獣乳の品質検査と乳獣の健康診断とを同時に行う方法 |
| JP5535636B2 (ja) | 2006-10-20 | 2014-07-02 | デラヴァル ホルディング アーベー | 乳生成動物によって消費される消費可能な物質の供給を管理するためのシステム |
| WO2011148774A1 (ja) | 2010-05-24 | 2011-12-01 | 独立行政法人物質・材料研究機構 | 表面応力センサ |
| JP2017167036A (ja) * | 2016-03-17 | 2017-09-21 | 国立研究開発法人物質・材料研究機構 | ポリアリルアミン塩酸塩を受容体として用いたナノメカニカルセンサ並びにアセトン濃度測定装置 |
| JP2017207424A (ja) * | 2016-05-20 | 2017-11-24 | 株式会社Nttドコモ | 判定装置 |
| WO2018123296A1 (ja) * | 2016-12-26 | 2018-07-05 | 太陽誘電株式会社 | 生体モニタ装置及び尿の分析方法 |
Non-Patent Citations (5)
| Title |
|---|
| A. H. GUSTAFSSONU. EMANUELSON: "Milk acetone concentration as an indicator of hyperketonaemia in dairy cows: The critical value revised", ANIMAL SCIENCE, vol. 63, 1996, pages 183 - 188 |
| F. ENJALBERTM. C. NICOTC. BAYOURTHER. MONCOULON: "Ketone Bodies in Milk and Blood of Dairy Cows: Relationship between Concentrations and Utilization for Detection of Subclinical Ketosis", JOURNAL OF DAIRY SCIENCE, vol. 84, no. 3, 2001, XP026990200 |
| HEUER, C. ; LUINGE, H.J. ; LUTZ, E.T.G. ; SCHUKKEN, Y.H. ; VAN DER MAAS, J.H. ; WILMINK, H. ; NOORDHUIZEN, J.P.T.M.: "Determination of Acetone in Cow Milk by Fourier Transform Infrared Spectroscopy for the Detection of Subclinical Ketosis", JOURNAL OF DAIRY SCIENCE, vol. 84, no. 3, 1 March 2001 (2001-03-01), US , pages 575 - 582, XP026990199, ISSN: 0022-0302, DOI: 10.3168/jds.S0022-0302(01)74510-9 * |
| See also references of EP4184146A4 |
| SHIN OIKAWA: "Recent Research Trend on Subclinical Ketosis", JOURNAL OF THE JAPAN VETERINARY MEDICAL ASSOCIATION, vol. 68, 2015, pages 33 - 42, Retrieved from the Internet <URL:http://nichiju.lin.gr.jp/mag/06801/b1.pdf> |
Also Published As
| Publication number | Publication date |
|---|---|
| US20230273183A1 (en) | 2023-08-31 |
| EP4184146A4 (en) | 2024-07-10 |
| EP4184146A1 (en) | 2023-05-24 |
| JP7617586B2 (ja) | 2025-01-20 |
| JPWO2022014512A1 (ja) | 2022-01-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Fischer et al. | Physiological variability in volatile organic compounds (VOCs) in exhaled breath and released from faeces due to nutrition and somatic growth in a standardized caprine animal model4 | |
| Antanaitis et al. | In-line registered milk fat-to-protein ratio for the assessment of metabolic status in dairy cows | |
| Kunes et al. | In-line technologies for the analysis of important milk parameters during the milking process: A review | |
| Sikorska et al. | Role of cortisol in horse’s welfare and health | |
| Van et al. | Influence of days in milk and parity on milk and blood fatty acid concentrations, blood metabolites and hormones in early lactation Holstein cows | |
| Li et al. | Optimised method for short-chain fatty acid profiling of bovine milk and serum | |
| DK3058341T3 (en) | DETERMINATION OF THE CONCENTRATION OF A COMPONENT IN A FLUID FROM AN ANIMAL BY SPECTROSCOPIC ANALYSIS OF ANOTHER FLUID | |
| Mottram et al. | Automatic on-line analysis of milk constituents (urea, ketones, enzymes and hormones) using biosensors | |
| Antanaitis et al. | The relation between milk lactose concentration and the rumination, feeding, and locomotion behavior of early-lactation dairy cows | |
| Bielak et al. | Body fat mobilization in early lactation influences methane production of dairy cows | |
| Jansen et al. | Accuracy of subclinical ketosis detection with rapid test methods for BHBA in blood in commercial dairy farms | |
| Pérez-Marín et al. | Colostrum Quality Assessment in Dairy Goats: Use of an on-farm optical refractometer | |
| Dragonieri et al. | Effect of food intake on exhaled volatile organic compounds profile analyzed by an electronic nose | |
| Džermeikaitė et al. | Relationships among in-line milk fat-to-protein ratio, metabolic profile, and inflammatory biomarkers during early stage of lactation in dairy cows | |
| van Erp-van der Kooij et al. | Breath analysis for early detection of rising ketone bodies in postpartum dairy cows classified as at risk of ketosis | |
| King et al. | Assessing the accuracy of inline milk fat-to-protein ratio data as an indicator of hyperketonemia in dairy cows in herds with automated milking systems | |
| Balivo et al. | E-nose analysis of milk to detect the inclusion of hydroponic barley forage in the buffalo diet | |
| US8116985B1 (en) | Real time sampling, monitoring and exposure control of test animals | |
| Džermeikaitė et al. | Milk Lactose and Inflammatory Marker Changes: Early Indicators of Metabolic and Inflammatory Stress in Early Lactation Dairy Cattle | |
| WO2022014512A1 (ja) | ケトーシス罹患判定方法及び装置 | |
| Worku et al. | Aroma profile, microbial and chemical quality of ensiled green forages mixtures of winter cereals and Italian ryegrass | |
| Iqbal et al. | Gas Endeavour: An Innovative Equipment for Estimating Methane Kinetics During In Vitro Rumen Fermentation | |
| JP2004531718A (ja) | 揮発成分の感知による診断 | |
| Chi et al. | Effect of a Dairy Cow’s Feeding System on the Flavor of Raw Milk: Indoor Feeding or Grazing | |
| Kusakabe et al. | Relationships between the response of the sweet taste receptor, salivation toward sweeteners, and sweetness intensity |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 21841598 Country of ref document: EP Kind code of ref document: A1 |
|
| ENP | Entry into the national phase |
Ref document number: 2022536337 Country of ref document: JP Kind code of ref document: A |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| ENP | Entry into the national phase |
Ref document number: 2021841598 Country of ref document: EP Effective date: 20230217 |