WO2012104008A1 - Flüssigkristallanzeigen mit homöotroper ausrichtung - Google Patents
Flüssigkristallanzeigen mit homöotroper ausrichtung Download PDFInfo
- Publication number
- WO2012104008A1 WO2012104008A1 PCT/EP2012/000068 EP2012000068W WO2012104008A1 WO 2012104008 A1 WO2012104008 A1 WO 2012104008A1 EP 2012000068 W EP2012000068 W EP 2012000068W WO 2012104008 A1 WO2012104008 A1 WO 2012104008A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- group
- atoms
- compounds
- replaced
- medium
- Prior art date
Links
- 0 *C(CC1)CCC1c(cc1)ccc1-c1ccc(C(CC2)CCC2*=*)c(F)c1F Chemical compound *C(CC1)CCC1c(cc1)ccc1-c1ccc(C(CC2)CCC2*=*)c(F)c1F 0.000 description 11
- OCOPOZUDAHHXRG-ONEGZZNKSA-N C/C=C/C(CC1)CCC1c(ccc(OC)c1F)c1F Chemical compound C/C=C/C(CC1)CCC1c(ccc(OC)c1F)c1F OCOPOZUDAHHXRG-ONEGZZNKSA-N 0.000 description 1
- VQFILRVNQCWANT-UHFFFAOYSA-N CC(C(OCCc(cc1)ccc1-c(cc1)ccc1OC(C(C)=C)=O)=O)=C Chemical compound CC(C(OCCc(cc1)ccc1-c(cc1)ccc1OC(C(C)=C)=O)=O)=C VQFILRVNQCWANT-UHFFFAOYSA-N 0.000 description 1
- FKRRGIZBYWZEHY-UHFFFAOYSA-N CC(C(Oc(cc1)cc(cc2)c1cc2OC(C(C)=C)=O)=O)=C Chemical compound CC(C(Oc(cc1)cc(cc2)c1cc2OC(C(C)=C)=O)=O)=C FKRRGIZBYWZEHY-UHFFFAOYSA-N 0.000 description 1
- CBPMAFPTGJZUSN-UHFFFAOYSA-N CC(C)(C)c1cc(Cc(cc2C(C)(C)C)c(C)cc2O)c(C)cc1O Chemical compound CC(C)(C)c1cc(Cc(cc2C(C)(C)C)c(C)cc2O)c(C)cc1O CBPMAFPTGJZUSN-UHFFFAOYSA-N 0.000 description 1
- HXIQYSLFEXIOAV-UHFFFAOYSA-N CC(C)(C)c1cc(Sc(cc2C(C)(C)C)c(C)cc2O)c(C)cc1O Chemical compound CC(C)(C)c1cc(Sc(cc2C(C)(C)C)c(C)cc2O)c(C)cc1O HXIQYSLFEXIOAV-UHFFFAOYSA-N 0.000 description 1
- IWVLDYOOUFYMNI-UHFFFAOYSA-N CC(CC1)CCC1=Cc(cc1)ccc1-c1ccc(-c(cc2)cc(F)c2F)c(F)c1 Chemical compound CC(CC1)CCC1=Cc(cc1)ccc1-c1ccc(-c(cc2)cc(F)c2F)c(F)c1 IWVLDYOOUFYMNI-UHFFFAOYSA-N 0.000 description 1
- KAHZFCWHUOVCPU-UHFFFAOYSA-N CC(CC1)CCC1C1COC(c(cc2F)cc(F)c2F)OC1 Chemical compound CC(CC1)CCC1C1COC(c(cc2F)cc(F)c2F)OC1 KAHZFCWHUOVCPU-UHFFFAOYSA-N 0.000 description 1
- PFORDEGIRMCYKX-UHFFFAOYSA-N CC(CC1)CCC1c(cc1)ccc1-c(ccc(C1CCC(C)CC1)c1F)c1F Chemical compound CC(CC1)CCC1c(cc1)ccc1-c(ccc(C1CCC(C)CC1)c1F)c1F PFORDEGIRMCYKX-UHFFFAOYSA-N 0.000 description 1
- AQTCJDSGFLWKCT-UHFFFAOYSA-N CCCCCc(cc1)ccc1C1=Cc2cc(OC(C(C)=C)=O)ccc2OC1=O Chemical compound CCCCCc(cc1)ccc1C1=Cc2cc(OC(C(C)=C)=O)ccc2OC1=O AQTCJDSGFLWKCT-UHFFFAOYSA-N 0.000 description 1
- UTSGRJGBZSUXSE-UHFFFAOYSA-N CCCCCc(cc1)ccc1C1=Cc2cc(OC(C=C)=O)ccc2OC1=O Chemical compound CCCCCc(cc1)ccc1C1=Cc2cc(OC(C=C)=O)ccc2OC1=O UTSGRJGBZSUXSE-UHFFFAOYSA-N 0.000 description 1
- DJBOQWUBFXGCIL-UHFFFAOYSA-N CCCOc(cc1)ccc1-c(ccc(-c1ccc(C)cc1)c1F)c1F Chemical compound CCCOc(cc1)ccc1-c(ccc(-c1ccc(C)cc1)c1F)c1F DJBOQWUBFXGCIL-UHFFFAOYSA-N 0.000 description 1
- DBLHOBLHKVAQSR-UHFFFAOYSA-N Cc(cc1)ccc1-c(cc1)cc(F)c1-c1ccc(C)cc1 Chemical compound Cc(cc1)ccc1-c(cc1)cc(F)c1-c1ccc(C)cc1 DBLHOBLHKVAQSR-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K19/00—Liquid crystal materials
- C09K19/52—Liquid crystal materials characterised by components which are not liquid crystals, e.g. additives with special physical aspect: solvents, solid particles
- C09K19/54—Additives having no specific mesophase characterised by their chemical composition
- C09K19/56—Aligning agents
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K19/00—Liquid crystal materials
- C09K19/04—Liquid crystal materials characterised by the chemical structure of the liquid crystal components, e.g. by a specific unit
- C09K19/06—Non-steroidal liquid crystal compounds
- C09K19/08—Non-steroidal liquid crystal compounds containing at least two non-condensed rings
- C09K19/30—Non-steroidal liquid crystal compounds containing at least two non-condensed rings containing saturated or unsaturated non-aromatic rings, e.g. cyclohexane rings
- C09K19/3001—Cyclohexane rings
- C09K19/3003—Compounds containing at least two rings in which the different rings are directly linked (covalent bond)
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K19/00—Liquid crystal materials
- C09K19/52—Liquid crystal materials characterised by components which are not liquid crystals, e.g. additives with special physical aspect: solvents, solid particles
- C09K19/54—Additives having no specific mesophase characterised by their chemical composition
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K19/00—Liquid crystal materials
- C09K19/04—Liquid crystal materials characterised by the chemical structure of the liquid crystal components, e.g. by a specific unit
- C09K19/06—Non-steroidal liquid crystal compounds
- C09K19/08—Non-steroidal liquid crystal compounds containing at least two non-condensed rings
- C09K19/30—Non-steroidal liquid crystal compounds containing at least two non-condensed rings containing saturated or unsaturated non-aromatic rings, e.g. cyclohexane rings
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K19/00—Liquid crystal materials
- C09K19/04—Liquid crystal materials characterised by the chemical structure of the liquid crystal components, e.g. by a specific unit
- C09K19/42—Mixtures of liquid crystal compounds covered by two or more of the preceding groups C09K19/06 - C09K19/40
- C09K19/44—Mixtures of liquid crystal compounds covered by two or more of the preceding groups C09K19/06 - C09K19/40 containing compounds with benzene rings directly linked
-
- G—PHYSICS
- G02—OPTICS
- G02F—OPTICAL DEVICES OR ARRANGEMENTS FOR THE CONTROL OF LIGHT BY MODIFICATION OF THE OPTICAL PROPERTIES OF THE MEDIA OF THE ELEMENTS INVOLVED THEREIN; NON-LINEAR OPTICS; FREQUENCY-CHANGING OF LIGHT; OPTICAL LOGIC ELEMENTS; OPTICAL ANALOGUE/DIGITAL CONVERTERS
- G02F1/00—Devices or arrangements for the control of the intensity, colour, phase, polarisation or direction of light arriving from an independent light source, e.g. switching, gating or modulating; Non-linear optics
- G02F1/01—Devices or arrangements for the control of the intensity, colour, phase, polarisation or direction of light arriving from an independent light source, e.g. switching, gating or modulating; Non-linear optics for the control of the intensity, phase, polarisation or colour
- G02F1/13—Devices or arrangements for the control of the intensity, colour, phase, polarisation or direction of light arriving from an independent light source, e.g. switching, gating or modulating; Non-linear optics for the control of the intensity, phase, polarisation or colour based on liquid crystals, e.g. single liquid crystal display cells
- G02F1/133—Constructional arrangements; Operation of liquid crystal cells; Circuit arrangements
- G02F1/1333—Constructional arrangements; Manufacturing methods
- G02F1/1337—Surface-induced orientation of the liquid crystal molecules, e.g. by alignment layers
- G02F1/133703—Surface-induced orientation of the liquid crystal molecules, e.g. by alignment layers by introducing organic surfactant additives into the liquid crystal material
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K19/00—Liquid crystal materials
- C09K19/52—Liquid crystal materials characterised by components which are not liquid crystals, e.g. additives with special physical aspect: solvents, solid particles
- C09K19/54—Additives having no specific mesophase characterised by their chemical composition
- C09K19/542—Macromolecular compounds
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K19/00—Liquid crystal materials
- C09K19/04—Liquid crystal materials characterised by the chemical structure of the liquid crystal components, e.g. by a specific unit
- C09K2019/0444—Liquid crystal materials characterised by the chemical structure of the liquid crystal components, e.g. by a specific unit characterized by a linking chain between rings or ring systems, a bridging chain between extensive mesogenic moieties or an end chain group
- C09K2019/0448—Liquid crystal materials characterised by the chemical structure of the liquid crystal components, e.g. by a specific unit characterized by a linking chain between rings or ring systems, a bridging chain between extensive mesogenic moieties or an end chain group the end chain group being a polymerizable end group, e.g. -Sp-P or acrylate
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K19/00—Liquid crystal materials
- C09K19/04—Liquid crystal materials characterised by the chemical structure of the liquid crystal components, e.g. by a specific unit
- C09K2019/0444—Liquid crystal materials characterised by the chemical structure of the liquid crystal components, e.g. by a specific unit characterized by a linking chain between rings or ring systems, a bridging chain between extensive mesogenic moieties or an end chain group
- C09K2019/0466—Liquid crystal materials characterised by the chemical structure of the liquid crystal components, e.g. by a specific unit characterized by a linking chain between rings or ring systems, a bridging chain between extensive mesogenic moieties or an end chain group the linking chain being a -CF2O- chain
-
- G—PHYSICS
- G02—OPTICS
- G02F—OPTICAL DEVICES OR ARRANGEMENTS FOR THE CONTROL OF LIGHT BY MODIFICATION OF THE OPTICAL PROPERTIES OF THE MEDIA OF THE ELEMENTS INVOLVED THEREIN; NON-LINEAR OPTICS; FREQUENCY-CHANGING OF LIGHT; OPTICAL LOGIC ELEMENTS; OPTICAL ANALOGUE/DIGITAL CONVERTERS
- G02F1/00—Devices or arrangements for the control of the intensity, colour, phase, polarisation or direction of light arriving from an independent light source, e.g. switching, gating or modulating; Non-linear optics
- G02F1/01—Devices or arrangements for the control of the intensity, colour, phase, polarisation or direction of light arriving from an independent light source, e.g. switching, gating or modulating; Non-linear optics for the control of the intensity, phase, polarisation or colour
- G02F1/13—Devices or arrangements for the control of the intensity, colour, phase, polarisation or direction of light arriving from an independent light source, e.g. switching, gating or modulating; Non-linear optics for the control of the intensity, phase, polarisation or colour based on liquid crystals, e.g. single liquid crystal display cells
- G02F1/133—Constructional arrangements; Operation of liquid crystal cells; Circuit arrangements
- G02F1/1333—Constructional arrangements; Manufacturing methods
- G02F1/1337—Surface-induced orientation of the liquid crystal molecules, e.g. by alignment layers
- G02F1/133742—Surface-induced orientation of the liquid crystal molecules, e.g. by alignment layers for homeotropic alignment
Definitions
- the present invention relates to liquid crystal media (FK media) having negative or positive dielectric anisotropy containing self-aligning additives which cause homeotropic (vertical) alignment of the FK media on a surface or cell walls of a liquid crystal display (FK display).
- the invention therefore also includes FK displays with homeotropic alignment of the liquid-crystalline medium (LC medium) without conventional imide orientation layers.
- the LC media are optionally supplemented by a polymerizable or polymerized component which serves to stabilize the alignment, to adjust the tilt angle and / or as a passivation layer.
- VAN Very Aligned Nematic displays
- MVA Multi-Domain Vertical Alignment
- eg: Yoshide, H. et al. Lecture 3.1: "MVA LCD for Notebook or Mobile PC SID 2004 International Symposium, Digest of Technical Papers, XXXV, Book I, pp. 6-9, and Liu, CT. et al., Lecture 15.1: "A 46-inch TFT-LCD HDTV Technology SID 2004 International Symposium, Digest of Technical Papers, XXXV, Book II, pp.
- An object of this invention is to simplify the manufacturing processes and the display devices themselves, without sacrificing the advantages of the VA technique, such as relatively fast switching times and good viewing angle dependency.
- VA displays containing FK media with positive dielectric anisotropy are described in SH Lee et al. Appl. Phys. Lett. (1997), 71, 2851-2853 described. These displays use interdigital electrodes (in-plane drive electrode configuration of comb-shaped structure) arranged on a substrate surface, as used inter alia in the commercially available IPS (in-p_lane switching) displays (as for example in DE 40 00 451 and EP 0 588 568), and have a homeotropic arrangement of the liquid crystal medium which changes to a planar arrangement upon application of an electric field.
- interdigital electrodes in-plane drive electrode configuration of comb-shaped structure
- IPS in-p_lane switching
- VA-I PS displays are also known as positive VA and HT-VA.
- VA-I PS displays there is one on both substrate surfaces
- An object of this invention is to simplify the manufacturing processes themselves, without the advantages of VA display technology, such as relatively fast switching times, good viewing angle dependence and high contrast
- Substrate surfaces and physical influences such as heat, radiation in the infrared, visible and ultraviolet range and electrical alternating and alternating fields.
- LC phases require a liquid-crystalline mesophase in a suitable temperature range and a low viscosity.
- VA and VA-I PS displays are generally said to have very high resistivity coupled with a large operating temperature range, short switching times, and low threshold voltage, which can be used to produce different levels of gray.
- a polyimide layer on the substrate surfaces provides for the homeotropic orientation of the substrate
- Liquid crystal The preparation of a suitable orientation layer in the display requires considerable effort. In addition, you can
- the disadvantage of the commonly used active matrix TN displays is their relatively low contrast, the relatively high viewing angle dependence, and the difficulty in producing grayscale in these displays. Significantly better viewing angle dependencies are found on VA displays and are therefore mainly used for TVs and monitors.
- PSA displays Polymer Sustained or “Polymer Sustained Alignment”
- Polymer Stabilized the PSA displays are characterized by the shortening of the switching times. In these displays, a small amount (e.g.
- polymerisable compound (s) which, after being introduced into the FK cell, are polymerized in situ with or without applied electrical voltage between the electrodes. is crosslinked, usually by UV photopolymerization.
- polymerisable mesogenic or liquid-crystalline compounds also referred to as reactive mesogens or "RM" s
- RM reactive mesogens
- PSA PS displays and PSA displays unless otherwise specified.
- PSA-VA PSA-OCB
- PSA-IPS PSA-IPS
- PSA-FFS PSA-TN displays
- polymerizable compound (s) is carried out in PSA-VA and PSA-OCB displays, preferably at applied electrical voltage, in PSA-IPS displays with or without applied electrical voltage.
- the PS (A) method leads to a pretilt in the cell.
- PSA-OCB displays for example, one can achieve that the Bend structure is stabilized, so that one can do without or reduce offset voltage.
- the 'pretilf' has a positive effect on the switching times.
- a standard MVA or PVA pixel and electrode layout can be used. In addition, but you can, for example, with only a structured electrode side and without 'Protrusions' get along, which significantly simplifies the production and at the same time leads to a very good contrast with very good light transmission.
- PSA-VA displays are described, for example, in JP 10-036847 A, EP 1 170 626 A2, US Pat. Nos. 6,861,107, 7,169,449, US 2004/0191428 A1, US 2006/0066793 A1 and US 2006/0103804 A1.
- PSA-OCB displays are described, for example, in T.-J-Chen et al., Jpn. J. Appl. Phys. 45, 2006, 2702-2704 and SH Kim, L.-C-Chien, Jpn. J. Appl. Phys. 43, 2004, 7643-7647 described.
- PSA-I PS displays are described, for example, in US 6,177,972 and Appl. Phys. Lett. 1999, 75 (21), 3264.
- PSA TN displays are described, for example, in Optics Express 2004, 12 (7), 1221.
- PSA-VA IPS displays are disclosed, for example, in WO 2010/089092 A1.
- PSA displays like the conventional FK displays described above, can be operated as active matrix or passive matrix displays.
- active matrix displays the control of individual pixels is usually carried out by integrated, non-linear active elements such as transistors (eg thin-film transistors, 'thin film transistor' or 'TFT'), in passive matrix displays usually by the multiplex method, both methods being known in the art.
- transistors eg thin-film transistors, 'thin film transistor' or 'TFT'
- polymerizable compounds of the following formula are used for PSA-VA wherein P 1 and P 2 each represents a polymerizable group, usually an acrylate or methacrylate group, as for example in US
- Passivation layer may encounter reliability issues such as R-DC ('Residual DC').
- a conference poster for SID 2010 (HY Gim et al., P-128) discloses that a phenethyl-substituted polyhedral oligomeric silsesquioxane is used at a concentration of 10% by weight in a display without a conventional PSA-VA type orientation layer becomes.
- the FK medium with negative dielectric anisotropy is homeotropically oriented by the PSS.
- the large amount of dopant significantly affects the properties of the FK medium, so the number of liquid crystal components that can be used for such FK display is very limited.
- a first subject of the present invention is an LC medium containing a low molecular weight liquid-crystalline component and one or more organic compounds which have at least one polar anchor group and at least one long-chain nonpolar radical having at least 8 carbon atoms.
- the liquid-crystalline component or the LC medium may optionally have a positive or a negative dielectric anisotropy.
- the LC medium according to the invention is preferably nematic.
- the LC medium also optionally contains a polymerized or polymerizable component, the polymerized component being obtainable by polymerizing a polymerizable component.
- Another object of the present invention is a process for producing a FK medium by a low molecular weight
- Compounds having at least one polar anchor group and at least one long-chain nonpolar radical having at least 8 carbon atoms mixes, optionally one or more polymerizable compounds and optional adjuvants.
- the liquid-crystalline component or the FK medium may optionally have a positive or a negative dielectric anisotropy.
- Another object of the present invention is a
- Liquid crystal display comprising a liquid crystal cell (FK cell) with two substrates and at least two electrodes, wherein at least one substrate is transparent, and between the substrates located layer of a liquid crystal medium (FK medium) containing a low molecular weight liquid crystalline component and a or more organic compounds, wherein the organic compound is characterized in that it has at least one polar anchor group and at least one long-chain nonpolar radical having at least 8 carbon atoms, and which is capable of a homeotropic (vertical) orientation of the FK medium opposite bring about the substrate surfaces.
- the FK medium of the LC display also optionally contains a polymerized or polymerizable component, wherein the
- Polymerized component is obtainable by polymerizing one or more polymerizable compounds between the substrates of the FK cell in the LC medium, optionally with application of an electrical voltage to the electrodes of the cell or under the action of another
- the LC display is preferably constructed to have at least one or two on at least one substrate
- Another object of the invention is a method for producing a FK display, preferably of the PSA-VA type, comprising a FK cell with two substrates and at least two electrodes, wherein at least one substrate is transparent, comprising the
- Component optionally under application of a voltage to the electrodes of the cell or under the action of an electric field.
- the organic compound having at least one polar anchor group and at least one long-chain nonpolar radical having at least 8 C atoms is dissolved in the liquid crystal. It effects homeotropic alignment of the liquid crystal with the substrate surfaces (such as a glass or ITO or polyimide coated glass surface). It seems in light of the
- the self-orientation additive is preferably used in a concentration of less than 10% by weight, more preferably ⁇ 8% by weight and most preferably ⁇ 5% by weight. It is preferably used in a concentration of at least 0.1% by weight, preferably at least 0.2% by weight.
- the use of 0.1 to 2.5 wt .-% of the self-alignment additive usually leads to completely homeotropic orientation of the FK layer at the usual cell thicknesses (3 to 4 ⁇ ).
- the polar anchor group preferably does not comprise polymerizable groups such as e.g. Acrylate groups.
- the polar anchor group of the self-alignment additive preferably consists of a group which has a non-covalent interaction with the
- Substrate surface made of glass or metal oxides.
- suitable Groups are polar groups comprising polar structural elements with atoms selected from N, O, S, and P. The groups should at the same time be sufficiently stable for use as LC medium. You should
- VHR values (voltage holding ratio ') of the FK medium in the FK cell and the long-term stability (' reliability ') have only a small influence.
- One or more, preferably two or more, of these are preferred
- the polar anchor group particularly preferably consists of at least two structural elements containing heteroatoms selected from (N, O), and covalent, linking structures between the heteroatoms and between one or more of the heteroatoms and the rest of the
- the polar anchor group preferably comprises at least one OH structure or one N atom in a primary, secondary or tertiary amine group.
- the self-alignment additives preferably have one or two long-chain nonpolar radicals, preferably one of these radicals.
- the term "long-chain nonpolar radical” preferably includes aliphatic hydrocarbon radicals, including branched ones, having a longest chain length of at least 8 carbon atoms, certain functional groups being included in the chain. The remainder may also be unsaturated and / or halogenated (with Cl, F).
- one or more non-adjacent and non-terminal CH 2 groups may be replaced by -O-, - (CO) - or an ester group.
- a CH 2 group may be replaced by a cycloalkylene group having 3 to 8 C atoms.
- the "long-chain non-polar residue” has at most 30 C atoms.
- the longest chain has a maximum chain length of 20 C atoms.
- the remainder has 8 to 18 carbon atoms.
- the radical is a linear alkyl chain having 10 to 16 carbon atoms, with at most 5 C atoms in side chains
- the self-orientation additive is preferably an organic compound having a relative molecular weight> 130 g / mol to make the substances less volatile. It particularly preferably has a relative molecular weight > 150 g / mol for an even more stable self-alignment effect. As upper limit, it preferably has a relative molecular weight of ⁇ 500 g / mol.
- the self-orientation additive particularly preferably has a structure of the formula I:
- R ⁇ is a polar anchor group
- n 1 or 2, preferably 1,
- the radical R 1 preferably comprises 8 to 20 C atoms. Most preferably, it does not comprise rings and means:
- the radical R 2 in the formula I includes, for example, alcohols, primary, secondary and tertiary amines, ketones, carboxylic acids, thiols, esters, and (thio) ethers, and combinations thereof.
- the structure may be linear, branched, cyclic or a combination thereof.
- the group R 2 in the preceding formulas preferably comprises a group of the formula (A1)
- kX 1 (A1) defines a single bond or a spacer group as defined by Sp a as defined below for formula M, preferably a spacer group Sp "-X” as defined for formula M below which is connected via group X "to the radical R 1 , where Sp" is especially is a single bond or an alkylene having 1 to 12 C atoms, a group -NH 2 , -NHR 11 -NR 11 2 , -OR 11 , -OH, - (CO) OH or a group of the formulas
- the group R 2 in the preceding formulas comprises an (N / O) heteroatom-containing group of the sub-formula (A2)
- R are as defined above for R 2 (Formula A1), and
- the group R 2 particularly preferably represents exactly one group of the formulas (A1) or (A2).
- Particularly preferred nitrogen-containing groups R 2 are selected from -NH 2 , -NH- (CH 2 ) n 3 H, - (CH 2 ) n -NH 2) - (CH 2 ) n -NH- (CH 2 ) n 3H, -NH- (CH 2) n -NH 2, -NH- (CH 2) n -NH- (CH 2) n3 H, - (CH 2) n1 -NH- (CH 2) n2 -NH 2) - ( CH 2) n1 -NH- (CH 2) n2 - NH- (CH 2) n3 H, -O- (CH 2) n -NH 2, - (CH 2) n1 -O- (CH 2) n -NH 2, - (CH 2) n1 -NH- (CH 2) n2-OH, -O- (CH 2) n1 -NH- (CH 2) n2 -NH 2, -0- (CH 2) n1 -NH- (CH2) n2-OH,
- n, n1, n2 and n3 are independently 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 or 12, in particular 1, 2, 3 or 4. Due to the better solubility in highly polar liquid-crystalline media, the groups -OH and -NH 2 are particularly preferred.
- the oxygen-containing functions in the anchor groups the OH group is preferred over the functions -O-, - (CO) - or - (CO) O- due to the high anchor force.
- the multiple heteroatom (N, O) equipped groups have a particular strength as an anchor group. They can be used in smaller concentrations.
- Particularly preferred nitrogen-free groups R 2 are selected from -OH, - (CH 2) n -OH, -O- (CH 2) n -OH, - [O- (CH 2) n1 -] n2-OH, - (CO )OH,
- halogen is fluorine, chlorine, bromine or iodine, preferably fluorine or chlorine.
- Particularly preferred compounds of the formula I are selected from the following exemplary compounds which at the same time are particularly preferred groups R and R 2 of the self-orientation additives
- organic compounds having the polar anchor group or compounds of the formula I which, as further functionalization, have one or more polymerizable groups in addition to the polar anchor (compare group P a or P b below).
- Preferred polymerizable groups in addition to the polar anchor (compare group P a or P b below).
- Groups are groups such as acrylate, methacrylate, fluoroacrylate, oxetane, vinyloxy or epoxy group, more preferably acrylate and methacrylate.
- An advantage of the FK displays according to the invention is that the display achieves the desired homeotropic orientation without the usual polyimide alignment layer. This considerably simplifies the manufacture of the FK displays. This orientation is usually retained even at higher temperatures.
- the polymer stabilization additionally stabilizes the homeotropic orientation; This achieves improved temperature stability of the electro-optical switching.
- the homeotropic orientation remains even at higher temperatures within the working range of the
- the polymer-stabilized displays according to the invention are characterized by improved switching times (pretilt angle
- the preferably contained polymerized component can simultaneously serve as a passivation layer, the reliability (the so-called.
- the self-orientation additives or the compounds of the formula I influence the properties of the LC media practically negligibly. Therefore, a wide variety of
- Liquid crystal components can be used in the FK display.
- the FK displays of the invention therefore preferably do not have an alignment layer for homeotropic alignment on the surfaces of the FK cell, i. they are polyimide-free. In the event that the FK displays still have one or both sides orientation layers, they are preferably made of polyimide.
- Orientation layers are preferably not rubbed. This eliminates the hitherto necessary rubbing the orientation layer, a particularly complex step in the production. An unstretched polyimide layer can nevertheless serve as a passivation layer.
- the FK displays according to the invention use a FK medium with negative dielectric anisotropy ( ⁇ ⁇ -1.5) in a particular embodiment.
- Corresponding liquid-crystalline media are likewise preferred. As a rule, this involves a VA display with electrodes arranged on opposite sides of the FK cell, preferably with electrodes which are arranged so as to produce an electric field oriented predominantly perpendicular to the substrate surface can. Typical substrates used are those used in VAN-mode and PSA-VA (structuring of the electrodes is therefore possible).
- the FK displays according to the invention use an FK medium with positive dielectric anisotropy ( ⁇ 1, 5).
- Corresponding liquid-crystalline media are likewise preferred.
- this is a VA-I PS display with electrodes arranged on one side of the FK cell, preferably with electrodes which are arranged such that they can generate an electric field oriented predominantly planar to the substrate surface, eg. B. Interdigital electrodes (in-plane drive electrode configuration of comb-shaped structure).
- the FK displays are provided in the usual way with one or more polarizer (s), which make the switching process of the FK medium visible.
- the polymerized component of the FK cell is obtainable by polymerizing a polymerizable component (monomers).
- the monomers are first dissolved in the FK medium and are polymerized in the FK cell after a homeotropic orientation or a high tilt angle of the FK medium has established.
- a voltage can be applied to the FK cell. In the simplest case, such a tension is unnecessary and the desired orientation is determined solely by the nature of the LC medium and the cell geometry.
- the suitable monomers (polymerisable component) of the LC medium are those of the prior art which are used for PSA-VA displays, in particular polymerizable compounds of the below-mentioned formula M and / or of the formulas M1 to M22.
- the LC media according to the invention for use in PSA ads preferably comprise ⁇ 5% by weight, more preferably ⁇ 1% by weight and very preferably ⁇ 0.5% by weight of polymerisable
- Suitable monomers of the polymerizable component of the FK medium are described by the following formula M:
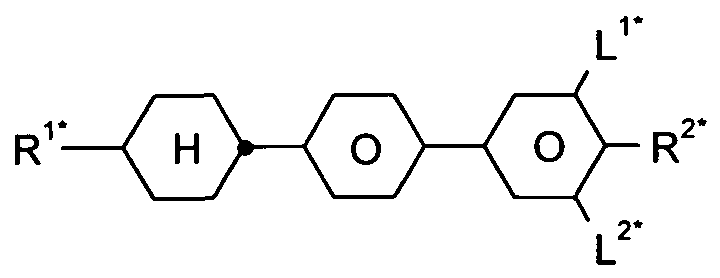
- a 1 , A 2 each independently a radical selected from the following groups a) the group consisting of trans-1, 4-cyclohexylene, 1, 4-cyclohexenylene and 4,4 ' bicyclohexylene, wherein also one or more non-adjacent CH 2 Groups may be replaced by -O- and / or -S- and in which also one or more H atoms may be replaced by F, b) the group consisting of 1, 4-phenylene and 1, 3-phenylene, wherein also one or two CH groups may be replaced by N and in which also one or more H atoms may be replaced by L, c) the group consisting of tetrahydropyran-2,5-diyl, 1, 3
- H atoms in these radicals may be replaced by L, and / or one or more double bonds may be replaced by single bonds can be replaced by N, and / or one or more CH groups can be replaced by N,
- Y 1 , and Y 2 are each independently one of the above for R °
- R c and R d are each, independently of one another, H or alkyl having 1 to 6 C atoms, preferably H, methyl or ethyl,
- the polymerizable group P ab is a group suitable for a polymerization reaction, such as, for example, the radical or ionic
- Chain polymerization, polyaddition or polycondensation, or for a polymer-analogous reaction, for example, the addition or condensation to a polymer backbone is suitable.
- Preferred groups P ab are selected from the group consisting of
- CW 1 CH-CO-NH-
- CH 2 CW 1 -CO-NH-
- CH 3 -CH CH-O-
- W 1 is H, F, Cl, CN, CF 3 , Phenyl or alkyl having 1 to 5 C atoms, in particular H, F, Cl or CH 3 , W 2 and W 3 are each independently H or alkyl having 1 to 5 C atoms, in particular H, methyl, ethyl or n -Propyl, W 4 , W 5 and W 6 are each independently
- each other is Cl, oxaalkyl or Oxacarbonylalkyl having 1 to 5 C-atoms
- W 7 and W 8 are each independently H, Cl or alkyl having 1 to 5 carbon atoms
- Phe is 1,4-phenylene, which optionally with one or a plurality of P-Sp- different radicals L as defined above
- ki, k 2 and k 3 are each independently 0 or 1
- k 3 is preferably 1 and 4 is an integer of 1 to 10.
- Particularly preferred groups P a, b are selected from the group
- W 1 is H, F, Cl, CN, CF 3 , phenyl or alkyl of 1 to 5 carbon atoms, especially H, F, Cl or CH 3 , W 2 and W 3 are each independently H or Alkyl having 1 to 5 carbon atoms, in particular H, methyl, ethyl or n-propyl, W 4 , W 5 and W 6 respectively
- ⁇ independently of one another are Cl, oxaalkyl or oxacarbonylalkyl having 1 to 5 C atoms, W 7 and W 8 in each case independently of one another are H, Cl or alkyl having 1 to 5 C atoms, Phe 1, 4-phenylene, ki, k 2 and k 3 are each independently 0 or 1, k 3 is preferably 1, and l 4 is an integer of 1 to 10.
- Vinyloxy, chloroacrylate, oxetane and epoxy groups and among these, preferably an acrylate or methacrylate group.
- Preferred spacer groups Sp ab are selected from the formula Sp "-X", so that the radical P ⁇ -Sp 37 * - the formula P ⁇ -Sp "- '-, wherein Sp" alkylene having 1 to 20, preferably 1 to 12 C atoms
- R 00 and R 0Ü0 each independently of one another denote H or alkyl having 1 to 12 C
- Y 2 and Y 3 are each independently H, F, Cl or CN
- X ' is preferably -O-, -S -CO-, -COO-, -OCO-, -O-COO-, -CO-NR 0 -, -NR ° CO-, -NR ° NR ° -CO- - or a single bond.
- Particularly preferred groups -Sp "-X" - are - (CH 2 ) p -, - (CH 2 ) p iO-, - (CH 2 ) p IO-CO-, - (CH 2 ) p IO-CO-O in which p1 and q1 are as defined above.
- Ethylenoxyethylene methyleneoxybutylene, ethylenethioethylene, ethylene-N-methyl-iminoethylene, 1-methylalkylene, ethenylene, propenylene and
- Particularly preferred monomers are the following:
- Each of P 1 and P 2 is independently a polymerizable group as defined for formula I, preferably an acrylate, methacrylate, fluoroacrylate, oxetane, vinyloxy or epoxy group,
- Each of Sp 1 and Sp 2 independently represents a single bond or a spacer group, preferably with one of the meanings given above and below for Sp a , and particularly preferably - (CH 2 ) p i-, - (CH 2 ) p i-0- , - (CH 2 ) p i -CO-O- or - (CH 2 ) p 10 -O-CO-O-, wherein p 1 is an integer from 1 to 12, and wherein in the latter groups the linkage to the adjacent ring is via the O atom is carried out, it also being possible for one or more of the radicals P -Sp 1 - and P 2 -Sp 2 - to denote a radical R aa , with the proviso that at least one of the radicals P 1 -Sp 1 - and P 2 present -Sp 2 - not R aa means
- R y and R z are each independently H, F, CH 3 or CF 3 ,
- Z 1 is -O-, -CO-, -C (R y R z ) -, or -CF 2 CF 2 -,
- Z 2 and Z 3 are each independently of one another -CO-O-, -O-CO-, -CH 2 O-,
- L for each occurrence equal or different F, Cl, CN, SCN,
- SF 5 straight-chain or branched, optionally mono- or polyfluorinated, alkyl, alkoxy, alkenyl, alkynyl, alkylcarbonyl, alkoxycarbonyl, alkylcarbonyloxy or
- L 'and L are each independently H, F or Cl,
- the FK medium or the polymerizable contains
- Component one or more compounds selected from the group consisting of the formulas M1-M21, particularly preferably consisting of the formulas M2-M15, very particularly preferably consisting of the formulas M2, M3, M9, M14 and M15.
- the FK medium or the polymerizable contains
- Suitable and preferred polymerization methods are, for example, thermal or photopolymerization, preferably photopolymerization, in particular UV photopolymerization. It can
- Suitable conditions for the polymerization are known in the art and described in the literature.
- the commercially available photoinitiators Irgacure651®, Irgacure184®, Irgacure907®, Irgacure369®, or Darocurel 173® (Ciba AG) are suitable for the free-radical polymerization.
- an initiator is used, its proportion is preferably 0.001 to 5 wt .-%, particularly preferably 0.001 to 1 wt .-%.
- the LC medium does not contain a polymerization initiator.
- the polymerizable component or LC medium may also contain one or more stabilizers to prevent undesired spontaneous polymerization of the RMs, for example during storage or transportation.
- stabilizers Suitable types and amounts of stabilizers are known to those skilled in the art and described in the literature. Particularly suitable are, for example, the commercially available stabilizers of the series Irganox® (Ciba AG), such as Irganox® 1076.
- Stabilizers are used, their proportion, based on the total amount of RMs or the polymerizable
- the LC media for use in the LC displays of the invention contain, in addition to the above-described additives and the optional polymerizable compounds (RMs), an LC mixture ("host mixture") containing one or more, preferably two or more low molecular weight (ie monomeric or unpolymerized) compounds.
- a host mixture containing one or more, preferably two or more low molecular weight (ie monomeric or unpolymerized) compounds.
- the latter are stable or unreactive to a polymerization reaction under the conditions used for the polymerization of the polymerizable compounds.
- the host mixture is any suitable dielectric negative or positive FK mixture for use in conventional VA and VA-I PS displays.
- Suitable FK mixtures with positive dielectric anisotropy suitable for LCDs and especially for IPS displays are e.g. out
- JP 07-181 439 (A), EP 0 667 555, EP 0 673 986, DE 195 09 410,
- liquid-crystalline medium which additionally contains one or more compounds selected from the group of the compounds of the formulas A, B and C,
- R 2C are each independently H, one
- Alkyl radical having up to 15 carbon atoms, wherein in these radicals also one or more Chfe groups by -O-, -S-,
- 1-4 are each independently of one another F, Cl, CF 3 or CHF 2 , each independently of one another single bond,
- Z 2 may have the same or different meanings.
- Z 2 and Z 2 may have the same or different meanings.
- R 2 ⁇ R 2B and R 2C are each preferably alkyl having 1-6 C atoms, in particular CH 3, C 2 H 5) nC 3 H 7 , nC 4 H 9) nC 5 hn.
- Z 2 and Z 2 ' in the formulas A and B preferably each independently a single bond, further a - C 2 H bridge.
- (O) C v H 2 v + i preferably denotes OCvH 2 v + i, furthermore C v H 2v + i.
- (0) C v H 2v + i preferably
- L 3 and L 4 are preferably in each case F.
- alkyl and alkyl * each independently represent a straight-chain alkyl radical having 1-6 C atoms.
- Particularly preferred mixtures according to the invention contain one or more compounds of the formulas A-2, A-8, A-14, A-29, A-35, B-2, B-11, B-16 and C-1.
- the proportion of compounds of the formulas A and / or B in the total mixture is preferably at least 20% by weight.
- Particularly preferred media according to the invention comprise at least one compound of the formula C-1, preferably in amounts of> 3% by weight, in particular> 5% by weight and particularly preferably of 5 to 25% by weight.
- R 3 and R 4 are each independently alkyl with 1 to 12 C
- the compounds of the formula ZK are preferably selected from the group consisting of the following sub-formulas:
- alkyl and AlkyP each independently represents a straight-chain alkyl radical having 1-6 C atoms
- alkenyl and alkenyl * mean a straight-chain alkenyl radical having 2-6 C atoms.
- R 5 and R 6 are each independently one of the meanings given above for R 3/4 ,
- the compounds of the formula DK are preferably selected from the group consisting of the following sub-formulas:
- alkyl and alkyl * each independently represent a straight-chain alkyl radical having 1-6 C atoms
- alkenyl and alkenyl * each independently a straight-chain alkenyl radical having 2 6 C atoms.
- L and L 2 are each independently F, Cl, OCF 3) CF 3 , CH 3>
- both radicals L 1 and L 2 are F or one of the radicals L 1 and L 2 F and the other Cl.
- the compounds of the formula LY are preferably selected from the group consisting of the following sub-formulas
- R 1 has the meaning given above, alkyl
- FK medium which additionally contains one or more compounds selected from the group consisting of the following formulas:
- alkyl Ci-e-alkyl, L x H or F and XF, Cl, OCF 3) OCHF 2 or OCH CF 2 .
- FK medium which additionally contains one or more compounds selected from the group consisting of the following formulas:
- R 5 has one of the meanings given above for R 1 , alkyl Ci-e-alkyl, d is 0 or 1, and z and m are each independently an integer from 1 to 6.
- R 5 in these compounds is particularly preferably C 1-6 -alkyl or -alkoxy or C 2-6 -alkenyl, d is preferably 1.
- the LC medium according to the invention contains one or more compounds of the abovementioned
- Biphenyl compounds selected from the group consisting of the following formulas:
- the proportion of the biphenyls of the formulas B1 to B3 in the LC mixture is preferably at least 3% by weight, in particular> 5% by weight.
- the compounds of the formula B2 are particularly preferred.
- the compounds of the formula B1 to B3 are preferably
- alkyl * is an alkyl radical having 1-6 C atoms.
- the medium according to the invention contains one or more compounds of the formulas B1a and / or B2c.
- Terphenylharmen of the following formula contains: wherein R 5 and R 6 each independently have one of the meanings given above for R 1 and he
- L 5 is F or Cl, preferably F
- L 6 is F, Cl, OCF 3 , CF 3 , CH 3 ( CH 2 F or CHF 2 , preferably F.
- the compounds of formula T are preferably selected from the group consisting of the following sub-formulas
- R is a straight-chain alkyl or alkoxy radical having 1-7 C atoms
- R * is a straight-chain alkenyl radical having 2-7 C atoms
- R is methyl, ethyl, propyl, butyl, pentyl, hexyl, methoxy, ethoxy, propoxy, butoxy or pentoxy.
- the LC medium according to the invention contains the terphenyls of the formulas T and their preferred sub-formulas preferably in an amount of 0.5-30% by weight, in particular of 1-20% by weight.
- R preferably denotes alkyl, furthermore alkoxy in each case with 1-5 C atoms.
- the terphenyls are in inventive
- Preferred mixtures contain 2-20% by weight of one or more terphenyl compounds of the formula T, preferably selected from the group of the compounds T1 to T22. -63-
- R 1 and R 2 have the meanings given above for formula LY, and preferably each independently of one another represent straight-chain alkyl having 1 to 6 C atoms or straight-chain alkenyl having 2 to 6 C atoms.
- Preferred media contain one or more compounds selected from formulas 01, 03 and O4.
- R 9 is H, CH 3, C 2 H 5 or n-C 3 H 7, (F) is an optional fluorine substituent and q is 1, 2 or 3, and R 7 has one of the meanings given for R, preferably in amounts of> 3% by weight, in particular> 5% by weight, and very particularly preferably from 5 to 30% by weight.
- Particularly preferred compounds of formula Fl are selected from the group consisting of the following sub-formulas:
- R 7 is preferably straight-chain alkyl and R 9 is CH 3 , C 2 H 5 or n-C 3 H 7 .
- Particularly preferred are the compounds of the formula FI1, FI2 and FI3.
- FK medium which additionally contains one or more compounds selected from the group consisting of the following formulas:
- Alkyl is a straight-chain alkyl radical having 1-6 C atoms.
- FK medium which additionally contains one or more compounds which are a tetrahydronaphthyl or naphthyl unit
- R 10 and R 11 each independently have one of the meanings given for R 1 for formula LY, preferably straight-chain alkyl or alkoxy having 1 to 6 C atoms or
- FK medium additionally containing one or more difluorodibenzochrome and / or chromans of the following formulas:
- R 10 and R 11 each independently of one another have the meaning given above for R 1 in formula LY, and c denotes 0 or 1, preferably in amounts of from 3 to 20% by weight,
- Particularly preferred compounds of the formulas BC and CR are selected from the group consisting of the following sub-formulas:
- FK medium which additionally contains one or more fluorinated ones
- R 11 and R 12 each independently of one another have the meanings given above for R 1 in formula LY, b is 0 or 1, LF and r is 1, 2 or 3.
- Particularly preferred compounds of the formulas PH and BF are selected from the group consisting of the following sub-formulas:
- R and R ' are each independently straight chain
- Alkyl or alkoxy radical having 1-7 C atoms Alkyl or alkoxy radical having 1-7 C atoms.
- the liquid-crystal mixture according to the invention is dielectrically negative with a dielectric anisotropy ( ⁇ ) of ⁇ -1.5.
- the compounds of formulas IIIA, HIB, IIIC, LY1-LY18, Y1-Y16, T1-T24, Fl, VK1-VK4, N1-N10, BC, CR, PH and BF are useful as a dielectrically negative component.
- the dielectrically negative compounds are selected from the formulas IIIA, HIB and IIIC.
- the LC medium preferably has a ⁇ of -1.5 to -8.0, in particular of -2.5 to -6.0.
- the values of the birefringence ⁇ in the liquid-crystal mixture are generally between 0.07 and 0.16, preferably between 0.08 and 0.12.
- the rotational viscosity ⁇ at 20 ° C before the polymerization is preferably ⁇ 165 mPa-s, in particular ⁇ 140 mPa-s.
- Ring A is 1,4-phenylene or trans-1,4-cyclohexylene
- Each R independently of one another is alkyl having 1 to 9 C atoms or alkenyl having 2 to 9 C atoms, preferably alkenyl having 2 to 9 C atoms, and
- the compounds of the formula II are preferably selected from the group consisting of the following formulas:
- the compounds of the formula III are preferably selected from the group consisting of the following formulas:
- R 3a is preferably H or CH 3 . Particular preference is given to compounds of the formula IIIb;
- LC medium additionally containing one or more compounds selected from the group consisting of the following formulas:
- O- or -O (CO) - may be replaced so that O atoms are not directly linked to one another, and in which also one or more H atoms may be replaced by halogen,
- Y 1 "6 are each independently H or F,
- R ° is preferably straight-chain alkyl or alkenyl, each having up to 6 C atoms.
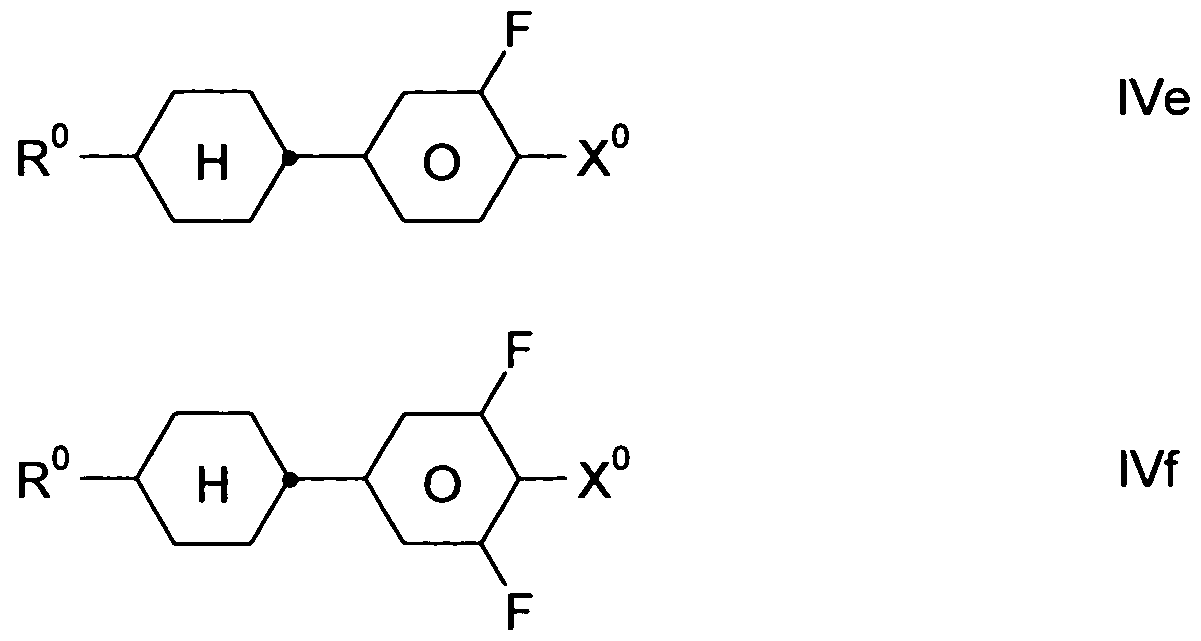
- the compounds of formula IV are preferably selected from the group consisting of the following formulas:
- R ° and X ° have the meanings given above.
- R ° is preferably alkyl or alkenyl.
- X ° is preferably Cl, furthermore F.
- the compounds of formula V are preferably selected from the group consisting of the following formulas:
- R ° and X ° have the meanings given above.
- R ° in formula V is alkyl having 1 to 8 C atoms and X ° F;
- R ° and X ° have the meanings given above.
- R ° in formula VI is alkyl having 1 to 8 C atoms and X ° F, furthermore OCF 3 .
- R ° and X ° have the meanings given above.
- R ° in formula VI is alkyl having 1 to 8 C atoms and X ° F;
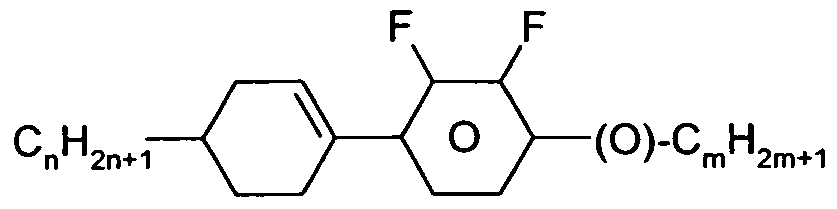
- LC medium which preferably contains one or more compounds of the formula VII in which Z is -CF 2 O-, -CH 2 CH 2 or - (CO) O-, particularly preferably those selected from the group consisting of the following formulas:
- R ° and X ° have the meanings given above.
- R ° in formula VII is alkyl having 1 to 8 C atoms and X ° F, furthermore OCF 3 .
- the compounds of formula VIII are preferably selected from the group consisting of the following formulas: villa
- R ° and X ° have the meanings given above.
- R ° is a straight-chain alkyl radical having 1 to
- X ° is preferably F.
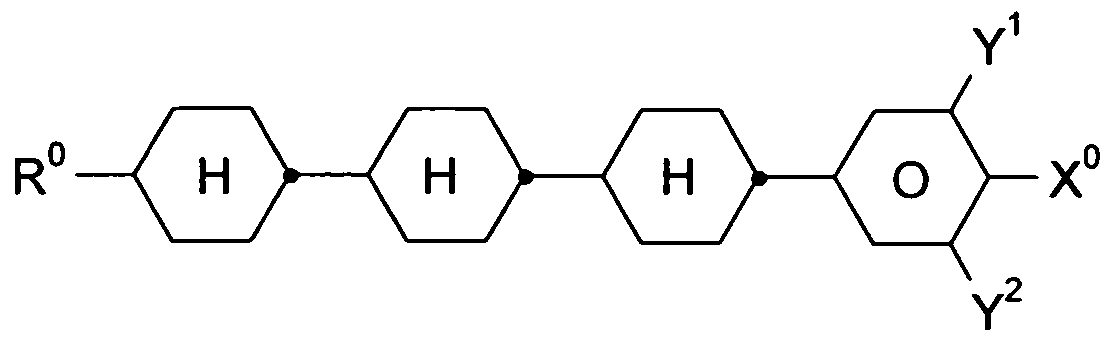
- LC medium which additionally contains one or more compounds of the following formula: wherein R °, X °, Y 1 and Y 2 have the abovementioned meaning, and depending on one another where rings A and B are not both simultaneously cyclohexylene;
- the compounds of formula IX are preferably selected from the group consisting of the following formulas:
- R ° and X ° have the meanings given above.
- R ° is alkyl having 1 to 8 C atoms and X ° F.
- Particular preference is given to compounds of the formula IXa;
- LC medium additionally containing one or more compounds selected from the group consisting of the following formulas:
- the compounds of the formulas X and XI are preferably selected from the group consisting of the following formulas:
- R ° and X ° have the meanings given above.
- R ° is alkyl having 1 to 8 C atoms and / or X ° F.
- Particularly preferred compounds are those in which Y 1 is F and Y 2 is H or F, preferably F;
- LC medium which additionally contains one or more compounds of the following formula XII: wherein R 5 and R 6 are each independently n-alkyl, alkoxy, oxaalkyl, fluoroalkyl or alkenyl each having up to 9 C atoms, and preferably each independently of one another alkyl having 1 to 7 carbon atoms or alkenyl having 2 to 7 C. Atoms mean.
- Y 1 is H or F.
- Preferred compounds of the formula XII are those selected from the group consisting of the following formulas:
- Alkyl and alkyl * each independently a straight-chain alkyl radical having 1 to 6 carbon atoms, and Alkenyl and
- Alkenyl * each independently represent a straight-chain alkenyl radical having 2 to 6 carbon atoms.
- alkyl has the abovementioned meaning and denotes RH or CH 3 .
- LC medium additionally containing one or more compounds selected from the group consisting of the following formulas:
- R ° is alkyl of 1 to 8 carbon atoms and X is F or Cl;
- R ° and X ° have the meanings given above.
- R ° is alkyl having 1 to 8 carbon atoms.
- LC medium which additionally contains one or more compounds of the formula D1 and / or D2:
- R ° is alkyl having 1 to 8 C atoms and X ° F.
- Particular preference is given to compounds of the following formulas:
- R> 0 has the meanings given above and preferably denotes straight-chain alkyl having 1 to 6 C atoms, in particular C 2 H 5> n-C3H 7 or nC 5 Hn.
- Y 1 , R 1 and R 2 have the meaning given above.
- R and R 2 preferably each independently of one another are alkyl having 1 to 8 C atoms.
- Y 1 is preferably F.
- Preferred media contain from 1 to 15% by weight, in particular from 1 to 10% by weight, of these compounds.
- R has the meaning given above and is preferably H
- LC medium which additionally contains one or more tetranuclear compounds selected from the group consisting of
- Formulas XIX to XXV contains:
- Y 1 " , R ° and X ° each independently of one another have one of the meanings given above.
- X ° is preferably F, Cl, CF 3 , OCF 3 or OCHF2.
- R ° is preferably alkyl, alkoxy, oxaalkyl, fluoroalkyl or alkenyl, each having up to 8 carbon atoms.
- R ° is generally preferably straight-chain alkyl or alkenyl having 2 to 7 C atoms
- X ° is preferably F, furthermore OCF 3 , Cl or CF 3 ;
- the medium preferably contains one or more compounds selected from the group of the compounds of the formula II;
- the medium preferably contains one or more compounds selected from the group of the compounds of the formulas VI-2, VI 1-1 a, VIMb, IX, X, XI and XXVI (CF 2 O-bridged compounds); the total content of compounds of the formulas VI-2, VII-1a, VII-1 b, IX, X, XI and XXVI is preferably 35% by weight or more, more preferably 40% by weight or more and most preferably 45% % By weight or more.
- the proportion of compounds of the formulas II-XXVII in the total mixture is preferably from 20 to 99% by weight;
- the medium preferably contains 25-80% by weight, more preferably 30-70% by weight, of compounds of the formula II and / or III;
- the medium preferably contains 20-70% by weight, particularly preferably 25-60% by weight, of compounds of the formula IIa;
- the medium preferably contains 2-25% by weight, more preferably 3-20% by weight, selected from the group of compounds of VI-2;
- the medium contains a total of 2-30 wt.%, Particularly preferably 3- 20 wt.% Of compounds of the formulas XI and XXVII together;
- the medium preferably contains 1-20% by weight, more preferably 2-15% by weight of compounds of formula XXIV;
- the medium contains a total of 15-65 wt.%, Particularly preferably 30-55 wt.% Selected from the highly polar compounds of the formulas VI-2, X, XI and XXV together.
- the nematic phase of the dielectric negative or positive FK medium according to the invention preferably has a nematic phase in a temperature range of from 10 ° C or less to 60 ° C or more, more preferably from 0 or less to 70 ° C or more.
- nV-Vm -CH CH-C m H 2 m + i HH Preferred mixture components are given in Tables A and B. TABLE A
- n, m, z are independently of one another preferably 1, 2, 3, 4, 5 or 6.
- the LC media of the invention contain one or more Compounds selected from the group consisting of compounds of Table A and B.
- Table C lists possible chiral dopants which can be added to the LC media according to the invention.
- the LC media contain from 0 to 10% by weight, in particular from 0.01 to 5% by weight, particularly preferably from 0.1 to 3% by weight, of dopants,
- Table D lists possible stabilizers which can be added to the LC media according to the invention.
- n here denotes an integer from 1 to 12, preferably 1, 2, 3, 4, 5, 6, 7 or 8, terminal methyl groups are not shown).
- the LC media preferably contain 0 to 10% by weight, in particular 1 ppm to 5% by weight, more preferably 1 ppm to 1% by weight
- the LC media contain one or more stabilizers selected from the group consisting of compounds of Table D.
- FK media according to the present invention can be preferably used as polymerizable compounds.
- the mesogenic media contain one or more compounds selected from the group of compounds of Table E.
- the term “compounds”, also written as “compound (s)”, unless explicitly stated otherwise, means both one or more compounds. Conversely, the The term “compound” also generally includes several compounds, if this is possible by definition and not stated otherwise. The same applies to the terms FK media and FK medium.
- the term “component” in each case comprises one or more substances, compounds and / or particles.
- n e extraordinary refractive index at 20 ° C and 589 nm
- n is 0 ordinary refractive index at 20 ° C and 589 nm
- the polymerizable compounds are polymerized in the display or test cell by irradiation with UVA light (usually 365 nm) of a defined intensity for a predetermined time, with optionally a voltage being simultaneously applied to the display (usually 5 to 30 V AC, 1 kHz).
- UVA light usually 365 nm
- a voltage being simultaneously applied to the display (usually 5 to 30 V AC, 1 kHz).
- a mercury vapor lamp with 100 mW / cm 2 is used, the intensity with a standard UV meter (manufactured by Ushio UNI meter) equipped with a band pass filter at 320 nm or 340 nm
- the compounds used are synthesized according to standard laboratory procedures.
- the FK media come from Merck KGaA, Germany.
- the self-oriented, long-chain alcohols and amines used are commercially available and may be cleaned before use.
- liquid-crystalline mixtures consisting of low molecular weight
- the FK medium has a spontaneous homeotropic (vertical)
- the VA cell can be reversibly switched between crossed polarizers by applying a voltage between 0 and 30 V.
- the resulting mixture is filled into a two-domain test cell (without polyimide orientation layer, layer thickness d 4.0 ⁇ , glass substrate, both sides structured ITO coating (10 ⁇ slit width), without passivation layer).
- the FK medium has a spontaneous homeotropic (vertical) orientation to the substrate surfaces. This orientation remains stable up to 40 ° C. In the temperature-stable range, the VA cell can be reversibly switched between crossed polarizers by applying a voltage between 0 and 30 V.
- test cells without preorientation layer ('alignment layer'):
- the FK medium has a spontaneous homeotropic (vertical) orientation to the substrate surfaces.
- VA cell Preoriented layer filled.
- the resulting orientation (homeotropic (vertical) or planar) to the substrate surfaces is given in Table 3.
- the VA cell In the temperature-stable range, the VA cell can be
- nematic FK medium M1 ( ⁇ ⁇ 0) according to Table 1, a polymerizable compound (RM-1, 0.5 wt.%) And a self-orienting compound according to Tables 5.a and 5.b are added and homogenized.
- the FK medium has a spontaneous
- Threshold voltage the cell is irradiated for 15 min with UV light of intensity 100 mW / cm 2 at 40 ° C. As a result, polymerization of the monomeric, polymerizable compound takes place.
- PSA-VA cell can be reversibly switched to 70 ° C while applying a voltage between 0 and 30 V.
- the Switching times are shortened compared to the unpolymerized examples.
- the FK medium (10 ⁇ slit width), without passivation layer).
- the FK medium has a spontaneous homeotropic (vertical) orientation to the
- the homeotropic orientation is thus additionally stabilized and a prefilter is set.
- the resulting PSA-VA cell can be up to 70 ° C.
- the switching times are, compared to the unpolymerized ones
- the LC media of Mixing Examples 1, 6, 19-21 are filled into mono- and two-domain test cells.
- the cells with homeotropic orientation can be switched reversibly.
Abstract
Description
Claims
Priority Applications (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP12700775.5A EP2670818B1 (de) | 2011-02-05 | 2012-01-09 | Flüssigkristallanzeigen mit homöotroper ausrichtung |
| KR1020137023414A KR101926207B1 (ko) | 2011-02-05 | 2012-01-09 | 호메오트로픽 정렬을 갖는 액정 디스플레이 |
| JP2013552125A JP6377908B2 (ja) | 2011-02-05 | 2012-01-09 | ホメオトロピック配向を有する液晶ディスプレイ |
| CN201280007427.3A CN103492531B (zh) | 2011-02-05 | 2012-01-09 | 具有垂面取向的液晶显示器 |
| US13/983,312 US9249355B2 (en) | 2011-02-05 | 2012-01-09 | Liquid-crystal displays having homeotropic alignment |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE102011010380 | 2011-02-05 | ||
| DE102011010380.5 | 2011-02-05 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2012104008A1 true WO2012104008A1 (de) | 2012-08-09 |
Family
ID=45524500
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/EP2012/000068 WO2012104008A1 (de) | 2011-02-05 | 2012-01-09 | Flüssigkristallanzeigen mit homöotroper ausrichtung |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US9249355B2 (de) |
| EP (1) | EP2670818B1 (de) |
| JP (1) | JP6377908B2 (de) |
| KR (1) | KR101926207B1 (de) |
| CN (1) | CN103492531B (de) |
| DE (1) | DE102012000632A1 (de) |
| TW (1) | TWI592469B (de) |
| WO (1) | WO2012104008A1 (de) |
Cited By (32)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2016170948A1 (ja) * | 2015-04-23 | 2016-10-27 | Jnc株式会社 | 液晶組成物および液晶表示素子 |
| WO2017068875A1 (ja) * | 2015-10-23 | 2017-04-27 | Jnc株式会社 | 液晶組成物および液晶表示素子 |
| WO2017082062A1 (ja) * | 2015-11-10 | 2017-05-18 | Dic株式会社 | ネマチック液晶組成物及びこれを用いた液晶表示素子 |
| WO2017102053A2 (en) | 2015-12-17 | 2017-06-22 | Merck Patent Gmbh | Cinnamic acid derivatives |
| WO2017209161A1 (ja) | 2016-06-03 | 2017-12-07 | Jnc株式会社 | 重合性極性化合物、液晶組成物、および液晶表示素子 |
| US9850428B2 (en) | 2014-11-27 | 2017-12-26 | Jnc Corporation | Compound having poly (difluoromethylene) chain, liquid crystal composition and liquid crystal display device |
| WO2018025460A1 (ja) * | 2016-08-05 | 2018-02-08 | Jnc株式会社 | 重合性極性化合物、液晶組成物および液晶表示素子 |
| KR20180037292A (ko) | 2015-12-17 | 2018-04-11 | 제이엔씨 주식회사 | 액정 조성물 및 액정 표시 소자 |
| KR20180090257A (ko) | 2015-12-08 | 2018-08-10 | 제이엔씨 주식회사 | 액정 조성물 및 액정 표시 소자 |
| KR20190024868A (ko) | 2016-06-28 | 2019-03-08 | 제이엔씨 주식회사 | 액정 표시 소자의 제조 방법 및액정 표시 소자 |
| WO2019111845A1 (ja) | 2017-12-05 | 2019-06-13 | Jnc株式会社 | 重合性極性化合物、液晶組成物、および液晶表示素子 |
| US10392339B2 (en) | 2015-02-09 | 2019-08-27 | Jnc Corporation | Polymerizable polar compound, liquid crystal composition, and liquid crystal display element |
| WO2019206791A1 (en) | 2018-04-23 | 2019-10-31 | Merck Patent Gmbh | Liquid crystal mixture and liquid crystal display |
| WO2019206788A1 (en) | 2018-04-23 | 2019-10-31 | Merck Patent Gmbh | Liquid crystal mixture and liquid crystal display |
| WO2019206789A1 (en) | 2018-04-23 | 2019-10-31 | Merck Patent Gmbh | Liquid crystal mixture and liquid crystal display |
| WO2019206787A1 (en) | 2018-04-23 | 2019-10-31 | Merck Patent Gmbh | Liquid crystal mixture and liquid crystal display |
| US10538705B2 (en) | 2016-12-13 | 2020-01-21 | Jnc Corporation | Liquid crystal composition and liquid crystal display device |
| WO2020038861A1 (en) | 2018-08-22 | 2020-02-27 | Merck Patent Gmbh | Liquid crystal mixture and liquid crystal display |
| WO2020038859A1 (en) | 2018-08-22 | 2020-02-27 | Merck Patent Gmbh | Liquid crystal mixture and liquid crystal display |
| WO2020043643A1 (en) | 2018-08-28 | 2020-03-05 | Merck Patent Gmbh | Liquid crystal mixture and liquid crystal display |
| WO2020074440A1 (en) | 2018-10-10 | 2020-04-16 | Merck Patent Gmbh | Liquid crystal mixture and liquid crystal display |
| US10662379B2 (en) | 2015-07-17 | 2020-05-26 | Jnc Corporation | Polymerizable polar compound, liquid crystal composition and liquid crystal display device |
| EP3656757A1 (de) | 2015-01-14 | 2020-05-27 | JNC Corporation | Verbindung mit polymerisierbarer gruppe, flüssigkristallzusammensetzung und flüssigkristallanzeigeelement |
| WO2020120371A2 (en) | 2018-12-12 | 2020-06-18 | Merck Patent Gmbh | Liquid crystal mixture and liquid crystal display |
| US10689576B2 (en) | 2015-07-23 | 2020-06-23 | Jnc Corporation | Liquid crystal composition and liquid crystal display device |
| US10761374B2 (en) | 2018-02-23 | 2020-09-01 | Samsung Display Co., Ltd. | Liquid crystal display including protrusions in a liquid crystal layer |
| WO2020245084A1 (en) | 2019-06-04 | 2020-12-10 | Merck Patent Gmbh | Liquid crystal mixture and liquid crystal display |
| EP3792334A1 (de) | 2019-09-16 | 2021-03-17 | Merck Patent GmbH | Flüssigkristallmischung und flüssigkristallanzeige |
| WO2021160633A1 (en) | 2020-02-13 | 2021-08-19 | Merck Patent Gmbh | Liquid crystal device |
| WO2021160705A1 (en) | 2020-02-13 | 2021-08-19 | Merck Patent Gmbh | Liquid crystal devive |
| EP4012004A1 (de) | 2020-12-11 | 2022-06-15 | Merck Patent GmbH | Flüssigkristallvorrichtung |
| WO2022122780A1 (en) | 2020-12-11 | 2022-06-16 | Merck Patent Gmbh | Liquid crystal mixture and liquid crystal display |
Families Citing this family (51)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR102082361B1 (ko) | 2011-07-07 | 2020-04-14 | 메르크 파텐트 게엠베하 | 액정 매질 |
| KR101386088B1 (ko) | 2012-09-20 | 2014-04-16 | 디아이씨 가부시끼가이샤 | 액정 표시 장치 |
| US9193906B2 (en) | 2012-10-03 | 2015-11-24 | Dic Corporation | Liquid crystal display device |
| TWI476270B (zh) * | 2012-10-04 | 2015-03-11 | Dainippon Ink & Chemicals | 液晶顯示裝置 |
| TWI468498B (zh) * | 2012-10-19 | 2015-01-11 | Dainippon Ink & Chemicals | 液晶顯示裝置 |
| CN107312552A (zh) | 2013-07-03 | 2017-11-03 | 捷恩智株式会社 | 液晶组合物及其用途、以及液晶显示元件 |
| WO2015025604A1 (ja) * | 2013-08-20 | 2015-02-26 | Jnc株式会社 | 液晶組成物および液晶表示素子 |
| EP2983037B1 (de) | 2013-09-24 | 2018-05-09 | DIC Corporation | Flüssigkristallanzeige |
| EP3730590A1 (de) | 2014-03-10 | 2020-10-28 | Merck Patent GmbH | Flüssigkristalline medien mit homöotroper ausrichtung |
| JP2015205982A (ja) * | 2014-04-18 | 2015-11-19 | Jnc株式会社 | 液晶組成物および液晶表示素子 |
| KR101607479B1 (ko) * | 2014-06-10 | 2016-03-30 | 명지대학교 산학협력단 | 액정 배향층, 이를 이용한 액정표시소자 및 이의 제조방법 |
| KR102452385B1 (ko) * | 2014-07-28 | 2022-10-07 | 메르크 파텐트 게엠베하 | 호메오트로픽 정렬을 갖는 액정 매질 |
| EP2985334B1 (de) * | 2014-08-15 | 2018-06-20 | Merck Patent GmbH | Flüssigkristallines medium |
| US10330981B2 (en) * | 2014-11-11 | 2019-06-25 | Samsung Display Co., Ltd. | Liquid crystal display device |
| KR102325210B1 (ko) * | 2014-11-11 | 2021-11-12 | 삼성디스플레이 주식회사 | 액정 표시 장치 |
| CN104503169B (zh) * | 2014-11-21 | 2018-03-06 | 深圳市华星光电技术有限公司 | 垂直配向型液晶显示器 |
| WO2016116119A1 (en) * | 2015-01-19 | 2016-07-28 | Merck Patent Gmbh | Polymerisable compounds and the use thereof in liquid-crystal displays |
| JP6729395B2 (ja) * | 2015-01-20 | 2020-07-22 | Jnc株式会社 | 液晶組成物および液晶表示素子 |
| EP3067405B1 (de) * | 2015-03-10 | 2019-03-27 | Merck Patent GmbH | Flüssigkristallines medium |
| KR20160113423A (ko) * | 2015-03-19 | 2016-09-29 | 삼성디스플레이 주식회사 | 액정 표시 장치 |
| US10647921B2 (en) | 2015-03-24 | 2020-05-12 | Jnc Corporation | Liquid crystal composition and liquid crystal display device |
| CN104845644B (zh) * | 2015-05-27 | 2017-03-15 | 深圳市华星光电技术有限公司 | 一种液晶介质组合物 |
| WO2016204066A1 (ja) * | 2015-06-19 | 2016-12-22 | Dic株式会社 | 液晶表示素子及びその製造方法 |
| EP3112441B1 (de) * | 2015-07-03 | 2020-04-08 | Merck Patent GmbH | Flüssigkristallines medium und flüssigkristallanzeige |
| CN104965359B (zh) * | 2015-07-20 | 2017-12-29 | 深圳市华星光电技术有限公司 | 多重稳态液晶显示面板 |
| EP3347434B1 (de) * | 2015-09-09 | 2023-03-29 | Merck Patent GmbH | Flüssigkristallines medium |
| TWI744235B (zh) * | 2015-09-15 | 2021-11-01 | 日商捷恩智股份有限公司 | 聚合性極性化合物、液晶組成物及液晶顯示元件 |
| US10385269B2 (en) | 2015-12-21 | 2019-08-20 | Jnc Corporation | Liquid crystal composition and liquid crystal display device |
| JP2017115122A (ja) * | 2015-12-21 | 2017-06-29 | Jnc株式会社 | 液晶組成物および液晶表示素子 |
| US10190050B2 (en) * | 2016-01-21 | 2019-01-29 | Samsung Display Co., Ltd. | Liquid crystal composition, liquid crystal display device including the same, and method of manufacturing liquid crystal display device |
| KR20180103856A (ko) * | 2016-01-29 | 2018-09-19 | 제이엔씨 주식회사 | 액정 조성물 및 액정 표시 소자 |
| CN105542796A (zh) * | 2016-02-01 | 2016-05-04 | 深圳市华星光电技术有限公司 | 自取向液晶介质组合物及液晶显示面板 |
| CN105785638A (zh) * | 2016-05-09 | 2016-07-20 | 深圳市华星光电技术有限公司 | Lcd显示器 |
| JP6587033B2 (ja) * | 2016-05-18 | 2019-10-09 | Jnc株式会社 | 液晶媒体をホモジニアス配向させる低分子極性化合物を含む液晶媒体を含有する液晶表示素子 |
| JP6683253B2 (ja) | 2016-05-18 | 2020-04-15 | Jnc株式会社 | 液晶媒体をホモジニアス配向させる低分子極性化合物、およびそれを含有する液晶媒体 |
| CN109153916A (zh) * | 2016-06-03 | 2019-01-04 | Dic株式会社 | 用于液晶组合物的自发取向助剂、适于该自发取向助剂的化合物、液晶组合物、及液晶显示元件 |
| US20210214615A1 (en) * | 2016-08-03 | 2021-07-15 | Jnc Corporation | Liquid crystal display device and display unit |
| TWI737834B (zh) * | 2016-10-26 | 2021-09-01 | 日商迪愛生股份有限公司 | 液晶組成物用自發配向助劑 |
| KR20180051726A (ko) | 2016-11-08 | 2018-05-17 | 삼성디스플레이 주식회사 | 액정 표시 장치 |
| EP3553595A1 (de) | 2016-12-08 | 2019-10-16 | JNC Corporation | Reverse-modus-flüssigkristallvorrichtung |
| CN106833677A (zh) | 2016-12-29 | 2017-06-13 | 深圳市华星光电技术有限公司 | 一种垂直取向剂材料 |
| CN106753428A (zh) | 2016-12-30 | 2017-05-31 | 深圳市华星光电技术有限公司 | 一种反式pdlc液晶材料组合物、基板及显示器 |
| CN107463029B (zh) * | 2017-08-25 | 2020-11-24 | 深圳市华星光电技术有限公司 | 自取向液晶显示面板及其制作方法 |
| KR20200041880A (ko) * | 2017-09-08 | 2020-04-22 | 디아이씨 가부시끼가이샤 | 배향 조제, 액정 조성물 및 액정 표시 소자 |
| JP2019073675A (ja) * | 2017-10-12 | 2019-05-16 | Jnc株式会社 | 液晶組成物および液晶表示素子 |
| KR20190047160A (ko) | 2017-10-25 | 2019-05-08 | 삼성디스플레이 주식회사 | 액정 조성물 및 이를 포함하는 표시 장치 |
| CN108410475A (zh) | 2018-03-01 | 2018-08-17 | 深圳市华星光电半导体显示技术有限公司 | 一种液晶材料及液晶显示面板 |
| CN110229679B (zh) * | 2018-03-06 | 2020-11-17 | 北京八亿时空液晶科技股份有限公司 | 一种液晶介质的自配向添加剂及其制备方法与应用 |
| JP7131048B2 (ja) * | 2018-04-20 | 2022-09-06 | Jnc株式会社 | 液晶組成物および液晶表示素子 |
| WO2019220673A1 (ja) * | 2018-05-15 | 2019-11-21 | Jnc株式会社 | 化合物、液晶組成物、および液晶表示素子 |
| CN110964539B (zh) * | 2018-09-28 | 2022-10-14 | 石家庄诚志永华显示材料有限公司 | 液晶组合物、高分子液晶配向聚合物、液晶显示元件、液晶显示器 |
Citations (26)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE2356889A1 (de) | 1972-11-15 | 1974-05-30 | Matsushita Electric Ind Co Ltd | Auf der basis fluessiger kristalle arbeitendes sichtgeraet |
| US3848966A (en) | 1973-10-15 | 1974-11-19 | Gen Motors Corp | Homeotropic alignment additive for liquid crystals |
| US3972589A (en) | 1972-06-23 | 1976-08-03 | General Electric Company | Nematic liquid crystal mixtures with stable homeotropic boundary conditions and methods of making the same |
| US4022934A (en) | 1975-04-21 | 1977-05-10 | Hughes Aircraft Company | Means for inducing perpendicular alignment of a nematic liquid crystal on a coated substrate |
| DE4000451A1 (de) | 1990-01-09 | 1991-07-11 | Fraunhofer Ges Forschung | Elektrooptisches fluessigkristallschaltelement |
| EP0588568A2 (de) | 1992-09-18 | 1994-03-23 | Hitachi, Ltd. | Flüssigkristall-Anzeigevorrichtung |
| JPH07181439A (ja) | 1993-12-24 | 1995-07-21 | Hitachi Ltd | アクティブマトリクス型液晶表示装置 |
| EP0667555A1 (de) | 1994-02-14 | 1995-08-16 | Hitachi, Ltd. | Flüssigkristall-Anzeigevorrichtung mit aktiver Matrix |
| EP0673986A2 (de) | 1994-03-17 | 1995-09-27 | Hitachi, Ltd. | Flüssigkristallanzeigegerät mit aktiver Matrix |
| DE19528106A1 (de) | 1995-02-03 | 1996-08-08 | Merck Patent Gmbh | Elektrooptische Flüssigkristallanzeige |
| WO1996023851A1 (de) | 1995-02-03 | 1996-08-08 | Merck Patent Gmbh | Elektrooptische flüssigkristallanzeige |
| DE19509410A1 (de) | 1995-03-15 | 1996-09-19 | Merck Patent Gmbh | Elektrooptische Flüssigkristallanzeige |
| DE19528107A1 (de) | 1995-03-17 | 1996-09-19 | Merck Patent Gmbh | Elektrooptische Flüssigkristallanzeige |
| JPH1036847A (ja) | 1996-07-25 | 1998-02-10 | Seiko Epson Corp | 液晶表示素子およびその製造方法 |
| US6177972B1 (en) | 1999-02-04 | 2001-01-23 | International Business Machines Corporation | Polymer stabilized in-plane switched LCD |
| EP1170626A2 (de) | 2000-07-07 | 2002-01-09 | Fujitsu Limited | Flüssigkristallanzeigevorrichtung und zugehöriges Herstellungsverfahren |
| WO2002068562A2 (en) * | 2001-02-21 | 2002-09-06 | The Procter & Gamble Company | Functionalized cubic liquid crystalline phase materials and methods for their preparation and use |
| EP1378557A1 (de) | 2002-07-06 | 2004-01-07 | MERCK PATENT GmbH | Flüssigkristallines Medium |
| US20040191428A1 (en) | 2003-03-26 | 2004-09-30 | Fujitsu Display Technologies Corporation | Liquid crystal panel |
| US20060066793A1 (en) | 2004-09-24 | 2006-03-30 | Fujitsu Display Technologies Corporation | Liquid crystal display device |
| US20060103804A1 (en) | 2004-11-12 | 2006-05-18 | Sharp Kabushiki Kaisha | Liquid crystal display device and method of manufacture of the same |
| US7169449B2 (en) | 2002-04-16 | 2007-01-30 | Sharp Kabushiki Kaisha | Liquid crystal display device |
| EP1813287A1 (de) * | 2004-10-19 | 2007-08-01 | National Institute of Advanced Industrial Science and Technology | Typ ii kubische flüssigkristallzusammensetzung |
| US20080198301A1 (en) | 2007-02-16 | 2008-08-21 | Industrial Technology Research Institute | Liquid crystal device |
| WO2009066947A2 (en) * | 2007-11-23 | 2009-05-28 | Lg Chem, Ltd. | Polymerizable liquid crystal composition, homeotropic alignment liquid crystal film made from the compostion and method for preparing the same |
| WO2010089092A1 (de) | 2009-02-06 | 2010-08-12 | Merck Patent Gmbh | Flüssigkristallines medium und flüssigkristallanzeige |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5223349B2 (de) * | 1972-11-17 | 1977-06-23 | ||
| US3981816A (en) * | 1972-11-15 | 1976-09-21 | Matsushita Electric Industrial Co., Ltd. | Liquid crystal display device |
| JPS5529556A (en) * | 1978-08-22 | 1980-03-01 | Matsushita Electric Ind Co Ltd | Dynamic scattering liquid crystal display |
| US5576867A (en) * | 1990-01-09 | 1996-11-19 | Merck Patent Gesellschaft Mit Beschrankter Haftung | Liquid crystal switching elements having a parallel electric field and βo which is not 0° or 90° |
| US7077984B1 (en) * | 1996-07-12 | 2006-07-18 | Science Applications International Corporation | Electrically switchable polymer-dispersed liquid crystal materials |
| US7075613B2 (en) * | 2002-08-16 | 2006-07-11 | Kent State University | Electro-optical display with in-situ polymerized columns providing alignment and structural bond between substrate |
| JP2006276643A (ja) * | 2005-03-30 | 2006-10-12 | Fuji Photo Film Co Ltd | 位相差膜、液晶表示装置および化合物 |
-
2012
- 2012-01-09 EP EP12700775.5A patent/EP2670818B1/de active Active
- 2012-01-09 US US13/983,312 patent/US9249355B2/en not_active Expired - Fee Related
- 2012-01-09 JP JP2013552125A patent/JP6377908B2/ja not_active Expired - Fee Related
- 2012-01-09 WO PCT/EP2012/000068 patent/WO2012104008A1/de active Application Filing
- 2012-01-09 CN CN201280007427.3A patent/CN103492531B/zh active Active
- 2012-01-09 KR KR1020137023414A patent/KR101926207B1/ko active IP Right Grant
- 2012-01-14 DE DE201210000632 patent/DE102012000632A1/de not_active Withdrawn
- 2012-02-03 TW TW101103592A patent/TWI592469B/zh active
Patent Citations (28)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3972589A (en) | 1972-06-23 | 1976-08-03 | General Electric Company | Nematic liquid crystal mixtures with stable homeotropic boundary conditions and methods of making the same |
| DE2356889A1 (de) | 1972-11-15 | 1974-05-30 | Matsushita Electric Ind Co Ltd | Auf der basis fluessiger kristalle arbeitendes sichtgeraet |
| US3848966A (en) | 1973-10-15 | 1974-11-19 | Gen Motors Corp | Homeotropic alignment additive for liquid crystals |
| US4022934A (en) | 1975-04-21 | 1977-05-10 | Hughes Aircraft Company | Means for inducing perpendicular alignment of a nematic liquid crystal on a coated substrate |
| DE4000451A1 (de) | 1990-01-09 | 1991-07-11 | Fraunhofer Ges Forschung | Elektrooptisches fluessigkristallschaltelement |
| EP0588568A2 (de) | 1992-09-18 | 1994-03-23 | Hitachi, Ltd. | Flüssigkristall-Anzeigevorrichtung |
| JPH07181439A (ja) | 1993-12-24 | 1995-07-21 | Hitachi Ltd | アクティブマトリクス型液晶表示装置 |
| EP0667555A1 (de) | 1994-02-14 | 1995-08-16 | Hitachi, Ltd. | Flüssigkristall-Anzeigevorrichtung mit aktiver Matrix |
| EP0673986A2 (de) | 1994-03-17 | 1995-09-27 | Hitachi, Ltd. | Flüssigkristallanzeigegerät mit aktiver Matrix |
| DE19528106A1 (de) | 1995-02-03 | 1996-08-08 | Merck Patent Gmbh | Elektrooptische Flüssigkristallanzeige |
| WO1996023851A1 (de) | 1995-02-03 | 1996-08-08 | Merck Patent Gmbh | Elektrooptische flüssigkristallanzeige |
| DE19509410A1 (de) | 1995-03-15 | 1996-09-19 | Merck Patent Gmbh | Elektrooptische Flüssigkristallanzeige |
| WO1996028521A1 (de) | 1995-03-15 | 1996-09-19 | Merck Patent Gmbh | Elektrooptische flüssigkristallanzeige |
| DE19528107A1 (de) | 1995-03-17 | 1996-09-19 | Merck Patent Gmbh | Elektrooptische Flüssigkristallanzeige |
| JPH1036847A (ja) | 1996-07-25 | 1998-02-10 | Seiko Epson Corp | 液晶表示素子およびその製造方法 |
| US6177972B1 (en) | 1999-02-04 | 2001-01-23 | International Business Machines Corporation | Polymer stabilized in-plane switched LCD |
| EP1170626A2 (de) | 2000-07-07 | 2002-01-09 | Fujitsu Limited | Flüssigkristallanzeigevorrichtung und zugehöriges Herstellungsverfahren |
| WO2002068562A2 (en) * | 2001-02-21 | 2002-09-06 | The Procter & Gamble Company | Functionalized cubic liquid crystalline phase materials and methods for their preparation and use |
| US7169449B2 (en) | 2002-04-16 | 2007-01-30 | Sharp Kabushiki Kaisha | Liquid crystal display device |
| EP1378557A1 (de) | 2002-07-06 | 2004-01-07 | MERCK PATENT GmbH | Flüssigkristallines Medium |
| US6861107B2 (en) | 2002-07-06 | 2005-03-01 | Merck Patent Gmbh | Liquid-crystalline medium |
| US20040191428A1 (en) | 2003-03-26 | 2004-09-30 | Fujitsu Display Technologies Corporation | Liquid crystal panel |
| US20060066793A1 (en) | 2004-09-24 | 2006-03-30 | Fujitsu Display Technologies Corporation | Liquid crystal display device |
| EP1813287A1 (de) * | 2004-10-19 | 2007-08-01 | National Institute of Advanced Industrial Science and Technology | Typ ii kubische flüssigkristallzusammensetzung |
| US20060103804A1 (en) | 2004-11-12 | 2006-05-18 | Sharp Kabushiki Kaisha | Liquid crystal display device and method of manufacture of the same |
| US20080198301A1 (en) | 2007-02-16 | 2008-08-21 | Industrial Technology Research Institute | Liquid crystal device |
| WO2009066947A2 (en) * | 2007-11-23 | 2009-05-28 | Lg Chem, Ltd. | Polymerizable liquid crystal composition, homeotropic alignment liquid crystal film made from the compostion and method for preparing the same |
| WO2010089092A1 (de) | 2009-02-06 | 2010-08-12 | Merck Patent Gmbh | Flüssigkristallines medium und flüssigkristallanzeige |
Non-Patent Citations (26)
| Title |
|---|
| "Merck Liquid Crystals, Physical Properties of Liquid Crystals", November 1997, MERCK KGAA |
| ABEYGUNARATNE S ET AL: "TILTED SUPRAMOLECULAR STRUCTURES OF AMPHIPHILIC GLYCOLIPIDS IN STRAIGHT-CORE SMECTIC C LIQUID CRYSTALS", LIQUID CRYSTALS: AN INTERNATIONAL JOURNAL OF SCIENCE AND TECHNOLOGY, TAYLOR & FRANCIS, GB, vol. 34, no. 4, 1 April 2007 (2007-04-01), pages 441 - 445, XP001540575, ISSN: 0267-8292, DOI: 10.1080/02678290701223939 * |
| APPL. PHYS. LETT., vol. 75, no. 21, 1999, pages 3264 |
| G. LABRUNIE; J. ROBERT, J. APPL. PHYS., vol. 44, 1973, pages 4869 |
| H. SCHAD, SID 82 DIGEST TECHN. PAPERS, 1982, pages 244 |
| H.Y. GIM ET AL., SID, 2010, pages 128 |
| J. DUCHENE, DISPLAYS, vol. 7, 1986, pages 3 |
| J. ROBERT; F. CLERC, SID 80 DIGEST TECHN. PAPERS, 1980, pages 30 |
| J.F. KAHN, APPL. PHYS. LETT., vol. 20, 1972, pages 1193 |
| K.S. HUN ET AL., J. APPL. PHYS., vol. 104, 2008, pages 084515 |
| KIM, HYEON KYEONG ET AL.: "SID 2004 International Symposium, Digest of Technical Papers", vol. XXXV, article "Vortrag 9.1: ''A 57-in. Wide UXGA TFT-LCD for HDTV Application", pages: 106 - 109 |
| KIM, SANG SOO: "SID 2004 International Symposium, Digest of Technical Papers", vol. XXXV, article "Super PVA Sets New State-of-the-Art for LCD-TV", pages: 760 - 763 |
| LIU, C.T. ET AL.: "SID 2004 International Symposium, Digest of Technical Papers", vol. XXXV, article "A 46-inch TFT-LCD HDTV Technology ..", pages: 750 - 753 |
| M. JIAO ET AL., APP. PHYS. LETT, vol. 92, 2008, pages 111101 |
| M.F. SCHIECKEL; K. FAHRENSCHON: "Deformation of nematic liquid crystals with vertical orientation in electrical fields", APPL. PHYS. LETT., vol. 19, 1971, pages 3912 |
| MILLER, LAN: "SIDSeminar 2004", article "LCD-Television", pages: M-7,1 - M-7,32 |
| OPTICS EXPRESS, vol. 12, no. 7, 2004, pages 1221 |
| S. H. KIM; L.-C- CHIEN, JPN. J. APPL. PHYS., vol. 43, 2004, pages 7643 - 7647 |
| S.H. LEE ET AL., APPL. PHYS. LETT., vol. 71, 1997, pages 2851 - 2853 |
| SHIE-CHANG JENG ET AL., OPTICS LETTERS, vol. 34, 2009, pages 455 - 457 |
| SHIGETA; MITZUHIRO; FUKUOKA; HIROFUMI: "SID 2004 International Symposium, Digest of Technical Papers", vol. XXXV, article "Development of High Quality LCDTV", pages: 754 - 757 |
| SOUK; JUN: "SIDSeminar 2004, Seminar M-6", article "Recent Advances in LCD Technology", pages: M-6,1 - M-6,26 |
| T.-J- CHEN ET AL., JPN. J. APPL. PHYS., vol. 45, 2006, pages 2702 - 2704 |
| Y.T. KIM ET AL., JAP. J. APP. PHYS., vol. 48, 2009, pages 110205 |
| YEO, S.D.: "SID 2004 International Symposium, Digest of Technical Papers, XXXV", article "A LC Display for the TV Application", pages: 758,759 |
| YOSHIDE, H. ET AL.: "SID 2004 International Symposium, Digest of Technical Papers", vol. XXXV, 2004, article "MVA LCD for Notebook or Mobile PCs ..", pages: 6 - 9 |
Cited By (40)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9850428B2 (en) | 2014-11-27 | 2017-12-26 | Jnc Corporation | Compound having poly (difluoromethylene) chain, liquid crystal composition and liquid crystal display device |
| EP3656757A1 (de) | 2015-01-14 | 2020-05-27 | JNC Corporation | Verbindung mit polymerisierbarer gruppe, flüssigkristallzusammensetzung und flüssigkristallanzeigeelement |
| US10392339B2 (en) | 2015-02-09 | 2019-08-27 | Jnc Corporation | Polymerizable polar compound, liquid crystal composition, and liquid crystal display element |
| US10479940B2 (en) | 2015-04-23 | 2019-11-19 | Jnc Corporation | Liquid crystal composition and liquid crystal display device |
| WO2016170948A1 (ja) * | 2015-04-23 | 2016-10-27 | Jnc株式会社 | 液晶組成物および液晶表示素子 |
| US10662379B2 (en) | 2015-07-17 | 2020-05-26 | Jnc Corporation | Polymerizable polar compound, liquid crystal composition and liquid crystal display device |
| US10689576B2 (en) | 2015-07-23 | 2020-06-23 | Jnc Corporation | Liquid crystal composition and liquid crystal display device |
| WO2017068875A1 (ja) * | 2015-10-23 | 2017-04-27 | Jnc株式会社 | 液晶組成物および液晶表示素子 |
| JPWO2017082062A1 (ja) * | 2015-11-10 | 2018-03-08 | Dic株式会社 | ネマチック液晶組成物及びこれを用いた液晶表示素子 |
| WO2017082062A1 (ja) * | 2015-11-10 | 2017-05-18 | Dic株式会社 | ネマチック液晶組成物及びこれを用いた液晶表示素子 |
| KR20180090257A (ko) | 2015-12-08 | 2018-08-10 | 제이엔씨 주식회사 | 액정 조성물 및 액정 표시 소자 |
| WO2017102053A3 (en) * | 2015-12-17 | 2017-08-24 | Merck Patent Gmbh | Cinnamic acid derivatives |
| KR20180037292A (ko) | 2015-12-17 | 2018-04-11 | 제이엔씨 주식회사 | 액정 조성물 및 액정 표시 소자 |
| US10465115B2 (en) | 2015-12-17 | 2019-11-05 | Merck Patent Gmbh | Cinnamic acid derivatives |
| WO2017102053A2 (en) | 2015-12-17 | 2017-06-22 | Merck Patent Gmbh | Cinnamic acid derivatives |
| US10442992B2 (en) | 2015-12-17 | 2019-10-15 | Jnc Corporation | Liquid crystal composition and liquid crystal display device |
| WO2017209161A1 (ja) | 2016-06-03 | 2017-12-07 | Jnc株式会社 | 重合性極性化合物、液晶組成物、および液晶表示素子 |
| KR20190024868A (ko) | 2016-06-28 | 2019-03-08 | 제이엔씨 주식회사 | 액정 표시 소자의 제조 방법 및액정 표시 소자 |
| US10428275B2 (en) | 2016-06-28 | 2019-10-01 | Jnc Corporation | Method for manufacturing liquid crystal display device and liquid crystal display device |
| KR20190039160A (ko) | 2016-08-05 | 2019-04-10 | 제이엔씨 주식회사 | 중합성 극성 화합물, 액정 조성물 및 액정 표시 소자 |
| WO2018025460A1 (ja) * | 2016-08-05 | 2018-02-08 | Jnc株式会社 | 重合性極性化合物、液晶組成物および液晶表示素子 |
| US10538705B2 (en) | 2016-12-13 | 2020-01-21 | Jnc Corporation | Liquid crystal composition and liquid crystal display device |
| WO2019111845A1 (ja) | 2017-12-05 | 2019-06-13 | Jnc株式会社 | 重合性極性化合物、液晶組成物、および液晶表示素子 |
| US10761374B2 (en) | 2018-02-23 | 2020-09-01 | Samsung Display Co., Ltd. | Liquid crystal display including protrusions in a liquid crystal layer |
| WO2019206787A1 (en) | 2018-04-23 | 2019-10-31 | Merck Patent Gmbh | Liquid crystal mixture and liquid crystal display |
| WO2019206789A1 (en) | 2018-04-23 | 2019-10-31 | Merck Patent Gmbh | Liquid crystal mixture and liquid crystal display |
| WO2019206791A1 (en) | 2018-04-23 | 2019-10-31 | Merck Patent Gmbh | Liquid crystal mixture and liquid crystal display |
| WO2019206788A1 (en) | 2018-04-23 | 2019-10-31 | Merck Patent Gmbh | Liquid crystal mixture and liquid crystal display |
| WO2020038861A1 (en) | 2018-08-22 | 2020-02-27 | Merck Patent Gmbh | Liquid crystal mixture and liquid crystal display |
| WO2020038859A1 (en) | 2018-08-22 | 2020-02-27 | Merck Patent Gmbh | Liquid crystal mixture and liquid crystal display |
| WO2020043643A1 (en) | 2018-08-28 | 2020-03-05 | Merck Patent Gmbh | Liquid crystal mixture and liquid crystal display |
| WO2020074440A1 (en) | 2018-10-10 | 2020-04-16 | Merck Patent Gmbh | Liquid crystal mixture and liquid crystal display |
| WO2020120371A2 (en) | 2018-12-12 | 2020-06-18 | Merck Patent Gmbh | Liquid crystal mixture and liquid crystal display |
| WO2020245084A1 (en) | 2019-06-04 | 2020-12-10 | Merck Patent Gmbh | Liquid crystal mixture and liquid crystal display |
| EP3792334A1 (de) | 2019-09-16 | 2021-03-17 | Merck Patent GmbH | Flüssigkristallmischung und flüssigkristallanzeige |
| WO2021160633A1 (en) | 2020-02-13 | 2021-08-19 | Merck Patent Gmbh | Liquid crystal device |
| WO2021160705A1 (en) | 2020-02-13 | 2021-08-19 | Merck Patent Gmbh | Liquid crystal devive |
| DE112021001011T5 (de) | 2020-02-13 | 2022-12-01 | MERCK Patent Gesellschaft mit beschränkter Haftung | Flüssigkristallvorrichtung |
| EP4012004A1 (de) | 2020-12-11 | 2022-06-15 | Merck Patent GmbH | Flüssigkristallvorrichtung |
| WO2022122780A1 (en) | 2020-12-11 | 2022-06-16 | Merck Patent Gmbh | Liquid crystal mixture and liquid crystal display |
Also Published As
| Publication number | Publication date |
|---|---|
| KR20140047589A (ko) | 2014-04-22 |
| DE102012000632A1 (de) | 2012-08-09 |
| JP2014513150A (ja) | 2014-05-29 |
| US20130314655A1 (en) | 2013-11-28 |
| KR101926207B1 (ko) | 2018-12-06 |
| EP2670818B1 (de) | 2016-10-05 |
| TW201239071A (en) | 2012-10-01 |
| EP2670818A1 (de) | 2013-12-11 |
| US9249355B2 (en) | 2016-02-02 |
| CN103492531B (zh) | 2016-06-22 |
| JP6377908B2 (ja) | 2018-08-22 |
| CN103492531A (zh) | 2014-01-01 |
| TWI592469B (zh) | 2017-07-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP2670818B1 (de) | Flüssigkristallanzeigen mit homöotroper ausrichtung | |
| EP2593529B1 (de) | Flüssigkristalline medien und flüssigkristallanzeigen mit polymerstabilisierter homöotroper ausrichtung | |
| EP2606101B1 (de) | Flüssigkristallines medium und flüssigkristallanzeigen | |
| EP2619284B1 (de) | Flüssigkristallanzeigen und flüssigkristalline medien mit homöotroper ausrichtung | |
| EP3323872B1 (de) | Verbindungen zur homöotropen ausrichtung von flüssigkristallinen medien | |
| EP2243812B2 (de) | Flüssigkristallanzeige | |
| EP2393902B1 (de) | Flüssigkristallines medium und flüssigkristallanzeige | |
| DE112014006109B4 (de) | Nematische Flüssigkristallzusammensetzung und ihre Verwendung zur Herstellung eines Flüssigkristallanzeigeelements | |
| EP2483370B1 (de) | Polymerisierbare verbindungen und ihre verwendung in flüssigkristallanzeigen | |
| EP2494003B1 (de) | Polymerisierbare verbindungen und ihre verwendung in flüssigkristallanzeigen | |
| EP3521401B1 (de) | Verbindungen zur homöotropen ausrichtung von flüssigkristallinen medien | |
| DE112016002852T5 (de) | Flüssigkristallmedium enthaltend polymerisierbare Verbindungen | |
| DE112016002882T5 (de) | Flüssigkristallmedium enthaltend polymerisierbare Verbindungen | |
| DE112016002886T5 (de) | Flüssigkristallimedium enthaltend polymerisierbare verbindungen | |
| DE112018003930T5 (de) | Flüssigkristallmedium | |
| DE112018006182T5 (de) | Flüssigkristallmedium | |
| DE102022001602A1 (de) | Flüssigkristallmedium enthaltend polymerisierbare Verbindungen |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 12700775 Country of ref document: EP Kind code of ref document: A1 |
|
| REEP | Request for entry into the european phase |
Ref document number: 2012700775 Country of ref document: EP |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2012700775 Country of ref document: EP |
|
| ENP | Entry into the national phase |
Ref document number: 2013552125 Country of ref document: JP Kind code of ref document: A |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 13983312 Country of ref document: US |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| ENP | Entry into the national phase |
Ref document number: 20137023414 Country of ref document: KR Kind code of ref document: A |