RU2673622C2 - Соединения альфа-аминоамидных производных и содержащие их фармацевтические композиции - Google Patents
Соединения альфа-аминоамидных производных и содержащие их фармацевтические композиции Download PDFInfo
- Publication number
- RU2673622C2 RU2673622C2 RU2017114506A RU2017114506A RU2673622C2 RU 2673622 C2 RU2673622 C2 RU 2673622C2 RU 2017114506 A RU2017114506 A RU 2017114506A RU 2017114506 A RU2017114506 A RU 2017114506A RU 2673622 C2 RU2673622 C2 RU 2673622C2
- Authority
- RU
- Russia
- Prior art keywords
- methyl
- amino
- mao
- pharmaceutically acceptable
- compound
- Prior art date
Links
- 239000008194 pharmaceutical composition Substances 0.000 title claims description 11
- 102000010909 Monoamine Oxidase Human genes 0.000 claims abstract description 85
- 108010062431 Monoamine oxidase Proteins 0.000 claims abstract description 85
- 150000001875 compounds Chemical class 0.000 claims abstract description 75
- BTCSSZJGUNDROE-UHFFFAOYSA-N gamma-aminobutyric acid Chemical compound NCCCC(O)=O BTCSSZJGUNDROE-UHFFFAOYSA-N 0.000 claims abstract description 46
- 150000003839 salts Chemical class 0.000 claims abstract description 31
- 229960003692 gamma aminobutyric acid Drugs 0.000 claims abstract description 24
- 208000008589 Obesity Diseases 0.000 claims abstract description 20
- 235000020824 obesity Nutrition 0.000 claims abstract description 20
- 229910052739 hydrogen Inorganic materials 0.000 claims abstract description 15
- 239000001257 hydrogen Substances 0.000 claims abstract description 15
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims abstract description 14
- 230000004770 neurodegeneration Effects 0.000 claims abstract description 13
- 208000015122 neurodegenerative disease Diseases 0.000 claims abstract description 13
- 239000000126 substance Substances 0.000 claims abstract description 13
- 229910052736 halogen Inorganic materials 0.000 claims abstract description 5
- 125000005843 halogen group Chemical group 0.000 claims abstract description 5
- -1 (3′-chlorobiphenyl-4-yl) methyl Chemical group 0.000 claims description 49
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 44
- 239000003112 inhibitor Substances 0.000 claims description 41
- CBATUQSECWXTQY-UHFFFAOYSA-N methanesulfonic acid propanamide Chemical compound CCC(N)=O.CS(O)(=O)=O CBATUQSECWXTQY-UHFFFAOYSA-N 0.000 claims description 37
- OGNSCSPNOLGXSM-UHFFFAOYSA-N (+/-)-DABA Natural products NCCC(N)C(O)=O OGNSCSPNOLGXSM-UHFFFAOYSA-N 0.000 claims description 22
- 208000018737 Parkinson disease Diseases 0.000 claims description 21
- 230000015572 biosynthetic process Effects 0.000 claims description 20
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 16
- 239000004480 active ingredient Substances 0.000 claims description 11
- 125000000217 alkyl group Chemical group 0.000 claims description 7
- 208000024827 Alzheimer disease Diseases 0.000 claims description 6
- 125000003545 alkoxy group Chemical group 0.000 claims description 4
- PIRXUWJYXOJSIU-UHFFFAOYSA-N acetamide;methanesulfonic acid Chemical compound CC(N)=O.CS(O)(=O)=O PIRXUWJYXOJSIU-UHFFFAOYSA-N 0.000 claims description 3
- 206010015037 epilepsy Diseases 0.000 claims 1
- 230000000694 effects Effects 0.000 abstract description 47
- 230000002401 inhibitory effect Effects 0.000 abstract description 22
- 210000001130 astrocyte Anatomy 0.000 abstract description 15
- 238000011282 treatment Methods 0.000 abstract description 15
- 230000002265 prevention Effects 0.000 abstract description 7
- 210000003016 hypothalamus Anatomy 0.000 abstract description 5
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical group CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 42
- 241000699670 Mus sp. Species 0.000 description 26
- 229950002652 safinamide Drugs 0.000 description 24
- 230000005764 inhibitory process Effects 0.000 description 23
- NEMGRZFTLSKBAP-LBPRGKRZSA-N safinamide Chemical compound C1=CC(CN[C@@H](C)C(N)=O)=CC=C1OCC1=CC=CC(F)=C1 NEMGRZFTLSKBAP-LBPRGKRZSA-N 0.000 description 23
- 239000003814 drug Substances 0.000 description 21
- 238000001644 13C nuclear magnetic resonance spectroscopy Methods 0.000 description 18
- 238000005160 1H NMR spectroscopy Methods 0.000 description 18
- 239000007787 solid Substances 0.000 description 18
- 238000003786 synthesis reaction Methods 0.000 description 18
- 210000002569 neuron Anatomy 0.000 description 17
- PLRACCBDVIHHLZ-UHFFFAOYSA-N 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine Chemical compound C1N(C)CCC(C=2C=CC=CC=2)=C1 PLRACCBDVIHHLZ-UHFFFAOYSA-N 0.000 description 16
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 15
- 101001135571 Mus musculus Tyrosine-protein phosphatase non-receptor type 2 Proteins 0.000 description 15
- 239000000872 buffer Substances 0.000 description 14
- 235000009200 high fat diet Nutrition 0.000 description 14
- 238000012360 testing method Methods 0.000 description 14
- 210000005064 dopaminergic neuron Anatomy 0.000 description 13
- VYFYYTLLBUKUHU-UHFFFAOYSA-N dopamine Chemical compound NCCC1=CC=C(O)C(O)=C1 VYFYYTLLBUKUHU-UHFFFAOYSA-N 0.000 description 12
- 229960003946 selegiline Drugs 0.000 description 12
- MEZLKOACVSPNER-GFCCVEGCSA-N selegiline Chemical compound C#CCN(C)[C@H](C)CC1=CC=CC=C1 MEZLKOACVSPNER-GFCCVEGCSA-N 0.000 description 12
- 108010069820 Pro-Opiomelanocortin Proteins 0.000 description 11
- 102100027467 Pro-opiomelanocortin Human genes 0.000 description 11
- 229920012196 Polyoxymethylene Copolymer Polymers 0.000 description 10
- 229940079593 drug Drugs 0.000 description 10
- 239000012453 solvate Substances 0.000 description 10
- 238000004519 manufacturing process Methods 0.000 description 9
- 230000002441 reversible effect Effects 0.000 description 9
- 229940124597 therapeutic agent Drugs 0.000 description 9
- 230000037396 body weight Effects 0.000 description 8
- 238000005265 energy consumption Methods 0.000 description 8
- 230000002427 irreversible effect Effects 0.000 description 8
- 102000004190 Enzymes Human genes 0.000 description 7
- 108090000790 Enzymes Proteins 0.000 description 7
- 210000004556 brain Anatomy 0.000 description 7
- 210000004027 cell Anatomy 0.000 description 7
- 238000006243 chemical reaction Methods 0.000 description 7
- 238000000034 method Methods 0.000 description 7
- 235000021590 normal diet Nutrition 0.000 description 7
- 239000000243 solution Substances 0.000 description 7
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 6
- 125000001309 chloro group Chemical group Cl* 0.000 description 6
- 229960003638 dopamine Drugs 0.000 description 6
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 6
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 6
- 125000001424 substituent group Chemical group 0.000 description 6
- 108091006146 Channels Proteins 0.000 description 5
- 108091000117 Tyrosine 3-Monooxygenase Proteins 0.000 description 5
- 102000048218 Tyrosine 3-monooxygenases Human genes 0.000 description 5
- 239000000203 mixture Substances 0.000 description 5
- 210000001577 neostriatum Anatomy 0.000 description 5
- 239000001488 sodium phosphate Substances 0.000 description 5
- 229910000162 sodium phosphate Inorganic materials 0.000 description 5
- 210000003523 substantia nigra Anatomy 0.000 description 5
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 5
- 206010001497 Agitation Diseases 0.000 description 4
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 4
- WGQKYBSKWIADBV-UHFFFAOYSA-N benzylamine Chemical compound NCC1=CC=CC=C1 WGQKYBSKWIADBV-UHFFFAOYSA-N 0.000 description 4
- 230000008499 blood brain barrier function Effects 0.000 description 4
- 210000001218 blood-brain barrier Anatomy 0.000 description 4
- 229910052799 carbon Inorganic materials 0.000 description 4
- 210000001947 dentate gyrus Anatomy 0.000 description 4
- 238000002360 preparation method Methods 0.000 description 4
- 230000002829 reductive effect Effects 0.000 description 4
- 230000001225 therapeutic effect Effects 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 4
- 102000016267 Leptin Human genes 0.000 description 3
- 108010092277 Leptin Proteins 0.000 description 3
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 3
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 3
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 3
- 230000010056 antibody-dependent cellular cytotoxicity Effects 0.000 description 3
- 230000033228 biological regulation Effects 0.000 description 3
- 230000006378 damage Effects 0.000 description 3
- 239000012153 distilled water Substances 0.000 description 3
- 239000003925 fat Substances 0.000 description 3
- NRYBAZVQPHGZNS-ZSOCWYAHSA-N leptin Chemical group O=C([C@H](CO)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)CNC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](N)CC(C)C)CCSC)N1CCC[C@H]1C(=O)NCC(=O)N[C@@H](CS)C(O)=O NRYBAZVQPHGZNS-ZSOCWYAHSA-N 0.000 description 3
- 229940039781 leptin Drugs 0.000 description 3
- 230000004060 metabolic process Effects 0.000 description 3
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 3
- 238000002156 mixing Methods 0.000 description 3
- 210000004498 neuroglial cell Anatomy 0.000 description 3
- 238000013116 obese mouse model Methods 0.000 description 3
- 239000012044 organic layer Substances 0.000 description 3
- 230000001681 protective effect Effects 0.000 description 3
- 229910052938 sodium sulfate Inorganic materials 0.000 description 3
- 235000011152 sodium sulphate Nutrition 0.000 description 3
- 238000005406 washing Methods 0.000 description 3
- FIAINKIUSZGVGX-HSHFZTNMSA-N (2r)-2-aminopropanamide;hydrochloride Chemical compound Cl.C[C@@H](N)C(N)=O FIAINKIUSZGVGX-HSHFZTNMSA-N 0.000 description 2
- KWTSXDURSIMDCE-QMMMGPOBSA-N (S)-amphetamine Chemical compound C[C@H](N)CC1=CC=CC=C1 KWTSXDURSIMDCE-QMMMGPOBSA-N 0.000 description 2
- PKYCWFICOKSIHZ-UHFFFAOYSA-N 1-(3,7-dihydroxyphenoxazin-10-yl)ethanone Chemical compound OC1=CC=C2N(C(=O)C)C3=CC=C(O)C=C3OC2=C1 PKYCWFICOKSIHZ-UHFFFAOYSA-N 0.000 description 2
- ZRYZBQLXDKPBDU-UHFFFAOYSA-N 4-bromobenzaldehyde Chemical compound BrC1=CC=C(C=O)C=C1 ZRYZBQLXDKPBDU-UHFFFAOYSA-N 0.000 description 2
- YLBBGWJYCHGOQQ-UHFFFAOYSA-N CS(=O)(=O)O.C(CCCC)(=O)N Chemical compound CS(=O)(=O)O.C(CCCC)(=O)N YLBBGWJYCHGOQQ-UHFFFAOYSA-N 0.000 description 2
- 108090000312 Calcium Channels Proteins 0.000 description 2
- 102000003922 Calcium Channels Human genes 0.000 description 2
- 102100039289 Glial fibrillary acidic protein Human genes 0.000 description 2
- 101710193519 Glial fibrillary acidic protein Proteins 0.000 description 2
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 2
- WTDRDQBEARUVNC-LURJTMIESA-N L-DOPA Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C(O)=C1 WTDRDQBEARUVNC-LURJTMIESA-N 0.000 description 2
- WTDRDQBEARUVNC-UHFFFAOYSA-N L-Dopa Natural products OC(=O)C(N)CC1=CC=C(O)C(O)=C1 WTDRDQBEARUVNC-UHFFFAOYSA-N 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- 108010052164 Sodium Channels Proteins 0.000 description 2
- 102000018674 Sodium Channels Human genes 0.000 description 2
- FIAINKIUSZGVGX-DKWTVANSSA-N [(2s)-1-amino-1-oxopropan-2-yl]azanium;chloride Chemical compound Cl.C[C@H](N)C(N)=O FIAINKIUSZGVGX-DKWTVANSSA-N 0.000 description 2
- 238000002835 absorbance Methods 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 230000004913 activation Effects 0.000 description 2
- 229940025084 amphetamine Drugs 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 230000036528 appetite Effects 0.000 description 2
- 235000019789 appetite Nutrition 0.000 description 2
- 229940031774 azilect Drugs 0.000 description 2
- 239000000090 biomarker Substances 0.000 description 2
- 125000006267 biphenyl group Chemical group 0.000 description 2
- ZADPBFCGQRWHPN-UHFFFAOYSA-N boronic acid Chemical compound OBO ZADPBFCGQRWHPN-UHFFFAOYSA-N 0.000 description 2
- IIBTZULAKWLCDS-UHFFFAOYSA-N butanamide methanesulfonic acid Chemical compound CS(O)(=O)=O.CCCC(N)=O IIBTZULAKWLCDS-UHFFFAOYSA-N 0.000 description 2
- 150000007942 carboxylates Chemical class 0.000 description 2
- 230000003013 cytotoxicity Effects 0.000 description 2
- 231100000135 cytotoxicity Toxicity 0.000 description 2
- 230000036425 denaturation Effects 0.000 description 2
- 238000004925 denaturation Methods 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 201000010099 disease Diseases 0.000 description 2
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 2
- 238000001035 drying Methods 0.000 description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 239000000706 filtrate Substances 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 125000000524 functional group Chemical group 0.000 description 2
- 210000005046 glial fibrillary acidic protein Anatomy 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- 150000002466 imines Chemical class 0.000 description 2
- 229960004502 levodopa Drugs 0.000 description 2
- 230000007774 longterm Effects 0.000 description 2
- 229940098779 methanesulfonic acid Drugs 0.000 description 2
- JDBJJCWRXSVHOQ-UTONKHPSSA-N methanesulfonic acid;(1r)-n-prop-2-ynyl-2,3-dihydro-1h-inden-1-amine Chemical compound CS(O)(=O)=O.C1=CC=C2[C@H](NCC#C)CCC2=C1 JDBJJCWRXSVHOQ-UTONKHPSSA-N 0.000 description 2
- 230000003287 optical effect Effects 0.000 description 2
- 238000012261 overproduction Methods 0.000 description 2
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 2
- KIDHWZJUCRJVML-UHFFFAOYSA-N putrescine Chemical compound NCCCCN KIDHWZJUCRJVML-UHFFFAOYSA-N 0.000 description 2
- 239000011541 reaction mixture Substances 0.000 description 2
- 102000005962 receptors Human genes 0.000 description 2
- 108020003175 receptors Proteins 0.000 description 2
- 238000011084 recovery Methods 0.000 description 2
- 239000013037 reversible inhibitor Substances 0.000 description 2
- 230000003248 secreting effect Effects 0.000 description 2
- 230000028327 secretion Effects 0.000 description 2
- 238000010898 silica gel chromatography Methods 0.000 description 2
- BEOOHQFXGBMRKU-UHFFFAOYSA-N sodium cyanoborohydride Chemical compound [Na+].[B-]C#N BEOOHQFXGBMRKU-UHFFFAOYSA-N 0.000 description 2
- 239000012064 sodium phosphate buffer Substances 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- 125000001273 sulfonato group Chemical class [O-]S(*)(=O)=O 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 210000000225 synapse Anatomy 0.000 description 2
- 230000002194 synthesizing effect Effects 0.000 description 2
- XFCNYSGKNAWXFL-WCCKRBBISA-N (2s)-2-amino-3-methylbutanamide;hydron;chloride Chemical compound Cl.CC(C)[C@H](N)C(N)=O XFCNYSGKNAWXFL-WCCKRBBISA-N 0.000 description 1
- GVNVAWHJIKLAGL-UHFFFAOYSA-N 2-(cyclohexen-1-yl)cyclohexan-1-one Chemical compound O=C1CCCCC1C1=CCCCC1 GVNVAWHJIKLAGL-UHFFFAOYSA-N 0.000 description 1
- MWPNPNLDBXDQCC-UHFFFAOYSA-N 2-amino-3-(diethylamino)propanoic acid Chemical compound CCN(CC)CC(N)C(O)=O MWPNPNLDBXDQCC-UHFFFAOYSA-N 0.000 description 1
- WKNMKGVLOWGGOU-UHFFFAOYSA-N 2-aminoacetamide;hydron;chloride Chemical compound Cl.NCC(N)=O WKNMKGVLOWGGOU-UHFFFAOYSA-N 0.000 description 1
- ZKHQWZAMYRWXGA-KQYNXXCUSA-N Adenosine triphosphate Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](COP(O)(=O)OP(O)(=O)OP(O)(O)=O)[C@@H](O)[C@H]1O ZKHQWZAMYRWXGA-KQYNXXCUSA-N 0.000 description 1
- ZKHQWZAMYRWXGA-UHFFFAOYSA-N Adenosine triphosphate Natural products C1=NC=2C(N)=NC=NC=2N1C1OC(COP(O)(=O)OP(O)(=O)OP(O)(O)=O)C(O)C1O ZKHQWZAMYRWXGA-UHFFFAOYSA-N 0.000 description 1
- 208000014644 Brain disease Diseases 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 101150065749 Churc1 gene Proteins 0.000 description 1
- MTCFGRXMJLQNBG-UWTATZPHSA-N D-Serine Chemical compound OC[C@@H](N)C(O)=O MTCFGRXMJLQNBG-UWTATZPHSA-N 0.000 description 1
- 229930195711 D-Serine Natural products 0.000 description 1
- 206010012289 Dementia Diseases 0.000 description 1
- 238000013218 HFD mouse model Methods 0.000 description 1
- 206010019851 Hepatotoxicity Diseases 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical class Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- 208000019430 Motor disease Diseases 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 239000000683 Pro-Opiomelanocortin Substances 0.000 description 1
- 102100038239 Protein Churchill Human genes 0.000 description 1
- 239000005700 Putrescine Substances 0.000 description 1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- 238000006069 Suzuki reaction reaction Methods 0.000 description 1
- 206010044565 Tremor Diseases 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 150000001242 acetic acid derivatives Chemical class 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 150000001299 aldehydes Chemical class 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 210000003295 arcuate nucleus Anatomy 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical class OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 150000001558 benzoic acid derivatives Chemical class 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 230000003925 brain function Effects 0.000 description 1
- 210000005013 brain tissue Anatomy 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 239000003054 catalyst Substances 0.000 description 1
- 239000003543 catechol methyltransferase inhibitor Substances 0.000 description 1
- 210000003169 central nervous system Anatomy 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 150000001860 citric acid derivatives Chemical class 0.000 description 1
- 230000001447 compensatory effect Effects 0.000 description 1
- 229940125904 compound 1 Drugs 0.000 description 1
- 210000003792 cranial nerve Anatomy 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- 238000007865 diluting Methods 0.000 description 1
- 238000013104 docking experiment Methods 0.000 description 1
- 239000003136 dopamine receptor stimulating agent Substances 0.000 description 1
- 229940052764 dopaminergic anti-parkinson drug mao b inhibitors Drugs 0.000 description 1
- 239000003651 drinking water Substances 0.000 description 1
- 235000020188 drinking water Nutrition 0.000 description 1
- 206010013990 dysuria Diseases 0.000 description 1
- 238000003372 electrophysiological method Methods 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-N ethanesulfonic acid Chemical class CCS(O)(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-N 0.000 description 1
- 125000001301 ethoxy group Chemical class [H]C([H])([H])C([H])([H])O* 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 230000037406 food intake Effects 0.000 description 1
- 235000012631 food intake Nutrition 0.000 description 1
- 230000008014 freezing Effects 0.000 description 1
- 238000007710 freezing Methods 0.000 description 1
- VZCYOOQTPOCHFL-OWOJBTEDSA-L fumarate(2-) Chemical class [O-]C(=O)\C=C\C([O-])=O VZCYOOQTPOCHFL-OWOJBTEDSA-L 0.000 description 1
- 230000005021 gait Effects 0.000 description 1
- 229930195712 glutamate Natural products 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 230000007686 hepatotoxicity Effects 0.000 description 1
- 231100000304 hepatotoxicity Toxicity 0.000 description 1
- 230000000971 hippocampal effect Effects 0.000 description 1
- 210000001320 hippocampus Anatomy 0.000 description 1
- 150000003840 hydrochlorides Chemical class 0.000 description 1
- 238000012151 immunohistochemical method Methods 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 239000013038 irreversible inhibitor Substances 0.000 description 1
- 150000003893 lactate salts Chemical class 0.000 description 1
- 102000005861 leptin receptors Human genes 0.000 description 1
- 108010019813 leptin receptors Proteins 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 230000033001 locomotion Effects 0.000 description 1
- 150000002688 maleic acid derivatives Chemical class 0.000 description 1
- 150000004701 malic acid derivatives Chemical class 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-M methanesulfonate group Chemical class CS(=O)(=O)[O-] AFVFQIVMOAPDHO-UHFFFAOYSA-M 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 238000012900 molecular simulation Methods 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- YZMHQCWXYHARLS-UHFFFAOYSA-N naphthalene-1,2-disulfonic acid Chemical class C1=CC=CC2=C(S(O)(=O)=O)C(S(=O)(=O)O)=CC=C21 YZMHQCWXYHARLS-UHFFFAOYSA-N 0.000 description 1
- 230000016273 neuron death Effects 0.000 description 1
- 239000002858 neurotransmitter agent Substances 0.000 description 1
- 231100000957 no side effect Toxicity 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- 235000021317 phosphate Nutrition 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 231100000614 poison Toxicity 0.000 description 1
- 230000001144 postural effect Effects 0.000 description 1
- 208000037821 progressive disease Diseases 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 238000013207 serial dilution Methods 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- 208000019116 sleep disease Diseases 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 150000003467 sulfuric acid derivatives Chemical class 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 150000003892 tartrate salts Chemical class 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- LBLYYCQCTBFVLH-UHFFFAOYSA-M toluenesulfonate group Chemical group C=1(C(=CC=CC1)S(=O)(=O)[O-])C LBLYYCQCTBFVLH-UHFFFAOYSA-M 0.000 description 1
- 239000003440 toxic substance Substances 0.000 description 1
- 125000000876 trifluoromethoxy group Chemical group FC(F)(F)O* 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
- 238000003828 vacuum filtration Methods 0.000 description 1
- 230000004584 weight gain Effects 0.000 description 1
- 235000019786 weight gain Nutrition 0.000 description 1
- 230000004580 weight loss Effects 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C237/00—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups
- C07C237/02—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups having the carbon atoms of the carboxamide groups bound to acyclic carbon atoms of the carbon skeleton
- C07C237/04—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups having the carbon atoms of the carboxamide groups bound to acyclic carbon atoms of the carbon skeleton the carbon skeleton being acyclic and saturated
- C07C237/06—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups having the carbon atoms of the carboxamide groups bound to acyclic carbon atoms of the carbon skeleton the carbon skeleton being acyclic and saturated having the nitrogen atoms of the carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/16—Amides, e.g. hydroxamic acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/16—Amides, e.g. hydroxamic acids
- A61K31/165—Amides, e.g. hydroxamic acids having aromatic rings, e.g. colchicine, atenolol, progabide
- A61K31/167—Amides, e.g. hydroxamic acids having aromatic rings, e.g. colchicine, atenolol, progabide having the nitrogen of a carboxamide group directly attached to the aromatic ring, e.g. lidocaine, paracetamol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C231/00—Preparation of carboxylic acid amides
- C07C231/12—Preparation of carboxylic acid amides by reactions not involving the formation of carboxamide groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C237/00—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups
- C07C237/02—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups having the carbon atoms of the carboxamide groups bound to acyclic carbon atoms of the carbon skeleton
- C07C237/04—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups having the carbon atoms of the carboxamide groups bound to acyclic carbon atoms of the carbon skeleton the carbon skeleton being acyclic and saturated
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C237/00—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups
- C07C237/02—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups having the carbon atoms of the carboxamide groups bound to acyclic carbon atoms of the carbon skeleton
- C07C237/20—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups having the carbon atoms of the carboxamide groups bound to acyclic carbon atoms of the carbon skeleton the carbon skeleton containing six-membered aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C309/00—Sulfonic acids; Halides, esters, or anhydrides thereof
- C07C309/01—Sulfonic acids
- C07C309/02—Sulfonic acids having sulfo groups bound to acyclic carbon atoms
- C07C309/03—Sulfonic acids having sulfo groups bound to acyclic carbon atoms of an acyclic saturated carbon skeleton
- C07C309/04—Sulfonic acids having sulfo groups bound to acyclic carbon atoms of an acyclic saturated carbon skeleton containing only one sulfo group
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/07—Optical isomers
Abstract
Изобретение относится к α-аминоамидному производному, представленному химической формулой 1, или его фармацевтически приемлемой соли, где R означает водород или C1-7-алкил; Х выбран из галогена, галогенированного C1-7-алкила, и галогенированного C1-7-алкокси. α-аминоамидное производное представляет собой (S)-изомер. Соединение по изобретению предотвращает гиперпродукцию ГАМК в реактивных астроцитах гипоталамуса путем ингибирования моноаминоксидазы В (MAO-B) и предназначено для лечения или профилактики нейродегенеративного заболевания, а также для лечения или профилактики ожирения. 5 н. и 7 з.п. ф-лы, 2 табл., 12 ил., 25 пр.
Description
Область техники, к которой относится изобретение
Настоящее изобретение касается соединений α-аминоамидных производных и содержащих их фармацевтических композиций.
УРОВЕНЬ ТЕХНИКИ
Болезнь Паркинсона является прогрессирующим заболеванием, которое стоит на втором месте по распространенности среди нейродегенеративных заболеваний. По оценкам, в мире насчитывается около 6,3 миллионов больных болезнью Паркинсона, то есть примерно 1 на 1000 человек. Хотя болезнь Паркинсона обычно встречается у пожилых людей, она встречается и у молодых. Болезнь Паркинсона нелегко отличить от других заболеваний, так как симптомы развиваются медленно. Она с трудом выявляется на ранних стадиях и сопровождается аномальными клиническими симптомами, такими как тремор, скованность, замедленность движений, постуральная нестабильность, сутулость, замирающая походка, депрессия, расстройства сна, дизурия, деменция и т.д.
Хотя причины болезни Паркинсона неясны, известно, что она вызывается дефицитом дофамина в результате гибели нейронов, секретирующих нейромедиатор дофамин в мозге. В настоящее время обычно применяется терапия препаратом леводопа, которая при введении превращается в дофамин в организме. Хотя леводопа является наиболее эффективным терапевтическим средством при болезни Паркинсона, во время лечения может происходить снижение эффективности препарата или различные двигательные расстройства. В качестве альтернативных лекарств применяются ингибиторы COMT, ингибиторы MAO-B и др., которые поддерживают концентрацию дофамина в мозге путем ингибирования метаболизма дофамина.
Известно, что MAO-B не только играет важную роль в метаболизме дофамина в мозге, но также ингибирует повреждение клеток черепных нервов. Хотя и нет четких доказательств того, что ингибиторы MAO-B в самом деле замедляют прогрессирование болезни Паркинсона, известно, что ингибирование MAO-B приводит к торможению денатурации или разрушения дофаминергических нейронов, поскольку оно играет важную роль в возникновении болезни Паркинсона под действием MPTP или аналогичных токсических веществ. Кроме того, имеются данные испытаний на животных и клинических испытаний о том, что ингибиторы MAO-B обладают эффектом защиты мозга, в отличие от других препаратов.
Селегилин, который одобрен как самый представительный ингибитор MAO-B, назначается в качестве терапевтического средства при болезни Паркинсона. Однако он вызывает гепатотоксичность, поскольку метаболизуется до амфетамина, а необратимое ингибирование сопровождается различными побочными эффектами. С тех пор, как на рынке в 2005 г. впервые появился разагилин (Azilect) в Израиле, он продавался примерно в 50 странах, включая Европу, США и т.д. Azilect лишен побочных эффектов амфетамина и проявляет большую эффективность, чем другие дофаминергические препараты. Однако, хотя разагилин, подобно селегилину, тоже проявляет превосходный эффект ингибирования MAO-B в качестве необратимого ингибитора MAO-B, у него есть проблемы с безопасностью. Поэтому в настоящее время разрабатываются препараты, которые могут эффективно и обратимо ингибировать активность MAO-B и в то же время лишены вышеописанных недостатков. Однако пока еще нет достойных внимания обратимых ингибиторов.
Ожирение есть такое медицинское состояние, при котором накапливается избыток жира в такой степени, что это может оказывать отрицательное влияние на здоровье. Это такое состояние, при котором накапливается избыточная энергия из-за разницы в поступлении энергии и расходовании энергии. Ожирение повышает вероятность различных заболеваний.
Поскольку предшествующие исследования на гипоталамусе в отношении регуляции потребления пищи проводились в основном с упором на нейроны в составе мозга, то понимание регуляции диеты/ожирения головным мозгом оказалось ограниченным. Поэтому для всестороннего понимания функции мозга необходимо изучение глиальных клеток (глии), которые составляют его большую часть. В последнее время привлекают внимание астроциты, которые являются наиболее многочисленными из глиальных клеток, как клетки, которые могут активировать или подавлять соседние нейроны, секретируя различные сигнальные молекулы типа ГАМК (гамма-аминомасляная кислота), глутамата, D-серина, АТФ и др. Астроциты в гипоталамусе, которые тесно взаимодействуют с содержащими POMC (про-опиомеланокортин) нейронами и экспрессируют рецепторы лептина, также могут способствовать передаче сигналов лептина.
В гипоталамусе существуют две группы POMC-нейронов, из которых одна стимулирует аппетит, а другая стимулирует потребление энергии. В норме астроциты способствуют активации близлежащих POMC-нейронов, стимулирующих потребление энергии. Однако при ожирении они превращаются в реактивные астроциты вследствие чрезмерных сигналов лептина, при этом под действием MAO-B (моноаминоксидаза В) путресцин превращается в ГАМК и секретируется. Кроме того, POMC-нейроны, которые стимулируют потребление энергии, экспрессируют ГАМКА-рецепторы вне синапсов, включая субъединицы a4, a5 и a6, вследствие избыточных сигналов лептина, и на них действует ГАМК, которая секретируется реактивными астроцитами. В результате этого происходит торможение POMC-нейронов и снижается потребление энергии, что приводит к накоплению жиров.
При ингибировании фермента MAO-B, который отвечает за продукцию ГАМК, подавляется продукция и секреция ГАМК, а потребление энергии стимулируется по мере того, как POMC-нейроны снова активируются. Однако POMC-нейроны, которые подавляют аппетит, не подвержены влиянию ГАМК, поскольку они не экспрессируют ГАМКА-рецепторы вне синапсов. Поэтому ингибиторы MAO-B действуют на те POMC-нейроны, которые избирательно стимулируют потребление энергии, и тем самым проявляют эффект лечения ожирения. Однако большинство существующих ингибиторов MAO-B проявляют различные побочные эффекты в качестве необратимых ингибиторов. Хотя препараты, которые могут обратимо ингибировать MAO-B, исследуют и разрабатывают именно по этой причине, однако пока еще нет достойных внимания обратимых ингибиторов MAO-B, которые способны эффективно воздействовать на ожирение.
CУЩНОСТЬ ИЗОБРЕТЕНИЯ
Техническая проблема
Настоящее изобретение направлено на преодоление недостатков существующих препаратов, применяемых в качестве ингибиторов MAO-B. Оно направлено на разработку терапевтических средств, обратимо ингибирующих MAO-B через нековалентные связи, чтобы ослабить или устранить побочные эффекты существующих препаратов, которые проявляют терапевтический эффект посредством необратимого действия через ковалентную связь с MAO-B. Оно также направлено на получение таких соединений, которые обладают превосходной стабильностью и эффективностью по сравнению с существующими обратимыми ингибиторами MAO-B, содержащих их композиций и способов их получения.
Техническое решение
В одном аспекте настоящего изобретения предусмотрены α-аминоамидные производные, представленные химической формулой 1, либо их фармацевтически приемлемые соли:
где R и X определены далее в описании.
В другом аспекте настоящее изобретение касается ингибиторов моноаминоксидазы B (MAO-B), содержащих α-аминоамидные производные в соответствии с различными типичными воплощениями настоящего изобретения либо их фармацевтически приемлемые соли или сольваты в качестве активного ингредиента.
В другом аспекте настоящее изобретение касается фармацевтических композиций для лечения или профилактики нейродегенеративных заболеваний, которые содержат α-аминоамидные производные в соответствии с различными типичными воплощениями настоящего изобретения либо их фармацевтически приемлемые соли или сольваты в качестве активного ингредиента.
В другом аспекте настоящее изобретение касается применения α-аминоамидных производных в соответствии с различными типичными воплощениями настоящего изобретения либо их фармацевтически приемлемых солей или сольватов для изготовления лекарственного средства для лечения или профилактики нейродегенеративных заболеваний.
В другом аспекте настоящее изобретение касается способов лечения или профилактики нейродегенеративных заболеваний путем введения млекопитающим фармацевтических композиций, содержащих α-аминоамидные производные в соответствии с различными типичными воплощениями настоящего изобретения либо их фармацевтически приемлемые соли или сольваты.
В другом аспекте настоящее изобретение касается фармацевтических композиций для лечения или профилактики ожирения, которые содержат α-аминоамидные производные в соответствии с различными типичными воплощениями настоящего изобретения либо их фармацевтически приемлемые соли или сольваты в качестве активного ингредиента.
В следующем аспекте настоящее изобретение касается способа получения α-аминоамидных производных, представленных химической формулой 1.
Преимущества
В соответствии с различными типичными воплощениями настоящего изобретения предусмотрены терапевтические средства, способные преодолеть недостатки существующих препаратов, применяемых в качестве ингибиторов MAO-B, в частности, они обратимо ингибируют MAO-B через нековалентные связи и тем самым ослабляют или устраняют побочные эффекты существующих препаратов, которые проявляют терапевтический эффект, действуя необратимо через ковалентную связь с MAO-B. В частности, предусмотрены новые соединения, обладающие превосходной стабильностью и эффективностью в сравнении с существующими обратимыми ингибиторами MAO-B.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг. 1 представлена процедура для проверки обратимости α-аминоамидных производных в соответствии с типичными воплощениями настоящего изобретения в отношении MAO-B (моноаминоксидазы B).
На фиг. 2a представлен защитный эффект соединения 9 на дофаминергические нейроны в черной субстанции и полосатом теле (до обработки).
На фиг. 2b представлен защитный эффект соединения 9 на дофаминергические нейроны в черной субстанции и полосатом теле (после обработки).
На фиг. 2c представлен защитный эффект соединения 9 на дофаминергические нейроны в черной субстанции и полосатом теле (30-дневная предобработка).
На фиг. 3a представлена вероятность появления спайков у мышей АРР/PS1 в зависимости от интенсивности стимула (Jo et al., Nature Medicine, 2014).
На фиг. 3b представлена вероятность вызова спайков соединением 9 у мышей АРР/PS1 в зависимости от интенсивности стимула.
На фиг. 4 представлен результат теста соединения 9 на возбудимость в DGGCs (гранулярные клетки зубчатой извилины).
На фиг. 5 представлен результат предсказания режима связывания у сафинамида и соединения 9.
На фиг. 6 представлены изменения веса тела у мышей, получавших нормальный рацион или диету с высоким содержанием жира.
На фиг. 7 представлены изменения реактивных астроцитов у мышей, получавших нормальный рацион или диету с высоким содержанием жира.
На фиг. 8 представлены изменения веса тела у мышей на модели ожирения, получавших диету с высоким содержанием жира, в зависимости от вводимого количества α-аминоамидного производного.
На фиг. 9 представлены изменения реактивных астроцитов и ГАМК у мышей, получавших нормальный рацион, у мышей, получавших диету с высоким содержанием жира, и у мышей, получавших диету с высоким содержанием жира вместе с α-аминоамидным производным.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Далее будут более подробно описаны некоторые аспекты и различные типичные воплощения настоящего изобретения.
Настоящее изобретение касается α-аминоамидных производных, представленных химической формулой 1, либо их фармацевтически приемлемых солей:
где R означает водород или C1-7-алкил; а Х выбран из галогена, алкила, галогенированного алкила, алкокси и галогенированного алкокси.
Звездочкой (*) обозначается оптическая активность.
В одном типичном воплощении R выбран из водорода и C1-C7-алкила; а Х выбран из галогена, C1-C7-алкила, галогенированного C1-C7-алкила, C1-C7-алкокси и галогенированного C1-C7-алкокси.
В другом типичном воплощении R выбран из водорода, метила, этила, н-пропила, изопропила, циклопропила, н-бутила, изобутила, втор-бутила и трет-бутила; а Х выбран из галогена, галогенированного метила, галогенированного этила, галогенированного метокси, галогенированного этокси, метокси и этокси. В частности, в этом случае может дополнительно достигаться эффект ослабления антителозависимой клеточной цитотоксичности.
В другом типичном воплощении R выбран из водорода, метила, изопропила и изобутила; а X выбран из фтора, хлора, трифторметила, трифторметокси и метокси. В частности, в этом случае почти отсутствует эффект ингибирования каналов и он заметно ниже, чем у сафинамида, который хорошо известен как ингибитор MAO-B. Соответственно, обеспечивается стабильность в качестве селективного ингибитора MAO-B.
В другом типичном воплощении R выбран из водорода, метила, изопропила и изобутила; а X выбран из п-трифторметила, п-трифторметокси, м-трифторметила, м-трифторметокси, п-хлора, м-хлора, п-метокси, м-метокси, п-фтора и м-фтора.
В другом типичном воплощении R выбран из водорода, метила, изопропила и изобутила; а X выбран из п-трифторметила, п-трифторметокси, m-трифторметила, м-трифторметокси, п-хлора, м-хлора, п-метокси и м-метокси. В другом типичном воплощении R означает водород или метил; а X выбран из п-трифторметила, п-трифторметокси, м-трифторметила, м-трифторметокси, п-хлора, м-хлора, п-метокси и м-метокси.
В другом типичном воплощении R означает водород или метил; а X выбран из п-трифторметила, п-трифторметокси, m-трифторметила и м-трифторметокси. В частности, в этом случае может дополнительно достигаться эффект полной блокировки антителозависимой клеточной цитотоксичности.
В другом типичном воплощении R означает водород или метил; а X означает п-трифторметил или п-трифторметокси.
В другом типичном воплощении R означает метил; а X означает п-трифторметил или п-трифторметокси.
В другом типичном воплощении R означает метил; а X означает п-трифторметил.
В следующем типичном воплощении α-аминоамидное производное выбирают из следующих соединений:
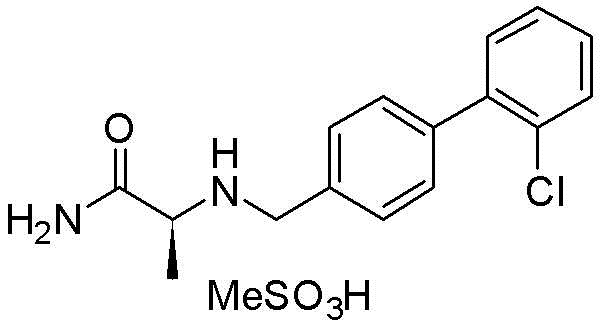
(S)-2-(((2′-фторбифенил-4-ил)метил)амино)пропанамид метансульфонат,
(S)-2-(((3′-фторбифенил-4-ил)метил)амино)пропанамид метансульфонат,
(S)-2-(((4′-фторбифенил-4-ил)метил)амино)пропанамид метансульфонат,
(S)-2-(((2′-хлорбифенил-4-ил)метил)амино)пропанамид метансульфонат,
(S)-2-(((3′-хлорбифенил-4-ил)метил)амино)пропанамид метансульфонат,
(S)-2-(((4′-хлорбифенил-4-ил)метил)амино)пропанамид метансульфонат,
(S)-2-(((2′-трифторметилбифенил-4-ил)метил)амино)пропанамид метансульфонат,
(S)-2-(((3′-трифторметилбифенил-4-ил)метил)амино)пропанамид метансульфонат,
(S)-2-(((4′-трифторметилбифенил-4-ил)метил)амино)пропанамид метансульфонат,
(S)-2-(((3′-трифторметоксибифенил4-ил)метил)амино)пропанамид метансульфонат,
(S)-2-(((4′-трифторметоксибифенил4-ил)метил)амино)пропанамид метансульфонат,
(S)-2-(((3′-метоксибифенил-4-ил)метил)амино)пропанамид метансульфонат,
(S)-2-(((4′-метоксибифенил-4-ил)метил)амино)пропанамид метансульфонат,
(R)-2-(((3′-фторметоксибифенил-4-ил)метил)амино)пропанамид метансульфонат,
(R)-2-(((4′-трифторметилбифенил-4-ил)метил)амино)пропанамид метансульфонат,
(R)-2-(((4′-трифторметилбифенил-4-ил)метил)амино)ацетамид метансульфонат,
(R)-3-метил-2-(((4′-трифторметилбифенил-4-ил)метил)амино)бутанамид метансульфонат и
(R)-4-метил-2-(((4′-трифторметилбифенил-4-ил)метил)амино)пентанамид метансульфонат.
В другом типичном воплощении настоящего изобретения α-аминоамидное производное в соответствии с различными типичными воплощениями настоящего изобретения может представлять собой (S)-изомер.
В настоящем изобретении фармацевтически приемлемые соли включают соли неорганических кислот, как-то гидрохлориды, гидробромиды, фосфаты или сульфаты, и соли органических кислот, как-то карбоксилаты или сульфонаты, но не ограничиваются ими. Карбоксилаты включают ацетаты, малеаты, фумараты, малаты, цитраты, тартраты, лактаты или бензоаты, но не ограничиваются ими. Сульфонаты включают метансульфонаты, этансульфонаты, бензолсульфонаты, толуолсульфонаты или нафталиндисульфонаты, но не ограничиваются ими.
Настоящим изобретением также предусмотрен способ получения α-аминоамидных производных, который включает:
(А) стадию синтеза соединения химической формулы 1с путем реакции соединения формулы 1а с соединением формулы 1b:
| 1а | 1b | 1с |
(B) стадию синтеза соединения химической формулы 1e путем реакции соединения формулы 1c с соединением формулы 1d:
| 1d | 1e |
(C) стадию превращения соединения химической формулы 1e в α-аминоамидное производное формулы 1:
В химической формуле 1 и формулах 1b–1e R и X являются такими, как определено выше.
Способ получения можно выразить схемой 1.
Схема 1
Поскольку соединение 1 обладает оптической активностью благодаря углероду, отмеченному звездочкой (*), то R- и S-соединения можно синтезировать по отдельности.
Настоящим изобретением также предусмотрены ингибиторы MAO-B (моноаминоксидазы В), содержащие α-аминоамидные производные либо их фармацевтически приемлемые соли или сольваты в качестве активного ингредиента.
α-аминоамидные производные по настоящему изобретению могут применяться в качестве ингибиторов MAO-B, так как они проявляют превосходный эффект ингибирования активности моноаминоксидазы B.
Настоящим изобретением также предусмотрены фармацевтические композиции для лечения или профилактики нейродегенеративных заболеваний, которые содержат α-аминоамидные производные либо их фармацевтически приемлемые соли или сольваты в качестве активного ингредиента.
В настоящем изобретении нейродегенеративные заболевания включают, к примеру, болезнь Паркинсона, болезнь Альцгеймера и т.п., но не ограничиваются ими.
В другом аспекте настоящее изобретение касается применения α-аминоамидных производных в соответствии с различными типичными воплощениями настоящего изобретения либо их фармацевтически приемлемых солей или сольватов для изготовления лекарственного средства для лечения или профилактики нейродегенеративных заболеваний.
В другом аспекте настоящее изобретение касается способов лечения или профилактики нейродегенеративных заболеваний путем введения млекопитающим фармацевтических композиций, содержащих α-аминоамидные производные в соответствии с различными типичными воплощениями настоящего изобретения либо их фармацевтически приемлемые соли или сольваты.
Настоящим изобретением также предусмотрены ингибиторы образования γ-аминомасляной кислоты (ГАМК), содержащие α-аминоамидные производные либо их фармацевтически приемлемые соли или сольваты в качестве активного ингредиента.
α-Аминоамидные производные по настоящему изобретению могут применяться в качестве ингибиторов образования ГАМК, так как они могут ингибировать выработку и секрецию ГАМК путем ингибирования MAO-B, то есть фермента, вырабатывающего ГАМК.
Кроме того, α-аминоамидные производные по настоящему изобретению могут применяться в качестве фармацевтических композиций для лечения или профилактики ожирения, так как они могут проявлять терапевтический эффект при ожирении путем ослабления ингибирования или активации POMC-нейронов, которые избирательно стимулируют потребление энергии и тем самым усиливают потребление энергии.
Далее настоящее изобретение будет описано подробно на примерах. Однако нижеследующие примеры приводятся только в целях иллюстрации и не должны восприниматься как сокращение или ограничение объема и содержания настоящего изобретения этими примерами. Кроме того, очевидно, что рядовые специалисты смогут легко осуществить настоящее изобретение на основе настоящего описания, включая примеры, даже если экспериментальный результат специально не предусмотрен, причем такие модификации или изменения попадают в рамки прилагаемой формулы изобретения.
Хотя структуры и физические свойства соединений будут колебаться в зависимости от заместителей, однако принципы и условия реакций, описанных в примерах, также применимы к соединениям, содержащим заместители, не описанные в примерах, поэтому очевидно, что специалисты в данной области смогут легко получить соединения с заместителями, исходя из описания в примерах и общеизвестных познаний в данной области.
ПРИМЕРЫ
Препаративные примеры
(1) Стадия (A)
4-Бромбензальдегид и бороновую кислоту подвергали реакции сочетания Судзуки с использованием палладиевого катализатора, как показано на схеме 1а. В частности, 4-бромбензальдегид (3 г, 16,21 ммоль), бороновую кислоту (1,28 эквивалента), тетракис(трифенилфосфин)палладий(0) (4-8 мол.%) и карбонат натрия (4,86 эквивалента) кипятили с обратным холодильником в смеси дегазированного толуола с дистиллированной водой (150 мл/21,6 мл) в течение 18 часов с нагреванием. Реакционную смесь фильтровали через целит, а фильтрат дважды промывали этилацетатом (200 мл) и водой (200 мл). Органические слои объединяли, сушили над сульфатом натрия и упаривали in vacuo, а затем разделяли и очищали методом колоночной хроматографии на силикагеле.
Схема 1a
X = F, Cl, CF3, OCF3, OMe
(2) Стадии (B) и (C)
Получали иминовое соединение, подвергая восстановительному аминированию соединение из стадии (А), используя L-аланинамид гидрохлорид или D-аланинамид гидрохлорид (стадия B, схема 1b). Затем получали аминовое соединение путем восстановления иминового соединения цианоборгидридом натрия (стадия C, схема 1c).
После добавления 1,2 эквивалента глицинамида гидрохлорида или L-аланинамида гидрохлорида или D-аланинамида гидрохлорида или L-валинамида гидрохлорида или L-лейцинамида гидрохлорида в безводный метанол до концентрации 0,92 М добавляли 1,5 эквивалента триэтиламина. Когда раствор становился прозрачным, добавляли 1,0 эквивалент альдегида, синтезированного на стадии (А). Через два часа раствор промывали этилацетатом и дистиллированной водой. После сушки органического слоя сульфатом натрия и высушивания in vacuo концентрированный реакционный раствор растворяли в безводном метаноле до концентрации 1,0 М, а затем добавляли 4,0 эквивалента цианоборгидрида натрия при 0°C. После проведения реакции при комнатной температуре в течение 18 часов реакционный раствор промывали этилацетатом и дистиллированной водой. Органический слой сушили над сульфатом натрия и упаривали in vacuo, а затем разделяли и очищали методом колоночной хроматографии на силикагеле.
Схема 1b
(3) Получение солей
Стадия получения соли является необязательной стадией, которая может проводиться при необходимости либо пропускаться. Соединения синтезируют в виде соли с тем, чтобы улучшить растворимость аминового соединения, синтезированного на предыдущей стадии. Соединения в виде солей можно синтезировать с помощью кислоты. Кислоты, которые можно использовать, описаны выше, но не ограничиваются ими.
В частности, соединение в виде соли синтезировали с помощью метансульфоновой кислоты. После нагревания этилацетата до 50-55°C и полного растворения 1,0 эквивалента соединения из стадии (С) добавляли 1,25 эквивалента метансульфоновой кислоты. Через 1 час реакционную смесь охлаждали до комнатной температуры и фильтровали с помощью устройства для вакуумной фильтрации. Фильтрат промывали этилацетатом и сушили без процесса очистки.
Схема 1d
Пример 1. Синтез (S)-2-(((2′-фторбифенил-4-ил)метил)амино)пропанамида метансульфоната
Белое твердое вещество; выход: 90%; 1H-ЯМР (300 MHz, DMSO-d6) δ 9.17 (br s, 2H), 7.94 (br s, 1H), 7.30-7.94 (m, 9H), 4.16 (m, 2H), 3.80 (q, J = 6.54 Hz, 1H), 2.30 (s, 3H), 1.45 (d, J = 6.93 Hz, 3H); 13C-ЯМР (75 MHz, DMSO-d6) δ 170.9 (C(O)), 161.2, 157.9, 136.2, 131.7, 131.2, 131.1, 130.8, 130.5, 130.3, 129.5, 129.4, 128.1, 127.9, 125.5, 125.4, 116.8, 116.5 (ArC), 55.1 (C(O)CH+NH2), 48.7 (+NH2CH2Ph), 16.4 (CH3). Сигнал SCH3 перекрывается с сигналом DMSO.
Пример 2. Синтез (S)-2-(((3′-фторбифенил-4-ил)метил)амино)пропанамида метансульфоната
Белое твердое вещество; выход: 97%; 1H-ЯМР (300 MHz, DMSO-d6) δ 9.15 (br s, 2H), 7.92 (br s, 1H), 7.81 (d, J = 8.25 Hz, 2ArH), 7.68 (br s, 1H), 7.49-7.60 (m, 5ArH), 7.20-7.27 (m, 1ArH), 4.15 (s, 2H), 3.76 (q, J = 9.24 Hz, 1H), 2.30 (s, 3H), 1.44 (d, J = 9.28 Hz, 3H); 13C-ЯМР (75 MHz, DMSO-d6) δ 171.0 (C(O)), 164.9, 161.8, 161.6, 142.4, 142.3, 139.8, 132.0, 131.5, 131.4, 131.2, 127.5, 123.3, 115.2, 114.9, 114.1, 113.8 (ArC), 55.0 (C(O)CH+NH2), 48.6 (+NH2CH2Ph), 16.4 (CH3). Сигнал SCH3 перекрывается с сигналом DMSO.
Пример 3. Синтез (S)-2-(((4′-фторбифенил-4-ил)метил)амино)пропанамида метансульфоната
Белое твердое вещество; выход: 88%; 1H-ЯМР (300 MHz, DMSO-d6) δ 9.18 (br s, 2H), 7.95 (br s, 1H), 7.72-7.77 (m, 4ArH), 7.65 (br s, 1H), 7.56 (d, J = 8.16 Hz, 2ArH), 7.28-7.34 (m, 2ArH), 4.12-4.15 (m, 2H), 3.78-3.84 (m, 1H), 2.37 (s, 3H), 1.45 (d, J = 6.93 Hz, 3H); 13C-ЯМР (75 MHz, DMSO-d6) δ 171.0 (C(O)), 164.9, 161.8, 161.6, 142.4, 142.3, 139.8, 132.0, 131.5, 131.4, 131.2, 127.5, 123.3, 115.2, 114.9, 114.1, 113.8 (ArC), 55.0 (C(O)CH+NH2), 48.6 (+NH2CH2Ph), 16.4 (CH3). Сигнал SCH3 перекрывается с сигналом DMSO.
Пример 4. Синтез (S)-2-(((2′-хлорбифенил-4-ил)метил)амино)пропанамида метансульфоната
Белое твердое вещество; выход: 62%; 1H-ЯМР (300 MHz, DMSO-d6) δ 9.18 (br s, +NH2), 7.96 (br s, 1C(O)NHH′), 7.67 (br s, 1C(O)NHH′), 7.59 (d, J = 8.1 Hz, 3ArH), 7.52 (d, J = 8.2 Hz, 2ArH), 7.39-7.47 (m, 3ArH), 4.09-4.28 (m, 2H), 3.86-3.90 (m, 1H), 2.30 (s, 3H), 1.47 (d, J = 6.9 Hz, 3H); 13C-ЯМР (75 MHz, DMSO-d6) δ 170.9 (C(O)), 139.8, 139.6, 131.9, 131.8, 131.7, 130.4, 130.0, 128.1, 55.2 (C(O)CH+NH2),48.7 (+NH2CH2Ph), 16.4 (CH3). Сигнал SCH3 перекрывается с сигналом DMSO. Другие пики не выявлялись или же перекрываются с другими сигналами.
Пример 5. Синтез (S)-2-(((3′-хлорбифенил-4-ил)метил)амино)пропанамида метансульфоната
Белое твердое вещество; выход: 90%; 1H-ЯМР (400 MHz, DMSO-d6) δ 9.16 (br s, 2H), 7.92 (br s, 1H), 7.81 (d, J = 8.14 Hz, 2ArH), 7.77 (br s, 1H), 7.67-7.70 (m, 2ArH), 7.59 (d, J = 8.14 Hz, 1ArH), 7.52 (t, J = 7.88 Hz, 1ArH), 7.46 (d, J = 8.1 Hz, 1ArH), 4.12-4.20 (m, 2H), 3.78 (d, J = 6.7 Hz, 1H), 2.30 (s, 3H), 1.45 (d, J = 6.7 Hz, 3H); 13C-ЯМР (75 MHz, DMSO-d6) δ 170.9 (C(O)), 141.9, 139.5, 134.3, 132.0, 131.3, 131.2, 128.7, 127.5, 126.9, 125.9 (ArC), 55.1 (C(O)CH+NH2), 48.6 (+NH2CH2Ph), 16.4 (CH3). Сигнал SCH3 перекрывается с сигналом DMSO.
Пример 6. Синтез (S)-2-(((4′-хлорбифенил-4-ил)метил)амино)пропанамида метансульфоната
Белое твердое вещество; выход: 84%; 1H-ЯМР (300 MHz, DMSO-d6) δ 9.17 (br s, 1H), 7.94 (br s, 1H), 7.73-7.78 (m, 4ArH), 7.66 (br s, 1H), 7.53-7.60 (m, 4ArH), 4.10-4.20 (m, 2H), 3.76-3.82 (m, 1H), 2.32 (s, 3H), 1.45 (d, J = 6.93 Hz, 3H); 13C-ЯМР (100 MHz, DMSO-d6) δ 170.9 (C(O)), 139.9, 138.6, 133.2, 131.7, 131.2, 129.5, 129.4, 129.0, 127.3 (ArC), 54.9, (C(O)CH+NH2), 48.5 (+NH2CH2Ph), 16.3 (CH3). Сигнал SCH3 перекрывается с сигналом DMSO.
Пример 7. Синтез (S)-2-(((2′-трифторметилбифенил-4-ил)метил)амино)пропанамида метансульфоната
Белое твердое вещество; выход: 87%; 1H-ЯМР (300 MHz, DMSO-d6) δ 9.20 (br s, +NH2), 7.94 (br s, 1C(O)NHH′), 7.85 (d, J = 7.8 Hz, 1ArH), 7.75 (t, J = 7.4 Hz, 1ArH), 7.61-7.67 (m, 2ArH), 7.57 (d, J = 7.2 Hz, 1ArH), 7.39-7.41 (m, 2ArH, 1C(O)NHH′), 4.11-4.22 (m, 2H), 3.86-3.88 (m, 1H), 2.32 (s, 3H), 1.47 (d, J = 6.7 Hz, 3H); 13C-ЯМР (75 MHz, DMSO-d6) δ 170.9 (C(O)), 140.5, 140.4, 132.8, 132.5, 131.9, 130.1, 129.4, 128.7, 127.3 (q, JC-F = 29.2 Hz), 126.5 (q, JC-F = 5.2 Hz), 124.6 (q, JC-F = 270.5 Hz), 55.4 (C(O)CH+NH2), 48.8 (+NH2CH2Ph), 40.2 (SCH3), 16.4 (CH3).
Пример 8. Синтез (S)-2-(((3′-трифторметилбифенил-4-ил)метил)амино)пропанамида метансульфоната
Белое твердое вещество; выход: 92%; 1H-ЯМР (400 MHz, DMSO-d6) δ 9.16 (br s, 2H), 7.98-8.02 (m, 2ArH), 7.90 (br s, 1H), 7.84 (d, J = 8.10 Hz, 2ArH), 7.69-7.76 (m, 2ArH), 7.65 (br s, 1H), 7.59 (d, J = 8.10 Hz, 2ArH), 4.14 (m, 2H), 3.76 (d, J = 5.36 Hz, 1H), 2.27 (s, 3H), 1.43 (d, J = 6.88 Hz, 3H); 13C-ЯМР (100 MHz, DMSO-d6) δ 170.9 (C(O)), 140.9, 139.5, 132.2, 131.3, 131.2, 130.7, 130.5, 130.2, 129.9, 128.7, 127.7, 126.0, 124.8, 123.6, 123.3 (ArC), 55.0 (C(O)CH+NH2), 48.5 (+NH2CH2Ph), 16.4 (CH3). Сигнал SCH3 перекрывается с сигналом DMSO.
Пример 9. Синтез (S)-2-(((4′-трифторметилбифенил-4-ил)метил)амино)пропанамида метансульфоната
Белое твердое вещество; выход: 82%; 1H-ЯМР (300 MHz, DMSO-d6) δ 9.17 (br s, 2H), 7.93-7.96 (m, 3H), 7.84 (d, J = 7.65 Hz, 4H), 7.63-7.66 (m, 3H), 4.12-4.23 (m, 2H), 3.78-3.83 (m, 1H), 2.32 (s, 3H), 1.46 (d, J = 6.93 Hz, 3H); 13C-ЯМР (75 MHz, DMSO-d6) δ 170.9 (C(O)), 143.8, 139.6, 132.4, 131.3, 128.8, 128.4, 128.0, 127.8, 126.6, 126.3, 126.2, 123.0 (ArC), 54.9 (C(O)CH+NH2), 48.5 (+NH2CH2Ph), 16.4 (CH3). Сигнал SCH3 перекрывается с сигналом DMSO.
Пример 10. Синтез (S)-2-(((3′-трифторметоксибифенил-4-ил)метил)амино)пропанамида метансульфоната
Белое твердое вещество; выход: 90%; 1H-ЯМР (300 MHz, DMSO-d6) δ 9.16 (br s, 2H), 7.92 (br s, 1H), 7.83 (d, J = 8.22 Hz, 2ArH), 7.77 (d, J = 8.22 Hz, 1ArH), 7.59-7.69 (m, 5H), 7.39-7.42 (m, 1ArH), 4.16 (s, 2H), 3.77 (q, J = 7.08 Hz, 1H), 2.30 (s, 3H), 1.44 (d, J = 6.99 Hz, 3H); 13C-ЯМР (100 MHz, DMSO-d6) δ 170.9 (C(O)), 149.5, 142.2, 139.4, 132.2, 131.5, 131.3, 131.2, 127.6, 126.3, 124.4, 121.9, 120.5, 119.8, 119.7, 119.3 (ArC), 55.0, (C(O)CH+NH2), 48.5 (+NH2CH2Ph), 16.4 (CH3). Сигнал SCH3 перекрывается с сигналом DMSO.
Пример 11. Синтез (S)-2-(((4′-трифторметоксибифенил-4-ил)метил)амино)пропанамида метансульфоната
Белое твердое вещество; выход: 92%; 1H-ЯМР (400 MHz, DMSO-d6) δ 9.17 (br s, 2H), 7.92 (br s, 1H), 7.83 (d, J = 8.68 Hz, 2ArH), 7.78 (d, J = 8.16 Hz, 2ArH), 7.67 (br s, 1H), 7.59 (d, J = 8.12 Hz, 2ArH), 7.48 (d, J = 8.20 Hz, 2ArH), 4.16 (s, 2H), 3.78 (s, 1H), 2.30 (s, 3H), 1.44 (d, J = 6.96 Hz, 3H); 13C-ЯМР (100 MHz, DMSO-d6) δ 170.9 (C(O)), 148.5, 139.7, 139., 131.8, 131.3, 131.2, 129.2, 129.1, 127.6, 127.5, 124.4, 122.1, 121.9, 121.8, 119.8, 116.7 (ArC), 55.3, 55.1, 54.9, 54.7 (C(O)CH+NH2), 48.6 (+NH2CH2Ph), 16.4 (CH3). Сигнал SCH3 перекрывается с сигналом DMSO.
Пример 12. Синтез (S)-2-(((3′-метоксибифенил-4-ил)метил)амино)пропанамида метансульфоната
Белое твердое вещество; выход: 91%; 1H-ЯМР (400 MHz, DMSO-d6) δ 9.14 (br s, 2H), 7.91 (br s, 1H), 7.76 (d, J = 8.16 Hz, 2ArH), 7.66 (br s, 1H), 7.66 (br s, 1H), 7.40 (t, J = 7.92 Hz, 3ArH), 7.26 (d, J = 7.76 Hz, 1ArH), 7.21 (m, 1ArH), 6.95-6.98 (m, 1ArH), 4.14 (m, 2H), 3.83 (s, 3H), 3.77 (q, J = 6.96 Hz, 1H), 2.30 (S, 3H), 1.44 (d, J = 6.96 Hz, 3H); 13C-ЯМР (75 MHz, DMSO-d6) δ 170.9 (C(O)), 160.3, 141.3, 141.1, 131.4, 131.1, 130.6, 127.4, 119.5, 113.8, 112.7 (ArC), 55.6, 54.9 (C(O)CH+NH2), 48.6 (+NH2CH2Ph), 16.4 (CH3). Сигнал SCH3 перекрывается с сигналом DMSO.
Пример 13. Синтез (S)-2-(((4′-метоксибифенил-4-ил)метил)амино)пропанамида метансульфоната
Белое твердое вещество; выход: 84%; 1H-ЯМР (300 MHz, DMSO-d6) δ 9.14 (br s, 2H), 7.92 (br s, 1H), 7.64-7.72 (m, 5H), 7.54 (d, J = 8.25 Hz, 2H), 7.04 (d, J = 8.79 Hz, 2ArH), 4.13 (s, 2H), 3.72-3.89 (m, 4H), 2.31 (s, 3H), 1.44 (d, J = 6.96 Hz, 3H); 13C-ЯМР (75 MHz, DMSO-d6) δ 170.9 (C(O)), 159.6, 140.9, 132.1, 131.0, 128.4, 128.2, 126.8, 115.2, 115.0, 114.8, 114.6 (ArC), 55.8, 55.6, 54.9, 54.8 (C(O)CH+NH2), 48.7 (+NH2CH2Ph), 16.4 (CH3). Сигнал SCH3 перекрывается с сигналом DMSO.
Пример 14. Синтез (R)-2-(((3′-фторметоксибифенил-4-ил)метил)амино)пропанамида метансульфоната
Белое твердое вещество; выход: 87%; 1H-ЯМР (300 MHz, DMSO-d6) δ 9.16 (br s, 2H), 7.93 (br s, 1H), 7.81 (d, J = 8.07 Hz, 2H), 7.67 (br s, 1H), 7.49-7.60 (m, 5ArH), 7.23 (m, 1H), 4.15-4.20 (m, 2H), 3.79 (q, J = 6.93 Hz, 1H), 2.30 (s, 3H), 1.44 (d, J = 6.90 Hz, 3H); 13C-ЯМР (75 MHz, DMSO-d6) δ 170.9 (C(O)), 164.8, 161.6, 142.3, 142.2, 139.7, 139.6, 132.0, 131.5, 131.4, 131.2, 127.5, 123.3, 123.2, 115.1, 114.8, 114.0, 113.7 (ArC), 55.0 (C(O)CH+NH2), 48.6 (+NH2CH2Ph), 16.4 (CH3). Сигнал SCH3 перекрывается с сигналом DMSO.
Пример 15. Синтез (R)-2-(((4′-трифторметилбифенил-4-ил)метил)амино)пропанамида метансульфоната
Белое твердое вещество; выход: 87%; 1H-ЯМР (300 MHz, DMSO-d6) δ 9.18 (br s, 2H), 7.93-7.95 (m, 3H), 7.84 (d, J = 7.89 Hz, 4H), 7.62-7.66 (m, 3H), 4.12-4.22 (m, 2H), 3.80 (q, J = 6.27 Hz, 1H), 2.31 (s, 3H), 1.45 (d, J = 6.78 Hz, 3H); 13C-ЯМР (75 MHz, DMSO-d6) δ 170.9 (C(O)), 143.8, 139.5, 132.4, 131.3, 130.2, 129.2, 128.8, 128.4, 128.0, 127.7, 126.6, 126.3, 126.2, 123.0, 119.4 (ArC), 55.1 (C(O)CH+NH2), 48.6 (+NH2CH2Ph), 16.4 (CH3). Сигнал SCH3 перекрывается с сигналом DMSO.
Пример 16. Синтез (R)-2-(((4′-трифторметилбифенил-4-ил)метил)амино)ацетамида метансульфоната
Белое твердое вещество; выход: 90%; 1H-ЯМР (300 MHz, DMSO-d6) δ 9.26 (br s, +NH2), 7.91-7.93 (m, 2ArH, 1C(O)NHH′), 7.79-7.82 (m, 4ArH), 7.65 (d, J = 7.2 Hz, 2ArH), 7.58 (br s, C(O)NHH′), 4.25 (s, 2H), 3.71 (s, 2H), 2.40 (s, 3H); 13C-ЯМР (75 MHz, DMSO-d6) δ 167.3 (C(O)), 143.8, 139.6, 132.3, 131.4, 128.6 (q, JC-F = 31.7 Hz), 128.0, 127.7, 126.3 (q, JC-F = 3.7 Hz), 124.8 (q, JC-F = 270.2 Hz) (ArC), 49.9 (C(O)CH+NH2), 47.3 (+NH2CH2Ph), 40.1 (SCH3).
Пример 17. Синтез (R)-3-метил-2-(((4′-трифторметилбифенил-4-ил)метил)амино)бутанамида метансульфоната
Белое твердое вещество; выход: 74%; 1H-ЯМР (300 MHz, DMSO-d6) δ 9.20 (br s, +NHH′), 8.95 (br s, +NHH′), 7.78-7.96 (m, 6ArH, C(O)NH2), 7.60-7.65 (m, 2ArH), 4.02-4.18 (m, 2H), 3.47-3.69 (m, 1H), 2.30 (s, 3H), 2.16-2.22 (m, 1H), 0.92-1.00 (m, 6H); 13C-ЯМР (75 MHz, DMSO-d6) δ 168.4 (C(O)), 143.8, 139.6, 131.8, 131.7, 128.6 (q, JC-F = 31.8 Hz), 126.3 (q, JC-F = 3.7 Hz), 124.8 (q, JC-F = 270.2 Hz), 64.1 (C(O)CH+NH2), 49.7 (+NH2CH2Ph), 40.2 (SCH3), 29.3 (CHCH2), 19.1 (CH3), 18.1(CH3).
Пример 18. Синтез (R)-4-метил-2-(((4′-трифторметилбифенил-4-ил)метил)амино)пентанамида метансульфоната
Белое твердое вещество; выход: 77%; 1H-ЯМР (300 MHz, DMSO-d6) δ 9.30 (br s, +NHH′), 9.16 (br s, +NHH′), 8.13 (br s, C(O)NHH′), 7.94 (d, J = 7.85 Hz, 2ArH), 7.84 (d, J = 7.80 Hz, 4ArH), 7.79 (br s, C(O)NHH′), 7.63 (d, J = 7.85 Hz, 2ArH), 4.05-4.25 (m, 2H), 3.70-3.83 (m, 1H), 2.35 (s, 3H), 1.59-1.79 (m, 1CH, 2CHCH2), 0.80-1.03 (m,6H); 13C-ЯМР (75 MHz, DMSO-d6) δ 169.9 (C(O)), 143.8, 139.6, 132.2, 131.4, 128.6 (q, JC-F = 31.9 Hz), 128.4, 127.7, 126.3 (q, JC-F = 3.7 Hz), 124.8 (q, JC-F = 270.3 Hz), 58.4 (C(O)CH+NH2), 49.0 (+NH2CH2Ph), 40.2 (SCH3), 24.4, 23.5, 22.3.
Тест-пример 1. Эффект ингибирования активности моноаминоксидазы B (анализ MAO-B)
(A) Из 10 мМ соединения готовили 5 концентраций: 1 мМ, 0,1 мМ, 0,01 мМ, 0,001 мМ и 0,0001 мМ путем серийного разведения в 10 раз, а также готовили 0,05 М натрий-фосфатный буфер (рН 7,4).
(B) Разводили моноаминоксидазу B человека 5 мг/мл до 1/200 в 0,05 М натрий-фосфатном буфере и готовили ферментные буферы путем смешивания с 2 мкл растворов соединений в 5 концентрациях до конечного объема 100 мкл. Ферментные буферы вносили в 96-луночный планшет и проводили реакцию в течение 1 часа.
(C) Смешивали 100 мкл рабочего буфера, полученного добавлением 20 мМ Amplex Red (200 мкл), 100 мМ бензиламинового субстрата (200 мкл) и 200 ед./мл пероксидазы хрена (100 мкл) в 0,05 М натрий-фосфатный (рН 7,4) буфер (9,5 мл), с ферментным буфером (B) в соотношении 1:1 и проводили инкубацию в течение 2 часов, после чего измеряли поглощение (570 нм). Измеренная активность соединений настоящего изобретения представлена в табл. 1.
В качестве контроля использовали сафинамид, который хорошо известен как обратимый ингибитор MAO-B. Как видно из химической формулы 2, сафинамид имеет структуру, в которой к α-аминоамиду по настоящему изобретению вместо бифенильной группы присоединена бензилоксифенильная группа:
(S)-сафинамид (2)
Сафинамид хорошо известен как вещество, проявляющее превосходный эффект ингибирования MAO-B и эффективность у животных. Однако его применение в качестве селективного ингибитора MAO-B ограничено тем, что он также действует как ингибитор кальциевых и натриевых каналов.
Таблица 1
| Стерео | R | X |
MAO-B
(IC 50 , мкМ) |
MAO-A
(IC 50 , мкМ) |
|
| Пример 1 | S | CH3 | 2′-F | > 10 | > 100 |
| Пример 2 | S | CH3 | 3′-F | > 10 | > 100 |
| Пример 3 | S | CH3 | 4′-F | > 10 | > 100 |
| Пример 4 | S | CH3 | 2′-Cl | > 10 | > 100 |
| Пример 5 | S | CH3 | 3′-Cl | 0,442 | > 100 |
| Пример 6 | S | CH3 | 4′-Cl | 0,416 | > 100 |
| Пример 7 | S | CH3 | 2′-CF3 | > 10 | > 100 |
| Пример 8 | S | CH3 | 3′-CF3 | 0,316 | > 100 |
| Пример 9 | S | CH3 | 4′-CF3 | 0,042 | > 500 |
| Пример 10 | S | CH3 | 3′-OCF3 | 0,216 | > 100 |
| Пример 11 | S | CH3 | 4′-OCF3 | 0,098 | > 100 |
| Пример 12 | S | CH3 | 3′-OCH3 | 3,33 | > 100 |
| Пример 13 | S | CH3 | 4′-OCH3 | 1,06 | > 100 |
| Пример 14 | R | CH3 | 3′-F | > 10 | > 100 |
| Пример 15 | R | CH3 | 4′-CF3 | 0,082 | > 100 |
| Пример 16 | S | H | 4′-CF3 | 0,126 | > 100 |
| Пример 17 | S | CH(CH3)2 | 4′-CF3 | 4,073 | > 100 |
| Пример 18 | S | CH2CH(CH3)2 | 4′-CF3 | 5,302 | > 100 |
| S-сафинамид | - | - | - | 0,120 | > 100 |
| Селегилин | - | - | - | 0,009 | ~1 |
Как видно из таблицы 1, при введении различных функциональных групп в положение X бифенильной группы лучшая активность достигалась тогда, когда функциональная группа вводилась в пара-положение по сравнению с орто- или мета-положением, а превосходный ингибирующий эффект наблюдался при введении -CF3 или -OCF3 по сравнению с введением F или Cl. В частности, соединение из примера 9 проявляло наилучшую активность, которая была более чем в 2 раза выше, чем у сафинамида. Хотя соединение из примера 15, которое является стереоизомером соединения из примера 9, также проявляло отличную активность, но его активность была несколько ниже, чем у соединения из примера 9. Кроме того, вводили и такие алкильные группы, как водород, изопропил и изобутил вместо метила в положении R. В то время, как соединение из примера 16, в которое вводили водород, проявляло небольшое снижение активности, существенное снижение активности наблюдалось при введении изопропильной и изобутильной группы, которые крупнее метильной группы.
Также исследовали цитотоксичность и прохождение через гематоэнцефалический барьер (BBB) соединений из примеров по настоящему изобретению. Было установлено следующее.
(1) Положение заместителя X предпочтительно в порядке пара-, мета-, орто-. В частности, пара-положение наиболее предпочтительно с точки зрения ингибирования активности MAO-B, к тому же проявляется эффект заметного снижения антителозависимой клеточной цитотоксичности по сравнению с орто- и мета-положением.
(2) В качестве заместителя X превосходное ингибирование активности MAO-B проявляли -OCF3, -CF3 и -Cl. В частности, -OCF3 и -CF3 проявляли лучшее ингибирование активности MAO-B, чем -Cl, -OCH3 или -F, а также проявляется эффект более легкого прохождения через гематоэнцефалический барьер.
(3) S-изомер проявлял лучшее ингибирование активности MAO-B и значительно лучшее восстановление активности MAO-B по сравнению с R-изомером. Кроме того, проявлялась хорошая метаболическая стабильность и значительно меньшая цитотоксичность.
(4) В качестве заместителя R превосходное ингибирование активности MAO-B проявляли -CH3 и -H. В частности, -CH3 проявляет лучшее ингибирование активности MAO-B, чем -H, -CH(CH3)2 или -CH2CH(CH3)2, а также проявляется эффект более легкого прохождения через гематоэнцефалический барьер.
В дальнейшем тест-примеры выполнялись на соединении из примера 9 в качестве репрезентативного примера соединений для проверки эффективности. Очевидно, что такие же тесты можно проводить и на других соединениях, исходя из описания в настоящем изобретении.
Тест-пример 2. Проверка обратимости ингибирующего эффекта
Обратимость ингибирующего эффекта исследовали в соответствии со способом, описанным на фиг. 1.
Готовили ферментный буфер путем разведения моноаминоксидазы B человека 5 мг/мл в 0,05 М натрий-фосфатном (рН 7,4) буфере до 1/40. После смешивания 441 мкл ферментного буфера с 9 мкл соединения из примера 9 (0,1 мМ) проводили реакцию в течение 2 часов.
Реакционный раствор разделяли на две части по 200 мкл. Одну переносили в 96-луночный планшет (A), а оставшуюся центрифугировали при 14000 g в течение 20 мин в центрифужном фильтре (Amicon® Ultra-3K) (B). После добавления 500 мкл 0,05 М натрий-фосфатного (рН 7,4) буфера в центрифужный фильтр проводили центрифугирование при 14000 g в течение 20 мин. Эту процедуру повторяли 2 раза.
Оставшуюся в центрифужном фильтре моноаминоксидазу B человека разбавляли добавлением 200 мкл 0,05 М натрий-фосфатного (рН 7,4) буфера в центрифужный фильтр, а затем переносили в 96-луночный планшет. Затем 100 мкл рабочего буфера, полученного добавлением 20 мМ Amplex Red (200 мкл), 100 мМ бензиламинового субстрата (200 мкл) и 200 ед./мл пероксидазы хрена (100 мкл) в 0,05 М натрий-фосфатный (рН 7,4) буфер (9,5 мл), смешивали с ферментным буфером в соотношении 1:1 и после инкубации в течение 2 часов измеряли поглощение (570 нм).
В качестве контроля для проверки обратимости соединений настоящего изобретения использовали селегилин, который хорошо известен как необратимый ингибитор MAO-B. Результаты представлены в таблице 2.
Таблица 2
| Доза | Степень ингибирования MAO-B (A) | Степень ингибирования MAO-B (B) | Восстановление активности MAO-B | Обратимость | |
| Селегилин | 1 мкМ | > 90% | > 90% | 0% | необратимо |
| Пример 9 | 1 мкМ | 82% | < 15% | > 85% | обратимо |
Как видно из таблицы 2, оба соединения проявляли ингибирующий эффект на 80% или выше при 1 мкМ. При измерении активности MAO-B опять после 3-кратной промывки буфером необратимый ингибитор селегилин сохранял ингибирующий эффект, тогда как соединение настоящего изобретения не проявляло ингибирующего эффекта, так как оно смывалось во время промывки. Тот факт, что активность MAO-B восстанавливалась при отмывании ингибирующего соединения, свидетельствует, что соединение по настоящему изобретению является обратимым ингибитором.
Тест-пример 3. Эффективность соединения 9 на MPTP-модели болезни Паркинсона у мышей
Эффективность соединения 9 на MPTP-модели болезни Паркинсона у мышей сравнивали с эффективностью существующего ингибитора MAO-B сафинамида. Для того чтобы индуцировать болезнь Паркинсона, вводили 20 мг/кг MPTP внутрибрюшинно, а ингибиторы MAO-B, включая соединение 9, вводили перорально по 10 мг/кг. Сначала ингибитор MAO-B вводили в течение 3 дней, начиная за 1 день до инъекции MPTP, а его влияние количественно анализировали иммуногистохимическим методом, используя TH (тирозингидроксилазу) в качестве маркера дофаминергических нейронов. В качестве частей мозга для анализа были выбраны черная субстанция и полосатое тело, где присутствуют дофаминергические нейроны. Хорошо известно, что экспрессия ТН в этих участках значительно снижается при болезни Паркинсона. В следующих экспериментах исследовали, защищает ли соединение 9 дофаминергические нейроны от MPTP путем ингибирования MAO-B.
(1) Сначала, после введения один раз соединения 9 проверяли его эффективность на модели у обработанных MPTP мышей.
Как видно из фиг. 2a, у мышей, обработанных только MPTP, экспрессия TH при окрашивании на тирозингидроксилазу заметно снижалась по сравнению с контрольной группой (физраствор), что указывает на заметное уменьшение количества дофаминергических нейронов. Однако у мышей, получавших ингибитор MAO-B сафинамид и соединение 9, выживаемость дофаминергических нейронов была сравнима с таковой у контрольной группы.
(2) Затем, после постановки MPTP-модели на мышах путем обработки MPTP, с 3-го дня вводили соединение и наблюдали, будут ли восстанавливаться дофаминергические нейроны на животной модели болезни Паркинсона при ингибировании MAO-B.
Как видно из фиг. 2b, в группе, обработанной MPTP, нейроны разрушались, как и в эксперименте с предварительной обработкой. Напротив, в группе, получавшей ингибитор MAO-B сафинамид и соединение 9, проявлялась значительно меньшая гибель нейронов. В частности, соединение 9 восстанавливало дофаминергические нейроны в черной субстанции до уровня, сравнимого с контрольной группой, не обработанной MPTP.
(3) Затем, учитывая долгосрочный период приема лекарств, исследовали, будет ли эффективным введение ингибитора MAO-B в течение 30 дней для защиты нейронов на MPTP-модели болезни Паркинсона. В полосатом теле необратимый ингибитор селегилин и соединение 9 защищали дофаминергические нейроны до уровня, сравнимого с контрольной группой, не обработанной MPTP. Сафинамид проявлял несколько меньшую эффективность. С другой стороны, в черной субстанции эффективность необратимого ингибитора селегилина снижалась, а количество нейронов восстанавливалось незначительно по сравнению с группой МРТР. Напротив, обратимый ингибитор – соединение 9 защищал нейроны аналогично контрольной группе. Это говорит о том, что эффект ингибирования MAO-B у селегилина компенсируется при долгосрочном приеме посредством компенсаторного механизма, так как он ингибирует MAO-B необратимо. Именно по этой причине селегилин неэффективен при лечении болезни Паркинсона при длительном приеме. Таким образом, как видно из фиг. 2c, соединение 9 проявляет высокую эффективность по сравнению с селегилином и сафинамидом по трем тестам на MPTP-модели болезни Паркинсона.
Тест-пример 4. Эффективность соединения 9 на модели болезни Альцгеймера у мышей APP/PS1
Авторы настоящего изобретения недавно открыли новую возможность лечения болезни Альцгеймера посредством ингибирования MAO-B (Jo et al., Nature Medicine 2014). В этом исследовании они обнаружили, что, как видно из фиг. 3a-3b, в то время, как необратимый ингибитор MAO-B селегилин сначала проявляет превосходную эффективность на модели болезни Альцгеймера, но его эффективность сильно снижается через 2 недели, а через 4 недели эффективность не наблюдается, обратимый ингибитор MAO-B сафинамид сохраняет отличную эффективность даже через 2 недели.
В тест-примере 4 эффективность обратимого ингибитора MAO-B – соединения 9 исследовали на мышах APP/PS1 следующим образом. Сначала мышам APP/PS1 давали свободно принимать соединение 9 в течение 2 недель при дозировке путем смешивания в питьевой воде. После 2 недель приема делали срезы тканей головного мозга и подводили электроды к гранулярным клеткам зубчатой извилины по методу патч-кламп. С помощью электродов можно детектировать изменения мембранного потенциала в гранулярных клетках и спайки. Вероятность спайков вычисляли путем подсчета количества спайков у гранулярных клеток при нанесении 10 электрических стимулов на зубчатую извилину. При измерении вероятности спайков с варьированием интенсивности электрической стимуляции после обработки соединением 9 в течение 2 недель наблюдалась более высокая эффективность, как видно из фиг. 3b. Эффективность соединения 9 была выше, чем у сафинамида.
Тест-пример 5. Дифференцируемость и превосходство соединения 9 в сравнении с сафинамидом
Существующий обратимый ингибитор MAO-B сафинамид хорошо известен не только своим эффектом ингибирования MAO-B, но также и как ингибитор натриевых каналов и кальциевых каналов. Терапевтическое средство для болезни Паркинсона и болезни Альцгеймера, которое селективно ингибирует MAO-B с минимальным ингибированием каналов, может обладать хорошей стабильностью в качестве терапевтического средства для заболеваний мозга. Для того, чтобы исследовать эффект ингибирования каналов, исследовали ингибирование возбудимости каналов электрофизиологическими методами, используя DGGCs (гранулярные клетки зубчатой извилины) гиппокампа.
Как видно из фиг. 4, в то время, как сафинамид проявлял эффект ингибирования возбудимости примерно на 40% при 10 мкМ, соединение 9 почти не проявляло эффекта ингибирования. Соединение 9 проявляло меньший ингибирующий эффект, чем сафинамид, и при более высокой концентрации в 50 мкМ. Это свидетельствует о том, что эффект ингибирования возбудимости у соединения 9 для DGGC гиппокампа намного меньше, чем у сафинамида. Этот результат свидетельствует, что соединение 9 является стабильным в качестве селективного ингибитора MAO-B вследствие гораздо меньшего ингибирующего эффекта на каналы по сравнению с сафинамидом.
Тест-пример 6. Молекулярное моделирование соединения 9 и сафинамида для MAO-B
Прогнозировали режим связывания соединения 9 с MAO-B посредством эксперимента по стыковке. Сначала прогнозировали режим связывания обратимого ингибитора сафинамида по рентгеновской кристаллической структуре MAO-B. Как видно из фиг. 5, превосходное сродство связывания наблюдалось в кармане, который известен в качестве активного сайта MAO-B (SP-оценка: -10,862 ккал/моль). При проведении расчетов для соединения 9 было предсказано, что оно связывается в том же активном центре, что и сафинамид, а сродство связывания оценивается как более сильное, чем у сафинамида (SP-оценка: -11,795 ккал/моль).
Тест-пример 7. Эффект ингибирования ожирения
A. Постановка модели ожирения на мышах при диете с высоким содержанием жира
7-недельных мышей разделяли на 2 группы, которые получали обычный рацион (корм, белый) и диету с высоким содержанием жира (HFD, синий), соответственно, в течение 8 недель. Результаты представлены на фиг. 6.
Общее количество калорий, получаемых мышами при обычном рационе и при высоком содержании жира, делали одинаковым. Через 8 недель средний вес тела в группе с обычным рационом составлял 3 г, что примерно на 20% больше, чем исходный вес 2,5 г. Напротив, средний вес тела при диете с высоким содержанием жира почти удвоился, примерно до 4,8 г.
B. Появление реактивных астроцитов у мышей с ожирением
У мышей, получавших диету с высоким содержанием жира в течение 8 недель, наблюдалось изменение реактивных астроцитов в аркуатном ядре. Как видно из фиг. 7, в аркуатном ядре у мышей при диете с высоким содержанием жира наблюдалось заметное повышение GFAP, который является биомаркером реактивных астроцитов, по сравнению с мышами на обычной диете. Наряду с возрастанием реактивных астроцитов также отмечалась гиперпродукция γ-аминомасляной кислоты (ГАМК).
C. Снижение массы тела у мышей с ожирением под действием соединения из примера 9
Исследовали эффект уменьшения веса тела соединением из примера 9 на модели ожирения у получавших HFD (диету с высоким содержанием жира) мышей. Как видно из фиг. 8, соединение из примера 9 тормозило возрастание веса тела вследствие диеты с высоким содержанием жира зависимым от концентрации образом, при этом не было отличий в количестве принимаемой пищи. В частности, мыши с высоким содержанием жира проявляли повышение веса на 20% и больше в сравнении с нормальными мышами (контроль). Введение соединения из примера 9 приводило к снижению массы тела. В частности, снижение массы тела проявлялось и в группе 10 мг/кг/день, и в группе 100 мг/кг/день зависимым от концентрации образом.
D. Повышение ГАМК в реактивных астроцитах аркуатного ядра у мышей с ожирением и снижение ГАМК под действием соединения из примера 9
Результаты введения соединения из примера 9 получавшим диету с высоким содержанием жира мышам представлены на фиг. 9. В аркуатном ядре наблюдалось заметное снижение GFAP, который является биомаркером реактивных астроцитов, а также отмечалось эффективное ингибирование гиперпродукции ГАМК.
Из этих результатов видно, что композиции, содержащие α-аминоамидные производные по настоящему изобретению в качестве активного ингредиента, могут применяться в качестве терапевтического средства при ожирении, так как α-аминоамидные производные могут проявлять эффективность против ожирения, обратимо ингибируя MAO-B.
Промышленная применимость
Поскольку α-аминоамидные производные могут предотвращать гиперпродукцию ГАМК в реактивных астроцитах гипоталамуса путем ингибирования MAO-B, они могут проявлять эффект лечения ожирения, действуя на POMC-нейроны, которые избирательно индуцируют потребление энергии. Соответственно, они могут преодолеть проблемы побочных эффектов и эффективности существующих терапевтических средств от ожирения, сосредоточенных на центральной нервной системе и регуляции метаболизма сахаров и жиров, и могут применяться в качестве нового терапевтического средства от ожирения. Кроме того, они могут применяться в качестве терапевтического средства для таких нейродегенеративных заболеваний, как болезнь Паркинсона, болезнь Альцгеймера и т.п., поскольку они могут ингибировать денатурацию или разрушение дофаминергических нейронов.
Claims (31)
1. α-Аминоамидное производное, представленное химической формулой 1, или его фармацевтически приемлемая соль:
где: R означает водород или C1-7-алкил; а
Х выбран из галогена, галогенированного C1-7-алкила, и галогенированного C1-7-алкокси.
2. α-Аминоамидное производное или его фармацевтически приемлемая соль по п. 1, где:
R означает водород или метил; а
X выбран из п-трифторметила, п-трифторметокси, м-трифторметила и м-трифторметокси.
3. α-Аминоамидное производное или его фармацевтически приемлемая соль по п. 1, где:
R означает водород или метил; а
X означает п-трифторметил или п-трифторметокси.
4. α-Аминоамидное производное или его фармацевтически приемлемая соль по п. 1, где:
R означает метил; а
X означает п-трифторметил или п-трифторметокси.
5. α-Аминоамидное производное или его фармацевтически приемлемая соль по п. 1, где:
R означает метил; а
X означает п-трифторметил.
6. α-Аминоамидное производное или его фармацевтически приемлемая соль по п. 1, где α-аминоамидное производное выбрано из следующих соединений:
(S)-2-(((3′-хлорбифенил-4-ил)метил)амино)пропанамид метансульфонат,
(S)-2-(((4′-хлорбифенил-4-ил)метил)амино)пропанамид метансульфонат,
(S)-2-(((3′-трифторметилбифенил-4-ил)метил)амино)пропанамид метансульфонат,
(S)-2-(((4′-трифторметилбифенил-4-ил)метил)амино)пропанамид метансульфонат,
(S)-2-(((3′-трифторметоксибифенил4-ил)метил)амино)пропанамид метансульфонат,
(S)-2-(((4′-трифторметоксибифенил4-ил)метил)амино)пропанамид метансульфонат,
(R)-2-(((4′-трифторметилбифенил-4-ил)метил)амино)пропанамид метансульфонат,
(R)-2-(((4′-трифторметилбифенил-4-ил)метил)амино)ацетамид метансульфонат.
7. α-аминоамидное производное или его фармацевтически приемлемая соль по п. 1, где α-аминоамидное производное представляет собой (S)-изомер.
8. Ингибитор моноаминоксидазы В (MAO-B), включающий α-аминоамидное производное по любому из пп. 1-7 или его фармацевтически приемлемую соль в качестве активного ингредиента.
9. Фармацевтическая композиция для лечения или профилактики нейродегенеративного заболевания, которая содержит α-аминоамидное производное по любому из пп. 1-7 или его фармацевтически приемлемую соль в качестве активного ингредиента.
10. Фармацевтическая композиция для лечения или профилактики нейродегенеративного заболевания по п. 9, где нейродегенеративное заболевание выбрано из болезни Паркинсона, болезни Альцгеймера, эпилепсии и депрессии.
11. Ингибитор образования γ-аминомасляной кислоты (ГАМК), содержащий α-аминоамидное производное по любому из пп. 1-7 или его фармацевтически приемлемую соль в качестве активного ингредиента.
12. Фармацевтическая композиция для лечения или профилактики ожирения, которая включает α-аминоамидное производное по любому из пп. 1-7 или его фармацевтически приемлемую соль в качестве активного ингредиента.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020140132983A KR101679568B1 (ko) | 2014-10-02 | 2014-10-02 | 알파-아미노아미드 유도체 화합물 및 이를 포함하는 약학적 조성물 |
| KR10-2014-0132983 | 2014-10-02 | ||
| KR1020150132281A KR101746060B1 (ko) | 2015-09-18 | 2015-09-18 | 항비만 치료용 가역적 마오비 저해제 |
| KR10-2015-0132281 | 2015-09-18 | ||
| PCT/KR2015/010104 WO2016052928A1 (ko) | 2014-10-02 | 2015-09-24 | 알파-아미노아미드 유도체 화합물 및 이를 포함하는 약학적 조성물 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| RU2017114506A3 RU2017114506A3 (ru) | 2018-11-05 |
| RU2017114506A RU2017114506A (ru) | 2018-11-05 |
| RU2673622C2 true RU2673622C2 (ru) | 2018-11-29 |
Family
ID=55630900
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2017114506A RU2673622C2 (ru) | 2014-10-02 | 2015-09-24 | Соединения альфа-аминоамидных производных и содержащие их фармацевтические композиции |
Country Status (11)
| Country | Link |
|---|---|
| US (2) | US10676425B2 (ru) |
| EP (1) | EP3202759B1 (ru) |
| JP (1) | JP6446131B2 (ru) |
| CN (1) | CN106795098B (ru) |
| AU (1) | AU2015324914B2 (ru) |
| BR (1) | BR112017006690B1 (ru) |
| CA (1) | CA2963371C (ru) |
| ES (1) | ES2774800T3 (ru) |
| PT (1) | PT3202759T (ru) |
| RU (1) | RU2673622C2 (ru) |
| WO (1) | WO2016052928A1 (ru) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2015367977B9 (en) * | 2014-12-24 | 2020-02-06 | Lg Chem, Ltd | Biaryl derivative as GPR120 agonist |
| CN109251155A (zh) * | 2017-07-14 | 2019-01-22 | 广东东阳光药业有限公司 | α-氨基酰胺衍生物及其用途 |
| CN108912029B (zh) * | 2017-08-25 | 2021-10-01 | 广东东阳光药业有限公司 | 含氮杂环酰胺衍生物及其用途 |
| KR101970099B1 (ko) * | 2018-02-07 | 2019-04-17 | 한국과학기술연구원 | 척수 손상의 예방 및 치료용 조성물 |
| KR102005019B1 (ko) * | 2018-04-04 | 2019-07-31 | 한국과학기술연구원 | 뇌졸중의 예방 및 치료용 조성물 |
| KR102531540B1 (ko) * | 2020-09-18 | 2023-05-16 | 한국과학기술연구원 | 류마티스 관절염 예방 또는 치료용 조성물 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5391577A (en) * | 1989-05-25 | 1995-02-21 | Farmitalia Carlo Erba S R L | N-phenylalkyl substituted α-amino carboxamide derivatives and process for their preparation |
| WO2012078994A1 (en) * | 2010-12-09 | 2012-06-14 | Janssen Pharmaceutica Nv | Imidazo [1, 2-a] pyridine sulfonamides as trpm8 modulators |
| US8283380B2 (en) * | 2003-04-11 | 2012-10-09 | Newron Pharmaceuticals S.P.A. | Methods for treatment of parkinson's disease |
| RU2397160C9 (ru) * | 2005-12-22 | 2012-10-27 | НЬЮРОН ФАРМАСЬЮТИКАЛЗ С.п.А. | 2-фенилэтиламинопроизводные в качестве модуляторов кальциевых и/или натриевых каналов |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101679568B1 (ko) | 2014-10-02 | 2016-11-28 | 한국과학기술연구원 | 알파-아미노아미드 유도체 화합물 및 이를 포함하는 약학적 조성물 |
-
2015
- 2015-09-24 EP EP15847985.7A patent/EP3202759B1/en active Active
- 2015-09-24 US US15/516,395 patent/US10676425B2/en active Active
- 2015-09-24 RU RU2017114506A patent/RU2673622C2/ru active
- 2015-09-24 PT PT158479857T patent/PT3202759T/pt unknown
- 2015-09-24 WO PCT/KR2015/010104 patent/WO2016052928A1/ko active Application Filing
- 2015-09-24 ES ES15847985T patent/ES2774800T3/es active Active
- 2015-09-24 CA CA2963371A patent/CA2963371C/en active Active
- 2015-09-24 BR BR112017006690-4A patent/BR112017006690B1/pt active IP Right Grant
- 2015-09-24 JP JP2017518101A patent/JP6446131B2/ja active Active
- 2015-09-24 CN CN201580053824.8A patent/CN106795098B/zh active Active
- 2015-09-24 AU AU2015324914A patent/AU2015324914B2/en active Active
-
2020
- 2020-04-24 US US16/858,433 patent/US11053190B2/en active Active
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5391577A (en) * | 1989-05-25 | 1995-02-21 | Farmitalia Carlo Erba S R L | N-phenylalkyl substituted α-amino carboxamide derivatives and process for their preparation |
| US8283380B2 (en) * | 2003-04-11 | 2012-10-09 | Newron Pharmaceuticals S.P.A. | Methods for treatment of parkinson's disease |
| RU2397160C9 (ru) * | 2005-12-22 | 2012-10-27 | НЬЮРОН ФАРМАСЬЮТИКАЛЗ С.п.А. | 2-фенилэтиламинопроизводные в качестве модуляторов кальциевых и/или натриевых каналов |
| WO2012078994A1 (en) * | 2010-12-09 | 2012-06-14 | Janssen Pharmaceutica Nv | Imidazo [1, 2-a] pyridine sulfonamides as trpm8 modulators |
Non-Patent Citations (4)
Also Published As
| Publication number | Publication date |
|---|---|
| CN106795098B (zh) | 2020-07-14 |
| PT3202759T (pt) | 2020-03-06 |
| US10676425B2 (en) | 2020-06-09 |
| CA2963371C (en) | 2020-06-02 |
| ES2774800T3 (es) | 2020-07-22 |
| EP3202759B1 (en) | 2019-12-18 |
| EP3202759A4 (en) | 2018-05-09 |
| JP2017531647A (ja) | 2017-10-26 |
| US11053190B2 (en) | 2021-07-06 |
| CN106795098A (zh) | 2017-05-31 |
| AU2015324914A1 (en) | 2017-05-04 |
| RU2017114506A3 (ru) | 2018-11-05 |
| RU2017114506A (ru) | 2018-11-05 |
| CA2963371A1 (en) | 2016-04-07 |
| BR112017006690A2 (pt) | 2018-01-02 |
| US20200308104A1 (en) | 2020-10-01 |
| BR112017006690B1 (pt) | 2023-11-21 |
| BR112017006690A8 (pt) | 2018-02-06 |
| WO2016052928A1 (ko) | 2016-04-07 |
| AU2015324914B2 (en) | 2018-10-04 |
| JP6446131B2 (ja) | 2018-12-26 |
| US20170298011A1 (en) | 2017-10-19 |
| EP3202759A1 (en) | 2017-08-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2673622C2 (ru) | Соединения альфа-аминоамидных производных и содержащие их фармацевтические композиции | |
| DK2041068T3 (en) | POSITIVELY CHARGED, WATER SOLUBLE PRODRUGS OF IBUPROFEN WITH VERY FAST SKIN PENETRATION SPEED | |
| US9518044B2 (en) | Prostaglandin receptor EP2 antagonists, derivatives, compositions, and uses related thereto | |
| JP5378221B2 (ja) | 非常に高い皮膚浸透率を有するオキシカム及び関連化合物の正荷電水溶性プロドラッグ | |
| EP2750671A2 (en) | Lysine demethylase inhibitors for thrombosis and cardiovascular diseases | |
| EP2712315A1 (en) | Lysine demethylase inhibitors for myeloproliferative disorders | |
| JP6506248B2 (ja) | 二環式鎮痛化合物 | |
| EP2741741A2 (en) | Lysine demethylase inhibitors for inflammatory diseases or conditions | |
| CA2658712A1 (en) | Positively charged water-soluble prodrugs of diclofenac with very fast skin penetration rate | |
| KR101679568B1 (ko) | 알파-아미노아미드 유도체 화합물 및 이를 포함하는 약학적 조성물 | |
| EP3833343B1 (en) | Heterocyclic flavone derivatives, compositions, and methods related thereto | |
| AU2016313138A1 (en) | Brain-penetrant chromone oxime derivative for the therapy of levodopa-induced dyskinesia | |
| RU2591210C2 (ru) | Соединения и способы лечения боли и других расстройств | |
| JP2012501301A (ja) | ガボキサドールおよびpat1阻害薬またはoat阻害薬を含む医薬組成物 | |
| KR101746060B1 (ko) | 항비만 치료용 가역적 마오비 저해제 | |
| WO2014129513A1 (ja) | 潰瘍性大腸炎の予防または治療剤と新規フラーレン誘導体 | |
| WO2014005721A1 (en) | Use of (r)-phenylpiracetam for the treatment of parkinson's disease | |
| JP2019509321A (ja) | 疼痛を処置するための組み合わせ | |
| US20150258197A1 (en) | Eutectic isometheptene mucate | |
| JP2004508312A (ja) | 置換ヒドラジン誘導体 | |
| KR20210061357A (ko) | 통증을 치료하기 위해 페녹시프로필아민 화합물을 사용하는 방법 | |
| OA18597A (en) | Brain-penetrant chromone oxime derivative for the therapy of levodopa-induced dyskinesia. |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PC41 | Official registration of the transfer of exclusive right |
Effective date: 20210205 |