RU2623877C1 - Method for obtaining of rifampicine polymeric complexes with reduced toxicity and high antituberculosis activity - Google Patents
Method for obtaining of rifampicine polymeric complexes with reduced toxicity and high antituberculosis activity Download PDFInfo
- Publication number
- RU2623877C1 RU2623877C1 RU2016131929A RU2016131929A RU2623877C1 RU 2623877 C1 RU2623877 C1 RU 2623877C1 RU 2016131929 A RU2016131929 A RU 2016131929A RU 2016131929 A RU2016131929 A RU 2016131929A RU 2623877 C1 RU2623877 C1 RU 2623877C1
- Authority
- RU
- Russia
- Prior art keywords
- rifampicin
- polymer
- rifampicine
- activity
- reduced toxicity
- Prior art date
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/496—Non-condensed piperazines containing further heterocyclic rings, e.g. rifampin, thiothixene
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/20—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing sulfur, e.g. dimethyl sulfoxide [DMSO], docusate, sodium lauryl sulfate or aminosulfonic acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/32—Macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. carbomers, poly(meth)acrylates, or polyvinyl pyrrolidone
Abstract
Description
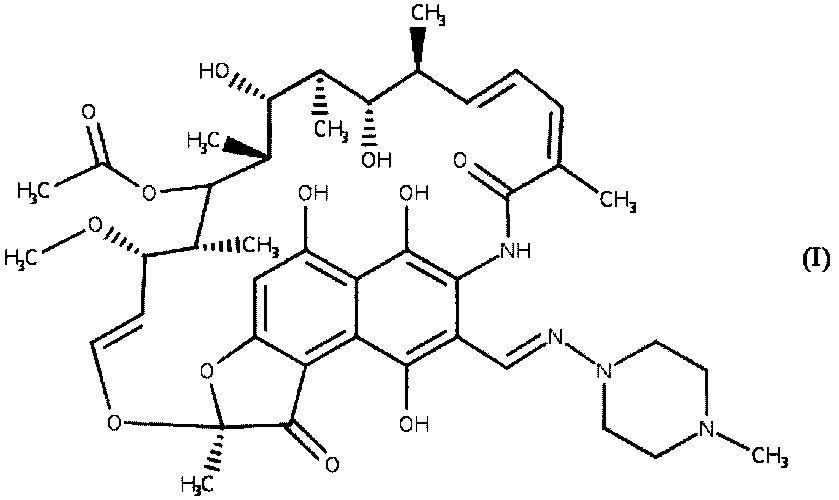
Способ относится к химии высокомолекулярных соединений, а именно к способу получения биологически активных полимеров, и касается получения полимерных комплексов антибиотика рифампицина. Антибиотик рифампицин (I) является одним из основных эффективных средств, используемых в настоящее время в комбинированной терапии туберкулезных заболеваний.The method relates to the chemistry of high molecular weight compounds, and in particular to a method for producing biologically active polymers, and for obtaining polymer complexes of the antibiotic rifampicin. The rifampicin (I) antibiotic is one of the main effective agents currently used in combination therapy of tuberculosis diseases.
Однако рифампицин токсичен, в частности обладает выраженной гепатотоксичностью. Поскольку рифампицин незаменим при лечении туберкулеза, занимающего первое место в структуре смертности от инфекционных заболеваний, модификация его свойств является актуальной задачей. При этом важно добиться не только снижения токсичности этого антибиотика, но и полного сохранения его биоспецефической активности. Как известно [Г.Е. Афиногенов, Е.Ф. Панарин. Антимикробные полимеры. СПб.: Гиппократ, 1993, 261 с.], одним из распространенных, технологичных способов снижения токсичности лекарственных веществ (ЛВ) является их комплексообразование с синтетическими полиэлектролитами в водных растворах.However, rifampicin is toxic, in particular, has pronounced hepatotoxicity. Since rifampicin is indispensable in the treatment of tuberculosis, which occupies the first place in the structure of mortality from infectious diseases, the modification of its properties is an urgent task. It is important to achieve not only a reduction in the toxicity of this antibiotic, but also a complete preservation of its biospecific activity. As is known [G.E. Afinogenov, E.F. Panarin. Antimicrobial polymers. SPb .: Hippocrates, 1993, 261 pp.], One of the common, technologically advanced ways to reduce the toxicity of drugs (drugs) is their complexation with synthetic polyelectrolytes in aqueous solutions.
Ближайшим аналогом заявляемого способа являются водорастворимые комплексы рифампицина (II) на основе сополимеров N-винил-2-пирролидона (ВП) с 3-бутеновой кислотой общей формулы:The closest analogue of the proposed method are water-soluble complexes of rifampicin (II) based on copolymers of N-vinyl-2-pyrrolidone (VP) with 3-butenoic acid of the general formula:
Комплексообразование проводят в гетерофазных условиях при добавлении к водному раствору полиэлектролита нерастворимого в воде рифампицина при массовом соотношении полиэлектролит : антибиотик, равном 2,3:1. Полимерные комплексы содержат 20,6-25,2 мас. % антибиотика. По показателю цитотоксичности они в 2,2-2,6 раза менее токсичны, чем рифампицин [М.С. Борисенко, Н.В. Захарова, Е.Б. Тарабукина, М.В. Соловский// ЖПХ, 2015. Т. 88. Вып. 11. С. 1579-1585]. Однако известные полимерные комплексы рифампицина ингибируют рост микобактерий туберкулеза при достаточно высокой концентрации (МИК), равной 50 мкг/мл. В то же время МИК рифампицина в отношении Micobacterium tuberculosis H37Rv составляет 3,1 мкг/мл.Complexation is carried out under heterophasic conditions when water-insoluble rifampicin is added to an aqueous solution of a polyelectrolyte at a weight ratio of polyelectrolyte: antibiotic of 2.3: 1. Polymer complexes contain 20.6-25.2 wt. % antibiotic. In terms of cytotoxicity, they are 2.2-2.6 times less toxic than rifampicin [M.S. Borisenko, N.V. Zakharova, E.B. Tarabukina, M.V. Solovskiy // ZhPKh, 2015.V. 88. Issue. 11. S. 1579-1585]. However, the known polymer complexes of rifampicin inhibit the growth of Mycobacterium tuberculosis at a sufficiently high concentration (MIC) of 50 μg / ml. At the same time, the MIC of rifampicin against Micobacterium tuberculosis H 37 Rv is 3.1 μg / ml.
Технической задачей изобретения является разработка способа снижения токсичности рифампицина при полном сохранении его противотуберкулезной активности путем комплексообразования рифампицина с анионным полиэлектролитом.An object of the invention is to develop a method for reducing the toxicity of rifampicin while fully preserving its anti-tuberculosis activity by complexing rifampicin with an anionic polyelectrolyte.
Поставленная задача и результат достигаются способом получения полимерных комплексов рифампицина с пониженной токсичностью и высокой противотуберкулезной активностью путем комплексообразования рифампицина с анионным полиэлектролитом в его водном растворе, при этом для получения полимерных комплексов рифампицина в качестве анионного полиэлектролита используют поли-2-акриламидо-2-метилпропансульфокислоту (поли-ААМПСК) с молекулярной массой (ММ) 20000-40000, а комплексообразование проводят при массовом соотношении полимер: антибиотик, равном 1,9-4,0, при этом полученный полимерный комплекс рифампицина (III) имеет структурную формулу:The task and result are achieved by the method of producing rifampicin polymer complexes with reduced toxicity and high anti-tuberculosis activity by complexing rifampicin with an anionic polyelectrolyte in its aqueous solution, using poly-2-acrylamido-2-methylpropanes as an anionic polyelectrolyte poly-AAMPSC) with a molecular weight (MM) of 20,000-40000, and complexation is carried out with a polymer: antibiotic mass ratio, clearly 1.9-4.0, while the resulting polymer complex of rifampicin (III) has the structural formula:
Для большего понимания сущности предлагаемого способа приводим конкретные примеры его выполнения.For a better understanding of the essence of the proposed method, we give specific examples of its implementation.
Пример 1. Синтез анионного полиэлектролита - поли-ААМПСК.Example 1. Synthesis of anionic polyelectrolyte - poly-AAMPSK.
В стеклянную ампулу сначала загружают 0,06 г инициатора (азо-бис-изобутиронитрила), а затем раствор, содержащий 6 г мономерной ААМПСК в 30 мл этанола. Через ампулу в течение 10 мин пропускают аргон. Ампулу запаивают и помещают в термостат, в котором поддерживается температура (70±0,1)°С. Через 48 ч ампулу охлаждают, вскрывают и вязкий полимеризат по каплям выливают в 400 мл серного эфира. Высадившийся полимер собирают на фильтре Шотта, сушат в вакууме и подвергают диализу против воды в течение 24 ч. После диализа водный раствор полимера лиофилизуют. Получают 3,98 г (66,3%) поли-ААМПСК.0.06 g of initiator (azo-bis-isobutyronitrile) is first loaded into a glass ampoule, and then a solution containing 6 g of monomeric AAMPSC in 30 ml of ethanol. Argon was passed through the ampoule for 10 minutes. The ampoule is sealed and placed in a thermostat, in which the temperature is maintained (70 ± 0.1) ° С. After 48 hours, the ampoule was cooled, opened, and the viscous polymerizate was dropwise poured into 400 ml of sulfuric ether. The precipitated polymer is collected on a Schott filter, dried in vacuo and dialyzed against water for 24 hours. After dialysis, the aqueous polymer solution is lyophilized. 3.98 g (66.3%) of poly-AAMPSC are obtained.
Найдено: %S=15,23; (Средневязкостная ММ) равна 29000.Found:% S = 15.23; (Medium viscosity MM) is 29000.
Вычислено: %S=15,46.Calculated:% S = 15.46.
Пример 2. Получение полимерного комплекса рифампицина III-1.Example 2. Obtaining a polymer complex of rifampicin III-1.
0,4 г поли-ААМПСК, полученной по примеру 1, растворяют в 20 мл дистиллированной воды, затем при перемешивании, при комнатной температуре добавляют 0,215 г рифампицина (массовое соотношение полимер: антибиотик равно 1,9: 1). Реакционный раствор перемешивают в течение 3-х часов, затем фильтруют через воронку с бумажным фильтром. Фильтрат подвергают лиофильной сушке. Выход: 0,385 г (62,6%). Содержание рифампицина в полученном комплексе III-1, определенное методом УФ-спектроскопии, составляет 35,2 мас %. Биологические характеристики полимерного комплекса III -1 приведены в таблице.0.4 g of the poly-AAMPSC obtained in Example 1 was dissolved in 20 ml of distilled water, then 0.215 g of rifampicin was added at room temperature with stirring (polymer: antibiotic weight ratio 1.9: 1). The reaction solution is stirred for 3 hours, then filtered through a funnel with a paper filter. The filtrate is freeze dried. Yield: 0.385 g (62.6%). The rifampicin content in the resulting complex III-1, determined by UV spectroscopy, is 35.2 wt%. The biological characteristics of the polymer complex III -1 are shown in the table.
Пример 3. В условиях примера 2 из 0,2 г поли-ААМПСК и 0,086 г рифампицина (массовое соотношение полимер: антибиотик равно 2,3: 1) получают 0,215 г (75,3%) полимерного комплекса рифампицина III-2, содержащего 30,7 мас. % антибиотика. Биологические характеристики полимерного комплекса III-2 приведены в таблице.Example 3. In the conditions of example 2, from 0.2 g of poly-AAMPSC and 0.086 g of rifampicin (mass ratio polymer: antibiotic is 2.3: 1), 0.215 g (75.3%) of the rifampicin III-2 polymer complex containing 30 7 wt. % antibiotic. The biological characteristics of the polymer complex III-2 are shown in the table.
Пример 4. В условиях примера 2 из 0,3 г поли-ААМПСК и 0,075 г рифампицина (массовое соотношение полимер: антибиотик равно 4,0:1) получают 0,247 г (65,9%) полимерного комплекса III-3, содержащего 16,9 мас % антибиотика. Биологические характеристики комплекса III-3 приведены в таблице.Example 4. In the conditions of example 2, from 0.3 g of poly-AAMPSC and 0.075 g of rifampicin (mass ratio polymer: antibiotic is 4.0: 1), 0.247 g (65.9%) of polymer complex III-3 containing 16, 9 wt.% Antibiotic. The biological characteristics of complex III-3 are shown in the table.
Полученные полимерные комплексы рифампицина имеют структурную формулу:The resulting polymer complexes of rifampicin have the structural formula:
Как следует из данных таблицы, заявляемые полимерные комплексы рифампицина в 2,4-2,8 раза менее токсичны, чем немодифицированный полимером рифампицин. По показателям токсичности они сопоставимы с известными комплексами рифампицина, например с комплексом II-3.As follows from the table, the claimed polymer complexes of rifampicin are 2.4-2.8 times less toxic than unmodified polymer rifampicin. In terms of toxicity, they are comparable with known rifampicin complexes, for example, with complex II-3.
Однако по значениям минимальных ингибирующих концентраций заявляемые полимерные комплексы в 16,6-33,3 раза более активны в отношении микобактерий туберкулеза человеческого типа, чем известные полимерные комплексы II-1 - II-3. По уровню противотуберкулезной активности заявляемые полимерные комплексы рифампицина сопоставимы с активностью исходного антибиотика.However, according to the values of minimum inhibitory concentrations, the claimed polymer complexes are 16.6-33.3 times more active against human type mycobacteria than the known polymer complexes II-1 - II-3. According to the level of anti-tuberculosis activity, the claimed polymer complexes of rifampicin are comparable with the activity of the initial antibiotic.
Наблюдаемое явление повышения антимикробной активности при использовании в качестве носителя в комплексе поли-ААМПСК с высокой плотностью заряженных -SO3 - групп на макромолекуле обусловлено эффектом высоких локальных концентраций, выражающимся в присоединении к одной макромолекуле значительного числа молекул низкомолекулярного ЛВ. Это благоприятствует интенсивному переходу молекул рифампицина с макромолекул полимера-носителя в микробную клетку. Напротив, в случае сополимера ВП с 3-бутеновой кислотой (прототип), где задержанные -СОО- группы разделены микроблоками из звеньев ВП и локальная плотность их понижена, такой переход происходит менее интенсивно.The observed phenomenon of increased antimicrobial activity when poly-AAMPSC with a high density of charged -SO 3 - groups on a macromolecule is used as a carrier in the macromolecule is due to the effect of high local concentrations, which is expressed in the addition of a significant number of low molecular weight drugs to one macromolecule. This favors the intensive transition of rifampicin molecules from macromolecules of the carrier polymer to the microbial cell. On the contrary, in the case of a copolymer of VP with 3-butenoic acid (prototype), where the delayed -COO - groups are separated by microblocks from the units of VP and their local density is reduced, this transition occurs less intensively.
Заявляемый интервал ММ полимерного носителя (20000 - 40000) обусловлен тем, что синтетические водорастворимые карбоцепные полимеры с ММ>40000 не выводятся из организма путем почечной фильтрации и накапливаются в клетках ретикулоэндотелиальной системы, оказывая неблагоприятное воздействие на живой организм [Е.Ф. Панарин, Н.А. Лавров, М.В. Соловский, Л.И. Шальнова. Полимеры-носители биологически активных веществ. СПб.: Профессия, 2014, 299 с.]. С другой стороны, эти полимеры с ММ<20000 быстро элиминируется из организма, не успев обеспечить в полной мере биологическое действие связанного ЛВ.The claimed interval of MM polymer carrier (20,000 - 40,000) is due to the fact that synthetic water-soluble carbochain polymers with MM> 40,000 are not excreted by renal filtration and accumulate in the cells of the reticuloendothelial system, having an adverse effect on a living organism [E.F. Panarin, N.A. Lavrov, M.V. Solovsky, L.I. Shalnova. Carrier polymers of biologically active substances. St. Petersburg: Profession, 2014, 299 pp.]. On the other hand, these polymers with MM <20,000 are rapidly eliminated from the body, failing to fully ensure the biological effect of the bound drug.
Заявляемый интервал массового соотношения полимер: антибиотик (1,9-4,0:1) связан с тем, что увеличение этого значения > 4,0: 1 может привести к снижению антимикробной активности полимерного комплекса рифампицина. Уменьшение этого показателя <1,9:1 может отразиться на увеличении его цитотоксичности.The claimed interval of the mass ratio of polymer: antibiotic (1.9-4.0: 1) is due to the fact that an increase in this value> 4.0: 1 can lead to a decrease in the antimicrobial activity of the polymer complex of rifampicin. A decrease in this indicator <1.9: 1 may affect an increase in its cytotoxicity.
Claims (2)
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2016131929A RU2623877C1 (en) | 2016-08-04 | 2016-08-04 | Method for obtaining of rifampicine polymeric complexes with reduced toxicity and high antituberculosis activity |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2016131929A RU2623877C1 (en) | 2016-08-04 | 2016-08-04 | Method for obtaining of rifampicine polymeric complexes with reduced toxicity and high antituberculosis activity |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| RU2623877C1 true RU2623877C1 (en) | 2017-06-29 |
Family
ID=59312530
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2016131929A RU2623877C1 (en) | 2016-08-04 | 2016-08-04 | Method for obtaining of rifampicine polymeric complexes with reduced toxicity and high antituberculosis activity |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2623877C1 (en) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2020005111A1 (en) * | 2018-06-25 | 2020-01-02 | Виктор Вениаминович ТЕЦ | Treatment and prevention of complications associated with elevated intestinal permeability |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2167642C2 (en) * | 1996-06-28 | 2001-05-27 | Л'Ореаль | Cosmetic and/or dermatologic composition with acidic ph value, method of nontherapeutic treatment of skin, method of nontherapeutic depigmentation of skin, and application of cross-linked poly(2-acrylamido-2- methylpropanesulfonic acid) neutralized to at least 90% |
| WO2004041284A1 (en) * | 2002-10-28 | 2004-05-21 | Council Of Scientific And Industrial Research | Inclusion complex of anti-tubercular rifampicin with beta-cyclodextrin or 2-hydroxypropyl beta-cyclodextrin and a process for producing the same |
| US20110020252A1 (en) * | 2010-10-01 | 2011-01-27 | Shantha Totada R | Method of long lasting human skin tanning |
-
2016
- 2016-08-04 RU RU2016131929A patent/RU2623877C1/en active
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2167642C2 (en) * | 1996-06-28 | 2001-05-27 | Л'Ореаль | Cosmetic and/or dermatologic composition with acidic ph value, method of nontherapeutic treatment of skin, method of nontherapeutic depigmentation of skin, and application of cross-linked poly(2-acrylamido-2- methylpropanesulfonic acid) neutralized to at least 90% |
| WO2004041284A1 (en) * | 2002-10-28 | 2004-05-21 | Council Of Scientific And Industrial Research | Inclusion complex of anti-tubercular rifampicin with beta-cyclodextrin or 2-hydroxypropyl beta-cyclodextrin and a process for producing the same |
| US20110020252A1 (en) * | 2010-10-01 | 2011-01-27 | Shantha Totada R | Method of long lasting human skin tanning |
Non-Patent Citations (1)
| Title |
|---|
| М.С. БОРИСЕНКО и др., Синтез сополимера N-винил-2-пирролидона с 3-бутеновой кислотой - носителей лекарственных веществ, Журнал прикладной химии, 2015, Т.88, вып. 11, стр. 1579-1585. * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2020005111A1 (en) * | 2018-06-25 | 2020-01-02 | Виктор Вениаминович ТЕЦ | Treatment and prevention of complications associated with elevated intestinal permeability |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Abdel-Mohsen et al. | Eco-synthesis of PVA/chitosan hydrogels for biomedical application | |
| EP0626974B1 (en) | Mitogen-free substance, its preparation and its use | |
| CN107778497B (en) | Composite covalent hydrogel capable of releasing according to needs as well as preparation method and application thereof | |
| Awasthi et al. | Poly (vinylpyrrolidone) | |
| WO1986000891A1 (en) | Polymeric iron chelators | |
| CN110386997B (en) | Biocompatible chitosan derivative with antibacterial function and preparation method thereof | |
| RU2623877C1 (en) | Method for obtaining of rifampicine polymeric complexes with reduced toxicity and high antituberculosis activity | |
| JP7387429B2 (en) | Polymeric metal chelate compositions and methods for their preparation for controlling growth and activity of living cells and organisms | |
| CN109517091A (en) | The preparation method and applications of guanidinated chitosan | |
| CN114478834A (en) | Guanidino hyaluronic acid antibacterial polymer and preparation method and application thereof | |
| CN104721831A (en) | Hyaluronic acid covalently linked targeting cell-penetrating peptide and active drug containing water-soluble prodrug and preparation method thereof | |
| CN104892917A (en) | Glucosamine-modified polyethyleneglycol-polylactic acid, preparation method therefor and application thereof | |
| Balitaan et al. | Healing Wounds Efficiently with Biomimetic Soft Matter: Injectable Self-Healing Neutral Glycol Chitosan/Dibenzaldehyde-Terminated Poly (ethylene glycol) Hydrogel with Inherent Antibacterial Properties | |
| CN106188350B (en) | Polyvinylalcohol graft polymer, preparation method and hydrogel and its application | |
| KR20110093211A (en) | Biocompatible and temperature-sensitive polyethyleneglycol/polyester block copolymer with high biodegradable property | |
| CN107648255B (en) | Organic antibacterial agent containing maltoheptaose and preparation method and application thereof | |
| EP2207819B1 (en) | Anti-microbial polymers and their compositions | |
| CN108721636B (en) | Drug delivery material with dual responsiveness connected by diselenide bond and preparation method and application thereof | |
| EP3572443B1 (en) | Copolymer containing cyclic nitroxide radical and trialkoxysilyl in side chain, and use thereof | |
| CN111363170A (en) | Preparation and application of hydroxyethyl cellulose-sodium alginate hydrogel | |
| CN115737897B (en) | Preparation method of injectable hemostatic crystal gel for clotting disorder wound | |
| Kanwal et al. | Cytocompatible and stimuli-responsive chitosan based carrier with 3-aminopropyl (diethoxy) methylsilane for controlled release of cefixime | |
| RU2659032C1 (en) | Method of gentamycin modification with vinylpirrolidone copolymer with acryoline diagetalum | |
| RU2352589C1 (en) | Method for producing biosoluble copolymers of acrylamide, vinylpyrrolidone and alkylacrylate | |
| Solovskii et al. | Polymeric complexes of ofloxacin and their activity against tuberculosis mycobacteria |