RU2587439C1 - Method of producing manganese dioxide nanorods - Google Patents
Method of producing manganese dioxide nanorods Download PDFInfo
- Publication number
- RU2587439C1 RU2587439C1 RU2015109828/05A RU2015109828A RU2587439C1 RU 2587439 C1 RU2587439 C1 RU 2587439C1 RU 2015109828/05 A RU2015109828/05 A RU 2015109828/05A RU 2015109828 A RU2015109828 A RU 2015109828A RU 2587439 C1 RU2587439 C1 RU 2587439C1
- Authority
- RU
- Russia
- Prior art keywords
- mno
- manganese dioxide
- nanorods
- inorganic acid
- diameter
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01G—COMPOUNDS CONTAINING METALS NOT COVERED BY SUBCLASSES C01D OR C01F
- C01G45/00—Compounds of manganese
- C01G45/02—Oxides; Hydroxides
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B82—NANOTECHNOLOGY
- B82B—NANOSTRUCTURES FORMED BY MANIPULATION OF INDIVIDUAL ATOMS, MOLECULES, OR LIMITED COLLECTIONS OF ATOMS OR MOLECULES AS DISCRETE UNITS; MANUFACTURE OR TREATMENT THEREOF
- B82B3/00—Manufacture or treatment of nanostructures by manipulation of individual atoms or molecules, or limited collections of atoms or molecules as discrete units
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B82—NANOTECHNOLOGY
- B82Y—SPECIFIC USES OR APPLICATIONS OF NANOSTRUCTURES; MEASUREMENT OR ANALYSIS OF NANOSTRUCTURES; MANUFACTURE OR TREATMENT OF NANOSTRUCTURES
- B82Y30/00—Nanotechnology for materials or surface science, e.g. nanocomposites
Abstract
Description
Изобретение относится к неорганической химии, конкретно к получению нанокристаллического диоксида марганца, полиморфные модификации которого, имеющие разнообразные морфологические формы, могут быть успешно использованы в составе катализаторов, биосенсоров, адсорбентов и особенно в источниках тока.The invention relates to inorganic chemistry, specifically to the production of nanocrystalline manganese dioxide, polymorphic modifications of which, having various morphological forms, can be successfully used as part of catalysts, biosensors, adsorbents, and especially in current sources.
Основными структурными единицами полиморфных модификаций диоксида марганца являются октаэдры MnO6, различное взаимное сочленение которых приводит к формированию в структуре MnO2 слоев и каналов. Именно наличие каналов делает MnO2 интересным с точки зрения создания катодных материалов. Наименьшее содержание примесей в MnO2 характерно для пиролюзита (β-MnO2) и рамсделита (γ-MnO2). Для других модификаций MnO2 (α, λ, ε и δ) крайне характерно присутствие в их кристаллической структуре ионов Na+и K+.The main structural units of polymorphic modifications of manganese dioxide are MnO 6 octahedra, the different interconnection of which leads to the formation of layers and channels in the structure of MnO 2 . It is the presence of channels that makes MnO 2 interesting from the point of view of creating cathode materials. The smallest impurity content in MnO 2 is characteristic of pyrolyusite (β-MnO 2 ) and ramsdelite (γ-MnO 2 ). For other modifications of MnO 2 (α, λ, ε, and δ), the presence of Na + and K + ions in their crystal structure is extremely characteristic.
В настоящее время актуальной задачей является разработка методов получения наностержней MnO2 β-модификации, представляющих большой практический интерес, ввиду того, что характерная для них анизотропия проводимости может приводить к появлению принципиально новых конструктивных решений при создании аккумуляторных элементов [Xu M.-W., Bao S.-J. // Energy Storage in the Emerging Era of Smart Grids; In tech: 2011; V. 12, P. 251-278].Currently, the urgent task is the development of methods for producing β-modification MnO 2 nanorods, which are of great practical interest, since their characteristic conductivity anisotropy can lead to the appearance of fundamentally new design solutions when creating battery cells [Xu M.-W. Bao S.-J. // Energy Storage in the Emerging Era of Smart Grids; In tech: 2011; V. 12, P. 251-278].
Из [RU 2536649] известно, что при заряде и разряде Li-ионных аккумуляторов имеют место топотактические реакции, они состоят в инжекции электрона и внедрении катиона Li в твердую матрицу без разрушения внутренней структуры материала. Однако интеркаляция ионов Li в структуру материала может привести к существенным изменениям в строении материала: образование новой фазы, увеличение объема кристаллической ячейки, «вспучиванию» и т.п.From [RU 2536649] it is known that when charging and discharging Li-ion batteries, topotactic reactions take place, they consist in the injection of an electron and the incorporation of the Li cation into a solid matrix without destroying the internal structure of the material. However, the intercalation of Li ions in the structure of the material can lead to significant changes in the structure of the material: the formation of a new phase, an increase in the volume of the crystalline cell, “swelling”, etc.
Материал, состоящий из однородных наностержней, в большей степени пригоден для интеркаляции ионов лития, поскольку он не будет испытывать серьезных структурных напряжений при прохождении катиона Li+ по каналам в структуре MnO2.A material consisting of homogeneous nanorods is more suitable for intercalation of lithium ions, since it will not experience serious structural stresses when the Li + cation passes through channels in the MnO 2 structure.
Известен способ [Xun Wang and Yadong Li // Synthesis and Formation Mechanism of Manganese Dioxide Nanowires/Nanorods, Chem. Eur. J: 2003, V. 9, №1, P. 19141-19147] получения наностержней диоксида марганца, заключающийся в том, что соли (NH4)2S2O8 и MnSO4·H2O растворяют в дистиллированной воде при комнатной температуре и перемешивают до образования однородного раствора. После чего его переносят в автоклав и подвергают гидротермальной обработке при температуре 140°C в течение 12 ч. Полученный продукт фильтруют, промывают дистиллированной водой и высушивают на воздухе. Образование наностержней α- и β-модификаций диоксида марганца проходит через промежуточную стадию образования δ-модификации диоксида марганца с пластинчатой морфологией.The known method [Xun Wang and Yadong Li // Synthesis and Formation Mechanism of Manganese Dioxide Nanowires / Nanorods, Chem. Eur. J: 2003, V. 9, No. 1, P. 19141-19147] for the production of manganese dioxide nanorods, namely, that the salts (NH 4 ) 2 S 2 O 8 and MnSO 4 · H 2 O are dissolved in distilled water at room temperature temperature and mix until a homogeneous solution is formed. Then it is transferred to an autoclave and subjected to hydrothermal treatment at a temperature of 140 ° C for 12 hours. The resulting product is filtered, washed with distilled water and dried in air. The formation of nanorods of α- and β-modifications of manganese dioxide passes through an intermediate stage of the formation of δ-modification of manganese dioxide with lamellar morphology.
Недостатком данного способа является то, что получаемая β-модификация диоксида марганца содержит примесь δ-модификации, имеющей слоистую структуру, что ухудшает фазовую однородность материала, необходимую при использовании в электрохимических ячейках.The disadvantage of this method is that the resulting β-modification of manganese dioxide contains an admixture of δ-modification having a layered structure, which impairs the phase uniformity of the material required when used in electrochemical cells.
Также недостатком этого метода является относительно высокая продолжительность синтеза.Another disadvantage of this method is the relatively high duration of the synthesis.
Известен способ получения наностержней диоксида марганца, изложенный в [М. Wei, Y. Konishi, Н. Zhou, Н. Sugihara and Н. Arakawa // Synthesis of single-crystal manganese dioxide nanowires by soft chemical process, Nanotechnology: 2005, V. 16, P. 245-249] (прототип), заключается в том, что коммерческий γ-MnO2 смешивают с водой, и полученную суспензию подвергают гидротермальной обработке при температуре 140-200°C в течение 72 дней. Полученный продукт фильтруют, промывают водой и высушивают при температуре 60°C в течение 4 ч.A known method of producing nanorods of manganese dioxide, described in [M. Wei, Y. Konishi, N. Zhou, N. Sugihara and N. Arakawa // Synthesis of single-crystal manganese dioxide nanowires by soft chemical process, Nanotechnology: 2005, V. 16, P. 245-249] (prototype), lies in the fact that commercial γ-MnO 2 is mixed with water, and the resulting suspension is subjected to hydrothermal treatment at a temperature of 140-200 ° C for 72 days. The resulting product is filtered, washed with water and dried at 60 ° C for 4 hours.
Существенным недостатком является относительно невысокая морфологическая однородность получаемого продукта.A significant drawback is the relatively low morphological homogeneity of the resulting product.
Недостатком предложенного способа также является слишком большая продолжительность синтеза.The disadvantage of the proposed method is too long synthesis time.
Техническая задача связана с тем, что коммерческий успех современных катодных материалов в значительной степени зависит от метода их получения, который должен обеспечивать возможность контроля морфологии и размера частиц.The technical problem is related to the fact that the commercial success of modern cathode materials largely depends on the method of their preparation, which should provide the ability to control the morphology and particle size.
Изобретение направлено на изыскание высокопроизводительного способа получения наностержней β-MnO2 для использования в литиевых источниках тока в качестве катодного материала с относительно высокой однородностью фракции по диаметру стержней, что значительно улучшает процесс интеркаляции ионов Li в структуру катодного материала.The invention is aimed at finding a high-performance method for producing β-MnO 2 nanorods for use in lithium current sources as a cathode material with a relatively high fraction uniformity in the diameter of the rods, which significantly improves the process of intercalation of Li ions into the structure of the cathode material.
Технический результат достигается тем, что предложен способ получения наностержней диоксида марганца, заключающийся в том, что смешивают водные растворы перманганата калия и нитрита натрия в мольном соотношении , равном 2:1÷5, до образования однородной дисперсной фазы в сильнощелочном растворе, после чего к нему при постоянном перемешивании медленно прикапывают неорганическую кислоту до достижения значения pH от 2 до 0,5, полученную суспензию помещают в тефлоновый автоклав, который устанавливают в гидротермально-микроволновую установку на 5÷25 мин при 90÷170°C при давлении 1÷20 атм и мощности микроволнового нагрева 150÷1000 Вт, полученный осадок отделяют декантацией, промывают дистиллированной водой и высушивают на воздухе при температуре не выше 70°C, в результате получают кристаллический пиролюзит β-MnO2, частицы которого имеют форму стержней диаметром свыше 10 нм и длиной до 2 мкм.The technical result is achieved by the fact that the proposed method for producing nanorods of manganese dioxide, which consists in mixing aqueous solutions of potassium permanganate and sodium nitrite in a molar ratio equal to 2: 1 ÷ 5, until a homogeneous dispersed phase forms in a strongly alkaline solution, after which inorganic acid is slowly added dropwise to it with constant stirring until a pH value of 2 to 0.5 is reached, the resulting suspension is placed in a Teflon autoclave, which is placed in a hydrothermal microwave installation for 5 ÷ 25 min at 90 ÷ 170 ° C at a pressure of 1 ÷ 20 atm and a microwave heating power of 150 ÷ 1000 W, the precipitate obtained is separated by decantation, washed with distilled water and dried in air at a temperature not exceeding 70 ° C, res ultrathe receive crystalline β-MnO 2 pyrolusite, particles of which have the form of rods with a diameter of more than 10 nm and a length of up to 2 microns.
Целесообразно, что в качестве неорганической кислоты используют либо H2SO4, либо HNO3.It is advisable that either H 2 SO 4 or HNO 3 be used as the inorganic acid.
Мольные соотношения , равные 2:1÷5, выбирают из тех соображений, что при них образуется однородная дисперсная фаза.Molar ratios equal to 2: 1 ÷ 5, choose from those considerations that they form a homogeneous dispersed phase.
Выбор диапазона кислотности обусловлен тем, что в среде с pH>2 в конечном продукте присутствует посторонняя примесь наночастиц δ-MnO2, которые характеризуются сфероидальной формой и шероховатой поверхностью, а при pH<0,5 в конечном продукте также присутствует посторонняя фаза.The choice of the acidity range is due to the fact that in the medium with pH> 2 there is an extraneous admixture of δ-MnO 2 nanoparticles in the final product, which are characterized by a spheroidal shape and rough surface, and at pH <0.5, the extraneous phase is also present in the final product.
Заявленный временной интервал 5÷25 минут определяется динамикой процесса формирования кристаллов, который в целом начинается с 5 минут и завершается через 25 минут, после чего линейные размеры наностержней не изменяются и улучшения функциональных свойств нанокристаллов не происходит.The claimed time interval of 5–25 minutes is determined by the dynamics of the crystal formation process, which generally begins with 5 minutes and ends after 25 minutes, after which the linear dimensions of the nanorods do not change and the functional properties of the nanocrystals do not improve.
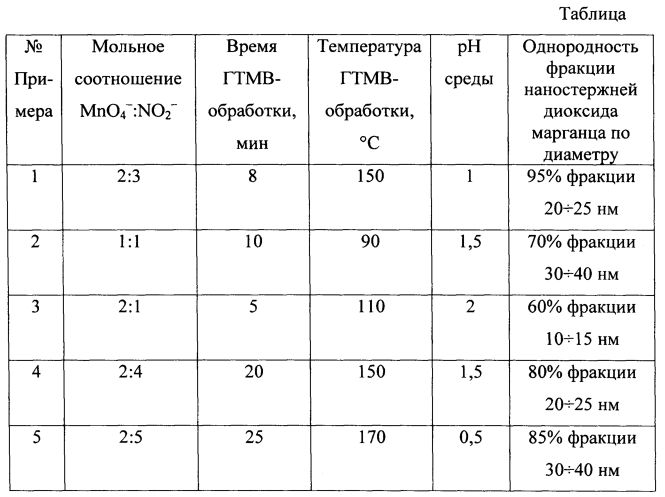
Заявленный температурный интервал гидротермально-микроволновой обработки определен экспериментальным путем и является оптимальным для получения однородной фазы наностержней диоксида марганца, содержащей в своем составе кристаллы диаметром менее 100 нм. Минимальная температура автоклавной обработки обусловлена тем, что ниже 90°C наностержни не образуются. Верхний предел температуры обусловлен тем, что при температурах выше 170°C в получаемом конечном продукте качественных изменений не происходит. Оптимальным является автоклавная обработка в течение 8 минут при 150°C, при которой в конечном продукте однородность фракции 20÷25 нм составляет 90%.The claimed temperature range of the hydrothermal microwave treatment is determined experimentally and is optimal for obtaining a homogeneous phase of manganese dioxide nanorods containing crystals with a diameter of less than 100 nm. The minimum autoclave temperature is due to the fact that nanorods are not formed below 90 ° C. The upper temperature limit is due to the fact that at temperatures above 170 ° C in the final product obtained, there are no qualitative changes. The autoclave treatment is optimal for 8 minutes at 150 ° C, at which the uniformity of the 20–25 nm fraction in the final product is 90%.
В качестве гидротермально-микроволновой установки используют аппаратуру Berghof Speedwave MWS four, характеризующуюся давлением R20 атм и мощностью микроволнового нагрева 150÷1000 Вт.As a hydrothermal-microwave installation, Berghof Speedwave MWS four equipment is used, characterized by a pressure of R20 atm and a microwave heating power of 150 ÷ 1000 watts.
Сущность изобретения заключается в том, что варьирование кислотности среды, продолжительности и температуры синтеза позволяет получать продукты с заданными параметрами однородности.The essence of the invention lies in the fact that varying the acidity of the medium, the duration and temperature of the synthesis allows you to get products with the given parameters of uniformity.
Изобретение проиллюстрировано следующими микрофотографиями.The invention is illustrated by the following micrographs.
Фиг. 1. Результаты растровой электронной микроскопии образца диоксида марганца, полученного по предложенному изобретению гидротермально микроволновой обработкой (ГТМВ) в течение 8 мин при 150°C из реакционной смеси с рН=1 (пример 1).FIG. 1. The results of scanning electron microscopy of a sample of manganese dioxide obtained by the proposed invention by hydrothermal microwave treatment (HTMV) for 8 min at 150 ° C from a reaction mixture with pH = 1 (example 1).
Фиг. 2. Результаты растровой электронной микроскопии образца диоксида марганца, полученного по прототипу.FIG. 2. The results of scanning electron microscopy of a sample of manganese dioxide obtained by the prototype.
Ниже приведены примеры иллюстрирующие, но не ограничивающие предложенный способ.The following are examples illustrating but not limiting the proposed method.
Пример 1Example 1
0,3 г KMnO4 растворяли в 38 мл дистиллированной воды, затем к полученному раствору добавляли 0,19 г NaNO2 (мольное соотношение составляло 2:3), после чего к смеси при постоянном перемешивании медленно прикапывали 0,5М H2SO4 до достижения рН=1. Полученную суспензию помещали в тефлоновый автоклав емкостью 100 мл (степень заполнения составляла 50%) и подвергали гидротермально-микроволновой обработке в установке Berghof Speedwave MWS four в течение 8 мин при 150°C. После завершения обработки автоклав извлекали и охлаждали на воздухе. Образовавшийся осадок отделяли декантацией, несколько раз промывали дистиллированной водой и сушили на воздухе при относительной влажности ~75% и температуре 60°C. Получали продукт с однородностью фракции 95% нм и диаметром наностержней 20÷25 нм.0.3 g of KMnO 4 was dissolved in 38 ml of distilled water, then 0.19 g of NaNO 2 was added to the resulting solution (molar ratio amounted to 2: 3), after which 0.5 M H 2 SO 4 was slowly added dropwise to the mixture with constant stirring until pH = 1 was reached. The resulting suspension was placed in a 100 ml Teflon autoclave (filling degree 50%) and subjected to hydrothermal microwave treatment in a Berghof Speedwave MWS four for 8 min at 150 ° C. After processing, the autoclave was recovered and cooled in air. The precipitate formed was separated by decantation, washed several times with distilled water, and dried in air at a relative humidity of ~ 75% and a temperature of 60 ° C. Received a product with a uniformity of the fraction of 95% nm and a diameter of nanorods 20 ÷ 25 nm.
Примеры 2-5 осуществляли по Примеру 1, меняя мольное соотношение реагентов, кислотность среды, время и температуру синтеза. Результаты сведены в Таблицу: «Показатель однородности фракции наностержней диоксида марганца, синтезированных по предлагаемому способу».Examples 2-5 were carried out according to Example 1, changing the molar ratio of the reactants, the acidity of the medium, the time and temperature of synthesis. The results are summarized in the Table: "The homogeneity index of the fraction of manganese dioxide nanorods synthesized by the proposed method."
Предлагаемый способ позволяет получать наностержни β-MnO2 с достаточно высокой производительностью, а также с относительно высокой однородностью фракции по диаметру стержней, что определяет пригодность их применения в катодных материалах.The proposed method allows to obtain β-MnO 2 nanorods with a sufficiently high productivity, as well as with relatively high homogeneity of the fraction along the diameter of the rods, which determines the suitability of their use in cathode materials.
Claims (2)
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2015109828/05A RU2587439C1 (en) | 2015-03-20 | 2015-03-20 | Method of producing manganese dioxide nanorods |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2015109828/05A RU2587439C1 (en) | 2015-03-20 | 2015-03-20 | Method of producing manganese dioxide nanorods |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| RU2587439C1 true RU2587439C1 (en) | 2016-06-20 |
Family
ID=56132172
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2015109828/05A RU2587439C1 (en) | 2015-03-20 | 2015-03-20 | Method of producing manganese dioxide nanorods |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2587439C1 (en) |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2108411C1 (en) * | 1996-11-05 | 1998-04-10 | Открытое акционерное общество "Электростальский химико-механический завод" | Method for production of electrolytic manganese dioxide |
| WO2001087775A1 (en) * | 2000-05-15 | 2001-11-22 | Eveready Battery Company Inc. | A method of preparation of porous manganese dioxide |
| RU2194666C2 (en) * | 1996-11-18 | 2002-12-20 | Дзе Юниверсити оф Коннектикут | Nanostructural oxides and hydroxides and methods of their synthesis |
| WO2009118526A2 (en) * | 2008-03-25 | 2009-10-01 | Nanotecture Ltd | Mesoporous manganese dioxide |
| US8962517B2 (en) * | 2011-11-29 | 2015-02-24 | Siluria Technologies, Inc. | Nanowire catalysts and methods for their use and preparation |
-
2015
- 2015-03-20 RU RU2015109828/05A patent/RU2587439C1/en not_active IP Right Cessation
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2108411C1 (en) * | 1996-11-05 | 1998-04-10 | Открытое акционерное общество "Электростальский химико-механический завод" | Method for production of electrolytic manganese dioxide |
| RU2194666C2 (en) * | 1996-11-18 | 2002-12-20 | Дзе Юниверсити оф Коннектикут | Nanostructural oxides and hydroxides and methods of their synthesis |
| WO2001087775A1 (en) * | 2000-05-15 | 2001-11-22 | Eveready Battery Company Inc. | A method of preparation of porous manganese dioxide |
| WO2009118526A2 (en) * | 2008-03-25 | 2009-10-01 | Nanotecture Ltd | Mesoporous manganese dioxide |
| US8962517B2 (en) * | 2011-11-29 | 2015-02-24 | Siluria Technologies, Inc. | Nanowire catalysts and methods for their use and preparation |
Non-Patent Citations (1)
| Title |
|---|
| WEI М. et al., Synthesis of single-crystal manganese dioxide nanowires by soft chemical process, Nanotechnology, 2005, v. 16, pp. 245-249. * |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Meng et al. | The progress of microwave-assisted hydrothermal method in the synthesis of functional nanomaterials | |
| CN102120619B (en) | Preparation method of brain-coral-shaped birnessite type manganese dioxide | |
| Zhang et al. | Microwave-assisted reflux rapid synthesis of MnO2 nanostructures and their application in supercapacitors | |
| US7887778B2 (en) | Manganese oxide nanowires, films, and membranes and methods of making | |
| CN105940145B (en) | Transition metal oxide particle and preparation method thereof | |
| Zhang et al. | Two-step grain-growth kinetics of sub-7 nm SnO2 nanocrystal under hydrothermal condition | |
| Zhang et al. | Zn 3 V 2 O 7 (OH) 2· 2H 2 O and Zn 3 (VO 4) 2 3D microspheres as anode materials for lithium-ion batteries | |
| Choi et al. | Growth mechanism of cubic MgO granule via common ion effect | |
| Zhao et al. | Effect of sequential morphology adjustment of hematite nanoplates to nanospindles on their properties and applications | |
| Zeng et al. | Synthesis of sea-urchin shaped γ-MnO 2 nanostructures and their application in lithium batteries | |
| Kozawa et al. | Wet mechanical route to synthesize morphology-controlled NH4MnPO4· H2O and its conversion reaction into LiMnPO4 | |
| KR20160100038A (en) | Method for preparing zinc oxide nanoparticle having porous shell and hollow core by using ultrasonic irradiation | |
| Li et al. | A simple hydrothermal route to synthesis of rod-like MnOOH and spindle-shaped MnCO3 | |
| JP2009173495A (en) | Nickel hydroxide nanosheet and its manufacturing method | |
| Xiao et al. | Synthesis and application of one-dimensional La (OH) 3 nanostructures: an overview | |
| RU2587439C1 (en) | Method of producing manganese dioxide nanorods | |
| Zou et al. | Synthesis of ZnO particles on zinc foil in ionic-liquid precursors | |
| Wang et al. | Electrochemical properties and controlled-synthesis of hierarchical β-Ni (OH) 2 micro-flowers and hollow microspheres | |
| CN105540673A (en) | Strontium manganate nanowires and microwires and preparation method thereof | |
| WO2008023597A1 (en) | R-type manganese dioxide nanoneedle porous body, r-type manganese dioxide nanoneedle constituting the same, hydrogenated manganese oxide, infrared absorbing material, infrared filter, and their production methods | |
| JP5527630B2 (en) | Nickel hydroxide nanosheet and method for producing the same | |
| JP2010037163A (en) | Nickel hydroxide hexagonal plate and its manufacturing method | |
| CN108946796A (en) | A kind of doped titanate and preparation method thereof | |
| Li et al. | Morphology-controlled ZnO particles from an ionic liquid precursor | |
| Cheney et al. | Synthesis and characterization of birnessite and cryptomelane nanostructures in presence of Hoffmeister anions |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20200321 |