RU2554740C2 - Композиции перорально распадающихся таблеток, содержащие комбинации высоко- и низкодозовых лекарственных средств - Google Patents
Композиции перорально распадающихся таблеток, содержащие комбинации высоко- и низкодозовых лекарственных средств Download PDFInfo
- Publication number
- RU2554740C2 RU2554740C2 RU2011145432/15A RU2011145432A RU2554740C2 RU 2554740 C2 RU2554740 C2 RU 2554740C2 RU 2011145432/15 A RU2011145432/15 A RU 2011145432/15A RU 2011145432 A RU2011145432 A RU 2011145432A RU 2554740 C2 RU2554740 C2 RU 2554740C2
- Authority
- RU
- Russia
- Prior art keywords
- coating
- drug
- dose drug
- water
- pharmaceutical composition
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/5005—Wall or coating material
- A61K9/5021—Organic macromolecular compounds
- A61K9/5036—Polysaccharides, e.g. gums, alginate; Cyclodextrin
- A61K9/5042—Cellulose; Cellulose derivatives, e.g. phthalate or acetate succinate esters of hydroxypropyl methylcellulose
- A61K9/5047—Cellulose ethers containing no ester groups, e.g. hydroxypropyl methylcellulose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/155—Amidines (), e.g. guanidine (H2N—C(=NH)—NH2), isourea (N=C(OH)—NH2), isothiourea (—N=C(SH)—NH2)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/16—Amides, e.g. hydroxamic acids
- A61K31/165—Amides, e.g. hydroxamic acids having aromatic rings, e.g. colchicine, atenolol, progabide
- A61K31/167—Amides, e.g. hydroxamic acids having aromatic rings, e.g. colchicine, atenolol, progabide having the nitrogen of a carboxamide group directly attached to the aromatic ring, e.g. lidocaine, paracetamol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/192—Carboxylic acids, e.g. valproic acid having aromatic groups, e.g. sulindac, 2-aryl-propionic acids, ethacrynic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/195—Carboxylic acids, e.g. valproic acid having an amino group
- A61K31/196—Carboxylic acids, e.g. valproic acid having an amino group the amino group being directly attached to a ring, e.g. anthranilic acid, mefenamic acid, diclofenac, chlorambucil
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/403—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil condensed with carbocyclic rings, e.g. carbazole
- A61K31/404—Indoles, e.g. pindolol
- A61K31/405—Indole-alkanecarboxylic acids; Derivatives thereof, e.g. tryptophan, indomethacin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/407—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil condensed with other heterocyclic ring systems, e.g. ketorolac, physostigmine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/415—1,2-Diazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4415—Pyridoxine, i.e. Vitamin B6
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/4439—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. omeprazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4468—Non condensed piperidines, e.g. piperocaine having a nitrogen directly attached in position 4, e.g. clebopride, fentanyl
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/485—Morphinan derivatives, e.g. morphine, codeine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/54—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one sulfur as the ring hetero atoms, e.g. sulthiame
- A61K31/5415—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one sulfur as the ring hetero atoms, e.g. sulthiame ortho- or peri-condensed with carbocyclic ring systems, e.g. phenothiazine, chlorpromazine, piroxicam
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/60—Salicylic acid; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2072—Pills, tablets, discs, rods characterised by shape, structure or size; Tablets with holes, special break lines or identification marks; Partially coated tablets; Disintegrating flat shaped forms
- A61K9/2077—Tablets comprising drug-containing microparticles in a substantial amount of supporting matrix; Multiparticulate tablets
- A61K9/2081—Tablets comprising drug-containing microparticles in a substantial amount of supporting matrix; Multiparticulate tablets with microcapsules or coated microparticles according to A61K9/50
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/5073—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals having two or more different coatings optionally including drug-containing subcoatings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/5073—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals having two or more different coatings optionally including drug-containing subcoatings
- A61K9/5078—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals having two or more different coatings optionally including drug-containing subcoatings with drug-free core
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/5084—Mixtures of one or more drugs in different galenical forms, at least one of which being granules, microcapsules or (coated) microparticles according to A61K9/16 or A61K9/50, e.g. for obtaining a specific release pattern or for combining different drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
Abstract
Настоящее изобретение направлено на фармацевтические композиции, содержащие множество микрочастиц с маскированным вкусом, содержащих высокодозовые/низкодозовые лекарственные средства, на лекарственные формы, содержащие такие фармацевтические композиции (такие как перорально распадающиеся таблетки), и на способы изготовления фармацевтических композиций и лекарственных форм. Лекарственные формы, содержащие фармацевтические композиции по настоящему изобретению, представляют собой улучшенные однородные смеси высокодозовых и низкодозовых лекарственных средств, которые обеспечивают возможность контролирования скорости высвобождения лекарственного средства из частиц различными путями, а также гибкость корректировки дозировок при введении комбинаций лекарственных средств, например, при лечении боли. 4 н. и 27 з.п. ф-лы, 4 ил., 12 табл., 8 пр.
Description
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
В настоящей заявке заявлен приоритет предварительных заявок US 61/174780 и 61/174788, поданных 1 мая 2009.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Боль от умеренной до сильной можно эффективно лечить опиоидными анальгетиками, такими как гидрокодон. Однако, так как многие опиоиды вызывают привыкание, риск злоупотребления можно ослабить путем комбинирования опиоида с неопиоидным анальгетиком, таким как ацетаминофен, аспирин, ибупрофен и так далее, таким образом делая возможным эффективное контролирование боли при более низких дозах опиоидных анальгетиков. Другие медицинские состояния, такие как диабет (гипергликемия), сердечно-сосудистое заболевание и шизофрения, также эффективно лечат комбинациями лекарственных средств. Однако необходимость вводить различные лекарственные формы может приводить к проблемам, таким как проблемы с соблюдением пациентом схемы лечения или ошибки дозирования при введении.
Одним подходом к предупреждению таких проблем является объединение различных лекарственных средств в одной лекарственной форме для уменьшения количества разных лекарственных форм, подлежащих введению, и гарантии того, что комбинацию лекарственных средств вводят в правильных относительных дозах. Например, Vicodin® представляет собой таблетку с немедленным высвобождением (IR), содержащую 5 мг гидрокодона битартрата и 500 мг ацетаминофена, предназначенную для контролирования сильной боли. Однако очень трудно воспроизводимо получать однородные смеси гидрокодона и ацетаминофена с нужным массовым отношением 1:100 (например с однородностью содержимого, имеющей RSD (относительное стандартное отклонение) 6% или менее, как требуют регулирующие органы во всем мире). Таким образом, существует потребность в способах однородного и воспроизводимого объединения высокодозового лекарственного средства и низкодозового лекарственного средства в одной лекарственной форме.
Двумя наиболее широко используемыми типами пероральных лекарственных форм являются таблетки и капсулы. Однако такие лекарственные формы имеют некоторые недостатки. Например, по оценкам, 50% населения имеют проблемы с проглатыванием таблеток (смотри Seager, Journal of Pharmacol. and Pharm. 50, pages 375-382, 1998). Особенно трудно проглатывать таблетки или капсулы пожилым людям или детям, или лечить лекарственным средством пациентов, которые неспособны или не хотят проглатывать таблетки или капсулы. Кроме того, обычные таблетки или капсулы обычно должны вводиться с водой, что не всегда возможно или удобно. Это приводит к плохому соблюдению или даже несоблюдению схемы лечения, что в результате оказывает негативное влияние на эффективность лечения. Лекарственные формы в виде перорально распадающихся таблеток (ODT) были внедрены для решения таких проблем, так как ODT быстро растворяются или распадаются в ротовой полости, и полученная взвесь или суспензия лекарственного средства легче проглатывается пациентом. Такие лекарственные формы являются также более удобными, так как они не нуждаются во введении с водой.
Так как лекарственная форма ODT распадается в полости рта пациента, распадающаяся ODT должна быть приятной на вкус. Например, если одно или более лекарственных средств в ODT имеют горький вкус, то частицы, содержащие лекарственное средство, и составляющие ODT должны быть с маскированным вкусом, например посредством покрытия частиц, содержащих лекарственное средство, полимерной мембраной для предотвращения высвобождения лекарственного средства в полости рта. Однако главным недостатком маскирования вкуса является более медленное растворение лекарственного(ых) средства(ств) из микрочастиц с эффективно маскированным вкусом. Чем более горьким является лекарственное средство, тем более толстым должно быть вкусомаскирующее покрытие, и, следовательно, тем более медленным будет высвобождение лекарственного средства из частиц с маскированным вкусом, содержащих лекарственное средство. Таким образом, именно процесс эффективного маскирования вкуса частиц, содержащих лекарственное средство, приводит к существенно более медленному высвобождению лекарственного средства, с сопутствующей более медленной системной абсорбцией лекарственного средства в желудочно-кишечном тракте.
В некоторых случаях более медленное высвобождение лекарственного средства является особой проблемой лекарственных форм ODT, которые предназначены быть биоэквивалентными референтной лекарственной форме с немедленным высвобождением (IR), например биоэквивалентными обычной таблетке или шипучей таблетке на основе лекарственной формы IR, имеющей Тмакс менее часа и быстрое начало действия. Для таких продуктов ODT, биоэквивалентных продуктам с немедленным высвобождением, важно, чтобы вкусомаскирующий слой существенно не снижал скорость высвобождения лекарственного средства. Для композиций ODT, содержащих комбинации двух или более лекарственных средств (например композиции высокодозового/низкодозового лекарственного средства) данная проблема является особенно острой, так как для разных лекарственных компонентов комбинации ODT могут требоваться разные уровни маскирования вкуса в зависимости от степени горечи лекарственных средств (то есть для лекарственных средств с низкими уровнями горечи может требоваться незначительное или вообще не требоваться маскирование вкуса, в то время как для очень горьких лекарственных средств могут требоваться существенные вкусомаскирующие слои). В качестве еще одного осложнения, вкусомаскирующие слои снижают скорость высвобождения плохорастворимых лекарственных средств в большей степени, чем более растворимых лекарственных средств. В некоторых случаях может быть более желательной композиция ODT, содержащая частицы низкодозового лекарственного средства с маскированным вкусом в комбинации с частицами высокодозового лекарственного средства, имеющими покрытие с замедленным высвобождением.
Кроме того, ODT должны быстро распадаться при контакте со слюной в полости рта, в то же время также обеспечивая достаточную твердость таблетки и прочность, достаточную, чтобы выдерживать трение в процессе упаковки, хранения, транспортировки, распределения и конечного применения, а также обеспечивать приемлемые органолептические свойства (например быть приятными на вкус, как описано выше, и обеспечивать гладкий (незернистый) привкус) и приемлемые фармакокинетические свойства (то есть быстрое начало действия, Смаке, характеристики AUC, подобные референтным лекарственным средствам). Часто является довольно трудным достигнуть всех этих свойств, так как для достаточного маскирования вкуса более растворимых и/или более горьких лекарственных средств могут требоваться более толстые вкусомаскирующие слои, что может сделать сложным получение нужного быстрого высвобождения лекарственного средства.
Таким образом, изготовление клинически эффективных фармацевтических композиций, содержащих по меньшей мере высокодозовое и низкодозовое лекарственное средство, в частности в форме ODT, является довольно сложным и требует согласования многих различных и часто конкурирующих требований.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В одном воплощении настоящее изобретение направлено на. фармацевтическую композицию, содержащую множество микрочастиц, имеющих покрытие с модифицированным высвобождением и содержащих высокодозовое/низкодозовое лекарственное средство, где микрочастицы" содержащие лекарственное средство, включают:
(а) ядро, содержащее высокодозовое лекарственное средство;
(б) первое покрытие, содержащее низкодозовое лекарственное средство, расположенное поверх ядра; и
(в) второе покрытие, расположенное поверх ядра, покрытие с модифицированным высвобождением (например вкусомаскирующее покрытие, или покрытие с замедленным высвобождением для достижения маскирования вкуса и/или свойств пролонгированного/замедленного высвобождения), содержащее нерастворимый в воде полимер.
В другом воплощении настоящее изобретение направлено на фармацевтическую композицию, содержащую множество микрочастиц с маскированным вкусом, содержащих неопиоидное анальгетическое лекарственное средство/опиоидное анальгетическое лекарственное средство, где микрочастицы, содержащие лекарственное средство, включают:
(а) ядро, содержащее высокодозовое лекарственное средство, такое как неопиоидное анальгетическое лекарственное средство;
(б) слой, содержащий низкодозовое лекарственное средство, такое как опиоидное анальгетическое лекарственное средство, расположенный поверх ядра, содержащего высокодозовое лекарственное средство; и
(в) по меньшей мере один слой покрытия с модифицированным высвобождением (например слой вкусомаскирующего покрытия, или слой покрытия с замедленным высвобождением), расположенный поверх ядра с высокодозовым лекарственным средством, а также ядра, содержащего высокодозовое/низкодозовое лекарственное средство, где по меньшей мере один слой вкусомаскирующего покрытия или покрытия с замедленным высвобождением содержит нерастворимый в воде полимер или комбинацию нерастворимого в воде полимера с одним или более растворимыми в воде полимерами, кишечнорастворимым полимером или желудочнорастворимым порообразователем.
В еще одном воплощении настоящее изобретение направлено на фармацевтическую композицию, содержащую множество микрочастиц, содержащих высокодозовое/низкодозовое лекарственное средство в комбинации с микрочастицами, содержащими высокодозовое лекарственное средство, где микрочастицы, содержащие лекарственное средство, включают:
(а) ядро, содержащее высокодозовое лекарственное средство;
(б) возможно герметизирующее покрытие, расположенное поверх ядра, содержащего высокодозовое лекарственное средство;
(в) слой покрытия с замедленным высвобождением, расположенный поверх ядра, содержащего высокодозовое лекарственное средство;
(г) слой низкодозового лекарственного средства, расположенный поверх слоя покрытия с замедленным высвобождением;
(д) герметизирующее покрытие, расположенное поверх слоя низкодозового лекарственного средства; и
(е) вкусомаскирующий слой, расположенный поверх герметизирующего покрытия;
где слой покрытия с замедленным высвобождением содержит нерастворимый в воде полимер, возможно в комбинации с одним или более водорастворимыми или кишечнорастворимыми полимерами; таким образом обеспечивая маскирование вкуса и/или свойства замедленного высвобождения микрочастицам, содержащим высокодозовое лекарственное средство; и вкусомаскирующий слой, расположенный поверх микрочастиц, содержащих низкодозовое лекарственное средство, содержит нерастворимый в воде полимер, возможно в комбинации с желудочнорастворимым полимером или желудочнорастворимым порообразователем.
В еще одном воплощении настоящее изобретение направлено на фармацевтическую композицию, содержащую множество покрытых оболочкой с модифицированным высвобождением микрочастиц, содержащих высокодозовое/низкодозовое лекарственное средство, где микрочастицы, содержащие лекарственное средство, включают:
(а) ядро, содержащее высокодозовое лекарственное средство;
(б) возможно герметизирующее покрытие, расположенное поверх ядра, содержащего высокодозовое лекарственное средство;
(в) слой вкусомаскирующего покрытия, расположенный поверх слоя герметизирующего покрытия;
(г) слой низкодозового лекарственного средства, расположенный поверх слоя вкусомаскирующего покрытия;
(д) герметизирующее покрытие, расположенное поверх слоя низкодозового лекарственного средства; и
(е) ароматизирующий слой, расположенный поверх герметизирующего покрытия.
В еще одном воплощении настоящее изобретение направлено на лекарственную форму ODT, содержащую комбинацию одной из фармацевтических композиций по настоящему изобретению, быстродиспергируемые микрогранулы и, возможно, вторую совокупность частиц, содержащих высокодозовое лекарственное средство, включающих ядро, содержащее высокодозовое лекарственное средство, покрытое слоем покрытия с модифицированным высвобождением.
В еще одном воплощении настоящее изобретение направлено на способ изготовления фармацевтических композиций, раскрытых в данном описании изобретения, включающий:
(1) получение ядер, содержащих высокодозовое лекарственное средство;
(2) покрытие ядер со стадии (1), содержащих высокодозовое лекарственное средство, слоем низкодозового лекарственного средства, с получением таким образом микрочастиц, содержащих высокодозовое/низкодозовое лекарственное средство; и
(3) покрытие ядер со стадии (1), содержащих высокодозовое лекарственное средство, и/или микрочастиц со стадии (2), содержащих высокодозовое/низкодозовое лекарственное средство, покрывающим слоем, содержащим нерастворимый в воде полимер, с образованием таким образом микрочастиц с замедленным высвобождением и маскированным вкусом, содержащих высокодозовое/низкодозовое лекарственное средство.
В еще одном воплощении настоящее изобретение направлено на способ изготовления фармацевтической композиции ODT, как раскрыто в данном описании изобретения, дополнительно включающий:
(1) изготовление быстродиспергируемых микрогранул, содержащих сахарный спирт, сахарид или их смесь со средним размером частиц не более чем 30 мкм и суперразрыхлитель;
(2) изготовление смеси, включающей микрочастицы, содержащие высокодозовое/низкодозовое лекарственное средство, с микрочастицами, содержащими высокодозовое лекарственное средство, и быстродиспергируемые микрогранулы
(3) прессование смеси в перорально распадающиеся таблетки. В еще одном воплощении настоящее изобретение направлено на способ лечения пациента, подверженного заболеванию или состоянию, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества композиций по настоящему изобретению, содержащих высокодозовое лекарственное средство и низкодозовое лекарственное средство.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
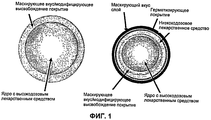
На Фиг.1 показано схематическое изображение одного воплощения микрочастицы, имеющей покрытие с модифицированным высвобождением, включающей ядро, содержащее высокодозовое лекарственное средство, а также микрочастицы с маскированным вкусом, содержащей низкодозовое/высокодозовое лекарственное средство. Поперечное сечение комбинации высокодозового/низкодозового лекарственных средств. Комбинация ODT высокодозового/низкодозового лекарственных средств содержит быстродиспергируемые микрогранулы, микрочастицы высокодозового/низкодозового лекарственных средств с маскированным вкусом и микрочастицы высокодозового лекарственного средства с маскированным вкусом или замедленным высвобождением
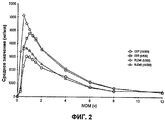
На Фиг.2 показаны профили зависимости концентрации в плазме от времени для ацетаминофена из таблеток гидрокодона битартрата/ацетаминофена, наблюдаемые в пилотном РК (фармакокинетическом) исследовании.
На Фиг.3 показаны профили зависимости концентрации в плазме от времени для гидрокодона битартрата из таблеток гидрокодона битартрат/ацетаминофена, наблюдаемые в пилотном РК исследовании.
На Фиг.4 показаны профили зависимости концентрации в плазме от времени для ацетаминофена из ODT ацетаминофена в сравнении с Panadol®, наблюдаемые в пилотном РК исследовании.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Все документы, приведенные в данном описании изобретения, включены посредством ссылки во всей их полноте для всех целей. Цитирование любого документа не может быть истолковано как признание того, что он представляет собой известный уровень техники по отношению к настоящему изобретению.
Настоящее изобретение направлено на фармацевтические композиции, содержащие множество имеющих покрытие с модифицированным высвобождением микрочастиц, содержащих высокодозовое/низкодозовое лекарственное средство, как описано в данном описании изобретения. Композиции по настоящему изобретению обеспечивают пероральные лекарственные формы, содержащие комбинацию высокодозового лекарственного средства/низкодозового лекарственного средства, удовлетворяющие одной или более из следующих характеристик:
- микрочастицы, имеющие вкусомаскирующее покрытие и/или покрытие с замедленным высвобождением, где низкодозовое лекарственное средство наносят слоем на микрочастицы, содержащие высокодозовое лекарственное средство, где однородность смеси удовлетворяют требованиям Фармакопеи США;
- микрочастицы с эффективно маскированным вкусом, независимо от различий в растворимости и горечи высокодозового и низкодозового лекарственных средств;
- в некоторых воплощениях также содержащие быстродиспергируемые гранулы так, чтобы обеспечивать лекарственную форму ODT, которая быстро распадается после контакта со слюной в полости рта и образует гладкую, легко проглатываемую суспензию, содержащую частицы лекарственного средства с маскированным вкусом;
- частицы лекарственного средства со средним диаметром частиц не более чем примерно 400 мкм для обеспечения гладкого привкуса, не оставляющие послевкусия (то есть незначительное или минимальное высвобождение лекарственного средства с незернистым или немеловым вкусом) вплоть до проглатывания;
- обеспечение быстрого, по существу полного высвобождения дозы из частиц лекарственного средства с немедленным высвобождением и маскированным вкусом после поступления в желудок, таким образом увеличение вероятности быть биоэквивалентным соответствующему(им) референтному(ым) лекарственному(ым) продукту(ам) с немедленным высвобождением или обеспечение целевого профиля высвобождения высокодозового лекарственного средства, подходящего для режима дозирования один раз или два раза в сутки; и
- получение прочных таблеточных препаратов, демонстрирующих приемлемую твердость и ломкость таблеток, подходящие для упаковки в HDPE (полиэтилен высокого давления) бутыли и/или транспортировки без упаковки или в виде упакованных таблеток для торгового распределения и конечного применения.
Термин «лекарственное средство», «активный» или «активный фармацевтический ингредиент» при использовании в данном описании изобретения включает фармацевтически приемлемое и терапевтически эффективное соединение, его фармацевтически приемлемые соли, стереоизомеры и смеси стереоизомеров, сольваты (включая гидраты), полиморфы и/или их эфиры. При упоминании лекарственного средства в описаниях различных воплощений изобретения, это упоминание охватывает основное лекарственное средство, его фармацевтически приемлемые соли, стереоизомеры и смеси стереоизомеров, сольваты (включая гидраты), полиморфы и/или эфиры, если не указано иное.
Термины «слой» или «покрытие» при использовании в данном описании изобретения являются синонимами. Например, термины герметизирующий слой, слой лекарственного средства и так далее являются синонимичными герметизирующему покрытию, лекарственному покрытию и так далее.
Термины «перорально распадающаяся таблетка» или «ODT» относятся к таблетке, которая быстро распадается в полости рта пациента после введения, без необходимости ее разжевывания. Скорость распадения может варьироваться, но она выше скорости распадения обычных твердых лекарственных форм (например таблеток или капсул), которые предназначены для проглатывания непосредственно после введения, или жевательных твердых лекарственных форм. Перорально распадающиеся композиции по настоящему изобретению могут содержать фармацевтически приемлемые ингредиенты, которые набухают, растворяются или иным образом облегчают распадение или растворение композиции ODT. Такие ингредиенты могут включать фармацевтический разрыхлитель, такой как кросповидон, водорастворимый сахарный спирт, такой как маннит, сахарид, такой как лактоза, или их смесь, водорастворимое связующее вещество, такое как повидон, плавкое твердое вещество (например гидрофобный воск, такой как полиэтиленгликоль, глицерилбегенат, стеариновая кислота, гидрогенизированное касторовое масло и так далее), которые могут высвобождать лекарственные средства при поступлении в желудок. Перорально распадающиеся композиции по настоящему изобретению могут находиться в форме таблетки, минитаблетки, капсулы или однодозового пакетика, или сухого порошка для восстановления.
Термин «примерно» при использовании в данном описании изобретения по отношению к численной величине включает «ровно». Например, «примерно 60 секунд» включает ровно 60 секунд, а также значения, близкие к 60 секундам (например 50 секунд, 55 секунд, 59 секунд, 61 секунду, 65 секунд, 70 секунд и так далее).
Если не указано иное, количество различных покрытий или слоев, описанных в данном описании изобретения («масса покрытия») выражают в процентах увеличения массы частиц или гранул, обеспечиваемого сухим покрытием относительно первоначальной массы частиц или гранул перед нанесением покрытия. Таким образом, масса покрытия 10% относится к сухому покрытию, которое увеличивает массу частицы на 10%.
При использовании в данном описании изобретения термин «немедленное высвобождение» или IR относится к высвобождению более или равному примерно 50%, или более примерно 75%, или более примерно 90%, или более примерно 95% лекарственного средства в течение примерно 2 часов, более конкретно в течение примерно одного часа после введения лекарственной формы.
Термин «по существу распадается» означает уровень распадения, соответствующий распадению по меньшей мере примерно 50%, по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 80%, по меньшей мере примерно 90% или примерно 100%-ному распадению композиции ODT.
При использовании в данном описании изобретения, термин покрытие «с модифицированным высвобождением» охватывает покрытия, которые приостанавливают высвобождение, замедляют высвобождение, продлевают высвобождение, предотвращают высвобождение и/или иным образом пролонгируют высвобождение лекарственного средства относительно композиций, не имеющих таких покрытий, которые высвобождают лекарственное средство относительно быстро (то есть композиции «с немедленным высвобождением»). Термин «регулируемое высвобождение» охватывает «замедленное высвобождение», «пролонгированное высвобождение», «отсроченное высвобождение» и «спланированное по времени, пульсирующее высвобождение». Термин покрытие «с задержкой по времени» относится к конкретному типу покрытия «с регулируемым высвобождением», где покрытие с задержкой по времени задерживает высвобождение лекарственного средства после введения. Термин «регулируемое высвобождение» также используется взаимозаменяемо с «модифицированным высвобождением». Термин «частица с регулируемым высвобождением» относится к частице, проявляющей одно или более свойств регулируемого высвобождения, как описано в данном описании изобретения. Термин «частица с регулируемым высвобождением» также относится к частице, содержащей лекарственное средство, покрытой одним или более покрытиями с регулируемым высвобождением, как описано в данном описании изобретения.
Термин «существенно маскирует вкус» по отношению к вкусомаскирующему слою частиц IR (при наличии) относится к способности вкусомаскирующего слоя существенно препятствовать высвобождению лекарственного средства с горьким вкусом в полости рта пациента. Вкусомаскирующий слой, который «существенно маскирует» вкус лекарственного средства, обычно высвобождает менее чем примерно 10% лекарственного средства в полости рта пациента, в других воплощениях менее чем примерно 5%, менее чем примерно 1%, менее чем примерно 0,5%, менее чем примерно 0,1%, менее чем примерно 0,05%, менее чем примерно 0,03%, менее чем примерно 0,01% лекарственного средства. Вкусомаскирующие свойства вкусомаскирующего слоя композиций по настоящему изобретению можно измерять in vivo (например, используя обычные органолептические способы тестирования, известные в данной области техники) или in vitro (например, используя тесты на растворение, как описано в данном описании изобретения). Специалисту очевидно, что величина высвобождения лекарственного средства, ассоциированного с вкусомаскирующим слоем, который «существенно маскирует» вкус лекарственного средства, не ограничена диапазонами, ясно раскрытыми в данном описании изобретения, и может варьироваться в зависимости от других факторов, таких как воспринимаемая горечь лекарственного средства и присутствие других ароматизирующих агентов в композиции.
Термин «существенно модифицирует высвобождение» по отношению к слою, относится к способности этого слоя обеспечивать свойства модифицированного высвобождения, то есть задерживать высвобождение, замедлять высвобождение, продлевать высвобождение, предотвращать высвобождение и/или иным образом пролонгировать высвобождение лекарственного средства по сравнению с композициями, лишенными такого покрытия, которые высвобождают лекарственное средство относительно быстро (то есть композициями «с немедленным высвобождением»), как описано в данном описании изобретения.
При использовании в данном описании изобретения, термин «замедленное высвобождение» (SR) относится к свойству медленного высвобождения лекарственного средства из частицы ядра, содержащей лекарственное средство, без существенной задержки по времени. Термин «покрытие с замедленным высвобождением или «покрытие SR» относится к покрытию, демонстрирующему свойства замедленного высвобождения. Термин «частица с замедленным высвобождением» относится к частице, содержащей лекарственное средство, демонстрирующей свойства замедленного высвобождения. В одном воплощении покрытие с замедленным высвобождением содержит нерастворимый в воде полимер и, возможно, водорастворимый полимер. Покрытие SR возможно может содержать пластификатор или другие ингредиенты, которые не оказывают негативного влияния на такие свойства покрытия как «замедленное высвобождение».
При использовании в данном описании изобретения термин «спланированное по времени пульсирующее высвобождение» (TPR) относится к свойству модифицированного высвобождения лекарственного средства после заранее определенной задержки по времени. Термин «покрытие со спланированным по времени пульсирующим высвобождением» или «покрытие TPR» относится к покрытию, демонстрирующему свойства спланированного по времени пульсирующего высвобождения. Термин «частица со спланированным по времени пульсирующим высвобождением» относится к частице, содержащей лекарственное средство, демонстрирующей свойства спланированного по времени пульсирующего высвобождения. В некоторых воплощениях задержка по времени от по меньшей мере примерно 2 до примерно 10 часов достигается путем покрытия частиц, например, комбинацией по меньшей мере одного нерастворимого в воде полимера и по меньшей мере одного кишечнорастворимого полимера (например комбинацией этилцеллюлозы и фталата гипромеллозы). Покрытие TPR возможно может содержать пластификатор или другие ингредиенты, которые не оказывают негативного влияния на свойства покрытия «спланированного по времени пульсирующего высвобождения».
Термин «имеющие покрытие с модифицированным высвобождением микрочастицы, содержащие лекарственное средство» относится главным образом к микрочастицам, содержащим лекарственное средство (например к кристаллам, гранулам, пеллетам, изготовленным посредством регулируемой сферонизации, или частицам/гранулам, покрытым слоем лекарственного средства), покрытым одним или более функциональными полимерами для достижения эффективной маскировки вкуса и/или пролонгированного/замедленного высвобождения. Что касается микрочастиц, содержащих высокодозовое/низкодозовое лекарственное средство, данный термин относится к микрочастицам, имеющим покрытие с модифицированным высвобождением, содержащим высокодозовое/низкодозовое лекарственное средство, как описано в данном описании изобретения.
Термины «профиль зависимости концентрации в плазме от времени», «Смаке», «AUC», «Тмакс» и «период полувыведения» имеют свои общепринятые значения, как определено в "Руководящих указаниях для производства:
Биоэквивалентность" FDA (Управление по контролю за продуктами и лекарствами США).
Если не указано иное, все проценты и соотношения рассчитаны по массе в расчете на массу всей композиции.
Термин «расположенный поверх» означает, что второе вещество нанесено поверх первого вещества, где это второе вещество может находиться или может не находиться в непосредственном физическом контакте с первым веществом. Таким образом, возможно, но не необходимо, чтобы между первым и вторым веществами располагалось промежуточное вещество.
Терапии комбинацией лекарственных средств все в большей степени полезны в лечении заболеваний или состояний, которые преимущественно лечат путем введения двух или более лекарственных средств. Например, лечение боли выигрывает от введения низких доз опиоидных анальгетиков комбинации с относительно высокими дозами неопиоидных анальгетиков (например NSAID (нестероидное противовоспалительное средство)), которые эффективно лечат боль от умеренной до сильной, кроме того снижая количество потенциально формирующего привыкание вводимого опиоидного лекарственного средства. Для других показаний (например диабета), комбинация лекарственных средств может взаимодействовать синергически с получением более значительных клинических преимуществ по сравнению с любым лекарственным средством, введенным отдельно. Однако необходимость вводить многократные лекарственные формы, каждая из которых содержит одно лекарственное средство, может приводить к таким проблемам, как ухудшенное соблюдение пациентом схемы лечения, ошибки при введении правильных доз каждого лекарственного средства и так далее. В таких ситуациях выгодно готовить одну лекарственную форму, комбинируя два (или более) лекарственных средства, тем самым обеспечивая возможность введения одной лекарственной формы, а не двух (или более) лекарственных форм. Однако изготовление таких комбинированных фармацевтических композиций, когда одно из лекарственных средств присутствует в относительно высокой концентрации по сравнению с одним или более другими лекарственными средствами может представлять трудность; на практике трудно получать однородную смесь высокодозового лекарственного средства и низкодозового лекарственного средства, так чтобы и высокодозовое лекарственное средство, и низкодозовое лекарственное средство были воспроизводимо обеспечены в их соответствующих правильных дозировках.
Настоящее изобретение направлено на фармацевтические композиции, содержащие множество микрочастиц, содержащих высокодозовое/низкодозовое лекарственного средство с маскированным вкусом, каждая из которых содержит как высокодозовое лекарственное средство (или лекарственные средства), так и низкодозовое лекарственное средство (или лекарственные средства). Ядро микрочастиц, содержащих высокодозовое/низкодозовое лекарственное средство с маскированным вкусом, содержит высокодозовое лекарственное средство, а низкодозовое лекарственное средство представлено в слое низкодозового лекарственного средства, расположенном поверх ядра, содержащего высокодозовое лекарственное средство.
Подходящие композиции ядра включают частицы высокодозового лекарственного средства самого по себе (например образованные посредством перекристаллизации или осаждения высокодозового лекарственного средства из раствора, или путем измельчения и просеивания высокодозового лекарственного средства и так далее, так чтобы получать частицы, содержащие высокодозовое лекарственное средство, с желательным размером частиц и распределением частиц по размерам). Альтернативно, ядро может содержать гранулят, содержащий частицы высокодозового лекарственного средства в комбинации с одним или более фармацевтически приемлемыми эксципиентами (например лактозой, маннитом, микрокристаллической целлюлозой и так далее) и возможно связующим веществом, полученные с помощью влажного или сухого гранулирования. В других воплощениях ядро может содержать экструдированные и сферонизированные частицы, содержащие высокодозовое лекарственное средство (например в комбинации с подходящими фармацевтически приемлемыми эксципиентами, как описано в данном описании изобретения), или пеллеты высокодозового лекарственного средства готовят посредством регулируемой сферонизации в Granurex VEC-35 или VEC-40 от Vector Corpoation и эти пеллеты покрывают полимерами или смесями полимеров, обеспечивая целевые профили высвобождения лекарственного средства, подходящие для режима дозирования один раз или два раза в сутки. В других воплощениях ядро содержит гранулы, покрытые слоем лекарственного средства, то есть инертное ядро (например сахарные сферы, микрокристаллическая целлюлоза, маннит-микрокристаллическая целлюлоза, диоксид кремния и так далее), покрытое слоем высокодозового лекарственного средства и возможно связующего вещества. В других воплощениях ядро может содержать высокодозовое лекарственное средство в комбинации с фармацевтически приемлемыми эксципиентами, спрессованное в «минитаблетки» с диаметром частиц в диапазоне примерно 2-5 мм. В конкретном воплощении ядро содержит частицы высокодозового лекарственного средства. Во многих воплощениях ядро имеет средний размер частиц менее примерно 500 мкм, или менее примерно 400 мкм, или менее примерно 300 мкм или менее примерно 200 мкм.
Любую фармацевтически приемлемую комбинацию высокодозового/низкодозового лекарственного средства, которая является эффективной в лечении болезненных состояний или состояний, включающих, например, сердечнососудистые заболевания, диабет, боль от умеренной до сильной, желудочно-кишечные расстройства и так далее, можно выбирать согласно конкретным воплощениям настоящего изобретения для создания фармацевтических композиций, содержащих одну или более совокупностей имеющих покрытие с модифицированным высвобождением микрочастиц, содержащих высокодозовое/низкодозовое лекарственное средство, демонстрирующих желательные профили высвобождения лекарственного средства in vitro/in vivo.
Любое фармацевтически приемлемое полимерное связующее вещество, которое совместимо с высокодозовым лекарственным средством и/или другими компонентами композиции, можно использовать в изготовлении ядер, содержащих высокодозовое лекарственное средство (например связующее вещество, используемое в формировании гранулята, в формировании гранул, покрытых слоем лекарственного средства, и так далее.). Подходящие полимерные связующие вещества включают, например, полимеры, выбранные из группы, состоящей из гидроксипропилцеллюлозы, повидона, метилцеллюлозы, гидроксипропилметилцеллюлозы, карбоксиалкилцеллюлоз, полиэтиленоксидов, полисахаридов, гуммиарабика, альгиновой кислоты, агара, кальция каррагинана, натрий-карбоксиметилцеллюлозы, микрокристаллической целлюлозы, декстрина, этилцеллюлозы, желатина, глюкозного сиропа (liquid glucose), гуаровой камеди, гидроксипропилметилцеллюлозы, метилцеллюлозы, пектина, PEG (полиэтиленгликоля), повидона, клейстеризованного крахмала и так далее.
Ядро, содержащее высокодозовое лекарственное средство, может быть непосредственно покрыто слоем низкодозового лекарственного средства, или может быть сначала покрыто герметизирующим слоем. Подходящие герметизирующие слои содержат гидрофильный водорастворимый полимер. Неограничивающие примеры подходящих гидрофильных полимеров включают гидрофильную гидроксипропилцеллюлозу (например Klucel® LF), гидроксипропилметилцеллюлозу или гипромеллозу (например Opadry® Clear или Pharmacoat™ 603), сополимер винилпирролидон-винилацетат (например Kollidon® VA 64 от BASF) и этилцеллюлозу, например этилцеллюлозу низкой вязкости. Во многих воплощениях, особенно когда ядро, содержащее высокодозовое лекарственное средство, представляет собой частицы высокодозового лекарственного средства, для композиций по настоящему изобретению не требуется герметизирующий слой, наносимый непосредственно на ядро.
Герметизирующий слой может быть нанесен с массой покрытия от примерно 1% до примерно 10%, например примерно 1%, примерно 2%, примерно 3%, примерно 4%, примерно 5%, примерно 6%, примерно 7%, примерно 8%, примерно 9% или примерно 10%, включая все диапазоны и поддиапазоны между этими значениями.
В некоторых воплощениях предполагается, что композиции по настоящему изобретению распадаются в полости рта пациента после введения (например лекарственная форма ODT, как описано в данном описании изобретения). В таких воплощениях, когда высокодозовое лекарственное средство и/или низкодозовое лекарственное средство имеет неприятные для органов чувств свойства (например горький вкус), вкус ядра, содержащего высокодозовое лекарственное средство, и/или слоя, содержащего низкодозовое лекарственное средство, маскируют, чтобы предохранить пациента от ощущения вкуса высокодозового и/или низкодозового лекарственного средства, например посредством покрытия ядра, содержащего высокодозовое лекарственное средство, и/или слоя, содержащего низкодозовое лекарственное средство, вкусомаскирующим слоем. Например, композиции по настоящему изобретению могут включать один вкусомаскирующий слой, как описано в данном описании изобретения, расположенный между ядром, содержащим высокодозовое лекарственное средство, и слоем, содержащим низкодозовое лекарственное средство, один вкусомаскирующий слой, как описано в данном описании изобретения, расположенный поверх слоя, содержащего низкодозовое лекарственное средство, или два вкусомаскирующих слоя, расположенных, соответственно, между ядром, содержащим высокодозовое лекарственное средство, и слоем, содержащим низкодозовое лекарственное средство, и поверх слоя, содержащего низкодозовое лекарственное средство. Вкусомаскирующий слой может быть нанесен непосредственно на ядро, содержащее высокодозовое лекарственное средство, и/или на слой, содержащий низкодозовое лекарственное средство, либо ядро, содержащее высокодозовое лекарственное средство, и/или слой, содержащий низкодозовое лекарственное средство, могут быть сначала покрыты герметизирующим слоем (например, как описано в данном описании изобретения), например, чтобы минимизировать или предотвратить статический заряд и/или трение частиц, с последующим нанесением вкусомаскирующего полимерного покрытия. Когда композиции по настоящему изобретению содержат два или более вкусомаскирующих слоя, вкусомаскирующие слои могут быть независимо выбраны из любых композиций вкусомаскирующего слоя, описанных в данном описании изобретения.
Подходящие вкусомаскирующие слои могут содержать нерастворимый в воде полимер или комбинацию нерастворимого в воде полимера и желудочнорастворимого порообразователя (например желудочнорастворимые и фармацевтически приемлемые органические, неорганические или полимерные вещества).
Вкусомаскирующий слой может быть нанесен на ядро, содержащее высокодозовое лекарственное средство, и/или на слой, содержащий низкодозовое лекарственное средство, любым подходящим способом, например, путем нанесения покрытия в кипящем слое или посредством коацервации. Например, вкусомаскирующее полимерное покрытие может быть нанесено на ядро с увеличением массы (после нанесения покрытия и сушки) от примерно 3% до примерно 50%, включая примерно 3%, примерно 5%, примерно 7%, примерно 10%, примерно 12%, примерно 15%, примерно 17%, примерно 20%, примерно 22%, примерно 25%, примерно 27%, примерно 30%, примерно 35%, примерно 40%, примерно 45%, или примерно 50%, включая все диапазоны и поддиапазоны между этими значениями.
Неограничивающие примеры подходящих нерастворимых в воде полимеров включают этилцеллюлозу, ацетилцеллюлозу, триацетатцеллюлозу, бутират ацетилцеллюлозы, поливинилацетат, нейтральные сополимеры метилакриловой кислоты-метилметакрилата (например Eudragit RL, RS и NE30D и так далее) и их смеси. В одном воплощении нерастворимый в воде полимер содержит этилцеллюлозу. В другом воплощении нерастворимый в воде полимер содержит этилцеллюлозу со средней вязкостью 10 сП (1 Па·с) (например Ethocel Standard 10 Premium) или примерно 100 сП (Ethocel Standard 100 Premium) в 5% растворе в смеси 80/20 толуол/этанол, измеренной при 25°С вискозиметром Ubbelohde.
Как описано в данном описании изобретения, в некоторых воплощениях вкусомаскирующий(ие) слой(и) независимо содержит(ат) комбинацию не растворимого в воде полимера (как описано в данном описании изобретения) и желудочнорастворимого порообразователя. Порообразователи включают полимерные и неполимерные фармацевтически приемлемые желудочнорастворимые вещества. Неограничивающие примеры неполимерных желудочнорастворимых порообразователей включают фармацевтически приемлемые неорганические вещества, такие как карбонат кальция, карбонат магния, фосфат кальция, гидроксид железа (III), фосфат железа (III), гидроксид магния, фосфат магния и так далее; фармацевтически приемлемые неполимерные органические вещества, такие как сахарид кальция, сукцинат кальция, тартрат кальция, цитрат магния, ацетат железа(III) и так далее; фармацевтически приемлемые желудочнорастворимые полимеры, включающие мальтрин, сополимеры аминоалкилметилакрилата, имеющиеся в продаже под торговой маркой Eudragit® (тип Е100 или ЕРО), поливинилацеталя диэтиламиноацетат, например АЕА®, имеющийся в продаже у Sankyo Company Limited, Tokyo (Japan) и тому подобные; и их смеси. В одном воплощении желудочнорастворимый полимер представляет собой терполимер на основе диметиламиноэтилметилакрилата, бутилметилакрилата и метилметакрилата. В другом воплощении терполимер имеет среднюю молекулярную массу 150000 и соотношение мономеров составляет 1:2:1 метилметакрилата, N,N-диметиламиноэтилметилакрилата и бутилметилакрилата, и их смеси.
Отношение нерастворимого в воде полимера к желудочнорастворимому порообразователю находится в диапазоне от примерно 95/5 до примерно 50/50, включая примерно 90/10, примерно 85/15, примерно 80/20, примерно 75/25, примерно 70/30, примерно 65/35, примерно 60/40 или примерно 55/45.
Масса покрытия вкусомаскирующего слоя, содержащего нерастворимый в воде полимер и желудочнорастворимый порообразователь, находится в диапазоне от примерно 5% до примерно 30%, или примерно 5%-25%, примерно 5%-20%, примерно 5%-15%, примерно 5%-10%, примерно 10%-30%, примерно 10%-25%, примерно 10%-20%, примерно 10%-15%, примерно 15%-30%, примерно 50%-25%, примерно 15%-20%, примерно 20%-30%, примерно 20%-25% или примерно 25%-30%.
Отношение нерастворимого в воде полимера к желудочнорастворимому полимеру находится в диапазоне от примерно 9/1 до примерно 1/1, включая диапазон от примерно 6/3 до примерно 2/1. В других воплощениях отношение нерастворимого в воде полимера к желудочнорастворимому полимеру составляет примерно 95/5, примерно 90/10, примерно 85/15, примерно 80/20, примерно 75/25, примерно 70/30, примерно 65/35, примерно 60/40, примерно 55/45 или примерно 50/50, включая все величины, диапазоны и поддиапазоны между этими значениями.
В некоторых воплощениях вкусомаскирующий слой, содержащий комбинацию нерастворимого в воде полимера и желудочнорастворимого полимера, имеет массу покрытия от примерно 10% до примерно 40% масс., включая диапазоны от примерно 12% до примерно 30%, от примерно 15% до примерно 25% и от примерно 20% до примерно 30%. В других воплощениях масса покрытия вкусомаскирующего слоя, содержащего комбинацию нерастворимого в воде и желудочнорастворимого полимеров, составляет примерно 10%, примерно 12,5%, примерно 13%, примерно 15%, примерно 17%, примерно 18%, примерно 20%, примерно 22%, примерно 24%, примерно 25%, примерно 27%, примерно 30%, примерно 35% или примерно 40%, включая все диапазоны и поддиапазоны между этими значениями.
В различных воплощениях желательно обеспечивать покрывающий слой с пролонгированным высвобождением на ядрах, содержащих высокодозовое лекарственное средство, чтобы модифицировать высвобождение высокодозового лекарственного средства. Покрытие с пролонгированным высвобождением, нанесенное на ядра, содержащие высокодозовое лекарственное средство, может содержать нерастворимый в воде полимер, тем самым образуя покрытие с замедленным высвобождением (SR); нерастворимый в воде полимер в комбинации с кишечнорастворимым или водорастворимым полимером, тем самым образуя покрытие со спланированным по времени пульсирующим высвобождением (TPR). В других воплощениях покрытие с пролонгированным высвобождением содержит кишечнорастворимый полимер, нанесенный на частицу, содержащую высокодозовое лекарственное средство, тем самым образуя покрытие с отсроченным высвобождением (DR).
В некоторых воплощениях покрытие с пролонгированным высвобождением обеспечивает подходящие свойства (например свойства пролонгированного высвобождения, механические свойства и свойства покрытия) без необходимости в пластификаторе. Например, этилцеллюлозу без пластификатора используют для нанесения покрытия на ядра, содержащие лекарственное средство, путем коацервации в растворителе посредством разделения фаз для маскирования вкуса, и/или она может быть нанесена, например, из подходящего растворителя для обеспечения свойств замедленного высвобождения. Также покрытия, содержащие поливинилацетат (PVA), нейтральные и катионные сополимеры эфиров акрилата/метилакрилата (например NE30D и ЕРО), воски и так далее, могут быть нанесены без пластификаторов.
Неограничивающие примеры подходящих кишечнорастворимых полимеров включают ацетофталат целлюлозы, фталат гидроксипропилметилцеллюлозы, ацетосукцинат гидроксипропилметилцеллюлозы, фталат поливинилацетата, рН-чувствительные сополимеры метилакриловой кислоты/метилметакрилата (например Eudragit® L, S и FS полимеры), шеллак и их смеси. В некоторых воплощениях неполимерные кишечнорастворимые вещества, такие как неполимерные воски и композиции жирных кислот, можно использовать вместо кишечнорастворимых полимеров, при условии, что они имеют рН-чувствительную растворимость, ассоциированную с кишечнорастворимыми полимерами. Такие кишечнорастворимые полимеры можно использовать в виде раствора в смеси растворителей или в водной дисперсии. Некоторые имеющиеся в продаже вещества, которые можно использовать, представляют собой сополимеры метилакриловой кислоты, продаваемые под торговой маркой Eudragit (L100, S100, L30D), изготовленные Rohm Pharma, Cellacefate (целлюлозы ацетофталата) от Eastman Chemical Co., Aquateric (водная дисперсия целлюлозы ацетофталата) от FMC Corp. и Aqoat (водная дисперсия гидроксипропилметилцеллюлозы ацетосукцината) от Shin Etsu K.K.
Масса покрытия с пролонгированным высвобождением, содержащего комбинацию нерастворимого в воде полимера и кишечнорастворимого полимера, находится в диапазоне от примерно 10 до 60%, более конкретно от примерно 30% до 60%, включая примерно 15%, примерно 20%, примерно 25%, примерно 30%, примерно 35%, примерно 40%, примерно 45%, примерно 50% или примерно 55%, включая все диапазоны и поддиапазоны между этими значениями. Отношение нерастворимого в воде полимера к кишечнорастворимому полимеру может варьироваться от примерно 10:1 до 1:2, более конкретно от примерно 2:1 до 1:1, включая примерно 9:1, примерно 8:1, примерно 7:1 примерно 6:1, примерно 5:1 примерно 4:1, примерно 3:1, примерно 2:1 или примерно 1:1.
В других воплощениях слой с пролонгированным высвобождением содержит комбинацию нерастворимого в воде полимера (как описано в данном описании изобретения) с водорастворимым полимером. Неограничивающие примеры подходящих водорастворимых полимеров включают поливинилпирролидон (например Повидон К-25), полиэтиленгликоль (например PEG 400), гидроксипропилметилцеллюлозу и гидроксипропилцеллюлозу.
Отношение нерастворимого в воде полимера к водорастворимому полимеру находится в диапазоне от примерно 95/5 до примерно 50/50, включая соотношения: примерно 95/5, примерно 90/10, примерно 85/15,, примерно 80/20, примерно 75/25, примерно 70/30, примерно 65/35, примерно 60/40, примерно 55/45 или примерно 50/50, включая все диапазоны и поддиапазоны между этими значениями. В других воплощениях вкусомаскирующий слой, содержащий комбинацию нерастворимого в воде полимера и водорастворимого полимера, наносят на ядро, содержащее высокодозовое лекарственное средство, с массой покрытия примерно 3%, примерно 5%, примерно 7%, примерно 10%, примерно 12%, примерно 15%, примерно 17%, примерно 20%, примерно 22%, примерно 25%, примерно 27%, примерно 30%, примерно 35%, примерно 40%, примерно 45% и примерно 50% масс., включая все величины, диапазоны и поддиапазоны между этими значениями.
В некоторых других воплощениях настоящее изобретение относится к фармацевтической композиции, содержащей ядра высокодозового лекарственного средства, имеющие покрытие с модифицированным высвобождением, содержащие по меньшей мере один терапевтический агент или его фармацевтически приемлемую соль, сольват и/или эфир;
нерастворимый в воде полимер (например этилцеллюлозу), второе возможное покрытие, расположенное поверх первого покрытия, содержащее кишечнорастворимый полимер и, возможно, нерастворимый в воде полимер (например этилцеллюлозу и гипромеллозы фталат в соотношении от примерно 9:1 до примерно 5:5).
Слой с модифицированным высвобождением или вкусомаскирующий слой могут быть непластифицированными или пластифицированными. Например, у частиц, содержащих лекарственное средство, можно маскировать вкус этилцеллюлозой посредством коацервации в растворителе с помощью разделения фаз без необходимости в пластификаторе или из подходящего фармацевтически приемлемого растворителя, используя устройство для нанесения покрытия в кипящем слое. Для покрытий с модифицированным высвобождением, содержащих различные полимеры, такие как Eudragit NE30D, или различные гидрофобные воски, в устройстве для нанесения покрытий в кипящем слое обычно не требуется пластификатор.
Когда желательно и удобно использовать пластификатор, неограничивающие примеры подходящих пластификаторов включают глицерин и его эфиры (например ацетилированные моно- или диглицериды, включая имеющийся в продаже Myvacet® 9-45), глицерилмоностеарат, глицерилтриацетат, глицерилтрибутират, фталаты (например дибутилфталат, диэтилфталат, диметилфталат, диоктилфталат и так далее), трибутиловый эфир ацетиллимонной кислоты, триэтиловый эфир ацетиллимонной кислоты, трибутилцитрат, ацетилтрибутилцитрат, триэтилцитрат, глицерилтрибутират; диэтилсебацинаты, дибутилсебацинаты, дибутиладипаты, дибутилазелаты, дибутилбензоаты, хлорбутанол, полиэтиленгликоли, растительные масла, диэтилфумарат, диэтилмалаты, диэтилоксалат, дибутилсукцинат, дибутилбутират, эфиры цетилового спирта, малонаты (например диэтилмалонат и так далее), касторовые масла, полисорбаты, N-бутилбензолсульфонамид, N-метилпирролидон и их смеси. В некоторых воплощениях желательно использовать нефталатный пластификатор. В различных воплощениях настоящего изобретения количество пластификатора во вкусомаскирующем слое относительно количества нерастворимого в воде полимера находится в диапазоне от примерно 3% до примерно 30% масс.В другом воплощении количество пластификатора находится в диапазоне от 10% до примерно 25% масс. нерастворимого в воде полимера. В других воплощениях количество пластификатора относительно массы нерастворимого в воде полимера составляет примерно 3%, примерно 5%, примерно 7%, примерно 10%, примерно 12%, примерно 15%, примерно 17%, примерно 20%, примерно 22%, примерно 25%, примерно 27% и примерно 30%, включая все диапазоны и поддиапазоны между этими значениями. Специалисту в данной области техники известно, как выбрать тип пластификатора на основе полимера или полимеров и природы покрывающей системы (например водной или на основе растворителя, раствора или на основе дисперсии и общего количества твердых веществ). В конкретном воплощении пластификатор представляет собой касторовое масло.
В некоторых воплощениях вкусомаскирующий слой может также содержать агент, препятствующий прилипанию, для снижения агрегации вкусомаскирующих частиц. Подходящие препятствующие прилипанию агенты включают тальк и/или стеарат магния.
В одном воплощении вкусомаскирующее полимерное покрытие содержит пластифицированный, нерастворимый в воде полимер, такой как этилцеллюлоза (ЕС-10), с массой покрытия примерно 5-50% масс.
В некоторых воплощениях ядро с модифицированным высвобождением (замедленное высвобождение и/или с маскированным вкусом), содержащее высокодозовое лекарственное средство, покрывают герметизирующим слоем, например для минимизации истирания или агломерации ядер с маскированным вкусом или, альтернативно, для предотвращения контакта между высокодозовым лекарственным средством в ядре и, например, низкодозовым лекарственным средством в слое низкодозового лекарственного средства. Композиция и наносимая масса герметизирующего слоя такая, как описано в данном описании изобретения.
Слой низкодозового лекарственного средства наносят непосредственно поверх ядра, содержащего высокодозовое лекарственное средство, или поверх ядра с герметизирующим покрытием, и/или ядра с маскированным вкусом. Низкодозовое лекарственное средство может быть нанесено в виде покрытия на ядро, содержащее высокодозовое лекарственное средство, любым подходящим способом, например путем нанесением покрытия в установке для нанесения покрытий или в кипящем слое, используя раствор низкодозового лекарственного средства (в фармацевтически приемлемом растворителе), возможно в комбинации с полимерным связующим веществом, как описано в данном описании изобретения. Например, раствор для нанесения покрытия низкодозового лекарственного средства может содержать подходящий растворитель (например воду, фармацевтически приемлемый органический растворитель, такой как ацетон или спирт, или водные органические растворители), в котором растворены низкодозовое лекарственное средство и возможно связующее вещество (например гидроксипропилцеллюлоза, поливинилпирролидон и так далее).
Полученные микрочастицы, содержащие высокодозовое лекарственное средство/низкодозовое лекарственное средство, затем могут быть покрыты, если необходимо, дополнительным герметизирующим слоем (как описано в данном описании изобретения) и/или вкусомаскирующим слоем (также как описано в данном описании изобретения). Таким образом, в некоторых воплощениях конечные микрочастицы, содержащие высокодозовое лекарственное средство/низкодозовое лекарственное средство, включают ядро, содержащее высокодозовое лекарственное средство (как описано в данном описании изобретения), покрытое возможным герметизирующим покрытием, вкусомаскирующим слоем (например содержащим нерастворимый в воде полимер или нерастворимый в воде полимер в комбинации с водорастворимым или желудочнорастворимым полимером), слоем низкодозового лекарственного средства, вторым возможным герметизирующим слоем и вторым вкусомаскирующим слоем (например содержащим нерастворимый в воде полимер или нерастворимый в воде полимер в комбинации с водорастворимым или желудочнорастворимым полимером).
Микрочастицы, содержащие высокодозовое лекарственное средство/низкодозовое лекарственное средство, возможно могут содержать один или более герметизирующих слоя, где герметизирующие слои могут иметь одинаковый состав или разные составы и могут быть нанесены с одинаковой массой покрытия или с разными массами покрытия. Аналогично, если микрочастицы, содержащие высокодозовое лекарственное средство/низкодозовое лекарственное средство, включают два вкусомаскирующих слоя, эти два вкусомаскирующих слоя могут иметь одинаковый состав или разные составы и/или одинаковую массу покрытия или разные массы покрытия. Например, внутренний вкусомаскирующий слой может содержать нерастворимый в воде полимер и наружный вкусомаскирующий слой может содержать комбинацию нерастворимого в воде полимера и водорастворимого полимера и/или желудочнорастворимый полимер и так далее.
В других воплощениях ароматизирующий покрывающий слой (который может включать подсластитель и/или ароматизатор, как описано в данном описании изобретения) может быть расположен поверх слоя, содержащего низкодозовое лекарственное средство (например вместо вкусомаскирующего слоя), так чтобы микрочастицы, содержащие высокодозовое лекарственное средство/низкодозовое лекарственное средство, включали в себя, например ядро, содержащее высокодозовое лекарственное средство (как описано в данном описании изобретения), покрытое возможным герметизирующим покрытием, вкусомаскирующим слоем (например содержащим нерастворимый в воде полимер или нерастворимый в воде полимер в комбинации с водорастворимым или желудочнорастворимым полимером), слоем низкодозового лекарственного средства, вторым возможным герметизирующим слоем и ароматизирующим покрывающим слоем.
Ароматизирующий покрывающий слой содержит комбинацию ароматизатора и связующего вещества. Подходящие связующие вещества включают описанные в данном описании изобретения. Ароматизатор включает водорастворимые подсластители, такие как сукралоза, сахарин, аспартам, неотам, ацесульфам К, сахаринат натрия, неогесперидин, лактит, мальтит, сорбит и их смеси, или, альтернативно, ароматизаторы, такие как клубнично-вишневый, перечная мята, клубничный и их смеси. В одном воплощении связующее вещество представляет собой гидроксипропилцеллюлозу и ароматизатор представляет собой сукралозу.
Масса ароматизирующего покрытия может варьироваться от примерно 1% до примерно 10% масс., включая диапазоны от примерно 3,0% до примерно 8%, от примерно 5% до примерно 7,5%, и от примерно 5% до примерно 10% от массы ядра с покрытием, или примерно 1%, примерно 2%, примерно 3% , примерно 4%, примерно 5%, примерно 6%, примерно 7%, примерно 8%, примерно 9% или примерно 10%, включая все диапазоны и поддиапазоны между этими значениями.
Как описано в данном описании изобретения, микрочастицы с маскированным вкусом, содержащие высокодозовое/низкодозовое лекарственное средство, могут включать разные слои в дополнение к вкусомаскирующему слою (например возможные герметизирующие слои и так далее). Таким образом, вкусомаскирующий слой может быть расположен непосредственно на ядре, содержащем высокодозовое лекарственное средство, или герметизирующий слой может быть помещен между ядром, содержащим высокодозовое лекарственное средство, и вкусомаскирующим слоем. В других воплощениях слой, содержащий низкодозовое лекарственное средство, покрыт вкусомаскирующим слоем, содержащим нерастворимый в воде полимер в комбинации с желудочнорастворимым полимером, таким как катионный сополимер диметиламиноэтил-метилакрилат.В другом воплощении вкусомаскирующий слой, расположенный поверх слоя низкодозового лекарственного средства, содержит нерастворимый в воде полимер и не содержит водорастворимый или желудочнорастворимый полимер. В альтернативном воплощении покрывающий ароматизирующий слой (например с массой покрытия от примерно 1% до примерно 10%), содержащий водорастворимый подсластитель, расположен непосредственно поверх слоя низкодозового лекарственного средства, или поверх герметизирующего слоя (например гидроксипропилцеллюлозы с массой покрытия от примерно 1% до примерно 10%), расположенного поверх слоя низкодозового лекарственного средства. Микрочастицы по настоящему изобретению, содержащие высокодозовое лекарственное средство/низкодозовое лекарственное средство, обеспечивают быстрое растворение высокодозового и низкодозового лекарственных средств в тесте на растворение с использованием Аппарата 1 USP (Фармакопея США) (корзины при 100 об/мин) или Аппарата 2 USP (лопасти при 50 об/мин) в 900 мл среды (рН 1,2, рН 5,8, рН 6,8 или рН 7 (вода)) при 37°С.
Как описано в данном описании изобретения, фармацевтические композиции, содержащие микрочастицы по настоящему изобретению, содержащие высокодозовое лекарственное средство/низкодозовое лекарственное средство, имеющие покрытие с модифицированным высвобождением, обеспечивают однородность смеси, а также однородность дозирования согласно требованиям USP, которые трудно достичь другими способами (например путем смешивания частиц, содержащих высокодозовое лекарственное средство со второй совокупностью частиц, содержащих низкодозовое лекарственное средство), особенно когда отношение высокодозового лекарственного средства к низкодозовому лекарственному средству составляет примерно 20/1 или выше (например примерно 20/1, примерно 25/1, примерно 30/1, примерно 35/1, примерно 40/1, примерно 45/1, примерно 50/1, примерно 60/1, примерно 70/1, примерно 80/1, примерно 90/1 примерно 100/1 и так далее).
Высокодозовое лекарственное средство и низкодозовое лекарственное средство может содержать любые лекарственные средства, которые предназначены для применения в комбинации для лечения состояния или заболевания у пациента. Например, фармацевтические композиции по настоящему изобретению могут включать комбинации высокодозового и низкодозового лекарственных средств, таких как неопиоидные анальгетики (например ацетаминофен и нестероидные противовоспалительные лекарственные средства, такие как аспирин, ибупрофен, кетопрофен, мелоксикам, диклофенак калия, этодолак, сулиндак, индометацин, целекоксиб и так далее) в комбинации с одним или более опиоидными анальгетиками (гидрокодона битартрат, оксиморфон, бупренорфин, фентанил, гидроморфон) для лечения боли от умеренной до сильной. Аналогично, противодиабетическая комбинация высокодозового и низкодозового лекарственных средств, подходящих для лечения сахарного диабета (путем снижения уровней глюкозы в крови), включает по меньшей мере один бигуанид (например метформин) в комбинации по меньшей мере с одной сульфонилмочевиной (такой как глипизид, гликлазид, глибурид, гликвидон, гликлопирамид, глимепирид), меглитинидом (таким как репаглинид, натеглинид) или тиазолидиндионом (таким как росиглитазон, пиоглитазон, троглитазон). Альтернативно, высокодозовое лекарственное средство (например никотиновая кислота) в комбинации с низкодозовым лекарственным средством (таким как ловастатин, флувастатин, аторвастатин, церивастатин, симвастатин, мевастатин, розувастатин, правастатин) полезно для снижения уровней холестерина (липопротеины очень низкой плотности) и триглицеридов у людей с сердечнососудистым заболеванием или с риском такого заболевания. Комбинации высокодозового лекарственного средства, такого как псевдоэфедрина гидрохлорид, псевдоэфедрина сульфат или фексофенадин, и низкодозового лекарственного средства, такого как цетиризин, лоратидин и фенилэфрин, полезны для лечения аллергии, возникающей в помещении, и аллергии, возникающей вне помещения. В конкретном воплощении низкодозовое лекарственное средство представляет собой терапевтически эффективное количество гидрокодона битартрата, и высокодозовое лекарственное средство представляет собой терапевтически эффективное количество ацетаминофена для лечения боли. В другом конкретном воплощении высокодозовое лекарственное средство представляет собой терапевтически эффективное количество метформина, и низкодозовое лекарственное средство представляет собой терапевтически эффективное количество росиглитазона для лечения гипергликемии.
В одном воплощении фармацевтические композиции по настоящему изобретению могут содержать ниацин (никотиновую кислоту) в качестве высокодозового лекарственного средства, изготовленную в виде частиц высокодозового лекарственного средства с маскированным вкусом с профилем немедленного высвобождения (IR), покрытых слоем статина и вкусомаскирующего покрытия. Альтернативно, ниацин может быть изготовлен в виде частиц высокодозового лекарственного средства с замедленным высвобождением (SR), имеющих покрытие с модифицированным высвобождением, для изготовления фармацевтических композиций с модифицированным высвобождением.
Фармацевтические композиции по настоящему изобретению содержат микрочастицы, содержащие высокодозовое/низкодозовое лекарственное средство. В альтернативном воплощении фармацевтические композиции по настоящему изобретению также могут содержать вторую совокупность микрочастиц, содержащих высокодозовое лекарственное средство. Микрочастицы, содержащие высокодозовое лекарственное средство, включают в себя, например, ядро, содержащее высокодозовое лекарственное средство (как описано в данном описании изобретения), покрытое нерастворимым в воде полимером, например с массой покрытия от примерно 15% до примерно 35%, посредством чего образуются частицы с замедленным высвобождением (SR), содержащие высокодозовое лекарственное средство. Комбинация микрочастиц, содержащих высокодозовое/низкодозовое лекарственное средство, и частиц, содержащих высокодозовое лекарственное средство SR, демонстрирует профили быстрого высвобождения низкодозового лекарственного средства и профили пролонгированного высвобождения высокодозового лекарственного средства (модифицированное высвобождение).
Фармацевтические композиции по настоящему изобретению можно использовать для изготовления пероральных лекарственных форм, таких как таблетки, капсулы и ODT. Таблетки можно изготовить путем объединения фармацевтических композиций по настоящему изобретению с подходящими фармацевтически приемлемыми эксципиентами, и последующего прессования полученной смеси с образованием таблеток. Альтернативно капсулы можно наполнять фармацевтическими композициями по настоящему изобретению (и возможными эксципиентами).
В конкретном воплощении фармацевтические композиции по настоящему изобретению могут быть объединены с быстродиспергируемыми микрогранулами с образованием перорально распадающихся таблеток (ODT). ODT представляет собой таблетку, разработанную так, чтобы по существу распадаться в полости рта после введения (без жевания) в течение примерно 60 секунд после контакта со слюной (то есть в полости рта) или с искусственной слюнной жидкостью (например при тестированную согласно тесту на распадаемость <701> USP). В конкретных воплощениях ODT по существу распадается в течение примерно 30 секунд. Распадение ODT в полости рта пациента обеспечивает гладкую, удобную для проглатывания суспензию, не имеющую песочного привкуса или послевкусия, и в то же время обеспечивает фармакокинетические профили для лекарственных средств, содержащихся в ODT (например профили зависимости концентрации в плазме от времени), которые являются биоэквивалентными соответствующим эталонным перечисленным лекарственным средствам (RLD).
ODT по настоящему изобретению содержат фармацевтические композиции по настоящему изобретению в комбинации с быстродиспергируемыми микрогранулами. Быстродиспергируемые микрогранулы могут быть изготовлены, как описано в US 2006/0078614, 2006/0105038, 2005/0232988 или 2003/0215500 (каждая из которых включена в данное описание изобретения посредством ссылки во всей своей полноте для всех целей), путем гранулирования разрыхлителя с сахарным спиртом и/или сахаридом, имеющим средний размер частиц не более чем примерно 30 мкм. Гранулирование можно выполнить, например, в грануляторе с высокой скоростью сдвига приблизительно с 20-25% воды в качестве гранулирующей жидкости и, если необходимо, измельчать во влажном состоянии и сушить для изготовления быстродиспергируемых микрогранул, например имеющих средний размер частиц не более чем примерно 300 мкм (например примерно 175-300 мкм).
Отношение разрыхлителя к сахарному спирту, сахариду или их смеси в быстродиспергируемых микрогранулах находится в диапазоне от примерно 90/10 до примерно 99/01, например примерно 90/10, примерно 91/9, примерно 92/8, примерно 93/7, примерно 94/6, примерно 95/5, примерно 96/4, примерно 97/3, примерно 98/2, примерно 99/1, включая все величины, диапазоны и поддиапазоны между этими значениями.
Отношение быстродиспергируемых микрогранул к частицам с маскированным вкусом, содержащим аналитическое лекарственное средство, находится в диапазоне от примерно 5/1 до примерно 1/1, включая примерно 5/1, 4/1, 3/1, 2/1, 1/1, включая все величины, диапазоны и поддиапазоны между этими значениями.
Микрочастицы с маскированным вкусом, содержащие неопиоидное анальгетическое/опиоидное анальгетическое лекарственное средство, включенные в лекарственную форму ODT, также должны иметь достаточно малый размер частиц, так, чтобы после распадения ODT в полости рта пациента получалась гладкая, удобная для проглатывания суспензия. В •большинстве воплощений, в которых фармацевтические композиции по настоящему изобретению предложены в виде лекарственной формы ODT, средний размер частиц микрочастиц с маскированным вкусом, содержащих неопиоидное анальгетическое/опиоидное анальгетическое лекарственное средство, равен не более чем примерно 400 мкм, или в некоторых воплощениях не более чем примерно 300 мкм.
Лекарственная форма ODT, как описано в данном описании изобретения, может также включать фармацевтически приемлемые эксципиенты, обычно используемые в композициях распадающихся таблеток, такие как микрокристаллическая целлюлоза и высушенный распылением маннит (сжимаемые разбавители), кроскармеллоза натрия или кросповидон (суперразрыхлитель), красители и возможно стеарат магния или стеарилфумарат натрия (смазывающее вещество, смешанное внутригранулярно, или применяемое наружно для смазывания поверхностей штампов и пуансонов).
Таблетированные лекарственные формы, включая лекарственные формы ODT, содержащие фармацевтическую композицию по настоящему изобретению, имеют низкую ломкость, например менее чем примерно 1%, (например менее чем примерно 0,9%, менее чем примерно 0,8%, менее чем примерно 0,7%, менее чем примерно 0,6%, менее чем примерно 0,5%, менее чем примерно 0,4%, менее чем примерно 0,3%, и так далее, включая все диапазоны и поддиапазоны между этими значениями) для того, чтобы обладать достаточной прочностью, чтобы выдерживать обработку, отгрузку и/или упаковку в блистерную упаковку с разрываемым слоем.
Неограничивающий перечень подходящих разрыхлителей для быстродиспергируемых микрогранул включает кросповидон (сшитый PVP (поливинилпирролидион)), натрия крахмала гликолят, сшитую натрий-карбоксиметилцеллюлозу, силикат кальция и низкозамещенную гидроксипропилцеллюлозу. Количество разрыхлителя в ODT обычно находится в диапазоне от примерно 1% до примерно 10% масс., включая примерно 1%, примерно 2%, примерно У/о, примерно 4%, примерно 5%, примерно 6%, примерно 7%, примерно 8%, примерно 9% или примерно 10%, включая все диапазоны и поддиапазоны между этими значениями. В конкретном воплощении разрыхлитель для быстродиспергируемых микрогранул выбирают из группы, состоящей из кросповидона, сшитой натрий-карбоксиметилцеллюлозы и низкозамещенной гидроксипропилцеллюлозы. В более конкретном воплощении разрыхлитель для быстродиспергируемых микрогранул представляет собой кросповидон.
Неограничивающий перечень подходящих сахарных спиртов включает маннит, сорбит, ксилит, мальтит, арабит, рибит, дульцит, идит, изомальт, лактит, эритрит и их комбинации. В конкретном воплощении сахарный спирт представляет собой маннит. Неограничивающий перечень подходящих сахаридов включает лактозу, сахарозу, мальтозу и их комбинации. В конкретном воплощении сахарид представляет собой лактозу. Количество сахарного спирта и/или сахарида в ODT находится в диапазоне от примерно 30% до примерно 70% масс., включая, например, примерно 30%, примерно 35%, примерно 40%, примерно 45%, примерно 50%, примерно 55%, примерно 60%, примерно 65%, или примерно 70%, включая все диапазоны и поддиапазоны между этими значениями.
Фармацевтически приемлемые эксципиенты включают наполнители, разбавители, скользящие вещества, разрыхлители, связующие вещества, смазывающие вещества и так далее. Другие фармацевтически приемлемые эксципиенты включают подкислители, подщелачивающие агенты, консерванты, антиоксиданты, буферные агенты, хелатирующие агенты, красители, комплексообразующие агенты, эмульгаторы и/или солюбилизирующие агенты, вкусовые агенты и ароматизаторы, увлажнители, подсластители, смачивающие агенты и так далее.
Примеры подходящих наполнителей, разбавителей и/или связующих веществ включают лактозу (например высушенную распылением лактозу, α-лактозу, β-лактозу, Tabletose®, различные марки Pharmatose®, Microtose® или Fast-Flo®), микрокристаллическую целлюлозу (различные марки Avicel®, Ceolus®, EIcema®, Vivacel®, Ming Tai или Solka-Floc®), гидроксипропилцеллюлозу, L-гидроксипропилцеллюлозу (низкозамещенную), низкомолекулярную гидроксипропилметилцеллюлозу (НРМС) (например Methocel E, F and К от Dow Chemical, Metolose SH от Shin-Etsu, Ltd), гидроксиэтилцеллюлозу, натрий-карбоксиметилцеллюлозу, карбоксиметилгидроксиэтилцеллюлозу и другие производные целлюлозы, сахарозу, агарозу, сорбит, маннит, декстрины, мальтодекстрины, крахмалы или модифицированные крахмалы (включая картофельный крахмал, кукурузный крахмал и рисовый крахмал), фосфат кальция (например основной фосфат кальция, гидрофосфат кальция, дигидрофосфат кальция), сульфат кальция, кальция карбонат, альгинат натрия, коллаген и так далее.
Примеры подходящих разбавителей включают, например, карбонат кальция, двухосновный фосфат кальция, трехосновный фосфат кальция, сульфат кальция, микрокристаллическую целлюлозу, порошковую целлюлозу, декстраны, декстрин, декстрозу, фруктозу, каолин, лактозу, маннит, сорбит, крахмал, клейстеризованный крахмал, сахарозу, сахар и так далее.
Примеры подходящих разрыхлителей включают, например, альгиновую кислоту или альгинаты, микрокристаллическую целлюлозу, гидроксипропилцеллюлозу и другие производные целлюлозы, кроскармеллозу натрия, кросповидон, полакриллин калия, натрия крахмала гликолят, крахмал, клейстеризованный крахмал, карбоксиметилкрахмал (например Primogel® и Explotab®) и так далее.
Конкретные примеры скользящих веществ и смазывающих веществ включают стеариновую кислоту, стеарат магния, стеарат кальция или стеараты других металлов, тальк, воски и глицериды, легкое минеральное масло, PEG (полиэтиленгликоль), глицерилбегенат, коллоидный диоксид кремния, гидрогенизированные растительные масла, кукурузный крахмал, стеарилфумарат натрия, полиэтиленгликоли, алкилсульфаты, бензоат натрия, ацетат натрия и так далее.
Другие эксципиенты включают, например, ароматизаторы, красители, вкусомаскирующие агенты, рН-регулирующие агенты, буферизующие агенты, консерванты, стабилизаторы, антиоксиданты, смачивающие агенты, регулирующие влажность агенты, поверхностно-активные агенты, суспендирующие агенты, усиливающие абсорбцию агенты, агенты для модифицированного высвобождения и так далее.
Настоящее изобретение также направлено на способы изготовления фармацевтических композиций и лекарственных форм, описанных в данном описании изобретения. В одном воплощении микрочастицы, содержащие высокодозовое/низкодозовое лекарственное средство, получают способом, включающим:
(а) изготовление ядра, содержащего высокодозовое лекарственное средство, как описано в данном описании изобретения (например неопиоидный анальгетик, такой как ацетаминофен, диклофенак калия и так далее);
(б) нанесение слоя низкодозового лекарственного средства (например содержащего низкодозовое лекарственное средство, как описано в данном описании изобретения, такое как гидрокодона битартрат) на ядро, содержащее высокодозовое лекарственное средство;
(в) нанесение на ядро, содержащее высокодозовое лекарственное средство со стадии (а) по меньшей мере одного вкусомаскирующего слоя и/или слоя покрытия с модифицированным высвобождением, и на частицы со стадии (б), содержащие высокодозовое/низкодозовое лекарственное средство, по меньшей мере одного вкусомаскирующего слоя или ароматизирующего слоя.
Стадию (а) изготовления ядра можно выполнять любым способом, известным в данной области техники; например путем наслаивания на инертную гранулу (например сахар, микрокристаллическую целлюлозу, маннит-микрокристаллическую целлюлозу, диоксид кремния и так далее) раствора, содержащего лекарственное средство и возможно полимерное связующее вещество (например путем нанесения покрытия в кипящем слое или в установке для нанесения покрытия). Альтернативно, ядро может содержать кристаллы лекарственного средства с желательным размером частиц (например примерно 50-500 мкм, включая 100-250 мкм), полученные посредством кристаллизации лекарственного средства из подходящего растворителя или путем измельчения кристаллов лекарственного средства до частиц желательного размера. В других воплощениях ядро может содержать пеллету, полученную посредством регулируемой сферонизации.
В конкретном воплощении микрогранулы, содержащие высокодозовое лекарственное средство (например неопиоидный анальгетик или противодиабетическое лекарственное средство) можно изготовить обычным способом гранулирования с большим усилием сдвига или планетарным гранулированием, либо пеллеты, содержащие высокодозовое лекарственное средство, можно изготовить обычным способом гранулирования-экструзии-сферонизации, включающими, например, ацетаминофен, полимерное связующее вещество и один или более наполнителей/разбавителей.
Стадия (б) включает покрытие ядра с маскированным вкусом, содержащего высокодозовое лекарственное средство, низкодозовым лекарственным средством, используя раствор для наслаивания лекарственного средства, как описано в данном описании изобретения (например содержащий раствор низкодозового лекарственного средства и возможно связующее вещество). Слой низкодозового лекарственного средства можно наносить, используя любой подходящий метод, например в кипящем слое, в установке для нанесения покрытия, коацервацией и так далее.
Стадия (в) включает покрытие ядра, содержащего высокодозовое лекарственное средство, и/или слоя, содержащего низкодозовое лекарственное средство, вкусомаскирующим слоем. В некоторых воплощениях вкусомаскирующий слой наносят непосредственно на ядро, содержащее высокодозовое лекарственное средство, или герметизирующий слой наносят на ядро, содержащее высокодозовое лекарственное средство, перед покрытием слоем, содержащим низкодозовое лекарственное средство, и/или вкусомаскирующим слоем. Аналогично герметизирующий слой можно наносить на слой, содержащий низкодозовое лекарственное средство, перед покрытием вкусомаскирующим слоем или ароматизирующим слоем, как описано в данном описании изобретения (например содержащим подсластитель и/или ароматизатор и возможное полимерное связующее вещество, такое как гидроксипропилцеллюлоза, нанесенным в виде раствора или суспензии). Вкусомаскирующий слой содержит нерастворимый в воде полимер или нерастворимый в воде полимер в комбинации с водорастворимым или желудочнорастворимым полимером (и возможно связующим веществом), например любую из композиций, описанную в данном описании изобретения, такую как этилцеллюлоза (Ethocel Standard 100 Premium, с массой покрытия примерно 10%), или комбинацию этилцеллюлозы с желудочнорастворимым полимером (например Eudragit Е100) с массой покрытия примерно 25%.
После нанесения слоя низкодозового лекарственного средства, полученные частицы возможно могут быть покрыты герметизирующим слоем (как описано в данном описании изобретения) и затем покрыты вкусомаскирующим слоем или ароматизирующим слоем (как описано в данном описании изобретения). Например, вкусомаскирующий слой, нанесенный на слой низкодозового лекарственного средства (или на герметизирующий слой, нанесенный на слой низкодозового лекарственного средства), может содержать нерастворимый в воде полимер (например этилцеллюлозу) или комбинацию нерастворимого в воде полимера и водорастворимого или желудочнорастворимого полимера (например этилцеллюлозу в комбинации с Eudragit E100). Альтернативно, вместо вкусомаскирующего слоя ароматизирующее покрытие может быть нанесено на слой низкодозового лекарственного средства или на защитный герметизирующий слой, нанесенный на слой низкодозового лекарственного средства.
В конкретных воплощениях способ включает нанесение посредством коацервации в растворителе вкусомаскирующего слоя непосредственно на ядро, содержащее высокодозовое лекарственное средство, или на герметизирующий слой, расположенный на ядре, содержащем высокодозовое лекарственное средство, где вкусомаскирующий слой содержит нерастворимую в воде этилцеллюлозу (Ethocel Standard 100 Premium) с массой покрытия примерно 6%. В других воплощениях способ включает нанесение покрытия нерастворимой в воде этилцеллюлозы (Ethocel Standard 10 Premium) в комбинации с водорастворимой гидроксипропилцеллюлозой в соотношении 7:3 или желудочнорастворимой Eudragit E100 в соотношении 8:7 с массой покрытия примерно 20% путем нанесения покрытия в кипящем слое.
В другом конкретном воплощении способ включает нанесение посредством коацервации в растворителе вкусомаскирующего слоя непосредственно на слой, содержащий низкодозовое лекарственное средство, или на герметизирующий слой, расположенный на слое, содержащем низкодозовое лекарственное средство, например с помощью нерастворимой в воде этилцеллюлозы (Ethocel Standard 100 Premium) с массой покрытия примерно 6%. В других воплощениях способ включает нанесение покрытия нерастворимой в воде этилцеллюлозы (Ethocel Standard 10 Premium) в комбинации с водорастворимой гидроксипропилцеллюлозой в соотношении 7:3 или желудочнорастворимой Eudragit Е100 в соотношении 8:7 в количестве примерно 20% масс.в расчете на общую массу частиц, покрытых оболочкой в кипящем слое. Вкусомаскирующие покрытия могут быть получены и применены, как описано, например, в патентных публикациях US 2006/0078614 и 2006/0105038.
В еще одном конкретном воплощении способ включает нанесение на слой, содержащий низкодозовое лекарственное средство, герметизирующего слоя, содержащего гидрофильную гидроксипропилцеллюлозу с массой покрытия примерно 5%, последующее покрытие вкусомаскирующим слоем, содержащим подсластитель, такой как сукралоза, с массой покрытия примерно 5% масс.
Конечную лекарственную форму, включающую микрочастицы с маскированным вкусом, содержащие высокодозовое/низкодозовое лекарственное средство, по настоящему изобретению, можно затем изготовить различными способами, известными в фармацевтике, такими как заполнение соответствующим количеством микрочастиц с маскированным вкусом, содержащих высокодозовое/низкодозовое лекарственное средство, например желатиновой капсулы или контейнера, подходящего для хранения суспензии, саше и так далее. В других воплощениях микрочастицы с маскированным вкусом, содержащие высокодозовое/низкодозовое лекарственное средство, по настоящему изобретению, комбинируют с подходящими фармацевтически приемлемыми эксципиентами и прессуют с образованием таблетки. Таблетки, содержащие фармацевтические композиции по настоящему изобретению, могут содержать внутреннее смазывающее вещество (например стеарат магния), или могут быть спрессованы в таблетки с использованием процесса наружного смазывания, в котором смазывающее вещество распыляют на поверхности штампов и пуансонов, а не включают в смесь для прессования. Наружное смазывание и способы прессования, которые можно использовать для изготовления пероральных лекарственных форм (например таблеток, ODT), содержащих фармацевтические композиции по настоящему изобретению, описаны, например, в US 5996902 и US 6776361.
Когда конечная лекарственная форма представляет собой ODT, способ также включает изготовление быстродиспергируемых микрогранул, содержащих разрыхлитель и сахарный спирт, сахарид или их смесь, где каждый из разрыхлителя, сахарного спирта и/или сахарида имеет средний диаметр частиц не более 30 мкм; последующее объединение быстродиспергируемых микрогранул с микрогранулами, содержащими высокодозовое/низкодозовое лекарственное средство с маскированным вкусом, и возможно другими фармацевтически приемлемыми эксципиентами, например в миксере или V-образном смесителе; и наконец прессование смеси быстродиспергируемых микрогранул и микрогранул, содержащих высокодозовое/низкодозовое лекарственное средство с маскированным вкусом в ODT, например с использованием таблеточного пресса с наружным смазыванием для получения ODT с желательными характеристиками таблеток (например достаточной твердостью, ломкостью <0,6%, низким временем - распадения и быстрым растворением). Быстродиспергируемые микрогранулы можно изготовить согласно способам, раскрытым в патентных публикациях US 2006/0078614, 2006/0105038, 2006/0105039 и 2005/0232988.
В конкретных воплощениях быстродиспергируемые микрогранулы и микрочастицы, содержащие лекарственное средство с маскированным вкусом, могут присутствовать в соотношении от примерно 4/1 до 2/1 для достижения гладкого ощущения во рту. Быстродиспергируемые микрогранулы могут быть изготовлены, как описано в данном описании изобретения, путем гранулирования разрыхлителя, такого как Кросповидон XL-10, с сахарным спиртом или сахаридом или их комбинацией, каждый из которых имеет средний диаметр частиц не более чем примерно 30 мкм, с водой или водно-спиртовой смесью в обычном грануляторе или грануляторе с высоким усилием сдвига и сушки в оборудовании с кипящим слоем или в полочной сушилке с получением гранул со средним размером частиц не более чем примерно 400 мкм (предпочтительно не более чем примерно 300 мкм).
Конечные лекарственные формы могут содержать одну совокупность микрочастиц с маскированным вкусом, содержащих высокодозовое/низкодозовое лекарственное средство, по настоящему изобретению, в комбинации с эксципиентами, быстродиспергируемыми микрогранулами и так далее, или могут включать комбинацию микрочастиц с маскированным вкусом, содержащих высокодозовое/низкодозовое лекарственное средство, в комбинации с частицами, содержащими высокодозовое лекарственное средство, или, альтернативно, содержать две или более совокупности разных микрочастиц с маскированным вкусом, содержащих высокодозовое/низкодозовое лекарственное средство. Соотношение разных совокупностей микрочастиц, содержащих высокодозовое/низкодозовое лекарственное средство, или микрочастиц, содержащих высокодозовое/низкодозовое лекарственное средство, и частиц, содержащих высокодозовое лекарственное средство, можно варьировать, чтобы обеспечить подходящие дозировки высокодозового и низкодозового лекарственных средств.
Альтернативно, конечные лекарственные формы могут содержать одну совокупность микрочастиц с маскированным вкусом, содержащих высокодозовое/низкодозовое лекарственное средство, по настоящему-изобретению, в комбинации с эксципиентами, быстродиспергируемыми микрогранулами и так далее, или могут включать комбинацию микрочастиц с маскированным вкусом, содержащих высокодозовое/низкодозовое лекарственное средство, в комбинации с микрочастицами, содержащими высокодозовое лекарственное средство, имеющими покрытие с модифицированным высвобождением (например с маскированным вкусом или замедленным высвобождением), или, альтернативно, могут содержать две или более совокупности разных микрочастиц с маскированным вкусом, содержащих высокодозовое/низкодозовое лекарственное средство, где микрочастицы, содержащие высокодозовое лекарственное средство, имеющие покрытие с замедленным высвобождением, содержат нерастворимый в воде полимер, возможно в комбинации с водорастворимым или кишечнорастворимым полимером, нанесенный перед наслаиванием низкодозового лекарственного средства. Соотношение разных совокупностей микрочастиц, содержащих высокодозовое/низкодозовое лекарственное средство, или микрочастиц, содержащих высокодозовое/низкодозовое лекарственное средство и микрочастиц, содержащих высокодозовое лекарственное средство с маскированным вкусом или имеющих покрытие с замедленным высвобождением, может варьироваться для обеспечения подходящих дозировок высокодозовых и низкодозовых лекарственных компонентов.
Пероральные лекарственные формы по настоящему изобретению, изготовленные способами, описанными в данном описании изобретения, обеспечивают in vivo концентрации в плазме и профили высвобождения, которые имитируют RLD. Согласно конкретным воплощениям, фармацевтические композиции по настоящему изобретению содержат микрогранулы или экструдированные/сферонизированные пеллеты, содержащие ацетаминофен, полимерное связующее вещество, которое придает упругие свойства высушенным микрогранулам/пеллетам, гидрофильный наполнитель/разбавитель и возможно ароматизатор, подсластитель и/или разрыхлитель.
В конкретных воплощениях настоящее изобретение направлено на, композиции по настоящему изобретению, содержащие по меньшей мере одну совокупность микрочастиц, содержащих неопиоидное анальгетическое/опиоидное анальгетическое лекарственное средство, в комбинации с микрочастицами, содержащими неопиоидное анальгетическое лекарственное средство с характеристиками высвобождения лекарственного средства, подходящими для схемы приема два раза или один раз в сутки, где одна или более совокупностей микрочастиц, содержащих неопиоидное анальгетическое лекарственное средство, содержат микрочастицы, содержащие неопиоидное анальгетическое лекарственное средство, с одним или более покрывающими слоями, содержащими нерастворимый в воде полимер, кишечнорастворимый полимер, или кишечнорастворимый полимер в комбинации с полимером, нерастворимым в воде.
В большинстве воплощений фармацевтические композиции по настоящему изобретению с маскированным вкусом демонстрируют следующие свойства:
1) приемлемое маскирование вкуса, не оставляющее послевкусия, когда композицию помещают в полость рта на 3 минуты, более конкретно на 2 минуты и в некоторых воплощениях на 60 секунд, и в других воплощениях до тех пор, пока ее не проглотят;
2) приемлемая однородность смеси согласно требованиям Фармакопеи США; и
3) быстрое, по существу полное высвобождение дозы при поступлении в желудок, то есть высвобождение не менее чем 75% суммарной дозы в течение 30 мин при тестировании растворения с использованием Аппарата 1 Фармакопеи США (корзины при 100 об/мин) или Аппарата 2 (лопасти при 50 об/мин в 900 мл среды для растворения при 37±0,5°С).
ODT, изготовленные согласно конкретным воплощениям настоящего изобретения, могут демонстрировать следующие свойства:
1) проявляют приемлемую однородность лекарственных форм, как определено в Фармакопее США;
2) распадаются при контакте со слюной в полости рта, образуя гладкую, удобную для проглатывания суспензию, содержащую микрочастицы с маскированным вкусом;
3) не оставляют послевкусия после проглатывания (отсутствие песочного или мелового привкуса);
4) обеспечивают быстрое, по существу полное высвобождение всей дозы при поступлении в желудок; или
5) ODT, при тестировании растворения с использованием Аппарата 1 Фармакопеи США (корзины при 100 об/мин) или Аппарата 2 (лопасти при 50 об/мин) в 900 мл буфера, высвобождают не менее 75% всей дозы в течение примерно 30 минут.
В другом конкретном воплощении фармацевтическая композиция по настоящему изобретению содержит ацетаминофен в качестве высокодозового лекарственного средства и гидрокодона битартрат в качестве низкодозового лекарственного средства. После перорального введения ацетаминофен быстро и почти полностью абсорбируется из ЖК (желудочно-кишечного) тракта. Пиковые концентрации в плазме достигаются в пределах 30-60 минут (связывание с сывороточным белком составляет примерно 25% после нормальных терапевтических дозировок) и период полувыведения из плазмы составляет от 1 до 2,5 часов у нормальных здоровых пациентов. Примерно через 8 часов можно обнаружить только следы лекарственного средства.
Фармацевтические композиции по настоящему изобретению, содержащие терапевтически эффективные количества микрочастиц с маскированным вкусом, содержащих высокодозовое/низкодозовое лекарственное средство, являются эффективными в лечении различных заболеваний или состояний. Например, фармацевтические композиции по настоящему изобретению, содержащие терапевтически эффективные количества нестероидного противовоспалительного лекарственного средства, такого как аспирин, ибупрофен, кетопрофен, мелоксикам, диклофенак калия, этодолак, сулиндак, индометацин, целекоксиб или их смеси, в комбинации с опиоидным анальгетиком, таким как гидрокодона битартрат, оксиморфон, бупренорфин, фентанил, гидроморфон или их смеси (например комбинация ацетаминофена и гидрокодона), являются эффективными для облегчения острой, хронической или послеоперационной боли в степени от слабой до умеренной, или инвалидизирующей боли терминальных состояний, таких как рак.
В конкретном воплощении фармацевтические композиции по настоящему изобретению содержат терапевтически эффективные количества ацетаминофена в комбинации с терапевтически эффективным количеством гидрокодона или его солей, например гидрокодона битартрата. В конкретном воплощении фармацевтические композиции по настоящему изобретению содержат 500 мг ацетаминофена и 5 мг гидрокодона битартрата, или 300 мг ацетаминофена и 100 мг гидрокодона битартрата. Композиции по настоящему изобретению, содержащие ацетаминофен/гидрокодон, являются биоэквивалентными известным композициям ацетаминофена/гидрокодона, таким как Vicodin®, Panadol® и Xodol®. Композиции по настоящему изобретению, содержащие 500 мг ацетаминофена/5 мг гидрокодона битартрата, имеют Смаке ацетаминофена 80-125% от 6115 нг/мл, Смаке гидрокодона битартрата 80-125% от 20,14 нг/мл, AUC (площадь под кривой) ацетаминофена 80-125% от 19920 нгч/мл и AUC гидрокодона битартрата 80-125% от 141 нг/мл. Композиции по настоящему изобретению, содержащие 300 мг ацетаминофена/10 мг гидрокодона битартрата, имеют Смаке ацетаминофена 80-125% от 3915 нг/мл, Смаке гидрокодона битартрата 80-125% от 40,53 нг/мл, AUC ацетаминофена 80-125% от 12794 нгч/мл и AUC гидрокодона битартрата 80-125% от 280 нгч/мл.
Аналогично фармацевтические композиции по настоящему изобретению, содержащие терапевтически эффективные количества ниацина в комбинации со статином, таким как аторвастатин, ловастатин, флувастатин, церивастатин, симвастатин, мевастатин, розувастатин, правастатин или их смеси, являются эффективными для снижения уровней холестерина (липопротеины очень низкой плотности) и триглицеридов у пациентов с заболеванием или с риском сердечнососудистого заболевания.
Аналогично, фармацевтические композиции по настоящему изобретению, содержащие терапевтически эффективные количества метформина в комбинации с лекарственным средством, таким как глипизид, глибурид, глимепирид, репаглинид, натеглинид, росиглитазон, пиоглитазон, троглитазон (например комбинация метформина и росиглитазона), являются эффективными в лечении гипергликемии, например у пациентов с диабетом.
Наконец, фармацевтические композиции по настоящему изобретению, содержащие терапевтически эффективные количества псевдоэфедрина гидрохлорида, псевдоэфедрина сульфата или фексофенадина, в комбинаций с лекарственным средством, таким как цетиризин или лоратидин, являются эффективными в лечении аллергий, возникающих в помещении, или аллергий, возникающих вне помещения.
ПРИМЕР 1
1.А Гранулы IR (загрузка лекарственного средства: приблизительно 5%, гидрокодона битартрата):
Гидрокодона битартрат (81,1 г) медленно добавляли к раствору гидроксипропилцеллюлозы (8,1 г Nisso HPC-L-FP) в смеси ацетон/вода(1453/782) и хорошо перемешивали для растворения. Сахарные сферы 60-80 меш (1500 г) покрывали композицией для наслаивания лекарственного средства в устройстве для нанесения покрытий в кипящем слое Glatt (Glatt GPCG 3, оборудованном 7-дюймовой вставкой Вурстера в нижнее сопло, колонкой 7 13/16", высота колонки 25 мм, пластиной для распределения воздуха С, и ситом для удержания продукта 200 меш) в следующих условиях -температура воздуха на входе: 70±5°С; температура продукта: 45±5°С;
давление распыляющего воздуха 2,43 бар (2,43×105 Па); размер отверстия: 1,0 мм; скорость потока: 2 г/мин увеличивалась на стадиях до 15 г/мин, поток воздуха: 25% клапан. После наслаивания лекарственного средства гидроксипропилцеллюлозный раствор герметизирующего покрытия (32,4 г в смеси 457/51 ацетон/вода) распыляли на гранулы, покрытые слоем лекарственного средства, для массы покрытия 2%. Сухие гранулы с немедленным высвобождением (IR) просеивали через сита 50 и 80 меш с практическим общим выходом 88,4%.
1.В Гранулы с маскированным вкусом (загрузка лекарственного средства: приблизительно 3.5% гидрокодона битартрата):
Гранулы IR (140 г) из Примера 1.А выше покрывали этилцеллюлозой (Ethocel Standard Premium 100 от Dow Chemicals) посредством коацервации в растворителе с массой покрытия 30%. Этилцеллюлозу (60 г) и полиэтилен (40 г Epolene C-10 от Eastman Chemicals) растворяли/суспендировали в 2000 г циклогексана при скорости перемешивания 300 об/мин. Резервуар нагревали до 80°С для растворения этилцеллюлозы, и после этого резервуар охлаждали до температуры ниже 30°С для получения микрокапсул гидрокодона битартрата с маскированным вкусом. Микрокапсулы отделяли декантированием, затем фильтровали и промывали свежим циклогексаном и сушили на воздухе в пароуловителе.
1.С Микрочастицы с вкусом, маскированным покрытием в кипящем слое:
Гранулы IR (1001,3 г), полученные, как описано в Примере 1.А выше, покрывали раствором этилцеллюлозы (Ethocel Standard Premium 10 сП, в дальнейшем упоминаемой как ЕС-10)/Eudragit Е100 (188,6 г каждого), пластифицированной диацетилированными моноглицеридами (Myvacet 9-45; 30,0 г), и кошерным стеаратом магния (30,0 г), растворенном в смеси 80/20 ацетон (3086 г)/вода (771 г) с массой покрытия 30%. Образцы отбирали в процессе нанесения покрытия с массой покрытия примерно 10%, 15%, 20% и 25% и тестировали растворение, чтобы оценить влияние величины покрытия на растворение и органолептические свойства. Покрытые гранулы сушили/отверждали при 60°С в течение 10 минут в Glatt GPCG 3 и просеивали, чтобы избавиться от агломератов.
1.D Стандартные микрокапсулы ацетаминофена (РЕ004*):
На микрокапсулы ацетаминофена, полученные в промышленном масштабе с использованием гранулированного ацетаминофена (размер частиц: 45-80 меш или 177-350 мкм) от Covidien, наносили покрытие, используя способ, подобный описанному выше в Примере 1.В, и используя 200-галлонную, 500-галлонную или 1000-галлонную систему, и применяя компьютеризированный рецепт для процесса (например количества для 200- галлонной системы с 10% покрытием - ацетаминофен: 94,1 кг; Ethocel 100:10,5 кг, Epolene: 2,1 кг и циклогексан: 146,0 галлонов или 547,5 л). При контролируемом охлаждении до <30°С, слой микрокапсул подвергают вакуум-фильтрации и промыванию циклогексаном для смывания остаточного полиэтилена. Микрокапсулы переносили в сушилку с кипящим слоем, подвергали процедуре сушки и сушили в течение 4-6 ч для снижения уровня циклогексана до уровня не более 1000 млн'1.
1.Е Быстродиспергируемые микрогранулы:
Быстродиспергируемые микрогранулы содержат сахарный спирт, такой как маннит, и/или сахарид, такой как лактоза, и разрыхлитель, такой как кросповидон. Сахарный спирт и/или сахарид и разрыхлитель обычно присутствуют в быстродиспергируемых микрогранулах в соотношении от примерно 99:1 до примерно 90:10 (сахарный спирт и/или сахарид:разрыхлитель). Например, быстродиспергируемые микрогранулы,' используемые в композициях ODT, раскрытых в различных примерах, согласно настоящему изобретению изготавливали посредством гранулирования 95 частей D-маннита со средним размером частиц примерно 15 мкм и 5 частей кросповидона (Кросповидон XL-10) в смесителе с высокой скоростью сдвига (например GMX 600 от Vector Corporation) с водой в качестве гранулирующей жидкости, сушки влажной массы в сушилке с кипящим слоем (например Glatt GPCG 200 или Fluid Air FA0300), и просеивания/измельчения с получением гранул со средним размером частиц менее 400 мкм. Альтернативно, влажные измельченные гранулы сушат в полочной сушилке до величины потери при сушке менее 1% масс.
1.F ODT гидрокодона битартрат/ацетаминофен. 5 мг/500 мг:
Гранулы (172,4 г) получали, как описано в Примере 1.В (масса покрытия 30%) выше; стандартные капсулы ацетаминофена (РЕ004, 531,9 г), изготовленные в Примере 1.D выше, и быстродиспергируемые микрогранулы (803,4 г) из Примера 1.Е выше смешивали с предварительно подготовленной смесью, содержащей кросповидон (XL-10. 80,0 г), сукралозу (5,6 г) и клубничный ароматизатор (6,7 г), затем спрессовывали в перорально распадающиеся таблетки (19 мм диаметром) 5 мг/500 мг гидрокодона битартрат/ацетаминофена, с массой приблизительно 1600 мг, используя таблеточный пресс Carver с силой сжатия 1 метрическая тонна (1000 кг).
ПРИМЕР 2
2.А Микрочастицы гидрокодона битартрата/ацетаминофена (загрузка лекарственного средства: 3%):
Гидрокодона битартрат (47,5 г) медленно добавляли к раствору гидроксипропилцеллюлозы (5,3 г от Nisso HPC-L-FP) в смеси 50/50 ацетон/вода (по 452 г каждого) и хорошо перемешивали для растворения. Капсулы ацетаминофена (РЕ004) из Примера 1.D с 6% покрытием ЕС-100 (1500 г) покрывали композицией для наслаивания лекарственного средства в устройстве для нанесения покрытий Glatt GPCG 3 с кипящим слоем. После наслаивания лекарственного средства на гранулы, покрытые слоем лекарственного средства, распыляли раствор герметизирующего покрытия из гидроксипропилцеллюлозы (31,7 г в смеси 447/50 ацетон/вода) с массой покрытия 2%. Высушенные гранулы IR просеивали через сита 35 и 80 меш с практическим общим выходом 99,0%.
2.В Микрочастицы гидрокодона битартрата/ацетаминофена с маскированным вкусом:
Частицы IR (1100 г), полученные, как описано в Примере 2.А выше, покрывали раствором этилцеллюлозы (ЕС-10; 43%)/Eudragit E100 (43%), пластифицированной диацетилированными моноглицеридами (Myvacet 9-45 при 7%), и кошерным стеаратом магния (7%), растворенным в смеси 80/20 ацетон (3294 г)/вода (848 г) с увеличением массы 30%. Образцы отбирали в процессе нанесения покрытия с массами покрытия примерно 5%, 10%, 15%, 20% и 25%, и тестировали растворение, чтобы оценить влияние величины покрытия на растворение, а также на органолептические свойства. Покрытые гранулы сушили при тех же установках температуры в Glatt GPCG 3 и просеивали, чтобы избавиться от агломератов, с общим практическим выходом 98,9%.
2.С OPT гидрокодона битартрата/ацетаминофена. 10 мг/300 мг:
Покрытые оболочкой 20% ЕС-10/Е100 (10,01% гранул гидрокодона битартрата/ацетаминофена при загрузке гидрокодона битартрата 15%) из Примера 2. В выше; стандартные капсулы ацетаминофена (РЕ004, 35,46%) из Примера 1.D выше и быстродиспергируемые микрогранулы (48,76%) из Примера 1-Е выше смешивали с предварительно подготовленной смесью, содержащей кросповидон (XL-10 при 5,0%), сукралозу (0,35%) и клубничный ароматизатор (0,42%), затем спрессовывали в перорально распадающиеся таблетки 10 мг/300 мг гидрокодона битартрата/ацетаминофена (диаметром 15 мм), с массой приблизительно 900 мг, используя таблеточный пресс Carver с силой сжатия 1 метрическая тонна (1000 кг).
2.D ОРТ гидрокодона битартрат/ацетаминофен. 5 мг/500 мг:
Гранулы с 30% покрытием (10,78%) из Примера 2.В выше, стандартные капсулы ацетаминофена (РЕ004, 33,24%) из Примера 1.D выше и быстродиспергируемые микрогранулы (37,71%) из Примера 1.Е выше смешивали с предварительно подготовленной смесью, содержащей микрокристаллическую целлюлозу (12,5% Avicel PH101), кросповидон (5,0% XL-10), сукралозу (0,35%) и клубничный ароматизатор (0,42%), затем спрессовывали в перорально распадающиеся таблетки (диаметром 17 мм) 5 мг/500 мг гидрокодона битартрат/ацетаминофена, с массой приблизительно 1600 мг, используя роторный таблеточный пресс Hata, оборудованный системой наружного смазывания (Matsui Ex-Lub Систему) для смазывания поверхностей штампов/пуансонов путем распыления стеарата магния перед каждым прессованием.
ПРИМЕР 3
3.А Микрочастицы ацетаминофена с маскированным вкусом:
Ацетаминофен (гранулированная марка от Covidien (А100); 2000 г) покрывали в GIatt GPCG 3 (7-дюймовая вставка Вурстера в нижнее сопло и сопло с отверстием размером 1,00 мм) раствором этилцеллюлозы (10 сП; 114,3 г)/Eudragit E100 (100,0 г), пластифицированной полиэтиленгликолем (PEG 400; 42,9 г), и кошерным стеаратом магния (28,6 г), гомогенно суспендированным в смеси ацетон (1359,5 г)/изопропиловый спирт (672,7 г)/вода (770,8 г) с увеличением массы 12,5%. Высушенные частицы просеивали с помощью сит 35 и 80 меш, чтобы избавиться от агломератов/мелкозернистых фракций (практический выход: 93,6%).
3.В Низкоактивный гидрокодона битартрат/ацетаминофен:
Гидрокодона битартрат наносили слоем на ацетаминофен (Гранулированный А100) путем распыления композиции для наслаивания лекарственного средства (композиции смотри в Таблице 1 - столбец "Низкоактивный") в устройстве для нанесения покрытий GIatt GPCG 3 в кипящем слое. После наслаивания лекарственного средство, раствор герметизирующего покрытия распыляли на покрытые слоем лекарственного средства частицы с массой покрытия 2%, затем наносили вкусомаскирующее покрытие с помощью смеси ЕС 10/E100/PEG 400/стеарат магния в соотношении 40/35/15/10 с массой покрытия 22%, используя способ, раскрытый в Примере 3.А выше.
3.С Высокоактивный гидрокодона битартрат/ацетаминофен:
Гидрокодона битартрат наносили слоем на ацетаминофен (Гранулированный А100) путем распыления композиции для наслаивания лекарственного средства (композиции смотри в Таблице 1 - столбец "Низкоактивный") в устройстве для нанесения покрытий Glatt GPCG 3 в кипящем слое. После наслаивания лекарственного средства, раствор герметизирующего покрытия распыляли на покрытые слоем лекарственного средства частицы с массой покрытия 2%, затем наносили вкусомаскирующее покрытие с помощью смеси ЕС 10/E100/PEG 400/стеарат магния в соотношении 40/35/15/10 с массой покрытия 27%.
Таблица 1: Низкоактивный (РЕ382)/высокоактивный (РЕ384) гидрокодона" битартрат/ацетаминофен (А100) с маскированным вкусом
| Ингредиенты | Процент | Необходимое количество (г) | ||||
| Гидрокодон /ацетаминофен -РЕ3829 (НА)/РЕ384 (ВА) или ацетаминофен РЕ380, с маскированным вкусом | Низкоактивный (НА) | Высокоактивный (ВА) | РЕ380 | Низко-активный | Высокоактивны и | |
| НА/ВА НСВ на ацетаминофене (А100) | ||||||
| Ацетаминофен гранулированный (А100) | 96,06 | 90,22 | 2500,0 | 2000,0 | ||
| Гидрокодона битартрат, NF | 1,75 | 7,00 | 45,5 | 155,2 | ||
| Гидроксипропил-целлюлоза, NF (Klucel LF) | 0,196 | 0,78 | 5,1 | 17,2 | ||
| Ацетон NF | 432,7 | 1474.1 | ||||
| Очищенная вода, USP | 432,7 | 1474,1 | ||||
| Гидроксипропилцеллюло за (Klucel ® LF) | 1,70 | 1,70 | 44,2 | 37.7 | ||
| Стеарат магния NF | 0,30 | 0,30 | 7,8 | 6,7 | ||
| Ацетон NF | 611,6 | 520,9 | ||||
| Очищенная вода, USP | 203,9 | 173,6 | ||||
| Итого | 100,0 | 100,0 | 2602,6 | 2216,8 | ||
| Вкусомаскирующее покрытие - (5% твердых веществ) | ||||||
| ацетаминофен, покрытый слоем НА/ВА гидрокодона | 78,00 | 73,00 | 2000,0 | 1500,0 | ||
| Ацетаминофен гранулированный (А100) | 2000,0 | |||||
| Этилцеллюлоза NF (Ethocel®Standart10 Premium) | 8,80 | 10,80 | 114,3 | 225,6 | 221,9 | |
| Аминоалкилметакрилатн ый сополимер Е (Eudragit®E100) | 7,70 | 9,48 | 100,0 | 197,4 | 194,2 | |
| Полиэтиленгликоль NF (Carbowax® 400) | 3,30 | 4,05 | 42,9 | 84,6 | 83,2 | |
| Стеарат магния NF | 2,20 | 2,70 | 28,6 | 56,4 | 55,5 | |
| Ацетон NF | следы | следы | 1359,5 | 2684,1 | 2639,8 | |
| Изопропиловый спирт, USP* | следы | следы | 672,7 | 1328,2 | 1306,3 | |
| Очищенная вода, USP | следы | следы | 770,8 | 1521,9 | 1496,8 | |
| Итого | 100,0 | 100,0 | 2285,8 | 2564,0 | 2054,8 | |
3.D OPT гидрокодона битартрата/ацетаминофена. 5 мг/500 мг:
Ацетаминофен с 12,5% покрытием из Примера 3.А выше, гидрокодон/ацетаминофен с 22% покрытием из Примера 3.В выше, быстродиспергируемые микрогранулы из Примера 1.Е выше смешивали с предварительно подготовленной смесью, содержащей микрокристаллическую целлюлозу (Avicel PH101), (Parteck M200), кросповидон, сукралозу и клубничный ароматизатор, затем спрессовывали в перорально распадающиеся таблетки гидрокодона битартрата/ацетаминофена 5 мг/500 мг (диаметром 17 мм), с массой приблизительно 1600 мг, используя роторный таблеточный пресс Hata, оборудованный системой наружного смазывания (Matsui Ex-Lub System) для смазывания поверхностей штампов/пуансона перед каждым прессованием с силой сжатия от 18 до 24 кН.
3.Е ОРТ гидрокодона битартрат/ацетаминофен. 10 мг/300 мг:
Ацетаминофен с 12,5% покрытием из Примера 3.А выше;
гидрокодон/ацетаминофен с 27% покрытием из Примера 3.С выше и быстродиспергируемые микрогранулы из Примера 1.Е выше, смешивали с предварительно подготовленной смесью, содержащей микрокристаллическую целлюлозу (Avicel PH101), маннит (Parteck M200), кросповидон, сукралозу и клубничный ароматизатор, затем спрессовывали в перорально распадающиеся таблетки (диаметром 17 мм) гидрокодона битартрата/ацетаминофена 5 мг/500 мг, с массой приблизительно 1000 мг, используя роторный таблеточный пресс Hata, оборудованный системой наружного смазывания (Matsui Ex-Lub System) для смазывания поверхностей штампа/пуансона перед каждым прессованием с силой сжатия от 10 до 15 кН (подробнее смотри Таблицу 2).
| Таблица 2 | |||||
| ODT гидрокодона битартрата/ацетаминофена, 5 мг/500 мг и 10 мг/300 мг | |||||
| Номер | Ингредиент | ODT гидрокодона/ацетаминофена | |||
| PF401 (5 мг/500 мг) | РР402(10 мг/300 мг) | ||||
| % таблетки | г/партия | % таблетки | г/партия | ||
| 1 | Низкоактивный гидрокодона битартрат/ацетаминофен (РЕ382) с маскированным вкусом | 22,89 | 572,25 | ||
| 2 | Высокоактивный гидрокодона битартрат/ацетаминофен с маскированным вкусом (РЕ384) | 15,66 | 391,5 | ||
| 3 | Микрокапсулы ацетаминофена (РЕ380) | 16,11 | 402,75 | 15,60 | 390,0 |
| 4 | Быстродиспергируемые микрогранулы | 40,15 | 1003,75 | 49,70 | 1242,5 |
| 5 | Маннит USP (Parteck® M200) | 4,25 | 106,25 | 5,00 | 125,0 |
| 6 | Микрокристаллическая целлюлоза, NF | 10,00 | 250,0 | 10,00 | 250,0 |
| 7 | Кросповидон, NF (XL-10) | 5,25 | 131,25 | 5,26 | 131,3 |
| 8 | Сукралоза, NF | 0,35 | 8,75 | 0,35 | 8,8 |
| 9 | Искусственный клубничный ароматизатор | 1,00 | 25,00 | 1,00 | 25,0 |
| 10 | Стеарат магния | Следы | Следы | Следы | След ы |
| Всего | 100,0 | 2500,0 | 100,0 | 2500,0 | |
| Масса таблетки (мг) | 1600,0 | 1250,0 | - |
ПРИМЕР 4
4.А Обеспечение пилотного РК (фармакокинетического) исследования:
ODT гидрокодона битартрата/ацетаминофена с двумя силами действия - 5 мг/500 мг и 10 мг/300 мг, и три разные композиции частиц с маскированным вкусом использовали между данными двумя силами действия таблетки: 1) кристаллы ацетаминофена (А100 - стандартный размер частиц, то есть 177-350 мкм) с композицией вкусомаскирующего покрытия в обеих композициях ODT; 2) кристаллы ацетаминофена (стандартный размер частиц) с слоем лекарственного средства 1,75% масс./масс. гидрокодона битартрата и последующим вкусомаскирующим покрытием, используемым в таблетке с силой действия 5 мг/500 мг; и 3) кристаллы ацетаминофена (стандартный размер частиц) с слоем лекарственного средства 7% масс./масс. гидрокодона битартрата и последующим вкусомаскирующим покрытием, используемым в таблетке с силой действия 10 мг/300 мг. Вкусомаскирующее покрытие композиционно было одинаковым для всех частиц, но количество покрытия в единицах масс./масс.варьируется от 12,5% для ацетаминофена (РЕ380), 22% для 1,75% гидрокодона битартрата/ацетаминофена (РЕ382), используемых в ODT 5 мг/500 мг (PF401), до 27% для 7% гидрокодона битартрата/ацетаминофена (РЕ384), используемых в ODT 10 мг/300 мг (PF402). Смесь для прессования спрессовывают в ODT гидрокодона битартрата/ацетаминофена, используя таблеточный пресс Elizabeth Hata, оборудованный системой смазывания Matsui Ex-Lub, в которой используют стеарат магния в качестве наружного смазывающего вещества. Каждая из дозировок имеет индивидуальную смесь и была получена с использованием разных параметров таблетирования (подробнее см. Таблицу 3 ниже). Данные партии ODT готовили, как описано в Примерах 3.А-3.Е (композиции смотри в Таблицах 1 и 2). Промежуточные и готовые продукты тестировали, используя методы квалифицированного аналитического тестирования, и использовали в пилотном исследовании РК на здоровых добровольцах.
| Таблица 3 | ||
| Параметры таблетирования для ODT гидрокодона битартрата/ацетаминофена: | ||
| Параметр | ODT 5 мг/500 мг | ОDT 10 мг/300 мг |
| Обработка - круглая, плоский торец, закругленная кромка | 17 мм | 15 мм |
| Целевая масса таблетки (мг) | 1600 | 1250 |
| Низшая целевая масса таблетки ×0,985 (мг) | 1576 | 1231 |
| Целевая масса таблетки ×1,015 (мг) | 1624 | 1269 |
| Скорость поворотного стола в диапазоне (об/мин) | 15(10-20) | 15(10-20) |
| Глубина заполнения (мм) | 10,94-10.98 | 5,11 |
| Основное положение (мм) | 10,6-11,1 | 4,44 |
| Предварительное положение (мм) | 6,2-6,4 | 4,61 |
| Градуировка на башмаке подачи | 2(0-4) | 2(0-4) |
| Масса таблетки (мг) | 1597 | 1248,6 |
| Твердость в диапазоне (н) | 6,80 | 6,92-6,95 |
| Толщина в диапазоне (мм) | 47-49 | 40-42 |
| Хрупкость в диапазоне (%) | 0,25-0,31 | 0,24-0,31 |
4.В Пилотное РК (фармакокинетическое) исследование:
ODT гидрокодона битартрата/ацетаминофена, с дозировками 5 мг/500 мг и 10 мг/300 мг, испытывали в пилотном РК (фармакокинетическом) исследовании в 4 группах, с привлечением 16 здоровых субъектов на группу в сравнении с соответствующими RLD, Abbott's VICODIN® (Викодин) 5 мг/500 мг, Mikart's Xodol® (Эксодол) 10 мг/300 мг. Профили зависимости концентрации ацетаминофена и гидрокодона битартрата в плазме от времени для этих ODT показаны на Фиг.2 и 3.
| Таблица 4 | |||||||
| РК Параметры для ODT гидрокодона/ацетаминофена | |||||||
| Тестируемая ODT | RLDIR | Активное вещество | Тест ODT | RLD | Соотношение | ||
| 5/500 мг | Викодин | Ацетаминофен | Смакc (НГ/МЛ) | Тест/RLD | Мин-макс | ||
| 5013,86 | 6115,49 | 81,99 | 67,79-99,15 | ||||
| AUC0→inf (нг.ч/мл) | Тест/RLD | Мин-макс | |||||
| 19205,98 | 19917,76 | 96,43 | 79,17-117,4 | ||||
| 10/300 мг | Эксодол | Ацетаминофен | Смакc (НГ/МЛ) | Тест/RLD | Мин-макс, | ||
| 3159,55 | 3914,16 | 80,72 | 67,80-96,10 | ||||
| AUC0→inf (нг.ч/мл) | Тест/RLD | Мин-макс | |||||
| 12196,49 | 12794,85 | 95,32 | 79,55-114,2 | ||||
| 5/500 мг | Викодин | Гидрокодон | Смакc (нг/мл) | Тест/RLD | Мин-макс | ||
| 19,708 | 20,139 | 97,86 | 90,44-105,9 | ||||
| AUC0→inf (нг.ч/мл) | Тест/RLD | Мин-макс | |||||
| 141,36 | 141,40 | 99,97 | 93,56-106,8 | ||||
| 10/300 мг | Эксодол | Гидрокодон | Смакc (НГ/МЛ) | Тест/RLD | Мин-макс | ||
| 38,719 | 40,530 | 95,53 | 88,87-102,7 | ||||
| AUC0→inf (нг.ч/мл) | Тест/RLD | Мин-макс | |||||
| 286,33 | 279,06 | 102,6 | 96,25-109,4 | ||||
На Фиг.4 показаны профили зависимости концентрации в плазме от времени для ацетаминофена, наблюдаемые в другом пилотном РК исследовании в 3 группах с привлечением 24 здоровых субъектов на группу, где ODT 500 мг ацетаминофена в присутствии или в отсутствие воды вводили воздерживающимся от пищи здоровым добровольцам в сравнении с соответствующим RLD, GSK' s Panadol® (Панадол) 500 мг. Вкус ацетаминофена полумелкой марки (А137) с более мелким распределением частиц по размеру 53-177 мкм маскировали коацервацией в растворителе с помощью Ethocel Standard Premium 100 сП до массы покрытия 10-12%. Для изготовления перорально распадающихся таблеток данные микрокапсулы смешивали с быстродиспергируемыми микрогранулами (РЕ378, изготовленными из маннита 25/кросповидона 95/5, как раскрыто в Примере 1.Е выше), кросповидоном, микрокристаллической целлюлозой, аспартамом (подсластитель) и клубничным ароматизатором в V-образном смесителе и затем спрессовывали на роторном таблеточном прессе, оборудованном системой наружного смазывания. Данные таблетки (композиции смотри в Таблице 5) высвобождали не менее 85% в течение 15 мин при испытании с использованием Аппарата 2 USP (лопасти при 75 об/мин в буфере рН 5,8 (смотри данные по растворению в Таблице 6))
| Таблица 5 | ||||
| Композиции ОРТ ацетаминофена | ||||
| Ингредиенты | % на таблетку | ODT (мг/таблетка) | Количество (кг)/партия | |
| 250 мг | 500 мг | 250 мг/500 мг | ||
| Ацетаминофен (А137) с маскированным вкусом (10-12%) | 39,68 | 277,8 | 555,5 | 63,5 |
| Быстродиспергируемые гранулы (РЕ375) | 42,12 | 294,8 | 589,7 | 67,4 |
| Микрокристаллическая целлюлоза (Avicel PH101) | 10,00 | 70,0 | 140,0 | 8,0 |
| Кросповидон NF (XL-10) | 5,00 | 35,0 | 70,0 | 16,0 |
| Сукралоза NF | 1,60 | 11,2 | 22,4 | 2,56 |
| Клубничный ароматизатор | 1,60 | 11,2 | 224 | 2,56 |
| Всего | 100,0 | 700,0 | 1400,0 | 160,0 |
РК (фармакокинетические) параметры для ODT ацетаминофена в сравнении с панадолом приведены ниже:
Режим Т1: ODT ацетаминофена (Р-300) с водой
Режим Т2: ODT ацетаминофена (Р-300) без воды
Режим 3: Эталонная таблетка (Panadol®), проглатываемая с водой
| РК параметр | Тест 1 (ODT) | Тест 2 (ODT) | 90% доверительный интервал | 90% доверительный интервал |
| с водой | без воды | Тест Т1 против RLD | Тест Т2 против RLD | |
| Смаке (НГ/МЛ) | 7,240 | 7,635 | 90,94-110,25 | 94,04-114,01 |
| AUC0→t (нг.ч/мл) | 21,44 | 21,00 | 99,61-106,19 | 98,06-104,53 |
| AUC0→inf (нг.ч/мл) | 22,43 | 21,69 | 99,41-106,33 | 96,83-103,57 |
Приведенные выше результаты подтверждают, что тестируемый продукт, 500 мг ODT ацетаминофена, при введении с водой и без воды является биоэквивалентной эталонному продукту, Panadol® 500 мг, проглатываемому с водой. Данные по растворению in vitro при различной скорости (50, 75 и 100 об/мин) и различных значениях рН (вода, рН 1, 2, 4,5, 5,8, 6,8) получали в партиях 5 мг/500 мг и 10 мг/300 мг ODT таблеток из Примеров 3 и 4 и 250 мг и 500 мг ODT таблеток из Примера 4, и совокупность сравнительных данных представлена в Таблице 6. Так как для изготовления партий 5 мг/500 мг - 10 мг/300 мг таблеток ODT и 250 мг - 500 мг таблеток ODT, соответственно, использовали различные марки лекарственного вещества, такие как гранулированный ацетаминофен и полумелкий ацетаминофен, определяли распределения по размеру частиц некоторых партий лекарственного вещества и соответствующих партий микрокапсул. В Таблице 7 показаны данные по распределению частиц по среднему размеру.
| Таблица 6 | ||||||
| Данные по растворению для IR таблеток и ODT гидрокодона/ацетаминофена и ODT ацетаминофена | ||||||
| Время | PF401EA0001 | PF402EA0001 | Викодин* | Эксодол | PF407EA0001A | PF408EA0002A |
| (мин) | 5 мг/500 мг | 10 мг/300 мг | 5 мг/500 мг | 10 мг/300 мг | 250МГ | 500 мг |
| 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 5 | 23 | 28 | 49 | 40 | ||
| 10 | 53 | 60 | 65 | 87 | 75 | |
| 15 | 75 | 87 | 71 | 84 | 95 | 88 |
| 30 | 101 | 103 | 76 | 93 | ||
| *→Викодин высвобождается посредством USP теста 2, который представляет собой среду 0,1 н. HCl | ||||||
| Таблица 7 | ||||
| Распределение по размеру частиц лекарственного вещества и микрокапсул ацетаминофена | ||||
| Лекарственное вещество ацетаминофен | Микрокапсулы | |||
| Марка | % удержанных частиц | Покрытие | % удержанных частиц | % анализа (STD) |
| Гранулированный | ||||
| (Среднее из нескольких партий) | >80% <425-180 мкм> | 6% (500/1000 галлонов) | 95% <425-180 мкм> | 93±1,37 |
| Полумелкая | ||||
| (Среднее из нескольких партий) | 90% <150-53 мкм> | 12% (5-галлонов) | 87% <250-74 мкм> | 87.9 |
| А13709532 | 89,5% <150-53 мкм> | 12% (500-галлонов) | 90% <250-74 мкм> | 86,8 |
| А13709533 | 86,2% <150-53 мкм> | 10% (500-галлонов) | 89,5% <250-74 меш> | 89,7 |
ODT таблетки ацетаминофена/гидрокодона (5 мг/500 мг или 10 мг/300 мг ODT) содержат два из трех типов микроинкапсулированных частиц лекарственного средства ацетаминофена - гранулированный ацетаминофен и частицы гранулированного лекарственного средства ацетаминофена, покрытые слоем гидрокодона при низкой или высокой загрузке лекарственного средства, все со вкусом, маскированным покрытием из смеси этилцеллюлоза/Eudragit ЕРО. Для улучшения растворения и биоэквивалентности до RLD и для улучшения стабильности гидрокодона при нанесении слоя непосредственно на частицы ацетаминофена, было решено использовать лекарственное вещество с более мелким распределением частиц по размеру (например полумелкий ацетаминофен) в таблеточной композиции для изготовления "более мелких ацетаминофеновых микрокапсул".
При оценке разных вкусомаскирующих покрытий, нанесенных на микрочастицы, содержащие гидрокодона битартрат, в отношении их способности придавать приемлемые органолептические свойства, обнаружили, что покрытие, содержащее подсластитель в комбинации со слоем герметизирующего покрытия, содержащего гидроксипропилцеллюлозу (Klucel LF), было эффективно в маскировании горького вкуса гидрокодона битартрата.
ПРИМЕР 5
5.А Микрочастицы ацетаминофена с маскированным вкусом (6%):
Вкус ацетаминофена (полумелкая марка от Covidien с размером частиц 80-270 меш или 53-177 мкм (А137); 1800,0 г) маскировали посредством коацервации в растворителе в 5-галлонной, системы. В 5-галонную систему, заполненную 10000 г циклогексана, загружали этилцеллюлозу (Ethocel Standard Premium 100 от Dow Chemicals; 114,9 г), полиэтилен (Epolene C-10; 50 г) и лекарственное средство. Систему подвергали циклу регулируемого нагревания до достижения температуры 80°С для растворения этилцеллюлозы, тем временем перемешивали содержимое со скоростью 300 об/мин. После этого систему подвергают циклу регулируемого компьютером охлаждения до<28°С в течение не менее 45 мин, чтобы инкапсулировать кристаллы лекарственного средства с гладким покрытием с массой покрытия 6% и избежать образования агломератов. Микрокапсулы отделяли декантированием, промывали свежим циклогексаном и сушили в пароуловителе. Микрокапсулы с размером менее 35 меш собирали для маскирования вкуса (практический выход: 98,0%).
5.В Микрокапсулы гидрокодона битартрата/ацетаминофена с маскированным вкусом:
Гидрокодона битартрат (57,4 г), ацетаминофен (полумелкая марка А137; 1742,6 г), этилцеллюлозу (156,5 г), полиэтилен (50,0 г) суспендировали в циклогексане в 5-галонной системе, и микроинкапсулированные частицы НСВ/ацетаминофена с 8% масс.покрытием ЕС-100 изготавливали, следуя процедуре Примера 5.А. На микроинкапсулированные частицы гидрокодона битартрата/ацетаминофена (1518,8 г) наносили герметизирующее покрытие из смеси Klucel LF (288,6 г)/стеарат магния (15,2 г) и, кроме того, обеспечивали второй вкусомаскирующей мембраной, содержащей смесь этилцеллюлоза (ЕС-10)/Eudragit EIOO/Myvacet/стеарат магния с соотношением 286,6/253,5/31,8/35,7 в Glatt GPCG 3 для покрытия массой 25%, как описано в Примере 3.
5.С Микрокапсулы гидрокодона битартрата/ацетаминофена с маскированным вкусом:
Гидрокодона битартрат (60,0 г и 6,7 г от Klucel LF) наносили слоем на микрокапсулы ацетаминофена (полумелкая А137 с покрытием ЕС-100 массой 6% из Примера 5.А; 1205,3 г) в Glatt GPCG 3 для покрытия массой 8%, как описано в Примере 3. После наслаивания лекарственного средства герметизирующее покрытие от Klucel LF (28,0 г) распыляли на частицы, покрытые слоем гидрокодона, с последующим вкусомаскирующим покрытием смесью EC-10/E100/PEG 400/Myvacet 9-45 с соотношением 40/35/15/10 для покрытия массой 35%.
5.D OPT гидрокодона битартрата/ацетаминофена:
Смесь для прессования, содержащая микрочастицы гидрокодона/ацетаминофена из Примера 5.В, выше, с маскированным вкусом или микрочастицы гидрокодоан/ацетаминофена с маскированным вкусом из Примера 5.С, выше, комбинировали с быстродиспергируемыми микрогранулами из 1-Е выше и предварительно подготовленной, смесью, содержащей микрокристаллическую целлюлозу, кросповидон, сукралозу и клубничный ароматизатор, и прессовали в ODT гидрокодона битартрата/ацетаминофена, 5 мг/500 мг и 10 мг/300 мг (композиции смотри в Таблице 8), используя таблеточный пресс Elizabeth Hata, оборудованный системой смазывания Matsui Ex-Lub, в которой используется стеарат магния в качестве наружного смазывающего вещества.
| Таблица 8 | |||||
| Композиции ODT ацетаминофена | |||||
| Ингредиенты (мг/таблетка) | ODT, 5 мг/500 мг | ODT, 10 мг/300 мг | |||
| 1300-086 | 1300-088 | 1300-085 | 1300-087 | ||
| Гидрокодон/ацетаминофен с маскированным вкусом (Пример 5.В) | 287,4 | 344,8 | |||
| Гидрокодон/ацетаминофен с маскированным вкусом (Пример 5.С) | 172,4 | 344,8 | |||
| Микрокапсулы ацетаминофена (РЕ378) | 378,4 | 445,4 | 123,3 | 123,3 | |
| Быстродиспергируемые гранулы (РЕ375) | 496,9 | 544,9 | 445,5 | 445,5 | |
| Микрокристаллическая целлюлоза (Avicel РН101) | 140,0 | 140,0 | 110,0 | 110,0 | |
| Кросповидон NF (XL-10) | 70,0 | 70,0 | 55,0 | 55,0 | |
| Сукралоза NF | 4,9 | 4,9 | 3,85 | 3,85 | |
| Клубничный ароматизатор | 22,4 | 2,4 | 17.6 | 17,6 | |
| Всего | 1400,0 | 1400,0 | 1100,0 | 1100,0 | |
В Таблице 9 представлены профили растворения гидрокодона битартрата и ацетаминофена из ODT. Немного более толстое покрытие на частицах лекарственного средства ацетаминофена посредством коацервации (ЕС-100) или более толстое покрытие в кипящем слое (ЕС-10/Е100), как оказалось, оказывает незначительное влияние на скорости растворения лекарственного средства.
| Таблица 9 | ||||||||
| Данные по растворению для ODT гидрокодона битартрата/ацетаминофена | ||||||||
| Время (мин) | Гидрокодона битартрат высвобожденный (%) | Ацетаминофен высвобожденный (%) | ||||||
| ODT(10 мг/300 мг) | ODT (5 мг/500 мг) | ODT (10 мг/300 мг) | ODT (5 мг/500 мг) | |||||
| 1300-085 | 1300-087 | 1300-086 | 1300-088 | 1300-085 | 1300-087 | 1300-086 | 1300-088 | |
| 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 5 | 90 | 101 | 87 | 98 | 54 | 49 | 47 | 51 |
| 10 | 94 | 104 | 91 | 101 | 91 | 80 | 81 | 81 |
| 15 | 94 | 104 | 92 | 101 | 102 | 95 | 93 | 92 |
| 30 | 95 | 104 | 93 | 102 | 105 | 103 | 98 | 98 |
ПРИМЕР 6
6.А Микроинкапсулирование ацетаминофена:
В 200-галлонную систему коацервации в растворителе (146 кг) загружали ацетаминофен (полумелкая марка А137; 75,5 кг), этилцеллюлозу (ЕС-100; 4,8 кг), Epolene (2,1 кг) и вкус ацетаминофена маскировали коацервацией в растворителе в 200-галлонной системе, при перемешивании со скоростью 80±5 об/мин. Регулируемый компьютером цикл "нагревание до 80°С и выдержка" использовали для достижения температуры 80°С для растворения этилцеллюлозы в системе коацервации. После этого систему подвергали циклу охлаждения до <28°С в течение не менее 45 мин, чтобы инкапсулировать кристаллы ацетаминофена гладким покрытием с массой 6% и избежать образования агломератов. Микрокапсулы фильтровали в вакууме, промывали циклогексаном и сушили в сушилке с кипящим слоем, используя 3-ступенчатую температуру (например 25°С, 35°С, 99°С) в течение 4-6 ч для достижения остаточного уровня циклогексана менее 1000 млн-1. Микрокапсулы просеивали через сито US 35 меш. Следуя такой же процедуре, получали несколько партий микрокапсул (размер партии: 80 кг) с покрытием массой 6% в 200-галлонной системе.
6.В Микрочастицы гидрокодона/ацетаминофена с маскированным вкусом:
Гидрокодона битартрат (композиции и количества партий смотри в Таблице 10) наносили слоем на микрокапсулы ацетаминофена (6% покрытие ЕС-100; 3375,0 г) из Примера 6.А, выше, посредством распыления композиции для наслаивания лекарственного средства, содержащей гидроксипропилцеллюлозу (10% твердых веществ), в Glatt GPCG 5 (9-дюймовый Вурстер, 25 мм зазор разделения, удержание продукта ситом 200 меш, диаметр наконечника сопла 1,0 мм, 'C'-пластина распределения воздуха в нижней части; температура продукта: 37±3°С; объем воздуха на входе: 40-45 CFM (кубических футов в минуту) (1,13-1,27 куб. метра в мин); скорость распыления: 8-24 мл/мин) для загрузки гидрокодона битартрата 9,0%. Герметизирующий раствор гидроксипропилового покрытия (5,0% или 73,68 г растворяли в смеси 50/50 ацетон/вода с 10% твердого вещества) распыляли на частицы, покрытые слоем лекарственного средства (1400 г) в Glatt GPCG 3 для получения массы покрытия 5% и затем вкусомаскирующего покрытия сукралозой (5,0%), растворенной в водном растворе гидроксипропилцеллюлозы (1,24%; при соотношении сукралоза/НРС 80/20), используя следующие условия процесса: температура на входе: 57±2°С; температура продукта: 37±2°С; скорость распыления: 8 мл/мин; объем воздуха на входе: 6 CFM (0,17 куб. метра в мин).
6.С Микрочастицы гидрокодона/ацетаминофена с маскированным вкусом:
Гидрокодона битартрат (композиции и величины партий смотри в Таблице 10) наносили слоем на капсулы ацетаминофена (6% покрытие ЕС-100; 3733,3 г) из Примера 6.А, выше, путем распыления композиции для наслаивания лекарственного средства, содержащей гидроксипропилцеллюлозу (10% твердых веществ), в Glatt GPCG 5, как описано в Примере 6.В, выше. После нанесения покрытия на микрочастицы наносили герметизирующее покрытие из гидроксипропилцеллюлозы в количестве 5% в том же устройстве, сушили в течение 5 минут для снижения остаточной влажности и просеивали через сита 30 и 80 меш, чтобы избавиться от частиц других размеров и мелкозернистых фракций.
| Таблица 10 | ||||
| Микрочастицы смеси 5.0% сукралоза/5.0% НРС/гидрокодона битартрат/ацетаминофен | ||||
| Ингредиенты | Процентное содержание | Необходимое количество (г) | ||
| микрокапсулы 5,0% сукралозы/5% гидрокодона, покрытого НРС /ацетаминофен | Формула А | Формула В | Формула А | Формула В |
| Нанесение лекарственного средства - (10% твердых веществ) | ||||
| Микрокапсулы АРАР (А137) (6% слой) | 80,16 | 84,24 | 3375,0 | 3733,3 |
| Гидрокодона битартрат, NF | 8,02 | 5,41 | 337,5 | 240,0 |
| Гидроксипропилцеллюлоза, NF (Klucel LF) | 0,89 | 0,60 | 37,5 | 26,7 |
| Ацетон, NF | следы | следы | 2400,0 | |
| Очищенная вода, USP | следы | следы | 3375,0 | 2400,0 |
| Герметизирующее покрытие НРС (6% твердых веществ) | ||||
| Микрокапсулы гидрокодон/ацетаминофен | 89,07 | 90,25 | 1400,0 | 4000,0 |
| Гидроксипропилцеллюлоза, NF (Klucel LF) | 4,69 | 4,75 | 73,68 | 210,5 |
| Ацетон, NF | следы | следы | 614,0 | 1649,1 |
| Очищенная вода, USP | следы | следы | 614,0 | 1649,1 |
| Покрытие сукралозой (15% твердых веществ) | ||||
| Гидрокодон/ацетаминофен, покрытый НРС | 93,76 | 95,00 | 1300,0 | 3400,0 |
| Сукралоза, NF | 5,00 | 5,00 | 69,33 | 179,0 |
| Гидроксипропилцеллюлоза, NF (Klucel LF) | 1,24 | 17,19 | ||
| Очищенная вода, USP | следы | следы | 490,27 | 1014,0 |
| Всего | 100,0 | 100,0 | 1386,52 | 3578,9 |
6.D ОРТ гидрокодона/ацетаминофена:
Смесь для прессования, содержащую микрочастицы гидрокодона/ацетаминофена с маскированным вкусом из Примера 6.В, выше, или микрочастицы гидрокодона/ацетаминофена с маскированным вкусом из Примера 6.С, выше, объединяли с быстродиспергируемыми микрогранулами из 1.Е выше и предварительно подготовленной смесью, содержащей микрокристаллическую целлюлозу, кросповидон, сукралозу и клубничный ароматизатор, и спрессовывали в ODT гидрокодона битартрата/ацетаминофена, 10 мг/300 мг и 5 мг/500 мг (композиции смотри в Таблице 11), используя таблеточный пресс Elizabeth Hata. В то время как ODT lot# 1334-JMC-142 спрессовывали, используя стеарат магния в качестве наружного смазывающего вещества, ODT lot# 1198-JMC-046 и 1198-JMC-062 спрессовывали, используя стеарилфумарат натрия (PRUV*) в качестве внутреннего смазывающего вещества. Характеристики таблетирования перечислены в Таблице 12.
| Таблица 11 | ||||
| OPT гидрокодона битартрата/ацетаминофена. 5 мг/500 мг и 10 мг/300 мг | ||||
| № | Ингредиент (мг/таблетка) | ODT гидрокодона/ацетаминофена | ||
| Юмг/300 мг | 10 мг/300 мг | 5 мг/500 мг | ||
| 1334.JMC-142 | 1198-JMC-062 | 1198-046 | ||
| мг/таблетка | мг/таблетка | мг/таблетка | ||
| 1 | Сукралоза/НРС/9%гидрокодон/ацетаминофен (из Примера 6.В) | 123,11 | ||
| Сукралоза/НРС/5,7%гидрокодон/ацетаминофен (из Примера 6.С) | 184,50 | 92,25 | ||
| 2 | Микрокапсулы ацетаминофена (10%) | 225,88 | 172,33 | 476,35 |
| 3 | Быстродиспергируемые гранулы | 542,01 | 443,97 | 454,10 |
| 4 | Микрокристаллическая целлюлоза, NF | 110,0 | 110,00 | 140,00 |
| 5 | Маннит, USP(Parteck® M200) | 110,00 | 140,00 | |
| 6 | Кросповидон | 55,0 | 1 | |
| Кроскармелоза натрия (Ac-Di-Sol) | 33,0 | 42,00 | ||
| 7 | Сукралоза, NF | 13,75 | 18,70 | 23,80 |
| 8 | Искусственный вишневый ароматизатор | 19,25 | 16,50 | 17,50 |
| 9 | Лимонная кислота | 11,00 | ||
| Стеарат магния (внешний) | следы | |||
| Стеарилфумарат натрия (PRUV) | 11,00 | 14,00 | ||
| Всего | 1100,0 | 1100,0 | 1400,0 | |
| Таблица 12 | |||||
| Характеристики таблетирования ODT гидрокодона битартрата/ацетаминофена | |||||
| Серия № | Сила сжатия | Масса | Толщина | Прочность | Хрупкость |
| ODT 10 мг/300 мг | |||||
| 1334-142 | 13 кН | 1102 мг | 6,12 мм | 41.3H | 0,51% |
| 14 кН | 1101 мг | 6,03 мм | 46,4 H | 0,37% | |
| 1198-062 | 12,5кН | 1099 мг | 6,09 мм | 46,0 Н | 0,20% |
| ODT 5 мг/500 мг | |||||
| 1198-046 | 18 кН | 1402 мг | 6,11 MM | 53 H | 0,18% |
| 20 кН | 1394 мг | 6,03 мм | 61 H | 0,05% | |
| 22 кН | 1390 мг | 5,97 мм | 67 H | 0,17% | |
ПРИМЕР 7
7.А Микрочастицы метформина с маскированным вкусом:
На метформина гидрохлорид (1000,0 г) в Glatt GPCG 3 наносили покрытие с помощью раствора этилцеллюлозы (Ethocel Standard 10 Premium; 78,5 r)/Eudragit E100 (75,0 г), пластифицированной полиэтиленгликолем (PEG 400; 25,9 г), и кошерным стеаратом магния (15,6 г), растворенными в смеси 80/20 ацетон (1359,5 г)/изопропиловый спирт (672,7 г)/вода (770,8 г) для получения массы покрытия 17,5%. Высушенные частицы просеивают, используя сита 35 и 80 меш, чтобы избавиться от агломератов/мелкозернистых фракций. Партию микрокапсул метформина с маскированным вкусом готовят также с массой покрытия 25%. Также используют 5%-ное герметизирующее покрытие Klucel LF, чтобы избежать возможного взаимодействия между катионным полимером вкусомаскирующей мембраны и низкодозовым лекарственным средством (например росиглитазоном). Для непосредственного включения в композицию ODT также готовят другую партию микрочастиц метформина с маскированным вкусом с композицией покрытия, имеющей такое же соотношение и такой же % твердых веществ, для массы покрытия 25%;
7.В Росиглитазон/метформин с маскированным вкусом:
Росиглитазона малеат наносят слоем на микрокапсулы метформина, имеющие герметизирующее покрытие, из Примера 7.А, выше, в Glatt GPCG 3 для увеличения массы покрытия на 2,5%, используя способ, аналогичный описанному в Примере 5.В, выше. После наслаивания лекарственного средства, герметизирующее покрытие 2% масс. раствора Klucel LF распыляют на частицы, покрытые слоем росиглитазона, затем наносят вкусомаскирующее покрытие из смеси EC-10/E100/PEG 400/стеарат магния в соотношении 40/35/15/10 с массой покрытия 20%.
7.С OPT росиглитазона/метформина:
Микрочастицы росиглитазона малеата/метформина гидрохлорида из Примера 7.В, выше, микрочастицы метформина гидрохлорида с маскированным вкусом из Примера 7.А, выше, быстродиспергируемые микрогранулы из Примера 1.Е, выше и предварительно подготовленную смесь, содержащую микрокристаллическую целлюлозу, сукралозу, клубничный ароматизатор и кросповидон, смешивают вместе в V-образном смесителе и прессуют в ODT росиглитазона/метформина, 1 мг/500 мг, 2 мг/500 мг, 4 мг/500 мг и 4 мг/1 г, используя таблеточный пресс Elizabeth Hata, оборудованный системой смазывания Matsui Ex-Lub, в которой используется стеарат магния в качестве наружного смазывающего вещества для смазывания поверхностей пуансона и штампа перед прессованием.
Данные примеры демонстрируют, что композиции ODT, включающие микрочастицы, содержащие высокодозовый метформина HCI/низкодозовый росиглитазона малеат (например 500 мг/1 мг, 500 мг/2 мг или 500 мг/4 мг), демонстрируют приемлемые характеристики таблетирования (например твердость, ломкость, однородность лекарственных форм, низкое время распадаемости in vitro/in vivo, быстрое растворение, приемлемые органолептические свойства), что значительно улучшает соблюдение пациентом схемы лечения. Кроме того, фармацевтические композиции (и пероральные лекарственные формы, приготовленные из них) по настоящему изобретению демонстрируют приемлемое маскирование вкуса и обеспечивают быстрое, по существу полное высвобождение дозы на входе в желудок, таким образом обеспечивая биоэквивалентность соответствующему эталонному продукту с немедленным высвобождением(IR).
ПРИМЕР 8
8.А Микрочастицы ниацина посредством регулируемой сферонизации
Повидон (PVP К-30; 50 г) медленно добавляют к очищенной воде (500 г), постоянно перемешивая с получением раствора полимерного связующего вещества с 10% масс./масс. твердых веществ. Ниацин (или никотиновую кислоту от Lonza Corporation; 2000 г) смешивают с 10 г коллоидного диоксида кремния (увеличитель текучести Cab-0-Sil М-5Р от Cabot Corporation) и повидоном (50 г) в V-образном смесителе и загружают в резервуар для продукта Granurex GX-35 от Vector Corporation (Iowa, USA). 10% раствор связующего вещества PVP распыляют во вращающийся слой вещества с регулируемой скоростью. Оптимизированные параметры процесса во время образования пеллет - технологическая температура воздуха: ~19-20°С; температура продукта: 16±2°С; скорость вращения: 425 об/мин; приток наружного воздуха: 150 л/мин; скорость распыления: 15 об/мин (~8 мл/мин); перепад давления на щели: 1,3-11 мм в воде. Оптимизированные параметры процесса во время сушки пеллет - технологический объем воздуха: 30 CFM (куб. футов в мин) (0,85 куб. м в мин); технологическая температура воздуха: ~60°С; температура продукта: 35°С (до окончания сушки); скорость вращения: 180 об/мин; объем воздуха щели: 10 CFM (куб. футов в мин) (0,28 куб. м в мин); время обработки: 40 мин. Примерно 65% пеллет, приготовленных таким образом, имеют размер в диапазоне 40-80 меш.
8.В Микрочастицы ниацина с SR-покрытием
На микрочастицы ниацина (1600 г) со стадии 8.А, выше, наносят SR-покрытие этилцеллюлозы (Ethocel Standard 10 Premium; 180 г)/ТЕС (триэтилцитрат, пластификатор; 20 г), растворенной в смеси 90/10 ацетон/вода с увеличением массы 15%. Образцы отбирают с покрытием 7,5, 10, 12,5% масс.для тестирования высвобождения лекарственного средства. Высушенные частицы просеивают, используя сита 30 и 80 меш, чтобы избавиться от агломератов/мелкозернистых фракций. Также наносят 2% герметизирующее покрытие Klucel LF, чтобы избежать возможного взаимодействия между смесью полимер/пластификатор и низкодозовым лекарственным средством (например аторвастатином).
Другую партию микрочастиц ниацина с маскированным вкусом готовят также с помощью композиции покрытия с тем же самым соотношением и тем же самым % твердых веществ для получения увеличения массы 15% в расчете на общую массу покрытых микрочастиц для непосредственного включения в композицию ODT.
8.С Микрочастицы ниацина, покрытые аторвастатином:
Аторвастатин кальция наносят слоем на покрытые герметизирующим слоем микрокапсулы ниацина со стадии 8.В, выше, в Glatt GPCG 3 до увеличения массы на 4%, как описано в Примере 1.С, выше. После наслаивания лекарственного средства герметизирующее покрытие Klucel LF с 2% масс. распыляют на частицы, покрытые слоем аторвастатина, с последующим нанесением вкусомаскирующего покрытия EC-10/E100/PEG 400/стеарат магния с соотношением 40/35/15/10 до увеличения массы на 20%.
8.D SR-ODT аторвастатина/ниацина:
Микрочастицы аторвастатина кальция/ниацина с маскированным вкусом со стадии 8.С, выше, микрочастицы ниацина с маскированным вкусом со стадии 8.В, выше, быстродиспергируемые микрогранулы со стадии 1-Е, выше, и предварительно подготовленную смесь, содержащую микрокристаллическую целлюлозу, сукралозу, клубничный ароматизатор и кросповидон, смешивали вместе в V-образном смесителе и спрессовывали в ODT аторвастатина/ниацина, 2,5 мг/500 мг, 5 мг/500 мг и 10 мг/500 мг, используя таблеточный пресс Elizabeth Hata, оборудованный системой смазывания Matsui Ex-Lub, в которой используется стеарат магния в качестве наружного смазывающего вещества для смазывания поверхностей пуансонов и штампов перед прессованием.
Специалистами в данной области техники могут быть произведены изменения в структуре, и различных компонентах, и в компоновке, описанных в данном описании изобретения, или в стадиях или последовательности стадий способа изготовления, описанного здесь, без отклонения от сущности и объема изобретения, как описано в данном описании изобретения.
Claims (31)
1. Фармацевтическая композиция, содержащая первую совокупность микрочастиц, которые содержат высокодозовое/низкодозовое лекарственное средство, и вторую совокупность частиц, содержащих высокодозовое лекарственное средство, где микрочастицы первой совокупности, содержащие высокодозовое/низкодозовое лекарственное средство, включают:
(а) ядро, содержащее высокодозовое лекарственное средство;
(б) первое покрытие, расположенное поверх ядра, содержащее низкодозовое лекарственное средство; и
(в) второе покрытие, расположенное поверх ядра, содержащее нерастворимый в воде полимер; и где
частицы второй совокупности, содержащие высокодозовое лекарственное средство, включают
(1) второе ядро, содержащее высокодозовое лекарственное средство; и
(2) четвертое покрытие, содержащее нерастворимый в воде полимер, расположенное поверх второго ядра, где нерастворимый в воде полимер четвертого покрытия является таким же, как нерастворимый в воде полимер второго покрытия, или отличается от него.
(а) ядро, содержащее высокодозовое лекарственное средство;
(б) первое покрытие, расположенное поверх ядра, содержащее низкодозовое лекарственное средство; и
(в) второе покрытие, расположенное поверх ядра, содержащее нерастворимый в воде полимер; и где
частицы второй совокупности, содержащие высокодозовое лекарственное средство, включают
(1) второе ядро, содержащее высокодозовое лекарственное средство; и
(2) четвертое покрытие, содержащее нерастворимый в воде полимер, расположенное поверх второго ядра, где нерастворимый в воде полимер четвертого покрытия является таким же, как нерастворимый в воде полимер второго покрытия, или отличается от него.
2. Фармацевтическая композиция по п.1, где массовое отношение высокодозового лекарственного средства к низкодозовому лекарственному средству в фармацевтической композиции составляет по меньшей мере примерно 20:1.
3. Фармацевтическая композиция по п.1, где ядро, содержащее высокодозовое лекарственное средство, содержит частицы высокодозового лекарственного средства, где второе покрытие представляет собой оболочку с модифицированным высвобождением, содержащую растворимый в воде полимер.
4. Фармацевтическая композиция по п.1, где покрытие с низкодозовым лекарственным средством дополнительно содержит связующее вещество.
5. Фармацевтическая композиция по п.4, где связующее вещество представляет собой фармацевтически приемлемый водорастворимый полимер.
6. Фармацевтическая композиция по п.1, где второе покрытие дополнительно содержит пластификатор, где пластификатор не содержит фталаты или пластификатор выбран из группы, состоящей из глицерина, сложных эфиров глицерина, ацетилированных моно- или диглицеридов, глицерилмоностеарата, глицерилтриацетата, глицерилтрибутирата, фталатов, дибутилфталата, диэтилфталата, диметилфталата, диоктилфталата, цитратов, трибутилового эфира ацетиллимонной кислоты, триэтилового эфира ацетиллимонной кислоты, трибутилцитрата, ацетилтрибутилцитрата, триэтилцитрата, глицеролтрибутирата, себацинатов, диэтилсебацината, дибутилсебацината, адипатов, азелатов, бензоатов, хлорбутанола, полиэтиленгликолей, растительных масел, фумаратов, диэтилфумарата, малатов, диэтилмалата, оксалатов, диэтилоксалата, сукцинатов, дибутилсукцината, бутиратов, сложных эфиров цетилового спирта, малонатов, диэтилмалоната, касторового масла и их комбинаций.
7. Фармацевтическая композиция по п.1, где второе покрытие существенно маскирует вкус высокодозового лекарственного средства и/или низкодозового лекарственного средства и расположено ниже первого покрытия.
8. Фармацевтическая композиция по п.7, где второе покрытие дополнительно содержит желудочнорастворимый полимер или желудочнорастворимый порообразователь.
9. Фармацевтическая композиция по п.8, где нерастворимый в воде полимер выбран из группы, состоящей из нерастворимых в воде простых эфиров целлюлозы, этилцеллюлозы, нерастворимых в воде сложных эфиров целлюлозы, ацетата целлюлозы, триацетата целлюлозы, ацетобутирата целлюлозы, поливинилацетата, нейтральных сополимеров метилакриловой кислоты/метилметакрилата и их смесей; и желудочнорастворимый порообразователь выбран из группы, состоящей из мальтрина, сополимеров аминоалкилметакрилата, Eudragit® E100, Eudragit® EPO, диэтиламиноацетата поливинилацеталя, АЕА®, терполимеров на основе диметиламиноэтилметакрилата, бутилметакрилата и метилметакрилата, карбоната кальция, фосфата кальция, сахарида кальция, сукцината кальция, тартрата кальция, ацетата железа (III), гидроксида железа (III), фосфата железа (III), карбоната магния, цитрата магния, гидроксида магния, фосфата магния и их смесей.
10. Фармацевтическая композиция по п.1, где второе покрытие существенно модифицирует высвобождение высокодозового лекарственного средства.
11. Фармацевтическая композиция по п.10, где второе покрытие дополнительно содержит водорастворимый полимер или кишечнорастворимый полимер.
12. Фармацевтическая композиция по п.10, где второе покрытие расположено между ядром и первым покрытием.
13. Фармацевтическая композиция по п.12, дополнительно содержащая третье покрытие, расположенное поверх первого покрытия, где третье покрытие содержит нерастворимый в воде полимер, который является таким же, как нерастворимый в воде полимер второго покрытия, или отличается от него.
14. Фармацевтическая композиция по п.13, где третье покрытие существенно маскирует вкус низкодозового лекарственного средства.
15. Фармацевтическая композиция по п.7, дополнительно содержащая третье покрытие, расположенное между ядром и первым покрытием, где третье покрытие содержит нерастворимый в воде полимер, который является таким же, как нерастворимый в воде полимер второго покрытия, или отличается от него.
16. Фармацевтическая композиция по п.15, где третье покрытие существенно маскирует вкус высокодозового лекарственного средства.
17. Фармацевтическая композиция по п.16, где третье покрытие дополнительно содержит желудочнорастворимый полимер или желудочнорастворимый порообразователь.
18. Фармацевтическая композиция по п.1, где высокодозовое лекарственное средство содержит неопиоидное анальгетическое лекарственное средство, и низкодозовое лекарственное средство содержит опиоидное анальгетическое лекарственное средство; или высокодозовое лекарственное средство содержит бигуанидин, и низкодозовое лекарственное средство содержит сульфонилмочевину; или высокодозовое лекарственное средство содержит никотиновую кислоту, и низкодозовое лекарственное средство содержит статин; или высокодозовое лекарственное средство содержит противоотечное средство или антагонист гистамина, и низкодозовое лекарственное средство содержит антагонист гистамина или противоотечное средство.
19. Фармацевтическая композиция по п.18, где второе покрытие расположено между ядром и первым покрытием, и второе покрытие существенно замедляет высвобождение высокодозового лекарственного средства.
20. Фармацевтическая композиция по п.19, дополнительно содержащая третье покрытие, расположенное поверх первого покрытия, где третье покрытие содержит нерастворимый в воде полимер, который является таким же, как нерастворимый в воде полимер второго покрытия, или отличается от него, или третье покрытие содержит ароматизирующее покрытие; и третье покрытие существенно маскирует вкус низкодозового лекарственного средства.
21. Фармацевтическая композиция по п.18, где высокодозовое лекарственное средство представляет собой нестероидное противовоспалительное лекарственное средство, и низкодозовое лекарственное средство представляет собой опиоидное анальгетическое лекарственное средство.
22. Фармацевтическая композиция по п.18, где высокодозовое лекарственное средство представляет собой метформин, и низкодозовое лекарственное средство выбрано из группы, состоящей из глипизида, глибурида, глимепирида, репаглинида, натеглинида, росиглитазона, пиоглитазона и троглитазона.
23. Фармацевтическая композиция по п.18, где высокодозовое лекарственное средство представляет собой никотиновую кислоту, и низкодозовое лекарственное средство выбрано из группы, состоящей из ловастатина, флувастатина, аторвастатина, церивастатина, симвастатина, мевастатина, розувастатина и правастатина.
24. Фармацевтическая композиция по п.18, где высокодозовое лекарственное средство выбрано из группы, состоящей из гидрохлорида или сульфата псевдоэфедрина, фексофенадина, и низкодозовое лекарственное средство выбрано из группы, состоящей из цетиризина, лоратидина и фенилэфрина.
25. Фармацевтическая композиция по п.1, где четвертое покрытие дополнительно содержит водорастворимый полимер или кишечнорастворимый полимер.
26. Фармацевтическая композиция по п.1, где нерастворимый в воде полимер четвертого покрытия выбран из группы, состоящей из нерастворимых в воде простых эфиров целлюлозы, этилцеллюлозы, нерастворимых в воде сложных эфиров целлюлозы, ацетата целлюлозы, триацетата целлюлозы, ацетобутирата целлюлозы, поливинилацетата, нейтральных сополимеров метилакриловой кислоты/метилметакрилата и их смесей; водорастворимый полимер выбран из группы, состоящей из поливинилпирролидона, полиэтиленгликоля, гидроксипропилметилцеллюлозы и гидроксипропилцеллюлозы; и кишечнорастворимый полимер выбран из группы, состоящей из ацетофталата целлюлозы, фталата гидроксипропилметилцеллюлозы, ацетосукцината гидроксипропилметилцеллюлозы, фталата поливинилацетата, рН-чувствительных сополимеров метилакриловой кислоты/метилметакрилата, шеллака и их смесей.
27. Фармацевтическая композиция по п.1, где четвертое покрытие дополнительно содержит желудочнорастворимый порообразователь.
28. Лекарственная форма, содержащая композицию по п.1 и один или более чем один фармацевтически приемлемый эксципиент.
29. Лекарственная форма по п.28, дополнительно содержащая быстродиспергируемые гранулы, содержащие разрыхлитель и сахарный спирт и/или сахарид; где лекарственная форма представляет собой ODT (перорально распадающиеся таблетки).
30. Способ изготовления фармацевтической композиции по п.1, включающий:
(1) получение ядер, содержащих высокодозовое лекарственное средство;
(2) покрытие ядер со стадии (1), содержащих высокодозовое лекарственное средство, слоем низкодозового лекарственного средства, посредством чего образуются микрочастицы, содержащие высокодозовое/низкодозовое лекарственное средство;
(3) покрытие ядер со стадии (1), содержащих высокодозовое лекарственное средство, и/или микрочастиц со стадии (2), содержащих высокодозовое/низкодозовое лекарственное средство, вторым покрытием, содержащим нерастворимый в воде полимер;
(4) получение ядер второй совокупности частиц, содержащих высокодозовое лекарственное средство, где ядра со стадий (1) и (4), содержащие высокодозовое лекарственное средство, являются такими же или отличаются; и
(5) покрытие ядер второй совокупности со стадии (4), содержащих высокодозовое лекарственное средство, вкусомаскирующим покрытием, с получением таким образом ядер с маскированным вкусом, содержащих высокодозовое лекарственное средство.
(1) получение ядер, содержащих высокодозовое лекарственное средство;
(2) покрытие ядер со стадии (1), содержащих высокодозовое лекарственное средство, слоем низкодозового лекарственного средства, посредством чего образуются микрочастицы, содержащие высокодозовое/низкодозовое лекарственное средство;
(3) покрытие ядер со стадии (1), содержащих высокодозовое лекарственное средство, и/или микрочастиц со стадии (2), содержащих высокодозовое/низкодозовое лекарственное средство, вторым покрытием, содержащим нерастворимый в воде полимер;
(4) получение ядер второй совокупности частиц, содержащих высокодозовое лекарственное средство, где ядра со стадий (1) и (4), содержащие высокодозовое лекарственное средство, являются такими же или отличаются; и
(5) покрытие ядер второй совокупности со стадии (4), содержащих высокодозовое лекарственное средство, вкусомаскирующим покрытием, с получением таким образом ядер с маскированным вкусом, содержащих высокодозовое лекарственное средство.
31. Способ изготовления лекарственной формы по п.28, включающий:
(1) изготовление ядер, содержащих высокодозовое лекарственное средство;
(2) нанесение на ядра со стадии (1), содержащие высокодозовое лекарственное средство, покрытия с замедленным высвобождением, содержащего нерастворимый в воде полимер, фармацевтически приемлемый растворитель и возможно пластификатор;
(3) покрытие ядер со стадии (2), содержащих высокодозовое лекарственное средство и покрытых оболочкой с замедленным высвобождением, низкодозовым лекарственным средством, фармацевтически приемлемым растворителем и возможно связующим веществом, посредством чего образуются микрочастицы, содержащие высокодозовое/низкодозовое лекарственное средство;
(4) нанесение на микрочастицы со стадии (3), содержащие высокодозовое/низкодозовое лекарственное средство, вкусомаскирующего покрытия, содержащего нерастворимый в воде полимер и фармацевтически приемлемый растворитель; или ароматизирующего покрытия, содержащего подсластитель, фармацевтически приемлемый растворитель и возможно связующее вещество;
(5) изготовление ядер второй совокупности частиц, содержащих высокодозовое лекарственное средство, где ядра со стадий (1) и (5), содержащие высокодозовое лекарственное средство, являются такими же или отличаются;
(6) нанесение на ядра второй совокупности со стадии (5), содержащие высокодозовое лекарственное средство, вкусомаскирующего покрытия, с получением таким образом ядер с маскированным вкусом, содержащих высокодозовое лекарственное средство;
(7) смешивание микрочастиц со стадии (4), содержащих высокодозовое/низкодозовое лекарственное средство и покрытых ароматизирующим или вкусомаскирующим покрытием, и ядер с маскированным вкусом со стадии (6), содержащих высокодозовое лекарственное средство по меньшей мере с одним фармацевтически приемлемым эксципиентом; и
(8) формование таблетки или капсулы.
(1) изготовление ядер, содержащих высокодозовое лекарственное средство;
(2) нанесение на ядра со стадии (1), содержащие высокодозовое лекарственное средство, покрытия с замедленным высвобождением, содержащего нерастворимый в воде полимер, фармацевтически приемлемый растворитель и возможно пластификатор;
(3) покрытие ядер со стадии (2), содержащих высокодозовое лекарственное средство и покрытых оболочкой с замедленным высвобождением, низкодозовым лекарственным средством, фармацевтически приемлемым растворителем и возможно связующим веществом, посредством чего образуются микрочастицы, содержащие высокодозовое/низкодозовое лекарственное средство;
(4) нанесение на микрочастицы со стадии (3), содержащие высокодозовое/низкодозовое лекарственное средство, вкусомаскирующего покрытия, содержащего нерастворимый в воде полимер и фармацевтически приемлемый растворитель; или ароматизирующего покрытия, содержащего подсластитель, фармацевтически приемлемый растворитель и возможно связующее вещество;
(5) изготовление ядер второй совокупности частиц, содержащих высокодозовое лекарственное средство, где ядра со стадий (1) и (5), содержащие высокодозовое лекарственное средство, являются такими же или отличаются;
(6) нанесение на ядра второй совокупности со стадии (5), содержащие высокодозовое лекарственное средство, вкусомаскирующего покрытия, с получением таким образом ядер с маскированным вкусом, содержащих высокодозовое лекарственное средство;
(7) смешивание микрочастиц со стадии (4), содержащих высокодозовое/низкодозовое лекарственное средство и покрытых ароматизирующим или вкусомаскирующим покрытием, и ядер с маскированным вкусом со стадии (6), содержащих высокодозовое лекарственное средство по меньшей мере с одним фармацевтически приемлемым эксципиентом; и
(8) формование таблетки или капсулы.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US17478809P | 2009-05-01 | 2009-05-01 | |
| US17478009P | 2009-05-01 | 2009-05-01 | |
| US61/174,780 | 2009-05-01 | ||
| US61/174,788 | 2009-05-01 | ||
| PCT/US2010/033389 WO2010127345A2 (en) | 2009-05-01 | 2010-05-03 | Orally disintegrating tablet compositions comprising combinations of high and low-dose drugs |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2011145432A RU2011145432A (ru) | 2013-06-10 |
| RU2554740C2 true RU2554740C2 (ru) | 2015-06-27 |
Family
ID=43032597
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2011145433/15A RU2567032C2 (ru) | 2009-05-01 | 2010-05-03 | Перорально распадающиеся таблеточные композиции, содержащие комбинации неопиоидных и опиоидных анальгетиков |
| RU2011145432/15A RU2554740C2 (ru) | 2009-05-01 | 2010-05-03 | Композиции перорально распадающихся таблеток, содержащие комбинации высоко- и низкодозовых лекарственных средств |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2011145433/15A RU2567032C2 (ru) | 2009-05-01 | 2010-05-03 | Перорально распадающиеся таблеточные композиции, содержащие комбинации неопиоидных и опиоидных анальгетиков |
Country Status (14)
| Country | Link |
|---|---|
| US (2) | US20100330150A1 (ru) |
| EP (2) | EP2424365A4 (ru) |
| JP (2) | JP5845172B2 (ru) |
| KR (2) | KR101752014B1 (ru) |
| CN (3) | CN106390129A (ru) |
| AR (2) | AR076540A1 (ru) |
| AU (2) | AU2010242749B2 (ru) |
| BR (1) | BRPI1007636A2 (ru) |
| CA (2) | CA2760615A1 (ru) |
| MX (2) | MX2011011480A (ru) |
| RU (2) | RU2567032C2 (ru) |
| TW (2) | TW201041607A (ru) |
| WO (2) | WO2010127346A1 (ru) |
| ZA (2) | ZA201108780B (ru) |
Families Citing this family (58)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7201920B2 (en) | 2003-11-26 | 2007-04-10 | Acura Pharmaceuticals, Inc. | Methods and compositions for deterring abuse of opioid containing dosage forms |
| US8852638B2 (en) | 2005-09-30 | 2014-10-07 | Durect Corporation | Sustained release small molecule drug formulation |
| CN101801415B (zh) | 2007-05-25 | 2015-09-23 | Rb医药品有限公司 | 利培酮化合物的持续递送制剂 |
| TW201041607A (en) * | 2009-05-01 | 2010-12-01 | Eurand Inc | Orally disintegrating tablet compositions comprising combinations of non-opioid and opioid analgesics |
| CA2775890C (en) | 2009-09-30 | 2016-06-21 | Acura Pharmaceuticals, Inc. | Methods and compositions for deterring abuse |
| NZ600123A (en) * | 2009-11-30 | 2015-04-24 | Aptalis Pharmatech Inc | Compressible-coated pharmaceutical compositions and tablets and methods of manufacture |
| WO2011114213A1 (en) * | 2010-03-15 | 2011-09-22 | Inventia Healthcare Private Limited | Stabilized prolonged release pharmaceutical composition comprising atypical antipsychotic |
| US9272044B2 (en) | 2010-06-08 | 2016-03-01 | Indivior Uk Limited | Injectable flowable composition buprenorphine |
| GB2481017B (en) | 2010-06-08 | 2015-01-07 | Rb Pharmaceuticals Ltd | Microparticle buprenorphine suspension |
| PT2593081E (pt) * | 2010-07-15 | 2014-06-11 | Tedec Meiji Farma S A | Composição de comprimido à base de ferrimanitol ovalbumina |
| KR20120135063A (ko) * | 2011-06-01 | 2012-12-12 | 닛토덴코 가부시키가이샤 | 입자 제제 및 그 제조 방법 |
| US20150238615A1 (en) * | 2011-12-12 | 2015-08-27 | Leonard Mackles | Denaturants for sympathomimetic amines |
| US10105330B2 (en) * | 2012-01-04 | 2018-10-23 | Wellesley Pharmaceuticals, Llc | Extended, delayed and immediate release formulation method of manufacturing and use thereof |
| PL2833880T3 (pl) * | 2012-04-02 | 2018-03-30 | Pharma Seeds Create, Llc | Stała doustna kompozycja dawkowana ibuprofenu zawierająca kopolimer kwasu metakrylowego |
| US9301016B2 (en) * | 2012-04-05 | 2016-03-29 | Facebook, Inc. | Sharing television and video programming through social networking |
| KR101397343B1 (ko) * | 2012-06-12 | 2014-05-19 | 씨제이제일제당 (주) | 메트포르민 및 HMG―CoA 환원효소 억제제를 포함하는 약제학적 복합제제 |
| KR20140013436A (ko) * | 2012-07-24 | 2014-02-05 | 한미약품 주식회사 | 메트포르민 및 로수바스타틴을 포함하는 경구용 복합 제제 |
| US8993041B2 (en) * | 2012-10-15 | 2015-03-31 | New Jersey Institute Of Technology | Taste masked active pharmaceutical powder compositions and processes for making them |
| EP3446685A1 (en) * | 2012-11-30 | 2019-02-27 | Acura Pharmaceuticals, Inc. | Self-regulated release of active pharmaceutical ingredient |
| US20150005334A1 (en) * | 2013-03-15 | 2015-01-01 | Inspirion Delivery Technologies, Llc | Abuse deterrent compositions and methods of use |
| US20140275149A1 (en) * | 2013-03-15 | 2014-09-18 | Inspirion Delivery Technologies, Llc | Abuse deterrent compositions and methods of use |
| KR102240429B1 (ko) * | 2013-05-06 | 2021-04-15 | 한미약품 주식회사 | 로수바스타틴 또는 이의 약학적으로 허용되는 염이 함유된 필름 코팅층을 포함하는 복합 제형 |
| WO2014182003A1 (en) * | 2013-05-06 | 2014-11-13 | Hanmi Pharm. Co., Ltd. | Composite formulation comprising a film coating layer containing rosuvastatin or a pharmaceutically acceptable salt thereof |
| JP6466417B2 (ja) * | 2013-05-29 | 2019-02-06 | グリュネンタール・ゲゼルシャフト・ミト・ベシュレンクテル・ハフツング | 二峰性放出プロファイルを有する改変防止(tamper−resistant)剤形 |
| WO2015023675A2 (en) | 2013-08-12 | 2015-02-19 | Pharmaceutical Manufacturing Research Services, Inc. | Extruded immediate release abuse deterrent pill |
| KR101639692B1 (ko) | 2013-12-13 | 2016-07-14 | 제일약품주식회사 | 2 이상의 유효성분을 포함하는 구강 내 속붕해 다중유닛 약제학적 조성물 |
| EP3082471B1 (en) * | 2013-12-16 | 2017-10-04 | Massachusetts Institute Of Technology | Fortified micronutrient salt formulations |
| US10172797B2 (en) | 2013-12-17 | 2019-01-08 | Pharmaceutical Manufacturing Research Services, Inc. | Extruded extended release abuse deterrent pill |
| US9492444B2 (en) | 2013-12-17 | 2016-11-15 | Pharmaceutical Manufacturing Research Services, Inc. | Extruded extended release abuse deterrent pill |
| EP3106152B1 (en) * | 2014-02-12 | 2021-02-17 | Sawai Pharmaceutical Co., Ltd. | Orally disintegrating tablet coated with film |
| GB201404139D0 (en) | 2014-03-10 | 2014-04-23 | Rb Pharmaceuticals Ltd | Sustained release buprenorphine solution formulations |
| EP3122336A4 (en) | 2014-03-26 | 2017-10-25 | Sun Pharma Advanced Research Company Ltd | Abuse deterrent immediate release biphasic matrix solid dosage form |
| US20180104197A9 (en) * | 2014-05-01 | 2018-04-19 | Sun Pharmaceutical Industries Limited | Extended release liquid compositions of metformin |
| US10258583B2 (en) | 2014-05-01 | 2019-04-16 | Sun Pharmaceutical Industries Limited | Extended release liquid compositions of guanfacine |
| RU2016147009A (ru) | 2014-05-01 | 2018-06-04 | Сан Фармасьютикал Индастриз Лимитед | Композиции с пролонгированным высвобождением в виде суспензии |
| US9962336B2 (en) | 2014-05-01 | 2018-05-08 | Sun Pharmaceutical Industries Limited | Extended release suspension compositions |
| US9707184B2 (en) | 2014-07-17 | 2017-07-18 | Pharmaceutical Manufacturing Research Services, Inc. | Immediate release abuse deterrent liquid fill dosage form |
| EP3174515A4 (en) | 2014-07-30 | 2018-03-21 | Sun Pharmaceutical Industries Limited | Dual-chamber pack |
| US9132096B1 (en) * | 2014-09-12 | 2015-09-15 | Alkermes Pharma Ireland Limited | Abuse resistant pharmaceutical compositions |
| US10354090B2 (en) * | 2014-10-02 | 2019-07-16 | Trunomi Ltd. | Systems and methods for context-based permissioning of personally identifiable information |
| US20160106737A1 (en) | 2014-10-20 | 2016-04-21 | Pharmaceutical Manufacturing Research Services, Inc. | Extended Release Abuse Deterrent Liquid Fill Dosage Form |
| US11103581B2 (en) | 2015-08-31 | 2021-08-31 | Acura Pharmaceuticals, Inc. | Methods and compositions for self-regulated release of active pharmaceutical ingredient |
| JP6775155B2 (ja) * | 2015-09-14 | 2020-10-28 | 日本新薬株式会社 | 錠剤 |
| WO2017064815A1 (ja) * | 2015-10-16 | 2017-04-20 | 持田製薬株式会社 | 低用量薬物を含有する口腔内崩壊錠 |
| MX2018008004A (es) * | 2015-12-28 | 2019-03-28 | Ssp Co Ltd Japan | Preparacion farmaceutica compactada. |
| JP6812104B2 (ja) * | 2015-12-28 | 2021-01-13 | エスエス製薬株式会社 | 経口固形組成物 |
| US10369078B2 (en) | 2016-05-02 | 2019-08-06 | Sun Pharmaceutical Industries Limited | Dual-chamber pack for pharmaceutical compositions |
| US10238803B2 (en) | 2016-05-02 | 2019-03-26 | Sun Pharmaceutical Industries Limited | Drug delivery device for pharmaceutical compositions |
| CN106619696A (zh) * | 2016-11-17 | 2017-05-10 | 郑州郑先医药科技有限公司 | 一种降血糖的复方制剂 |
| US20180256515A1 (en) | 2017-03-10 | 2018-09-13 | Adare Pharmaceuticals, Inc. | Oral amphetamine composition |
| CN107224439A (zh) * | 2017-06-13 | 2017-10-03 | 江苏黄河药业股份有限公司 | 一种用于治疗过敏性疾病的氯雷他定口腔崩解片及其制备方法 |
| WO2019131891A1 (ja) * | 2017-12-28 | 2019-07-04 | 大日本住友製薬株式会社 | 苦味がマスキングされた薬物含有粒子及び該薬物含有粒子を含む製剤 |
| CN111698980A (zh) * | 2018-02-06 | 2020-09-22 | 3M创新有限公司 | 具有多孔或中空的芯和pH敏感性壳的微胶囊及其用途 |
| CN110840850B (zh) * | 2018-07-24 | 2023-03-17 | 烟台药物研究所 | 一种高生物利用度的塞来昔布冻干口崩片及其制备方法 |
| CN109701461B (zh) * | 2018-10-25 | 2021-06-08 | 西南交通大学 | 一种基于PEG/Dex双水相的碳酸钙/海藻酸钙复合微囊的制备及其应用 |
| CN109776873B (zh) * | 2018-12-12 | 2020-10-27 | 华南理工大学 | 乳液溶剂挥发法制备大孔聚合物微球 |
| FR3093419B1 (fr) * | 2019-03-08 | 2021-06-18 | Univ Grenoble Alpes | Composition et procédé associé de mesure de l’observance thérapeutique |
| WO2023095183A1 (en) * | 2021-11-24 | 2023-06-01 | Jordan University Of Science And Technology | A pharmaceutical composition and a solid dosage form thereof |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6210714B1 (en) * | 1993-11-23 | 2001-04-03 | Euro-Celtique S.A. | Immediate release tablet cores of acetaminophen having sustained-release coating |
Family Cites Families (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4891223A (en) * | 1987-09-03 | 1990-01-02 | Air Products And Chemicals, Inc. | Controlled release delivery coating formulation for bioactive substances |
| DE3826846A1 (de) * | 1988-08-06 | 1990-02-08 | Goedecke Ag | Alkoxy-4(1h)-pyridon-derivate, verfahren zu deren herstellung und deren verwendung als arzneimittel |
| GB9117361D0 (en) * | 1991-08-12 | 1991-09-25 | Euro Celtique Sa | Oral dosage form |
| US5500227A (en) * | 1993-11-23 | 1996-03-19 | Euro-Celtique, S.A. | Immediate release tablet cores of insoluble drugs having sustained-release coating |
| EP1017390B1 (en) * | 1997-07-31 | 2007-04-18 | Kos Life Sciences, Inc. | Coated tablet comprising nicotinic acid or a compound metabolized to nicotinic acid in an extended release form, and a coating containing an hmg-coa reductase inhibitor in an immediate release form |
| RS49982B (sr) | 1997-09-17 | 2008-09-29 | Euro-Celtique S.A., | Sinergistička analgetička kombinacija analgetičkog opijata i inhibitora ciklooksigenaze-2 |
| US6485747B1 (en) | 1998-10-30 | 2002-11-26 | Monsanto Company | Coated active tablet(s) |
| AU2001257456B2 (en) * | 2000-05-01 | 2006-02-09 | Aeropharm Technology, Inc. | A core formulation |
| EP1306127B2 (en) * | 2001-10-26 | 2011-09-07 | OctoPlus PolyActive Sciences B.V. | Method for the preparation of purified microparticles |
| EP1350512A1 (en) * | 2002-04-03 | 2003-10-08 | BOEHRINGER INGELHEIM INTERNATIONAL GmbH | Combinations of epinastine, belladonna and pseudoephedrine as new pharmaceutical formulations |
| JP5241059B2 (ja) * | 2002-05-09 | 2013-07-17 | オンコリティクス バイオテク,インコーポレーテッド | 腫瘍崩壊ウイルスを使用して疼痛を軽減するための方法 |
| FR2850576B1 (fr) * | 2003-02-05 | 2007-03-23 | Ethypharm Sa | Composition comprenant un melange de principes actifs, et procede de preparation |
| FR2855756B1 (fr) * | 2003-06-06 | 2005-08-26 | Ethypharm Sa | Comprime orodispersible multicouche |
| US8263126B2 (en) * | 2003-06-06 | 2012-09-11 | Ethypharm | Orally-dispersible multilayer tablet |
| US7387793B2 (en) * | 2003-11-14 | 2008-06-17 | Eurand, Inc. | Modified release dosage forms of skeletal muscle relaxants |
| TW200616604A (en) * | 2004-08-26 | 2006-06-01 | Nicholas Piramal India Ltd | Nitric oxide releasing prodrugs containing bio-cleavable linker |
| US8541026B2 (en) * | 2004-09-24 | 2013-09-24 | Abbvie Inc. | Sustained release formulations of opioid and nonopioid analgesics |
| CN100404025C (zh) * | 2005-01-14 | 2008-07-23 | 信谊药厂 | 含有盐酸曲马多和对乙酰氨基酚的口崩片及其制备方法 |
| AU2007280471B2 (en) * | 2006-08-04 | 2012-10-18 | Ethypharm | Multilayer orally disintegrating tablet |
| EP2046285B1 (en) * | 2006-08-04 | 2018-02-21 | Ethypharm | Granule and orally disintegrating tablet comprising oxycodone |
| CN101352425B (zh) * | 2007-07-27 | 2010-11-10 | 鲁南制药集团股份有限公司 | 一种复方渗透泵控释制剂及其制备方法 |
| TW201041607A (en) * | 2009-05-01 | 2010-12-01 | Eurand Inc | Orally disintegrating tablet compositions comprising combinations of non-opioid and opioid analgesics |
-
2010
- 2010-05-03 TW TW099114102A patent/TW201041607A/zh unknown
- 2010-05-03 MX MX2011011480A patent/MX2011011480A/es not_active Application Discontinuation
- 2010-05-03 EP EP10770482A patent/EP2424365A4/en not_active Withdrawn
- 2010-05-03 CN CN201610815678.4A patent/CN106390129A/zh active Pending
- 2010-05-03 CA CA2760615A patent/CA2760615A1/en not_active Abandoned
- 2010-05-03 AU AU2010242749A patent/AU2010242749B2/en not_active Ceased
- 2010-05-03 KR KR1020117028537A patent/KR101752014B1/ko active IP Right Grant
- 2010-05-03 JP JP2012508818A patent/JP5845172B2/ja not_active Expired - Fee Related
- 2010-05-03 CN CN201080028794.2A patent/CN102458117B/zh not_active Expired - Fee Related
- 2010-05-03 AR ARP100101500A patent/AR076540A1/es unknown
- 2010-05-03 KR KR1020117028540A patent/KR20120031002A/ko not_active Application Discontinuation
- 2010-05-03 CA CA2760614A patent/CA2760614A1/en not_active Abandoned
- 2010-05-03 MX MX2011011478A patent/MX345942B/es active IP Right Grant
- 2010-05-03 AR ARP100101499A patent/AR076835A1/es unknown
- 2010-05-03 BR BRPI1007636-0A patent/BRPI1007636A2/pt not_active IP Right Cessation
- 2010-05-03 CN CN2010800285970A patent/CN102458360A/zh active Pending
- 2010-05-03 US US12/772,770 patent/US20100330150A1/en not_active Abandoned
- 2010-05-03 RU RU2011145433/15A patent/RU2567032C2/ru not_active IP Right Cessation
- 2010-05-03 WO PCT/US2010/033392 patent/WO2010127346A1/en active Application Filing
- 2010-05-03 EP EP10770481A patent/EP2424504A4/en not_active Withdrawn
- 2010-05-03 AU AU2010242748A patent/AU2010242748B2/en not_active Ceased
- 2010-05-03 TW TW099114104A patent/TW201041608A/zh unknown
- 2010-05-03 WO PCT/US2010/033389 patent/WO2010127345A2/en active Application Filing
- 2010-05-03 RU RU2011145432/15A patent/RU2554740C2/ru not_active IP Right Cessation
- 2010-05-03 JP JP2012508819A patent/JP5845173B2/ja not_active Expired - Fee Related
- 2010-05-03 US US12/772,776 patent/US9572781B2/en not_active Expired - Fee Related
-
2011
- 2011-11-30 ZA ZA2011/08780A patent/ZA201108780B/en unknown
- 2011-11-30 ZA ZA2011/08781A patent/ZA201108781B/en unknown
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6210714B1 (en) * | 1993-11-23 | 2001-04-03 | Euro-Celtique S.A. | Immediate release tablet cores of acetaminophen having sustained-release coating |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2554740C2 (ru) | Композиции перорально распадающихся таблеток, содержащие комбинации высоко- и низкодозовых лекарственных средств | |
| US10952971B2 (en) | Taste-masked pharmaceutical compositions with gastrosoluble pore-formers | |
| US10568832B2 (en) | Taste-masked pharmaceutical compositions | |
| JP5604304B2 (ja) | 口腔内崩壊性固形製剤 | |
| EP1809251B1 (en) | Taste-masked multiparticulate pharmaceutical compositions comprising a drug-containing core particle and a solvent-coacervated membrane | |
| JP5366558B2 (ja) | 口腔内崩壊性固形製剤 | |
| US20090155360A1 (en) | Orally disintegrating tablets comprising diphenhydramine | |
| JP2014501224A (ja) | 口腔内崩壊錠 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PD4A | Correction of name of patent owner | ||
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20160504 |