RU2124510C1 - Производные аминохинолона, замещенные фенильной или гетероароматической группой - Google Patents
Производные аминохинолона, замещенные фенильной или гетероароматической группой Download PDFInfo
- Publication number
- RU2124510C1 RU2124510C1 RU93035829A RU93035829A RU2124510C1 RU 2124510 C1 RU2124510 C1 RU 2124510C1 RU 93035829 A RU93035829 A RU 93035829A RU 93035829 A RU93035829 A RU 93035829A RU 2124510 C1 RU2124510 C1 RU 2124510C1
- Authority
- RU
- Russia
- Prior art keywords
- group
- formula
- difluoromethoxy
- fluoro
- dihydro
- Prior art date
Links
- 0 CC1C(C(C(C)=**)=O)=C(C)*=C(C)C1* Chemical compound CC1C(C(C(C)=**)=O)=C(C)*=C(C)C1* 0.000 description 3
- DFDPLSJDDWFYCB-UHFFFAOYSA-N C=C(CCC=C1N)C1NC1CCNCC1 Chemical compound C=C(CCC=C1N)C1NC1CCNCC1 DFDPLSJDDWFYCB-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D215/00—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems
- C07D215/02—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom
- C07D215/16—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D215/48—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen
- C07D215/54—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen attached in position 3
- C07D215/56—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen attached in position 3 with oxygen atoms in position 4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/06—Peri-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D513/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00
- C07D513/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00 in which the condensed system contains two hetero rings
- C07D513/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D513/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00
- C07D513/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00 in which the condensed system contains two hetero rings
- C07D513/06—Peri-condensed systems
Abstract
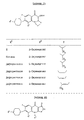
Предложены новые соединения формул Ia или Iс, где Х - атом водорода или галогена; Y - атом водорода или аминогруппа; Z - карбоксильная группа; Q - атом азота или группа формулы: где R2 - водород, галоген, низшая алкоксигруппа или низшая алкоксигруппа, замещенная одним или более атомами галогена; Т - метиленовая группа, необязательно замещенная низшей алкильной группой; R1 - атом водорода, низшая алкенильная группа, низшая алкинильная группа, аминогруппа, необязательно замещенная одной низшей алкильной группой, (C3-С6)-циклоалкил; низшая алкоксигруппа, фенил, необязательно замещенный одним галогеном; низший алкил и т.д.; R - группа формулы (h) или (i). Предложенные соединения обладают антиВИЧ активностью. 21 з.п.ф-лы, 5 ил., 31 табл.
Description
Изобретение относится к новым производным аминохинолона.
СПИД (синдром приобретенного иммунодефицита) вызывается вирусом, который называется вирусом иммунодефицита человека (ВИЧ).
ВИЧ инфицирует главным образом СД4-лимфоциты, генерируемые классом хелпер/индуктор-клетками. Он снижает постепенно число лимфоцитов и вызывает таким образом тяжелый клеточный иммунодефицит. Предпринято много усилий с целью лечения СПИДа, но разработка вакцины является очень трудной задачей, поэтому желательна разработка антивирусных средств. Антивирусные средства, которые разработаны на сегодняшний день, например AZT (азидотимидин), обладающий ингибирующим действием по отношению к обратной транскриптазе, неотъемлемо присущей ВИЧ, оказывают действие, продляющее жизнь, но не могут вылечить полностью. Кроме того, эти ингибирующие средства вызывают множество проблем, таких как сильное побочное действие, выражающееся в нарушениях в костном мозге и в системе пищеварения, и устойчивый или невосприимчивый к действию лекарства вирус часто обнаруживается у пациентов, которым средство назначалось длительное время, вследствие чего желательна разработка новых химических веществ и терапевтического применения составных препаратов в сочетании с ранее разработанными средствами.
Недавно появилось сообщение об антиВИЧ-активности DR-3355, который представляет собой оптический изомер (S-изомер) синтетического антибактериального офлоксацина (ofloxacin), имеющего хинолоновый скелет [J.Nozaki, Renard et al., AIDS, vol, 4, p. 1283 (1990)]. Однако, когда заявители настоящего изобретения изучали ингибирующую клеточные нарушения активность DR-3355 в ВИЧ-инфицированных клетках в соответствии со способом R. Pauwel et al, описанным ниже, они не смогли подтвердить антиВИЧ-активность. Таким же образом исследования заявлений изобретения не смогли подтвердить антиВИЧ-активность норфлоксацина (Norfloxacin), эноксацина (Enoxacin), ципрофлоксацина (Ciprofloxacin), ломефлоксацина (Lomefloxacin), дифлоксацина (Difloxacin) и тозуфлоксацина (Tosufloxacin), хотя об их активности сообщалось в патенте ВОИС 90-13542.
Заявители изобретения открыли серию новых производных хинолона, которые обладают более широкой антибактериальной активностью, чем производные, описанные выше, и более широкой антиВИЧ-активностью. Новые соединения обладают повышенной липофильностью, отсутствием гиаминов, которые замещены ароматической группой, такой как арильная группа, или ароматической гетероциклической группой. Эти вещества, составляющие суть изобретения, способны как подавлять репликацию вируса СПИДа, так и подавлять его цитопатическое влияние (СРЕ) и являются веществами, успешно ингибирующими как репликацию ВИЧ, так и антивирусными препаратами.
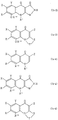
Изобретение относится к соединению аминохинолона, которое изображается формулой (Ia), (Ib) или (Ic)
где X представляет собой атом водорода или атом галогена;
Y представляет собой атом водорода, атом галогена, низшую алкильную группу, аминогруппу, моно- или дизамещенную низшим алкилом аминогруппу или моно- или дизамещенную аралкилом аминогруппу;
Z представляет собой карбоксильную группу, которая может быть защищенной, или 5-тетразолильную группу;
Q представляет собой атом азота или группу, изображаемую формулой (d)
где R2 представляет собой атом водорода, атом галогена или низшую алкоксильную группу, которая может быть замещена атомом/атомами галогена, низшую алкильную группу, которая может быть замещена атомом/атомами галогена;
W представляет собой атом кислорода или атом серы;
T представляет собой C1-C4-алкиленовую группу или C2-C4-алкиленовую группу, эти группы могут быть замещены низшей алкильной группой;
R1 представляет атом водорода, низшую алкенильную группу, которая необязательно может быть замещена одним или более атомами галогена, низшую алкинильную группу, аминогруппу, которая необязательно может быть замещена одной или более низшими алкильными группами, циклоалкильную группу, которая необязательно может быть замещена по крайней мере одним атомом галогена, низшую алкоксильную группу, арильную группу, которая необязательно может замещаться по крайней мере одним заместителем R0, как описано ниже, 5- или 6-членной гетероароматической моноциклической группой, имеющей 1 или 2 гетероатома, выбранных из N, O и S, вышеупомянутое кольцо, не обязательно замещенное по крайней мере одним замещающим R0, как будет описано ниже, конденсированную ароматическую группу, состоящую из бензольного кольца, связанного с 5- или 6-членной гетероароматической моноциклической группой, как описано выше, вышеупомянутую синтетическую группу, необязательно замещенную по крайней мере одним замещающим R0, как описано ниже, низшую алкильную группу, или низшую алкильную группу, замещенную по крайней мере одним заместителем, выбранным из группы: галогеновые атомы, гидроксильная группа, карбоксильные группы, алканоилоксигруппа, циклоалканильные группы, арильная группа, которые необязательно могут замещаться по крайней мере одним замещающим R0, как описано ниже, 5- или 6-членные гетероароматические моноциклические группы, имеющие один или два гетероатома, выбранные из N, O и S, вышеупомянутое кольцо, необязательно замещенное по крайней мере одним замещающим R0, как описано ниже, ароматические группы, как описано выше, конденсированную группу, необязательно замещенную по крайней мере одним заместителем R0, как описано ниже, или аминогруппу, представленную формулой (e):
где R9 и R10 каждый представляет собой атом водорода или низшую алкильную группу, или R9 и R10 вместе с атомом азота, к которому они присоединены, образуют 3-7-членную насыщенную моноциклическую группу, связанную по крайней мере с одним гетероатомом, выбираемым из N, O и S,
R1 и R2 в формуле (d) Q могут быть объединены с образованием группы, представленной формулой (f)
где A представляет собой атом водорода или низшую алкильную группу, которая может быть замещена галогеном, гидроксилом или низшим алкоксилом;
G представляет собой атом азота или группу, представляемую формулой (g)
G1 представляет собой метиленовую группу, карбонильную группу, атом кислорода, атом серы или - N(R11)-, где R11 представляет собой атом водорода, или низшую алкильную группу;
p представляет собой целое число - 0 или 1;
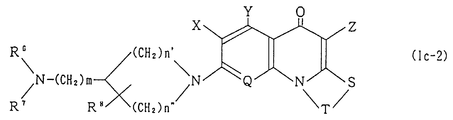
R является группой, представляемой формулами (h) или (i)
где R3 и R6 каждый представляет собой арильную группу, 5- или 6-членную гетероароматическую моноциклическую группу, содержащую один или два гетероатома, выбираемых из N, O, и S, или конденсированную ароматическую гетероциклическую группу, образованную гетероароматической моноциклической группой и бензольным кольцом, причем каждая часть может быть замещена R0;
R0 представляет собой группу, выбираемую из галогена, нитрогруппы, гидроксила, низшего алкила, фторзамещенного низшего алкила, низшего алкоксила, аминогруппы или моно- или ди-(низший алкил) замещенной аминогруппы;
R4, R5 и R7 каждый представляет собой атом водорода или низшую алкильную группу;
R8 представляет собой атом водорода, низшую алкильную группу, гидроксильную группу или низшую алкоксильную группу;
n = 1 или 2;
m = 0 или 1;
n' = 1 или 2;
n'' = 1, 2, 3 или 4,
или к соли соединения, или к сложному эфиру, и к средству для лечения СПИДа, содержащему соединение, изображаемое формулой (Ia) или (Ib), или (Ic), или его сложный эфир в качестве активного ингредиента.
где X представляет собой атом водорода или атом галогена;
Y представляет собой атом водорода, атом галогена, низшую алкильную группу, аминогруппу, моно- или дизамещенную низшим алкилом аминогруппу или моно- или дизамещенную аралкилом аминогруппу;
Z представляет собой карбоксильную группу, которая может быть защищенной, или 5-тетразолильную группу;
Q представляет собой атом азота или группу, изображаемую формулой (d)
где R2 представляет собой атом водорода, атом галогена или низшую алкоксильную группу, которая может быть замещена атомом/атомами галогена, низшую алкильную группу, которая может быть замещена атомом/атомами галогена;
W представляет собой атом кислорода или атом серы;
T представляет собой C1-C4-алкиленовую группу или C2-C4-алкиленовую группу, эти группы могут быть замещены низшей алкильной группой;
R1 представляет атом водорода, низшую алкенильную группу, которая необязательно может быть замещена одним или более атомами галогена, низшую алкинильную группу, аминогруппу, которая необязательно может быть замещена одной или более низшими алкильными группами, циклоалкильную группу, которая необязательно может быть замещена по крайней мере одним атомом галогена, низшую алкоксильную группу, арильную группу, которая необязательно может замещаться по крайней мере одним заместителем R0, как описано ниже, 5- или 6-членной гетероароматической моноциклической группой, имеющей 1 или 2 гетероатома, выбранных из N, O и S, вышеупомянутое кольцо, не обязательно замещенное по крайней мере одним замещающим R0, как будет описано ниже, конденсированную ароматическую группу, состоящую из бензольного кольца, связанного с 5- или 6-членной гетероароматической моноциклической группой, как описано выше, вышеупомянутую синтетическую группу, необязательно замещенную по крайней мере одним замещающим R0, как описано ниже, низшую алкильную группу, или низшую алкильную группу, замещенную по крайней мере одним заместителем, выбранным из группы: галогеновые атомы, гидроксильная группа, карбоксильные группы, алканоилоксигруппа, циклоалканильные группы, арильная группа, которые необязательно могут замещаться по крайней мере одним замещающим R0, как описано ниже, 5- или 6-членные гетероароматические моноциклические группы, имеющие один или два гетероатома, выбранные из N, O и S, вышеупомянутое кольцо, необязательно замещенное по крайней мере одним замещающим R0, как описано ниже, ароматические группы, как описано выше, конденсированную группу, необязательно замещенную по крайней мере одним заместителем R0, как описано ниже, или аминогруппу, представленную формулой (e):
где R9 и R10 каждый представляет собой атом водорода или низшую алкильную группу, или R9 и R10 вместе с атомом азота, к которому они присоединены, образуют 3-7-членную насыщенную моноциклическую группу, связанную по крайней мере с одним гетероатомом, выбираемым из N, O и S,
R1 и R2 в формуле (d) Q могут быть объединены с образованием группы, представленной формулой (f)
где A представляет собой атом водорода или низшую алкильную группу, которая может быть замещена галогеном, гидроксилом или низшим алкоксилом;
G представляет собой атом азота или группу, представляемую формулой (g)
G1 представляет собой метиленовую группу, карбонильную группу, атом кислорода, атом серы или - N(R11)-, где R11 представляет собой атом водорода, или низшую алкильную группу;
p представляет собой целое число - 0 или 1;
R является группой, представляемой формулами (h) или (i)
где R3 и R6 каждый представляет собой арильную группу, 5- или 6-членную гетероароматическую моноциклическую группу, содержащую один или два гетероатома, выбираемых из N, O, и S, или конденсированную ароматическую гетероциклическую группу, образованную гетероароматической моноциклической группой и бензольным кольцом, причем каждая часть может быть замещена R0;
R0 представляет собой группу, выбираемую из галогена, нитрогруппы, гидроксила, низшего алкила, фторзамещенного низшего алкила, низшего алкоксила, аминогруппы или моно- или ди-(низший алкил) замещенной аминогруппы;
R4, R5 и R7 каждый представляет собой атом водорода или низшую алкильную группу;
R8 представляет собой атом водорода, низшую алкильную группу, гидроксильную группу или низшую алкоксильную группу;
n = 1 или 2;
m = 0 или 1;
n' = 1 или 2;
n'' = 1, 2, 3 или 4,
или к соли соединения, или к сложному эфиру, и к средству для лечения СПИДа, содержащему соединение, изображаемое формулой (Ia) или (Ib), или (Ic), или его сложный эфир в качестве активного ингредиента.
Следующее далее объясняет изобретение подробно.
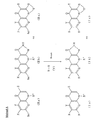
Соединения, представленные формулами (Ia), Ib) и (Ic), включают соединения, представляемые формулами (Ia-1), (Ib-1) и (Ic-1), и формулами (Ia-2) и (Ib-2) и (Ic-2) (см. в конце описания), где X, Y, Z, W, Q, T, R1, R3 - R8, m, n, n' и n'' (каждый) имеют те же значения, которые установлены выше.
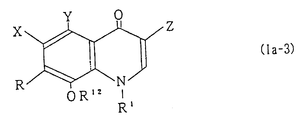
Кроме того, в качестве соединений формул (Ia), (Ib) и (Ic) в числе предпочтительных могут быть упомянуты соединения формул (Ia-3), (Ib-3) и (Ic-3), формул (Ia-4), (Ib-4) и (Ic-4), формул (Ia-5), (Ib-5) и (Ic-5), и формул (Ia-6) и (Ia-7) (см. в конце описания),
где A, X, Y, Z, W, R, T и R1 (каждый) имеют те же значения, которые установлены выше;
-OR12 представляет собой низшую алкоксигруппу, которая может быть замещена атомом (атомами) фтора, в частности дифторметоксигруппу;
R13 представляет собой атом водорода, атом галогена или низшую алкильную группу, которая может быть замещена атомом (атомами) фтора;
A представляет собой атом водорода или низшую алкильную группу, которая может быть замещена атомом (атомами) галогена.
где A, X, Y, Z, W, R, T и R1 (каждый) имеют те же значения, которые установлены выше;
-OR12 представляет собой низшую алкоксигруппу, которая может быть замещена атомом (атомами) фтора, в частности дифторметоксигруппу;
R13 представляет собой атом водорода, атом галогена или низшую алкильную группу, которая может быть замещена атомом (атомами) фтора;
A представляет собой атом водорода или низшую алкильную группу, которая может быть замещена атомом (атомами) галогена.
В изобретении предпочтительными являются соединения, представляемые формулами (Ia-3), (Ib-3), (Ic-3) и (Ia-6), и особенно предпочтительными являются соединения, представляемые формулой (Ia-3) и формулой (Ia-6), в которых A' представляет низшую алкильную группу, замещенную атомом (атомами) фтора.
Когда X означает атом галогена в формулах (Ia), (Ib) и (Ic), можно упомянуть фтор, хлор, бром и иод, и предпочтительно, когда X представляет собой водород, фтор или хлор, особенно предпочтительны фтор или хлор и наиболее предпочтителен фтор.
В качестве значений Y в формулах (Ia), (Ib) и (Ic), можно упомянуть атом водорода, атом галогена, такой как атом фтора, хлора, брома и иода, C1-C4-алкильную группу с прямой или разветвленной цепью, такую как метильную, этильную, пропильную, изопропильную, бутильную и изобутильную, аминогруппу, моно C1-C4-алкилзамещенную аминогруппу, такую как метиламино-, этиламино-, пропиламино-, изопропиламино- и бутиламиногруппу, ди(C1- C4)-алкилзамещенную аминогруппу, такую как диметиламино-, диэтиламино-, дирпопиламино-, диизопропиламино- и дибутиламиногруппу, моноаралкиламиногруппу, такую как бензиламино- и фенилэтиламиногруппу, и диаралкиламиногруппу, такую как дибензиламиногруппу.
Y предпочтительно представляет собой водород, фтор, аминогруппу, метил или этил, особенно предпочтительны водород, фтор, аминогруппа или метил, наиболее предпочтителен водород.
В качестве значений Z в формулах (Ia) и (Ic) можно упомянуть карбоксильную группу, которая может быть защищена, или 5-тетразолильную группу. В качестве защитной группы для карбоксильной группы можно упомянуть C1-C4-алкил, аралкил, C1-C4-алканоилоксиалкил, C1-C4-алкоксикарбонилоксиалкил, N,N-диалкилзамещенный аминокарбонилалкил, N,N-диалкилзамещенный аминоалкил, алкил, замещенный 5- или 6-членной насыщенной моноциклической группой, содержащей один или два гетероатома, выбираемых из N, O и S, и (5-метил- или 5-фенил-2-оксо-1,3-диоксолен-4-ил)метил. В качестве Z предпочтительной является карбоксильная группа, которая может быть защищенной.
В формуле (Ib) W представляет собой атом кислорода или атом серы, особенно предпочтителен атом серы.
В качестве T в формуле (Ic) можно упомянуть C1-C4-алкиленовую группу, которая может быть замещена C1-C4-алкилом, такую как метилен, этилиден, -CH(CH3)-, этилен, триметилен, пропилен и тетраметилен, или C2-C4-алкиленовую группу, которая может быть замещена C1-C4-алкилом, такую как -CH=CH- и -C(CH3)= CH-. Предпочтительно, T представляет собой этилиден, =CH=CH- или -C(CH3)=CH-, особенно предпочтителен этилиден.
В качестве галогена, представленного R2 в формуле (d), представленной Q в вышеприведенных формулах (Ia), (Ib) и (Ic), можно упомянуть фтор, хлор, бром и иод, предпочтителен фтор или хлор.
В качестве низшей алкильной группы, в которой заместителем(ями) может (могут) быть атом(ы) фтора, изображаемой R2, можно упомянуть C1-C4-алкилгруппу, такую как метил-, этил-, пропил-, изопропил- и бутил-, или фторзамещенную C1-C4-(низший алкил)группу, такую как фторметил-, дифторметил-, трифторметил-, 2-фторэтил-, 3-фторпропил- и 4-фторбутилгруппу, и предпочтительными являются метил- и трифторметилгруппы.
В качестве низшей алкоксигруппы, которая может быть замещена атомом (атомами) фтора, представленной R2, можно упомянуть C1-C4-алкоксигруппу, такую как метокси-, этокси-, пропокси-, изопропокси- и бутоксигруппу, или фторзамещенную C1-C4-алкоксигруппу, такую как фторметокси-, дифторметокси-, трифторметокси-, 2-фторэтокси-, 2- или 3-фторпропокси- и 4-фторбутоксигруппу, предпочтительны метокси-, этокси-, моно-, ди- или трифторметокси- или 2-фторэтоксигруппы, особенно предпочтительны метокси- и моно-, ди- или трифторметоксигруппы и наиболее предпочтительны метокси- или дифторметоксигруппы.
R2 предпочтительно представляет собой водород, атом галогена, такого как фтор или хлор, низшую алкильную группу, которая может быть замещена атомом фтора, такую как метил- и трифторметилгруппу, низшую алкоксигруппу, которая может быть замещена атомом фтора, такую как метокси-, этокси-, фторметокси-, дифторметокси-, трифторметокси- или 2-фторэтоксигруппу, особенно предпочтительна метоксигруппа, которая может быть замещена атомом (атомами) фтора. Кроме того, в случае формулы (Ia) соединение, в котором R2 представляет собой метоксигруппу или дифторметоксигруппу, является наиболее предпочтительным.
Низшая алкил/алкоксигруппа, включающая не более чем 6 атомов углерода, является более предпочтительной, чем включающая 4, и особенно 1, 2 или 3 атома углерода.
В изобретении отличительная особенность соединений, изображенных формулами (Ia), (Ib) и (Ic), состоит в том, что R в формулах представляет собой группу, изображаемую формулой (h) или (i), и к атому азота привязана упомянутая выше арильная группа или ароматическая гетероциклическая группа R3 или R6, каждая из которых может быть замещена R0.
В формуле (h) n предпочтительно равен 1. В формуле (i) сумма n' и n'' предпочтительно составляет 3, 4 или 5 и особенно предпочтительно 3 или 4. Предпочтительно, чтобы m = 0.
В формулах (h) и (i) арильная группа, изображенная R3 или R6, может включать фенильную и нафтильную группу, и гетероароматическая и моноциклическая или конденсированная гетероциклическая группа (далее называемая здесь "ароматическая гетероциклическая группа") могут включать такие радикалы, как 2-тиенил, 2-фурил, 2-оксазолил, 2-тиазолил, 2-имидазолил, 2-, 3- или 4-пиридил, 2-, 4- или 5-пиримидинид, 2-пиразинил, 3-пиридазинил, 2-бензоксазолил, 2-бензотиазолил, и 2-бензимидазолил.
В качестве заместителя R0, вводимого в арильную или ароматическую гетероциклическую группы, могут быть упомянуты атом галогена, такого как фтор, хлор, бром и иод, нитрогруппа, гидроксильная группа, C1-C4-алкильная группа с прямой или разветвленной цепью, такая как метильная, этильная, пропильная, изопропильная, бутильная, втор-бутильная, изобутильная и трет-бутильная группа, фторзамещенная C1-C4-алкильная группа, такая как моно-, ди- или трифторметильная группа, 2-фторэтильная, 2- или 3-фторпропильная и 2-, 3- или 4-фторбутильная группа, C1-C4-алкоксигруппа, такая как метокси-, этокси-, пропокси-, изопропокси- и бутоксигруппа, аминогруппа, моно-(C1-C4)-алкилзамещенная аминогруппа, такая как метиламино-, этиламино-, пропиламино-, изопропиламино-, бутиламино-, изобутиламино-, втор-бутиламино- и трет-бутиламиногруппа, и ди(C1-C4)-алкилзамещенная аминогруппа, такая как диметиламино-, диэтиламино-, дипропиламино-, диизопропиламино-, дибутиламино-, диизобутиламино- и этил(метил)аминогруппа.
В качестве R3 и R6 предпочтительной является ароматическая гетероциклическая группа, которая может быть замещена R0, как упоминалось выше, и особенно предпочтителен случай, когда R изображается формулой (h), и R3 в формуле (h) является ароматической гетероциклической группой, которая может быть замещена R0. При этом особенно предпочтительно, когда R3 представляет собой 5- или 6-членную гетеромоноциклическую группу, содержащую 1 или 2 атома азота, которая может быть замещена R0. Также предпочтительно, когда R3 представляет собой пиридильную группу, пиразинильную группу или пиримидинильную группу, которые могут быть замещены R0, и особенно предпочтительно, когда R3 представляет собой 2-пиримидинильную группу.
Также предпочтительным является соединение, в котором R изображается формулой (h), и R3 в формуле (h) представляет собой фенильную группу, замещенную R0, упомянутым выше.
В качестве R3 можно предпочтительно упомянуть фенил, 2-пиридил, 2-пиразинил, 2- или 4-пиримидинил, диметокси-2-пиримидинил, 2-тиазолил, 2-бензоксазолил, 2-бензотиазолил, фенил, замещенный фтором, хлором, метоксилом, нитрогруппой, трифторметилом, амино- или диметиламиногруппой в положении 2, 3 или 4, метокси-, амино- или нитрозамещенный 2-пиридил, и хлор-, метил- или этилзамещенный 2- или 4-пиримидинил, особенно предпочтительными являются фенил, 2-пиридил, 2-пиразинил, 2- или 4-пиримидинил, 2-тиазолил, фенил, замещенный фтором, хлором, метокси-, нитрогруппой, трифторметилом, амино- или диметиламиногруппой в положении 2-, 3- или 4, метокси- или нитрозамещенный 2-пиридил, или хлор-, метил- или этилзамещенный 2- или 4-пиримидинил.
Наиболее предпочтительно R представляет собой 4-(2-пиримидинил)пиперазин-1-ил.
В формулах (h) и (i) низшая алкильная группа, изображаемая R4, R5 или R7, может включать C1-C4-алкильную группу, такую как метильная, этильная, пропильная, изопропильная, бутильная, изобутильная и третбутильная группа, предпочтительно метильную или этильную группу.
В формуле (i) низшая алкильная группа, изображаемая R8, может включать C1-C4-алкильную группу с прямой или разветвленной цепью, такую как метильная, этильная, пропильная, изопропильная, бутильная, изобутильная и трет-бутильная группа, более предпочтительно - метильную или этильную группу.
В формуле (i) низшая алкоксильная группа, изображаемая R8, может включать C1-C4-алкоксигруппу такую, как метокси-, этокси-, пропокси-, изопропокси- и бутоксигруппу, предпочтительно - метокси-, этокси- или пропоксигруппу.
R4, R5 и R7 предпочтительно представляют собой атомы водорода, метил, этил, пропил или изопропил, особенно предпочтительно - атомы водорода, метил или этил.
R8 предпочтительно представляет собой атом водорода, гидроксильную группу, метил, этил, пропил, изопропил, метоксил, этоксил или пропоксил, особенно предпочтительно - атом водорода, гидроксильную группу, метил, этил, метоксил или этоксил.
В формулах (Ia) и (Ib) низшая алкильная группа и низшая алкоксильная группа, изображаемые R1, могут включать ту же самую C1-C4-алкильную группу с прямой или разветвленной цепью, которая упомянута в качестве низшей алкильной группы, изображаемой вышеупомянутым R8, и ту же самую C1-C4-алкоксильную группу, которая упомянута в качестве низшей алкоксильной группы, изображаемой упомянутым выше R8.
В качестве низшей алкильной группы, содержащей заместитель(и), изображенный(е) упомянутым выше R1, можно назвать гидрокси-(C1-C4)-алкильную группу, такую как 2-оксиэтильную, 2- или 3-оксипропильную, 2-, 3- или 4-оксибутильную группы, карбокси-(C1-C4)-алкильную группу, такую как карбоксиметильную, 1- или 2-карбоксиэтильную, 1- или 3-карбоксипропильную, 1-карбоксибутильную и 1-карбокси-2-оксиэтильную группы; галоидзамещенную C1-C4-алкильную группу, такую как фтор-, хлор-, бром- или иодметильную группу, 2-(фтор-, хлор-, бром- или иод)этильную группу, 2- или 3-(фтор-, хлор-, бром- или иод)-пропильную группу, 2-, 3- или 4-(фтор-, хлор-, бром- или иод)бутильную группу, дифторметильную, трифторметильную и 2,2,2-трифторэтильную группу, C3-C6-циклоалкил-(C1-C4)-алкильную группу, такую как циклопропилметильную, циклобутилметильную, циклопентилметильную, циклогексилметильную, циклопропилэтильную, циклопропилпропильную и циклопропилбутильную группы, C1-C4-алканоилоксил-(C1-C4)-алкилгруппу, такую как 2-ацетоксиэтильную, 2- или 3-ацетоксипропильную, 2-, 3- или 4-ацетоксибутильную, 2-пропионилоксиэтильную и 2-бутирилоксиэтильную группы, C1-C4-алкильную группу, замещенную той же арильной группой или ароматической-гетероциклической группой, которые упоминались в качестве примеров R3 и R6 в вышеупомянутых формулах (h) и (i), или C1-C4-алкильную группу с заместителем, упомянутым выше для формулы (e).
Низшая алкильная группа, изображаемая R9 или R10 в формуле (e), может включать ту же C1-C4-алкильную группу с прямой или разветвленной цепью, которая упоминалась в качестве низшей алкильной группы, изображаемой R8, и насыщенная гетеромоноциклическая группа, образованная R9 и R10 в сочетании в формуле (e), может включать каждую группу из числа азиридино-, азетидино-, пирролидино-, пиперидино-, морфолино-, тиоморфолино- и пиперазиногруппы.
В качестве моно- или дизамещенной низшим алкилом аминогруппы, изображаемой вышеприведенным R1, можно упомянуть моно-(C1-C4)-алкиламиногруппу, такую как метиламино-, этиламино-, пропиламино-, изопропиламино- и бутиламиногруппу, и ди-(C1-C4)-алкиламиногруппу, такую как диметиламино-, диэтиламино-, дипропиламино-, диизопропиламино- и дибутиламиногруппу.
В качестве циклоалкильной группы, которая может иметь галоидные заместители, изображаемой вышеприведенным R1, можно упомянуть C3-C6-циклоалкильную группу, такую как циклопропильную, циклобутильную, циклопентильную и циклогексильную группу, и галоидзамещенную C3-C6-циклоалкильную группу, такую как 2-фтор-, 2-хлор- или 2-бромциклопропильную, 2,2-дифторциклопропильную, 2-хлор-2-фторциклопропильную, 2-фторциклобутильную, 2-фторциклопентильную и 2-фторциклогексильную группу.
В качестве низшей алкенильной группы, которая может содержать галоидные заместители, изображаемой вышеприведенным R1, можно упомянуть C2-C5-низшую алкенильную группу, такую как винильную, 1- или 2-пропенильную, 1-, 2- или 3-бутенильную и 3,3-диметил-2-пропенильную, и галоидзамещенную C2-C4-низшую алкенильную группу, такую как 3,3-дихлор-2-пропенильную, 2,3-дихлор-2-пропенильную и 4-хлор-3-бутенильную.
В качестве низшей алкинильной группы, изображаемой R1, можно упомянуть C2-C4-низшую алкинильную группу, такую как этинильную, 1- или 2-пропинильную и 2-бутинильную.
Что касается R1, то обозначенные им предпочтительные группы представляют собой атом водорода, метил-, этил-, пропил-, изопропил-, бутил- или трет-бутилгруппу, как низшую алкильную группу, 2-оксиэтил-, 2- или 3-оксипропил-, карбоксиметил-, 1- или 2-карбоксиэтил-, фторметил-, 2-фторэтил-, 2-хлорэтил-, 3-фторпропил-, 3-хлорпропил-, дифторметил-, трифторметил-, 2,2,2-трифторэтил-, циклопропилметил-, 2-ацетоксиэтил-, 2- или 3-ацетоксипропил-, фенилметил-, 1- или 2-фенилэтил-, нафтилметил-, 2-, 3- или 4-фторфенилметил-, 2,4-, 3,4-, или 2,6-дифторфенилметил-, 2-, 3- или 4-метилфенилметил, 2-, 3- или 4-хлорфенилметил-, 2-, 3- или 4-метоксифенилметил-, 2-тиенилметил-, 2-фурилметил-, 2-пиридилметил-, 2-пиримидинилметил-, 2-аминоэтил-, 2-метиламиноэтил-, 2-диметиламиноэтил-, 2-морфолиноэтил- или 2-пиперадиноэтилгруппу, как низшую алкильную группу, содержащую заместитель(и), аминогруппу, метиламино-, этиламино- или диметиламиногруппу, как аминогруппу, замещенную низшим алкилом, метокси-, этокси- или пропоксигруппу, как низшую алкоксигруппу, циклопропил-, циклобутил-, циклопентил- или 2-фторциклопропилгруппу, как циклоалкилгруппу, которая может быть галоидзамещенной, фенил-, нафтил-, 2-, 3- или 4-фторфенил-, 2-, 3- или 4-хлорфенил-, 2,4-, 3,4- или 2,6-дифторфенил- или 2-, 3- или 4-метилфенилгруппу, как арильную группу, 2-тиазолил-, 2-оксазолил-, 2-, 3- или 4-пиридил-, 2-, 4- или 5-пиримидинил-, 2-бензоксазолил- или 2-бензотиазолилгруппу, как ароматическую гетероциклическую группу, винил-, 2-пропенил-, 3,3-диметилпропенил- или 3,3-дихлорпропенилгруппу, как низшую алкенильную группу, которая может быть галоидозамещенной, и этинил- или 2-пропинилгруппу, как низшую алкинильную группу.
Что касается R1, то особенно предпочтительно, когда обозначенная им низшая алкильная группа представляет собой метил-, этил-, пропил- или изопропилгруппу, низшая алкильная группа, имеющая заместитель(и), представляет собой 2-оксиэтил-, карбоксиметил-, 2-фторэтил-, 2-ацетоксиэтил-, фенилметил-, фенилэтил-, 2-пиридилметил-, 2-диметиламиноэтил- или 2-морфолиноэтилгруппу, когда это аминогруппа, когда аминогруппа, замещенная низшим алкилом, представляет собой метиламиногруппу, низшая алкоксигруппа представляет собой метоксигруппу, циклоалкильная группа, которая может быть галоидозамещенной, представляет собой циклопропил- или 2-фторциклопропилгруппу, арильная группа, которая может быть замещена галогеном (галогенами), представляет собой фенил-, 2-, 3- или 4-фторфенил- или 2,4-дифторфенилгруппу, низшая алкенильная группа, которая может быть замещена галогеном, представляет собой винил- или 2-пропенилгруппу, и низшая алкинильная группа представляет собой 2-пропинилгруппу.
Когда связка, представленная формулой (f), образуется соединением R1 в вышеупомянутых формулах (Ia) и (Ib) и R2, A в формуле (f) может включать атом водорода, C1-C4-алкильную группу, такую как метил-, этил-, пропил-, изопропил- и бутилгруппу, галоидзамещенную C1-C4-алкильную группу, такую как фторметил-, хлорметил-, дифторметил-, трифторметил-, 2-фторэтил-, 2-хлорэтил-, 2-бромэтил-, 2- или 3-фторпропил- и 2-, 3- или 4-фторбутилгруппу, гидрокси C1-C4-алкильную группу, такую как гидроксиметил-, 2-гидроксиэтил-, 3-гидроксипропил- и 4-гидроксибутилгруппу, и C1-C4-алкокси-(C1-C4)-алкильную группу, такую как метоксиметил-, этоксиметил-, пропоксиметил-, бутоксиметил-, метоксиэтил-, метоксипропил- или метоксибутилгруппу. В формуле (f) G может включать атом азота или трехвалентную группу, изображаемую формулой (g), G1 может включать метиленовую группу, карбонильную группу, атом кислорода, атом серы и -N(R11)-, где R11 представляет собой атом водорода, C1-C4-алкильную группу, такую как метил-, этил-, пропил- и бутилгруппу, p = 0 или 1.
В формуле (f) A предпочтительно представляет собой атом водорода, низшую алкильную группу, которая может быть замещена галогеном, такую как метил-, этил-, пропил-, изопропил- и фторметилгруппу, особенно предпочтительны метильная и фторметильная группы. В качестве G предпочтительной является группа, изображаемая формулой (g). Кроме того, в качестве G1 предпочтительными являются атом кислорода или атом серы, особенно подходящим является атом кислорода. Наиболее предпочтительной величиной p является 1.
Когда вышеупомянутая формула (Ia), (Ib) или (Ic) имеет в молекуле (т.е. на месте Z или R1) карбоксильную группу, такая карбоксильная группа может быть защищенной. В качестве такой защитной группы можно упоминать о группе, которая легко удаляется in vivo с превращением в карбоксильную группу, содержащую C1-C4-алкильную группу, такую как метил-, этил-, пропил-, изопропил-, бутил- и изобутилгруппу, аралкильную группу, такую как бензил- и фенилэтилгруппу, C1-C4-алканоилоксиалкильную группу, такую как ацетоксиметил- и пивалоилоксиметилгруппу, C1-C4-алкоксикарбонилоксиалкильную группу, такую как 1-(этоксикарбонилокси)-этил- и 1-(изопропоксикарбонилокси)этилгруппу, N, N-диалкилзамещенную аминокарбонилалкильную группу, такую как N,N-диметиламинокарбонилметильную, и N,N-диалкилзамещенную аминоалкильную группу, такую как 2-(N,N-диметиламино)этильную алкильную группу, замещенную 5- или 6-членной насыщенной гетеромоноциклической группой, содержащей один или два гетероатома, выбираемых из N, O и S, такую как 2-морфолиноэтил-, 2-пиперидиноэтил- и 2-(4-метилпиперидино)этилгруппу, или (5-метил- (или 5-фенил)-2-оксо- 1,3-диоксолен-4-ил)метильную группу.
В соединениях, изображаемых приведенными выше формулами (Ia) и (Ib), в которых R1 представляет собой атом водорода, могут существовать таутомеры, изображаемые следующими далее формулами, и все эти таутомеры включаются в изобретение.
В изобретении соединение, изображаемое упомянутыми выше формулами (Ia), (Ib) или (Ic), могут быть получены, в случае необходимости, в форме фармацевтически приемлемой соли.
Такая соль может включать соль, образовавшуюся от присоединения минеральной кислоты, такую как хлоргидрат, бромгидрат, иодгидрат, сульфат и фосфат, соль, образовавшуюся при присоединении органической кислоты, такую как метансульфонат, этансульфонат, бензолсульфонат, р-толуолсульфонат, оксалат, малеат, фумарат, тартрат и цитрат, или соль металла и карбоновой кислоты, такую как натриевую соль, калиевую соль, соль кальция, магния, марганца, соль железа и соль алюминия.
Соединение формулы (Ia), (Ib) или (Ic) изобретения может существовать в виде гидрата.
Примерами соединения, изображаемого формулой (Ia), (Ib) или (Ic), могут служить соединения, перечисленные в табл. 1 - 20.
Среди представленных выше веществ данного изобретения приготовлены следующие соединения:
1-циклопропил-6-фтор-8-дифторметокси-7-[4-(2-метоксифенил) пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбоновая кислота,
1-циклопропил-6-фтор-8-дифторметокси-7-(4-фенилпиперазин-1-ил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота,
1-циклопропил-6-фтор-8-дифторметокси-7-[4-(4-метоксифенил)- пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбоновая кислота,
1-циклопропил-6-фтор-8-дифторметокси-7-[4-(2-пиримидинил) пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбоновая кислота,
6-фтор-8-дифторметокси-1-метил-7-[4-(2-метоксифенил)- пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбоновая кислота,
6-фтор-8-дифторметокси-1-метил-7-[4-(2-пиримидинил)- пиперазин-1-ил] -1,4-дигидро-4-оксохинолин-3-карбоновая кислота,
1-(2-ацетоксиэтил)-6-фтор-8-дифторметокси-7-[4-(2- метоксифенил)-пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбоновая кислота,
1-этил-6-фтор-8-дифторметокси-7-[4-(2-метоксифенил)-пиперазин-1- ил] -1,4-дигидро-4-оксохинолин-3-карбоновая кислота,
1-этил-6-фтор-8-дифторметокси-7-[4-(2-пиримидинил)-пиперазин-1- ил] -1,4-дигидро-4-оксохинолин-3-карбоновая кислота,
9-фтор-3-фторметил-10-[4-(2-пиримидинил)-пиперазин-1-ил] -2,3- дигидро-7-оксо-7H-пиридо[1,2,3-де][1,4]бензоксазин-6-карбоновая кислота,
2-морфолиноэтил-1-этил-6-фтор-8-дифторметокси-7-[4-(2- пиримидинил)-пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбоновая кислота,
этил-1-этил-6-фтор-8-дифторметокси-7-[4-(2-пиримидинил)- пиперазин-1-ил] -1,4-дигидро-4-оксохинолин-3-карбоновая кислота,
2-пиперидинэтил-1-этил-6-фтор-8-дифторметокси-7-[4-(2- пиримидинил)-пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбоновая кислота,
2-(4-метилпиперидин)-этил-1-этил-6-фтор-8-дифторметокси-7-[4-(2- пиримидинил)-пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбонат, и
2-морфолинэтил-6-фтор-8-дифторметокси-1-метил-7-[4-(2-метоксифенил)- пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбонат, и
1-этил-6-фтор-8-дифторметокси-7-[4-(2-пиримидинил)-пиперазин-1- ил] -1,4-дигидро-4-оксохинолин-3-карбоновая кислота являются особенно предпочтительными.
1-циклопропил-6-фтор-8-дифторметокси-7-[4-(2-метоксифенил) пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбоновая кислота,
1-циклопропил-6-фтор-8-дифторметокси-7-(4-фенилпиперазин-1-ил)-1,4-дигидро-4-оксохинолин-3-карбоновая кислота,
1-циклопропил-6-фтор-8-дифторметокси-7-[4-(4-метоксифенил)- пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбоновая кислота,
1-циклопропил-6-фтор-8-дифторметокси-7-[4-(2-пиримидинил) пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбоновая кислота,
6-фтор-8-дифторметокси-1-метил-7-[4-(2-метоксифенил)- пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбоновая кислота,
6-фтор-8-дифторметокси-1-метил-7-[4-(2-пиримидинил)- пиперазин-1-ил] -1,4-дигидро-4-оксохинолин-3-карбоновая кислота,
1-(2-ацетоксиэтил)-6-фтор-8-дифторметокси-7-[4-(2- метоксифенил)-пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбоновая кислота,
1-этил-6-фтор-8-дифторметокси-7-[4-(2-метоксифенил)-пиперазин-1- ил] -1,4-дигидро-4-оксохинолин-3-карбоновая кислота,
1-этил-6-фтор-8-дифторметокси-7-[4-(2-пиримидинил)-пиперазин-1- ил] -1,4-дигидро-4-оксохинолин-3-карбоновая кислота,
9-фтор-3-фторметил-10-[4-(2-пиримидинил)-пиперазин-1-ил] -2,3- дигидро-7-оксо-7H-пиридо[1,2,3-де][1,4]бензоксазин-6-карбоновая кислота,
2-морфолиноэтил-1-этил-6-фтор-8-дифторметокси-7-[4-(2- пиримидинил)-пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбоновая кислота,
этил-1-этил-6-фтор-8-дифторметокси-7-[4-(2-пиримидинил)- пиперазин-1-ил] -1,4-дигидро-4-оксохинолин-3-карбоновая кислота,
2-пиперидинэтил-1-этил-6-фтор-8-дифторметокси-7-[4-(2- пиримидинил)-пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбоновая кислота,
2-(4-метилпиперидин)-этил-1-этил-6-фтор-8-дифторметокси-7-[4-(2- пиримидинил)-пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбонат, и
2-морфолинэтил-6-фтор-8-дифторметокси-1-метил-7-[4-(2-метоксифенил)- пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбонат, и
1-этил-6-фтор-8-дифторметокси-7-[4-(2-пиримидинил)-пиперазин-1- ил] -1,4-дигидро-4-оксохинолин-3-карбоновая кислота являются особенно предпочтительными.
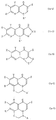
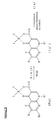
Соединения, изображаемые формулами (Ia), (Ib) и (Ic), могут быть получены по способу A, представленному в конце описания.
В случае, когда соединение изображается формулой (Ia), оно может быть также получено по способу B, представленному в конце описания.
В способах A и B R, R1, Q, T, W, X, Y и Z имеют те же значения, которые установлены выше, Hal означает атом галогена и L означает атом фтора или ацетоксигруппу.
По способу A, нужное соединение формулы (Ia), (Ib) или (Ic) получают взаимодействием производного хинолина (IIIa), (IIIb) или (IIIc) с производным циклического амина (V) в присутствии или в отсутствие основания, и в присутствии или в отсутствие растворителя.
В качестве растворителя для применения в этой реакции может быть предпочтительно использован апротонный полярный растворитель, такой как диметилсульфоксид, N,N-диметилформамид, гексаметилфосфортриамид и N,N-диметилацетамид, и кроме того, также могут быть использованы кетоны, такие как ацетон и метилэтилкетон, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и диоксан, сложные эфиры, такие как этилацетат, спирты, такие как метанол, этанол, пропанол, изопропанол и бутанол, и нитрилы, такие как ацетонитрил. В качестве примеров подходящих оснований могут быть названы третичные амины, такие как 1,8-диазабицикло[5,4,0]-7-ундецен, 1,5-диазабицикло[4,3,0]-5-нонен, триэтиламин, трибутиламин, пиридин, пиколин, лутидин и коллидин, алккоксиды металлов, такие как метилат натрия, этилат натрия и трет-бутилат калия, и неорганические основания, такие как карбонат натрия и карбонат калия.
Количество используемого основания, предпочтительно, составляет количество, эквимолярное 5-кратному молярному количеству соединения (IIIa), (IIIb) или (IIIc), а когда используется третичный амин, значительный избыток может быть использован в качестве растворителя. Избыток циклического амина (V) также действует как основание, так что реакция может гладко протекать даже в том случае, если другое основание не добавляют. Реакция осуществляется при 0 - 200oC.
По способу A, нужное соединение, изображаемое формулой (Ia) или (Ic) может быть также получено путем осуществления той же самой реакции, но используя соединение (IIIa) или (IIIc), в котором Z представляет собой карбоксильную группу, а его сложный алкиловый (низшего алкила) эфир, чтобы получить сложный алкиловый эфир соединения, соответствующего формуле (Ia) или (Ic), и затем гидролизуя полученное в результате соединение в соответствии с обычными методами.
По способу B, нужное соединение формулы (Ia), получают взаимодействием борохелатного соединения карбоксихинолона (IVa) с циклическим амином (V) по тому же методу, что и в способе A, чтобы получить соединение (Ia'), и затем осуществляя реакцию соединения (Ia') в водном спирте в присутствии основания, посредством которой происходит разложение хелата.
В качестве основания, которое используется для разложения хелата в способе B, можно назвать гидроксиды щелочных металлов, такие как гидркосид натрия и гидркосид калия, карбонаты щелочных металлов, такие как карбонат натрия и карбонат калия, третичные амины, такие как 1,8-диазабицикло[5,4,0]-7-ундецен, 1,5-диазабицикло[4,3,0]-5-нонен, триэтиламин и 4-диметиламинопиридин, или алкоголят металла, такой как метилат натрия, этилат натрия и трет-бутилат калия.
В случае упомянутой выше реакции после завершения реакции нужное соединение может быть получено путем обработки реакционной смеси в соответствии с обычными приемами и в случае необходимости соединение может быть очищено обычными способами очистки, такими как перекристаллизация и колоночная хроматография.
Полученные таким образом соединения формул (Ia), (Ib) и (Ic) в случае необходимости переводят в нужную соль в соответствии с обычными приемами.
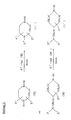
Соединения формул (Ia), (Ib) и (Ic), в которых R3 в заместителе R представляет собой ароматическую гетероциклическую группу, может быть получено также по способу C, представленному в конце описания.
На схеме способа C в формулах R4, R5, R7, R8, m, n, n', n'' и Hal имеют те же значения, которые установлены выше, R3 и R6 означают ароматические гетероциклические группы, упомянутые в описаниях R3 и R6; означают ароматические гетероциклические группы, упомянутые в описаниях R3 и R6; M изображается формулами (Ma), (Mb) или (Mc),
или
где R1, Q, T, W, X, Y и Z имеют те же значения, которые установлены выше.
или
где R1, Q, T, W, X, Y и Z имеют те же значения, которые установлены выше.
Реакцию по способу C осуществляют таким же образом, как и по способу A.
Соединения (VI) и (VII), которые используются в качестве исходных веществ в способе C, могут быть получены с использованием соединений (IIIa), (IIIb), (IIIc) или (IVa) в качестве исходного вещества путем взаимодействия упомянутого исходного вещества по той же схеме, что и в способе A или в способе B, с циклическим амином (V' - 1) или (V' - 2), изображенными ниже, которые заменяют в реакции, упомянутой выше, циклический амин (V).
Соединение формулы (Ia) или (Ic), в котором Z представляет собой 5-тетразолил, может быть также получено из соответствующего цианосоединения формулы (IX) или (X) соответственно по способу D, представленному в конце описания.
На схеме способа D в формулах R, R1, Q, T, X и Y имеют те же значения, которые установлены выше.
По способу D, соединение (Ia'') или (Ic'') синтезируется в растворителе путем взаимодействия соединения (IX) или (X) с 1-10-кратным молярным количеством, предпочтительно - с 1-5-кратным молярным количеством, азидного соединения.
В качестве азидного соединения, которое используется в реакции, могут быть упомянуты, например, азиды щелочных металлов, такие как азид натрия, азид калия и азид лития, азиды щелочно-земельных металлов, такие как азид кальция и азид магния, оловоорганические азиды, такие как азид трибутилолова и азид трифенилолова. В названной реакции азидное соединение может быть использовано одно или в сочетании, например, с кислотой Льюиса, такой как хлорид алюминия, хлорид олова, хлорид цинка, хлорид титана, хлорид трибутилолова, и комплекс трифторборана с диэтиловым эфиром, солями аммония, такими как аммонийхлорид и тетраметиламмонийхлорид, сульфокислотами, такими как метансульфокислота и этансульфокислота, хлоридами щелочных металлов, такими как хлорид лития, и с солями амина, такими как хлоргидрат триэтиламина. Как о примере использования азидного соединения, можно упомянуть о способе, в котором азид трибутилолова получают из хлорида трибутилолова и азида натрия, и затем используют эту систему.
Растворитель, который используется, не имеет особых ограничений до тех пор, пока он является неактивным в реакции, и может включать, например, апротонные полярные растворители, такие как N,N-диметилформамид, диметилсульфоксид, N-метилпирролидон и N,N-диемтилацетамид, простые эфиры, такие как тетрагидрофуран, диметоксиэтан, диэтоксиэтан и диоксан, ароматические углеводороды, такие как бензол, толуол и ксилол, а алифатические углеводороды, такие как гексан и петролейный эфир.
Температура реакции составляет 0 - 200oC, предпочтительно 0 - 150oC. Время реакции изменяется в зависимости от других условий, но как правило, составляет 1 - 72 ч, предпочтительно 3 - 48 ч.
Для способов A и B соединения формул (IIIb) и (IVa) и соединения формул (IIIa) и (IIIc), в которых Z представляют собой карбоксильную группу, или их сложные алкиловые (низших алкилов) эфиры, которые используются в качестве исходных веществ, могут быть легко получены с использованием соответствующих исходных материалов в соответствии с подходящими известными способами, например такими методами, которые описаны в Japanese Provisional Patent Publications N 30964/1981, N 74667/1983 (которые соответствуют патентам США NN 4620007, 4670444 и 5077429), N 90511/1983, N 103393/1983 (патент США N 4426381), N 67290/1984, N 76091/1984, N 56959/1985 (патент США N 4730000), N 126271/1985, N 163866/1985 (патент США N 4774246), N 172981/1985, N 174786/1985 (патент США N 4616019), N 452/1987 (патенты США NN 4762831, 4859773 и 4958045), N 53987/1987 (патент США N 4720495), N 155282/1987, N 187472/1987 (патент США N 4767762), N 228063/1987, N 132891/1988 (патент США N 4801584), N 198664/1988 (патент США N 4997943), N 264461/1988 (патенты США NN 4855292, 4935420), N 297366/1988, N 124873/1990 (патент США N 5073556), N 191257/1990 (патент США N 4971970), N 231476/1990 (патент США N 5073556) и N 209367/1991.
Из числа соединений формул (IIIa) или (IIIc) соединения формул (IIIa') или (IIIc'), в которых Z представляет собой 5-тетразолил, могут быть получены из соответствующих цианосоединений по способу E, представленному в конце описания.
Здесь в формулах R1, Q, T, X, Y и Hal имеют те же значения, которые установлены выше.
Способ E осуществляют таким же образом, что способ D. Для способа E соединения формул (IIIa'') и (IIIc''), которые используются в качестве исходных веществ, могут быть получены путем использования различных исходных веществ, в которых часть, соответствующая карбоксильной группе, представляет собой цианогруппу, в соответствии со способами, описанными в перечисленных публикациях, относящихся к соединениям формул (IIIa) и (IIIc), в которых Z представляет собой карбоксильную группу.
В соединениях формул (Ia), (Ib) и (Ic), полученных так, как описано выше, могут существовать оптические изомеры или геометрические (цис- или транс-) изомеры. В таком случае, оптические изомеры или геометрические изомеры, соответствующие нужным соединениям формул (Ia), (Ib) и (Ic), могут быть получены путем осуществления вышеупомянутой реакции с применением оптически определенных или разделенных исходных веществ, если это желательно. К тому же, соответствующие стереоизомеры могут быть также получены путем обработки смеси оптических или геометрических изомеров соединений, изображаемых формулами (Ia), (Ib) и (Ic), в соответствии с обычными методами разделения изомеров.
Когда соединения формул (Ia), (Ib) и (Ic) имеют в своих молекулах карбоксильные группы, карбоксильные группы могут быть защищены путем образования сложных эфиров, как описано выше, и реакции образования сложных эфиров осуществляются путем использования соответствующего карбоксильного соединения и соответствующего спирта обычными методами (например, конденсацией с отщеплением воды с кислотным катализатором, методом через галогенангидриды или конденсацией с отщеплением воды с использованием карбодиимида).
Соединения формул (Ia), (Ib) и (Ic) являются пригодными в качестве лечебных средств при СПИДе. В качестве формы введения для таких целей можно упомянуть, например, оральное введение в виде таблеток, капсул, гранул, порошков и сиропов или парентеральное введение путем внутривенного вливания, внутримышечных инъекций, подкожных и внутрибрюшинных введений и суппозитория.
Препараты обычно вводят с допустимыми фармакологическими носителями, можно добавлять один или более дополнительных противовирусных препаратов. Препараты вводят в изотоническом растворе и с другими физиологическими растворителями и в виде эмульсий.
Введение можно проводить дробно, либо однократно вводить дозу в подходящие дни недели. Препараты готовят используя наполнители, обволакивающие средства, дезинтеграторы и стабилизаторы.
Доза меняется в зависимости от возраста, веса, состояния пациента, формы введения и времени введения, но для взрослых она обычно составляет 100 - 2000 мг в день или 1 - 25 мг/кг массы тела в день, которая назначается одноразово или разделяется на несколько приемов. Когда дозы соединений формул (Ia), (Ib) и (Ic), в несколько раз превышающие вышеупомянутые дозы (в расчете на вес), вводились орально крысам, их токсичность не обнаружена.
Пример 1. Синтез гидрохлорида 1-циклопропил-6-фтор-8- дифторметокси-7-[4-(2-метоксифенил)пиперазин-1-ил] -1,4-дигидро-4- оксохинолин-3-карбоновой кислоты
В 20 мл пиридина растворяют 1,66 г (0,005 моль) 1-циклопропил- 6,7-дифтор-8-дифторметокси-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты и 2,4 г (0,0125 моль) 1-(2-метоксифенил)-пиперазина, и смесь перемешивают при 105 - 110oC в течение 3 ч. Затем удаляют растворитель при уменьшенном давлении, и остаток подвергают колоночной хроматографии на силикагеле (элюент - смесь хлороформа и метанола в соотношении 9,5 : 0,5), и получают 1,33 г свободной формы соединения, названного в заголовке. Затем 1,33 г свободного соединения растворяют в 100 мл смеси хлороформа и метанола (4:1), и добавляют в раствор 2 мл концентрированной соляной кислоты. Смесь концентрируют при уменьшенном давлении, остаток промывают смесью метанола и этанола (4 : 1) и высушивают, получают 1,08 г соединения, названного в заголовке, в виде белого порошка.
В 20 мл пиридина растворяют 1,66 г (0,005 моль) 1-циклопропил- 6,7-дифтор-8-дифторметокси-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты и 2,4 г (0,0125 моль) 1-(2-метоксифенил)-пиперазина, и смесь перемешивают при 105 - 110oC в течение 3 ч. Затем удаляют растворитель при уменьшенном давлении, и остаток подвергают колоночной хроматографии на силикагеле (элюент - смесь хлороформа и метанола в соотношении 9,5 : 0,5), и получают 1,33 г свободной формы соединения, названного в заголовке. Затем 1,33 г свободного соединения растворяют в 100 мл смеси хлороформа и метанола (4:1), и добавляют в раствор 2 мл концентрированной соляной кислоты. Смесь концентрируют при уменьшенном давлении, остаток промывают смесью метанола и этанола (4 : 1) и высушивают, получают 1,08 г соединения, названного в заголовке, в виде белого порошка.
Температура плавления: 223 - 225oC.
ЯМР (DMCO-d6, δ): 1,04 - 1,07 (2H, м.), 1,16 - 1,17 (2H, м.), 3,30 (4H, ш. с.), 3,47 (4H, ш.с.), 3,86 (3H, с.), 4,09-4,12 (1H, м.), 6,90 - 7,27 (5H, м.), 7,95 - 7,98 (1H, д., J = 12,1 Гц), 8,79 (1H, с.).
Масс-спектр (CI): m/e 504 (M+ + 1).
Примеры 2 - 62. Тем же способом, что и в примере 1, синтезируют соединения, перечисленные в табл. 21.
Примеры 63. Синтез 1-этил-6-фтор-8-дифторметокси-7-[4-(2-метоксифенил)-пиперазин-1- ил]-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты
К суспензии 5,0 г (0,016 моль) 1-этил-6,7-дифтор-8-дифторметокси-1,4-дигидро-4-оксохинолин-3- карбоновой кислоты в 20 мл метилизибутилкетона добавляли 4,54 г (0,031 моль) сложного эфира трифтордиэтилбора и смесь кипятили в колбе с обратным холодильником в течение 6 ч при помешивании. Реакционную смесь охлаждали и выпавшие кристаллы собирали фильтрацией, отмывали эфиром и хлороформом, получают 32 г 1-этил-6,7-дифтор-8-дифторметокси-1,4-дигидро-4-оксохинолин-3-карбоновая кислота • BF2. Полученное хелатное соединение представляло собой слаборозовые кристаллы.
К суспензии 5,0 г (0,016 моль) 1-этил-6,7-дифтор-8-дифторметокси-1,4-дигидро-4-оксохинолин-3- карбоновой кислоты в 20 мл метилизибутилкетона добавляли 4,54 г (0,031 моль) сложного эфира трифтордиэтилбора и смесь кипятили в колбе с обратным холодильником в течение 6 ч при помешивании. Реакционную смесь охлаждали и выпавшие кристаллы собирали фильтрацией, отмывали эфиром и хлороформом, получают 32 г 1-этил-6,7-дифтор-8-дифторметокси-1,4-дигидро-4-оксохинолин-3-карбоновая кислота • BF2. Полученное хелатное соединение представляло собой слаборозовые кристаллы.
К 5 мл диметилсульфоксида добавляют 0,5 г (0,00136 моль) хелатного соединения (1-этил-6,7-дифтор-8-дифторметокси-1,4-дигидро-4-оксохинолин-3- карбоновая кислота) • BF2, 1,3 г (0,0068 моль) 1-(2-метоксифенил)пиперазина и 2 мл триэтиламина, смесь перемешивают при комнатной температуре в течение 5 ч, и затем оставляют стоять в течение ночи. К реакционной смеси добавляют воду, и выпавшие кристаллы желтого цвета собирают посредством фильтрования и промывают водой. Кристаллы растворяют в 100 мл 80%-ного метанола, содержащего 2,5 мл триэтиламина, и раствор кипятят с обратным холодильником в течение 12 ч. Затем удаляют растворитель при пониженном давлении, и остаток промывают смесью этанола и воды и сушат, получают 0,5 г названного в заголовке соединения в виде светло-красного порошка.
Температура плавления: 219 - 222oC.
ЯМР (DMCO-d6, δ): 1,28 (3H, т., J = 7,0 Гц), 3,11 (4H, ш.с.), 3,47 (4H, ш. с.), 3,81 (3H, с.), 4,74 (2H, к., J = 7,0 Гц), 6,92 - 7,32 (5H, м.), 8,01 - 8,04 (1H, д., J = 12,1 Гц), 8,96 (1H, с.).
Масс-спектр (CI): m/e 492 (M+ + 1).
Примеры 64 - 89. По тому самому методу, что и в примере 63, синтезируют соединения, перечисленные в табл. 22 и 23.
Пример 90. Синтез 6-фтор-1-(4-фторфенил)-7-[4(2-метоксифенил)-пиперазин-1-ил]-1,4- дигидро-4-оксо-1,8-нафтиридин-3-карбоновой кислоты
В 40 мл этанола растворяют 0,81 г (0,0042 моль) 1-(2-метоксифенил)пиперазина, и к раствору при перемешивании постепенно добавляют 1,02 г (0,0028 моль) этил-7-хлор-6-фтор-1-(4-фторфенил)-1,4-дигидро-4-оксо-1,8-нафтиридин -3-карбоксилата при 30oC. По окончании добавления, смесь реагирует при этой температуре в течение 4 ч. После охлаждения реакционной смеси выпавшие кристаллы собирают фильтрацией и промывают этанолом. К кристаллам добавляют 12 мл водного 6N раствора соляной кислоты, и смесь кипятят с обратным холодильником в течение 6 ч. После охлаждения, регулируют величину pH реакционной смеси до 8,5 добавлением водного 1N раствора гидроксида натрия, выпавшие кристаллы собирают фильтрацией и подвергают колоночной хроматографии на силикагеле (элюент - смесь хлороформа с метанолом в соотношении 9,5 : 0,5), получают 0,87 г соединения, названного в заголовке, в виде желтоватого порошка.
В 40 мл этанола растворяют 0,81 г (0,0042 моль) 1-(2-метоксифенил)пиперазина, и к раствору при перемешивании постепенно добавляют 1,02 г (0,0028 моль) этил-7-хлор-6-фтор-1-(4-фторфенил)-1,4-дигидро-4-оксо-1,8-нафтиридин -3-карбоксилата при 30oC. По окончании добавления, смесь реагирует при этой температуре в течение 4 ч. После охлаждения реакционной смеси выпавшие кристаллы собирают фильтрацией и промывают этанолом. К кристаллам добавляют 12 мл водного 6N раствора соляной кислоты, и смесь кипятят с обратным холодильником в течение 6 ч. После охлаждения, регулируют величину pH реакционной смеси до 8,5 добавлением водного 1N раствора гидроксида натрия, выпавшие кристаллы собирают фильтрацией и подвергают колоночной хроматографии на силикагеле (элюент - смесь хлороформа с метанолом в соотношении 9,5 : 0,5), получают 0,87 г соединения, названного в заголовке, в виде желтоватого порошка.
Температура плавления: 272 - 273oC.
ЯМР (DMCO-d6, δ): 2,97 (4H, ш.с.), 3,71 (4H, ш.с.), 3,80 (3H, с.), 6,86 - 7,70 (8H, м. ), 8,17 - 8,20 (1H, д., J = 13,6 Гц), 8,70 (1H, с.), 15,13 (1H, с.).
Масс-спектр (CI): m/e 493 (M+ + 1).
Примеры 91 - 93. Тем же способом, что и в примере 90, синтезируют соединения, перечисленные в табл. 24.
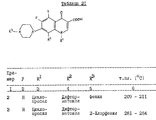
Пример 94. Синтез 1-этил-6-фтор-8-дифторметокси-7-[3-метил-4- (2-пиримидинил)пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3- карбоновой кислоты
В 60 мл пиридина растворяют 3,19 г (0,01 моль) 1-этил-6,7-дифтор-8-дифторметокси-1,4-дигидро-4-оксохинолин-3- карбоновой кислоты и 3,0 г (0,03 моль) 2-метилпиперазина, и смесь перемешивают при 105 - 110oC в течение 2 ч. Затем удаляют растворитель при пониженном давлении. К остатку добавляют воду, и осевшие кристаллы собирают фильтрацией, промывают водой и этанолом и сушат, получают 3,23 г 1-этил-6-фтор-8-дифторметокси-7-(3-метилпиперазин-1-ил)-1,4- дигидро-4-оксохинолин-3-карбоновой кислоты в виде бледно-желтого порошка.
В 60 мл пиридина растворяют 3,19 г (0,01 моль) 1-этил-6,7-дифтор-8-дифторметокси-1,4-дигидро-4-оксохинолин-3- карбоновой кислоты и 3,0 г (0,03 моль) 2-метилпиперазина, и смесь перемешивают при 105 - 110oC в течение 2 ч. Затем удаляют растворитель при пониженном давлении. К остатку добавляют воду, и осевшие кристаллы собирают фильтрацией, промывают водой и этанолом и сушат, получают 3,23 г 1-этил-6-фтор-8-дифторметокси-7-(3-метилпиперазин-1-ил)-1,4- дигидро-4-оксохинолин-3-карбоновой кислоты в виде бледно-желтого порошка.
К 20 мл N,N-диметилформамида добавляют 1,6 г (0,004 моль) порошка, 0,9 г (0,008 моль) 2-хлорпиримидина и 0,81 г (0,008 моль) триэтиламина, и смесь перемешивают при 130oC в течение 15 ч. Затем удаляют растворитель при уменьшенном давлении. К остатку добавляют этанол, выпавшие кристаллы собирают фильтрацией и подвергают колоночной хроматографии на силикагеле (элюент - смесь хлороформа с метанолом в соотношении 9,5 : 0,5), получают 0,34 г соединения, названного в заголовке, в виде бледно-желтого порошка.
Температура плавления: 219 - 221oC.
Масс-спектр (CI): m/e 478 (M+ + 1).
Элементный анализ (%): в переводе на C22H22F3N5O4.
Вычислено: C 55,35; H 4,64; N 14,67.
Найдено: C 55,41; H 4,56; N 14,65.
Примеры 95 - 97. Тем же способом, что и в примере 94, синтезируют соединения, представленные в табл. 25.
Пример 98. Синтез 1-этил-6-фтор-8-дифторметокси-7-[4-(2- пиримидинил)-пиперазин-1-ил]-3-(5-тетразолил)-1,4-дигидро-4- оксохинолина
Тем же способом, что в примере 1, но с участием 4,85 г 3-циано-1-этил-6,7-дифтор-8-дифторметокси-1,4-дигидро-4- оксохинолина и 9,49 г 1-(2-пиримидинил)пиперазина, получают 4,2 г 3-циано-1-этил-6-фтор-8-дифторметокси-7-[4-(2-пиримидинил)- пиперазин-1-ил]-1,4-дигидро-4-оксохинолина в виде бледно-желтого порошка.
Тем же способом, что в примере 1, но с участием 4,85 г 3-циано-1-этил-6,7-дифтор-8-дифторметокси-1,4-дигидро-4- оксохинолина и 9,49 г 1-(2-пиримидинил)пиперазина, получают 4,2 г 3-циано-1-этил-6-фтор-8-дифторметокси-7-[4-(2-пиримидинил)- пиперазин-1-ил]-1,4-дигидро-4-оксохинолина в виде бледно-желтого порошка.
Температура плавления: 286 - 290oC (разлагается).
К 25 мл ксилола добавляют 0,5 г (0,0011 моль) 3-циано-1-этил-6-фтор-8-дифторметокси-7-[4-(2-пиримидинил) пиперазин-1-ил] -1,4-дигидро-4-оксохинолина, полученного так, как описано выше, 0,21 г (0,0033 моль) азида натрия и 1,07 г (0,0033 моль) хлорида трибутилолова, и смесь перемешивают при кипячении с обратным холодильником в течение 9 ч. После охлаждения смеси до комнатной температуры в нее добавляют 7 мл 1N водного раствора соляной кислоты, и смесь перемешивают. Затем осевшие кристаллы собирают фильтрацией, промывают этанолом и толуолом, и подвергают колоночной хроматографии на силикагеле (элюент - смесь хлороформа и метанола в соотношении 9:1), получают 0,37 г соединения, названного в заголовке, в виде бледно-желтого порошка.
Температура плавления: 265 - 268oC.
Масс-спектр (CI): m/e 488 (M+ + 1).
Элементный анализ (%): в переводе на C21H20F3N9O2 • 1/2 H2O.
Вычислено: C 50,81; H 4,06; N 25,39.
Найдено: C 50,96; H 4,16; N 25,58.
Пример 99. Смесь 1-этил-8-дифторметокси-7-[4-(2-пиримидинил) пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты
Выполняют ту же реакцию, что и в примере 1, используя 1-этил-7-фтор-8-дифторметокси-1,4-дигидро-4-оксохинолин-3- карбоновую кислоту и 1-(2-пиримидинил)пиперазин, и получают названное в заголовке соединение в виде белого порошка.
Выполняют ту же реакцию, что и в примере 1, используя 1-этил-7-фтор-8-дифторметокси-1,4-дигидро-4-оксохинолин-3- карбоновую кислоту и 1-(2-пиримидинил)пиперазин, и получают названное в заголовке соединение в виде белого порошка.
Температура плавления: > 300oC.
Масс-спектр (CI): m/e 446 (M+ + 1).
Элементный анализ (%): в переводе на C21H21F2N5O4.
Вычислено: C 56,63; H 4,75; N 15,72.
Найдено: C 56,70; H 4,62; N 15,34.
Пример 100. Синтез 6-фтор-1-метил-4-оксо-7-[4-(2-пиримидинил) пиперазин-1-ил]-1H,4H-[1,3]тиазето[3,2-a]хинолин-3-карбоновой кислоты
К 16 мл N,N-диметилформамида добавляют 2,0 г (0,0064 моль) этил-6,7-дифтор-1-метил-4-оксо-1H, 4H-[1,3] -тиазето-[3,2-a] хинолин-3- карбоксилата, 3,0 г (0,0129 моль) 1-(2-пиримидинил)пиперазин-дихлоргидрата и 3,9 г (0,0256 моль) 1,8-диазабицикло[5,4,0] -ундецена, и смесь перемешивают при комнатной температуре в течение 5 дней. Реакционную смесь добавляют к воде, и выпавшие кристаллы собирают фильтрацией, промывают водой и сушат, получают 2,8 г этил-6-фтор-1-метил-4-оксо-7-[4-(2-пиримидинил)пиперазин-1-ил] - 1H,4H-[1,3] -тиазето[3,2-a]хинолин-3-карбоксилата в виде бледно-желтого порошка.
К 16 мл N,N-диметилформамида добавляют 2,0 г (0,0064 моль) этил-6,7-дифтор-1-метил-4-оксо-1H, 4H-[1,3] -тиазето-[3,2-a] хинолин-3- карбоксилата, 3,0 г (0,0129 моль) 1-(2-пиримидинил)пиперазин-дихлоргидрата и 3,9 г (0,0256 моль) 1,8-диазабицикло[5,4,0] -ундецена, и смесь перемешивают при комнатной температуре в течение 5 дней. Реакционную смесь добавляют к воде, и выпавшие кристаллы собирают фильтрацией, промывают водой и сушат, получают 2,8 г этил-6-фтор-1-метил-4-оксо-7-[4-(2-пиримидинил)пиперазин-1-ил] - 1H,4H-[1,3] -тиазето[3,2-a]хинолин-3-карбоксилата в виде бледно-желтого порошка.
К 0,8 г (0,0018 моль) порошка добавляют 5 мл метанола, 1 мл диоксана, 1 мл воды и 7 мл 1N раствора гидроксида натрия, и смесь перемешивают при комнатной температуре в течение 3 дней. Величину pH реакционной смеси доводят до 7,2 путем добавления разбавленного водного раствора уксусной кислоты, выпавшие кристаллы собирают фильтрацией и подвергают колоночной хроматографии на силикагеле (элюент - смесь хлороформа с метанолом в соотношении 20:1), и получают 0,22 г соединения, названного в заголовке, в виде желтоватого порошка.
Температура плавления: 266 - 268oC (разлагается).
Масс-спектр (CI): m/e 428 (M+ + 1).
Элементный анализ (%): в переводе на C20H18FN5O3S • 1/2 H2O.
Вычислено: C 55,04; H 4,39; N 16,05.
Найдено: C 54,85; H 4,19; N 15,92.
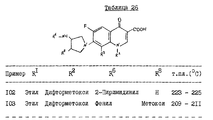
Пример 101. Синтез 1-этил-6-фтор-8-дифторметокси-7-[(4-оксо-3- фениламино)-пирролидин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты
К 20 мл пиридина добавляют 0,9 г (0,0028 моль) 1-этил-6,7-дифтор-8-дифторметокси-1,4-дигидро-4-оксохинолин-3- карбоновой кислоты, 1,52 г (0,0071 моль) (4-оксо-3-фениламино)-пирролидин-гидрохлорида и 1,6 г (0,0142 моль) триэтилендиамина, смесь перемешивают при комнатной температуре в течение 30 мин, и вслед за этим перемешивают в течение 3 ч при 105 - 110oC. Затем удаляют растворитель при пониженном давлении. К остатку добавляют воду, выпавшие кристаллы собирают фильтрацией, промывают этанолом и подвергают хроматографии на колонках с силикагелем (элюент - смесь хлороформа с метанолом в соотношении 9,5 : 0,5), получают 0,71 г соединения, названного в заголовке, в виде желтовато-белого порошка.
К 20 мл пиридина добавляют 0,9 г (0,0028 моль) 1-этил-6,7-дифтор-8-дифторметокси-1,4-дигидро-4-оксохинолин-3- карбоновой кислоты, 1,52 г (0,0071 моль) (4-оксо-3-фениламино)-пирролидин-гидрохлорида и 1,6 г (0,0142 моль) триэтилендиамина, смесь перемешивают при комнатной температуре в течение 30 мин, и вслед за этим перемешивают в течение 3 ч при 105 - 110oC. Затем удаляют растворитель при пониженном давлении. К остатку добавляют воду, выпавшие кристаллы собирают фильтрацией, промывают этанолом и подвергают хроматографии на колонках с силикагелем (элюент - смесь хлороформа с метанолом в соотношении 9,5 : 0,5), получают 0,71 г соединения, названного в заголовке, в виде желтовато-белого порошка.
Температура плавления: 233 - 235oC.
Масс-спектр (CI): m/e 478 (M+ + 1).
Элементный анализ (%): в переводе на C23H22F3N3O5.
Вычислено: C 57,86; H 4,64; N 8,80.
Найдено: C 57,83; H 4,59; N 8,80.
Примеры 102 и 103. По такой же реакции, что и в примере 101, но используя подходящие исходные материалы, синтезируют соединения, представленные в табл. 26.
Пример 104. Синтез 2-морфолиноэтил-1-этил-6-фтор-8-дифторметокси- 7-[4-(2-пиримидинил)пиперазин-1-ил] -1,4-дигидро-4-оксохинолин-3-карбоксилата
К 3 л метиленхлорида добавляют 58,94 г (0,127 моль) 1-этил-6-фтор-8-дифторметокси-7-[4-(2-пиримидинил)пиперазин-1-ил] -1,4- дигидро-4-оксихинолин-3-карбоновой кислоты, 25,05 г (0,191 моль) 4-(2-оксиэтил)морфолина, 23,3 г (0,191 моль) 4-диметиламинопиридина и 48,8 г (0,254 моль) 1-этил-3-(3-диметиламинопропил)карбодиимид-гидрохлорида, и смесь перемешивают при комнатной температуре в течение 4 дней. Затем удаляют растворитель при пониженном давлении. Остаток растворяют в хлороформе, промывают 1N водным раствором соляной кислоты, промывают водой и сушат. Растворитель удаляют при пониженном давлении, остаток обрабатывают колоночной хроматографией на силикагеле (элюент - смесь хлороформа с метанолом и 28%-ным водным аммиаком в соотношении 40:9:1), и получают названное в заголовке соединение в виде желтовато-белого порошка.
К 3 л метиленхлорида добавляют 58,94 г (0,127 моль) 1-этил-6-фтор-8-дифторметокси-7-[4-(2-пиримидинил)пиперазин-1-ил] -1,4- дигидро-4-оксихинолин-3-карбоновой кислоты, 25,05 г (0,191 моль) 4-(2-оксиэтил)морфолина, 23,3 г (0,191 моль) 4-диметиламинопиридина и 48,8 г (0,254 моль) 1-этил-3-(3-диметиламинопропил)карбодиимид-гидрохлорида, и смесь перемешивают при комнатной температуре в течение 4 дней. Затем удаляют растворитель при пониженном давлении. Остаток растворяют в хлороформе, промывают 1N водным раствором соляной кислоты, промывают водой и сушат. Растворитель удаляют при пониженном давлении, остаток обрабатывают колоночной хроматографией на силикагеле (элюент - смесь хлороформа с метанолом и 28%-ным водным аммиаком в соотношении 40:9:1), и получают названное в заголовке соединение в виде желтовато-белого порошка.
Температура плавления: 162 - 164oC.
Масс-спектр (CI): m/e 577 (M++1).
Элементный анализ (%): в переводе на C27H31F3N6O5•1/2 H2O.
Вычислено: C 55,38; H 5,34; N 14,35.
Найдено: C 55,06; H 5,20; N 14,26.
Примеры 105 - 108. Тем же способом, что и в примере 104, синтезируют соединения, представленные в табл. 27.
Пример 109. Синтез 9-этил-6-фтор-8-дифторметокси-7-[4-(2-пиримидинил)-пиперазин-1-ил]-2,3,4,9- тетрагидроизотиазоло-[5,4-b]-хинолин-3,4-диона
Осуществляют ту же реакцию, что в примере 1, используя 500 мг (1,44 ммоль) 9-этил-6,7-дифтор-8-дифторметокси-2,3,4,9-тетрагидроизотиазоло[5,4-b] хинолин-3,4-диона и 1,9 г (11,5 ммоль) 1-(2-пиримидинил)пиперазина, и получают 10 мг соединения, названного в заголовке, в виде светло-желтого порошка.
Осуществляют ту же реакцию, что в примере 1, используя 500 мг (1,44 ммоль) 9-этил-6,7-дифтор-8-дифторметокси-2,3,4,9-тетрагидроизотиазоло[5,4-b] хинолин-3,4-диона и 1,9 г (11,5 ммоль) 1-(2-пиримидинил)пиперазина, и получают 10 мг соединения, названного в заголовке, в виде светло-желтого порошка.
Температура плавления: 259 - 262oC.
Масс-спектр (CI): m/e 493 (M++1).
Элементный анализ (%): в переводе на C21H19F3N6O3S • 1/2 H2O.
Вычислено: C 50,30; H 3,82; N 16,75.
Найдено: C 50,56; H 3,51; N 17,03.
Пример 110. Синтез 8-бром-6-фтор-1-метил-7-[(2-пиримидинил)пиперазин-1-ил]-1,4-дигидро-4- оксохинолин-3-карбоновой кислоты.
Названное выше соединение синтезируют по методике примера 1.
Температура плавления: 236 - 239oC (разложение).
Масс-спектр (химическая ионизация): m/e 382 (M++1).
Спектр ЯМР (DMCO-d6, δ, м.д.): 3,20-3,48 (4H, м.), 3,75-4,10 (4H, м.), 4,36 (3H, с.), 6,69 (1H, т.), 8,08 (1H, д.), 8,41 (2H, д.), 8,91 (1H, с.), 14,7 (1H, с.).
Пример 111. Синтез 1-бензил-6-фтор-8-дифторметокси-7-[(2-пиримидинил)пиперазин-1-ил]-1,4-дигидро -4-оксохинолин-3-карбоновой кислоты.
Названное выше соединение синтезируют по методике примера 1.
Температура плавления: 278 - 282oC (разложение).
Масс-спектр (химическая ионизация): m/e 382 (M++1).
Спектр ЯМР (DMCO-d6, δ, м.д.): 3,08-3,27 (4H, м.), 3,78-3,98 (4H, м.), 5,76 (2H, с.), 6,51 (1H, т.), 6,55 (1H, д.), 7,01-7,08 (2H, м.), 7,28-7,31 (3H, м.), 2,08 (1H, д.), 8,31-8,37 (2H, д.), 8,84 (1H, с.), 14,49 (1H, с.).
Пример 112. Синтез 9-фтор-2,3-дигидро-10-[(2-пиримидинил)пиперазин-1-ил] -7-оксо-7H-пиридо [1,2,3de]-1,4-бензоксазин-6-карбоновой кислоты.
Названное выше соединение синтезируют по методике примера 63.
Температура плавления: 289 - 298oC (разложение).
Масс-спектр (химическая ионизация): m/e 412 (M++1).
Пример 113. АнтиВИЧ активность.
АнтиВич активность соединений изобретения измеряют в соответствии со способом R. Rauwel et al. ["J.Virological Methods", vol. 20, pp. 309 - 321 (1988)] , т.е. клеточные осадки, полученные центрифугированием клеток МТ-4, суспендируют в среде RPMI-1640, содержащей 10% сыворотки плода, и в образовавшийся раствор плавающих клеток инокулируют ВИЧ так, чтобы клетки были им инфицированы. Затем к раствору добавляют сывороточную питательную среду, смесь промывают и центрифугируют. Клетки МТ-4, инфицированные ВИЧ, так же, как и клетки МТ-4, не инфицированные ВИЧ, суспендируют в сывороточной питательной среде до концентрации 4•105 клеток/мл, соответственно. В каждую из ячеек 96-ти ячеечной пластины микротитратора помещают по 100 мкл каждого предварительно разбавленного до разумной степени раствора образцов соединений (суспендированных в сывороточной питательной среде). Далее, в каждую из ячеек помещают по 100 мкл каждой из вышеупомянутых клеточных суспензий, и вслед за этим культивируют, выдерживая плату при 37oC в течение 5 дней в присутствии 5% газообразного диоксида углерода. Таким же образом инкубируют клетки, инфицированные ВИЧ, и клетки, не инфицированные ВИЧ, к которым соединение не добавлялось. После завершения инкубации определяют активность ингибирования СРЕ методом спектрофотометрии голубого формазана, который образуется при разрушении МТТ [3-(4,5-диметилтио-3-ил-2-ил) 2,5-дифенил-тетразол-бромид], который добавляли к пробам, при добавлении соединения.
Ингибирующая СРЕ активность, близкая к клеткам, не инфицированным ВИЧ, к которым соединение не добавляется, принимается за 100%, и упомянутая активность, близкая к клеткам, инфицированным ВИЧ, к которым соединение добавляется, принимается за 0%. Определяют концентрацию соединения (ЕС50), при которой ингибирующая СРЕ активность против клеток, инфицированных ВИЧ, составляет 50%. Кроме того, определяют цитотоксическую активность, как концентрацию соединения (СС50), при которой рост клеток, не инфицированных ВИЧ, ингибируется на 50%, и величину CC50/EC50 рассматривают как индекс селективности (S.I.) антиВИЧ-активности. Результаты испытаний представлены в табл. 28.
Как видно из данных табл. 28, соединения данного изобретения эффективны в очень низких концентрациях и обладают очень высоким индексом селективности.
Каждое из соединений табл. 29 и 30, которые известны как антибактериальные, при таких испытаниях, какие описаны выше, имеют EC50 свыше 100 мкг/мл, и имеют очень низкую антиВИЧ-активность и также весьма малую применимость в качестве антиВИЧ-средства по сравнению с такими же параметрами соединений изобретения.
Справочный пример 1. Синтез 6,7-дифтор-8-дифторметокси-1-(2-пиридилметил)-1,4-дигидро-4-оксохинолин- 3-карбоновой кислоты
В 37 мл толуола растворяют 30 г (0,124 моль) 2,4,5-трифтор-3-дифторметоксибензойной кислоты, и добавляют в это 35 мл тионилхлорида и 0,5 мл N, N-диметилформамида. Смесь кипятят с обратным холодильником в течение 4 ч. После завершения реакции толуол и избыток тионилхлорида удаляют при пониженном давлении, и получают 2,4,5-трифтор-3-дифторметоксибензоилхлорид.
В 37 мл толуола растворяют 30 г (0,124 моль) 2,4,5-трифтор-3-дифторметоксибензойной кислоты, и добавляют в это 35 мл тионилхлорида и 0,5 мл N, N-диметилформамида. Смесь кипятят с обратным холодильником в течение 4 ч. После завершения реакции толуол и избыток тионилхлорида удаляют при пониженном давлении, и получают 2,4,5-трифтор-3-дифторметоксибензоилхлорид.
Отдельно 15,5 г (0,135 моль) этоксилата магния и 20,9 г (0,130 моль) диэтилмалоната в 100 мл безводного тетрагидрофурана кипятят с обратным холодильником в течение 2,5 ч при перемешивании, и получают суспензию диэтилэтоксималоната магния в тетрагидрофуране. К суспензии добавляют по каплям раствор хлорангидрида вышеупомянутой кислоты, который растворили в 20 мл тетрагидрофурана при комнатной температуре при перемешивании, и смесь затем перемешивают при комнатной температуре еще в течение 2 ч. К реакционной смеси добавляют 100 мл 1N соляной кислоты, и смесь энергично перемешивают. Смесь разделяют, органический слой промывают водой и сушат над безводным сульфатом натрия. Затем растворитель удаляют при пониженном давлении, и получают 51,8 г диэтил-2,4,5-трифтор-3-дифторметоксибензоилмалоната в виде светло-красной жидкости.
Масс-спектр (CI): m/e 385 (M+ + 1),
m/e 339 (M+ -OC2H5).
m/e 339 (M+ -OC2H5).
Далее, полученную жидкость смешивают с 200 мл диоксана, и в эту смесь добавляют 23,6 г (0,124 моль) моногидрата п-толуолсульфокислоты. Смесь кипятят с обратным холодильником в течение 8,5 ч. Реакционную смесь концентрируют при пониженном давлении, к остатку добавляют воду и 10,41 г (0,124 моль) двууглекислого натрия, и смесь экстрагируют этилацетатом. Этилацетатный слой промывают водой, сушат над безводным сульфатом натрия, и затем концентрируют при пониженном давлении, получают 32,0 г этил-2,4,5-трифтор-3-дифторметокси-бензоилацетата в виде жидкости желтого цвета.
Масс-спектр (CI): m/e 313 (M+ + 1),
m/e 225 (M+ -CH2COOC2H5).
m/e 225 (M+ -CH2COOC2H5).
К 4,85 г (0,0155 моль) этил-2,4,5-трифтор -3-дифторметоксибензоилацетата, полученного так, как описано выше, добавляют 11 мл уксусного ангидрида и 3,2 г триэтилового эфира ортомуравьиной кислоты, и смесь кипятят с обратным холодильником в течение 2 ч. Затем избыток уксусного ангидрида и триэтилового эфира ортомуравьиной кислоты удаляют при пониженном давлении. Остаток растворяют в 150 мл дихлорметана, и к раствору по каплям добавляют 2,01 г (0,0186 моль) 2-аминометилпипиридина при охлаждении льдом и при перемешивании. Смесь перемешивают при охлаждении льдом в течение 1 ч. Реакционную смесь концентрируют при уменьшенном давлении, и остаток подвергают колоночной хроматографии на силикагеле (элюент - смесь толуола с этилацетатом при соотношении 9: 1), и получают 6,56 г этил-2-(2,4,5-трифтор-3-дифторметоксибензоил)-3-(2-пиридилметиламино) акрилата в виде жидкости янтарного цвета. Выполняют перекристаллизацию, используя н-гексан, и получают 3,6 г кристаллов белого цвета.
Масс-спектр (CI): m/e 431 (M+ + 1).
В 50 мл N, N-диметилформамида растворяют 5,6 г (0,013 моль) этил-2-(2,4,5-трифтор-3-дифторметоксибензоил)-3-(2-пиридилметиламино)акрилата, и к раствору добавляют 2,2 г (0,026 моль) двууглекислого натрия. Смесь перемешивают при 120oC в течение 30 мин. Затем реакционную смесь выливают в 200 мл воды, и выпавшие кристаллы собирают фильтрацией. Собранные кристаллы промывают водой и этанолом и сушат, получают 2,6 г этил-6,7-дифтор-8-дифторметокси-1-(2-пиридилметил)-1,4- дигидро-4-оксохинолин-3-карбоксилата в виде желтых кристаллов.
Масс-спектр (CI): m/e 411 (M+ + 1).
Далее, 1,7 г (0,0041 моль) эфирного соединения суспендируют в смешанном растворителе, состоящем из 4,2 мл уксусной кислоты, 1,5 мл воды и 0,48 мл концентрированной серной кислоты, и суспензию кипятят с обратным холодильником при перемешивании в течение 2 ч. Затем суспензию охлаждают до комнатной температуры, прибавляют к ней воду, и нерастворимые собирают фильтрацией. Нерастворимые, собранные фильтрацией, промывают водой и сушат, получают 1,1 г 6,7-дифтор-8-дифторметокси-1-(2-пиридилметил)-1,4-дигидро-4- оксохинолин-3-карбоновой кислоты в виде белых кристаллов.
Температура плавления: 207 - 213oC (разлагается).
Масс-спектр (CI): m/e 383 (M+ + 1).
Справочные примеры 2 - 9. Тем же способом, что и в справочном примере 1, синтезируют соединения, представленные в табл. 31.
Справочный пример 10. Синтез 1-этил-7-фтор-8-дифторметокси-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты
В 290 мл уксусной кислоты растворяют 26,4 г (0,168 моль) 2-фтор-6-нитрофенола и 17,2 (0,168 моль) уксусного ангидрида, и в раствор добавляют 3,0 г 5%-ного палладированного угля. При комнатной температуре и при перемешивании сквозь смесь в течение 2 ч пропускают газообразный водород. Затем реакционную смесь фильтруют, и фильтрат концентрируют при пониженном давлении, остаток экстрагируют этилацетатом. Этилацетатный слой промывают водой и сушат над безводным сульфатом натрия. Растворитель удаляют при пониженном давлении, и остаток подвергают хроматографии на колонках с силикагелем (элюент - смесь этилацетата с толуолом в соотношении 1:2), получают 25,9 г 2-ацетиламино-6-фторфенола в виде коричневых кристаллов.
В 290 мл уксусной кислоты растворяют 26,4 г (0,168 моль) 2-фтор-6-нитрофенола и 17,2 (0,168 моль) уксусного ангидрида, и в раствор добавляют 3,0 г 5%-ного палладированного угля. При комнатной температуре и при перемешивании сквозь смесь в течение 2 ч пропускают газообразный водород. Затем реакционную смесь фильтруют, и фильтрат концентрируют при пониженном давлении, остаток экстрагируют этилацетатом. Этилацетатный слой промывают водой и сушат над безводным сульфатом натрия. Растворитель удаляют при пониженном давлении, и остаток подвергают хроматографии на колонках с силикагелем (элюент - смесь этилацетата с толуолом в соотношении 1:2), получают 25,9 г 2-ацетиламино-6-фторфенола в виде коричневых кристаллов.
Масс-спектр (CI): m/e 170 (M+ + 1),
m/e 127 (M+ + I-COCH3).
m/e 127 (M+ + I-COCH3).
В 110 мл N,N-диметилформамида растворяют 25,9 г (0,153 моль) 2-ацетиламино-6-фторфенола, полученного так, как описано выше, и к раствору добавляют 25,4 г (0,184 моль) карбоната калия и 33,1 г (0,383 моль) хлордифторметана. Смесь перемешивают в автоклаве при 100oC в течение 5 ч. По завершении реакции реакционную смесь выливают в 1 л воды и экстрагируют этилацетатом. Этилацетатный слой промывают водой и сушат над безводным сульфатом натрия. Затем удаляют растворитель при пониженном давлении, и остаток подвергают колоночной хроматографии на силикагеле (элюент - смесь этилацетата с толуолом в соотношении 1:3), получают 30,4 г 3-фтор-2-дитфторметоксиацетанилида в виде слегка коричневатых кристаллов.
Масс-спектр (CI): m/e 220 (M+ + 1).
В 180 мл этилового спирта растворяют 30,3 г (0,138 моль) 3-фтор-2-дифторметоксиацетанилида, полученного так, как описано выше, и к раствору добавляют 50,3 мл конц. соляной кислоты. Смесь кипятят с обратным холодильником в течение 3 ч. По завершении реакции этиловый спирт и концентрированную соляную кислоту удаляют при пониженном давлении, и к остатку добавляют 200 мл воды. Смесь нейтрализуют карбонатом калия и затем экстрагируют хлороформом. Хлороформный слой промывают насыщенным соляным раствором и сушат над безводными сульфатом натрия. Затем удаляют растворитель при пониженном давлении, и остаток подвергают колоночной хроматографии на силикагеле (элюент - хлороформ), получают 22,4 г 3-фтор-2-дифторметоксианилина в виде жидкости красного цвета.
Смесь 22,4 г (0,127 моль) 3-фтор-2-дифторметоксианилина, полученного так, как описано выше, и 27,4 г (0,127 моль) диэтилэтоксиметиленмалоната нагревают при 120oC в течение 5 ч. Смесь охлаждают до комнатной температуры, добавляют в нее н-гексан и фильтруют. Продукты, собранные при фильтрации, промывают н-гексаном и сушат, получают 37,5 г N-(2,2-диэтоксикарбонилвинил)-3-фтор-2-дифторметоксианилина в виде белого порошка.
Смесь 10,0 г (0,029 моль) N-(2,2-диэтоксикарбонилвинил)-3-фтор-2-дифторметоксианилина, полученного так, как описано выше, и 70 мл дифенилового эфира кипятят с обратным холодильником в течение 30 мин. Смесь охлаждают до комнатной температуры, и добавляют в нее н-гексан. Выпавшие кристаллы собирают фильтрацией и сушат, получают 5,25 г этил-7-фтор-8-дифторметокси-4-оксихинолин-3-карбоксилата в виде белого порошка.
Температура плавления: 218 - 219oC.
Масс-спектр (CI): m/e 302 (M+ + 1).
В 96 мл N,N-диметилформамида растворяют 3,0 г (0,01 моль) этил-7-фтор-8-дифторметокси-4-оксихинолин-3-карбоксилата, полученного так, как описано выше, и 6,9 г (0,05 моль) карбоната калия, и в раствор добавляют 12,5 г ( 0,08 моль) йодистого этила. Смесь перемешивают при 100oC в течение 14 ч. По завершении реакции растворитель удаляют при пониженном давлении, и к остатку добавляют воду. Выпавшие кристаллы собирают фильтрацией и подвергают колоночной хроматографии на силикагеле (элюент - смесь хлороформа с метанолом в соотношении 95: 5), получают 1,1 г этил-1-этил-7-фтор-8-дифторметокси-1,4-дигидро-4-оксохинолин-3-карбоксилата в виде белых кристаллов.
Температура плавления: 214,5 - 215,5oC.
Масс-спектр (CI): m/e 329 (M+ + 1).
Далее, 1,1 г (0,0033 моль) эфирного соединения суспендируют в смешанном растворителе, состоящем из 9 мл уксусной кислоты, 6,6 мл воды и 1,2 мл конц. серной кислоты, и суспензию кипятят с обратным холодильником в течение 2 ч при перемешивании. После охлаждения суспензии до комнатной температуры к ней добавляют воду, и нерастворимые собирают фильтрацией. Нерастворимые, собранные фильтрацией, промывают водой и сушат, получают 0,85 г 1-этил-7-фтор-8-дифторметокси-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты в виде белых кристаллов.
Температура плавления: 169 - 170oC.
Масс-спектр (CI): m/e 302 (M++1).
Справочный пример 11. Синтез 3-циано-1-этил-6,7-дифтор-8-дифторметокси-1,4-дигидро-4-оксохинолина
К 36 г (0,15 моль) 2,4,5-трифтор-3-дифторметоксибензойной кислоты добавляют 45 мл толуола, 15 мл тионилхлорида и 0,2 мл N,N-диметилформамида, и смесь кипятят с обратным холодильником в течение 4 ч. По завершении реакции толуол и избыток тионилхлорида удаляют при пониженном давлении, и получают 2,4,5-трифтор-3-дифторметоксибензоилхлорид.
К 36 г (0,15 моль) 2,4,5-трифтор-3-дифторметоксибензойной кислоты добавляют 45 мл толуола, 15 мл тионилхлорида и 0,2 мл N,N-диметилформамида, и смесь кипятят с обратным холодильником в течение 4 ч. По завершении реакции толуол и избыток тионилхлорида удаляют при пониженном давлении, и получают 2,4,5-трифтор-3-дифторметоксибензоилхлорид.
В 75 мл безводного тетрагидрофурана растворяют 15,2 г (0,158 моль) 3-диметиламиноакрилонитрила, и добавляют в раствор 16,7 г (0,165 моль) триэтиламина. К смеси постепенно, по каплям, при комнатной температуре добавляют раствор вышеупомянутого хлорангидрида кислоты, растворенного в 15 мл безводного терагидрофурана. После завершения добавления, смесь кипятят с обратным холодильником в течение одного часа, охлаждают до комнатной температуры и затем фильтруют. К фильтрату добавляют 9,7 мл триэтиламина и 14,7 г (0,18 моль) хлоргидрата этиламина, и смесь перемешивают при 40oC в течение 2 ч. Смесь охлаждают до комнатной температуры и затем фильтруют. Фильтрат концентрируют при пониженном давлении, и остаток подвергают колоночной хроматографии на силикагеле (элюент - смесь этилацетата с толуолом в соотношении 3: 7), получают 39,3 г 2-(2,4,5-трифтор-3-дифторметоксибензоил)-3-этиламиноакрилонитрила в виде жидкости красного цвета. Продукт растворяют в 700 мл смешанного растворителя, состоящего из безводных диэтилового эфира и тетрагидрофурана, и к нему постепенно добавляют при охлаждении льдом нефть (нефтепродукт) с 60% гидрида натрия. Смесь перемешивают при той же температуре в течение 1 ч. Путем добавления 120 мл 1N соляной кислоты к реакционной смеси и энергичного перемешивания смеси всю реакционную смесь делают кислой. Выпавшие кристаллы собирают фильтрацией, промывают водой и затем промывают диэтиловым эфиром, получают 17,2 г 3-циано-1-этил-6,7-дифтор-8-дифторметокси-1,4-дигидро-4-оксохинолина в виде белого порошка.
Температура плавления: 194-195oC.
Масс-спектр (CI): m/e 301 (M++1).
Справочный пример 12. Синтез 1-(4,6-диметокси-2-пиримидинил)пиперазина
В 100 мл ацетонитрила растворяют 10 г (0,0567 моль) 1-бензилпиперазина, и добавляют к раствору 11,7 г (0,085 моль) карбоната калия и 14,8 г (0,068 моль) 4,6-диметокси- 2-метилсульфонилпиримидина. Смесь кипятят с обратным холодильником в течение 5 ч. Смесь охлаждают до комнатной температуры и затем фильтруют. Фильтрат концентрируют при пониженном давлении, и остаток подвергают колоночной хроматографии на силикагеле (элюент - смесь этилацетата с толуолом в соотношении 1:9), получают 17,6 г 4-(4,6-диметокси-2-пиримидинил)-1-бензилпиперазина в виде бесцветной жидкости.
В 100 мл ацетонитрила растворяют 10 г (0,0567 моль) 1-бензилпиперазина, и добавляют к раствору 11,7 г (0,085 моль) карбоната калия и 14,8 г (0,068 моль) 4,6-диметокси- 2-метилсульфонилпиримидина. Смесь кипятят с обратным холодильником в течение 5 ч. Смесь охлаждают до комнатной температуры и затем фильтруют. Фильтрат концентрируют при пониженном давлении, и остаток подвергают колоночной хроматографии на силикагеле (элюент - смесь этилацетата с толуолом в соотношении 1:9), получают 17,6 г 4-(4,6-диметокси-2-пиримидинил)-1-бензилпиперазина в виде бесцветной жидкости.
Масс-спектр (CI): m/e 315 (M++1).
В 110 мл этанола растворяют 3,9 г (0,0125 моль) 4-(4,6-диметокси-2-пиримидинил)-1-бензилпиперазина, полученного так, как описано выше, и добавляют в раствор 2,5 г 5% палладированного угля. При кипячении смеси с обратным холодильником в нее в течение 6 ч пропускают газообразный водород. Реакционную смесь охлаждают до комнатной температуры и затем фильтруют. Фильтрат концентрируют при пониженном давлении, и остаток подвергают колоночной хроматографии на силикагеле (элюент - смесь хлороформа с метанолом в соотношении 9:1), получают 1,38 г 1-(4,6-диметокси-2-пиримидинил)пиперазина в виде светло-красных кристаллов.
Масс-спектр (CI): m/e 225 (M++1).
Справочный пример 13. Синтез 1-(6-метокси-2-пиридил)пиперазина
В запаянной стеклянной трубке проводят реакцию 8,6 г пиперазина и 2,9 г (0,02 моль) 2-хлор-6 метоксипиридина при 150oC в течение 4 ч. По завершении реакции, реакционную смесь подвергают колоночной хроматографии на силикагеле (элюент - смесь хлороформа с метанолом и водным 28%-ным аммиаком в соотношении 40: 9: 1), получают 2,4 г 1-(6-метокси-2-пиридил) пиперазина в виде жидкости светло-желтого цвета.
В запаянной стеклянной трубке проводят реакцию 8,6 г пиперазина и 2,9 г (0,02 моль) 2-хлор-6 метоксипиридина при 150oC в течение 4 ч. По завершении реакции, реакционную смесь подвергают колоночной хроматографии на силикагеле (элюент - смесь хлороформа с метанолом и водным 28%-ным аммиаком в соотношении 40: 9: 1), получают 2,4 г 1-(6-метокси-2-пиридил) пиперазина в виде жидкости светло-желтого цвета.
Масс-спектр (CI): m/e 194 (M++1).
Справочный пример 14. Синтез 1-(2-тиазолил)пиперазина
В 50 мл ацетонитрила растворяют 5,0 г (0,0305 моль) 2-бромтиазола, и добавляют в раствор 13,3 г (0,153 моль) пиперазина, 8,4 г (0,061 моль) карбоната калия и каталитическое количество иодистого калия. Смесь кипятят с обратным холодильником в течение 5 ч. Смесь охлаждают до комнатной температуры и затем фильтруют. Фильтрат концентрируют при пониженном давлении, и остаток подвергают колоночной хроматографии на силикагеле (элюент - смесь хлороформа с метанолом и с водным 28%-ным аммиаком в соотношении 40:9:1), получают 3,62 г 1-(2-тиазолил)пиперазина в виде бесцветной жидкости.
В 50 мл ацетонитрила растворяют 5,0 г (0,0305 моль) 2-бромтиазола, и добавляют в раствор 13,3 г (0,153 моль) пиперазина, 8,4 г (0,061 моль) карбоната калия и каталитическое количество иодистого калия. Смесь кипятят с обратным холодильником в течение 5 ч. Смесь охлаждают до комнатной температуры и затем фильтруют. Фильтрат концентрируют при пониженном давлении, и остаток подвергают колоночной хроматографии на силикагеле (элюент - смесь хлороформа с метанолом и с водным 28%-ным аммиаком в соотношении 40:9:1), получают 3,62 г 1-(2-тиазолил)пиперазина в виде бесцветной жидкости.
Масс-спектр (CI): m/e 170 (M++1).
Справочный пример 15. Синтез 1-(3-амино-2-пиридил)пиперазина
В 30 мл метанола растворяют 3,13 г (0,015 моль) 1-(3-нитро-2-пиридил)пиперазина, и добавляют в раствор 2 г 5%-ного палладированного угля. При перемешивании при комнатной температуре в смесь пропускают газообразный водород в течение 1 ч. Реакционную смесь фильтруют, и фильтрат концентрируют при пониженном давлении, получают 2,56 г 1-(3- амино-2-пиридил)пиперазина в виде светло-желтой жидкости.
В 30 мл метанола растворяют 3,13 г (0,015 моль) 1-(3-нитро-2-пиридил)пиперазина, и добавляют в раствор 2 г 5%-ного палладированного угля. При перемешивании при комнатной температуре в смесь пропускают газообразный водород в течение 1 ч. Реакционную смесь фильтруют, и фильтрат концентрируют при пониженном давлении, получают 2,56 г 1-(3- амино-2-пиридил)пиперазина в виде светло-желтой жидкости.
Масс-спектр (CI): m/e 179 (M++1).
Справочный пример 16. Синтез 1-(2-бензоксазолил)пиперазина
В 200 мл ацетонитрила растворяют 33,6 г (0,39 моль) пиперазина и 10,0 г (0,065 моль) 2-хлорбензоксазола, и в раствор добавляют 9,0 г (0,065 моль) карбоната калия и каталитическое количество иодистого калия. Смесь кипятят с обратным холодильником в течение 11 ч при перемешивании. Смесь охлаждают до комнатной температуры и затем фильтруют. Фильтрат концентрируют при пониженном давлении, и остаток подвергают колоночной хроматографии на силикагеле (элюент - смесь хлороформа с метанолом в соотношении 9:1), получают 7,54 г 1-(2-бензоксазолил)пиперазина в виде белого кристаллического вещества.
В 200 мл ацетонитрила растворяют 33,6 г (0,39 моль) пиперазина и 10,0 г (0,065 моль) 2-хлорбензоксазола, и в раствор добавляют 9,0 г (0,065 моль) карбоната калия и каталитическое количество иодистого калия. Смесь кипятят с обратным холодильником в течение 11 ч при перемешивании. Смесь охлаждают до комнатной температуры и затем фильтруют. Фильтрат концентрируют при пониженном давлении, и остаток подвергают колоночной хроматографии на силикагеле (элюент - смесь хлороформа с метанолом в соотношении 9:1), получают 7,54 г 1-(2-бензоксазолил)пиперазина в виде белого кристаллического вещества.
Масс-спектр (CI): m/e 204 (M++1).
Справочный пример 17. Синтез 3-окси-4-фениламинопирролидингидрохлорида
(1) В 20 мл этилового спирта растворяют 5 г (0,027 моль) 1-трет-бутоксикарбонил-3-эпоксипирролидина, и в раствор добавляют 12,6 г (0,135 моль) анилина. Смесь кипятят с обратным холодильником в течение 20 ч. После охлаждения смеси до комнатной температуры, растворитель удаляют при пониженном давлении, и остаток подвергают колоночной хроматографии на силикагеле (элюент - смесь этилацетата с толуолом в соотношении 1:4), получают 4,85 г 1-трет-бутоксикарбонил-3- окси-4-фениламинопирролидина в виде желтовато-коричневых кристаллов.
(1) В 20 мл этилового спирта растворяют 5 г (0,027 моль) 1-трет-бутоксикарбонил-3-эпоксипирролидина, и в раствор добавляют 12,6 г (0,135 моль) анилина. Смесь кипятят с обратным холодильником в течение 20 ч. После охлаждения смеси до комнатной температуры, растворитель удаляют при пониженном давлении, и остаток подвергают колоночной хроматографии на силикагеле (элюент - смесь этилацетата с толуолом в соотношении 1:4), получают 4,85 г 1-трет-бутоксикарбонил-3- окси-4-фениламинопирролидина в виде желтовато-коричневых кристаллов.
Масс-спектр (CI): m/e 278 (M+),
m/e 57 (С4H9 +).
m/e 57 (С4H9 +).
(2) В 100 мл метанола растворяют 2,4 г (0,0086 моль) 1-трет-бутоксикарбонил-3-окси-4-фениламинопирролидина, полученного так, как описано выше, и добавляют в раствор 30 мл 6N соляной кислоты. После кипячения смеси с обратным холодильником в течение 2,5 ч растворитель удаляют при пониженном давлении. Полученный в результате остаток промывают этанолом и эфиром, и получают 1,52 г 3-окси-4-фениламинопирролидингидрохлорида в виде светло-коричневого порошка.
Масс-спектр (CI): m/e 179 (M++1).
Справочный пример 18. Синтез 3-метокси-4-фениламинопирролидингидрохлорида
К 10 мл безводного тетрагидрофурана добавляют 0,34 г (0,0085 моль) нефти с 60% гидрида натрия, и при перемешивании смеси при 45 - 50oC добавляют в нее 1,21 г (0,0085 моль) иодистого метила. К смеси по каплям добавляют раствор 2,37 г 1-трет-бутоксикарбонил-3-окси-4-фениламинопирролидина, полученного в справочном примере 17 (1), в 10 мл безводного тетрагидрофурана, и смесь еще перемешивают при той же температуре в течение 1 ч. После охлаждения смеси до комнатной температуры растворитель удаляют при пониженном давлении, и остаток подвергают колоночной хроматографии на силикагеле (элюент - смесь метилацетата с толуолом в соотношении 1:4), получают 1,98 г 1-трет-бутоксикарбонил-3-метокси-4-фениламинопирролидина в виде белых кристаллов.
К 10 мл безводного тетрагидрофурана добавляют 0,34 г (0,0085 моль) нефти с 60% гидрида натрия, и при перемешивании смеси при 45 - 50oC добавляют в нее 1,21 г (0,0085 моль) иодистого метила. К смеси по каплям добавляют раствор 2,37 г 1-трет-бутоксикарбонил-3-окси-4-фениламинопирролидина, полученного в справочном примере 17 (1), в 10 мл безводного тетрагидрофурана, и смесь еще перемешивают при той же температуре в течение 1 ч. После охлаждения смеси до комнатной температуры растворитель удаляют при пониженном давлении, и остаток подвергают колоночной хроматографии на силикагеле (элюент - смесь метилацетата с толуолом в соотношении 1:4), получают 1,98 г 1-трет-бутоксикарбонил-3-метокси-4-фениламинопирролидина в виде белых кристаллов.
Масс-спектр (CI): m/e 292 (M+).
В 100 мл метанола растворяют 1,98 г (0,0068 моль) 1-трет-бутоксикарбонил-3-метокси-4-фениламинопирролидина, полученного так, как описано выше, и к раствору добавляют 23,5 мл 6N соляной кислоты. Смесь оставляют стоять при комнатной температуре в течение ночи. Растворитель удаляют при пониженном давлении, и остаток промывают этанолом, получают 1,71 г 3-метокси-4-фениламинопирролидингидрохлорида в виде белого порошка.
Масс-спектр (CI): m/e 193 (M++1).
Справочный пример 19. Синтез 1-(6-этил-4-пиримидинил)пиперазина
К 12,4 г (0,1 моль) 6-этил-4-оксипиримидина добавляют 50 мл 1,2-дихлорэтана, и к этому добавляют 18,4 г (0,12 моль) хлорангидрида фосфорной кислоты. Смесь кипятят с обратным холодильником в течение 3 ч. После охлаждения к реакционной смеси добавляют воду, и смесь экстрагируют хлороформом. Хлороформный слой промывают содой и сушат над безводным сульфатом натрия. Растворитель удаляют при пониженном давлении, и получают 10,38 г 4-хлор-6-этилпиримидина в виде светло-красной жидкости.
К 12,4 г (0,1 моль) 6-этил-4-оксипиримидина добавляют 50 мл 1,2-дихлорэтана, и к этому добавляют 18,4 г (0,12 моль) хлорангидрида фосфорной кислоты. Смесь кипятят с обратным холодильником в течение 3 ч. После охлаждения к реакционной смеси добавляют воду, и смесь экстрагируют хлороформом. Хлороформный слой промывают содой и сушат над безводным сульфатом натрия. Растворитель удаляют при пониженном давлении, и получают 10,38 г 4-хлор-6-этилпиримидина в виде светло-красной жидкости.
Далее, жидкость смешивают со 100 мл ацетонитрила, и к раствору добавляют 11,5 г (0,073 моль) 1-этоксикарбонилпиперазина, 20,2 г (0,146 моль) карбоната калия и каталитическое количество иодистого калия. Смесь кипятят с обратным холодильником в течение 10 ч. Реакционную смесь охлаждают до комнатной температуры и затем фильтруют. Фильтрат концентрируют при пониженном давлении, и остаток подвергают колоночной хроматографии на силикагеле (элюент - смесь хлороформа с метанолом в соотношении 4:1), получают 20,69 г 1-(6-этил-4-пиримидинил)-4-этоксикарбонилпиперазина в виде жидкости оранжевого цвета.
Масс-спектр (CI): m/e 265 (M++1).
К 20,69 г (0,78 моль) 1-(6-этил-4-пиримидинил)-4-этоксикарбонилпиперазина, полученного так, как описало выше, добавляют 200 мл 6N соляной кислоты, и смесь кипятят с обратным холодильником в течение 18 ч. Доводят величину pH реакционной смеси до 10 или более, добавляя гидроксид натрия, и экстрагируют диэтиловым эфиром. Органической слой сушат над безводным сульфатом натрия. Растворитель удаляют при пониженном давлении, и остаток подвергают колоночной хроматографии на силикагеле (элюент - смесь хлороформа с метанолом в соотношении 4:1), получают 1-(6-этил-4-пиримидинил)пиперазин в виде бесцветной жидкости.
Масс-спектр (CI): m/e 193 (M++1).
Ссылочный пример 20. Синтез 9-этил-6,7-дифтор-8-дифторметокси-2,3,4,9-тетрагидроизотиазоло[5,4-b] -хинолин-3,4-диона.
В соответствии с методикой ссылочного примера 23 из предварительной патентной публикации N 209367/1991 (Япония) получают целевое соединение в виде порошка бледно-розового цвета.
Точка плавления: 211-213oC.
Масс-спектр (CI): m/e 349 (M++1).
Claims (22)
1. Производные аминохинолона, замещенные фенильной или гетероароматической группой формулы Ia или Ic
где X - атом водорода или атом галогена;
Y - водород или аминогруппа;
Z - карбоксильная группа;
Q - атом азота или группа формулы (d)
где R2 представляет собой водород, галоген, низшую алкоксигруппу или низшую алкоксигруппу, замещенную одним или более атомами галогена;
Т - метиленовая группа, необязательно замещенная низшей алкильной группой;
R1 - атом водорода, низшая алкенильная группа, низшая алкинильная группа, аминогруппа, необязательно замещенная одной низшей алкильной группой, (C3-C6)-циклоалкил; низшая алкоксигруппа; фенил, необязательно замещенный по крайней мере одним галогеном; низший алкил, необязатель замещенный одним заместителем, выбираемым из галогена, гидроксида, пиридила, алканоилокси, фенила, или аминогруппы формулы (е)
где R9 и R10 каждый независимо представляет собой низшую алкильную группу, или R9 и R10, взятые вместе с атомом азота, к которому они присоединены, образуют морфолиногруппу или, когда Q представляет собой группу формулы (d), то R1 и R2 вместе представляют собой группу формулы (f)
где А - атом водорода или низшая алкильная группа, необязательно замещенная по крайней мере одним атомом галогена;
p = 0 или 1;
G - атом азота или группа формулы (g)
G1 - атом кислорода;
R - группа формулы (h) или (i)
где R3 - фенил, необязательно замещенный одним заместителем R0, определенным ниже; пиридильная группа, пиримидинильная группа, бензоксазолильная группа, пиразинильная группа, тиазолильная группа, причем указанные циклы необязательно замещены одним заместителем R0, определенным ниже;
R4 - атом водорода или низшая алкильная группа;
R5 - атом водорода;
R6 - фенильная группа;
R7 - атом водорода;
R8 - низшая алкоксигруппа;
заместитель R0 выбирают из галогена, нитро, гидрокси, низшего алкила, необязательно замещенного по крайней мере одним атомом галогена; низшей алкоксигруппы и аминогруппы, необязательно замещенной одной или двумя низшими алкильными группами, при условии, что R3 не является фенильной группой, когда G1 представляет собой атом кислорода, p = 1, G представляет собой Z представляет собой карбоксильную группу, Y представляет собой атом водорода, X представляет собой атом фтора и R имеет формулу (h); и при условии, что R0 не является незамещенной или замещенной аминогруппой, когда R1 представляет собой фенильную группу;
или его фармацевтически приемлемая соль или эфир.
где X - атом водорода или атом галогена;
Y - водород или аминогруппа;
Z - карбоксильная группа;
Q - атом азота или группа формулы (d)
где R2 представляет собой водород, галоген, низшую алкоксигруппу или низшую алкоксигруппу, замещенную одним или более атомами галогена;
Т - метиленовая группа, необязательно замещенная низшей алкильной группой;
R1 - атом водорода, низшая алкенильная группа, низшая алкинильная группа, аминогруппа, необязательно замещенная одной низшей алкильной группой, (C3-C6)-циклоалкил; низшая алкоксигруппа; фенил, необязательно замещенный по крайней мере одним галогеном; низший алкил, необязатель замещенный одним заместителем, выбираемым из галогена, гидроксида, пиридила, алканоилокси, фенила, или аминогруппы формулы (е)
где R9 и R10 каждый независимо представляет собой низшую алкильную группу, или R9 и R10, взятые вместе с атомом азота, к которому они присоединены, образуют морфолиногруппу или, когда Q представляет собой группу формулы (d), то R1 и R2 вместе представляют собой группу формулы (f)
где А - атом водорода или низшая алкильная группа, необязательно замещенная по крайней мере одним атомом галогена;
p = 0 или 1;
G - атом азота или группа формулы (g)
G1 - атом кислорода;
R - группа формулы (h) или (i)
где R3 - фенил, необязательно замещенный одним заместителем R0, определенным ниже; пиридильная группа, пиримидинильная группа, бензоксазолильная группа, пиразинильная группа, тиазолильная группа, причем указанные циклы необязательно замещены одним заместителем R0, определенным ниже;
R4 - атом водорода или низшая алкильная группа;
R5 - атом водорода;
R6 - фенильная группа;
R7 - атом водорода;
R8 - низшая алкоксигруппа;
заместитель R0 выбирают из галогена, нитро, гидрокси, низшего алкила, необязательно замещенного по крайней мере одним атомом галогена; низшей алкоксигруппы и аминогруппы, необязательно замещенной одной или двумя низшими алкильными группами, при условии, что R3 не является фенильной группой, когда G1 представляет собой атом кислорода, p = 1, G представляет собой Z представляет собой карбоксильную группу, Y представляет собой атом водорода, X представляет собой атом фтора и R имеет формулу (h); и при условии, что R0 не является незамещенной или замещенной аминогруппой, когда R1 представляет собой фенильную группу;
или его фармацевтически приемлемая соль или эфир.
2. Соединение по п.1, где Q представляет собой группу формулы (d) и R2 представляет собой низший алкокси, необязательно замещенный по крайней мере одним атомом галогена.
3. Соединение по п.2, где R2 представляет собой метоксигруппу, необязательно замещенную по крайней мере одним атомом фтора.
4. Соединение по п.3, где R2 представляет собой дифторметоксигруппу.
6. Соединение или его соль по п.5, где Q представляет собой группу формулы (d) и R2 представляет собой низшую алкоксигруппу, которая может быть замещена по крайней мере одним атомом галогена.
7. Соединение по п.6, где R2 представляет собой метоксигруппу, которая может быть замещена по крайней мере одним атомом фтора.
8. Соединение по п.7, где R2 представляет собой дифторметоксигруппу.
9. Соединение по п.1 формулы Ia, где Q представляет собой группу формулы (d), где R2 представляет собой атом водорода, атом галогена или низшую алкоксигруппу, необязательно замещенную по крайней мере одним атомом галогена.
10. Соединение по п.1 формула Ia, где Q представляет собой группу формулы (d), R2 и R1 вместе представляют группу формулы -O-CH2-CH(A1)-, где A1 представляет собой атом водорода или низшую алкильную группу, необязательно замещенную одним атомом галогена.
11. Соединение по п.10, где A1 представляет собой монофторметильную группу.
12. Соединение по п.1, где Q представляет собой атом азота.
13. Соединение по п.1, где R представляет собой группу формулы (h) и R3 представляет собой пиридильную группу, пиримидинильную группу, пиразинильную группу, необязательно замещенную одним заместителем R0 или бензоксазольную группу, необязательно замещенную одним заместителем R0.
14. Соединение по п.1, где R представляет собой группу формулы (i) и R6 представляет собой фенильную группу.
15. Соединение по п.5, где R представляет собой группу формулы (h).
16. Соединение по п.5, где R представляет собой группу формулы (h), и R3 представляет собой пиридильную группу, пиримидинильную группу, пиразинильную группу.
17. Соединение по п. 16, где R представляет собой 4-(2-пиримидинил)пиперазин-1-ил.
18. Соединение по п.1, где R представляет собой группу формулы (h) и R3 представляет собой фенильную группу.
19. Соединение по п. 1 формулы Ia, где R1 представляет собой водород; аминогруппу, необязательно замещенную одной низшей алкильной группой; (C3-C6) циклопропил; низший алкил, необязательно замещенный заместителем, выбираемым из галогена, гидрокси, низшего алканоилокси, пиридила или морфолиногруппы.
20. Соединение по п.1, где X представляет собой атом фтора и Y представляет собой атом водорода.
21. Соединение по п.1, представляющее собой:
1-циклопропил-6-фтор-8-дифторметокси-7-[4-(2-метоксифенил)-пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбоновую кислоту;
1-циклопропил-6-фтор-8-дифторметокси-7-(4-фенилпиперазин-1-ил)-1,4-дигидро-4-оксохинолин-3-карбоновую кислоту;
1-циклопропил-6-фтор-8-дифторметокси-7-[4-(4-метоксифенил)-пиперазин-1-ил)-1,4-дигидро-4-оксохинолин-3-карбоновую кислоту;
1-циклопропил-6-фтор-8-дифторметокси-7-[4-(2-пиримидинил)-пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбоновую кислоту;
6-фтор-8-дифторметокси-1-метил-7-[4-(2-метоксифенил)пиперазин-1-ил] -1,4-дигидро-4-оксохинолин-3-карбоновую кислоту;
6-фтор-8-дифторметокси-1-метил-7-[4-(2-пиримидинил)пиперазин-1-ил] -1,4-дигидро-4-оксохинолин-3-карбоновую кислоту;
1-(2-ацетоксиэтил)-6-фтор-8-дифторметокси-7-[4-(2-метоксифенил)пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбоновую кислоту;
1-этил-6-фтор-8-дифторметокси-7-[4-(2-метоксифенил)пиперазин-1-ил] -1,4-дигидро-4-оксохинолин-3-карбоновую кислоту;
1-этил-6-фтор-8-дифторметокси-7-[4-(2-пиримидинил)пиперазин-1-ил] -1,4-дигидро-4-оксохинолин-3-карбоновую кислоту; 9-фтор-3-фторметил-10-[4-(2-пиримидинил)пиперазин-1-ил]-2,3-дигидро-7-оксо-7Н-пиридо[1,2,3-de] [1,4]бензоксазин-6-карбоновую кислоту;
2-морфолиноэтил-1-этил-6-фтор-8-дифторметокси-7-[4-(2-пиримидинил)пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбоксилат;
этил-1-этил-6-фтор-8-дифторметокси-7-[4-(2-пиримидинил)пиперазин-1-ил] -1,4-дигидро-4-оксохинолин-3-карбоксилат;
2-пиперининоэтил-1-этил-6-фтор-8-дифторметокси-7-[4-(2-пиримидинил)пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбоксилат;
2-(4-метилпиперидино)этил-1-этил-6-фтор-8-дифторметокси-7-[4-(2-пиримидинил)пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбоксилат;
2-морфолиноэтил-6-фтор-8-дифторметокси-1-метил-7-[4-(2-метоксифенил)пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбоксилат.
1-циклопропил-6-фтор-8-дифторметокси-7-[4-(2-метоксифенил)-пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбоновую кислоту;
1-циклопропил-6-фтор-8-дифторметокси-7-(4-фенилпиперазин-1-ил)-1,4-дигидро-4-оксохинолин-3-карбоновую кислоту;
1-циклопропил-6-фтор-8-дифторметокси-7-[4-(4-метоксифенил)-пиперазин-1-ил)-1,4-дигидро-4-оксохинолин-3-карбоновую кислоту;
1-циклопропил-6-фтор-8-дифторметокси-7-[4-(2-пиримидинил)-пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбоновую кислоту;
6-фтор-8-дифторметокси-1-метил-7-[4-(2-метоксифенил)пиперазин-1-ил] -1,4-дигидро-4-оксохинолин-3-карбоновую кислоту;
6-фтор-8-дифторметокси-1-метил-7-[4-(2-пиримидинил)пиперазин-1-ил] -1,4-дигидро-4-оксохинолин-3-карбоновую кислоту;
1-(2-ацетоксиэтил)-6-фтор-8-дифторметокси-7-[4-(2-метоксифенил)пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбоновую кислоту;
1-этил-6-фтор-8-дифторметокси-7-[4-(2-метоксифенил)пиперазин-1-ил] -1,4-дигидро-4-оксохинолин-3-карбоновую кислоту;
1-этил-6-фтор-8-дифторметокси-7-[4-(2-пиримидинил)пиперазин-1-ил] -1,4-дигидро-4-оксохинолин-3-карбоновую кислоту; 9-фтор-3-фторметил-10-[4-(2-пиримидинил)пиперазин-1-ил]-2,3-дигидро-7-оксо-7Н-пиридо[1,2,3-de] [1,4]бензоксазин-6-карбоновую кислоту;
2-морфолиноэтил-1-этил-6-фтор-8-дифторметокси-7-[4-(2-пиримидинил)пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбоксилат;
этил-1-этил-6-фтор-8-дифторметокси-7-[4-(2-пиримидинил)пиперазин-1-ил] -1,4-дигидро-4-оксохинолин-3-карбоксилат;
2-пиперининоэтил-1-этил-6-фтор-8-дифторметокси-7-[4-(2-пиримидинил)пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбоксилат;
2-(4-метилпиперидино)этил-1-этил-6-фтор-8-дифторметокси-7-[4-(2-пиримидинил)пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбоксилат;
2-морфолиноэтил-6-фтор-8-дифторметокси-1-метил-7-[4-(2-метоксифенил)пиперазин-1-ил]-1,4-дигидро-4-оксохинолин-3-карбоксилат.
22. Соединение по п.1, обладающее анти-ВИЧ активностью.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP15891292 | 1992-05-27 | ||
| JP158912/1992 | 1992-05-27 | ||
| JP158912/92 | 1992-05-27 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU93035829A RU93035829A (ru) | 1996-06-20 |
| RU2124510C1 true RU2124510C1 (ru) | 1999-01-10 |
Family
ID=15682065
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU93035829A RU2124510C1 (ru) | 1992-05-27 | 1993-05-26 | Производные аминохинолона, замещенные фенильной или гетероароматической группой |
Country Status (18)
| Country | Link |
|---|---|
| US (2) | US5519016A (ru) |
| EP (1) | EP0572259A1 (ru) |
| KR (1) | KR100266305B1 (ru) |
| CN (1) | CN1042936C (ru) |
| AU (1) | AU656859B2 (ru) |
| CA (1) | CA2096998A1 (ru) |
| CZ (1) | CZ99693A3 (ru) |
| FI (1) | FI932412A (ru) |
| HU (1) | HUT64051A (ru) |
| ID (1) | ID20476A (ru) |
| IL (1) | IL105806A (ru) |
| MX (1) | MX9303158A (ru) |
| NO (1) | NO304832B1 (ru) |
| NZ (1) | NZ247720A (ru) |
| PH (1) | PH31078A (ru) |
| RU (1) | RU2124510C1 (ru) |
| TW (1) | TW234121B (ru) |
| ZA (1) | ZA933732B (ru) |
Families Citing this family (58)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE4329600A1 (de) * | 1993-09-02 | 1995-03-09 | Bayer Ag | Pyrido [1,2,3-d,e] [1,3,4] benzoxadiazinderivate |
| KR970704693A (ko) * | 1994-07-18 | 1997-09-06 | 나가히로 마오미 | 트리플루오로메틸퀴놀린카르복실산 유도체(trifluoromethylquinolinecarboxylic acid derivative) |
| DE4425649A1 (de) * | 1994-07-20 | 1996-01-25 | Bayer Ag | Neue 1-[4-(Aminomethyl)phenyl] substituierte Chinoloncarbonsäuren |
| DE4425647A1 (de) * | 1994-07-20 | 1996-01-25 | Bayer Ag | Heterocyclyl-1-phenyl substituierte Chinoloncarbonsäuren |
| DE4425660A1 (de) * | 1994-07-20 | 1996-01-25 | Bayer Ag | 7-substituierte 1-[4-(1H-1,2,4-triazol-1-yl-methyl)phenyl] substituierte Chinoloncarbonsäuren |
| JP3117721B2 (ja) * | 1994-11-24 | 2000-12-18 | エフ・ホフマン−ラ ロシュ アーゲー | 新規なベンジルピリミジン類 |
| US5620997A (en) * | 1995-05-31 | 1997-04-15 | Warner-Lambert Company | Isothiazolones |
| DK0952151T3 (da) * | 1995-09-22 | 2003-09-22 | Wakunaga Pharma Co Ltd | Mellemprodukter til anvendelse ved fremstilling af nye pyridoncarboxylsyrederivater eller deres salte |
| US6001863A (en) * | 1996-11-26 | 1999-12-14 | Warner-Lambert Company | Isothiazolones |
| US6387928B1 (en) * | 1997-09-15 | 2002-05-14 | The Procter & Gamble Co. | Antimicrobial quinolones, their compositions and uses |
| ID24703A (id) | 1997-09-15 | 2000-08-03 | Procter & Gamble | Kuinolon antimikroba, komposisi dan penggunaannya |
| DE19751948A1 (de) * | 1997-11-24 | 1999-05-27 | Bayer Ag | Verfahren zur Herstellung von 8-Methoxy-Chinoloncarbonsäuren |
| IL124195A (en) * | 1998-04-23 | 2000-08-31 | Chemagis Ltd | Process for the preparation of esters of 2-¬4-¬4-chlorophenyl¾phenylmethyl¾-1-piperazinyl¬ethoxy¾acetic acid |
| DE69924702T2 (de) * | 1998-08-12 | 2006-01-19 | Ihara Chemical Industry Co., Ltd. | Difluormethoxybenzolderivate und ihre verwendung als zwischenprodukte |
| ATE261962T1 (de) * | 1998-12-21 | 2004-04-15 | Aventis Pharma Sa | Benzonaphtyridin-1,8 derivate |
| ES2312411T3 (es) * | 2000-02-09 | 2009-03-01 | Daiichi Sankyo Company, Limited | Agentes antibacterianos resistentes a los acidos que contienen acidos piridonocarboxilicos como principio activo. |
| MY127336A (en) | 2000-03-22 | 2006-11-30 | Upjohn Co | Container for linezolid iv solution |
| US6514529B2 (en) | 2000-03-22 | 2003-02-04 | Pharmacia & Upjohn Company | Oxazolidinone tablet formulation |
| US6608078B2 (en) | 2000-05-08 | 2003-08-19 | Wockhardt Limited | Antibacterial chiral 8-(substituted piperidino)-benzo [i,j] quinolizines, processes, compositions and methods of treatment |
| US7098219B2 (en) | 2000-08-01 | 2006-08-29 | Wockhart Limited | Inhibitors of cellular efflux pumps of microbes |
| PE20020578A1 (es) | 2000-10-10 | 2002-08-14 | Upjohn Co | Una composicion de antibiotico topico para el tratamiento de infecciones oculares |
| AU2002230891B2 (en) | 2000-12-14 | 2005-04-07 | The Procter & Gamble Company | Antimicrobial quinolones |
| IL155678A0 (en) | 2000-12-14 | 2003-11-23 | Procter & Gamble | Antimicrobial 2-pyridones, their compositions and uses |
| US6878713B2 (en) | 2001-04-25 | 2005-04-12 | Wockhardt Limited | Generation triple-targeting, chiral, broad-spectrum antimicrobial 7-substituted piperidino-quinolone carboxylic acid derivatives, their preparation, compositions and use as medicaments |
| US6964966B2 (en) | 2001-04-25 | 2005-11-15 | Wockhardt Limited | Generation triple-targeting, chiral, broad-spectrum antimicrobial 7-substituted piperidino-quinolone carboxylic acid derivatives, their preparation, compositions and use as medicaments |
| MXPA04008173A (es) * | 2002-02-22 | 2004-11-26 | Pharmacia Corp | Formulaciones de farmaco antibiotico oftalmico que contienen un compuesto de ciclodextrina y cloruro de cetil piridinio. |
| JP2005521690A (ja) * | 2002-02-22 | 2005-07-21 | ファルマシア・コーポレーション | ゴム系を含む眼科用製剤 |
| US6664267B1 (en) | 2002-05-28 | 2003-12-16 | Wockhardt Limited | Crystalline fluoroquinolone arginine salt form |
| EP4059923A1 (en) * | 2002-11-20 | 2022-09-21 | Japan Tobacco Inc. | 4-oxoquinoline compound and use thereof as hiv integrase inhibitor |
| WO2006089054A1 (en) * | 2005-02-16 | 2006-08-24 | Achillion Pharmaceuticals, Inc. | New isothiazoloquinolones and related compounds as anti-infective agents |
| TW200510425A (en) * | 2003-08-13 | 2005-03-16 | Japan Tobacco Inc | Nitrogen-containing fused ring compound and use thereof as HIV integrase inhibitor |
| ES2290560T3 (es) | 2003-09-04 | 2008-02-16 | Wockhardt Limited | Sal de arginina del acido benzoquinolizina-2-carboxilico tetrahidratada. |
| ES2232309B1 (es) * | 2003-11-13 | 2006-08-01 | Quimica Sintetica, S.A. | Procedimiento simplificado para la obtencion de gatifloxacino. |
| DE602005023717D1 (de) * | 2004-03-10 | 2010-11-04 | Usa | Chinolin-4-one als inhibitoren der retroviralen integrase zur behandlung von hiv, aids und aids-related complex (arc) |
| WO2005113509A1 (en) * | 2004-05-20 | 2005-12-01 | Japan Tobacco Inc. | Novel 4-oxoquinoline compound and use thereof as hiv integrase inhibitor |
| MY134672A (en) * | 2004-05-20 | 2007-12-31 | Japan Tobacco Inc | Stable crystal of 4-oxoquinoline compound |
| KR100589429B1 (ko) | 2004-08-31 | 2006-06-14 | 한국화학연구원 | N-1 위치에 아미노피리딜기가 치환된 퀴놀론 유도체의 제조방법 |
| US7732612B2 (en) * | 2004-09-09 | 2010-06-08 | Janssen Pharmaceutica, N.V. | 7-amino alkylidenyl-heterocyclic quinolones and naphthyridones |
| US20090156577A1 (en) * | 2004-09-09 | 2009-06-18 | Benjamin Davis | 7-amino alkylidenyl-heterocyclic quinolones and naphthyridones |
| US20060100215A1 (en) * | 2004-11-11 | 2006-05-11 | Bradbury Barton J | 8A,9-dihydro-4aH-isothiazolo[5,4-b]quinoline-3,4-diones and related compounds as anti-infective agents |
| US7659399B2 (en) * | 2005-01-05 | 2010-02-09 | Achillion Pharmaceuticals, Inc. | 1-thia-2,4a-diaza-cyclopenta[b]napththalene-3,4-diones and related compounds as anti-infective agents |
| WO2006084053A1 (en) * | 2005-02-02 | 2006-08-10 | Achillion Pharmaceuticals, Inc. | 8-n-substituted-2h-isothiazolo[5,4-b]quinolizine-3,4-diones and related compounds as antiinfective agents |
| EA013244B1 (ru) | 2005-07-27 | 2010-04-30 | Ачиллион Фармасьютикалз, Инк. | 8-МЕТОКСИ-9Н-ИЗОТИАЗОЛО[5,4-b]ХИНОЛИН-3,4-ДИОНЫ И РОДСТВЕННЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ПРОТИВОИНФЕКЦИОННЫХ СРЕДСТВ |
| AU2007223260C1 (en) * | 2006-03-06 | 2011-02-03 | Japan Tobacco Inc. | Method for producing 4-oxoquinoline compound |
| MX2008012488A (es) * | 2006-03-28 | 2008-10-10 | Procter & Gamble | Un proceso de acoplamiento para preparar intermedios de quinolona. |
| DE602007014191D1 (en) | 2006-03-28 | 2011-06-09 | Warner Chilcott Co Llc | Malatsalze und polymorphe von (3s,5s)-7-ä3-amino-5-methyl-piperidinylü-1-cyclopropyl-1,4-dihydro-8-methoxy-4-oxo-3-chinolincarbonsäure |
| CN101045724B (zh) * | 2006-03-28 | 2011-08-17 | 宝洁公司 | 用于制备喹诺酮中间体的偶联方法 |
| JP4876165B2 (ja) * | 2006-03-28 | 2012-02-15 | ザ プロクター アンド ギャンブル カンパニー | キノロン中間体を調製するための水素化物還元法 |
| US20080318938A1 (en) * | 2007-06-22 | 2008-12-25 | Ryckman David M | Methods for treating aberrant cell proliferation disorders |
| US20080318939A1 (en) * | 2007-06-22 | 2008-12-25 | Whitten Jeffrey P | Methods for treating ophthalmic disorders |
| US7902227B2 (en) * | 2007-07-27 | 2011-03-08 | Janssen Pharmaceutica Nv. | C-7 isoxazolinyl quinolone / naphthyridine derivatives useful as antibacterial agents |
| US8389514B2 (en) * | 2007-09-11 | 2013-03-05 | Kyorin Pharmaceutical Co., Ltd. | Cyanoaminoquinolones and tetrazoloaminoquinolones as GSK-3 inhibitors |
| CN102344457B (zh) * | 2007-09-12 | 2015-07-22 | 杏林制药株式会社 | 作为 gsk-3 抑制剂的螺环状氨基喹诺酮 |
| AU2008310883A1 (en) * | 2007-10-09 | 2009-04-16 | Hamann, Mark T | Method to use compositions having antidepressant anxiolytic and other neurological activity and compositions of matter |
| EP2222662A4 (en) * | 2007-11-15 | 2011-08-03 | Univ Maryland | INHIBITORS OF KYNURENINE AMINO TRANSFERASE |
| CA2711500A1 (en) * | 2008-01-07 | 2009-07-16 | Huanming Chen | Novel hiv integrase inhibitors and methods of use |
| AU2010232388A1 (en) * | 2009-04-03 | 2011-10-27 | Achillion Pharmaceuticals, Inc. | Hydroxythienoquinolones and related compounds as anti-infective agents |
| WO2010131054A1 (en) | 2009-05-15 | 2010-11-18 | Bradford Pharma Limited | Redox drug derivatives |
Family Cites Families (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5097032A (en) * | 1984-07-20 | 1992-03-17 | Warner-Lambert Company | Antibacterial agents - II |
| US5210193A (en) * | 1986-01-17 | 1993-05-11 | American Cyanamid Company | Piperazine derivatives |
| US4840956A (en) * | 1986-02-18 | 1989-06-20 | Warner-Lambert Company | Novel disubstituted-7-pyrrolidinoquinoline antibacterial agents |
| DE3705621C2 (de) * | 1986-02-25 | 1997-01-09 | Otsuka Pharma Co Ltd | Heterocyclisch substituierte Chinoloncarbonsäurederivate |
| IT1197841B (it) * | 1986-10-14 | 1988-12-06 | Mediolanum Farmaceutici Srl | Derivati pirido-benzotiazinici ad attivita' antibatterica ed a lunga durata di azione |
| JPH0751579B2 (ja) * | 1987-11-07 | 1995-06-05 | 日本新薬株式会社 | キノリンカルボン酸誘導体 |
| CA2053926A1 (en) * | 1989-04-28 | 1990-10-29 | Genkichi Ohta | Anti-hiv agent |
| DE3934082A1 (de) * | 1989-10-12 | 1991-04-18 | Bayer Ag | Chinoloncarbonsaeurederivate, verfahren zu ihrer herstellung sowie ihre verwendung als antivirale mittel |
| JPH0754830Y2 (ja) * | 1990-01-24 | 1995-12-18 | 株式会社ユニシアジェックス | 荷重センサ取付構造 |
| KR920004385A (ko) * | 1990-08-09 | 1992-03-27 | 와꾸나가 기스께 | 신규 삼환화합물 또는 그의 염, 이의 제조방법 및 이를 함유하는 항균제 |
| ES2151488T3 (es) * | 1991-05-28 | 2001-01-01 | Daiichi Seiyaku Co | Derivado de acido piridonacarboxilico. |
-
1993
- 1993-05-24 NO NO931867A patent/NO304832B1/no not_active IP Right Cessation
- 1993-05-25 IL IL105806A patent/IL105806A/en not_active IP Right Cessation
- 1993-05-26 FI FI932412A patent/FI932412A/fi unknown
- 1993-05-26 AU AU39815/93A patent/AU656859B2/en not_active Ceased
- 1993-05-26 CA CA002096998A patent/CA2096998A1/en not_active Abandoned
- 1993-05-26 RU RU93035829A patent/RU2124510C1/ru active
- 1993-05-26 TW TW082104157A patent/TW234121B/zh active
- 1993-05-26 CZ CZ93996A patent/CZ99693A3/cs unknown
- 1993-05-26 PH PH46240A patent/PH31078A/en unknown
- 1993-05-26 HU HU9301536A patent/HUT64051A/hu unknown
- 1993-05-27 CN CN93108210A patent/CN1042936C/zh not_active Expired - Fee Related
- 1993-05-27 EP EP93304139A patent/EP0572259A1/en not_active Ceased
- 1993-05-27 ZA ZA933732A patent/ZA933732B/xx unknown
- 1993-05-27 NZ NZ247720A patent/NZ247720A/en unknown
- 1993-05-27 KR KR1019930009397A patent/KR100266305B1/ko not_active IP Right Cessation
- 1993-05-27 ID IDP98154193A patent/ID20476A/id unknown
- 1993-05-27 MX MX9303158A patent/MX9303158A/es not_active IP Right Cessation
-
1994
- 1994-11-15 US US08/341,295 patent/US5519016A/en not_active Expired - Fee Related
-
1995
- 1995-09-11 US US08/526,225 patent/US5688791A/en not_active Expired - Fee Related
Non-Patent Citations (1)
| Title |
|---|
| J.Nozaki, Renard et al, AIDS, v.4, 1990, p.1283. Машковский М.Д. Лекарственные средства.-М.: Медицина, 1972, ч.2, с.252-312. * |
Also Published As
| Publication number | Publication date |
|---|---|
| PH31078A (en) | 1998-02-05 |
| KR930023360A (ko) | 1993-12-18 |
| IL105806A0 (en) | 1993-09-22 |
| AU3981593A (en) | 1993-12-02 |
| ID20476A (id) | 1998-12-24 |
| FI932412A (fi) | 1993-11-28 |
| HU9301536D0 (en) | 1993-09-28 |
| CN1042936C (zh) | 1999-04-14 |
| AU656859B2 (en) | 1995-02-16 |
| ZA933732B (en) | 1993-12-15 |
| IL105806A (en) | 1998-02-22 |
| FI932412A0 (fi) | 1993-05-26 |
| CN1086515A (zh) | 1994-05-11 |
| NO304832B1 (no) | 1999-02-22 |
| US5519016A (en) | 1996-05-21 |
| NZ247720A (en) | 1994-09-27 |
| KR100266305B1 (ko) | 2000-09-15 |
| CA2096998A1 (en) | 1993-11-28 |
| NO931867L (no) | 1993-11-29 |
| TW234121B (ru) | 1994-11-11 |
| CZ99693A3 (en) | 1993-12-15 |
| NO931867D0 (no) | 1993-05-24 |
| EP0572259A1 (en) | 1993-12-01 |
| US5688791A (en) | 1997-11-18 |
| HUT64051A (en) | 1993-11-29 |
| MX9303158A (es) | 1994-04-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2124510C1 (ru) | Производные аминохинолона, замещенные фенильной или гетероароматической группой | |
| JP6790040B2 (ja) | Fasnを阻害するための新規化合物および組成物 | |
| RU2061695C1 (ru) | Способ получения арилпиперазинил-гетероциклических соединений или их фармацевтически приемлемой кислотно-аддитивной соли | |
| JPS62103065A (ja) | ピリジン誘導体 | |
| JPH0853447A (ja) | 新規1,3−ジヒドロ−2H−ピロロ〔2,3−b〕ピリジン−2−オンとオキサゾロ〔4,5−b〕ピリジン−2(3H)−オン化合物、その製造方法及びそれらを含む薬剤組成物 | |
| EA032434B1 (ru) | Применение изохинолонов для получения лекарственных средств, изохинолоны и способ их синтеза | |
| JP4108123B2 (ja) | Nmdaアンタゴニストとしてのテトラヒドロキノリン | |
| US20080249092A1 (en) | Novel Quinoline Compounds Capable Of Binding At The Cb2 Receptor | |
| JPH0774204B2 (ja) | 化合物 | |
| JP2993316B2 (ja) | アリール基又は複素芳香環基置換アミノキノロン誘導体及びエイズ治療剤 | |
| JPH10130149A (ja) | Tnf産生抑制剤 | |
| KR20220062051A (ko) | 트리시클릭 구조를 갖는 방향족 헤테로시클릭 화합물, 및 이의 제조 방법과 응용 | |
| CN112243437A (zh) | 含丙烯酰基的核转运调节剂及其用途 | |
| JPS63179869A (ja) | ピペリジン誘導体 | |
| JPWO2019131798A1 (ja) | 新規ジヒドロキナゾリノン系化合物又はその薬理学的に許容される塩、及び細胞増殖阻害剤 | |
| RU2140919C1 (ru) | Производные 8-трифторметилхинолинкарбоновой кислоты, фармацевтическая композиция и способ ингибирования вируса иммунодефицита | |
| JP2930539B2 (ja) | トリフルオロメチルキノリンカルボン酸誘導体 | |
| GB2176185A (en) | N-(3-Nitroquinolin-4-yl)guanidine derivatives | |
| US3567716A (en) | 1,8-naphthyridine derivatives and intermediates thereof | |
| US5334595A (en) | Pyrazoloquinolones as anticancer agents | |
| JPS6097984A (ja) | セフエム誘導体、その製造方法および医薬組成物 | |
| CN114805350B (zh) | 一类苯并杂环-吡啶酮衍生物及其制备方法和用途 | |
| JP4328873B2 (ja) | 放射線増感剤 | |
| WO2023072969A1 (en) | Imidazolone derivatives as inhibitors of protein kinases in particular dyrk1a, clk1 and/or clk4 | |
| JP2024511617A (ja) | 新規なインドールアミン-2,3-ジオキシゲナーゼ阻害剤、その製造方法、およびそれを含む医薬組成物 |