KR20140003564A - 인돌로카르바졸 고리 구조를 갖는 화합물 및 유기 일렉트로루미네선스 소자 - Google Patents
인돌로카르바졸 고리 구조를 갖는 화합물 및 유기 일렉트로루미네선스 소자 Download PDFInfo
- Publication number
- KR20140003564A KR20140003564A KR1020137022146A KR20137022146A KR20140003564A KR 20140003564 A KR20140003564 A KR 20140003564A KR 1020137022146 A KR1020137022146 A KR 1020137022146A KR 20137022146 A KR20137022146 A KR 20137022146A KR 20140003564 A KR20140003564 A KR 20140003564A
- Authority
- KR
- South Korea
- Prior art keywords
- group
- compound
- atom
- carbon atoms
- layer
- Prior art date
Links
- 0 c1ccc(*(c2ccccc2-c2c(cc3c4c5cccc4)-c(cc4)ccc4-[n]4c(ccc(-c6ccccc6)c6)c6c6cc(-c7ccccc7)ccc46)c2c3[n]5-c2ccccc2)cc1 Chemical compound c1ccc(*(c2ccccc2-c2c(cc3c4c5cccc4)-c(cc4)ccc4-[n]4c(ccc(-c6ccccc6)c6)c6c6cc(-c7ccccc7)ccc46)c2c3[n]5-c2ccccc2)cc1 0.000 description 7
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- H—ELECTRICITY
- H05—ELECTRIC TECHNIQUES NOT OTHERWISE PROVIDED FOR
- H05B—ELECTRIC HEATING; ELECTRIC LIGHT SOURCES NOT OTHERWISE PROVIDED FOR; CIRCUIT ARRANGEMENTS FOR ELECTRIC LIGHT SOURCES, IN GENERAL
- H05B33/00—Electroluminescent light sources
- H05B33/10—Apparatus or processes specially adapted to the manufacture of electroluminescent light sources
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/14—Carrier transporting layers
- H10K50/15—Hole transporting layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/17—Carrier injection layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/18—Carrier blocking layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
- H10K85/633—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine comprising polycyclic condensed aromatic hydrocarbons as substituents on the nitrogen atom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
- H10K85/636—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine comprising heteroaromatic hydrocarbons as substituents on the nitrogen atom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/654—Aromatic compounds comprising a hetero atom comprising only nitrogen as heteroatom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6572—Polycyclic condensed heteroaromatic hydrocarbons comprising only nitrogen in the heteroaromatic polycondensed ring system, e.g. phenanthroline or carbazole
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6574—Polycyclic condensed heteroaromatic hydrocarbons comprising only oxygen in the heteroaromatic polycondensed ring system, e.g. cumarine dyes
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1007—Non-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1011—Condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1014—Carbocyclic compounds bridged by heteroatoms, e.g. N, P, Si or B
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1029—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1029—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom
- C09K2211/1037—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom with sulfur
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1088—Heterocyclic compounds characterised by ligands containing oxygen as the only heteroatom
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1092—Heterocyclic compounds characterised by ligands containing sulfur as the only heteroatom
Abstract
본 발명의 인돌로카르바졸 고리 구조를 갖는 화합물은, 하기 일반식 (1) 로 나타내고, 고효율, 고내구성의 유기 일렉트로루미네선스 소자를 형성하기 위한 재료로서 사용되며, 정공의 주입·수송 성능이 우수하고, 전자 저지 능력을 갖고, 박막 상태에서의 안정성이 높다.
식 중, A 는, 2 가의 방향족 탄화수소기 또는 방향족 복소고리기이고, Ar1 ∼ Ar4 는 1 가의 방향족 탄화수소기 또는 방향족 복소고리기이고, R1 ∼ R9 는, 수소 원자, 중수소 원자, 불소 원자, 염소 원자, 시아노기, 니트로기, 알킬기, 시클로알킬기, 알케닐기, 알킬옥시기, 시클로알킬옥시기, 방향족 탄화수소기, 방향족 복소고리기 또는 아릴옥시기이다.
식 중, A 는, 2 가의 방향족 탄화수소기 또는 방향족 복소고리기이고, Ar1 ∼ Ar4 는 1 가의 방향족 탄화수소기 또는 방향족 복소고리기이고, R1 ∼ R9 는, 수소 원자, 중수소 원자, 불소 원자, 염소 원자, 시아노기, 니트로기, 알킬기, 시클로알킬기, 알케닐기, 알킬옥시기, 시클로알킬옥시기, 방향족 탄화수소기, 방향족 복소고리기 또는 아릴옥시기이다.
Description
본 발명은, 각종 표시 장치에 바람직한 자발광 소자인 유기 일렉트로루미네선스 소자 (organic electro-luminescence device) 에 적합한 화합물과 그 소자에 관한 것으로, 상세하게는 인돌로카르바졸 고리 구조를 갖는 화합물과, 그 화합물을 사용한 유기 일렉트로루미네선스 소자에 관한 것이다.
유기 일렉트로루미네선스 소자는 자기 발광성 소자이기 때문에, 액정 소자에 비해 밝아 시인성이 우수하고, 선명한 표시가 가능하기 때문에, 활발한 연구가 이루어져 왔다.
1987년에 이스트먼·코닥사의 C. W. Tang 들은 발광을 위한 각종 역할을 각 재료에 분담한 적층 구조 소자를 개발함으로써 유기 재료를 사용한 유기 일렉트로루미네선스 소자를 실용적인 것으로 하였다. 그들은 전자를 수송할 수 있는 형광체, 트리스(8-하이드록시퀴놀린)알루미늄 (이후, Alq3 으로 약칭한다) 과 정공을 수송할 수 있는 방향족 아민 화합물을 적층하고, 양방의 전하를 형광체의 층 중에 주입하여 발광시킴으로써, 10 V 이하의 전압으로 1000 cd/㎡ 이상의 고휘도를 얻었다.
현재까지 유기 일렉트로루미네선스 소자 (이하, 「유기 EL 소자」라고 부르는 경우가 있다) 의 실용화를 위해서 많은 개량이 이루어지고, 각종 역할을 더욱 세분화하여 기판 상에 양극, 정공 주입층, 정공 수송층, 발광층, 전자 수송층, 전자 주입층 및 음극을 이 순서대로 형성한 구조의 것이 일반적으로 알려져 있으며, 이와 같은 소자에서는 고효율과 내구성이 달성되어 있다.
또, 발광 효율의 추가적인 향상을 목적으로 하여 삼중항 여기자의 이용이 시도되고, 발광 재료로서 인광 발광체의 이용도 검토되고 있다.
유기 EL 소자에 있어서는, 양 전극으로부터 주입된 전하가 발광층에서 재결합하여 발광이 얻어지지만, 정공, 전자의 양 전하를 어떻게 효율적으로 발광층에 수수할지가 중요하며, 정공 주입성을 높이고, 음극으로부터 주입된 전자를 블록하는 전자 저지성을 높임으로써, 정공과 전자가 재결합하는 확률을 향상시키고, 나아가서는 발광층 내에서 생성된 여기자를 가둠으로써, 고발광 효율을 얻을 수 있다. 그 때문에, 정공 수송 재료가 하는 역할은 중요하며, 정공 주입성이 높고, 정공의 이동도가 크며, 전자 저지성이 높고, 나아가서는 전자에 대한 내구성이 높은 정공 수송 재료가 요구되고 있다.
또, 소자의 수명에 관해서는, 이것을 형성하고 있는 각종 재료의 내열성이나 아모르퍼스성도 중요하다. 내열성이 낮은 재료가 사용되고 있으면, 소자 구동시에 발생하는 열에 의해 열분해가 일어나 재료가 열화된다. 아모르퍼스성이 낮은 재료가 사용되고 있으면, 짧은 시간이어도 박막의 결정화가 일어나 소자가 열화되어 버린다. 그 때문에, 유기 EL 소자의 형성에 사용하는 재료에는 내열성이 높고, 아모르퍼스성이 양호한 성질이 요구된다.
지금까지 유기 EL 소자에 사용되어 온 정공 수송 재료로는, N,N'-디페닐-N,N'-디(α-나프틸)벤지딘 (이후, NPD 라고 약칭한다) 이나 여러 방향족 아민 유도체가 알려져 있다 (예를 들어, 특허문헌 1 및 특허문헌 2 참조).
NPD 는 양호한 정공 수송 능력을 갖고 있지만, 내열성의 지표가 되는 유리 전이점 (Tg) 이 96 ℃ 로 낮아, 고온 조건하에서는 결정화에 의한 소자 특성의 저하가 일어나 버린다. 또, 방향족 아민 유도체 중에는, 정공의 이동도가 높고 (예를 들어 10-3 ㎠/Vs 이상), 우수한 이동도를 갖는 것이 있지만, 이와 같은 화합물은 전자 저지성이 불충분하기 때문에, 전자의 일부가 발광층을 빠져나가 발광 효율의 향상을 기대할 수 없다.
이와 같이, 추가적인 고효율화를 위해, 보다 전자 저지성이 높고, 박막이 보다 안정적이며 내열성이 높은 유기 EL 소자용 재료가 요구되고 있다.
열안정성이나 정공 수송성 등의 특성을 개량한 유기 EL 용 재료로서, 인돌로카르바졸 고리 구조를 갖는 것이 제안되어 있다 (예를 들어, 특허문헌 3 및 4 참조).
그러나, 이들 화합물을 사용하여 정공 주입층이나 정공 수송층이 형성되어 있는 소자에서는, 내열성이나 발광 효율 등이 개량되어 있지만, 여전히 충분하다고는 할 수 없고, 또, 구동 전압이 높고, 전류 효율도 충분하지 않다. 그 때문에, 추가적인 저구동 전압이나 고발광 효율화가 요구되고 있다.
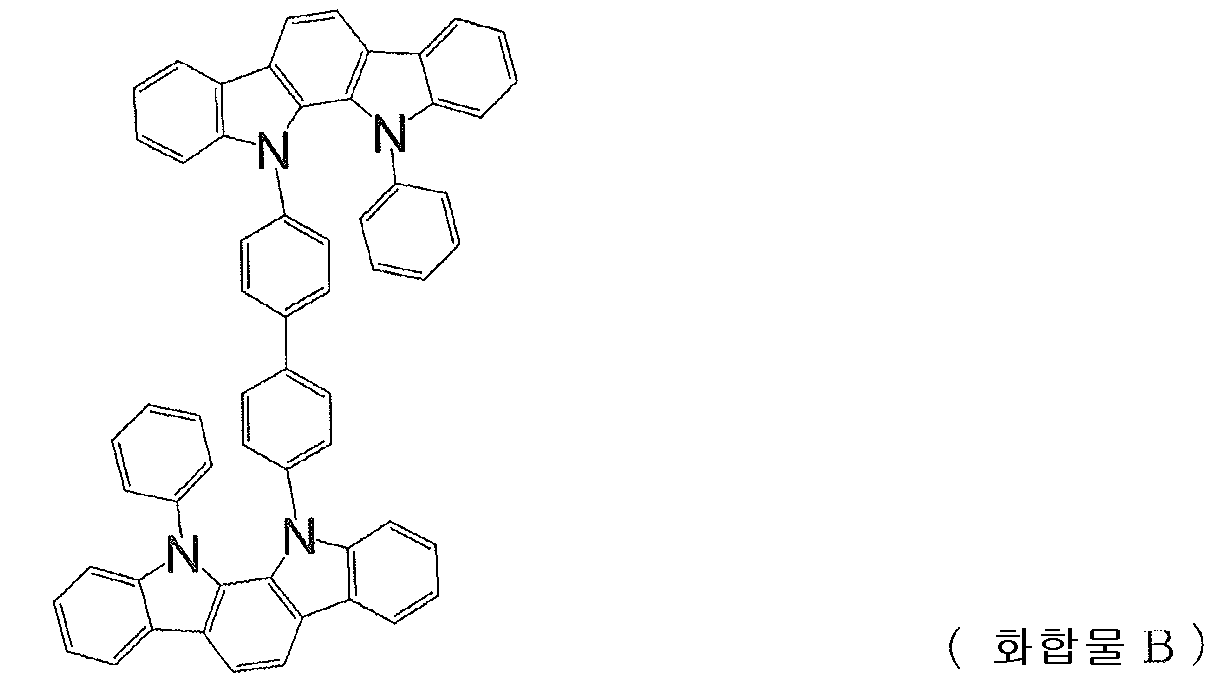
또, 인돌로카르바졸 고리 구조를 갖는 화합물로서, 하기 식으로 나타내는 치환 인돌로[2,3-a]카르바졸 고리 구조를 갖는 화합물 A 및 B 가 제안되어 있다 (예를 들어, 특허문헌 5 ∼ 9 참조).
[화학식 1]
[화학식 2]
그러나, 이들 화합물은 발광층의 호스트 재료로서 사용되고 있으며, 정공 수송 재료로서의 성능에 대해서는 전혀 검토되어 있지 않다.
본 발명의 목적은, 고효율, 고내구성의 유기 일렉트로루미네선스 소자를 형성하기 위한 재료로서 사용되고, 정공의 주입·수송 성능이 우수하고, 전자 저지 능력을 가지며, 박막 상태에서의 안정성이 높은 우수한 특성을 갖는 신규 유기 화합물을 제공하는 것에 있다.
또, 본 발명의 다른 목적은, 발광을 위해서 필요한 전하 수송층 등의 유기층이 상기의 화합물을 사용하여 형성되고, 고효율, 고내구성을 갖는 유기 일렉트로루미네선스 소자를 제공하는 것에 있다.
본 발명자들은 인돌로카르바졸 고리 구조에 의해, 높은 정공 이동도, 높은 삼중항 에너지 레벨 및 우수한 전자 저지성을 기대할 수 있고, 나아가서는 우수한 내열성과 박막 안정성도 기대할 수 있는 것, 그리고 방향족 3 급 아민 구조가 높은 정공 주입·수송 능력을 갖고 있는 것에 주목하여, 인돌로카르바졸 고리 구조와 방향족 3 급 아민 구조를 갖는 화합물을 설계하여 화학 합성하고, 그 화합물을 사용하여 여러 유기 일렉트로루미네선스 소자를 시작 (試作) 하여, 소자의 특성 평가를 실시한 결과, 본 발명을 완성하기에 이르렀다.
본 발명에 의하면,
인돌로카르바졸 고리 구조를 갖는 화합물로서, 하기 일반식 (1) 로 나타내는 것을 특징으로 하는 화합물이 제공된다.
[화학식 3]
식 중,
A 는 2 가의 방향족 탄화수소기 또는 방향족 복소고리기이고,
Ar1, Ar2, Ar3, Ar4 는 각각 1 가의 방향족 탄화수소기 또는 방향족 복소고리기를 나타내고, 이들 중, Ar3 및 Ar4 는, 단결합, 메틸렌기, 산소 원자 또는 황 원자를 개재하여 서로 결합되거나 혹은 기 A 와 결합되어 추가로 고리를 형성하고 있어도 되고,
R1 ∼ R9 는, 각각 수소 원자, 중수소 원자, 불소 원자, 염소 원자, 시아노기, 니트로기, 탄소 원자수 1 내지 6 의 알킬기, 탄소 원자수 5 내지 10 의 시클로알킬기, 탄소 원자수 2 내지 6 의 알케닐기, 탄소 원자수 1 내지 6 의 알킬옥시기, 탄소 원자수 5 내지 10 의 시클로알킬옥시기, 1 가의 방향족 탄화수소기, 1 가의 방향족 복소고리기 또는 아릴옥시기이다.
상기의 일반식 (1) 로 나타내는 본 발명의 인돌로카르바졸 고리 구조를 갖는 화합물에 있어서는, 상기 일반식 (1) 에 있어서, A 가 페닐렌기인 것이 바람직하다.
또, 본 발명에 있어서는, 상기 일반식 (1) 로 나타내는 화합물 중에서도, 특히 하기 일반식 (1a) ;
[화학식 4]
식 중,
Ar1 ∼ Ar3, R1 ∼ R9 는 상기 일반식 (1) 에 기재한 바와 같고,
R10 ∼ R16 은, 각각 수소 원자, 중수소 원자, 불소 원자, 염소 원자, 시아노기, 니트로기, 탄소 원자수 1 내지 6 의 알킬기, 탄소 원자수 5 내지 10 의 시클로알킬기, 탄소 원자수 2 내지 6 의 알케닐기, 탄소 원자수 1 내지 6 의 알킬옥시기, 탄소 원자수 5 내지 10 의 시클로알킬옥시기, 1 가의 방향족 탄화수소기, 1 가의 방향족 복소고리기 또는 아릴옥시기이다,
로 나타내는 화합물이 바람직하다.
이 일반식 (1a) 의 화합물은, 일반식 (1) 에 있어서의 기 A 가 페닐렌기이고, 또한 기 Ar4 가 그 페닐렌기에 결합 (단결합) 하여 고리를 형성하고 있는 것이다.
본 발명에 있어서는, 또한 상기 일반식 (1) 에 있어서,
(a) Ar1, Ar2 가 방향족 탄화수소기 (1 가) 인 것,
(b) Ar1, Ar2 가 페닐기인 것,
(c) R9 가 수소 원자, 중수소 원자 또는 페닐기인 것
이 바람직하다.
본 발명에 의하면, 또, 적어도 발광층을 포함하는 적층 구조가 1 쌍의 전극 사이에 형성되어 있는 유기 일렉트로루미네선스 소자에 있어서, 상기의 인돌로카르바졸 고리 구조를 갖는 화합물이 상기 적층 구조를 형성하고 있는 어느 층에 사용되고 있는 것을 특징으로 하는 유기 일렉트로루미네선스 소자 (유기 EL 소자) 가 제공된다.
본 발명의 유기 EL 소자에 있어서는,
(d) 상기 적층 구조는 정공 수송층을 포함하고, 상기 화합물이 그 정공 수송층에 사용되고 있는 것,
(e) 상기 적층 구조는 전자 저지층을 포함하고, 상기 화합물이 그 전자 저지층에 사용되고 있는 것,
(f) 상기 적층 구조는 정공 주입층을 포함하고, 상기 화합물이 그 정공 주입층에 사용되고 있는 것,
(g) 상기 화합물이 발광층에 사용되고 있는 것
이 바람직하다.
전술한 일반식 (1) 로 나타내는 본 발명의 인돌로카르바졸 고리 구조를 갖는 화합물은,
(ⅰ) 정공의 주입 특성이 양호하다,
(ⅱ) 정공의 이동도가 크다,
(ⅲ) 전자 저지 능력이 우수하다,
(ⅳ) 박막 상태가 안정적이다,
(ⅴ) 내열성이 우수하다,
는 특성을 갖고 있어, 유기 EL 소자에 요구되는 특성이 우수하다.
이와 같은 특성을 갖는 본 발명의 화합물은, 유기 EL 소자의 정공 주입층, 정공 수송층, 전자 저지층 혹은 발광층의 구성 재료로서 유용하고, 전자 저지 능력 이 우수하며, 우수한 전자의 저지 능력을 갖고, 또한 아모르퍼스성이 양호하며, 박막 상태가 안정적이고, 내열성이 우수하다. 이 때문에, 이 화합물이 사용되고 있는 본 발명의 유기 EL 소자는, 발광 효율 및 전력 효율이 높고, 이에 따라, 발광 개시 전압이 낮고, 나아가서는 실용 구동 전압이 낮고, 내구성도 우수하다는 이점을 갖고 있다.
도 1 은 본 발명 실시예 1 의 화합물 (화합물 4) 의 1H-NMR 차트도이다.
도 2 는 본 발명 실시예 2 의 화합물 (화합물 12) 의 1H-NMR 차트도이다.
도 3 은 본 발명 실시예 3 의 화합물 (화합물 13) 의 1H-NMR 차트도이다.
도 4 는 본 발명 실시예 4 의 화합물 (화합물 17) 의 1H-NMR 차트도이다.
도 5 는 본 발명 실시예 5 의 화합물 (화합물 76) 의 1H-NMR 차트도이다.
도 6 은 본 발명 실시예 6 의 화합물 (화합물 77) 의 1H-NMR 차트도이다.
도 7 은 실시예 9 ∼ 10, 비교예 1 의 EL 소자 구성을 나타낸 도이다.
도 2 는 본 발명 실시예 2 의 화합물 (화합물 12) 의 1H-NMR 차트도이다.
도 3 은 본 발명 실시예 3 의 화합물 (화합물 13) 의 1H-NMR 차트도이다.
도 4 는 본 발명 실시예 4 의 화합물 (화합물 17) 의 1H-NMR 차트도이다.
도 5 는 본 발명 실시예 5 의 화합물 (화합물 76) 의 1H-NMR 차트도이다.
도 6 은 본 발명 실시예 6 의 화합물 (화합물 77) 의 1H-NMR 차트도이다.
도 7 은 실시예 9 ∼ 10, 비교예 1 의 EL 소자 구성을 나타낸 도이다.
본 발명의 인돌로카르바졸 고리 구조를 갖는 화합물은, 앞에도 나타내고 있지만, 하기 일반식 (1) 로 나타낸다.
[화학식 5]
상기의 일반식 (1) 에 있어서, A, Ar1 ∼ Ar4, R1 ∼ R9 가 나타내는 기는 이하와 같다.
(기 A)
일반식 (1) 에 있어서, 기 A 는 방향족 탄화수소기 또는 방향족 복소고리기를 나타낸다. 이와 같은 방향족 탄화수소기나 방향족 복소고리기는 단고리에 한정되지 않고, 추가로 탄화수소 고리나 복소고리가 축합된 다고리 구조를 갖는 것이어도 된다.
예를 들어, 이 방향족 탄화수소기는 2 가의 기이고, 페닐렌기, 비페닐렌기, 터페닐렌기, 테트라키스페닐렌기, 나프틸렌기, 안트릴렌, 페난트릴렌기, 플루오레닐렌기, 페난트롤릴렌기 등이 대표적이다.
또, 방향족 복소고리기도 2 가의 기이고, 인데닐렌기, 피레닐렌기, 페릴레닐렌기, 플루오란테닐렌기, 트리페닐레닐렌기, 피리디닐렌기, 피리미디닐렌기, 퀴놀릴렌기, 이소퀴놀릴렌기, 인돌릴렌기, 카르바졸릴렌기, 퀴녹살릴렌기, 벤조이미다졸릴렌기, 피라졸릴렌기, 나프티리디닐렌기, 페난트롤리닐렌기, 아크리디닐렌기, 티에닐렌기, 벤조티에닐렌기, 벤조티아졸릴렌기, 디벤조티에닐렌기 등을 예시할 수 있다.
또한, 기 A 가 나타내는 방향족 탄화수소기 및 방향족 복소고리기는, 후기의 Ar3 혹은 Ar4 가 결합되어 추가로 고리를 형성하고 있어도 된다. 후술하는 일반식 (1a) 에서는, 기 A 에 Ar4 가 결합되어 추가로 고리를 형성하고 있다.
또한, 상기의 방향족 탄화수소기 및 방향족 복소고리기는 치환기를 갖고 있어도 된다. 이와 같은 치환기로는, 중수소 원자 ; 시아노기 ; 니트로기 ; 불소 원자, 염소 원자, 브롬 원자, 요오드 원자 등의 할로겐 원자 ; 메틸기, 에틸기, n-프로필기, 이소프로필기, n-부틸기, 이소부틸기, tert-부틸기, n-펜틸기, 이소펜틸기, 네오펜틸기, n-헥실기 등의 탄소 원자수 1 내지 6 의 직사슬형 혹은 분기형의 알킬기 ; 시클로펜틸기, 시클로헥실기, 1-아다만틸기, 2-아다만틸기 등의 탄소 원자수 5 내지 10 의 시클로알킬기 ; 메톡시기, 에톡시기, 프로필옥시기 등의 탄소 원자수 1 내지 6 의 직사슬형 혹은 분기형의 알콕시기 ; 시클로펜틸옥시기, 시클로헥실옥시기, 시클로헵틸옥시기, 시클로옥틸옥시기, 1-아다만틸옥시기, 2-아다만틸옥시기 등의 탄소 원자수 5 내지 10 의 시클로알킬옥시기 ; 알릴기, 이소프로페닐기, 2-부테닐기 등의 탄소 원자수 2 내지 6 의 직사슬형 혹은 분기형의 알케닐기 ; 페녹시기, 톨릴옥시기 등의 아릴옥시기 ; 벤질옥시기, 페네틸옥시기 등의 아릴알콕시기 ; 페닐기, 비페닐릴기, 터페닐릴기, 나프틸기, 안트라세닐기, 페난트릴기, 플루오레닐기, 인데닐기, 피레닐기, 페릴레닐기, 플루오란테닐기, 트리페닐레닐기 등의 방향족 탄화수소기 혹은 축합 다고리 방향족기 ; 피리딜기, 푸라닐기, 피라닐기, 티에닐기, 푸릴기, 피롤릴기, 퀴놀릴기, 이소퀴놀릴기, 벤조푸라닐기, 벤조티에닐기, 인돌릴기, 카르바졸릴기, 벤조옥사졸릴기, 벤조티아졸릴기, 퀴녹살릴기, 벤조이미다졸릴기, 피라졸릴기, 디벤조푸라닐기, 디벤조티에닐기, 카르볼리닐기 등의 방향족 복소고리기와 같은 기를 들 수 있다.
상기의 치환기는 추가로 치환기를 갖고 있어도 된다. 또, 이들 치환기끼리가 단결합, 치환 혹은 비치환의 메틸렌기, 산소 원자 또는 황 원자를 개재하여 서로 결합되어 고리를 형성하고 있어도 된다.
(Ar1 ∼ Ar4)
Ar1 ∼ Ar4 도 각각 방향족 탄화수소기 또는 방향족 복소고리기를 나타내지만, 이들은 1 가의 기이다. 이들 방향족 탄화수소기나 방향족 복소고리기도 단고리에 한정되지 않고, 추가로 탄화수소 고리나 복소고리가 축합된 다고리 구조를 갖는 것이어도 된다.
이와 같은 1 가의 방향족 탄화수소기의 대표예로는, 페닐기, 비페닐릴기, 터페닐릴기, 나프틸기, 안트릴기, 페난트릴기, 플루오레닐기를 예시할 수 있다.
또, 1 가의 방향족 복소고리기로는, 인데닐기, 피레닐기, 페릴레닐기, 플루오란테닐기, 트리페닐레닐기, 피리딜기, 푸라닐기, 피라닐기, 티에닐기, 퀴놀릴기, 이소퀴놀릴기, 벤조푸라닐기, 벤조티에닐기, 인돌릴기, 카르바졸릴기, 벤조옥사졸릴기, 벤조티아졸릴기, 퀴녹살릴기, 벤조이미다졸릴기, 피라졸릴기, 디벤조푸라닐기, 디벤조티에닐기, 및 카르볼리닐기 등을 들 수 있다. 이들 복소고리기는, 헤테로 원자가 아니라, 고리 중의 탄소 원자가 일반식 (1) 중의 N 원자에 결합되어 있는 것이 화합물의 안정성, 내열성의 관점에서 바람직하다.
또한, 이들 1 가의 방향족 탄화수소기 및 1 가의 방향족 복소고리기도 치환기를 갖고 있어도 되고, 이와 같은 치환기는 상기의 기 A 가 갖고 있어도 되는 치환기와 동일하다.
또한, Ar3 및 Ar4 는, 단결합, 치환 혹은 비치환의 메틸렌기, 산소 원자 또는 황 원자를 개재하여 서로 결합되거나 혹은 전술한 기 A 와 결합되어 추가로 고리를 형성하고 있어도 된다.
(R1 ∼ R9)
R1 ∼ R9 는, 각각 수소 원자, 중수소 원자, 불소 원자, 염소 원자, 시아노기, 니트로기, 탄소 원자수 1 내지 6 의 알킬기, 탄소 원자수 5 내지 10 의 시클로알킬기, 탄소 원자수 2 내지 6 의 알케닐기, 탄소 원자수 1 내지 6 의 알킬옥시기, 탄소 원자수 5 내지 10 의 시클로알킬옥시기, 1 가의 방향족 탄화수소기, 1 가의 방향족 복소고리기 또는 아릴옥시기이다.
탄소수가 1 ∼ 6 인 알킬기는 직사슬형이어도 되고 분지형이어도 되며, 예를 들어, 메틸기, 에틸기, n-프로필기, 이소프로필기, n-부틸기, 이소부틸기, tert-부틸기, n-펜틸기, 이소펜틸기, 네오펜틸기, n-헥실기를 들 수 있다.
탄소수가 5 ∼ 10 인 시클로알킬기로는, 시클로펜틸기, 시클로헥실기, 1-아다만틸기, 2-아다만틸기를 예시할 수 있다.
탄소수가 2 ∼ 6 인 알케닐기는 직사슬형이어도 되고 분지형이어도 되며, 그 구체예로는, 비닐기, 알릴기, 이소프로페닐기, 2-부테닐기를 들 수 있다.
탄소수 1 ∼ 6 의 알킬옥시기도 직사슬형이어도 되고 분지형이어도 되며, 그 구체예로는, 메틸옥시기, 에틸옥시기, n-프로필옥시기, 이소프로필옥시기, n-부틸옥시기, tert-부틸옥시기, n-펜틸옥시기, n-헥실옥시기를 들 수 있다.
탄소수 5 ∼ 10 의 시클로알킬옥시기의 예로는, 시클로펜틸옥시기, 시클로헥실옥시기, 시클로헵틸옥시기, 시클로옥틸옥시기, 1-아다만틸옥시기, 2-아다만틸옥시기 등을 들 수 있다.
또, 1 가의 방향족 탄화수소기나 방향족 복소고리기도 기 Ar1 ∼ Ar4 에 대해 설명한 바와 같이, 이들 기도 단고리에 한정되지 않고, 추가로 탄화수소 고리나 복소고리가 축합된 다고리 구조를 갖는 것이면 된다.
이와 같은 방향족 탄화수소기의 예로는, 페닐기, 비페닐릴기, 터페닐릴기, 나프틸기, 안트릴기, 페난트릴기, 플루오레닐기, 인데닐기, 피레닐기, 페릴레닐기, 플루오란테닐기, 트리페닐레닐기를 들 수 있다.
방향족 복소고리기의 예로는, 피리딜기, 푸라닐기, 피라닐기, 티에닐기, 퀴놀릴기, 이소퀴놀릴기, 벤조푸라닐기, 벤조티에닐기, 인돌릴기, 카르바졸릴기, 벤조옥사졸릴기, 벤조티아졸릴기, 퀴녹살릴기, 벤조이미다졸릴기, 피라졸릴기, 디벤조푸라닐기, 디벤조티에닐기, 및 카르볼리닐기 등을 들 수 있다. 또, 이들 복소고리기에 있어서도, 헤테로 원자가 아니라, 고리 중의 탄소 원자가 일반식 (1) 중의 방향족 고리 중의 탄소 원자에 결합되어 있는 것이 화합물의 안정성, 내열성의 관점에서 바람직하다.
또한, 아릴옥시기로는, 페녹시기, 비페닐릴옥시기, 터페닐릴옥시기, 나프틸옥시기, 안트릴옥시기, 페난트릴옥시기, 플루오레닐옥시기, 인데닐옥시기, 피레닐옥시기, 페릴레닐옥시기 등을 들 수 있다.
상기 서술한 R1 ∼ R9 가 나타내는 각 기 중, 알킬기, 시클로알킬기, 알케닐기, 알킬옥시기, 시클로알킬옥시기, 방향족 탄화수소기, 방향족 복소고리기 및 아릴옥시기는 모두 치환기를 갖고 있어도 된다. 이와 같은 치환기는, 각 기의 탄소 원자수가 소정의 범위 내인 것을 조건으로 하여, 전술한 기 A 나 Ar1 ∼ Ar4 가 갖고 있어도 되는 치환기와 동일하다. 또한, 이와 같은 치환기는 추가로 치환기를 갖고 있어도 된다. 또, 이들 치환기끼리가 단결합, 치환 혹은 비치환의 메틸렌기, 산소 원자 또는 황 원자를 개재하여 서로 결합되어 고리를 형성하고 있어도 된다.
또, 상기의 R1 ∼ R9 는 상기의 치환기 이외에도, 디치환 아미노기를 치환기로서 갖고 있어도 된다. 이와 같은 디치환 아미노기가 갖는 치환기 (즉, 아미노기의 N 원자에 결합되어 있는 기) 로는, 알킬기, 방향족 탄화수소기, 축합 다고리 방향족기, 아르알킬기, 방향족 복소고리기 및 알케닐기를 들 수 있고, 특히, 디페닐아미노기, 디나프틸아미노기, 페닐나프틸아미노기가 디치환 아미노기로서 바람직하다.
본 발명에 있어서, 상기 서술한 R1 ∼ R9 중, 기 R9 는, 단고리 혹은 다고리의 방향족 탄화수소기인 것이 바람직하고, 특히, 페닐기, 비페닐기 혹은 나프틸기인 것이 바람직하다.
또, 기 R9 로서 바람직한 방향족 탄화수소기는 치환기를 갖고 있어도 되고, 특히 전술한 디페닐아미노기, 디나프틸아미노기, 페닐나프틸아미노기를 치환기로서 갖는 것이 바람직하다.
상기 서술한 일반식 (1) 로 나타내는 본 발명의 인돌로카르바졸 고리 구조를 갖는 화합물에 있어서는, 특히 하기 일반식 (1a) 로 나타내는 화합물이 내열성이나 안정성 등의 관점에서 바람직하다.
[화학식 6]
상기의 일반식 (1a) 에 있어서, Ar1 ∼ Ar3, R1 ∼ R9 는 상기 일반식 (1) 에 기재한 바와 같다.
또, R10 ∼ R16 은, 각각 수소 원자, 중수소 원자, 불소 원자, 염소 원자, 시아노기, 니트로기, 탄소 원자수 1 내지 6 의 알킬기, 탄소 원자수 5 내지 10 의 시클로알킬기, 탄소 원자수 2 내지 6 의 알케닐기, 탄소 원자수 1 내지 6 의 알킬옥시기, 탄소 원자수 5 내지 10 의 시클로알킬옥시기, 방향족 탄화수소기, 방향족 복소고리기 또는 아릴옥시기이다. 이들 중, 알킬기, 시클로알킬기, 알케닐기, 알킬옥시기, 방향족 탄화수소기, 방향족 복소고리기 및 아릴옥시기에 대해서는, 상기에서 예시한 것과 동일한 것을 들 수 있다.
이미 서술한 바와 같이, 이 일반식 (1a) 의 화합물은, 일반식 (1) 에 있어서의 기 A 가 페닐렌기이고, 또한 기 Ar4 가 그 페닐렌기에 결합 (단결합) 되어 고리를 형성하고 있는 것이다.
(인돌로카르바졸 고리 구조를 갖는 화합물의 제조)
상기 서술한 본 발명의 인돌로카르바졸 고리 구조를 갖는 화합물은 신규 화합물이며, 이하와 같이 하여 합성할 수 있다.
출발 원료로서 11,12-디하이드로인돌로[2,3-a]카르바졸을 사용한다. 이 원료 카르바졸은, 예를 들어 2-아미노시클로헥사논 염산염과 페닐하이드라진 염산염의 반응에 의해 합성할 수 있다 (Synlett., 1, 42(2005) 참조).
상기의 원료 카르바졸과 요오드벤젠의 울만 반응 등의 축합 반응을 실시함으로써, 11,12-디페닐-인돌로[2,3-a]카르바졸을 합성할 수 있다.
이와 같이 하여 얻어진 11,12-디페닐-인돌로[2,3-a]카르바졸을 N-브로모숙신산이미드 등을 사용하여 브로모화하여, 5-브로모-11,12-디페닐-인돌로[2,3-a]카르바졸을 합성할 수 있다.
상기와 같이 하여 브로모 치환 카르바졸을 합성할 때에는, 예를 들어 일반식 (1) 의 구조에 따라, 상당하는 치환기로 치환된 2-아미노시클로헥사논 염산염, 요오드, 혹은 브로모아릴 화합물을 사용하면 되고, 이로써, 일반식 (1) 의 구조에 대응하는 11,12-디아릴-인돌로[2,3-a]카르바졸의 5-브로모 치환체를 합성할 수 있다.
이어서, 여러 디아릴아미노기로 치환된 아릴할라이드와 피나콜보란이나 비스(피나콜레이트)디보론 등과의 반응으로 합성되는 보론산 또는 보론산에스테르를 준비한다 (예를 들어, J. Org. Chem., 60, 7508(1995) 참조).
이 보론산 또는 보론산에스테르와, 일반식 (1) 의 구조에 대응하는 11,12-디아릴-인돌로[2,3-a]카르바졸의 5-브로모 치환체를 Suzuki 커플링 등의 크로스 커플링 반응 (예를 들어, Synth. Commun., 11, 513(1981) 참조) 함으로써, 목적으로 하는 본 발명의 인돌로카르바졸 고리 구조를 갖는 화합물을 합성할 수 있다.
또한, 상기와 같이 하여 합성되는 본 발명의 화합물의 정제는, 칼럼 크로마토그래프를 사용한 정제, 실리카 겔, 활성탄, 활성 백토 등에 의한 흡착 정제, 용매에 의한 재결정이나 정석법 등에 의해 실시되고, NMR 등에 의한 분석에 의해 동정 (同定) 할 수 있다.
본 발명에 있어서, 일반식 (1) 로 나타내는 인돌로카르바졸 고리 구조를 갖는 화합물 중에서, 특히 바람직한 화합물의 구체예를 이하에 나타낸다. 이하에 예시된 화합물 중에서도, 전술한 일반식 (1a) 로 나타내는 화합물은, 특히 바람직하다.
[화학식 7]
[화학식 8]
[화학식 9]
[화학식 10]
[화학식 11]
[화학식 12]
[화학식 13]
[화학식 14]
[화학식 15]
[화학식 16]
[화학식 17]
[화학식 18]
[화학식 19]
[화학식 20]
[화학식 21]
[화학식 22]
[화학식 23]
[화학식 24]
[화학식 25]
[화학식 26]
[화학식 27]
[화학식 28]
[화학식 29]
[화학식 30]
[화학식 31]
[화학식 32]
[화학식 33]
[화학식 34]
[화학식 35]
[화학식 36]
[화학식 37]
[화학식 38]
[화학식 39]
[화학식 40]
[화학식 41]
[화학식 42]
[화학식 43]
[화학식 44]
[화학식 45]
[화학식 46]
[화학식 47]
[화학식 48]
[화학식 49]
[화학식 50]
[화학식 51]
[화학식 52]
[화학식 53]
[화학식 54]
[화학식 55]
[화학식 56]
[화학식 57]
[화학식 58]
[화학식 59]
[화학식 60]
[화학식 61]
[화학식 62]
[화학식 63]
[화학식 64]
[화학식 65]
[화학식 66]
[화학식 67]
[화학식 68]
[화학식 69]
[화학식 70]
[화학식 71]
[화학식 72]
[화학식 73]
[화학식 74]
[화학식 75]
[화학식 76]
[화학식 77]
[화학식 78]
[화학식 79]
[화학식 80]
[화학식 81]
[화학식 82]
(용도)
상기 서술한 본 발명의 인돌로카르바졸 고리 구조를 갖는 화합물은 신규 화합물이고, 예를 들어, 유리 전이점 (Tg) 이 높고, 후술하는 실시예에도 나타나 있는 바와 같이, 100 ℃ 이상, 특히 150 ℃ 이상의 유리 전이점 (Tg) 을 갖고 있다. 이와 같은 높은 유리 전이점 (Tg) 은, 내열성이 우수한 박막을 형성할 수 있고, 또한 아모르퍼스 상태가 안정적으로 유지되어 박막 상태가 안정적인 것을 알 수 있다.
또, 본 발명의 화합물을 사용하여 100 ㎚ 두께의 증착막을 형성하고, 그 일함수를 측정하면, NPD 나 TPD 등의 공지된 정공 수송 재료에 비해 높은 값을 나타낸다.
이와 같은 관점에서, 본 발명의 인돌로카르바졸 고리 구조를 갖는 화합물은, 유기 EL 소자의 정공 주입층 및/또는 정공 수송층의 구성 재료로서 사용할 수 있다. 즉, 본 발명의 화합물을 사용하여 정공 주입층이나 정공 수송층을 형성함으로써, 정공의 주입성을 높이고 또한 그 이동도를 크게 할 수 있으며, 나아가서는 전자 저지성을 높이고, 전자에 대한 안정성을 높여, 그 소자의 발광층 내에서 생성된 여기자를 가둘 수 있고, 또한 정공과 전자가 재결합하는 확률을 향상시켜, 고발광 효율을 얻을 수 있음과 함께, 구동 전압을 저하시키고, 유기 EL 소자의 내구성을 향상시킬 수 있다.
또, 본 발명의 화합물은, 유기 EL 소자의 전자 저지층의 구성 재료로서도 사용할 수 있다. 우수한 전자의 저지 능력과 함께 종래의 재료에 비해 정공 수송성이 우수하고, 또한 박막 상태의 안정성이 높은 본 발명의 화합물을 사용함으로써, 높은 발광 효율을 가지면서, 구동 전압이 저하되고, 전류 내성이 개선되며, 유기 EL 소자의 최대 발광 휘도를 향상시킬 수 있다.
또한, 본 발명의 화합물은, 유기 EL 소자의 발광층의 구성 재료로서도 사용할 수 있다. 종래의 재료에 비해 정공 수송성이 우수하고, 또한 밴드 갭이 넓은 본 발명의 재료를 발광층의 호스트 재료로서 사용하여, 도펀트라고 불리는 형광 발광체나 인광 발광체를 담지시켜 발광층을 형성함으로써, 구동 전압이 저하되고, 발광 효율이 개선된 유기 EL 소자를 실현할 수 있다.
(유기 EL 소자)
상기 서술한 본 발명의 화합물을 사용하여 형성되는 유기 EL 소자는, 소정의 기판 (예를 들어 유리 기판이나 투명 수지 기판 등) 상에, 양극, 정공 수송층, 전자 저지층, 발광층, 전자 수송층 및 음극을 이 순서대로 형성한 구조를 갖는 것이 대표적이지만, 이와 같은 구조에 한정되는 것은 아니다.
예를 들어, 양극과 정공 수송층 사이에 정공 주입층을 형성할 수 있고, 전자 수송층과 음극 사이에 전자 주입층을 형성할 수도 있다.
나아가서는, 상기의 다층 구조에 있어서, 몇 개의 층을 생략할 수도 있다. 예를 들어 기판 상에, 양극, 정공 수송층, 발광층, 전자 수송층, 음극을 순차 형성한 구조로 할 수도 있다.
전술한 본 발명의 화합물은, 상기와 같은 다층 구조에 있어서의 정공 수송층, 정공 주입층, 전자 저지층, 발광층 등의 형성에 사용되게 된다.
유기 EL 소자의 양극은, 그 자체 공지된 전극 재료로 형성되어 있어도 되고, ITO 나 금과 같은 일함수가 큰 전극 재료가 사용된다.
정공 주입층은, 전술한 본 발명의 일반식 (1) 로 나타내는 인돌로카르바졸 고리 구조를 갖는 화합물 외에, 구리 프탈로시아닌으로 대표되는 포르피린 화합물, 스타버스트형의 트리페닐아민 유도체, 여러 트리페닐아민 사량체 등의 재료, 헥사시아노아자트리페닐렌과 같은 억셉터성의 복소고리 화합물이나 도포형의 고분자 재료를 사용하여 형성할 수 있다. 이들 재료를 사용한 박막 형성은, 증착법 외에, 스핀 코트법이나 잉크젯법 등의 공지된 방법에 의해 실시할 수 있다. 이하에 서술하는 각종 층도 동일하게, 증착이나 스핀 코트, 잉크젯 등에 의해 성막할 수 있다.
정공 수송층은, 본 발명의 화합물 외에, 종래 공지된 정공 수송 재료를 사용하여 형성할 수 있다.
이와 같은 정공 재료로서 대표적인 것은 다음과 같다.
벤지딘 유도체, 예를 들어,
N,N'-디페닐-N,N'-디(m-톨릴)벤지딘
(이하, TPD 라고 약기한다) ;
N,N'-디페닐-N,N'-디(α-나프틸)벤지딘
(이하, NPD 라고 약기한다) ;
N,N,N',N'-테트라비페닐릴벤지딘 ;
아민계 유도체, 예를 들어,
1,1-비스[4-(디-4-톨릴아미노)페닐]시클로헥산
(이하, TAPC 라고 약기한다) ;
여러 트리페닐아민 삼량체 및 사량체 ;
본 발명의 화합물을 포함하여, 상기 서술한 종래 공지된 정공 수송 재료의 화합물은 각각 단독으로 성막해도 되지만, 2 종 이상을 혼합하여 성막할 수도 있고, 또, 상기 화합물의 1 종 또는 복수종을 사용하여 복수의 층을 형성하고, 이와 같은 층이 적층된 다층막을 정공 수송층으로 할 수도 있다.
정공 주입층 또는 정공 수송층은, 폴리(3,4-에틸렌디옥시티오펜) (이후, PEDOT 라고 약칭한다) 및 폴리(스티렌술포네이트) (이후, PSS 라고 약칭한다) 등의 도포형의 고분자 재료를 사용하여 형성할 수 있다.
또, 정공 주입층 혹은 정공 수송층에 있어서, 그 층에 통상적으로 사용되는 재료에 대해, 추가로 트리스브로모페닐아민헥사클로로안티몬 등을 P 도핑한 것이나, TPD 의 구조를 그 부분 구조로 갖는 고분자 화합물 등을 사용할 수도 있다.
전자 저지층으로는, 전술한 본 발명의 화합물 외에, 전자 저지 작용을 갖는 공지된 화합물, 예를 들어, 카르바졸 유도체나, 트리페닐실릴기를 갖고 또한 트리아릴아민 구조를 갖는 화합물 등을 사용할 수 있다. 카르바졸 유도체를 갖는 화합물 및 트리아릴아민 구조를 갖는 화합물의 구체예는 이하와 같다.
<카르바졸 유도체>
4,4',4"-트리(N-카르바졸릴)트리페닐아민
(이후, TCTA 라고 약칭한다) ;
9,9-비스[4-(카르바졸-9-일)페닐]플루오렌 ;
1,3-비스(카르바졸-9-일)벤젠
(이후, mCP 라고 약칭한다) ;
2,2-비스(4-카르바졸-9-일페닐)아다만탄
(이후, Ad-Cz 라고 약칭한다) ;
<트리아릴아민 구조를 갖는 화합물>
9-[4-(카르바졸-9-일)페닐]-9-[4-(트리페닐실릴)페닐]-9H-플루오렌 ;
이와 같은 전자 저지층도, 본 발명의 화합물이나 종래 공지된 정공 수송 재료의 화합물을 1 종 단독 혹은 2 종 이상을 사용하여 형성되지만, 이들 화합물의 1 종 또는 복수종을 사용하여 복수의 층을 형성하고, 이와 같은 층이 적층된 다층막을 전자 저지층으로 할 수도 있다.
유기 EL 소자의 발광층은 Alq3 을 비롯한 퀴놀리놀 유도체의 금속 착물 외에, 아연이나 베릴륨, 알루미늄 등의 각종 금속 착물, 안트라센 유도체, 비스스티릴벤젠 유도체, 피렌 유도체, 옥사졸 유도체, 폴리파라페닐렌비닐렌 유도체 등의 발광 재료를 사용하여 형성된다.
또, 발광층을 호스트 재료와 도펀트 재료로 구성할 수도 있고, 이 경우의 호스트 재료로서, 전술한 본 발명의 인돌로카르바졸 고리 구조를 갖는 화합물을 사용할 수 있다. 또, 본 발명의 화합물 이외에도, 상기의 발광 재료 외에, 티아졸 유도체, 벤즈이미다졸 유도체, 폴리디알킬플루오렌 유도체 등을 호스트 재료로서 사용할 수 있다.
도펀트 재료로는, 퀴나크리돈, 쿠마린, 루브렌, 페릴렌 및 그들의 유도체, 벤조피란 유도체, 로다민 유도체, 아미노스티릴 유도체 등을 사용할 수 있다.
상기 서술한 발광층도 각 발광 재료의 1 종 혹은 2 종 이상을 사용한 단층 구성으로 할 수도 있고, 복수의 층을 적층한 다층 구조로 할 수도 있다.
또한, 발광 재료로서 인광 발광 재료를 사용하여 발광층을 형성할 수도 있다.
인광 발광 재료로는, 이리듐이나 백금 등의 금속 착물의 인광 발광체를 사용할 수 있다. 예를 들어, Ir(ppy)3 등의 녹색의 인광 발광체, FIrpic, FIr6 등의 청색의 인광 발광체, Btp2Ir(acac) 등의 적색의 인광 발광체 등을 사용할 수 있고, 이들 인광 발광 재료는, 정공 주입·수송성의 호스트 재료나 전자 수송성의 호스트 재료에 도프하여 사용된다.
정공 수송성의 호스트 재료로는, 4,4'-디(N-카르바졸릴)비페닐 (이후, CBP 라고 약칭한다) 이나 TCTA, mCP 등의 카르바졸 유도체 등에 더하여, 본 발명의 화합물을 사용할 수 있다.
또, 전자 수송성의 호스트 재료로는, p-비스(트리페닐실릴)벤젠 (이후, UGH2 라고 약칭한다) 이나 2,2',2"-(1,3,5-페닐렌)-트리스(1-페닐-1H-벤즈이미다졸) (이후, TPBI 라고 약칭한다) 등을 사용할 수 있다.
또한, 인광성 발광 재료의 호스트 재료에 대한 도프는 농도 소광을 피하기 위해, 발광층 전체에 대하여 1 ∼ 30 중량퍼센트의 범위에서 공증착에 의해 도프하는 것이 바람직하다.
유기 EL 소자의 정공 저지층으로는, 그 자체 공지된 정공 저지 작용을 갖는 화합물을 사용할 수 있다.
이와 같은 정공 저지 작용을 갖는 화합물의 예로는, 바소큐프로인 (이후, BCP 라고 약칭한다) 등의 페난트롤린 유도체나, 알루미늄 (Ⅲ) 비스(2-메틸-8-퀴놀리네이트)-4-페닐페놀레이트 (이후, BAlq 라고 약칭한다) 등의 퀴놀리놀 유도체의 금속 착물 외에, 트리아졸 유도체, 트리아진 유도체, 옥사디아졸 유도체 등을 들 수 있다.
이들 재료는 전자 수송층의 재료를 겸해도 된다.
이와 같은 정공 저지층도 단층 혹은 다층의 적층 구조로 할 수 있고, 각 층은 상기 서술한 정공 저지 작용을 갖는 화합물의 1 종 혹은 2 종 이상을 사용하여 성막된다.
유기 EL 소자의 전자 수송층은, 전자 수송성의 화합물, 예를 들어, Alq3, BAlq 를 비롯한 퀴놀리놀 유도체의 금속 착물 외에, 아연이나 베릴륨, 알루미늄 등의 각종 금속 착물, 트리아졸 유도체, 트리아진 유도체, 옥사디아졸 유도체, 티아디아졸 유도체, 카르보디이미드 유도체, 퀴녹살린 유도체, 페난트롤린 유도체, 실롤 유도체 등을 사용하여 형성된다.
이 전자 수송층도 단층 혹은 다층의 적층 구조로 할 수 있고, 각 층은 상기 서술한 전자 수송성 화합물의 1 종 혹은 2 종 이상을 사용하여 성막된다.
또한, 유기 EL 소자의 전자 주입층은 종래 공지된 것과 동일하게, 불화리튬, 불화세슘 등의 알칼리 금속염, 불화마그네슘 등의 알칼리 토금속염, 산화알루미늄 등의 금속 산화물 등을 사용하여 형성할 수 있지만, 전자 수송층과 음극의 바람직한 선택에 있어서는 이것을 생략할 수 있다.
유기 EL 소자의 음극으로는, 알루미늄과 같은 일함수가 낮은 전극 재료나, 마그네슘 은 합금, 마그네슘 인듐 합금, 알루미늄 마그네슘 합금과 같은 보다 일함수가 낮은 합금이 전극 재료로서 사용된다.
실시예
<실시예 1>
5-(9-페닐-9H-카르바졸-3-일)-11,12-디페닐인돌로[2,3-a]카르바졸 (화합물 4) 의 합성 ;
질소 치환한 반응 용기에,
11,12-디하이드로인돌로[2,3-a]카르바졸 15.0 g
요오드벤젠 19.6 ㎖
구리 분말 0.37 g
3,5-디(tert-부틸)살리실산 1.47 g
탄산칼륨 12.13 g
도데실벤젠 25 ㎖
를 첨가하여 가열하고, 200 ℃ 에서 7 시간 교반하였다. 100 ℃ 까지 냉각시킨 후, 톨루엔 400 ㎖ 를 첨가하여 용해시키고, 불용물을 여과에 의해 제거하였다.
감압하에서 농축한 후, 메탄올 500 ㎖ 를 사용한 결정화를 실시하여,
11,12-디페닐인돌로[2,3-a]카르바졸의 백색 분체 22.6 g
을 얻었다 (수율 94.5 %).
이어서, 반응 용기에,
상기에서 얻어진 카르바졸의 백색 분체 22.6 g
DMF 300 ㎖
N-브로모숙신산이미드 9.36 g
을 첨가하고, 실온하, 8 시간 교반한 후, 다시 하룻밤 방치하였다.
이어서, 반응 용액을 물 1000 ㎖ 에 첨가하고, 여과에 의해 조제물 (粗製物) 을 채취한 후, 수세정, 계속해서 메탄올 세정을 실시하여,
5-브로모-11,12-디페닐인돌로[2,3-a]카르바졸의 분체
26.3 g (수율 100 %)
을 얻었다.
이어서, 미리 질소 치환한 반응 용기에,
상기에서 얻어진 브로모화된 카르바졸의 분말 3.80 g
9-페닐-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-9H-카르바졸 2.88 g
톨루엔/에탄올 (4/1, v/v) 의 혼합 용매 35 ㎖
2 M 탄산칼륨 수용액 12 ㎖
를 첨가하고, 초음파를 조사하면서 30 분간 질소 가스를 통기하였다.
또한,
테트라키스(트리페닐포스핀)팔라듐 (0) 0.24 g
을 첨가하여 가열하고, 환류하, 15 시간 교반하였다. 실온까지 냉각시킨 후, 톨루엔 50 ㎖, 물 20 ㎖ 를 첨가하고, 분액 조작을 실시하여 유기층을 채취하였다. 또한, 수층을 톨루엔 20 ㎖ 에 의한 추출 조작을 실시하여 유기층을 채취하였다. 유기층을 합한 후, 무수 황산마그네슘에 의한 탈수를 실시하고, 감압하에서 농축함으로써 조제물을 얻었다.
얻어진 조제물을 칼럼 크로마토그래프 (담체 : 실리카 겔, 용리액 : 톨루엔/시클로헥산) 에 의해 정제하고, 전술한 화합물 4 에 상당하는,
5-(9-페닐-9H-카르바졸-3-일)-11,12-디페닐인돌로[2,3-a]카르바졸의 담황색 분체 1.69 g (수율 33.3 %)
을 얻었다.
얻어진 담황색 분체에 대해 NMR 을 사용하여 구조를 동정하였다. 1H-NMR 측정 결과를 도 1 에 나타냈다.
1H-NMR (THF-d8) 로 이하의 31 개의 수소의 시그널을 검출하였다. 그 결과는 다음과 같다.
<실시예 2>
5-[{(비페닐-4-일)-페닐아미노}페닐-4-일]-11,12-디페닐인돌로[2,3-a]카르바졸 (화합물 12) 의 합성 ;
미리 질소 치환한 반응 용기에,
실시예 1 에서 합성한 5-브로모-11,12-디페닐인돌로[2,3-a]카르바졸
3.40 g
(비페닐-4-일)-{4-(4,4,5,5-테트라메틸-1,3,2-디옥사보란-2-일)페닐}-페닐아민 3.12 g
톨루엔/에탄올 (4/1, v/v) 의 혼합 용매 30 ㎖
2 M 탄산칼륨 수용액 10.5 ㎖
를 첨가하고, 초음파를 조사하면서 30 분간 질소 가스를 통기하였다. 이어서,
테트라키스(트리페닐포스핀)팔라듐 (0) 0.24 g
을 첨가하여 가열하고, 환류하, 13 시간 교반하였다. 실온까지 냉각시킨 후, 톨루엔 50 ㎖, 물 50 ㎖ 를 첨가하고, 분액 조작을 실시하여 유기층을 채취하였다. 또한, 수층을 톨루엔 30 ㎖ 에 의한 추출 조작을 실시하여 유기층을 채취하였다. 유기층을 합한 후, 무수 황산마그네슘에 의한 탈수를 실시하고, 감압하에서 농축함으로써 조제물을 얻었다.
실시예 1 과 동일하게 하여, 조제물을 칼럼 크로마토그래프에 의해 정제한 후, 추가로 헥산 세정을 실시하여 전술한 화합물 12 에 상당하는,
5-[{(비페닐-4-일)-페닐아미노}페닐-4-일]-11,12-디페닐인돌로[2,3-a]카르바졸의 담황색 분체 3.68 g
을 얻었다 (수율 72.4 %).
얻어진 담황색 분체에 대해 NMR 을 사용하여 구조를 동정하였다. 1H-NMR 측정 결과를 도 2 에 나타냈다.
1H-NMR (THF-d8) 로 이하의 37 개의 수소의 시그널을 검출하였다. 그 결과는 다음과 같다.
<실시예 3>
5-[{비스(비페닐-4-일)아미노}페닐-4-일]-11,12-디페닐인돌로[2,3-a]카르바졸 (화합물 13) 의 합성 ;
미리 질소 치환한 반응 용기에,
실시예 1 에서 합성한 5-브로모-11,12-디페닐인돌로[2,3-a]카르바졸
3.40 g
비스(비페닐-4-일)-{4-(4,4,5,5-테트라메틸-1,3,2-디옥사보란-2-일)페닐}아민 3.22 g
톨루엔/에탄올 (4/1, v/v) 의 혼합 용매 30 ㎖
2 M 탄산칼륨 수용액 9.2 ㎖
를 첨가하고, 초음파를 조사하면서 30 분간 질소 가스를 통기하였다. 또한,
테트라키스(트리페닐포스핀)팔라듐 (0) 0.43 g
을 첨가하여 가열하고, 환류하, 8 시간 교반하였다. 실온까지 냉각시킨 후, 톨루엔 50 ㎖, 물 50 ㎖ 를 첨가하고, 분액 조작을 실시하여 유기층을 채취하였다. 유기층을 무수 황산마그네슘에 의한 탈수를 실시하고, 감압하에서 농축함으로써 조제물을 얻었다.
이 조제물을 NH 실리카 겔에 의한 흡착 정제, 아세트산에틸/n-헥산의 혼합 용매에 의한 결정화, 아세트산에틸 세정, 톨루엔에 의한 재결정, 톨루엔/n-헥산의 혼합 용매에 의한 결정화, 메탄올 세정을 순차 실시하여, 화합물 13 에 상당하는,
5-[{비스(비페닐-4-일)아미노}페닐-4-일]-11,12-디페닐인돌로[2,3-a]카르바졸 백색 분체 2.92 g
을 얻었다 (수율 59.1 %).
얻어진 백색 분체에 대해 NMR 을 사용하여 구조를 동정하였다. 1H-NMR 측정 결과를 도 3 에 나타냈다.
1H-NMR (THF-d8) 로 이하의 41 개의 수소의 시그널을 검출하였다. 그 결과는 다음과 같다.
<실시예 4>
5-[{(비페닐-4-일)-페닐아미노}페닐-4-일]-6,11,12-트리페닐인돌로[2,3-a]카르바졸 (화합물 17) 의 합성 ;
미리 질소 치환한 반응 용기에,
실시예 1 에서 합성한 5-브로모-11,12-디페닐인돌로[2,3-a]카르바졸 100 g
페닐보론산 25.0 g
톨루엔/에탄올 (4/1, v/v) 의 혼합 용매 1000 ㎖
2 M 탄산칼륨 수용액 205 ㎖
를 첨가하고, 초음파를 조사하면서 30 분간 질소 가스를 통기한 후, 또한,
테트라키스(트리페닐포스핀)팔라듐 (0) 2.37 g
을 첨가하여 가열하고, 환류하, 8 시간 교반하였다. 실온까지 냉각시킨 후, 톨루엔 500 ㎖, 물 100 ㎖ 를 첨가하고, 분액 조작을 실시하여 유기층을 채취하였다. 또한, 수층을 톨루엔 200 ㎖ 에 의한 추출 조작을 실시하여 유기층을 채취하였다. 유기층을 합한 후, 무수 황산마그네슘에 의한 탈수를 실시하고, 감압하에서 농축함으로써 조제물을 얻었다.
이 조제물을 실리카 겔에 의한 흡착 정제, 아세트산에틸/메탄올의 혼합 용매에 의한 결정화, 톨루엔/n-헥산의 혼합 용매에 의한 결정화, 아세트산에틸 세정, 1,2-디클로로벤젠/메탄올의 혼합 용매에 의한 결정화, 메탄올 세정을 순차 실시하여,
5,11,12-트리페닐인돌로[2,3-a]카르바졸의 분체 57.8 g
을 얻었다 (수율 58.2 %).
이어서, 반응 용기에,
상기에서 얻어진 트리페닐화된 카르바졸 분말 68.0 g
DMF 680 ㎖
N-브로모숙신산이미드 25.0 g
을 첨가하고, 실온하, 6 시간 교반한 후, 다시 하룻밤 방치하였다. 반응 용액에 물 1000 ㎖ 를 첨가하고, 여과에 의해 조제물을 채취한 후, 메탄올 세정, 톨루엔/n-헥산의 혼합 용매에 의한 결정화를 순차 실시하여,
5-브로모-6,11,12-트리페닐인돌로[2,3-a]카르바졸의 분체 58.4 g
을 얻었다 (수율 73.9 %).
또한, 미리 질소 치환한 반응 용기에,
상기에서 얻어진 브로모화된 카르바졸의 분말 15.0 g
(비페닐-4-일)-{4-(4,4,5,5-테트라메틸-1,3,2-디옥사보란-2-일)페닐}-페닐아민 13.1 g
톨루엔/에탄올 (4/1, v/v) 의 혼합 용매 150 ㎖
2 M 탄산칼륨 수용액 26.6 ㎖
를 첨가하고, 초음파를 조사하면서 30 분간 질소 가스를 통기하고, 또한,
테트라키스(트리페닐포스핀)팔라듐 (0) 0.62 g
을 첨가하여 가열하고, 환류하, 6 시간 교반하였다. 실온까지 냉각시킨 후, 물 100 ㎖, 메탄올 200 ㎖ 를 첨가하고, 여과에 의해 조제물을 채취하였다.
이 조제물을 1,2-디클로로벤젠에 용해시키고, 황산마그네슘에 의한 탈수, 실리카 겔에 의한 흡착 정제, 아세트산에틸 세정, 1,2-디클로로벤젠/아세트산에틸의 혼합 용매에 의한 결정화, 톨루엔 세정, 메탄올 세정을 순차 실시하여, 화합물 17 에 상당하는,
5-[{(비페닐-4-일)-페닐아미노}페닐-4-일]-6,11,12-트리페닐인돌로[2,3-a]카르바졸의 백색 분체 12.8 g
을 얻었다 (수율 59.6 %).
얻어진 백색 분체에 대해 NMR 을 사용하여 구조를 동정하였다. 1H-NMR 측정 결과를 도 4 에 나타냈다.
1H-NMR (THF-d8) 로 이하의 41 개의 수소의 시그널을 검출하였다. 그 결과는 다음과 같다.
<실시예 5>
5-[{(나프탈렌-1-일)-페닐아미노}페닐-4-일]-6,11,12-트리페닐인돌로[2,3-a]카르바졸 (화합물 76) 의 합성 ;
미리 질소 치환한 반응 용기에,
실시예 4 에서 합성한 5-브로모-6,11,12-트리페닐인돌로[2,3-a]카르바졸 15.0 g
(나프탈렌-1-일)-{4-(4,4,5,5-테트라메틸-1,3,2-디옥사보란-2-일)페닐}-페닐아민 12.3 g
톨루엔/에탄올 (4/1, v/v) 의 혼합 용매 150 ㎖
2 M 탄산칼륨 수용액 26.6 ㎖
를 첨가하고, 초음파를 조사하면서 30 분간 질소 가스를 통기하고, 또한,
테트라키스(트리페닐포스핀)팔라듐 (0) 0.62 g
을 첨가하여 가열하고, 환류하, 13 시간 교반하였다. 실온까지 냉각시킨 후, 물 100 ㎖, 아세트산에틸 200 ㎖ 를 첨가하고, 여과에 의해 조제물을 채취하였다.
이 조제물을 1,2-디클로로벤젠에 용해시키고, 황산마그네슘에 의한 탈수, 실리카 겔에 의한 흡착 정제, 1,2-디클로로벤젠/메탄올의 혼합 용매에 의한 결정화, 메탄올 세정을 순차 실시하여, 화합물 76 에 상당하는,
5-[{(나프탈렌-1-일)-페닐아미노}페닐-4-일]-6,11,12-트리페닐인돌로[2,3-a]카르바졸의 백색 분체 13.1 g
을 얻었다 (수율 63.2 %)
얻어진 백색 분체에 대해 NMR 을 사용하여 구조를 동정하였다. 1H-NMR 측정 결과를 도 5 에 나타냈다.
1H-NMR (THF-d8) 로 이하의 39 개의 수소의 시그널을 검출하였다. 그 결과는 다음과 같다.
<실시예 6>
5-(9-페닐-9H-카르바졸-3-일)-6,11,12-트리페닐인돌로[2,3-a]카르바졸 (화합물 77) 의 합성 ;
미리 질소 치환한 반응 용기에,
실시예 4 에서 합성한 5-브로모-6,11,12-트리페닐인돌로[2,3-a]카르바졸 8.00 g
9-페닐-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-9H-카르바졸
5.24 g
톨루엔/에탄올 (4/1, v/v) 의 혼합 용매 160 ㎖
2 M 탄산칼륨 수용액 14.2 ㎖
를 첨가하고, 초음파를 조사하면서 30 분간 질소 가스를 통기하고, 또한,
테트라키스(트리페닐포스핀)팔라듐 (0) 0.32 g
을 첨가하여 가열하고, 환류하, 6 시간 교반하였다. 실온까지 냉각시킨 후, 톨루엔 200 ㎖, 물 50 ㎖ 를 첨가하고, 분액 조작을 실시하여 유기층을 채취하였다. 또한, 수층을 톨루엔 150 ㎖ 에 의한 추출 조작을 실시하여 유기층을 채취하였다. 유기층을 합한 후, 무수 황산마그네슘에 의한 탈수를 실시하고, 감압하에서 농축함으로써 조제물을 얻었다.
이 조제물을 실리카 겔에 의한 흡착 정제, 1,2-디클로로벤젠/메탄올의 혼합 용매에 의한 결정화, 메탄올 세정을 순차 실시하여, 화합물 77 에 상당하는,
5-(9-페닐-9H-카르바졸-3-일)-6,11,12-트리페닐인돌로[2,3-a]카르바졸의 백색 분체 6.76 g
을 얻었다 (수율 65.6 %).
얻어진 백색 분체에 대해 NMR 을 사용하여 구조를 동정하였다. 1H-NMR 측정 결과를 도 6 에 나타냈다.
1H-NMR (THF-d8) 로 이하의 35 개의 수소의 시그널을 검출하였다. 그 결과는 다음과 같다.
<실시예 7>
상기의 실시예 1 ∼ 6 에서 얻어진 본 발명의 화합물에 대해, 유리 전이점 (Tg) 을 측정하였다.
유리 전이점은, 고감도 시차 주사 열량계 (브루커·에이엑스에스 제조, DSC3100S) 를 사용하여 측정하였다. 그 결과는 다음과 같다.
유리 전이점
실시예 1 의 화합물 (화합물 4) 182 ℃
실시예 2 의 화합물 (화합물 12) 153 ℃
실시예 3 의 화합물 (화합물 13) 171 ℃
실시예 4 의 화합물 (화합물 17) 160 ℃
실시예 5 의 화합물 (화합물 76) 161 ℃
실시예 6 의 화합물 (화합물 77) 203 ℃
상기의 결과로부터 이해되는 바와 같이, 본 발명의 화합물은 100 ℃ 이상, 특히 150 ℃ 이상의 유리 전이점을 갖고 있으며, 이것은 본 발명의 화합물에 있어서 형성되는 박막이 안정적으로 유지되는 것을 나타내는 것이다.
<실시예 8>
상기의 실시예 1 ∼ 3 에서 얻어진 본 발명의 화합물을 사용하여, ITO 기판 상에 막두께 100 ㎚ 의 증착막을 제조하고, 대기 중 광전자 분광 장치 (리켄 계기 제조, AC-3 형) 로 일함수를 측정하였다.
일함수
실시예 1 의 화합물 5.64 eV
실시예 2 의 화합물 5.52 eV
실시예 3 의 화합물 5.51 eV
이와 같이 본 발명의 화합물은, NPD, TPD 등이 일반적인 정공 수송 재료가 갖는 일함수 5.4 eV 와 비교하여, 바람직한 에너지 준위를 나타내고 있어, 양호한 정공 수송 능력을 갖고 있는 것을 알 수 있다.
<실시예 9>
실시예 3 의 화합물을 사용하여, 도 7 에 나타내는 구조의 유기 EL 소자를 제조하고 그 평가를 실시하였다.
즉, 이 유기 EL 소자는, 유리 기판 (1) 상에, 투명 양극 (2) (ITO 전극) 을 미리 형성해 두고, 이 투명 전극 (2) 상에, 정공 주입층 (3), 정공 수송층 (4), 발광층 (5), 전자 수송층 (6), 전자 주입층 (7), 음극 (알루미늄 전극) (8) 을 이 순서대로 증착에 의해 형성한 것이며, 구체적으로는, 이하와 같이 하여 제조하였다.
먼저, 막두께 150 ㎚ 의 ITO (투명 전극 (2)) 를 성막한 유리 기판 (1) 을 유기 용매로 세정한 후에, 산소 플라스마 처리로 표면을 세정하였다.
그 후, 이 투명 전극이 부착된 유리 기판 (1) 을 진공 증착기 내에 장착하고 0.001 ㎩ 이하까지 감압하였다.
이어서, 투명 양극 (2) 을 덮도록 정공 주입층 (3) 으로서, 하기 구조식의 화합물 78 을 막두께 20 ㎚ 가 되도록 형성하였다.
[화학식 83]
상기의 정공 주입층 (3) 상에, 정공 수송층 (4) 으로서 실시예 3 에서 합성된 화합물 (화합물 13) 을 막두께 40 ㎚ 가 되도록 형성하였다.
이 정공 수송층 (4) 상에, 발광층 (5) 으로서 하기 구조식의 화합물 79 와 하기 구조식의 화합물 80 을 증착 속도비가 화합물 79 : 화합물 80 = 5 : 95 가 되는 증착 속도로 이원 증착을 실시하여, 막두께 30 ㎚ 가 되도록 형성하였다.
[화학식 84]
[화학식 85]
이 발광층 (5) 상에, 전자 수송층 (6) 으로서 Alq3 을 막두께 30 ㎚ 가 되도록 형성하였다. 이 전자 수송층 (6) 상에, 전자 주입층 (7) 으로서 불화리튬을 막두께 0.5 ㎚ 가 되도록 형성하였다. 마지막으로, 알루미늄을 막두께 150 ㎚ 가 되도록 증착하여 음극 (8) 을 형성하였다.
제조한 유기 EL 소자에 대해, 상온, 대기 중에서 직류 전압을 인가했을 때의 발광 특성의 측정 결과를 표 1 에 정리하여 나타냈다.
<실시예 10>
정공 수송층 (4) 의 재료로서 실시예 3 의 화합물 (화합물 13) 대신에 실시예 2 의 화합물 (화합물 12) 을 사용하여, 막두께 40 ㎚ 가 되도록 하여 정공 수송층 (4) 을 형성한 것 이외에는, 실시예 9 와 동일한 조건으로 유기 EL 소자를 제조하였다.
제조한 유기 EL 소자에 대해, 상온, 대기 중에서 직류 전압을 인가했을 때의 발광 특성의 측정 결과를 표 1 에 정리하여 나타냈다.
<비교예 1>
비교를 위해서, 정공 수송층 (4) 의 재료로서 실시예 3 의 화합물 (화합물 13) 대신에, 하기 구조식의 화합물 81 을 사용하여 정공 수송층 (4) 을 형성한 것 이외에는, 실시예 9 와 동일한 조건으로 유기 EL 소자를 제조하였다.
제조한 유기 EL 소자에 대해, 상온, 대기 중에서 직류 전압을 인가했을 때의 발광 특성의 측정 결과를 표 1 에 정리하여 나타냈다.
[화학식 86]
표 1 에 나타내는 바와 같이, 전류 밀도 10 ㎃/㎠ 의 전류를 흘렸을 때의 구동 전압은, 상기 구조식의 화합물 81 을 사용한 비교예 1 의 5.17 V 에 대해, 실시예 3 의 화합물 (화합물 13) 을 사용한 실시예 9 에서는 5.07 V, 실시예 2 의 화합물 (화합물 12) 을 사용한 실시예 10 에서는 4.88 V 로, 본 발명의 화합물을 사용한 경우에는, 구동 전압이 저전압화한 것을 알 수 있다.
또, 전력 효율에 있어서도, 비교예 1 의 5.49 ㏐/W 에 대해, 실시예 3 의 화합물 (화합물 13) 을 사용한 실시예 9 에서는 6.39 ㏐/W, 실시예 2 의 화합물 (화합물 12) 을 사용한 실시예 10 에서는 6.66 ㏐/W 로 모두 크게 향상되었다.
이상의 결과로부터 분명한 바와 같이, 본 발명의 인돌로카르바졸 고리 구조를 갖는 화합물을 사용한 유기 EL 소자는, 이미 알려진 상기 화합물 81 을 사용한 유기 EL 소자와 비교해도, 전력 효율의 향상이나 실용 구동 전압의 저하를 달성할 수 있는 것을 알 수 있었다.
산업상의 이용가능성
본 발명의 인돌로카르바졸 고리 구조를 갖는 화합물을 갖는 화합물은, 정공 수송 능력이 높고, 전자 저지 능력이 우수하며, 아모르퍼스성이 우수하고, 박막 상태가 안정적이기 때문에, 유기 EL 소자용 화합물로서 우수하다. 그 화합물을 사용하여 유기 EL 소자를 제조함으로써, 높은 발광 효율 및 전력 효율을 얻을 수 있음과 함께, 실용 구동 전압을 저하시킬 수 있으며, 내구성을 개선시킬 수 있다. 예를 들어, 가정 전화 제품이나 조명의 용도에 대한 전개가 가능해졌다.
1 : 유리 기판
2 : 투명 양극
3 : 정공 주입층
4 : 정공 수송층
5 : 발광층
6 : 전자 수송층
7 : 전자 주입층
8 : 음극
2 : 투명 양극
3 : 정공 주입층
4 : 정공 수송층
5 : 발광층
6 : 전자 수송층
7 : 전자 주입층
8 : 음극
Claims (11)
- 인돌로카르바졸 고리 구조를 갖는 화합물로서, 하기 일반식 (1) 로 나타내는 것을 특징으로 하는 화합물 ;
[화학식 1]
식 중,
A 는 2 가의 방향족 탄화수소기 또는 방향족 복소고리기이고,
Ar1, Ar2, Ar3, Ar4 는 각각 1 가의 방향족 탄화수소기 또는 방향족 복소고리기를 나타내고, 이들 중, Ar3 및 Ar4 는, 단결합, 메틸렌기, 산소 원자 또는 황 원자를 개재하여 서로 결합되거나 혹은 기 A 와 결합되어 추가로 고리를 형성하고 있어도 되고,
R1 ∼ R9 는, 각각 수소 원자, 중수소 원자, 불소 원자, 염소 원자, 시아노기, 니트로기, 탄소 원자수 1 내지 6 의 알킬기, 탄소 원자수 5 내지 10 의 시클로알킬기, 탄소 원자수 2 내지 6 의 알케닐기, 탄소 원자수 1 내지 6 의 알킬옥시기, 탄소 원자수 5 내지 10 의 시클로알킬옥시기, 1 가의 방향족 탄화수소기, 1 가의 방향족 복소고리기 또는 아릴옥시기이다. - 제 1 항에 있어서,
상기 일반식 (1) 에 있어서, A 가 페닐렌기인 인돌로카르바졸 고리 구조를 갖는 화합물. - 제 1 항에 있어서,
하기 일반식 (1a) ;
[화학식 2]
식 중,
Ar1 ∼ Ar3, R1 ∼ R9 는 상기 일반식 (1) 에 기재한 바와 같고,
R13 ∼ R16 은, 각각 수소 원자, 중수소 원자, 불소 원자, 염소 원자, 시아노기, 니트로기, 탄소 원자수 1 내지 6 의 알킬기, 탄소 원자수 5 내지 10 의 시클로알킬기, 탄소 원자수 2 내지 6 의 알케닐기, 탄소 원자수 1 내지 6 의 알킬옥시기, 탄소 원자수 5 내지 10 의 시클로알킬옥시기, 1 가의 방향족 탄화수소기, 1 가의 방향족 복소고리기 또는 아릴옥시기이다,
로 나타내는 인돌로카르바졸 고리 구조를 갖는 화합물. - 제 1 항에 있어서,
상기 일반식 (1) 에 있어서, Ar1, Ar2 가 1 가의 방향족 탄화수소기인 인돌로카르바졸 고리 구조를 갖는 화합물. - 제 4 항에 있어서,
상기 일반식 (1) 에 있어서, Ar1, Ar2 가 페닐기인 인돌로카르바졸 고리 구조를 갖는 화합물. - 제 1 항에 있어서,
상기 일반식 (1) 에 있어서, R9 가 수소 원자, 중수소 원자 또는 페닐기인 인돌로카르바졸 고리 구조를 갖는 화합물. - 적어도 발광층을 포함하는 적층 구조가 1 쌍의 전극 사이에 형성되어 있는 유기 일렉트로루미네선스 소자에 있어서, 제 1 항에 기재된 인돌로카르바졸 고리 구조를 갖는 화합물이 상기 적층 구조를 형성하고 있는 임의 층에 사용되고 있는 것을 특징으로 하는 유기 일렉트로루미네선스 소자.
- 제 7 항에 있어서,
상기 적층 구조는 정공 수송층을 포함하고, 상기 화합물이 그 정공 수송층에 사용되고 있는 유기 일렉트로루미네선스 소자. - 제 7 항에 있어서,
상기 적층 구조는 전자 저지층을 포함하고, 상기 화합물이 그 전자 저지층에 사용되고 있는 유기 일렉트로루미네선스 소자. - 제 7 항에 있어서,
상기 적층 구조는 정공 주입층을 포함하고, 상기 화합물이 그 정공 주입층에 사용되고 있는 유기 일렉트로루미네선스 소자. - 제 7 항에 있어서,
상기 화합물이 발광층에 사용되고 있는 유기 일렉트로루미네선스 소자.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JPJP-P-2011-035287 | 2011-02-22 | ||
| JP2011035287 | 2011-02-22 | ||
| PCT/JP2012/053336 WO2012114928A1 (ja) | 2011-02-22 | 2012-02-14 | インドロカルバゾール環構造を有する化合物および有機エレクトロルミネッセンス素子 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20140003564A true KR20140003564A (ko) | 2014-01-09 |
| KR101975611B1 KR101975611B1 (ko) | 2019-05-07 |
Family
ID=46720710
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020137022146A KR101975611B1 (ko) | 2011-02-22 | 2012-02-14 | 인돌로카르바졸 고리 구조를 갖는 화합물 및 유기 일렉트로루미네선스 소자 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US9564600B2 (ko) |
| EP (1) | EP2679589B1 (ko) |
| JP (2) | JP5836358B2 (ko) |
| KR (1) | KR101975611B1 (ko) |
| CN (1) | CN103384671B (ko) |
| TW (1) | TWI551602B (ko) |
| WO (1) | WO2012114928A1 (ko) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20150124637A (ko) * | 2014-04-29 | 2015-11-06 | (주)피엔에이치테크 | 유기발광 화합물 및 이를 포함하는 유기전계발광소자 |
| KR101858028B1 (ko) | 2017-11-10 | 2018-06-27 | (주)엠비티 | 고속 복합 수처리 장치 |
Families Citing this family (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2767534B1 (en) | 2011-10-14 | 2020-06-03 | Hodogaya Chemical Co., Ltd. | New benzotriazole derivative and organic electroluminescent element in which said derivative is used |
| KR102063820B1 (ko) * | 2013-07-18 | 2020-01-08 | 덕산네오룩스 주식회사 | 유기전기 소자용 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| US11818949B2 (en) | 2015-04-06 | 2023-11-14 | Universal Display Corporation | Organic electroluminescent materials and devices |
| US20160293855A1 (en) | 2015-04-06 | 2016-10-06 | Universal Display Corporation | Organic Electroluminescent Materials and Devices |
| US11495749B2 (en) | 2015-04-06 | 2022-11-08 | Universal Display Corporation | Organic electroluminescent materials and devices |
| KR102044946B1 (ko) | 2016-02-03 | 2019-11-14 | 삼성에스디아이 주식회사 | 유기 화합물, 유기 광전자 소자 및 표시 장치 |
| KR20180007617A (ko) | 2016-07-13 | 2018-01-23 | 삼성에스디아이 주식회사 | 유기 광전자 소자용 조성물, 유기 광전자 소자 및 표시 장치 |
| KR102049419B1 (ko) | 2016-07-19 | 2019-11-27 | 삼성에스디아이 주식회사 | 유기 광전자 소자용 조성물, 유기 광전자 소자 및 표시 장치 |
| KR20180010533A (ko) | 2016-07-21 | 2018-01-31 | 삼성에스디아이 주식회사 | 유기 광전자 소자용 조성물, 유기 광전자 소자 및 표시 장치 |
| KR102001478B1 (ko) | 2016-08-11 | 2019-07-24 | 삼성에스디아이 주식회사 | 유기 광전자 소자용 조성물, 유기 광전자 소자 및 표시 장치 |
| JP6834400B2 (ja) * | 2016-11-22 | 2021-02-24 | ソニー株式会社 | 撮像素子、積層型撮像素子、撮像装置及び電子装置 |
| JP7022528B2 (ja) * | 2017-07-28 | 2022-02-18 | 日本放送協会 | 有機エレクトロルミネッセンス素子 |
| GB201804511D0 (en) * | 2018-03-21 | 2018-05-02 | Univ Birmingham | Luminescent compounds |
| CN111253302A (zh) * | 2018-12-03 | 2020-06-09 | 北京鼎材科技有限公司 | 一种新型化合物及其在有机电致发光器件中的应用 |
| US11834459B2 (en) | 2018-12-12 | 2023-12-05 | Universal Display Corporation | Host materials for electroluminescent devices |
| CN110759918B (zh) | 2019-10-31 | 2021-07-06 | 上海天马有机发光显示技术有限公司 | 一种化合物、显示面板及电子设备 |
| CN112250685B (zh) * | 2020-11-25 | 2022-04-19 | 中钢集团南京新材料研究院有限公司 | 一种吲哚并[2,3-a]咔唑的制备方法 |
| JP2022100258A (ja) | 2020-12-23 | 2022-07-05 | 保土谷化学工業株式会社 | インドロカルバゾール環を有する化合物、受光素子用材料、有機薄膜、受光素子、及び撮像素子 |
| JP7264182B2 (ja) * | 2021-02-03 | 2023-04-25 | ソニーグループ株式会社 | 撮像素子、積層型撮像素子、撮像装置及び電子装置 |
| JP2023050149A (ja) | 2021-09-29 | 2023-04-10 | 保土谷化学工業株式会社 | 光電変換素子に用いる有機薄膜 |
Citations (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH0848656A (ja) | 1994-02-08 | 1996-02-20 | Tdk Corp | 有機el素子用化合物および有機el素子 |
| JPH11167215A (ja) | 1997-10-02 | 1999-06-22 | Xerox Corp | インドロカルバゾールを含む光伝導性の画像形成部材 |
| JPH11176578A (ja) | 1997-10-02 | 1999-07-02 | Xerox Corp | インドロカルバゾールを用いたエレクトロルミネセントデバイス |
| JP3194657B2 (ja) | 1993-11-01 | 2001-07-30 | 松下電器産業株式会社 | 電界発光素子 |
| WO2007063754A1 (ja) | 2005-12-01 | 2007-06-07 | Nippon Steel Chemical Co., Ltd. | 有機電界発光素子用化合物及び有機電界発光素子 |
| WO2007063796A1 (ja) | 2005-12-01 | 2007-06-07 | Nippon Steel Chemical Co., Ltd. | 有機電界発光素子 |
| WO2008056746A1 (fr) | 2006-11-09 | 2008-05-15 | Nippon Steel Chemical Co., Ltd. | Composé pour un dispositif électroluminescent organique et dispositif électroluminescent organique |
| WO2008149691A1 (ja) | 2007-05-30 | 2008-12-11 | Nippon Steel Chemical Co., Ltd. | 有機電界発光素子用化合物及び有機電界発光素子 |
| JP4564584B1 (ja) | 2009-08-31 | 2010-10-20 | 富士フイルム株式会社 | 有機電界発光素子 |
| KR20110011578A (ko) * | 2009-07-27 | 2011-02-08 | 에스에프씨 주식회사 | 인돌로카바졸 유도체 및 이를 이용한 유기전계발광소자 |
| KR20110016044A (ko) * | 2009-08-10 | 2011-02-17 | 에스에프씨 주식회사 | 방향족 화합물 및 이를 이용한 유기전계발광소자 |
| KR20110016047A (ko) * | 2009-08-10 | 2011-02-17 | 에스에프씨 주식회사 | 방향족 화합물 및 이를 이용한 유기전계발광소자 |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE69412567T2 (de) | 1993-11-01 | 1999-02-04 | Hodogaya Chemical Co Ltd | Aminverbindung und sie enthaltende Elektrolumineszenzvorrichtung |
| EP0666298A3 (en) | 1994-02-08 | 1995-11-15 | Tdk Corp | Organic electroluminescent element and compound used therein. |
| US7829727B2 (en) | 2005-11-16 | 2010-11-09 | Xerox Corporation | Device containing compound having indolocarbazole moiety and divalent linkage |
| JP5457907B2 (ja) | 2009-08-31 | 2014-04-02 | ユー・ディー・シー アイルランド リミテッド | 有機電界発光素子 |
-
2012
- 2012-02-14 JP JP2013500965A patent/JP5836358B2/ja active Active
- 2012-02-14 US US14/000,406 patent/US9564600B2/en active Active
- 2012-02-14 EP EP12750152.6A patent/EP2679589B1/en active Active
- 2012-02-14 KR KR1020137022146A patent/KR101975611B1/ko active IP Right Grant
- 2012-02-14 CN CN201280009985.3A patent/CN103384671B/zh active Active
- 2012-02-14 WO PCT/JP2012/053336 patent/WO2012114928A1/ja active Application Filing
- 2012-02-15 TW TW101104944A patent/TWI551602B/zh active
-
2015
- 2015-10-29 JP JP2015212791A patent/JP2016106076A/ja active Pending
Patent Citations (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP3194657B2 (ja) | 1993-11-01 | 2001-07-30 | 松下電器産業株式会社 | 電界発光素子 |
| JPH0848656A (ja) | 1994-02-08 | 1996-02-20 | Tdk Corp | 有機el素子用化合物および有機el素子 |
| JPH11167215A (ja) | 1997-10-02 | 1999-06-22 | Xerox Corp | インドロカルバゾールを含む光伝導性の画像形成部材 |
| JPH11176578A (ja) | 1997-10-02 | 1999-07-02 | Xerox Corp | インドロカルバゾールを用いたエレクトロルミネセントデバイス |
| WO2007063754A1 (ja) | 2005-12-01 | 2007-06-07 | Nippon Steel Chemical Co., Ltd. | 有機電界発光素子用化合物及び有機電界発光素子 |
| WO2007063796A1 (ja) | 2005-12-01 | 2007-06-07 | Nippon Steel Chemical Co., Ltd. | 有機電界発光素子 |
| WO2008056746A1 (fr) | 2006-11-09 | 2008-05-15 | Nippon Steel Chemical Co., Ltd. | Composé pour un dispositif électroluminescent organique et dispositif électroluminescent organique |
| WO2008149691A1 (ja) | 2007-05-30 | 2008-12-11 | Nippon Steel Chemical Co., Ltd. | 有機電界発光素子用化合物及び有機電界発光素子 |
| KR20110011578A (ko) * | 2009-07-27 | 2011-02-08 | 에스에프씨 주식회사 | 인돌로카바졸 유도체 및 이를 이용한 유기전계발광소자 |
| KR20110016044A (ko) * | 2009-08-10 | 2011-02-17 | 에스에프씨 주식회사 | 방향족 화합물 및 이를 이용한 유기전계발광소자 |
| KR20110016047A (ko) * | 2009-08-10 | 2011-02-17 | 에스에프씨 주식회사 | 방향족 화합물 및 이를 이용한 유기전계발광소자 |
| JP4564584B1 (ja) | 2009-08-31 | 2010-10-20 | 富士フイルム株式会社 | 有機電界発光素子 |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20150124637A (ko) * | 2014-04-29 | 2015-11-06 | (주)피엔에이치테크 | 유기발광 화합물 및 이를 포함하는 유기전계발광소자 |
| KR101858028B1 (ko) | 2017-11-10 | 2018-06-27 | (주)엠비티 | 고속 복합 수처리 장치 |
Also Published As
| Publication number | Publication date |
|---|---|
| JPWO2012114928A1 (ja) | 2014-07-07 |
| TW201240995A (en) | 2012-10-16 |
| EP2679589A4 (en) | 2014-01-08 |
| JP5836358B2 (ja) | 2015-12-24 |
| JP2016106076A (ja) | 2016-06-16 |
| CN103384671B (zh) | 2016-03-23 |
| TWI551602B (zh) | 2016-10-01 |
| KR101975611B1 (ko) | 2019-05-07 |
| WO2012114928A1 (ja) | 2012-08-30 |
| US9564600B2 (en) | 2017-02-07 |
| US20140124756A1 (en) | 2014-05-08 |
| EP2679589A1 (en) | 2014-01-01 |
| EP2679589B1 (en) | 2017-04-05 |
| CN103384671A (zh) | 2013-11-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101975611B1 (ko) | 인돌로카르바졸 고리 구조를 갖는 화합물 및 유기 일렉트로루미네선스 소자 | |
| EP2471771B1 (en) | Compound having carbazole ring structure and organic electroluminescent device | |
| EP2599773B1 (en) | Compound having indenocarbazole ring structure and organic electroluminescent element | |
| JP6134476B2 (ja) | 有機エレクトロルミネッセンス素子 | |
| WO2011048822A1 (ja) | 有機エレクトロルミネッセンス素子 | |
| WO2013157367A1 (ja) | 新規なトリフェニレン誘導体及び該誘導体が使用されている有機エレクトロルミネッセンス素子 | |
| JP5807011B2 (ja) | カルバゾール環構造を有する化合物および有機エレクトロルミネッセンス素子 | |
| KR20130112850A (ko) | 아크리단환 구조를 가지는 화합물 및 유기 일렉트로 루미네센스 소자 | |
| KR20140026536A (ko) | 아크리단환 구조를 가지는 화합물 및 유기 일렉트로루미네선스 소자 | |
| KR20140084051A (ko) | 신규 트리페닐렌 유도체 및 상기 유도체를 사용하는 유기 전계발광 소자 | |
| KR102533036B1 (ko) | 유기 일렉트로루미네선스 소자 | |
| JP2014101374A (ja) | 新規なベンゾチエノインドール誘導体および該誘導体が使用されている有機エレクトロルミネッセンス素子 | |
| US20210009584A1 (en) | Compound including benzimidazole ring structure and organic electroluminescent element | |
| JP6580553B2 (ja) | ベンゾフロインドール誘導体および有機エレクトロルミネッセンス素子 | |
| KR20230088341A (ko) | 아릴아민 화합물, 유기 일렉트로 루미네선스 소자, 및 전자 기기 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant |