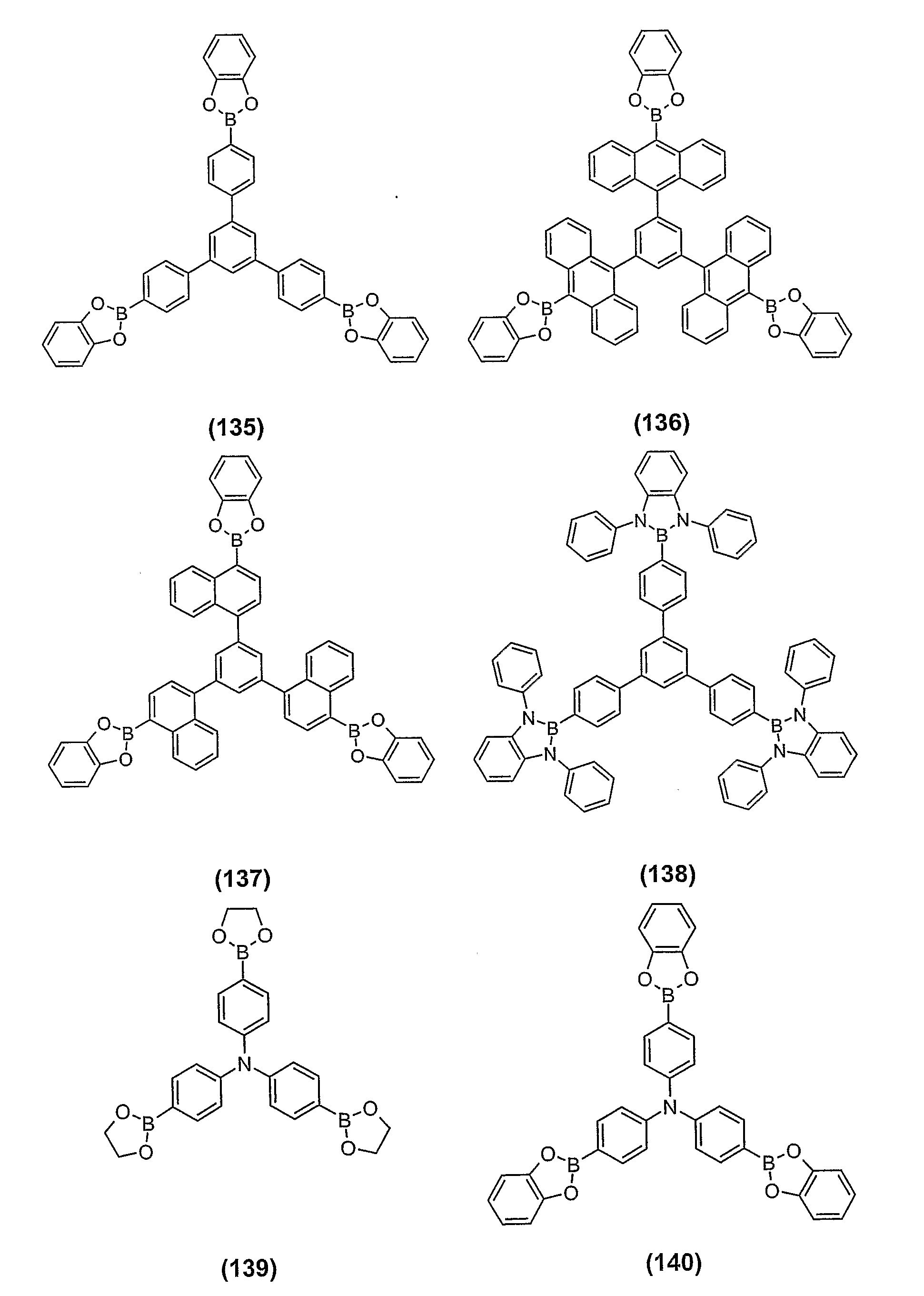
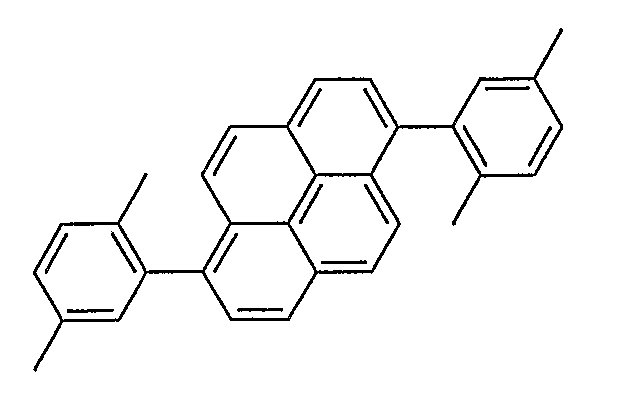
KR101289923B1 - 유기 전계발광 장치 및 그에 사용되는 붕산 및 보린산유도체 - Google Patents
유기 전계발광 장치 및 그에 사용되는 붕산 및 보린산유도체 Download PDFInfo
- Publication number
- KR101289923B1 KR101289923B1 KR1020077028263A KR20077028263A KR101289923B1 KR 101289923 B1 KR101289923 B1 KR 101289923B1 KR 1020077028263 A KR1020077028263 A KR 1020077028263A KR 20077028263 A KR20077028263 A KR 20077028263A KR 101289923 B1 KR101289923 B1 KR 101289923B1
- Authority
- KR
- South Korea
- Prior art keywords
- aromatic
- atoms
- carbon atoms
- differently
- occurrence
- Prior art date
Links
- KGBXLFKZBHKPEV-UHFFFAOYSA-N boric acid Chemical compound OB(O)O KGBXLFKZBHKPEV-UHFFFAOYSA-N 0.000 title abstract description 82
- 239000004327 boric acid Substances 0.000 title abstract description 11
- UYANAUSDHIFLFQ-UHFFFAOYSA-N borinic acid Chemical class OB UYANAUSDHIFLFQ-UHFFFAOYSA-N 0.000 title description 8
- 125000003118 aryl group Chemical group 0.000 claims abstract description 165
- 239000010410 layer Substances 0.000 claims description 96
- 150000001875 compounds Chemical class 0.000 claims description 93
- -1 aromatic boronic acid derivative Chemical class 0.000 claims description 91
- ZADPBFCGQRWHPN-UHFFFAOYSA-N boronic acid Chemical compound OBO ZADPBFCGQRWHPN-UHFFFAOYSA-N 0.000 claims description 91
- 239000000463 material Substances 0.000 claims description 88
- 125000004432 carbon atom Chemical group C* 0.000 claims description 84
- 150000003254 radicals Chemical class 0.000 claims description 64
- 239000000203 mixture Substances 0.000 claims description 62
- 239000002019 doping agent Substances 0.000 claims description 61
- 125000004122 cyclic group Chemical group 0.000 claims description 51
- 229910052760 oxygen Inorganic materials 0.000 claims description 51
- 229920000642 polymer Polymers 0.000 claims description 42
- 229910052717 sulfur Inorganic materials 0.000 claims description 35
- 125000001072 heteroaryl group Chemical group 0.000 claims description 34
- 150000001642 boronic acid derivatives Chemical class 0.000 claims description 33
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical group N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims description 31
- 125000001424 substituent group Chemical group 0.000 claims description 30
- IVDFJHOHABJVEH-UHFFFAOYSA-N pinacol Chemical compound CC(C)(O)C(C)(C)O IVDFJHOHABJVEH-UHFFFAOYSA-N 0.000 claims description 28
- 125000001931 aliphatic group Chemical group 0.000 claims description 27
- 229910052796 boron Inorganic materials 0.000 claims description 27
- ZOXJGFHDIHLPTG-UHFFFAOYSA-N Boron Chemical group [B] ZOXJGFHDIHLPTG-UHFFFAOYSA-N 0.000 claims description 25
- 239000003446 ligand Substances 0.000 claims description 24
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 23
- 229910052751 metal Inorganic materials 0.000 claims description 23
- 239000002184 metal Substances 0.000 claims description 23
- 125000002950 monocyclic group Chemical group 0.000 claims description 23
- 125000000217 alkyl group Chemical group 0.000 claims description 22
- 229910052731 fluorine Inorganic materials 0.000 claims description 22
- 229910052794 bromium Inorganic materials 0.000 claims description 21
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 claims description 20
- 229910052757 nitrogen Chemical group 0.000 claims description 20
- 125000003367 polycyclic group Chemical group 0.000 claims description 20
- 229910052801 chlorine Inorganic materials 0.000 claims description 19
- 229910052740 iodine Inorganic materials 0.000 claims description 19
- YNPNZTXNASCQKK-UHFFFAOYSA-N phenanthrene Chemical compound C1=CC=C2C3=CC=CC=C3C=CC2=C1 YNPNZTXNASCQKK-UHFFFAOYSA-N 0.000 claims description 18
- 239000002253 acid Substances 0.000 claims description 17
- 125000004429 atom Chemical group 0.000 claims description 17
- 125000003545 alkoxy group Chemical group 0.000 claims description 16
- 150000002148 esters Chemical class 0.000 claims description 15
- 230000005525 hole transport Effects 0.000 claims description 14
- 239000001301 oxygen Substances 0.000 claims description 14
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 claims description 13
- 229910002091 carbon monoxide Inorganic materials 0.000 claims description 13
- 238000006243 chemical reaction Methods 0.000 claims description 13
- 125000005842 heteroatom Chemical group 0.000 claims description 13
- 239000011593 sulfur Substances 0.000 claims description 13
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 claims description 12
- 229910052799 carbon Inorganic materials 0.000 claims description 12
- 125000005309 thioalkoxy group Chemical group 0.000 claims description 12
- 238000002347 injection Methods 0.000 claims description 11
- 239000007924 injection Substances 0.000 claims description 11
- 238000000034 method Methods 0.000 claims description 11
- ICPSWZFVWAPUKF-UHFFFAOYSA-N 1,1'-spirobi[fluorene] Chemical compound C1=CC=C2C=C3C4(C=5C(C6=CC=CC=C6C=5)=CC=C4)C=CC=C3C2=C1 ICPSWZFVWAPUKF-UHFFFAOYSA-N 0.000 claims description 9
- 125000006165 cyclic alkyl group Chemical group 0.000 claims description 9
- PJANXHGTPQOBST-UHFFFAOYSA-N stilbene Chemical group C=1C=CC=CC=1C=CC1=CC=CC=C1 PJANXHGTPQOBST-UHFFFAOYSA-N 0.000 claims description 9
- 239000000126 substance Substances 0.000 claims description 9
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 claims description 8
- 150000008064 anhydrides Chemical class 0.000 claims description 8
- RMBPEFMHABBEKP-UHFFFAOYSA-N fluorene Chemical compound C1=CC=C2C3=C[CH]C=CC3=CC2=C1 RMBPEFMHABBEKP-UHFFFAOYSA-N 0.000 claims description 8
- NIHNNTQXNPWCJQ-UHFFFAOYSA-N o-biphenylenemethane Natural products C1=CC=C2CC3=CC=CC=C3C2=C1 NIHNNTQXNPWCJQ-UHFFFAOYSA-N 0.000 claims description 8
- 238000012546 transfer Methods 0.000 claims description 8
- OXCIGGOKELWQSU-UHFFFAOYSA-N NBO Chemical compound NBO OXCIGGOKELWQSU-UHFFFAOYSA-N 0.000 claims description 7
- 229910052786 argon Inorganic materials 0.000 claims description 7
- 239000000412 dendrimer Substances 0.000 claims description 7
- 229920000736 dendritic polymer Polymers 0.000 claims description 7
- UJOBWOGCFQCDNV-UHFFFAOYSA-N 9H-carbazole Chemical compound C1=CC=C2C3=CC=CC=C3NC2=C1 UJOBWOGCFQCDNV-UHFFFAOYSA-N 0.000 claims description 6
- 150000001338 aliphatic hydrocarbons Chemical class 0.000 claims description 6
- 125000005259 triarylamine group Chemical group 0.000 claims description 6
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 5
- 229910052739 hydrogen Inorganic materials 0.000 claims description 5
- 239000001257 hydrogen Substances 0.000 claims description 5
- 125000004433 nitrogen atom Chemical group N* 0.000 claims description 5
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 claims description 4
- 150000004982 aromatic amines Chemical class 0.000 claims description 4
- XXPBFNVKTVJZKF-UHFFFAOYSA-N dihydrophenanthrene Natural products C1=CC=C2CCC3=CC=CC=C3C2=C1 XXPBFNVKTVJZKF-UHFFFAOYSA-N 0.000 claims description 4
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 claims description 4
- 239000012044 organic layer Substances 0.000 claims description 4
- 229930192474 thiophene Natural products 0.000 claims description 4
- YPFDHNVEDLHUCE-UHFFFAOYSA-N 1,3-propanediol Substances OCCCO YPFDHNVEDLHUCE-UHFFFAOYSA-N 0.000 claims description 3
- UWRZIZXBOLBCON-UHFFFAOYSA-N 2-phenylethenamine Chemical class NC=CC1=CC=CC=C1 UWRZIZXBOLBCON-UHFFFAOYSA-N 0.000 claims description 3
- JRXXLCKWQFKACW-UHFFFAOYSA-N biphenylacetylene Chemical group C1=CC=CC=C1C#CC1=CC=CC=C1 JRXXLCKWQFKACW-UHFFFAOYSA-N 0.000 claims description 3
- 230000001747 exhibiting effect Effects 0.000 claims description 3
- 230000009477 glass transition Effects 0.000 claims description 3
- 125000001624 naphthyl group Chemical group 0.000 claims description 3
- 229920000166 polytrimethylene carbonate Polymers 0.000 claims description 3
- 230000008569 process Effects 0.000 claims description 3
- DNIAPMSPPWPWGF-VKHMYHEASA-N (+)-propylene glycol Chemical compound C[C@H](O)CO DNIAPMSPPWPWGF-VKHMYHEASA-N 0.000 claims description 2
- MYMOFIZGZYHOMD-UHFFFAOYSA-N Dioxygen Chemical compound O=O MYMOFIZGZYHOMD-UHFFFAOYSA-N 0.000 claims description 2
- 150000008365 aromatic ketones Chemical class 0.000 claims description 2
- OWBTYPJTUOEWEK-UHFFFAOYSA-N butane-2,3-diol Chemical compound CC(O)C(C)O OWBTYPJTUOEWEK-UHFFFAOYSA-N 0.000 claims description 2
- 239000000539 dimer Substances 0.000 claims description 2
- 230000005669 field effect Effects 0.000 claims description 2
- 239000010408 film Substances 0.000 claims description 2
- PJULCNAVAGQLAT-UHFFFAOYSA-N indeno[2,1-a]fluorene Chemical compound C1=CC=C2C=C3C4=CC5=CC=CC=C5C4=CC=C3C2=C1 PJULCNAVAGQLAT-UHFFFAOYSA-N 0.000 claims description 2
- 125000000962 organic group Chemical group 0.000 claims description 2
- 125000000843 phenylene group Chemical group C1(=C(C=CC=C1)*)* 0.000 claims description 2
- 108091008695 photoreceptors Proteins 0.000 claims description 2
- 238000010791 quenching Methods 0.000 claims description 2
- 239000010409 thin film Substances 0.000 claims description 2
- 150000003577 thiophenes Chemical class 0.000 claims description 2
- 239000013638 trimer Substances 0.000 claims description 2
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 67
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 48
- MWPLVEDNUUSJAV-UHFFFAOYSA-N anthracene Chemical compound C1=CC=CC2=CC3=CC=CC=C3C=C21 MWPLVEDNUUSJAV-UHFFFAOYSA-N 0.000 description 46
- 238000005160 1H NMR spectroscopy Methods 0.000 description 45
- 230000015572 biosynthetic process Effects 0.000 description 44
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 42
- 238000003786 synthesis reaction Methods 0.000 description 42
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 35
- 238000000859 sublimation Methods 0.000 description 32
- 230000008022 sublimation Effects 0.000 description 32
- UFWIBTONFRDIAS-UHFFFAOYSA-N Naphthalene Chemical compound C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 description 28
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 27
- 239000007983 Tris buffer Substances 0.000 description 25
- 239000007787 solid Substances 0.000 description 23
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 21
- BBEAQIROQSPTKN-UHFFFAOYSA-N antipyrene Natural products C1=CC=C2C=CC3=CC=CC4=CC=C1C2=C43 BBEAQIROQSPTKN-UHFFFAOYSA-N 0.000 description 19
- 230000000052 comparative effect Effects 0.000 description 19
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 18
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Chemical compound BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 17
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 16
- 239000011159 matrix material Substances 0.000 description 16
- 238000001816 cooling Methods 0.000 description 15
- 229910052741 iridium Inorganic materials 0.000 description 15
- 239000000243 solution Substances 0.000 description 15
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 14
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 14
- AWJUIBRHMBBTKR-UHFFFAOYSA-N isoquinoline Chemical compound C1=NC=CC2=CC=CC=C21 AWJUIBRHMBBTKR-UHFFFAOYSA-N 0.000 description 14
- 238000003756 stirring Methods 0.000 description 14
- 239000000725 suspension Substances 0.000 description 14
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 12
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 12
- 150000001412 amines Chemical class 0.000 description 12
- GVEPBJHOBDJJJI-UHFFFAOYSA-N fluoranthrene Natural products C1=CC(C2=CC=CC=C22)=C3C2=CC=CC3=C1 GVEPBJHOBDJJJI-UHFFFAOYSA-N 0.000 description 12
- VFUDMQLBKNMONU-UHFFFAOYSA-N 9-[4-(4-carbazol-9-ylphenyl)phenyl]carbazole Chemical group C12=CC=CC=C2C2=CC=CC=C2N1C1=CC=C(C=2C=CC(=CC=2)N2C3=CC=CC=C3C3=CC=CC=C32)C=C1 VFUDMQLBKNMONU-UHFFFAOYSA-N 0.000 description 11
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 11
- 238000010561 standard procedure Methods 0.000 description 11
- NEJQCQFYOYURPI-UHFFFAOYSA-N 9,10-bis(2-bromophenyl)anthracene Chemical compound BrC1=CC=CC=C1C(C1=CC=CC=C11)=C(C=CC=C2)C2=C1C1=CC=CC=C1Br NEJQCQFYOYURPI-UHFFFAOYSA-N 0.000 description 10
- 125000005620 boronic acid group Chemical class 0.000 description 10
- 238000007429 general method Methods 0.000 description 10
- GKOZUEZYRPOHIO-UHFFFAOYSA-N iridium atom Chemical compound [Ir] GKOZUEZYRPOHIO-UHFFFAOYSA-N 0.000 description 10
- 238000004519 manufacturing process Methods 0.000 description 10
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 9
- LZPWAYBEOJRFAX-UHFFFAOYSA-N 4,4,5,5-tetramethyl-1,3,2$l^{2}-dioxaborolane Chemical compound CC1(C)O[B]OC1(C)C LZPWAYBEOJRFAX-UHFFFAOYSA-N 0.000 description 8
- GWNJZSGBZMLRBW-UHFFFAOYSA-N 9,10-dinaphthalen-1-ylanthracene Chemical class C12=CC=CC=C2C(C=2C3=CC=CC=C3C=CC=2)=C(C=CC=C2)C2=C1C1=CC=CC2=CC=CC=C12 GWNJZSGBZMLRBW-UHFFFAOYSA-N 0.000 description 8
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 8
- KYQCOXFCLRTKLS-UHFFFAOYSA-N Pyrazine Chemical compound C1=CN=CC=N1 KYQCOXFCLRTKLS-UHFFFAOYSA-N 0.000 description 8
- 230000008901 benefit Effects 0.000 description 8
- MVPPADPHJFYWMZ-UHFFFAOYSA-N chlorobenzene Chemical compound ClC1=CC=CC=C1 MVPPADPHJFYWMZ-UHFFFAOYSA-N 0.000 description 8
- WDECIBYCCFPHNR-UHFFFAOYSA-N chrysene Chemical class C1=CC=CC2=CC=C3C4=CC=CC=C4C=CC3=C21 WDECIBYCCFPHNR-UHFFFAOYSA-N 0.000 description 8
- 229920000547 conjugated polymer Polymers 0.000 description 8
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 8
- 125000002080 perylenyl group Chemical group C1(=CC=C2C=CC=C3C4=CC=CC5=CC=CC(C1=C23)=C45)* 0.000 description 8
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 8
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 8
- XSCHRSMBECNVNS-UHFFFAOYSA-N quinoxaline Chemical compound N1=CC=NC2=CC=CC=C21 XSCHRSMBECNVNS-UHFFFAOYSA-N 0.000 description 8
- 229910000085 borane Inorganic materials 0.000 description 7
- MPQXHAGKBWFSNV-UHFFFAOYSA-N oxidophosphanium Chemical class [PH3]=O MPQXHAGKBWFSNV-UHFFFAOYSA-N 0.000 description 7
- CSHWQDPOILHKBI-UHFFFAOYSA-N peryrene Natural products C1=CC(C2=CC=CC=3C2=C2C=CC=3)=C3C2=CC=CC3=C1 CSHWQDPOILHKBI-UHFFFAOYSA-N 0.000 description 7
- 238000001953 recrystallisation Methods 0.000 description 7
- FCEHBMOGCRZNNI-UHFFFAOYSA-N 1-benzothiophene Chemical compound C1=CC=C2SC=CC2=C1 FCEHBMOGCRZNNI-UHFFFAOYSA-N 0.000 description 6
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 6
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 6
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical compound C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 description 6
- 229920001609 Poly(3,4-ethylenedioxythiophene) Polymers 0.000 description 6
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 6
- DZBUGLKDJFMEHC-UHFFFAOYSA-N acridine Chemical compound C1=CC=CC2=CC3=CC=CC=C3N=C21 DZBUGLKDJFMEHC-UHFFFAOYSA-N 0.000 description 6
- UORVGPXVDQYIDP-UHFFFAOYSA-N borane Chemical class B UORVGPXVDQYIDP-UHFFFAOYSA-N 0.000 description 6
- 239000004020 conductor Substances 0.000 description 6
- 238000001194 electroluminescence spectrum Methods 0.000 description 6
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 6
- 239000012074 organic phase Substances 0.000 description 6
- 125000005504 styryl group Chemical group 0.000 description 6
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 6
- MVGJIMIVNAKXMP-UHFFFAOYSA-N 1,6-bis(2,5-dimethylphenyl)pyrene Chemical compound CC1=CC=C(C)C(C=2C3=CC=C4C=CC(=C5C=CC(C3=C54)=CC=2)C=2C(=CC=C(C)C=2)C)=C1 MVGJIMIVNAKXMP-UHFFFAOYSA-N 0.000 description 5
- MTUBTKOZCCGPSU-UHFFFAOYSA-N 2-n-naphthalen-1-yl-1-n,1-n,2-n-triphenylbenzene-1,2-diamine Chemical compound C1=CC=CC=C1N(C=1C(=CC=CC=1)N(C=1C=CC=CC=1)C=1C2=CC=CC=C2C=CC=1)C1=CC=CC=C1 MTUBTKOZCCGPSU-UHFFFAOYSA-N 0.000 description 5
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 description 5
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 5
- 150000001491 aromatic compounds Chemical class 0.000 description 5
- 125000005619 boric acid group Chemical group 0.000 description 5
- HXNZTJULPKRNPR-UHFFFAOYSA-N borinine Chemical compound B1=CC=CC=C1 HXNZTJULPKRNPR-UHFFFAOYSA-N 0.000 description 5
- 239000011521 glass Substances 0.000 description 5
- ADUFDSSCDCLUFT-UHFFFAOYSA-N n-[4-(4-aminophenyl)phenyl]-n-phenylnaphthalen-1-amine Chemical group C1=CC(N)=CC=C1C1=CC=C(N(C=2C=CC=CC=2)C=2C3=CC=CC=C3C=CC=2)C=C1 ADUFDSSCDCLUFT-UHFFFAOYSA-N 0.000 description 5
- 229910052763 palladium Inorganic materials 0.000 description 5
- 125000003003 spiro group Chemical group 0.000 description 5
- 150000003462 sulfoxides Chemical class 0.000 description 5
- WRECIMRULFAWHA-UHFFFAOYSA-N trimethyl borate Chemical compound COB(OC)OC WRECIMRULFAWHA-UHFFFAOYSA-N 0.000 description 5
- 229910052727 yttrium Inorganic materials 0.000 description 5
- QJVXYPMHBUUJMB-UHFFFAOYSA-N 1-n,6-n-bis(4-methylphenyl)pyrene-1,6-diamine Chemical compound C1=CC(C)=CC=C1NC(C1=CC=C2C=C3)=CC=C(C=C4)C1=C2C4=C3NC1=CC=C(C)C=C1 QJVXYPMHBUUJMB-UHFFFAOYSA-N 0.000 description 4
- IGTQPXMEWQTTBJ-UHFFFAOYSA-N 2,7-dibromopyrene Chemical compound C1=C(Br)C=C2C=CC3=CC(Br)=CC4=CC=C1C2=C43 IGTQPXMEWQTTBJ-UHFFFAOYSA-N 0.000 description 4
- VQGHOUODWALEFC-UHFFFAOYSA-N 2-phenylpyridine Chemical compound C1=CC=CC=C1C1=CC=CC=N1 VQGHOUODWALEFC-UHFFFAOYSA-N 0.000 description 4
- UCFSYHMCKWNKAH-UHFFFAOYSA-N 4,4,5,5-tetramethyl-1,3,2-dioxaborolane Chemical compound CC1(C)OBOC1(C)C UCFSYHMCKWNKAH-UHFFFAOYSA-N 0.000 description 4
- VAJLGRHMEFMPPI-UHFFFAOYSA-N 4-(2,2-diphenylethenyl)-n,n-bis[4-(2,2-diphenylethenyl)phenyl]aniline Chemical compound C=1C=C(N(C=2C=CC(C=C(C=3C=CC=CC=3)C=3C=CC=CC=3)=CC=2)C=2C=CC(C=C(C=3C=CC=CC=3)C=3C=CC=CC=3)=CC=2)C=CC=1C=C(C=1C=CC=CC=1)C1=CC=CC=C1 VAJLGRHMEFMPPI-UHFFFAOYSA-N 0.000 description 4
- YLQBMQCUIZJEEH-UHFFFAOYSA-N Furan Chemical compound C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 4
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 4
- 238000006069 Suzuki reaction reaction Methods 0.000 description 4
- DGEZNRSVGBDHLK-UHFFFAOYSA-N [1,10]phenanthroline Chemical compound C1=CN=C2C3=NC=CC=C3C=CC2=C1 DGEZNRSVGBDHLK-UHFFFAOYSA-N 0.000 description 4
- REDXJYDRNCIFBQ-UHFFFAOYSA-N aluminium(3+) Chemical compound [Al+3] REDXJYDRNCIFBQ-UHFFFAOYSA-N 0.000 description 4
- 239000004305 biphenyl Substances 0.000 description 4
- 235000010290 biphenyl Nutrition 0.000 description 4
- 150000001721 carbon Chemical group 0.000 description 4
- YCIMNLLNPGFGHC-UHFFFAOYSA-N catechol Chemical compound OC1=CC=CC=C1O YCIMNLLNPGFGHC-UHFFFAOYSA-N 0.000 description 4
- 230000008859 change Effects 0.000 description 4
- 238000005859 coupling reaction Methods 0.000 description 4
- 239000013078 crystal Substances 0.000 description 4
- 239000000543 intermediate Substances 0.000 description 4
- DCZNSJVFOQPSRV-UHFFFAOYSA-N n,n-diphenyl-4-[4-(n-phenylanilino)phenyl]aniline Chemical compound C1=CC=CC=C1N(C=1C=CC(=CC=1)C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 DCZNSJVFOQPSRV-UHFFFAOYSA-N 0.000 description 4
- 229910052698 phosphorus Inorganic materials 0.000 description 4
- 239000011574 phosphorus Substances 0.000 description 4
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 4
- 150000003220 pyrenes Chemical class 0.000 description 4
- 239000011541 reaction mixture Substances 0.000 description 4
- 230000035484 reaction time Effects 0.000 description 4
- MFRIHAYPQRLWNB-UHFFFAOYSA-N sodium tert-butoxide Chemical compound [Na+].CC(C)(C)[O-] MFRIHAYPQRLWNB-UHFFFAOYSA-N 0.000 description 4
- 239000007858 starting material Substances 0.000 description 4
- 150000003573 thiols Chemical class 0.000 description 4
- 229920002554 vinyl polymer Polymers 0.000 description 4
- JYEUMXHLPRZUAT-UHFFFAOYSA-N 1,2,3-triazine Chemical compound C1=CN=NN=C1 JYEUMXHLPRZUAT-UHFFFAOYSA-N 0.000 description 3
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 3
- WQONPSCCEXUXTQ-UHFFFAOYSA-N 1,2-dibromobenzene Chemical compound BrC1=CC=CC=C1Br WQONPSCCEXUXTQ-UHFFFAOYSA-N 0.000 description 3
- IBGUDZMIAZLJNY-UHFFFAOYSA-N 1,4-dibromonaphthalene Chemical compound C1=CC=C2C(Br)=CC=C(Br)C2=C1 IBGUDZMIAZLJNY-UHFFFAOYSA-N 0.000 description 3
- VOIVTTPPKHORBL-UHFFFAOYSA-N 1-naphthalen-1-ylanthracene Chemical compound C1=CC=C2C(C=3C4=CC5=CC=CC=C5C=C4C=CC=3)=CC=CC2=C1 VOIVTTPPKHORBL-UHFFFAOYSA-N 0.000 description 3
- 125000001637 1-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C(*)=C([H])C([H])=C([H])C2=C1[H] 0.000 description 3
- AEBGSJKDFZNJLT-UHFFFAOYSA-N 4-[2-[4-[2-[4-(4-bromo-n-(4-bromophenyl)anilino)phenyl]ethenyl]phenyl]ethenyl]-n,n-bis(4-bromophenyl)aniline Chemical compound C1=CC(Br)=CC=C1N(C=1C=CC(C=CC=2C=CC(C=CC=3C=CC(=CC=3)N(C=3C=CC(Br)=CC=3)C=3C=CC(Br)=CC=3)=CC=2)=CC=1)C1=CC=C(Br)C=C1 AEBGSJKDFZNJLT-UHFFFAOYSA-N 0.000 description 3
- CRGHMHFRUWWRBW-UHFFFAOYSA-N 4-[4-(4-bromo-n-(4-bromophenyl)anilino)phenyl]-n,n-bis(4-bromophenyl)aniline Chemical compound C1=CC(Br)=CC=C1N(C=1C=CC(=CC=1)C=1C=CC(=CC=1)N(C=1C=CC(Br)=CC=1)C=1C=CC(Br)=CC=1)C1=CC=C(Br)C=C1 CRGHMHFRUWWRBW-UHFFFAOYSA-N 0.000 description 3
- BRUOAURMAFDGLP-UHFFFAOYSA-N 9,10-dibromoanthracene Chemical compound C1=CC=C2C(Br)=C(C=CC=C3)C3=C(Br)C2=C1 BRUOAURMAFDGLP-UHFFFAOYSA-N 0.000 description 3
- RVAIKDGUBQSXIQ-UHFFFAOYSA-N C1=CC=CC2=CC3=CC=CC=C3C=C12.BrC1=C(C=CC=C1)C=1C2=CC=CC=C2C(=C2C=CC=CC12)C1=C(C=CC=C1)Br Chemical compound C1=CC=CC2=CC3=CC=CC=C3C=C12.BrC1=C(C=CC=C1)C=1C2=CC=CC=C2C(=C2C=CC=CC12)C1=C(C=CC=C1)Br RVAIKDGUBQSXIQ-UHFFFAOYSA-N 0.000 description 3
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 3
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 3
- TZHYBRCGYCPGBQ-UHFFFAOYSA-N [B].[N] Chemical class [B].[N] TZHYBRCGYCPGBQ-UHFFFAOYSA-N 0.000 description 3
- 238000000862 absorption spectrum Methods 0.000 description 3
- 150000001454 anthracenes Chemical class 0.000 description 3
- 239000011324 bead Substances 0.000 description 3
- 238000009835 boiling Methods 0.000 description 3
- 150000001638 boron Chemical class 0.000 description 3
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 3
- 239000003054 catalyst Substances 0.000 description 3
- 238000011097 chromatography purification Methods 0.000 description 3
- 230000008878 coupling Effects 0.000 description 3
- 238000010168 coupling process Methods 0.000 description 3
- 238000000151 deposition Methods 0.000 description 3
- JKWMSGQKBLHBQQ-UHFFFAOYSA-N diboron trioxide Chemical compound O=BOB=O JKWMSGQKBLHBQQ-UHFFFAOYSA-N 0.000 description 3
- 150000002009 diols Chemical class 0.000 description 3
- 238000001704 evaporation Methods 0.000 description 3
- 230000008020 evaporation Effects 0.000 description 3
- 239000007789 gas Substances 0.000 description 3
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 3
- PZOUSPYUWWUPPK-UHFFFAOYSA-N indole Natural products CC1=CC=CC2=C1C=CN2 PZOUSPYUWWUPPK-UHFFFAOYSA-N 0.000 description 3
- RKJUIXBNRJVNHR-UHFFFAOYSA-N indolenine Natural products C1=CC=C2CC=NC2=C1 RKJUIXBNRJVNHR-UHFFFAOYSA-N 0.000 description 3
- 150000002576 ketones Chemical class 0.000 description 3
- 238000004020 luminiscence type Methods 0.000 description 3
- 150000002987 phenanthrenes Chemical class 0.000 description 3
- HXITXNWTGFUOAU-UHFFFAOYSA-N phenylboronic acid Chemical compound OB(O)C1=CC=CC=C1 HXITXNWTGFUOAU-UHFFFAOYSA-N 0.000 description 3
- 239000002244 precipitate Substances 0.000 description 3
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 3
- 238000000746 purification Methods 0.000 description 3
- PBMFSQRYOILNGV-UHFFFAOYSA-N pyridazine Chemical compound C1=CC=NN=C1 PBMFSQRYOILNGV-UHFFFAOYSA-N 0.000 description 3
- IFLREYGFSNHWGE-UHFFFAOYSA-N tetracene Chemical compound C1=CC=CC2=CC3=CC4=CC=CC=C4C=C3C=C21 IFLREYGFSNHWGE-UHFFFAOYSA-N 0.000 description 3
- 238000010792 warming Methods 0.000 description 3
- JHVQEUGNYSVSDH-UHFFFAOYSA-N (4-methylnaphthalen-1-yl)boronic acid Chemical compound C1=CC=C2C(C)=CC=C(B(O)O)C2=C1 JHVQEUGNYSVSDH-UHFFFAOYSA-N 0.000 description 2
- GKDCWKGUOZVDFX-UHFFFAOYSA-N 1,1,1,4,4,4-hexafluoro-2,3-bis(trifluoromethyl)butane-2,3-diol Chemical compound FC(F)(F)C(C(F)(F)F)(O)C(O)(C(F)(F)F)C(F)(F)F GKDCWKGUOZVDFX-UHFFFAOYSA-N 0.000 description 2
- NCWDBNBNYVVARF-UHFFFAOYSA-N 1,3,2-dioxaborolane Chemical compound B1OCCO1 NCWDBNBNYVVARF-UHFFFAOYSA-N 0.000 description 2
- YJTKZCDBKVTVBY-UHFFFAOYSA-N 1,3-Diphenylbenzene Chemical group C1=CC=CC=C1C1=CC=CC(C=2C=CC=CC=2)=C1 YJTKZCDBKVTVBY-UHFFFAOYSA-N 0.000 description 2
- LPCWDYWZIWDTCV-UHFFFAOYSA-N 1-phenylisoquinoline Chemical compound C1=CC=CC=C1C1=NC=CC2=CC=CC=C12 LPCWDYWZIWDTCV-UHFFFAOYSA-N 0.000 description 2
- WJFKNYWRSNBZNX-UHFFFAOYSA-N 10H-phenothiazine Chemical compound C1=CC=C2NC3=CC=CC=C3SC2=C1 WJFKNYWRSNBZNX-UHFFFAOYSA-N 0.000 description 2
- TZMSYXZUNZXBOL-UHFFFAOYSA-N 10H-phenoxazine Chemical compound C1=CC=C2NC3=CC=CC=C3OC2=C1 TZMSYXZUNZXBOL-UHFFFAOYSA-N 0.000 description 2
- HDGCGHBEIGZDSX-UHFFFAOYSA-N 2,6-dibromo-9,10-dinaphthalen-1-ylanthracene Chemical compound C1=CC=C2C(C3=C4C=CC(Br)=CC4=C(C=4C5=CC=CC=C5C=CC=4)C4=CC=C(C=C43)Br)=CC=CC2=C1 HDGCGHBEIGZDSX-UHFFFAOYSA-N 0.000 description 2
- JUFYHUWBLXKCJM-UHFFFAOYSA-N 2,6-dibromoanthracene-9,10-dione Chemical class BrC1=CC=C2C(=O)C3=CC(Br)=CC=C3C(=O)C2=C1 JUFYHUWBLXKCJM-UHFFFAOYSA-N 0.000 description 2
- STTGYIUESPWXOW-UHFFFAOYSA-N 2,9-dimethyl-4,7-diphenyl-1,10-phenanthroline Chemical compound C=12C=CC3=C(C=4C=CC=CC=4)C=C(C)N=C3C2=NC(C)=CC=1C1=CC=CC=C1 STTGYIUESPWXOW-UHFFFAOYSA-N 0.000 description 2
- GBHRGHJTZFOAKE-UHFFFAOYSA-N 2-anthracen-9-yl-4,4,5,5-tetramethyl-1,3,2-dioxaborolane Chemical compound O1C(C)(C)C(C)(C)OB1C1=C(C=CC=C2)C2=CC2=CC=CC=C12 GBHRGHJTZFOAKE-UHFFFAOYSA-N 0.000 description 2
- BMIBJCFFZPYJHF-UHFFFAOYSA-N 2-methoxy-5-methyl-3-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)pyridine Chemical compound COC1=NC=C(C)C=C1B1OC(C)(C)C(C)(C)O1 BMIBJCFFZPYJHF-UHFFFAOYSA-N 0.000 description 2
- FSEXLNMNADBYJU-UHFFFAOYSA-N 2-phenylquinoline Chemical compound C1=CC=CC=C1C1=CC=C(C=CC=C2)C2=N1 FSEXLNMNADBYJU-UHFFFAOYSA-N 0.000 description 2
- IDCRGMNEAOWPRP-UHFFFAOYSA-N 4-(4-bromo-n-(4-bromophenyl)anilino)benzaldehyde Chemical compound C1=CC(Br)=CC=C1N(C=1C=CC(C=O)=CC=1)C1=CC=C(Br)C=C1 IDCRGMNEAOWPRP-UHFFFAOYSA-N 0.000 description 2
- DENKGPBHLYFNGK-UHFFFAOYSA-N 4-bromobenzoyl chloride Chemical compound ClC(=O)C1=CC=C(Br)C=C1 DENKGPBHLYFNGK-UHFFFAOYSA-N 0.000 description 2
- 125000004800 4-bromophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1Br 0.000 description 2
- RHPVVNRNAHRJOQ-UHFFFAOYSA-N 4-methyl-n-(4-methylphenyl)aniline Chemical compound C1=CC(C)=CC=C1NC1=CC=C(C)C=C1 RHPVVNRNAHRJOQ-UHFFFAOYSA-N 0.000 description 2
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 2
- SNFCXVRWFNAHQX-UHFFFAOYSA-N 9,9'-spirobi[fluorene] Chemical compound C12=CC=CC=C2C2=CC=CC=C2C21C1=CC=CC=C1C1=CC=CC=C21 SNFCXVRWFNAHQX-UHFFFAOYSA-N 0.000 description 2
- OSDONTNFJISHKN-UHFFFAOYSA-N 9-(2-anthracen-9-ylphenyl)anthracene Chemical compound C1=CC=C2C(C3=CC=CC=C3C=3C4=CC=CC=C4C=C4C=CC=CC4=3)=C(C=CC=C3)C3=CC2=C1 OSDONTNFJISHKN-UHFFFAOYSA-N 0.000 description 2
- BOKBJQGIHDNSEK-UHFFFAOYSA-N 9-bromo-10-[2-(10-bromoanthracen-9-yl)phenyl]anthracene Chemical compound C12=CC=CC=C2C(Br)=C(C=CC=C2)C2=C1C1=CC=CC=C1C1=C(C=CC=C2)C2=C(Br)C2=CC=CC=C12 BOKBJQGIHDNSEK-UHFFFAOYSA-N 0.000 description 2
- LMKPXUCLBVQWIQ-UHFFFAOYSA-N 9-bromo-10-[4-(10-bromoanthracen-9-yl)naphthalen-1-yl]anthracene Chemical compound C12=CC=CC=C2C(Br)=C(C=CC=C2)C2=C1C(C1=CC=CC=C11)=CC=C1C1=C(C=CC=C2)C2=C(Br)C2=CC=CC=C12 LMKPXUCLBVQWIQ-UHFFFAOYSA-N 0.000 description 2
- ZIRVQSRSPDUEOJ-UHFFFAOYSA-N 9-bromoanthracene Chemical compound C1=CC=C2C(Br)=C(C=CC=C3)C3=CC2=C1 ZIRVQSRSPDUEOJ-UHFFFAOYSA-N 0.000 description 2
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 2
- PHBXSUBZBOVYKO-UHFFFAOYSA-N CC1(C)OB(c2ccc(cc3)c4c2ccc2c4c3ccc2)OC1(C)C Chemical compound CC1(C)OB(c2ccc(cc3)c4c2ccc2c4c3ccc2)OC1(C)C PHBXSUBZBOVYKO-UHFFFAOYSA-N 0.000 description 2
- PANUKMYENAQJTA-UHFFFAOYSA-N CCOP(=O)OCC.CC1=CC=C(C)C=C1 Chemical compound CCOP(=O)OCC.CC1=CC=C(C)C=C1 PANUKMYENAQJTA-UHFFFAOYSA-N 0.000 description 2
- 229920000858 Cyclodextrin Polymers 0.000 description 2
- 239000007818 Grignard reagent Substances 0.000 description 2
- 101000801643 Homo sapiens Retinal-specific phospholipid-transporting ATPase ABCA4 Proteins 0.000 description 2
- UTKNUPLTWVCBHU-UHFFFAOYSA-N OBO.CC(C)(O)C(C)(C)O Chemical compound OBO.CC(C)(O)C(C)(C)O UTKNUPLTWVCBHU-UHFFFAOYSA-N 0.000 description 2
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 2
- 102100033617 Retinal-specific phospholipid-transporting ATPase ABCA4 Human genes 0.000 description 2
- PJANXHGTPQOBST-VAWYXSNFSA-N Stilbene Natural products C=1C=CC=CC=1/C=C/C1=CC=CC=C1 PJANXHGTPQOBST-VAWYXSNFSA-N 0.000 description 2
- 229910021626 Tin(II) chloride Inorganic materials 0.000 description 2
- VOYBYJOEGZUTHM-UHFFFAOYSA-N [2'-(4-bromobenzoyl)-9,9'-spirobi[fluorene]-2-yl]-(4-bromophenyl)methanone Chemical compound C1=CC(Br)=CC=C1C(=O)C1=CC=C(C=2C(=CC=CC=2)C23C4=CC(=CC=C4C4=CC=CC=C43)C(=O)C=3C=CC(Br)=CC=3)C2=C1 VOYBYJOEGZUTHM-UHFFFAOYSA-N 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 150000001298 alcohols Chemical class 0.000 description 2
- VSCWAEJMTAWNJL-UHFFFAOYSA-K aluminium trichloride Chemical compound Cl[Al](Cl)Cl VSCWAEJMTAWNJL-UHFFFAOYSA-K 0.000 description 2
- 125000003277 amino group Chemical group 0.000 description 2
- VHHDLIWHHXBLBK-UHFFFAOYSA-N anthracen-9-ylboronic acid Chemical compound C1=CC=C2C(B(O)O)=C(C=CC=C3)C3=CC2=C1 VHHDLIWHHXBLBK-UHFFFAOYSA-N 0.000 description 2
- 239000008346 aqueous phase Substances 0.000 description 2
- 239000012298 atmosphere Substances 0.000 description 2
- VERMEZLHWFHDLK-UHFFFAOYSA-N benzene-1,2,3,4-tetrol Chemical compound OC1=CC=C(O)C(O)=C1O VERMEZLHWFHDLK-UHFFFAOYSA-N 0.000 description 2
- 150000001639 boron compounds Chemical class 0.000 description 2
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 2
- 239000011248 coating agent Substances 0.000 description 2
- 238000000576 coating method Methods 0.000 description 2
- 150000004985 diamines Chemical class 0.000 description 2
- TXCDCPKCNAJMEE-UHFFFAOYSA-N dibenzofuran Chemical compound C1=CC=C2C3=CC=CC=C3OC2=C1 TXCDCPKCNAJMEE-UHFFFAOYSA-N 0.000 description 2
- IYYZUPMFVPLQIF-UHFFFAOYSA-N dibenzothiophene Chemical compound C1=CC=C2C3=CC=CC=C3SC2=C1 IYYZUPMFVPLQIF-UHFFFAOYSA-N 0.000 description 2
- USIUVYZYUHIAEV-UHFFFAOYSA-N diphenyl ether Chemical compound C=1C=CC=CC=1OC1=CC=CC=C1 USIUVYZYUHIAEV-UHFFFAOYSA-N 0.000 description 2
- DMBHHRLKUKUOEG-UHFFFAOYSA-N diphenylamine Chemical compound C=1C=CC=CC=1NC1=CC=CC=C1 DMBHHRLKUKUOEG-UHFFFAOYSA-N 0.000 description 2
- 150000004662 dithiols Chemical class 0.000 description 2
- 238000000295 emission spectrum Methods 0.000 description 2
- 125000004185 ester group Chemical group 0.000 description 2
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 2
- JVZRCNQLWOELDU-UHFFFAOYSA-N gamma-Phenylpyridine Natural products C1=CC=CC=C1C1=CC=NC=C1 JVZRCNQLWOELDU-UHFFFAOYSA-N 0.000 description 2
- 230000008570 general process Effects 0.000 description 2
- 150000004795 grignard reagents Chemical class 0.000 description 2
- 230000006872 improvement Effects 0.000 description 2
- MILUBEOXRNEUHS-UHFFFAOYSA-N iridium(3+) Chemical compound [Ir+3] MILUBEOXRNEUHS-UHFFFAOYSA-N 0.000 description 2
- DLEDOFVPSDKWEF-UHFFFAOYSA-N lithium butane Chemical compound [Li+].CCC[CH2-] DLEDOFVPSDKWEF-UHFFFAOYSA-N 0.000 description 2
- 150000002739 metals Chemical class 0.000 description 2
- HZVOZRGWRWCICA-UHFFFAOYSA-N methanediyl Chemical class [CH2] HZVOZRGWRWCICA-UHFFFAOYSA-N 0.000 description 2
- 150000002900 organolithium compounds Chemical class 0.000 description 2
- WCPAKWJPBJAGKN-UHFFFAOYSA-N oxadiazole Chemical compound C1=CON=N1 WCPAKWJPBJAGKN-UHFFFAOYSA-N 0.000 description 2
- 230000003647 oxidation Effects 0.000 description 2
- 238000007254 oxidation reaction Methods 0.000 description 2
- AUONHKJOIZSQGR-UHFFFAOYSA-N oxophosphane Chemical compound P=O AUONHKJOIZSQGR-UHFFFAOYSA-N 0.000 description 2
- LXNAVEXFUKBNMK-UHFFFAOYSA-N palladium(II) acetate Substances [Pd].CC(O)=O.CC(O)=O LXNAVEXFUKBNMK-UHFFFAOYSA-N 0.000 description 2
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 2
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 2
- SLIUAWYAILUBJU-UHFFFAOYSA-N pentacene Chemical compound C1=CC=CC2=CC3=CC4=CC5=CC=CC=C5C=C4C=C3C=C21 SLIUAWYAILUBJU-UHFFFAOYSA-N 0.000 description 2
- RDOWQLZANAYVLL-UHFFFAOYSA-N phenanthridine Chemical compound C1=CC=C2C3=CC=CC=C3C=NC2=C1 RDOWQLZANAYVLL-UHFFFAOYSA-N 0.000 description 2
- 229950000688 phenothiazine Drugs 0.000 description 2
- 229910052697 platinum Inorganic materials 0.000 description 2
- 238000006068 polycondensation reaction Methods 0.000 description 2
- NROKBHXJSPEDAR-UHFFFAOYSA-M potassium fluoride Chemical compound [F-].[K+] NROKBHXJSPEDAR-UHFFFAOYSA-M 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 238000007639 printing Methods 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- JWVCLYRUEFBMGU-UHFFFAOYSA-N quinazoline Chemical class N1=CN=CC2=CC=CC=C21 JWVCLYRUEFBMGU-UHFFFAOYSA-N 0.000 description 2
- 238000010992 reflux Methods 0.000 description 2
- 239000004065 semiconductor Substances 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 239000000741 silica gel Substances 0.000 description 2
- 229910002027 silica gel Inorganic materials 0.000 description 2
- 239000002002 slurry Substances 0.000 description 2
- 235000011150 stannous chloride Nutrition 0.000 description 2
- 235000021286 stilbenes Nutrition 0.000 description 2
- 238000005092 sublimation method Methods 0.000 description 2
- 235000000346 sugar Nutrition 0.000 description 2
- 150000005846 sugar alcohols Chemical class 0.000 description 2
- 150000003457 sulfones Chemical class 0.000 description 2
- AXZWODMDQAVCJE-UHFFFAOYSA-L tin(II) chloride (anhydrous) Chemical compound [Cl-].[Cl-].[Sn+2] AXZWODMDQAVCJE-UHFFFAOYSA-L 0.000 description 2
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 2
- ODHXBMXNKOYIBV-UHFFFAOYSA-N triphenylamine Chemical compound C1=CC=CC=C1N(C=1C=CC=CC=1)C1=CC=CC=C1 ODHXBMXNKOYIBV-UHFFFAOYSA-N 0.000 description 2
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 2
- COIOYMYWGDAQPM-UHFFFAOYSA-N tris(2-methylphenyl)phosphane Chemical compound CC1=CC=CC=C1P(C=1C(=CC=CC=1)C)C1=CC=CC=C1C COIOYMYWGDAQPM-UHFFFAOYSA-N 0.000 description 2
- OOMZKLJLVGQZGV-UHFFFAOYSA-N (2,5-dimethylphenyl)boronic acid Chemical compound CC1=CC=C(C)C(B(O)O)=C1 OOMZKLJLVGQZGV-UHFFFAOYSA-N 0.000 description 1
- KQFYWHQMZPLKLQ-UHFFFAOYSA-N 1,1'-spirobi[fluorene]-2',3',6',7'-tetrol Chemical compound C12=CC3=CC(O)=C(O)C=C3C2=CC(O)=C(O)C11C2=CC3=CC=CC=C3C2=CC=C1 KQFYWHQMZPLKLQ-UHFFFAOYSA-N 0.000 description 1
- HQDYNFWTFJFEPR-UHFFFAOYSA-N 1,2,3,3a-tetrahydropyrene Chemical compound C1=C2CCCC(C=C3)C2=C2C3=CC=CC2=C1 HQDYNFWTFJFEPR-UHFFFAOYSA-N 0.000 description 1
- JNWSOMCGRXAFOY-UHFFFAOYSA-N 1,2,3,3a-tetrahydropyrene-4,5,9,10-tetrol Chemical compound C1CCC2C(O)=C(O)C3=CC=CC4=C(O)C(O)=C1C2=C34 JNWSOMCGRXAFOY-UHFFFAOYSA-N 0.000 description 1
- FNQJDLTXOVEEFB-UHFFFAOYSA-N 1,2,3-benzothiadiazole Chemical compound C1=CC=C2SN=NC2=C1 FNQJDLTXOVEEFB-UHFFFAOYSA-N 0.000 description 1
- UGUHFDPGDQDVGX-UHFFFAOYSA-N 1,2,3-thiadiazole Chemical compound C1=CSN=N1 UGUHFDPGDQDVGX-UHFFFAOYSA-N 0.000 description 1
- HTJMXYRLEDBSLT-UHFFFAOYSA-N 1,2,4,5-tetrazine Chemical compound C1=NN=CN=N1 HTJMXYRLEDBSLT-UHFFFAOYSA-N 0.000 description 1
- BBVIDBNAYOIXOE-UHFFFAOYSA-N 1,2,4-oxadiazole Chemical compound C=1N=CON=1 BBVIDBNAYOIXOE-UHFFFAOYSA-N 0.000 description 1
- YGTAZGSLCXNBQL-UHFFFAOYSA-N 1,2,4-thiadiazole Chemical compound C=1N=CSN=1 YGTAZGSLCXNBQL-UHFFFAOYSA-N 0.000 description 1
- FYADHXFMURLYQI-UHFFFAOYSA-N 1,2,4-triazine Chemical compound C1=CN=NC=N1 FYADHXFMURLYQI-UHFFFAOYSA-N 0.000 description 1
- UDGKZGLPXCRRAM-UHFFFAOYSA-N 1,2,5-thiadiazole Chemical compound C=1C=NSN=1 UDGKZGLPXCRRAM-UHFFFAOYSA-N 0.000 description 1
- UUSUFQUCLACDTA-UHFFFAOYSA-N 1,2-dihydropyrene Chemical compound C1=CC=C2C=CC3=CCCC4=CC=C1C2=C43 UUSUFQUCLACDTA-UHFFFAOYSA-N 0.000 description 1
- 150000000180 1,2-diols Chemical class 0.000 description 1
- 125000002030 1,2-phenylene group Chemical group [H]C1=C([H])C([*:1])=C([*:2])C([H])=C1[H] 0.000 description 1
- YMHLQLLOFIXQSB-UHFFFAOYSA-N 1,3,2-diazaborinane Chemical compound B1NCCCN1 YMHLQLLOFIXQSB-UHFFFAOYSA-N 0.000 description 1
- FKASFBLJDCHBNZ-UHFFFAOYSA-N 1,3,4-oxadiazole Chemical compound C1=NN=CO1 FKASFBLJDCHBNZ-UHFFFAOYSA-N 0.000 description 1
- MBIZXFATKUQOOA-UHFFFAOYSA-N 1,3,4-thiadiazole Chemical compound C1=NN=CS1 MBIZXFATKUQOOA-UHFFFAOYSA-N 0.000 description 1
- 150000000183 1,3-benzoxazoles Chemical class 0.000 description 1
- 150000000185 1,3-diols Chemical class 0.000 description 1
- FLBAYUMRQUHISI-UHFFFAOYSA-N 1,8-naphthyridine Chemical compound N1=CC=CC2=CC=CN=C21 FLBAYUMRQUHISI-UHFFFAOYSA-N 0.000 description 1
- WYECURVXVYPVAT-UHFFFAOYSA-N 1-(4-bromophenyl)ethanone Chemical compound CC(=O)C1=CC=C(Br)C=C1 WYECURVXVYPVAT-UHFFFAOYSA-N 0.000 description 1
- BATKIZWNRQGSKE-UHFFFAOYSA-N 1-[4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)phenyl]ethanone Chemical compound C1=CC(C(=O)C)=CC=C1B1OC(C)(C)C(C)(C)O1 BATKIZWNRQGSKE-UHFFFAOYSA-N 0.000 description 1
- AWNXKZVIZARMME-UHFFFAOYSA-N 1-[[5-[2-[(2-chloropyridin-4-yl)amino]pyrimidin-4-yl]-4-(cyclopropylmethyl)pyrimidin-2-yl]amino]-2-methylpropan-2-ol Chemical compound N=1C(NCC(C)(O)C)=NC=C(C=2N=C(NC=3C=C(Cl)N=CC=3)N=CC=2)C=1CC1CC1 AWNXKZVIZARMME-UHFFFAOYSA-N 0.000 description 1
- DLKQHBOKULLWDQ-UHFFFAOYSA-N 1-bromonaphthalene Chemical compound C1=CC=C2C(Br)=CC=CC2=C1 DLKQHBOKULLWDQ-UHFFFAOYSA-N 0.000 description 1
- QWENRTYMTSOGBR-UHFFFAOYSA-N 1H-1,2,3-Triazole Chemical compound C=1C=NNN=1 QWENRTYMTSOGBR-UHFFFAOYSA-N 0.000 description 1
- HYZJCKYKOHLVJF-UHFFFAOYSA-N 1H-benzimidazole Chemical compound C1=CC=C2NC=NC2=C1 HYZJCKYKOHLVJF-UHFFFAOYSA-N 0.000 description 1
- BAXOFTOLAUCFNW-UHFFFAOYSA-N 1H-indazole Chemical compound C1=CC=C2C=NNC2=C1 BAXOFTOLAUCFNW-UHFFFAOYSA-N 0.000 description 1
- PLJDGKPRGUMSAA-UHFFFAOYSA-N 2,2',7,7'-tetraphenyl-1,1'-spirobi[fluorene] Chemical compound C12=CC=C(C=3C=CC=CC=3)C=C2C=C(C23C(=CC=C4C5=CC=C(C=C5C=C43)C=3C=CC=CC=3)C=3C=CC=CC=3)C1=CC=C2C1=CC=CC=C1 PLJDGKPRGUMSAA-UHFFFAOYSA-N 0.000 description 1
- 125000004206 2,2,2-trifluoroethyl group Chemical group [H]C([H])(*)C(F)(F)F 0.000 description 1
- NIBFJPXGNVPNHK-UHFFFAOYSA-N 2,2-difluoro-1,3-benzodioxole-4-carbaldehyde Chemical group C1=CC(C=O)=C2OC(F)(F)OC2=C1 NIBFJPXGNVPNHK-UHFFFAOYSA-N 0.000 description 1
- PFRPMHBYYJIARU-UHFFFAOYSA-N 2,3-diazatetracyclo[6.6.2.04,16.011,15]hexadeca-1(14),2,4,6,8(16),9,11(15),12-octaene Chemical compound C1=CC=C2N=NC3=CC=CC4=CC=C1C2=C43 PFRPMHBYYJIARU-UHFFFAOYSA-N 0.000 description 1
- VEPOHXYIFQMVHW-XOZOLZJESA-N 2,3-dihydroxybutanedioic acid (2S,3S)-3,4-dimethyl-2-phenylmorpholine Chemical compound OC(C(O)C(O)=O)C(O)=O.C[C@H]1[C@@H](OCCN1C)c1ccccc1 VEPOHXYIFQMVHW-XOZOLZJESA-N 0.000 description 1
- BIEFDNUEROKZRA-UHFFFAOYSA-N 2-(2-phenylethenyl)aniline Chemical class NC1=CC=CC=C1C=CC1=CC=CC=C1 BIEFDNUEROKZRA-UHFFFAOYSA-N 0.000 description 1
- JHKKTXXMAQLGJB-UHFFFAOYSA-N 2-(methylamino)phenol Chemical compound CNC1=CC=CC=C1O JHKKTXXMAQLGJB-UHFFFAOYSA-N 0.000 description 1
- BGZHOUYGJXZNAI-UHFFFAOYSA-N 2-N,2-N,2-N',2-N',7-N,7-N,7-N',7-N'-octakis-phenyl-1,1'-spirobi[fluorene]-2,2',7,7'-tetramine Chemical compound C12=CC=C(N(C=3C=CC=CC=3)C=3C=CC=CC=3)C=C2C=C(C23C(=CC=C4C5=CC=C(C=C5C=C43)N(C=3C=CC=CC=3)C=3C=CC=CC=3)N(C=3C=CC=CC=3)C=3C=CC=CC=3)C1=CC=C2N(C=1C=CC=CC=1)C1=CC=CC=C1 BGZHOUYGJXZNAI-UHFFFAOYSA-N 0.000 description 1
- RICKKZXCGCSLIU-UHFFFAOYSA-N 2-[2-[carboxymethyl-[[3-hydroxy-5-(hydroxymethyl)-2-methylpyridin-4-yl]methyl]amino]ethyl-[[3-hydroxy-5-(hydroxymethyl)-2-methylpyridin-4-yl]methyl]amino]acetic acid Chemical compound CC1=NC=C(CO)C(CN(CCN(CC(O)=O)CC=2C(=C(C)N=CC=2CO)O)CC(O)=O)=C1O RICKKZXCGCSLIU-UHFFFAOYSA-N 0.000 description 1
- WUNPSTODJSDWQD-UHFFFAOYSA-N 2-[3,8-bis(2,5-dimethylphenyl)-6-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)pyren-1-yl]-4,4,5,5-tetramethyl-1,3,2-dioxaborolane Chemical compound CC1=CC=C(C)C(C=2C3=CC=C4C(B5OC(C)(C)C(C)(C)O5)=CC(=C5C=CC(C3=C54)=C(B3OC(C)(C)C(C)(C)O3)C=2)C=2C(=CC=C(C)C=2)C)=C1 WUNPSTODJSDWQD-UHFFFAOYSA-N 0.000 description 1
- UXGVMFHEKMGWMA-UHFFFAOYSA-N 2-benzofuran Chemical compound C1=CC=CC2=COC=C21 UXGVMFHEKMGWMA-UHFFFAOYSA-N 0.000 description 1
- LYTMVABTDYMBQK-UHFFFAOYSA-N 2-benzothiophene Chemical compound C1=CC=CC2=CSC=C21 LYTMVABTDYMBQK-UHFFFAOYSA-N 0.000 description 1
- AZYGEWXDKHFOKB-UHFFFAOYSA-N 2-chloro-1,3,2-benzodioxaborole Chemical class C1=CC=C2OB(Cl)OC2=C1 AZYGEWXDKHFOKB-UHFFFAOYSA-N 0.000 description 1
- 125000004493 2-methylbut-1-yl group Chemical group CC(C*)CC 0.000 description 1
- VHMICKWLTGFITH-UHFFFAOYSA-N 2H-isoindole Chemical compound C1=CC=CC2=CNC=C21 VHMICKWLTGFITH-UHFFFAOYSA-N 0.000 description 1
- AGIJRRREJXSQJR-UHFFFAOYSA-N 2h-thiazine Chemical compound N1SC=CC=C1 AGIJRRREJXSQJR-UHFFFAOYSA-N 0.000 description 1
- GLXOHSHPIMRJFK-UHFFFAOYSA-N 3-methyl-n-[4-[2-[4-[2-[4-(3-methyl-n-(3-methylphenyl)anilino)phenyl]ethenyl]phenyl]ethenyl]phenyl]-n-(3-methylphenyl)aniline Chemical compound CC1=CC=CC(N(C=2C=CC(C=CC=3C=CC(C=CC=4C=CC(=CC=4)N(C=4C=C(C)C=CC=4)C=4C=C(C)C=CC=4)=CC=3)=CC=2)C=2C=C(C)C=CC=2)=C1 GLXOHSHPIMRJFK-UHFFFAOYSA-N 0.000 description 1
- HLVGOLCGJYVSTM-UHFFFAOYSA-N 4,4-dibromo-1-[1-(4,4-dibromocarbazol-1-yl)-4-phenylcyclohexa-2,4-dien-1-yl]carbazole Chemical group C1C=C(C=CC1(C2=C3C(=C4C=CC=CC4=N3)C(C=C2)(Br)Br)C5=C6C(=C7C=CC=CC7=N6)C(C=C5)(Br)Br)C8=CC=CC=C8 HLVGOLCGJYVSTM-UHFFFAOYSA-N 0.000 description 1
- NCPUXHNPVZMXMF-UHFFFAOYSA-N 4,4-dibromo-1-[4-[4-(4,4-dibromocarbazol-1-yl)phenyl]phenyl]carbazole Chemical group N1=C2C=CC=CC2=C(C(Br)(Br)C=C2)C1=C2C(C=C1)=CC=C1C(C=C1)=CC=C1C(C=CC1(Br)Br)=C2C1=C1C=CC=CC1=N2 NCPUXHNPVZMXMF-UHFFFAOYSA-N 0.000 description 1
- CPDDXQJCPYHULE-UHFFFAOYSA-N 4,5,14,16-tetrazapentacyclo[9.7.1.12,6.015,19.010,20]icosa-1(18),2,4,6,8,10(20),11(19),12,14,16-decaene Chemical group C1=CC(C2=CC=CC=3C2=C2C=NN=3)=C3C2=CC=NC3=N1 CPDDXQJCPYHULE-UHFFFAOYSA-N 0.000 description 1
- MZEFNGQKJROKHS-UHFFFAOYSA-N 4-(3,4-dihydroxyphenyl)benzene-1,2-diol Chemical group C1=C(O)C(O)=CC=C1C1=CC=C(O)C(O)=C1 MZEFNGQKJROKHS-UHFFFAOYSA-N 0.000 description 1
- QGHDLJAZIIFENW-UHFFFAOYSA-N 4-[1,1,1,3,3,3-hexafluoro-2-(4-hydroxy-3-prop-2-enylphenyl)propan-2-yl]-2-prop-2-enylphenol Chemical group C1=C(CC=C)C(O)=CC=C1C(C(F)(F)F)(C(F)(F)F)C1=CC=C(O)C(CC=C)=C1 QGHDLJAZIIFENW-UHFFFAOYSA-N 0.000 description 1
- 125000002672 4-bromobenzoyl group Chemical group BrC1=CC=C(C(=O)*)C=C1 0.000 description 1
- NSPMIYGKQJPBQR-UHFFFAOYSA-N 4H-1,2,4-triazole Chemical compound C=1N=CNN=1 NSPMIYGKQJPBQR-UHFFFAOYSA-N 0.000 description 1
- YSSVQYFOHYQSHR-UHFFFAOYSA-N 9,10-bis(4-bromonaphthalen-1-yl)anthracene Chemical compound C12=CC=CC=C2C(Br)=CC=C1C(C1=CC=CC=C11)=C(C=CC=C2)C2=C1C1=CC=C(Br)C2=CC=CC=C12 YSSVQYFOHYQSHR-UHFFFAOYSA-N 0.000 description 1
- VIZUPBYFLORCRA-UHFFFAOYSA-N 9,10-dinaphthalen-2-ylanthracene Chemical compound C12=CC=CC=C2C(C2=CC3=CC=CC=C3C=C2)=C(C=CC=C2)C2=C1C1=CC=C(C=CC=C2)C2=C1 VIZUPBYFLORCRA-UHFFFAOYSA-N 0.000 description 1
- HAOKDDFIDHVSCI-UHFFFAOYSA-N 9-(4-anthracen-9-ylnaphthalen-1-yl)anthracene Chemical compound C1=CC=CC2=CC3=CC=CC=C3C(C=3C4=CC=CC=C4C(C=4C5=CC=CC=C5C=C5C=CC=CC5=4)=CC=3)=C21 HAOKDDFIDHVSCI-UHFFFAOYSA-N 0.000 description 1
- IBFNLCZFNABMHC-UHFFFAOYSA-N 9-(4-methylnaphthalen-1-yl)anthracene Chemical compound C12=CC=CC=C2C(C)=CC=C1C1=C(C=CC=C2)C2=CC2=CC=CC=C12 IBFNLCZFNABMHC-UHFFFAOYSA-N 0.000 description 1
- DEJGCXGGTKKUEK-UHFFFAOYSA-N 9-n,9-n,10-n,10-n-tetrakis(4-bromophenyl)anthracene-9,10-diamine Chemical compound C1=CC(Br)=CC=C1N(C=1C2=CC=CC=C2C(N(C=2C=CC(Br)=CC=2)C=2C=CC(Br)=CC=2)=C2C=CC=CC2=1)C1=CC=C(Br)C=C1 DEJGCXGGTKKUEK-UHFFFAOYSA-N 0.000 description 1
- RZGMFRRDBNHLJU-UHFFFAOYSA-N 9-n,9-n,10-n,10-n-tetraphenylanthracene-9,10-diamine Chemical compound C1=CC=CC=C1N(C=1C2=CC=CC=C2C(N(C=2C=CC=CC=2)C=2C=CC=CC=2)=C2C=CC=CC2=1)C1=CC=CC=C1 RZGMFRRDBNHLJU-UHFFFAOYSA-N 0.000 description 1
- BPMFPOGUJAAYHL-UHFFFAOYSA-N 9H-Pyrido[2,3-b]indole Chemical compound C1=CC=C2C3=CC=CC=C3NC2=N1 BPMFPOGUJAAYHL-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 239000005964 Acibenzolar-S-methyl Substances 0.000 description 1
- 229920001450 Alpha-Cyclodextrin Polymers 0.000 description 1
- 229920000945 Amylopectin Polymers 0.000 description 1
- 229920000856 Amylose Polymers 0.000 description 1
- FMMWHPNWAFZXNH-UHFFFAOYSA-N Benz[a]pyrene Chemical compound C1=C2C3=CC=CC=C3C=C(C=C3)C2=C2C3=CC=CC2=C1 FMMWHPNWAFZXNH-UHFFFAOYSA-N 0.000 description 1
- FIPWRIJSWJWJAI-UHFFFAOYSA-N Butyl carbitol 6-propylpiperonyl ether Chemical compound C1=C(CCC)C(COCCOCCOCCCC)=CC2=C1OCO2 FIPWRIJSWJWJAI-UHFFFAOYSA-N 0.000 description 1
- QNDJQWQXDQKILW-UHFFFAOYSA-N C1OB(C(C=C2)=CC=C2C(C=CC=C2)=C2C2=CC=C(B3OCCO3)C3=C2NC2=CC=CC=C32)OC1 Chemical group C1OB(C(C=C2)=CC=C2C(C=CC=C2)=C2C2=CC=C(B3OCCO3)C3=C2NC2=CC=CC=C32)OC1 QNDJQWQXDQKILW-UHFFFAOYSA-N 0.000 description 1
- WFEYOKTWWWBTKE-UHFFFAOYSA-N C1OB(c(c2c3cccc2)c(cccc2)c2c3-c(cc2)c(cccc3)c3c2-c2c(cccc3)c3c(B3OCCO3)c3ccccc23)OC1 Chemical compound C1OB(c(c2c3cccc2)c(cccc2)c2c3-c(cc2)c(cccc3)c3c2-c2c(cccc3)c3c(B3OCCO3)c3ccccc23)OC1 WFEYOKTWWWBTKE-UHFFFAOYSA-N 0.000 description 1
- HQKSKENJKIRSSB-UHFFFAOYSA-N C1OB(c(c2c3cccc2)c(cccc2)c2c3-c2c(cccc3)c3c(-c3cccc4c3cccc4)c3c2cccc3)OC1 Chemical compound C1OB(c(c2c3cccc2)c(cccc2)c2c3-c2c(cccc3)c3c(-c3cccc4c3cccc4)c3c2cccc3)OC1 HQKSKENJKIRSSB-UHFFFAOYSA-N 0.000 description 1
- ZFBWHLGJTHJRPI-UHFFFAOYSA-N C1OB(c(c2c3cccc2)c(cccc2)c2c3-c2c(cccc3)c3ccc2)OC1 Chemical compound C1OB(c(c2c3cccc2)c(cccc2)c2c3-c2c(cccc3)c3ccc2)OC1 ZFBWHLGJTHJRPI-UHFFFAOYSA-N 0.000 description 1
- LAPLQHFXDNXZCP-UHFFFAOYSA-N C1OB(c(c2c3cccc2)ccc3-c(cc2)c(cccc3)c3c2-c2ccc(B3OCCO3)c3ccccc23)OC1 Chemical compound C1OB(c(c2c3cccc2)ccc3-c(cc2)c(cccc3)c3c2-c2ccc(B3OCCO3)c3ccccc23)OC1 LAPLQHFXDNXZCP-UHFFFAOYSA-N 0.000 description 1
- QYCMDHFTHAXACE-UHFFFAOYSA-N C1OB(c(c2ccccc22)c(cccc3)c3c2-c(cc2)c(cccc3)c3c2-c2c(cccc3)c3c(-c3ccccc3)c3c2cccc3)OC1 Chemical compound C1OB(c(c2ccccc22)c(cccc3)c3c2-c(cc2)c(cccc3)c3c2-c2c(cccc3)c3c(-c3ccccc3)c3c2cccc3)OC1 QYCMDHFTHAXACE-UHFFFAOYSA-N 0.000 description 1
- RPGSMQCUJFGIOS-UHFFFAOYSA-N C1OB(c(c2ccccc22)c(cccc3)c3c2-c2c(cccc3)c3ncc2)OC1 Chemical compound C1OB(c(c2ccccc22)c(cccc3)c3c2-c2c(cccc3)c3ncc2)OC1 RPGSMQCUJFGIOS-UHFFFAOYSA-N 0.000 description 1
- WCXZAEKBFYQUDX-UHFFFAOYSA-N C1OB(c(c2ccccc22)ccc2-c(cc2)c(cccc3)c3c2-c2cccc3c2cccc3)OC1 Chemical compound C1OB(c(c2ccccc22)ccc2-c(cc2)c(cccc3)c3c2-c2cccc3c2cccc3)OC1 WCXZAEKBFYQUDX-UHFFFAOYSA-N 0.000 description 1
- XJDXYTVHVWOSCB-UHFFFAOYSA-N C1OS(c2c(cccc3)c3c(-c3ccccc3)c3c2cccc3)OC1 Chemical compound C1OS(c2c(cccc3)c3c(-c3ccccc3)c3c2cccc3)OC1 XJDXYTVHVWOSCB-UHFFFAOYSA-N 0.000 description 1
- LOBPVASWMZNVDA-UHFFFAOYSA-N CC(C)(C(C)(C)OBc1cc(cc2)c3c4c2cc(BOC(C)(C)C(C)(C)O)cc4ccc3c1)O Chemical compound CC(C)(C(C)(C)OBc1cc(cc2)c3c4c2cc(BOC(C)(C)C(C)(C)O)cc4ccc3c1)O LOBPVASWMZNVDA-UHFFFAOYSA-N 0.000 description 1
- VKFMPAOBRYBGDO-UHFFFAOYSA-N CC(C)(CO)CO[B+]c(cc1)c(cc2)c3c1ccc1cccc2c31 Chemical compound CC(C)(CO)CO[B+]c(cc1)c(cc2)c3c1ccc1cccc2c31 VKFMPAOBRYBGDO-UHFFFAOYSA-N 0.000 description 1
- SVMCFFQLPIKJNR-UHFFFAOYSA-N CC1(C)COB(c2ccc(cc3)c4c2ccc2c4c3ccc2)OC1 Chemical compound CC1(C)COB(c2ccc(cc3)c4c2ccc2c4c3ccc2)OC1 SVMCFFQLPIKJNR-UHFFFAOYSA-N 0.000 description 1
- HMBOWZOMKXMRJK-UHFFFAOYSA-N CC1(C)OB(c(c2ccccc22)c(cccc3)c3c2-c(cc2)c(cccc3)c3c2-c2cccc3c2cccc3)OC1(C)C Chemical compound CC1(C)OB(c(c2ccccc22)c(cccc3)c3c2-c(cc2)c(cccc3)c3c2-c2cccc3c2cccc3)OC1(C)C HMBOWZOMKXMRJK-UHFFFAOYSA-N 0.000 description 1
- OSXGWTSPWMDJLH-UHFFFAOYSA-N CC1(C)OB(c(cc2cc3)cc4c2c2c3cc(B3OC(C)(C)C(C)(C)O3)cc2cc4)OC1(C)C Chemical compound CC1(C)OB(c(cc2cc3)cc4c2c2c3cc(B3OC(C)(C)C(C)(C)O3)cc2cc4)OC1(C)C OSXGWTSPWMDJLH-UHFFFAOYSA-N 0.000 description 1
- MVGDRHFJGXEKBG-UHFFFAOYSA-N CC1(C)OB(c2c(cccc3)c3c(-c3ccccc3)c3c2cccc3)OC1(C)C Chemical compound CC1(C)OB(c2c(cccc3)c3c(-c3ccccc3)c3c2cccc3)OC1(C)C MVGDRHFJGXEKBG-UHFFFAOYSA-N 0.000 description 1
- YREWNAIHDLIYMI-UHFFFAOYSA-N CC1(C)OB(c2cc3ccccc3c3ccccc23)OC1(C)C Chemical compound CC1(C)OB(c2cc3ccccc3c3ccccc23)OC1(C)C YREWNAIHDLIYMI-UHFFFAOYSA-N 0.000 description 1
- KZIBZYUABJVXSB-UHFFFAOYSA-N CC1(C)OB(c2ccccc2-c2c(cccc3)c3c(-c3c(B4OC(C)(C)C(C)(C)O4)cccc3)c3c2cccc3)OC1(C)C Chemical compound CC1(C)OB(c2ccccc2-c2c(cccc3)c3c(-c3c(B4OC(C)(C)C(C)(C)O4)cccc3)c3c2cccc3)OC1(C)C KZIBZYUABJVXSB-UHFFFAOYSA-N 0.000 description 1
- RSTJFSDIYWQOFQ-UHFFFAOYSA-N CC1=CC(=C(C=C1)C)C2=CC(=C3C=CC4=C5C3=C2C=CC5=C(C=C4)Br)Br Chemical compound CC1=CC(=C(C=C1)C)C2=CC(=C3C=CC4=C5C3=C2C=CC5=C(C=C4)Br)Br RSTJFSDIYWQOFQ-UHFFFAOYSA-N 0.000 description 1
- IKPHVYRBAZWWNL-UHFFFAOYSA-N COc1cccc2c1OB(c1c3c(OC)cccc3cc3cccc(OC)c13)O2 Chemical compound COc1cccc2c1OB(c1c3c(OC)cccc3cc3cccc(OC)c13)O2 IKPHVYRBAZWWNL-UHFFFAOYSA-N 0.000 description 1
- IRQSGRLLUKNZBZ-UHFFFAOYSA-N COc1cccc2c1c(B1Oc3ccccc3O1)c1c(OC)cccc1c2 Chemical compound COc1cccc2c1c(B1Oc3ccccc3O1)c1c(OC)cccc1c2 IRQSGRLLUKNZBZ-UHFFFAOYSA-N 0.000 description 1
- NOBZSHWUMMYYGM-UHFFFAOYSA-N COc1cccc2cc3cccc(OC)c3c(B3Sc(cccc4)c4S3)c12 Chemical compound COc1cccc2cc3cccc(OC)c3c(B3Sc(cccc4)c4S3)c12 NOBZSHWUMMYYGM-UHFFFAOYSA-N 0.000 description 1
- ZECQULDRMHWKIK-UHFFFAOYSA-O Cc(cc1)c(cccc2)c2c1-c1c(cccc2)c2c(BOCC[OH2+])c2ccccc12 Chemical compound Cc(cc1)c(cccc2)c2c1-c1c(cccc2)c2c(BOCC[OH2+])c2ccccc12 ZECQULDRMHWKIK-UHFFFAOYSA-O 0.000 description 1
- JMNPQXBOOZLRHN-UHFFFAOYSA-N Cc(cc1c2c3ccc(Br)c2)ccc1[n]3-c(cc1)ccc1-c(cc1)ccc1-[n](c(ccc(Br)c1)c1c1c2)c1ccc2Br Chemical compound Cc(cc1c2c3ccc(Br)c2)ccc1[n]3-c(cc1)ccc1-c(cc1)ccc1-[n](c(ccc(Br)c1)c1c1c2)c1ccc2Br JMNPQXBOOZLRHN-UHFFFAOYSA-N 0.000 description 1
- PKTCYPLNDAYUHF-UHFFFAOYSA-N Cc(cccc1)c1-c1c(cccc2)c2c(BOCCO)c2ccccc12 Chemical compound Cc(cccc1)c1-c1c(cccc2)c2c(BOCCO)c2ccccc12 PKTCYPLNDAYUHF-UHFFFAOYSA-N 0.000 description 1
- XFXPMWWXUTWYJX-UHFFFAOYSA-N Cyanide Chemical compound N#[C-] XFXPMWWXUTWYJX-UHFFFAOYSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 229910052693 Europium Inorganic materials 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- PWHULOQIROXLJO-UHFFFAOYSA-N Manganese Chemical compound [Mn] PWHULOQIROXLJO-UHFFFAOYSA-N 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- ZOKXTWBITQBERF-UHFFFAOYSA-N Molybdenum Chemical compound [Mo] ZOKXTWBITQBERF-UHFFFAOYSA-N 0.000 description 1
- ICKDTPDWPKXRKM-UHFFFAOYSA-N OBO.OC1=CC=CC=C1O Chemical compound OBO.OC1=CC=CC=C1O ICKDTPDWPKXRKM-UHFFFAOYSA-N 0.000 description 1
- HGPQZFZEFLKKAR-UHFFFAOYSA-N OCCOBc(c1ccccc11)c(cccc2)c2c1-c(cc1)c(cccc2)c2c1-c1cccc2c1cccc2 Chemical compound OCCOBc(c1ccccc11)c(cccc2)c2c1-c(cc1)c(cccc2)c2c1-c1cccc2c1cccc2 HGPQZFZEFLKKAR-UHFFFAOYSA-N 0.000 description 1
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical compound C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 description 1
- KJTLSVCANCCWHF-UHFFFAOYSA-N Ruthenium Chemical compound [Ru] KJTLSVCANCCWHF-UHFFFAOYSA-N 0.000 description 1
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 description 1
- DPOPAJRDYZGTIR-UHFFFAOYSA-N Tetrazine Chemical compound C1=CN=NN=N1 DPOPAJRDYZGTIR-UHFFFAOYSA-N 0.000 description 1
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical class C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 description 1
- JPOZEGVRLWADCM-UHFFFAOYSA-O [OH2+]CCOBc(c1ccccc11)c(cccc2)c2c1-c1c(cccc2)c2ccn1 Chemical compound [OH2+]CCOBc(c1ccccc11)c(cccc2)c2c1-c1c(cccc2)c2ccn1 JPOZEGVRLWADCM-UHFFFAOYSA-O 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- 230000009102 absorption Effects 0.000 description 1
- 125000000641 acridinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3C=C12)* 0.000 description 1
- 125000002015 acyclic group Chemical group 0.000 description 1
- 125000003158 alcohol group Chemical group 0.000 description 1
- 150000007824 aliphatic compounds Chemical class 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- HFHDHCJBZVLPGP-RWMJIURBSA-N alpha-cyclodextrin Chemical compound OC[C@H]([C@H]([C@@H]([C@H]1O)O)O[C@H]2O[C@@H]([C@@H](O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O3)[C@H](O)[C@H]2O)CO)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@@H]3O[C@@H]1CO HFHDHCJBZVLPGP-RWMJIURBSA-N 0.000 description 1
- 229940043377 alpha-cyclodextrin Drugs 0.000 description 1
- UNKKIEMUNUHYPD-UHFFFAOYSA-K aluminum 2-carboxy-5-hydroxy-4-oxo-1H-quinolin-3-olate Chemical compound [Al+3].[O-]C(=O)C1=C(O)C(O)=C2C(O)=CC=CC2=N1.[O-]C(=O)C1=C(O)C(O)=C2C(O)=CC=CC2=N1.[O-]C(=O)C1=C(O)C(O)=C2C(O)=CC=CC2=N1 UNKKIEMUNUHYPD-UHFFFAOYSA-K 0.000 description 1
- VNJGVUDVNNPPAG-UHFFFAOYSA-K aluminum;quinolin-2-olate Chemical compound [Al+3].C1=CC=CC2=NC([O-])=CC=C21.C1=CC=CC2=NC([O-])=CC=C21.C1=CC=CC2=NC([O-])=CC=C21 VNJGVUDVNNPPAG-UHFFFAOYSA-K 0.000 description 1
- IUFDZNVMARBLOJ-UHFFFAOYSA-K aluminum;quinoline-2-carboxylate Chemical compound [Al+3].C1=CC=CC2=NC(C(=O)[O-])=CC=C21.C1=CC=CC2=NC(C(=O)[O-])=CC=C21.C1=CC=CC2=NC(C(=O)[O-])=CC=C21 IUFDZNVMARBLOJ-UHFFFAOYSA-K 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- LDPIQRWHBLWKPR-UHFFFAOYSA-N aminoboronic acid Chemical class NB(O)O LDPIQRWHBLWKPR-UHFFFAOYSA-N 0.000 description 1
- 125000005365 aminothiol group Chemical group 0.000 description 1
- 125000005577 anthracene group Chemical group 0.000 description 1
- PYKYMHQGRFAEBM-UHFFFAOYSA-N anthraquinone Natural products CCC(=O)c1c(O)c2C(=O)C3C(C=CC=C3O)C(=O)c2cc1CC(=O)OC PYKYMHQGRFAEBM-UHFFFAOYSA-N 0.000 description 1
- 150000004056 anthraquinones Chemical class 0.000 description 1
- 150000004984 aromatic diamines Chemical class 0.000 description 1
- 150000001543 aryl boronic acids Chemical class 0.000 description 1
- 150000001499 aryl bromides Chemical class 0.000 description 1
- 238000005801 aryl-aryl coupling reaction Methods 0.000 description 1
- RFRXIWQYSOIBDI-UHFFFAOYSA-N benzarone Chemical compound CCC=1OC2=CC=CC=C2C=1C(=O)C1=CC=C(O)C=C1 RFRXIWQYSOIBDI-UHFFFAOYSA-N 0.000 description 1
- UYQMSQMCIYSXOW-UHFFFAOYSA-N benzene-1,2,4,5-tetrol Chemical compound OC1=CC(O)=C(O)C=C1O UYQMSQMCIYSXOW-UHFFFAOYSA-N 0.000 description 1
- VWPUAXALDFFXJW-UHFFFAOYSA-N benzenehexol Chemical compound OC1=C(O)C(O)=C(O)C(O)=C1O VWPUAXALDFFXJW-UHFFFAOYSA-N 0.000 description 1
- HFACYLZERDEVSX-UHFFFAOYSA-N benzidine Chemical compound C1=CC(N)=CC=C1C1=CC=C(N)C=C1 HFACYLZERDEVSX-UHFFFAOYSA-N 0.000 description 1
- IOJUPLGTWVMSFF-UHFFFAOYSA-N benzothiazole Chemical class C1=CC=C2SC=NC2=C1 IOJUPLGTWVMSFF-UHFFFAOYSA-N 0.000 description 1
- QRUDEWIWKLJBPS-UHFFFAOYSA-N benzotriazole Chemical compound C1=CC=C2N[N][N]C2=C1 QRUDEWIWKLJBPS-UHFFFAOYSA-N 0.000 description 1
- 239000012964 benzotriazole Substances 0.000 description 1
- WHGYBXFWUBPSRW-FOUAGVGXSA-N beta-cyclodextrin Chemical compound OC[C@H]([C@H]([C@@H]([C@H]1O)O)O[C@H]2O[C@@H]([C@@H](O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O3)[C@H](O)[C@H]2O)CO)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@@H]3O[C@@H]1CO WHGYBXFWUBPSRW-FOUAGVGXSA-N 0.000 description 1
- 229960004853 betadex Drugs 0.000 description 1
- 125000002619 bicyclic group Chemical group 0.000 description 1
- AIEZFWSIZQLXEG-UHFFFAOYSA-N biphenyl-2,2',3,3'-tetraol Chemical group OC1=CC=CC(C=2C(=C(O)C=CC=2)O)=C1O AIEZFWSIZQLXEG-UHFFFAOYSA-N 0.000 description 1
- 125000006269 biphenyl-2-yl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C1=C(*)C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 125000006268 biphenyl-3-yl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C1=C([H])C(*)=C([H])C([H])=C1[H] 0.000 description 1
- 125000000319 biphenyl-4-yl group Chemical group [H]C1=C([H])C([H])=C([H])C([H])=C1C1=C([H])C([H])=C([*])C([H])=C1[H] 0.000 description 1
- 125000002529 biphenylenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3C12)* 0.000 description 1
- KKAXNAVSOBXHTE-UHFFFAOYSA-N boranamine Chemical class NB KKAXNAVSOBXHTE-UHFFFAOYSA-N 0.000 description 1
- UORVGPXVDQYIDP-BJUDXGSMSA-N borane Chemical group [10BH3] UORVGPXVDQYIDP-BJUDXGSMSA-N 0.000 description 1
- HVAFGESYLSBECZ-UHFFFAOYSA-N borotrithioic acid Chemical class SB(S)S HVAFGESYLSBECZ-UHFFFAOYSA-N 0.000 description 1
- 230000031709 bromination Effects 0.000 description 1
- 238000005893 bromination reaction Methods 0.000 description 1
- 244000309464 bull Species 0.000 description 1
- 125000004369 butenyl group Chemical group C(=CCC)* 0.000 description 1
- 125000000480 butynyl group Chemical group [*]C#CC([H])([H])C([H])([H])[H] 0.000 description 1
- VCPUQTJOEHSAAV-UHFFFAOYSA-N c(cc1)cc2c1OB(c(c1c3cccc1)ccc3-c(cc1)c(cccc3)c3c1-c1ccc(B3Oc(cccc4)c4O3)c3ccccc13)O2 Chemical compound c(cc1)cc2c1OB(c(c1c3cccc1)ccc3-c(cc1)c(cccc3)c3c1-c1ccc(B3Oc(cccc4)c4O3)c3ccccc13)O2 VCPUQTJOEHSAAV-UHFFFAOYSA-N 0.000 description 1
- BLRCLYGXPZEFLL-UHFFFAOYSA-N c(cc1)ccc1N(B1c(cc2)ccc2N(c2ccc(B(N(c3c4cccc3)c3ccccc3)N4c3ccccc3)cc2)c(cc2)ccc2S(N(c2c3cccc2)c2ccccc2)N3c2ccccc2)c(cccc2)c2N1c1ccccc1 Chemical compound c(cc1)ccc1N(B1c(cc2)ccc2N(c2ccc(B(N(c3c4cccc3)c3ccccc3)N4c3ccccc3)cc2)c(cc2)ccc2S(N(c2c3cccc2)c2ccccc2)N3c2ccccc2)c(cccc2)c2N1c1ccccc1 BLRCLYGXPZEFLL-UHFFFAOYSA-N 0.000 description 1
- WLYOGEXZSODOSD-UHFFFAOYSA-N c(cc1)ccc1N1c2ccccc2OB1c1c(B2Oc(cccc3)c3N2c2ccccc2)c(cc(cc2)-c3c(cccc4)c4ccc3)c2c(cc2)c1cc2-c1cccc2c1cccc2 Chemical compound c(cc1)ccc1N1c2ccccc2OB1c1c(B2Oc(cccc3)c3N2c2ccccc2)c(cc(cc2)-c3c(cccc4)c4ccc3)c2c(cc2)c1cc2-c1cccc2c1cccc2 WLYOGEXZSODOSD-UHFFFAOYSA-N 0.000 description 1
- UKHNTGQKXGWKTN-UHFFFAOYSA-N c1ccc2OB(c3c(B4Oc5ccccc5O4)c(cc(cc4)-c5c(cccc6)c6ccc5)c4c(cc4)c3cc4-c3cccc4c3cccc4)Oc2c1 Chemical compound c1ccc2OB(c3c(B4Oc5ccccc5O4)c(cc(cc4)-c5c(cccc6)c6ccc5)c4c(cc4)c3cc4-c3cccc4c3cccc4)Oc2c1 UKHNTGQKXGWKTN-UHFFFAOYSA-N 0.000 description 1
- UEJLDEAEKFGSHI-UHFFFAOYSA-N c1ccc2OB(c3c(cccc4)c4cc4ccccc34)Oc2c1 Chemical compound c1ccc2OB(c3c(cccc4)c4cc4ccccc34)Oc2c1 UEJLDEAEKFGSHI-UHFFFAOYSA-N 0.000 description 1
- IZHJWNYFWOBWHR-UHFFFAOYSA-N c1ccc2OB(c3cc(cc(cc4)-c5cccc6c5cccc6)c4c(cc4)c3cc4-c3c(cccc4)c4ccc3)Oc2c1 Chemical compound c1ccc2OB(c3cc(cc(cc4)-c5cccc6c5cccc6)c4c(cc4)c3cc4-c3c(cccc4)c4ccc3)Oc2c1 IZHJWNYFWOBWHR-UHFFFAOYSA-N 0.000 description 1
- DIIYYMDJKBPZGO-UHFFFAOYSA-N c1ccc2OB(c3cc(cccc4)c4c4c3cccc4)Oc2c1 Chemical compound c1ccc2OB(c3cc(cccc4)c4c4c3cccc4)Oc2c1 DIIYYMDJKBPZGO-UHFFFAOYSA-N 0.000 description 1
- 150000001716 carbazoles Chemical class 0.000 description 1
- 239000012159 carrier gas Substances 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- WCZVZNOTHYJIEI-UHFFFAOYSA-N cinnoline Chemical class N1=NC=CC2=CC=CC=C21 WCZVZNOTHYJIEI-UHFFFAOYSA-N 0.000 description 1
- CDAISMWEOUEBRE-JMVOWJSSSA-N cis-inositol Chemical compound O[C@@H]1[C@H](O)[C@H](O)[C@H](O)[C@H](O)[C@@H]1O CDAISMWEOUEBRE-JMVOWJSSSA-N 0.000 description 1
- 150000004696 coordination complex Chemical class 0.000 description 1
- 125000001162 cycloheptenyl group Chemical group C1(=CCCCCC1)* 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000522 cyclooctenyl group Chemical group C1(=CCCCCCC1)* 0.000 description 1
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 230000018044 dehydration Effects 0.000 description 1
- 238000006297 dehydration reaction Methods 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- 238000010511 deprotection reaction Methods 0.000 description 1
- 150000001987 diarylethers Chemical class 0.000 description 1
- IMDXZWRLUZPMDH-UHFFFAOYSA-N dichlorophenylphosphine Chemical compound ClP(Cl)C1=CC=CC=C1 IMDXZWRLUZPMDH-UHFFFAOYSA-N 0.000 description 1
- DOWCWUCBOQRQJE-UHFFFAOYSA-N ditert-butylphosphane;hydrochloride Chemical compound Cl.CC(C)(C)PC(C)(C)C DOWCWUCBOQRQJE-UHFFFAOYSA-N 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- RLODKUVHHRFYRQ-UHFFFAOYSA-N ethynylborane Chemical group BC#C RLODKUVHHRFYRQ-UHFFFAOYSA-N 0.000 description 1
- OGPBJKLSAFTDLK-UHFFFAOYSA-N europium atom Chemical compound [Eu] OGPBJKLSAFTDLK-UHFFFAOYSA-N 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 239000000706 filtrate Substances 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- JKFAIQOWCVVSKC-UHFFFAOYSA-N furazan Chemical compound C=1C=NON=1 JKFAIQOWCVVSKC-UHFFFAOYSA-N 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- GDSRMADSINPKSL-HSEONFRVSA-N gamma-cyclodextrin Chemical compound OC[C@H]([C@H]([C@@H]([C@H]1O)O)O[C@H]2O[C@@H]([C@@H](O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O3)[C@H](O)[C@H]2O)CO)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@@H]3O[C@@H]1CO GDSRMADSINPKSL-HSEONFRVSA-N 0.000 description 1
- 229940080345 gamma-cyclodextrin Drugs 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 1
- 229910052737 gold Inorganic materials 0.000 description 1
- 239000010931 gold Substances 0.000 description 1
- 150000004820 halides Chemical class 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- 150000002367 halogens Chemical group 0.000 description 1
- 125000006038 hexenyl group Chemical group 0.000 description 1
- 125000005980 hexynyl group Chemical group 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 150000002466 imines Chemical class 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- HOBCFUWDNJPFHB-UHFFFAOYSA-N indolizine Chemical compound C1=CC=CN2C=CC=C21 HOBCFUWDNJPFHB-UHFFFAOYSA-N 0.000 description 1
- 238000007641 inkjet printing Methods 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 150000002503 iridium Chemical class 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- ZLTPDFXIESTBQG-UHFFFAOYSA-N isothiazole Chemical class C=1C=NSC=1 ZLTPDFXIESTBQG-UHFFFAOYSA-N 0.000 description 1
- 150000002545 isoxazoles Chemical class 0.000 description 1
- 125000000468 ketone group Chemical group 0.000 description 1
- 125000005647 linker group Chemical group 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- 229910052748 manganese Inorganic materials 0.000 description 1
- 239000011572 manganese Substances 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 239000008204 material by function Substances 0.000 description 1
- 229910052750 molybdenum Inorganic materials 0.000 description 1
- 239000011733 molybdenum Substances 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 150000002772 monosaccharides Chemical class 0.000 description 1
- 239000012452 mother liquor Substances 0.000 description 1
- FGGAOQTXQHKQOW-UHFFFAOYSA-N n,n-diphenylnaphthalen-1-amine Chemical compound C1=CC=CC=C1N(C=1C2=CC=CC=C2C=CC=1)C1=CC=CC=C1 FGGAOQTXQHKQOW-UHFFFAOYSA-N 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000003136 n-heptyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- OVALYCIUDYJCCC-UHFFFAOYSA-N naphthalene-1,4,5,8-tetrol Chemical compound C1=CC(O)=C2C(O)=CC=C(O)C2=C1O OVALYCIUDYJCCC-UHFFFAOYSA-N 0.000 description 1
- SLCVBVWXLSEKPL-UHFFFAOYSA-N neopentyl glycol Chemical compound OCC(C)(C)CO SLCVBVWXLSEKPL-UHFFFAOYSA-N 0.000 description 1
- 125000004365 octenyl group Chemical group C(=CCCCCCC)* 0.000 description 1
- 238000007645 offset printing Methods 0.000 description 1
- 229920001542 oligosaccharide Polymers 0.000 description 1
- 150000002482 oligosaccharides Chemical class 0.000 description 1
- 238000005580 one pot reaction Methods 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 229910052762 osmium Inorganic materials 0.000 description 1
- SYQBFIAQOQZEGI-UHFFFAOYSA-N osmium atom Chemical compound [Os] SYQBFIAQOQZEGI-UHFFFAOYSA-N 0.000 description 1
- WKGDNXBDNLZSKC-UHFFFAOYSA-N oxido(phenyl)phosphanium Chemical compound O=[PH2]c1ccccc1 WKGDNXBDNLZSKC-UHFFFAOYSA-N 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- WXZMFSXDPGVJKK-UHFFFAOYSA-N pentaerythritol Chemical compound OCC(CO)(CO)CO WXZMFSXDPGVJKK-UHFFFAOYSA-N 0.000 description 1
- 125000006340 pentafluoro ethyl group Chemical group FC(F)(F)C(F)(F)* 0.000 description 1
- 125000002255 pentenyl group Chemical group C(=CCCC)* 0.000 description 1
- 125000005981 pentynyl group Chemical group 0.000 description 1
- XYFCBTPGUUZFHI-UHFFFAOYSA-N phosphine group Chemical group P XYFCBTPGUUZFHI-UHFFFAOYSA-N 0.000 description 1
- 150000003003 phosphines Chemical class 0.000 description 1
- 238000005424 photoluminescence Methods 0.000 description 1
- 238000000103 photoluminescence spectrum Methods 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 229960005235 piperonyl butoxide Drugs 0.000 description 1
- 238000006116 polymerization reaction Methods 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 235000003270 potassium fluoride Nutrition 0.000 description 1
- 239000011698 potassium fluoride Substances 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 125000004368 propenyl group Chemical group C(=CC)* 0.000 description 1
- 125000002568 propynyl group Chemical group [*]C#CC([H])([H])[H] 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 125000005581 pyrene group Chemical group 0.000 description 1
- 150000004892 pyridazines Chemical class 0.000 description 1
- 150000003230 pyrimidines Chemical class 0.000 description 1
- 125000001567 quinoxalinyl group Chemical group N1=C(C=NC2=CC=CC=C12)* 0.000 description 1
- 230000009103 reabsorption Effects 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 229910052702 rhenium Inorganic materials 0.000 description 1
- WUAPFZMCVAUBPE-UHFFFAOYSA-N rhenium atom Chemical compound [Re] WUAPFZMCVAUBPE-UHFFFAOYSA-N 0.000 description 1
- 229910052703 rhodium Inorganic materials 0.000 description 1
- 239000010948 rhodium Substances 0.000 description 1
- MHOVAHRLVXNVSD-UHFFFAOYSA-N rhodium atom Chemical compound [Rh] MHOVAHRLVXNVSD-UHFFFAOYSA-N 0.000 description 1
- 125000006413 ring segment Chemical group 0.000 description 1
- 229910052707 ruthenium Inorganic materials 0.000 description 1
- 238000007650 screen-printing Methods 0.000 description 1
- CDAISMWEOUEBRE-UHFFFAOYSA-N scyllo-inosotol Natural products OC1C(O)C(O)C(O)C(O)C1O CDAISMWEOUEBRE-UHFFFAOYSA-N 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 229910052709 silver Inorganic materials 0.000 description 1
- 239000004332 silver Substances 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 238000004528 spin coating Methods 0.000 description 1
- 239000012258 stirred mixture Substances 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 150000003463 sulfur Chemical class 0.000 description 1
- 150000003464 sulfur compounds Chemical class 0.000 description 1
- 238000001308 synthesis method Methods 0.000 description 1
- 125000006836 terphenylene group Chemical group 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 150000003518 tetracenes Chemical class 0.000 description 1
- 150000003536 tetrazoles Chemical class 0.000 description 1
- 238000001931 thermography Methods 0.000 description 1
- 125000004149 thio group Chemical group *S* 0.000 description 1
- 150000003568 thioethers Chemical class 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 238000010023 transfer printing Methods 0.000 description 1
- 238000007832 transition metal-catalyzed coupling reaction Methods 0.000 description 1
- VPYJNCGUESNPMV-UHFFFAOYSA-N triallylamine Chemical group C=CCN(CC=C)CC=C VPYJNCGUESNPMV-UHFFFAOYSA-N 0.000 description 1
- 150000003852 triazoles Chemical class 0.000 description 1
- 229910000404 tripotassium phosphate Inorganic materials 0.000 description 1
- 235000019798 tripotassium phosphate Nutrition 0.000 description 1
- RMNIZOOYFMNEJJ-UHFFFAOYSA-K tripotassium;phosphate;hydrate Chemical compound O.[K+].[K+].[K+].[O-]P([O-])([O-])=O RMNIZOOYFMNEJJ-UHFFFAOYSA-K 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- WFKWXMTUELFFGS-UHFFFAOYSA-N tungsten Chemical compound [W] WFKWXMTUELFFGS-UHFFFAOYSA-N 0.000 description 1
- 229910052721 tungsten Inorganic materials 0.000 description 1
- 239000010937 tungsten Substances 0.000 description 1
- 238000001771 vacuum deposition Methods 0.000 description 1
- 238000002061 vacuum sublimation Methods 0.000 description 1
- 238000007740 vapor deposition Methods 0.000 description 1
- 238000001947 vapour-phase growth Methods 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
Images
Classifications
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/30—Coordination compounds
- H10K85/321—Metal complexes comprising a group IIIA element, e.g. Tris (8-hydroxyquinoline) gallium [Gaq3]
- H10K85/322—Metal complexes comprising a group IIIA element, e.g. Tris (8-hydroxyquinoline) gallium [Gaq3] comprising boron
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F15/00—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic System
- C07F15/0006—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic System compounds of the platinum group
- C07F15/0033—Iridium compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F15/00—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic System
- C07F15/0006—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic System compounds of the platinum group
- C07F15/0086—Platinum compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F5/00—Compounds containing elements of Groups 3 or 13 of the Periodic System
- C07F5/02—Boron compounds
- C07F5/025—Boronic and borinic acid compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F5/00—Compounds containing elements of Groups 3 or 13 of the Periodic System
- C07F5/02—Boron compounds
- C07F5/04—Esters of boric acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F5/00—Compounds containing elements of Groups 3 or 13 of the Periodic System
- C07F5/02—Boron compounds
- C07F5/05—Cyclic compounds having at least one ring containing boron but no carbon in the ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic System
- C07F9/02—Phosphorus compounds
- C07F9/28—Phosphorus compounds with one or more P—C bonds
- C07F9/46—Phosphinous acids R2=P—OH; Thiophosphinous acids; Aminophosphines R2-P-NH2 including R2P(=O)H; derivatives thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic System
- C07F9/02—Phosphorus compounds
- C07F9/28—Phosphorus compounds with one or more P—C bonds
- C07F9/50—Organo-phosphines
- C07F9/53—Organo-phosphine oxides; Organo-phosphine thioxides
- C07F9/5325—Aromatic phosphine oxides or thioxides (P-C aromatic linkage)
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G79/00—Macromolecular compounds obtained by reactions forming a linkage containing atoms other than silicon, sulfur, nitrogen, oxygen, and carbon with or without the latter elements in the main chain of the macromolecule
- C08G79/08—Macromolecular compounds obtained by reactions forming a linkage containing atoms other than silicon, sulfur, nitrogen, oxygen, and carbon with or without the latter elements in the main chain of the macromolecule a linkage containing boron
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B1/00—Dyes with anthracene nucleus not condensed with any other ring
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B1/00—Dyes with anthracene nucleus not condensed with any other ring
- C09B1/02—Hydroxy-anthraquinones; Ethers or esters thereof
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B23/00—Methine or polymethine dyes, e.g. cyanine dyes
- C09B23/14—Styryl dyes
- C09B23/141—Bis styryl dyes containing two radicals C6H5-CH=CH-
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B23/00—Methine or polymethine dyes, e.g. cyanine dyes
- C09B23/14—Styryl dyes
- C09B23/148—Stilbene dyes containing the moiety -C6H5-CH=CH-C6H5
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B3/00—Dyes with an anthracene nucleus condensed with one or more carbocyclic rings
- C09B3/02—Benzathrones
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B3/00—Dyes with an anthracene nucleus condensed with one or more carbocyclic rings
- C09B3/78—Other dyes in which the anthracene nucleus is condensed with one or more carbocyclic rings
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B57/00—Other synthetic dyes of known constitution
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B57/00—Other synthetic dyes of known constitution
- C09B57/001—Pyrene dyes
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B57/00—Other synthetic dyes of known constitution
- C09B57/008—Triarylamine dyes containing no other chromophores
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B57/00—Other synthetic dyes of known constitution
- C09B57/10—Metal complexes of organic compounds not being dyes in uncomplexed form
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/02—Use of particular materials as binders, particle coatings or suspension media therefor
- C09K11/025—Use of particular materials as binders, particle coatings or suspension media therefor non-luminescent particle coatings or suspension media
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- H—ELECTRICITY
- H05—ELECTRIC TECHNIQUES NOT OTHERWISE PROVIDED FOR
- H05B—ELECTRIC HEATING; ELECTRIC LIGHT SOURCES NOT OTHERWISE PROVIDED FOR; CIRCUIT ARRANGEMENTS FOR ELECTRIC LIGHT SOURCES, IN GENERAL
- H05B33/00—Electroluminescent light sources
- H05B33/12—Light sources with substantially two-dimensional radiating surfaces
- H05B33/14—Light sources with substantially two-dimensional radiating surfaces characterised by the chemical or physical composition or the arrangement of the electroluminescent material, or by the simultaneous addition of the electroluminescent material in or onto the light source
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/10—Organic polymers or oligomers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/10—Organic polymers or oligomers
- H10K85/111—Organic polymers or oligomers comprising aromatic, heteroaromatic, or aryl chains, e.g. polyaniline, polyphenylene or polyphenylene vinylene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/30—Coordination compounds
- H10K85/341—Transition metal complexes, e.g. Ru(II)polypyridine complexes
- H10K85/342—Transition metal complexes, e.g. Ru(II)polypyridine complexes comprising iridium
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/30—Coordination compounds
- H10K85/361—Polynuclear complexes, i.e. complexes comprising two or more metal centers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/658—Organoboranes
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1007—Non-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1011—Condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1014—Carbocyclic compounds bridged by heteroatoms, e.g. N, P, Si or B
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1022—Heterocyclic compounds bridged by heteroatoms, e.g. N, P, Si or B
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1029—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1029—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom
- C09K2211/104—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom with other heteroatoms
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1044—Heterocyclic compounds characterised by ligands containing two nitrogen atoms as heteroatoms
- C09K2211/1055—Heterocyclic compounds characterised by ligands containing two nitrogen atoms as heteroatoms with other heteroatoms
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1059—Heterocyclic compounds characterised by ligands containing three nitrogen atoms as heteroatoms
- C09K2211/1062—Heterocyclic compounds characterised by ligands containing three nitrogen atoms as heteroatoms with oxygen
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1059—Heterocyclic compounds characterised by ligands containing three nitrogen atoms as heteroatoms
- C09K2211/107—Heterocyclic compounds characterised by ligands containing three nitrogen atoms as heteroatoms with other heteroatoms
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1096—Heterocyclic compounds characterised by ligands containing other heteroatoms
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/18—Metal complexes
- C09K2211/185—Metal complexes of the platinum group, i.e. Os, Ir, Pt, Ru, Rh or Pd
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2101/00—Properties of the organic materials covered by group H10K85/00
- H10K2101/10—Triplet emission
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/14—Carrier transporting layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/14—Carrier transporting layers
- H10K50/16—Electron transporting layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E10/00—Energy generation through renewable energy sources
- Y02E10/50—Photovoltaic [PV] energy
- Y02E10/549—Organic PV cells
Abstract
본 발명은 유기 전자 장치, 특히 전계발광 장치에서 방향족 붕산 또는 보린산 유도체의 적용에 관한 것이다.
Description
광의의 전자 산업에 속할 수 있는 각종 유형의 다수 적용에서, 기능성 물질로서의 유기 반도체 용도가 머지않아 현실화되거나 가까운 미래에 현실화될 것으로 기대된다. 유기 전계발광 장치의 일반적인 구조가, 예를 들면, US 4539507, US 5151629, EP 0676461 및 WO 98/27136 에 기재되어 있다. 그러나, 이러한 장치는 다음과 같은 긴급한 개선을 요하는 상당한 문제점을 여전히 나타낸다:
1. 특히 청색 발광의 경우에 작동수명이 여전히 짧고, 이는 지금까지 간단한 상업적 적용만을 달성할 수 있었음을 의미한다.
2. 일부 경우에, 물리적 특성 (유리 전이 온도, 유리 형성성, 흡광도, 광발광 (photoluminescence))이 상이할 수 있는 이성질체 화합물의 혼합물이 사용된다. 이러한 입체이성질체는 또한 일부의 경우에 처리 온도에서 상이한 증기압을 나타내기 때문에, 균일하고 재연가능한 유기 전자 장치의 제조가 불가능하다. 이러한 문제는 미공개 출원 EP 04026402.0 에 상세히 기재되어 있다.
3. 사용된 화합물은 일부의 경우에 통상의 유기 용매에 단지 소량만 용해되고, 이는 합성 중 이들의 정제를 더욱 어렵게 하고, 유기 전자 장치를 제조하는 경 우 플랜트의 세척을 더욱 어렵게 한다.
4. 사용된 화합물 중 다수, 특히 형광 또는 인광 장치에서 호스트 물질로서 사용되는 것은 다단계의 합성을 통해서만 수득가능하고, 상기 화합물의 정제가 종종 복잡하며, 이는 이들 화합물의 사용에 있어서 상당한 단점을 나타낸다.
5. 사용된 물질 다수가 적절한 열 안정성을 가지지 않거나 또는 증발 온도가 매우 높은데, 이는 예를 들면 셰도우 마스크 (shadow mask)와 같은 민간한 장치 부품에 대한 높은 열 부하와 연관된다. 이는 특히 스틸벤아민 화합물 및 오르소-금속화 이리듐 착물에 적용된다.
가장 최근의 선행 기술은 형광 OLED, 특히 청색 발광 전계발광 장치에서 호스트 물질로서 각종 융합 방향족 화합물, 특히 안트라센 또는 피렌 유도체, 예를 들면 9,10-비스(2-나프틸)안트라센 (US 5935721)을 사용하는 것에 관한 것일 수 있다. WO 03/095445 및 CN 1362464 에는 OLED 에 사용되는 9,10-비스(1-나프틸)안트라센 유도체가 기재되어 있다. 호스트 물질로서 적합한 추가적인 안트라센 유도체가 WO 01/076323, WO 01/021729, WO 04/013073, WO 04/018588, WO 03/087023 또는 WO 04/018587 에 기재되어 있다. 아릴-치환된 피렌 및 크리센 기재 호스트 물질이 WO 04/016575 에 기재되어 있고, 이는 또한 이론적으로는 상응하는 안트라센 및 페난트렌 유도체를 포함한다. 이러한 화합물을 사용하여 양호한 결과를 이미 달성했음에도 불구하고, 고품질의 적용을 위해서는, 이용가능한 개선된 호스트 물질이 필요하다. 또한, 상기 화합물 중 일부는 다단계 합성에서 복잡한 방식으로만이 수득 가능하다.
인광 OLED 에서, 매트릭스 물질로 종종 4,4'-비스(N-카르바졸릴)비페닐 (CBP)이 사용된다. 이의 단점은, 특히, 이를 통해 제조된 장치의 짧은 수명 및, 낮은 전력 효율을 초래하는, 종종 높은 작동 전압이다. 더욱이, 에너지 측면에서 CBP 는 청색 발광 전계발광 장치에 적합하지 않고, 이는 불량한 효율을 초래한다는 것이 발견되었다. 또한, CBP 를 매트릭스 물질로 사용하는 경우, 장치의 구조가 복잡해지는데, 이는 정공-차단층 및 전자-수송층이 추가적으로 사용되어야 하기 때문이다. 스피로비플루오렌의 케토 화합물 기재인, 향상된 삼중항 매트릭스 물질이 WO 04/093207 에 기재되어 있다. 그러나, 여기에 기재된 가장 양호한 매트릭스 물질의 합성에 독성 무기 시아나이드가 요구되고, 이는 상기 물질의 제조가 생태학적으로 허용되지 않음을 의미한다.
유기 전계발광 장치에 사용되는 전자-수송 화합물은 통상적으로 AlQ3 (알루미늄 트리스히드록시퀴놀리네이트)이다 (US 4539507). 이는 하기의 다수의 단점을 갖는다: 이는 증착될 때 잔류물이 발생할 수 있는데, 승화 온도에서 부분적으로 분해되기 때문이고, 이는 특히 제조 플랜트에서 중요한 문제점을 나타낸다. 실제적인 중요한 단점은 AlQ3 의 높은 단파장화이다. 따라서, OLED 에 사용하기 위해서는, AlQ3 는 복잡한 다단계 승화 과정에서 복잡한 방식으로 정제되어야 하고, 후속적으로 물이 배제된 보호-기체 분위기 하에서 보관 및 취급되어야 한다. 또한, AlQ3 는 낮은 전자 이동성을 가져, 높은 전압이 요구되고, 따라서 전력 효율이 낮다. 디스플레이에서 단락을 피하기 위해, 층의 두께를 늘이는 것이 바람 직한데, 이는 AlQ3 의 낮은 전하-수반 이동성 및 이로 인한 전압 증가 때문에 AlQ3 로는 불가능하다. 또한, 특히 재흡수 및 약한 재-발광 때문에 청색 OLED 의 경우에서 색상 이동을 초래할 수 있는, AlQ3 의 고유색 (고체로서 황색)이 매우 불리한 것으로 드러났다. 여기서, 청색 OLED 는 상당한 효율 손실과 색상 위치 결손을 동반해야만 제조될 수 있다. AlQ3 의 추가 단점은 정공에 대한 불안정성이고 (Z. Popovic 등, Proceedings of SPIE 1999, 3797, 310-31 5), 이는 장기간 사용시 구성 요소에서 항상 문제를 야기할 수 있다. 이러한 단점에도 불구하고, 현재까지 AlQ3 는 여전히 OLED 에서의 전자-수송 물질의 각종 요건을 가장 양호하게 충족하는 것으로 제시되고 있다.
따라서, 유기 전자 장치에서 양호한 효율과 동시에 오랜 작동수명을 제공하고 상기 장치의 제조 및 작동 도중 재연가능한 결과를 제공하며 용이하게 합성될 수 있는 개선된 물질에 대한 요구가 계속해서 존재한다.
놀랍게도, 방향족 보론산 또는 보린산 유도체를 포함하는 유기 전계발광 장치가 선행 기술 보다 상당한 개선을 나타냄을 발견하였다. 이러한 물질은 선행 기술에 따른 물질에 비해 유기 전자 장치의 효율 및 작동수명을 증가시킬 수 있다. 이러한 물질은, 부분입체이성질체를 초래하는, 아릴-보론 결합 주위에서의 회전장애 이성질화를 나타낼 수 없기 때문에, 유기 전자 장치의 재연가능한 제조를 가능하게 한다. 더욱이, 이들 물질은, 선행 기술에 따른 물질에 비해, 유기 화학 의 표준 방법으로 용이하게 수득가능하고 또한 정제가 용이하다는 이점을 갖는다. 특히 놀라운 관찰은 이러한 물질이 비교적 높은 분자량에도 불구하고 비교적 낮은 증발 온도를 갖는다는 것이다. 따라서, 본 발명은 유기 전자 장치에서의 이러한 물질의 용도에 관한 것이다.
4치환된 붕소를 포함한 붕소-질소 화합물의 용도가 문헌에 기재되어 있다 (예를 들면 US 2005/0048311). 이러한 화합물은 붕소 상에 음전하를 그리고 질소 상에 양전하를 수반하여, 붕소 원자가 3치환만 된 붕소-질소 화합물과는 완전히 상이한 전자적 특성을 갖는다. 3치환된 붕소를 포함한 붕소-질소 화합물, 특히 붕소-탄소 결합을 또한 갖는 것의 용도는 상기 기재로부터 명확하지 않다.
더욱이, WO 02/052661 및 WO 02/051850 에는 방향족 보란, 즉, 3 개의 붕소-아릴 결합을 갖는 붕소 화합물의 OLED 에서의 용도가 기재되어 있다. JP 2003/031368 에는 2 개의 치환된 보란기가 방향족 기로 다리연결되고, 추가적인 방향족 또는 지방족 기가 붕소에 결합된 비스보란이 기재되어 있다. 이러한 물질은 전자-수송 또는 정공-차단 물질 및 호스트 물질로서 기재되어 있다. 그러나, 보란은 일반적으로 높은 화학 반응성이라는 문제를 갖는다. 특히, 이러한 화합물은 산화에 극히 민감하고, 이는 이들의 합성 및 취급을 상당히 어렵게 한다. 따라서, 비교적 입체적으로 장애받지 않은 보란은 공기 중에서 매우 짧은 기간에 분해되고 (A. Schulz, W. Kaim, Chem . Ber . 1989, 122, 1863-1 868), 메시틸-치환 보란과 같은 입체 장애 보란도 매우 민감하여, 이들은 보호 기체 하에서 취급되어야 한다. 이러한 민감성은 상기 화합물의 잠재적 용도를 상당히 제한한다.
아릴보론산 및 아릴보린산 유도체는 상기 보란의 전술한 단점을 갖지 않거나 상당히 감소된 정도로만 갖는다. 이러한 유형의 보론산 및 보린산 유도체는 스즈끼 (Suzuki) 커플링 반응의 중요한 중간체이고, 지금까지 유기 반도체 합성에서 출발 물질 또는 중간체로서 종종 사용되어 왔다. 그러나, OLED 에서의 활성 성분으로서의 이들의 용도는 알려지지 않았다.
본 발명은 유기 전자 장치에서의 방향족 보론산 또는 보린산 유도체의 용도에 관한 것이다.
여기서 용도는, 추가 화합물 합성을 위한 중간체로서가 아닌, 유기 전자 장치에서 활성 성분으로서 상응하는 화합물을 직접 사용하는 것을 의미한다.
또한, 본 발명은 하나 이상의 방향족 보론산 또는 보린산 유도체를 포함한 유기층을 하나 이상 포함한 유기 전자 장치에 관한 것이다.
방향족 보론산 또는 보린산 유도체라는 용어는 붕소 원자가 방향족 또는 헤테로방향족 단위에 직접 결합된 화합물을 의미한다. 붕소 원자는 바람직하게는, 존재할 수 있는 임의의 헤테로원자가 아닌, 방향족 또는 헤테로방향족 단위의 탄소 원자에 결합된다. 본 발명의 목적상, 방향족 보론산 또는 보린산 유도체라는 용어는, 보론산 또는 보린산 유도체가 단지 쇄 말단에 결합된 중합체 또는 올리고머를 의미하지는 않는다.
본 발명의 목적상, 보론산 또는 보린산 유도체에서의 붕소 원자는 3치환된다. 4 치환된 붕소를 함유한 화합물은 보론산 또는 보린산 유도체라는 명칭에 속하지 않는다. 보론산 또는 보린산 유도체는 바람직하게는 고리형 보론산 무수물, 고리형 보론산 이미드, 보론산 에스테르, 보론산 아미드, 보론산 아미도에스테르, 보론산 니트리드, 보린산 무수물, 보린산 이미드, 보린산 에스테르, 보린산 아미드 또는 보린산 니트리드이다. 상응하는 황 유사체 또한 바람직하다. 올리고머성 또는 중합체성 보론산 무수물, 보론산 이미드, 보론산 에스테르 또는 상응하는 황 화합물은 이들이 용액으로부터 적용되는 경우 또한 적합하나; 이들이 승화를 통해 적용되는 경우 덜 적합하다. 유기 전자 장치에서 유리 보론산 또는 보린산을 사용하는 것은 적합하지 않은데, 이들은 열 탈수되어 물의 생성과 함께 보론 또는 보린산 무수물을 형성하는 경향이 있기 때문이다. 따라서, 보론산 또는 보린산 유도체라는 용어에는 유리 보론산 또는 유리 보린산이 포함되지 않는다. 그러나, 유리 보론산 또는 보린산을 출발 물질로서 사용하여, 그로부터 상응하는 보론 또는 보린산 무수물을 증착 방법을 통해 증착시킬 수 있다. 또한, 상기 장치를 제조하는데 유리 보론산 또는 보린산을 사용하여, 상기 장치 내에서, 예를 들면, 상기 층의 또다른 화합물과 반응할 때까지 이를 상응하는 보론산 또는 보린산 유도체로 전환시키지 않을 수 있다. 일부 보론산 유도체의 일반적인 구조를 아래 개요도 1 에 제시하고, 여기서 Ar 은 일반적으로 방향족 고리계를 나타내고, R 은 유기 라디칼을 나타낸다.
개요도 1: 일부 보론산 및 보린산 유도체의 구조
상기 보론산 또는 보린산 유도체는 바람직하게는 유리 전이 온도가 70 ℃ 초과, 특히 바람직하게는 100 ℃ 초과, 매우 특히 바람직하게는 130 ℃ 초과인 유리형 필름을 형성한다.
또한, 보론산 또는 보린산 유도체은 바람직하게는 분자량이 250 g/몰 이상, 특히 바람직하게는 300 g/몰 이상, 매우 특히 바람직하게는 400 g/몰 이상이다. 더욱이, 보론산 또는 보린산 유도체의 분자량은, 증착 방법으로 적용되는 경우, 바람직하게는 5,000 g/몰 미만, 특히 바람직하게는 2,000 g/몰 미만, 매우 특히 바람직하게는 1,500 g/몰 미만이다. 이는 바람직하게는 한정된 화합물이다.
유기 전자 장치는 바람직하게는 유기 및 중합체성 발광 다이오드 (OLED, PLED), 유기 전계효과 트랜지스터 (O-FET), 유기 박막 트랜지스터 (O-TFT), 유기 발광 트랜지스터 (O-LET), 유기 집적 회로 (O-lC), 유기 태양전지 (O-SC), 유기 전계-켄치 (field-quench) 장치 (O-FQD), 발광 화학전지 (LEC), 유기 광-수용체 및 유기 레이저 다이오드 (O-레이저)로 이루어진 군으로부터 선택된다. 유기 및 중합체성 발광 다이오드가 특히 바람직하다.
유기 전자 장치는 통상적으로 애노드, 캐소드, 및 하나 이상의 방향족 보론산 또는 보린산 유도체를 포함하는 하나 이상의 유기층을 포함한다. 유기 전계발광 장치 내의 유기층 중 하나 이상은 발광층이다. 여기서, 발광은 형광 또는 인광일 수 있거나, 또는 복수의 상이한 발광체가 하나의 층에 또는 복수의 층에 존재할 수 있고, 여기서 발광체 중 일부는 형광을 나타내고 다른 발광체는 인광을 나타낸다. 유기 전자 장치가 애노드, 캐소드 및 발광층 이외에 추가로 층을 포함하는 것이 또한 바람직할 수 있다. 이러한 층은, 예를 들면, 정공-주입층, 정공-수송층, 정공-차단층, 전자-수송층 및/또는 전자-주입층일 수 있다. 그러나, 이 시점에서 이러한 층 각각이 반드시 존재해야되는 것은 아님을 지적해야 한다.
즉, 특히 발광층에서 보론산 또는 보린산 유도체의 사용시, 유기 전계발광 장치가 별도의 전자-수송층 및/또는 별도의 정공-차단층을 포함하지 않고 발광층이 전자-주입층 또는 캐소드에 직접 인접하는 경우, 매우 양호한 결과가 또한 달성된다. 유기 전계발광 장치가 별도의 정공-수송층을 포함하지 않고 발광층이 정공-주입층 또는 애노드에 직접 인접하는 것 또한 바람직할 수 있다.
본 발명의 바람직한 구현예에서, 보론산 또는 보린산 유도체는 발광층에 사용된다. 이는 순물질로서 사용될 수 있으나, 바람직하게는 형광 또는 인광 도판트와 조합된 호스트 물질로서 사용된다. 이론적으로, 문헌에 기재되고 아래에 상세히 언급되는 모든 형광 또는 인광 도판트가 이러한 목적에 적합하다.
형광 장치에서, 도판트는 바람직하게는 모노스티릴아민, 디스티릴아민, 트리스티릴아민, 테트라스티릴아민 및 아릴아민의 부류로부터 선택된다. 모노스티릴아민이란 용어는 스티릴기 및 하나 이상의 아민을 포함하고, 바람직하게는 방향족인 화합물을 의미한다. 디스티릴아민이란 용어는 2 개의 스티릴기 및 하나 이상의 아민을 포함하고, 바람직하게는 방향족인 화합물을 의미한다. 트리스티릴아민이란 용어는 3 개의 스티릴기 및 하나 이상의 아민을 포함하고, 바람직하게는 방향족인 화합물을 의미한다. 테트라스티릴아민이란 용어는 4 개의 스티릴기 및 하나 이상의 아민을 포함하고, 바람직하게는 방향족인 화합물을 의미한다. 본 발명의 목적상, 아릴아민 또는 방향족 아민이란 용어는 질소에 직접 결합된 3 개의 방향족 또는 헤테로방향족 고리계를 포함하는 화합물을 의미한다. 본 발명의 목적상, 스티릴기라는 용어는 아릴 또는 헤테로아릴기에 직접 결합되는 치환 또는 비치환 비닐기를 의미한다. 스티릴기는 특히 바람직하게는 스틸벤이고, 이는 이중 결합 상에서 또는 방향족 고리 상에서 추가로 치환될 수 있다. 여기서 적합한 치환기는, 특히, 아래에 언급되는 기 R1 이다. 상기 도판트의 예는 치환 또는 비치환 트리스틸벤아민, 또는 예를 들면 WO 06/000388 및 미공개 특허출원 EP 04028407.7 및 EP 05001891.0 에 기재된 도판트이다.
여기서, 발광층의 형광 혼합물 중 호스토로서의 보론산 또는 보린산 유도체의 비는 통상적으로 1 내지 99.9 중량%, 바람직하게는 50 내지 99.5 중량%, 특히 바람직하게는 80 내지 99 중량%, 특히는 90 내지 99 중량% 이다. 따라서, 형광 도판트의 비는 0.1 내지 99 중량%, 바람직하게는 0.5 내지 50 중량%, 특히 바람직하게는 1 내지 20 중량%, 특히는 1 내지 10 중량% 이다.
인광 장치에서 도판트는 바람직하게는, 원자 번호가 20 초과, 바람직하게는 38 초과 및 84 미만, 특히 바람직하게는 56 초과 및 80 미만인 원소를 하나 이상 포함하는 금속 착물 부류로부터 선택된다. 사용되는 인광 발광체는 바람직하게는 몰리브덴, 텅스텐, 레늄, 루테늄, 오스뮴, 로듐, 이리듐, 팔라듐, 백금, 은, 금 또는 유로퓸, 특히 이리듐 또는 백금을 포함하는 금속 착물이다.
상기 금속에 대한 리간드는 바람직하게는 두자리 방식으로 킬레이트되는 1음이온성 리간드이다. 특히, 금속-탄소 결합, 및 공여 원자, 특히 질소, 산소 또는 인으로부터 상기 금속으로의 배위 결합을 형성하는 리간드가 이러한 목적에 적합하다. 상기 금속 착물은 바람직하게는 하나 이상의 상기 리간드, 특히 바람직하게는 둘 이상의 상기 리간드를 포함한다. 금속-탄소 및 금속-질소 결합을 형성하는 것이 여기서 바람직하다. 여기서, 상기 2 개의 배위성 기는 고리형, 예를 들면 페닐피리딘, 페닐이소퀴놀린 또는 이들의 유도체일 수 있거나, 이들은 또한 비고리형, 예를 들면 피리딘 및 비닐 C 원자를 통해 결합하는 리간드일 수 있다. 추가 리간드, 예를 들면 β-디케토네이트 등이 또한 존재할 수 있다. 본 발명의 특히 바람직한 구현예에서, 착물은 두자리 방식으로 킬레이트화되고 금속-탄소 결합을 형성하는 리간드만을 포함한다.
바람직하게는, 혼합물은 형광 발광체로서 하기 화학식 (A) 내지 (D)의 화합물을 하나 이상 포함한다;
(식 중, 사용된 기호 및 지수는 하기와 같음:
DCy 는, 각각의 경우 동일하거나 상이하게, 하나 이상의 공여 원자 (이를 통해 고리형 기가 금속에 결합되고, 이는 하나 이상의 치환기 R1 을 가질 수 있음), 바람직하게는 질소 또는 인을 함유하는 고리형 기이고; 기 DCy 및 CCy 는 하나 이상의 공유 결합을 통해 서로 결합되고;
CCy 는, 각각의 경우 동일하거나 상이하게, 탄소 원자 (이를 통해 고리형 기가 금속에 결합되고, 이는 하나 이상의 치환기 R1 을 가질 수 있음)를 함유하는 고리형 기이고;
A 는, 각각의 경우 동일하거나 상이하게, 두자리 방식으로 킬레이트화되는 1음이온성 리간드, 바람직하게는 디케토네이트 리간드이고;
R1 은 아래에 언급되는 의미를 가짐).
고리형 기 CCy 및 DCy 는 단일고리형 또는 다중고리형일 수 있고, 바람직하게는 방향족 또는 헤테로방향족이다. 기 CCy 및 DCy 는 바람직하게는 단일고리형 또는 이중고리형이고, 여기서 각 고리는 5 또는 6 개의 고리 원자를 가지며, 예를 들면, 벤젠, 피리딘, 나프탈렌, 퀴놀린 또는 이소퀴놀린이다. 더욱이, 복수의 리간드가 다리 단위로서 하나 이상의 치환기 R1 을 통해 또한 연결되어 비교적 큰 다각형 리간드를 형성할 수 있고/있거나, 직접적인 공유 결합 이외에, 특히 1, 2 또는 3 개의 다리 원자를 갖는 다리가 CCy 와 DCy 사이에 존재할 수 있다.
추가 리간드 A 를 포함하지 않는 화학식 (B) 및 (D)의 구조가 특히 바람직하다.
인광 발광체의 예는 출원 WO 00/70655, WO 01/41512, WO 02/02714, WO 02/15645, EP 1191613, EP 1191612, EP 1191614, WO 04/081017, WO 05/033244, 및 미공개 출원 EP 04029182.5 및 EP 05002237.5 에 기재되어 있다.
인광 혼합물 중 호스트로서의 보론산 또는 보린산 유도체의 비는 통상적으로 1 내지 99.9 중량%, 바람직하게는 50 내지 99.5 중량%, 특히 바람직하게는 70 내지 99 중량%, 특히는 80 내지 95 중량% 이다. 따라서, 인광 도판트의 비는 0.1 내지 99 중량%, 바람직하게는 0.5 내지 50 중량%, 특히 바람직하게는 1 내지 30 중량%, 특히는 5 내지 20 중량% 이다.
더욱이, 복수의 발광 화합물이 동일층에 사용되거나, 또는 복수의 발광층이 존재하고, 여기서 상기 발광층 중 하나 이상이 하나 이상의 보론산 또는 보린산 유도체를 포함하는 것을 특징으로 하는 유기 전계발광 장치가 바람직하다. 이러한 장치는 특히 바람직하게는 380 nm 내지 750 nm 에서 복수의 발광 최대치를 가져, 전체적으로는 백색 발광을 일으킨다. 여기서 사용되는 발광 화합물은 형광을 나타내는 것과 인광을 나타내는 것 모두일 수 있다. 백색 발광의 생성에 대한 대안은 광대역 (broad-band) 발광체를 사용하는 것이다.
본 발명의 더욱 바람직한 구현예에서, 보론산 또는 보린산 유도체는 유기 전자 장치, 특히는 형광 또는 인광 전계발광 장치 내 전자-수송층에서 순물질 또는 혼합물로서, 바람직하게는 순물질로서 전자-수송 물질로 사용된다. 여기서, 보론산 또는 보린산 유도체는 또한, 예를 들면 알칼리 금속으로 도핑될 수 있다.
본 발명의 더욱 바람직한 구현예에서, 보론산 또는 보린산 유도체는, 특히, 인광 유기 전계발광 장치 내 정공-차단층에서 순물질 또는 혼합물로서, 바람직하게는 순물질로서 정공-차단 물질로 사용된다.
본 발명의 더욱 바람직한 구현예에서, 보론산 또는 보린산 유도체는 유기 전자 장치, 특히 형광 또는 인광 유기 전계발광 장치 내 정공-수송층 또는 정공-주입층에서 순물질 또는 혼합물로서, 바람직하게는 순물질로서 정공-전달 물질로서 사용된다. 이는, 특히 보론산 또는 보린산 유도체가 하나 이상의 트리아릴아민기를 포함하는 경우이다. 여기서, 보론산 또는 보린산 유도체는, 예를 들면, WO 03/070822 에 기재된 바와 같이 또한 도핑될 수 있다.
본 발명의 더욱 바람직한 구현예에서, 보론산 또는 보린산 유도체는 형광 유기 전계발광 장치 내 발광층에서, 바람직하게는 호스트 물질과 조합된, 형광 도판트로서 이용된다. 이는, 특히 보론산 또는 보린산 유도체가, 특히 하나 이상의 트리아릴아민기와 조합된, 하나 이상의 스틸벤기를 포함하는 경우이다. 여기서 적합한 호스트 물질은 또한 이미 전술한 바와 같은 보론산 또는 보린산 유도체이다. 바람직하게는 올리고아릴렌 (예를 들면, EP 676461 에 따른 2,2',7,7'-테트라페닐스피로비플루오렌, 또는 디나프틸안트라센), 특히 융합 방향족기를 포함한 올리고아릴렌, 올리고아릴렌비닐렌 (예를 들면 EP 676461 에 따른 DPVB1 또는 스피로-DPVB1), 다각형 금속 착물 (예를 들면 WO 04/081017 에 따른 것), 정공-전도성 화합물 (예를 들면 WO 04/058911 에 따른 것), 전자-전도성 화합물, 특히 케톤, 포스핀 옥시드, 설폭시드 등 (예를 들면 WO 05/084081 또는 WO 05/084082 에 따른 것) 또는 회전장애 이성질체 (예를 들면 미공개 출원 EP 04026402.0 에 따른 것)의 부류로부터 선택되는, 호스트 물질로서 통상적으로 사용되는 기타 화합물이 또한 적합하다. 특히 바람직한 호스트 물질은 나프탈렌, 안트라센 및/또는 피렌, 또는 상기 화합물의 회전장애 이성질체를 포함하는 올리고아릴렌, 올리고아릴렌비닐렌, 케톤, 포스핀 옥시드 및 설폭시드의 부류로부터 선택된다. 매우 특히 바람직한 호스트 물질은 안트라센 및/또는 피렌, 또는 이들 화합물의 회전장애 이성질체를 포함하는 올리고아릴렌, 포스핀 옥시드 및 설폭시드의 부류로부터 선택된다. 혼합물 중 도판트로서의 보론산 또는 보린산 유도체의 비율은 바람직하게는 형광 유기 전계발광 장치에서의 도판트에 관해 위에서 기술한 바와 같다.
본 발명의 더욱 바람직한 구현예에서, 보론산 또는 보린산 유도체는 인광 유기 전계발광 장치 내 발광층에서, 바람직하게는 호스트 물질과 조합된, 인광 도판트로서 이용된다. 여기서, 적합한 호스트 물질은 또한 이미 전술한 바와 같은 보론산 또는 보린산 유도체이다. 바람직하게는 카르바졸 유도체, 예를 들면 4,4'-비스(N-카르바졸릴)비페닐 (CBP), 케톤 및 이민 (예를 들면 WO 04/093207 에 따른 것), 포스핀 옥시드, 설폭시드 및 설폰 (예를 들면 WO 05/003253 에 따른 것), 포스핀 및 설파이드 (예를 들면 WO 05/053051 에 따른 것), 테트라아릴실란 (예를 들면 WO 04/095598 에 따른 것) 또는 올리고아릴렌 유도체의 부류로부터 선택되는, 호스트 물질로서 통상적으로 사용되는 기타 화합물이 또한 적합하다. 보론산 또는 보린산 유도체를 포함하는 본 발명에 따른 인광 도판트는 바람직하게는 인광 발광체에 관해 이미 전술한 바와 같은 원소 및 구조를 가지고, 여기서 하나 이상의 보론산 또는 보린산 유도체는 하나 이상의 리간드에 결합된다. 상기 리간드가 페닐피리딘, 페닐퀴놀린 또는 페닐이소퀴놀린의 유도체이고, 보론산 유도체가 보론산 에스테르인 경우, 이는 바람직하게는 고리형 구조를 갖는다. 보론산 유도체가 보론산 에스테르인 경우, 일반적으로 이는 바람직하게는 고리형 구조를 갖는다. 보론산 또는 보린산 유도체기를 갖는 더욱 바람직한 인광 도판트는 금속/카르벤 착물이다. OLED 에서의 용도가 알려진 간단한 금속/카르벤 착물은, 예를 들면, WO 05/019373 에 기재되어 있다.
보론산 또는 보린산 유도체를 다수의 층 및/또는 기능에 동시에 사용하는 것이 더욱 바람직할 수 있다. 예를 들면, 이를 하나 이상의 발광층 및 하나 이상의 전자-수송층 및/또는 정공-차단층 및/또는 정공-수송층 모두에 동시에 사용할 수 있다. 상이한 층에서의 보론산 또는 보린산 유도체는 동일하거나 상이할 수 있다.
승화법을 사용하여 하나 이상의 층을 코팅하는 것을 특징으로 하는 유기 전자 장치가 또한 바람직하다. 이 경우, 상기 물질은 10-5 mbar 미만, 바람직하게는 10-6 mbar 미만, 특히 바람직하게는 10-7 mbar 미만의 압력 하에 진공 승화 유닛에서 증착된다.
또한, OVPD (유기 증기상 침착) 방법에 의해 또는 운반-기체 승화를 통해 하나 이상의 층을 코팅하는 것을 특징으로 하는 유기 전자 장치가 또한 바람직하다. 여기서 상기 물질은 일반적으로 10-5 mbar 내지 1 bar 의 압력에서 도포된다.
또한, 예를 들면 스핀 코팅에 의한 것과 같이 용액으로부터, 또는 예를 들면 스크린 인쇄, 플렉소그래프 인쇄 (flexographic printing) 또는 오프셋 인쇄와 같은 임의의 목적된 인쇄 방법, 특히 바람직하게는 LITI (광 유발 열 이미징 (light induced thermal imaging), 열 전사 인쇄) 또는 잉크-젯 인쇄를 통해 하나 이상의 층을 생성하는 것을 특징으로 하는 유기 전자 장치가 바람직하다.
본 발명의 바람직한 구현예에서, 보론산 또는 보린산 유도체는 하나 이상의 하기 화학식 (1) 하부구조를 포함한다:
[화학식 (1)]
(식 중, 사용된 기호는 하기와 같음:
B1 은 각각의 경우에 3치환되는 붕소 원자를 나타내고;
Ar 은, 각각의 경우 동일하거나 또는 상이하게, 방향족 고리의 원자수가 5 내지 40 이고 하나 이상의 라디칼 R1 로 치환될 수 있는 방향족 또는 헤테로방향족 고리계이고;
E 는, 각각의 경우 동일하거나 또는 상이하게, 산소, 황 또는 질소 원자 원자이고, 여기에 산소 또는 황인 경우 수소가 아닌 추가 치환기가, 그리고 질소인 경우 2 개의 추가 치환기 (이중 하나 이상이 수소가 아님)가 결합되고;
R1 은, 각각의 경우 동일하거나 또는 상이하게, F, Cl, Br, I, CN, 탄소수 1 내지 40 인 직쇄 알킬, 알콕시 또는 티오알콕시쇄, 또는 탄소수 3 내지 40 인 분지형 또는 고리형 알킬, 알콕시 또는 티오알콕시쇄 (이들 각각은 R3 으로 치환될 수 있고, 하나 이상의 비인접 C 원자는 N-R3, O, S, CO, O-CO-O, CO-O, -CR3=CR3- 또는 -C≡C- 로 대체될 수 있고, 하나 이상의 H 원자는 F, Cl, Br, I 또는 CN 으로 대체될 수 있음), 또는 탄소수 5 내지 40 인 방향족 또는 헤테로방향족 고리계 (이는 또한 하나 이상의 라디칼 R3 로 치환될 수 있음), 또는 2, 3 또는 4 개의 상기 계의 조합이고; 여기서, 둘 이상의 라디칼 R1 은 함께 단일- 또는 다중고리형, 지방족 또는 방향족 고리계를 또한 형성할 수 있고;
R3 은, 각각의 경우 동일하거나 또는 상이하게, H, 또는 탄소수 1 내지 20 의 지방족 또는 방향족 탄화수소 라디칼임).
화학식 (1) 하부구조에는 정확히 하나의 보론산 또는 보린산 유도체가 방향족 고리계에 결합된 화합물 및 둘 이상의 상기 유도체가 방향족 고리계에 결합된 화합물 모두가 포함된다. 복수의 기 E, 예를 들면, 올리고알코올, 올리코티올 또는 올리고아민에 의해 복수의 하부구조 Ar-B' 이 다리연결되는 화합물이 또한 포함된다. 더욱이, 한정된 저분자량 화합물, 및 올리고머성, 덴드리머성 또는 중합체성 화합물이 또한 포함된다. 기 Ar 이 하나 이상의 금속 원자에 결합되는 금속 착물이 또한 포함된다.
바람직한 보론산 또는 보린산 유도체는, 이하에 더욱 상세히 설명되는 화학식 (2) 내지 (8)의 화합물 군으로부터 선택된다.
보론산 또는 보린산 유도체 바람직하게는 하기 화학식 (2), 화학식 (3) 또는 화학식 (4)의 구조를 갖는다:
(식 중, Ar, R1 및 R3 은 전술한 바와 동일한 의미를 가지고, 추가의 기호 및 지수는 하기와 같음:
B 는 각각의 경우에 붕소 원자를 나타내고;
X 는, 각각의 경우 동일하거나 또는 상이하게, 기 OR2, SR2, N(R2)2, NHR2 또는 OBAr2 이고;
Y 는, 각각의 경우 동일하거나 또는 상이하게, 기 Ar 또는 X 이고;
Z 는, 각각의 경우 동일하거나 또는 상이하게, O, S, NR2 또는 NH 이고;
L 은, 각각의 경우 동일하거나 또는 상이하게, 탄소수 4 내지 60 의 유기기이고, 여기에 4 개 이상의 기 Z 가, 이들이 붕소 원자와 함께 고리형 계를 형성할 수 있는 방식으로 결합되며;
R2 는, 각각의 경우 동일하거나 또는 상이하게, 탄소수 1 내지 40 인 직쇄 알킬쇄 또는 탄소수 3 내지 40 인 분지형 또는 고리형 알킬쇄 (이들 각각은 R3 으로 치환될 수 있고, 하나 이상의 비인접 C 원자는 N-R3, O, S, CO, O-CO-O, CO-O, -CR3=CR3- 또는 -C≡C- 로 대체될 수 있고, 단 헤테로원자는 기 X 또는 Y 의 산소 또는 황 또는 질소에 직접 결합되지 않으며, 하나 이상의 H 원자는 F, Cl, Br, I 또는 CN 으로 대체될 수 있음), 또는 탄소수 5 내지 40 인 방향족 또는 헤테로방향족 고리계 (이는 또한 하나 이상의 라디칼 R3 로 대체될 수 있음), 또는 2, 3 또는 4 개의 상기 계의 조합이고; 여기서 2 이상의 라디칼 R2 는 함께 단일- 또는 다중 고리형, 지방족 또는 방향족 고리계를 또한 형성할 수 있고;
n 은, 각각의 경우 동일하거나 또는 상이하게, 1, 2, 3, 4, 5 또는 6 이고;
m 은, 각각의 경우 동일하거나 또는 상이하게, 1, 2 또는 3 이고;
q 는, 각각의 경우 동일하거나 또는 상이하게, 2, 3, 4, 5 또는 6 임).
보론산 또는 보린산 유도체는 더욱 바람직하게는 하기 화학식 (5), 화학식 (6), 화학식 (7) 또는 화학식 (8)의 구조를 갖는다:
(식 중, B, X, Y, Ar, R1, R2 및 R3 은 전술한 바와 같은 의미를 가지고, 추가로:
DCy 는, 각각의 경우 동일하거나 상이하게, 하나 이상의 공여 원자 (이를 통해 고리형 기가 금속에 결합되고, 이는 하나 이상의 치환기 R1 을 가질 수 있음), 바람직하게는 질소 또는 인을 함유하는 고리형 기이고; 기 DCy 및 CCy 는 하나 이상의 공유 결합을 통해 서로 결합되고;
CCy 는, 각각의 경우 동일하거나 상이하게, 탄소 원자 (이를 통해 고리형 기가 금속에 결합되고, 이는 하나 이상의 치환기 R1 을 가질 수 있음)를 함유하는 고리형 기이고;
A 는, 각각의 경우 동일하거나 상이하게, 두자리 방식으로 킬레이트화되는 1음이온성 리간드, 바람직하게는 디케토네이트 리간드이고;
z 는, 각각의 경우 동일하거나 또는 상이하게, 0, 1, 2, 3, 4, 5 또는 6 이고, 단 각 착물에서 하나 이상의 z 는 0 이 아니며, 또한 z 는 상응하는 고리 DCy 또는 CCy 상의 치환가능한 수소 원자의 최대 수보다 큰 수를 취할 수 없음).
고리형 기 CCy 및 DCy 는 단일고리형 또는 다중고리형일 수 있고, 바람직하게는 방향족 또는 헤테로방향족이다. 더욱이, 복수의 리간드가 다리 단위로서 하나 이상의 치환기 R1 을 통해 또한 연결되어 비교적 큰 다각형 리간드를 형성할 수 있고/있거나, 직접적인 공유 결합 이외에, 특히 1, 2 또는 3 개의 다리 원자를 갖는 다리가 CCy 와 DCy 사이에 존재할 수 있다.
추가 리간드 A 를 포함하지 않는 화학식 (6) 및 (8)의 구조가 특히 바람직하다.
X = OR2 이고 Y = OR2 인 화학식 (2) 및 (5) 내지 (8)은 보론산 에스테르를 나타낸다. X = SR2 이고 Y = SR2 인 화학식 (2) 및 (5) 내지 (8)은 티오보론산 에스테르를 나타낸다. X = OR2 이고 Y = Ar 인 화학식 (2) 및 (5) 내지 (8)은 보린산 에스테르를 나타낸다. X = SR2 이고 Y = Ar 인 화학식 (2) 및 (5) 내지 (8)은 티오보린산 에스테르를 나타낸다. X = N(R2)2 또는 NHR2 이고 Y = N(R2)2 또는 NHR2 인 화학식 (2) 및 (5) 내지 (8)은 보론산 아미드를 나타낸다. X = N(R2)2 또는 NHR2 이고 Y = Ar 인 화학식 (2) 및 (5) 내지 (8)은 보린산 아미드를 나타낸다. X = OR2 이고 Y = N(R2)2 또는 NHR2 인 화학식 (2) 및 (5) 내지 (8)은 보론산 아미도에스테르를 나타낸다. X = SR2 이고 Y = N(R2)2 또는 NHR2 인 화학식 (2) 및 (5) 내지 (8)은 보론산 아미도티오에스테르를 나타낸다. X = OBAr2 이고 Y = Ar 인 화학식 (2) 및 (5) 내지 (8)은 보린산 무수물을 나타낸다. Z = 0 인 화학식 (3)은 고리형 보론산 무수물을 나타낸다. Z = NH 또는 NR2 인 화학식 (3)은 고리형 보론산 이미드를 나타낸다. Z = 0 인 화학식 (4)는 기 L 을 통해 다리연결되는 복수의 보론산 에스테르 단위를 포함하는 화합물을 나타낸다. Z = NH 또는 NR2 인 화학식 (4)는 기 L 을 통해 다리연결되는 복수의 보론산 아미드 단위를 포함하는 화합물을 나타낸다. Z = S 인 화학식 (4)는 기 L 을 통해 다리연결되는 복수의 티오보론산 에스테르 단위를 포함하는 화합물을 나타낸다. 혼합된 형태, 예를 들면, 일부의 기 Z = 0 이고 다른 기 Z = NH, NR2 또는 S 인 것이 또한 여기서 허용될 수 있다.
상기 기재로부터 명백하나, 복수의 라디칼 R1 이 함께 고리계를 형성할 수 있고/있거나 복수의 라디칼 R2 가 함께 고리계를 형성할 수 있음을 여기서 다시 한번 강조한다. 이와 관련하여, "방향족 고리계"라는 용어는 또한 헤테로방향족 고리계를 포함하는 것으로 의도된다. 복수의 라디칼 R2 가 함께 지방족 또는 방향족 고리계를 형성하는 것이 바람직하다.
본 발명의 목적상, 방향족 고리계는 고리계에 6 내지 60 개의 탄소 원자를 포함한다. 본 발명의 목적상, 헤테로방향족 고리계는 고리계에 2 내지 60 개의 탄소 원자 및 하나 이상의 헤테로원자를 포함하고, 단, 탄소 원자 및 헤테로원자의 총 수는 5 이상이다. 헤테로원자는 바람직하게는 N, O 및/또는 S 로부터 선택된다. 이러한 고리계는 R1 로 치환될 수 있다. 본 발명의 목적상, 방향족 또는 헤테로방향족 고리계는 반드시 아릴 또는 헤테로아릴기만을 포함하는 것이 아니라 복수의 아릴 또는 헤테로아릴기에, 예를 들면 sp3-혼성된 C, N 또는 O 원자와 같은 짧은 비-방향족 단위 (바람직하게는 10 % 미만의 H 이외의 원자, 특히 바람직하게는 5 % 미만의 수소 이외의 원자)가 또한 삽입될 수 있는 계를 의미한다. 또한, 복수의 아릴 또는 헤테로아릴기에는 비닐기 또는 아세틸렌기가 삽입될 수 있다. 복수의 아릴 또는 헤테로아릴기에는 또한 카르보닐기, 포스핀 옥시드기 등이 삽입될 수 있다. 즉, 예를 들면, 본 발명의 목적상 방향족 고리계는 9,9'-스피로비플루오렌, 9,9-디아릴플루오렌, 트리아릴아민, 디아릴 에테르, 스틸벤, 톨란 등과 같은 계를 의미한다. 여기서, 상기 방향족 또는 헤테로방향족 고리계, 또는 이들의 부분은 또한 하기 정의에서의 융합기일 수 있다.
본 발명의 목적상, 융합 아릴 또는 헤테로아릴기는 2 이상의 방향족 또는 헤테로방향족 고리가 서로 융합된, 즉, 하나 이상의 공통 모서리 및 공통 방향족 π-전자계를 갖는, 9 내지 40 개의 방향족 고리 원자를 갖는 고리계를 의미한다. 이러한 고리계는 비치환되거나 R1 로 치환될 수 있다. 융합 방향족 또는 헤테로방향족 고리계의 예는 나프탈렌, 퀴놀린, 이소퀴놀린, 퀴녹살린, 안트라센, 아크리딘, 페난트렌, 페난트롤린, 피렌, 나프타센, 페릴렌, 크리센 등이고, 예를 들면 비페닐은 융합 아릴기가 아닌데, 이는 그의 두 고리계 사이에 공통 모서리가 존재하지 않기 때문이다. 플루오렌 또는 스피로비플루오렌 또한 융합 방향족 고리계가 아닌데, 이는 그의 페닐 단위가 공통의 방향족 전자계를 형성하지 않기 때문이다.
본 발명의 목적상, 개별 H 원자 또는 CH2 기가 전술한 기로 또한 치환될 수 있는 C1- 내지 C40-알킬기는 특히 바람직하게는 라디칼 메틸, 에틸, n-프로필, i-프로필, n-부틸, i-부틸, s-부틸, t-부틸, 2-메틸-부틸, n-펜틸, s-펜틸, 시클로펜틸, n-헥실, 시클로헥실, n-헵틸, 시클로헵틸, n-옥틸, 시클로옥틸, 2-에틸헥실, 트리플루오로메틸, 펜타플루오로에틸, 2,2,2-트리플루오로에틸, 에테닐, 프로페닐, 부테닐, 펜테닐, 시클로펜테닐, 헥세닐, 시클로헥세닐, 헵테닐, 시클로헵테닐, 옥테닐, 시클로옥테닐, 에티닐, 프로피닐, 부티닐, 펜티닐, 헥시닐 또는 옥티닐을 의미한다. C1- 내지 C40-알콕시기는 특히 바람직하게는 메톡시, 에톡시, n-프로폭시, i-프로폭시, n-부톡시, i-부톡시, s-부톡시, t-부톡시 또는 2-메틸부톡시를 의미한다. 각각의 경우에 전술한 라디칼 R1 로 또한 치환될 수 있고 임의의 목적된 위치를 통해 방향족 또는 헤테로방향족 고리에 연결될 수 있는, 탄소 원자수가 6 내지 60 인 방향족 고리계 또는 탄소 원자수가 2 내지 60 인 헤테로방향족 고리계는 벤젠, 나프탈렌, 안트라센, 페난트렌, 피렌, 크리센, 페릴렌, 플루오란텐, 나프타센, 펜타센, 벤조피렌, 비페닐, 비페닐렌, 터페닐, 터페닐렌, 플루오렌, 스피로비플루오렌, 디페닐 에테르, 트리페닐아민, 디히드로페난트렌, 디히드로피렌, 테트라히드로피렌, 시스- 또는 트랜스-인데노플루오렌, 푸란, 벤조푸란, 이소벤조푸란, 디벤조푸란, 티오펜, 벤조티오펜, 이소벤조티오펜, 디벤조티오펜, 피롤, 인돌, 이소인돌, 카르바졸, 피리딘, 퀴놀린, 이소퀴놀린, 아크리딘, 페난트리딘, 벤조-5,6-퀴놀린, 벤조-6,7-퀴놀린, 벤조-7,8-퀴놀린, 페노티아진, 페녹사진, 피라졸, 인다졸, 이미다졸, 벤즈이미다졸, 나프티미다졸, 페난트리미다졸, 피리디미다졸, 피라진이미다졸, 퀴녹살린이미다졸, 옥사졸, 벤족사졸, 나프트옥사졸, 안트록사졸, 페난트록사졸, 이속사졸, 1,2-티아졸, 1,3-티아졸, 벤조티아졸, 피리다진, 벤조피리다진, 피리미딘, 벤조피리미딘, 퀴녹살린, 1,5-디아자안트라센, 2,7-디아자피렌, 2,3-디아자피렌, 1,6-디아자피렌, 1,8-디아자피렌, 4,5-디아자피렌, 4,5,9,10-테트라아자페릴렌, 피라진, 페나진, 페녹사진, 페노티아진, 플루오루빈, 나프티리딘 아자카르바졸, 벤조카르볼린, 페난트롤린, 1,2,3-트리아졸, 1,2,4-트리아졸, 벤조트리아졸, 1,2,3-옥사디아졸, 1,2,4-옥사디아졸, 1,2,5-옥사디아졸, 1,3,4-옥사디아졸, 1,2,3-티아디아졸, 1,2,4-티아디아졸, 1,2,5-티아디아졸, 1,3,4-티아디아졸, 1,3,5-트리아진, 1,2,4-트리아진, 1,2,3-트리아진, 테트라졸, 1,2,4,5-테트라진, 1,2,3,4-테트라진, 1,2,3,5-테트라진, 퓨린, 프테리딘, 인돌리진 또는 벤조티아디아졸에서 유래된 기를 의미한다.
본 발명의 바람직한 구현예에서, 기호 X 는 OR2 또는 OBAr2 를 나타낸다. 이와같은 화학식 (2) 및 (5) 내지 (8)의 화합물은 바람직하게는 보론산 에스테르 또는 보린산 에스테르 또는 보린산 무수물을 나타낸다. 본 발명의 특히 바람직한 구현예에서, 기호 X 는 OR2 를 나타낸다. 본 발명의 매우 특히 바람직한 구현예에서, 기호 X 는 OR2 를 나타내고, 동시에 기호 Y 는 OR2 를 나타낸다. 이와 같은 화학식 (2) 및 (5) 내지 (8)의 화합물은 매우 특히 바람직하게는 보론산 에스테르를 나타낸다. 여기서, 기 OR2 의 2 개의 라디칼 R2 가 함께 지방족 또는 방향족 고리계를 형성하는 것이 매우 특히 바람직하다. 이는 보론산 에스테르가 지방족 또는 방향족 디올에 의해 형성되는 것을 의미한다. 여기서 형성되는 고리형 계는 바람직하게는 5-원 고리 (1,3,2-디옥사보롤란) 또는 6-원 고리 (1,3,2-디옥사보리난)이고, 즉, 고리형 보론산 에스테르는 바람직하게는 1,2-디올 또는 1,3-디올에 의해 형성된다.
본 발명의 더욱 바람직한 구현예에서, 각각의 경우에 동일하거나 상이한 기호 X 및 Y 는 NHR2 또는 N(R2)2, 특히 바람직하게는 N(R2)2 를 나타낸다. 이와 같은 화학식 (2) 및 (5) 내지 (8)의 화합물은 바람직하게는 보론산 아미드를 나타낸다. 여기서, 상이한 N 원자 상의 기 N(R2)2 의 두 라디칼 R2 가 함께 지방족 또는 방향족 고리계를 형성하는 것이 매우 바람직하다. 이는 보론산 에스테르가 지방족 또는 방향족 디아민에 의해 형성된다는 것을 의미한다. 여기서 형성되는 고리형 계는 바람직하게는 5-원 고리 (1,3,2-디아자보롤란) 또는 6-원 고리 (1,3,2-디아자보리난)이고, 즉, 고리형 보론산 아미드는 바람직하게는 1,2-디아민 또는 1,3-디아민에 의해 형성된다.
본 발명의 더욱 바람직한 구현예에서, 화학식 (3)에서의 기호 Z 는 O 를 나타낸다. 이와 같은 화학식 (3)의 화합물은 바람직하게는 고리형 보론산 무수물을 나타낸다. 여기서 m 은 특히 바람직하게는 1 또는 2, 매우 특히 바람직하게는 2 이다.
본 발명의 더욱 바람직한 구현예에서, 화학식 (4)에서의 기호 Z 는, 각각의 경우에 동일하거나 상이하게는, O 또는 NR2 를 나타내고, 특히 바람직하게는 모든 Z 는 O 또는 NR2 를 나타낸다. 이와 같은 화학식 (4)의 화합물은 특히 바람직하게는 복수의 보론산 에스테르가 기 L 을 통해 연결되는 올리고보론산 에스테르, 또는 복수의 보론산 아미드가 기 L 을 통해 연결되는 올리고보론산 아미드를 나타낸다. 여기서 q 는 특히 바람직하게는 2, 3 또는 4 이고, 매우 특히 바람직하게는 q = 2 또는 3 이다. 연결기 L 로서 적합한 것은 직쇄, 분지형 또는 고리형 지방족 화합물과 방향족 화합물 모두이다. 이론적으로, 모든 지방족 올리고알코올 및 올리고아민이 상기 합성에 적합하다. 용이하게 합성되거나 또는 천연 생성되는 것이 바람직하다. 바람직한 지방족 알코올은 펜타에리트리톨이다. 더욱 바람직한 지방족 화합물은 당 알코올이고, 이는 상응하는 유리 보론산과 반응하여 올리고보론산 에스테르를 생성한다. 이는 직쇄 (예를 들면 만니톨) 또는 고리형 (예를 들면 시스-, 에피-, 알로-, 마이오-, 네오-, 무코-, 카이로- 또는 스실로-이노시톨)일 수 있다. 이론적으로는, 모든 천연 발생 당 알코올이 바람직하다. 단당류, 올리고당류, 다당류, 예를 들면 α-, β- 또는 γ-시클로덱스트린과 같은 고리형 당이 또한 바람직하다. 방향족 화합물의 경우, 4 개 이상의 히드록실기 및/또는 아미노기로 치환되는 모든 방향족 고리가 이론적으로 적합하다. 여기서, 히드록실기는 서로 연결된 하나 이상의 아릴기에 결합될 수 있다. 여기서 바람직한 단위는 1,2,3,4-테트라히드록시벤젠, 1,2,4,5-테트라히드록시벤젠, 1,2,3,4,5,6-헥사히드록시벤젠, 4,5,9,10-테트라히드록시테트라히드로피렌, 1,4,5,8-테트라히드록시나프탈렌, 2,2',3,3'-테트라히드록시-1,1'-비페닐, 3,3',4,4'-테트라히드록시-1,1'-비페닐, 2,3,6,7-테트라히드록시스피로비플루오렌 등이다.
바람직한 라디칼 R1 은, 존재하는 경우, 각각의 경우에 동일하거나 또는 상이하게, F, 탄소수 1 내지 10 인 직쇄 알킬 또는 알콕시쇄 또는 탄소수 3 내지 10 인 분지형 알킬 또는 알콕시쇄 (이들 각각은 R3 으로 치환될 수 있고, 하나 이상의 비인접 C 원자는 N-R3, O, S, -CR3=CR3- 또는 -C≡C- 로 대체될 수 있고, 하나 이상의 H 원자는 F 또는 CN 으로 대체될 수 있음), 또는 방향족 고리 원자 수가 5 내지 16 인 방향족 또는 헤테로방향족 고리계 (이는 또한 하나 이상의 라디칼 R3 로 치환될 수 있음), 또는 2 또는 3 개의 상기 계의 조합이고; 여기서 2 이상의 라디칼 R1 은 또한 함께 단일- 또는 다중고리형, 지방족 또는 방향족 고리계를 형성할 수 있다. 특히 바람직한 라디칼 R1 은, 존재하는 경우, 각각의 경우에 동일하거나 또는 상이하게, F, 탄소수 1 내지 5 인 직쇄 알킬쇄 또는 탄소수 3 내지 5 인 분지형 알킬쇄 (여기서 하나 이상의 비인접 C 원자는 또한 -CR3=CR3- 또는 -C≡C- 로 대체될 수 있고, 하나 이상의 H 원자는 F 로 대체될 수 있음), 또는 방향족 고리 원자수가 5 내지 10 개인 아릴 또는 헤테로아릴기 (이는 또한 하나 이상의 라디칼 R3, 로 치환될 수 있음), 또는 2 개의 상기 계의 조합이고; 여기서 2 이상의 라디칼 R1 은 또한 함께 단일- 또는 다중고리형, 지방족 또는 방향족 고리계를 형성할 수 있다.
바람직한 라디칼 R2 는, 각각의 경우에 동일하거나 또는 상이하게, 탄소수 1 내지 10 인 직쇄 알킬쇄 또는 탄소수 3 내지 10 인 분지형 또는 고리형 알킬쇄 (이들 각각은 R3 으로 치환될 수 있고, 하나 이상의 비인접 C 원자는 N-R3, O, S, -CR3=CR3- 또는 -C≡C- 로 대체될 수 있고, 단 헤테로원자는 기 X 또는 Y 의 산소 또는 황 또는 질소에 직접 결합되지 않고, 하나 이상의 H 원자는 F 로 대체될 수 있음), 또는 방향족 고리 원자수가 5 내지 16 인 방향족 또는 헤테로방향족 고리계 (이는 또한 하나 이상의 라디칼 R3 로 치환될 수 있음), 또는 2 또는 3 개의 상기 계의 조합이고; 여기서, 둘 이상의 라디칼 R2 는 또한 함께 단일- 또는 다중고리형, 지방족 또는 방향족 고리계를 형성할 수 있다. 본 발명의 특히 바람직한 구현예에서, 두 라디칼 R2 가 B, X 및 Y 와 함께 고리계를 형성하고, 여기서 5-, 6- 또는 7-원 고리, 특히 5- 또는 6-원 고리의 형성이 특히 바람직하다. 고리계의 형성에서 매우 특히 바람직한 기 R2 는 1,2-에틸렌, 1,3-프로필렌, 1,2-페닐렌 및 1,8-나프틸렌이고, 이들 각각은 또한 하나 이상의 라디칼 R3 으로 치환될 수 있다. 라디칼 R2 가 R1 과 고리계를 형성하는 것 또한 바람직하다.
화학식 (2) 내지 (4)에서의 바람직한 기 Ar 은 유기 전자 장치에서 보론산 또는 보린산 유도체의 각각의 의도된 용도에 따른다. 특히, 이는 화합물이 형광 또는 인광 발광체용 호스트로서 사용되는지에 따라 다르다. 바람직한 호스트 물질은 동일하게 전자-수송 물질로서 적합하다. 보론산 또는 보린산 유도체를 정공-전달 화합물 또는 형광 또는 인광 도판트로서 사용하고자 하는 경우, 상이한 Ar 기가 또한 바람직하다.
형광 발광체용 호스트 물질로서, 그리고 전자-수송 물질로서의 용도와 관련하여, 바람직한 구현예에서의 방향족 고리계 Ar 은 하나 이상의 융합 아릴 또는 헤테로아릴기를 포함한다. 붕소 원자는 바람직하게는 상기 융합 아릴 또는 헤테로아릴기에 직접 결합된다. 여기서, 추가적인 방향족 라디칼이 상기 융합 아릴 또는 헤테로아릴기에 결합되는 것이 바람직할 수 있다. 또한, 하나 초과의 붕소 원자가 상기 융합 아릴 또는 헤테로아릴기에 결합되거나, 각각에 하나 이상의 하나 이상의 보론산 또는 보린산 유도체가 결합된 복수의 융합 아릴 또는 헤테로아릴기가 서로 결합되는 것이 바람직할 수 있다. 특히, 청색-발광 장치에 관해서는, 호스트 물질이 이중 결합을 포함하지 않는, 즉 스틸벤 구조 등이 아닌 것이 더욱 바람직하다.
상기 융합 아릴 또는 헤테로아릴기는 특히 바람직하게는 2, 3, 4 또는 5 개의 방향족 또는 헤테로방향족 단위를 포함하고, 이들은 각각의 경우에 하나 이상의 공통 모서리를 통해 서로 융합하여 공통의 방향족 계를 형성하고, 비치환되거나 R1 로 치환될 수 있다. R1 에 의한 치환이 전자성을 조정하거나 용해성이 보다 양호한 화합물을 수득하기 위해 적절할 수 있다. 융합 아릴 또는 헤테로아릴기는 매우 특히 바람직하게는 3 또는 4 개의 방향족 또는 헤테로방향족 단위를 포함하고, 이들은 각각의 경우에 하나 이상의 공통 모서리를 통해 서로 융합하여 공통의 방향족 계를 형성하고, 비치환되거나 R1 로 치환될 수 있다. 서로 융합된 방향족 및 헤테로방향족 단위는 매우 특히 바람직하게는 벤젠, 피리딘, 피리미딘, 피라진 및 피리다진 (이들 각각은 비치환되거나 R1 로 치환될 수 있음), 특히 벤젠 및 피리딘 (이들 각각은 비치환되거나 R1 로 치환될 수 있음)으로부터 선택된다.
상기 융합 아릴 또는 헤테로아릴기는 특히 바람직하게는 안트라센, 아크리딘, 페난트렌, 페난트롤린, 피렌, 나프타센, 크리센, 펜타센 및 페릴렌 (이들 각각은 임의로 R1 로 치환될 수 있음)으로 이루어진 군으로부터 선택된다. 상기 융합 방향족 고리계는 특히 바람직하게는 안트라센, 페난트렌, 피렌 및 나프타센, 특히 안트라센, 페난트렌 및 피렌 (이들 각각은 임의로 R1 로 치환될 수 있음)으로 이루어진 군으로부터 선택된다. R2 는 매우 특히 바람직하게는, 1,2-페닐렌, 1,8-나프틸렌, 1,2-에틸렌 및 1,3-프로필렌으로부터 선택되는, X 와 Y 사이의 다리연결 기이다. 동일 화합물에서 상이한 보론산 유도체 상의 복수의 R2 는 더욱 바람직하게는 고리계를 또한 형성하여, 예를 들면 안사 (ansa) 화합물을 생성할 수 있다.
명확하게 하기 위해, 안트라센, 페난트렌, 피렌 및 페릴렌의 번호 매김을 하기에 제시한다:
바람직하게는, 여기서 보론산 또는 보린산 유도체는, 상기 기가 오직 1 개만 존재하는 경우, 2- 또는 9-위치를 통해, 특히는 9-위치를 통해 안트라센에 연결된다. 이때, 10-위치는 특히 바람직하게는 방향족 치환기로 추가 치환된다. 보론산 또는 보린산 유도체는, 상기 기가 2 개 존재하는 경우, 바람직하게는 2,9-위치, 2,10-위치, 9,10-위치 또는 2,6-위치를 통해, 특히 바람직하게는 9,10-위치를 통해 안트라센에 연결된다.
보론산 또는 보린산 유도체는 바람직하게는, 상기 기가 1 개만 존재하는 경우, 1- 또는 2-위치를 통해 피렌에 연결된다. 보론산 또는 보린산 유도체는 바람직하게는, 상기 기가 2 개 존재하는 경우, 1,6-, 1,8-, 1,3- 또는 2,7-위치를 통해, 특히 바람직하게는 1 ,6- 또는 2,7-위치를 통해 피렌에 연결된다. 보론산 또는 보린산 유도체는, 상기 기가 4 개 존재하는 경우, 바람직하게는 1,3,6,8-위치를 통해 피렌에 연결된다.
보론산 또는 보린산 유도체는 바람직하게는, 상기 기가 1 개만 존재하는 경우, 2-, 3- 또는 9-위치를 통해 페난트렌에 연결된다. 보론산 또는 보린산 유도체는, 상기 기가 2 개 존재하는 경우, 바람직하게는 2,7-, 3,6-, 2,9-, 2,10- 또는 9,10-위치를 통해, 특히 바람직하게는 2,7- 또는 3,6-위치를 통해 페난트렌에 연결된다.
보론산 또는 보린산 유도체는, 상기 기가 1 개만 존재하는 경우, 바람직하게는 3-위치를 통해 페릴렌에 연결된다. 보론산 또는 보린산 유도체는, 상기 기가 2 개 존재하는 경우, 바람직하게는 3,4-, 3,9- 또는 3,10-위치를 통해, 특히 바람직하게는 3,9- 또는 3,10-위치를 통해 페릴렌에 연결된다. 보론산 또는 보린산 유도체는, 상기 기가 4 개 존재하는 경우, 바람직하게는 3,4,9,10-위치를 통해 페릴렌에 연결된다.
인광 발광체용 호스트 물질로서의, 그리고 전자전달 물질로서의 용도와 관련하여, 바람직한 구현예에서의 방향족 고리계 Ar 은 방향족 고리 원자수가 5 내지 14 개인 아릴 또는 헤테로아릴기만을 포함하고, 방향족 고리 원자가 14 개를 초과하는 것은 포함하지 않는다. 이는 복수의 상기 기가 방향족 고리계 Ar 에 존재할 수 있다는 것을 배제하는 것이 아니고, 방향족 고리 원자 수가 14 개를 초과하는 융합 아릴 또는 헤테로아릴기를 배제한다. 여기서, 하나 초과의 붕소 원자가 상기 방향족 또는 헤테로방향족 고리계에 결합되는 것이 바람직할 수 있다. 호스트 물질이 이중 결합을 포함하지 않는 것, 즉 스틸벤 구조 등이 아닌 것이 또한 바람직하다. 특히 바람직한 구현예에서, 방향족 고리계 Ar 은, 10 개 이하의 방향족 고리 원자를 포함하고, 특히 벤젠, 나프탈렌, 피리딘, 피리미딘, 피라진, 피리다진, 퀴놀린, 이소퀴놀린, 퀴녹살린, 트리아진, 티오펜, 벤조티오펜, 피롤, 인돌, 푸란, 피라졸, 이미다졸, 트리아졸 및 옥사디아졸 (이들은 R1 로 치환될 수 있음)로부터 선택되는 아릴 또는 헤테로아릴기만을 포함한다. 특히, 인광 발광체용 호스트 물질, 및 전자-수송 물질로서의 용도와 관련하여, 복수의 아릴기에 비콘쥬게이션된 단위, 특히 바람직하게는 카르보닐기, 방향족 포스핀기, 방향족 포스핀 옥시드기, 티오기, 설폭시드, 설폰 또는 C(R1)2 기, 특히 카르보닐기 또는 방향족 포스핀 옥시드기가 삽입된 것이 또한 바람직하다.
특히 바람직한 Ar 기는 벤젠, 2-비페닐, 3-비페닐, 4-비페닐, 플루오렌, 디히드로페난트렌, 스피로비플루오렌, 터페닐, 나프틸 또는 비나프틸을 포함한다. 이들은 각각 비치환 또는 R1 으로 치환될 수 있고, 하나 이상의 결합된 보론산 또는 보린산 유도체를 가질 수 있다.
형광 또는 인광 유기 전계발광 장치용 또는 기타 유기 전자 장치용 정공-전달 물질로서의 용도와 관련하여, Ar 기가 하나 이상의 트리알릴아민 단위 및/또는 하나 이상의 티오펜 유도체를 포함하는 것이 바람직하다. 상기 기는 특히 바람직하게는 하나 이상의 트리아릴아민 단위를 포함한다. 이는 정확히 하나 또는 복수의 질소 원자를 갖는 구조, 예를 들면 트리페닐아민, 나프틸디페닐아민, TAD, NPB, NaphDATA 등일 수 있다.
유기 전계발광 장치용 형광 도판트로서의 용도와 관련하여, Ar 기가 하나 이상의 스틸벤 단위 및/또는 하나 이상의 톨란 단위, 특히 바람직하게는 하나 이상의 스틸벤 단위를 포함하는 것이 바람직하다. 스틸벤 단위 이외에, Ar 기는 매우 특히 바람직하게는 하나 이상의 트리아릴아민 단위를 포함한다.
형광 또는 인광 장치용 호스트 물질, 전자-수송 물질, 정공-전달 물질 또는 발광체로서 적합한 보론산 또는 보린산 유도체의 예는 아래에 제시된 (1) 내지 (198)의 구조이다. 제시된 화합물 중 형광 장치에 특히 적합한 것 그리고 인광 장치에 특히 적합한 것, 또는 기타 용도에 특히 적합한 것은 이미 위에 기재되어 있다.
방향족 보론산 또는 보린산 유도체 및 이의 합성은, 특히, 스즈끼 커플링 반응의 중간체로서 알려져 있다. 이는 유기 화학의 표준 방법으로 용이하게 합성될 수 있고, 상기 합성은 일반적으로 방향족 할라이드로부터 수행되는데, 이는 유기리튬 화합물 또는 그리나드 (Grignard) 화합물로 전환되며, 이어서 트리알킬 보레이트, 통상적으로는 트리메틸 보레이트와 반응시킨다. 단일 용기 방법 (one-pot process)으로 또한 제조할 수 있고, 여기서 방향족 할라이드는 알킬 보레이트의 존재 하에 반응성 금속 (Li, Mg 등) 또는 유기리튬 화합물과 반응한다 [K.-T. Wong 등, J. Org. Chem. 2002, 67, 1041-1 044]. 가수분해를 통해 수득된 보론산을 탈수화시켜 보론산 무수물로, 물을 분리하면서 알코올과 반응시켜 상응하는 보론산 에스테르로, 또는 아민과 반응시켜 상응하는 보론산 아미드로 전환시킬 수 있다. 디올과의 반응을 통해 고리형 보론산 에스테르가 생성되고, 디아민과의 반응을 통해 고리형 보론산 아미드가 생성됨 (C. Kaupp 등, Chem. Eur. J. 2003, 9,4156-4160). 따라서, 티올과의 반응을 통해 티오보론산 에스테르가 생성되고, 디티올과의 반응을 통해 고리형 티오보론산 에스테르가 생성된다. 여기서, 알코올, 티올 및 아민은 방향족 또는 지방족일 수 있다. 방향족 또는 지방족 아미노 알코올과의 반응이 또한 가능하고, 아미노티올과의 반응과 유사하게, 고리형 보론산 아미도에스테르가 생성된다. 또한, 팔라듐 촉매와 함께, 붕소-붕소 결합을 함유하는 화합물 (예를 들면 비스피나콜라토디보란)과 방향족 할라이드를 반응시켜 방향족 보론산 유도체를 수득할 수 있다 (JP 2004/189705; T. Ishiyama 등, Special Publication - Royal Society of Chemistiy 1997, 201 (Advances in Boron Chemistry), 92-95). 또다른 가능한 합성은 클로로카테콜보란 유도체와 리튬화 방향족 화합물의 반응이고, 이는 보론산 에스테르를 직접 생성한다 (M. Yamashita 등, Angew . Chem . Int . Ed . 2000, 39, 4055-4058). 보릴아세틸렌의 시클로올리고머화가 또한 문헌에 기재되어 있다 (A. Goswami 등, Eur . J. lnorg . Chem. 2004, 2635-2645). 보린산 유도체는, 아릴 화합물과 붕소 화합물간의 화학정량비가 상응하게 선택된다는 것을 제외하고는, 보론산 유도체와 유사하게 합성될 수 있다. 상기 화합물을 상기 합성에서 이미 높은 순도로 형성되고, 유기 화학의 표준 방법, 특히 재결정을 통해 추가로 정제될 수 있다. 이들의 높은 열적 안정성 때문에, 이는 또한 승화를 통해 문제없이 정제될 수 있다. 이것은 OLED 에서의 사용에 매우 중요한데, 승화된 화합물이 일반적으로 상기 목적에 사용되고 상기 화합물은 종종 증착을 통해 적용되기 때문이다.
출발 화합물로서 사용되는 방향족 할라이드는 시판되는 할라이드, 예를 들면 아릴 브로마이드 또는 아릴 디브로마이드일 수 있다. 또한, 예를 들면 복수의 아릴기를 포함하는 보다 복잡한 방향족 계를 먼저 구축할 수 있다. 이를 위한 표준 반응은 팔라듐 촉매와의 스즈끼 아릴-아릴 커플링, 팔라듐 촉매와의 호트위그-부쉬발트 (Hartwig-Buchwald) 아릴-N 커플링, 또는 기타 전이 금속-촉매된 커플링 반응이다. 다음 단계에서, 예를 들면, 브롬 또는 NBS 를 사용한 브롬화를 통해, 상기 방향족 고리 중 하나를 할로겐화시킬 수 있다.
본 발명은 또한 유기 전자 장치, 특히 유기 전계발광 장치에서 방향족 보론산 또는 보린산 유도체를 포함한 올리고머, 중합체 또는 덴드리머의 용도에 관한 것이고, 여기서, 올리고머 또는 중합체 내 보론산 또는 보린산 유도체는 올리고머 또는 중합체의 쇄 말단에 결합하지 않거나 단지 말단기인 것은 아니다.
본 발명은 또한, 하나 이상의 보론산 또는 보린산 유도체를 포함하는 하나 이상의 올리고머, 중합체 또는 덴드리머를 포함한, 유기 전자 장치, 특히는 유기 전계발광 장치에 관한 것이고, 여기서 올리고머 또는 중합체 내 보론산 또는 보린산 유도체는 주쇄 및/또는 측쇄 내의 하나 이상의 지점에 결합되고, 올리고머 또는 중합체의 쇄 말단에 결합하지 않거나 단지 말단기인 것은 아니다.
상기 중합체는 콘쥬게이션되거나, 부분 콘쥬게이션되거나 비콘쥬게이션된 중합체이다. 보론산 또는 보린산 유도체는 상기 중합체의 주쇄 및/또는 측쇄 내로 결합될 수 있다. 유기 전자 장치에 사용되는 중합체는 통상적으로, 방향족 반복 단위를 포함한, 콘쥬게이션된 또는 부분 콘쥬게이션된 중합체이다. 일반적으로, 이러한 중합체는 방향족 할라이드와 방향족 보론산 또는 방향족 보린산 유도체의 팔라듐-촉매된 커플링 반응, 특히 스즈끼 커플링에 의해 합성된다. 반응이 완전하게 일어나지 않거나 또는 말단 캡핑을 실행하지 않은 경우, 보론산 또는 보론산 유도체가 말단 기로서 상기 중합체 내에 다시 잔류하고 유기 전자 장치에 또한 존재하게 된다. 본 발명의 목적상, 중합체성 및 올리고머성 보론산 또는 보린산 유도체에는 중합체 또는 올리고머의 쇄 말단에 단지 말단기로서 결합된 보론산 또는 보린산 유도체를 포함하는 중합체는 포함되지 않는데, 이러한 기는 불완전 반응으로부터의 불순물로서 거기에 존재할 뿐이기 때문이다. 본 발명의 목적상 본 발명에 따른 중합체는, 중합체의 쇄 말단에 결합되거나 또는 단지 말단기인 보론산 또는 보린산 유도체를 포함하지 않고, 대신 말단기가 아닌 중합체 내 하나 이상의 추가 지점에 결합되는 보론산 또는 보린산 유도체를 포함하는 것이다. 이는 올리고머에도 동일하게 적용된다. 여기서 중합체 내 붕소의 최소 함량은 바람직하게는 5 ppm 이상, 특히 바람직하게는 10 ppm 이상, 매우 특히 바람직하게는 100 ppm 이상이다.
본 발명의 바람직한 구현예는 중합체의 측쇄에 결합된 보론산 또는 보린산 유도체를 포함하는 콘쥬게이션된 또는 부분 콘쥬게이션된 중합체에 관한 것이다.
본 발명의 더욱 바람직한 구현예는 중합체의 측쇄에 결합된 보론산 또는 보린산 유도체를 포함하는 비콘쥬게이션된 중합체에 관한 것이다. 특히 바람직한 구현예에서, 비콘쥬게이션된 중합체 골격은 올리고머성 또는 중합체성 당의 유도체, 예를 들면 아밀로오스 또는 아밀로펙틴이다.
본 발명의 더욱 바람직한 구현예는 중합체의 주쇄에 보론산 또는 보린산 유도체를 포함하는 부분 콘쥬게이션된 또는 비콘쥬게이션된 중합체에 관한 것이다.
콘쥬게이션된, 부분 콘쥬게이션된 또는 비콘쥬게이션된 중합체 또는 올리고머의 바람직한 반복 단위는 플루오렌 (예를 들면 EP 842208 또는 WO 00/22026 에 따른 것), 스피로비플루오렌 (예를 들면 EP 707020, EP 894107 또는 EP 04028865.6 에 따른 것), 페닐렌 (예를 들면 WO 92/18552 에 따른 것), 카르바졸 (예를 들면 WO 04/070772 및 WO 04/113468 에 따른 것), 티오펜 (예를 들면 EP 1028136 에 따른 것), 디히드로페난트렌 (예를 들면 WO 05/014689 에 따른 것), 인데노플루오렌 (예를 들면 WO 04/041901 및 WO 04/113412 에 따른 것), 페난트렌 (예를 들면 WO 05/104264 에 따른 것), 방향족 케톤 (예를 들면 WO 05/040302 에 따른 것), 또는 다수의 상기 단위로부터 선택된다. 인광 금속 착물이 또한 상기 중합체의 반복 단위를 나타낼 수 있다 (예를 들면 WO 02/068435 또는 WO 06/003000 에 따른 것).
중합체가 방향족 보론산 또는 보린산 유도체를 포함하는 것이 의도되는 경우그리고 상기 단위가 단량체 내에 이미 존재하고 있는 경우, 통상적으로 사용되는 스즈끼 커플링 또는 종종 사용되는 야마모토 (Yamamoto) 커플링 (두 방향족 할라이드의 커플링)은 합성법으로서 적합하지 않은데, 상기 기가 통상적인 중축합 조건 하에서 반응하기 때문이다. 따라서, 상기 중합체의 합성은 콘쥬게이션된 또는 부분 콘쥬게이션된 중합체에 일반적으로 자주 사용되는 표준 조건 하에서 실행될 수 없다. 비콘쥬게이션된 중합체의 합성에 관하여, 표준 합성, 예를 들면 측쇄에 보론산 또는 보린산 유도체를 포함하는 비닐계 이중 결합의 중합을 사용할 수 있다. 추가의 가능한 합성은, 측쇄에 보호되지 않은 또는 바람직하게는 보호된 알코올, 티올 또는 아미노기를 포함하는, 콘쥬게이션된 또는 부분 콘쥬게이션된 중합체의 표준 방법에 의한 합성이다. 이는 바람직하게는 보호된 알코올기, 특히 바람직하게는 보호된 디올을 포함한다. 탈보호시킨 후, 이를 중합체-유사 반응에서 보론산과 반응시켜 상응하는 보론산 유도체를 생성할 수 있다. 비콘쥬게이션된 또는 부분 콘쥬게이션된 중합체를 제조하는 또다른 추가의 합성법은, 하기 반응식 1a 에 제시되는 바와 같은, 중축합 반응에서 지방족 또는 방향족 비스(디올), 비스(디티올) 또는 비스(디아민)과 방향족 비스보론산의 반응, 또는 하기 반응식 1b 에 제시되는 바와 같은, 2 개의 히드록실, 티올 또는 아미노기와 보론산기 모두를 포함한 방향족 화합물의 반응이다:
반응식 1a
반응식 1b
(식 중, B, Ar, L 및 Z 는 전술한 바와 같은 의미를 가지고, o 는, 각각의 경우 동일하거나 또는 상이하게, 3 내지 10,000, 바람직하게는 10 내지 1,000 의 정수를 취할 수 있음).
해당 반응은 올리고보론산 및/또는 올리고알코올 또는 올리고아민을 사용할 수 있고, 덴드리머 또는 분지형 중합체 구조를 생성한다.
반응식 1 에 따른 방법은 신규한 것이어서, 또한 본 발명의 주제이다.
화학식 (9) 내지 (33)의 화합물이 본 발명에 따른 용도를 실행하는데 유용한 중합체임이 발견되었다. 이러한 보론산 및 보린산 유도체는 신규한 것이어서, 또한 본 발명의 주제이다.
본 발명의 하기 화학식 (9) 및 (9a) 의 화합물에 관한 것이고:
(식 중, 안트라센 또는 아크리딘 골격은 또한 치환기 R1 로 치환될 수 있고, B, X, Y 및 R1 은 전술한 바와 같은 의미를 가지고, 또한:
G 는, 각각의 경우 동일하거나 또는 상이하게, C-H, C-R1, C-BXY 또는 N 이고;
v 는 각각의 경우에 0 또는 1 임);
단, 하기 화합물은 제외된다:
화학식 (9)의 바람직한 구현예에서, G 는 C-BXY 또는 C-R1 를 나타낸다. G 는 특히 바람직하게는 C-R1 을 나타내고, 여기서 R1 은 방향족 또는 헤테로방향족 고리계를 나타낸다. 안트라센 골격은 또한 바람직하게는 9- 및 10-위치를 제외하고는 치환되지 않는다.
화학식 (9a)의 바람직한 구현예에서, G 는 C-R1 을 나타낸다. 여기서 R1 은 특히 바람직하게는 방향족 또는 헤테로방향족 고리계를 나타낸다.
본 발명은 하기 화학식 (10) 및 (11)의 화합물에 관한 것이고:
(식 중, 피렌 골격은 또한 R1 로 치환될 수 있고, B, X, Y 및 R1 은 전술한 바와 동일한 의미를 가지고, 또한 J 는, 각각의 경우 동일하거나 또는 상이하게, C-H, C-R1 또는 C-BXY 임);
단, 하기 화합물은 제외된다:
또한, 본 발명은 하기 화학식 화학식 (12) 내지 (17)의 화합물에 관한 것이고;
(식 중, 페난트렌 또는 페난트롤린 골격은 또한 치환기 R1 로 치환될 수 있고, B, X, Y, J 및 R1 은 전술한 바와 동일한 의미를 가짐);
단, 하기 화합물은 제외된다:
본 발명은 또한 하기 화학식 (18) 의 화합물에 관한 것이다:
[화학식 (18)]
(식 중, 페릴렌 골격은 또한 치환기 R1 로 치환될 수 있고, B, X, Y, J 및 R1 은 전술한 바와 동일한 의미를 가짐).
본 발명은 또한 하기 화학식 (19) 내지 (23)의 화합물에 관한 것이다:
(식 중, 나프탈렌, 퀴놀린, 이소퀴놀린 또는 퀴녹살린 골격은 또한 치환기 R1 로 치환될 수 있고, B, X, Y, J 및 R1 은 전술한 바와 동일한 의미를 가지며, Ar1 은, 방향족 고리 원자수가 5 내지 40 이고 치환기 R1 로 또한 치환될 수 있는 아릴 또는 헤테로아릴기를 나타냄).
본 발명은 또한 하기 화학식 (24) 및 (25)의 화합물에 관한 것이다:
(식 중, 플루오렌 또는 스피로비플루오렌 계는 또한 치환기 R1 로 치환될 수 있고, B, X, Y, J 및 R1 은 전술한 바와 동일한 의미를 가지나, 단 X = OR2 및 Y = OR2 에 관해, 상기 두 라디칼 R2 는 함께 방향족 고리계를 형성함).
화학식 (24)의 화합물은 바람직하게는 2 개의 치환기 R1 에 의해 9,9-위치에서 치환되고, 다르게는 치환되지 않는다. 화학식 (25)의 화합물은 바람직하게는 치환되지 않거나 또는 위치 2, 7, 2' 및 7' 중 하나 이상에서 치환기를 가질 뿐이다.
본 발명은 또한 하기 화학식 (26)의 화합물에 관한 것이다:
[화학식 (26)]
(식 중, B, X, Y, Ar1 및 R1 은 전술한 바와 동일한 의미를 가짐).
본 발명은 하기 화학식 (27) 및 (27a)의 화합물에 관한 것이다:
[화학식 (27)]
[화학식 (27a)]
(식 중, B, X, Y, Ar 및 R1 은 전술한 바와 동일한 의미를 가지고, 또한:
Ar2 는, 각각의 경우 동일하거나 또는 상이하게, 방향족 고리 원자수가 9 내지 20 이고 R1 로 치환될 수 있는 융합 아릴 또는 헤테로아릴기이고;
Ar3 은 각각의 경우, 동일하거나 또는 상이하게, 치환기 R1 로 치환될 수 있는 플루오렌 또는 스피로비플루오렌기이고;
Q 는, 각각의 경우 동일하거나 또는 상이하게, Ar, O, S, SO, SO2, Se, SeO, SeO2, Te, TeO, TeO2, NAr, PAr, P(=O)Ar, AsAr, As(=O)Ar, SbAr, Sb(=O)Ar, C(R1)2, C=O, Si(R1)2 및 O-BAr-O 로부터 선택되는 2가 단위이고;
p 는, 각각의 경우 동일하거나 또는 상이하게, 1, 2, 3, 4, 5 또는 6 이고;
v 는 각각의 경우, 동일하거나 또는 상이하게는, 0 또는 1 이고;
t 는 1, 2, 3, 4 또는 5 이며;
단, 화학식 (27)에서의 Ar2 는, 모든 p = 1 이고 동시에 v = 0 이고 t = 1 인 각각의 경우에, 나프틸이 아님).
Ar2 는 바람직하게는, 각각의 경우 동일하거나 또는 상이하게, 탄소수 9 내지 20 인 융합 아릴 또는 헤테로아릴기, 특히 바람직하게는 탄소수 10 내지 16 인 융합 아릴기이다.
p 는 또한 바람직하게는 2, 3, 4 또는 5, 특히 바람직하게는 2, 3 또는 4, 매우 특히 바람직하게는 2 또는 3 이다.
또한, 본 발명은 하기 화학식 (28)의 화합물에 관한 것이고:
[화학식 (28)]
(식 중, B, X, Y, AR1 및 R1 은 전술한 바와 동일한 의미를 가지고, 또한:
v 는, 각각의 경우 동일하거나 또는 상이하게, 0 또는 1 이고;
w 는, 각각의 경우 동일하거나 또는 상이하게, 1, 2, 3, 4, 5 또는 6 임);
단, 피나콜, 1,2-에탄디올, 2,2-디메틸-1,3-프로판디올, 2,3-부탄디올 및 이소프로판올로 형성된 보론산 에스테르는 본 발명에서 제외된다.
본 발명은 또한 하기 화학식 (29), (29a) 및 (29b)의 화합물에 관한 것이고:
[화학식 (29)]
[화학식 (29a)]
[화학식 (29b)]
(식 중, B, X, Y, Ar, R1, R2 및 v 는 전술한 바와 동일한 의미를 가지고, a 는 각각의 경우에, 동일하거나 또는 상이하게, 1, 2 또는 3 을 나타냄);
단, 화학식 (29)의 구조는 피나콜, 글리콜 및/또는 1,3-프로판디올의 보론산 에스테르는 아니다.
여기서, 기호 Ar 또는 AR1 은 바람직하게는 벤젠, 비페닐 또는 나프탈렌에서 유래되는 기를 나타내고, 이들 각각은 비치환되거나 치환기 R1 로 치환될 수 있다.
본 발명은 또한 하기 화학식 (30), 화학식 (31), 화학식 (32) 또는 화학식 (33)의 화합물에 관한 것이다:
(식 중, B, X, Y, Z, Ar, R1, R2 및 R3 은 전술한 바와 동일한 의미를 가지고, 또한:
DCy 는, 각각의 경우 동일하거나 또는 상이하게, 하나 이상의 공여 원자 (이를 통해 고리형 기가 금속에 결합되고 이는 하나 이상의 치환기 R1 을 가질 수 있음), 바람직하게는 질소 또는 인을 포함하는 고리형기이고; 기 DCy 와 CCy 는 하나 이상의 공유 결합을 통해 서로 결합되고;
CCy 는, 각각의 경우 동일하거나 또는 상이하게, 탄소 원자 (이를 통해 고리형기가 금속에 결합되고, 이는 하나 이상의 치환기 R1 을 가질 수 있음)를 포함하는 고리형기이고;
A 는, 각각의 경우 동일하거나 또는 상이하게, 2자리 방식으로 킬레이트화되는 1음이온성 리간드, 바람직하게는 디케토네이트 리간드이고;
z 는, 각각의 경우 동일하거나 또는 상이하게, 0, 1, 2, 3, 4, 5 또는 6 이고, 단 각 착물에서 하나 이상의 z 가 0 이 아니고, 또한 z 는 상응하는 고리 DCy 또는 CCy 상의 치환가능한 수소 원자의 최대 수보다 큰 수를 가질 수 없음).
본 발명의 바람직한 구현예에서, 기 DCy 는 방향족 고리 원자 수가 5 또는 6 인 단일고리형 기, 또는 방향족 고리 원자의 수가 9 또는 10 인 융합된 기이고, 특히 바람직하게는 피리딘, 피리미딘, 피리다진, 피라진, 트리아진, 퀴놀린, 이소퀴놀린, 퀴녹살린 및 벤조피리미딘으로부터 선택되고; DCy 는 특히 바람직하게는 피리딘, 퀴놀린 또는 이소퀴놀린을 나타낸다. 이러한 기 각각은 R1 로 치환될 수 있다.
기 CCy 는 또한 바람직하게는 방향족 고리 원자수 5 또는 6 인 단일고리형 기 또는 방향족 고리 원자수가 9 또는 10 인 융합기이고, 특히 바람직하게는 벤젠, 나프탈렌, 안트라센, 티오펜, 벤조티오펜, 피롤 및 인돌로부터 선택되고; CCy 는 특히 바람직하게는 벤젠 또는 나프탈렌을 나타낸다. 이러한 기 각각은 R1 로 치환될 수 있다.
위의 설명으로부터 자명하나, 복수의 라디칼 R1 이 함께 고리계를 형성할 수 있음을 재차 명확하게 강조한다. 기 CCy 및 DCy 상의 라디칼 R1 은 따라서 추가적인 다리를 통해 이들 두 고리를 연결할 수 있다.
이미 위에서 기술한 바와 같은 바람직한 것들이 기 X 및 Y 에 적용된다. 화학식 (5) 내지 (33)의 화합물은 또한 올리고알코올, 올리고아민 또는 올리고아미노알코올과 반응하여, 이량체, 삼량체, 사량체 등을 생성할 수 있다. 이는 또한 본 발명의 주제이다.
또한, 본 발명은 다시 하나 이상의 보론산 또는 보린산 유도체를 포함하는 올리고머, 중합체 및 덴드리머에 관한 것이고, 단, 중합체 및 올리고머 내 보론산 또는 보린산 유도체는 중합체의 쇄 말단에 결합하지 않거나 단지 말단기인 것은 아니다.
이러한 화합물의 용도에 대해 위에서 이미 기술한 바와 같은 바람직한 것들이 본 발명에 따른 중합체, 올리고머 및 덴드리머에 적용된다.
전술한 장치는 선행 기술에 비해 하기의 이점을 갖는다:
1. 상응하는 장치의 안정성은 선행 기술에 따른 계에 비해 더 높고, 이는 특히 OLED 의 보다 긴 작동수명으로부터 분명히 나타난다.
2. 보론산 또는 보린산 유도체는 매우 작은 스토크 (Stoke) 이동만을 나타낸다. 따라서, 호스트로서 사용된 보론산 또는 보린산 유도체의 발광 스펙트럼은 도판트의 흡수 스펙트럼과 상당히 겹친다. 발광 및 흡수 스펙트럼의 겹침은 도판트로의 양호한 에너지 전달 및 그에 따른 고효율을 위한 전제조건이다.
3. 현재까지 사용된 화합물 (이의 일부는 불량한 용해성 때문에 정제가 어려웠음)에 반해, 보론산 및 보린산 유도체는 용이하게 용해되고, 따라서 정제가 간단하며 용액으로부터의 처리가 더욱 용이하다.
4. 이용되는 보론산 또는 보린산 유도체는 유기 화학의 표준 방법에 의해 용이하게 합성될 수 있고, 정제가 용이하다. 따라서, 이는 선행 기술에 따라 사용된 화합물보다 이로운 점을 나타낸다.
5. 보론산 및 보린산 유도체는 상기 치환기를 갖지 않는 비교 화합물보다 증발 온도가 더 낮다. 이는 진공 증착에 의한 OLED 의 제조에 있어서 주요한 이점인데, 이는 상기 장치의 열적으로 민감한 부분, 예컨대 셰도우 마스크가 이로 인해 적은 정도로 가열되기 때문이다.
6. 특히 삼중항 발광체의 보론산 및 보린산 유도체는, 선행 기술에 따라 비치환되거나 또는 단지 알킬 또는 아릴기, 할로겐 등으로 치환된, 선행 기술에 따른 상응하는 화합물, 특히 삼중항 발광체보다 열 안정성이 더 높다. 보다 높은 승화 안정성 때문에, 이는 장치 제조 도중 특히 승화를 통해 처리하기가 쉽고, 이는 선행 기술에 따른 물질을 넘는 상당한 이점을 의미한다.
7. 보론산 및 보린산 유도체는 선행 기술에 따라 사용되는 보란 보다 산화에 대해 현저하게 더 안정하다. 따라서, 이는 선행 기술에 따른 방향족 보란 보다 취급이 쉽고, 따라서 산업적 용도에 더욱 적합하다.
본 출원의 내용 하기 실시예는 OLED 및 해당 디스플레이와 관련된 보론산 또는 보린산 유도체의 용도에 관한 것이다. 이러한 제한에도 불구하고, 당업자는 발명적인 단계 없이 기타 전자 장치에서의 추가 용도를 위해 보론산 또는 보린산 유도체를 또한 쉽게 사용할 수 있다.
본 발명을 하기 실시예를 통해 설명하나 이로써 본 발명을 제한하고자 하는 것은 아니다.
하기 합성은 달리 지시되지 않는 한 보호-기체 분위기 하에서 실행된다. 출발 물질 (9-브로모안트라센, 4-메틸나프트-1-일보론산, 9,10-디브로모안트라센, 에틸렌 글리콜, 피나콜, 헥사플루오로-2,3-비스(트리플루오로메틸)부탄-2,3-디올, 피나콜보란, 1,4-디브로모나프탈렌, p-자일렌 디에틸 포스포네이트, N,N,N',N'-테트라페닐벤지딘, 4-브로모벤조일 클로라이드, DPEPhos, 무기물, 용매)은 ALDRICH, Lancaster, Sensient, Strem 또는 ABCR 로부터 수득할 수 있다. 디브로모피렌 (이성질체 혼합물)은 [Minabe 등, Bull . Chem . Soc . Jpn . 1994, 67(1), 172]의 방법으로 제조할 수 있고, 2,6-디브로모안트라퀴논은 [Lee 등, Org . Lett . 2005, 7(2), 323]의 방법으로 제조할 수 있고, 비스(4-브로모페닐)메틸 디에틸 포스포네이트는 JP 09003079 에 따라 제조할 수 있고, 비스(4-브로모페닐)(4-포르밀페닐)아민은 [Holmberg 등, Poly . Mat . Sci . Engen . 2001, 84, 717]의 방법으로 제조할 수 있고, 4-브로모페닐인 디브로마이드는 [Hinke 등, Phos . Suif . Rel . El . 1983, 15(1), 93]의 방법으로 제조할 수 있고; fac-트리스[2-(2-피리디닐-κN)(5-브로모페닐)-κC]-이리듐(III), fac-트리스[2-(2-피리디닐-κN)(4-플루오로-5-브로모페닐)-κC]-이리듐(III) 및 fac-트리스[2-(1-이소퀴놀리닐-κN)(5-브로모페닐)-κC]-이리듐(III)은 WO 02/068435 (실시예 4)에 따라/유사하게 제조한다.
실시예
1: 안트라센-9,10-
비스(보론산 글리콜 에스테르)의
합성
428.0 ml (1.07 mol)의 n-부틸리튬 (n-헥산 중 2.5 M)을 2,000 ml 의 디에틸 에테르 중 150.0 g (446 mmol)의 9,10-디브로모안트라센의 강하게 교반되고 -78 ℃ 로 냉각된 현탁액에 20 분의 기간에 걸쳐 첨가하고, 이어서 혼합물을 -78 ℃ 에서 30 분간 교반하였다. 상기 현탁액을 2 시간에 걸쳐 20 ℃ 로 가온하고, 추가 2 시간 동안 20 ℃ 에서 교반하고, -78 ℃ 로 다시 냉각하였다. 199.0 ml (1.78 mol)의 트리메틸 보레이트를 강하게 교반하면서 5 분에 걸쳐 첨가하고, 상기 현탁액을 20 ℃ 로 다시 가온하였다. 20 ℃ 에서 15 시간 후, 300 ml 의 물 중 67.0 ml (1.12 mol)의 아세트산 혼합물을 첨가하고, 상기 혼합물을 실온에서 추가로 5 시간 동안 교반하였다. 수상을 분리한 후, 유기상을 감압 하에서 증발 건조시켰다. 500 ml 의 n-헥산을 남은 슬러리에 첨가하고, 혼합물을 1 시간 동안 강하게 교반하였다. 이어서, 형성된 고체를 석션 여과하고, 200 ml 의 n-헥산으로 2 회 세척하고, 석션 건조시켰다. 고체물을 500 ml 의 톨루엔에 현탁시키고, 60 ml 의 에틸렌 글리콜을 첨가하고, 혼합물을 탈수기 상에서 5 시간 동안 비등시켰다. 톨루엔 용액을 냉각시킨 후 침착된 결정을 석션 여과하고, 톨루엔으로부터 추가로 2 회 재결정한 후, 승화시켰다 (T = 240 ℃, p = 5 × 10-5 mbar). 수율: 71.3 g (이론값의 50.3 %), 99.9 % (1H-NMR). 안트라센-9,10-비스(보론산 글리콜 에스테르)의 흡수 및 광발광 스펙트럼을 표 1 에 제시하였다. 명확히 알 수 있는 바와 같이, 화합물은 매우 작은 스토크 이동을 나타낸다.
실시예
2: 10-(4-
메틸나프트
-1-일)안트라센-9-
보론산
피나콜
에스테르의 합성
a) 9-(4-
메틸나프트-1-일
)안트라센
3.6 g (11.7 mmol)의 트리-o-톨릴포스핀, 이어서 437 mg (1.9 mmol)의 팔라듐(II) 아세테이트를, 강하게 교반하면서, 400 ml 의 디옥산, 600 ml 의 톨루엔 및 1000 ml 의 물의 혼합물 중 93.0 g (500 mmol)의 4-메틸나프탈렌-1-보론산, 100.0 g (389 mmol)의 9-브로모안트라센, 212.3 g (1 mol)의 인산삼칼륨 현탁액에 첨가하고, 상기 혼합물을 16 시간 동안 환류시켰다. 반응 혼합물을 냉각시킨 후, 유기상을 분리하고, 500 ml 의 물로 3 회 세척하였다. 이어서, 유기상을 실리카 겔을 통해 여과하고, 증발 건조시켰다. 남은 오일을 1000 ml 의 에탄올에 넣고, 환류 하에 용해시켰다. 냉각 후, 무색의 고체물을 석션 여과시키고, 1,000 ml 의 에탄올로 교반하여 다시 세척하고, 감압 하에서 최종 건조시켰다. 수율: 103.0 g (이론값의 83.1 %), 약 96 % (1H-NMR).
b) 9-
브로모
-10-(4-
메틸나프트
-1-일)안트라센
100 ml 의 디클로로메탄 중 18.0 ml (352 mmol)의 브롬 혼합물을, 강하게 교반하면서, 2,000 ml 의 디클로로메탄 중 102.0 g (320 mmol)의 9-(4-메틸나프트-1-일)안트라센 용액에 -5 ℃ 에서 적가하고, 혼합물을 실온에서 12 시간 동안 교반하였다. 이어서, 현탁액을 1,000 ml 의 에탄올로 희석하였다. 침전된 고체물을 석션 여과하고, 500 ml 의 물과 에탄올 혼합물 (1:1, v:v)로 세척하고, 200 ml 의 에탄올로 3 회 세척하였다. 매번 1,000 ml 의 비등 에탄올로 2 회 세척한 후, 고체물을 감압 건조시켰다. 수율: 108.0 g (이론값의 84.9 %), 약 97% (1H-NMR).
c) 10-(4-
메틸나프트
-1-일)안트라센-9-
보론산
피나콜
에스테르
44.0 ml (110 mmol)의 n-부틸리튬 (n-헥산 중 2.5 M)을, 20 분에 걸쳐, 1,000 ml 의 디에틸 에테르 중 39.7 g (100 mmol)의 9-브로모-10-(4-메틸나프트-1-일)안트라센의 강하게 교반되고 -78 ℃ 로 냉각된 현탁액에 첨가하고, 이어서 혼합 물을 -78 ℃ 에서 30 분간 교반하였다. 2 시간에 걸쳐 상기 현탁액을 20 ℃ 로 가온하고, 추가로 2 시간 동안 20 ℃ 에서 교반하고, -78 ℃ 로 다시 냉각하였다. 28.0 ml (250 mol)의 트리메틸 보레이트를 강하게 교반하면서 5 분에 걸쳐 첨가하고, 현탁액을 20 ℃ 로 다시 가온하였다. 20 ℃ 에서 15 시간 후, 200 ml 의 물 중 15.0 ml (250 mol)의 아세트산 혼합물을 첨가하고, 상기 혼합물을 실온에서 추가로 5 시간 동안 교반하였다. 수상을 분리시킨 후, 유기상을 감압 하에서 증발 건조시켰다. 300 ml 의 n-헥산을 남은 슬러리에 첨가하고, 혼합물을 1 시간 동안 강하게 교반하였다. 형성된 고체물을 이어서 석션 여과하고, 100 ml 의 n-헥산으로 2 회 세척하고, 석션 건조시켰다. 고체물을 150 ml 의 톨루엔에 현탁시키고, 13.0 g (110 mmol)의 피나콜을 첨가하고, 상기 혼합물을 5 시간 동안 탈수기 상에서 비등시켰다. 톨루엔 용액의 냉각 후 침착된 결정을 석션 여과하고, DMSO 로부터 2 회 재결정한 후, 승화시켰다 (T = 350 ℃, p = 5 × 10-5 mbar). 수율: 30.4 g (이론값의 68.4 %), 99.9 % (1H-NMR).
실시예
3: 9,10-비스(
페닐
-2-
보론산
피나콜
에스테르)안트라센의 합성
a) 9,10-
비스(2-브로모페닐)안트라센
6.7 g (5.8 mmol)의 테트라키스(트리페닐포스피노)팔라듐(0)을 1,300 ml 의 디옥산, 350 ml 의 에탄올 및 950 ml 의 물의 혼합물 중 149.0 ml (1.2 mol)의 1,2-디브로모벤젠, 98.0 g (308 mmol)의 9,10-안트라센디보론산 에틸렌 글리콜 에스테르 및 179.0 g (3.1 mol)의 플루오르화칼륨 (무수물, 분무-건조됨) 용액에 첨가하고, 상기 혼합물을 120 시간 동안 환류시켰다. 냉각 후, 침전 고체물을 석션 여과하고, 매번 100 ml 의 물로 3 회 세척하고, 매번 100 ml 의 에탄올로 3 회 세척하고, 감압 하에서 건조시켰다. 수율: 64.3 g (132 mmol), 이론값의 42.8 %; 순도 98 % (1H-NMR), 회전장애 이성질적으로 순수함.
b) 9,10-비스(
페닐
-2-
보론산
피나콜
에스테르)안트라센의 합성
40.0 ml 의 n-BuLi (헥산 중 2.5 M)를 1,000 ml 의 디에틸 에테르 중 19.5 g (40 mmol)의 9,10-비스(2-브로모페닐)안트라센의 현탁액에 첨가하고, 상기 혼합물을 실온에서 6 시간 동안 교반하였다. 이어서, 반응 혼합물을 -78 ℃ 로 냉각하고, 26.8 ml (240 mmol)의 트리메틸 보레이트를 강하게 교반하면서 신속히 첨가하였다. 서서히 실온으로 가온한 후, 8 ml 의 아세트산과 300 ml 의 물의 혼합물, 이어서 500 ml 의 에틸 아세테이트를 첨가하였다. 상기 혼합물을 실온에서 추가로 1 시간 동안 교반하고, 유기상을 분리시키고, 500 ml 의 물로 2 회 세척하 고, 감압 하에서 증발시켰다. 300 ml 의 톨루엔 및 10.6 g (90 mmol)의 피나콜을 잔류물에 첨가하고, 혼합물을 탈수기 상에서 가열하였다. 탈수가 완료되었을 때, 250 ml 의 톨루엔을 증류 제거하고, 300 ml 의 에탄올을 첨가하였다. 냉각 후, 무색의 고체물을 석션 여과시키고, 톨루엔으로부터 3 회 재결정하고, 감압 하에서 건조시켰다. 승화: p = 1 × 10-5 mbar, T = 260 ℃. 수율: 10.6 g (18 mmol), 이론값의 45.5 %; 순도: 99.9 % (1H-NMR).
실시예
4: 1,2-비스(안트라센-9-일-10-
보론산
피나콜
에스테르)벤젠의 합성
a) 1,2-
비스(안트라센-9-일)벤젠
실시예 3a 에 유사한 절차. 149.0 ml (1.2 mol)의 1,2-디브로모벤젠 및 98.0 g (308 mmol)의 9,10-안트라센디보론산 에틸렌 글리콜 에스테르 대신, 12.1 ml (100 mmol)의 디브로모벤젠 및 68.0 g (306 mmol)의 9-안트라센보론산을 사용하였다. 냉각 후, 고체물을 석션 여과시키고, 매번 100 ml 의 에탄올로 3 회 세척하고, 이어서 매번 1,000 ml 의 환류 아세트산으로 교반하여 2 회 세척하고 (1 시간), 매번 90 ℃ 로 냉각 후 석션 여과시켰다. 각각의 경우에 모액을 버렸다. 최종적으로 고체물을 비등 에탄올로 1 회 세척하였다. 수율: 33.0 g (76 mmol), 이론값의 76.6 %; 순도: 98 % (1H-NMR).
b) 1,2-
비스(10-브로모안트라센-9-일)벤젠
빛 차단 하에, 142.4 g (800 mmol)의 N-브로모숙신이미드를, 정밀 유리 교반기로 교반된, 2,000 ml 의 THF 중 86.1 g (200 mmol)의 1,2-비스(안트라센-9-일)벤젠 및 500 g 의 유리 비드 (직경 4 mm) 현탁액에 첨가하였다. 상기 혼합물을 실온에서 24 시간 동안 교반한 후, 유리 비드를 체로 여과시키고, THF 로 세척하고, 고체물을 THF 로부터 여과시키고, 매번 200 ml 의 에탄올로 3 회 세척한 후, 감압 하에서 건조시켰다. 수율: 114.1 g (194 mmol), 이론값의 97.0 %; 순도: 97 % (1H-NMR).
c) 1,2-비스(안트라센-9-일-10-
보론산
피나콜
에스테르)벤젠
실시예 3b 와 유사하게 제조함. 19.5 g (40 mmol)의 9,10-10 비스(2-브로모페닐)안트라센 대신, 23.5 g (40 mmol)의 1,2-비스(10-브로모안트라센-9-일)벤젠을 사용하였다. 승화: p = 1 × 10-5 mbar, T = 310 ℃. 수율: 17.1 g (25 mmol), 이론값의 62.6 %; 순도: 99.9 % (1H-NMR).
실시예
5: 1,4-비스(안트라센-9-일-10-
보론산
피나콜
에스테르)나프탈렌의 합성
a) 1,4-
비스(안트라센-9-일)나프탈렌
실시예 3a 에 유사한 절차. 149.0 ml (1.2 mol)의 1,2-디브로모벤젠 및 98.0 g (308 mmol)의 9,10-안트라센디보론산 에틸렌 글리콜 에스테르 대신, 28.6 g (100 mmol)의 1,4-디브로모나프탈렌 및 68.0 g (306 mmol)의 9-안트라센보론산을 사용하였다. 냉각 후, 고체물을 석션 여과시키고, 매번 500 ml 의 비등 에탄올로 2 회 세척하였다. 수율: 33.0 g (69 mmol), 이론값의 68.7 %; 순도: 98 % (1H-NMR).
b) 1,4-
비스(10-브로모안트라센-9-일)나프탈렌
실시예 4b 에 유사한 절차. 86.0 g (200 mmol)의 1,2-비스(안트라센-9-일)벤젠 및 142.4 g (800 mmol)의 N-브로모숙신이미드 대신, 96.1 g (200 mmol)의 1,4-비스(안트라센-9-일)나프탈렌 및 42.7 g (240 mmol)의 N-브로모숙신이미드를 사용하였다. 수율: 109.2 g (171 mmol), 이론값의 85.5 %; 순도: 97 % (1H-NMR).
c) 1,4-비스(안트라센-9-일-10-
보론산
피나콜
에스테르)나프탈렌
실시예 3b 와 유사하게 제조. 19.5 g (40 mmol)의 9,10-비스(2-브로모페닐)안트라센 대신, 25.5 g (40 mmol)의 1,4-비스(10-브로모-안트라센-9-일)나프탈렌을 사용하였다. p = 1 × 10-5 mbar, T = 300 ℃ 에서 승화. 수율: 12.1 g (16.5 mmol), 이론값의 41.3 %; 순도: 99.8 % (1H-NMR).
실시예
6: 9,10-
비스(나프트-1-일)안트라센
-2,6-
비스
-(
보론산
피나콜
에스테르)의 합성
a) 2,6-
디브로모
-9,10-
비스(나프트-1-일)안트라센
상응하는 그리나드 시약을 500 ml 의 THF 에서 30.5 ml (220 mmol)의 1-브로모나프탈렌 및 5.5 g (225 mmol)의 망간으로부터 제조하였다. 36.6 g (100 mmol)의 2,6-디브로모안트라퀴논을 상기 그리나드 시약에 첨가하고, 혼합물을 6 시간 동안 환류하고 냉각하고, 15 ml 의 아세트산을 첨가하고, 혼합물을 증발 건조시키고, 잔류물을 500 ml 의 DMF 에 녹이고, 56.9 g (300 mmol)의 주석 (II) 클로라이드를 첨가하고, 혼합물을 5 시간 동안 환류시켰다. 냉각 후, 200 ml 의 2 N 염산을 첨가하고, 혼합물을 추가로 1 시간 동안 교반하고, 고체물을 석션 여과시키고, 매번 200 ml 의 2 N 염산으로 3 회, 매번 300 ml 의 물로 3 회, 매번 200 ml 의 에탄올로 3 회 세척하고, 감압 하에서 건조시키고, DMF 로부터 1 회 재결정하였다. 수율: 48.9 g (83 mmol), 이론값의 83.1 %; 순도: 98 % (1H-NMR).
b) 9,10-
비스(나프트-1-일)안트라센
-2,6-
비스
(
보론산
피나콜 에스테르
)
실시예 3b 와 유사하게 제조. 19.5 g (40 mmol)의 9,10-비스(2-브로모페닐)안트라센 대신, 23.5 g (40 mmol)의 2,6-디브로모-9,10-비스-(나프트-1-일)안트라센을 사용하였다. 톨루엔, 이어서 디옥산으로부터 2 회 재결정하였다. p = 1 × 10-5 mbar, T = 270 ℃ 에서의 승화. 수율: 14.6 g (21 mmol), 이론값의 53.5 %; 순도: 99.9 % (1H-NMR).
실시예
7: 9,10-비스(
나프트
-1-일-4-
보론산
피나콜
에스테르)안트라센의 합성
a) 9,10-
비스(4-브로모나프트-1-일)안트라센
48.0 ml (120 mmol)의 n-부틸리튬 (헥산 중 2.5 M)을, -78 ℃ 에서 강하게 교반하면서, 1,000 ml 의 THF 중 31.9 g (120 mmol)의 1,4-디브로모-나프탈렌 용액에 첨가하였다. 혼합물을 -78 ℃ 에서 1 시간 동안 교반하고, 이어서 0 ℃ 로 가온하고, 10.4 g (50 mmol)의 안트라퀴논을 첨가하고, 혼합물을 0 ℃ 에서 추가로 3 시간 동안 교반하였다. 15 ml 의 아세트산을 첨가한 후, 혼합물을 증발 건조시키고, 잔류물을 500 ml 의 DMF 에 녹이고, 28.4 g (150 mmol)의 주석 (II) 클로라이드를 첨가하고, 혼합물을 5 시간 동안 환류시켰다. 냉각 후, 200 ml 의 2 N 염산을 첨가하고, 혼합물을 추가로 1 시간 동안 교반하고, 고체물을 석션 여과시키고, 매번 200 ml 의 2 N 염산으로 3 회, 매번 300 ml 의 물로 3 회, 매번 200 ml 의 에탄올로 3 회 세척하고, 감압 하에서 건조시키고, NMP 로부터 재결정시켰다. 수율: 25.9 g (44 mmol), 이론값의 88.0 %; 순도: 98 % (1H-NMR).
b) 9,10-
비스(4-브로모나프트-1-일)안트라센
실시예 3b 와 유사하게 제조. 19.5 g (40 mmol)의 9,10-10 비스(2-브로모페닐)안트라센 대신, 23.5 g (40 mmol)의 9,10-비스(4-브로모-나프트-1-일)안트라센을 사용하였다. 9,10-비스(4-브로모나프트-1-일)안트라센의 용해도가 불량하여, 200 g 의 유리 비드 (직경 4 mm)를 배치에 첨가하고, 기계적 패들 교반기를 사용하여 교반하였고, 리튬화 반응 시간을 24 시간으로 연장시켰다. 디옥산으로부터 재결정 4 회. 승화: p = 1 × 10-5 mbar, T = 290 ℃. 수율: 17.6 g (26 mmol), 이론값의 64.5 %; 순도: 99.9 % (1H-NMR).
실시예
8: 1,6-
비스(2,5-디메틸페닐)피렌
-3,8-
비스(보론산 피나콜 에스테르)
의 합성
a) 1,6-
비스(2,5-디메틸페닐)피렌
7.2 g (20 mmol)의 트리-o-톨릴포스핀 및 740 mg (3.3 mmol)의 팔라듐(Il) 아세테이트를, 강하게 교반된, 500 ml 의 톨루엔, 500 ml 의 디옥산 및 100 ml 의 물의 혼합물 중 76.0 g (211 mmol)의 디브로모피렌 (이성질체 혼합물), 72.9 g (486 mmol)의 2,5-디메틸페닐보론산 및 222.4 g (966 mmol)의 인산칼륨 1수화물의 현탁액에 첨가하고, 혼합물을 12 시간 동안 환류시켰다. 실온으로의 냉각 후, 침전 고체물을 석션 여과시키고, 200 ml 의 에탄올로 세척하고, 가온하면서 500 ml 의 디클로로메탄에 용해시키고, 용액을 실리카 겔을 통해 여과시키고, 여과액을 감압 하에 1,000 ml 로 증발시키고, 300 ml 의 에탄올을 첨가하였다. 2 시간 동안 정치시킨 후, 무색 결정을 석션 여과시키고, 100 ml 의 에탄올로 세척하고, 감압 하에서 건조시켰다. 수율: 32.5 g (79 mmol), 이론값의 37.5 %; 순도 98 % (1H-NMR).
b) 1,6-
비스
(2,5-
디메틸페닐
)-3,8-
디브로모피렌
800 ml 의 THF 중 25.8 g (63 mmol)의 1,6-비스(2,5-디메틸페닐)피렌 및 24.8 g (139 mmol)의 N-브로모숙신이미드 현탁액을 빛을 차단한 상태로 16 시간 동안 실온에서 교반하였다. 반응 혼합물을 감압 하에서 100 ml 로 증발시키고, 200 ml 의 에탄올 및 200 ml 의 물을 첨가하였다. 침전물을 석션 여과시키고, 100 ml 의 에탄올로 3 회 세척하고, 감압 하에서 건조시키고, 클로로벤젠으로부터 2 회 재결정하였다. 수율: 26.0 g (46 mmol), 이론값의 72.6 %; 순도 97 % (1H-NMR).
c) 1,6-
비스(2,5-디메틸페닐)피렌
-3,8-
비스
(
보론산
피나콜
에스테르)
실시예 3b 에 유사한 절차. 19.5 g (40 mmol)의 9,10-비스(2-브로모페닐)안트라센 대신, 22.7 g (40 mmol)의 1,6-비스(2,5-디메틸-페닐)-3,8-디브로모피렌을 사용하였다. 디옥산으로부터 결정화시켰다. 승화: p = 1 × 10-5 mbar, T = 290 ℃. 수율: 11.5 g (17 mmol), 이론값의 43.3 %; 순도: 99.9 % (1H-NMR).
실시예
9: 1,4-비스(안트라센-9-일-10-
보론산
피로카테콜
에스테르)나프탈렌의 합성
실시예 3b 와 유사하게 제조. 19.5 g (40 mmol)의 9,10-비스(2-브로모페 닐)안트라센 대신에, 25.5 g (40 mmol)의 1,4-비스(I0-브로모-안트라센-9-일)나프탈렌을 사용하고, 10.6 g (90 mmol)의 피나콜 대신에, 9.9 g (90 mmol)의 피로카테콜을 사용하였다. 승화: p = 1 × 10-5 mbar, T = 330 ℃. 수율: 17.7 g (25 mmol), 이론값의 61.8 %; 순도: 99.7 % (1H-NMR).
실시예
10: 9,10-
비스(나프트-1-일)안트라센
-3,8-
비스
-(
보론산
피로카테콜
에스테르)의 합성
실시예 3b 와 유사하게 제조. 19.5 g (40 mmol)의 9,10-비스(2-브로모페닐)안트라센 대신, 23.5 g (40 mmol)의 2,6-디브로모-9,10-비스-(나프트-1-일)안트라센을 사용하고, 10.6 g (90 mmol)의 피나콜 대신, 9.9 g (90 mmol)의 피로카테콜을 사용하였다. 승화: p = 1 × 10-5 mbar, T = 305 ℃. 수율: 9.2 g (14 mmol), 이론값의 34.5 %; 순도: 99.9 % (1H-NMR).
실시예
11: 2,4,6-
트리스
[1 0-(4-
메틸나프트
-1-일)안트라센-9-일]-
시클로트리보록산
실시예 2c 와 유사하게 제조. 보론산을 분리한 후, 이를 300 ml 의 아세토니트릴 중에 현탁시키고, 5 시간 동안 탈수기 상에서 비등시키고, 이 동안 공비물을 50 ml 까지 연속해서 제거하였다. 300 ml 의 에탄올 첨가 및 냉각 후, 침착된 결정을 석션 여과시키고, 디옥산으로부터 4 회 재결정시키고, 이어서 승화시켰다 (T = 370 ℃, p = 5 × 10-5 mbar); 수율: 15.8 g (18 mmol), 이론값의 45.9 %; 순도: 99.9 % (1H-NMR).
실시예
12: 9,10-
비스(나프트-1-일)안트라센
-3,8-비스(
보론산
헥사플루오로
-2,3-비
스(트리플루오로메틸)
부트-2,3-일 에스테르)
실시예 3b 와 유사하게 제조. 19.5 g (40 mmol)의 9,10-비스(2-브로모페 닐)안트라센 대신, 23.5 g (40 mmol)의 2,6-디브로모-9,10-비스(나프트-1-일)안트라센을 사용하였다. 10.6 g (90 mmol)의 피나콜 대신, 30.1 g (90 mmol)의 헥사플루오로-2,3-비스(트리플루오로메틸)부탄-2,3-디올을 사용하였다. 톨루엔/아세토니트릴로부터 5 회 재결정시켰다. 승화: p = 1 × 10-5 mbar, T = 280 ℃. 수율: 18.1 g (16 mmol), 이론값의 40.6 %; 순도: 99.8 % (1H-NMR).
실시예
13: 9,10-
비스(나프트-1-일)안트라센
-3,8-비스(2-10 (3-
메틸
-2,3-
디
히드로벤조-1 ,3,2-
옥사자보롤
)의 합성
실시예 3b 와 유사하게 제조. 19.5 g (40 mmol)의 9,10-비스(2-브로모페닐)안트라센 대신, 23.5 g (40 mmol)의 2,6-디브로모-9,10-비스(나프트-1-일)안트라센을 사용하였다. 10.6 g (90 mmol)의 피나콜 대신, 11.1 g (90 mmol)의 2-메틸아미노페놀을 사용하였다. DMF 로부터 4 회 재결정시켰다. 승화: p = 1 × 10-5 mbar, T = 280 ℃. 수율: 14.9 g (21.5 mmol), 이론값의 53.8 %; 순도: 99.9 % (1H-NMR).
실시예
14: 트리스((4-(2,2-
디(4-페닐보론산 피나콜 에스테르)비닐
)펜-1-일) 아민의 합성
a) 트리스((4-(2,2-
디(4-브로모페닐)비닐
)펜-1-일)아민
200 ml 의 DMF 중 184.8 g (400 mmol)의 비스(4-브로모페닐)메틸 디에틸포스포네이트 용액을, 0 ℃ 로 냉각된, 1,000 ml 의 무수물 DMF 중 76.9 g (800 mmol)의 나트륨 tert-부톡시드 현탁액에 첨가하였다. 혼합물을 추가로 30 분간 교반한 후, 300 ml 의 DMF 중 32.9 g (100 mmol)의 트리스(4-포르밀)아민 용액을 30 분에 걸쳐 첨가하고, 상기 혼합물을 0 ℃ 에서 추가로 4 시간 동안 교반하고, 이어서, 1,000 ml 의 1 N 염산 및 500 ml 의 에탄올을 첨가하였다. 고체물을 석션 여과시키고, 300 ml 의 물로 3 회 그리고 200 ml 의 에탄올로 3 회 세척하고, 감압 하에서 건조시켰다. 이어서, 생성물을 DMF 로부터 재결정시키고, 석션 여과하고, 200 ml 의 에탄올로 3 회 세척하고, 감압 하에서 건조시켰다. 수율: 109.4 g (87 mmol), 이론값의 87.3 %; 순도: 99 % (1H-NMR).
b) 트리스((4-(2,2-
디(4-페닐보론산 피나콜 에스테르)비닐
)펜-1-일)아민
65 ml 의 n-BuLi (헥산 중 2.5 M)를 1,000 ml 의 디에틸 에테르 중 31.3 g (25 mmol)의 트리스((4-(2,2-디(4-브로모페닐)비닐)펜-1-일)아민 현탁액에 첨가하고, 상기 혼합물을 실온에서 6 시간 동안 교반하였다. 이어서, 반응 혼합물을 -78 ℃ 로 냉각하고, 44.5 ml (450 mmol)의 트리메틸 보레이트를 강하게 교반하면서 신속하게 첨가하였다. 실온으로 서서히 가온한 후, 15 ml 의 아세트산과 500 ml 의 물의 혼합물, 이어서 500 ml 의 에틸 아세테이트를 첨가하였고, 상기 혼합물을 실온에서 추가로 1 시간 동안 교반하고, 유기상을 분리하고, 500 ml 의 물로 2 회 세척하고, 감압 하에서 증발시켰다. 500 ml 의 톨루엔 및 18.9 g (160 mmol)의 피나콜을 잔류물에 첨가하고, 혼합물을 탈수기 상에서 가열하였다. 물이 완전히 분리되었을 때, 400 ml 의 톨루엔을 증류 제거하고, 300 ml 의 에탄올 첨가하였다. 냉각 후, 황색 고체를 석션 여과시키고, 디옥산/에탄올 (1:3, v:v)로부터 5 회 재결정시키고, 감압 하에서 승화시켰다 (p = 1 × 10-5 mbar, T = 330 ℃). 수율: 14.5 g (9 mmol), 이론값의 37.7 %; 순도: 99.9 % (1H-NMR).
실시예
15: 1,4-비스(4-디(4-
페닐보론산
피나콜
에스테르)아미노스티릴)벤젠 의 합성
a) 1,4-
비스(4-디(4-브로모페닐)아미노스티릴)벤젠
200 ml 의 DMF 중 37.8 g (100 mmol)의 p-자일렌 디에틸포스포네이트 용액을, 0 ℃ 로 냉각된, 1,000 ml 의 무수물 DMF 중 38.5 g (400 mmol)의 나트륨 tert-부톡시드 현탁액에 첨가하였다. 혼합물을 추가로 30 분간 교반한 후, 300 ml 의 DMF 중 90.5 g (210 mmol)의 비스(4-브로모페닐)(4-포르밀페닐)아민 용액을 30 분에 걸쳐 첨가하고, 혼합물을 0 ℃ 에서 추가로 4 시간 동안 교반한 후, 500 ml 의 1 N 염산 및 300 ml 의 에탄올을 첨가하였다. 고체물을 석션 여과시키고, 300 ml 의 물로 3 회, 그리고 200 ml 의 에탄올로 3 회 세척하고, 감압 하에서 건조시켰다. 이어서, 상기 생성물을 DMF 로부터 재결정시키고, 석션 여과시키고, 200 ml 의 에탄올로 3 회 세척하고, 감압 하에서 건조시켰다. 수율: 86.1 g (92 mmol), 이론값의 92.3 %; 순도: 99 % (1H-NMR).
b) 1,4-비스(4-디(4-
페닐보론산
피나콜
에스테르)아미노스티릴)벤젠
실시예 14b 와 유사하게 제조. 31.3 g (25 mmol)의 트리스((4-(2 ,2-디(4-브로모페닐)비닐)펜-1-일)아민 대신에, 34.5 g (37 mmol)의 1,4-비스(4-디(4-브로모페닐)아미노스티릴)벤젠을 사용하였다. 승화: p = 1 × 10-5 mbar, T = 310 ℃. 수율: 18.9 g (17 mmol), 이론값의 45.6 %; 순도: 99.7 % (1H-NMR).
실시예
16: N,N,
N'
,
N'
-테트라키스(4-1,3,2-
디옥사보롤란
-2-
일페닐
)비페닐-4,4'-디아민의 합성
a) N,N,
N'
,
N'
-
테트라(4-브로모페닐)벤지딘
74.8 g (420 mmol)의 N-브로모숙신이미드를, 40 ℃ 에서 강하게 교반하면서, 500 ml 의 THF 중 48.9 g (100 mmol)의 N,N,N',N'-테트라페닐벤지딘의 용액에 나누어 첨가하고, 혼합물을 16 시간 동안 교반하였다. 이어서, 혼합물을 2,000 g 의 얼음 위로 옮기고, 생성된 침전물을 석션 여과시키고, 300 ml 의 물로 3 회, 200 ml 의 에탄올로 2 회 세척하고, 이어서 DMF 로부터 재결정시켰다. 수율: 73.5 g (91 mmol), 이론값의 91.4 %; 순도 98 % (1H-NMR).
b)
N4
,
N4'
,
N4
",
N4'
"-테트라키스(4-1,3,2-
디옥사보롤란
-2-
일페닐
)비페닐-4,4'-디아민
실시예 15b 와 유사하게 제조. 34.5 g (37 mmol)의 1,4-비스(4-디(4-브로모페닐)아미노스티릴)벤젠 대신, 29.8 g (37 mmol)의 N,N,N',N'-테트라(4-브로모페닐)벤지딘을 사용하고, 18.9 g (160 mmol)의 피나콜 대신, 9.0 ml (160 mmol)의 에틸렌 글리콜을 사용하였다. 톨루엔으로부터 재결정. 승화: p = 1 × 10-5 mbar, T = 250 ℃. 수율: 21.3 g (28 mmol), 이론값의 75.0 %; 순도: 99.9 % (1H-NMR).
실시예
17: 2,2'-비스(4-(4,4,5,5-
테트라메틸
-1,3,2-
디옥사
-
보롤란
-2-일)
페
닐)
스피로
-9,9'-
비플루오렌의
합성
a) 2,2'-
비스(4-브로모벤조일)스피로
-9,9'-
비플루오렌
100 ml 의 1,2-디클로로에탄 중 24.1 g (110 mmol)의 4-브로모벤조일 클로라이드 용액을 300 ml 의 1,2-디클로로에탄 중 16.0 g (120 mmol)의 알루미늄 클로라이드 현탁액에 적가하였다. 200 ml 의 1,2-디클로로에탄 중 15.8 g (50 mmol)의 스피로-9,9'-비플루오렌을 상기 혼합물에 적가하였다. 이어서, 혼합물을 실온에서 추가로 4 시간 동안 교반하고, 강하게 교반하면서 1,000 g 의 얼음과 200 ml 의 2 N 염산 혼합물에 붓고, 침전 고체물은 석션 여과시켰다. 고체물을 500 ml 의 물로 3 회, 200 ml 의 에탄올로 3 회 세척하고, 감압 하에서 건조시켰다. 수율: 29.2 g (43 mmol), 이론값의 85.6 %; 순도: 98 % (1H-NMR).
b) 2,2 ‘-
비스
(4-(4,4,5,5-
테트라메틸
-1,3,2-
디옥사보롤란
-2-일)
페닐
)-
스피로
-9,9'-
비플루오렌
2-(4-아세틸페닐)-4,4,5,5-테트라메틸-1,3,2-디옥사보롤란의 제조와 유사하게, [Melaimi 등, J. Organomet . Chem . 2004, 689(19), 2988]의 방법에 의해 제조하였다. 4-아세틸-브로모벤젠 대신, 17.1 g (25 mmol)의 2,2'-비스(4-브로모벤조일)스피로-9,9'-비플루오렌을 이용하였다. 승화: p = 1 × 10-5 mbar, T = 265 ℃. 수율: 8.4 g (11 mmol), 이론값의 43.2 %; 순도: 99.9 % (1H-NMR).
실시예
18: 2-
비스
(
스피로
-9,9'-
비플루오렌
)-(4-(4,4,5,5-
테트라메틸
-1 ,3,2-디
옥사보
롤란-2-일)
페닐
)포스핀
옥시드의
합성
a) 2-
비스
(
스피로
-9,9-
비플루오렌
)-(4-
브로모페닐
))포스핀
옥시드
WO 05/003253 의 실시예 1 과 유사하게 제조. 디클로로페닐포스핀 대신, 41.6 g (120 mmol)의 4-브로모페닐인 디브로마이드를 사용하였다. 클로로벤젠으로부터 재결정 2 회. 수율: 71.0 g (71 mmol), 이론값의 71.0 %; 순도: 98 % (1H-NMR).
b) 2-
비스
(
스피로
-9,9'-
비플루오렌
)-(4-(4,4,5,5-
테트라메틸
-1,3,2-
디옥사
-보롤란-2-일)
페닐
)포스핀
옥시드
실시예 17b 와 유사하게 제조. 17.1 g (25 mmol)의 2,2'-비스(4-브로모벤조일)스피로-9,9'-비플루오렌 대신, 20.8 g (25 mmol)의 2-비스(스피로-9,9'-비플루오렌)-(4-브로모페닐))포스핀 옥시드를 이용하였다. 승화: p = 1 × 10-5 mbar, T = 310 ℃. 수율: 8.0 g (9 mmol), 이론값의 36.3 %; 순도: 99.9 % (1H-NMR).
실시예
19: 4,4'-비스(4,4'-
비스
(1,3,2-
디옥사보롤란
-2-일)-
카르바졸릴
)비페닐의 합성
a) 4,4-
비스(4,4'-비스브로모카르바졸릴)비페닐
74.8 g (420 mmol)의 N-브로모숙신이미드를 1,000 ml 의 THF 중 48.5 g (100 mmol)의 비스카르바졸릴비페닐 용액에 40 ℃ 에서 강하게 교반하면서 나누어 첨가하고, 이어서 혼합물을 16 시간 동안 교반하였다. 이어서, 혼합물을 2,000 g 의 얼음 위로 옮기고, 생성된 침전물을 석션 여과시키고, 300 ml 의 물로 3 회, 200 ml 의 에탄올로 2 회 세척하고, DMF 로부터 재결정시켰다. 수율: 74.3 g (93 mmol), 이론값의 92.8 %; 순도 98 % (1H-NMR).
b) 4,4'-비스(4,4'-
비스(1,3,2-디옥사보롤란-2-일)카르바졸릴
)비페닐
실시예 16b 와 유사하게 제조. 29.8 g (37 mmol)의 N,N,N',N'-테트라(4-브로모페닐)벤지딘 대신, 29.6 g (37 mmol)의 4,4'-비스(4,4'-비스브로모카르바졸릴)비페닐을 사용하고, 18.9 g (160 mmol)의 피나콜 대신, 9.0 ml (160 mmol)의 에틸렌 글리콜을 사용하였다. 디옥산으로부터의 재결정. 승화: p = 1 × 10-5 mbar, T = 270 ℃. 수율: 21.3 g (28 mmol), 이론값의 75.3 %; 순도: 99.9 % (1H-NMR).
실시예
20: 1,6-
비스((4-메틸페닐)아미노)피렌
-3,8-
비스(보론산 피나콜 에스
테르)의 합성
a) 1,6-
비스((4-메틸페닐)아미노)피렌
1.05 ml (5.2 mmol)의 디-tert-부틸포스핀 클로라이드, 이어서 898 mg (4.0 mmol)의 팔라듐(II) 아세테이트를 강하게 교반된, 1,000 ml 의 톨루엔 중 76.0 g (211 mmol)의 디브로모피렌 (이성질체 혼합물), 94.7 g (480 mmol)의 비스(4-메틸페닐)아민 및 50.0 g (520 mmol)의 나트륨 tert-부톡시드의 현탁액에 첨가하고, 혼합물을 5 시간 동안 환류시켰다. 실온으로 냉각시킨 후, 1,000 ml 의 물을 첨가하고, 침전 고체물을 석션 여과시키고, 200 ml 의 에탄올로 세척하고, 감압 하에서 건조시켰다. DMF 로부터의 3 회의 재결정. 수율: 41.4 g (70 mmol), 이론값의 33.1 %; 순도 99 % (1H-NMR).
b) 1,6-
비스
((4-
메틸페닐
)아미노)-3,8-
디브로모피렌
실시예 8b 와 유사하게 제조. 25.8 g (63 mmol)의 1,6-비스(2,5-디메틸페닐)피렌 대신, 29.6 g (50 mmol)의 1,6-비스((4-메틸페닐)아미노)피렌을 사용하고, 24.8 g (139 mmol)의 N-브로모숙신이미드 대신, 19.6 g (110 mmol)의 N-브로모숙신이미드를 사용하였다. 수율: 27.4 g (36.5 mmol), 이론값의 73.0 %; 순도 99 % (1H-NMR).
c) 1,6-
비스((4-메틸페닐)아미노)피렌
-3,8-
비스
(
보론산
피나콜
에스테르)
실시예 3b 에 유사한 절차. 19.5 g (40 mmol)의 9,10-비스(2-브로모페닐)안트라센 대신, 30.0 g (40 mmol)의 1,6-비스((4-메틸페닐)아미노)-3,8-디브로 모피렌을 이용하였다. 클로로벤젠으로부터 재결정시켰다. 승화: p = 1 × 10-5 mbar, T = 285 ℃. 수율: 13.8 g (16 mmol), 이론값의 40.8 %; 순도: 99.9 % (1H-NMR).
실시예
21: 9,1O-비스((
비스
-4-(4,4,5,5-
테트라메틸
-1,3,2-
디옥사보롤란
-2-일)
페닐
)아미노)안트라센의 합성
a) 9,1O-
비스(디페닐아미노)안트라센
실시예 20a 와 유사하게 제조. 76.0 g (211 mmol)의 디브로모피렌 (이성질체 혼합물) 및 94.7 g (480 mmol)의 비스(4-메틸페닐)아민 대신, 70.9 g (211 mmol)의 9,10-디브로모안트라센 및 81.2 g (480 mmol)의 디페닐아민을 사용하였다. 수율: 86.2 g (168 mmol), 이론값의 79.7 %; 순도 99 % (1H-NMR).
b) 9,1O-
비스
-N,N-(
디(4-브로모페닐)아미노
)안트라센
실시예 16a 와 유사하게 제조. 48.9 g (100 mmol)의 N,N,N',N'-테트라페닐벤지딘 대신, 51.3 g (100 mmol)의 9,10-비스(디페닐아미노)안트라센을 사용하였다. 수율: 70.8 g (85 mmol), 이론값의 85.5 %; 순도 98 % (1H-NMR).
c) 9,10-비스((
비스
-4-(4,4,5,5-
테트라메틸
-1,3,2-
디옥사보롤란
-2-일)-
페닐
)아미노)안트라센
실시예 3b 와 유사하게 제조. 19.5 g (40 mmol)의 9,10-비스(2-브로모페닐)안트라센 대신, 16.6 g (20 mmol)의 9,10-비스(디(4-브로모페닐)아미노)안트라센을 사용하였다. 클로로벤젠으로부터 재결정시켰다. 승화: p = 1 × 10-5 mbar, T = 285 ℃. 수율: 9.9 g (9.7 mmol), 이론값의 48.7 %; 순도 99.8 % (1H-NMR).
실시예
22:
fac
-트리스[2-(2-
피리디닐
-κN)(5-(4,4,5,5-
테트라메틸
-1,3,2-
디옥사보롤란
-2-일)
페닐
)-κC]-이리듐(
III
)의 합성
페닐보로네이트의 일반적인 제조 방법과 유사하게, [Broutin 등, Org . Lett. 2004, 6(24), 4419]의 방법을 통해 제조하였다. 10 ml 의 디옥산 중 892 mg (1 mmol)의 fac-트리스[2-(2-피리디닐-κN)(5-브로모-페닐)-κC]이리듐(III), 및 1.3 g (10 mmol)의 피나콜보란을 사용하고, 반응 시간을 16 시간으로 하였다. 디클로로메탄:n-헥산 (1:10, v:v)으로 용출되는, 탈활성화 실리카 겔 (5 % 의 트리에틸아민) 상의 크로마토그래피 정제. 승화: p = 1 × 10-5 mbar, T = 295 ℃. 수율: 325 mg (315 μmol), 이론값의 31.5 %; 순도: 99.9 % (1H-NMR).
실시예
23:
fac
-트리스[2-(2-
피리디닐
-κN)(4-
플루오로
-5-(4,4,5,5-
테트라메
틸-1,3,2-
디옥사보롤란
-2-일)
페닐
)-κC]이리듐(
IlI
)의 합성
페닐보로네이트의 일반 제조 방법과 유사하게, [Broutin 등, Org . Lett . 2004, 6(24), 4419]의 방법을 통해 제조하였다. 10 ml 의 디옥산 중 946 mg (1 mmol)의 fac-트리스[2-(2-피리디닐-κN)(4-플루오로-5-브로모페닐)-κC]이리듐(IIl), 및 1.3 g (10 mmol)의 피나콜보란을 사용하고, 반응 시간을 16 시간으로 하였다. 디클로로메탄:n-헥산 (1:10, v:v)으로 용출되는, 탈활성화 실리카 겔 (5 % 의 트리에틸아민) 상의 크로마토그래피 정제. 승화: p = 1 × 10-5 mbar, T = 280 ℃. 수율: 324 mg (298 μmol), 이론값의 29.8 %; 순도: 99.8 % (1H-NMR).
실시예
24:
fac
-트리스[2-(1-
이소퀴놀리닐
-κN)(5-(4,4,5,5-
테트라메틸
-1,3,2-디
옥사
보롤란-2-일)
페닐
)-κC]이리듐(
III
)의 합성
페닐보로네이트의 일반 제조 방법과 유사하게, [Broutin 등, Org . Lett . 2004, 6(24), 4419]의 방법을 통해 제조하였다. 10 ml 의 디옥산 중 1042 mg (1 mmol)의 fac-트리스[2-(1-이소퀴놀리닐-κN)(5-브로모페닐)-κC]이리듐(III), 및 1.3 g (10 mmol)의 피나콜보란을 사용하고, 반응 시간을 16 시간으로 하였다. 디클로로메탄:n-헥산 (1:10, v:v)으로 용출되는, 탈활성화 실리카 겔 (5 % 의 트 리에틸아민) 상의 크로마토그래피 정제. 승화: p = 1 × 10-5 mbar, T = 340 ℃. 수율: 485 mg (410 μmol), 이론값의 41.0 %; 순도: 99.9 % (1H-NMR).
실시예
25:
실시예
1 내지 13 에 따른 본 발명 물질을 포함하는
OLED 의
제조
OLED 를 WO 04/058911 에 따른 일반 방법으로 제조하고, 이는 개개의 경우에 특정 환경에 맞게 조정하였다 (예를 들면 최적 효율 또는 색상을 달성하기 위한 층-두께의 변화).
각종 OLED 에 관한 결과물을 아래 실시예 26 내지 39 에 제시하였다. 보다 양호한 비교를 위해, (발광층을 제외한) 사용된 기본 구조 및 물질은 상기 실시예에서 동일하였다. 하기 구조를 갖는 OLED 를 전술한 일반 방법과 유사하게 제조하였다:
정공-주입층 (HIL): 20 nm PEDOT (물로부터 스핀 코팅됨; H.C. Starck, Goslar, Germany; 폴리(3,4-에틸렌디옥시-2,5-티오펜))
정공-수송층 (HTL): 30 nm 4,4',4"-트리스(N-1-나프틸-N-페닐아미노)트리페닐아민 (NaphDATA 로 약칭, SynTec 사제)
정공-수송층 (HTL): 30 nm NPB (N-나프틸-N-페닐-4,4'-디아미노비페닐)
발광층 (EML): 도판트로서 5 % 의 트리스[4-(2,2-디페닐-비닐)페닐]아민 (D1 로 약칭, 증착됨, WO 06/000388 에 따라 합성됨)으로 도핑된, 실시예 1 내지 13 에 따른 호스트 물질 30 nm 층 (표 참조); 또는 도판트로서 5% 의 트리스[4-(2,2-디페 닐비닐)페닐]아민 (D1 로 약칭)으로 도핑된, 호스트 물질로서의 9,10-비스(1-나프틸안트라센) (H 로 약칭) 30 nm (비교예)
전자 전도체 (ETC): 20 nm AlQ3 (SynTec 사제, 트리스(퀴놀리네이토)알루미늄(III))
캐소드: 1 nm LiF, 상부의 150 nm Al
이러한 OLED 는 표준 방법으로 특징화되고; 이를 위해, 전류/전압/휘도 특징선 (IUL 특징선)으로부터 계산되는, 휘도 함수로서의 전계발광 스펙트럼, 효율 (cd/A 로 측정됨), 전력 효율 (lm/W 으로 측정됨)을 측정하였다.
표 1 은 일부 OLED (실시예 26 내지 39)의 결과를 나타낸다.
비교예에 사용된 호스트 물질은 9,10-비스(1-나프틸)안트라센이고; 모든 실시예에 사용된 도판트는 D1 이었다. 이들 모두를 다음과 같이 제조하였다:
표 1 에서의 실시예로부터 알 수 있듯이, 본 발명의 실시예 1 내지 13 에 따른 호스트 물질을 포함하는 OLED 는 낮은 작동 전압을 나타낸다. 게다가, 보다 낮은 전력 소비로 동일한 휘도를 발휘하는, 현저히 향상된 전력 효율은 또한 작동 수명이 향상되도록 한다.
| 실시예 | EML | 최대 효율 (cd/A) |
1000 cd/m2 에서의 전압 (V) | CIE |
| 실시예 26 (비교예) |
호스트 H 도판트 D1 |
7.9 | 6.6 | x = 0.17; y = 0.31 |
| 실시예 27 | 실시예 1 에 따른 호스트 도판트 D1 |
8.2 | 5.3 | x = 0.16; y = 0.28 |
| 실시예 28 | 실시예 2 에 따른 호스트 도판트 D1 |
8.3 | 5.2 | x = 0.16; y = 0.29 |
| 실시예 29 | 실시예 3 에 따른 호스트 도판트 D1 |
8.2 | 5.3 | x = 0.16; y = 0.29 |
| 실시예 30 | 실시예 4 에 따른 호스트 도판트 D1 |
8.0 | 5.4 | x = 0.16; y = 0.30 |
| 실시예 31 | 실시예 5 에 따른 호스트 도판트 D1 |
8.5 | 5.0 | x = 0.16; y = 0.28 |
| 실시예 32 | 실시예 6 에 따른 호스트 도판트 D1 |
8.6 | 4.9 | x = 0.16; y = 0.29 |
| 실시예 33 | 실시예 7 에 따른 호스트 도판트 D1 |
8.7 | 4.7 | x = 0.15; y = 0.27 |
| 실시예 34 | 실시예 8 에 따른 호스트 도판트 D1 |
8.5 | 4.9 | x = 0.16; y = 0.28 |
| 실시예 35 | 실시예 9 에 따른 호스트 도판트 D1 |
8.3 | 5.0 | x = 0.17; y = 0.29 |
| 실시예 36 | 실시예 10 에 따른 호스트 도판트 D1 |
8.4 | 5.1 | x = 0.16; y = 0.29 |
| 실시예 37 | 실시예 11 에 따른 호스트 도판트 D1 |
8.7 | 5.4 | x = 0.15; y = 0.27 |
| 실시예 38 | 실시예 12 에 따른 호스트 도판트 D1 |
8.6 | 5.5 | x = 0.16; y = 0.28 |
| 실시예 39 | 실시예 13 에 따른 호스트 도판트 D1 |
7.9 | 5.3 | x = 0.16; y = 0.29 |
실시예
40:
실시예
5 내지 8 에 따른 호스트 물질 또는 호스트 H, 및
실시예
14 및 15 에 따른 발광체를 포함하는
OLED 의
제조
다양한 OLED 에 대한 결과를 하기 실시예 41 내지 51 에 제시하였다. 보다 양호한 비교를 위해, (발광층을 제외한) 사용된 기본 구조 및 물질은 실시예에서 동일하였다. 하기 구조를 갖는 OLED 를 전술한 일반 방법과 유사하게 제조하였다:
정공-주입층 (HIL): 20 nm PEDOT (물로부터 스핀 코팅됨; H.C. Starck, Goslar, Germany; 폴리(3,4-에틸렌디옥시-2,5-티오펜))
정공-수송층 (HTL): 30 nm 4,4',4"-트리스(N-1-나프틸-N-페닐아미노)트리페닐아민 (NaphDATA 로 약칭, SynTec 사제)
정공-수송층 (HTL): 30 nm NPB (N-나프틸-N-페닐-4,4'-디아미노비페닐)
발광층 (EML): 5 % 의 실시예 14 또는 15 에 따른 도판트로 도핑된, 실시예 5, 6, 7, 8 에 따른 호스트 물질 30 nm 층 (표 참조); 또는 도판트로서 WO 06/000388 에 따라 합성되고 증착된 5% 의 트리스[4-(2,2-디페닐비닐)페닐]아민 (D1 로 약칭)으로 도핑된, 또는 도판트로서 JP 06001973 에 따라 합성되고 증착된 5 % 의 1,4-비스(4-디(3-메틸페닐)아미노스티릴)벤젠 (D2 로 약칭)으로 도핑된, 호스트 물질로서의 9,10-비스(1-나프틸안트라센) (H 로 약칭) (비교예)
전자 전도체 (ETC): 20 nm AlQ3 (SynTec 사제, 트리스(퀴놀리네이토)알루미늄(III))
캐소드: 1 nm LiF, 상부의 150 nm Al
이러한 OLED 는 표준 방법으로 특징화되고; 이를 위해, 전류/전압/휘도 특징선 (IUL 특징선)으로부터 계산되는, 휘도 함수로서의 전계발광 스펙트럼, 효율 (cd/A 로 측정됨), 전력 효율 (lm/W 으로 측정됨)을 측정하였다.
표 2 는 일부 OLED (실시예 41 내지 51)에 대한 결과를 나타낸다. 비교예의 호스트 물질은 9,10-비스(1-나프틸)안트라센 (위 참조)이고, 비교예에 사용된 도판트는 D1 (위 참조) 및 D2 였다.
표 2 의 실시예로부터 알 수 있듯이, 본 발명에 따른 호스트 물질을 포함하는 OLED 는 필적할 만한 색상 배위 및 향상된 수명을 나타냄과 동시에 현저히 향상된 효율을 나타낸다.
또한, 구조적으로 유사하나 4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일기로 치환되지 않는 도판트 (D2)에 비해, 본 발명의 실시예 15 에 따른 도판트의 열 안정성이 상당히 향상되었음을 이 시점에서 다시 지적한다. 이러한 향상된 안정성은 특히 공업 용도에서 매우 중요한데, 공업 용도에서의 도판트는 고온에서 수일 내지 수주의 작동수명을 가져야하기 때문이다.
| 실시예 | EML | 최대 효율 (cd/A) |
1000 cd/m2 에서의 전압 (V) | CIE |
| 실시예 41 (비교예) |
호스트 H 도판트 D |
7.9 | 6.6 | x = 0.17; y = 0.31 |
| 실시예 42 | 호스트 H 실시예 14 에 따른 도판트 |
9.8 | 5.1 | x = 0.19; y = 0.31 |
| 실시예 43 | 호스트 H 실시예 15 에 따른 도판트 |
12.3 | 5.0 | x = 0.21; y = 0.33 |
| 실시예 44 | 실시예 5 에 따른 호스트 실시예 14 에 따른 도판트 |
10.2 | 5.0 | x = 0.17; y = 0.31 |
| 실시예 45 | 실시예 6 에 따른 호스트 실시예 14 에 따른 도판트 |
10.3 | 4.9 | x = 0.18; y = 0.32 |
| 실시예 46 | 실시예 7 에 따른 호스트 실시예 14 에 따른 도판트 |
9.9 | 5.2 | x = 0.18; y = 0.32 |
| 실시예 47 | 실시예 8 에 따른 호스트 실시예 14 에 따른 도판트 |
10.6 | 4.9 | x = 0.18; y = 0.32 |
| 실시예 48 | 실시예 5 에 따른 호스트 실시예 15 에 따른 도판트 |
13.2 | 5.0 | x = 0.19; y = 0.32 |
| 실시예 49 | 실시예 6 에 따른 호스트 실시예 15 에 따른 도판트 |
13.0 | 4.9 | x = 0.19; y = 0.32 |
| 실시예 50 | 실시예 7 에 따른 호스트 실시예 15 에 따른 도판트 |
12.9 | 5.2 | x = 0.19; y = 0.32 |
| 실시예 51 | 실시예 8 에 따른 호스트 실시예 15 에 따른 도판트 |
12.7 | 4.9 | x = 0.19; y = 0.32 |
실시예
52:
실시예
16 에 따른 정공-전달 물질을 포함한
OLDE
제조
다양한 OLED 에 대한 결과를 하기 실시예 53 및 54 에 제시하였다. 보다 양호한 비교를 위해, (발광층을 제외한) 사용된 기본 구조 및 물질은 실시예에서 동일하였다. 하기 구조를 갖는 OLED 를 전술한 일반 방법과 유사하게 제조하였다:
정공-주입층 (HIL): 20 nm PEDOT (물로부터 스핀 코팅됨; H.C. Starck, Goslar, Germany; 폴리(3,4-에틸렌디옥시-2,5-티오펜))
정공-수송층 (HTL): 실시예 16 에 따른 정공-전달 물질 30 nm 층; 또는 N,N,N',N'-테트라페닐-[1,1'-비페닐]-4,4'-디아민 (TAD 로 약칭됨: Syntec 사제)의 30 nm 층 (비교예)
정공-수송층 (HTL): 30 nm NPB (N-나프틸-N-페닐-4,4'-디아미노비페닐)
발광층 (EML): 5 % 의 실시예 14 에 따른 도판트로 도핑된, 실시예 8 에 따른 호스트 물질 30 nm 층 (표 참조)
전자 전도체 (ETC): 20 nm AlQ3 (SynTec 사제, 트리스(퀴놀리네이토)알루미늄(III))
캐소드: 1 nm LiF, 상부의 150 nm Al
이러한 OLED 는 표준 방법으로 특징화되고; 이를 위해, 전류/전압/휘도 특징선 (IUL 특징선)으로부터 계산되는, 휘도 함수로서의 전계발광 스펙트럼, 효율 (cd/A 로 측정됨), 전력 효율 (lm/W 으로 측정됨)을 측정하였다.
표 3 은 두가지 OLED (실시예 53 내지 54)에 대한 결과를 나타낸다. 표 3 의 실시예로부터 알 수 있듯이, 본 발명의 실시예 16 에 따른 정공-전달 물질을 포함하는 OLED 는 필적할 만한 색상 배위 및 향상된 수명을 나타냄과 동시에 현저히 향상된 효율을 나타낸다.
| 실시예 | HTL | 최대 효율 (cd/A) |
1000 cd/m2 에서의 전압 (V) | CIE |
| 실시예 53 (비교예) |
TAD | 9.0 | 5.6 | x = 0.19; y = 0.33 |
| 실시예 54 | 실시예 16 에 따른 HTL | 10.8 | 4.7 | x = 0.18; y = 0.32 |
실시예
55:
실시예
17, 18 및 19 에 따른 매트릭스 물질 및
실시예
22, 23 및 24 에 따른 발광체를 포함하는
OLED 의
제조
OLED 를 WO 04/93207 에 따른 일반 방법으로 제조하고, 이는 개개의 경우에 특정 환경에 맞게 조정하였다 (예를 들면 최적 효율 또는 색상을 달성하기 위한 층-두께의 변화).
다양한 OLED 의 결과를 여기서 비교하였다. 보다 양호한 비교를 위해, 사용된 물질, 도핑도 및 이의 층 두께와 같은 기본 구조는 실시예 실험에서 동일하였다. 오직 발광체층 내 호스트 물질만을 교환하였고, 상기 실시예는 상이한 삼중항 발광체를 사용하여 실행되었다.
제 1 예는, 발광체층이 매트릭스 물질 CBP 로 이루어지는, 선행 기술에 따른 비교 표준을 기술한다.
또한, 본 발명의 실시예 17, 18 및 19 에 따른 매트릭스 물질로 이루어진 발광체층을 포함하는 OLED 를 기술한다.
하기 구조를 갖는 녹색- 및 적색-발광 OLED 를 전술한 일반 방법과 유사하게 제조하였다:
PEDOT: 60 nm (물로부터 스핀 코팅됨; H.C. Starck 사제; 폴리 [3,4-에틸렌디옥시-2,5-티오펜])
NaphDATA: 20 nm (증착됨; SynTec 사제 NaphDATA; 4,4',4"-트리스(N-1-나프틸-N-페닐아미노)트리페닐아민
S-TAD: 20 nm (증착됨; WO99/12888 에 따라 제조된 S-TAD; 2,2',7,7'-테트라키스(디페닐아미노)스피로비플루오렌)
발광체층: 각각의 경우에 10% 의 E1 (WO 04/085449 에 따라 합성됨) 또는 E2 (US 2003/0068526 에 따라 합성됨)로 도핑된, 실시예 17, 18 또는 19 에 따른 매트릭스 물질 20 nm; 또는 각각의 경우에 10 % 의 실시예 22, 23 또는 24 에 따른 발광체로 도핑된, 실시예 17, 18 또는 19 에 따른 매트릭스 물질 20 nm; 또는 비교예로서, 10% 의 E1 (WO 04/085449 에 따라 합성됨) 또는 E2 (US 2003/0068526 에 따라 합성됨)로 도핑된, 20 nm CBP (증착됨; ALDRICH 사제이고, 추가 정제되고, 최종적으로 2 회 승화된 CBP; 4,4'-비스(N-카르바졸릴)비페닐) (비교 표준)
바소쿠프로인 (BCP: bathocuproin): 10 nm (증착됨; 공급되는 대로 사용된, ABCR 사제 BCP; 2,9-디메틸-4,7-디페닐-1,10-페난트롤린); 모든 실시예에서 사용되지는 않음
AlQ3: 10 nm (증착됨; SynTec 사제 AlQ3; 트리스(퀴놀리놀레이트)알루미늄(III)); 모든 실시예에서 사용되지는 않음
Ba/Al: 캐소드로서 3 nm Ba, 상부의 150 nm Al.
이러한 OLED 는 표준 방법으로 특징화되고; 이를 위해, 전류/전압/휘도 특징선 (IUL 특징선)으로부터 계산되는, 휘도 함수로서의 전계발광 스펙트럼, 효율 (cd/A 로 측정됨), 전력 효율 (lm/W 으로 측정됨), 및 작동수명을 측정하였다. 상기 작동수명은 그 이후에 1,000 cd/m2 의 초기 휘도가 절반으로 떨어지는 시간으로서 정의된다.
개관을 위해, 사용된 삼중항 발광체 및 호스트 물질을 아래에 제시한다:
전계발광
스펙트럼
비교예, 및 본 발명에 따른 매트릭스와 발광체를 포함하는 OLED 모두로부터의 OLED 는 유사한 색상 배위를 나타내었고, 여기서 4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일기를 수반하는 본 발명의 실시예 22, 23 및 24 에 따른 발광체는 약간 단파장쪽으로 이동된 발광을 나타내었다.
효율:
본 발명의 실시예 17, 18 또는 19 에 따른 매트릭스 물질을 사용하여 제조되고, 실시예 22, 23 및 24 에 따른 발광체를 포함하는 OLED 는 선행 기술에 따른 매트릭스 물질에 비해 상당히 양호한 광도 효율 및 양호한 전력 효율 모두를 나타내었다. 이는 특히 전력 효율에 적용되는데, 이는 기술적 관점에서, 본 발명에 따른 매트릭스 물질 사용시의 보다 낮은 작동 전압 때문에 중요한다.
작동수명:
본 발명에 따른 매트릭스 물질 17, 18 및 19, 및 발광체 22, 23 및 24 를 사용하여 수득된 작동수명은 매트릭스 물질 CBP 를 포함한 비교예의 작동 수명을 상당히 초과한다.
층 단순화:
실시예 64, 65 및 66 으로부터 알 수 있는 바와 같이, 본 발명에 따른 매트릭스 물질을 사용하여, 전체적인 전자-광학적 특성 프로파일을 훼손하지 않으면서, 정공-차단층이나 전자-전도층을 포함하지 않는 OLED 를 제조할 수 있다. 이는 제조 면에 있어서 상당한 이점이다.
열 안정성:
실시예 22, 23 및 24 에 따른 발광체는 구조적으로 유사하나 보론산 에스테르기로 치환되지 않은 화합물에 비해 상당히 높은 열 안정성을 갖는다. 이러한 향상된 안정성은 특히 산업적 용도에서 특히 중요한데, 산업적 용도에서의 도판트는 고온에서 수일 내지 수주의 작동수명을 가져야 하기 때문이다.
실시예
76:
실시예
17, 18 및 19 에 따른 전자-수송 물질을 포함한
OLED 의
제조
OLED 를 WO 04/058911 에 따른 일반 방법으로 제조하고, 이는 개개의 경우에 특정 환경에 맞게 조정하였다 (예를 들면 최적 효율 또는 색상을 달성하기 위한 층-두께의 변화).
각종 OLED 에 관한 결과물을 아래 실시예 77 내지 79 에 제시하였다. 보다 양호한 비교를 위해, (전자-수송층을 제외한) 사용된 기본 구조 및 물질은 상기 실시예에서 동일하였다. 하기 구조를 갖는 OLED 를 전술한 일반 방법과 유사하게 제조하였다:
정공-주입층 (HIL): 20 nm PEDOT (물로부터 스핀 코팅됨; H.C. Starck, Goslar, Germany; 폴리(3,4-에틸렌디옥시-2,5-티오펜))
정공-수송층 (HTL): 30 nm 4,4',4"-트리스(N-1-나프틸-N-페닐아미노)트리페닐아민 (NaphDATA 로 약칭, SynTec 사제)
정공-수송층 (HTL): 30 nm NPB (N-나프틸-N-페닐-4,4'-디아미노비페닐)
발광층 (EML): 도판트로서 5 % 의 트리스[4-(2,2-디페닐-비닐)페닐]아민 (D1 로 약칭)으로 도핑되고, 증착된, 호스트 물질로서의 9,10-비스(1-나프틸안트라센) (H 로 약칭) 의 30 nm 도핑층
전자 전도체 (ETC): 실시예 17 또는 18 에 따른 전자 전도체 20 nm, 또는 비교예로서 20 nm AlQ3 (SynTec 사제, 트리스(퀴놀리네이토)알루미늄(III))
캐소드: 1 nm LiF, 상부의 150 nm Al
이러한 OLED 는 표준 방법으로 특징화되고; 이를 위해, 전류/전압/휘도 특징선 (IUL 특징선)으로부터 계산되는, 휘도 함수로서의 전계발광 스펙트럼, 효율 (cd/A 로 측정됨), 전력 효율 (lm/W 으로 측정됨)을 측정하였다.
표 5 는 전자-수송층 (ETL)이 본 발명에 따른 화합물 17 또는 18 로 이루어진 OLED 일부 (실시예 79 및 80)의 결과를 나타낸다. 비교예에서 사용된 비교 물질은 선행 기술에 따른 AlQ3 이었다.
표 5 에서의 실시예 77 내지 79 에서 알 수 있듯이, 본 발명에 따른 실시예 17 및 18 의 전자-수송 물질을 포함한 OLED 장치는 현저하게 낮은 1,000 cd/m2 에서의 작동 전압을 나타내고, 이는 보다 양호한 전력 효율로부터 명백한 것이다.
| 실시예 | ETL | 최대 효율 (cd/A) |
1000 cd/m2 에서의 전압 (V) | CIE |
| 실시예 77 (비교예) |
AlQ3 | 7.9 | 6.6 | x = 0.17; y = 0.31 |
| 실시예 78 | 실시예 17 에 따른 ETL | 8.0 | 5.1 | x = 0.16; y = 0.32 |
| 실시예 79 | 실시예 18 에 따른 ETL | 8.0 | 5.0 | x = 0.16; y = 0.31 |
실시예
80:
실시예
20 및 21 에 따른 발광 물질을 포함한
OLED 의
제조
OLED 를 WO 04/058911 에 따른 일반 방법으로 제조하고, 이는 개개의 경우에 특정 환경에 맞게 조정하였다 (예를 들면 최적 효율 또는 색상을 달성하기 위한 층-두께의 변화).
각종 OLED 에 관한 결과를 아래 실시예 81 및 82 에 제시하였다. 보다 양호한 비교를 위해, (전자-수송층을 제외한) 사용된 기본 구조 및 물질은 상기 실시예에서 동일하였다. 하기 구조를 갖는 OLED 를 전술한 일반 방법과 유사하게 제조하였다:
정공-주입층 (HIL): 20 nm PEDOT (물로부터 스핀 코팅됨; H.C. Starck, Goslar, Germany; 폴리(3,4-에틸렌디옥시-2,5-티오펜))
정공-수송층 (HTL): 30 nm 4,4',4"-트리스(N-1-나프틸-N-페닐아미노)트리페닐아민 (NaphDATA 로 약칭, SynTec 사제)
정공-수송층 (HTL): 30 nm NPB (N-나프틸-N-페닐-4,4'-디아미노비페닐)
발광층 (EML): 5 % 의 실시예 20 또는 21 에 따른 발광 물질로 도핑된, 호스트 물질로서의 9,10-비스(1-나프틸안트라센) (H 로 약칭)의 30 nm 도핑층
전자 전도체 (ETC): 20 nm AlQ3 (SynTec 사제, 트리스(퀴놀리네이토)알루미늄(III))
캐소드: 1 nm LiF, 상부의 150 nm Al
이러한 OLED 는 표준 방법으로 특징화되고; 이를 위해, 전류/전압/휘도 특징선 (IUL 특징선)으로부터 계산되는, 휘도 함수로서의 전계발광 스펙트럼, 효율 (cd/A 로 측정됨), 전력 효율 (lm/W 으로 측정됨)을 측정하였다.
표 6 은 발광 물질이 본 발명에 따른 화합물 20 및 21 로 이루어진 OLED 일부 (실시예 81 및 82)의 결과를 나타낸다.
표 6 에서의 실시예 81 내지 82 에서 알 수 있듯이, 본 발명에 따른 실시예 20 및 21 의 발광 물질을 포함한 OLED 장치는 효율적인 녹색 발광을 나타낸다.
| 실시예 | EML | 최대 효율 (cd/A) |
1000 cd/m2 에서의 전압 (V) | CIE |
| 실시예 81 | 실시예 20 에 따른 발광체 | 21.0 | 5.1 | x = 0.27; y = 0.62 |
| 실시예 82 | 실시예 21 에 따른 발광체 | 18.2 | 5.0 | x = 0.24; y = 0.58 |
실시예
83: 승화 온도
아래의 표 7 에서, 앞선 실시예에 기재된 일부 화합물의 승화 온도 (1 × 10-5 mbar 의 압력에서)를 기본 구조는 동일하나 보론산 에스테르로 치환되지 않은 화합물의 승화 온도와 비교하였다. 상응하는 보론산 에스테르의 승화 온도가 모든 경우에서 비치환 화합물의 승화 온도보다 낮은 것을 제시된 실시예로부터 알 수 있다. 이는 산업적으로 상당한 이점인데, 예를 들면 셰도우 마스크와 같은 증착 장치의 온도 민감 부분이 이에 의해 적은 정도로만 가열되기 때문이다.
또한, 비치환 화합물로서 승화 도중 분해되는 화합물 중 일부는, 보론산 에스테르기로 치환되는 경우, 분해되지 않고 승화될 수 있음이 분명하게 제시된다. 이는 산업적으로 상당한 이점이다.
Claims (36)
- 하나 이상의 방향족 보론산 유도체를 포함하는 하나 이상의 유기층을 포함하는 유기 전자 장치로서,붕소 원자가 3치환되고, 보론산 유도체가 고리형 보론산 무수물, 고리형 보론산 이미드, 보론산 에스테르, 티오보론산 에스테르, 보론산 아미드, 보론산 아미도에스테르, 보론산 니트리드 또는 올리고머성 또는 중합체성 보론산 무수물, 보론산 이미드, 보론산 에스테르 또는 티오보론산 에스테르인 것을 특징으로 하는 유기 전자 장치.
- 제 1 항에 있어서, 보론산 유도체가, 유리 전이 온도 Tg 가 70 ℃ 초과인 유리형 필름을 형성하는 것을 특징으로 하는 유기 전자 장치.
- 제 1 항에 있어서, 보론산 유도체가 분자량이 250 g/mol 이상인 것을 특징으로 하는 유기 전자 장치.
- 제 1 항에 있어서, 유기 또는 중합체성 발광 다이오드 (OLED, PLED), 유기 전계효과 트랜지스터 (O-FET), 유기 박막 트랜지스터 (O-TFT), 유기 발광 트랜지스터 (O-LET), 유기 집적 회로 (O-lC), 유기 태양전지 (O-SC), 유기 전계-켄치 (field-quench) 장치 (O-FQD), 유기 발광전지 (LEC), 유기 광-수용체 및 유기 레이저 다이오드 (O-레이저)로 이루어진 군으로부터 선택되는 유기 전자 장치.
- 제 1 항에 있어서, 애노드, 캐소드, 및 형광 또는 인광을 나타내는 하나 이상의 발광층을 포함하는 것을 특징으로 하는 유기 전자 장치.
- 제 5 항에 있어서, 정공-주입층, 정공-수송층, 정공-차단층, 전자-수송층 및/또는 전자-주입층으로부터 선택되는 층이 추가로 존재하는 것을 특징으로 하는 유기 전자 장치.
- 제 1 항에 있어서, 보론산 유도체가 형광 또는 인광 도판트와 조합되어 발광층에 사용되는 것을 특징으로 하는 유기 전자 장치.
- 제 7 항에 있어서, 형광 도판트가 모노스티릴아민, 디스티릴아민, 트리스티릴아민, 테트라스티릴아민 및 아릴아민의 부류로부터 선택되는 것을 특징으로 하는 유기 전자 장치.
- 제 7 항에 있어서, 인광 도판트가, 원자 번호 20 초과 및 84 미만인 원소를 하나 이상 포함하는 금속 착물 부류로부터 선택되는 것을 특징으로 하는 유기 전자 장치.
- 제 1 항에 있어서, 보론산 유도체가 전자-수송층에서 전자-수송 물질로서 순물질로 또는 혼합물로 사용되는 것 및/또는 보론산 유도체가 정공-차단층에서 정공-차단 물질로서 순물질로 또는 혼합물로 사용되는 것을 특징으로 하는 유기 전자 장치.
- 제 1 항에 있어서, 보론산 유도체가 유기 전자 장치 내의 정공-수송층 또는 정공-주입층에서 정공-전달 물질로서 순물질로 또는 혼합물로 사용되는 것을 특징으로 하는 유기 전자 장치.
- 제 1 항에 있어서, 보론산 유도체가 형광 또는 인광 유기 전계발광 장치 내의 발광층에서, 형광 또는 인광 도판트로서 사용되는 것을 특징으로 하는 유기 전자 장치.
- 제 1 항에 있어서, 보론산 유도체가 하기 화학식 (1)의 하부구조를 하나 이상 포함하는 것을 특징으로 하는 유기 전자 장치:[화학식 (1)](식 중, 사용된 기호는 하기와 같음:B1 은 각각의 경우에 3치환되는 붕소 원자를 나타내고;Ar 은, 각각의 경우 동일하거나 또는 상이하게, 방향족 고리의 원자수가 5 내지 40 이고 하나 이상의 라디칼 R1 로 치환될 수 있는 방향족 또는 헤테로방향족 고리계이고;E 는, 각각의 경우 동일하거나 또는 상이하게, 산소, 황 또는 질소 원자 원자이고, 여기에 산소 또는 황인 경우 수소가 아닌 추가 치환기가, 그리고 질소인 경우 2 개의 추가 치환기 (이중 하나 이상이 수소가 아님)가 결합되고;R1 은, 각각의 경우 동일하거나 또는 상이하게, F, Cl, Br, I, CN, 탄소수 1 내지 40 인 직쇄 알킬, 알콕시 또는 티오알콕시쇄, 또는 탄소수 3 내지 40 인 분지형 또는 고리형 알킬, 알콕시 또는 티오알콕시쇄 (이들 각각은 R3 으로 치환될 수 있고, 여기서 하나 이상의 비인접 C 원자는 N-R3, O, S, CO, O-CO-O, CO-O, -CR3=CR3- 또는 -C≡C- 로 대체될 수 있고, 여기서 하나 이상의 H 원자는 F, Cl, Br, I 또는 CN 으로 대체될 수 있음), 또는 탄소수 5 내지 40 인 방향족 또는 헤테로방향족 고리계 (이는 하나 이상의 라디칼 R3 로 치환될 수 있음), 또는 2, 3 또는 4 개의 상기 계의 조합이고; 여기서, 둘 이상의 라디칼 R1 은 함께 단일- 또는 다중고리형, 지방족 또는 방향족 고리계를 또한 형성할 수 있고;R3 은, 각각의 경우 동일하거나 또는 상이하게, H, 또는 탄소수 1 내지 20 의 지방족 또는 방향족 탄화수소 라디칼임).
- 제 13 항에 있어서, 보론산 유도체가 하기 화학식 (2), 화학식 (3) 또는 화학식 (4)의 구조를 갖는 것을 특징으로 하는 유기 전자 장치:(식 중, Ar, R1 및 R3 은 제 13 항에 기재된 바와 같은 동일한 의미를 가지고, 추가의 기호 및 지수는 하기와 같음:B 는 각각의 경우에 붕소 원자를 나타내고;X 는, 각각의 경우 동일하거나 또는 상이하게, 기 OR2, SR2, N(R2)2, NHR2 또는 OBAr2 이고;Y 는, 각각의 경우 동일하거나 또는 상이하게, X 이고;Z 는, 각각의 경우 동일하거나 또는 상이하게, O, S, NR2 또는 NH 이고;L 은, 각각의 경우 동일하거나 또는 상이하게, 탄소수 4 내지 60 의 유기기이고, 여기에 4 개 이상의 기 Z 가, 이들이 붕소 원자와 함께 고리형 계를 형성할 수 있는 방식으로 결합되며;R2 는, 각각의 경우 동일하거나 또는 상이하게, 탄소수 1 내지 40 인 직쇄 알킬쇄 또는 탄소수 3 내지 40 인 분지형 또는 고리형 알킬쇄 (이들 각각은 R3 으로 치환될 수 있고, 하나 이상의 비인접 C 원자는 N-R3, O, S, CO, O-CO-O, CO-O, -CR3=CR3- 또는 -C≡C- 로 대체될 수 있고, 단 헤테로원자는 기 X 또는 Y 의 산소 또는 황 또는 질소에 직접 결합되지 않으며, 여기서 하나 이상의 H 원자는 F, Cl, Br, I 또는 CN 으로 대체될 수 있음), 또는 탄소수 5 내지 40 인 방향족 또는 헤테로방향족 고리계 (이는 또한 하나 이상의 라디칼 R3 로 치환될 수 있음), 또는 2, 3 또는 4 개의 상기 계의 조합이고; 여기서 2 이상의 라디칼 R2 는 함께 단일- 또는 다중 고리형, 지방족 또는 방향족 고리계를 또한 형성할 수 있고;n 은, 각각의 경우 동일하거나 또는 상이하게, 1, 2, 3, 4, 5 또는 6 이고;m 은, 각각의 경우 동일하거나 또는 상이하게, 1, 2 또는 3 이고;q 는, 각각의 경우 동일하거나 또는 상이하게, 2, 3, 4, 5 또는 6 임).
- 제 13 항에 있어서, 보론산 유도체가 하기 화학식 (5), 화학식 (6), 화학식 (7) 또는 화학식 (8)의 구조를 갖는 것을 특징으로 하는 유기 전자 장치:(식 중, Ar, R1 및 R3 은 제 13 항에 기재된 바와 같은 의미를 가지고, 추가로:B 는 각각의 경우에 붕소 원자를 나타내고;X 는, 각각의 경우 동일하거나 또는 상이하게, 기 OR2, SR2, N(R2)2, NHR2 또는 OBAr2 이고;Y 는, 각각의 경우 동일하거나 또는 상이하게, X 이고;R2 는, 각각의 경우 동일하거나 또는 상이하게, 탄소수 1 내지 40 인 직쇄 알킬쇄 또는 탄소수 3 내지 40 인 분지형 또는 고리형 알킬쇄 (이들 각각은 R3 으로 치환될 수 있고, 하나 이상의 비인접 C 원자는 N-R3, O, S, CO, O-CO-O, CO-O, -CR3=CR3- 또는 -C≡C- 로 대체될 수 있고, 단 헤테로원자는 기 X 또는 Y 의 산소 또는 황 또는 질소에 직접 결합되지 않으며, 여기서 하나 이상의 H 원자는 F, Cl, Br, I 또는 CN 으로 대체될 수 있음), 또는 탄소수 5 내지 40 인 방향족 또는 헤테로방향족 고리계 (이는 또한 하나 이상의 라디칼 R3 로 치환될 수 있음), 또는 2, 3 또는 4 개의 상기 계의 조합이고; 여기서 2 이상의 라디칼 R2 는 함께 단일- 또는 다중 고리형, 지방족 또는 방향족 고리계를 또한 형성할 수 있고;DCy 는, 각각의 경우 동일하거나 상이하게, 하나 이상의 공여 원자 (이를 통해 고리형 기가 금속에 결합되고, 이는 하나 이상의 치환기 R1 을 가질 수 있음) 를 함유하는 고리형 기이고; 기 DCy 및 CCy 는 하나 이상의 공유 결합을 통해 서로 결합되고;CCy 는, 각각의 경우 동일하거나 상이하게, 탄소 원자 (이를 통해 고리형 기가 금속에 결합되고, 이는 하나 이상의 치환기 R1 을 가질 수 있음)를 함유하는 고리형 기이고;A 는, 각각의 경우 동일하거나 상이하게, 두자리 방식으로 킬레이트화되는 1음이온성 리간드이고;z 는, 각각의 경우 동일하거나 또는 상이하게, 0, 1, 2, 3, 4, 5 또는 6 이고, 단 각 착물에서 하나 이상의 z 는 0 이 아니며, 또한 z 는 상응하는 고리 DCy 또는 CCy 상의 치환가능한 수소 원자의 최대 수보다 큰 수를 취할 수 없음).
- 제 14 항 또는 제 15 항에 있어서, 화학식 (2) 및 (5) 내지 (8)에서의 기호 X 가 OR2 또는 OBAr2 를 나타내는 것을 특징으로 하는 유기 전자 장치.
- 제 16 항에 있어서, 화학식 (2) 및 (5) 내지 (8)에서의 기호 X 가 OR2 를 나타내고 동시에 기호 Y 가 OR2 를 나타내는 것을 특징으로 하는 유기 전자 장치.
- 제 14 항 또는 제 15 항에 있어서, 화학식 (2) 및 (5) 내지 (8)에서의 기호 X 및 Y 가, 각각의 경우에 동일하거나 상이하게, NHR2 또는 N(R2)2 를 나타내는 것, 또는 화학식 (3)에서의 기호 Z 가 O 를 나타내는 것, 또는 화학식 (4)에서의 기호 Z 가 O 또는 NR2 를 나타내는 것을 특징으로 하는 유기 전자 장치.
- 제 13 항 내지 제 15 항 중 어느 한 항에 있어서, 라디칼 R1 이, 각각의 경우에 동일하거나 또는 상이하게, F, 탄소수 1 내지 10 인 직쇄 알킬 또는 알콕시쇄 또는 탄소수 3 내지 10 인 분지형 알킬 또는 알콕시쇄 (이들 각각은 R3 으로 치환될 수 있고, 하나 이상의 비인접 C 원자는 N-R3, O, S, -CR3=CR3- 또는 -C≡C- 로 대체될 수 있고, 하나 이상의 H 원자는 F 또는 CN 으로 대체될 수 있음), 또는 방향족 고리 원자 수가 5 내지 16 인 방향족 또는 헤테로방향족 고리계 (이는 하나 이상의 라디칼 R3 로 치환될 수 있음), 또는 2 또는 3 개의 상기 계의 조합이고; 여기서 2 이상의 라디칼 R1 은 또한 함께 단일- 또는 다중고리형, 지방족 또는 방향족 고리계를 형성할 수 있는 것을 특징으로 하는 유기 전자 장치.
- 제 13 항 내지 제 15 항 중 어느 한 항에 있어서, 라디칼 R2 가, 각각의 경우에 동일하거나 또는 상이하게, 탄소수 1 내지 10 인 직쇄 알킬쇄 또는 탄소수 3 내지 10 인 분지형 또는 고리형 알킬쇄 (여기서 이들 각각은 R3 으로 치환될 수 있고, 하나 이상의 비인접 C 원자는 N-R3, O, S, -CR3=CR3- 또는 -C≡C- 로 대체될 수 있고, 단 헤테로원자는 기 X 또는 Y 의 산소 또는 황 또는 질소에 직접 결합되지 않고, 하나 이상의 H 원자는 F 로 대체될 수 있음), 또는 방향족 고리 원자수가 5 내지 16 인 방향족 또는 헤테로방향족 고리계 (이는 하나 이상의 라디칼 R3 으로 또한 치환될 수 있음), 또는 2 또는 3 개의 상기 계의 조합이고; 여기서, 둘 이상의 라디칼 R2 는 또한 함께 단일- 또는 다중고리형, 지방족 또는 방향족 고리계를 형성하는 것을 특징으로 하는 유기 전자 장치.
- 제 13 항 내지 제 15 항 중 어느 한 항에 있어서, 두 라디칼 R2 가 B, X 및 Y 와 함께 고리계를 형성하는 것을 특징으로 하는 유기 전자 장치.
- 제 13 항 내지 제 15 항 중 어느 한 항에 있어서, 형광 발광체용 호스트 물질로서의 용도와 관련하여, 방향족 고리계 Ar 이 하나 이상의 융합 아릴 또는 헤테로아릴기를 포함하는 것을 특징으로 하는 유기 전자 장치.
- 제 13 항 내지 제 15 항 중 어느 한 항에 있어서, 인광 발광체용 호스트 물질로서의 용도와 관련하여, 바람직한 구현예에서의 방향족 고리계 Ar 이 방향족 고리 원자 수가 5 내지 14 인 아릴 또는 헤테로아릴기만을 포함하는 것을 특징으로 하는 유기 전자 장치.
- 제 13 항 내지 제 15 항 중 어느 한 항에 있어서, 형광 또는 인광 유기 전계발광 장치 또는 기타 유기 전자 장치용 정공-전달 물질로서의 용도와 관련하여, Ar 기가 하나 이상의 트리아릴아민 단위 및/또는 하나 이상의 티오펜 유도체를 포함하는 것을 특징으로 하는 유기 전자 장치.
- 제 13 항 내지 제 15 항 중 어느 한 항에 있어서, 유기 전계발광 장치용 형광 도판트로서의 용도와 관련하여, Ar 기가 하나 이상의 스틸벤 단위 및/또는 하나 이상의 톨란 단위를 함유하는 것을 특징으로 하는 유기 전자 장치.
- 제 1 항, 제 13 항, 제 14 항 또는 제 15 항에 있어서, 하나 이상의 보론산 유도체를 포함하는 하나 이상의 올리고머, 중합체 또는 덴드리머를 포함하는 유기 전자 장치: 단, 상기 올리고머 또는 중합체 내의 보론산 유도체는 주쇄 및/또는 측쇄 내의 하나 이상의 지점에서 결합되며, 올리고머 또는 중합체의 쇄 말단에 결합하지 않거나 단지 말단기는 아님.
- 제 26 항에 있어서, 중합체의 반복 단위가 플루오렌, 스피로비플루오렌, 페닐렌, 카르바졸, 티오펜, 디히드로페난트렌, 인데노플루오렌, 페난트렌, 방향족 케톤, 인광 금속 착물로부터, 또는 복수의 상기 단위들로부터 선택되는 것을 특징으로 하는 유기 전자 장치.
- 하기 화학식 (9) 내지 (26)의 화합물:(여기서, 상기 화합물은 치환기 R1 로 치환될 수 있고,여기서, B 는 각각의 경우에 붕소 원자를 나타내고;X 는, 각각의 경우 동일하거나 또는 상이하게, 기 OR2, SR2, N(R2)2, NHR2 또는 OBAr2 이고;Y 는, 각각의 경우 동일하거나 또는 상이하게, X 이고;R1 은, 각각의 경우 동일하거나 또는 상이하게, F, Cl, Br, I, CN, 탄소수 1 내지 40 인 직쇄 알킬, 알콕시 또는 티오알콕시쇄, 또는 탄소수 3 내지 40 인 분지형 또는 고리형 알킬, 알콕시 또는 티오알콕시쇄 (이들 각각은 R3 으로 치환될 수 있고, 여기서 하나 이상의 비인접 C 원자는 N-R3, O, S, CO, O-CO-O, CO-O, -CR3=CR3- 또는 -C≡C- 로 대체될 수 있고, 여기서 하나 이상의 H 원자는 F, Cl, Br, I 또는 CN 으로 대체될 수 있음), 또는 탄소수 5 내지 40 인 방향족 또는 헤테로방향족 고리계 (이는 하나 이상의 라디칼 R3 로 치환될 수 있음), 또는 2, 3 또는 4 개의 상기 계의 조합이고; 여기서, 둘 이상의 라디칼 R1 은 함께 단일- 또는 다중고리형, 지방족 또는 방향족 고리계를 또한 형성할 수 있고;R2 는, 각각의 경우 동일하거나 또는 상이하게, 탄소수 1 내지 40 인 직쇄 알킬쇄 또는 탄소수 3 내지 40 인 분지형 또는 고리형 알킬쇄 (이들 각각은 R3 으로 치환될 수 있고, 하나 이상의 비인접 C 원자는 N-R3, O, S, CO, O-CO-O, CO-O, -CR3=CR3- 또는 -C≡C- 로 대체될 수 있고, 단 헤테로원자는 기 X 또는 Y 의 산소 또는 황 또는 질소에 직접 결합되지 않으며, 여기서 하나 이상의 H 원자는 F, Cl, Br, I 또는 CN 으로 대체될 수 있음), 또는 탄소수 5 내지 40 인 방향족 또는 헤테로방향족 고리계 (이는 또한 하나 이상의 라디칼 R3 로 치환될 수 있음), 또는 2, 3 또는 4 개의 상기 계의 조합이고; 여기서 2 이상의 라디칼 R2 는 함께 단일- 또는 다중 고리형, 지방족 또는 방향족 고리계를 또한 형성할 수 있고;R3 은, 각각의 경우 동일하거나 또는 상이하게, H, 또는 탄소수 1 내지 20 의 지방족 또는 방향족 탄화수소 라디칼이고;Ar 은, 각각의 경우 동일하거나 또는 상이하게, 방향족 고리의 원자수가 5 내지 40 이고 하나 이상의 라디칼 R1 로 치환될 수 있는 방향족 또는 헤테로방향족 고리계이고;단 화학식 (24) 및 (25)에서의 X = OR2 및 Y = OR2 에 관해서 두 개의 라디칼 R2 는 함께 방향족 고리계를 형성하고, 또한:Ar1 은, 각각의 경우 동일하거나 또는 상이하게, 방향족 고리 원자수가 5 내지 40 이고 R1 로 치환될 수 있는 아릴 또는 헤테로아릴기이고;G 는, 각각의 경우 동일하거나 또는 상이하게, C-H, C-R1, C-BXY 또는 N 이고;J 는, 각각의 경우에 동일하거나 또는 상이하게, C-H, C-R1 또는 C-BXY 이고;v 는, 각각의 경우에 동일하거나 또는 상이하게, 0 또는 1 이며;하기의 화합물은 제외됨:
- 하기 화학식 (27), (27a) 및 (28) 의 화합물:[화학식 (27)][화학식 (27a)][화학식 (28)](식 중, Ar1 및 v 는 제 28 항에 기재된 바와 동일한 의미를 가지고, 또한:B 는 각각의 경우에 붕소 원자를 나타내고;X 는, 각각의 경우 동일하거나 또는 상이하게, 기 OR2, SR2, N(R2)2, NHR2 또는 OBAr2 이고;Y 는, 각각의 경우 동일하거나 또는 상이하게, X 이고;Ar 은, 각각의 경우 동일하거나 또는 상이하게, 방향족 고리의 원자수가 5 내지 40 이고 하나 이상의 라디칼 R1 로 치환될 수 있는 방향족 또는 헤테로방향족 고리계이고;R1 은, 각각의 경우 동일하거나 또는 상이하게, F, Cl, Br, I, CN, 탄소수 1 내지 40 인 직쇄 알킬, 알콕시 또는 티오알콕시쇄, 또는 탄소수 3 내지 40 인 분지형 또는 고리형 알킬, 알콕시 또는 티오알콕시쇄 (이들 각각은 R3 으로 치환될 수 있고, 여기서 하나 이상의 비인접 C 원자는 N-R3, O, S, CO, O-CO-O, CO-O, -CR3=CR3- 또는 -C≡C- 로 대체될 수 있고, 여기서 하나 이상의 H 원자는 F, Cl, Br, I 또는 CN 으로 대체될 수 있음), 또는 탄소수 5 내지 40 인 방향족 또는 헤테로방향족 고리계 (이는 하나 이상의 라디칼 R3 로 치환될 수 있음), 또는 2, 3 또는 4 개의 상기 계의 조합이고; 여기서, 둘 이상의 라디칼 R1 은 함께 단일- 또는 다중고리형, 지방족 또는 방향족 고리계를 또한 형성할 수 있고;R2 는, 각각의 경우 동일하거나 또는 상이하게, 탄소수 1 내지 40 인 직쇄 알킬쇄 또는 탄소수 3 내지 40 인 분지형 또는 고리형 알킬쇄 (이들 각각은 R3 으로 치환될 수 있고, 하나 이상의 비인접 C 원자는 N-R3, O, S, CO, O-CO-O, CO-O, -CR3=CR3- 또는 -C≡C- 로 대체될 수 있고, 단 헤테로원자는 기 X 또는 Y 의 산소 또는 황 또는 질소에 직접 결합되지 않으며, 여기서 하나 이상의 H 원자는 F, Cl, Br, I 또는 CN 으로 대체될 수 있음), 또는 탄소수 5 내지 40 인 방향족 또는 헤테로방향족 고리계 (이는 또한 하나 이상의 라디칼 R3 로 치환될 수 있음), 또는 2, 3 또는 4 개의 상기 계의 조합이고; 여기서 2 이상의 라디칼 R2 는 함께 단일- 또는 다중 고리형, 지방족 또는 방향족 고리계를 또한 형성할 수 있고;R3 은, 각각의 경우 동일하거나 또는 상이하게, H, 또는 탄소수 1 내지 20 의 지방족 또는 방향족 탄화수소 라디칼이고;Ar2 는, 각각의 경우 동일하거나 또는 상이하게, 방향족 고리 원자수가 9 내지 20 이고 R1 로 치환될 수 있는 융합 아릴 또는 헤테로아릴기이고;Ar3 은 각각의 경우, 동일하거나 또는 상이하게, 치환기 R1 로 치환될 수 있는 플루오렌 또는 스피로비플루오렌기이고;Q 는, 각각의 경우 동일하거나 또는 상이하게, Ar, O, S, SO, SO2, Se, SeO, SeO2, Te, TeO, TeO2, NAr, PAr, P(=O)Ar, AsAr, As(=O)Ar, SbAr, Sb(=O)Ar, C(R1)2, C=O, Si(R1)2 및 O-BAr-O 로부터 선택되는 2가 단위이고;p 는, 각각의 경우 동일하거나 또는 상이하게, 1, 2, 3, 4, 5 또는 6 이고;s 는 0 또는 1 이고;t 는 1, 2, 3, 4 또는 5 이고;w 는, 각각의 경우 동일하거나 상이하게, 1, 2, 3, 4, 5 또는 6 이며;단, 화학식 (27)에서의 Ar2 는, 모든 p 가 1 이고 동시에 s 가 0 이며 t 가 1 인 각각의 경우에, 나프틸이 아니며, 또한 피나콜, 1,2-에탄디올, 2,2-디메틸-1,3-프로판디올, 2,3-부탄디올 및 이소프로판올로 형성된 화학식 (28)의 보론산 에스테르는 본 발명에서 제외됨).
- 하기 화학식 (29), (29a) 및 (29b)의 화합물:[화학식 (29)][화학식 (29a)][화학식 (29b)](여기서, v 는 제 28 항에 기재된 바와 동일한 의미를 가지고,B 는 각각의 경우에 붕소 원자를 나타내고;X 는, 각각의 경우 동일하거나 또는 상이하게, 기 OR2, SR2, N(R2)2, NHR2 또는 OBAr2 이고;Y 는, 각각의 경우 동일하거나 또는 상이하게, X 이고;Ar 은, 각각의 경우 동일하거나 또는 상이하게, 방향족 고리의 원자수가 5 내지 40 이고 하나 이상의 라디칼 R1 로 치환될 수 있는 방향족 또는 헤테로방향족 고리계이고;R1 은, 각각의 경우 동일하거나 또는 상이하게, F, Cl, Br, I, CN, 탄소수 1 내지 40 인 직쇄 알킬, 알콕시 또는 티오알콕시쇄, 또는 탄소수 3 내지 40 인 분지형 또는 고리형 알킬, 알콕시 또는 티오알콕시쇄 (이들 각각은 R3 으로 치환될 수 있고, 여기서 하나 이상의 비인접 C 원자는 N-R3, O, S, CO, O-CO-O, CO-O, -CR3=CR3- 또는 -C≡C- 로 대체될 수 있고, 여기서 하나 이상의 H 원자는 F, Cl, Br, I 또는 CN 으로 대체될 수 있음), 또는 탄소수 5 내지 40 인 방향족 또는 헤테로방향족 고리계 (이는 하나 이상의 라디칼 R3 로 치환될 수 있음), 또는 2, 3 또는 4 개의 상기 계의 조합이고; 여기서, 둘 이상의 라디칼 R1 은 함께 단일- 또는 다중고리형, 지방족 또는 방향족 고리계를 또한 형성할 수 있고;R2 는, 각각의 경우 동일하거나 또는 상이하게, 탄소수 1 내지 40 인 직쇄 알킬쇄 또는 탄소수 3 내지 40 인 분지형 또는 고리형 알킬쇄 (이들 각각은 R3 으로 치환될 수 있고, 하나 이상의 비인접 C 원자는 N-R3, O, S, CO, O-CO-O, CO-O, -CR3=CR3- 또는 -C≡C- 로 대체될 수 있고, 단 헤테로원자는 기 X 또는 Y 의 산소 또는 황 또는 질소에 직접 결합되지 않으며, 여기서 하나 이상의 H 원자는 F, Cl, Br, I 또는 CN 으로 대체될 수 있음), 또는 탄소수 5 내지 40 인 방향족 또는 헤테로방향족 고리계 (이는 또한 하나 이상의 라디칼 R3 로 치환될 수 있음), 또는 2, 3 또는 4 개의 상기 계의 조합이고; 여기서 2 이상의 라디칼 R2 는 함께 단일- 또는 다중 고리형, 지방족 또는 방향족 고리계를 또한 형성할 수 있고;R3 은, 각각의 경우 동일하거나 또는 상이하게, H, 또는 탄소수 1 내지 20 의 지방족 또는 방향족 탄화수소 라디칼이고;a 는, 각각의 경우에 동일하거나 또는 상이하게, 1, 2 또는 3 을 나타내며, 단, 화학식 (29)의 구조는 피나콜, 글리콜 및/또는 1,3-프로판디올의 보론산 에스테르는 아님).
- 하기 화학식 (30) 내지 (33)의 화합물:(식 중,B 는 각각의 경우에 붕소 원자를 나타내고;X 는, 각각의 경우 동일하거나 또는 상이하게, 기 OR2, SR2, N(R2)2, NHR2 또는 OBAr2 이고;Y 는, 각각의 경우 동일하거나 또는 상이하게, X 이고;Z 는, 각각의 경우 동일하거나 또는 상이하게, O, S, NR2 또는 NH 이고;Ar 은, 각각의 경우 동일하거나 또는 상이하게, 방향족 고리의 원자수가 5 내지 40 이고 하나 이상의 라디칼 R1 로 치환될 수 있는 방향족 또는 헤테로방향족 고리계이고;R1 은, 각각의 경우 동일하거나 또는 상이하게, F, Cl, Br, I, CN, 탄소수 1 내지 40 인 직쇄 알킬, 알콕시 또는 티오알콕시쇄, 또는 탄소수 3 내지 40 인 분지형 또는 고리형 알킬, 알콕시 또는 티오알콕시쇄 (이들 각각은 R3 으로 치환될 수 있고, 여기서 하나 이상의 비인접 C 원자는 N-R3, O, S, CO, O-CO-O, CO-O, -CR3=CR3- 또는 -C≡C- 로 대체될 수 있고, 여기서 하나 이상의 H 원자는 F, Cl, Br, I 또는 CN 으로 대체될 수 있음), 또는 탄소수 5 내지 40 인 방향족 또는 헤테로방향족 고리계 (이는 하나 이상의 라디칼 R3 로 치환될 수 있음), 또는 2, 3 또는 4 개의 상기 계의 조합이고; 여기서, 둘 이상의 라디칼 R1 은 함께 단일- 또는 다중고리형, 지방족 또는 방향족 고리계를 또한 형성할 수 있고;R2 는, 각각의 경우 동일하거나 또는 상이하게, 탄소수 1 내지 40 인 직쇄 알킬쇄 또는 탄소수 3 내지 40 인 분지형 또는 고리형 알킬쇄 (이들 각각은 R3 으로 치환될 수 있고, 하나 이상의 비인접 C 원자는 N-R3, O, S, CO, O-CO-O, CO-O, -CR3=CR3- 또는 -C≡C- 로 대체될 수 있고, 단 헤테로원자는 기 X 또는 Y 의 산소 또는 황 또는 질소에 직접 결합되지 않으며, 여기서 하나 이상의 H 원자는 F, Cl, Br, I 또는 CN 으로 대체될 수 있음), 또는 탄소수 5 내지 40 인 방향족 또는 헤테로방향족 고리계 (이는 또한 하나 이상의 라디칼 R3 로 치환될 수 있음), 또는 2, 3 또는 4 개의 상기 계의 조합이고; 여기서 2 이상의 라디칼 R2 는 함께 단일- 또는 다중 고리형, 지방족 또는 방향족 고리계를 또한 형성할 수 있고;R3 은, 각각의 경우 동일하거나 또는 상이하게, H, 또는 탄소수 1 내지 20 의 지방족 또는 방향족 탄화수소 라디칼이고; 또한DCy 는, 각각의 경우 동일하거나 또는 상이하게, 하나 이상의 공여 원자 (이를 통해 고리형 기가 금속에 결합되고 이는 하나 이상의 치환기 R1 을 가질 수 있음) 를 포함하는 고리형기이고; 기 DCy 와 CCy 는 하나 이상의 공유 결합을 통해 서로 결합되고;CCy 는, 각각의 경우 동일하거나 또는 상이하게, 탄소 원자 (이를 통해 고리형기가 금속에 결합되고, 이는 하나 이상의 치환기 R1 을 가질 수 있음)를 포함하는 고리형기이고;A 는, 각각의 경우 동일하거나 또는 상이하게, 2자리 방식으로 킬레이트화되는 1음이온성 리간드이고;z 는, 각각의 경우 동일하거나 또는 상이하게, 0, 1, 2, 3, 4, 5 또는 6 이고, 단 각 착물에서 하나 이상의 z 가 0 이 아니고, 또한 z 는 상응하는 고리 DCy 또는 CCy 상의 치환가능한 수소 원자의 최대 수보다 큰 수를 가질 수 없음).
- 제 28 항 내지 제 31 항 중 어느 한 항에 있어서, 올리고알코올, 올리고아민 또는 올리고아미노알코올과의 반응을 통해 수득되는 화합물이 이량체, 삼량체, 사량체, 올리고머 또는 중합체인 것을 특징으로 하는 화합물.
- 하나 이상의 방향족 보론산 유도체를 포함하는 올리고머, 중합체 및 덴드리머: 단 상기 중합체 및 올리고머 내의 방향족 보론산 유도체가 주쇄 및/또는 측쇄 내의 하나 이상의 지점에서 결합되고, 중합체의 쇄 말단에 결합하지 않거나 또는 단지 말단기는 아님.
- 삭제
- 삭제
- 삭제
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP05009643 | 2005-05-03 | ||
| EP05009643.7 | 2005-05-03 | ||
| PCT/EP2006/003150 WO2006117052A1 (de) | 2005-05-03 | 2006-04-06 | Organische elektrolumineszenzvorrichtung und in deren herstellung verwendete boronsäure- und borinsäure-derivate |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20080012337A KR20080012337A (ko) | 2008-02-11 |
| KR101289923B1 true KR101289923B1 (ko) | 2013-07-25 |
Family
ID=34936062
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020077028263A KR101289923B1 (ko) | 2005-05-03 | 2006-04-06 | 유기 전계발광 장치 및 그에 사용되는 붕산 및 보린산유도체 |
Country Status (7)
| Country | Link |
|---|---|
| US (3) | US8674141B2 (ko) |
| EP (1) | EP1888706B1 (ko) |
| JP (1) | JP5242380B2 (ko) |
| KR (1) | KR101289923B1 (ko) |
| CN (2) | CN101171320B (ko) |
| TW (1) | TW200710198A (ko) |
| WO (1) | WO2006117052A1 (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11626564B2 (en) | 2019-10-21 | 2023-04-11 | Samsung Display Co., Ltd. | Organic electroluminescence device and organometallic compound for organic electroluminescence device |
Families Citing this family (485)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101289923B1 (ko) * | 2005-05-03 | 2013-07-25 | 메르크 파텐트 게엠베하 | 유기 전계발광 장치 및 그에 사용되는 붕산 및 보린산유도체 |
| DE102005058557A1 (de) | 2005-12-08 | 2007-06-14 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| JP5093879B2 (ja) * | 2006-03-20 | 2012-12-12 | 国立大学法人京都大学 | ピレン系有機化合物、トランジスタ材料及び発光トランジスタ素子 |
| DE102006013802A1 (de) | 2006-03-24 | 2007-09-27 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102006031990A1 (de) | 2006-07-11 | 2008-01-17 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102006039423A1 (de) * | 2006-08-23 | 2008-02-28 | Werner, Johannes | Halbleitende Polyaddukte mit kolumnarer Struktur |
| JP5374908B2 (ja) * | 2007-04-27 | 2013-12-25 | 住友化学株式会社 | ピレン系高分子化合物及びそれを用いてなる発光素子 |
| DE102007024850A1 (de) | 2007-05-29 | 2008-12-04 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102007031261A1 (de) | 2007-07-05 | 2009-01-08 | Universtität Regensburg | Lumineszierende Metallkomplexe mit sperrigen Hilfsliganden |
| CN103107284A (zh) | 2007-12-28 | 2013-05-15 | 出光兴产株式会社 | 芳胺衍生物及使用该芳胺衍生物的有机电致发光元件 |
| DE102008013691A1 (de) * | 2008-03-11 | 2009-09-17 | Merck Patent Gmbh | Verwendung von Zusammensetzungen neutraler Übergangsmetallkomplexe in opto-elektronischen Bauelementen |
| DE102008018670A1 (de) | 2008-04-14 | 2009-10-15 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008027005A1 (de) | 2008-06-05 | 2009-12-10 | Merck Patent Gmbh | Organische elektronische Vorrichtung enthaltend Metallkomplexe |
| DE102008033563A1 (de) | 2008-07-17 | 2010-01-21 | Merck Patent Gmbh | Komplexe mit kleinen Singulett-Triplett-Energie-Abständen zur Verwendung in opto-elektronischen Bauteilen (Singulett-Harvesting-Effekt) |
| DE102008035413A1 (de) | 2008-07-29 | 2010-02-04 | Merck Patent Gmbh | Verbindungen für organische elektronische Vorrichtungen |
| DE102008036247A1 (de) | 2008-08-04 | 2010-02-11 | Merck Patent Gmbh | Elektronische Vorrichtungen enthaltend Metallkomplexe |
| DE102008036982A1 (de) | 2008-08-08 | 2010-02-11 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| WO2010027583A1 (en) * | 2008-09-03 | 2010-03-11 | Universal Display Corporation | Phosphorescent materials |
| DE102008048336A1 (de) | 2008-09-22 | 2010-03-25 | Merck Patent Gmbh | Einkernige neutrale Kupfer(I)-Komplexe und deren Verwendung zur Herstellung von optoelektronischen Bauelementen |
| DE102008050841B4 (de) | 2008-10-08 | 2019-08-01 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008054141A1 (de) | 2008-10-31 | 2010-05-06 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2010054730A1 (de) | 2008-11-11 | 2010-05-20 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtungen |
| DE102009022858A1 (de) | 2009-05-27 | 2011-12-15 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtungen |
| DE102008057050B4 (de) * | 2008-11-13 | 2021-06-02 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008063490B4 (de) | 2008-12-17 | 2023-06-15 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung und Verfahren zum Einstellen des Farbortes einer weiß emittierenden Elektrolumineszenzvorrichtung |
| DE102008063470A1 (de) | 2008-12-17 | 2010-07-01 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| DE102009005288A1 (de) | 2009-01-20 | 2010-07-22 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009005289B4 (de) | 2009-01-20 | 2023-06-22 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen, Verfahren zu deren Herstellung und elektronische Vorrichtungen, enthaltend diese |
| DE102009005290A1 (de) | 2009-01-20 | 2010-07-22 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| DE102009005746A1 (de) | 2009-01-23 | 2010-07-29 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009007038A1 (de) | 2009-02-02 | 2010-08-05 | Merck Patent Gmbh | Metallkomplexe |
| DE102009009277B4 (de) | 2009-02-17 | 2023-12-07 | Merck Patent Gmbh | Organische elektronische Vorrichtung, Verfahren zu deren Herstellung und Verwendung von Verbindungen |
| DE102009011223A1 (de) | 2009-03-02 | 2010-09-23 | Merck Patent Gmbh | Metallkomplexe |
| DE102009012346B4 (de) | 2009-03-09 | 2024-02-15 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung und Verfahren zu deren Herstellung |
| DE102009013041A1 (de) | 2009-03-13 | 2010-09-16 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009017064A1 (de) | 2009-04-09 | 2010-10-14 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| WO2010122810A1 (ja) | 2009-04-24 | 2010-10-28 | 出光興産株式会社 | 芳香族アミン誘導体及びそれを用いた有機エレクトロルミネッセンス素子 |
| US8586203B2 (en) * | 2009-05-20 | 2013-11-19 | Universal Display Corporation | Metal complexes with boron-nitrogen heterocycle containing ligands |
| DE102009023154A1 (de) | 2009-05-29 | 2011-06-16 | Merck Patent Gmbh | Zusammensetzung, enthaltend mindestens eine Emitterverbindung und mindestens ein Polymer mit konjugationsunterbrechenden Einheiten |
| DE102009023155A1 (de) | 2009-05-29 | 2010-12-02 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| CN102421858A (zh) | 2009-06-22 | 2012-04-18 | 默克专利有限公司 | 导电制剂 |
| DE102009030847A1 (de) * | 2009-06-26 | 2010-12-30 | Merck Patent Gmbh | Polymere enthaltend substituierte Anthracenyleinheiten, Blends enthaltend diese Polymere sowie Vorrichtungen enthaltend diese Polymere oder Blends |
| DE102009031021A1 (de) | 2009-06-30 | 2011-01-05 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009032922A1 (de) | 2009-07-14 | 2011-01-20 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| KR101314383B1 (ko) * | 2009-07-15 | 2013-10-04 | 주식회사 엘지화학 | 신규한 화합물 및 이를 이용한 유기 전자 소자 |
| DE102009033371A1 (de) | 2009-07-16 | 2011-05-12 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102009034625A1 (de) | 2009-07-27 | 2011-02-03 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2011015265A2 (en) | 2009-08-04 | 2011-02-10 | Merck Patent Gmbh | Electronic devices comprising multi cyclic hydrocarbons |
| DE102009041414A1 (de) | 2009-09-16 | 2011-03-17 | Merck Patent Gmbh | Metallkomplexe |
| DE102009053645A1 (de) | 2009-11-17 | 2011-05-19 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtung |
| WO2011032686A1 (de) | 2009-09-16 | 2011-03-24 | Merck Patent Gmbh | Formulierungen zur herstellung von elektronischen vorrichtungen |
| DE102009053644B4 (de) | 2009-11-17 | 2019-07-04 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009041289A1 (de) | 2009-09-16 | 2011-03-17 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| DE102009042680A1 (de) | 2009-09-23 | 2011-03-24 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| DE102009042693A1 (de) | 2009-09-23 | 2011-03-24 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102009048791A1 (de) | 2009-10-08 | 2011-04-14 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009049587A1 (de) | 2009-10-16 | 2011-04-21 | Merck Patent Gmbh | Metallkomplexe |
| DE102009053191A1 (de) | 2009-11-06 | 2011-05-12 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102009052428A1 (de) | 2009-11-10 | 2011-05-12 | Merck Patent Gmbh | Verbindung für elektronische Vorrichtungen |
| DE102009053382A1 (de) | 2009-11-14 | 2011-05-19 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102009053836A1 (de) | 2009-11-18 | 2011-05-26 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009057167A1 (de) | 2009-12-05 | 2011-06-09 | Merck Patent Gmbh | Elektronische Vorrichtung enthaltend Metallkomplexe |
| EP2517275B1 (en) | 2009-12-22 | 2018-11-07 | Merck Patent GmbH | Formulations comprising phase-separated functional materials |
| JP5897472B2 (ja) | 2009-12-22 | 2016-03-30 | メルク パテント ゲーエムベーハー | エレクトロルミネセンス機能性界面活性剤 |
| EP2517278B1 (en) | 2009-12-22 | 2019-07-17 | Merck Patent GmbH | Electroluminescent formulations |
| EP2517274B1 (en) | 2009-12-23 | 2017-05-24 | Merck Patent GmbH | Compositions comprising polymeric binders |
| KR20120123361A (ko) | 2009-12-23 | 2012-11-08 | 메르크 파텐트 게엠베하 | 유기 반도성 화합물을 포함하는 조성물 |
| DE102010004803A1 (de) | 2010-01-16 | 2011-07-21 | Merck Patent GmbH, 64293 | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102010005697A1 (de) | 2010-01-25 | 2011-07-28 | Merck Patent GmbH, 64293 | Verbindungen für elektronische Vorrichtungen |
| JPWO2011099232A1 (ja) * | 2010-02-12 | 2013-06-13 | 嶋田 豊司 | ハロゲノ芳香族化合物の製造方法 |
| DE102010009193B4 (de) | 2010-02-24 | 2022-05-19 | MERCK Patent Gesellschaft mit beschränkter Haftung | Zusammensetzung enthaltend Fluor-Fluor Assoziate, Verfahren zu deren Herstellung, deren Verwendung sowie organische elektronische Vorrichtung diese enthaltend |
| DE102010009903A1 (de) | 2010-03-02 | 2011-09-08 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| DE102010010481A1 (de) | 2010-03-06 | 2011-09-08 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| DE102010010631A1 (de) | 2010-03-09 | 2011-09-15 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| JP2013522816A (ja) | 2010-03-11 | 2013-06-13 | メルク パテント ゲーエムベーハー | 発光ファイバー |
| EP2544765A1 (en) | 2010-03-11 | 2013-01-16 | Merck Patent GmbH | Fibers in therapy and cosmetics |
| CN102812573B (zh) | 2010-03-23 | 2015-09-30 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| DE102010012738A1 (de) | 2010-03-25 | 2011-09-29 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102010013068A1 (de) | 2010-03-26 | 2011-09-29 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| EP2559079B1 (en) | 2010-04-12 | 2020-04-01 | Merck Patent GmbH | Composition and method for preparation of organic electronic devices |
| EP2559078A1 (en) | 2010-04-12 | 2013-02-20 | Merck Patent GmbH | Composition having improved performance |
| DE102010014933A1 (de) | 2010-04-14 | 2011-10-20 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102010018321A1 (de) | 2010-04-27 | 2011-10-27 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| WO2011137922A1 (de) | 2010-05-03 | 2011-11-10 | Merck Patent Gmbh | Formulierungen und elektronische vorrichtungen |
| DE102010019306B4 (de) | 2010-05-04 | 2021-05-20 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtungen |
| DE102010020044A1 (de) | 2010-05-11 | 2011-11-17 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| DE102010020567A1 (de) | 2010-05-14 | 2011-11-17 | Merck Patent Gmbh | Metallkomplexe |
| EP2576724B1 (en) | 2010-05-27 | 2019-04-24 | Merck Patent GmbH | Method for preparation of organic electronic devices |
| EP2576723B1 (en) | 2010-05-27 | 2017-09-20 | Merck Patent GmbH | Compositions comprising quantum dots |
| CN102939296B (zh) | 2010-06-15 | 2016-02-10 | 默克专利有限公司 | 金属络合物 |
| DE102010024335A1 (de) | 2010-06-18 | 2011-12-22 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| DE102010024542A1 (de) | 2010-06-22 | 2011-12-22 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102010024897A1 (de) | 2010-06-24 | 2011-12-29 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102010027218A1 (de) | 2010-07-15 | 2012-01-19 | Merck Patent Gmbh | Organische Komplexe enthaltend Metalle |
| DE102010027319A1 (de) | 2010-07-16 | 2012-01-19 | Merck Patent Gmbh | Metallkomplexe |
| DE102010027316A1 (de) | 2010-07-16 | 2012-01-19 | Merck Patent Gmbh | Metallkomplexe |
| DE102010027317A1 (de) | 2010-07-16 | 2012-01-19 | Merck Patent Gmbh | Metallkomplexe |
| WO2012013272A1 (en) | 2010-07-26 | 2012-02-02 | Merck Patent Gmbh | Quantum dots and hosts |
| CN103026525B (zh) | 2010-07-26 | 2016-11-09 | 默克专利有限公司 | 在器件中的纳米晶体 |
| JP5968885B2 (ja) | 2010-07-30 | 2016-08-10 | メルク パテント ゲーエムベーハー | 有機エレクトロルミネセンスデバイス |
| DE102010033548A1 (de) | 2010-08-05 | 2012-02-09 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| US9287514B2 (en) | 2010-09-15 | 2016-03-15 | Sumitomo Chemical Company, Limited | Metal complex and device using the metal complex |
| DE102010045405A1 (de) | 2010-09-15 | 2012-03-15 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102010046412B4 (de) | 2010-09-23 | 2022-01-13 | Merck Patent Gmbh | Metall-Ligand Koordinationsverbindungen |
| DE102010046512A1 (de) | 2010-09-24 | 2012-03-29 | Merck Patent Gmbh | Phosphorhaltige Metallkomplexe |
| DE102010048074A1 (de) | 2010-10-09 | 2012-04-12 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102010048607A1 (de) | 2010-10-15 | 2012-04-19 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| DE102010048608A1 (de) | 2010-10-15 | 2012-04-19 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| CN102464794B (zh) * | 2010-11-16 | 2014-05-07 | 海洋王照明科技股份有限公司 | 含苯并三唑基共聚物、其制备方法和应用 |
| US9324954B2 (en) | 2010-11-24 | 2016-04-26 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| DE102010054316A1 (de) | 2010-12-13 | 2012-06-14 | Merck Patent Gmbh | Substituierte Tetraarylbenzole |
| DE102011106849A1 (de) | 2010-12-15 | 2012-06-21 | Merck Patent Gmbh | Verfahren zur Synthese N-N verknüpfter und um die N-N Bindung rotationsgehinderter bis-N-heterocyclische Carbene und deren Einsatz als Liganden für Metallkomplexe |
| DE102010054525A1 (de) | 2010-12-15 | 2012-04-26 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| DE102010055901A1 (de) | 2010-12-23 | 2012-06-28 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| DE102010055902A1 (de) | 2010-12-23 | 2012-06-28 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| EP2663567B1 (de) | 2011-01-13 | 2016-06-01 | Merck Patent GmbH | Verbindungen für organische elektrolumineszenzvorrichtungen |
| DE102012000064A1 (de) | 2011-01-21 | 2012-07-26 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| US8751777B2 (en) | 2011-01-28 | 2014-06-10 | Honeywell International Inc. | Methods and reconfigurable systems to optimize the performance of a condition based health maintenance system |
| DE102011010841A1 (de) | 2011-02-10 | 2012-08-16 | Merck Patent Gmbh | (1,3)-Dioxan-5-on-Verbindungen |
| DE102011011104A1 (de) | 2011-02-12 | 2012-08-16 | Merck Patent Gmbh | Substituierte Dibenzonaphtacene |
| WO2012110178A1 (en) | 2011-02-14 | 2012-08-23 | Merck Patent Gmbh | Device and method for treatment of cells and cell tissue |
| DE102011011539A1 (de) | 2011-02-17 | 2012-08-23 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| EP2688646A1 (en) | 2011-03-24 | 2014-01-29 | Merck Patent GmbH | Organic ionic functional materials |
| US9469667B2 (en) | 2011-04-04 | 2016-10-18 | Merck Patent Gmbh | Metal complexes |
| US9385335B2 (en) | 2011-04-05 | 2016-07-05 | Merck Patent Gmbh | Organic electroluminescent device |
| WO2012139693A1 (de) | 2011-04-13 | 2012-10-18 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| US9876171B2 (en) | 2011-04-13 | 2018-01-23 | Merck Patent Gmbh | Materials for electronic devices |
| JP6215192B2 (ja) | 2011-04-18 | 2017-10-18 | メルク パテント ゲーエムベーハー | 有機エレクトロルミネッセンス素子用材料 |
| EP2699641B1 (de) | 2011-04-18 | 2017-05-17 | Merck Patent GmbH | Verbindungen für elektronische vorrichtungen |
| WO2012149992A1 (de) | 2011-05-04 | 2012-11-08 | Merck Patent Gmbh | Vorrichtung zur aufbewahrung von frischwaren |
| JP6195823B2 (ja) | 2011-05-05 | 2017-09-13 | メルク パテント ゲーエムベーハー | 電子素子のための化合物 |
| WO2012150001A1 (de) | 2011-05-05 | 2012-11-08 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012152366A1 (en) | 2011-05-12 | 2012-11-15 | Merck Patent Gmbh | Organic ionic compounds, compositions and electronic devices |
| DE102012007810A1 (de) | 2011-05-16 | 2012-11-22 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| DE102011102586A1 (de) | 2011-05-27 | 2012-11-29 | Merck Patent Gmbh | Organische elektronische Vorrichtung |
| KR101934135B1 (ko) | 2011-06-03 | 2019-04-05 | 메르크 파텐트 게엠베하 | 유기 전계발광 디바이스 |
| US10103340B2 (en) | 2011-06-03 | 2018-10-16 | Merck Patent Gmbh | Metal complexes |
| US9673402B2 (en) | 2011-06-28 | 2017-06-06 | Merck Patent Gmbh | Platinum metal complexes with divalent groups bridging two ligands |
| EP2737553A1 (en) | 2011-07-25 | 2014-06-04 | Merck Patent GmbH | Copolymers with functionalized side chains |
| CN107814820B (zh) | 2011-07-29 | 2020-08-11 | 默克专利有限公司 | 用于电子器件的化合物 |
| KR101983019B1 (ko) | 2011-08-03 | 2019-05-28 | 메르크 파텐트 게엠베하 | 전자 소자용 물질 |
| WO2013020631A1 (de) | 2011-08-10 | 2013-02-14 | Merck Patent Gmbh | Metallkomplexe |
| DE102012016192A1 (de) | 2011-08-19 | 2013-02-21 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| EP2748878B1 (de) | 2011-08-22 | 2020-04-01 | Merck Patent GmbH | Organische elektrolumineszenzvorrichtung |
| US9353085B2 (en) * | 2011-08-26 | 2016-05-31 | E-Ray Optoelectronics Technology Co., Ltd. | Compound for organic electroluminescent device and organic electroluminescent devices using the same |
| CA2849087A1 (en) | 2011-09-21 | 2013-03-28 | Merck Patent Gmbh | Carbazole derivatives for organic electroluminescent devices |
| CN103858249B (zh) | 2011-10-06 | 2017-10-17 | 默克专利有限公司 | 有机电致发光器件 |
| DE102011116165A1 (de) | 2011-10-14 | 2013-04-18 | Merck Patent Gmbh | Benzodioxepin-3-on-Verbindungen |
| US9515266B2 (en) | 2011-10-20 | 2016-12-06 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| KR102045197B1 (ko) | 2011-10-27 | 2019-11-18 | 메르크 파텐트 게엠베하 | 전자 소자용 물질 |
| DE102011117422A1 (de) | 2011-10-28 | 2013-05-02 | Merck Patent Gmbh | Hyperverzweigte Polymere, Verfahren zu deren Herstellung sowie deren Verwendung in elektronischen Vorrichtungen |
| KR102021162B1 (ko) | 2011-11-01 | 2019-09-11 | 메르크 파텐트 게엠베하 | 유기 전계발광 소자 |
| KR102310368B1 (ko) | 2011-11-17 | 2021-10-07 | 메르크 파텐트 게엠베하 | 스피로디히드로아크리딘 유도체 및 이의 유기 전계발광 소자용 재료로서의 용도 |
| KR101921896B1 (ko) | 2011-12-12 | 2018-11-26 | 메르크 파텐트 게엠베하 | 전자 소자용 화합물 |
| DE102012022880A1 (de) | 2011-12-22 | 2013-06-27 | Merck Patent Gmbh | Elektronische Vorrichtungen enthaltend organische Schichten |
| WO2013097920A1 (en) | 2011-12-27 | 2013-07-04 | Merck Patent Gmbh | Metal complexes comprising 1,2,3-triazoles |
| CN106986858B (zh) | 2012-01-16 | 2019-08-27 | 默克专利有限公司 | 有机金属络合物 |
| CN104081553B (zh) | 2012-01-30 | 2017-07-04 | 默克专利有限公司 | 在纤维上的纳米晶体 |
| KR20220005650A (ko) | 2012-02-14 | 2022-01-13 | 메르크 파텐트 게엠베하 | 유기 전계발광 소자용 스피로비플루오렌 화합물 |
| KR20190136129A (ko) | 2012-03-15 | 2019-12-09 | 메르크 파텐트 게엠베하 | 전자 소자 |
| US9425401B2 (en) | 2012-03-23 | 2016-08-23 | Merck Patent Gmbh | 9,9′-spirobixanthene derivatives for electroluminescent devices |
| KR102082111B1 (ko) | 2012-05-24 | 2020-02-27 | 메르크 파텐트 게엠베하 | 축합 헤테로방향족 고리를 포함하는 금속 착물 |
| DE102012011335A1 (de) | 2012-06-06 | 2013-12-12 | Merck Patent Gmbh | Verbindungen für Organische Elekronische Vorrichtungen |
| DE112013002910T5 (de) | 2012-06-12 | 2015-03-19 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| JP6262226B2 (ja) | 2012-07-10 | 2018-01-17 | メルク パテント ゲーエムベーハー | 有機エレクトロルミネッセンスデバイス用の材料 |
| CN104428392B (zh) | 2012-07-13 | 2017-05-31 | 默克专利有限公司 | 金属络合物 |
| US9768391B2 (en) | 2012-07-23 | 2017-09-19 | Merck Patent Gmbh | Derivatives of 2-diarylaminofluorene and organic electronic compounds containing them |
| US10991892B2 (en) | 2012-07-23 | 2021-04-27 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| EP2875004B1 (de) | 2012-07-23 | 2018-07-18 | Merck Patent GmbH | Fluorene und elektronische vorrichtungen, die sie enthalten |
| JP6382193B2 (ja) | 2012-07-23 | 2018-08-29 | メルク パテント ゲーエムベーハー | 化合物および有機エレクトロルミッセンス素子 |
| EP2882763B1 (de) | 2012-08-07 | 2018-08-22 | Merck Patent GmbH | Metallkomplexe |
| KR102015270B1 (ko) | 2012-08-10 | 2019-08-28 | 메르크 파텐트 게엠베하 | 유기 전계발광 소자용 물질 |
| US9859517B2 (en) | 2012-09-07 | 2018-01-02 | Nitto Denko Corporation | White organic light-emitting diode |
| JP6167105B2 (ja) | 2012-09-12 | 2017-07-19 | 出光興産株式会社 | 新規化合物、有機エレクトロルミネッセンス素子用材料、有機エレクトロルミネッセンス素子および電子機器 |
| JP6239624B2 (ja) | 2012-09-18 | 2017-11-29 | メルク パテント ゲーエムベーハー | 電子素子のための材料 |
| DE112013004610A5 (de) | 2012-09-20 | 2015-06-03 | Merck Patent Gmbh | Metallkomplexe |
| US9287513B2 (en) * | 2012-09-24 | 2016-03-15 | Universal Display Corporation | Organic electroluminescent materials and devices |
| WO2014056567A1 (de) | 2012-10-11 | 2014-04-17 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| DE102012020167A1 (de) | 2012-10-13 | 2014-04-17 | Eberhard Karls Universität Tübingen | Metallkomplexe |
| EP2915199B1 (de) | 2012-10-31 | 2021-03-31 | Merck Patent GmbH | Elektronische vorrichtung |
| DE102012021650A1 (de) | 2012-11-03 | 2014-05-08 | Eberhard Karls Universität Tübingen | Metallkomplexe |
| US9978949B2 (en) | 2012-11-12 | 2018-05-22 | Merck Patent Gmbh | Materials for electronic devices |
| US9695354B2 (en) | 2012-11-20 | 2017-07-04 | Merck Patent Gmbh | Formulation in high-purity solvent for producing electronic devices |
| US10065959B2 (en) | 2012-11-30 | 2018-09-04 | Merck Patent Gmbh | Electronic device |
| JP6367229B2 (ja) | 2013-01-03 | 2018-08-01 | メルク パテント ゲーエムベーハー | 電子素子のための化合物 |
| US20150340627A1 (en) | 2013-01-03 | 2015-11-26 | Merck Patent Gmbh | Materials for electronic devices |
| JP6367230B2 (ja) | 2013-01-03 | 2018-08-01 | メルク パテント ゲーエムベーハー | 電子素子 |
| KR20150119431A (ko) | 2013-02-22 | 2015-10-23 | 이데미쓰 고산 가부시키가이샤 | 안트라센 유도체, 유기 일렉트로 루미네선스 소자용 재료, 유기 일렉트로 루미네선스 소자, 및 전자 기기 |
| DE102013008189A1 (de) | 2013-05-14 | 2014-12-04 | Eberhard Karls Universität Tübingen | Metallkomplexe |
| CN105409022B (zh) | 2013-07-29 | 2018-06-19 | 默克专利有限公司 | 电光器件及其用途 |
| CN105408449B (zh) | 2013-07-30 | 2018-06-29 | 默克专利有限公司 | 用于电子器件的材料 |
| WO2015014434A1 (de) | 2013-07-30 | 2015-02-05 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| CN111848659A (zh) | 2013-10-02 | 2020-10-30 | 默克专利有限公司 | 用于oled中的含硼化合物 |
| CN103554444B (zh) * | 2013-10-21 | 2016-02-24 | 南京邮电大学 | 一种白光聚合物材料及其制备方法与应用 |
| WO2015068987A1 (ko) * | 2013-11-08 | 2015-05-14 | (주)씨에스엘쏠라 | 신규한 유기화합물, 이를 포함하는 유기전계발광소자 및 전자 기기 |
| KR101559428B1 (ko) * | 2013-11-08 | 2015-10-13 | 주식회사 엠비케이 | 신규한 유기화합물, 이를 포함하는 유기전계발광소자 및 전자 기기 |
| US10374170B2 (en) | 2013-12-06 | 2019-08-06 | Merck Patent Gmbh | Substituted oxepines |
| KR20160094430A (ko) | 2013-12-06 | 2016-08-09 | 메르크 파텐트 게엠베하 | 아크릴산 및/또는 메타크릴산 에스테르 단위를 포함하는 폴리머 결합제를 함유하는 조성물 |
| KR20240005971A (ko) | 2013-12-06 | 2024-01-12 | 메르크 파텐트 게엠베하 | 화합물 및 유기 전자 소자 |
| KR101993129B1 (ko) | 2013-12-12 | 2019-06-26 | 메르크 파텐트 게엠베하 | 전자 소자용 물질 |
| JP6542228B2 (ja) | 2013-12-19 | 2019-07-10 | メルク、パテント、ゲゼルシャフト、ミット、ベシュレンクテル、ハフツングMerck Patent GmbH | 複素環式スピロ化合物 |
| JP6252170B2 (ja) * | 2013-12-26 | 2017-12-27 | 東ソー株式会社 | アリールボロン酸アルキレンジオールエステル結晶の製造方法 |
| AU2015201630A1 (en) | 2014-03-31 | 2015-10-15 | Commonwealth Scientific And Industrial Research Organisation | Diamine compounds for phosphorescent diazaborole metal complexes and electroluminescent devices |
| AU2015201628A1 (en) | 2014-03-31 | 2015-10-15 | Commonwealth Scientific And Industrial Research Organisation | Phenylenediamine compounds for phosphorescent diazaborole metal complexes |
| EP3137458B1 (de) | 2014-04-30 | 2019-04-24 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| US10622565B2 (en) | 2014-05-05 | 2020-04-14 | Merck Patent Gmbh | Materials for organic light emitting devices |
| DE102015006708A1 (de) | 2014-06-12 | 2015-12-17 | Merck Patent Gmbh | Metallkomplexe |
| DE102014008722A1 (de) | 2014-06-18 | 2015-12-24 | Merck Patent Gmbh | Zusammensetzungen für elektronische Vorrichtungen |
| WO2015197156A1 (de) | 2014-06-25 | 2015-12-30 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| EP2960315A1 (de) | 2014-06-27 | 2015-12-30 | cynora GmbH | Organische Elektrolumineszenzvorrichtung |
| EP2963044A1 (de) | 2014-06-30 | 2016-01-06 | cynora GmbH | Zweikernige Metall(I)-Komplexe mit tetradentaten Liganden für optoelektronische Anwendungen |
| KR102277659B1 (ko) | 2014-07-03 | 2021-07-15 | 덕산네오룩스 주식회사 | 유기전기 소자용 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| US10903430B2 (en) | 2014-07-21 | 2021-01-26 | Merck Patent Gmbh | Materials for electronic devices |
| KR102314735B1 (ko) * | 2014-07-24 | 2021-10-21 | 삼성디스플레이 주식회사 | 유기 발광 소자 및 이를 포함하는 표시 장치 |
| KR102287341B1 (ko) * | 2014-08-19 | 2021-08-06 | 삼성디스플레이 주식회사 | 유기 발광 소자 및 이를 포함하는 유기 발광 표시 장치 |
| DE102014012818A1 (de) | 2014-08-28 | 2016-03-03 | Eberhard Karls Universität Tübingen | Metallkomplexe |
| WO2016034262A1 (de) | 2014-09-05 | 2016-03-10 | Merck Patent Gmbh | Formulierungen und elektronische vorrichtungen |
| EP3204463B1 (de) | 2014-10-08 | 2019-04-17 | cynora GmbH | Metall-komplexe mit tridentaten liganden für optoelektronische anwendungen |
| CN104447358B (zh) * | 2014-10-28 | 2016-04-13 | 常州大学 | 一种合成n,n′,n″,n″′-四(3-溴苯基)-联苯胺方法 |
| WO2016074755A1 (de) | 2014-11-11 | 2016-05-19 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| US9882151B2 (en) * | 2014-11-14 | 2018-01-30 | Universal Display Corporation | Organic electroluminescent materials and devices |
| EP3221422B1 (de) | 2014-11-18 | 2018-06-13 | cynora GmbH | Kupfer(i)komplexe für optoelektronische anwendungen |
| WO2016091353A1 (de) | 2014-12-12 | 2016-06-16 | Merck Patent Gmbh | Organische verbindungen mit löslichen gruppen |
| EP3241248A1 (de) | 2014-12-30 | 2017-11-08 | Merck Patent GmbH | Formulierungen und elektronische vorrichtungen |
| JP7030519B2 (ja) | 2015-01-30 | 2022-03-07 | メルク パテント ゲーエムベーハー | 低粒子含有量をもつ調合物 |
| WO2016119992A1 (en) | 2015-01-30 | 2016-08-04 | Merck Patent Gmbh | Materials for electronic devices |
| KR102554987B1 (ko) | 2015-02-03 | 2023-07-12 | 메르크 파텐트 게엠베하 | 금속 착물 |
| KR102556584B1 (ko) * | 2015-02-16 | 2023-07-17 | 메르크 파텐트 게엠베하 | 전자 디바이스용 스피로비플루오렌 유도체 계의 재료 |
| US10600966B2 (en) * | 2015-02-27 | 2020-03-24 | Universal Display Corporation | Organic electroluminescent materials and devices |
| JP6800879B2 (ja) | 2015-03-30 | 2020-12-16 | メルク パテント ゲーエムベーハー | シロキサン溶媒を含む有機機能性材料の調合物 |
| CN104725378A (zh) * | 2015-04-01 | 2015-06-24 | 吉林奥来德光电材料股份有限公司 | 有机电致发光材料、其合成方法及其制成的器件 |
| US10147893B2 (en) * | 2015-04-10 | 2018-12-04 | Samsung Electronics Co., Ltd. | Organometallic compound and organic light-emitting device including the same |
| US11208401B2 (en) | 2015-06-10 | 2021-12-28 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| EP3307846B1 (en) | 2015-06-12 | 2019-08-14 | Merck Patent GmbH | Esters containing non-aromatic cycles as solvents for oled formulations |
| WO2017008883A1 (en) | 2015-07-15 | 2017-01-19 | Merck Patent Gmbh | Composition comprising organic semiconducting compounds |
| CN107924999B (zh) | 2015-07-22 | 2022-04-19 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| GB201513037D0 (en) | 2015-07-23 | 2015-09-09 | Merck Patent Gmbh | Phenyl-derived compound for use in organic electronic devices |
| JP6983754B2 (ja) | 2015-07-29 | 2021-12-17 | メルク パテント ゲーエムベーハー | 有機エレクトロルミネッセンス素子のための材料 |
| JP6839697B2 (ja) | 2015-07-30 | 2021-03-10 | メルク、パテント、ゲゼルシャフト、ミット、ベシュレンクテル、ハフツングMerck Patent GmbH | 電子素子のための材料 |
| KR20180039680A (ko) | 2015-08-13 | 2018-04-18 | 메르크 파텐트 게엠베하 | 헥사메틸인단 |
| KR102599157B1 (ko) | 2015-08-14 | 2023-11-06 | 메르크 파텐트 게엠베하 | 유기 전계발광 소자용 페녹사진 유도체 |
| EP3341448B1 (en) | 2015-08-28 | 2020-02-12 | Merck Patent GmbH | Compounds for electronic devices |
| JP2018527733A (ja) | 2015-08-28 | 2018-09-20 | メルク パテント ゲーエムベーハー | エポキシ基含有溶媒を含む有機機能性材料の調合物 |
| DE102015013381A1 (de) | 2015-10-14 | 2017-04-20 | Eberhard Karls Universität Tübingen | Metallkomplexe |
| JP6974315B2 (ja) | 2015-10-27 | 2021-12-01 | メルク パテント ゲーエムベーハー | 有機エレクトロルミネッセンス素子のための材料 |
| WO2017097391A1 (en) | 2015-12-10 | 2017-06-15 | Merck Patent Gmbh | Formulations containing ketones comprising non-aromatic cycles |
| DE102015016016A1 (de) | 2015-12-10 | 2017-06-14 | Eberhard Karls Universität Tübingen | Metallkomplexe |
| CN108369997B (zh) | 2015-12-15 | 2020-03-24 | 默克专利有限公司 | 作为用于有机电子制剂的溶剂的含芳族基团的酯 |
| JP7438661B2 (ja) | 2015-12-16 | 2024-02-27 | メルク パテント ゲーエムベーハー | 固体溶媒を含む調合物 |
| US11407916B2 (en) | 2015-12-16 | 2022-08-09 | Merck Patent Gmbh | Formulations containing a mixture of at least two different solvents |
| US20190040034A1 (en) | 2016-02-05 | 2019-02-07 | Merck Patent Gmbh | Materials for electronic devices |
| EP3417033B1 (en) | 2016-02-17 | 2021-02-24 | Merck Patent GmbH | Formulation of an organic functional material |
| CN108699437A (zh) | 2016-03-03 | 2018-10-23 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| DE102016003104A1 (de) | 2016-03-15 | 2017-09-21 | Merck Patent Gmbh | Behälter umfassend eine Formulierung enthaltend mindestens einen organischen Halbleiter |
| TWI821807B (zh) | 2016-03-17 | 2023-11-11 | 德商麥克專利有限公司 | 具有螺聯茀結構之化合物 |
| TW202340153A (zh) | 2016-04-11 | 2023-10-16 | 德商麥克專利有限公司 | 具有二苯并呋喃及/或二苯并噻吩結構之雜環化合物 |
| KR102385482B1 (ko) | 2016-04-29 | 2022-04-12 | 메르크 파텐트 게엠베하 | 유기 전계발광 소자용 재료 |
| WO2017194435A1 (de) | 2016-05-11 | 2017-11-16 | Merck Patent Gmbh | Zusammensetzungen für elektrochemische zellen |
| TWI731981B (zh) | 2016-06-03 | 2021-07-01 | 德商麥克專利有限公司 | 用於有機電激發光裝置之材料 |
| JP2019523997A (ja) | 2016-06-16 | 2019-08-29 | メルク パテント ゲーエムベーハー | 有機機能材料の調合物 |
| EP3472249B1 (en) | 2016-06-17 | 2022-02-02 | Merck Patent GmbH | Formulation of an organic functional material |
| TW201815998A (zh) | 2016-06-28 | 2018-05-01 | 德商麥克專利有限公司 | 有機功能材料之調配物 |
| JP7034954B2 (ja) | 2016-06-30 | 2022-03-14 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツング | エナンチオマー混合物を分離する方法 |
| TWI745395B (zh) | 2016-07-08 | 2021-11-11 | 德商麥克專利有限公司 | 有機電致發光裝置用之材料 |
| CN106146810B (zh) * | 2016-07-13 | 2018-04-24 | 山西大学 | 一种发射红光的聚合物及其制备方法 |
| CN109415344B (zh) | 2016-07-14 | 2022-06-03 | 默克专利有限公司 | 金属络合物 |
| CN116987124A (zh) | 2016-07-25 | 2023-11-03 | 默克专利有限公司 | 用作有机电致发光器件中的发光体的金属络合物 |
| JP7030780B2 (ja) | 2016-07-25 | 2022-03-07 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツング | 三脚型二座副配位子を含む、二核およびオリゴ核の金属錯体、並びにその電子デバイスにおける使用 |
| CN109563402B (zh) | 2016-08-04 | 2022-07-15 | 默克专利有限公司 | 有机功能材料的制剂 |
| WO2018041769A1 (de) | 2016-08-30 | 2018-03-08 | Merck Patent Gmbh | Bl- und trinukleare metallkomplexe aufgebaut aus zwei miteinander verknüpften tripodalen hexadentaten liganden zur verwendung in elektrolumineszenzvorrichtungen |
| US11447464B2 (en) | 2016-09-14 | 2022-09-20 | Merck Patent Gmbh | Compounds with spirobifluorene-structures |
| JP2019530676A (ja) | 2016-09-14 | 2019-10-24 | メルク パテント ゲーエムベーハー | カルバゾール構造を有する化合物 |
| CN109715642A (zh) | 2016-09-21 | 2019-05-03 | 默克专利有限公司 | 用作有机电致发光器件中的发光体的双核金属络合物 |
| CN109790173B (zh) | 2016-09-30 | 2022-09-06 | 默克专利有限公司 | 具有二氮杂二苯并呋喃或二氮杂二苯并噻吩结构的咔唑 |
| TWI766884B (zh) | 2016-09-30 | 2022-06-11 | 德商麥克專利有限公司 | 具有二氮雜二苯并呋喃或二氮雜二苯并噻吩結構的化合物、其製法及其用途 |
| TWI764942B (zh) | 2016-10-10 | 2022-05-21 | 德商麥克專利有限公司 | 電子裝置 |
| WO2018069197A1 (de) | 2016-10-12 | 2018-04-19 | Merck Patent Gmbh | Metallkomplexe |
| JP7064488B2 (ja) | 2016-10-12 | 2022-05-10 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツング | 二核金属錯体および電子デバイス、特に、前記金属錯体を含んでなる有機エレクトロルミネッセンス素子 |
| JP7023946B2 (ja) | 2016-10-13 | 2022-02-22 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツング | 金属錯体 |
| DE102017008794A1 (de) | 2016-10-17 | 2018-04-19 | Merck Patent Gmbh | Materialien zur Verwendung in elektronischen Vorrichtungen |
| WO2018077769A1 (de) | 2016-10-25 | 2018-05-03 | Merck Patent Gmbh | Metallkomplexe |
| KR102436600B1 (ko) | 2016-10-31 | 2022-08-25 | 메르크 파텐트 게엠베하 | 유기 기능성 재료의 제형 |
| CN109863223B (zh) | 2016-10-31 | 2023-06-20 | 默克专利有限公司 | 有机功能材料的制剂 |
| US11302870B2 (en) | 2016-11-02 | 2022-04-12 | Merck Patent Gmbh | Materials for electronic devices |
| WO2018087020A1 (en) | 2016-11-08 | 2018-05-17 | Merck Patent Gmbh | Compounds for electronic devices |
| KR102474328B1 (ko) | 2016-11-09 | 2022-12-06 | 메르크 파텐트 게엠베하 | 유기 전계발광 소자용 재료 |
| TWI756292B (zh) | 2016-11-14 | 2022-03-01 | 德商麥克專利有限公司 | 具有受體基團與供體基團之化合物 |
| KR102580980B1 (ko) | 2016-11-17 | 2023-09-20 | 메르크 파텐트 게엠베하 | 유기 전계발광 소자용 재료 |
| TW201833118A (zh) | 2016-11-22 | 2018-09-16 | 德商麥克專利有限公司 | 用於電子裝置之材料 |
| WO2018095940A1 (en) | 2016-11-25 | 2018-05-31 | Merck Patent Gmbh | Bisbenzofuran-fused indeno[1,2-b]fluorene derivatives and related compounds as materials for organic electroluminescent devices (oled) |
| CN109963857A (zh) | 2016-11-25 | 2019-07-02 | 默克专利有限公司 | 作为用于有机电致发光器件(oled)的材料的双苯并呋喃稠合的2,8-二氨基茚并[1,2-b]芴衍生物和相关化合物 |
| EP3548467B1 (de) | 2016-11-30 | 2023-06-21 | Merck Patent GmbH | Verbindungen mit valerolaktam-strukturen |
| TW201831468A (zh) | 2016-12-05 | 2018-09-01 | 德商麥克專利有限公司 | 含氮的雜環化合物 |
| US11466021B2 (en) | 2016-12-05 | 2022-10-11 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| EP3548485B1 (de) | 2016-12-05 | 2021-01-20 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| KR102472751B1 (ko) | 2016-12-06 | 2022-11-30 | 메르크 파텐트 게엠베하 | 전자 디바이스의 제조 방법 |
| KR102486614B1 (ko) | 2016-12-13 | 2023-01-09 | 메르크 파텐트 게엠베하 | 유기 기능성 재료의 제형 |
| WO2018114744A1 (en) | 2016-12-20 | 2018-06-28 | Merck Patent Gmbh | A white light emitting solid state light source |
| WO2018114883A1 (de) | 2016-12-22 | 2018-06-28 | Merck Patent Gmbh | Mischungen umfassend mindestens zwei organisch funktionelle verbindungen |
| WO2018114882A1 (de) | 2016-12-22 | 2018-06-28 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2018127465A1 (de) | 2017-01-04 | 2018-07-12 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| EP3573973B1 (de) | 2017-01-25 | 2023-12-06 | Merck Patent GmbH | Carbazolderivate |
| US11407766B2 (en) | 2017-01-30 | 2022-08-09 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| TWI791481B (zh) | 2017-01-30 | 2023-02-11 | 德商麥克專利有限公司 | 形成有機電致發光(el)元件之方法 |
| TWI763772B (zh) | 2017-01-30 | 2022-05-11 | 德商麥克專利有限公司 | 電子裝置之有機元件的形成方法 |
| CN110291064B (zh) | 2017-02-02 | 2023-04-28 | 默克专利有限公司 | 用于电子器件的材料 |
| TW201835075A (zh) | 2017-02-14 | 2018-10-01 | 德商麥克專利有限公司 | 用於有機電致發光裝置之材料 |
| CN117440703A (zh) | 2017-03-01 | 2024-01-23 | 默克专利有限公司 | 有机电致发光器件 |
| US20200055822A1 (en) | 2017-03-02 | 2020-02-20 | Merck Patent Gmbh | Materials for organic electronic devices |
| TW201843143A (zh) | 2017-03-13 | 2018-12-16 | 德商麥克專利有限公司 | 含有芳基胺結構之化合物 |
| JP7155142B2 (ja) | 2017-03-15 | 2022-10-18 | メルク パテント ゲーエムベーハー | 有機エレクトロルミネッセントデバイス用の材料 |
| CN110446703A (zh) | 2017-03-29 | 2019-11-12 | 默克专利有限公司 | 芳族化合物 |
| JP7123967B2 (ja) | 2017-03-31 | 2022-08-23 | メルク パテント ゲーエムベーハー | 有機発光ダイオード(oled)のための印刷方法 |
| JP7200128B2 (ja) | 2017-04-10 | 2023-01-06 | メルク パテント ゲーエムベーハー | 有機機能材料の調合物 |
| CN110520503A (zh) | 2017-04-13 | 2019-11-29 | 默克专利有限公司 | 用于有机电子器件的组合物 |
| EP3615542B1 (de) | 2017-04-25 | 2023-08-23 | Merck Patent GmbH | Verbindungen für elektronische vorrichtungen |
| KR20200003068A (ko) | 2017-05-03 | 2020-01-08 | 메르크 파텐트 게엠베하 | 유기 기능성 재료의 제형 |
| WO2018206537A1 (en) | 2017-05-11 | 2018-11-15 | Merck Patent Gmbh | Carbazole-based bodipys for organic electroluminescent devices |
| US11056656B2 (en) | 2017-05-11 | 2021-07-06 | Merck Patent Gmbh | Organoboron complexes and their use in organic electroluminescent devices |
| US11535619B2 (en) | 2017-05-22 | 2022-12-27 | Merck Patent Gmbh | Hexacyclic heteroaromatic compounds for electronic devices |
| TW201920343A (zh) | 2017-06-21 | 2019-06-01 | 德商麥克專利有限公司 | 電子裝置用材料 |
| KR20200020841A (ko) | 2017-06-23 | 2020-02-26 | 메르크 파텐트 게엠베하 | 유기 전계발광 디바이스용 재료 |
| KR20200022010A (ko) | 2017-06-26 | 2020-03-02 | 메르크 파텐트 게엠베하 | 균질 혼합물 |
| US20200136045A1 (en) | 2017-06-28 | 2020-04-30 | Merck Patent Gmbh | Materials for electronic devices |
| TWI786143B (zh) | 2017-07-03 | 2022-12-11 | 德商麥克專利有限公司 | 有機電致發光裝置及其產製方法 |
| TWI813576B (zh) | 2017-07-03 | 2023-09-01 | 德商麥克專利有限公司 | 具有低含量苯酚類雜質的調配物 |
| WO2019007867A1 (de) | 2017-07-05 | 2019-01-10 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| WO2019007866A1 (de) | 2017-07-05 | 2019-01-10 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| WO2019016184A1 (en) | 2017-07-18 | 2019-01-24 | Merck Patent Gmbh | FORMULATION OF AN ORGANIC FUNCTIONAL MATERIAL |
| TWI776926B (zh) | 2017-07-25 | 2022-09-11 | 德商麥克專利有限公司 | 金屬錯合物 |
| EP3658541A1 (en) | 2017-07-28 | 2020-06-03 | Merck Patent GmbH | Spirobifluorene derivatives for use in electronic devices |
| WO2019048443A1 (de) | 2017-09-08 | 2019-03-14 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| EP3681890B1 (de) | 2017-09-12 | 2021-08-18 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| EP3692043B1 (en) | 2017-10-06 | 2022-11-02 | Merck Patent GmbH | Materials for organic electroluminescent devices |
| CN108675975A (zh) | 2017-10-17 | 2018-10-19 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| EP3700909B1 (de) | 2017-10-24 | 2024-01-24 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| TWI785142B (zh) | 2017-11-14 | 2022-12-01 | 德商麥克專利有限公司 | 用於有機電子裝置之組成物 |
| CN107868018A (zh) * | 2017-11-22 | 2018-04-03 | 遵义医学院 | N,n,n′,n′‑四[4‑(4′‑羧基)联苯基)]‑ 9,10‑蒽二胺合成法 |
| EP3714022B1 (de) | 2017-11-23 | 2023-06-07 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| TWI820057B (zh) | 2017-11-24 | 2023-11-01 | 德商麥克專利有限公司 | 用於有機電致發光裝置的材料 |
| JP2021504347A (ja) | 2017-11-24 | 2021-02-15 | メルク、パテント、ゲゼルシャフト、ミット、ベシュレンクテル、ハフツングMerck Patent GmbH | 有機エレクトロルミネッセンス素子のための材料 |
| CN111406062B (zh) | 2017-12-13 | 2024-01-19 | Udc爱尔兰有限公司 | 金属络合物 |
| EP3724175A1 (en) | 2017-12-15 | 2020-10-21 | Merck Patent GmbH | Substituted aromatic amines for use in organic electroluminescent devices |
| KR20200093653A (ko) | 2017-12-15 | 2020-08-05 | 메르크 파텐트 게엠베하 | 유기 기능성 재료의 제형 |
| TW201938562A (zh) | 2017-12-19 | 2019-10-01 | 德商麥克專利有限公司 | 雜環化合物 |
| CN111479815A (zh) | 2017-12-20 | 2020-07-31 | 默克专利有限公司 | 杂芳族化合物 |
| EP3503241B1 (en) * | 2017-12-22 | 2022-08-24 | Novaled GmbH | Electronic device and method for preparing the same |
| TWI811290B (zh) | 2018-01-25 | 2023-08-11 | 德商麥克專利有限公司 | 用於有機電致發光裝置的材料 |
| KR20200120698A (ko) | 2018-02-13 | 2020-10-21 | 메르크 파텐트 게엠베하 | 금속 착물 |
| CN111712551A (zh) | 2018-02-26 | 2020-09-25 | 默克专利有限公司 | 有机功能材料的制剂 |
| TWI802656B (zh) | 2018-03-06 | 2023-05-21 | 德商麥克專利有限公司 | 用於有機電致發光裝置之材料 |
| TW201938761A (zh) | 2018-03-06 | 2019-10-01 | 德商麥克專利有限公司 | 用於有機電致發光裝置的材料 |
| CN111819167A (zh) | 2018-03-16 | 2020-10-23 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| TWI828664B (zh) | 2018-03-19 | 2024-01-11 | 愛爾蘭商Udc愛爾蘭責任有限公司 | 金屬錯合物 |
| US20220332724A1 (en) | 2018-05-30 | 2022-10-20 | Merck Patent Gmbh | Composition for organic electronic devices |
| CN112219292A (zh) | 2018-06-07 | 2021-01-12 | 默克专利有限公司 | 有机电致发光器件 |
| JP7379389B2 (ja) | 2018-06-15 | 2023-11-14 | メルク パテント ゲーエムベーハー | 有機機能材料の調合物 |
| KR20210031714A (ko) | 2018-07-09 | 2021-03-22 | 메르크 파텐트 게엠베하 | 유기 전계발광 디바이스용 재료 |
| US20220069231A1 (en) | 2018-07-20 | 2022-03-03 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| TWI823993B (zh) | 2018-08-28 | 2023-12-01 | 德商麥克專利有限公司 | 用於有機電致發光裝置之材料 |
| WO2020043646A1 (en) | 2018-08-28 | 2020-03-05 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2020043657A1 (en) | 2018-08-28 | 2020-03-05 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| TWI826522B (zh) | 2018-09-12 | 2023-12-21 | 德商麥克專利有限公司 | 電致發光裝置 |
| TW202030902A (zh) | 2018-09-12 | 2020-08-16 | 德商麥克專利有限公司 | 電致發光裝置 |
| JP7459065B2 (ja) | 2018-09-12 | 2024-04-01 | メルク パテント ゲーエムベーハー | 有機エレクトロルミネッセンスデバイス用の材料 |
| DE102018122708A1 (de) * | 2018-09-17 | 2020-03-19 | Novaled Gmbh | Organische elektronische Vorrichtung, organisches halbleitendes Material und eine Boranverbindung |
| KR20210056432A (ko) | 2018-09-24 | 2021-05-18 | 메르크 파텐트 게엠베하 | 과립형 재료의 제조 방법 |
| KR20210065972A (ko) | 2018-09-27 | 2021-06-04 | 메르크 파텐트 게엠베하 | 입체 장애 함질소 헤테로방향족 화합물의 제조 방법 |
| WO2020064666A1 (de) | 2018-09-27 | 2020-04-02 | Merck Patent Gmbh | Verbindungen, die in einer organischen elektronischen vorrichtung als aktive verbindungen einsetzbar sind |
| CN112930343A (zh) | 2018-10-31 | 2021-06-08 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| US11917906B2 (en) | 2018-11-05 | 2024-02-27 | Merck Patent Gmbh | Compounds that can be used in an organic electronic device |
| KR20210083347A (ko) | 2018-11-06 | 2021-07-06 | 메르크 파텐트 게엠베하 | 전자 디바이스의 유기 소자의 형성 방법 |
| CN112867709A (zh) | 2018-11-06 | 2021-05-28 | 默克专利有限公司 | 作为用于oled的有机电致发光材料的5,6-二苯基-5,6-二氢-二苯并[c,e][1,2]氮杂磷杂苯和6-苯基-6h-二苯并[c,e][1,2]噻嗪-5,5-二氧化物衍生物及类似化合物 |
| US20220006018A1 (en) | 2018-11-14 | 2022-01-06 | Merck Patent Gmbh | Compounds that can be used for producing an organic electronic device |
| EP3880682B1 (de) | 2018-11-15 | 2023-06-14 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| TW202039493A (zh) | 2018-12-19 | 2020-11-01 | 德商麥克專利有限公司 | 用於有機電致發光裝置之材料 |
| WO2020148243A1 (en) | 2019-01-16 | 2020-07-23 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| TW202043247A (zh) | 2019-02-11 | 2020-12-01 | 德商麥克專利有限公司 | 金屬錯合物 |
| JP2022520284A (ja) | 2019-02-18 | 2022-03-29 | メルク パテント ゲーエムベーハー | 有機電子デバイス用の組成物 |
| US20220127286A1 (en) | 2019-03-04 | 2022-04-28 | Merck Patent Gmbh | Ligands for nano-sized materials |
| CN113544132A (zh) | 2019-03-12 | 2021-10-22 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| KR20210141593A (ko) | 2019-03-20 | 2021-11-23 | 메르크 파텐트 게엠베하 | 유기 전계 발광 디바이스용 재료 |
| EP3947372A1 (de) | 2019-03-25 | 2022-02-09 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| TW202104238A (zh) | 2019-04-11 | 2021-02-01 | 德商麥克專利有限公司 | 用於有機電致發光裝置之材料 |
| KR20210151905A (ko) | 2019-04-15 | 2021-12-14 | 메르크 파텐트 게엠베하 | 금속 착물 |
| JP2022546334A (ja) | 2019-08-26 | 2022-11-04 | メルク パテント ゲーエムベーハー | 有機エレクトロルミネッセントデバイスのための材料 |
| CN110372863B (zh) * | 2019-08-31 | 2022-11-01 | 湘潭大学 | 一种具有聚集诱导发光性质的聚酰亚胺及其制备方法 |
| KR20220056223A (ko) | 2019-09-02 | 2022-05-04 | 메르크 파텐트 게엠베하 | 유기 전계발광 디바이스용 재료 |
| TW202122558A (zh) | 2019-09-03 | 2021-06-16 | 德商麥克專利有限公司 | 用於有機電致發光裝置之材料 |
| WO2021052924A1 (en) | 2019-09-16 | 2021-03-25 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| US20230006143A1 (en) | 2019-09-19 | 2023-01-05 | Merck Patent Gmbh | Mixture of two host materials, and organic electroluminescent device comprising same |
| EP4031549A1 (de) | 2019-09-20 | 2022-07-27 | Merck Patent GmbH | Peri-kondensierte heterozyklische verbindungen als materialien für elektronische vorrichtungen |
| EP4049325A1 (en) | 2019-10-22 | 2022-08-31 | Merck Patent GmbH | Materials for organic electroluminescent devices |
| EP4048675A1 (de) | 2019-10-25 | 2022-08-31 | Merck Patent GmbH | In einer organischen elektronischen vorrichtung einsetzbare verbindungen |
| EP4055642A1 (en) | 2019-11-04 | 2022-09-14 | Merck Patent GmbH | Materials for organic electroluminescent devices |
| TW202134252A (zh) | 2019-11-12 | 2021-09-16 | 德商麥克專利有限公司 | 有機電致發光裝置用材料 |
| TW202136181A (zh) | 2019-12-04 | 2021-10-01 | 德商麥克專利有限公司 | 有機電致發光裝置用的材料 |
| WO2021110720A1 (de) | 2019-12-04 | 2021-06-10 | Merck Patent Gmbh | Metallkomplexe |
| TW202136471A (zh) | 2019-12-17 | 2021-10-01 | 德商麥克專利有限公司 | 有機電致發光裝置用的材料 |
| KR20220116013A (ko) | 2019-12-18 | 2022-08-19 | 메르크 파텐트 게엠베하 | 유기 전계 발광 디바이스용 방향족 화합물 |
| US20230104248A1 (en) | 2019-12-19 | 2023-04-06 | Merck Patent Gmbh | Polycyclic compounds for organic electroluminescent devices |
| CN111019098B (zh) * | 2019-12-23 | 2023-05-16 | 黑龙江大学 | 含联苯结构的三苯胺类苯并噻二唑聚合物及其制备方法和应用 |
| CN110951054A (zh) * | 2019-12-23 | 2020-04-03 | 黑龙江大学 | 含联苯结构的三苯胺类异靛蓝聚合物及其制备方法和应用 |
| US11917900B2 (en) * | 2020-01-28 | 2024-02-27 | Universal Display Corporation | Organic electroluminescent materials and devices |
| WO2021151922A1 (de) | 2020-01-29 | 2021-08-05 | Merck Patent Gmbh | Benzimidazol-derivate |
| EP4110884A1 (de) | 2020-02-25 | 2023-01-04 | Merck Patent GmbH | Verwendung von heterocyclischen verbindungen in einer organischen elektronischen vorrichtung |
| WO2021175706A1 (de) | 2020-03-02 | 2021-09-10 | Merck Patent Gmbh | Verwendung von sulfonverbindungen in einer organischen elektronischen vorrichtung |
| TW202200529A (zh) | 2020-03-13 | 2022-01-01 | 德商麥克專利有限公司 | 有機電致發光裝置 |
| WO2021185829A1 (de) | 2020-03-17 | 2021-09-23 | Merck Patent Gmbh | Heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| KR20220154774A (ko) | 2020-03-17 | 2022-11-22 | 메르크 파텐트 게엠베하 | 유기 전계 발광 디바이스용 헤테로방향족 화합물 |
| EP4126884A1 (en) | 2020-03-23 | 2023-02-08 | Merck Patent GmbH | Materials for organic electroluminescent devices |
| EP4126868A1 (de) | 2020-03-24 | 2023-02-08 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| DE102020108402B4 (de) | 2020-03-26 | 2021-11-11 | Novaled Gmbh | Organische elektronische Vorrichtung, organisches halbleitendes Material, eine Trioxatriborinanverbindung und deren Verwendung |
| CN115335383A (zh) | 2020-03-26 | 2022-11-11 | 默克专利有限公司 | 用于有机电致发光器件的环状化合物 |
| KR20220162156A (ko) | 2020-04-02 | 2022-12-07 | 메르크 파텐트 게엠베하 | 유기 전계 발광 디바이스용 재료 |
| EP4132939B1 (de) | 2020-04-06 | 2024-01-31 | Merck Patent GmbH | Polycyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021213918A1 (en) | 2020-04-21 | 2021-10-28 | Merck Patent Gmbh | Formulation of an organic functional material |
| KR20230002860A (ko) | 2020-04-21 | 2023-01-05 | 메르크 파텐트 게엠베하 | 유기 기능성 재료를 포함하는 에멀젼 |
| TW202208594A (zh) | 2020-05-27 | 2022-03-01 | 德商麥克專利有限公司 | 電子裝置用材料 |
| WO2021254984A1 (de) | 2020-06-18 | 2021-12-23 | Merck Patent Gmbh | Indenoazanaphthaline |
| CN115867426A (zh) | 2020-06-23 | 2023-03-28 | 默克专利有限公司 | 生产混合物的方法 |
| EP4172164A1 (de) | 2020-06-29 | 2023-05-03 | Merck Patent GmbH | Heteroaromatische verbindungen für organische elektrolumineszenzvorrichtungen |
| JP2023530915A (ja) | 2020-06-29 | 2023-07-20 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツング | 有機エレクトロルミネッセンス素子のためのヘテロ環式化合物 |
| KR20230043106A (ko) | 2020-07-22 | 2023-03-30 | 메르크 파텐트 게엠베하 | 유기 전계 발광 디바이스용 재료 |
| WO2022017998A1 (en) | 2020-07-22 | 2022-01-27 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| KR20230049107A (ko) | 2020-08-06 | 2023-04-12 | 메르크 파텐트 게엠베하 | 유기 전계 발광 디바이스용 재료 |
| US20230271989A1 (en) | 2020-08-13 | 2023-08-31 | Merck Patent Gmbh | Metal complexes |
| US20240090327A1 (en) | 2020-08-18 | 2024-03-14 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| EP4200289A1 (de) | 2020-08-19 | 2023-06-28 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| EP4163315A4 (en) | 2020-09-02 | 2023-11-22 | Lg Chem, Ltd. | POLYMER, COATING COMPOSITION COMPRISING SAME, AND ORGANIC ELECTROLUMINESCENT ELEMENT USING SAME |
| WO2022058504A1 (en) | 2020-09-18 | 2022-03-24 | Cynora Gmbh | Organic electroluminescent device |
| US20230331754A1 (en) | 2020-09-29 | 2023-10-19 | Merck Patent Gmbh | Mononuclear tripodal hexadentate iridium complexes for use in oleds |
| TW202229215A (zh) | 2020-09-30 | 2022-08-01 | 德商麥克專利有限公司 | 用於有機電致發光裝置功能層之結構化的化合物 |
| TW202222748A (zh) | 2020-09-30 | 2022-06-16 | 德商麥克專利有限公司 | 用於結構化有機電致發光裝置的功能層之化合物 |
| EP4229145A1 (de) | 2020-10-16 | 2023-08-23 | Merck Patent GmbH | Verbindungen mit heteroatomen für organische elektrolumineszenzvorrichtungen |
| WO2022079068A1 (de) | 2020-10-16 | 2022-04-21 | Merck Patent Gmbh | Heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| EP4244228A1 (de) | 2020-11-10 | 2023-09-20 | Merck Patent GmbH | Schwefelhaltige verbindungen für organische elektrolumineszenzvorrichtungen |
| KR20230116023A (ko) | 2020-12-02 | 2023-08-03 | 메르크 파텐트 게엠베하 | 유기 전계 발광 디바이스용 복소환 화합물 |
| JP2023552761A (ja) | 2020-12-08 | 2023-12-19 | メルク パテント ゲーエムベーハー | インク系およびインクジェット印刷のための方法 |
| WO2022122682A2 (de) | 2020-12-10 | 2022-06-16 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| EP4263746A1 (de) | 2020-12-18 | 2023-10-25 | Merck Patent GmbH | Stickstoffhaltige heteroaromaten für organische elektrolumineszenzvorrichtungen |
| EP4263543A1 (de) | 2020-12-18 | 2023-10-25 | Merck Patent GmbH | Stickstoffhaltige verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022129116A1 (de) | 2020-12-18 | 2022-06-23 | Merck Patent Gmbh | Indolo[3.2.1-jk]carbazole-6-carbonitril-derivate als blau fluoreszierende emitter zur verwendung in oleds |
| WO2022148717A1 (de) | 2021-01-05 | 2022-07-14 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2022157343A1 (de) | 2021-01-25 | 2022-07-28 | Merck Patent Gmbh | Stickstoffhaltige verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022184601A1 (de) | 2021-03-02 | 2022-09-09 | Merck Patent Gmbh | Verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022194799A1 (de) | 2021-03-18 | 2022-09-22 | Merck Patent Gmbh | Heteroaromatische verbindungen für organische elektrolumineszenzvorrichtungen |
| TW202309243A (zh) | 2021-04-09 | 2023-03-01 | 德商麥克專利有限公司 | 用於有機電致發光裝置之材料 |
| TW202309242A (zh) | 2021-04-09 | 2023-03-01 | 德商麥克專利有限公司 | 用於有機電致發光裝置之材料 |
| EP4320648A1 (en) | 2021-04-09 | 2024-02-14 | Merck Patent GmbH | Materials for organic electroluminescent devices |
| EP4079742A1 (de) | 2021-04-14 | 2022-10-26 | Merck Patent GmbH | Metallkomplexe |
| KR20240000559A (ko) | 2021-04-23 | 2024-01-02 | 메르크 파텐트 게엠베하 | 유기 기능성 재료의 포뮬레이션 |
| KR20240005782A (ko) | 2021-04-29 | 2024-01-12 | 메르크 파텐트 게엠베하 | 유기 전계 발광 디바이스용 재료 |
| WO2022229298A1 (de) | 2021-04-29 | 2022-11-03 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| KR20240005791A (ko) | 2021-04-30 | 2024-01-12 | 메르크 파텐트 게엠베하 | 유기 전계 발광 디바이스용 질소 함유 복소환 화합물 |
| EP4340969A1 (de) | 2021-05-21 | 2024-03-27 | Merck Patent GmbH | Verfahren zur kontinuierlichen aufreinigung von mindestens einem funktionalen material und vorrichtung zur kontinuierlichen aufreinigung von mindestens einem funktionalen material |
| WO2022200638A1 (de) | 2021-07-06 | 2022-09-29 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| CN117730638A (zh) | 2021-08-02 | 2024-03-19 | 默克专利有限公司 | 通过组合油墨进行的印刷方法 |
| WO2023041454A1 (de) | 2021-09-14 | 2023-03-23 | Merck Patent Gmbh | Borhaltige, heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023052314A1 (de) | 2021-09-28 | 2023-04-06 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023052313A1 (de) | 2021-09-28 | 2023-04-06 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023052272A1 (de) | 2021-09-28 | 2023-04-06 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023052275A1 (de) | 2021-09-28 | 2023-04-06 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| TW202349760A (zh) | 2021-10-05 | 2023-12-16 | 德商麥克專利有限公司 | 電子裝置之有機元件的形成方法 |
| WO2023072799A1 (de) | 2021-10-27 | 2023-05-04 | Merck Patent Gmbh | Bor- und stickstoffhaltige, heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023094412A1 (de) | 2021-11-25 | 2023-06-01 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023099543A1 (en) | 2021-11-30 | 2023-06-08 | Merck Patent Gmbh | Compounds having fluorene structures |
| WO2023110742A1 (de) | 2021-12-13 | 2023-06-22 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2023117837A1 (de) | 2021-12-21 | 2023-06-29 | Merck Patent Gmbh | Verfahren zur herstellung von deuterierten organischen verbindungen |
| WO2023117835A1 (en) | 2021-12-21 | 2023-06-29 | Merck Patent Gmbh | Electronic devices |
| WO2023117836A1 (en) | 2021-12-21 | 2023-06-29 | Merck Patent Gmbh | Electronic devices |
| WO2023152063A1 (de) | 2022-02-09 | 2023-08-17 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2023152346A1 (de) | 2022-02-14 | 2023-08-17 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023161167A1 (de) | 2022-02-23 | 2023-08-31 | Merck Patent Gmbh | Stickstoffhaltige heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2023161168A1 (de) | 2022-02-23 | 2023-08-31 | Merck Patent Gmbh | Aromatische heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2023213837A1 (de) | 2022-05-06 | 2023-11-09 | Merck Patent Gmbh | Cyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023222559A1 (de) | 2022-05-18 | 2023-11-23 | Merck Patent Gmbh | Verfahren zur herstellung von deuterierten organischen verbindungen |
| WO2023237458A1 (en) | 2022-06-07 | 2023-12-14 | Merck Patent Gmbh | Method of printing a functional layer of an electronic device by combining inks |
| WO2023247338A1 (de) | 2022-06-20 | 2023-12-28 | Merck Patent Gmbh | Organische heterocyclen für photoelektrische vorrichtungen |
| WO2023247345A1 (de) | 2022-06-20 | 2023-12-28 | Merck Patent Gmbh | Heterocyclen für photoelektrische vorrichtungen |
| WO2024013004A1 (de) | 2022-07-11 | 2024-01-18 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| EP4311849A1 (en) | 2022-07-27 | 2024-01-31 | UDC Ireland Limited | Metal complexes |
| CN115449085B (zh) * | 2022-09-12 | 2023-08-08 | 西北工业大学 | 核壳型超支化聚硼硅氧烷红色延迟荧光材料及制备方法 |
| WO2024061948A1 (de) | 2022-09-22 | 2024-03-28 | Merck Patent Gmbh | Stickstoffenthaltende heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2024061942A1 (de) | 2022-09-22 | 2024-03-28 | Merck Patent Gmbh | Stickstoffenthaltende verbindungen für organische elektrolumineszenzvorrichtungen |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2003229275A (ja) * | 2001-11-27 | 2003-08-15 | Semiconductor Energy Lab Co Ltd | 発光素子 |
Family Cites Families (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE19829947A1 (de) * | 1998-07-04 | 2000-01-05 | Bayer Ag | Elektrolumineszierende Anordnungen mit Bor-Chelaten |
| DE19858594A1 (de) * | 1998-12-18 | 2000-06-21 | Merck Patent Gmbh | Verfahren zur Herstellung von Cyanbenzolboronsäuren |
| EP1142895B1 (en) | 1999-01-08 | 2006-07-05 | Chisso Corporation | Borane derivatives and organic electroluminescents |
| US20020019527A1 (en) * | 2000-04-27 | 2002-02-14 | Wei-Bo Wang | Substituted phenyl farnesyltransferase inhibitors |
| EP1345948B1 (de) * | 2000-12-22 | 2004-10-13 | Covion Organic Semiconductors GmbH | Bor- oder aluminium-spiroverbindungen, deren verwendung in elekronikindustrie |
| EP1217668A1 (de) * | 2000-12-22 | 2002-06-26 | Covion Organic Semiconductors GmbH | Verwendung von Bor- und Aluminium-Verbindungen in Elektronik-Bauteilen |
| JP4804662B2 (ja) * | 2001-07-11 | 2011-11-02 | コニカミノルタホールディングス株式会社 | 有機エレクトロルミネッセンス素子及び表示装置 |
| US6835469B2 (en) * | 2001-10-17 | 2004-12-28 | The University Of Southern California | Phosphorescent compounds and devices comprising the same |
| US6734457B2 (en) * | 2001-11-27 | 2004-05-11 | Semiconductor Energy Laboratory Co., Ltd. | Light emitting device |
| DE10159946A1 (de) * | 2001-12-06 | 2003-06-18 | Covion Organic Semiconductors | Prozess zur Herstellung von Aryl-Aryl gekoppelten Verbindungen |
| CN1556803A (zh) * | 2002-05-07 | 2004-12-22 | LG��ѧ��ʽ���� | 用于电致发光的新有机化合物和使用该化合物的有机电致发光器件 |
| US7005432B2 (en) * | 2002-05-16 | 2006-02-28 | Hoffman-La Roche Inc. | Substituted imidazol-pyridazine derivatives |
| GB0226010D0 (en) * | 2002-11-08 | 2002-12-18 | Cambridge Display Tech Ltd | Polymers for use in organic electroluminescent devices |
| US20060051611A1 (en) * | 2002-12-13 | 2006-03-09 | Koninklijke Philips Electronics N.V. | Electroluminescent device |
| JP2004189705A (ja) | 2002-12-13 | 2004-07-08 | Koei Chem Co Ltd | アリールボラン化合物の製造法 |
| TWI278503B (en) * | 2003-01-21 | 2007-04-11 | Univ Nat Taiwan | Pyrimidine containing di-fluorene oligomer for OLED |
| KR101289923B1 (ko) * | 2005-05-03 | 2013-07-25 | 메르크 파텐트 게엠베하 | 유기 전계발광 장치 및 그에 사용되는 붕산 및 보린산유도체 |
-
2006
- 2006-04-06 KR KR1020077028263A patent/KR101289923B1/ko active IP Right Grant
- 2006-04-06 JP JP2008509318A patent/JP5242380B2/ja active Active
- 2006-04-06 CN CN2006800154018A patent/CN101171320B/zh active Active
- 2006-04-06 CN CN201310075065.8A patent/CN103204996B/zh active Active
- 2006-04-06 EP EP06724095.2A patent/EP1888706B1/de active Active
- 2006-04-06 US US11/912,939 patent/US8674141B2/en active Active
- 2006-04-06 WO PCT/EP2006/003150 patent/WO2006117052A1/de not_active Application Discontinuation
- 2006-04-28 TW TW095115339A patent/TW200710198A/zh unknown
-
2014
- 2014-01-14 US US14/154,323 patent/US9403849B2/en active Active
-
2016
- 2016-06-20 US US15/186,723 patent/US9871213B2/en active Active
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2003229275A (ja) * | 2001-11-27 | 2003-08-15 | Semiconductor Energy Lab Co Ltd | 発光素子 |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11626564B2 (en) | 2019-10-21 | 2023-04-11 | Samsung Display Co., Ltd. | Organic electroluminescence device and organometallic compound for organic electroluminescence device |
Also Published As
| Publication number | Publication date |
|---|---|
| EP1888706B1 (de) | 2017-03-01 |
| WO2006117052A1 (de) | 2006-11-09 |
| US20090134384A1 (en) | 2009-05-28 |
| US8674141B2 (en) | 2014-03-18 |
| US9403849B2 (en) | 2016-08-02 |
| US20150322091A1 (en) | 2015-11-12 |
| JP2008541417A (ja) | 2008-11-20 |
| EP1888706A1 (de) | 2008-02-20 |
| TW200710198A (en) | 2007-03-16 |
| KR20080012337A (ko) | 2008-02-11 |
| US9871213B2 (en) | 2018-01-16 |
| JP5242380B2 (ja) | 2013-07-24 |
| US20160322570A1 (en) | 2016-11-03 |
| CN101171320A (zh) | 2008-04-30 |
| CN101171320B (zh) | 2013-04-10 |
| CN103204996B (zh) | 2015-12-09 |
| CN103204996A (zh) | 2013-07-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101289923B1 (ko) | 유기 전계발광 장치 및 그에 사용되는 붕산 및 보린산유도체 | |
| JP5389646B2 (ja) | 有機エレクトロルミネセンス素子のための新規な材料 | |
| JP5653902B2 (ja) | 有機エレクトロルミネセント素子用フッ素誘導体 | |
| KR102193244B1 (ko) | 유기 전계 발광 소자용 신규 물질 | |
| TWI428424B (zh) | 用於有機電子裝置之化合物類 | |
| KR101352300B1 (ko) | 유기 전계발광 장치 | |
| JP5420249B2 (ja) | 有機エレクトロルミネセンス素子のための新規な材料 | |
| KR101959575B1 (ko) | 유기 전계발광 디바이스용 트리페닐렌계 재료 | |
| KR101307587B1 (ko) | 유기 전계발광 장치 | |
| KR101739241B1 (ko) | 신규한 유기 전계발광 소자용 재료 | |
| KR101884027B1 (ko) | 유기 전계발광 디바이스용 재료 | |
| KR101465270B1 (ko) | 유기 전계발광 소자용 물질 | |
| JP2015007050A (ja) | 有機エレクトロルミネセンス素子のための新規な材料 | |
| KR20070038110A (ko) | 유기 전계발광 장치 | |
| TWI532708B (zh) | 電子裝置用化合物 | |
| JP2015212261A (ja) | 有機エレクトロルミネセンス素子のための新規な材料 | |
| JP2008536320A (ja) | 有機エレクトロルミネッセンス素子 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| FPAY | Annual fee payment |
Payment date: 20160617 Year of fee payment: 4 |
|
| FPAY | Annual fee payment |
Payment date: 20170616 Year of fee payment: 5 |
|
| FPAY | Annual fee payment |
Payment date: 20180628 Year of fee payment: 6 |