JP6018567B2 - 腎不全血液治療、特に、家庭血液透析のための治療予測および最適化 - Google Patents
腎不全血液治療、特に、家庭血液透析のための治療予測および最適化 Download PDFInfo
- Publication number
- JP6018567B2 JP6018567B2 JP2013505190A JP2013505190A JP6018567B2 JP 6018567 B2 JP6018567 B2 JP 6018567B2 JP 2013505190 A JP2013505190 A JP 2013505190A JP 2013505190 A JP2013505190 A JP 2013505190A JP 6018567 B2 JP6018567 B2 JP 6018567B2
- Authority
- JP
- Japan
- Prior art keywords
- treatment
- patient
- solute
- renal failure
- case
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M1/00—Suction or pumping devices for medical purposes; Devices for carrying-off, for treatment of, or for carrying-over, body-liquids; Drainage systems
- A61M1/14—Dialysis systems; Artificial kidneys; Blood oxygenators ; Reciprocating systems for treatment of body fluids, e.g. single needle systems for hemofiltration or pheresis
- A61M1/16—Dialysis systems; Artificial kidneys; Blood oxygenators ; Reciprocating systems for treatment of body fluids, e.g. single needle systems for hemofiltration or pheresis with membranes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M1/00—Suction or pumping devices for medical purposes; Devices for carrying-off, for treatment of, or for carrying-over, body-liquids; Drainage systems
- A61M1/14—Dialysis systems; Artificial kidneys; Blood oxygenators ; Reciprocating systems for treatment of body fluids, e.g. single needle systems for hemofiltration or pheresis
- A61M1/16—Dialysis systems; Artificial kidneys; Blood oxygenators ; Reciprocating systems for treatment of body fluids, e.g. single needle systems for hemofiltration or pheresis with membranes
- A61M1/1601—Control or regulation
- A61M1/1613—Profiling or modelling of patient or predicted treatment evolution or outcome
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M1/00—Suction or pumping devices for medical purposes; Devices for carrying-off, for treatment of, or for carrying-over, body-liquids; Drainage systems
- A61M1/14—Dialysis systems; Artificial kidneys; Blood oxygenators ; Reciprocating systems for treatment of body fluids, e.g. single needle systems for hemofiltration or pheresis
- A61M1/16—Dialysis systems; Artificial kidneys; Blood oxygenators ; Reciprocating systems for treatment of body fluids, e.g. single needle systems for hemofiltration or pheresis with membranes
- A61M1/1601—Control or regulation
- A61M1/1619—Sampled collection of used dialysate, i.e. obviating the need for recovery of whole dialysate quantity for post-dialysis analysis
-
- G—PHYSICS
- G16—INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR SPECIFIC APPLICATION FIELDS
- G16H—HEALTHCARE INFORMATICS, i.e. INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR THE HANDLING OR PROCESSING OF MEDICAL OR HEALTHCARE DATA
- G16H20/00—ICT specially adapted for therapies or health-improving plans, e.g. for handling prescriptions, for steering therapy or for monitoring patient compliance
- G16H20/40—ICT specially adapted for therapies or health-improving plans, e.g. for handling prescriptions, for steering therapy or for monitoring patient compliance relating to mechanical, radiation or invasive therapies, e.g. surgery, laser therapy, dialysis or acupuncture
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M2202/00—Special media to be introduced, removed or treated
- A61M2202/04—Liquids
- A61M2202/0496—Urine
- A61M2202/0498—Urea
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M2205/00—General characteristics of the apparatus
- A61M2205/15—Detection of leaks
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M2205/00—General characteristics of the apparatus
- A61M2205/50—General characteristics of the apparatus with microprocessors or computers
- A61M2205/502—User interfaces, e.g. screens or keyboards
- A61M2205/505—Touch-screens; Virtual keyboard or keypads; Virtual buttons; Soft keys; Mouse touches
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M2205/00—General characteristics of the apparatus
- A61M2205/50—General characteristics of the apparatus with microprocessors or computers
- A61M2205/52—General characteristics of the apparatus with microprocessors or computers with memories providing a history of measured variating parameters of apparatus or patient
Description
(項目1)
腎不全血液治療システムであって、
該システムは、
腎不全血液治療機と、
患者のための治療処方であって、該患者は、該患者の血液から溶質を除去するように該腎不全血液治療機によって治療される、治療処方と、
検査治療中に複数回、採取される複数の血液サンプルを含む検査であって、該検査は、該複数回の各々において該溶質の濃度レベルを決定する、検査と、
デバイスであって、該デバイスは、該溶質に対する動態モデルを使用して、(i)該溶質の該濃度レベルのうちの少なくとも1つについての第1の事例において、少なくとも1つの推定患者パラメータを推定することと、(ii)該少なくとも1つの推定患者パラメータおよび該溶質に対する所望の治療結果についての第2の事例において、該治療処方のための治療継続時間、治療頻度、透析液流量、または血液流量のうちの少なくとも1つを決定することとを行うようにプログラムされる、デバイスと
を含む、腎不全血液治療システム。
(項目2)
前記治療処方は、前記腎不全血液治療機のメモリの中に記憶される、項目1に記載の腎不全血液治療システム。
(項目3)
(i)前記腎不全血液治療機は、家庭用血液透析機であること、(ii)前記デバイスは、医師コンピュータを含むこと、または(iii)該家庭用血液透析機は、該医師コンピュータとデータネットワーク通信をしていることのうちの少なくとも1つである、項目1に記載の腎不全血液治療システム。
(項目4)
前記デバイスは、前記第1の事例において、前記溶質の前記濃度レベルの各々を使用して、前記少なくとも1つの推定患者パラメータを推定するようにプログラムされる、項目1に記載の腎不全血液治療システム。
(項目5)
前記デバイスは、前記第1の事例において、前記溶質の前記濃度レベルの組み合わせを使用して、前記少なくとも1つの推定患者パラメータを推定するようにプログラムされる、項目1に記載の腎不全血液治療システム。
(項目6)
前記デバイスは、前記第1の事例において、前記溶質の前記濃度レベルのうちの前記少なくとも1つを使用して、複数の異なる推定患者パラメータを推定するようにプログラムされる、項目1に記載の腎不全血液治療システム。
(項目7)
前記デバイスは、前記第1の事例において、前記少なくとも1つの推定患者パラメータおよび前記溶質に対する前記所望の治療結果を使用して、該所望の治療結果を満足させる複数の治療継続時間と治療頻度との組み合わせを決定するようにプログラムされる、項目1に記載の腎不全血液治療システム。
(項目8)
前記満足させる治療継続時間と治療頻度との組み合わせのうちの少なくとも1つは、前記腎不全血液治療機とともに使用するために選択される、項目7に記載の腎不全血液治療システム。
(項目9)
前記少なくとも1つの推定患者パラメータは、生成率(G)、細胞拡散係数(K IC )、および溶質分布容量(V D )から成る群より選択される、項目1に記載の腎不全血液治療システム。
(項目10)
前記デバイスは、前記(i)または(ii)のうちの少なくとも1つを行う際に、少なくとも1つの入力された機械動作パラメータを使用するようにさらにプログラムされる、項目1に記載の腎不全血液治療システム。
(項目11)
前記少なくとも1つの機械動作パラメータは、血液流量、透析液流量、透析液全容量、限外濾過流量、および限外濾過容量から成る群より選択される、項目10に記載の腎不全血液治療システム。
(項目12)
前記溶質は、第1の溶質であり、前記動態モデルは、第1の動態モデルであり、および複数の溶質および対応する動態モデルを含み、前記デバイスは、該動態モデルの各々を使用して、(i)前記対応する溶質の前記濃度レベルのうちの少なくとも1つについての前記第1の事例において、少なくとも1つの推定患者パラメータを推定することと、(ii)該少なくとも1つの推定患者パラメータおよび該対応する溶質に対する所望の治療結果についての前記第2の事例において、前記治療処方のための前記治療継続時間または前記治療頻度のうちの少なくとも1つを決定することとを行うようにプログラムされる、項目1に記載の腎不全血液治療システム。
(項目13)
前記デバイスは、操作者が、前記溶質、対応する動態モデル、および所望の治療結果のうちのどれを前記(ii)に含むべきかを選択することを可能にするようにさらにプログラムされる、項目12に記載の腎不全血液治療システム。
(項目14)
前記溶質のうちの1つは、リン酸塩であり、その対応する動態モデルは、リン酸塩の可動化が瞬時と治療前とのリン酸塩濃度の間の差に比例すると仮定する、項目12に記載の腎不全血液治療システム。
(項目15)
腎不全血液治療システムであって、
該システムは、
腎不全血液治療機と、
患者のための治療処方であって、該患者は、該患者の血液から溶質を除去するように該腎不全血液治療機によって治療される、治療処方と、
検査治療中に複数回、採取される複数の血液サンプルを含む検査であって、該検査は、該複数回の各々において該溶質の濃度レベルを決定する、検査と、
デバイスであって、該デバイスは、該溶質に対する動態モデルを使用して、(i)該溶質の該濃度レベルのうちの少なくとも1つについての第1の事例において、少なくとも1つの推定患者パラメータを推定することと、(ii)該少なくとも1つの推定患者パラメータ、および治療継続時間または治療頻度のうちの少なくとも1つについての第2の事例において、該パラメータに対する治療結果を予測することとを行うようにプログラムされる、デバイスと
を含む、腎不全血液治療システム。
(項目16)
前記デバイスは、前記(i)または(ii)のうちの少なくとも1つにおいて、少なくとも1つの入力された機械動作パラメータを使用するようにさらにプログラムされる、項目15に記載の腎不全血液治療システム。
(項目17)
前記少なくとも1つの機械動作パラメータは、血液流量、透析液流量、透析液全容量、限外濾過流量、および限外濾過容量から成る群より選択される、項目16に記載の腎不全血液治療システム。
(項目18)
前記溶質は、第1の溶質であり、前記動態モデルは、第1の動態モデルであり、および複数の溶質および対応する動態モデルを含み、前記デバイスは、該動態モデルの各々を使用して、(i)前記対応する溶質の前記濃度レベルのうちの少なくとも1つについての第1の事例において、少なくとも1つの推定患者パラメータを推定することと、(ii)該少なくとも1つの推定患者パラメータ、および治療継続時間または治療頻度のうちの少なくとも1つについての第2の事例において、該パラメータに対する治療結果を予測することとを行うようにプログラムされる、項目15に記載の腎不全血液治療システム。
(項目19)
前記デバイスは、操作者が、前記溶質、対応する動態モデル、および所望の治療結果のうちのどれを前記(ii)に含むべきかを選択することを可能にするようにさらにプログラムされる、項目18に記載の腎不全血液治療システム。
(項目20)
腎不全血液治療システムであって、
該システムは、
腎不全血液治療機と、
患者のための治療処方であって、該患者は、該患者の血液から溶質を除去するように該腎不全血液治療機によって治療される、治療処方と、
検査治療中に複数回、採取される複数の血液サンプルを含む検査であって、該検査は、該複数回の各々において該溶質の濃度レベルを決定する、検査と、
デバイスであって、該デバイスは、該溶質の該濃度レベルのうちの少なくとも1つについての第1の事例において、該溶質に対する動態モデルを使用して、少なくとも1つの推定患者パラメータを推定するようにプログラムされ、該デバイスは、ユーザが、該溶質に対する該動態モデルを使用して、(i)該少なくとも1つの推定患者パラメータ、および治療継続時間または治療頻度のうちの少なくとも1つについての第2の事例において、該パラメータの治療結果を予測すること、または(ii)該少なくとも1つの推定患者パラメータおよび該溶質の所望の治療結果についての第2の事例において、該治療処方のための治療継続時間、治療頻度、透析液流量、または血液流量のうちの少なくとも1つを決定することの間で選択することを可能にするようにさらにプログラムされる、デバイスと
を備える、腎不全血液治療システム。
(項目21)
腎不全血液治療機とともに使用するためのデバイスであって、該腎不全血液治療機は、患者の血液から溶質を除去するように該患者を治療するための治療処方を実行し、該患者は、検査を受け、該検査は、検査治療中に採取される複数の血液サンプルを含むことにより、複数回の各々において該溶質の濃度レベルを決定し、
該デバイスは、
プロセシングおよびメモリを備え、該プロセシングおよびメモリは、該溶質に対する動態モデルを使用して、(i)該溶質の該濃度レベルのうちの少なくとも1つについての第1の事例において、少なくとも1つの推定患者パラメータを推定することと、(ii)該少なくとも1つの推定患者パラメータおよび該溶質に対する所望の治療結果についての第2の事例において、該治療処方のための治療継続時間、治療頻度、透析液流量、または血液流量のうちの少なくとも1つを決定することとを行うようにプログラムされる、デバイス。
(項目22)
腎不全血液治療機とともに使用するためのデバイスであって、該腎不全血液治療機は、患者の血液から溶質を除去するように該患者を治療するための治療処方を実行し、該患者は、検査を受け、該検査は、検査治療中に採取される複数の血液サンプルを含むことにより、複数回の各々において該溶質の濃度レベルを決定し、
該デバイスは、
プロセシングおよびメモリを備え、該プロセシングおよびメモリは、該溶質に対する動態モデルを使用して、(i)該溶質の該濃度レベルのうちの少なくとも1つについての第1の事例において、少なくとも1つの推定患者パラメータを推定することと、(ii)該少なくとも1つの推定患者パラメータ、および治療継続時間または治療頻度のうちの少なくとも1つについての第2の事例において、該パラメータに対する治療結果を予測することとを行うようプログラムされる、デバイス。
(項目23)
腎不全血液治療機とともに使用するためのデバイスであって、該腎不全血液治療機は、患者の血液から溶質を除去するように該患者を治療するための治療処方を実行し、該患者は、検査を受け、該検査は、検査治療中に採取される複数の血液サンプルを含むことにより、複数回の各々において該溶質の濃度レベルを決定し、該デバイスは、
プロセシングおよびメモリを備え、該プロセシングおよびメモリは、該溶質の該濃度レベルのうちの少なくとも1つについての第1の事例において、該溶質に対する動態モデルを使用して、少なくとも1つの推定患者パラメータを推定するようにプログラムされ、該デバイスは、ユーザが、該溶質に対する該動態モデルを使用して、(i)該少なくとも1つの推定患者パラメータ、および治療継続時間または治療頻度のうちの少なくとも1つについての第2の事例において、該パラメータに対する治療結果を予測すること、または(ii)該少なくとも1つの推定患者パラメータおよび該溶質に対する所望の治療結果についての第2の事例において、該治療処方のための治療継続時間、治療頻度、透析液流量、または血液流量のうちの少なくとも1つを決定することの間で選択することを可能にするようにさらにプログラムされる、デバイス。
(項目24)
腎不全血液治療機とともに使用するためのデバイスであって、該腎不全血液治療機は、患者の血液から溶質を除去するように該患者を治療するための治療処方を実行し、該溶質の該濃度レベルは、該患者の複数の身体特性に基づいて、該患者に対して推定され、
該デバイスは、
プロセシングおよびメモリを備え、該プロセシングおよびメモリは、該溶質の濃度レベルについての第1の事例において、該溶質に対する動態モデルを使用して、少なくとも1つの推定患者パラメータを推定するようにプログラムされ、該デバイスは、ユーザが、該溶質に対する該動態モデルを使用して、(i)該少なくとも1つの推定患者パラメータ、および治療継続時間または治療頻度のうちの少なくとも1つについての第2の事例において、該パラメータの治療結果を予測すること、または(ii)該少なくとも1つの推定患者パラメータおよび該溶質に対する所望の治療結果についての第2の事例において、該治療処方のための治療継続時間、治療頻度、透析液流量、または血液流量のうちの少なくとも1つを決定することを可能にするようにさらにプログラムされる、デバイス。
(項目25)
腎不全治療とともに使用するための方法であって、
該方法は、
患者特有のパラメータを計算して患者を検査することであって、該検査は、該検査の結果および該腎不全治療によって除去される溶質に対する動態モデルを使用する、こと、
該患者特有のパラメータおよび機械動作パラメータを該動態モデルに入力することによって、該溶質に対する値を計算すること、または、
該患者特有のパラメータおよび該溶質に対する値を該動態モデルに入力することによって、機械動作パラメータを計算すること
を含む、方法。
付加的な特徴および利点が本明細書において説明され、以下の発明を実施するための形態および図から明白となるであろう。
ここで図面、特に図1を参照すると、システム10は、血液透析機、特に家庭用血液透析(「HHD」)機等の腎不全血液治療機100に治療処方を実装するための本開示の1つの最適化システムおよび方法を図示する。本開示のシステムおよび方法を操作するための1つの特によく適したHHD機は、(i)米国特許出願公開第2008/0202591号、(ii)米国特許出願公開第2008/0208103号、(iii)米国特許出願公開第2008/0216898号、(iv)米国特許出願公開第2009/0004033号、(v)米国特許出願公開第2009/0101549号、(vi)米国特許出願公開第2009/0105629号、米国特許出願公開第2009/0107335号、および(vii)米国特許出願公開第2009/0114582号といった、米国特許出願に記載されており、そのそれぞれの内容は、参照することにより明示的に本明細書に組み込まれ、根拠とされる。HHD機は、医師、臨床医、または看護師(便宜上、特に指定がない限り以降では医師14と集合的に呼ばれる)によって処方される、実行する治療処方を容認するように特異的に修正または事前プログラムされる、少なくとも1つのプロセッサおよび少なくとも1つのメモリを含む。治療は、例えば、フラッシュドライブまたはユニバーサルシリアルバス(「USB」)等のメモリ記憶デバイスを介して、あるいはインターネットまたは他のローカルエリアまたは広域データネットワークを介して、HHD機(便宜上、「HHD機」とは、特に指定がない限り、以降では家庭血液透析、家庭血液濾過、家庭血液透析濾過、または連続腎代償療法(「CRRT」)機を指す)にダウンロードされる。
推定構成要素20は、選択の治療、例えば、血液透析、血液濾過、血液透析濾過、またはCRRT療法を患者12に実際に行うことと、実際の治療中の異なるときに、例えば、5回の異なるときに、血液サンプルを採取することとを有する患者検査22を含む。検査治療は、例えば、サンプル時間が、例えば、検査の初め、30分、1時間、および2時間である4時間治療となり得るか、または検査治療は、例えば、サンプルが、治療の初め、および1時間、2時間、4時間、5時間、6時間、および8時間で採取される8時間治療となり得る。検査治療持続時間およびサンプルの数は、所望に応じて変化させることができる。
KICは、分子および溶質に対する患者の区画間拡散係数であり、かつ推定パラメータ32である;
KDは、特定の分子および溶質に対する既知の透析機クリアランスであり、かつモデル外で計算されるパラメータ42となり得る;
KMは、患者のリン可動化クリアランスであり、かつ推定パラメータ32である;
KNRは、特定の分子または溶質に対する患者の残留腎臓係数であり、かつ定数であると仮定されるパラメータ42であってもよい;
Vは、リンの分布容量であり、かつ推定パラメータ32である;
Gは、患者の摂取によって産生される特定の溶質または分子に対する生成率であり、かつ推定パラメータ32であるか、または仮定パラメータ42であってもよい;
VPは、かん流または細胞外容量であり、かつ推定パラメータ32である;
VNP、非かん流または細胞内容量であり、かつ推定パラメータ32である、
VDは、尿素およびベータ2−ミクログロブリンに対するVP+VNPに等しい、体内の溶質分布容量であり、推定パラメータ32である;
CPは、溶質の細胞外濃度であり、検査22から決定されるパラメータ42であり、したがって、推定構成要素20のモデル30の中の既知数である(CPは、測定された推定構成要素20となり得るだけでなく、CPは、予想モジュールによってCnpとともに予測することもでき、その後に、CP等の測定および予測バージョンを比較して、システム10の性能を計測できることに留意されたい);
CNPは、溶質の細胞内濃度であり、測定することができず、検査22の結果ではなく、モデルへの入力ではなく、代わりに、予測および最適化構成要素からの予測出力である;
ΦNPは、全分布容量に対する細胞外区画容量の比であり、ΦPは、全分布容量に対する細胞内区画容量の比であり、その両方が文献からの既知のパラメータ42である;
αは、透析間流体摂取、すなわち、水分摂取であり、平均流体摂取または体重増加に基づいてモデル30の外で計算されるパラメータ42である。
Tは、1つの事例では、各サンプルが推定構成要素20において採取される持続時間であり、したがって、推定構成要素20の検査22に対する既知のパラメータ42であり、別の事例では、予測40および最適化60構成要素における透析の持続時間であり;
Fは、治療の頻度であり、単一の検査治療22については1であると解釈されるが、予測40および最適化60構成要素において変化させられる。
次いで、推定患者パラメータ32は、予測構成要素40におけるモデルに、特に、個人化溶質流束および容量流束ルーチン50にフィードバックされる。個人化溶質流束および容量流束ルーチン50は、本質的に、構成要素20の同じモデルまたはアルゴリズム30を使用するが、ここでは、入力として推定構成要素30の推定患者パラメータ32を使用し、パラメータ32を変数の代わりに既知の数にする。
最適化構成要素60は、尿素24の標的除去、β2−Mの標的除去、リン酸塩28の標的除去、および限外濾過(「UF」)または治療の間に患者の内側に蓄積した過剰な水分の標的除去等の複数の治療標的62を入力する。治療標的62は、最適化ルーチン70に導入される。一実施形態では、最適化ルーチン70は、本質的に、ルーチン50の場合のように、推定構成要素20から得られた推定患者パラメータ32を入力した推定構成要素20について上記で論議された動態モデルまたは式30を使用する。次いで、各溶質に対する計算は、予測構成要素40の逆で行われる。つまり、処方動作パラメータ44を入力し、溶質濃度52を計算する代わりに、所望の溶質濃度52が入力され、所望のまたは最適化された溶質濃度52を満足させる動作パラメータ44が計算される。ここで、最適化構成要素60の結果72は、予測構成要素40の結果から独立しており、またはより正確には、予測構成要素40の結果の逆である。最適化ルーチン70は、各指定溶質の所望のまたは最適化された溶質濃度52を満足させる1つ以上の治療処方72を同定する。
図2から8Bは、図1に関連して説明されたシステム10をさらに図示するサンプルスクリーンショットである。図2から8Bのスクリーンショットは、医師の要求によってカスタム生成することができ、例えば、インターネット、ローカルエリアまたは広域ネットワークを介して、HHD機100とデータネットワーク通信することができる医師、臨床医、または看護師によって使用される1つ以上のコンピュータのプロセシングおよびメモリ上に実装することができる。また、特にセンター内機械について、機械100の1つ以上のプロセシングおよびメモリにおいて、システム10および図2から8Bのスクリーンショットを実装することも検討される。
ここで図9を参照すると、方法110は、本明細書で論議されるシステム10の構成要素20、40、および60の間の関係を図示する。方法110は、構成要素20、40、および60の間の関係を理解するのに役立つように意図されており、上記で詳細に説明されている構成要素の全ての代替案を説明するように決して意図されていない。
((i)尿素およびβ2−Mモデル化)
システム10に対する尿素およびβ2−Mの好適な動態モデル30が、以下に示され、2区画モデルに対して、
および、
システム10に対する電解質平衡、例えば、ナトリウム、カリウム等の1つの好適なモデルは、3区画モデルであり、その内容全体が、参照することにより明示的に本明細書に組み込まれ、根拠とされる、Ursinoら(Ursino M.et al.,Prediction of Solute Kinetics,Acid−Base Status,and Blood Volume Changes During Profiled Hemodialysis,Annals of Biomedical Engineering,Vol.28,pp.204−216(2000))によって詳細に説明されている。
本明細書で説明されるように、システム10は、透析に限定されず、血液濾過および血液透析濾過等の他の腎不全血液治療に適用することができる。血液濾過および血液透析濾過は両方とも、透析の浸透クリアランスの代わりに(血液濾過)またはそれに加えて(血液透析濾過)使用される、対流クリアランスのために、血液ラインの中へ直接送出される代替液の使用を伴う。
(血液透析患者におけるリン酸塩予測方法およびその用途)
本明細書で論議されるシステムに照らして、血液透析両方の前、間、および後の血液透析患者における血清または血漿リン濃度またはレベルを予測する方法を提供することが検討される。血清リンレベルを予測できることは、血液透析患者のための最適な治療計画を決定するのに有用となり得る。これらの方法は、患者のための血液透析療法を最適化するように、本明細書で説明されるシステムおよびコンピュータデバイスのうちのいずれかに組み込むことができる。
ここで、tは、血液透析治療セッション中の時間であり、Tは、血液透析治療セッションの終了後の時間であり、ttxは、血液透析治療セッションの全持続時間であり、CPREは、透析前血漿リン濃度であり、CPOSTは、透析後血漿リン濃度であり、KMは、患者のリン可動化クリアランスであり、KRは、リン酸塩の残留腎クリアランスであり、KDは、透析機リン酸塩クリアランスであり、VPREは、患者のリンの透析前分布容量であり、
ここで、tsは、サンプリング時間であり、CD(ts)は、時間tsにおける透析液流出中のリンの濃度であり、QD(ts)は、時間tsにおける透析液流量であり、C(ts)は、時間tsにおける血清リン濃度である。
そして、(c)患者の所与の一組の推定パラメータKMおよびVPREに対する式LおよびMを使用することによって、血液透析中の任意のときに患者のCを予測するために、プロセッサを表示デバイスおよび入力デバイスとともに動作させる複数の命令を記憶するメモリデバイスとを含むことができる。本明細書に記載される式のうちのいずれかを使用して、式LおよびMに対する変数を決定できることを理解されたい。血液透析患者について得られる情報/データは、表示/印刷することができ、血液透析患者のための改良型治療および栄養計画を提供するために、医療提供者によって使用することができる。血液透析中の患者におけるリン可動化を決定する方法について以前に論議された適切な式および測定を使用して、未知の因数のうちのいずれかを決定することができる。
ここで、Fは、1週間当たりの治療の頻度であり、ttxは、(例えば、1回の治療セッション当たりの分数の単位での)1回の血液透析治療セッションの治療時間であり、KDは、透析機リン酸塩クリアランスであり、KRは、リン酸塩の残留腎クリアランスであり、
ここで、KMは、患者のリン可動化クリアランスであり、QWGは、透析間時間間隔中の患者による一定の流体獲得の速度(QWG=(ttxQUF)/(10080/F)によって計算される)であり、QUFは、患者から除去される流体の一定の速度であり、VPREは、血液透析治療セッション前の患者のリンの透析前分布容量であり、VPOSTは、血液透析治療セッションの終了時の患者のリンの透析後分布容量である。
ここで、tsは、サンプリング時間であり、CD(ts)は、時間tsにおける透析液流出中のリンの濃度であり、QD(ts)は、時間tsにおける透析液流量であり、C(ts)は、時間tsにおける血清リン濃度である。
ここで、IPは、血液透析患者のリンの毎週の食事摂取であり、APは、血液透析患者のリン吸収率であり、IBは、血液透析患者の毎週の結合剤摂取であり、PBは、結合剤の結合力である。
ここで、tは、血液透析治療セッション中の時間であり、Tは、血液透析治療セッションの終了後の時間であり、ttxは、血液透析治療セッションの全持続時間であり、CPREは、透析前血漿リン濃度であり、CPOSTは、透析後血漿リン濃度であり、KMは、患者のリン可動化クリアランスであり、KRは、リン酸塩の残留腎クリアランスであり、KDは、透析機リン酸塩クリアランスであり、VPREは、患者のリンの透析前分布容量であり、
ここで、Fは、1週間当たりの治療の頻度であり、ttxは、(例えば、1回の治療セッション当たりの分数の単位での)1回の血液透析治療セッションの治療時間であり、KDは、透析機リン酸塩クリアランスであり、KRは、リン酸塩の残留腎クリアランスであり、
ここで、CSS−PRE−INは、式EEを使用したGの計算前の特定の時間にわたって血液透析療法(例えば、KD、F、およびttxによって同定される)によって維持される血液透析患者の最初の測定された定常状態透析前血清リンレベルである。特定の時間は、例えば、Gが計算される時間の前の少なくとも1週間、2週間、3週間、1ヶ月、2ヶ月、3ヶ月、4ヶ月、またはそれ以上となり得る。Fは、1週間当たりの治療の頻度であり、ttxは、1回の血液透析治療セッションの治療時間であり、KDは、透析機リン酸塩クリアランスであり、KRは、リン酸塩の残留腎クリアランスであり、
(c)血液透析患者のCSS−PREへの患者パラメータまたは治療パラメータのうちの少なくとも1つの影響をシミュレートする。本明細書に記載される適切な式または方法のうちのいずれかを使用して、式EEおよびFFに対する変数を決定できることを理解されたい。
(目的)
この分析の目的は、臨床データを使用した疑似1区画モデルから患者特有のパラメータ(例えば、KMおよびVPRE)を推定するための非線形最小二乗適合法を実証すること、および異なるHD治療法にわたるパラメータ推定値の妥当性を評価することであった。
疑似1区画モデルの概念的説明が図11に示されている。このモデルにおいて、リンが、分布容量とも呼ばれる容量Vおよびリン濃度Cの区画から、透析機によって除去される。分布容量は、血漿と平衡状態にあると仮定される。この区画の中へのリン可動化は、透析機にアクセス不可能である体内のリンのプールから生じる。これらのプールは、透析前血漿リン濃度(「CPRE」)と等しい一定のリン濃度を有する大型区画として表される。分布容量の中へのリン可動化の速度は、リン可動化クリアランス(「KM」)を掛けた透析前および瞬間血漿リンレベルの間の差として表される。KMは、区画間質量移動係数に類似し、治療および透析後リバウンド期間中に一定であると仮定される。リン酸塩の残留腎クリアランスは、この実施例では無視される。
ここで、Θは、透析治療が行われているか(Θ=1)否か(Θ=0)を示す変数である。KDは、透析機リン酸塩クリアランスであり、QUFは、限外濾過(「UF」)速度である。上記で説明される動態モデルはまた、治療中に除去される全ての流体がリンの分布容量からであることも仮定する。
ここで、VPREは、リンの透析前分布容量であり、tは、治療中の時間であり、Tは、治療の終了後の時間であり、ttxは、リバウンド期間前の治療の全持続時間である。また、リンの分布容量は、透析後リバウンド期間中に一定のままであると仮定される。
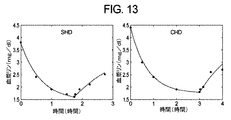
クロスオーバー臨床試験に参加した5人の慢性血液透析患者から臨床データを取得した。患者は、1週間おいて短期HD(「SHD」)治療セッションおよび従来のHD(「CHD」)治療セッションを受けた。SHD中のt=0、60、90分、およびCHD治療中のt=0、30、60、120、180分に血液サンプルを収集した。透析機リン酸塩クリアランスを決定するように、治療の開始から60分後に透析液サンプルを収集した。治療の終了後t=10秒、2、10、30、60分に、付加的な血液サンプルを収集した。血漿および透析液サンプルをリンについて分析した。
(目的)
この研究の目的は、従来の4時間血液透析治療からのデータを使用した疑似1区画モデルから患者特有のパラメータKMを推定するための簡単な方法の適用を実証すること、および非線形最小二乗適合を使用して得られた結果との比較を介して推定KM値の精度を評価することであった。
CHD治療を受けた5人の慢性血液透析患者から臨床データを取得した。治療中のt=0、30、60、120、180分に、および治療の終了から10秒、2、10、30、60分後に、血液サンプルを収集した。透析機リン酸塩クリアランスを決定するように、治療の開始から60分後に透析液サンプルを収集した。血漿および透析液サンプルをリンについて分析した。
式E−B1を使用して計算され、頻繁な測定への非線形最小二乗適合から推定された個々の患者のKM値が、透析前および透析後血漿リン濃度、限外濾過速度、および透析機リン酸塩クリアランスとともに、表II.2に表示されている。式E−B1を使用して得られたKM値と非線形最小二乗適合との間には良好な一致があった。
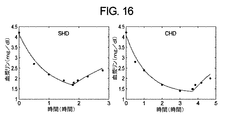
(定常状態リン質量平衡モデル)
(目的)
以前に論議されたように、発明者らは、血液透析(より一般的には体外治療)および透析後リバウンド期間中の血清または血漿リン濃度の変化を表すための動態モデルを提案した。その動態モデルは、1)血漿または血清中のリンの透析前濃度、2)リン酸塩の透析機クリアランス、3)リンの分布の容量、4)治療中に除去された流体の量、および5)患者特有のリン可動化クリアランスを知ることから、時間および全リン酸塩除去の関数としての透析中リン濃度の予測を可能にする。以下で説明される定常状態リン質量平衡モデルは、上記のパラメータ2−5が確立され、1週間当たりの血液透析治療の頻度および血液透析治療持続時間が処方され、リンの正味生成(以下で定義される)および残留腎臓または腎リンクリアランスが周知であるときに、任意の血液透析治療処方を受けている個々の患者に対する透析前血清リン濃度の決定を可能にするために、以前の動態モデルと組み合わせて使用される。代替として、以前の動態モデルと組み合わせた定常状態リン質量平衡モデルは、上記のパラメータ1−5が確立され、1週間当たりの血液透析治療の頻度、血液透析治療持続時間、および残留腎臓リンクリアランスが分かっている時に、所与の患者に対するリンの正味生成を決定するために使用することができる。他の質量平衡モデルの場合のように、患者は、定常状態にあると仮定される。
血液透析によって治療される患者に対する、時間平均期間、すなわち、1週間にわたる定常状態リン質量平衡を説明するために使用されるモデルが、図17で概略的に示されている。このモデルは、治療および透析後リバウンド期間中のリン動態を特性化する、以前に説明された動態モデルの一般化バージョンである。モデルは、リンが単一の十分に混合した区画の中で分布していることを仮定する。
式E−C9からE−C11は、実施例1および2で分析されたデータから、患者特有のGの値を計算するために使用することができる。リンの測定された透析前濃度(「CPRE」)、および従来の4時間治療中のそのデータからの計算されたGの値は、以下の表II.3
本明細書で説明される主題の側面は、単独で、または本明細書で説明される1つ以上の他の側面と組み合わせて有用であってもよい。先述の説明を限定することなく、本開示の第1の側面では、腎不全血液治療システムは、腎不全血液治療機と、患者の血液から溶質を除去するように腎不全血液治療機によって治療される患者用の治療処方と、複数の回のそれぞれで前記溶質の濃度レベルを決定するように、検査治療中に複数の回で採取される複数の血液サンプルを含む、検査と、(i)少なくとも1つの推定患者パラメータを推定するための溶質の濃度レベルのうちの少なくとも1つについての第1の事例において、および(ii)治療処方のための治療持続時間、治療頻度、透析液流量、または血液流量のうちの少なくとも1つを決定するための少なくとも1つの推定患者パラメータおよび溶質の所望の治療結果についての第2の事例において、溶質に対する動態モデルを使用するようにプログラムされる、デバイスとを含む。
ここで、tは、血液透析治療セッション中の時間であり、Tは、血液透析治療セッションの終了後の時間であり、ttxは、血液透析治療セッションの全持続時間であり、CPREは、透析前血漿リン濃度であり、CPOSTは、透析後血漿リン濃度であり、KMは、患者のリン可動化クリアランスであり、KRは、リン酸塩の残留腎クリアランスであり、KDは、透析機リン酸塩クリアランスであり、VPREは、患者のリンの透析前分布容量であり、V(t)=VPRE−QUF×t(1−C)である、ステップと、患者の推定KMおよびVPREとともに式1および式2を使用することによって、任意の血液透析治療セッション中の任意の時間に患者のCを予測するステップとを含む。
(c)式3−Aならびに患者の推定KMおよびVPREを使用することによって、血液透析中の任意のときに患者のCを予測するように、プロセッサを表示デバイスおよび入力デバイスとともに動作させる、複数の命令を記憶する、メモリデバイスとを含む。
(c)血液透析患者のCSS−PREへの患者パラメータまたは治療パラメータのうちの少なくとも1つの影響をシミュレートする。
Claims (25)
- 腎不全血液治療システムであって、
該システムは、
腎不全血液治療機と、
患者のための治療処方であって、該患者は、該患者の血液から溶質を除去するように該腎不全血液治療機によって治療される、治療処方と、
検査治療中に複数回、採取される複数の血液サンプルを含む検査であって、該検査は、該複数回の各々において該溶質の濃度レベルを決定する、検査と、
疑似1区画動態モデルを含む非一時的なコンピュータ可読媒体であって、該モデルの区画は、無視される容量と、該溶質に対する透析前濃度と等しい一定の溶質濃度とを有する、非一時的なコンピュータ可読媒体と、
デバイスであって、該デバイスは、該溶質に対する該動態モデルを使用して、(i)該溶質の該濃度レベルのうちの少なくとも1つについての第1の事例において、少なくとも1つの推定患者パラメータを推定することと、該動態モデルを使用して、(ii)該少なくとも1つの推定患者パラメータおよび該溶質に対する所望の治療結果についての第2の事例において、該第1の事例における該動態モデルの使用の後に、該治療処方のための治療継続時間、治療頻度、透析液流量、または血液流量のうちの少なくとも1つを決定することと、該第2の事例における該動態モデルの使用の後に、該患者に対する該治療処方を生成することとを行うようにプログラムされ、該第2の事例において、該少なくとも1つの推定患者パラメータは、該動態モデルにおける既知の変数として使用される、デバイスと
を含む、腎不全血液治療システム。 - 前記治療処方は、前記腎不全血液治療機のメモリの中に記憶される、請求項1に記載の腎不全血液治療システム。
- (i)前記腎不全血液治療機は、家庭用血液透析機であること、(ii)前記デバイスは、医師コンピュータを含むこと、または(iii)該家庭用血液透析機は、該医師コンピュータとデータネットワーク通信をしていることのうちの少なくとも1つである、請求項1に記載の腎不全血液治療システム。
- 前記デバイスは、前記第1の事例において、前記溶質の前記濃度レベルの各々を使用して、前記少なくとも1つの推定患者パラメータを推定するようにプログラムされる、請求項1に記載の腎不全血液治療システム。
- 前記デバイスは、前記第1の事例において、前記溶質の前記濃度レベルの組み合わせを使用して、前記少なくとも1つの推定患者パラメータを推定するようにプログラムされる、請求項1に記載の腎不全血液治療システム。
- 前記デバイスは、前記第1の事例において、前記溶質の前記濃度レベルのうちの前記少なくとも1つを使用して、複数の異なる推定患者パラメータを推定するようにプログラムされる、請求項1に記載の腎不全血液治療システム。
- 前記デバイスは、前記第1の事例において、前記少なくとも1つの推定患者パラメータおよび前記溶質に対する前記所望の治療結果を使用して、該所望の治療結果を満足させる複数の治療継続時間と治療頻度との組み合わせを決定するようにプログラムされる、請求項1に記載の腎不全血液治療システム。
- 前記満足させる治療継続時間と治療頻度との組み合わせのうちの少なくとも1つは、前記腎不全血液治療機とともに使用するために選択される、請求項7に記載の腎不全血液治療システム。
- 前記少なくとも1つの推定患者パラメータは、生成率(G)、可動化クリアランス(KM)、および透析前分布容量(VPRE)から成る群より選択される、請求項1に記載の腎不全血液治療システム。
- 前記デバイスは、(i)または(ii)のうちの少なくとも1つを行う際に、少なくとも1つの入力された機械動作パラメータを使用するようにさらにプログラムされる、請求項1に記載の腎不全血液治療システム。
- 前記少なくとも1つの機械動作パラメータは、血液流量、透析液流量、透析液全容量、限外濾過流量、および限外濾過容量から成る群より選択される、請求項10に記載の腎不全血液治療システム。
- 前記溶質は、第1の溶質であり、前記動態モデルは、第1の動態モデルであり、および複数の溶質および対応する動態モデルを含み、前記デバイスは、該動態モデルの各々を使用して、(i)前記対応する溶質の前記濃度レベルのうちの少なくとも1つについての前記第1の事例において、少なくとも1つの推定患者パラメータを推定することと、(ii)該少なくとも1つの推定患者パラメータおよび該対応する溶質に対する所望の治療結果についての前記第2の事例において、前記治療処方のための前記治療継続時間または前記治療頻度のうちの少なくとも1つを決定することとを行うようにプログラムされる、請求項1に記載の腎不全血液治療システム。
- 前記デバイスは、操作者が、前記溶質、対応する動態モデル、および所望の治療結果のうちのどれを(ii)、すなわち、前記少なくとも1つの推定患者パラメータおよび前記対応する溶質に対する所望の治療結果についての前記第2の事例において、前記治療処方のための前記治療継続時間または前記治療頻度のうちの少なくとも1つを決定することに含むべきかを選択することを可能にするようにさらにプログラムされる、請求項12に記載の腎不全血液治療システム。
- 前記溶質のうちの1つは、リン酸塩であり、その対応する動態モデルは、リン酸塩の可動化が前記患者の血液における瞬時リン酸塩濃度と該患者の血液における治療前リン酸塩濃度との間の差に比例すると仮定する、請求項12に記載の腎不全血液治療システム。
- 腎不全血液治療システムであって、
該システムは、
腎不全血液治療機と、
患者のための治療処方であって、該患者は、該患者の血液から溶質を除去するように該腎不全血液治療機によって治療される、治療処方と、
検査治療中に複数回、採取される複数の血液サンプルを含む検査であって、該検査は、該複数回の各々において該溶質の濃度レベルを決定する、検査と、
疑似1区画動態モデルを含む非一時的なコンピュータ可読媒体であって、該モデルの区画は、無視される容量と、該溶質に対する透析前濃度と等しい一定の溶質濃度とを有する、非一時的なコンピュータ可読媒体と、
デバイスであって、該デバイスは、該溶質に対する該動態モデルを使用して、(i)該溶質の該濃度レベルのうちの少なくとも1つについての第1の事例において、少なくとも1つの推定患者パラメータを推定することと、該動態モデルを使用して、(ii)該少なくとも1つの推定患者パラメータ、および治療継続時間または治療頻度のうちの少なくとも1つについての第2の事例において、該第1の事例における該動態モデルの使用の後に、該パラメータに対する治療結果を予測することと、該第2の事例における該動態モデルの使用の後に、該患者に対する該治療処方を生成することとを行うようにプログラムされ、該第2の事例において、該少なくとも1つの推定患者パラメータは、該動態モデルにおける既知の変数として使用される、デバイスと
を含む、腎不全血液治療システム。 - 前記デバイスは、(i)または(ii)のうちの少なくとも1つにおいて、少なくとも1つの入力された機械動作パラメータを使用するようにさらにプログラムされる、請求項15に記載の腎不全血液治療システム。
- 前記少なくとも1つの機械動作パラメータは、血液流量、透析液流量、透析液全容量、限外濾過流量、および限外濾過容量から成る群より選択される、請求項16に記載の腎不全血液治療システム。
- 前記溶質は、第1の溶質であり、前記動態モデルは、第1の動態モデルであり、および複数の溶質および対応する動態モデルを含み、前記デバイスは、該動態モデルの各々を使用して、(i)前記対応する溶質の前記濃度レベルのうちの少なくとも1つについての第1の事例において、少なくとも1つの推定患者パラメータを推定することと、(ii)該少なくとも1つの推定患者パラメータ、および前記治療継続時間または前記治療頻度のうちの少なくとも1つについての第2の事例において、該パラメータに対する前記治療結果を予測することとを行うようにプログラムされる、請求項15に記載の腎不全血液治療システム。
- 前記デバイスは、操作者が、前記溶質、対応する動態モデル、および所望の治療結果のうちのどれを(ii)に含むべきかを選択することを可能にするようにさらにプログラムされる、請求項18に記載の腎不全血液治療システム。
- 腎不全血液治療システムであって、
該システムは、
腎不全血液治療機と、
患者のための治療処方であって、該患者は、該患者の血液から溶質を除去するように該腎不全血液治療機によって治療される、治療処方と、
検査治療中に複数回、採取される複数の血液サンプルを含む検査であって、該検査は、該複数回の各々において該溶質の濃度レベルを決定する、検査と、
疑似1区画動態モデルを含む非一時的なコンピュータ可読媒体であって、該モデルの区画は、無視される容量と、該溶質に対する透析前濃度と等しい一定の溶質濃度とを有する、非一時的なコンピュータ可読媒体と、
デバイスであって、該デバイスは、該溶質の該濃度レベルのうちの少なくとも1つについての第1の事例において、該溶質に対する該動態モデルを使用して、少なくとも1つの推定患者パラメータを推定するようにプログラムされ、該デバイスは、ユーザが、該溶質に対する該動態モデルを使用して、(i)該少なくとも1つの推定患者パラメータ、および治療継続時間または治療頻度のうちの少なくとも1つについての第2の事例において、該第1の事例における該動態モデルの使用の後に、該パラメータの治療結果を予測すること、または(ii)該少なくとも1つの推定患者パラメータおよび該溶質の所望の治療結果についての第2の事例において、該第1の事例における該動態モデルの使用の後に、該治療処方のための治療継続時間、治療頻度、透析液流量、または血液流量のうちの少なくとも1つを決定することとの間で選択することを可能にするようにさらにプログラムされ、該第2の事例において、該少なくとも1つの推定患者パラメータは、該動態モデルにおける既知の変数として使用される、デバイスと
を備え、
該デバイスは、該第2の事例における該動態モデルの使用の後に、該治療処方を生成するようにさらにプログラムされる、腎不全血液治療システム。 - 腎不全血液治療機とともに使用するためのデバイスであって、該腎不全血液治療機は、患者の血液から溶質を除去するように該患者を治療するための治療処方を実行し、該患者は、検査を受け、該検査は、検査治療中に採取される複数の血液サンプルを含むことにより、複数回の各々において該溶質の濃度レベルを決定し、
該デバイスは、
プロセシングおよびメモリを備え、該プロセシングおよびメモリは、該溶質に対する動態モデルを使用して、(i)該溶質の該濃度レベルのうちの少なくとも1つについての第1の事例において、少なくとも1つの推定患者パラメータを推定することと、該動態モデルを使用して、(ii)該少なくとも1つの推定患者パラメータおよび該溶質に対する所望の治療結果についての第2の事例において、該第1の事例における該動態モデルの使用の後に、該治療処方のための治療継続時間、治療頻度、透析液流量、または血液流量のうちの少なくとも1つを決定することと、該第2の事例における該動態モデルの使用の後に、該治療処方を生成することとを行うようにプログラムされ、
該動態モデルは、疑似1区画動態モデルであり、該疑似1区画動態モデルにおいて、該モデルの区画は、無視される容量と、該溶質に対する透析前濃度と等しい一定の溶質濃度とを有し、
該第2の事例において、該少なくとも1つの推定患者パラメータは、該動態モデルにおける既知の変数として使用される、デバイス。 - 腎不全血液治療機とともに使用するためのデバイスであって、該腎不全血液治療機は、患者の血液から溶質を除去するように該患者を治療するための治療処方を実行し、該患者は、検査を受け、該検査は、検査治療中に採取される複数の血液サンプルを含むことにより、複数回の各々において該溶質の濃度レベルを決定し、
該デバイスは、
プロセシングおよびメモリを備え、該プロセシングおよびメモリは、該溶質に対する動態モデルを使用して、(i)該溶質の該濃度レベルのうちの少なくとも1つについての第1の事例において、少なくとも1つの推定患者パラメータを推定することと、該動態モデルを使用して、(ii)該少なくとも1つの推定患者パラメータ、および治療継続時間または治療頻度のうちの少なくとも1つについての第2の事例において、該第1の事例における該動態モデルの使用の後に、該パラメータに対する治療結果を予測することと、該第2の事例における該動態モデルの使用の後に、該治療処方を生成することとを行うようにプログラムされ、
該動態モデルは、疑似1区画動態モデルであり、該疑似1区画動態モデルにおいて、該モデルの区画は、無視される容量と、該溶質に対する透析前濃度と等しい一定の溶質濃度とを有し、
該第2の事例において、該少なくとも1つの推定患者パラメータは、該動態モデルにおける既知の変数として使用される、デバイス。 - 腎不全血液治療機とともに使用するためのデバイスであって、該腎不全血液治療機は、患者の血液から溶質を除去するように該患者を治療するための治療処方を実行し、該患者は、検査を受け、該検査は、検査治療中に採取される複数の血液サンプルを含むことにより、複数回の各々において該溶質の濃度レベルを決定し、該デバイスは、
プロセシングおよびメモリを備え、該プロセシングおよびメモリは、該溶質の該濃度レベルのうちの少なくとも1つについての第1の事例において、該溶質に対する動態モデルを使用して、少なくとも1つの推定患者パラメータを推定するようにプログラムされ、該プロセシングおよびメモリは、ユーザが、該溶質に対する該動態モデルを使用して、(i)該少なくとも1つの推定患者パラメータ、および治療継続時間または治療頻度のうちの少なくとも1つについての第2の事例において、該第1の事例における該動態モデルの使用の後に、該パラメータに対する治療結果を予測すること、または(ii)該少なくとも1つの推定患者パラメータおよび該溶質に対する所望の治療結果についての第2の事例において、該第1の事例における該動態モデルの使用の後に、該治療処方のための治療継続時間、治療頻度、透析液流量、または血液流量のうちの少なくとも1つを決定することとの間で選択することを可能にするようにさらにプログラムされ、
該動態モデルは、疑似1区画動態モデルであり、該疑似1区画動態モデルにおいて、該モデルの区画は、無視される容量と、該溶質に対する透析前濃度と等しい一定の溶質濃度とを有し、
該第2の事例において、該少なくとも1つの推定患者パラメータは、該動態モデルにおける既知の変数として使用され、
該プロセシングおよびメモリは、該第2の事例における該動態モデルの使用の後に、該治療処方を生成するようにさらにプログラムされる、デバイス。 - 腎不全血液治療機とともに使用するためのデバイスであって、該腎不全血液治療機は、患者の血液から溶質を除去するように該患者を治療するための治療処方を実行し、該溶質の該濃度レベルは、該患者の複数の身体特性に基づいて、該患者に対して推定され、
該デバイスは、
プロセシングおよびメモリを備え、該プロセシングおよびメモリは、該溶質の濃度レベルについての第1の事例において、該溶質に対する動態モデルを使用して、少なくとも1つの推定患者パラメータを推定するようにプログラムされ、該プロセシングおよびメモリは、ユーザが、該溶質に対する該動態モデルを使用して、(i)該少なくとも1つの推定患者パラメータ、および治療継続時間または治療頻度のうちの少なくとも1つについての第2の事例において、該第1の事例における該動態モデルの使用の後に、該パラメータの治療結果を予測すること、または(ii)該少なくとも1つの推定患者パラメータおよび該溶質に対する所望の治療結果についての第2の事例において、該第1の事例における該動態モデルの使用の後に、該治療処方のための治療継続時間、治療頻度、透析液流量、または血液流量のうちの少なくとも1つを決定することを可能にするようにさらにプログラムされ、
該動態モデルは、疑似1区画動態モデルであり、該疑似1区画動態モデルにおいて、該モデルの区画は、無視される容量と、該溶質に対する透析前濃度と等しい一定の溶質濃度とを有し、
該第2の事例において、該少なくとも1つの推定患者パラメータは、該動態モデルにおける既知の変数として使用され、
該プロセシングおよびメモリは、該第2の事例における該動態モデルの使用の後に、該治療処方を生成するようにさらにプログラムされる、デバイス。 - 腎不全治療とともに使用するための方法であって、
該方法は、
患者特有のパラメータを計算することであって、該計算することは、患者の検査の結果および該腎不全治療によって除去される溶質に対する動態モデルを使用し、該動態モデルは、疑似1区画動態モデルであり、該疑似1区画動態モデルにおいて、該モデルの区画は、無視される容量と、該溶質に対する透析前濃度と等しい一定の溶質濃度とを有する、ことと、
該患者特有のパラメータの計算の後に、該患者特有のパラメータおよび機械動作パラメータを該動態モデルに入力することによって、該溶質に対する値を計算することであって、該溶質に対する値の計算において該患者特有のパラメータが該動態モデルにおける既知の変数である、または、
該患者特有のパラメータの計算の後に、該患者特有のパラメータおよび該溶質に対する値を該動態モデルに入力することによって、機械動作パラメータを計算することと、
該溶質に対する値または機械動作パラメータの計算の後に、患者に対する治療処方を生成することと
を含む、方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US32511310P | 2010-04-16 | 2010-04-16 | |
| US61/325,113 | 2010-04-16 | ||
| PCT/US2011/032736 WO2011130669A1 (en) | 2010-04-16 | 2011-04-15 | Therapy prediction and optimization for renal failure blood therapy, especially home hemodialysis |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015178146A Division JP6043850B2 (ja) | 2010-04-16 | 2015-09-10 | 腎不全血液治療、特に、家庭血液透析のための治療予測および最適化 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2013524893A JP2013524893A (ja) | 2013-06-20 |
| JP2013524893A5 JP2013524893A5 (ja) | 2014-05-15 |
| JP6018567B2 true JP6018567B2 (ja) | 2016-11-02 |
Family
ID=44041518
Family Applications (8)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013505189A Expired - Fee Related JP5747072B2 (ja) | 2010-04-16 | 2011-04-15 | 腎不全血液療法、特に、在宅血液透析のための療法の予測および最適化 |
| JP2013505190A Expired - Fee Related JP6018567B2 (ja) | 2010-04-16 | 2011-04-15 | 腎不全血液治療、特に、家庭血液透析のための治療予測および最適化 |
| JP2015096421A Active JP6078582B2 (ja) | 2010-04-16 | 2015-05-11 | 腎不全血液療法、特に、在宅血液透析のための療法の予測および最適化 |
| JP2015178146A Expired - Fee Related JP6043850B2 (ja) | 2010-04-16 | 2015-09-10 | 腎不全血液治療、特に、家庭血液透析のための治療予測および最適化 |
| JP2017005263A Expired - Fee Related JP6543279B2 (ja) | 2010-04-16 | 2017-01-16 | 腎不全血液療法、特に、在宅血液透析のための療法の予測および最適化 |
| JP2019111351A Active JP7057321B2 (ja) | 2010-04-16 | 2019-06-14 | 腎不全血液療法、特に、在宅血液透析のための療法の予測および最適化 |
| JP2022063908A Active JP7438257B2 (ja) | 2010-04-16 | 2022-04-07 | 腎不全血液療法、特に、在宅血液透析のための療法の予測および最適化 |
| JP2024019498A Pending JP2024045513A (ja) | 2010-04-16 | 2024-02-13 | 腎不全血液療法、特に、在宅血液透析のための療法の予測および最適化 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013505189A Expired - Fee Related JP5747072B2 (ja) | 2010-04-16 | 2011-04-15 | 腎不全血液療法、特に、在宅血液透析のための療法の予測および最適化 |
Family Applications After (6)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015096421A Active JP6078582B2 (ja) | 2010-04-16 | 2015-05-11 | 腎不全血液療法、特に、在宅血液透析のための療法の予測および最適化 |
| JP2015178146A Expired - Fee Related JP6043850B2 (ja) | 2010-04-16 | 2015-09-10 | 腎不全血液治療、特に、家庭血液透析のための治療予測および最適化 |
| JP2017005263A Expired - Fee Related JP6543279B2 (ja) | 2010-04-16 | 2017-01-16 | 腎不全血液療法、特に、在宅血液透析のための療法の予測および最適化 |
| JP2019111351A Active JP7057321B2 (ja) | 2010-04-16 | 2019-06-14 | 腎不全血液療法、特に、在宅血液透析のための療法の予測および最適化 |
| JP2022063908A Active JP7438257B2 (ja) | 2010-04-16 | 2022-04-07 | 腎不全血液療法、特に、在宅血液透析のための療法の予測および最適化 |
| JP2024019498A Pending JP2024045513A (ja) | 2010-04-16 | 2024-02-13 | 腎不全血液療法、特に、在宅血液透析のための療法の予測および最適化 |
Country Status (10)
| Country | Link |
|---|---|
| EP (3) | EP2558967B1 (ja) |
| JP (8) | JP5747072B2 (ja) |
| AU (2) | AU2011239489B2 (ja) |
| BR (1) | BR112012026361A2 (ja) |
| CA (2) | CA2796496C (ja) |
| CO (3) | CO6660434A2 (ja) |
| ES (2) | ES2802609T3 (ja) |
| MX (4) | MX2012012062A (ja) |
| NZ (2) | NZ602996A (ja) |
| WO (2) | WO2011130668A1 (ja) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8845570B2 (en) | 2010-04-16 | 2014-09-30 | Baxter International Inc. | Therapy prediction and optimization for renal failure blood therapy, especially home hemodialysis |
| US9132219B2 (en) | 2010-04-16 | 2015-09-15 | Baxter International Inc. | Therapy prediction and optimization of serum potassium for renal failure blood therapy, especially home hemodialysis |
| CA2919223A1 (en) * | 2013-08-16 | 2015-02-26 | Baxter International Inc. | Therapy prediction and optimization of serum potassium for renal failure blood therapy, especially home hemodialysis |
| DE102014005122A1 (de) * | 2014-04-08 | 2015-10-08 | Fresenius Medical Care Deutschland Gmbh | Verfahren zur Abschätzung der Behandlungsdauer einer Pertionealdialyse-Behandlung |
| EP3539586B1 (en) | 2014-10-10 | 2022-08-24 | NxStage Medical Inc. | Flow balancing methods |
| JP7086926B2 (ja) | 2016-07-18 | 2022-06-20 | ネクステージ メディカル インコーポレイテッド | フローバランシングの装置、方法、及びシステム |
| WO2018045102A1 (en) | 2016-08-30 | 2018-03-08 | Nxstage Medical, Inc. | Parameter monitoring in medical treatment systems |
| JP2019212249A (ja) * | 2018-06-10 | 2019-12-12 | 大 益満 | プログラム及び情報処理システム |
| CN115050238B (zh) * | 2022-07-08 | 2024-03-12 | 卡斯柯信号有限公司 | 一种基于真实ctc系统的多模式切换仿真实训系统 |
Family Cites Families (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5602116A (en) * | 1988-08-02 | 1997-02-11 | Bone Care International, Inc. | Method for treating and preventing secondary hyperparathyroidism |
| CA2124808A1 (en) * | 1992-10-13 | 1994-04-28 | Vernon H. Troutner | Fluid sampling module |
| JP2812460B2 (ja) * | 1995-10-04 | 1998-10-22 | 日機装株式会社 | 血液浄化モニタ装置 |
| JP3402360B2 (ja) * | 1998-08-21 | 2003-05-06 | 株式会社ジェイ・エム・エス | 腹膜透析システム |
| AUPP790898A0 (en) * | 1998-12-23 | 1999-01-28 | Life Therapeutics Limited | Renal dialysis |
| EP1396274B2 (en) * | 2002-09-05 | 2013-05-22 | Gambro Lundia AB | Controller for a blood treatment equipment |
| US20040048837A1 (en) * | 2002-09-06 | 2004-03-11 | Lazarus J. Michael | Method for treatment of renal disease |
| JP4379027B2 (ja) * | 2003-05-14 | 2009-12-09 | 株式会社ジェイ・エム・エス | 腹膜透析および血液透析併用プランニング方法ならびに腹膜透析および血液透析併用プランニング装置 |
| DE102006045437A1 (de) * | 2006-09-26 | 2008-04-03 | Fresenius Medical Care Deutschland Gmbh | Vorrichtung und Verfahren zur Vorgabe einer Dialysierflüssigkeitsrate oder Blutflussrate für eine extrakorporale Blutbehandlung |
| US8888470B2 (en) | 2007-02-27 | 2014-11-18 | Deka Products Limited Partnership | Pumping cassette |
| US8409441B2 (en) * | 2007-02-27 | 2013-04-02 | Deka Products Limited Partnership | Blood treatment systems and methods |
| US20090107335A1 (en) | 2007-02-27 | 2009-04-30 | Deka Products Limited Partnership | Air trap for a medical infusion device |
| US9028691B2 (en) | 2007-02-27 | 2015-05-12 | Deka Products Limited Partnership | Blood circuit assembly for a hemodialysis system |
| US8393690B2 (en) * | 2007-02-27 | 2013-03-12 | Deka Products Limited Partnership | Enclosure for a portable hemodialysis system |
| US8042563B2 (en) | 2007-02-27 | 2011-10-25 | Deka Products Limited Partnership | Cassette system integrated apparatus |
| US8562834B2 (en) | 2007-02-27 | 2013-10-22 | Deka Products Limited Partnership | Modular assembly for a portable hemodialysis system |
| CN101772783A (zh) * | 2007-08-03 | 2010-07-07 | 皇家飞利浦电子股份有限公司 | 药物动力学建模的方法、装置、计算机可读介质及用途 |
| US7981281B2 (en) | 2008-07-09 | 2011-07-19 | Baxter International, Inc. | Dialysis system having regimen generation methodology |
| US9514283B2 (en) | 2008-07-09 | 2016-12-06 | Baxter International Inc. | Dialysis system having inventory management including online dextrose mixing |
| US8057679B2 (en) | 2008-07-09 | 2011-11-15 | Baxter International Inc. | Dialysis system having trending and alert generation |
| US8062513B2 (en) | 2008-07-09 | 2011-11-22 | Baxter International Inc. | Dialysis system and machine having therapy prescription recall |
| US8168063B2 (en) * | 2008-07-09 | 2012-05-01 | Baxter International Inc. | Dialysis system having filtering method for determining therapy prescriptions |
| EP2163272B1 (en) * | 2008-09-15 | 2014-06-25 | B. Braun Avitum AG | Device to early predict the Kt/V parameter in kidney substitution treatments |
| AU2009305602B2 (en) * | 2008-10-17 | 2012-08-16 | Fresenius Medical Care Holdings, Inc. | Method of determining a phosphorus binder dosage for a dialysis patient |
-
2011
- 2011-04-15 AU AU2011239489A patent/AU2011239489B2/en not_active Ceased
- 2011-04-15 MX MX2012012062A patent/MX2012012062A/es active IP Right Grant
- 2011-04-15 EP EP11716759.3A patent/EP2558967B1/en active Active
- 2011-04-15 WO PCT/US2011/032735 patent/WO2011130668A1/en active Application Filing
- 2011-04-15 AU AU2011239488A patent/AU2011239488B2/en not_active Ceased
- 2011-04-15 CA CA2796496A patent/CA2796496C/en not_active Expired - Fee Related
- 2011-04-15 EP EP20165684.0A patent/EP3706134A1/en not_active Withdrawn
- 2011-04-15 MX MX2012012061A patent/MX2012012061A/es active IP Right Grant
- 2011-04-15 BR BR112012026361A patent/BR112012026361A2/pt not_active IP Right Cessation
- 2011-04-15 JP JP2013505189A patent/JP5747072B2/ja not_active Expired - Fee Related
- 2011-04-15 NZ NZ602996A patent/NZ602996A/en not_active IP Right Cessation
- 2011-04-15 JP JP2013505190A patent/JP6018567B2/ja not_active Expired - Fee Related
- 2011-04-15 NZ NZ603010A patent/NZ603010A/en not_active IP Right Cessation
- 2011-04-15 WO PCT/US2011/032736 patent/WO2011130669A1/en active Application Filing
- 2011-04-15 ES ES11716759T patent/ES2802609T3/es active Active
- 2011-04-15 EP EP11716154.7A patent/EP2558966B1/en not_active Not-in-force
- 2011-04-15 MX MX2015014313A patent/MX347513B/es unknown
- 2011-04-15 ES ES11716154.7T patent/ES2501715T3/es active Active
- 2011-04-15 CA CA2796505A patent/CA2796505C/en not_active Expired - Fee Related
-
2012
- 2012-10-16 MX MX2022001536A patent/MX2022001536A/es unknown
- 2012-11-14 CO CO12205072A patent/CO6660434A2/es active IP Right Grant
- 2012-11-15 CO CO12207312A patent/CO6630153A2/es unknown
- 2012-11-15 CO CO12207315A patent/CO6620023A2/es not_active Application Discontinuation
-
2015
- 2015-05-11 JP JP2015096421A patent/JP6078582B2/ja active Active
- 2015-09-10 JP JP2015178146A patent/JP6043850B2/ja not_active Expired - Fee Related
-
2017
- 2017-01-16 JP JP2017005263A patent/JP6543279B2/ja not_active Expired - Fee Related
-
2019
- 2019-06-14 JP JP2019111351A patent/JP7057321B2/ja active Active
-
2022
- 2022-04-07 JP JP2022063908A patent/JP7438257B2/ja active Active
-
2024
- 2024-02-13 JP JP2024019498A patent/JP2024045513A/ja active Pending
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11285248B2 (en) | Therapy prediction and optimization for renal failure blood therapy | |
| JP6043850B2 (ja) | 腎不全血液治療、特に、家庭血液透析のための治療予測および最適化 | |
| US9132219B2 (en) | Therapy prediction and optimization of serum potassium for renal failure blood therapy, especially home hemodialysis | |
| JP6477704B2 (ja) | 腎不全血液療法、特に在宅血液透析のための血清カリウムの療法予測及び最適化 | |
| AU2015203634B2 (en) | Therapy prediction and optimization for renal failure blood therapy, especially home hemodialysis |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140327 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20140327 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20150130 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20150203 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150410 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20150512 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150910 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20150918 |
|
| A912 | Re-examination (zenchi) completed and case transferred to appeal board |
Free format text: JAPANESE INTERMEDIATE CODE: A912 Effective date: 20151030 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20160930 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6018567 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |