JP4533382B2 - マイクロ流体分析およびソーティング用の一体化された構造物 - Google Patents
マイクロ流体分析およびソーティング用の一体化された構造物 Download PDFInfo
- Publication number
- JP4533382B2 JP4533382B2 JP2006524942A JP2006524942A JP4533382B2 JP 4533382 B2 JP4533382 B2 JP 4533382B2 JP 2006524942 A JP2006524942 A JP 2006524942A JP 2006524942 A JP2006524942 A JP 2006524942A JP 4533382 B2 JP4533382 B2 JP 4533382B2
- Authority
- JP
- Japan
- Prior art keywords
- channel
- cell
- sorting
- cells
- flow
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 230000003287 optical effect Effects 0.000 claims description 164
- 238000001514 detection method Methods 0.000 claims description 49
- 239000012530 fluid Substances 0.000 claims description 35
- 239000000872 buffer Substances 0.000 claims description 29
- 239000002699 waste material Substances 0.000 claims description 11
- 239000000853 adhesive Substances 0.000 claims description 4
- 230000001070 adhesive effect Effects 0.000 claims description 4
- 239000000463 material Substances 0.000 claims description 3
- 230000004044 response Effects 0.000 claims description 3
- 210000004027 cell Anatomy 0.000 description 271
- 238000000034 method Methods 0.000 description 32
- 239000000523 sample Substances 0.000 description 29
- 239000000758 substrate Substances 0.000 description 27
- 238000013461 design Methods 0.000 description 23
- 238000013459 approach Methods 0.000 description 22
- 238000010586 diagram Methods 0.000 description 15
- 230000002123 temporal effect Effects 0.000 description 15
- 239000002245 particle Substances 0.000 description 14
- 239000011521 glass Substances 0.000 description 10
- 230000001960 triggered effect Effects 0.000 description 9
- 230000005284 excitation Effects 0.000 description 8
- 238000003384 imaging method Methods 0.000 description 8
- 230000008569 process Effects 0.000 description 8
- 238000009826 distribution Methods 0.000 description 6
- 238000001917 fluorescence detection Methods 0.000 description 6
- 230000005484 gravity Effects 0.000 description 5
- 230000003993 interaction Effects 0.000 description 5
- 238000000206 photolithography Methods 0.000 description 5
- 238000011084 recovery Methods 0.000 description 5
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 4
- 239000000654 additive Substances 0.000 description 4
- 239000011324 bead Substances 0.000 description 4
- 229940098773 bovine serum albumin Drugs 0.000 description 4
- 230000000694 effects Effects 0.000 description 4
- 238000005530 etching Methods 0.000 description 4
- 239000004033 plastic Substances 0.000 description 4
- 229920003023 plastic Polymers 0.000 description 4
- 230000010287 polarization Effects 0.000 description 4
- 238000005086 pumping Methods 0.000 description 4
- 230000005855 radiation Effects 0.000 description 4
- NIXOWILDQLNWCW-UHFFFAOYSA-N 2-Propenoic acid Natural products OC(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 3
- 230000004913 activation Effects 0.000 description 3
- 238000011109 contamination Methods 0.000 description 3
- 230000008878 coupling Effects 0.000 description 3
- 238000010168 coupling process Methods 0.000 description 3
- 238000005859 coupling reaction Methods 0.000 description 3
- 239000004973 liquid crystal related substance Substances 0.000 description 3
- 230000007246 mechanism Effects 0.000 description 3
- 239000000203 mixture Substances 0.000 description 3
- 229920000642 polymer Polymers 0.000 description 3
- -1 polypropylene Polymers 0.000 description 3
- SMZOUWXMTYCWNB-UHFFFAOYSA-N 2-(2-methoxy-5-methylphenyl)ethanamine Chemical compound COC1=CC=C(C)C=C1CCN SMZOUWXMTYCWNB-UHFFFAOYSA-N 0.000 description 2
- 239000004743 Polypropylene Substances 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 239000007853 buffer solution Substances 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 238000004720 dielectrophoresis Methods 0.000 description 2
- 239000007850 fluorescent dye Substances 0.000 description 2
- 238000010348 incorporation Methods 0.000 description 2
- 239000010954 inorganic particle Substances 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 239000011146 organic particle Substances 0.000 description 2
- 229920003229 poly(methyl methacrylate) Polymers 0.000 description 2
- 239000004926 polymethyl methacrylate Substances 0.000 description 2
- 229920001155 polypropylene Polymers 0.000 description 2
- 239000010453 quartz Substances 0.000 description 2
- 239000012723 sample buffer Substances 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N silicon dioxide Inorganic materials O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- 230000032258 transport Effects 0.000 description 2
- 238000011144 upstream manufacturing Methods 0.000 description 2
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical compound O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- 229920002972 Acrylic fiber Polymers 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 244000007835 Cyamopsis tetragonoloba Species 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 229920002125 Sokalan® Polymers 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 229940072056 alginate Drugs 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 238000000149 argon plasma sintering Methods 0.000 description 1
- 239000000305 astragalus gummifer gum Substances 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 229960001631 carbomer Drugs 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 235000010418 carrageenan Nutrition 0.000 description 1
- 239000000679 carrageenan Substances 0.000 description 1
- 229920001525 carrageenan Polymers 0.000 description 1
- 229940113118 carrageenan Drugs 0.000 description 1
- 230000004656 cell transport Effects 0.000 description 1
- 238000003486 chemical etching Methods 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 239000006059 cover glass Substances 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 1
- 238000005370 electroosmosis Methods 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 238000004049 embossing Methods 0.000 description 1
- 210000003743 erythrocyte Anatomy 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 238000000684 flow cytometry Methods 0.000 description 1
- 238000012921 fluorescence analysis Methods 0.000 description 1
- 238000001215 fluorescent labelling Methods 0.000 description 1
- 230000004907 flux Effects 0.000 description 1
- 238000003306 harvesting Methods 0.000 description 1
- UQEAIHBTYFGYIE-UHFFFAOYSA-N hexamethyldisiloxane Polymers C[Si](C)(C)O[Si](C)(C)C UQEAIHBTYFGYIE-UHFFFAOYSA-N 0.000 description 1
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 1
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 1
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 1
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 1
- 238000005286 illumination Methods 0.000 description 1
- NBQNWMBBSKPBAY-UHFFFAOYSA-N iodixanol Chemical compound IC=1C(C(=O)NCC(O)CO)=C(I)C(C(=O)NCC(O)CO)=C(I)C=1N(C(=O)C)CC(O)CN(C(C)=O)C1=C(I)C(C(=O)NCC(O)CO)=C(I)C(C(=O)NCC(O)CO)=C1I NBQNWMBBSKPBAY-UHFFFAOYSA-N 0.000 description 1
- 229960004359 iodixanol Drugs 0.000 description 1
- 238000010329 laser etching Methods 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 230000000873 masking effect Effects 0.000 description 1
- 239000011859 microparticle Substances 0.000 description 1
- 238000000465 moulding Methods 0.000 description 1
- 238000011527 multiparameter analysis Methods 0.000 description 1
- 239000002105 nanoparticle Substances 0.000 description 1
- 230000009871 nonspecific binding Effects 0.000 description 1
- 238000012634 optical imaging Methods 0.000 description 1
- 239000002953 phosphate buffered saline Substances 0.000 description 1
- 229920000058 polyacrylate Polymers 0.000 description 1
- 229940070721 polyacrylate Drugs 0.000 description 1
- 229920001296 polysiloxane Polymers 0.000 description 1
- 238000003825 pressing Methods 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 238000009790 rate-determining step (RDS) Methods 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 238000010187 selection method Methods 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- ZEYOIOAKZLALAP-UHFFFAOYSA-M sodium amidotrizoate Chemical compound [Na+].CC(=O)NC1=C(I)C(NC(C)=O)=C(I)C(C([O-])=O)=C1I ZEYOIOAKZLALAP-UHFFFAOYSA-M 0.000 description 1
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 1
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 239000000243 solution Substances 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 238000010408 sweeping Methods 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- 230000001052 transient effect Effects 0.000 description 1
- 230000035899 viability Effects 0.000 description 1
- 238000012800 visualization Methods 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
- 238000001039 wet etching Methods 0.000 description 1
- 239000000230 xanthan gum Substances 0.000 description 1
- 235000010493 xanthan gum Nutrition 0.000 description 1
- 229920001285 xanthan gum Polymers 0.000 description 1
- 229940082509 xanthan gum Drugs 0.000 description 1
- UHVMMEOXYDMDKI-JKYCWFKZSA-L zinc;1-(5-cyanopyridin-2-yl)-3-[(1s,2s)-2-(6-fluoro-2-hydroxy-3-propanoylphenyl)cyclopropyl]urea;diacetate Chemical compound [Zn+2].CC([O-])=O.CC([O-])=O.CCC(=O)C1=CC=C(F)C([C@H]2[C@H](C2)NC(=O)NC=2N=CC(=CC=2)C#N)=C1O UHVMMEOXYDMDKI-JKYCWFKZSA-L 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N15/00—Investigating characteristics of particles; Investigating permeability, pore-volume, or surface-area of porous materials
- G01N15/10—Investigating individual particles
- G01N15/14—Electro-optical investigation, e.g. flow cytometers
- G01N15/1456—Electro-optical investigation, e.g. flow cytometers without spatial resolution of the texture or inner structure of the particle, e.g. processing of pulse signals
- G01N15/1459—Electro-optical investigation, e.g. flow cytometers without spatial resolution of the texture or inner structure of the particle, e.g. processing of pulse signals the analysis being performed on a sample stream
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/502761—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip specially adapted for handling suspended solids or molecules independently from the bulk fluid flow, e.g. for trapping or sorting beads, for physically stretching molecules
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/502769—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by multiphase flow arrangements
- B01L3/502776—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by multiphase flow arrangements specially adapted for focusing or laminating flows
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/06—Fluid handling related problems
- B01L2200/0636—Focussing flows, e.g. to laminate flows
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/06—Fluid handling related problems
- B01L2200/0647—Handling flowable solids, e.g. microscopic beads, cells, particles
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0809—Geometry, shape and general structure rectangular shaped
- B01L2300/0816—Cards, e.g. flat sample carriers usually with flow in two horizontal directions
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0861—Configuration of multiple channels and/or chambers in a single devices
- B01L2300/0864—Configuration of multiple channels and/or chambers in a single devices comprising only one inlet and multiple receiving wells, e.g. for separation, splitting
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/04—Moving fluids with specific forces or mechanical means
- B01L2400/0403—Moving fluids with specific forces or mechanical means specific forces
- B01L2400/0406—Moving fluids with specific forces or mechanical means specific forces capillary forces
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/04—Moving fluids with specific forces or mechanical means
- B01L2400/0403—Moving fluids with specific forces or mechanical means specific forces
- B01L2400/0415—Moving fluids with specific forces or mechanical means specific forces electrical forces, e.g. electrokinetic
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/04—Moving fluids with specific forces or mechanical means
- B01L2400/0403—Moving fluids with specific forces or mechanical means specific forces
- B01L2400/0454—Moving fluids with specific forces or mechanical means specific forces radiation pressure, optical tweezers
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/04—Moving fluids with specific forces or mechanical means
- B01L2400/0475—Moving fluids with specific forces or mechanical means specific mechanical means and fluid pressure
- B01L2400/0487—Moving fluids with specific forces or mechanical means specific mechanical means and fluid pressure fluid pressure, pneumatics
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/502707—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by the manufacture of the container or its components
-
- G01N15/149—
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T436/00—Chemistry: analytical and immunological testing
- Y10T436/25—Chemistry: analytical and immunological testing including sample preparation
- Y10T436/2575—Volumetric liquid transfer
Description
本願は、出典明示して本明細書の一部とみなす、"Microsorter Cartridge"なる発明の名称で2003年8月28日に出願した米国仮特許出願番号60/499,294および"Optical Switch to Enable Cell Sorting in a Microfluidic Channel Network"なる発明の名称で2004年5月26日に出願した米国仮特許出願番号60/574,897に基づく優先権を主張する。
本発明は、マイクロ流体チャネルネットワークを通る標的細胞の選択的ルート設定を可能にする光学スイッチを配して非標的細胞からそれをソートし、それを収集するための、該ネットワークにおける光圧力の使用のための方法および装置に関する。
従来の蛍光活性化セルソーター(FACS)が、研究および臨床的な応用において広く使用されている1。これらの機器は非常に迅速なマルチパラメーター分析およびソーティングが可能であるが、一般的に大きな試料容量、操作およびメインテナンスのための訓練されたオペレーターを必要とし、しかも滅菌が困難である。FACS機器は10,000ほどの少ない細胞および何千万ほども多い細胞を分析することができる。しかしながら、100,000未満の細胞の場合には、ソーティングを行う能力が減じられる1。磁気ビーズのような他の分離方法はFACSほど多い細胞を必要としないが、それは非特異的な結合、細胞およびビーズの凝集、およびビーズ自体がその後の処理工程において妨げとなり得るという可能性に苦しめられる。したがって、一次組織からの貴重な小さい試料または細胞をソーティングするために、少ない細胞数の小容量の試料を取り扱うことができ、かつ、ソートした集団の効率的な回収を許容するセルソーターは、ユニークな科学的市場の隙間を扱う。
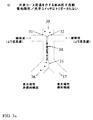
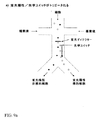
以下に記載するように、これらの光圧力を用いて、セルソーティングシステムとして作動可能なマイクロ流体チャネルネットワークにおける光学スイッチを実現する。光学スイッチは、光散乱のような他の検出属性も光学スイッチの活性化のために等しく使用し得るが、光学スイッチ位置の上流のマイクロ流体チャネルネットワークで流動している標的細胞からの蛍光シグナルを検出することによってトリガーされる。光学スイッチを用いて、基礎をなす流動を改変することなく、細胞または粒子を複数の出力チャネル流動ストリームの1に方向付け、それによって目的の細胞をさらに使用するために収集する。マイクロ流体チャネル中の流動は、典型的には非常に低いレイノルド数の層であることは重要である。その結果、特定の層中または流動ストリーム中で流動しているいずれの細胞も、層を横切るいずれかの力が存在しなければその流動ストリーム中に留まるであろう。光学スイッチは細胞に対する光圧力を利用してまさにこれを成し遂げ、細胞の輸送は層を横切り、1の出力チャネルを通る分岐接合部を出る流動ストリームから第2の出力チャネルを通る分岐接合部を出る流動ストリームに運動する。
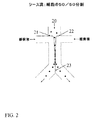
図1は、1x2マイクロ流体チャネルネットワーク、すなわち1の主入力チャネル(11)および分岐接合部から延在する2の出力チャネル(12)および(13)を有するネットワーク、中で細胞をソートするように作用する光学スイッチ(10)の1の態様を示している。分岐接合部の“Y”構造を図1に示すが、“T”構造のような他の分岐も使用し得る。一般的に、これらのマイクロ流体チャネルは光学的に透明な基体で製造されており、光学スイッチおよび他の細胞検出光学構成部品のチャネルへの投射を可能にする。この基体は、典型的には、限定されるものではないがガラス、クウォーツ、プラスチック、例えばポリメチルメタクリレート(PMMA)ほか、および他のキャスト可能または作用可能なポリマー(例えば、ポリジメチルシロキサン、PDMSまたはSU8)である。マイクロ流体チャネルの深さは、典型的には、限定されるものではないが10μmないし100μmの範囲である。マイクロ流体チャネルの幅は、典型的には、限定されるものではないが深さの1ないし5倍である。断面は、典型的には矩形、またはガラス基体のフォトリソグラフィーマスク形成につづくチャネルの等方エッチングによって製作したマイクロ流体チャネルの場合は四半円形角(quarter-round corner)を有する矩形である。
1. H. M. Shapiro, Practical flow cytometry, Wiley-Liss, New York, 2003.
2. Y. Fu, C. Spence, A. Scherer, F. H. Arnold and S. R. A. Quake, “Microfabricated fluorescence-activated cell sorter,” Nat. Biotechnol. 17, pp. 1109-1111, 1999.
3. Y. Fu, H.-P. Chou, C. Spence, F. H. Arnold, and S. R. Quake, “An integrated microfabricated cell sorter,” Anal. Chem. 74, pp. 2451-2457, 2002.
4. Wolff, I. R. Perch-Nielsen, U. D. Larsen, P. Friis, G. Goranovic, C. R. Poulsen, J. P. Kutter and P. Telleman, “Integrating advanced functionality in a microfabricated high-throughput fluorescent-activated cell sorter,” Lab Chip 3, pp. 22-27, 2003.
5. Li, P. C. H. & Harrison, D. J. Transport, manipulation, and reaction of biological cells on-chip using electrokinetic effects. Anal. Chem. 69, 1564-1568 (1997).
6. Dittrich, P. S. & Schwille, P. An integrated microfluidic system for reaction, high-sensitivity detection, and sorting of fluorescent cells and particles. Anal. Chem. 75, 5767-5774 (2003).
7. Fiedler, S., Shirley, S. G., Schnelle, T. & Fuhr, G. Dielectrophoretic sorting of particles and cells in a microsystem. Anal. Chem. 70, 1909-1915 (1998).
8. Y. Huang, K. L. Ewalt, M. Tirado, R. Haigis, A. Forster, D. Ackley, M. J. Heller, J. P. O'Connell, M. T. Krihak, “Electric manipulation of bioparticles and macromolecules on microfabricated electrodes,” Anal. Chem. 73, pp.1549-1559, 2001.
9. M. Durr, J. Kentsch, T. Muller, T. Schnelle and M. Stelzle, “Microdevices for manipulation and accumulation of micro- and nanoparticles by dielectrophoresis,” Electrophoresis 24, pp. 722-731, 2003.
10. T. N. Buican, M. J. Smyth, H. A. Crissman, G. C. Salzman, C. C. Stewart and J. C. Martin, “Automated single-cell manipulation and sorting by light trapping,” Appl. Opt. 26, pp. 5311-5316, 1987.
Claims (10)
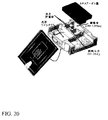
- カートリッジ、チップ、蓋、ディテクターおよび水平力スイッチを含むマイクロ流体分析およびソーティング用の一体化された構造物であって、
該カートリッジは、
光学ウィンドウ、
少なくとも:
試料細胞体積を含むように適合した試料貯留部、
緩衝液流体を含むように適合した流体貯留部、
廃棄物貯留部、および
標的収集貯留部
を含む複数の貯留部を含み、
該チップは、少なくとも:
入口、検出領域および分岐したソーティング領域を有する主チャネル;
試料入口チャネル、ここに試料入口チャネルは試料貯留部および主チャネル入口に流体的に結合しており、
1またはそれを超える流体入口チャネル、ここに該流体入口チャネルは該流体貯留部および該主チャネル入口に流体的に結合しており、
少なくとも廃棄チャネルおよび標的チャネルを含む少なくとも2の出口チャネル、ここに該廃棄チャネルは該主チャネルの分岐したソーティング領域および該廃棄物貯留部に流体的に結合し、該標的チャネルは該主チャネルの分岐したソーティング領域および該標的収集貯留部に結合しており、
ここに、該チップは光学ウィンドウに隣接して配置されており、
を含むマイクロ流体チャネルネットワークを含み、
該蓋は、少なくとも:
圧力式圧力出入口、該出入口は入口を有し、該試料貯留部および該流体貯留部のうちの少なくとも1に結合しており、および
該圧力式圧力出入口の入口と該試料貯留部および該流体貯留部のうちの少なくとも1との間に配置されたフィルタを含み、
該ディテクターは、検出領域中の与えられた状態の細胞を検出するよう、および、それに応答してシグナルを発生するように適合し、および
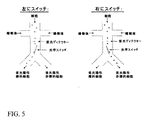
該水平力スイッチは、該ディテクターに結合し、該シグナルに応答して作動可能であり、検出領域を通る流動ストリームに対してある角度で検出領域の縦方向を下流に移動するように構成されたレーザースポットを含み、
これによって、与えられた状態の細胞が検出された場合に、水平力スイッチが活性化して細胞が流動する際に細胞のそばのレーザースポットをスウィープして、細胞が分岐したソーティング領域から少なくとも2の出口チャネルのうちの1に選択的に出て行くように運動するように細胞に水平力を与える
ことを特徴とする該一体化された構造物。 - 該試料貯留部が、円錐形、先細りであって、またはさらに細胞付着を最小限化する材料からなるインサートを含む、請求項1記載のマイクロ流体分析およびソーティング用の一体化された構造物。
- 該蓋が、試料貯留部、標的収集貯留部、廃棄物貯留部および1またはそれを超える流体貯留部よりなる群のための独立した圧力式圧力出入口を含む、請求項1記載のマイクロ流体分析およびソーティング用の一体化された構造物。
- 該蓋が、貯留部に対する光学アクセスを提供する、請求項1記載のマイクロ流体分析およびソーティング用の一体化された構造物。
- 該蓋が、カートリッジに結合したスナップ−オン付属物を含む、請求項1記載のマイクロ流体分析およびソーティング用の一体化された構造物。
- 該フィルタが、以下の特性:気体透過性および流体不透過性、のうちの1またはそれを超えるものを有する、請求項1記載のマイクロ流体分析およびソーティング用の一体化された構造物。
- 該流体入口チャネルおよび該流体出口チャネルが異なる幅を有する、請求項1記載のマイクロ流体分析およびソーティング用の一体化された構造物。
- 接着剤が該チップと該カートリッジとの間に配置されている、請求項1記載のマイクロ流体分析およびソーティング用の一体化された構造物。
- さらに、該蓋とカートリッジとの間にガスケットを含む、請求項1記載のマイクロ流体分析およびソーティング用の一体化された構造物。
- 該チップおよびカートリッジが2の別の構造物を含む、請求項1記載のマイクロ流体分析およびソーティング用の一体化された構造物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US49929403P | 2003-08-28 | 2003-08-28 | |
| US57489704P | 2004-05-26 | 2004-05-26 | |
| PCT/US2004/028213 WO2005022147A1 (en) | 2003-08-28 | 2004-08-27 | Methods and apparatus for sorting cells using an optical switch in a microfluidic channel network |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2007504446A JP2007504446A (ja) | 2007-03-01 |
| JP2007504446A5 JP2007504446A5 (ja) | 2007-10-11 |
| JP4533382B2 true JP4533382B2 (ja) | 2010-09-01 |
Family
ID=34278657
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006524942A Expired - Fee Related JP4533382B2 (ja) | 2003-08-28 | 2004-08-27 | マイクロ流体分析およびソーティング用の一体化された構造物 |
Country Status (7)
| Country | Link |
|---|---|
| US (2) | US7745221B2 (ja) |
| EP (1) | EP1668355A4 (ja) |
| JP (1) | JP4533382B2 (ja) |
| CN (1) | CN1860363B (ja) |
| AU (1) | AU2004269406B2 (ja) |
| CA (1) | CA2536360C (ja) |
| WO (1) | WO2005022147A1 (ja) |
Families Citing this family (186)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2006507921A (ja) * | 2002-06-28 | 2006-03-09 | プレジデント・アンド・フェロウズ・オブ・ハーバード・カレッジ | 流体分散のための方法および装置 |
| US7699767B2 (en) * | 2002-07-31 | 2010-04-20 | Arryx, Inc. | Multiple laminar flow-based particle and cellular separation with laser steering |
| US11243494B2 (en) | 2002-07-31 | 2022-02-08 | Abs Global, Inc. | Multiple laminar flow-based particle and cellular separation with laser steering |
| EP2359689B1 (en) | 2002-09-27 | 2015-08-26 | The General Hospital Corporation | Microfluidic device for cell separation and use thereof |
| GB0307428D0 (en) | 2003-03-31 | 2003-05-07 | Medical Res Council | Compartmentalised combinatorial chemistry |
| GB0307403D0 (en) | 2003-03-31 | 2003-05-07 | Medical Res Council | Selection by compartmentalised screening |
| US20060078893A1 (en) | 2004-10-12 | 2006-04-13 | Medical Research Council | Compartmentalised combinatorial chemistry by microfluidic control |
| WO2004091763A2 (en) | 2003-04-10 | 2004-10-28 | President And Fellows Of Harvard College | Formation and control of fluidic species |
| AU2004241455A1 (en) * | 2003-05-16 | 2004-12-02 | University Of Chicago | Optical fractionation methods and apparatus |
| KR20070029618A (ko) | 2003-08-27 | 2007-03-14 | 더 프레지던트 앤드 펠로우즈 오브 하바드 칼리지 | 유체종의 전자적 제어 |
| CA2536360C (en) * | 2003-08-28 | 2013-08-06 | Celula, Inc. | Methods and apparatus for sorting cells using an optical switch in a microfluidic channel network |
| EP1682438B1 (en) | 2003-10-30 | 2013-05-08 | Cytonome/ST, LLC | Multilayer hydrodynamic sheath flow structure |
| US20050221339A1 (en) | 2004-03-31 | 2005-10-06 | Medical Research Council Harvard University | Compartmentalised screening by microfluidic control |
| US9477233B2 (en) | 2004-07-02 | 2016-10-25 | The University Of Chicago | Microfluidic system with a plurality of sequential T-junctions for performing reactions in microdroplets |
| US8124032B2 (en) * | 2004-07-16 | 2012-02-28 | Simon Fraser University | Microfluidic device and method of using same |
| US7968287B2 (en) | 2004-10-08 | 2011-06-28 | Medical Research Council Harvard University | In vitro evolution in microfluidic systems |
| US9492400B2 (en) | 2004-11-04 | 2016-11-15 | Massachusetts Institute Of Technology | Coated controlled release polymer particles as efficient oral delivery vehicles for biopharmaceuticals |
| WO2006052822A2 (en) * | 2004-11-05 | 2006-05-18 | Cytolution, Inc. | Methods and devices for screening cervical cancer |
| US7615762B2 (en) * | 2004-12-03 | 2009-11-10 | Nano Science Diagnostics, Inc. | Method and apparatus for low quantity detection of bioparticles in small sample volumes |
| US20070054119A1 (en) * | 2005-03-04 | 2007-03-08 | Piotr Garstecki | Systems and methods of forming particles |
| CA2599683A1 (en) | 2005-03-04 | 2006-09-14 | President And Fellows Of Harvard College | Method and apparatus for forming multiple emulsions |
| US20070196820A1 (en) | 2005-04-05 | 2007-08-23 | Ravi Kapur | Devices and methods for enrichment and alteration of cells and other particles |
| EP1874920A4 (en) * | 2005-04-05 | 2009-11-04 | Cellpoint Diagnostics | DEVICES AND METHODS FOR ENRICHING AND MODIFYING CIRCULATING TUMOR CELLS AND OTHER PARTICLES |
| US7574076B2 (en) * | 2005-04-08 | 2009-08-11 | Arryx, Inc. | Apparatus for optically-based sorting within liquid core waveguides |
| FR2888932A1 (fr) * | 2005-07-19 | 2007-01-26 | Commissariat Energie Atomique | Procede de calibration d'un dispositif de tri en flux de particules |
| US8921102B2 (en) | 2005-07-29 | 2014-12-30 | Gpb Scientific, Llc | Devices and methods for enrichment and alteration of circulating tumor cells and other particles |
| US20070095667A1 (en) * | 2005-10-27 | 2007-05-03 | Applera Corporation | Optoelectronic Separation of Biomolecules |
| WO2007070682A2 (en) | 2005-12-15 | 2007-06-21 | Massachusetts Institute Of Technology | System for screening particles |
| WO2007081387A1 (en) | 2006-01-11 | 2007-07-19 | Raindance Technologies, Inc. | Microfluidic devices, methods of use, and kits for performing diagnostics |
| AU2007210152A1 (en) * | 2006-01-27 | 2007-08-09 | President And Fellows Of Harvard College | Fluidic droplet coalescence |
| ES2776100T3 (es) | 2006-03-31 | 2020-07-29 | Massachusetts Inst Technology | Sistema para el suministro dirigido de agentes terapéuticos |
| US20080003142A1 (en) | 2006-05-11 | 2008-01-03 | Link Darren R | Microfluidic devices |
| US9562837B2 (en) | 2006-05-11 | 2017-02-07 | Raindance Technologies, Inc. | Systems for handling microfludic droplets |
| US9074242B2 (en) | 2010-02-12 | 2015-07-07 | Raindance Technologies, Inc. | Digital analyte analysis |
| JP5630998B2 (ja) | 2006-05-15 | 2014-11-26 | マサチューセッツ インスティテュート オブ テクノロジー | 機能的粒子のためのポリマー |
| JP2007301534A (ja) * | 2006-05-15 | 2007-11-22 | Ebara Corp | 微細化装置 |
| JP5032792B2 (ja) * | 2006-05-22 | 2012-09-26 | 浜松ホトニクス株式会社 | 細胞選別装置 |
| FR2901717A1 (fr) | 2006-05-30 | 2007-12-07 | Centre Nat Rech Scient | Procede de traitement de gouttes dans un circuit microfluidique. |
| US20080050739A1 (en) | 2006-06-14 | 2008-02-28 | Roland Stoughton | Diagnosis of fetal abnormalities using polymorphisms including short tandem repeats |
| EP2589668A1 (en) | 2006-06-14 | 2013-05-08 | Verinata Health, Inc | Rare cell analysis using sample splitting and DNA tags |
| US20080070792A1 (en) | 2006-06-14 | 2008-03-20 | Roland Stoughton | Use of highly parallel snp genotyping for fetal diagnosis |
| US8137912B2 (en) | 2006-06-14 | 2012-03-20 | The General Hospital Corporation | Methods for the diagnosis of fetal abnormalities |
| WO2007150030A2 (en) * | 2006-06-23 | 2007-12-27 | Massachusetts Institute Of Technology | Microfluidic synthesis of organic nanoparticles |
| US9012390B2 (en) | 2006-08-07 | 2015-04-21 | Raindance Technologies, Inc. | Fluorocarbon emulsion stabilizing surfactants |
| US7676122B2 (en) * | 2006-12-11 | 2010-03-09 | Jiahua James Dou | Apparatus, system and method for particle manipulation using waveguides |
| CA2580589C (en) * | 2006-12-19 | 2016-08-09 | Fio Corporation | Microfluidic detection system |
| US8772046B2 (en) | 2007-02-06 | 2014-07-08 | Brandeis University | Manipulation of fluids and reactions in microfluidic systems |
| EP2134830A2 (en) | 2007-02-09 | 2009-12-23 | Massachusetts Institute of Technology | Oscillating cell culture bioreactor |
| US7776927B2 (en) * | 2007-03-28 | 2010-08-17 | President And Fellows Of Harvard College | Emulsions and techniques for formation |
| JP2010523595A (ja) | 2007-04-04 | 2010-07-15 | マサチューセッツ インスティテュート オブ テクノロジー | ポリ(アミノ酸)ターゲッティング部分 |
| US8186913B2 (en) | 2007-04-16 | 2012-05-29 | The General Hospital Corporation | Systems and methods for particle focusing in microchannels |
| WO2008130623A1 (en) | 2007-04-19 | 2008-10-30 | Brandeis University | Manipulation of fluids, fluid components and reactions in microfluidic systems |
| US8691164B2 (en) * | 2007-04-20 | 2014-04-08 | Celula, Inc. | Cell sorting system and methods |
| WO2009021215A1 (en) * | 2007-08-09 | 2009-02-12 | Celula, Inc. | Methods and devices for correlated, multi-parameter single cell measurements and recovery of remnant biological material |
| WO2009051837A2 (en) | 2007-10-12 | 2009-04-23 | Massachusetts Institute Of Technology | Vaccine nanotechnology |
| JP4539707B2 (ja) | 2007-10-25 | 2010-09-08 | ソニー株式会社 | 微小粒子分取装置及び微小粒子分取用基板、並びに微小粒子分取方法 |
| WO2009131722A2 (en) * | 2008-01-24 | 2009-10-29 | Sandia National Laboratories | Methods and devices for immobilization of single particles |
| CN102076841B (zh) * | 2008-06-27 | 2015-04-22 | 古河电气工业株式会社 | 细胞的识别和分选方法及其装置 |
| EP4047367A1 (en) | 2008-07-18 | 2022-08-24 | Bio-Rad Laboratories, Inc. | Method for detecting target analytes with droplet libraries |
| WO2010023596A1 (en) * | 2008-08-25 | 2010-03-04 | Koninklijke Philips Electronics N.V. | Reconfigurable microfluidic filter |
| SI2334812T1 (sl) | 2008-09-20 | 2017-05-31 | The Board of Trustees of the Leland Stanford Junior University Office of the General Counsel Building 170 | Neinvazivna diagnoza fetalne anevploidije s sekvenciranjem |
| US8343497B2 (en) | 2008-10-12 | 2013-01-01 | The Brigham And Women's Hospital, Inc. | Targeting of antigen presenting cells with immunonanotherapeutics |
| US8591905B2 (en) | 2008-10-12 | 2013-11-26 | The Brigham And Women's Hospital, Inc. | Nicotine immunonanotherapeutics |
| US8343498B2 (en) | 2008-10-12 | 2013-01-01 | Massachusetts Institute Of Technology | Adjuvant incorporation in immunonanotherapeutics |
| US8277812B2 (en) | 2008-10-12 | 2012-10-02 | Massachusetts Institute Of Technology | Immunonanotherapeutics that provide IgG humoral response without T-cell antigen |
| KR101023040B1 (ko) * | 2008-11-13 | 2011-03-24 | 한국항공대학교산학협력단 | 고속 입자분리 장치 및 그 방법 |
| US9051602B2 (en) | 2008-12-22 | 2015-06-09 | Celula, Inc. | Methods and genotyping panels for detecting alleles, genomes, and transcriptomes |
| US8162149B1 (en) | 2009-01-21 | 2012-04-24 | Sandia Corporation | Particle sorter comprising a fluid displacer in a closed-loop fluid circuit |
| US9134221B2 (en) | 2009-03-10 | 2015-09-15 | The Regents Of The University Of California | Fluidic flow cytometry devices and particle sensing based on signal-encoding |
| US9645010B2 (en) | 2009-03-10 | 2017-05-09 | The Regents Of The University Of California | Fluidic flow cytometry devices and methods |
| US8528589B2 (en) | 2009-03-23 | 2013-09-10 | Raindance Technologies, Inc. | Manipulation of microfluidic droplets |
| US8689981B2 (en) | 2009-04-10 | 2014-04-08 | President And Fellows Of Harvard College | Manipulation of particles in channels |
| WO2010120818A2 (en) * | 2009-04-13 | 2010-10-21 | University Of Washington | Ensemble-decision aliquot ranking |
| CA2764678C (en) | 2009-06-04 | 2017-12-12 | Lockheed Martin Corporation | Multiple-sample microfluidic chip for dna analysis |
| US8535536B1 (en) * | 2009-07-04 | 2013-09-17 | University Of Utah Research Foundation | Cross-flow split-thin-flow cell |
| US9605298B2 (en) | 2009-08-06 | 2017-03-28 | Cornell University | Device and methods for molecular analysis |
| US8202486B2 (en) * | 2009-08-12 | 2012-06-19 | Caliper Life Sciences, Inc. | Pinching channels for fractionation of fragmented samples |
| BR112012004719A2 (pt) | 2009-09-02 | 2016-04-05 | Harvard College | emulsões múltiplas criadas por uso de jateamento e outras técnicas |
| WO2011042564A1 (en) | 2009-10-09 | 2011-04-14 | Universite De Strasbourg | Labelled silica-based nanomaterial with enhanced properties and uses thereof |
| JP5823405B2 (ja) | 2009-11-04 | 2015-11-25 | ザ ユニバーシティ オブ ブリティッシュ コロンビア | 核酸含有脂質粒子および関連方法 |
| EP2517025B1 (en) | 2009-12-23 | 2019-11-27 | Bio-Rad Laboratories, Inc. | Methods for reducing the exchange of molecules between droplets |
| US9366632B2 (en) | 2010-02-12 | 2016-06-14 | Raindance Technologies, Inc. | Digital analyte analysis |
| US9399797B2 (en) | 2010-02-12 | 2016-07-26 | Raindance Technologies, Inc. | Digital analyte analysis |
| US10351905B2 (en) | 2010-02-12 | 2019-07-16 | Bio-Rad Laboratories, Inc. | Digital analyte analysis |
| KR101120137B1 (ko) * | 2010-03-10 | 2012-05-17 | 주식회사 넥스비보 | 미소입자 선택적 포획-회수 장치 |
| US8774488B2 (en) | 2010-03-11 | 2014-07-08 | Cellscape Corporation | Method and device for identification of nucleated red blood cells from a maternal blood sample |
| ITTO20100068U1 (it) * | 2010-04-20 | 2011-10-21 | Eltek Spa | Dispositivi microfluidici e/o attrezzature per dispositivi microfluidici |
| WO2012045012A2 (en) | 2010-09-30 | 2012-04-05 | Raindance Technologies, Inc. | Sandwich assays in droplets |
| US8969071B2 (en) * | 2010-10-13 | 2015-03-03 | Lawrence Livermore National Security, Llc | Passive chip-based droplet sorting |
| CA2814720C (en) | 2010-10-15 | 2016-12-13 | Lockheed Martin Corporation | Micro fluidic optic design |
| WO2012054904A2 (en) | 2010-10-21 | 2012-04-26 | The Regents Of The University Of California | Microfluidics with wirelessly powered electronic circuits |
| CN102019277B (zh) * | 2010-10-29 | 2013-05-22 | 北京惟馨雨生物科技有限公司 | 一种用于细胞和颗粒分离的分选仪及分选方法 |
| JP2012095603A (ja) * | 2010-11-02 | 2012-05-24 | Univ Of Fukui | 遺伝子発現状態追跡装置 |
| US10908066B2 (en) | 2010-11-16 | 2021-02-02 | 1087 Systems, Inc. | Use of vibrational spectroscopy for microfluidic liquid measurement |
| EP2661614A2 (en) * | 2011-01-03 | 2013-11-13 | Cytonome/ST, LLC | Method and apparatus for monitoring and optimizing particle sorting |
| US8822207B2 (en) | 2011-01-21 | 2014-09-02 | Owl biomedical, Inc. | Cartridge for MEMS particle sorting system |
| EP3859011A1 (en) | 2011-02-11 | 2021-08-04 | Bio-Rad Laboratories, Inc. | Methods for forming mixed droplets |
| WO2012112804A1 (en) | 2011-02-18 | 2012-08-23 | Raindance Technoligies, Inc. | Compositions and methods for molecular labeling |
| EP2490005A1 (en) * | 2011-02-18 | 2012-08-22 | Koninklijke Philips Electronics N.V. | Microfluidic resistance network and microfluidic device |
| CN102175590A (zh) * | 2011-03-23 | 2011-09-07 | 重庆天海医疗设备有限公司 | 一种显微检测用一次性计数板 |
| US8528582B2 (en) | 2011-04-28 | 2013-09-10 | The United States Of America As Represented By The Secretary Of The Navy | Method of changing fluid flow by using an optical beam |
| JP6122843B2 (ja) | 2011-05-23 | 2017-04-26 | プレジデント アンド フェローズ オブ ハーバード カレッジ | 多重エマルジョンを含むエマルジョンの制御 |
| US8841071B2 (en) | 2011-06-02 | 2014-09-23 | Raindance Technologies, Inc. | Sample multiplexing |
| WO2012167142A2 (en) | 2011-06-02 | 2012-12-06 | Raindance Technolgies, Inc. | Enzyme quantification |
| CN103764265A (zh) | 2011-07-06 | 2014-04-30 | 哈佛学院院长等 | 多重乳剂和用于配制多重乳剂的技术 |
| EP2732053B1 (en) * | 2011-07-14 | 2017-10-25 | Progenity, Inc. | Systems, apparatus and methods for biochemical analysis |
| US8658430B2 (en) | 2011-07-20 | 2014-02-25 | Raindance Technologies, Inc. | Manipulating droplet size |
| US9242248B2 (en) * | 2011-09-16 | 2016-01-26 | The University Of North Carolina At Charlotte | Methods and devices for optical sorting of microspheres based on their resonant optical properties |
| US9841367B2 (en) * | 2011-09-16 | 2017-12-12 | The University Of North Carolina At Charlotte | Methods and devices for optical sorting of microspheres based on their resonant optical properties |
| EP3069785A1 (en) | 2011-10-25 | 2016-09-21 | The University Of British Columbia | Limit size lipid nanoparticles and related methods |
| CN103175950B (zh) * | 2011-12-20 | 2015-04-22 | 中国科学院深圳先进技术研究院 | 血细胞分析芯片及应用该芯片的系统 |
| US9108196B1 (en) * | 2012-01-24 | 2015-08-18 | Stratedigm, Inc. | Method and apparatus for control of fluid flow or fluid suspended particle flow in a microfluidic channel |
| US9322054B2 (en) | 2012-02-22 | 2016-04-26 | Lockheed Martin Corporation | Microfluidic cartridge |
| RU2510509C1 (ru) * | 2012-07-16 | 2014-03-27 | Федеральное государственное бюджетное учреждение науки Институт цитологии и генетики Сибирского отделения Российской академии наук | Микрофлюидная система для проведения иммуноанализа |
| US9372144B2 (en) * | 2013-10-01 | 2016-06-21 | Owl biomedical, Inc. | Particle manipulation system with out-of-plane channel |
| US11898954B2 (en) * | 2012-08-01 | 2024-02-13 | Owl biomedical, Inc. | Particle manipulation system with camera/classifier confirmation and deep learning algorithm |
| US9194786B2 (en) * | 2012-08-01 | 2015-11-24 | Owl biomedical, Inc. | Particle manipulation system with cytometric capability |
| US9168568B2 (en) | 2012-08-01 | 2015-10-27 | Owl biomedical, Inc. | Particle manipulation system with cytometric confirmation |
| CN110579435B (zh) | 2012-10-15 | 2023-09-26 | 纳诺赛莱克特生物医药股份有限公司 | 颗粒分选的系统、设备和方法 |
| TWI498593B (zh) | 2012-11-06 | 2015-09-01 | Ind Tech Res Inst | 投影鏡頭、使用其之投影裝置及光驅動微粒子裝置 |
| WO2014078785A1 (en) * | 2012-11-19 | 2014-05-22 | The General Hospital Corporation | System and method for integrated multiplexed photometry module |
| US10215687B2 (en) | 2012-11-19 | 2019-02-26 | The General Hospital Corporation | Method and system for integrated mutliplexed photometry module |
| CN103105352A (zh) * | 2013-01-28 | 2013-05-15 | 大连海事大学 | 一种快速检测船舶压载水中存活单细胞生物的装置和方法 |
| WO2014138715A1 (en) * | 2013-03-08 | 2014-09-12 | Duke University | Devices, systems, and methods for acoustically -enhanced magnetophoresis |
| EP2972212B1 (en) | 2013-03-14 | 2022-12-21 | Cytonome/ST, LLC | Hydrodynamic focusing apparatus and methods |
| BR112015023155B1 (pt) * | 2013-03-14 | 2022-09-20 | Inguran, Llc | Dispositivo e métodos de triagem de elevado rendimento de espermatozóides |
| CN105264127B (zh) | 2013-03-15 | 2019-04-09 | Gpb科学有限责任公司 | 颗粒的片上微流体处理 |
| WO2014172045A1 (en) | 2013-03-15 | 2014-10-23 | The University Of British Columbia | Lipid nanoparticles for transfection and related methods |
| US20150064153A1 (en) | 2013-03-15 | 2015-03-05 | The Trustees Of Princeton University | High efficiency microfluidic purification of stem cells to improve transplants |
| US10324011B2 (en) | 2013-03-15 | 2019-06-18 | The Trustees Of Princeton University | Methods and devices for high throughput purification |
| KR101412777B1 (ko) | 2013-03-29 | 2014-07-01 | 성원기 | 다성분 동시 정량 분석용 측방 유동 디바이스 |
| JP2016527494A (ja) | 2013-07-05 | 2016-09-08 | ユニバーシティ オブ ワシントン スルー イッツ センター フォー コマーシャライゼーション | マイクロ流体アッセイのための方法、組成物およびシステム |
| US8961904B2 (en) | 2013-07-16 | 2015-02-24 | Premium Genetics (Uk) Ltd. | Microfluidic chip |
| US9863865B2 (en) | 2013-10-01 | 2018-01-09 | Owl biomedical, Inc. | Cell sorting system using electromagnetic solenoid |
| US9404838B2 (en) | 2013-10-01 | 2016-08-02 | Owl biomedical, Inc. | Particle manipulation system with out-of-plane channel and focusing element |
| US9604214B2 (en) * | 2013-10-01 | 2017-03-28 | Owl biomedical, Inc. | Cell sorting system using microfabricated components |
| US11901041B2 (en) | 2013-10-04 | 2024-02-13 | Bio-Rad Laboratories, Inc. | Digital analysis of nucleic acid modification |
| US11796449B2 (en) | 2013-10-30 | 2023-10-24 | Abs Global, Inc. | Microfluidic system and method with focused energy apparatus |
| SG2013090790A (en) * | 2013-12-04 | 2015-07-30 | Clearbridge Mfluidics Pte Ltd | A microfluidic device |
| US9944977B2 (en) | 2013-12-12 | 2018-04-17 | Raindance Technologies, Inc. | Distinguishing rare variations in a nucleic acid sequence from a sample |
| WO2015103367A1 (en) | 2013-12-31 | 2015-07-09 | Raindance Technologies, Inc. | System and method for detection of rna species |
| US9453787B2 (en) * | 2014-03-05 | 2016-09-27 | Owl biomedical, Inc. | MEMS-based single particle separation system |
| US8820538B1 (en) | 2014-03-17 | 2014-09-02 | Namocell LLC | Method and apparatus for particle sorting |
| EP3120130B1 (en) | 2014-03-18 | 2023-07-26 | The Regents of the University of California | Parallel flow cytometer using radiofrequency mulitplexing, and method |
| CN103911275B (zh) * | 2014-04-03 | 2015-08-05 | 河北工业大学 | 一种用于细胞筛选的微流控芯片 |
| WO2016031486A1 (ja) | 2014-08-28 | 2016-03-03 | シスメックス株式会社 | 粒子撮像装置および粒子撮像方法 |
| WO2016030726A1 (en) * | 2014-08-29 | 2016-03-03 | Synaptive Medical (Barbados) Inc. | Molecular cell imaging using optical spectroscopy |
| US20170299492A1 (en) | 2014-09-30 | 2017-10-19 | Foss Analytical A/S | Method, device and system for hydrodynamic flow focusing |
| WO2016063364A1 (ja) * | 2014-10-22 | 2016-04-28 | 株式会社日立ハイテクノロジーズ | 細胞計測機構及びそれを有する細胞培養装置並びに細胞計測方法 |
| EP4137798A1 (en) | 2015-02-19 | 2023-02-22 | 1087 Systems, Inc. | Scanning infrared measurement system |
| US10976232B2 (en) | 2015-08-24 | 2021-04-13 | Gpb Scientific, Inc. | Methods and devices for multi-step cell purification and concentration |
| WO2017035287A1 (en) * | 2015-08-27 | 2017-03-02 | President And Fellows Of Harvard College | Acoustic wave sorting |
| US10647981B1 (en) | 2015-09-08 | 2020-05-12 | Bio-Rad Laboratories, Inc. | Nucleic acid library generation methods and compositions |
| US10078045B2 (en) | 2015-10-13 | 2018-09-18 | Omega Biosystems Incorporated | Multi-modal fluorescence imaging flow cytometry system |
| JP6555363B2 (ja) * | 2016-01-26 | 2019-08-07 | 株式会社リコー | 液滴形成装置、分注装置、方法 |
| US10688493B2 (en) * | 2016-03-09 | 2020-06-23 | Texas Tech University System | Integrated microfluidic rectifier for various bioanalytical applications |
| WO2017161247A1 (en) | 2016-03-17 | 2017-09-21 | Bd Biosciences | Cell sorting using a high throughput fluorescence flow cytometer |
| US10935485B2 (en) * | 2016-05-12 | 2021-03-02 | Bd Biosciences | Fluorescence imaging flow cytometry with enhanced image resolution |
| US11291756B2 (en) | 2016-07-28 | 2022-04-05 | The Charles Stark Draper Laboratory, Inc. | Acoustic separation for bioprocessing |
| ES2908736T3 (es) * | 2016-07-28 | 2022-05-03 | Charles Stark Draper Laboratory Inc | Separación acústica para bioprocesamiento |
| EP3513167B1 (en) | 2016-09-13 | 2023-05-24 | Becton, Dickinson and Company | Flow cytometer with optical equalization |
| EP3538277A4 (en) * | 2016-11-14 | 2020-05-27 | Orca Biosystems, Inc. | METHODS AND APPARATUS FOR SORTING TARGET PARTICLES |
| US10272431B2 (en) | 2017-02-18 | 2019-04-30 | Owl biomedical, Inc. | Microfabricated cell sorter using pressure pulse |
| WO2018201034A1 (en) | 2017-04-28 | 2018-11-01 | The Charles Stark Draper Laboratory, Inc. | Acoustic separation of particles for bioprocessing |
| TWI677464B (zh) * | 2017-05-10 | 2019-11-21 | 上準微流體股份有限公司 | 微流體晶片、用於富集細胞的裝置及方法 |
| JP6805392B2 (ja) * | 2017-08-15 | 2020-12-23 | ザ ジェネラル ホスピタル コーポレイション | マイクロ流体装置 |
| JP6871116B2 (ja) * | 2017-09-15 | 2021-05-12 | 株式会社東芝 | セルソータ |
| US11931738B2 (en) | 2018-04-24 | 2024-03-19 | Hewlett-Packard Development Company, L.P. | Sequenced droplet ejection to deliver fluids |
| US11925932B2 (en) | 2018-04-24 | 2024-03-12 | Hewlett-Packard Development Company, L.P. | Microfluidic devices |
| EP3796998A1 (en) | 2018-05-23 | 2021-03-31 | ABS Global, Inc. | Systems and methods for particle focusing in microchannels |
| US11325380B2 (en) | 2018-07-17 | 2022-05-10 | Hewlett-Packard Development Company, L.P. | Droplet ejectors to provide fluids to droplet ejectors |
| US11547993B2 (en) | 2018-07-17 | 2023-01-10 | Hewlett-Packard Development Company, L.P. | Droplet ejectors with target media |
| EP3908676A4 (en) * | 2019-01-07 | 2023-02-01 | Elegen Corporation | METHODS OF USING MICROFLUIDIC POSITION ENCODED DEVICES |
| EP4245140A3 (en) | 2019-04-18 | 2024-01-17 | ABS Global, Inc. | System and process for continuous addition of cryoprotectant |
| US11701658B2 (en) | 2019-08-09 | 2023-07-18 | President And Fellows Of Harvard College | Systems and methods for microfluidic particle selection, encapsulation, and injection using surface acoustic waves |
| US11327084B2 (en) * | 2019-09-19 | 2022-05-10 | Invidx Corp. | Joint hematology and biochemistry point-of-care testing system |
| US11161109B2 (en) | 2019-09-19 | 2021-11-02 | Invidx Corp. | Point-of-care testing cartridge with sliding cap |
| WO2021142133A1 (en) * | 2020-01-07 | 2021-07-15 | Elegen Corporation | Dna assembly in microfluidics device having integrated solid-phase columns |
| US11628439B2 (en) | 2020-01-13 | 2023-04-18 | Abs Global, Inc. | Single-sheath microfluidic chip |
| JP2023527306A (ja) | 2020-05-19 | 2023-06-28 | ベクトン・ディキンソン・アンド・カンパニー | レーザービームの強度プロファイルを変調するための方法及びそのシステム |
| CN111644212B (zh) * | 2020-05-22 | 2022-05-24 | 华东理工大学 | 一种微流控芯片和纳米颗粒分离装置 |
| EP4172592A4 (en) | 2020-06-26 | 2023-12-06 | Becton, Dickinson and Company | DOUBLE EXCITATION BEAMS FOR IRRADIATION OF A SAMPLE IN A FLOW AND METHOD FOR USE THEREOF |
| US11200446B1 (en) * | 2020-08-31 | 2021-12-14 | Element Biosciences, Inc. | Single-pass primary analysis |
| WO2023154874A2 (en) * | 2022-02-10 | 2023-08-17 | University Of Virginia Patent Foundation | Buffer exchange of biological samples in-line with separation and measurement operations |
| WO2023177601A1 (en) * | 2022-03-18 | 2023-09-21 | Owl biomedical, Inc. | Microfabricated droplet dispensor with hydrogel |
| CN114693646B (zh) * | 2022-03-31 | 2023-04-11 | 中山大学中山眼科中心 | 一种基于深度学习的角膜内皮细胞活性因子的分析方法 |
Family Cites Families (193)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US520654A (en) * | 1894-05-29 | Method of making chairs for railroad-rails | ||
| US3638139A (en) | 1964-09-29 | 1972-01-25 | Bell Telephone Labor Inc | Frequency-selective laser devices |
| US3558877A (en) | 1966-12-19 | 1971-01-26 | Gca Corp | Method and apparatus for mass separation by selective light absorption |
| US3628182A (en) | 1969-03-20 | 1971-12-14 | Bell Telephone Labor Inc | Ring-type parametric oscillator |
| US3826899A (en) | 1969-08-15 | 1974-07-30 | Nuclear Res Ass Inc | Biological cell analyzing system |
| US3778612A (en) | 1969-12-15 | 1973-12-11 | A Ashkin | Neutral particle beam separator and velocity analyzer using radiation pressure |
| US3710279A (en) | 1969-12-15 | 1973-01-09 | Bell Telephone Labor Inc | Apparatuses for trapping and accelerating neutral particles |
| US3808550A (en) | 1969-12-15 | 1974-04-30 | Bell Telephone Labor Inc | Apparatuses for trapping and accelerating neutral particles |
| CA944466A (en) | 1970-01-26 | 1974-03-26 | Western Electric Company, Incorporated | Guided raman devices |
| US3808432A (en) | 1970-06-04 | 1974-04-30 | Bell Telephone Labor Inc | Neutral particle accelerator utilizing radiation pressure |
| US3662183A (en) | 1970-12-28 | 1972-05-09 | Bell Telephone Labor Inc | Continuously tunable optical parametric oscillator |
| US3725810A (en) | 1971-04-23 | 1973-04-03 | Bell Telephone Labor Inc | Optical stimulated emission devices employing split optical guides |
| US3761721A (en) | 1972-07-06 | 1973-09-25 | Trw Inc | Matter wave interferometric apparatus |
| US4127329A (en) | 1976-12-21 | 1978-11-28 | Northeast Utilities Service Company | Raman scattering system and method for aerosol monitoring |
| US4092535A (en) | 1977-04-22 | 1978-05-30 | Bell Telephone Laboratories, Incorporated | Damping of optically levitated particles by feedback and beam shaping |
| US4063106A (en) | 1977-04-25 | 1977-12-13 | Bell Telephone Laboratories, Incorporated | Optical fiber Raman oscillator |
| US4247815A (en) | 1979-05-22 | 1981-01-27 | The United States Of America As Represented By The Secretary Of The Army | Method and apparatus for physiologic facsimile imaging of biologic targets based on complex permittivity measurements using remote microwave interrogation |
| US4253846A (en) | 1979-11-21 | 1981-03-03 | Technicon Instruments Corporation | Method and apparatus for automated analysis of fluid samples |
| US4327288A (en) | 1980-09-29 | 1982-04-27 | Bell Telephone Laboratories, Incorporated | Method for focusing neutral atoms, molecules and ions |
| US4386274A (en) | 1980-11-10 | 1983-05-31 | Saul Altshuler | Isotope separation by standing waves |
| US4453805A (en) | 1981-02-19 | 1984-06-12 | Bell Telephone Laboratories, Incorporated | Optical grating using a liquid suspension of dielectric particles |
| FR2506530A1 (fr) | 1981-05-22 | 1982-11-26 | Thomson Csf | Source coherente de rayonnement generant un faisceau de direction de propagation reglable |
| US4390403A (en) | 1981-07-24 | 1983-06-28 | Batchelder J Samuel | Method and apparatus for dielectrophoretic manipulation of chemical species |
| FR2519777A1 (fr) | 1982-01-12 | 1983-07-18 | Thomson Csf | Procede de fabrication de structures de phase diffractantes |
| US4440638A (en) | 1982-02-16 | 1984-04-03 | U.T. Board Of Regents | Surface field-effect device for manipulation of charged species |
| FR2537768A1 (fr) | 1982-12-08 | 1984-06-15 | Commissariat Energie Atomique | Procede et dispositif d'obtention de faisceaux de particules de densite spatialement modulee, application a la gravure et a l'implantation ioniques |
| US4627689A (en) | 1983-12-08 | 1986-12-09 | University Of Pittsburgh | Crystalline colloidal narrow band radiation filter |
| US4632517A (en) | 1983-12-08 | 1986-12-30 | University Of Pittsburgh | Crystalline colloidal narrow band radiation filter |
| EP0177718B1 (de) | 1984-09-11 | 1989-12-06 | Partec AG | Verfahren und Vorrichtung zur Sortierung von mikroskopischen Partikeln |
| US4758427A (en) * | 1985-08-08 | 1988-07-19 | Ciba-Geigy Corporation | Enhanced absorption of psychoactive 2-aryl-pyrazolo quinolines as a solid molecular dispersion in polyvinylpyrrolidone |
| GB8623072D0 (en) | 1986-09-25 | 1986-10-29 | Amersham Int Plc | Particle analysis |
| US4827125A (en) | 1987-04-29 | 1989-05-02 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Confocal scanning laser microscope having no moving parts |
| US4939081A (en) | 1987-05-27 | 1990-07-03 | The Netherlands Cancer Institute | Cell-separation |
| US4893886A (en) | 1987-09-17 | 1990-01-16 | American Telephone And Telegraph Company | Non-destructive optical trap for biological particles and method of doing same |
| US4887721A (en) | 1987-11-30 | 1989-12-19 | The United States Of America As Represented By The United States Department Of Energy | Laser particle sorter |
| US4908112A (en) | 1988-06-16 | 1990-03-13 | E. I. Du Pont De Nemours & Co. | Silicon semiconductor wafer for analyzing micronic biological samples |
| US5100627A (en) | 1989-11-30 | 1992-03-31 | The Regents Of The University Of California | Chamber for the optical manipulation of microscopic particles |
| FR2655435B1 (fr) | 1989-12-01 | 1992-02-21 | Thomson Csf | Dispositif d'addition coherente de faisceaux laser. |
| CA2031716C (en) | 1989-12-07 | 1996-06-18 | Hiroaki Misawa | Laser microprocessing and the device therefor |
| US5795457A (en) | 1990-01-30 | 1998-08-18 | British Technology Group Ltd. | Manipulation of solid, semi-solid or liquid materials |
| US5029791A (en) | 1990-03-08 | 1991-07-09 | Candela Laser Corporation | Optics X-Y positioner |
| US5198369A (en) | 1990-04-25 | 1993-03-30 | Canon Kabushiki Kaisha | Sample measuring method using agglomeration reaction of microcarriers |
| US5079169A (en) | 1990-05-22 | 1992-01-07 | The Regents Of The Stanford Leland Junior University | Method for optically manipulating polymer filaments |
| US5338930A (en) | 1990-06-01 | 1994-08-16 | Research Corporation Technologies | Frequency standard using an atomic fountain of optically trapped atoms |
| US5245466A (en) | 1990-08-15 | 1993-09-14 | President And Fellows Of Harvard University And Rowland Institute | Optical matter |
| US5113286A (en) | 1990-09-27 | 1992-05-12 | At&T Bell Laboratories | Diffraction grating apparatus and method of forming a surface relief pattern in diffraction grating apparatus |
| US6149789A (en) | 1990-10-31 | 2000-11-21 | Fraunhofer Gesellschaft Zur Forderung Der Angewandten Forschung E.V. | Process for manipulating microscopic, dielectric particles and a device therefor |
| US5170890A (en) | 1990-12-05 | 1992-12-15 | Wilson Steven D | Particle trap |
| CA2057506C (en) | 1990-12-13 | 2003-05-13 | Keiji Sasaki | Laser trapping and method for applications thereof |
| JP3129471B2 (ja) | 1991-06-01 | 2001-01-29 | 科学技術振興事業団 | マルチビーム微粒子操作方法 |
| US5206504A (en) | 1991-11-01 | 1993-04-27 | The United States Of America As Represented By The Administrator, National Aeronautics And Space Administration | Sample positioning in microgravity |
| JP3018687B2 (ja) | 1991-12-12 | 2000-03-13 | 松下電器産業株式会社 | 走査型レーザー顕微鏡 |
| JPH05203878A (ja) | 1992-01-27 | 1993-08-13 | Jeol Ltd | 走査型レーザー顕微鏡 |
| EP0556748B1 (en) | 1992-02-20 | 1998-10-28 | Canon Kabushiki Kaisha | Method and apparatus for particle manipulation, and measuring apparatus utilizing the same |
| US5495105A (en) | 1992-02-20 | 1996-02-27 | Canon Kabushiki Kaisha | Method and apparatus for particle manipulation, and measuring apparatus utilizing the same |
| US5274231A (en) | 1992-04-14 | 1993-12-28 | Board Of Trustees, Leland Stanford Jr. University | Method and apparatus for manipulating atoms, ions or molecules and for measuring physical quantities using stimulated Raman transitions |
| US5486335A (en) * | 1992-05-01 | 1996-01-23 | Trustees Of The University Of Pennsylvania | Analysis based on flow restriction |
| JPH0693038B2 (ja) | 1992-06-11 | 1994-11-16 | 東京工業大学長 | 少数の中性原子の運動を制御する方法および装置 |
| US5189294A (en) | 1992-07-08 | 1993-02-23 | The United States Of America As Represented By The Secretary Of The Air Force | Transform lens with a plurality of sliced lens segments |
| US5374556A (en) | 1992-07-23 | 1994-12-20 | Cell Robotics, Inc. | Flexure structure for stage positioning |
| US5364744A (en) | 1992-07-23 | 1994-11-15 | Cell Robotics, Inc. | Method for the manufacture of an optical manipulation chamber |
| JP3292515B2 (ja) | 1992-09-07 | 2002-06-17 | オリンパス光学工業株式会社 | 顕微鏡観察のための微調整方法及び微調整装置 |
| US6399397B1 (en) | 1992-09-14 | 2002-06-04 | Sri International | Up-converting reporters for biological and other assays using laser excitation techniques |
| GB9220564D0 (en) | 1992-09-29 | 1992-11-11 | Univ London | The method of rheological investigation |
| LU88184A1 (fr) | 1992-10-28 | 1994-09-09 | Europ Communities | Modulateur optique |
| US5452123A (en) | 1992-12-30 | 1995-09-19 | University Of Pittsburgh Of The Commonwealth System Of Higher Education | Method of making an optically nonlinear switched optical device and related devices |
| DE4300698A1 (de) | 1993-01-13 | 1994-07-14 | Raimund Schuetze | Vorrichtung und Verfahren zur Handhabung, Bearbeitung und Beobachtung kleiner Teilchen, insbesondere biologischer Teilchen |
| US5327515A (en) | 1993-01-14 | 1994-07-05 | At&T Laboratories | Method for forming a Bragg grating in an optical medium |
| GB9301122D0 (en) | 1993-01-21 | 1993-03-10 | Scient Generics Ltd | Method of analysis/separation |
| US5360764A (en) | 1993-02-16 | 1994-11-01 | The United States Of America, As Represented By The Secretary Of Commerce | Method of fabricating laser controlled nanolithography |
| GB9306729D0 (en) | 1993-03-31 | 1993-05-26 | British Tech Group | Improvements in separators |
| US5473471A (en) | 1993-04-16 | 1995-12-05 | Matsushita Electric Industrial Co., Ltd. | Complex lens with diffraction grating |
| US5366559A (en) | 1993-05-27 | 1994-11-22 | Research Triangle Institute | Method for protecting a substrate surface from contamination using the photophoretic effect |
| EP0635994B1 (en) | 1993-07-08 | 1998-09-23 | Canon Kabushiki Kaisha | Method and apparatus for separating particles |
| US5770856A (en) | 1993-07-22 | 1998-06-23 | British Technology Group Ltd | Near field sensor with cantilever and tip containing optical path for an evanescent wave |
| CA2168107C (en) | 1993-07-27 | 2001-02-13 | Joel Petersen | Light source destructuring and shaping device |
| DE4326181A1 (de) | 1993-08-04 | 1995-02-09 | Europ Lab Molekularbiolog | Verfahren und Vorrichtung zur Lumineszenzspektroskopie und Materialmikrobearbeitung von fixierten und bewegten Molekülen, Partikeln und Objekten |
| EP0732398B1 (en) | 1993-08-25 | 2004-07-14 | Asahi Kasei Kabushiki Kaisha | Novel tyrosine kinase |
| US5445011A (en) | 1993-09-21 | 1995-08-29 | Ghislain; Lucien P. | Scanning force microscope using an optical trap |
| US5900160A (en) | 1993-10-04 | 1999-05-04 | President And Fellows Of Harvard College | Methods of etching articles via microcontact printing |
| US5512745A (en) | 1994-03-09 | 1996-04-30 | Board Of Trustees Of The Leland Stanford Jr. University | Optical trap system and method |
| JP3355021B2 (ja) | 1994-03-26 | 2002-12-09 | 科学技術振興事業団 | マイクロメモリおよびマイクロセンサ |
| DE4411268C2 (de) | 1994-03-31 | 2001-02-01 | Danfoss As | Analyseverfahren und Analysevorrichtung |
| US6071394A (en) | 1996-09-06 | 2000-06-06 | Nanogen, Inc. | Channel-less separation of bioparticles on a bioelectronic chip by dielectrophoresis |
| US5637458A (en) | 1994-07-20 | 1997-06-10 | Sios, Inc. | Apparatus and method for the detection and assay of organic molecules |
| US6001229A (en) | 1994-08-01 | 1999-12-14 | Lockheed Martin Energy Systems, Inc. | Apparatus and method for performing microfluidic manipulations for chemical analysis |
| JP3474652B2 (ja) | 1994-11-11 | 2003-12-08 | 株式会社モリテックス | 多点レーザトラッピング装置及びその方法 |
| US5629802A (en) | 1995-01-05 | 1997-05-13 | The United States Of America As Represented By The Secretary Of The Air Force | Spatially multiplexed optical signal processor |
| US5795782A (en) | 1995-03-17 | 1998-08-18 | President & Fellows Of Harvard College | Characterization of individual polymer molecules based on monomer-interface interactions |
| US5608519A (en) | 1995-03-20 | 1997-03-04 | Gourley; Paul L. | Laser apparatus and method for microscopic and spectroscopic analysis and processing of biological cells |
| US5793485A (en) | 1995-03-20 | 1998-08-11 | Sandia Corporation | Resonant-cavity apparatus for cytometry or particle analysis |
| US5953166A (en) | 1995-03-22 | 1999-09-14 | Moritex Corporation | Laser trapping apparatus |
| US6797942B2 (en) | 2001-09-13 | 2004-09-28 | University Of Chicago | Apparatus and process for the lateral deflection and separation of flowing particles by a static array of optical tweezers |
| US5677286A (en) | 1995-04-27 | 1997-10-14 | The University Of Michigan | Glycosylated analogs of camptothecin |
| US5631141A (en) | 1995-05-05 | 1997-05-20 | The Regents Of The University Of California | High resolution biosensor for in-situ microthermometry |
| US5776674A (en) | 1995-06-05 | 1998-07-07 | Seq, Ltd | Chemical biochemical and biological processing in thin films |
| US5659561A (en) | 1995-06-06 | 1997-08-19 | University Of Central Florida | Spatial solitary waves in bulk quadratic nonlinear materials and their applications |
| US5620857A (en) | 1995-06-07 | 1997-04-15 | United States Of America, As Represented By The Secretary Of Commerce | Optical trap for detection and quantitation of subzeptomolar quantities of analytes |
| US5950071A (en) | 1995-11-17 | 1999-09-07 | Lightforce Technology, Inc. | Detachment and removal of microscopic surface contaminants using a pulsed detach light |
| WO1997021832A1 (de) | 1995-12-08 | 1997-06-19 | Evotec Biosystems Gmbh | Verfahren zur bestimmung von nukleinsäuremolekülen in niedriger konzentration |
| US5993630A (en) | 1996-01-31 | 1999-11-30 | Board Of Regents The University Of Texas System | Method and apparatus for fractionation using conventional dielectrophoresis and field flow fractionation |
| US6641708B1 (en) | 1996-01-31 | 2003-11-04 | Board Of Regents, The University Of Texas System | Method and apparatus for fractionation using conventional dielectrophoresis and field flow fractionation |
| US5888370A (en) | 1996-02-23 | 1999-03-30 | Board Of Regents, The University Of Texas System | Method and apparatus for fractionation using generalized dielectrophoresis and field flow fractionation |
| US6078681A (en) | 1996-03-18 | 2000-06-20 | Marine Biological Laboratory | Analytical imaging system and process |
| NZ331865A (en) | 1996-03-18 | 1999-04-29 | Univ Wales Bangor Change Of Na | Apparatus with electrode arrays for carrying out chemical, physical or physico-chemical reactions |
| US5942443A (en) | 1996-06-28 | 1999-08-24 | Caliper Technologies Corporation | High throughput screening assay systems in microscale fluidic devices |
| US5760395A (en) | 1996-04-18 | 1998-06-02 | Universities Research Assoc., Inc. | Method and apparatus for laser-controlled proton beam radiology |
| US5694216A (en) | 1996-04-25 | 1997-12-02 | University Of Central Florida | Scanning heterodyne acousto-optical interferometers |
| US5752606A (en) | 1996-05-23 | 1998-05-19 | Wilson; Steve D. | Method for trapping, manipulating, and separating cells and cellular components utilizing a particle trap |
| US5726404A (en) | 1996-05-31 | 1998-03-10 | University Of Washington | Valveless liquid microswitch |
| US5952651A (en) | 1996-06-10 | 1999-09-14 | Moritex Corporation | Laser manipulation apparatus and cell plate used therefor |
| JP3688820B2 (ja) | 1996-08-26 | 2005-08-31 | 株式会社モリテックス | レーザトラッピング装置及びこれを利用したマイクロマニピュレータ |
| EP0907412B1 (en) | 1996-06-28 | 2008-08-27 | Caliper Life Sciences, Inc. | High-throughput screening assay systems in microscale fluidic devices |
| JPH1048102A (ja) | 1996-07-31 | 1998-02-20 | Hitachi Ltd | 光学ピンセット |
| US6280967B1 (en) | 1996-08-02 | 2001-08-28 | Axiom Biotechnologies, Inc. | Cell flow apparatus and method for real-time of cellular responses |
| US5804436A (en) | 1996-08-02 | 1998-09-08 | Axiom Biotechnologies, Inc. | Apparatus and method for real-time measurement of cellular response |
| CA2264389A1 (en) | 1996-09-04 | 1998-03-12 | Technical University Of Denmark | A micro flow system for particle separation and analysis |
| US6221654B1 (en) | 1996-09-25 | 2001-04-24 | California Institute Of Technology | Method and apparatus for analysis and sorting of polynucleotides based on size |
| US5858192A (en) | 1996-10-18 | 1999-01-12 | Board Of Regents, The University Of Texas System | Method and apparatus for manipulation using spiral electrodes |
| US6008010A (en) | 1996-11-01 | 1999-12-28 | University Of Pittsburgh | Method and apparatus for holding cells |
| DE19649048C1 (de) | 1996-11-27 | 1998-04-09 | Evotec Biosystems Gmbh | Verfahren zur Unterscheidung oder Erfassung von Partikeln in einer Probe durch Identifizierung von Signalabschnitten zeitaufgelöster, optischer Rohsignale aus der Probe auf Basis von Einzelphotonendetektion |
| US6534308B1 (en) | 1997-03-27 | 2003-03-18 | Oncosis, Llc | Method and apparatus for selectively targeting specific cells within a mixed cell population |
| US5874266A (en) | 1997-03-27 | 1999-02-23 | Palsson; Bernhard O. | Targeted system for removing tumor cells from cell populations |
| US5939716A (en) | 1997-04-02 | 1999-08-17 | Sandia Corporation | Three-dimensional light trap for reflective particles |
| US6215134B1 (en) | 1997-05-09 | 2001-04-10 | California Institute Of Technology | Semiconductor surface lenses and shaped structures |
| GB2326229A (en) | 1997-06-13 | 1998-12-16 | Robert Jeffrey Geddes Carr | Detecting and analysing submicron particles |
| US6111398A (en) | 1997-07-03 | 2000-08-29 | Coulter International Corp. | Method and apparatus for sensing and characterizing particles |
| US6143558A (en) | 1997-07-08 | 2000-11-07 | The Regents Of The University Of Michigan | Optical fiberless sensors for analyzing cellular analytes |
| US6540895B1 (en) | 1997-09-23 | 2003-04-01 | California Institute Of Technology | Microfabricated cell sorter for chemical and biological materials |
| US6833242B2 (en) * | 1997-09-23 | 2004-12-21 | California Institute Of Technology | Methods for detecting and sorting polynucleotides based on size |
| JPH11119800A (ja) * | 1997-10-20 | 1999-04-30 | Fujitsu Ltd | 音声符号化復号化方法及び音声符号化復号化装置 |
| US6121603A (en) | 1997-12-01 | 2000-09-19 | Hang; Zhijiang | Optical confocal device having a common light directing means |
| ATE477850T1 (de) | 1998-01-12 | 2010-09-15 | Massachusetts Inst Technology | Vorrichtung zur mikrotestdurchführung |
| DE19801139B4 (de) | 1998-01-14 | 2016-05-12 | Till Photonics Gmbh | Punktabtastendes Luminiszenz-Mikroskop |
| US6485905B2 (en) | 1998-02-02 | 2002-11-26 | Signature Bioscience, Inc. | Bio-assay device |
| US6338968B1 (en) | 1998-02-02 | 2002-01-15 | Signature Bioscience, Inc. | Method and apparatus for detecting molecular binding events |
| US6287776B1 (en) | 1998-02-02 | 2001-09-11 | Signature Bioscience, Inc. | Method for detecting and classifying nucleic acid hybridization |
| US6287874B1 (en) | 1998-02-02 | 2001-09-11 | Signature Bioscience, Inc. | Methods for analyzing protein binding events |
| US6368795B1 (en) | 1998-02-02 | 2002-04-09 | Signature Bioscience, Inc. | Bio-assay device and test system for detecting molecular binding events |
| US6395480B1 (en) | 1999-02-01 | 2002-05-28 | Signature Bioscience, Inc. | Computer program and database structure for detecting molecular binding events |
| US6055106A (en) | 1998-02-03 | 2000-04-25 | Arch Development Corporation | Apparatus for applying optical gradient forces |
| JPH11218691A (ja) | 1998-02-04 | 1999-08-10 | Hitachi Ltd | 液滴操作方法および装置 |
| US6082205A (en) | 1998-02-06 | 2000-07-04 | Ohio State University | System and device for determining particle characteristics |
| US5974901A (en) | 1998-02-06 | 1999-11-02 | The Cleveland Clinic Foundation | Method for determining particle characteristics |
| US6156576A (en) | 1998-03-06 | 2000-12-05 | The Regents Of The University Of California | Fast controllable laser lysis of cells for analysis |
| US6740497B2 (en) | 1998-03-06 | 2004-05-25 | The Regents Of The University Of California | Method and apparatus for detecting cancerous cells using molecules that change electrophoretic mobility |
| US5998152A (en) | 1998-03-09 | 1999-12-07 | Tularik Inc. | High-throughput screening assays for modulators of nucleic acid topoisomerases |
| US6088376A (en) | 1998-03-16 | 2000-07-11 | California Institute Of Technology | Vertical-cavity-surface-emitting semiconductor devices with fiber-coupled optical cavity |
| US6642018B1 (en) | 1998-03-27 | 2003-11-04 | Oncosis Llc | Method for inducing a response in one or more targeted cells |
| EP1071809B1 (en) * | 1998-04-17 | 2003-08-27 | Rigel Pharmaceuticals, Inc. | Multiparameter facs assays to detect alterations in cellular parameters |
| EP1190229B1 (en) | 1998-05-22 | 2011-10-26 | California Institute Of Technology | Microfabricated cell sorter |
| US6139831A (en) | 1998-05-28 | 2000-10-31 | The Rockfeller University | Apparatus and method for immobilizing molecules onto a substrate |
| JP2002528744A (ja) | 1998-09-30 | 2002-09-03 | ボード・オブ・コントロール・オブ・ミシガン・テクノロジカル・ユニバーシティ | 非原子粒子のレーザガイドされる操作 |
| CA2356623C (en) | 1998-12-23 | 2005-10-18 | Medispectra, Inc. | Systems and methods for optical examination of samples |
| WO2000045179A2 (en) | 1999-01-27 | 2000-08-03 | The Regents Of The University Of California | Screening for modulators of g-protein subunit beta 3 |
| US6929925B1 (en) | 1999-01-27 | 2005-08-16 | The Regents Of The University Of California | Assays for sensory modulators using a sensory cell specific G-protein beta subunit |
| WO2000045160A1 (en) | 1999-02-01 | 2000-08-03 | Signature Bioscience Inc. | Method and apparatus for detecting molecular binding events |
| US6294063B1 (en) | 1999-02-12 | 2001-09-25 | Board Of Regents, The University Of Texas System | Method and apparatus for programmable fluidic processing |
| US6507400B1 (en) | 1999-02-27 | 2003-01-14 | Mwi, Inc. | Optical system for multi-part differential particle discrimination and an apparatus using the same |
| US6067859A (en) | 1999-03-04 | 2000-05-30 | The Board Of Regents, The University Of Texas System | Optical stretcher |
| CN1185492C (zh) | 1999-03-15 | 2005-01-19 | 清华大学 | 可单点选通式微电磁单元阵列芯片、电磁生物芯片及应用 |
| US6518056B2 (en) | 1999-04-27 | 2003-02-11 | Agilent Technologies Inc. | Apparatus, systems and method for assaying biological materials using an annular format |
| US6485690B1 (en) * | 1999-05-27 | 2002-11-26 | Orchid Biosciences, Inc. | Multiple fluid sample processor and system |
| MXPA01012959A (es) | 1999-06-28 | 2002-07-30 | California Inst Of Techn | Sistemas elastomericos, microfabricados, de valvulas y bombas. |
| US6818395B1 (en) | 1999-06-28 | 2004-11-16 | California Institute Of Technology | Methods and apparatus for analyzing polynucleotide sequences |
| GB9916848D0 (en) | 1999-07-20 | 1999-09-22 | Univ Wales Bangor | Travelling wave dielectrophoretic apparatus and method |
| AU1471001A (en) | 1999-11-04 | 2001-05-14 | California Institute Of Technology | Methods and apparatus for analyzing polynucleotide sequences |
| CA2392534A1 (en) | 1999-11-30 | 2001-06-07 | Oncosis | Method and apparatus for selectively targeting specific cells within a cell population |
| WO2001040769A2 (de) | 1999-12-02 | 2001-06-07 | Evotec Oai Ag | Hochdurchsatzscreening-verfahren und -vorrichtung zur optischen erfassung von proben |
| DE19960583A1 (de) | 1999-12-15 | 2001-07-05 | Evotec Biosystems Ag | Verfahren und Vorrichtung zur Mikroskopie |
| AU4907101A (en) | 2000-02-23 | 2001-09-03 | Caliper Technologies Inc | Multi-reservoir pressure control system |
| US6287758B1 (en) | 2000-03-23 | 2001-09-11 | Axiom Biotechnologies, Inc. | Methods of registering trans-membrane electric potentials |
| WO2002022774A1 (en) | 2000-09-12 | 2002-03-21 | Oncosis Llc | Chamber for laser-based processing |
| AU2001290867A1 (en) | 2000-09-14 | 2002-03-26 | Caliper Technologies Corp. | Microfluidic devices and methods for performing temperature mediated reactions |
| EP1334347A1 (en) | 2000-09-15 | 2003-08-13 | California Institute Of Technology | Microfabricated crossflow devices and methods |
| US20030007894A1 (en) * | 2001-04-27 | 2003-01-09 | Genoptix | Methods and apparatus for use of optical forces for identification, characterization and/or sorting of particles |
| US6784420B2 (en) | 2000-11-13 | 2004-08-31 | Genoptix, Inc. | Method of separating particles using an optical gradient |
| US6744038B2 (en) * | 2000-11-13 | 2004-06-01 | Genoptix, Inc. | Methods of separating particles using an optical gradient |
| US6936811B2 (en) | 2000-11-13 | 2005-08-30 | Genoptix, Inc. | Method for separating micro-particles |
| US6833542B2 (en) | 2000-11-13 | 2004-12-21 | Genoptix, Inc. | Method for sorting particles |
| AU2002230530B2 (en) * | 2000-11-28 | 2007-07-19 | The Regents Of The University Of California | Storing microparticles in optical switch which is transported by micro-fluidic device |
| WO2002044689A2 (en) * | 2000-11-28 | 2002-06-06 | The Regents Of The University Of California | Storing microparticles in optical switch which is transported by micro-fluidic device |
| US6778724B2 (en) | 2000-11-28 | 2004-08-17 | The Regents Of The University Of California | Optical switching and sorting of biological samples and microparticles transported in a micro-fluidic device, including integrated bio-chip devices |
| US6991939B2 (en) | 2001-07-19 | 2006-01-31 | Tufts University | Optical array device and methods of use thereof for screening, analysis and manipulation of particles |
| AU2003216175A1 (en) | 2002-02-04 | 2003-09-02 | Colorado School Of Mines | Laminar flow-based separations of colloidal and cellular particles |
| US6808075B2 (en) | 2002-04-17 | 2004-10-26 | Cytonome, Inc. | Method and apparatus for sorting particles |
| EP2282214B1 (en) | 2002-05-09 | 2022-10-05 | The University of Chicago | Device and method for pressure-driven plug transport and reaction |
| US7041481B2 (en) | 2003-03-14 | 2006-05-09 | The Regents Of The University Of California | Chemical amplification based on fluid partitioning |
| GB0307233D0 (en) * | 2003-03-28 | 2003-04-30 | Medical Res Council | Improvements in biosensor electrodes |
| CA2536360C (en) | 2003-08-28 | 2013-08-06 | Celula, Inc. | Methods and apparatus for sorting cells using an optical switch in a microfluidic channel network |
| US20080213821A1 (en) | 2004-05-06 | 2008-09-04 | Nanyang Technological University | Microfluidic Cell Sorter System |
| FR2888932A1 (fr) | 2005-07-19 | 2007-01-26 | Commissariat Energie Atomique | Procede de calibration d'un dispositif de tri en flux de particules |
| US7726561B2 (en) * | 2006-07-21 | 2010-06-01 | Intuit Inc. | System and method for reconciling credit card payments with corresponding transactions |
-
2004
- 2004-08-27 CA CA2536360A patent/CA2536360C/en not_active Expired - Fee Related
- 2004-08-27 WO PCT/US2004/028213 patent/WO2005022147A1/en active Application Filing
- 2004-08-27 AU AU2004269406A patent/AU2004269406B2/en not_active Ceased
- 2004-08-27 CN CN2004800281349A patent/CN1860363B/zh active Active
- 2004-08-27 US US10/928,650 patent/US7745221B2/en not_active Expired - Fee Related
- 2004-08-27 EP EP04782647A patent/EP1668355A4/en not_active Withdrawn
- 2004-08-27 JP JP2006524942A patent/JP4533382B2/ja not_active Expired - Fee Related
-
2010
- 2010-06-28 US US12/825,037 patent/US8426209B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| CN1860363B (zh) | 2011-12-28 |
| US8426209B2 (en) | 2013-04-23 |
| EP1668355A1 (en) | 2006-06-14 |
| AU2004269406B2 (en) | 2010-12-16 |
| US7745221B2 (en) | 2010-06-29 |
| US20100304429A1 (en) | 2010-12-02 |
| AU2004269406A1 (en) | 2005-03-10 |
| EP1668355A4 (en) | 2011-11-09 |
| CN1860363A (zh) | 2006-11-08 |
| CA2536360C (en) | 2013-08-06 |
| WO2005022147A1 (en) | 2005-03-10 |
| US20050207940A1 (en) | 2005-09-22 |
| JP2007504446A (ja) | 2007-03-01 |
| CA2536360A1 (en) | 2005-03-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4533382B2 (ja) | マイクロ流体分析およびソーティング用の一体化された構造物 | |
| US8691164B2 (en) | Cell sorting system and methods | |
| KR100746431B1 (ko) | 셀 소터 칩 | |
| US20080070311A1 (en) | Microfluidic flow cytometer and applications of same | |
| US20170299492A1 (en) | Method, device and system for hydrodynamic flow focusing | |
| US11733152B2 (en) | Microfluidic system with combined electrical and optical detection for high accuracy particle sorting and methods thereof | |
| WO2008036083A1 (en) | Microfluidic flow cytometer and applications of same | |
| JP4512686B2 (ja) | 微粒子の分別回収方法および回収装置 | |
| CN101743303B (zh) | 细胞分选系统和方法 | |
| Tu et al. | Microfluidic cell analysis and sorting using photonic forces | |
| Kirei et al. | An all optical microfluidic sorter | |
| Watts et al. | Microchip‐Based Flow Cytometry in Photonic Sensing: Principles and Applications for Safety and Security Monitoring |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070824 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20070824 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20090901 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20091201 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20091208 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100506 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100519 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20100608 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20100611 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4533382 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130618 Year of fee payment: 3 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |