JP2012531961A - 粉末を気流に引き込むためのディスペンサーおよび方法 - Google Patents
粉末を気流に引き込むためのディスペンサーおよび方法 Download PDFInfo
- Publication number
- JP2012531961A JP2012531961A JP2012518513A JP2012518513A JP2012531961A JP 2012531961 A JP2012531961 A JP 2012531961A JP 2012518513 A JP2012518513 A JP 2012518513A JP 2012518513 A JP2012518513 A JP 2012518513A JP 2012531961 A JP2012531961 A JP 2012531961A
- Authority
- JP
- Japan
- Prior art keywords
- cavity
- flow
- opening
- flow path
- powder
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M15/00—Inhalators
- A61M15/0028—Inhalators using prepacked dosages, one for each application, e.g. capsules to be perforated or broken-up
- A61M15/0045—Inhalators using prepacked dosages, one for each application, e.g. capsules to be perforated or broken-up using multiple prepacked dosages on a same carrier, e.g. blisters
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M15/00—Inhalators
- A61M15/0001—Details of inhalators; Constructional features thereof
- A61M15/0003—Details of inhalators; Constructional features thereof with means for dispensing more than one drug
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M15/00—Inhalators
- A61M15/0001—Details of inhalators; Constructional features thereof
- A61M15/0021—Mouthpieces therefor
- A61M15/0025—Mouthpieces therefor with caps
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M15/00—Inhalators
- A61M15/0028—Inhalators using prepacked dosages, one for each application, e.g. capsules to be perforated or broken-up
- A61M15/003—Inhalators using prepacked dosages, one for each application, e.g. capsules to be perforated or broken-up using capsules, e.g. to be perforated or broken-up
- A61M15/0043—Non-destructive separation of the package, e.g. peeling
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M15/00—Inhalators
- A61M15/0028—Inhalators using prepacked dosages, one for each application, e.g. capsules to be perforated or broken-up
- A61M15/0045—Inhalators using prepacked dosages, one for each application, e.g. capsules to be perforated or broken-up using multiple prepacked dosages on a same carrier, e.g. blisters
- A61M15/0046—Inhalators using prepacked dosages, one for each application, e.g. capsules to be perforated or broken-up using multiple prepacked dosages on a same carrier, e.g. blisters characterized by the type of carrier
- A61M15/0048—Inhalators using prepacked dosages, one for each application, e.g. capsules to be perforated or broken-up using multiple prepacked dosages on a same carrier, e.g. blisters characterized by the type of carrier the dosages being arranged in a plane, e.g. on diskettes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M2202/00—Special media to be introduced, removed or treated
- A61M2202/06—Solids
- A61M2202/064—Powder
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M2206/00—Characteristics of a physical parameter; associated device therefor
- A61M2206/10—Flow characteristics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M2206/00—Characteristics of a physical parameter; associated device therefor
- A61M2206/10—Flow characteristics
- A61M2206/14—Static flow deviators in tubes disturbing laminar flow in tubes, e.g. archimedes screws
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M2206/00—Characteristics of a physical parameter; associated device therefor
- A61M2206/10—Flow characteristics
- A61M2206/16—Rotating swirling helical flow, e.g. by tangential inflows
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M2209/00—Ancillary equipment
- A61M2209/02—Equipment for testing the apparatus
Abstract
Description
(i)酸化防止剤:−アロプリノールと、エルドステインと、マンニトールと、N−アセチルシステインコリンエステルと、N−アセチルシステインエチルエステルと、N−アセチルシステインと、N−アセチルシステインアミドと、ナイアシンと;
(ii)ケモカインアンタゴニスト:−BX471((2R)−1−[[2−[(アミノカルボニル)アミノ]−4−クロロフェノキシ]アセチル]−4−[(4−フルオロフェニル)メチル]−2−メチルピペラジン一塩酸塩)と、CCX634と、N−{2−[((2S)−3−{[1−(4−クロロベンジル)ピペリジン−4−イル]アミノ}−2−ヒドロキシ−2−メチルプロピル)オキシ]−4−ヒドロキシフェニル}アセトアミド(特許文献11を参照されたい)と、2−{2−クロロ−5−{[(2S)−3−(5−クロロ−1’Η,3H−スピロ[1−ベンゾフラン−2,4’−ピペリジン]−1’−イル)−2−ヒドロキシプロピル]オキシ}−4−[(メチルアミノ)カルボニル]フェノキシ}−2−メチルプロパン酸(特許文献12を参照されたい)と、656933(N−(2−ブロモフェニル)−N’−(4−シアノ−1H−1,2,3−ベンゾトリアゾール−7−イル)尿素)と、766994(4−({[({[(2R)−4−(3,4−ジクロロベンジル)モルフォリン−2−イル]メチル}アミノ)カルボニル]−アミノ}メチル)ベンズアミド)と、CCX−282と、CCX−915と、シアノビリンNと、E−921と、INCB−003284と、INCB−9471と、マラビロクと、MLN−3701と、MLN−3897と、T−487(N−{1−[3−(4−エトキシフェニル)−4−オキソ−3,4−ジヒドロピリド[2,3−d]ピリミジン−2−イル]エチル}−N−(ピリジン−3−イルメチル)−2−[4−(トリフルオロメトキシ)フェニル]アセトアミド)と、ビクリビロックと;
(iii)コルチコステロイド:−ジプロピオン酸アルクロメタゾンと、アメロメタゾンと、ジプロピオン酸ベクロメタゾンと、ブデソニドと、プロピオン酸ブチキソコルトと、シクレソニドと、プロピオン酸クロベタゾールと、脱イソブチルシクレソニド(Desisobutyrylciclesonide)と、エチプレドノールジクロアセタート(Etiprednol dicloacetate)と、フルオシノロンアセトニドと、フロ酸フルチカゾンと、プロピオン酸フルチカゾンと、エタボン酸ロテプレドノール(局所的)と、フロ酸モメタゾンと;
(iv)DPIアンタゴニスト:−L888839とMK0525と;
(v)ヒストンデアセチラーゼ誘導物質:−ADC4022、アミノフィリン、メチルキサンチン、またはテオフィリン;
(vi)IKK2阻害剤:−2−{[2−(2−メチルアミノ−ピリミジン−4−イル)−1H−インドール−5−カルボニル]−アミノ}−3−(フェニル−ピリジン−2−イル−アミノ)−プロピオン酸;
(vii)COX阻害剤:−セレコキシブと、ジクロフェナクナトリウムと、エトドラクと、イブプロフェンと、インドメタシンと、メロキシカムと、ニメスリドと、OC1768と、OC2125と、OC2184と、OC499と、OCD9101と、パレコキシブナトリウムと、ピセタノールと、ピロキシカムと、ロフェコキシブと、バルデコキシブと;
(viii)リポキシゲナーゼ阻害剤:−アジュレミン酸(Ajulemic acid)と、ダルブフェロンと、メシル酸ダルブフェロンと、デキシブプロフェンリシン(Dexibuprofen lysine)(一水和物)と、エタロシブナトリウム(Etalocib sodium)と、リコフェロン(Licofelone)と、リナゾラスト(Linazolast)と、ロナパレンと、マソプロコールと、MN−001と、テポキサリン(Tepoxalin)と、UCB−35440と、ベリフラポン(Veliflapon)と、ZD−2138と、ZD−4007と、ジレウトン((±)−1−(1−ベンゾ[b]チエン−2−イルエチル)−1−ヒドロキシ尿素)と;
(ix)ロイコトリエン受容体アンタゴニスト:−アブルカスト(Ablukast)と、イラルカスト(Iralukast)(CGP45715A)と、モンテルカストと、モンテルカストナトリウムと、オンタゾラストと、プランルカストと、プランルカスト水和物(一ナトリウム塩)と、ベルルカスト(Verlukast)(MK−679)と、ザフィルルカストと;
(x)MPO阻害剤:−ヒドロキサム酸誘導体(N−(4−クロロ−2−メチル−フェニル)−4−フェニル−4−[[(4−プロパン−2−イルフェニル)スルホニルアミノ]メチル]ピペリジン−1−カルボキサミド)と、ピセアタンノールと、レスベラトロールと;
(xi)β2−アドレナリン受容体アゴニスト:−メタプロテレノールと、イソプロテレノールと、イソプレナリンと、アルブテロールと、サルブタモール(例えば、硫酸塩として)と、フォルモテロール(例えば、フマル酸塩として)と、サルメテロール(例えば、キシナホ酸塩として)と、テルブタリンと、オルシプレナリンと、ビトルテロール(例えば、メシル酸塩として)と、ピルブテロールと、インダカテロールと、サルメテロール(例えば、キシナホ酸塩として)と、バンブテロール(例えば、塩酸塩として)と、カルモテロールと、インダカテロール(CAS番号312753−06−3;QAB−149)と、ホルムアニリド誘導体、例えば、3−(4−{[6−({(2R)−2−[3−(ホルミルアミノ)−4−ヒドロキシフェニル]−2−ヒドロキシエチル}アミノ)ヘキシル]オキシ}−ブチル)−ベンゼンスルホンアミド;3−(4−{[6−({(2R)−2−ヒドロキシ−2−[4−ヒドロキシ−3−(ヒドロキシ−メチル)フェニル]エチル}アミノ)−ヘキシル]オキシ}ブチル)ベンゼンスルホンアミドと;GSK159797と、GSK159802と、GSK597901と、GSK642444と、GSK678007と;以下から選択される化合物:N−[2−(ジエチルアミノ)エチル]−N−(2−{[2−(4−ヒドロキシ−2−オキソ−2,3−ジヒドロ−1,3−ベンゾチアゾール−7−イル)エチル]アミノ}エチル)−3−[2−(1−ナフチル)エトキシ]プロパンアミドと、N−[2−(ジエチルアミノ)エチル]−N−(2−{[2−(4−ヒドロキシ−2−オキソ−2,3−ジヒドロ−1,3−ベンゾチアゾール−7−イル)エチル]アミノ}エチル)−3−[2−(3−クロロフェニル)エトキシ]プロパンアミドと、7−[(1R)−2−({2−[(3−{[2−(2−クロロフェニル)エチル]アミノ}プロピル)チオ]エチル}アミノ)−1−ヒドロキシエチル]−4−ヒドロキシ−1,3−ベンゾチアゾール−2(3H)−オンと、N−シクロヘキシル−N3−[2−(3−フルオロフェニル)エチル]−N−(2−{[2−(4−ヒドロキシ−2−オキソ−2,3−ジヒドロ−1,3−ベンゾチアゾール−7−イル)エチル]アミノ}エチル)−β−アラニンアミドまたはその薬学的に許容され得る塩(例えば、対イオンは、塩酸塩(例えば、一塩酸塩または二塩酸塩)、臭化水素酸塩(例えば、一臭化水素酸塩または二臭化水素酸塩)、フマル酸塩、メタンスルホン酸塩、エタンスルホン酸塩、ベンゼンスルホン酸塩、2,5−ジクロロベンゼンスルホン酸塩、p−トルエンスルホン酸塩、ナパジシル酸塩(ナフタレン−1,5−二硫酸塩またはナフタレン−1−(スルホン酸)−5−スルホン酸塩)、エジシル酸塩(エタン−1,2−二硫酸塩またはエタン−1−(スルホン酸)−2−スルホン酸塩)、D−マンデル酸塩、L−マンデル酸塩、桂皮酸塩、または安息香酸塩である)と;
(xii)ムスカリンアンタゴニスト:−臭化アクリジニウムと、グリコピロレート(例えば、R,R−、R,S−、S,R−、またはS,S−臭化グリコピロニウム)と、臭化オキシトロピウムと、ピレンゼピンと、テレンゼピンと、臭化チトロピウムと、3(R)−1−フェネチル−3−(9H−キサンテン−9−カルボニルオキシ)−1−アゾニアビシクロ[2.2.2]臭化オクタンと、(3R)−3−[(2S)−2−シクロペンチル−2−ヒドロキシ−2−チエン−2−イルアセトキシ]−1−(2−フェノキシエチル)−1−アゾニアビシクロ[2.2.2]臭化アクタン(actane bromide)と、第4級塩(例えば、[2−((R)−シクロヘキシル−ヒドロキシ−フェニル−メチル)−オキサゾール−5−イルメチル]−ジメチル−(3−フェノキシ−プロピル)−アンモニウム塩と、[2−(4−クロロ−ベンジルオキシ)−エチル]−[2−((R)−シクロヘキシル−ヒドロキシ−フェニル−メチル)−オキサゾール−5−イルメチル]−ジメチル−アンモニウム塩と、(R)−1−[2−(4−フルオロ−フェニル)−エチル]−3−((S)−2−フェニル−2−ピペリジン−1−イル−プロピオニルオキシ)−1−アゾニア−ビシクロ[2.2.2]オクタン塩(対イオンは、例えば、塩化物、臭化物、硫酸塩、メタンスルホン酸塩、ベンゼンスルホン酸塩(ベシル酸塩)、トルエンスルホン酸塩(トシル酸塩)、ナフタレンビスルホン酸塩(ナパジル酸塩またはヘミ−ナパジル酸塩)、リン酸塩、酢酸塩、クエン酸塩、乳酸塩、酒石酸塩、メシル酸塩、マレイン酸塩、フマル酸塩、またはコハク酸塩)と;
(xiii)p38阻害剤:−681323と、856553と、AMG548(2−[[(2S)−2−アミノ−3−フェニルプロピル]アミノ]−3−メチル−5−(2−ナフタレニル)−6−(4−ピリジニル)−4(3H)−ピリミジノン)と、Array−797と、AZD6703と、ドラマピモド(Doramapimod)と、KC−706と、PH797804と、R1503と、SC−80036と、SCIO469と、6−クロロ−5−[[(2S,5R)−4−[(4−フルオロフェニル)メチル]−2,5−ジメチル(domethyl)−1−ピペラジニル]カルボニル]−N,N,1−トリメチル− −オキソ−1H−インドール−3−アセトアミドと、VX702と、VX745(5−(2,6−ジクロロフェニル)−2−(フェニルチオ)−6Η−ピリミド[1,6−b]ピリダジン−6−オン)と;
(xiv)PDE阻害剤:−256066と、アロフィリン(3−(4−クロロフェニル)−3,7−ジヒドロ−1−プロピル−1H−プリン−2,6−ジオン)と、AWD12−281(N−(3,5−ジクロロ−4−ピリジニル)−1−[(4−フルオロフェニル)メチル]−5−ヒドロキシ−α−オキソ−1H−インドール−3−アセトアミド)と、BAY19−8004(Bayer)と、CDC−801(Calgene)と、Celgeneの化合物((βR)−β−(3,4−ジメトキシフェニル)−1,3−ジヒドロ−1−オキソ−2H−イソインドール−2−プロパンアミド)と、シロミラスト(シス−4−シアノ−4−[3−(シクロペンチルオキシ)−4−メトキシフェニル]−シクロヘキサンカルボン酸)と、2−(3,5−ジクロロ−4−ピリジニル)−1−(7−メトキシスピロ[1,3−ベンゾジオキソール−2,1’−シクロペンタン]−4−イル)エタノン(CAS番号185406−34−2))と、(2−(3,4−ジフルオロフェノキシ)−5−フルオロ−N−[シス−4−[(2−ヒドロキシ−5−メチルベンゾイル)アミノ]シクロヘキシル]−)−3−ピリジンカルボキサミド)と、(2−(3,4−ジフルオロフェノキシ)−5−フルオロ−N−[シス−4−[[2−ヒドロキシ−5−(ヒドロキシメチル)ベンゾイル]アミノ]シクロヘキシル]−3−ピリジンカルボキサミド)と、CT2820と、GPD−1116と、イブジラストと、IC485と、KF31334と、KW−4490と、リリミラスト([2−(2,4−ジクロロベンゾイル)−6−[(メチルスルホニル)オキシ]−3−ベンゾフラニル])−尿素)と、(N−シクロプロピル−1,4−ジヒドロ−4−オキソ−1−[3−(3−ピリジニルエチニル)フェニル]−)−1,8−ナフチリジン−3−カルボキサミド)と、(N−(3,5−ジクロロ−4−ピリジニル)−4−(ジフルオロメトキシ)−8−[(メチルスルホニル)アミノ])−1−ジベンゾフランカルボキサミド)と、ONO6126と、ORG20241(4−(3,4−ジメトキシフェニル)−N−ヒドロキシ−)−2−チアゾールカルボキシミドアミド)と、PD189659/PD168787(Parke−Davis)と、ペントキシフィリン(3,7−ジヒドロ−3,7−ジメチル−1−(5−オキソヘキシル)−)−1H−プリン−2,6−ジオン)と、化合物(5−フルオロ−N−[4−[(2−ヒドロキシ−4−メチル−ベンゾイル)アミノ]シクロヘキシル]−2−(チアン(thian)−4−イルオキシ)ピリジン−3−カルボキサミド)と、ピクラミラスト(3−(シクロペンチルオキシ)−N−(3,5−ジクロロ−4−ピリジニル)−4−メトキシ−ベンズアミド)と、PLX−369(特許文献13)と、ロフルミラスト(3−(シクロプロピルメトキシ)−N−(3,5−ジクロロ−4−ピリジニル)−4−(ジフルオロメトキシ)ベンズアミド)と、SCH351591(N−(3,5−ジクロロ−1−オキシド−4−ピリジニル)−8−メトキシ−2−(トリフルオロメチル)−5−キノリンカルボキサミド)と、SelCID(TM)CC−10004(Calgene)と、T−440(Tanabe)と、Tetomilast(6−[2−(3,4−ジエトキシフェニル)−4−チアゾリル]−2−ピリジンカルボン酸)と、トフィミラスト(Tofimilast)(9−シクロペンチル−7−エチル−6,9−ジヒドロ−3−(2−チエニル)−5H−ピラゾロ[3,4−c]−1,2,4−トリアゾロ[4,3−a]ピリジン)と、TPI1100と、UCB101333−3(N,2−ジシクロプロピル−6−(ヘキサヒドロ−1H−アゼピン−1−イル)−5−メチル−4−ピリミジンアミン)と、V−11294A(Napp)と、VM554/VM565(Vernalis)と、ザルダベリン(6−[4−(ジフルオロメトキシ)−3−メトキシフェニル]−3(2H)−ピリダジノン)と;
(xv)PDE5阻害剤:−γグルタミル[s−(2−ヨードベンジル)システイニル]グリシンと、タダラフィルと、バルデナフィルと、シルデナフィルと、4−フェニル−メチルアミノ−6−クロロ−2−(1−イミダゾリル)−キナゾリンと、4−フェニル−メチルアミノ−6−クロロ−2−(3−ピリジル)−キナゾリンと、1,3−ジメチル−6−(2−プロポキシ−5−メタンスルホニルアミドフェニル)−1,5−ジヒドロピラゾロ[3,4−d]ピリミジン−4−オンと、1−シクロペンチル−3−エチル−6−(3−エトキシ−4−ピリジル)−ピラゾロ[3,4−d]ピリミジン−4−オンと;
(xvi)PPARγアゴニスト:−ピオグリタゾンと、塩酸ピオグリタゾンと、マレイン酸ロシグリタゾンと、マレイン酸ロシグリタゾン((−)−エナンチオマー、遊離塩基)と、マレイン酸ロシグリタゾン/塩酸メトホルミンと、テサグリタザル(Tesaglitizar)と;
(xvii)プロテアーゼ阻害剤:−α1−アンチトリプシンプロテイナーゼ阻害剤と、EPI−HNE4と、UT−77と、ZD−0892と、DPC−333と、Sch−709156と、ドキシサイクリンと;
(xviii)スタチン:−アトルバスタチンと、ロバスタチンと、プラバスタチンと、ロスバスタチンと、シンバスタチンと;
(xix)トロンボキサンアンタゴニスト:ラマトロバンとセラトロダストと;
(xx)血管拡張剤:−A−306552と、アンブリセンタンと、アボセンタンと、BMS−248360と、BMS−346567と、BMS−465149と、BMS−509701と、ボセンタンと、BSF−302146(アンブリセンタン)と、カルシトニン遺伝子関連ペプチドと、ダグルトリルと、ダルセンタンと、ファンドセンタンカリウムと、ファスジルと、イロプロストと、KC−12615(ダグルトリル)と、KC−12792 2AB(ダグルトリル)と、リポソームトレプロスチニルと、PS−433540と、シタクスセンタンナトリウム(Sitaxsentan sodium)と、フェルラ酸ナトリウム(Sodium Ferulate)と、TBC−11241(シタクスセンタン)と、TBC−3214(N−(2−アセチル−4,6−ジメチルフェニル)−3−[[(4−クロロ−3−メチル−5−イソキサゾリル)アミノ]スルホニル]−2−チオフェンカルボキサミド)と、TBC−3711と、トラピジルと、トレプロスチニルジエタノールアミンと、トレプロスチニルナトリウムと;
(xxi)ENAC:−アミロライドと、ベンザミルと、トリアムテレンと、552−02と、PSA14984と、PSA25569と、PSA23682と、AER002とが挙げられる。
(a)フォルモテロール(例えば、フマル酸塩)とブデソニド;
(b)フォルモテロール(例えば、フマル酸塩)とフルチカゾン;
(c)N−[2−(ジエチルアミノ)エチル]−N−(2−{[2−(4−ヒドロキシ−2−オキソ−2,3−ジヒドロ−1,3−ベンゾチアゾール−7−イル)エチル]アミノ}エチル)−3−[2−(1−ナフチル)エトキシ]プロパンアミドまたはその薬学的に許容され得る塩(例えば、二臭化水素酸塩)と[2−(4−クロロ−ベンジルオキシ)−エチル]−[2−((R)−シクロヘキシル−ヒドロキシ−フェニル−メチル)−オキサゾール−5−イルメチル]−ジメチル−アンモニウム塩(例えば、ヘミ−ナフタレン−1,5−ジスルホン酸塩);
(d)N−[2−(ジエチルアミノ)エチル]−N−(2−{[2−(4−ヒドロキシ−2−オキソ−2,3−ジヒドロ−1,3−ベンゾチアゾール−7−イル)エチル]アミノ}エチル)−3−[2−(1−ナフチル)エトキシ]プロパンアミドまたはその薬学的に許容され得る塩(例えば、二臭化水素酸塩)と(R)−1−[2−(4−フルオロ−フェニル)−エチル]−3−((S)−2−フェニル−2−ピペリジン−1−イル−プロピオニルオキシ)−1−アゾニア−ビシクロ[2.2.2]オクタン塩(例えば、臭化物またはトルエンスルホン酸塩);
(e)N−シクロヘキシル−N3−[2−(3−フルオロフェニル)エチル]−N−(2−{[2−(4−ヒドロキシ−2−オキソ−2,3−ジヒドロ−1,3−ベンゾチアゾール−7−イル)エチル]アミノ}エチル)−β−アラニンアミドまたはその薬学的に許容され得る塩(例えば、ジ−D−マンデル酸塩)と[2−(4−クロロ−ベンジルオキシ)−エチル]−[2−((R)−シクロヘキシル−ヒドロキシ−フェニル−メチル)−オキサゾール−5−イルメチル]−ジメチル−アンモニウム塩(例えば、ヘミ−ナフタレン−1,5−ジスルホン酸塩);
(f)N−シクロヘキシル−N3−[2−(3−フルオロフェニル)エチル]−N−(2−{[2−(4−ヒドロキシ−2−オキソ−2,3−ジヒドロ−1,3−ベンゾチアゾール−7−イル)エチル]アミノ}エチル)−β−アラニンアミドまたはその薬学的に許容され得る塩(例えば、ジ−D−マンデル酸塩)と(R)−1−[2−(4−フルオロ−フェニル)−エチル]−3−((S)−2−フェニル−2−ピペリジン−1−イル−プロピオニルオキシ)−1−アゾニア−ビシクロ[2.2.2]オクタン塩(例えば、臭化物またはトルエンスルホン酸塩)。
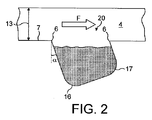
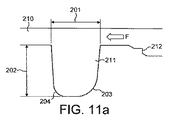
キャビティー開口のアスペクト比は、開口の垂直方向の長さ(台形の場合には、対称線の長さである)を平均幅で除した値として定義する。
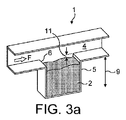
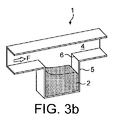
図7および図8は、特許文献7(上述)に記載されている装置の流路のコンピュータモデルを示している。このモデルは、この先行特許(図1〜図4a)に記載されている主な実施形態に基づいている。この装置は、平らな円筒状のフローチャンバー101を備え、その底部には、吸入用の粉末が入った標準的なサイズ4の製剤カプセルの別個の部分102が配設されている。6つの空気吸入口103が、チャンバーの周囲の半分に均等に下端部の近傍に配設されている。吸入口103の対称的に反対側には、吸入口103よりも直径の大きいマウスピース104が存在する。
パラメータ2:キャビティーの下半分におけるキャビティー表面の平均せん断応力(Pa)
パラメータ3:キャビティー全体における平均流速(ms−1)
パラメータ4:キャビティーの下半分における平均流速(ms−1)
パラメータ5:キャビティー全体における平均渦度(1/s)
パラメータ6:キャビティーの下半分における平均渦度(1/s)
パラメータ7:キャビティー全体における平均乱流運動エネルギー(m2/s2)
パラメータ8:キャビティーの下半分における平均乱流運動エネルギー(m2/s2)
w ν/n
式中、 は分子粘性であり、v/nは、壁における法線速度勾配である。
本発明による装置のコンピュータモデルを、実施例1に使用したソフトウエアと同じソフトウエアを用いて作成した。吸入器全体は、特許文献7に記載されている装置よりも自動化された機能を有し、より複雑である。また、吸入器内に2つの流路が存在し、1つが粉末キャビティーの上を通り、もう1つがバイパス路である。キャビティーの上を通る流路は、従来技術の流路よりもやや蛇行しており、流路がキャビティーに達する前に適度かつ相当な圧力低下が生じ得る。例えば、通常の使用では、全流路のキャビティーまでの部分で0.01〜2.0kPaの圧力低下が生じ得る。これは、好ましくは、範囲の下限、例えば、0.1〜1.0kPaである。
異なるCFDモデル化技術、ANSYS(登録商標)ソフトウエアCFX(登録商標)、リリース11.0を使用するRANS乱流3次元非定常多層CFDを利用して、特にキャビティーを空にすることに関する結果を得るために、キャビティー内の気流における粉末の運動をモデル化した。このソフトウエアは、粒径が50ミクロンの分散粒子モデルを用いて相間運動量移動をシミュレーションした。
図11aと図11bとを参照すると、本発明による流路が示されている。実施例2で参照したCFDモデルにおけるキャビティーの様々な寸法を変更した。これらの寸法は、図11aと図11b、および以下の表3にも示されている。図11bに、フィレット半径が207で示され、図11aに、後半径が203、前(下流)半径が204、長さが201、深さが202で示されている。図11bに、後の幅の半分が205、前の幅の半分が206で示されている。キャビティーの上を通る流路は210で示され、キャビティーは211で示されている。流れの方向は、矢印Fで示されている。キャビティーの1つの代替形状が、図11cと図11dとに示され、一致する参照番号は、形状の等しい機能構造を示している。合計6つのデザインを試験した。
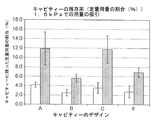
実施例4のデザインA、B、C、およびFの物理的プロトタイプを、高速プロトタイプ作成技術によって作成した。次いで、これらのモデルを、一方は非常に排出しにくく、他方はそれほど排出しにくくない2つの異なる粉末製剤で満たして試験した。各デザインに1.5kPaの圧力をかけて、非常に弱い人間の患者の吸入に等しい、プロトタイプを通る気流を生じさせた。キャビティーに残った活性薬剤成分(API)の質量百分率として表される空にする数値を、各デザインに対して決定した。
実施例5の試験と同様の試験を、デザインAおよびBのプロトタイプを用いて、9つの異なる標準粉末製剤と実験用粉末製剤とを使用して行った。
装置の性能に対する流路の高さの影響を評価するために、本発明による装置の僅かに異なる流路のコンピュータモデルを作成した。通路の高さが1.5mmのモデルと通路の高さが10mmのモデルとがそれぞれ、図14aと図14bおよび図15aと図15bに示されている。通路の幅は、各モデルとも同じであり、下流方向に僅かに広がっており、最も狭い点で3.1mmで、最も広い点で5.1mmであった。流路52の上流部53は、平らな「底部」54(すなわち、キャビティーが形成されている流路の壁)を有するようにデザインが変更されていた。この理由は、「天井」の高さ(すなわち、「底部」から反対側の壁までの距離55)が増大するモデルで傾斜した底部が続いていると、流れが、上方に案内され、流路の底部から離れることを見出したためである。上流の流路の傾斜は、キャビティーの上の流路の高さが低い(例えば、約1.5mm)の場合は比較的影響が小さいが、本発明者らは、増加する流路の高さの影響は、流路が、キャビティー開口を横断するように流れを案内し続ける(開口から離れる方向に案内するのとは対照的)場合にのみ、正確な評価を行うことができると考えている。
単純な立方形キャビティーとカプセル形キャビティーとのCFDによる検討を行い、立方形キャビティーが、カプセル形キャビティーよりも有望な結果を示すことが分かった。空にする速度は、カプセル形キャビティーでやや遅いことが分かっている。立方形キャビティー内の流れは、実質的に2次元であることが分かっているが、カプセル形キャビティー内の流れは、3次元であることが分かっている。カプセル形キャビティー内の3次元の流れは、キャビティーの中心線の下流とその近傍で粒子密度が高くなることが分かっている。主な差は、円筒流パターンを促進する能力においてである。
Claims (37)
- 1回投与量の薬物粉末を輸送する気流をディスペンスするための乾燥粉末吸入装置であって、流路(4;37;42;52;210)と、開口(20)を有する粉末貯蔵キャビティー(5;33;41;51;211)とを備え、前記キャビティー開口が、前記流路の壁(7;54)に存在し、前記流路が、前記キャビティー開口を横断するように空気の流れを案内するように配置され、(i)前記キャビティー開口が、長方形または台形などの四角形の形状を有し、(ii)流れ方向(F)における前記キャビティー開口の長さ(201)が、(i)前記キャビティーの深さ(202)の50%〜150%であり、かつ(iii)前記流れ方向における前記キャビティーの最大長さの少なくとも80%である、装置。
- 前記キャビティー開口(20)が、0.001mm〜0.5mm、好ましくは0.01mm〜0.3mmのフィレット半径を有することを特徴とする、請求項1に記載の装置。
- 前記開口(20)が、1.5〜4.0、好ましくは1.8〜3.5、より好ましくは2.6〜3.2の範囲のアスペクト比を有することを特徴とする、請求項1または2に記載の装置。
- 前記流れ方向(F)における前記キャビティー開口の前記長さ(201)が、前記キャビティーの深さ(202)の105%〜140%、好ましくは110%〜135%であることを特徴とする、請求項1〜3のいずれか1項に記載の装置。
- 前記キャビティーの近傍の前記流路(4;37;42;52;210)の最大高さが、0.5mm〜4mm、好ましくは0.5mm〜3mm、より好ましくは1mm〜2mmであることを特徴とする、請求項1〜4のいずれか1項に記載の装置。
- 前記流路(4;37;42;52;210)が、前記キャビティー開口を横断する実質的に単一方向の流れを発生させるように配置されていることを特徴とする、請求項1〜5のいずれか1項に記載の装置。
- 前記キャビティーの領域における前記流路(4;37;42;52;210)の最大幅が、2mm〜6mmであることを特徴とする、請求項1〜6のいずれか1項に記載の装置。
- 前記流れ方向に対する前記キャビティー(5;33;41;51;211)の下側の前縁および/または後縁(17、16)が、0.5mm〜3mm、好ましくは1.5mm〜2.5mm、より好ましくは1.75mm〜2.25mmの半径を有することを特徴とする、請求項1〜7のいずれか1項に記載の装置。
- 流れを乱す部材(44、212)が、流路壁から突出し、前記流れを乱す部材が、その最も上流部が、前記キャビティー(5;33;41;51;211)の1mm〜20mm、好ましくは2mm〜10mm、より好ましくは3mm〜7mm上流に位置していることを特徴とする、請求項1〜8のいずれか1項に記載の装置。
- 前記流れを乱す部材(44;212)が、前記キャビティー開口が形成されている壁から突出していることを特徴とする、請求項9に記載の装置。
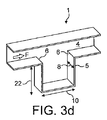
- 前記キャビティー(33)が閉じている第1の位置と前記キャビティーが開いている第2の位置との間で移動可能であり、かつ前記流路(37)の境界の一部を構成する蓋部材(35)が、前記キャビティーに付随していることを特徴とする、請求項1〜10のいずれか1項に記載の装置。
- 前記キャビティーの下流で、第2の粉末貯蔵キャビティーが、前記流路に開口していることを特徴とする、請求項1〜11のいずれか1項に記載の装置。
- 複数の流路(37)が、円の外周部に配置され、前記流路が、前記流れ方向が前記円に対して径方向であるように配置され、少なくとも1つの前記粉末貯蔵キャビティー(33)が、前記各流路に位置していることを特徴とする、請求項1〜12のいずれか1項に記載の装置。
- 前記1つまたは複数のキャビティー内に薬物粉末(38)が充填されている、請求項1〜13のいずれか1項に記載の装置。
- 前記薬物粉末が、モメタゾン、臭化イプラトロピウム、チオトロピウムおよびその塩、サルメテロール、プロピオン酸フルチカゾン、ジプロピオン酸ベクロメタゾン、レプロテロール、クレンブテロール、ロフレポニドおよび塩、ネドクロミル、クロモグリク酸ナトリウム、フルニソリド、ブデソニド、フマル酸フォルモテロール二水和物、テルブタリン、硫酸テルブタリン、サルブタモール塩基および硫酸塩、フェノテロール、3−[2−(4−ヒドロキシ−2−オキソ−3H−1,3−ベンゾチアゾール−7−イル)エチルアミノ]−N−[2−[2−(4−メチルフェニル)エトキシ]エチル]プロパンスルホンアミド、塩酸塩、インダカテロール、臭化アクリジニウム、N−[2−(ジエチルアミノ)エチル]−N−(2−{[2−(4−ヒドロキシ−2−オキソ−2,3−ジヒドロ−1,3−ベンゾチアゾール−7−イル)エチル]アミノ}エチル)−3−[2−(1−ナフチル)エトキシ]プロパンアミドまたはその薬学的に許容され得る塩(例えば、二臭化水素酸塩);N−シクロヘキシル−N3−[2−(3−フルオロフェニル)エチル]−N−(2−{[2−(4−ヒドロキシ−2−オキソ−2,3−ジヒドロ−1,3−ベンゾチアゾール−7−イル)エチル]アミノ}エチル)−β−アラニンアミドまたはその薬学的に許容され得る塩(例えば、ジ−D−マンデル酸塩);[2−(4−クロロ−ベンジルオキシ)−エチル]−[2−((R)−シクロヘキシル−ヒドロキシ−フェニル−メチル)−オキサゾール−5−イルメチル]−ジメチル−アンモニウム塩(例えば、ヘミ−ナフタレン−1,5−ジスルホン酸塩);(R)−1−[2−(4−フルオロ−フェニル)−エチル]−3−((S)−2−フェニル−2−ピペリジン−1−イル−プロピオニルオキシ)−1−アゾニア−ビシクロ[2.2.2]オクタン塩(例えば、臭化物またはトルエンスルホン酸塩);またはこれらの任意の2つ以上の組み合わせから選択される活性成分を含む、請求項14に記載の装置。
- 1回投与量の薬物粉末を輸送する気流をディスペンスするための装置であって、(a)1つの開口を有する粉末貯蔵キャビティー(33)と、(b)前記キャビティーが閉じている第1の位置と前記キャビティーが開いている第2の位置との間で移動可能な蓋部材(35)とを備え、前記蓋部材が前記第2の位置にあるときは、前記蓋部材が流路(37)の境界の一部を構成し、前記キャビティー開口が、前記流路の壁に存在し、前記流路が、前記キャビティー開口を横断するように空気の流れを案内するように配置され、(i)前記キャビティー開口が、長方形または台形などの四角形の形状を有し、(ii)流れ方向における前記キャビティー開口の長さが、前記キャビティーの深さの50%〜150%である、装置。
- 前記キャビティーの下流で、第2の粉末貯蔵キャビティーが、前記流路(37)に開口し、前記第2のキャビティーが、前記蓋部材(35)が前記第1の位置にあるときは閉じ、前記蓋部材が前記第2の位置にくると開くことを特徴とする、請求項16に記載の装置。
- 前記1つまたは複数のキャビティー内に薬物粉末(38)が充填されている、請求項16または17に記載の装置。
- 前記薬物粉末が、モメタゾン、臭化イプラトロピウム、チオトロピウムおよびその塩、サルメテロール、プロピオン酸フルチカゾン、ジプロピオン酸ベクロメタゾン、レプロテロール、クレンブテロール、ロフレポニドおよび塩、ネドクロミル、クロモグリク酸ナトリウム、フルニソリド、ブデソニド、フマル酸フォルモテロール二水和物、テルブタリン、硫酸テルブタリン、サルブタモール塩基および硫酸塩、フェノテロール、3−[2−(4−ヒドロキシ−2−オキソ−3H−1,3−ベンゾチアゾール−7−イル)エチルアミノ]−N−[2−[2−(4−メチルフェニル)エトキシ]エチル]プロパンスルホンアミド、塩酸塩、インダカテロール、臭化アクリジニウム、N−[2−(ジエチルアミノ)エチル]−N−(2−{[2−(4−ヒドロキシ−2−オキソ−2,3−ジヒドロ−1,3−ベンゾチアゾール−7−イル)エチル]アミノ}エチル)−3−[2−(1−ナフチル)エトキシ]プロパンアミドまたはその薬学的に許容され得る塩(例えば、二臭化水素酸塩);N−シクロヘキシル−N3−[2−(3−フルオロフェニル)エチル]−N−(2−{[2−(4−ヒドロキシ−2−オキソ−2,3−ジヒドロ−1,3−ベンゾチアゾール−7−イル)エチル]アミノ}エチル)−β−アラニンアミドまたはその薬学的に許容され得る塩(例えば、ジ−D−マンデル酸塩);[2−(4−クロロ−ベンジルオキシ)−エチル]−[2−((R)−シクロヘキシル−ヒドロキシ−フェニル−メチル)−オキサゾール−5−イルメチル]−ジメチル−アンモニウム塩(例えば、ヘミ−ナフタレン−1,5−ジスルホン酸塩);(R)−1−[2−(4−フルオロ−フェニル)−エチル]−3−((S)−2−フェニル−2−ピペリジン−1−イル−プロピオニルオキシ)−1−アゾニア−ビシクロ[2.2.2]オクタン塩(例えば、臭化物またはトルエンスルホン酸塩);またはこれらの任意の2つ以上の組み合わせから選択される活性成分を含む、請求項18に記載の装置。
- 1回投与量の薬物粉末を輸送する気流をディスペンスするための乾燥粉末吸入装置であって、流路(4;37;42;52;210)と、開口(20)を有する粉末貯蔵キャビティー(5;33;41;51;211)とを備え、前記キャビティー開口が、前記流路の壁(7;54)に存在し、前記流路が、前記キャビティー開口を横断するように空気の流れを案内するように配置され、流れ方向(F)における前記キャビティー開口の長さ(201)が、(i)前記キャビティーの深さ(202)の50%〜150%であり、かつ(ii)前記流れ方向における前記キャビティーの最大長さの少なくとも80%であり、前記キャビティーの近傍の前記流路が、1mm2〜20mm2、好ましくは3mm2〜10mm2の範囲の断面積を有することを特徴とする、装置。
- 1回投与量の薬物粉末を輸送する気流をディスペンスするための乾燥粉末吸入装置であって、流路(4;37;42;52;210)と、唯1つの開口(20)を有する粉末貯蔵キャビティー(5;33;41;51;211)とを備え、前記キャビティー開口が、前記流路の壁(7;54)に存在し、前記流路が、前記キャビティー開口を横断するように空気の流れを案内するように配置され、流れ方向(F)における前記キャビティー開口の長さ(201)が、前記キャビティーの深さ(202)の50%〜150%であり、前記キャビティーの近傍の前記流路が、1mm2〜20mm2、好ましくは3mm2〜10mm2の範囲の断面積を有することを特徴とする、装置。
- 1回投与量の薬物粉末を輸送する気流をディスペンスするための乾燥粉末吸入装置であって、流路(4;37;42;52;210)と、唯1つの開口(20)を有する粉末貯蔵キャビティー(5;33;41;51;211)とを備え、前記キャビティー開口が、前記流路の壁(7;54)に存在し、前記流路が、前記キャビティー開口を横断するように空気の流れを案内するように配置され、流れ方向(F)における前記キャビティー開口の長さ(201)が、前記キャビティーの深さ(202)の50%〜150%であり、前記キャビティーのすぐ近傍の前記流路の最大高さが、0.5mm〜4mmであることを特徴とする、装置。
- 1回投与量の薬物粉末を輸送する気流をディスペンスするための方法であって、請求項1〜22のいずれか1項に記載の装置の粉末含有キャビティー(5;33;41;51;211)の前記開口(20)を、空気の流れを横断させるステップを含む、方法。
- 1回投与量の薬物粉末を輸送する気流をディスペンスするための方法であって、粉末含有キャビティー(5;33;41;51;211)の前記開口(20)を、空気の流れを横断させるステップを含み、流れ方向(F)における前記キャビティー開口の長さ(201)が、(i)前記キャビティーの深さ(202)の50%〜150%であり、かつ(ii)前記流れ方向における前記キャビティーの最大長さの少なくとも80%であり、前記キャビティー開口のすぐ近傍の流速が、少なくとも15m/sであることを特徴とする、方法。
- 1回投与量の薬物粉末を輸送する気流をディスペンスするための方法であって、唯1つの開口を有する粉末含有キャビティー(5;33;41;51;211)の前記開口(20)を、空気の流れを横断させるステップを含み、前記キャビティー開口が、前記キャビティーの深さの50%〜150%の流れ方向における長さを有し、前記キャビティー開口のすぐ近傍の流速が、少なくとも15m/sであることを特徴とする、方法。
- 前記キャビティー開口のすぐ近傍の流速が、少なくとも20m/s、好ましくは少なくとも20m/s、より好ましくは少なくとも30m/s、さらに好ましくは少なくとも40m/s、または実に50m/sであることを特徴とする、請求項23〜25のいずれか1項に記載の方法。
- ディスペンス後の前記キャビティーにおける残存粉末が、ディスペンス前の前記キャビティーにおける粉末の総質量の0.1質量%〜10質量%、好ましくは1質量%〜8質量%、より好ましくは1質量%〜5質量%であることを特徴とする、請求項23〜26のいずれか1項に記載の方法。
- 前記キャビティーの下半分における平均表面せん断応力が、少なくとも0.5Pa、好ましくは少なくとも1Pa、より好ましくは少なくとも1.5Paであることを特徴とする、請求項23〜27のいずれか1項に記載の方法。
- 前記キャビティーの下半分における平均乱流運動エネルギーが、少なくとも3m2/s2、好ましくは少なくとも4m2/s2、より好ましくは少なくとも5m2/s2であることを特徴とする、請求項23〜28のいずれか1項に記載の方法。
- 前記キャビティーの下半分における平均渦度が、少なくとも2,000 1/s、好ましくは少なくとも4,000 1/s、より好ましくは少なくとも10,000 1/sである、ことを特徴とする、請求項23〜29のいずれか1項に記載の方法。
- 前記キャビティーの下半分における平均流速が、少なくとも1.5m/s、好ましくは少なくとも3m/s、より好ましくは少なくとも4m/sであることを特徴とする、請求項23〜30のいずれか1項に記載の方法。
- 前記キャビティー内の流れが、せん断誘導キャビティー流の現象のみによって生じることを特徴とする、請求項23〜31のいずれか1項に記載の方法。
- 前記薬物粉末が、モメタゾン、臭化イプラトロピウム、チオトロピウムおよびその塩、サルメテロール、プロピオン酸フルチカゾン、ジプロピオン酸ベクロメタゾン、レプロテロール、クレンブテロール、ロフレポニドおよび塩、ネドクロミル、クロモグリク酸ナトリウム、フルニソリド、ブデソニド、フマル酸フォルモテロール二水和物、テルブタリン、硫酸テルブタリン、サルブタモール塩基および硫酸塩、フェノテロール、3−[2−(4−ヒドロキシ−2−オキソ−3H−1,3−ベンゾチアゾール−7−イル)エチルアミノ]−N−[2−[2−(4−メチルフェニル)エトキシ]エチル]プロパンスルホンアミド、塩酸塩、インダカテロール、臭化アクリジニウム、N−[2−(ジエチルアミノ)エチル]−N−(2−{[2−(4−ヒドロキシ−2−オキソ−2,3−ジヒドロ−1,3−ベンゾチアゾール−7−イル)エチル]アミノ}エチル)−3−[2−(1−ナフチル)エトキシ]プロパンアミドまたはその薬学的に許容され得る塩(例えば、二臭化水素酸塩);N−シクロヘキシル−N3−[2−(3−フルオロフェニル)エチル]−N−(2−{[2−(4−ヒドロキシ−2−オキソ−2,3−ジヒドロ−1,3−ベンゾチアゾール−7−イル)エチル]アミノ}エチル)−β−アラニンアミドまたはその薬学的に許容され得る塩(例えば、ジ−D−マンデル酸塩);[2−(4−クロロ−ベンジルオキシ)−エチル]−[2−((R)−シクロヘキシル−ヒドロキシ−フェニル−メチル)−オキサゾール−5−イルメチル]−ジメチル−アンモニウム塩(例えば、ヘミ−ナフタレン−1,5−ジスルホン酸塩);(R)−1−[2−(4−フルオロ−フェニル)−エチル]−3−((S)−2−フェニル−2−ピペリジン−1−イル−プロピオニルオキシ)−1−アゾニア−ビシクロ[2.2.2]オクタン塩(例えば、臭化物またはトルエンスルホン酸塩);またはこれらの任意の2つ以上の組み合わせから選択される活性成分を含むことを特徴とする、請求項23〜32のいずれか1項に記載の方法。
- 請求項1〜22のいずれか1項に記載の装置に使用する交換用マガジンであって、薬物粉末が充填された1つまたは複数のキャビティーを備えた、交換用マガジン。
- 乾燥粉末吸入器用のキャビティーディスク(32)であって、前記ディスク上に環状パターンに配置された複数の粉末含有キャビティー(33)を備え、前記各キャビティーが、除去可能なシールまたは蓋(35)によって覆われ得る台形の開口を有し、前記各キャビティーが、前記キャビティーの深さの50%〜150%である径方向における長さを有する、キャビティーディスク。
- 前記各キャビティー(33)の径方向における前記長さが、前記径方向における前記キャビティーの最大長さの少なくとも80%である、請求項35に記載のキャビティーディスク。
- 流れ方向に対する前記キャビティー(33)の下側の前縁および/または後縁が、0.5mm〜3mm、好ましくは1.5mm〜2.5mm、より好ましくは1.75mm〜2.25mmの半径を有する、請求項35または36に記載のキャビティーディスク。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US22220909P | 2009-07-01 | 2009-07-01 | |
| US61/222,209 | 2009-07-01 | ||
| PCT/SE2010/050749 WO2011002406A1 (en) | 2009-07-01 | 2010-06-30 | Dispenser and method for entraining powder in an airflow |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015119887A Division JP6193918B2 (ja) | 2009-07-01 | 2015-06-15 | 粉末を気流に引き込むためのディスペンサーおよび方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2012531961A true JP2012531961A (ja) | 2012-12-13 |
| JP2012531961A5 JP2012531961A5 (ja) | 2013-08-08 |
Family
ID=43411288
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2012518513A Pending JP2012531961A (ja) | 2009-07-01 | 2010-06-30 | 粉末を気流に引き込むためのディスペンサーおよび方法 |
| JP2015119887A Expired - Fee Related JP6193918B2 (ja) | 2009-07-01 | 2015-06-15 | 粉末を気流に引き込むためのディスペンサーおよび方法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015119887A Expired - Fee Related JP6193918B2 (ja) | 2009-07-01 | 2015-06-15 | 粉末を気流に引き込むためのディスペンサーおよび方法 |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US9211383B2 (ja) |
| EP (1) | EP2448623B1 (ja) |
| JP (2) | JP2012531961A (ja) |
| KR (1) | KR20120107845A (ja) |
| CN (1) | CN102711883B (ja) |
| AU (1) | AU2010266754B2 (ja) |
| BR (1) | BRPI1015579A2 (ja) |
| CA (1) | CA2765497A1 (ja) |
| MX (1) | MX2011013368A (ja) |
| NZ (1) | NZ597009A (ja) |
| RU (1) | RU2536826C2 (ja) |
| WO (1) | WO2011002406A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP7166327B2 (ja) | 2017-03-15 | 2022-11-07 | シーエスピー テクノロジーズ,インコーポレイティド | 吸入器並びに吸入器を使用する方法及び製造する方法 |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| MX2010006658A (es) | 2007-12-20 | 2010-10-05 | Astrazeneca Ab | Surtidor y metodo para arrastrar polvo en un flujo de aire 537. |
| US9211383B2 (en) | 2009-07-01 | 2015-12-15 | Astrazeneca Ab | Dispenser and method for entraining powder in an airflow |
| WO2012010878A1 (en) | 2010-07-21 | 2012-01-26 | Astrazeneca Ab | Inhaler |
| KR20130090877A (ko) | 2010-07-21 | 2013-08-14 | 아스트라제네카 아베 | 흡입기 |
| ES2773375T3 (es) * | 2011-03-21 | 2020-07-10 | Simplified Solutions Sweden Ab | Inhalador para sustancias en polvo |
| CN109475404B (zh) | 2016-05-11 | 2022-08-30 | 制定实验室公司 | 医疗植入物及其制备方法 |
| US10960151B2 (en) * | 2017-04-26 | 2021-03-30 | Lafayette College | Inhalation device with shape memory alloy actuator |
| WO2018222810A1 (en) * | 2017-05-31 | 2018-12-06 | Virginia Commonwealth University | Devices, systems, and methods for dry powder therapies |
| US20230173203A1 (en) * | 2020-01-22 | 2023-06-08 | Virginia Commonwealth University | Dry powder inhalers and interfaces for improved aerosol delivery to children |
Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH06500934A (ja) * | 1990-09-12 | 1994-01-27 | アストラ・アクチエボラーグ | 使い捨て吸入器 |
| JPH07508184A (ja) * | 1992-03-04 | 1995-09-14 | アストラ・アクチエボラーグ | 使い捨て吸入器 |
| JPH11510412A (ja) * | 1995-08-10 | 1999-09-14 | アストラ・アクチエボラーグ | 吸入器 |
| JP2002542999A (ja) * | 1999-04-24 | 2002-12-17 | グラクソ グループ リミテッド | 薬剤キャリヤ |
| JP2007520247A (ja) * | 2003-07-02 | 2007-07-26 | ファイザー・リミテッド | 投与デバイス |
| WO2008008021A1 (en) * | 2006-07-14 | 2008-01-17 | Astrazeneca Ab | Inhalation system and delivery device for the administration of a drug in the form of dry powder. |
| US20090084379A1 (en) * | 2007-10-02 | 2009-04-02 | Baxter International Inc. | Dry powder inhaler |
Family Cites Families (82)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE2346914C3 (de) | 1973-09-18 | 1980-10-16 | Paul Ritzau Pari-Werk, Gmbh & Co, 8130 Starnberg | Inhalator für pulverförmige Substanzen |
| US3872970A (en) | 1974-01-11 | 1975-03-25 | Lilly Co Eli | Child-resistant blister package |
| IT1017153B (it) | 1974-07-15 | 1977-07-20 | Isf Spa | Apparecchio per inalazioni |
| US4014336A (en) | 1975-01-13 | 1977-03-29 | Syntex Puerto Rico, Inc. | Inhalation device |
| US3948264A (en) | 1975-05-21 | 1976-04-06 | Mead Johnson & Company | Inhalation device |
| GB1521000A (en) | 1975-06-13 | 1978-08-09 | Syntex Puerto Rico Inc | Inhalation device |
| GB1598081A (en) | 1977-02-10 | 1981-09-16 | Allen & Hanburys Ltd | Inhaler device for dispensing medicaments |
| WO1981001243A1 (en) | 1979-10-30 | 1981-05-14 | Riker Laboratories Inc | Breath actuated devices for administering powdered medicaments |
| ES506585A0 (es) | 1980-10-30 | 1982-09-01 | Riker Laboratories Inc | Un dispositivo para facilitar la inhalacion oral de medica- mentos en forma de polvo |
| US4849606A (en) | 1987-12-23 | 1989-07-18 | S. C. Johnson & Son, Inc. | Tamper-resistant container utilizing a flexible seal |
| US4946038A (en) | 1989-12-20 | 1990-08-07 | Rolland Eaton | Medicine container and cover therefor |
| GB9004781D0 (en) | 1990-03-02 | 1990-04-25 | Glaxo Group Ltd | Device |
| GB9021433D0 (en) | 1990-10-02 | 1990-11-14 | Atomic Energy Authority Uk | Power inhaler |
| US5042472A (en) | 1990-10-15 | 1991-08-27 | Merck & Co., Inc. | Powder inhaler device |
| CA2093809A1 (en) | 1991-08-15 | 1993-02-16 | Franco Del Bon | Inhaler |
| US5469843A (en) | 1991-11-12 | 1995-11-28 | Minnesota Mining And Manufacturing Company | Inhalation device |
| GB2264237A (en) | 1992-02-05 | 1993-08-25 | Robert Edward Newell | An inhaler |
| DE4208880A1 (de) | 1992-03-19 | 1993-09-23 | Boehringer Ingelheim Kg | Separator fuer pulverinhalatoren |
| ATE142515T1 (de) | 1992-06-05 | 1996-09-15 | Hoechst Ag | Inhalator |
| WO1994023772A2 (en) | 1993-04-06 | 1994-10-27 | Minnesota Mining And Manufacturing Company | Deagglomerators for dry powder inhalers |
| US5497763A (en) * | 1993-05-21 | 1996-03-12 | Aradigm Corporation | Disposable package for intrapulmonary delivery of aerosolized formulations |
| US5921237A (en) | 1995-04-24 | 1999-07-13 | Dura Pharmaceuticals, Inc. | Dry powder inhaler |
| DE19522415C2 (de) * | 1995-06-21 | 2003-12-04 | Sofotec Gmbh & Co Kg | Arzneimittelpulverpatrone mit integrierter Dosiereinrichtung und Pulverinhalator mit Mitteln zum Betätigen der Dosiereinrichtung der Arzneimittelpulverpatrone |
| IL125183A0 (en) | 1996-01-03 | 1999-03-12 | Glaxo Group Ltd | Inhalation device |
| US5694920A (en) | 1996-01-25 | 1997-12-09 | Abrams; Andrew L. | Inhalation device |
| US5699789A (en) | 1996-03-11 | 1997-12-23 | Hendricks; Mark R. | Dry powder inhaler |
| SE9700423D0 (sv) | 1997-02-07 | 1997-02-07 | Astra Ab | Disposable inhaler |
| SE9700421D0 (sv) | 1997-02-07 | 1997-02-07 | Astra Ab | Single dose inhaler I |
| US6006747A (en) | 1997-03-20 | 1999-12-28 | Dura Pharmaceuticals, Inc. | Dry powder inhaler |
| CA2212430A1 (en) | 1997-08-07 | 1999-02-07 | George Volgyesi | Inhalation device |
| NL1008031C2 (nl) | 1998-01-15 | 1999-07-21 | Pharmachemie Bv | Inrichting voor het inhaleren van medicament. |
| US7371254B2 (en) | 1998-01-23 | 2008-05-13 | Innercool Therapies, Inc. | Medical procedure |
| US6234169B1 (en) | 1998-08-14 | 2001-05-22 | Arthur Slutsky | Inhaler |
| GB9905538D0 (en) | 1999-03-10 | 1999-05-05 | Glaxo Group Ltd | A device |
| US6810872B1 (en) | 1999-12-10 | 2004-11-02 | Unisia Jecs Corporation | Inhalant medicator |
| SE9904706D0 (sv) | 1999-12-21 | 1999-12-21 | Astra Ab | An inhalation device |
| US6427688B1 (en) | 2000-02-01 | 2002-08-06 | Dura Pharmaceuticals, Icn. | Dry powder inhaler |
| US6971383B2 (en) | 2001-01-24 | 2005-12-06 | University Of North Carolina At Chapel Hill | Dry powder inhaler devices, multi-dose dry powder drug packages, control systems, and associated methods |
| US6948494B1 (en) * | 2000-05-10 | 2005-09-27 | Innovative Devices, Llc. | Medicament container with same side airflow inlet and outlet and method of use |
| AR028746A1 (es) | 2000-06-23 | 2003-05-21 | Norton Health Care Ltd | Cartucho de dosis previamente medidas para inhalador de polvo seco accionado por la respiracion, el inhalador y un metodo de provision de dosis previamente medidas de polvo seco |
| US7080644B2 (en) | 2000-06-28 | 2006-07-25 | Microdose Technologies, Inc. | Packaging and delivery of pharmaceuticals and drugs |
| AUPR020400A0 (en) | 2000-09-19 | 2000-10-12 | Glaxo Wellcome Australia Ltd | Inhalation device |
| FI20002363A0 (fi) | 2000-10-27 | 2000-10-27 | Orion Yhtymae Oyj | Jauheinhalaattori |
| EG24184A (en) | 2001-06-15 | 2008-10-08 | Otsuka Pharma Co Ltd | Dry powder inhalation system for transpulmonary |
| US6681768B2 (en) | 2001-06-22 | 2004-01-27 | Sofotec Gmbh & Co. Kg | Powder formulation disintegrating system and method for dry powder inhalers |
| WO2003024514A1 (en) | 2001-09-19 | 2003-03-27 | Advent Pharmaceuticals Pty Ltd | An inhaler |
| SE0104251D0 (sv) | 2001-12-14 | 2001-12-14 | Astrazeneca Ab | Novel compounds |
| SE524957C2 (sv) | 2002-04-12 | 2004-11-02 | Microdrug Ag | Förfarande för uppdelning och fördelning i luft av torrt pulvermedikament |
| WO2003103563A2 (en) | 2002-06-07 | 2003-12-18 | Sun Pharmaceutical Industries Limited | Powder inhaler |
| JP2004116946A (ja) * | 2002-09-27 | 2004-04-15 | Asahi Kasei Chemicals Corp | バルク含水爆薬またはその中間体用の容器 |
| AU2003285246A1 (en) | 2002-12-02 | 2004-06-23 | The Governors Of The University Of Alberta | Device and method for deagglomeration of powder for inhalation |
| GB2401548B (en) | 2003-05-13 | 2005-07-13 | Boots Healthcare Int Ltd | Improvements relating to vaporisers |
| EP1488819A1 (en) | 2003-06-16 | 2004-12-22 | Rijksuniversiteit te Groningen | Dry powder inhaler and method for pulmonary inhalation of dry powder |
| AP2006003491A0 (en) | 2003-07-09 | 2006-02-28 | Cipla Ltd | Multi-dose inhaler. |
| GB0322544D0 (en) | 2003-09-26 | 2003-10-29 | Innovata Biomed Ltd | Apparatus |
| GB2407042B (en) | 2003-10-17 | 2007-10-24 | Vectura Ltd | Inhaler |
| MXPA06009516A (es) | 2004-02-24 | 2007-03-26 | Microdose Technologies Inc | Inhalador con sensor de flujo direccional. |
| SE0401654D0 (sv) * | 2004-06-24 | 2004-06-24 | Astrazeneca Ab | A support structure for a medicament |
| ES2353018T3 (es) * | 2004-07-16 | 2011-02-24 | Almirall, S.A. | Inhalador para la administración de productos farmacéuticos en polvo, y un cartucho de polvo para uso con este inhalador. |
| CA2574398C (en) | 2004-07-26 | 2010-05-18 | 1355540 Ontario Inc. | Powder inhaler featuring reduced compaction |
| AU2005279795A1 (en) | 2004-09-03 | 2006-03-09 | Plexxikon, Inc. | Bicyclic heteroaryl PDE4B inhibitors |
| GB0427028D0 (en) | 2004-12-09 | 2005-01-12 | Cambridge Consultants | Dry powder inhalers |
| GB0427856D0 (en) | 2004-12-20 | 2005-01-19 | Glaxo Group Ltd | Maniflod for use in medicament dispenser |
| WO2006118527A1 (en) | 2005-05-02 | 2006-11-09 | Astrazeneca Ab | An arrangement and a method for opening a cavity, a medical package and a dispensing device |
| US8763605B2 (en) | 2005-07-20 | 2014-07-01 | Manta Devices, Llc | Inhalation device |
| DE102005046645B3 (de) | 2005-09-29 | 2006-07-20 | Braunform Gmbh | Pulverinhalator |
| US20070131576A1 (en) | 2005-11-07 | 2007-06-14 | Advanced Inhalation Research, Inc. | Receptacle packaging with inhaler-accommodating geometry |
| EP1844806A1 (de) | 2006-04-13 | 2007-10-17 | Boehringer Ingelheim Pharma GmbH | Medikamenten-Ausgabevorrichtung, Medikamentenmagazin dafür, und Verfahren zur Entnahme eines Medikaments aus einer Medikamentenkammer |
| DE102006043637A1 (de) | 2006-05-18 | 2007-11-22 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Zerstäuber |
| GB0611656D0 (en) | 2006-06-13 | 2006-07-19 | Cambridge Consultants | Dry powder inhalers |
| CN101553493B (zh) | 2006-07-19 | 2012-07-04 | 阿斯利康(瑞典)有限公司 | 三环螺哌啶化合物、它们的合成和它们作为趋化因子受体活性调节剂的用途 |
| GB0704928D0 (en) | 2007-03-14 | 2007-04-25 | Cambridge Consultants | Dry powder inhalers |
| DK2898914T3 (en) | 2007-07-06 | 2018-09-03 | Manta Devices Llc | INHALATION DEVICES FOR STORAGE AND DELIVERY OF MEDICINES |
| WO2009008832A1 (en) * | 2007-07-12 | 2009-01-15 | Astrazeneca Ab | Medicament containing structure, method and inhalation device comprising such structure |
| MX2010006658A (es) | 2007-12-20 | 2010-10-05 | Astrazeneca Ab | Surtidor y metodo para arrastrar polvo en un flujo de aire 537. |
| KR20100129728A (ko) | 2008-01-23 | 2010-12-09 | 아스트라제네카 아베 | 사용자에게 표시부를 제공하는 디스플레이가 제공되는 의약-수용 분배기 |
| DK2293833T3 (en) | 2008-06-13 | 2016-05-23 | Mannkind Corp | DRY POWDER INHALER AND MEDICINAL ADMINISTRATION SYSTEM |
| KR20110083651A (ko) | 2008-10-08 | 2011-07-20 | 아스트라제네카 아베 | 가청 표시기 수단을 갖는 흡입기 |
| WO2010042035A1 (en) | 2008-10-08 | 2010-04-15 | Astrazeneca Ab | Inhaler with indexing linked to movement of cover |
| US9211383B2 (en) | 2009-07-01 | 2015-12-15 | Astrazeneca Ab | Dispenser and method for entraining powder in an airflow |
| WO2012010878A1 (en) | 2010-07-21 | 2012-01-26 | Astrazeneca Ab | Inhaler |
| KR20130090877A (ko) | 2010-07-21 | 2013-08-14 | 아스트라제네카 아베 | 흡입기 |
-
2010
- 2010-06-30 US US13/380,055 patent/US9211383B2/en not_active Expired - Fee Related
- 2010-06-30 MX MX2011013368A patent/MX2011013368A/es active IP Right Grant
- 2010-06-30 RU RU2011152515/14A patent/RU2536826C2/ru not_active IP Right Cessation
- 2010-06-30 KR KR1020117031606A patent/KR20120107845A/ko not_active Application Discontinuation
- 2010-06-30 CA CA2765497A patent/CA2765497A1/en not_active Abandoned
- 2010-06-30 AU AU2010266754A patent/AU2010266754B2/en not_active Ceased
- 2010-06-30 NZ NZ597009A patent/NZ597009A/en not_active IP Right Cessation
- 2010-06-30 EP EP10794459.7A patent/EP2448623B1/en not_active Not-in-force
- 2010-06-30 WO PCT/SE2010/050749 patent/WO2011002406A1/en active Application Filing
- 2010-06-30 CN CN201080038777.7A patent/CN102711883B/zh not_active Expired - Fee Related
- 2010-06-30 BR BRPI1015579A patent/BRPI1015579A2/pt not_active IP Right Cessation
- 2010-06-30 JP JP2012518513A patent/JP2012531961A/ja active Pending
-
2015
- 2015-06-15 JP JP2015119887A patent/JP6193918B2/ja not_active Expired - Fee Related
Patent Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH06500934A (ja) * | 1990-09-12 | 1994-01-27 | アストラ・アクチエボラーグ | 使い捨て吸入器 |
| JPH07508184A (ja) * | 1992-03-04 | 1995-09-14 | アストラ・アクチエボラーグ | 使い捨て吸入器 |
| JPH11510412A (ja) * | 1995-08-10 | 1999-09-14 | アストラ・アクチエボラーグ | 吸入器 |
| JP2002542999A (ja) * | 1999-04-24 | 2002-12-17 | グラクソ グループ リミテッド | 薬剤キャリヤ |
| JP2007520247A (ja) * | 2003-07-02 | 2007-07-26 | ファイザー・リミテッド | 投与デバイス |
| WO2008008021A1 (en) * | 2006-07-14 | 2008-01-17 | Astrazeneca Ab | Inhalation system and delivery device for the administration of a drug in the form of dry powder. |
| US20090084379A1 (en) * | 2007-10-02 | 2009-04-02 | Baxter International Inc. | Dry powder inhaler |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP7166327B2 (ja) | 2017-03-15 | 2022-11-07 | シーエスピー テクノロジーズ,インコーポレイティド | 吸入器並びに吸入器を使用する方法及び製造する方法 |
| US11617842B2 (en) | 2017-03-15 | 2023-04-04 | Csp Technologies, Inc. | Inhaler and methods of using and making the same |
Also Published As
| Publication number | Publication date |
|---|---|
| RU2536826C2 (ru) | 2014-12-27 |
| EP2448623A4 (en) | 2016-04-06 |
| EP2448623B1 (en) | 2017-12-20 |
| JP6193918B2 (ja) | 2017-09-06 |
| BRPI1015579A2 (pt) | 2019-09-24 |
| KR20120107845A (ko) | 2012-10-04 |
| WO2011002406A1 (en) | 2011-01-06 |
| CA2765497A1 (en) | 2011-01-06 |
| NZ597009A (en) | 2014-05-30 |
| MX2011013368A (es) | 2012-01-20 |
| AU2010266754B2 (en) | 2013-12-05 |
| EP2448623A1 (en) | 2012-05-09 |
| RU2011152515A (ru) | 2013-08-10 |
| JP2015163276A (ja) | 2015-09-10 |
| US20120298106A1 (en) | 2012-11-29 |
| US9211383B2 (en) | 2015-12-15 |
| AU2010266754A1 (en) | 2012-02-02 |
| CN102711883A (zh) | 2012-10-03 |
| CN102711883B (zh) | 2015-04-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6193918B2 (ja) | 粉末を気流に引き込むためのディスペンサーおよび方法 | |
| US8578933B2 (en) | Entraining powder in an airflow | |
| JP5518082B2 (ja) | 吸入装置および医薬を投与する方法 | |
| JP5841429B2 (ja) | 可聴インジケータ手段を備えた吸入器 | |
| KR20080099856A (ko) | 분말 물질용 흡입기 | |
| MX2012012464A (es) | Inhalador individual con capsula. | |
| JP5512686B2 (ja) | 呼吸作動式吸入器 | |
| JP5632848B2 (ja) | カバーの動作にリンクしてインデックス動作を行う吸入器 | |
| AU2014200558A1 (en) | Dispenser and method for entraining powder in an airflow |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130620 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20130620 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20140423 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20140507 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20140806 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20140813 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140908 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20150303 |