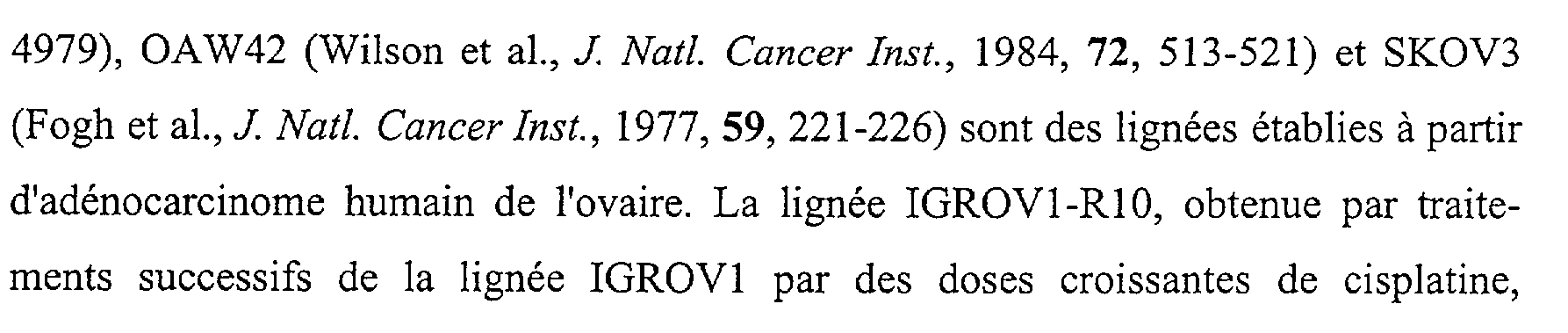FR2826869A1 - PRODUCTS SUITABLE TO TREAT OVARIAN CANCERS AND PREVENT RELAPSES - Google Patents
PRODUCTS SUITABLE TO TREAT OVARIAN CANCERS AND PREVENT RELAPSES Download PDFInfo
- Publication number
- FR2826869A1 FR2826869A1 FR0108864A FR0108864A FR2826869A1 FR 2826869 A1 FR2826869 A1 FR 2826869A1 FR 0108864 A FR0108864 A FR 0108864A FR 0108864 A FR0108864 A FR 0108864A FR 2826869 A1 FR2826869 A1 FR 2826869A1
- Authority
- FR
- France
- Prior art keywords
- bcl
- cells
- cddp
- nucleic acid
- igrov1
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K33/00—Medicinal preparations containing inorganic active ingredients
- A61K33/24—Heavy metals; Compounds thereof
- A61K33/243—Platinum; Compounds thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7048—Compounds having saccharide radicals and heterocyclic rings having oxygen as a ring hetero atom, e.g. leucoglucosan, hesperidin, erythromycin, nystatin, digitoxin or digoxin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/337—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having four-membered rings, e.g. taxol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/1703—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- A61K38/1709—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Public Health (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Epidemiology (AREA)
- Inorganic Chemistry (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- General Chemical & Material Sciences (AREA)
- Marine Sciences & Fisheries (AREA)
- Zoology (AREA)
- Gastroenterology & Hepatology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Immunology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
Description
<Desc/Clms Page number 1> <Desc / Clms Page number 1>
PRODUITS APTES A TRAITER LES CANCERS DE L'OVAIRE ET A EN
PREVENIR LES RECHUTES. PRODUCTS SUITABLE TO TREAT OVARIAN CANCERS AND
PREVENT RELAPSES.
La présente invention est relative à des produits aptes à traiter les cancers de l'ovaire et à en prévenir les rechutes. The present invention relates to products capable of treating ovarian cancer and preventing relapses.
Les cancers de l'ovaire représentent la première cause de mortalité par cancer gynécologique et se placent au quatrième rang des causes de décès par cancer chez la femme et leur incidence ne fait que progresser (de l'ordre de 4 % par an). La gravité de ces cancers est liée en particulier à leur découverte tardive et à leur capacité à développer une forte chimiorésistance au cours des cycles de chimiothérapie, ce qui fait que le taux de mortalité suite à ce cancer a peu évolué durant ces quinze dernières années. Ovarian cancer is the leading cause of death from gynecological cancer and ranks fourth among causes of cancer death in women, and their incidence is only increasing (around 4% per year). The severity of these cancers is linked in particular to their late discovery and their ability to develop strong chemoresistance during cycles of chemotherapy, which means that the death rate following this cancer has changed little over the past fifteen years.
En France, le taux d'incidence du cancer de l'ovaire est estimé à
11,1/100. 000 et s'accroît avec l'âge. In France, the incidence rate of ovarian cancer is estimated at
11.1 / 100. 000 and increases with age.
L'étiologie des cancers de l'ovaire est peu connue ; la majorité de ces cancers est due à une transformation maligne de l'épithélium ovarien (cancers épithéliaux). Ils présentent des propriétés particulières de croissance : ils peuvent se présenter à la fois sous forme de tumeurs solides envahissant l'ovaire, de sphéroïdes multicellulaires en suspension dans un liquide d'ascite dans la cavité péritonéale ou sous forme de nodules disséminés sur le péritoine. La dissémination se réalise également par voie lymphatique ou sanguine, provoquant l'apparition de métastases ganglionnaires, pulmonaires ou hépatiques. Little is known about the etiology of ovarian cancer; the majority of these cancers are due to a malignant transformation of the ovarian epithelium (epithelial cancers). They have particular growth properties: they can appear both in the form of solid tumors invading the ovary, of multicellular spheroids in suspension in an ascitic fluid in the peritoneal cavity or in the form of nodules disseminated on the peritoneum. The dissemination is also carried out by lymphatic or bloodstream, causing the appearance of lymph node, pulmonary or hepatic metastases.
Leur thérapie usuelle associe la chirurgie et une chimiothérapie basée essentiellement sur les sels de platine, tels que le cisplatine (cis-dichlorodiamino-platine (II) ou CDDP) ou le carboplatine (diaminecyclobutane-dicarboxyloplatine ou CBDCA), analogue du cisplatine, dont l'équivalence de dose a été établie (rapport CBDCA/CDDP de 4). Their usual therapy combines surgery and chemotherapy based mainly on platinum salts, such as cisplatin (cis-dichlorodiamino-platinum (II) or CDDP) or carboplatin (diaminecyclobutane-dicarboxyloplatin or CBDCA), an analogue of cisplatin, of which the Dose equivalence has been established (CBDCA / CDDP ratio of 4).
Les différentes polychimiothérapies utilisant l'un des dérivés du platine ont constitué un progrès majeur dans le traitement de ces tumeurs. Aussi bien le cisplatine que le carboplatine sont administrés à des doses allant, selon le produit et selon les cas, de 100 à 650 mg/m2 par mois, sous la forme de perfusions en 1 à 24 heures (Poulain et al., Int. J. Cancer, 1998,78, 454-463, M. Marone et al., Clin. The various multidrug therapies using one of the platinum derivatives have constituted a major advance in the treatment of these tumors. Both cisplatin and carboplatin are administered at doses ranging, depending on the product and depending on the case, from 100 to 650 mg / m2 per month, in the form of infusions over 1 to 24 hours (Poulain et al., Int. J. Cancer, 1998,78, 454-463, M. Marone et al., Clin.
Cancer Res., 1998,4, 517-524, J. R. Liu et al., Gynecol. Oncol., 1998,70, 398-403, Cancer Res., 1998,4, 517-524, J. R. Liu et al., Gynecol. Oncol., 1998,70, 398-403,
<Desc/Clms Page number 2><Desc / Clms Page number 2>
J. K. Taylor et al., Oncogene, 1999,18, 4495-4504, et J. K. Taylor et al., Nature Biotechnol., 1999,17, 1097-1100). J. K. Taylor et al., Oncogene, 1999,18, 4495-4504, and J. K. Taylor et al., Nature Biotechnol., 1999,17, 1097-1100).
Dans les polychimiothérapies, les principaux médicaments actuellement utilisés sont outre les dérivés du platine, les agents alkylants, tels que le méphalan, le chlorambucil, le cyclophosphamide ou le thiotepa, les anthracyclines, telles que
l'adriamycin ou les taxanes. Les associations de polychimiothérapie suivantes sont de préférence préconisées : CDDP 100 mg/m2-cyclophosphamide 600 mg/m paclitaxel-carboplatine, cisplatine-carboplatine ou cisplatine 100 mg/m-cyclophosphamide 300 mg/m2-carboplatine 300 mg/m. In multidrug therapy, the main drugs currently used are in addition to platinum derivatives, alkylating agents, such as mephalan, chlorambucil, cyclophosphamide or thiotepa, anthracyclines, such as
adriamycin or taxanes. The following polychemotherapy combinations are preferably recommended: CDDP 100 mg / m2-cyclophosphamide 600 mg / m paclitaxel-carboplatin, cisplatin-carboplatin or cisplatin 100 mg / m-cyclophosphamide 300 mg / m2-carboplatin 300 mg / m.
L'exérèse, aussi complète que possible, conditionne l'efficacité des traitements adjuvants. Elle est classiquement suivie de 4 à 6 cures de chimiothérapie, espacées de 28 jours, comprenant principalement, en association ou non, les produits précités et notamment des sels de platine, du cyclophosphamide et de l'adriamycine. The excision, as complete as possible, conditions the effectiveness of adjuvant treatments. It is conventionally followed by 4 to 6 courses of chemotherapy, spaced 28 days apart, comprising mainly, in combination or not, the aforementioned products and in particular platinum salts, cyclophosphamide and adriamycin.
La radiothérapie peut également intervenir, en particulier au niveau de zones massivement atteintes. Radiotherapy can also intervene, in particular at the level of heavily affected areas.
Les carcinomes ovariens sont généralement sensibles à la chimiothérapie de première ligne mais paradoxalement la survie des patientes reste courte, du fait de l'acquisition de la chimiorésistance au cours des traitements, dans la très grande majorité des cas. Ovarian carcinomas are generally sensitive to first-line chemotherapy, but paradoxically, patient survival remains short, due to the acquisition of chemoresistance during treatment, in the vast majority of cases.
Les mécanismes de résistance sont notamment décrit dans Poulain et al., 1998 (précité) ; ils concernent plus précisément : - l'altération de l'incorporation intracellulaire du CDDP, par diminution de l'incorporation intracellulaire de platine ou par élévation des taux intracellulaires de composés soufrés (glutathion, thiorédoxine), - les modifications des systèmes de réparation de l'ADN, - des altérations mitochondriales ou - des altérations dans l'expression de gènes impliqués dans le contrôle du cycle et/ou de la régulation de l'apoptose. The resistance mechanisms are described in particular in Poulain et al., 1998 (cited above); they concern more precisely: - the alteration of the intracellular incorporation of CDDP, by reduction of the intracellular incorporation of platinum or by elevation of the intracellular levels of sulfur compounds (glutathione, thioredoxin), - modifications of the repair systems of the 'DNA, - mitochondrial alterations or - alterations in the expression of genes involved in the control of the cycle and / or the regulation of apoptosis.
En particulier, le rôle des gènes homologues de la famille Bel-2 dans le cycle cellulaire et le contrôle de l'apoptose est mis en avant pour expliquer une partie des mécanismes de chimiorésistance : In particular, the role of homologous genes of the Bel-2 family in the cell cycle and the control of apoptosis is put forward to explain part of the mechanisms of chemoresistance:
<Desc/Clms Page number 3><Desc / Clms Page number 3>
. la surexpression de Bcl-2 est corrélée à la chimiorésistance de divers types de tumeurs, dont les cancers de l'ovaire. . overexpression of Bcl-2 is correlated with drug resistance in various types of tumors, including ovarian cancers.
. la protéine Bcl-x, présente deux isoformes issues d'un épissage alternatif : Bcl-xL, qui a une fonction anti-apoptotique, similaire à celle de Bcl-2 et
Bcl-xS (Brevet US 5,834, 309), qui a une fonction pro-apoptotique. . the Bcl-x protein, presents two isoforms resulting from an alternative splicing: Bcl-xL, which has an anti-apoptotic function, similar to that of Bcl-2 and
Bcl-xS (US Patent 5,834,309), which has a pro-apoptotic function.
. l'acquisition de la résistance au cisplatine, associée à la capacité des cellules traitées à progresser dans le cycle cellulaire au-delà de la phase G 1 : le défaut observé dans la régulation du cycle cellulaire pourrait intervenir au niveau de l'inhibiteur de cdk p21 CIPI/WAFI. En effet, le cisplatine exerce son effet cytotoxique en induisant une mort cellulaire par apoptose, résultant d'un dommage létal de l'ADN ; de plus, ce médicament interrompt la progression cellulaire et conduit ainsi à une accumulation des cellules dans des phases spécifiques du cycle, généralement avant l'apoptose. On observe un dysfonctionnement du métabolisme de la p53 nucléaire de l'inhibiteur de cdk p21 dans les cellules résistantes au cisplatine. . the acquisition of resistance to cisplatin, associated with the capacity of the treated cells to progress in the cell cycle beyond phase G 1: the defect observed in the regulation of the cell cycle could occur at the level of the cdk inhibitor p21 CIPI / WAFI. Indeed, cisplatin exerts its cytotoxic effect by inducing cell death by apoptosis, resulting from lethal DNA damage; moreover, this drug interrupts cell progression and thus leads to an accumulation of cells in specific phases of the cycle, usually before apoptosis. A dysfunction of the nuclear p53 metabolism of the cdk p21 inhibitor is observed in cisplatin-resistant cells.
Une diminution de la sensibilité à la chimiothérapie est liée à l'altération des taux de Bcl-2, Bax ou Bcl-x, qui interviennent dans le mécanisme de l'apoptose (M. Marone et al., Clin. Cancer Res., 1998,4, 517-524). A decrease in sensitivity to chemotherapy is linked to the alteration of the levels of Bcl-2, Bax or Bcl-x, which are involved in the mechanism of apoptosis (M. Marone et al., Clin. Cancer Res., 1998,4, 517-524).
Le gène Bcl-2 (pour B cells lymphomas) a été découvert grâce à son expression constitutive dans certains lymphomes folliculaires humains du fait d'une translocation t (14,18) (q32, q32) le plaçant à proximité du promoteur fort du gène des immunoglobulines. La protéine Bcl-2 protège la cellule contre l'apoptose induite par une large gamme de stimuli. Elle est exprimée dans la membrane externe mitochondriale, le réticulum endoplasmique, et l'enveloppe nucléaire. Les protéines de la famille Bcl-2 présentent une homologie de structure plus ou moins étendue, parfois même restreinte à deux domaines particuliers BH1 et BH2, impliqués dans la dimérisation de ces protéines, qui constitue un élément essentiel de la régulation de leur activité : ces protéines peuvent avoir des rôles opposés, puisque certaines interviennent dans l'induction de l'apoptose (Bax, Bcl-xS, Bad, Bak, Bik), alors que d'autres (Bcl-2, Bcl-xL, Mcll, Bfll, Al) sont impliquées dans sa répression. Leur homo-ou dimérisation permet un déplacement d'équilibre d'une situation de survie et de croissance cellulaire vers une induction de la mort cellulaire programmée (J. R. Liu et al., The Bcl-2 gene (for B cells lymphomas) was discovered thanks to its constitutive expression in certain human follicular lymphomas due to a translocation t (14,18) (q32, q32) placing it near the strong promoter of the gene immunoglobulins. The Bcl-2 protein protects the cell against apoptosis induced by a wide range of stimuli. It is expressed in the mitochondrial outer membrane, endoplasmic reticulum, and nuclear envelope. The proteins of the Bcl-2 family exhibit a more or less extensive structural homology, sometimes even restricted to two particular domains BH1 and BH2, involved in the dimerization of these proteins, which constitutes an essential element in the regulation of their activity: these proteins can have opposite roles, since some are involved in the induction of apoptosis (Bax, Bcl-xS, Bad, Bak, Bik), while others (Bcl-2, Bcl-xL, Mcll, Bfll, Al) are involved in its crackdown. Their homo-or dimerization allows an equilibrium shift from a situation of cell survival and growth towards induction of programmed cell death (J. R. Liu et al.,
<Desc/Clms Page number 4><Desc / Clms Page number 4>
Gynecol. Oncol., 1998,70, 398-403 ; J. K. Taylor et al., Nature Biotechnol., 1999,17,
1097-1100). Gynecol. Oncol., 1998, 70, 398-403; JK Taylor et al., Nature Biotechnol., 1999,17,
1097-1100).
La résistance à l'apoptose, qui joue un rôle important dans les tumeurs qui sont réfractaires à une chimiothérapie, est régulée par le rapport protéines anti-apoptotiques/protéines pro-apoptotiques. Resistance to apoptosis, which plays an important role in tumors that are refractory to chemotherapy, is regulated by the ratio of anti-apoptotic proteins to pro-apoptotic proteins.
J. K. Taylor et al., Nature Biotechnol., (précité), émettent l'hypothèse qu'en manipulant les taux de ces différentes protéines, les cellules peuvent devenir sensibles à l'apoptose, en réponse aux agents anti-tumoraux. Ils montrent en particu- lier qu'en modifiant le rapport Bcl-xL/Bcl-xS dans la cellule, en utilisant un oligo- nucléotide anti-sens, on peut obtenir une sensibilisation des cellules à l'apoptose. J. K. Taylor et al., Nature Biotechnol., (Cited above), hypothesize that by manipulating the levels of these different proteins, cells can become sensitive to apoptosis, in response to anti-tumor agents. They show in particular that by modifying the Bcl-xL / Bcl-xS ratio in the cell, by using an antisense oligonucleotide, it is possible to obtain sensitization of the cells to apoptosis.
Compte tenu du fait qu'une surexpression de Bcl-xL est associée à une diminution de l'apoptose dans les tumeurs, à une résistance aux agents anticancéreux et à une évolution clinique défavorable, ils émettent l'hypothèse qu'une intervention pharmacologique qui diminue les taux de Bcl-xL et augmente les taux de Bcl-xS pourrait constituer une chimiothérapie alternative intéressante. Considering that overexpression of Bcl-xL is associated with decreased apoptosis in tumors, resistance to anticancer agents, and unfavorable clinical course, they hypothesize that a pharmacological intervention that decreases Bcl-xL levels and increased Bcl-xS levels could be an interesting alternative chemotherapy.
Dans ce contexte, l'utilisation des membres de cette famille a été préconisée à des fins thérapeutiques. In this context, the use of members of this family has been advocated for therapeutic purposes.
Il a été proposé, pour augmenter l'expression de Bcl-xS, d'inhiber l'utilisation du site d'épissage 5'dans l'exon II de l'ARN bcl-xl, de manière à rediriger la machinerie d'épissage, à l'aide d'oligonucléotides antisens (J. K. Taylor et al., Nature Biotechnol., 1999, précité) : des cellules A549 (lignées de cellules carcinomes de poumons humains), transfectées par de la lipofectine (contrôle), l'oligonucléotide ISIS 22783 (Brevet US 6,172, 216) en présence de lipofectine ou un oligonucléotide contrôle en présence de lipofectine montrent que 1 Le traitement des cellules avec l'oligonucléotide ISIS 22783, qui cible l'exon 1 du transcrit Bcl-xL et est capable de modifier le rapport Bcl-xS/Bcl-xL de 17 % à 293 % sans réduire la quantité d'ARN Bcl-x totale dans les cellules A549, entraîne une augmentation d'un facteur 2 de l'apoptose, après traitement avec du cisplatine. It has been proposed, in order to increase the expression of Bcl-xS, to inhibit the use of the 5 'splice site in exon II of the bcl-xl RNA, so as to redirect the splicing machinery , using antisense oligonucleotides (JK Taylor et al., Nature Biotechnol., 1999, cited above): A549 cells (human lung carcinoma cell lines), transfected with lipofectin (control), the oligonucleotide ISIS 22783 (US Patent 6,172, 216) in the presence of lipofectin or a control oligonucleotide in the presence of lipofectin show that 1 Treatment of cells with the oligonucleotide ISIS 22783, which targets exon 1 of the Bcl-xL transcript and is capable of changing the Bcl-xS / Bcl-xL ratio from 17% to 293% without reducing the amount of total Bcl-x RNA in A549 cells, results in a 2-fold increase in apoptosis, after treatment with cisplatin .
Toutefois, ce document J. K. Taylor et al. ne permet pas de conclure : . à l'effet de Bcl-xS ; en effet, il est notamment précisé dans cet article que compte tenu d'autres essais, dans lesquels on obtenait la même stimulation de l'apoptose, uniquement par diminution de la Bcl-xL, il semblerait que la diminu- However, this document J. K. Taylor et al. does not allow to conclude:. to the effect of Bcl-xS; in fact, it is specified in this article in particular that, taking into account other tests, in which the same stimulation of apoptosis was obtained, only by reduction of Bcl-xL, it would seem that the decrease
<Desc/Clms Page number 5><Desc / Clms Page number 5>
tion du taux de Bcl-xL a un effet plus significatif sur l'induction de l'apoptose que l'augmentation de l'expression de Bcl-xS et . au rôle de Bcl-xS dans les tumeurs ovariennes ; en effet, aucune des cellules mises en oeuvre dans ce document ne provient de tumeurs ovariennes. tion of the level of Bcl-xL has a more significant effect on the induction of apoptosis than the increase in the expression of Bcl-xS and. the role of Bcl-xS in ovarian tumors; in fact, none of the cells used in this document originate from ovarian tumors.
D'autres traitements ont également été proposés : - J. S. Han et al., Springer Semin. Immunopathol., 1998,19, 279-288 préconisent d'utiliser un vecteur viral (adénovirus) exprimant le gène bel-xS, qui diffuse uniquement à des distances limitées dans les tumeurs solides et qui est un inhibiteur fonctionnel de Bcl-2 et de Bcl-xL. L'utilisation d'un tel vecteur est particulièrement recommandée, du fait de ses propriétés de faible diffusion, dans le traitement des cancers qui induisent une dissémination dans une cavité : vessie, cancer ovarien (cavité péritonéale). Other treatments have also been proposed: - J. S. Han et al., Springer Semin. Immunopathol., 1998,19, 279-288 recommend using a viral vector (adenovirus) expressing the bel-xS gene, which diffuses only at limited distances in solid tumors and which is a functional inhibitor of Bcl-2 and of Bcl-xL. The use of such a vector is particularly recommended, because of its low diffusion properties, in the treatment of cancers which induce dissemination in a cavity: bladder, ovarian cancer (peritoneal cavity).
- A. P. Simoes-Wust et al., Int. J. cancer, 2000,87, 582-590 décrivent un traitement anti-sens bcl-xl pour induire l'apoptose dans les cancers du sein (carcinomes). L'oligonucléotide utilisé est le 2'-O-méthoxy-éthoxy nucléotide 4259 qui cible les nucléotides 687-706 de l'ARNm bel-xL, une séquence qui ne se retrouve pas dans le transcrit pro-apoptotique bcl-xS. Un tel oligonucléotide présente plusieurs avantages : il est spécifique de bcl-xl, les modifications aux extrémités 5'et 3'par des résidus 2'-MOE lui permettant de présenter une affinité significativement augmentée pour sa cible et une stabilité dans le sérum. Le traitement de cellules MCF7 avec cet oligonucléotide 4259 à une concentration de 600 nM pendant 20 heures diminue les taux d'ARNm bel-xi et de protéine correspondante de 80 % et de 50 %, respectivement. - A. P. Simoes-Wust et al., Int. J. cancer, 2000,87, 582-590 describe an anti-sense bcl-xl treatment for inducing apoptosis in breast cancers (carcinomas). The oligonucleotide used is 2'-O-methoxy-ethoxy nucleotide 4259 which targets nucleotides 687-706 of bel-xL mRNA, a sequence which is not found in the pro-apoptotic bcl-xS transcript. Such an oligonucleotide has several advantages: it is specific for bcl-xl, the modifications at the 5 ′ and 3 ′ ends by 2′-MOE residues allowing it to exhibit a significantly increased affinity for its target and stability in the serum. Treatment of MCF7 cells with this 4259 oligonucleotide at a concentration of 600 nM for 20 hours decreases the levels of bel-xi mRNA and corresponding protein by 80% and 50%, respectively.
Ce type de traitement est préconisé exclusivement dans les cancers du sein, dans la mesure où l'expression de Bcl-2 et de Bcl-xL (membres anti-apoptotiques de la famille) est souvent augmentée dans les cancers primaires du sein. This type of treatment is recommended exclusively in breast cancers, since the expression of Bcl-2 and Bcl-xL (anti-apoptotic members of the family) is often increased in primary breast cancers.
En ce qui concerne le protocole mis en oeuvre, il est précisé que l'oligonucléotide est administré sous la forme d'un complexe avec la lipofectine. As regards the protocol implemented, it is specified that the oligonucleotide is administered in the form of a complex with lipofectin.
- P. J. Beale et al., Br. J. Cancer, 2000,82, 2, 436-440Dans cet article, les Auteurs ont cherché à déterminer si les taux des protéines de la famille Bcl- 2 sont corrélés avec la sensibilité ou la résistance au traitement avec les dérivés du platine, dans des tumeurs ovariennes (carcinomes). Ils considèrent en particulier que : - PJ Beale et al., Br. J. Cancer, 2000,82, 2, 436-440 In this article, the authors sought to determine whether the levels of proteins of the Bcl-2 family are correlated with sensitivity or resistance treatment with platinum derivatives in ovarian tumors (carcinomas). They consider in particular that:
<Desc/Clms Page number 6><Desc / Clms Page number 6>
(1) la surexpression de la protéine Bcl-2 dans les tumeurs ovariennes confère une sensibilité au cisplatine, plutôt qu'une résistance ; (2) on n'observe aucune corrélation significative lorsque l'on compare la sensibilité au cisplatine in vitro aux taux de Bax, Bcl-xL ou Bak ; (3) l'introduction de Bax, dans des lignées résistantes au cisplatine ou de Bcl-xL dans des lignées sensibles n'entraîne pas de modifications significatives de la chimiosensibilité. (1) overexpression of Bcl-2 protein in ovarian tumors confers sensitivity to cisplatin, rather than resistance; (2) no significant correlation is observed when comparing susceptibility to cisplatin in vitro with levels of Bax, Bcl-xL or Bak; (3) the introduction of Bax in lines resistant to cisplatin or of Bcl-xL in sensitive lines does not lead to significant changes in chemosensitivity.
D'autres traitements pour pallier le phénomène de chimiorésistance, préconisent de potentialiser la cytotoxicité du cisplatine et du carboplatine dans les cancers de l'ovaire, ce qui permet de récupérer une sensibilité au traitement : . par l'amphotéricine B (Poulain et al., Cancer Chemother. Pharma- col., 1997,40, 385-390) ; toutefois, l'association cisplatine-AmB est trop néphro- toxique pour une utilisation clinique, alors que l'association carboplatine-AmB ne présente pas une telle néphrotoxicité. D'autres modulateurs, tels que les méthylxanthines, sont préconisés, en association à l'AmB, pour atténuer la néphrotoxicité de l'association cisplatine-AmB ou . par le gène cipl-wafl (Lincet et al., Cancer Letters, 2000,161, 17- 26). Other treatments to overcome the phenomenon of chemoresistance recommend potentiating the cytotoxicity of cisplatin and carboplatin in ovarian cancers, which makes it possible to recover sensitivity to the treatment:. by amphotericin B (Poulain et al., Cancer Chemother. Pharmacol., 1997, 40, 385-390); however, the cisplatin-AmB combination is too nephrotoxic for clinical use, while the carboplatin-AmB combination does not exhibit such nephrotoxicity. Other modulators, such as methylxanthines, are recommended, in combination with AmB, to attenuate the nephrotoxicity of the cisplatin-AmB combination or. by the cipl-wafl gene (Lincet et al., Cancer Letters, 2000,161, 17-26).
Toutefois, les différents traitements préconisés dans l'art antérieur, pour les cancers de l'ovaire, ne permettent pas d'éviter la chimio-résistance observée ni d'éliminer les récidives ou rechutes à long terme. However, the various treatments recommended in the prior art for ovarian cancer do not make it possible to avoid the chemoresistance observed or to eliminate long-term recurrences or relapses.
En conséquence, la Demanderesse s'est donnée pour but de pourvoir à un traitement plus adapté et qui réponde mieux aux besoins de la pratique que les traitements proposés dans l'art antérieur, notamment en ce qu'il évite les récidives ou rechutes à long terme. Consequently, the Applicant has set itself the goal of providing a treatment that is more suitable and which meets the needs of practice better than the treatments proposed in the prior art, in particular in that it avoids recurrences or relapses in the long term. term.
La présente invention a pour objet des produits contenant (1) un vecteur d'acide nucléique non viral comprenant au moins une polyéthylène imine (PEI) de poids moléculaire inférieur à 25 kDa, (2) une séquence d'acide nucléique comprenant le gène bcl-xS ou un fragment fonctionnel de celui-ci et (3) au moins un agent anti-tumoral actif sur le cancer de l'ovaire, comme préparation combinée pour une utilisation séquentielle dans le traitement des cancers de l'ovaire, la séquence The present invention relates to products containing (1) a non-viral nucleic acid vector comprising at least one polyethylene imine (PEI) of molecular weight less than 25 kDa, (2) a nucleic acid sequence comprising the bcl gene -xS or a functional fragment thereof and (3) at least one anti-tumor agent active in ovarian cancer, as a combined preparation for sequential use in the treatment of ovarian cancer, the sequence
<Desc/Clms Page number 7><Desc / Clms Page number 7>
d'acide nucléique associée audit vecteur d'acide nucléique non viral étant administrée après le composé anti-tumoral. of nucleic acid associated with said non-viral nucleic acid vector being administered after the anti-tumor compound.
Une telle combinaison séquentielle permet, de manière inattendue, de résoudre à la fois le problème de la chimiorésistance et le problème des récidives ou rechutes à long terme. Such a sequential combination unexpectedly makes it possible to solve both the problem of drug resistance and the problem of long-term relapses or relapses.
Conformément à l'invention : - le vecteur non viral est de préférence sélectionné dans le groupe constitué par les PEI linéaires de poids moléculaire < 25 kDa, les PEI sur lesquelles sont greffés un sucre ou un peptide, tel que le peptide de liaison aux intégrines (RGD) ; lesdites PEI sont éventuellement associées à du polyéthylène glycol (PEG) ou de l'acide folique. In accordance with the invention: the non-viral vector is preferably selected from the group consisting of linear PEIs of molecular weight <25 kDa, PEIs onto which are grafted a sugar or a peptide, such as the integrin-binding peptide (RGD); said PEIs are optionally combined with polyethylene glycol (PEG) or folic acid.
Des PEI linéaires utilisables comme vecteur non viral sont notamment décrites dans O. Boussif et al., (PNAS, 1995,92, 7297-7301), L. Poulain et al., (Cancer Gene Ther., 2000,7, 4,644-652), le Brevet américain 6,013, 240 au nom de Rhone-Poulenc Rorer, J. S. Rémy et al., (Adv. Drug Delivery Rev., 1998,30, 85-95), S. Linear PEIs which can be used as a non-viral vector are described in particular in O. Boussif et al., (PNAS, 1995,92, 7297-7301), L. Poulain et al., (Cancer Gene Ther., 2000,7, 4,644- 652), US Patent 6,013, 240 in the name of Rhone-Poulenc Rorer, JS Rémy et al., (Adv. Drug Delivery Rev., 1998,30, 85-95), S.
Ferrari et al., (Gene Ther, 1997,4, 1100-1106), D. Goula et al., (Gene Ther., 1998,5,
1291-1295), F. Labat-Moleur et al., (Gene Ther., 1996,3, 1010-1017). Ferrari et al., (Gene Ther, 1997,4, 1100-1106), D. Goula et al., (Gene Ther., 1998,5,
1291-1295), F. Labat-Moleur et al., (Gene Ther., 1996,3, 1010-1017).
Des thio-dérivés de PEI d'environ 25 kDa, conjugués au peptide de liaison aux intégrines (PEI-RGD) sont décrits dans P. Erbacher et al., (Gene Ther.,
1999,6, 138-145) ; des PEI galactosylées sont décrites dans M. A. Zanta et al., (Bioconjugate Chem., 1997,8, 839-844) ; et le couplage de ligands membranaires aux PEI est décrit dans R. Kircheis et al., (Gene Ther., 1997,4, 409-418) - l'agent anti-tumoral actif sur le cancer de l'ovaire est de préférence sélectionné dans le groupe constitué par les dérivés du platine, les taxanes, les inhibiteurs des topoisomérases 1 et 2 et les associations de ces différents produits ; lesdits agents anti-tumoraux sont éventuellement associés à d'autres agents anti-cancéreux et/ou à de l'amphotéricine B ou des dérivés de la caféine. About 25 kDa PEI thio-derivatives conjugated to the integrin-binding peptide (PEI-RGD) are described in P. Erbacher et al., (Gene Ther.,
1999,6, 138-145); galactosylated PEIs are described in MA Zanta et al. (Bioconjugate Chem., 1997,8, 839-844); and the coupling of membrane ligands to PEIs is described in R. Kircheis et al., (Gene Ther., 1997,4, 409-418) - the anti-tumor agent active on ovarian cancer is preferably selected from the group consisting of platinum derivatives, taxanes, topoisomerase 1 and 2 inhibitors and combinations of these different products; said anti-tumor agents are optionally combined with other anti-cancer agents and / or with amphotericin B or caffeine derivatives.
Le plasmide Bc1-xS combiné avec l'agent antitumoral augmente de manière significative la mort des cellules cancéreuses de telle sorte que les rechutes ou récidives sont significativement diminuées. The Bc1-xS plasmid combined with the antitumor agent significantly increases the death of cancer cells so that relapses or recurrences are significantly reduced.
Lesdits produits sont avantageusement combinés dans le cadre d'une utilisation séquentielle dans le traitement des cancers de l'ovaire. Said products are advantageously combined in the context of sequential use in the treatment of ovarian cancer.
<Desc/Clms Page number 8> <Desc / Clms Page number 8>
En effet, l'ordre d'administration des produits est essentiel : la séquence nucléique vectorisée doit impérativement être administrée après le composé antitumoral. In fact, the order of administration of the products is essential: the vectorized nucleic acid sequence must imperatively be administered after the antitumor compound.
La combinaison d'une séquence d'acide nucléique vectorisée (Bcl- xS associée à une PEI, telle que définie ci-dessus) et d'au moins un agent anti- tumoral, administrés dans l'ordre indiqué, présente les avantages suivants : - potentialisation de l'activité de l'agent antitumoral, ce qui permet de diminuer les doses de l'agent antitumoral - élimination de l'effet de chimiorésistance à l'agent antitumoral et rétablissement d'un niveau de sensibilité des cellules à l'agent antitumoral, tout à fait satisfaisant et - élimination des récidives ou rechutes à long terme. The combination of a vectorized nucleic acid sequence (Bcl- xS associated with a PEI, as defined above) and at least one anti-tumor agent, administered in the order indicated, has the following advantages: - potentiation of the activity of the anti-tumor agent, which makes it possible to reduce the doses of the anti-tumor agent - elimination of the effect of chemoresistance to the anti-tumor agent and restoration of a level of sensitivity of the cells to the antitumor agent, quite satisfactory and - elimination of long-term relapses or relapses.
De manière plus précise, la combinaison séquentielle agent antitumoral et notamment cisplatine puis gène bcl-xS vectorisé par un vecteur non viral à base de PEI de poids moléculaire inférieur ou égal à 25 kDa, permet de détruire un nombre suffisant de cellules tumorales par apoptose, pour éviter les récidives, ce que l'on ne peut obtenir avec le gène Bcl-xS seul, ni avec l'agent antitumoral seul. More precisely, the sequential combination of antitumor agent and in particular cisplatin then bcl-xS gene vectorized by a non-viral vector based on PEI of molecular weight less than or equal to 25 kDa, makes it possible to destroy a sufficient number of tumor cells by apoptosis, to avoid recurrence, which cannot be achieved with the Bcl-xS gene alone, nor with the antitumor agent alone.
Les complexes PEI/ADN seront préférentiellement administrés par voie intra-péritonéale, bien que la voie intraveineuse reste possible. Les complexes sont préparés de préférence dans une solution de glucose 5 % en utilisant un rapport N/P de 5 comme détaillé dans Poulain et al., Cancer Gene Ther. ; 2000,7, 4,644-652. The PEI / DNA complexes will preferably be administered intraperitoneally, although the intravenous route remains possible. The complexes are preferably prepared in a 5% glucose solution using an N / P ratio of 5 as detailed in Poulain et al., Cancer Gene Ther. ; 2000.7, 4.644-652.
Trois injections à 12 heures d'intervalle sont préférentiellement envisagées. Three injections at 12 hour intervals are preferably considered.
Outre les dispositions qui précèdent, l'invention comprend encore d'autres dispositions, qui ressortiront de la description qui va suivre, qui se réfère à des exemples de mise en oeuvre du procédé objet de la présente invention ainsi qu'aux dessins annexés, dans lesquels : - la figure 1A illustre les modifications, induites par une exposition à 5 ptg/ml de CDDP, du cycle cellulaire des lignées cellulaires tumorales ovariennes sensibles IGROV1 et OAW42. In addition to the foregoing arrangements, the invention also comprises other arrangements, which will emerge from the description which follows, which refers to examples of implementation of the method which is the subject of the present invention as well as to the accompanying drawings, in which: FIG. 1A illustrates the modifications, induced by exposure to 5 μg / ml of CDDP, of the cell cycle of the sensitive ovarian tumor cell lines IGROV1 and OAW42.
- la figure 1B illustre le temps de récupération d'un état de prolifération normal des lignées cellulaires tumorales ovariennes sensibles IGROVI et OAW42, après une exposition à 5 ug/ml de CDDP. FIG. 1B illustrates the time for recovery from a normal state of proliferation of the sensitive ovarian tumor cell lines IGROVI and OAW42, after exposure to 5 μg / ml of CDDP.
<Desc/Clms Page number 9> <Desc / Clms Page number 9>
- la figure 2 est un histogramme présentant l'évolution de la réponse de la lignée cellulaire sensible IGROV1 dans le temps, après une exposition à 5 ig/ml de CDDP. FIG. 2 is a histogram showing the evolution of the response of the sensitive IGROV1 cell line over time, after exposure to 5 μg / ml of CDDP.
- la figure 3A illustre les modifications, induites par une exposition à 5 tg/ml de CDDP, du cycle cellulaire des lignées cellulaires résistantes IGROVI-RIO et SKOV3.
FIG. 3A illustrates the modifications, induced by exposure to 5 tg / ml of CDDP, of the cell cycle of the resistant cell lines IGROVI-RIO and SKOV3.
- la figure 3B illustre le temps de récupération d'un état de prolifération normal des lignées cellulaires IGROV1 et OAW42, IGROV1-R10 et SKOV3, après une exposition à 5 g/ml de CDDP. FIG. 3B illustrates the recovery time from a normal state of proliferation of the IGROV1 and OAW42, IGROV1-R10 and SKOV3 cell lines, after exposure to 5 g / ml of CDDP.
- la figure 4 illustre l'évolution de la réponse de la lignée cellulaire résistante SKOV3 dans le temps, après une exposition à 5 ug/ml de CDDP. FIG. 4 illustrates the evolution of the response of the resistant cell line SKOV3 over time, after exposure to 5 μg / ml of CDDP.
- la figure 5 illustre les modifications, induites par une exposition à 20 g/ml de CDDP, du cycle cellulaire des lignées cellulaires sensibles IGROV1 et OAW42 (A) et des lignées cellulaires résistantes IGROVI-R10 et SKOV3 (B). FIG. 5 illustrates the modifications, induced by exposure to 20 g / ml of CDDP, of the cell cycle of the sensitive cell lines IGROV1 and OAW42 (A) and of the resistant cell lines IGROVI-R10 and SKOV3 (B).
- la figure 6A illustre l'expression basale de bcl-xL et bcl-xS dans les lignées cellulaires IGROVI (OVI) et OAW42 (OA) et les lignées cellulaires IGROV1-R10 (OVR) et SKOV3 (SK). FIG. 6A illustrates the basal expression of bcl-xL and bcl-xS in the IGROVI (OVI) and OAW42 (OA) cell lines and the IGROV1-R10 (OVR) and SKOV3 (SK) cell lines.
- la figure 6B illustre la présence des protéines BCI-XL et Bcl-xs dans les lignées cellulaires IGROV1 (OVl) et OAW42 (OA) et les lignées cellulaires IGROV1-RlO (OVR) et SKOV3 (SK) évaluée par Western blot. FIG. 6B illustrates the presence of the BCI-XL and Bcl-xs proteins in the IGROV1 (OVl) and OAW42 (OA) cell lines and the IGROV1-R10 (OVR) and SKOV3 (SK) cell lines evaluated by Western blot.
- la figure 7A illustre l'expression de bcl-xL et bcl-xS dans le cytoplasme de cellules tumorales ovariennes mise en évidence par immunohistochimie. - Figure 7A illustrates the expression of bcl-xL and bcl-xS in the cytoplasm of ovarian tumor cells demonstrated by immunohistochemistry.
- la figure 7B illustre l'expression des protéines Bcl-xL et Bcl-xS dans des échantillons de tumeurs ovariennes, évaluées par Western blot. FIG. 7B illustrates the expression of the Bcl-xL and Bcl-xS proteins in samples of ovarian tumors, evaluated by Western blot.
- la figure 8A illustre les modifications de l'expression de bcl-x dans les lignées cellulaires IGROV1, OAW42 et IGROV1-R10 et SKOV3,6h après une
exposition à 5 et 20 ug/ml de CDDP. - Figure 8A illustrates the modifications of the expression of bcl-x in the cell lines IGROV1, OAW42 and IGROV1-R10 and SKOV3,6h after a
exposure to 5 and 20 µg / ml CDDP.
- la figure 8B illustre les modifications du taux des protéines Bcl-xL et Bcl-xS dans les lignées cellulaires IGROV1, OAW42 et IGROV1-R10 et SKOV3, 24h après une exposition à 5,20 et 100 fJ-g/mI de CDDP. FIG. 8B illustrates the modifications of the level of the Bcl-xL and Bcl-xS proteins in the IGROV1, OAW42 and IGROV1-R10 and SKOV3 cell lines, 24 hours after exposure to 5.20 and 100 fJ-g / mI of CDDP.
- les figures 9 et 10 illustrent l'efficacité d'un protocole combinatoire alliant chimiothérapie (avec différentes concentrations de CDDP) puis transfert - Figures 9 and 10 illustrate the effectiveness of a combinatorial protocol combining chemotherapy (with different concentrations of CDDP) then transfer
<Desc/Clms Page number 10><Desc / Clms Page number 10>
non viral de gène bcl-x pour surmonter la chimiorésistance des cancers de l'ovaire ; ces figures illustrent le nombre de cellules viables (ordonnées) après transfection des cellules SKOV3 avec un plasmide Bcl-xS, 24 h après exposition au CDDP 5/lg/ml.
non-viral bcl-x gene to overcome drug resistance in ovarian cancer; these figures illustrate the number of viable cells (ordered) after transfection of the SKOV3 cells with a Bcl-xS plasmid, 24 h after exposure to CDDP 5 µg / ml.
- la figure lIA illustre les résultats obtenus avec un protocole combinatoire dans lequel des cellules SKOV3 sont transfectées par bol-xi puis exposée à 5/lg/ml de CDDP, pendant 2 h. FIG. 11A illustrates the results obtained with a combinatorial protocol in which SKOV3 cells are transfected by bol-xi and then exposed to 5 μg / ml of CDDP, for 2 h.
- la figure lIB illustre l'efficacité d'un protocole combinatoire dans lequel des cellules SKOV3 sont exposées à 5/lg/ml de CDDP pendant 2 h, puis transfectées par bc1-xS. FIG. 11B illustrates the efficiency of a combinatorial protocol in which SKOV3 cells are exposed to 5 μg / ml of CDDP for 2 h, then transfected with bc1-xS.
- la figure 12 illustre les résultats obtenus avec un protocole dans lequel le transfert de gène précède de 24 h l'exposition au cisplatine (un effet protecteur peut être observé après exposition à 5/lg/ml de CDDP seul). Dans ce cas, la transfection de Bcl-xS n'augmente pas la cytotoxicité du CDDP et protège même les cellules vis-à-vis de cet agent. Ces résultats montrent bien l'importance de l'ordre d'administration des produits. FIG. 12 illustrates the results obtained with a protocol in which the gene transfer precedes exposure to cisplatin by 24 h (a protective effect can be observed after exposure to 5 μg / ml of CDDP alone). In this case, transfection of Bcl-xS does not increase the cytotoxicity of CDDP and even protects cells against this agent. These results clearly show the importance of the order of administration of the products.
Il doit être bien entendu, toutefois, que ces exemples sont donnés uniquement à titre d'illustration de l'objet de l'invention, dont ils ne constituent en aucune manière une limitation. It should be understood, however, that these examples are given only by way of illustration of the object of the invention, of which they in no way constitute a limitation.
Exemple 1 : Matériels et méthodes
Lignées cellulaires
Les lignées IGROVI (Bénard et al., Cancer Res., 1985,45, 4970-
4979), OAW42 (Wilson et al., J : A//. CcT., 1984, 72, 513-521) et SKOV3 (Fogh et al., A/. Cc-T., 1977, 59, 221-226) sont des lignées établies à partir d'adénocarcinome humain de l'ovaire. La lignée IGROV1-RIO, obtenue par traitements successifs de la lignée IGROV1 par des doses croissantes de cisplatine, présente une résistance au cisplatine 10 fois supérieure à celle de la lignée parentale (Poulain et al., Int. J. Cancer, 1998,78, 454-463), comme le démontrent les résultats du test XTT. Example 1: Materials and methods
Cell lines
The IGROVI lines (Bénard et al., Cancer Res., 1985,45, 4970-
4979), OAW42 (Wilson et al., J: A //. CcT., 1984, 72, 513-521) and SKOV3 (Fogh et al., A /. Cc-T., 1977, 59, 221-226 ) are lines established from human adenocarcinoma of the ovary. The IGROV1-RIO line, obtained by successive treatments of the IGROV1 line with increasing doses of cisplatin, exhibits a resistance to cisplatin 10 times greater than that of the parental line (Poulain et al., Int. J. Cancer, 1998,78 , 454-463), as demonstrated by the results of the XTT test.
Les lignées IGROV1 et SKOV3 sont cultivées dans du milieu RPMI 1640 (GIBCO-BRL) contenant 10% de sérum de veau foetal (GIBCO-BRL), 2 mM de L-glutamine (GIBCO-BRL), 33 mM de bicarbonate de sodium et 20 mM d'Hepes. La lignée OAW42 est cultivée dans du milieu DMEM (GIBCO-BRL) contenant 10 % de The IGROV1 and SKOV3 lines are cultured in RPMI 1640 medium (GIBCO-BRL) containing 10% fetal calf serum (GIBCO-BRL), 2 mM of L-glutamine (GIBCO-BRL), 33 mM of sodium bicarbonate and 20 mM of Hepes. The OAW42 line is cultured in DMEM medium (GIBCO-BRL) containing 10% of
<Desc/Clms Page number 11><Desc / Clms Page number 11>
sérum de veau fcetal, 2 mM de L-glutamine (GIBCO-BRL), 1 mM de pyruvate de sodium et 20 UVI d'insuline bovine (GIBCO-BRL). fetal calf serum, 2 mM L-glutamine (GIBCO-BRL), 1 mM sodium pyruvate and 20 UVI bovine insulin (GIBCO-BRL).
Les cellules sont cultivées à 37 C dans une atmosphère humide, en présence de 5 % de C02 et divisées deux fois par semaine par trypsination. The cells are cultured at 37 ° C. in a humid atmosphere, in the presence of 5% CO 2 and divided twice a week by trypsination.
Les cellules IGROV1, d'aspect polygonal (caractéristique des cellules épithéliales), poussent en monocouche et sont capables, une fois la confluence atteinte, de former des dômes libérés dans le milieu et de réadhérer sur un nouveau support. Ces cellules sont tumorigènes chez la souris nude. La courbe de croissance de la lignée IGROV1 présente une phase de latence suivie d'une phase exponentielle avant d'atteindre un plateau après 6 jours de culture. En début de phase exponentielle la population de cellules en suspension représente 1/5 de la population totale alors qu'à la fin de cette phase elle représente 1/10 de la population totale. Le temps de doublement des cellules est de 27h. IGROV1 cells, polygonal in appearance (characteristic of epithelial cells), grow in a monolayer and are capable, once confluence has been reached, of forming domes released into the medium and of re-adhering to a new support. These cells are tumorigenic in nude mice. The growth curve of the IGROV1 line exhibits a lag phase followed by an exponential phase before reaching a plateau after 6 days of culture. At the start of the exponential phase, the population of cells in suspension represents 1/5 of the total population while at the end of this phase it represents 1/10 of the total population. The cell doubling time is 27 hours.
Les cellules OAW42 (Wilson et al., 1984, précité) présentent un aspect similaire à celui des cellules IGROV1, bien que de plus grande taille, mais ne présentent pas les mêmes caractéristiques de croissance. En effet, leur temps de doublement est de l'ordre de 40h, et la confluence provoque un arrêt de croissance et une dégénérescence progressive de la culture en absence de repiquage. OAW42 cells (Wilson et al., 1984, supra) exhibit a similar appearance to IGROV1 cells, although larger in size, but do not exhibit the same growth characteristics. In fact, their doubling time is of the order of 40 h, and the confluence causes growth arrest and progressive degeneration of the culture in the absence of subculturing.
La lignée SKOV3 est issue d'un adénocarcinome ovarien humain (Fogh et al., 1977, précité). Ces cellules, qui ne poussent qu'en monocouche et supportent difficilement la confluence, présentent un aspect fibroblastique. Leur courbe de croissance montre qu'elles ont un temps de doublement de 26 h. The SKOV3 line is derived from a human ovarian adenocarcinoma (Fogh et al., 1977, cited above). These cells, which only grow in a monolayer and have difficulty tolerating confluence, have a fibroblastic appearance. Their growth curve shows that they have a doubling time of 26 h.
Traitement avec le cisplatine
Le cisplatine [cis-diamino-dichloro-platine II (CDDP)] fourni par Roger-Bellon (CisplatyF) est dilué à 1 mg/ml dans de l'eau distillée stérile et conservé à-20 C. Les cellules en phase exponentielle de croissance sont traitées pendant 2 heures à 37 C avec différentes concentrations de CDDP dans du milieu sans sérum. Après traitement, les cellules sont rincées et incubées dans du milieu de culture. Treatment with cisplatin
The cisplatin [cis-diamino-dichloro-platinum II (CDDP)] supplied by Roger-Bellon (CisplatyF) is diluted to 1 mg / ml in sterile distilled water and stored at -20 C. The cells in the exponential phase of growth are treated for 2 hours at 37 C with different concentrations of CDDP in serum-free medium. After treatment, the cells are rinsed and incubated in culture medium.
Test au XTT
Les cellules sont ensemencées sur une plaque à 96 puits (104 cellules/puits) puis 2 jours plus tard, pendant la phase exponentielle de croissance, les XTT test
The cells are seeded on a 96-well plate (104 cells / well) then 2 days later, during the exponential growth phase, the cells are
<Desc/Clms Page number 12><Desc / Clms Page number 12>
cellules sont traitées avec des doses croissantes de CDDP. La cytotoxicité du cisplatine est mesurée par le test de coloration au XTT-PMS, qui mesure la viabilité cellulaire, 6 jours après l'exposition au CDDP, en utilisant le protocole décrit par Scudiero et al., Cancer Res., 1988,48, 4827-4833. cells are treated with increasing doses of CDDP. The cytotoxicity of cisplatin is measured by the XTT-PMS staining test, which measures cell viability, 6 days after exposure to CDDP, using the protocol described by Scudiero et al., Cancer Res., 1988,48, 4827-4833.
RT-PCR
1 ig d'ARN total, extrait à l'aide du kit RNAeasy (QIAGEN) sont rétro-transcrits en ADNc, en présence de 200 UI de transcriptase inverse (Superscript II, GIBCO-BRL), en suivant les instructions du fabricant. L'ADNc obtenu est amplifié à l'aide des amorces 5'-CGCAGAAGGGGTCCTGGTGA-3'et 5'CAGCTCCTTCTTCTGCTCCGGGGT-3', comme décrit dans Maronne et al. précité. RT-PCR
1 μg of total RNA, extracted using the RNAeasy kit (QIAGEN) are reverse transcribed into cDNA, in the presence of 200 IU of reverse transcriptase (Superscript II, GIBCO-BRL), following the manufacturer's instructions. The cDNA obtained is amplified using the primers 5'-CGCAGAAGGGGTCCTGGTGA-3 'and 5'CAGCTCCTTCTTCTGCTCCGGGGT-3', as described in Maronne et al. above.
La réaction de PCR est réalisée en présence de 2 mM MgCl2, 250 mM dNTP, 10 pmoles de chacune des amorces et 5 UI de Taq polymérase (EUROBIO) dans les conditions suivantes : dénaturation à 94 C pendant 40 sec, hybridation à 58 C pendant 60 sec et extension à 72 C pendant 40 sec (30 cycles), à l'aide d'un thermocycleur AmplitronR (BIOBLOCK). Après électrophorèse des produits obtenus en gel d'agarose à 2 %, deux fragments distincts, correspondant respectivement à Bcl-xS et Bcl-xL sont observés. Le fragment correspondant à la forme longue est beaucoup plus abondant que celui correspondant à la forme courte. The PCR reaction is carried out in the presence of 2 mM MgCl2, 250 mM dNTP, 10 pmoles of each of the primers and 5 IU of Taq polymerase (EUROBIO) under the following conditions: denaturation at 94 C for 40 sec, hybridization at 58 C for 60 sec and extension at 72 C for 40 sec (30 cycles), using an AmplitronR thermal cycler (BIOBLOCK). After electrophoresis of the products obtained in a 2% agarose gel, two distinct fragments, corresponding respectively to Bcl-xS and Bcl-xL, are observed. The fragment corresponding to the long form is much more abundant than that corresponding to the short form.
Immunoblotting
Après 6 heures de traitement avec le CDDP, les cellules ou les broyats de tumeurs congelées sont lysés pendant 30 min sur de la glace, dans un tampon contenant 150 mM NaCI, 50 mM Tris-HCl, pH 8,0, 1 % Triton X-100,4 mM PMSF, 2 mM aprotinine et 5 mM EDTA. Les lysats sont clarifiés par centrifugation à
10000 g pendant 15 min à 4 C et la concentration en protéine est mesurée par le test de Bradford (BIO-RAD). Une fraction d'extrait cellulaire (100 ig de protéines) est séparée par électrophorèse en gel de 10% polyacrylamide-SDS, transférée sur une membrane de nitrocellulose par électrotransfert, 30 minutes à 500 mA dans du Trisglycine-méthanol (Hybond, AMERSHAM). La membrane est incubée toute la nuit à 4 C dans un tampon T-TBS (132 mM NaCI, 20 mM Tris-cl pH 7,6 et 0,1 % Tween 20) contenant 5 % de poudre de lait écrémé. La membrane est incubée, l h à température ambiante, avec l'anticorps primaire (anti-Bcl-x, L/S 651186 E, PHARMINGEN) dilué au 1/1000 dans le tampon T-TBS contenant 5 % de poudre de Immunoblotting
After 6 hours of treatment with CDDP, the frozen tumor cells or grinds are lysed for 30 min on ice, in a buffer containing 150 mM NaCl, 50 mM Tris-HCl, pH 8.0, 1% Triton X -100.4 mM PMSF, 2 mM aprotinin and 5 mM EDTA. The lysates are clarified by centrifugation at
10,000 g for 15 min at 4 ° C. and the protein concentration is measured by the Bradford test (BIO-RAD). A fraction of cell extract (100 μg of proteins) is separated by 10% polyacrylamide-SDS gel electrophoresis, transferred to a nitrocellulose membrane by electrotransfer, for 30 minutes at 500 mA in Trisglycine-methanol (Hybond, AMERSHAM). The membrane is incubated overnight at 4 ° C. in T-TBS buffer (132 mM NaCl, 20 mM Tris-cl pH 7.6 and 0.1% Tween 20) containing 5% skimmed milk powder. The membrane is incubated for 1 hour at room temperature with the primary antibody (anti-Bcl-x, L / S 651186 E, PHARMINGEN) diluted to 1/1000 in T-TBS buffer containing 5% of powder of
<Desc/Clms Page number 13><Desc / Clms Page number 13>
lait écrémé. Après 3 lavages avec le tampon T-TBS, la membrane est incubée, 1 h à température ambiante, avec l'anticorps secondaire conjugué à la peroxydase (anticorps
NA 934, AMERSHAM) dilué au 1/5000 dans le même tampon que l'anticorps primaire. Après, 4 lavages avec le tampon T-TBS et un lavage à l'eau, l'immuno- réaction est révélée par chimioluminescence (kit ECL, AMERSHAM). Des marqueurs colorés de faible poids moléculaire (BIORAD) servent de référence. skimmed milk. After 3 washes with T-TBS buffer, the membrane is incubated for 1 h at room temperature with the secondary antibody conjugated to peroxidase (antibody
NA 934, AMERSHAM) diluted 1/5000 in the same buffer as the primary antibody. After 4 washes with T-TBS buffer and washing with water, the immunoreaction is revealed by chemiluminescence (ECL kit, AMERSHAM). Colored low molecular weight markers (BIORAD) are used as a reference.
Immunohistochimie
Une fois les coupes de 4 am réalisées dans les blocs de paraffine, elles sont étalées sur lames polysilanisées de façon à favoriser l'adhérence du tissu sur la lame lors des différentes étapes qui suivent. Les lames peuvent être stockées entre deux papiers cartonnés à l'abri de l'air et de la lumière jusqu'à utilisation. Les lames sont ensuite déparaffinées par passages successifs de 5 minutes dans 3 bains de toluène, puis dans des bains d'alcool à 100 (x2), 95 , 70 et 50 . Immunohistochemistry
Once the 4 μm sections have been made in the paraffin blocks, they are spread on polysilanized slides so as to promote the adhesion of the tissue to the slide during the various steps which follow. Slides can be stored between two card stock in order to protect from air and light until use. The slides are then dewaxed by successive passages of 5 minutes in 3 toluene baths, then in alcohol baths at 100 (x2), 95, 70 and 50.
Elles sont ensuite incubées dans un bain de TBS-H202 1 % durant
10 min, avant de subir 3 passages de 4'15"au micro-onde 750W dans du tampon citrate 10mMpH6. They are then incubated in a 1% TBS-H202 bath for
10 min, before undergoing 3 passages of 4'15 "in the microwave 750W in 10mMpH6 citrate buffer.
Après blocage de l'activité peroxydase endogène par incubation dans une solution de peroxyde d'hydrogène à 1 % dans du PBS, les coupes sont transférées dans du tampon PBS. Après une pré-incubation de 20 min dans du tampon TBS contenant 20 % de sérum de chèvre, les lames sont incubées, 1 h à température ambiante, avec l'anticorps primaire anti-Bcl-x (anticorps S18, SANTA-CRUZ) dilué au 1/500 dans du tampon PBS contenant 0,5 % de sérum albumine bovine (BSA). After blocking the endogenous peroxidase activity by incubation in a solution of 1% hydrogen peroxide in PBS, the sections are transferred into PBS buffer. After a 20 min pre-incubation in TBS buffer containing 20% goat serum, the slides are incubated for 1 h at room temperature with the primary anti-Bcl-x antibody (S18 antibody, SANTA-CRUZ) diluted. at 1/500 in PBS buffer containing 0.5% bovine serum albumin (BSA).
Après des lavages extensifs, les complexes immuns sont amplifiés à l'aide du kit HRP duet (DAKO), en suivant les instructions du fabricant. Enfin, l'activité immunoperoxydase est révélée par incubation, 5 min à température ambiante, dans une solution de DAB (10 mg/ml, SIGMA) dans un tampon 50 mM Tris-HCI, pH 7,6, 0,03 % H202. Les lames sont rapidement contre-colorées à l'hématoxyline. After extensive washings, the immune complexes are amplified using the duet HRP kit (DAKO), following the manufacturer's instructions. Finally, the immunoperoxidase activity is revealed by incubation, 5 min at room temperature, in a solution of DAB (10 mg / ml, SIGMA) in a 50 mM Tris-HCl buffer, pH 7.6, 0.03% H2O2. The slides are rapidly counterstained with hematoxylin.
Protocole de transfection du plasmide
La transfection est effectuée comme décrit dans Poulain et al., Cancer Gene Ther., 2000, 7, 4, 644-652. Plasmid transfection protocol
The transfection is carried out as described in Poulain et al., Cancer Gene Ther., 2000, 7, 4, 644-652.
<Desc/Clms Page number 14> <Desc / Clms Page number 14>
Exemple 2 : Efficacité de la chimiothérapie sur des lignées cellulaires tumorales ovariennes (IGROV1, OAW42). Example 2: Efficacy of chemotherapy on ovarian tumor cell lines (IGROV1, OAW42).
Les cellules tumorales ovariennes IGROVI et OAW42 décrites à l'exemple 1 sont exposées 2 h à différentes concentrations de CDDP. Les modifications de leur cycle cellulaire et le temps de récupération d'un état de prolifération normal sont observés. The ovarian tumor cells IGROVI and OAW42 described in Example 1 are exposed for 2 h to different concentrations of CDDP. Changes in their cell cycle and the time to recover from a normal proliferative state are observed.
On constate l'élongation de la phase S et l'accumulation des cellules dans les phases G2-M (figure 1A). Les principales différences concernent l'induction de l'apoptose et la survie à long terme des cellules traitées. Alors que les cellules
hautement sensibles (OAW42) sont accumulées en phase S et entrent massivement en apoptose dès 48 h après l'exposition à 5 j-t-g/ml de CDDP, les cellules moins sensibles (IGROV1) n'entrent pas en apoptose avant 72 h à 96 h après l'exposition à 5 u. g/ml de CDDP. Cependant, dans les deux cas, la quasi-totalité des cellules meurt après 4 jours ; un très faible nombre de cellules sont alors maintenues dans un état quiescent pour plusieurs semaines, avant de récupérer un modèle de croissance normal et la régénération d'une population apte à proliférer. The elongation of the S phase and the accumulation of the cells in the G2-M phases are observed (FIG. 1A). The main differences concern the induction of apoptosis and the long-term survival of the treated cells. While the cells
highly sensitive cells (OAW42) are accumulated in S phase and massively enter apoptosis as early as 48 h after exposure to 5 μg / ml of CDDP, less sensitive cells (IGROV1) do not enter apoptosis before 72 h to 96 h after exposure to 5 u. g / ml CDDP. However, in both cases, almost all of the cells die after 4 days; a very low number of cells are then maintained in a quiescent state for several weeks, before recovering a normal growth pattern and regeneration of a population capable of proliferating.
Le délai avant de récupérer un état de prolifération est de 2 à 4 semaines pour les cellules IGROV1 et est de 8 semaines pour les cellules OAW42 (figure 1B). Après 4 semaines, l'effet de l'exposition à 5) g/ml de CDDP n'est plus
visible sur les histogrammes des cellules IGROV1 (figure 2). The time to recover from a proliferative state is 2-4 weeks for IGROV1 cells and 8 weeks for OAW42 cells (Figure 1B). After 4 weeks, the effect of exposure to 5) g / ml CDDP is no longer
visible on the histograms of IGROV1 cells (Figure 2).
Quand les cellules sensibles sont exposées à 20 p. g/ml de CDDP, un fort blocage en phase GO-G 1 est observé et les cellules entrent massivement en apop- tose après 24 h à 48 h (figure 5A). When sensitive cells are exposed to 20 p. g / ml of CDDP, a strong blocking in the GO-G 1 phase is observed and the cells enter massively into apoptosis after 24 h to 48 h (FIG. 5A).
Dans cette situation, aucune récidive n'intervient, la population tumorale ovarienne est totalement éliminée. In this situation, no recurrence occurs, the ovarian tumor population is completely eliminated.
Exemple 3 : Chimiorésistance de lignées cellulaires tumorales ovariennes (SKOV3, IGROV1-R10)
Les cellules tumorales ovariennes SKOV3 et IGROV1-R10 décrites à l'exemple sont exposées 2 h à différentes concentrations de CDDP. Les modifications de leur cycle cellulaire et le temps de récupération d'un état de prolifération normal sont observés. Example 3: Chemoresistance of ovarian tumor cell lines (SKOV3, IGROV1-R10)
The ovarian tumor cells SKOV3 and IGROV1-R10 described in the example are exposed for 2 hours to different concentrations of CDDP. The changes in their cell cycle and the time to recover from a normal proliferative state are observed.
<Desc/Clms Page number 15> <Desc / Clms Page number 15>
On constate un ralentissement de la progression du cycle cellulaire, l'accumulation des cellules en phase G2-M et l'induction de l'apoptose (figure 3A). There is a slowdown in the progression of the cell cycle, the accumulation of cells in G2-M phase and the induction of apoptosis (Figure 3A).
Chaque événement semble intervenir d'une façon très accélérée en comparaison des cellules sensibles. Ainsi, malgré une mort cellulaire massive, le délai avant la réapparition de cellules aptes à proliférer est quasi éliminé, et la réapparition intervient entre environ 5 et 7 jours pour les cellules SKOV3, et entre 8 et 12 jours pour les cellules IGROV1-RIO (figure 3B). Each event seems to occur in a very accelerated way compared to sensitive cells. Thus, despite massive cell death, the time before the reappearance of cells capable of proliferating is almost eliminated, and reappearance occurs between approximately 5 and 7 days for SKOV3 cells, and between 8 and 12 days for IGROV1-RIO cells ( figure 3B).
Après ce temps, les histogrammes ne présentent plus de trace d'exposition à S llg/ml de CDDP (figure 4). After this time, the histograms no longer show any trace of exposure to S llg / ml CDDP (FIG. 4).
Quand les cellules tumorales ovariennes résistantes sont exposées à 20/lglml de CDDP, elles sont capables de progresser dans le cycle cellulaire (figure 5B). Les cellules IGROV1-R10 s'accumulent en phase G2-M, ce qui n'est pas le cas des cellules SKOV3. When resistant ovarian tumor cells are exposed to 20 µg / ml CDDP, they are able to progress through the cell cycle (Figure 5B). IGROV1-R10 cells accumulate in the G2-M phase, which is not the case with SKOV3 cells.
La plupart des cellules subissent alors une apoptose après 48 h, mais une faible population d'entre elles restent capables de ré-engager un nouveau cycle cellulaire et de re-coloniser un flacon de culture en environ 4 à 5 semaines. Most cells then undergo apoptosis after 48 h, but a small population of them are still able to re-initiate a new cell cycle and re-colonize a culture flask in about 4 to 5 weeks.
Exemple 4 : Expression basale de bcl-x dans les lignées tumorales ovariennes. Example 4: Basal expression of bcl-x in ovarian tumor lines.
Par RT-PCR, l'ARNm de bcl-x a été mis en évidence dans toutes les lignées cellulaires étudiées, mais seulement sous sa forme longue (forme L) (figure 6A). Une analyse par Western blot démontre en effet que 2 à 3 bandes d'environ 30 kDa, correspondant à la protéine Bcl-xL, sont présentes dans toutes les lignées cellulaires étudiées, alors que la protéine Bcl-xS reste indétectable (figure 6B). By RT-PCR, the mRNA of bcl-x was demonstrated in all the cell lines studied, but only in its long form (L form) (FIG. 6A). Western blot analysis in fact demonstrates that 2 to 3 bands of approximately 30 kDa, corresponding to the Bcl-xL protein, are present in all the cell lines studied, while the Bcl-xS protein remains undetectable (FIG. 6B).
Le niveau de la protéine Bcl-xL est assez similaire dans les lignées cellulaires IGROV1, IGROV1-R10 et SKOV3, mais est visiblement inférieur dans la lignée cellulaire OAW42. The level of the Bcl-xL protein is quite similar in the IGROV1, IGROV1-R10 and SKOV3 cell lines, but is noticeably lower in the OAW42 cell line.
L'expression de Bcl-x a été également évaluée par histochimie sur un panel de 60 spécimens de tumeurs ovariennes. 90% d'entre elles expriment Bcl-x dans le cytoplasme des cellules tumorales (figure 7A). Le Western blot réalisé sur ces échantillons n'a mis en évidence que la forme longue de la protéine, Bcl-xL (figure 7B). The expression of Bcl-x was also evaluated by histochemistry on a panel of 60 specimens of ovarian tumors. 90% of them express Bcl-x in the cytoplasm of tumor cells (FIG. 7A). The Western blot carried out on these samples only revealed the long form of the protein, Bcl-xL (FIG. 7B).
<Desc/Clms Page number 16> <Desc / Clms Page number 16>
Exemple 5 : Modifications de l'expression de bcl-x après une exposition au cispla- tine des différentes lignées cellulaires tumorales ovariennes sensibles et résis- tantes. Example 5: Changes in the expression of bcl-x after exposure to cisplatin of the different sensitive and resistant ovarian tumor cell lines.
Les cellules sont exposées 2 h à différentes concentrations de CDDP puis les modifications d'expression de l'ARNm de bcl-x sont étudiées. The cells are exposed for 2 h to different concentrations of CDDP then the modifications of expression of the mRNA of bcl-x are studied.
En réponse à une exposition à 20 g/ml de CDDP, le niveau d'ARNm est diminué dès 6 h après exposition au CDDP dans les lignées cellulaires
OAW42 et IGROV1, alors qu'il est maintenu à un niveau élevé dans les lignées cellulaires SKOV3 et IGROV1-R10 (figure 8A). In response to exposure to 20 g / ml of CDDP, the level of mRNA is decreased as early as 6 h after exposure to CDDP in cell lines
OAW42 and IGROV1, while it is maintained at a high level in the SKOV3 and IGROV1-R10 cell lines (Figure 8A).
Les mêmes résultats ont été observés au niveau de la protéine 24 h après l'exposition (figure 8B). The same results were observed at the protein level 24 h after exposure (FIG. 8B).
En réponse à une exposition à 5 ptg/ml de CDDP, le niveau de l'ARNm de bcl-x et le niveau de protéine restent stables dans les lignées cellulaires
IGROV1, IGROVI-RIO et SKOV3,6 h et 24 h, respectivement, après l'exposition. In response to exposure to 5 µg / ml CDDP, the level of bcl-x mRNA and the level of protein remain stable in cell lines.
IGROV1, IGROVI-RIO and SKOV 3.6 h and 24 h, respectively, after exposure.
Dans le cas de la lignée cellulaire OAW42, le niveau d'ARNm reste stable 6 h après exposition mais le niveau de protéine est largement réduit 24 h après exposition. In the case of the cell line OAW42, the level of mRNA remains stable 6 h after exposure but the level of protein is greatly reduced 24 h after exposure.
Exemple 6 : Niveau d'expression de Bcl-x et sensibilité au CDDP. Example 6: Level of expression of Bcl-x and sensitivity to CDDP.
Le niveau d'expression de la protéine Bcl-x est similaire dans les cellules IGROV1, IGROVI-RIO et SKOV3, mais sensiblement inférieur dans les cellules OAW42, ces dernières étant également les plus sensibles au CDDP (cf exemple 1, figure 5A). The level of expression of the Bcl-x protein is similar in the IGROV1, IGROVI-RIO and SKOV3 cells, but appreciably lower in the OAW42 cells, the latter also being the most sensitive to CDDP (cf. example 1, FIG. 5A).
Aussi, ont été étudiées les modifications d'expression de Bcl-x, en réponse au CDDP dans les différentes lignées cellulaire tumorales ovariennes. Also, were studied the modifications of expression of Bcl-x, in response to CDDP in the different ovarian tumor cell lines.
Le CDDP est capable d'induire une répression de l'expression de Bcl-x dans les lignées cellulaires sensibles (IGROV1, OAW42) mais pas dans les lignées cellulaires résistantes (IGROVI-RIO, SKOV3). Néanmoins cette répression peut être observée seulement dans des conditions où une apoptose massive et précoce est observée : IGROV1 exposées à 20 J. g/ml de CDDP et OAW42 exposée à 5 ou 20 jn. g/ml de CDDP et dans lesquelles aucune récidive n'est observable. CDDP is capable of inducing repression of the expression of Bcl-x in sensitive cell lines (IGROV1, OAW42) but not in resistant cell lines (IGROVI-RIO, SKOV3). However, this repression can be observed only under conditions where massive and early apoptosis is observed: IGROV1 exposed to 20 μg / ml of CDDP and OAW42 exposed to 5 or 20 μm. g / ml of CDDP and in which no recurrence is observable.
La corrélation entre les variations de l'ARN de bcl-x et le niveau de protéine après une exposition au CDDP suggère que le niveau de protéine est principalement contrôlé au niveau de l'ARN. The correlation between changes in bcl-x RNA and the protein level after exposure to CDDP suggests that the protein level is primarily controlled at the RNA level.
<Desc/Clms Page number 17> <Desc / Clms Page number 17>
Exemple 7 : Efficacité in vitro de la combinaison d'un agent antitumoral (CDDP) et du transfert non viral d'un gène impliqué dans l'induction de l'apoptose (belx) pour surmonter la chimiorésistance des cancers de l'ovaire. Example 7 Efficacy in vitro of the combination of an anti-tumor agent (CDDP) and the non-viral transfer of a gene involved in the induction of apoptosis (belx) to overcome chemoresistance in ovarian cancers.
A. Exposition à l'agent antitumoral après transfection (figure
11A). A. Exposure to the antitumor agent after transfection (figure
11A).
Dans ce sens, le protocole combinatoire n'est pas efficace. In this sense, the combinatorial protocol is not efficient.
B. Transfection après exposition à l'agent antitumoral. B. Transfection after exposure to the anti-tumor agent.
Des cellules tumorales ovariennes SKOV3 (figures 9,10 et 11B), résistantes au CDDP, sont exposées 2 heures à différentes concentrations de CDDP. SKOV3 ovarian tumor cells (FIGS. 9,10 and 11B), resistant to CDDP, are exposed for 2 hours to different concentrations of CDDP.
Environ 24 h après cette exposition, les cellules sont transfectées par le vecteur non viral PEI (22kDa) porteur du gène bcl-xS. La viabilité des cellules exposées à ce protocole combinatoire est alors observée au cours du temps par comparaison avec des cellules n'ayant subi aucun traitement, des cellules exposées au CDDP ou des cellules transfectées. Les résultats sont présentés dans les figures 9 et 10 ci-dessous. About 24 hours after this exposure, the cells are transfected with the non-viral PEI vector (22kDa) carrying the bcl-xS gene. The viability of the cells exposed to this combinatorial protocol is then observed over time by comparison with cells which have not undergone any treatment, cells exposed to CDDP or transfected cells. The results are shown in Figures 9 and 10 below.
Les cellules exposées à 5 p-g/ml de CDDP ou transfectées ont une viabilité réduite par rapport au témoin 72 h après le début du traitement mais récupèrent progressivement un état de prolifération normal entre 72 h et 168 h. The cells exposed to 5 μg / ml of CDDP or transfected have a reduced viability compared to the control 72 h after the start of the treatment but gradually recover a normal state of proliferation between 72 h and 168 h.
Les cellules subissant le protocole combinatoire présentent une viabilité largement réduite 72 h après l'exposition à 5 fg/ml de CDDP par rapport aux autres cellules exposées au CDDP seul ou seulement transfectées ; cette viabilité réduite persiste jusqu'à 168 h. Cells undergoing the combinatorial protocol exhibit greatly reduced viability 72 h after exposure to 5 µg / ml CDDP compared to other cells exposed to CDDP alone or only transfected; this reduced viability persists for up to 168 h.
Les cellules exposées à 20 tg/ml de CDDP ou transfectées par bcl-x après une exposition à 20 ug/ml de CDDP ont une viabilité largement réduite 72 h après le traitement et cet effet persiste jusqu'à 168 h après le traitement. Cells exposed to 20 µg / ml CDDP or transfected with bcl-x after exposure to 20 µg / ml CDDP have greatly reduced viability 72 h after treatment and this effect persists for up to 168 h after treatment.
Cependant, le protocole combinatoire permet d'anéantir totalement la population et, contrairement à la seule exposition à 20 Ilglml de CDDP, aucune récidive n'est possible, les cellules étant dans un état incapable d'évoluer vers la prolifération. However, the combinatorial protocol makes it possible to completely destroy the population and, unlike the sole exposure to 20 μlml of CDDP, no recurrence is possible, the cells being in a state incapable of evolving towards proliferation.
Ainsi que cela ressort de ce qui précède, l'invention ne se limite nullement à ceux de ses modes de mise en oeuvre, de réalisation et d'application qui viennent d'être décrits de façon plus explicite ; elle en embrasse au contraire toutes les As emerges from the foregoing, the invention is in no way limited to those of its embodiments, embodiments and applications which have just been described more explicitly; on the contrary, it embraces all
<Desc/Clms Page number 18><Desc / Clms Page number 18>
variantes qui peuvent venir à l'esprit du technicien en la matière, sans s'écarter du cadre, ni de la portée, de la présente invention. variants which may occur to the person skilled in the art, without departing from the scope or the scope of the present invention.
Claims (5)
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR0108864A FR2826869A1 (en) | 2001-07-04 | 2001-07-04 | PRODUCTS SUITABLE TO TREAT OVARIAN CANCERS AND PREVENT RELAPSES |
| PCT/FR2002/002350 WO2003004064A2 (en) | 2001-07-04 | 2002-07-04 | Products for treating ovarian cancers and for preventing relapses |
| AU2002329323A AU2002329323A1 (en) | 2001-07-04 | 2002-07-04 | Products for treating ovarian cancers and for preventing relapses |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR0108864A FR2826869A1 (en) | 2001-07-04 | 2001-07-04 | PRODUCTS SUITABLE TO TREAT OVARIAN CANCERS AND PREVENT RELAPSES |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| FR2826869A1 true FR2826869A1 (en) | 2003-01-10 |
Family
ID=8865111
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| FR0108864A Withdrawn FR2826869A1 (en) | 2001-07-04 | 2001-07-04 | PRODUCTS SUITABLE TO TREAT OVARIAN CANCERS AND PREVENT RELAPSES |
Country Status (3)
| Country | Link |
|---|---|
| AU (1) | AU2002329323A1 (en) |
| FR (1) | FR2826869A1 (en) |
| WO (1) | WO2003004064A2 (en) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7816630B2 (en) * | 2003-04-12 | 2010-10-19 | Eichenauer Heizelemente Gmbh & Co. Kg | Device for receiving ceramic heating elements and method for the manufacture thereof |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5834309A (en) * | 1993-06-22 | 1998-11-10 | Arch Development Corporation | Vertebrate apoptosis gene: compositions and methods |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1322337A2 (en) * | 2000-09-25 | 2003-07-02 | Board of Regents, The University of Texas System | Pei : dna vector formulations for in vitro and in vivo gene delivery |
-
2001
- 2001-07-04 FR FR0108864A patent/FR2826869A1/en not_active Withdrawn
-
2002
- 2002-07-04 AU AU2002329323A patent/AU2002329323A1/en not_active Abandoned
- 2002-07-04 WO PCT/FR2002/002350 patent/WO2003004064A2/en not_active Application Discontinuation
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5834309A (en) * | 1993-06-22 | 1998-11-10 | Arch Development Corporation | Vertebrate apoptosis gene: compositions and methods |
Non-Patent Citations (5)
| Title |
|---|
| BETTINGER T ET AL: "SIZE REDUCTION OF GALACTOSYLATED PEI/DNA COMPLEXES IMPROVES LECTIN-MEDIATED GENE TRANSFER INTO HEPATOCYTES", BIOCONJUGATE CHEMISTRY, AMERICAN CHEMICAL SOCIETY, WASHINGTON, US, vol. 10, 1999, pages 558 - 561, XP000952655, ISSN: 1043-1802 * |
| CHUNG-HUA FU CHAN KO TSA CHIH [CHINESE JOURNAL OF OBSTETRICS AND GYNECOLOGY], (2000 FEB) 35 (2) 94-7. * |
| DATABASE MEDLINE [online] US NATIONAL LIBRARY OF MEDICINE (NLM), BETHESDA, MD, US; WANG H ET AL: "Synergistic Efficacy of Adenovirus-mediated bcl - Xs Gene Therapy and Cisplatin in Ovarian Cancer Cell.", XP002193940, retrieved from STN Database accession no. 2002083677 * |
| KIM, RYUNGSA (1) ET AL: "Enhancement of antitumor effect by intratumoral injection of bax cDNA plasmid in combination with anticancer drugs in gastric tumor in nude mice.", PROCEEDINGS OF THE AMERICAN ASSOCIATION FOR CANCER RESEARCH ANNUAL MEETING, (MARCH, 2000) NO. 41, PP. 730-731. PRINT.. MEETING INFO.: 91ST ANNUAL MEETING OF THE AMERICAN ASSOCIATION FOR CANCER RESEARCH. SAN FRANCISCO, CALIFORNIA, USA APRIL 01-05, 200, XP002193939 * |
| RYUNGSA KIM ET AL.: "An analysis of the therapeutic efficacy of protracted infusion of low-dose 5-fluorouracil and cisplatin in advanced gastric cancer", J. INFECT. CHEMOTHER., vol. 6, 2000, pages 222 - 228, XP002193938 * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7816630B2 (en) * | 2003-04-12 | 2010-10-19 | Eichenauer Heizelemente Gmbh & Co. Kg | Device for receiving ceramic heating elements and method for the manufacture thereof |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2003004064A3 (en) | 2003-11-06 |
| AU2002329323A1 (en) | 2003-01-21 |
| WO2003004064A2 (en) | 2003-01-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Alshaer et al. | siRNA: Mechanism of action, challenges, and therapeutic approaches | |
| Baig et al. | Tumor-derived exosomes in the regulation of macrophage polarization | |
| Li et al. | Combination therapy with epigenetic-targeted and chemotherapeutic drugs delivered by nanoparticles to enhance the chemotherapy response and overcome resistance by breast cancer stem cells | |
| JP5697988B2 (en) | Method for silencing polo-like kinase expression using interfering RNA | |
| JP6523399B2 (en) | Method of treating fibrosis | |
| HRP20030102A2 (en) | Methods of treatment of a bcl-2 disorder using bcl-2 antisense oligomers | |
| Liu et al. | Polymeric nanoparticle mediated inhibition of miR-21 with enhanced miR-124 expression for combinatorial glioblastoma therapy | |
| Zu et al. | Browning white adipose tissue using adipose stromal cell-targeted resveratrol-loaded nanoparticles for combating obesity | |
| Wang et al. | Paclitaxel tumor priming promotes delivery and transfection of intravenous lipid-siRNA in pancreatic tumors | |
| Aly et al. | Antineoplastic activity of Salmonella Typhimurium outer membrane nanovesicles | |
| JP2012510965A (en) | Methods for preventing or reducing colon cancer development | |
| JP2021172597A (en) | Lipid nanoparticle | |
| EP0526608A1 (en) | Therapeutic agents for the treatment of multidrug resistance to cancers. | |
| Zhao et al. | Arsenic trioxide-loaded nanoparticles enhance the chemosensitivity of gemcitabine in pancreatic cancer via the reversal of pancreatic stellate cell desmoplasia by targeting the AP4/galectin-1 pathway | |
| US20240229041A2 (en) | Nucleic acids for inhibiting expression of cnnm4 in a cell | |
| FR2826869A1 (en) | PRODUCTS SUITABLE TO TREAT OVARIAN CANCERS AND PREVENT RELAPSES | |
| JP5406024B2 (en) | Cancer therapy using Bcl-XL specific siNA | |
| RU2583290C2 (en) | Preventive or therapeutic agent for treating fibrosis | |
| FR2784897A1 (en) | Non-fermented osmotic laxatives, especially polyethylene glycols and/or polyethylene-polypropylene glycols, are useful in prevention and treatment of colorectal cancers | |
| US20240141342A1 (en) | Rna interference delivery formulation and methods for malignant tumors | |
| US20170166896A1 (en) | Treatment of Liver Cancer through Embolization Depot Delivery of BORIS Gene Silencing Agents | |
| EP1303296B1 (en) | Composition containing an iron complexing protein and a precursor of nitrogen monoxide metabolism and/or a chemical donor of nitrogen monoxide and uses thereof | |
| EP2895149B1 (en) | Synergistic anti-cancer composition and a process for the preparation thereof | |
| FR3023483A1 (en) | PROCESS FOR PREPARING MESSENGER RNA NANOPARTICLES AND HYPOTONIC AQUEOUS COMPOSITION COMPRISING THE ARNM NANOPARTICLES | |
| US20220143065A1 (en) | Use of the mir-27a-5p microrna for treating clostridium difficile-induced bowel inflammation |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| ST | Notification of lapse |