FR2796943A1 - Derives de benzoxazinnes, leur procede de preparation et leur utilisation en therapeutique - Google Patents
Derives de benzoxazinnes, leur procede de preparation et leur utilisation en therapeutique Download PDFInfo
- Publication number
- FR2796943A1 FR2796943A1 FR9909894A FR9909894A FR2796943A1 FR 2796943 A1 FR2796943 A1 FR 2796943A1 FR 9909894 A FR9909894 A FR 9909894A FR 9909894 A FR9909894 A FR 9909894A FR 2796943 A1 FR2796943 A1 FR 2796943A1
- Authority
- FR
- France
- Prior art keywords
- methyl
- benzo
- oxazine
- radical
- dihydro
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 0 *C(OC(C=C1)=CCC1=C)=O Chemical compound *C(OC(C=C1)=CCC1=C)=O 0.000 description 2
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/54—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members
- C07D233/64—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with substituted hydrocarbon radicals attached to ring carbon atoms, e.g. histidine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/24—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D213/36—Radicals substituted by singly-bound nitrogen atoms
- C07D213/38—Radicals substituted by singly-bound nitrogen atoms having only hydrogen or hydrocarbon radicals attached to the substituent nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/06—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/10—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings linked by a carbon chain containing aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing three or more hetero rings
Abstract
La présente invention concerne de nouveaux dérivés de 8-carbonyl benzoxazine, qui inhibent la farnésyle transférase. La présente invention concerne également leur procédé de préparation et leur utilisation en tant qu'agent thérapeutique.
Description
<Desc/Clms Page number 1>
DERIVES DE BENZOXAZINES. LEUR PROCEDE DE PREPARATION ET LEUR
UTILISATION EN THERAPEUTIQUE
La présente invention concerne les nouveaux dérivés de 8-carbonyI benzoxazine de formule générale (I) :
leur préparation, les compositions pharmaceutiques qui les contiennent et leur utilisation pour la préparation de médicaments.
UTILISATION EN THERAPEUTIQUE
La présente invention concerne les nouveaux dérivés de 8-carbonyI benzoxazine de formule générale (I) :
leur préparation, les compositions pharmaceutiques qui les contiennent et leur utilisation pour la préparation de médicaments.
La protéine famésyle transférase est une enzyme qui catalyse le transfert du groupement famésyle du pyrophosphate de famésyle (FPP) au résidue cystéine terminal de la séquence tétrapeptidique CAAX d'un certain nombre de protéines et en particulier de la protéine p21Ras, expression de l'oncogène ras.
L'oncogène ras (H-, N- ou K-ras) est connu pour jouer un rôle clé dans les voies de signalisation cellulaire et les processus de division cellulaire. La mutation de l'oncogène ras ou sa surexpression est souvent associée aux cancers humains : la protéine p21Ras mutée se retrouve dans de nombreux cancers humains et notamment dans plus de 50 % des cancers du colon et 90 % des cancers du pancréas (Kohl et al., Science, 260,1834-1837, 1993).
L'inhibition de la famésyle transférase et par conséquent de la farnésylation de la protéine p21 Ras bloque la capacité de la protéine p21 Ras mutée à induire une prolifération cellulaire et à transformer les cellules normales en cellules cancéreuses.
D'autre part, il a été démontré que les inhibiteurs de farnésyle transférase sont également actifs sur des lignées cellulaires tumorales n'exprimant pas de ras muté ou
<Desc/Clms Page number 2>
surexprimé, mais présentant la mutation d'un oncogène ou la surexpression d'une oncoprotéine dont la voie de signalisation utilise la farnésylation d'une protéine, telle qu'une protéine p21 Ras normale (Nagasu et al., Cancer Research 55, 5310-5314,
1995 ; Sepp-Lorenzino et al., Cancer Research 55,5302-5309, 1995), ou telle que rhoB (Wei et al, Molecular and Cellular Biology, 19, 1831-1840, 1999).
1995 ; Sepp-Lorenzino et al., Cancer Research 55,5302-5309, 1995), ou telle que rhoB (Wei et al, Molecular and Cellular Biology, 19, 1831-1840, 1999).
Les inhibiteurs de la famésyle transférase peuvent donc être des inhibiteurs de la prolifération cellulaire et par conséquent des agents anti-tumoraux et anti- leucémiques.
Des dérivés de tétrahydronaphtyles 1,5-disubstitués ont été décrits dans la demande WO 96/22278 comme présentant une activité in vitro enzymatique inhibitrice de la farnésyle transférase à des concentrations supérieures à 10nM, tout comme des dérivés de 1,2,3,4-tétrahydroisoquinoléines, décrits dans la demande WO 96/24612. D'autres inhibiteurs de farnésyle transférase présentant une structure isoquinoléine ont également été décrits dans la demande EP 0618221. Ces demandes antérieures présentaient donc un répartiteur hydrocarboné ou azoté ; on entend par répartiteur le système condensé sur lequel sont greffées les chaînes fonctionnelles.
Il a maintenant été trouvé, et c'est ce qui fait l'objet de la présente invention, que les composés de formule générale (I), possédant comme répartiteur un système hétérocyclique oxygéné et azoté (noyau benzoxazine), distinct de celui des composés de l'art antérieur précédemment cité, manifestent leur activité inhibitrice tant au niveau enzymatique qu'au niveau cellulaire, et ceci à des concentrations tout à fait significatives.
Du fait de cette activité, les composés de formule générale (I) sont donc des agents anti-tumoraux et anti-leucémiques remarquables.
Rien dans l'art antérieur ne suggérait d'apporter une telle modification au niveau de la structure chimique et ne laissait prévoir les propriétés anticancéreuses avantageuses manifestées par les présents composés.
En outre, selon l'invention, les nouveaux produits de formule générale (I), inhibiteurs de la farnésyle transférase, peuvent être compétitifs vis-à-vis d'un substrat de la
<Desc/Clms Page number 3>
Farnésyle Transférase, tel que ceux décrits par A. D.Cox et C. J.Der, Biochimica et Biophysica acta, 1333 (1997), f 51-f 71 et notamment la protéine p21 Ras, telles que H-Ras, Ki-Ras, N-Ras, la protéine Rho...; cette particularité leur permettant d'agir spécifiquement au niveau du substrat.
La présente invention concerne les nouveaux dérivés de formule générale (I)
sous forme racémique, ou de leurs stéréoisomères ainsi que sous forme de sels.
sous forme racémique, ou de leurs stéréoisomères ainsi que sous forme de sels.
Dans la formule générale (I) : R1 représente # un radical alkyle, # un radical -ORil dans lequel Ri) représente un atome d'hydrogène, un radical alkyle ou un radical hydroxyalkyle, # un radical aryle ou hétéroaryle, éventuellement substitués par un ou plusieurs atomes ou radicaux choisis parmi les atomes d'halogène, et les radicaux alkoxy, alkyle, hydroxy, nitro, amino, aralkoxy, sulfamoyle, polyfluoroalkyle, polyfluoroalkoxy, aryle tel que phényle, aralkyle; de préférence, ledit radical aryle ou hétéroaryle représente les radicaux phényle, pyridyle, tel que 2-, 3- ou 4- pyridyle # un radical hétérocyclyle, de préférence tétrahydrofuryle ; R2 représente un atome d'hydrogène, un radical -C(O)-Ri2 , ou un radical -(CH2)mRi3 , dans lesquels :
<Desc/Clms Page number 4>
# Ri2 représente un radical choisi parmi les radicaux hydroxy, amino, alkoxy, alkylamino, étant entendu que lorsque Ri2 représente un radical hydroxy, la fonction acide correspondante peut éventuellement être sous forme de sel, tel que le sel de sodium ; # Ri3 représente, un atome d'halogène, un radical alkylthio, ou hydroxy ; # m représente un chiffre entier égal à 1, 2 ; R3 représente un atome d'hydrogène ou un radical alkyle, -(CH2)pRi4 dans lequel
Ri4 représente un radical hydroxy, -CORis où Ris représente un radical hydroxy, alkoxy, amino p représente un chiffre entier égal à 1, 2, 3 ; R4, R5 représentent indépendamment un atome d'hydrogène ou un radical alkyle ; R6, R7 représentent chacun un atome d'hydrogène ou forment ensemble avec l'atome de carbone auquel ils sont attachés le radical carbonyle ; R8 représente un atome d'hydrogène ou un atome d'halogène R9 représente un atome ou radical choisi parmi les atomes d'hydrogène, d'halogène et - les radicaux alkyle, - aryle, ou hétéroaryle, éventuellement substitués par un ou plusieurs atomes ou radicaux choisis parmi les atomes d'halogène ou les radicaux alkoxy, alkyle ; - cycloalkyle, alkoxy, cyano, nitro, - polyfluoroalkyle, tel que trifluoroalkyle, comme trifluorométhyle, polyfluoroalkoxy, tel que trifluoroalkoxy, ou difluoroalkoxy comme trifluorométhoxy ou difluorométhoxy, polyfluoroalkylthio, tel que trifluoroalkylthio, comme trifluorométhylthio, - aralkyle, aryloxy ; - un radical -Ri6-CO-Ri7. pour lequel : Ri6 représente un radical alkylène, alkènylène ; Ri7 représente un radical hydroxy, alkoxy, amino ;
Ri4 représente un radical hydroxy, -CORis où Ris représente un radical hydroxy, alkoxy, amino p représente un chiffre entier égal à 1, 2, 3 ; R4, R5 représentent indépendamment un atome d'hydrogène ou un radical alkyle ; R6, R7 représentent chacun un atome d'hydrogène ou forment ensemble avec l'atome de carbone auquel ils sont attachés le radical carbonyle ; R8 représente un atome d'hydrogène ou un atome d'halogène R9 représente un atome ou radical choisi parmi les atomes d'hydrogène, d'halogène et - les radicaux alkyle, - aryle, ou hétéroaryle, éventuellement substitués par un ou plusieurs atomes ou radicaux choisis parmi les atomes d'halogène ou les radicaux alkoxy, alkyle ; - cycloalkyle, alkoxy, cyano, nitro, - polyfluoroalkyle, tel que trifluoroalkyle, comme trifluorométhyle, polyfluoroalkoxy, tel que trifluoroalkoxy, ou difluoroalkoxy comme trifluorométhoxy ou difluorométhoxy, polyfluoroalkylthio, tel que trifluoroalkylthio, comme trifluorométhylthio, - aralkyle, aryloxy ; - un radical -Ri6-CO-Ri7. pour lequel : Ri6 représente un radical alkylène, alkènylène ; Ri7 représente un radical hydroxy, alkoxy, amino ;
<Desc/Clms Page number 5>
X représente un radical -(CH2-)n dans lequel n représente un chiffre entier égal à 0, 1,
2,3;
Y représente un radical alkylène ;
Z représente un radical alkylène ; Het # représente un radical imidazolyle ou pyridyl pour lequel Y et Z peuvent être attachés sur 2 quelconques des atomes de carbone ou d'azote qui le constituent ; # représente un radical phényle pour lequel Z et R9 peuvent être attachés sur 2 quelconques des atomes de carbone qui le constituent ; sous forme racémique ou leurs stéréoisomères ainsi que leurs sels.
2,3;
Y représente un radical alkylène ;
Z représente un radical alkylène ; Het # représente un radical imidazolyle ou pyridyl pour lequel Y et Z peuvent être attachés sur 2 quelconques des atomes de carbone ou d'azote qui le constituent ; # représente un radical phényle pour lequel Z et R9 peuvent être attachés sur 2 quelconques des atomes de carbone qui le constituent ; sous forme racémique ou leurs stéréoisomères ainsi que leurs sels.
Dans ce qui précède et ce qui suit : - les radicaux et portions alkyles contiennent 1 à 10 atomes de carbone en chaîne droite ou ramifiée, et comprennent notamment les radicaux et portions méthyle, éthyle, propyle, butyle, pentyle, hexyle ainsi que leurs isomères iso, sec., tert ; - les radicaux et portions alkylène définissent les radicaux hydrocarbonés divalents, dont les valences libres sont portées par le même atome de carbone ou deux atomes de carbone différents de la portion alkylène, en chaîne droite ou ramifiée, contenant de 1 à 10 atomes de carbone, et incluent notamment les radicaux méthylène, éthylène, propylène, butylène, pentylène, hexylène, ainsi que leurs isomères iso, sec, tert ; - les radicaux alkènylène définissent les radicaux hydrocarbonés divalents possédant au moins une liaison double insaturée, dont les valences libres sont portées par le même atome de carbone ou deux atomes de carbone différents de la portion alkènylène, en chaîne droite ou ramifiée, contenant de 1 à 10 atomes de carbone, et incluent notamment les radicaux éthènylène, propènylène, butènylène, pentènylène, hexènylène, ainsi que leurs isomères iso, sec, tert; - le terme halogène définit les atomes de fluor, chlore, brome et iode; préférentiellement fluor, chlore ou brome ;
<Desc/Clms Page number 6>
- le terme cycloalkyle définit un radical cyclique hydrocarboné saturé de 3 à 6 chaînons ; il représente de préférence le radical cyclohexyle ; - le terme aryle des radicaux aryle ou aralkyle définit un système aromatique hydrocarboné mono ou bicyclique de 6 à 10 chaînons, sauf mention particulière ; aryle représente de préférence les radicaux phényle, napthyle ; et encore plus avantageusement phényle ; aralkyle représente de préférence benzyle ; - le terme hétéroaryle définit un système aromatique mono ou bicyclique, de 5 à 10 chaînons contenant de 1 à 4 hétéroatomes, choisis parmi l'azote, l'oxygène et le soufre, et représente de préférence les radicaux thiényle, pyrrolyle, imidazolyle, pyrazolyle, triazolyle, oxazolyle, oxadiazolyle, thiadiazolyle, isothiazolyle, isothiazolyle, pyridazinyle, pyrimidinyle, pyrazinyle, furanyle, thiazolyle, isoxazolyle, tétrazolyle, pyridyle ainsi que les radicaux résultants de la fusion de ces cyles ci-dessus mentionnés avec le groupe phényle ; - hétérocyclyle définit un radical cyclique mono- ou bicyclique de 5 à 10 chaînons, dont au moins un des cycles est non aromatique, contenant 1,2, 3 ou 4 hétéroatomes, identiques ou différents choisis parmi les atomes de N, 0, S ; de préférence, et sauf mention contraire hétérocyclyle désigne morpholinyle, pyrrolidinyle, pipérazinyle, furfuryle, tétrahydrofuryle ; - le terme BOC définit le radical tert.butoxycarbonyle, - le terme Ph définit le radical phényle, - le terme Hal définit un atome d'halogène tel que Fluor, Chlore, Brome, Iode.
Les produits de formule générale (I) possèdent au moins un carbone asymétrique : ce carbone asymétrique peut présenter les configurations (R) ou (S) ; notamment, les produits de formule générale (I) peuvent avoir 2 carbones asymétriques, et peuvent donc se présenter sous forme de 4 stéréoisomères : diastéréoisomères et 2 énantiomères, les énantiomères pouvant éventuellement être sous forme de mélange racémique.
Toutes les formes stéréoisomères des composés de formule générale (I) font également partie de l'invention.
<Desc/Clms Page number 7>
Dans ce qui précède et ce qui suit, l'expression "stéréoisomère", définit la forme pure dudit stéréoisomère ou éventuellement le mélange des stéréoisomères "enrichi", c'est-à-dire contenant majoritairement ledit stéréoisomère ou ladite forme.
Parmi les produits de formule générale (I), on préfère ceux pour lesquels :
R1 représente # un radical alkyle, # un radical -ORi1 dans lequel Ri1 représente un atome d'hydrogène, un radical alkyle ou un radical hydroxyalkyle, ou # un radical phényle, 2- ou 3- ou 4- pyridyle, éventuellement substitués par un ou 2 atomes ou radicaux choisis parmi les atomes d'halogène, ou les radicaux alkoxy, alkyle, sulfamoyle, polyfluoroalkoxy ; R2 représente un atome d'hydrogène, ou un radical -C(O)-Ri2, ou un radical - (CH2)mRi3 ; Ri2 représente un radical choisi parmi les radicaux hydroxy, alkoxy, amino ; Ri3 représente un radical alkylthio, hydroxy, un atome d'halogène ; m est égal à 1, 2 ; R3 représente représente un atome d'hydrogène ; R4, R5 représentent un atome d'hydrogène ou un radical alkyle ; R6, R7 représentent chacun un atome d'hydrogène ou forment ensemble avec l'atome de carbone auquel ils sont attachés le radical carbonyle ; R8 représente un atome d'hydrogène ; R9 représente un atome ou radical choisi parmi les atomes d'halogène et les radicaux alkyle, cyano, polyfluoroalkoxy, tel que trifluorométhoxy, polyfluoroalkylthio, tel que trifluorométhylthio, aryle, tel que phényle, éventuellement substitué par un ou plusieurs atomes ou radicaux choisis parmi les atomes d'halogène
R1 représente # un radical alkyle, # un radical -ORi1 dans lequel Ri1 représente un atome d'hydrogène, un radical alkyle ou un radical hydroxyalkyle, ou # un radical phényle, 2- ou 3- ou 4- pyridyle, éventuellement substitués par un ou 2 atomes ou radicaux choisis parmi les atomes d'halogène, ou les radicaux alkoxy, alkyle, sulfamoyle, polyfluoroalkoxy ; R2 représente un atome d'hydrogène, ou un radical -C(O)-Ri2, ou un radical - (CH2)mRi3 ; Ri2 représente un radical choisi parmi les radicaux hydroxy, alkoxy, amino ; Ri3 représente un radical alkylthio, hydroxy, un atome d'halogène ; m est égal à 1, 2 ; R3 représente représente un atome d'hydrogène ; R4, R5 représentent un atome d'hydrogène ou un radical alkyle ; R6, R7 représentent chacun un atome d'hydrogène ou forment ensemble avec l'atome de carbone auquel ils sont attachés le radical carbonyle ; R8 représente un atome d'hydrogène ; R9 représente un atome ou radical choisi parmi les atomes d'halogène et les radicaux alkyle, cyano, polyfluoroalkoxy, tel que trifluorométhoxy, polyfluoroalkylthio, tel que trifluorométhylthio, aryle, tel que phényle, éventuellement substitué par un ou plusieurs atomes ou radicaux choisis parmi les atomes d'halogène
<Desc/Clms Page number 8>
ou les radicaux alkoxy ou alkyle, hétéroaryle tels que pyridyle, thiazolyle, isoxazolyle, thiényle, un radical -Ri6-CO-Ri7. pour lequel :
Ri6 représente un radical alkylène, alkènylène ;
Ri7 représente un radical hydroxy, alkoxy, amino ;
X représente un radical -(CH2-)n dans lequel n est égal à 0, 1, 2, 3 ; Y représente un radical alkylène ; Z représente un radical alkylène ; Het représente un radical imidazolyle ; # représente un radical phényle ; sous forme racémique ou leurs stéréoisomères ainsi que leurs sels.
Ri6 représente un radical alkylène, alkènylène ;
Ri7 représente un radical hydroxy, alkoxy, amino ;
X représente un radical -(CH2-)n dans lequel n est égal à 0, 1, 2, 3 ; Y représente un radical alkylène ; Z représente un radical alkylène ; Het représente un radical imidazolyle ; # représente un radical phényle ; sous forme racémique ou leurs stéréoisomères ainsi que leurs sels.
On préfère tout particulièrement les composés de formule générale (I) pour lesquels : R1 représente un radical phényle, 2-, 3-, 4- pyridyle, éventuellement substitués par un ou 2 atomes ou radicaux choisis parmi les atomes d'halogène, ou les radicaux alkoxy, polyfluoroalkoxy, alkyle ; R2 représente un atome d'hydrogène, ou un radical -C(O)-Ri2 ou un radical - (CH2)mRi3 ; Ri2 représente un radical choisi parmi les radicaux hydroxy, amino ; Ri3 représente un radical hydroxy ; = 1,2 R3 représente représente un atome d'hydrogène ; R4, R5 représentent un atome d'hydrogène ou un radical méthyle ; R6, R7 représentent chacun un atome d'hydrogène ou forment ensemble avec l'atome de carbone auquel ils sont attachés le radical carbonyle ; R8 représente un atome d'hydrogène ;
<Desc/Clms Page number 9>
R9 représente un atome ou radical choisi parmi les atomes d'halogène et les radicaux méthyle, aryle, tel que phényle éventuellement substitué par un ou plusieurs atomes ou radicaux choisis parmi les atomes d'halogène, hétéroaryle tels que pyridyle, thiazolyle, isoxazolyle, thiényle, un radical -Ri6-CO-Ri7 pour lequel : Ri6 représente un radical alkylène, alkènylène ; Ri7 représente un radical hydroxy, alkoxy, amino ; X représente le radical -CH2- Y représente un radical méthylène ; Z représente un radical méthylène ; Het représente un radical imidazolyle ; # représente un radical phényle ; sous forme racémique ou leurs stéréoisomères ainsi que leurs sels.
A titre illustratif et non limitatif des composés revendiqués, on peut particulièrement citer tout composé de formule générale (I), sélectionné individuellement parmi :
8N-[ 1-(S)-Carbamoyl-2-(4-chlorophényl)éthylJ-4-[ 1-(4-chlorobenzyl)-1 H-Simidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][l,4]oxazine-8-carboxamide, 8N-[ 1-(S)-Carbamoyl-2-(4-méthoxyphényl)éthyl]-4-[3-(4-chlorobenryl)-4pyridylméthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxamide, 8N-[ 1-(S)-Carbamoyl-2-(4-méthoxyphényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1 1 H-5imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][I,4]oxazine-8-carboxamide, 8N-[ 1-(S)-Carbamoyl-2-(4-méthoxyphényl)éthyl]-4-[ 1-(4-méthylbenzyl)-1 H-Simidazolyl-méthyl]-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8-carboxamide, 8N-[ 1-(S)-Carbamoyl-2-(4-méthoxyphényl)éthylJ-4-[ 1-(4-méthylbenzyl)-1 1 H-5imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][l,4]oxazine-8-carboxamide,
8N-[ 1-(S)-Carbamoyl-2-(4-chlorophényl)éthylJ-4-[ 1-(4-chlorobenzyl)-1 H-Simidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][l,4]oxazine-8-carboxamide, 8N-[ 1-(S)-Carbamoyl-2-(4-méthoxyphényl)éthyl]-4-[3-(4-chlorobenryl)-4pyridylméthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxamide, 8N-[ 1-(S)-Carbamoyl-2-(4-méthoxyphényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1 1 H-5imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][I,4]oxazine-8-carboxamide, 8N-[ 1-(S)-Carbamoyl-2-(4-méthoxyphényl)éthyl]-4-[ 1-(4-méthylbenzyl)-1 H-Simidazolyl-méthyl]-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8-carboxamide, 8N-[ 1-(S)-Carbamoyl-2-(4-méthoxyphényl)éthylJ-4-[ 1-(4-méthylbenzyl)-1 1 H-5imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][l,4]oxazine-8-carboxamide,
<Desc/Clms Page number 10>
8N-[ 1-(S)-Carbamoyl-2-(4-méthoxyphényl)éthyl]-4-[ 1-(4-phénylbenzyl)-1 H-5imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][ I ,4]oxazine-8-carboxamide, 8N-[ 1-(S)-Carbamoyl-2-(4-méthoxyphényl)éthyl]-4-[ 1-(4-phénylbenzyl)-1 1 H-5imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8-carboxamide, 8N-[2-(4-chlorophényl)éthyl]-4-[ 1-(4-phénylbenzyl)-1 1 H-5-imidazolyl-méthyl]-3,4dihydro-2H-benzo[b] [ 1,4]oxazine-8-carboxamide, 8N-[ 1-(S)-Carbamoyl-2-(4-chlorophényl)éthyl]-2,2-diméthyl-4-[ 1-(4-méthylbenzyl)- 1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8-carboxamide, 8N-[ 1-(S)-Carbamoyl-2-(4-chlorophényl)éthyl]-2,2-diméthyl-4-[ 1-(4-chlorobenzyl)- 1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxamide, 8N-[2-(4-chlorophényl)éthyl]-4-[l-(4-chlorobenzyl)-lH-5-imidazolyl-méthyl]-3,4dihydro-2H-benzo[b] [ 1,4]oxazine-8-carboxamide, 8N-[l-(S)-Méthoxycarbonyl-2-(4-chlorophényl)éthyl]-4-[l-(4-méthylbenzyl)-lH-5imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b] [ 1,4)oxazine-8-carboxamide, monohydrate de 3-(4-chlorophényl)-2 f f 4-[I-(4-méthylbenzyl)- H-5-imidazolylméthyl]-3,4-dihydro-2H-benzo[b][ 1 ,4]oxazine-8-carbonyl}-amino }-propionate de sodium, 4-[ 1-(4-chlorobenzyl)-1 1 H-J-imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro- 2H-benzo[b][l,4]oxazine-8-carboxamide, 4-[ 1-(4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-[2-phényléthyl]-3,4-dihydro-2Hbenzo[b] [ 1,4]oxazine-8-carboxamide, 4-[ 1-(4-chlorobenzyl)-1 H-S-imidazolyl-méthyl]-8N-isopentyl-3,4-dihydro-2Hbenzo[b][ 1 ,4]oxazine-8-carboxamide, 4-[ 1-(4-chlorobenzyl)- I H-S-imidazolyl-méthyl]-8N-[2-(2-hydroxyéthoxy)éthyl]-3,4dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxamide, 4-[ 1-(4-chlorobenzyl)-1 H-S-imidazolyl-méthyl]-8N-(4-hydroxybutyl)-3,4-dihydro- 2H-benzo[b] [ 1,4]oxazine-8-carboxamide,
<Desc/Clms Page number 11>
4-[ 1-(4-chlorobenzyl)-1 1 H-5-imidazoIyl-méthyl]-8N-[(2-(2,4-dichlorophényl)éthyl]- 3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxamide, 4-[ 1-(4-chlorobenzyl)-1 H-S-imidazolyl-méthyl]-8N-(6-hydroxyhexyl)-3,4-dihydro- 2H-benzo[b][ 1,4]oxazine-8-carboxamide, 4-[ 1-(4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-[I-hydroxy-4-méthylsulfanyl- 2(S)-butyl] -3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, 4-[ 1-(4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-[(RS)-2-tétrahydrofurylméthyl]- 3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8-carboxamide, 4-[l-(4-chlorobenzyl)-lH-5-imidazolyl-méthyl]-8N-[2-(2-pyridyl)éthyl]-3,4-dihydro- 2H-benzo[b][ 1,4]oxazine-8-carboxamide, 4-[ 1-(4-chlorobenzyl)- I H-S-imidazolyl-méthyl]-8N-(3-pyridylméthyl)-3,4-dihydro- 2H-benzo[b][ 1,4]oxazine-8-carboxamide, 4-[ 1-(4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-(2-méthoxy-éthyl)-3,4-dihydro- 2H-benzo[b][1 ,4]oxazine-8-carboxamide,
4-[ 1-(4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-[(2-(2-méthoxyphényl)éthyl]-3,4dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxamide, 4-[ 1-(4-chlorobenzyl)-1 H-S-imidazolyl-méthyl]-8N-[(2-(2-chlorophényl)éthylJ-3,4dihydro-2H-benzo[b] [ 1,4]oxazine-8-carboxamide, 4-[ 1-(4-chlorobenzyl)-1 1 H-5-imidazolyl-méthyl]-8N-[(2-(3-méthoxyphényl)éthyl]-3,4dihydro-2H-benzo[b] [ 1,4]oxazine-8-carboxamide, 4-[ 1-(4-chlorobenzyl)-1 H-5-imidazolyl-méthylJ-8N-[(2-(4-fluorophényl)éthylJ-3,4- dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxamide,
8N-[(2-(4-bromophényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-3,4dihydro-2H-benzo[b] 1 1,4]oxazine-8-carboxamide, 4-[I-(4-chlorobenzyl)- 1 H-5-imidazolyl-méthyl]-8N-[(2-(4-méthoxyphényl)éthyl]-3,4- dihydro-2H-benzo[b] [ 1,4]oxazine-8-carboxamide,
<Desc/Clms Page number 12>
4-[ 1-(4-chlorobenzyl)-1 H-5-imidazolyl-méthylJ-8N-[(2-(3,4-diméthoxyphényl)éthyl]- 3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxamide, 4-[1-(4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N -[(2-( 4-sulfamoyl-phényl)éthyl]- 3 ,4-dihydro-2H-benzo[b][ 1,4Joxazine-8-carboxamide, 4-[l-(4-chlorobenzyl)-lH-5-imidazolyl-méthyl]-8N-[(2-(3-fluorophényl)éthyl]-3,4dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxamide, 4-[ 1-(4-chlorobenzyl)-1 1 H-5-imidazolyl-méthyl]-8N-[(2-(2-fluorophényl)éthyl]-3,4dihydro-2H-benzo[b] [ 1,4]oxazine-8-carboxamide, 8N-(4-pyridylméthyl]-4-[ I -(4-phénylbenzyl)-1 H-S-imidazolyl-méthyl]-3,4-dihydro- 2H-benzo[b][ 1,4]oxazine-8-carboxamide, 8N-[ 1 -hydroxy-3(4-chlorophényl)-2(RS)-propyl]-4-[ 1 -(4-chlorobenzyl)- H-5- imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxamide, ou leurs stéréoisomères, ou sous forme racémique ainsi que leurs sels.
La présente invention concerne également la préparation des nouveaux produits de formule générale (I). Divers protocoles opératoires ainsi que des intermédiaires réactionnels susceptibles d'être mis en oeuvre pour préparer les composés de formule générale (I) sont proposés. Bien entendu, sont inclus dans la présente invention les procédés analogues en vue de conduire à ces mêmes composés : il est à la portée de l'homme du métier d'appliquer ou adapter ces procédés pour mettre en oeuvre l'invention à l'aide de ses connaissances générales.
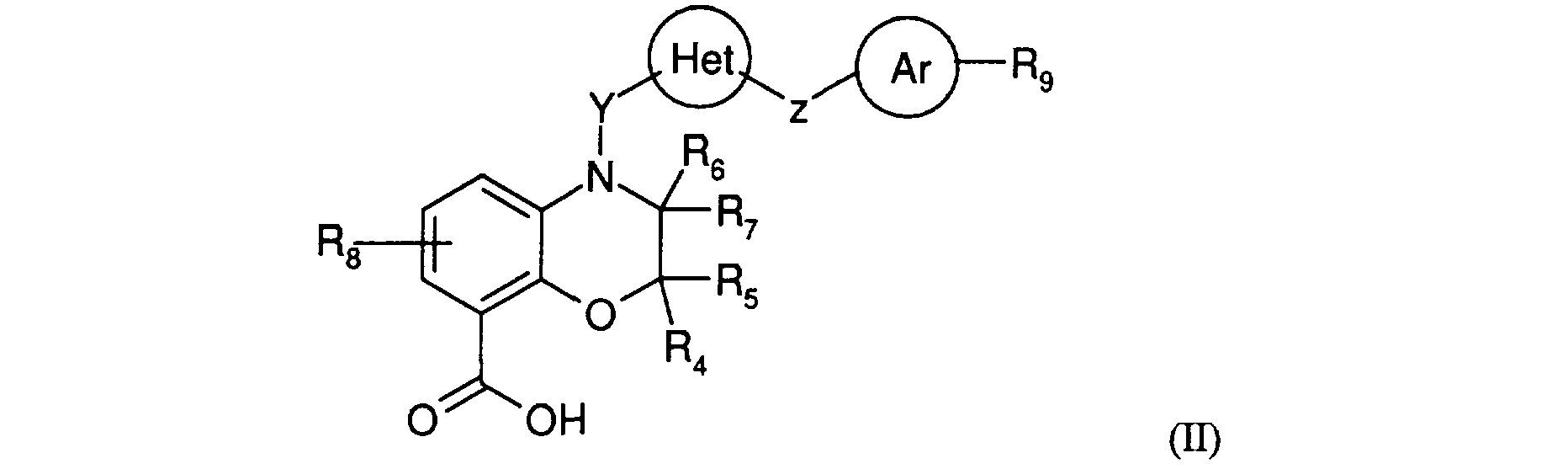
Les nouveaux produits de formule générale (I), dans laquelle RI, R2, R3, R4, R5, R6, R7, R8, R9, X, Y, Z, Het et Ar sont définis comme en formule générale (I), peuvent être obtenus à partir du produit de formule générale (II)
<Desc/Clms Page number 13>
dans laquelle R4, R5, R6, R7, Rs , R9, Y, Z, Het et Ar sont définis comme précédemment, par action d'un composé de formule générale (III)
dans laquelle X, R1, R2, R3 sont tels que définis précédemment, en opérant selon les méthodes d'amidification. Notamment, cette réaction peut être effectuée en opérant selon les conditions d'amidification. Cette réaction peut être effectuée avantageusement en opérant dans un solvant organique tel qu'un hydrocarbure aliphatique halogéné tel que le dichlorométhane en présence d'un agent de condensation tel que le chlorhydrate de l-éthyl-3-[3-(diméthylamino) propyl]carbodiimide, le 1,1-dicyclohexylcarbodiimide ou l'hexafluorophosphate de benzotriazol-1-oxy tris(diméthylamino)phosphonium, éventuellement en présence d'un agent d'activation tel que l'hydroxybenzotriazole, à une température de préférence comprise entre 0 C et la température de reflux du solvant.
Le composé de formule générale (III) peut être obtenu commercialement ou selon les méthodes décrites dans les exemples, par exemple en utilisant les procédures décrites par S. Sagan Bioorg. Med. Chem. Letters (1996), 4, 2167-2178, par W.Oppolzer Helv.Chim.Acta, (1994), 77,2366-2380 ou selon les méthodes décrites par Larock, Comprehensive Organic Transformations, VCH, New York, 1989 pour la préparation d'amines fonctionnalisées.
<Desc/Clms Page number 14>
De préférence, lorsque R2 représente un radical -C(0)-Ri2 pour lequel Ri2 est tel que défini dans la formule générale (I), on préfère utiliser un acide aminé (ou un dérivé de cet acide aminé) de série naturelle, étant entendu que la configuration de l'acide aminé peut être modifiée au cours de la réaction d'amidification et que plusieurs stéréoisomères peuvent être alors obtenus à l'issue de cette réaction.
Eventuellement, lorsque R2 représente le radical -CORi2 pour lequel Ri2 représente un radical amino comme défini dans la formule générale (I), les produits de formule générale (I) peuvent être également obtenus à partir des composés de formule générale (II) par action d'un composé de formule générale (nI)
dans laquelle R1, R3, X sont tels que définis en formule générale (I) et R2 représente le radical -CORi2 pour lequel Ri2 représente un radical alkoxy, dans les mêmes conditions que celles utilisées pour l'amidification précédente, puis soit suivie de l'action de l'ammoniac, dans un solvant organique tel qu'un alcool, le méthanol de préférence, éventuellement en présence de quantités catalytiques de cyanure de sodium, à une température de préférence comprise entre 0 C et la température de reflux du solvant, en opérant éventuellement en autoclave, ou soit suivie, après hydrolyse du radical -CORi2 en radical carboxy, de l'action de l'ammoniac dans les conditions de couplage décrites ci-avant.
dans laquelle R1, R3, X sont tels que définis en formule générale (I) et R2 représente le radical -CORi2 pour lequel Ri2 représente un radical alkoxy, dans les mêmes conditions que celles utilisées pour l'amidification précédente, puis soit suivie de l'action de l'ammoniac, dans un solvant organique tel qu'un alcool, le méthanol de préférence, éventuellement en présence de quantités catalytiques de cyanure de sodium, à une température de préférence comprise entre 0 C et la température de reflux du solvant, en opérant éventuellement en autoclave, ou soit suivie, après hydrolyse du radical -CORi2 en radical carboxy, de l'action de l'ammoniac dans les conditions de couplage décrites ci-avant.
Avantageusement, la réaction d'amidification des composés de formule générale (II) par les composés de formule générale (III) peut être effectuée sur résine.
Notamment, la réaction peut être effectuée sur une résine de type fluorophénol de formule générale :
<Desc/Clms Page number 15>
dans laquelle # est un support solide
A représente le radical -CH2-NRi-CO-, dans laquelle Ri représente un atome d'hydrogène ou un radical alkyle, tel que méthyle.
Par support solide, on entend support habituellement utilisé pour effectuer des réactions chimiques, pouvant être choisi parmi les substrats inorganiques tels que le gel de silice ; les polymères organiques tels que les polystyrène, comme 1-2 % copolystyrène divinyl benzène (gel) et 20-40 % copolystyrène divinyl benzène (forme macroporeuse), polypropylène, polyéthylène glycol, polyacrylamide, cellulose, et leurs dérivés, et les composites inorganiques/compositions polymériques tels que polyacrylamide supporté dans une matrice de particules de gel de silice (voir J.M.
Stewart and J.D. Young, Solid Phase Peptide Synthesis, 2nd. Ed., Pierce Chemical Co. (Chicago, IL, 1984)).
Egalement, "support solide" inclut un support solide tel que décrit ci-dessus qui est fixé sur un second support tel que les dispositifs décrits dans Technical Manual, MultipinTM SPOC, Chiron Technologies (1995), comprenant une tête en polyéthylène- ou polypropylène greffée avec un copolymère amino fonctionnalisé méthacrylate, et un système inerte.
Egalement, "support solide" inclut des supports polymériques tels que les supports polyéthylène glycol , décrits par Janda et al., Proc. Natl. Acad. Sci. USA, 92, 6419-6423 (1995) et S. Brenner, WO 95/16918, qui sont solubles dans de nombreux solvants mais peuvent être précipités par addition d'un solvant précipitant.
La préparation de la résine tétrafluorophénol de formule générale 3 est illustrée au Schéma 1 :
<Desc/Clms Page number 16>
Selon le schéma 1, la résine amino 1 est couplée avec le dérivé de l'acide 4-hydroxyfluorobenzoique 2 dans un solvant organique convenable tel que le dichlorométhane, DMF, DMSO ou THF pour former la résine tétrafluorophénol 3.. Les temps de couplage sont compris entre 2 à 24 heures, selon la résine aminée et le dérivé de l'acide 4-hydroxyfluorobenzoique à coupler, l'agent activant, le solvant, et la température. Le couplage est effectué à température comprise entre -10 C à 50 C, de préférence à température ambiante. Le dérivé de l'acide carboxylique est activé avec un agent activant approprié (comme par exemple ceux listés dans Arrieta et al., Synth. Commun. 13, 471, 1983) tel que le chloroformate d'isopropyle en présence de N-méthylmorpholine, le diisopropylcarbodiimide (DIC) en présence de 1-hydroxybenzotriazole (HOBT), le diisopropylcarbodiimide (DIC) en présence de 4-diméthylaminopyridine (DMAP), le chlorure de bis(2-oxo-3-oxazolidinyl)phosphonyle (BOP-CI) en présence de triéthylamine, l'hexafluorophosphate de bromotripyrrolidinophosphonium (PyBroPTM) en présence de triéthylamine (TEA), le
tétrafluoroborate de 2-( 1 H-benzotriazole-1-yl)-1,1,3,3-tétraméthyluronium (TBTU) en présence de diisopropyléthyl amine, le N-hydroxysuccinimide en présence de N,N'-dicyclohexylcarbodiimide (DCC), le sel de pyridinium BU3N, le dichlorophosphate de phényle PhOPOCI2, le 2-chloro-1,3,5-trinitrobenzène et pyridine, les esters de polyphosphate, le chlorosulfonyle isocyanate CIS02NCO, les chlorosilanes, MeSO2Cl-Et3N, PH3P-CC14-Et3N, et leurs dérivés.
tétrafluoroborate de 2-( 1 H-benzotriazole-1-yl)-1,1,3,3-tétraméthyluronium (TBTU) en présence de diisopropyléthyl amine, le N-hydroxysuccinimide en présence de N,N'-dicyclohexylcarbodiimide (DCC), le sel de pyridinium BU3N, le dichlorophosphate de phényle PhOPOCI2, le 2-chloro-1,3,5-trinitrobenzène et pyridine, les esters de polyphosphate, le chlorosulfonyle isocyanate CIS02NCO, les chlorosilanes, MeSO2Cl-Et3N, PH3P-CC14-Et3N, et leurs dérivés.
De préférence, la résine amino 1 pour la préparation des résines 4-hydroxyfluorobenzamido est l'aminométhyle polystyrène. Selon la taille des
<Desc/Clms Page number 17>
particules, (200 ou 400 mesh), l'aminométhyle polystyrène a une capacité de greffage comprise entre 0.5 et 1.2 mmol/g et entre 0.1et 0. 5 mmol/g, respectivement.
La préparation des résines tétrafluorophénol ester activé 6 mettant en oeuvre les résines tétrafluorophénol 3 et les composés de formule générale (II) est illustrée au Schéma 2.
Les composés de formule générale (II) peuvent porter des groupes fonctionnels qui peuvent être protégés pour éviter toute interférence avec la réaction de couplage et clivage avec la résine. Ces groupes protecteurs appropriés ainsi que les réactions de protection et déprotection peuvent être choisis dans T. H. Greene et al., Protective Groups in Organic Synthesis, 2nd edition, John Wiley & Sons, New York (1991).
<Desc/Clms Page number 18>
Selon le Schéma 2, l'acide carboxylique II est couplé à la résine tétrafluorophénol 3 en mettant en oeuvre des conditions de couplage analogues à celles décrites au Schéma 1. Les temps de couplage sont compris entre 2 et 24 heures, selon la nature de la résine fluorophényle 3, l'acide carboxylique II, le solvant, la température de réaction et l'agent activant. De préférence, le couplage est effectué en mettant en oeuvre le diisopropylcarbodiimide (DIC) éventuellement en présence de 4-dimethylaminopyridine (DMAP) catalytique, ou l'hexafluorophosphate de bromotripyrrolidinophosphonium (PyBroPTM) en présence de triéthylamine (TEA).
De préférence, la réaction de couplage est mise en oeuvre dans un solvant convenable tel que le benzène, dichlorométhane, dichloroéthane, dioxane, THF or DMF à température ambiante pendant 18 heures. Préférentiellement, le solvant est le DMF anhydre. La résine tétrafluorophénol ester activé 6 est ensuite lavée avec un ou plusieurs solvant (s) convenable (s) retirer les réactifs en excès. La résine tétrafluorophénol ester activé 6 peut être séchée et stockée pour des utilisations ultérieures ou utilisée directement dans des réactions ultérieures.
Intermédiairement, on peut obtenir une résine tétrafluorophénol activé de formule générale 5, résultant de l'activation de la résine tétrafluorophénol par l'agent activant, avant de former la résine tétrafluorophénol ester activé 6.
Notamment, dans le cas de l'utilisation de l'agent PyBrop, on obtient intermédiairement le produit de formule générale 5 suivant :
Cette résine tétrafluorophénol activée 5 peut être séchée et stockée pour des utilisations ultérieures. Elle permet avantageusement d'utiliser un sel de l'acide II, par exemple un sel minéral tel qu'un sel de sodium, pour préparer la résine tétrafluorophénol ester activé 6.
Cette résine tétrafluorophénol activée 5 peut être séchée et stockée pour des utilisations ultérieures. Elle permet avantageusement d'utiliser un sel de l'acide II, par exemple un sel minéral tel qu'un sel de sodium, pour préparer la résine tétrafluorophénol ester activé 6.
<Desc/Clms Page number 19>
Le clivage de la résine tétrafluorophénol ester activé 6 avec l'amine de formule générale (III) est illustrée au Schéma 3.
Schéma 3
où #, A, Ri, R2, R3, R4, R5, R6, R7, Rs , R9, X, Y, Z, Het et Ar sont définis tels que précédemment.
où #, A, Ri, R2, R3, R4, R5, R6, R7, Rs , R9, X, Y, Z, Het et Ar sont définis tels que précédemment.
Tel qu'illustré au Schéma 3, la résine tétrafluorophénol ester activé 6 est clivée par une réaction avec l'amine de formule (III) dans un solvant organique tel que le dichlorométhane, dichloroéthane, dioxane, THF ou DMF à une température comprise entre 20 C et 60 C pour préparer l'amide (I). La température de réaction et la durée nécessaire pour le clivage dépendent de la nature des substituants R1, R2 et R3, X. Le clivage est généralement effectué à température ambiante pendant 2 à 48 heures. Un catalyseur tel que 4-dimethylaminopyridine est éventuellement ajouté pour accéléré la réaction de clivage.
La réactivité de la résine tétrafluorophénol ester activé 6~vis-à-vis du clivage par les amines est comparable à la réactivité du réactif acylant correspondant non supporté. De nombreuses amines de réactivités variables, incluant les anilines désactivées telles que 4-nitroaniline, réagissent avec la résine tétrafluorophénol ester activé 6 pour former des amides. Généralement, moins d'un équivalent de nucléophile est nécessaire pour permettre une acylation quantitative de nucléophile.
<Desc/Clms Page number 20>
Les résines précédemment décrites peuvent être avantageusement utilisées pour préparer des composés par synthèse parallèle, tel qu'illustré par le schéma 4 suivant :
Schéma 4
Généralement, les acides de formule générale (II) dans laquelle R4, R5, R6, R7, Rg , R9, Y, Z, Het et Ar sont définis comme précédemment peuvent être obtenus à partir des esters correspondants de formule générale (IV) :
dans laquelle R4, R5, R6, R7, R8, R9, Y, Z, Het et Ar sont définis comme précédemment et R représente un radical alkyle, le méthyle de préférence, par application ou adaptation des méthodes de saponification connues, décrites notamment par J. March, Advanced Organic Chemistry, Wiley-Interscience (1992) ; avantageusement, la saponification de l'ester de formule générale (IV) peut être
Schéma 4
Généralement, les acides de formule générale (II) dans laquelle R4, R5, R6, R7, Rg , R9, Y, Z, Het et Ar sont définis comme précédemment peuvent être obtenus à partir des esters correspondants de formule générale (IV) :
dans laquelle R4, R5, R6, R7, R8, R9, Y, Z, Het et Ar sont définis comme précédemment et R représente un radical alkyle, le méthyle de préférence, par application ou adaptation des méthodes de saponification connues, décrites notamment par J. March, Advanced Organic Chemistry, Wiley-Interscience (1992) ; avantageusement, la saponification de l'ester de formule générale (IV) peut être
<Desc/Clms Page number 21>
effectuée dans un solvant organique tel qu'un alcool comme le méthanol ou l'éthanol, éventuellement aqueux, au moyen d'une base minérale telle que la soude ou la potasse ou le carbonate de sodium.
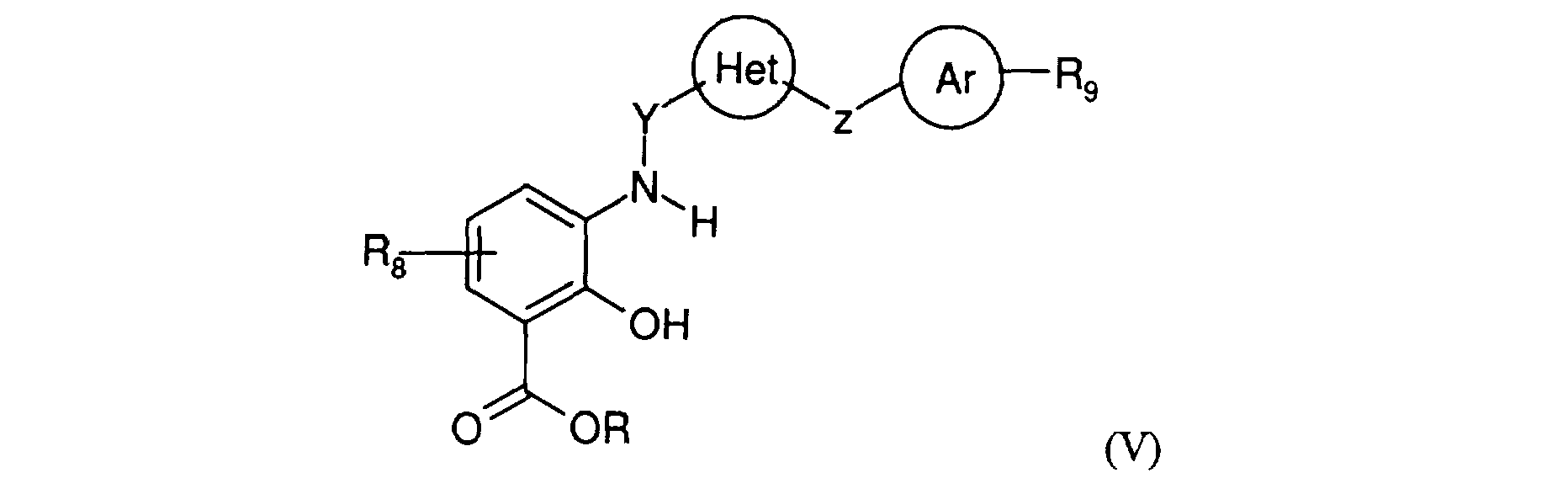
Généralement, les composés de formule générale (IV) dans laquelle R, R4, R5, R6, R7, R8, R9, Y, Z, Het et Ar sont définis comme précédemment peuvent être obtenus à partir de composés de formule générale (V)
dans laquelle R, Rg, R9, Y, Z, Het et Ar sont définis comme précédemment, par action d'un dihalogénure de structure (VI) :
dans laquelle R4, R5, R6, R7 sont définis comme précédemment et Hal représente un atome d'halogène.
dans laquelle R, Rg, R9, Y, Z, Het et Ar sont définis comme précédemment, par action d'un dihalogénure de structure (VI) :
dans laquelle R4, R5, R6, R7 sont définis comme précédemment et Hal représente un atome d'halogène.
Préférentiellement, cette réaction est effectuée dans des conditions d'alkylation ou acylation, telles que celles décrites par Larock, Comprehensive Organic Transformations, VCH, New York, 1989, ou selon les procédures décrites dans les exemples, notamment soit en présence d'un sel tel que le carbonate de potassium, dans un solvant organique tel que le DMF, l'acétonitrile ou soit dans un solvant organique tel qu'un hydrocarbure aliphatique halogéné tel que le dichlorométhane en
<Desc/Clms Page number 22>
présence d'un agent de condensation tel que le chlorhydrate de l-éthyl-3-[3-
(diméthyl amino)propyl]carbodi i m ide.
(diméthyl amino)propyl]carbodi i m ide.
Généralement, les composés de formule générale (V) dans laquelle R, R8, R9, Y, Z, Het et Ar sont définis comme précédemment peuvent être obtenus à partir de composés de formule générale (VII) :
dans laquelle R, Rg sont définis comme précédemment, par action d'un réactif de formule générale (VIII)
dans laquelle R9, Z, Het et Ar sont définis comme précédemment et Y' représente un radical alkylène tel que Y' et l'atome de carbone du groupe carbonyle auquel il est attaché forment le radical Y tel que défini précédemment.
dans laquelle R, Rg sont définis comme précédemment, par action d'un réactif de formule générale (VIII)
dans laquelle R9, Z, Het et Ar sont définis comme précédemment et Y' représente un radical alkylène tel que Y' et l'atome de carbone du groupe carbonyle auquel il est attaché forment le radical Y tel que défini précédemment.
La réaction du produit de formule générale (VIII) sur le produit de formule générale (VII) est effectuée dans des conditions d'amination réductrice : notamment, en opérant dans un solvant organique tel que l'acétonitrile ou le méthanol, en présence d'acide tel que l'acide acétique, sur tamis moléculaire 3 , puis par action d'un composé réducteur, tel que le cyanoborohydrure de sodium (NaBH3CN) ou le triacétoxyborohydrure de sodium (NaBH(OCOCH3) 3) ou le complexe BH3.pyridine, en opérant dans un solvant organique tel que l'éthanol, à une température de préférence comprise entre 0 C et la température de reflux du solvant.
Le produit de formule générale (VIII) peut être obtenu commercialement ou par fonctionnalisation de carboxaldéhydes disponibles commercialement selon les
<Desc/Clms Page number 23>
méthodes décrites par Larock, Comprehensive Organic Transformations, VCH, New York, 1989, ou selon les procédures décrites dans les exemples, ou selon les méthodes décrites par J. Jeong Lee J. Heterocyclic. Chem, (1998), 35, 81-89, par S.Sebti J. Med. Chem, (1996), 39, 219, par G.Bold, J. Med. Chem, (1998), 41, 3387-3401.
En particulier, les produits de formule générale (VIII) dans lesquels R9 représente un radical - Ri6-CO-Ri7 pour lequel Ri6 représente un radical alkénylène et Ri7 est défini comme en formule générale (I) peuvent être obtenus à partir des composés de formule générale (Villa) :
dans laquelle Hal représente un atome d'halogène tel que le brome, par action d'un réactif de formule générale (VIIIb) : HRi6-CORi7 , dans laquelle Ri6 représente un radical alkénylène et Ri7 est défini comme en formule générale (I) par réaction de Heck. Notamment, cette réaction peut être effectuée en présence d'une base, telle qu'une amine, comme la triéthyle amine, de palladium (tel que l'acétate de palladium), de tri-o-tolylphosphine, dans un solvant organique tel que le diméthylformamide, éventuellement en chauffant au reflux du solvant.
dans laquelle Hal représente un atome d'halogène tel que le brome, par action d'un réactif de formule générale (VIIIb) : HRi6-CORi7 , dans laquelle Ri6 représente un radical alkénylène et Ri7 est défini comme en formule générale (I) par réaction de Heck. Notamment, cette réaction peut être effectuée en présence d'une base, telle qu'une amine, comme la triéthyle amine, de palladium (tel que l'acétate de palladium), de tri-o-tolylphosphine, dans un solvant organique tel que le diméthylformamide, éventuellement en chauffant au reflux du solvant.
Lorsque Ri6 représente un radical alkylène, les composés de formule générale (VIII) peuvent être obtenus à partir de composés de formule générale (VIII) pour lesquels Ri6 représente un radical alkènylène par réduction, en présence d'agents réducteurs tels que le borohydrure de sodium, éventuellement en présence de chlorure de nickel éventuellement hexahydraté ; puis éventuellement suivie dans le cas où l'aldéhyde à été réduit en alcool, par une réaction d'oxydation de l'alcool intermédiairement formé en l'aldéhyde désiré, par réaction en présence d'un ou plusieurs agents oxydants, connus en soi, tels que l'oxyde de manganèse, le trioxyde de chrome, le réactif de Swem, le permanganate de potassium, etc...
Eventuellement, lorsque Ri7 représente un radical amino, les composés de formule générale (VIII) peuvent être obtenus à partir de composés de formule générale (VIII)
<Desc/Clms Page number 24>
dans lesquels Ri7 représente un radical alkoxy, par réaction de l'ammoniac dans un alcool tel que le méthanol.
Les composés de formule générale (IIIa) peuvent être obtenus à partir des composés de formule générale (IIIc) :
par action d'un halogénure arylique de formule (IIId) :
dans laquelle Hal représente un atome d'halogène tel que le brome, dans un solvant organique, tel que l'acétonitrile, en présence d'une base minérale, telle que le carbonate de potassium.
par action d'un halogénure arylique de formule (IIId) :
dans laquelle Hal représente un atome d'halogène tel que le brome, dans un solvant organique, tel que l'acétonitrile, en présence d'une base minérale, telle que le carbonate de potassium.
Selon un autre mode de mise en oeuvre, les produits de formule générale (IV) dans laquelle R4, R5, R6, R7, Rs, R9, R, Y, Z, Het et Ar sont définis comme précédemment peuvent être obtenus à partir des composés (IX) :
dans laquelle R4, R5, R6, R7, R8, R sont définis comme précédemment par réaction sur un aldéhyde de formule (VIII) tel que défini précédemment selon les mêmes procédures d'amination réductrices que ci-dessus.
dans laquelle R4, R5, R6, R7, R8, R sont définis comme précédemment par réaction sur un aldéhyde de formule (VIII) tel que défini précédemment selon les mêmes procédures d'amination réductrices que ci-dessus.
Les composés de formule IX peuvent être obtenus à partir des produits de formule VII par action d'un dihalogénure de formule VI comme décrit ci-dessus.
<Desc/Clms Page number 25>
Les produits de formule générale (I) obtenus à l'issue du procédé selon l'invention peuvent présenter différentes formes stéréoisomères, énantiomères et/ou diastéréoisomères, qui peuvent être séparées par les méthodes de séparation classique, telles que la chromatographie ou la cristallisation. Pour les diastéréoisomères, on emploiera de préférence la chromatographie liquide à haute performance sur colonne de silice : phase normale, phase inverse C18 ou phase chirale, et pour les énantiomères la chromatographie sur colonne chirale, telle que celle de type Pirkle (Pirkle et coll.,
Asymetric Synthesis, vol. 1, Academic Press (1983)), ou par synthèse à partir des précurseurs chiraux.
Asymetric Synthesis, vol. 1, Academic Press (1983)), ou par synthèse à partir des précurseurs chiraux.
Il en est de même pour les produits de formule (II), dans laquelle R4, R5, R6, R7, R8,
R9, Y, Z, Het et Ar sont définis comme précédemment, les étapes ultérieures de synthèse pouvant être alors réalisées à partir des isomères (énantiomères, diastéréoisomères) séparés et purifiés.
R9, Y, Z, Het et Ar sont définis comme précédemment, les étapes ultérieures de synthèse pouvant être alors réalisées à partir des isomères (énantiomères, diastéréoisomères) séparés et purifiés.
Les mélanges réactionnels obtenus par les divers procédés décrits précédemment sont traités suivant des méthodes classiques physiques (évaporation, extraction, distillation, chromatographie, cristallisation par exemple) ou chimiques (formation de sels par exemple).
Les composés de formule (I) peuvent être éventuellement transformés en sels d'addition avec un acide minéral ou organique par action d'un tel acide au sein d'un solvant organique tel qu'un alcool, une cétone, un éther ou un solvant chloré. Ces sels font également partie de l'invention ; notamment,les produits de formule générale (I) peuvent se présenter sous forme de ditrifluoroacétate.
La présente invention a également pour objet toute composition pharmaceutique contenant au moins un produit de formule générale en association avec un ou plusieurs diluants ou adjuvants pharmaceutiquement acceptables qu'ils soient inertes ou biologiquement actifs.
Les nouveaux produits de formule générale (I) peuvent se présenter sous forme de sels, non toxiques et pharmaceutiquement acceptables. Comme exemple de sels pharmaceutiquement acceptables, peuvent être cités les sels d'addition avec les acides
<Desc/Clms Page number 26>
minéraux ou organiques tels que acétate, propionate, succinate, benzoate, fumarate, maléate, méthanesulfonate, iséthionate, théophyllinacétate, salicylate, méthylène-bis- b-oxynaphtoate, chlorhydrate, sulfate, nitrate et phosphate.
La présente invention concerne l'utilisation des composés de formule générale (I) pour la préparation de compositions pharmaceutiques utiles pour le traitement et/ou la prévention des conditions pathologiques liées aux voies de signalisations cellulaires, associées à la farnésyle transférase, ou à leurs conséquences ou symptômes.
La présente invention concerne également l'utilisation des composés de formule générale (I) selon l'invention pour la préparation de compositions pharmaceutiques utiles pour inhiber la famésyle transférase, et plus particulièrement pour inhiber la farnésylation des protéines Ras produites par les oncogènes ras.
Notamment, la présente invention concerne l'utilisation des composés de formule générale (I) selon l'invention pour la préparation de compositions pharmaceutiques utiles pour le traitement des maladies liées à des proliférations cellulaires par inhibition de la farnésyle transférase et en particulier pour le traitement des maladies liées à des proliférations cellulaires, surexprimant l'une quelconque des oncoprotéines H-Ras, N-Ras ou K-Ras, ou présentant une mutation de l'un quelconque des oncogènes ras correspondants.
L'invention concerne en particulier l'utilisation des composés de formule générale (I) selon l'invention pour la préparation de compositions pharmaceutiques utiles pour le traitement des maladies liées à des proliférations cellulaires, malignes ou bénignes, des cellules de divers tissus et/ou organes, comprenant les tissus musculaires, osseux ou conjonctifs, la peau, le cerveau, les poumons, les organes sexuels, les systèmes lymphatiques ou rénaux, les cellules mammaires ou sanguines, le foie, l'appareil digestif, le colon, le pancréas et les glandes thyroïdes ou adrénales, et incluant les pathologies suivantes : le psoriasis, la resténose, les tumeurs solides, le sarcome de Kaposi, les carcinomes, le cholangiocarcinome, le choriocarcinome, le neuroblastome, la tumeur de Wilms, la maladie de Hodgkin, les mélanomes, les
<Desc/Clms Page number 27>
tératocarcinomes, les gliomes, les myélomes multiples, les leucémies lymphocytaires chroniques, les lymphomes granulocytaires aigus ou chroniques, et les cancers tels que les cancers du pancréas, du colon, du poumon, de l'ovaire, du sein, du cerveau, de la prostate, du foie, de l'estomac, de la vessie ou des testicules.
L'invention concerne tout particulièrement l'utilisation des composés de formule générale (I) selon l'invention, pour la préparation de compositions pharmaceutiques utiles pour le traitement des cancers tels que les cancers du pancréas, du colon, du poumon, de l'ovaire, du sein, du cerveau, de la prostate, du foie, de l'estomac, de la vessie ou des testicules.
Le dit traitement peut être notamment effectué par inhibition de la croissance tumorale, notamment par inhibition de la farnésyle transférase, ou encore par inhibition de la croissance de tumeurs exprimant l'oncogène ras activé.
Un autre objet de la présente invention est toute association d'un produit de formule générale (I) avec un ou plusieurs composés compatibles et pharmacologiquement actifs et/ou un traitement radiothérapique ; lesdits composés étant préférentiellement des principes actifs connus pour leur activité inhibitrice de la prolifération cellulaire et particulièrement pour leur activité dans le traitement du cancer ; ils peuvent être préférentiellement des composés antiprolifératifs agissant à l'un quelconque des stades de la voie de signalisation de l'oncogène ras comme un inhibiteur de protéine tyrosine kinase, ou un autre inhibiteur de farnésyle transférase, ou un inhibiteur de HMG-Co-réductase, ou un traitement de thérapie génique résultant par exemple de l'administration d'un gène suppresseur de tumeur, ou les composés cytotoxiques utilisés habituellement dans le traitement du cancer.
Notamment, les autres traitements et/ou produits thérapeutiques pouvant être utilisés en association avec les produits de formule générale (I) peuvent être choisis parmi des médicaments antinéoplastiques, des anticorps monoclonaux, des thérapies immunologiques ou des radiothérapies ou des modificateurs des réponses biologiques. Les modificateurs des réponses incluent, de manière non limitative, les lymphokines et les cytokines telles que les interleukines, les interférons (a, p ou 8) et
<Desc/Clms Page number 28>
le TNF. D'autres agents chimiothérapeutiques utiles dans le traitement des désordres dus à la prolifération anormale des cellules incluent, de manière non limitative, les agents alkylants tels que les moutardes à l'azote comme la mechloretamine, le cyclophosphamide, le melphalan et le chlorambucil, des sulfonates d'alkyle comme le busulfan, les nitrosourées comme la carmustine, la lomustine, la sémustine et la streptozocine, les triazènes comme la dacarbazine, les antimétabolites comme les analogues de l'acide folique tel que le méthotrexate, les analogues de pyrimidine comme le fluorouracil et la cytarabine, des analogues de purines comme la mercaptopurine et la thioguanine, des produits naturels tels que les alcaloïdes de vinca comme la vinblastine, la vincristine et la vendésine, des dérivés des taxoides, des inhibiteurs de topoisomérase tels que les dérivés de la camptothécine, des épipodophyllotoxines comme l'étoposide et le teniposide, des antibiotiques comme la dactinomycine, la daunorubicine, la doxorubicine, la bléomycine, la plicamycine et la mitomycine, des enzymes comme la L-asparaginase, des agents divers comme les complexes de coordination du platine tel que le cisplatine, les urées substituées telles que l'hydroxyurée, les dérivés de méthylhydrazine comme la procarbazine, les suppresseurs adrénocoticoïques comme le mitotane et l'aminoglutéthymide, les hormones et les antagonistes comme les adrénocorticostéroïdes comme la prednisone, les progestines comme le caproate d'hydroxyprogestérone, l'acétate de méthoxyprogestérone et l'acétate de megestrol, les oestrogènes comme le diéthylstilbestrol et l'éthynylestradiol, les antioestrogènes comme le tamoxifène, les androgènes comme le propionate de testostérone et la fluoxymesterone.
Les produits selon l'invention peuvent être utilisés pour prévenir ou retarder l'apparition ou la réapparition des conditions pathologiques ou pour traiter ces conditions pathologiques.
Les produits selon l'invention peuvent être administrés par voie orale, parentérale, telle que intraveineuse ou intrapéritonéale ou rectale.
Les compositions pour administration orale comprennent des comprimés, des pilules, des poudres ou des granulés. Dans ces compositions le produit actif selon l'invention
<Desc/Clms Page number 29>
est mélangé à un ou plusieurs diluants inertes tels que saccharose, lactose ou amidon.
Ces compositions peuvent comprendre des substances autres que les diluants, par exemple un lubrifiant tel que le stéarate de magnésium.
Ces compositions peuvent comprendre des substances autres que les diluants, par exemple un lubrifiant tel que le stéarate de magnésium.
Comme compositions liquides pour administration orale peuvent être utilisées des émulsions pharmaceutiquement acceptables, des solutions, des suspensions, des sirops, des élixirs contenant des diluants inertes tel que l'eau ou l'huile de paraffine.
Ces compositions peuvent également comprendre des substances autres que les diluants, par exemple des produits mouillants, édulcorants ou aromatisants.
Les compositions selon l'invention pour administration parentérale peuvent être des solutions stériles aqueuses ou non aqueuses, des suspensions ou des émulsions.
Comme solvant ou véhicule, on peut employer le propylèneglycol, un polyéthylèneglycol, des huiles végétales, en particulier l'huile d'olive ou des esters organiques injectables par exemple l'oléate d'éthyle. Ces compositions peuvent également contenir des adjuvants, en particulier des agents mouillants, émulsifiants et dispersants. La stérilisation peut se faire de plusieurs façons, par exemple à l'aide d'un filtre bactériologique, en incorporant à la composition des agents stérilisants ou par chauffage. Elles peuvent être également préparées sous forme de compositions solides stériles qui peuvent être dissoutes au moment de l'emploi dans de l'eau stérile ou tout autre milieu stérile injectable.
Les compositions pour administration rectale sont des suppositoires qui peuvent contenir, outre le produit actif, des excipients tels que le beurre de cacao.
Les doses utilisées pour mettre en oeuvre les méthodes selon l'invention sont celles qui permettent un traitement prophylactique ou un maximum de réponse thérapeutique. Les doses varient selon la forme d'administration, le produit particulier sélectionné et les caractéristiques propres du sujet à traiter. En général, les doses sont celles qui sont thérapeutiquement efficaces pour le traitement des désordres dus à une prolifération cellulaire anormale, et notamment un traitement cytostatique. Les produits selon l'invention peuvent être administrés aussi souvent et aussi longtemps que nécessaire pour obtenir l'effet thérapeutique désiré.
<Desc/Clms Page number 30>
Généralement, les doses sont comprises, chez l'homme, entre 0,1et 10000 mg/kg par jour, préférentiellement comprises entre 100 et 2000 mg/kg par jour. Il est entendu que, pour choisir le dosage le plus approprié, devront être pris en compte la voie d'administration, le poids du malade, son état de santé général, son âge et tous les facteurs qui peuvent influer sur l'efficacité du traitement.
D'une façon générale, le médecin déterminera la posologie appropriée en fonction de l'âge, du poids et de tous les autres facteurs propres au sujet à traiter.
L'exemple 39 illustre des compositions selon l'invention.
Les exemples suivants sont présentés à titre illustratif et non limitatif de la présente invention.
Exemple 1
L'oxalate de 8N-[l-(S)-Carbamoyl-2-(4-chlorophényl)éthyl]-4-[l-(4-chlorobenzyl)- 1H-5-imidazolyl-méthylJ-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, peut être préparé en opérant de la façon suivante : A de 1,0 g de 8N-[I-(S)-Méthoxycarbonyl-2-(4-chlorophényl)éthyl]-4-[I-(4-
chlorobenzyl)-1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8- carboxamide on ajoute en autoclave 25 cm' d'une solution saturée d'ammoniac dans le méthanol. Après 15 heures d'agitation à 55 C, l'autoclave est laissé refroidir à 20 C, puis le mélange réactionnel est concentré à sec sous pression réduite (2,7 kPa).
L'oxalate de 8N-[l-(S)-Carbamoyl-2-(4-chlorophényl)éthyl]-4-[l-(4-chlorobenzyl)- 1H-5-imidazolyl-méthylJ-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, peut être préparé en opérant de la façon suivante : A de 1,0 g de 8N-[I-(S)-Méthoxycarbonyl-2-(4-chlorophényl)éthyl]-4-[I-(4-
chlorobenzyl)-1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8- carboxamide on ajoute en autoclave 25 cm' d'une solution saturée d'ammoniac dans le méthanol. Après 15 heures d'agitation à 55 C, l'autoclave est laissé refroidir à 20 C, puis le mélange réactionnel est concentré à sec sous pression réduite (2,7 kPa).
Le résidu est repris par 10 cm d'acétate d'éthyle, la suspension résultante filtrée. Le filtrat, concentré à sec sous pression réduite (2,7 kPa), est redissous dans 60 cm d'éthanol, et additionné à chaud d'une solution de 0,300 g d'acide oxalique dans 5 cm d'éthanol. Les cristaux obtenus après agitation du mélange à 5 C, sont filtrés, lavés par 5 cm3 d'éthanol et 20 cm3 d'oxyde de diéthyle, puis essorés et séchés sous pression réduite (0,7 kPa) à 40 C. On obtient 0,83 g d'oxalate de 8N-[1-(S)-
Carbamoyl-2-( 4-chlorophényl)éthyl]-4-[ 1-(4-chlorobenzyl)- 1 H-5-imidazolyl-méthyl]- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme de cristaux blanc cassé.
Carbamoyl-2-( 4-chlorophényl)éthyl]-4-[ 1-(4-chlorobenzyl)- 1 H-5-imidazolyl-méthyl]- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme de cristaux blanc cassé.
<Desc/Clms Page number 31>
Spectre de masse : IE m/z = 563 M* 'H RMN (500 MHz, DMSO-d6) : S en ppm : 2,95 ( 1H, dd, J=8 et 14Hz), 3,09 (1H, dd, J=5 et 14Hz), 3,17 (2H, m), 4,10 (1H, m), 4,18 (1H, m), 4,35 (2H, m), 4,65 (1H, m), 5,31 (2H, s), 6,72 ( 1 H, dd, J=7 et 2Hz), 6,76 (1H, t, J=7Hz), 7,04 (1H, dd, J=7 et 2Hz), 7,07 (1H, s), 7,13(1H, s), 7,18 (2H, d, J=7Hz), 7,25 (2H, d, J=7Hz), 7,33 (2H, d, J=7Hz), 7,42 (2H, d, J=7Hz), 7,51 (1H, s), 8,18, ( 1 H, d, J=6Hz), 8,20 (1H, s).
Le 8N-[ 1 -(S)-méthoxycarbonyl-2-(4-chlorophényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1 H- 5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][l ,4]oxazine-8-carboxamide peut être préparé en opérant de la façon suivante : A une solution de 0,92 g d'acide 4-[l -(4-chlorobenzyl)- lH-5-imidazolyl-méthyl]-3, 4dihydro-2H-benzo[b][1,4]oxazine-8-carboxylique dans 30 cm de dichlorométhane, on ajoute 0,534 g de chlorhydrate de (L)-4-chlorophénylalaninate de méthyle, et 0,575 g de chlorhydrate de 1-(3-diméthylaminopropyl)-3-éthylcarbodiimide. Après 20 heures d'agitation à 20 C, le mélange réactionnel est concentré à sec sous pression réduite (2,7 kPa), repris par 100 cm' d'acétate d'éthyle et la solution obtenue est lavée par 50 cm3d'eau. La phase aqueuse est extraite par 50 cm' d'acétate d'éthyle, et les phases organiques réunies sont lavées par 50 cm3de saumure, séchées sur sulfate de magnésium, puis concentrées à sec sous pression réduite (2,7 kPa). Le résidu est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,06 mm, diamètre 2 cm, hauteur 35 cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange de dichlorométhane et de méthanol (98 / 2 en volumes), et en recueillant des fractions de 15 cm . Les fractions 12 à 22 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On obtient 1,05 g de 8N-[I-(S)-Méthoxycarbonyl-2-(4-
chlorophényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H- benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'une meringue blanche.
chlorophényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H- benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'une meringue blanche.
Spectre de masse : IE m/z = 578 M+ Le chlorhydrate de (L)-4-chlorophénylalaninate de méthyle peut être préparé en opérant de la façon suivante : A une bouillie épaisse de 25 g de (L)-4-
<Desc/Clms Page number 32>
chlorophénylalanine dans 175 cm' de méthanol, on envoie un courant gazeux d'acide chlorhydrique pendant 1 heure en maintenant la température à 15 C environ, puis porte à 50 C la solution obtenue pendant 1 heure. Après 48 heures supplémentaires d'agitation à 20 C, le mélange réactionnel est refroidi à 0 C, et filtré. Le solide est lavé avec 10 cm' de méthanol, puis avec 50 cm' d'oxyde de diéthyle, essoré et séché sous pression réduite (2,7 kPa) à 40 C. On obtient 14 g de chlorhydrate de (L)-4chlorophénylalaninate de méthyle, sous la forme de cristaux blancs.
L'acide 4-[1 -(4-chlorobenzyl)-1 1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b] [1,4]oxazine-8-carboxylique peut être préparé en opérant de la façon suivante : A une solution de 2,0 g 4-[I-(4-chlorobenzyl)-IH-5-imidazolyl-méthyl]-3,4-dihydro- 2H-benzo[b][1,4]oxazine-8-carboxylate de méthyle dans 25 cm de méthanol, on ajoute 12,5 cm3 d'hydroxyde de sodium IN. Après 2 heures et 15 minutes d'agitation du mélange réactionnel à la température du reflux, le méthanol est chassé sous pression réduite (2,7 kPa). Le mélange résultant est dilué avec 50 cm d'eau, additionné de 100 cm3 d'acétate d'éthyle, et neutralisé en agitant avec 12,5 cm3 d'acide chlorhydrique IN. La phase organique est décantée, la phase aqueuse est réextraite avec 50 cm3 d'acétate d'éthyle. Les phases organiques réunies, sont lavées par 2 fois 50 cm3 d'eau, 50 cm3de saumure, séchées sur sulfate de magnésium, puis concentrées à sec sous pression réduite (2,7 kPa). On obtient 0,92 g d'acide 4-[1-(4-
chlorobenzyl)-1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8carboxylique, sous la forme d'un solide jaune.
chlorobenzyl)-1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8carboxylique, sous la forme d'un solide jaune.
Le 4-[ 1 -(4-chlorobenzyl)-1 1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b] [1,4]oxazine-8-carboxylate de méthyle peut être préparé en opérant de la façon suivante : A une solution de 3,4 g de 3-[I-(4-chlorobenzyl)-IH-5-imidazolyl-méthylamino] salicylate de méthyle dans 55 cm3de diméthylformamide, on ajoute 0,87 cm de dibromo-1,2-éthane et 2,8 g de carbonate de potassium. Après 24 heures d'agitation à 70 C, Le mélange réactionnel est refroidi à 20 C, dilué avec 200 cm3d'acétate
<Desc/Clms Page number 33>
d'éthyle et agité avec 100 cm d'eau. La phase organique est décantée, lavée par 2 fois 100 cm3 d'eau, 100 cm' de saumure, séchée puis concentrée à sec sous pression réduite (2,7 kPa). L'huile obtenue est chromatographiée sur une colonne de gel de silice (granulométrie 0,04 - 0,06 mm, diamètre 4 cm, hauteur 20 cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange de dichlorométhane et de méthanol (98 / 2 en volumes), et en recueillant des fractions de 35 cm . Les fractions 7 à 25 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On obtient 2,0 g de 4-[1-
(4-chlorobenzyl)-lH-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][l,4]oxazine-8- carboxylate de méthyle, sous la forme d'une huile brun clair utilisée telle quelle à l'étape suivante.
(4-chlorobenzyl)-lH-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][l,4]oxazine-8- carboxylate de méthyle, sous la forme d'une huile brun clair utilisée telle quelle à l'étape suivante.
Spectre de masse : IE m/z = 397 M+ Le 3-[I-(4-chlorobenzyl)-IH-5-imidazolyl-méthylamino] salicylate de méthyle peut être préparé en opérant de la façon suivante : A une solution de 3,34 g de 3-amino-salicylate de méthyle dans 100 cm' de
dichlorométhane, on ajoute 4,84 g de l-(4-chlorobenzyI)-lH-5-imidazolyl- carboxaldéhyde et 6,4 g de triacétoxyborohydrure de sodium. Après 48 heures d'agitation à 20 C, le mélange réactionnel est filtré sur celite, le filtrat lavé par 2 fois 150 cm' d'eau et par 100 cm' de saumure, séché sur sulfate de magnésium, puis concentré à sec sous pression réduite (2,7 kPa). L'huile jaune brun obtenue est chromatographiée sur une colonne de gel de silice (granulométrie 0,04 - 0,06 mm, diamètre 4 cm, hauteur 20 cm), en éluant sous une pression d'argon de 0,5 bar avec du dichlorométhane, et en recueillant des fractions de 35 cm . Les fractions 32 à 42 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On obtient 3,44 g de
3-[1-(4-chlorobenzyl)-1H-5-imidazolyl-méthylamino] salicylate de méthyle, sous la forme de cristaux de couleur crème.
dichlorométhane, on ajoute 4,84 g de l-(4-chlorobenzyI)-lH-5-imidazolyl- carboxaldéhyde et 6,4 g de triacétoxyborohydrure de sodium. Après 48 heures d'agitation à 20 C, le mélange réactionnel est filtré sur celite, le filtrat lavé par 2 fois 150 cm' d'eau et par 100 cm' de saumure, séché sur sulfate de magnésium, puis concentré à sec sous pression réduite (2,7 kPa). L'huile jaune brun obtenue est chromatographiée sur une colonne de gel de silice (granulométrie 0,04 - 0,06 mm, diamètre 4 cm, hauteur 20 cm), en éluant sous une pression d'argon de 0,5 bar avec du dichlorométhane, et en recueillant des fractions de 35 cm . Les fractions 32 à 42 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On obtient 3,44 g de
3-[1-(4-chlorobenzyl)-1H-5-imidazolyl-méthylamino] salicylate de méthyle, sous la forme de cristaux de couleur crème.
Spectre de masse : IE m/z = 371 M+ Le 3-amino-salicylate de méthyle peut être préparé en opérant de la façon suivante :
<Desc/Clms Page number 34>
A une solution chauffée à 70 C de 51,0 g de 3-nitro salicylate de méthyle dans 500 cm' d'acide acétique et 50 cm d'eau, on ajoute en 1 heure par petites fractions,
72,5 g de fer en poudre. Le mélange, après 3 heures et 30 minutes d'agitation à la température du reflux, est laissé pendant 20 heures à 20 C, puis concentré à sec sous pression réduite (2,7 kPa). Le résidu, repris par 1,0 litre d'eau et 1,0 litre d'acétate d'éthyle, est agité, alcalinisé avec de l'hydroxyde de sodium ION filtré sur célite, en rincant celle ci avec 2 fois 500 cmd'eau et 2 fois 50 cmd'acétate d'éthyle. Les phases organiques réunies sont lavées par 2 fois 500 cm3 de saumure, séchées sur sulfate de magnésium avec du noir 3S, puis concentrées à sec sous pression réduite (2,7 kPa). Les cristaux bruns obtenus sont chromatographiés sur une colonne de gel de silice (granulométrie 0,06 - 0,200 mm, diamètre 7 cm, hauteur 35 cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange de cyclohexane et d'acétate d'éthyle (80 / 20 en volumes), et en recueillant des fractions de 250 cm . Les fractions 7 à 18 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On obtient
13 g de 3-amino-salicylate de méthyle, sous la forme de cristaux blancs fondant à 90 C.
72,5 g de fer en poudre. Le mélange, après 3 heures et 30 minutes d'agitation à la température du reflux, est laissé pendant 20 heures à 20 C, puis concentré à sec sous pression réduite (2,7 kPa). Le résidu, repris par 1,0 litre d'eau et 1,0 litre d'acétate d'éthyle, est agité, alcalinisé avec de l'hydroxyde de sodium ION filtré sur célite, en rincant celle ci avec 2 fois 500 cmd'eau et 2 fois 50 cmd'acétate d'éthyle. Les phases organiques réunies sont lavées par 2 fois 500 cm3 de saumure, séchées sur sulfate de magnésium avec du noir 3S, puis concentrées à sec sous pression réduite (2,7 kPa). Les cristaux bruns obtenus sont chromatographiés sur une colonne de gel de silice (granulométrie 0,06 - 0,200 mm, diamètre 7 cm, hauteur 35 cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange de cyclohexane et d'acétate d'éthyle (80 / 20 en volumes), et en recueillant des fractions de 250 cm . Les fractions 7 à 18 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On obtient
13 g de 3-amino-salicylate de méthyle, sous la forme de cristaux blancs fondant à 90 C.
Spectre de masse : IE m/z = 167 M+ Le 3-nitro salicylate de méthyle peut être préparé en opérant de la façon suivante : A une suspension de 50,0 g d'acide 3-nitro salicylique dans 200 cm' de méthanol, on coule en 10 minutes 8,5 cmd'acide sulfurique concentré. Après 20 heures d'agitation au reflux, le mélange réactionnel refroidi à 5 C est versé avec précaution sur 1,4 litre d'eau, puis la suspension obtenue est filtrée et le solide laissé sécher sur claie à l'air.
On obtient 51,0 g de 3-nitro salicylate de méthyle, sous la forme de cristaux jaune clair, fondant à 132 C.
Spectre de masse : IE m/z = 197 M+
Le 1-(4-chlorobenzyl)-1 H-5-imidazolyl-carboxaldéhyde peut être préparé en opérant de la façon suivante :
Le 1-(4-chlorobenzyl)-1 H-5-imidazolyl-carboxaldéhyde peut être préparé en opérant de la façon suivante :
<Desc/Clms Page number 35>
A une solution de 23,0 g de 1-(4-chlorobenzyl) 5-hydroxyméthyl imidazole dans 200 cm' de 1,4-dioxane, on ajoute 36,0 g de dioxyde de manganèse. Après 24 heures d'agitation à la température du reflux, le mélange réactionnel est refroidi à 20 C, filtré sur célite, et le filtrat concentré à sec sous pression réduite (2,7 kPa). La pâte brune obtenue est reprise en tiédissant par 250 cm3 d'oxyde de diéthyle, la suspension résultante est filtrée sur célite, et le filtrat est concentré à sec sous pression réduite
(2,7 kPa). On obtient 17,2 g de l-(4-chlorobenzyl)-lH-5-imidazolyl-carboxaldéhyde, sous la forme de cristaux orange, fondant à 85 C.
(2,7 kPa). On obtient 17,2 g de l-(4-chlorobenzyl)-lH-5-imidazolyl-carboxaldéhyde, sous la forme de cristaux orange, fondant à 85 C.
Le 1-(4-chlorobenzyl)-5-hydroxyméthylimidazole peut être préparé en opérant de la façon suivante : A 1,5 litre d'acide nitrique à 30 % refroidi à 8 C on ajoute par petites fractions en 45 minutes, 82 g de 1-(4-chlorobenzyl) 5-hydroxyméthyl 2-mercapto imidazole. Après 30 minutes à froid, le mélange, additionné de 100 cm3 d'acide nitrique à 30 %, est amené à 40 C puis laissé revenir à température ambiante. Après 20 heures d'agitation à 20 C, le mélange réactionnel est filtré, et le filtrat refroidi à 0 C est alcalinisé lentement en maintenant la température vers 20 C, avec 1 litre d'hydroxyde de sodium à 30 %. La suspension obtenue est filtrée, le solide est lavé avec de l'eau puis séché à l'air sur claie. On obtient 28,2 g de 1-(4-chlorobenzyl)-5-hydroxyméthyl imidazole, sous la forme d'un solide crème, fondant à 139 C.
Le 1-(4-chlorobenzyl)-5-hydroxyméthyl2-mercapto imidazole peut être préparé en opérant de la façon suivante : A une solution fortement agitée et refroidie à 10 C de 200 g de 4-chlorobenzylamine dans 1 litre d'éthanol, on coule goutte à goutte 140 cm' d'acide acétique, laisse revenir le mélange à 20 C puis ajoute en 5 minutes 108 g de dihydroxyacétone et 181 g de thiocyanate de potassium. Après 48 heures d'agitation à 20 C, la suspension noire obtenue est filtrée, le solide est lavé avec de l'éthanol jusqu'à obtention d'un filtrat incolore, puis rincé avec de l'oxyde de diisopropyle, essoré et séché à l'air sur claie. On obtient 75,6 g de 1-(4-chlorobenzyl) 5-hydroxyméthyl 2-mercapto imidazole, sous la forme de cristaux beiges fondant à 242 C.
<Desc/Clms Page number 36>
Exemple 2
L'oxalate de 8N-[ 1 -(S)-Carbamoyl-2-(4-méthoxyphényl)éthyll-4-[3-(4chlorobenzyl)-4-pyridylméthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 1, à partir de 0,850 g de 8N-[ 1-(S)-méthoxycarbonyl-2-(4-méthoxyphényl)éthyl]-4-[3-(4-chlorobenzyl)-4- pyridylméthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, et de 30 cm3 d'une solution saturée d'ammoniac dans le méthanol. Le produit brut est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 1,6 cm, hauteur 15 cm), en éluant sous une pression d'argon de 0,5 bar avec de l'acétate d'éthyle, puis avec un mélange d'acétate d'éthyle et de méthanol (98 / 2 puis 96 / 4 en volumes) et en recueillant des fractions de 15 cm . Les fractions 22 à 46 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). La meringue blanche obtenue est dissoute dans 3 cm' d'éthanol, additionnée en tiédissant d'une solution de 0,070 g d'acide oxalique dans 3 cm' d'éthanol. Après une heure d'agitation, les cristaux formés sont filtrés, lavés avec 3 cm3 d'éthanol puis par 2 fois 5 cm' d'oxyde de diéthyle. Les cristaux sont essorés, séchés sous pression réduite (0,7 kPa) à 40 C. On obtient 0,250 g d'oxalate de 8N-[I-(S)-Carbamoyl-2-(4- méthoxyphényl)éthyl]-4-[3-(4-chlorobenzyl)-4-pyridylméthyl]-3,4-dihydro-2H- benzo[b][1,4]oxazine-8-carboxamide, sous la forme de cristaux jaunes fondant à 190 C.
L'oxalate de 8N-[ 1 -(S)-Carbamoyl-2-(4-méthoxyphényl)éthyll-4-[3-(4chlorobenzyl)-4-pyridylméthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 1, à partir de 0,850 g de 8N-[ 1-(S)-méthoxycarbonyl-2-(4-méthoxyphényl)éthyl]-4-[3-(4-chlorobenzyl)-4- pyridylméthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, et de 30 cm3 d'une solution saturée d'ammoniac dans le méthanol. Le produit brut est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 1,6 cm, hauteur 15 cm), en éluant sous une pression d'argon de 0,5 bar avec de l'acétate d'éthyle, puis avec un mélange d'acétate d'éthyle et de méthanol (98 / 2 puis 96 / 4 en volumes) et en recueillant des fractions de 15 cm . Les fractions 22 à 46 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). La meringue blanche obtenue est dissoute dans 3 cm' d'éthanol, additionnée en tiédissant d'une solution de 0,070 g d'acide oxalique dans 3 cm' d'éthanol. Après une heure d'agitation, les cristaux formés sont filtrés, lavés avec 3 cm3 d'éthanol puis par 2 fois 5 cm' d'oxyde de diéthyle. Les cristaux sont essorés, séchés sous pression réduite (0,7 kPa) à 40 C. On obtient 0,250 g d'oxalate de 8N-[I-(S)-Carbamoyl-2-(4- méthoxyphényl)éthyl]-4-[3-(4-chlorobenzyl)-4-pyridylméthyl]-3,4-dihydro-2H- benzo[b][1,4]oxazine-8-carboxamide, sous la forme de cristaux jaunes fondant à 190 C.
Spectre de masse : IE m/z = 570 M+ 'H NMR (400 MHz, DMSO-d6) : # en ppm : 2,95(1H, dd, J=8 et I4Hz), 3,09 (1H, dd, J=5 et 14Hz), 3,47 (2H, m), 3,77 (3H, s), 4,16 (2H, s), 4,32 (1H, m), 4,40 (1H, m), 4,48 (2H, s), 4,65 (1H, m), 6,20 (1H, dd, J=7 et 2Hz), 6,67 (1H, t, J=7Hz), 6,90 (2H, d, J=7Hz), 7,04 (1H, dd, J=7 et 2Hz), 7,15 (1H, s), 7,20 (3 H, m), 7,29 (2H, d, J=7Hz),
7,45 (2H, d, J=7Hz), 7,52 ( 1 H, s), 8,25, ( 1 H, d, J=6Hz), 8,45 ( 1 H, m), 8,50 ( 1 H, m).
7,45 (2H, d, J=7Hz), 7,52 ( 1 H, s), 8,25, ( 1 H, d, J=6Hz), 8,45 ( 1 H, m), 8,50 ( 1 H, m).
<Desc/Clms Page number 37>
Le 8N-[1-(S)-méthoxycarbonyl-2-(4-méthoxyphényl)-éthyl]-4-[3-(4-chlorobenzyl)-4pyridylméthyl]-3,4-dihydro-2H-benzo[bJ[1,4]oxazine-8-carboxamide peut être préparé en opérant de la façon suivante : A une solution de 0,900 g de 4-[3-(4-chlorobenzyl)-4-pyridylméthyl]-3,4-dihydro- 2H-benzo[b][l,4]oxazine-8-carboxylate de sodium pur à 87 %, dans 30 cm' de dichlorométhane, on ajoute 0,525 g de chlorhydrate de (L)-4-méthoxyphénylalaninate de méthyle, 0,430 g de chlorhydrate de 1-(3-diméthylaminopropyl)- 3-éthylcarbodiimide, 0,675 cm' de N-diisopropyléthylamine et 10 mg d'hydrate de benzotriazole. Après 20 heures d'agitation à 20 C, le mélange réactionnel est concentré à sec sous pression réduite (2,7 kPa), le résidu est additionné de 100 cm' d'acétate d'éthyle et 50 cm d'eau. Après agitation, la phase organique est décantée, lavée par 50 cm d'eau, séchée sur sulfate de magnésium, et concentrée à sec sous pression réduite (2,7 kPa). Le résidu est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 1,6 cm, hauteur 14 cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange d'acétate d'éthyle et de cyclohéxane (60/ 40 en volumes) et en recueillant des fractions de 15 cm . Les fractions 6 à 15 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On
obtient 0,85 g de 8N-[1-(S)-méthoxycarbonyl-2-(4-méthoxyphényl)éthyl]-4-[3-(4chlorobenzyl)-4-pyridylméthyl]-3,4-dihydro-2H-benzo[bJ [ 1,4]oxazine-8- carboxamide, sous la forme d'une meringue jaune.
obtient 0,85 g de 8N-[1-(S)-méthoxycarbonyl-2-(4-méthoxyphényl)éthyl]-4-[3-(4chlorobenzyl)-4-pyridylméthyl]-3,4-dihydro-2H-benzo[bJ [ 1,4]oxazine-8- carboxamide, sous la forme d'une meringue jaune.
Le chlorhydrate de (L) -4-méthoxy-phénylalaninate de méthyle, peut être préparé en opérant de la façon suivante : A une solution de 14,0 g de N-tertiobutyloxycarbonyl-(L)-4-méthoxyphénylalaninate de méthyle dans 100 cm' de 1,4-dioxane, on ajoute lentement 30 cm3 d'une solution d'acide chlorhydrique 5,5N dans le 1,4-dioxane puis 1 cm3 d'eau.. Après 1 heure et 30 minutes d'agitation à 20 C, le mélange réactionnel est concentré à sec sous pression réduite (2,7 kPa). Le résidu est repris par 100 cm3 de d'oxyde de diéthyle, la suspension est filtrée, le solide essoré puis séché sous pression réduite (2,7 kPa). On
<Desc/Clms Page number 38>
obtient 10,2 g de chlorhydrate de (L)-4-méthoxy-phénylalaninate de méthyle, sous la forme d'un solide blanc cassé.
Le N-tertiobutyloxycarbonyl-(L)-4-méthoxyphénylalaninate de méthyle peut être préparé en opérant de la façon suivante :
A une solution de 12,9 g de N-tertiobutyloxycarbonyl-(L)-tyrosine, dans 100 cm3 de
N,N-diméthylformamide, on ajoute en agitant 60 g de carbonate de césium, puis coule goutte à goutte en maintenant la température à 20 C, 17 cm' de diméthylsulfate.
A une solution de 12,9 g de N-tertiobutyloxycarbonyl-(L)-tyrosine, dans 100 cm3 de
N,N-diméthylformamide, on ajoute en agitant 60 g de carbonate de césium, puis coule goutte à goutte en maintenant la température à 20 C, 17 cm' de diméthylsulfate.
Après 20 heures d'agitation à 20 C, on rajoute au mélange 10 cm3 de diméthylsulfate, agite encore 1 heure, et dilue avec 250 cm d'acétate d'éthyle. Le mélange est lavé par 2 fois 250 cm' d'eau, puis par 250 cm de saumure, séché sur sulfate de magnésium et concentré à sec sous pression réduite (2,7 kPa). Le résidu est repris par 250 cm d'acétate d'éthyle, la solution résultante lavée par 2 fois 250 cm d'ammoniaque à 15 % puis par 250 cm de saumure, séchée sur sulfate de magnésium et concentrée à sec sous pression réduite (2,7 kPa) à 40 C. On obtient 14 g de N-tertiobutyloxycarbonyl-(L)-4-méthoxyphénylalaninate de méthyle, sous la forme de cristaux blancs.
Le 4-[3-(4-chlorobenzyl)-4-pyridylméthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8carboxylate de sodium pur à 87 % peut être préparé en opérant de la façon suivante : A une solution de 0,760 g de, 4-[3-(4-chlorobenzyl)-4-pyridylméthyl]-3,4-dihydro- 2H-benzo[b][1,4]oxazine-8-carboxylate de méthyle dans 25 cm' de méthanol, on ajoute 2 cm3 d'hydroxyde de sodium IN. Après 2 heures d'agitation à 20 C, puis 5 heures de reflux, le mélange est concentré sous pression réduite à volume réduit (10 cm3) puis additionné de 10 cm3 de tétrahydrofurane et 1,86 cm3 d'hydroxyde de sodium IN. Après 2 heures de reflux supplémentaires, le mélange est refroidi à 5 C, amené à pH 6-7 avec 2 cm' d'acide chlohydrique IN puis concentré à sec sous pression réduite (2,7kPa). On obtient 0,90 g de 4-[3-(4-chlorobenzyl)-4- pyridylméthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium, pur à 87 %, qui sera utilisé tel quel.
<Desc/Clms Page number 39>
Spectre de masse : LSIMS m/z = 395 MH+, m/z = 417 MNa+ Le 4-[3-(4-chlorobenzyl)-4-pyridylméthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8carboxylate de méthyle peut être préparé en opérant comme il est décrit pour la
préparation du 4-[1-(4-chlorobenzyl)-1H-5-imidazolyl-méthyl]-3,4-dihydro-2H- benzo[b][1,4]oxazine-8-carboxylate de méthyle, dans l'exemple 1, à partir de 2,2 g de 4-[3-(4-chlorobenzyl)-4-pyridylméthylamino] salicylate de méthyle, 100 cm3 de N,Ndiméthylformamide, 1,74 g de carbonate de potassium, et 0,54 cm3 de dibromo-1,2- éthane. Le produit brut (0,80 g) est chromatographié par CLHP, sur une colonne de gel de silice, (granulométrie 0,01 mm, diamètre 4 cm, hauteur 20 cm), en éluant avec un débit de 50 cm3 par minute avec un mélange de cyclohexane et d'acétate d'éthyle (45 / 55 en volumes) et en recueillant des fractions de 100 cm . On obtient 0,280 g de
4-[3-(4-chlorobenzyl)-4-pyridinylméthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8- carboxylate de méthyle, sous la forme d'une huile jaunâtre.
préparation du 4-[1-(4-chlorobenzyl)-1H-5-imidazolyl-méthyl]-3,4-dihydro-2H- benzo[b][1,4]oxazine-8-carboxylate de méthyle, dans l'exemple 1, à partir de 2,2 g de 4-[3-(4-chlorobenzyl)-4-pyridylméthylamino] salicylate de méthyle, 100 cm3 de N,Ndiméthylformamide, 1,74 g de carbonate de potassium, et 0,54 cm3 de dibromo-1,2- éthane. Le produit brut (0,80 g) est chromatographié par CLHP, sur une colonne de gel de silice, (granulométrie 0,01 mm, diamètre 4 cm, hauteur 20 cm), en éluant avec un débit de 50 cm3 par minute avec un mélange de cyclohexane et d'acétate d'éthyle (45 / 55 en volumes) et en recueillant des fractions de 100 cm . On obtient 0,280 g de
4-[3-(4-chlorobenzyl)-4-pyridinylméthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8- carboxylate de méthyle, sous la forme d'une huile jaunâtre.
Spectre de masse : IE m/z = 408 M+ Le 4-[3-(4-chlorobenzyl)-4-pyridylméthylamino] salicylate de méthyle peut être préparé en opérant de la façon suivante : A une solution de 6,0 g de 4-[3-(4-chlorobenzyl)-4-pyridylimino] salicylate de méthyle dans 60 cm' de méthanol, on ajoute par petites fractions 0,60 g de borohydrure de sodium. Après 20 heures d'agitation à 20 C, Le mélange réactionnel est additionné de 0,60 g de borohydrure de sodium, agité pendant 1 heure et 30 minutes à 20 C, puis concentré à sec sous pression réduite (2,7 kPa). Le résidu est repris par 100 cm3 d'eau et 150 cm3d'acétate d'éthyle. Après agitation, la phase organique est décantée, lavée par 2 fois 75 cm3d'eau, par 75 cm3de saumure, puis séchée sur sulfate de magnésium et concentrée à sec sous pression réduite (2,7 kPa).
Le résidu est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 3,6 cm, hauteur 20 cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange d'acétate d'éthyle et de cyclohexane (20 / 80 en volumes) et en recueillant des fractions de 50 cm . Les fractions 15à 22 sont réunies et
<Desc/Clms Page number 40>
concentrées à sec sous pression réduite (2,7 kPa). On obtient 2,2 g de 4-[3-(4-
chlorobenzyl)-4-pyridylméthylamino] salicylate de méthyle, sous la forme de cristaux jaunes.
chlorobenzyl)-4-pyridylméthylamino] salicylate de méthyle, sous la forme de cristaux jaunes.
Spectre de masse : IE m/z = 382 M+
Le 3-[3-f4-chlorobenzyO-4-pyridylirnino] salicylate de méthyle peut être préparé en opérant de la façon suivante :
A une solution de 4,6 g de 3-(4-chlorobenzyl)-4-pyridylcarboxaldéhyde dans 50 cm3 de méthanol, on ajoute 3,34 g de 3-amino-salicylate de méthyle. Après 20 heures d'agitation à 20 C, le mélange réactionnel est concentré à sec sous pression réduite (2,7 kPa), repris par 100 cm d'eau et 150 cm3 d'acétate d'éthyle. Après agitation, la phase organique est décantée, lavée par 100 cm' de saumure, séchée sur sulfate de magnésium, puis concentrée à sec sous pression réduite (2,7 kPa). Le résidu est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 4 cm, hauteur 28 cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange d'acétate d'éthyle et de cyclohexane (30/ 70 en volumes) et en recueillant des fractions de 100 cm . Les fractions 8 à 19 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On obtient 6,23 g de 4-[3-(4-chlorobenzyl)-4pyridylimino] salicylate de méthyle, sous la forme d'une huile orangée.
Le 3-[3-f4-chlorobenzyO-4-pyridylirnino] salicylate de méthyle peut être préparé en opérant de la façon suivante :
A une solution de 4,6 g de 3-(4-chlorobenzyl)-4-pyridylcarboxaldéhyde dans 50 cm3 de méthanol, on ajoute 3,34 g de 3-amino-salicylate de méthyle. Après 20 heures d'agitation à 20 C, le mélange réactionnel est concentré à sec sous pression réduite (2,7 kPa), repris par 100 cm d'eau et 150 cm3 d'acétate d'éthyle. Après agitation, la phase organique est décantée, lavée par 100 cm' de saumure, séchée sur sulfate de magnésium, puis concentrée à sec sous pression réduite (2,7 kPa). Le résidu est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 4 cm, hauteur 28 cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange d'acétate d'éthyle et de cyclohexane (30/ 70 en volumes) et en recueillant des fractions de 100 cm . Les fractions 8 à 19 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On obtient 6,23 g de 4-[3-(4-chlorobenzyl)-4pyridylimino] salicylate de méthyle, sous la forme d'une huile orangée.
Spectre de masse : IE m/z = 369 M+ Le 3-(4-chlorobenzyl)-4-pyridylcarboxaldéhyde peut être préparé en opérant comme il est décrit dans l'exemple 1, pour la préparation du 1-(4-chlorobenzyl)-1 H-5imidazolyl-carboxaldéhyde, à partir de 4,7 g de 3-(4-chlorobenzyl)-4-hydroxyméthylpyridine, 125 cm' de dioxane, et 5,66 g de dioxyde de manganèse. On obtient 4,4 g de 3-(4-chlorobenzyl)-4-pyridylcarboxaldéhyde, sous la forme d'une huile jaune qui cristallise à température ambiante.
Spectre de masse : IE m/z = 231 M+ Le 3-(4-chlorobenzyl)- 4-hydroxyméthyl-pyridine peut être préparé en opérant de la façon suivante :
<Desc/Clms Page number 41>
A une solution refroidie à +5 C de 16 g d'acide 3-(4-chlorobenzyl)-4-pyridyl- carboxylique dans 160 cm' de tétrahydrofurane, sous argon, on ajoute lentement par petites fractions 2,45 g d'hydrure de lithium et d'aluminium. Après 1 heure d'agitation à +5 C et 2 heures à 20 C, le mélange réactionnel à nouveau refroidi est additionné successivement en agitant de 2,5 cm' d'eau, 2,5 cm' d'hydroxyde de sodium 4N, 7,5 cm' d'eau. La phase organique est décantée, additionné de sulfate de magnésium filtré sur célite, puis le filtrat est concentré sous pression réduite (2,7 kPa). Le solide jaune obtenu est repris par 50 cm' d'acétate d'éthyle et 250 cm' d'oxyde de diéthyle. Après 15 minutes d'agitation, la suspension est filtrée, le filtrat concentré à sec. Le résidu est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 4 cm, hauteur 20 cm), en éluant sous une pression d'argon de 0,5 bar avec de l'acétate d'éthyle et en recueillant des fractions de 35 cm . Les fractions 13 à 35 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On obtient 4,7 g de 3-(4-chlorobenzyl)-4-hydroxyméthyl-pyridine, sous la forme de cristaux jaune clair.
L'acide 3-(4-chlorobenzyl)-4-pyridyl-carboxylique peut être préparé en opérant de la façon suivante : A 165 cm' d'acide iodhydrique, on ajoute 98 cm' d'acide hypophosphoreux. A ce mélange refroidi à -5 C on coule goutte à goutte 354 cm d'anhydride acétique sans dépasser la température de +10 C. On ajoute par petites fractions, 29 g de 1- oxo 3(4chlorophényl) IH,3H furo[3,4-c]pyridine, chauffe le mélange au reflux pendant 1 heure et 30 minutes puis laisse refroidir à 20 C et concentre à sec sous pression réduite (2,7 kPa). Le résidu est repris par 1 litre d'eau, la solution obtenue refroidie à +5 C est amenée à pH 4 avec de l'hydroxyde de sodium ION. La suspension jaune est filtrée, le solide lavé à l'eau est essoré puis séché à l'air sur claie. On obtient 24 g d'acide 3-(4-chlorobenzyl)-4-pyridyl-carboxylique, sous la forme de cristaux jaunes.
Spectre de masse :IE m/z = 247 M+
<Desc/Clms Page number 42>
Le 1-oxo 3(4-chlorophényl) 1H,3H furo[3,4-c]pyridine peut être préparé en opérant de la façon suivante :
A une solution refroidie à -75 C de 37 g de N-phényl-4-pyridyl carboxamide, 47,7 g de tétraméthylènediamine dans 1 litre de tétrahydrofurane, on coule goutte à goutte sous argon 257 cm3 d'une solution de n-butyllithium 1,6M dans l'héxane. Après 15 minutes d'agitation à -75 C, le mélange est amené à 0 C pendant 10 minutes, refroidi à nouveau à -75 C et additionné goutte à goutte d'une solution de 26,3 g de
4-chlorobenzaldéhyde dans 200 cm3 de tétrahydrofurane. La solution jaune obtenue est laissée revenir à 0 C, puis est additionnée de 1 litre d'eau et 1 litre d'acétate d'éthyle. Après agitation, la phase organique est décantée, la phase aqueuse est réextraite avec 500 cm' d'acétate d'éthyle, et les phases organiques réunies sont lavées par 500 cm3 d'eau, 500 cm de saumure, puis séchées sur sulfate de magnésium et concentrées à sec sous pression réduite (2,7 kPa). Le résidu huileux est repris par 750 cm3 d'acide sulfurique à 10% et le mélange est chauffé au reflux pendant 20 heures. Le mélange résultant, refroidi à +5 C est extrait par 2 fois 300 cm3 d'oxyde de diéthyle, la phase aqueuse est amenée à pH 4 avec de l'hydroxyde de sodium ION, la suspension crème obtenue est agitée pendant 1 heure, filtrée, le solide lavé à l'eau, est essoré, puis séché à l'air sur claie. On obtient 29 g de 1- oxo 3(4-chlorophényl) 1 H,3H furo[3,4-c]pyridine, sous la forme de cristaux beige.
A une solution refroidie à -75 C de 37 g de N-phényl-4-pyridyl carboxamide, 47,7 g de tétraméthylènediamine dans 1 litre de tétrahydrofurane, on coule goutte à goutte sous argon 257 cm3 d'une solution de n-butyllithium 1,6M dans l'héxane. Après 15 minutes d'agitation à -75 C, le mélange est amené à 0 C pendant 10 minutes, refroidi à nouveau à -75 C et additionné goutte à goutte d'une solution de 26,3 g de
4-chlorobenzaldéhyde dans 200 cm3 de tétrahydrofurane. La solution jaune obtenue est laissée revenir à 0 C, puis est additionnée de 1 litre d'eau et 1 litre d'acétate d'éthyle. Après agitation, la phase organique est décantée, la phase aqueuse est réextraite avec 500 cm' d'acétate d'éthyle, et les phases organiques réunies sont lavées par 500 cm3 d'eau, 500 cm de saumure, puis séchées sur sulfate de magnésium et concentrées à sec sous pression réduite (2,7 kPa). Le résidu huileux est repris par 750 cm3 d'acide sulfurique à 10% et le mélange est chauffé au reflux pendant 20 heures. Le mélange résultant, refroidi à +5 C est extrait par 2 fois 300 cm3 d'oxyde de diéthyle, la phase aqueuse est amenée à pH 4 avec de l'hydroxyde de sodium ION, la suspension crème obtenue est agitée pendant 1 heure, filtrée, le solide lavé à l'eau, est essoré, puis séché à l'air sur claie. On obtient 29 g de 1- oxo 3(4-chlorophényl) 1 H,3H furo[3,4-c]pyridine, sous la forme de cristaux beige.
Spectre de masse : IE m/z = 245 M+ Le N-phényl-4-pyridyl- carboxamide peut être préparé en opérant de la façon suivante : A une suspension de 24,6 g d'acide isonicotinique dans 300 cm de dichlorométhane, on ajoute 35,6 g de NN'-carbonyldiimidazole. Après une heure d'agitation à 20 C, on ajoute 20,4 g d'aniline. Après 20 heures d'agitation à 20 C, le mélange réactionnel est concentré à sec sous pression réduite (2,7 kPa). Le résidu est agité avec 250 cm d'oxyde de diéthyle, la suspension est filtrée, le solide est lavé par 2 fois 50 cm' d'oxyde de diéthyle, essoré, lavé par 3 fois 250 cm3d'eau puis essoré et séché à l'air
<Desc/Clms Page number 43>
sur claie. On obtient 37 g de N-phényl-4-pyridylcarboxamide, sous la forme de cristaux beiges.
Spectre de masse : IE m/z = 198 M* Exemple 3
Le 8N-[ 1-(S)-Carbamoyl-2-(4-méthoxyphényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1 1 H-5- imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][ 1 ,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 1 pour la préparation du
8N-[ 1 -(S)-carbamoyl-2-(4-chlorophényl)éthyl]-4-[ 1 -(4-chlorobenzyl)-1 1 H-5imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, à partir de 0,74 g de 8N-[l-(S)-Méthoxycarbonyl-2-(4-méthoxyphényl)éthyl]-4-[l-(4chlorobenzyl)- lH-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][ 1,4]oxazine- 8-carboxamide, et de 30 cm3de solution saturée d'ammoniac dans le méthanol. Le produit brut est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 1,0 cm, hauteur 15cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange de dichlorométhane et de méthanol (98/ 2 en volumes) et en recueillant des fractions de 15 cm . Les fractions 11à 31 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). Le résidu est repris par 50 cm' d'acétate d'éthyle et la solution résultante agitée avec 50 cm' d'hydroxyde de sodium 0,1N. La phase organique est décantée, lavée par 50 cm' d'hydroxyde de sodium 0,1 N, 50 cm de saumure puis séchée sur sulfate de magnésium et contrée à sec sous
pression réduite (2,7 kPa). On obtient 0,42 g de 8N-[1-(S)-Carbamoyl-2-(4méthoxyphényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-3-oxo-3,4- dihydro-2H-benzo[b][l,4]oxazine-8-carboxamide, sous la forme d'une meringue blanche.
Le 8N-[ 1-(S)-Carbamoyl-2-(4-méthoxyphényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1 1 H-5- imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][ 1 ,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 1 pour la préparation du
8N-[ 1 -(S)-carbamoyl-2-(4-chlorophényl)éthyl]-4-[ 1 -(4-chlorobenzyl)-1 1 H-5imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, à partir de 0,74 g de 8N-[l-(S)-Méthoxycarbonyl-2-(4-méthoxyphényl)éthyl]-4-[l-(4chlorobenzyl)- lH-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][ 1,4]oxazine- 8-carboxamide, et de 30 cm3de solution saturée d'ammoniac dans le méthanol. Le produit brut est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 1,0 cm, hauteur 15cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange de dichlorométhane et de méthanol (98/ 2 en volumes) et en recueillant des fractions de 15 cm . Les fractions 11à 31 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). Le résidu est repris par 50 cm' d'acétate d'éthyle et la solution résultante agitée avec 50 cm' d'hydroxyde de sodium 0,1N. La phase organique est décantée, lavée par 50 cm' d'hydroxyde de sodium 0,1 N, 50 cm de saumure puis séchée sur sulfate de magnésium et contrée à sec sous
pression réduite (2,7 kPa). On obtient 0,42 g de 8N-[1-(S)-Carbamoyl-2-(4méthoxyphényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-3-oxo-3,4- dihydro-2H-benzo[b][l,4]oxazine-8-carboxamide, sous la forme d'une meringue blanche.
Spectre de masse : IE m/z = 573 M+ 'H NMR (400 MHz, DMSO-d6) : d en ppm : 2,95 ( 1H, dd, J=8 et 14Hz), 3,09 (1H, dd, J=5 et 14Hz), 3,77 (3H, s), 4,62 (2H, m), 4,71 (1H, d, J=14Hz), 5,11(2H, s), 5,33 (2H, s), 6,91 (2H, m), 6,92 (1H, s), 7,08 (1H, t, J=7Hz), 7,11 (2H, d, J=7Hz), 7,18
<Desc/Clms Page number 44>
(1H, s), 7,13 (3H, m), 7,40 (1H, dd, J=7et 1 Hz), 7,45 (2H, d, J=7Hz), 7,55 (1H, s), 7,80 (1 H, s), 8,13 (1 H, d, J=6Hz).
Le 8N-[ 1-(S)-Méthoxycarbonyl-2-(4-méthoxyphényl)éthyl]-4-[ 1-(4-chlorobenzyl)- 1 H-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 1, pour la préparation du 8N-[1-(S)-Méthoxycarbonyl-2-(4-chlorophényl)éthyl]-4-[1-(4chIorobenzyl)-lH-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][l,4]oxazine-8carboxamide, à partir de 0,86 g de 4-[ I -(4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-3- oxo-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium pur à 87 %, 30 cm 3 de dichlorométhane, 0,515 g de (L)-4-méthoxyphénylalaninate de méthyle, 0,43 g de chlorhydrate de 1-(3-diméthylaminopropyl)-3-éthylcarbodiimide, 0,675 cm' de N-éthyl diisopropylamine, et de 10 mg d'hydrate d'hydroxybenzotriazole. Le produit brut est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 2,2 cm, hauteur 22 cm), en éluant sous une pression d'argon de 0,5 bar avec de l'acétate d'éthyle, puis avec un mélange d'acétate d'éthyle et de méthanol (98/ 2 en volumes) et en recueillant des fractions de 35 cm . Les fractions 11à 17 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On
obtient 0,74 g de 8N-[I-(S)-Méthoxycarbonyl-2-(4-méthoxyphényl)éthyl]-4-[I-(4chIorobenzyl)-lH-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][l,4]oxazine- 8-carboxamide, sous la forme d'une meringue beige marron. Spectre de masse : IE m/z = 588 M*
Le 4-[1-(4-chlorobenzyl)-1H-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b] [1,4]oxazine-8-carboxylate de sodium pur à 87 % peut être préparé en opérant de la façon suivante :
A une solution de 0,75 g de 4-[I-(4-chlorobenzyl)-IH-5-imidazolyl-méthyl]-3-oxo- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de méthyle, dans 15 cm de tétrahydrofurane, on ajoute 3,6 cm d'hydroxyde de sodium IN. Après 20 heures d'agitation à 20 C, le mélange réactionnel est additionné de 3,6 cm' d'acide
obtient 0,74 g de 8N-[I-(S)-Méthoxycarbonyl-2-(4-méthoxyphényl)éthyl]-4-[I-(4chIorobenzyl)-lH-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][l,4]oxazine- 8-carboxamide, sous la forme d'une meringue beige marron. Spectre de masse : IE m/z = 588 M*
Le 4-[1-(4-chlorobenzyl)-1H-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b] [1,4]oxazine-8-carboxylate de sodium pur à 87 % peut être préparé en opérant de la façon suivante :
A une solution de 0,75 g de 4-[I-(4-chlorobenzyl)-IH-5-imidazolyl-méthyl]-3-oxo- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de méthyle, dans 15 cm de tétrahydrofurane, on ajoute 3,6 cm d'hydroxyde de sodium IN. Après 20 heures d'agitation à 20 C, le mélange réactionnel est additionné de 3,6 cm' d'acide
<Desc/Clms Page number 45>
chlorhydrique 0,5N, puis concentré à sec sous pression réduite (0,7 kPa) à 40 C. On
obtient 0,86g de 4-[1-(4-chlorobenzyl)-IH-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro- 2H-benzo[b][1,4]oxazine-8-carboxylate de sodium pur à 87 %, sous la forme d'une meringue jaune, qui est utilisée telle quelle.
obtient 0,86g de 4-[1-(4-chlorobenzyl)-IH-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro- 2H-benzo[b][1,4]oxazine-8-carboxylate de sodium pur à 87 %, sous la forme d'une meringue jaune, qui est utilisée telle quelle.
Le 4-[ 1-( 4-chlorobenzyl)-1 1 H-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b] [1,4]oxazine-8-carboxylate de méthyle peut être préparé en opérant de la façon suivante :
A une solution de 1,6 g de 3-[I-(4-chlorobenzyl)-5-imidazolyl-méthylaminol salicylate de méthyle dans 50 cm3 d'acétonitrile, on ajoute 0,41 cm de chlorure de chloroacétyle, puis 1,3 g de carbonate de potassium. Après 4 heures et 30 minutes de chauffage au reflux, le mélange réactionnel est concentré à sec sous pression réduite (2,7 kPa). Le résidu est repris par 100 cm d'acétate d'éthyle et 50 cm3 d'eau, le faible insoluble filtré, et le filtrat décanté.
A une solution de 1,6 g de 3-[I-(4-chlorobenzyl)-5-imidazolyl-méthylaminol salicylate de méthyle dans 50 cm3 d'acétonitrile, on ajoute 0,41 cm de chlorure de chloroacétyle, puis 1,3 g de carbonate de potassium. Après 4 heures et 30 minutes de chauffage au reflux, le mélange réactionnel est concentré à sec sous pression réduite (2,7 kPa). Le résidu est repris par 100 cm d'acétate d'éthyle et 50 cm3 d'eau, le faible insoluble filtré, et le filtrat décanté.
La phase organique est lavée par 50 cm' d'eau, 50 cm de saumure, puis séchée sur sulfate de magnésium et concentrée à sec sous pression réduite (2,7 kPa). Le résidu est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 3 cm, hauteur 15 cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange de dichlorométhane et de méthanol (97 / 3 en volumes) et en recueillant des fractions de 15 cm . Les fractions 6 à 11sont réunies et concentrées à sec sous
pression réduite (2,7 kPa). On obtient 0,75 g de 4-[I-(4-chlorobenzyl)-IH-5- imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de méthyle, sous la forme d'une huile jaune.
pression réduite (2,7 kPa). On obtient 0,75 g de 4-[I-(4-chlorobenzyl)-IH-5- imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de méthyle, sous la forme d'une huile jaune.
Spectre de masse : IE m/z = 411M+ Exemple 4
Le 8N-[ 1 -(S)-Carbamoyl-2-(4-méthoxyphényl)éthyI]-4-[ 1 -(4-méthyIbenzyl)- 1 H-5imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][l,4]oxazine-8-carboxamide, peut être préparé en opérant comme il est décrit dans l'exemple 1, pour la préparation du 8N- [ 1-(S)-Carbamoyl-2-(4-chlorophényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1 1 H-5-imidazolyl-
Le 8N-[ 1 -(S)-Carbamoyl-2-(4-méthoxyphényl)éthyI]-4-[ 1 -(4-méthyIbenzyl)- 1 H-5imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][l,4]oxazine-8-carboxamide, peut être préparé en opérant comme il est décrit dans l'exemple 1, pour la préparation du 8N- [ 1-(S)-Carbamoyl-2-(4-chlorophényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1 1 H-5-imidazolyl-
<Desc/Clms Page number 46>
méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, à partir de 1,05 g de 8N-[ 1 -(S)-méthoxycarbonyl-2-(4-méthoxyphényl)éthyl]-4-[I-(4-méthylbenzyl)- 1 H-5imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, et 35 cm' de solution saturée d'ammoniac dans le méthanol. Le produit brut est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 2,4 cm, hauteur 16 cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange de dichlorométhane et de méthanol (98 / 2 en volumes) et en recueillant des fractions de 35 cm . Les fractions 9 à 20 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). Le résidu est repris par 75 cm3 d'acétate d'éthyle et la solution résultante agitée avec 50 cm3 d'hydroxyde de sodium 0,1N. La phase organique est décantée, lavée par 50 cm3 d'hydroxyde de sodium 0,1N, 50 cm de saumure puis séchée sur sulfate de magnésium et contrée à sec sous pression réduite (2,7 kPa). On obtient 0,53 g de 8N-[I-(S)-Carbamoyl-2-(4-méthoxyphényl)éthyl]-4- [ 1 -(4-méthylbenzyl)- H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine- 8-carboxamide, sous la forme d'une meringue blanc cassé.
Spectre de masse : IE m/z = 539 M+ 'H NMR (400 MHz, DMSO-d6) : d en ppm : 2,32 (3H, s), 2,95 (1H, dd, J=8 et 14Hz), 3,07 ( 1 H, dd, J=5 et 14Hz), 3,18 (2H, m), 3,77 (3H, s), 4,12 ( 1 H, m), 4,20 (1H, m), 4,35 (2H, m), 4,62 (1H, m), 5,20 (2H, s), 6,78 (2H, m), 6,90 (3H, m), 7,04 (2H, d, J=7Hz), 7,11 (1H, dd, J=7 et 3Hz), 7,15 ( 1 H, s), 7,20 (4H, d, J=7Hz), 7,53 ( 1 H, s), 7,80 ( 1 H, s), 8,22 (1H, d, J=6Hz).
Le 8N-[ 1-(S)-méthoxycarbonyl-2-( 4-méthoxyphényl)éthyl]-4-[ 1-( 4-méthylbenzyl)lH-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][l,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du 8N-[ 1-(S)-Méthoxycarbonyl-2-(4-méthoxyphényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1 H-5imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, à partir de 1,84 g de 4-[l -(4-méthylbenzyl)- 1 H- J-imidazolyl-méthyI]-3,4-dihydro-2H- benzo[b][l,4]oxazine-8-carboxylate de sodium pur à 87 %, 50 cm de
<Desc/Clms Page number 47>
dichlorométhane, 1,2 g de chlorhydrate de (L)-4-méthoxyphénylalaninate de méthyle, 1,0 g de chlorhydrate de 1-(3-diméthylaminopropyl)-3-éthylcarbodiimide, 1,8 cm' de N-éthyl diisopropylamine, et de 10 mg d'hydrate d'hydroxybenzotriazole. Le produit brut est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 2,3 cm, hauteur 30 cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange de dichlorométhane et de méthanol (99 / 1 en volumes) et en recueillant des fractions de 50 cm . Les fractions 10 à 13 sont réunies et concentrées à
sec sous pression réduite (2,7 kPa). On obtient 1,15 g de 8N-[1-(S)-méthoxycarbonyl- 2-(4-méthoxyphényl)éthyl]-4-[ 1-(4-méthylbenzyl)-1 H-J-imidazo!y!-méthyt]-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'une huile jaune. Spectre de masse : IE m/z = 554 M+
Le 4-[ 1-( 4-méthylbenzyl)- 1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b] [1,4]oxazine-8-carboxylate de sodium pur à 87 %, peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du 4-[I-(4-chlorobenzyl)-
lH-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][l,4]oxazine-8-carboxylate de sodium, à partir de 1,6 g de 4-[ 1-(4-méthylbenzyl)-1 1 H-5-imidazolyl-méthyl]-3,4dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de méthyle, 50 cm de tétrahydrofurane, 8,4 cm3 d'hydroxyde de sodium IN, et 8,4 cm' d'acide chlorhydrique 0,5N, en agitant le mélange réactionnel pendant 20 heures à 20 C puis
au reflux pendant pendant 4 heures. On obtient 1,84 g de 4-[ 1-(4-méthylbenzyl)-1 HS-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium pur à 87 %, sous la forme d'une meringue beige foncé, utilisée telle quelle.
sec sous pression réduite (2,7 kPa). On obtient 1,15 g de 8N-[1-(S)-méthoxycarbonyl- 2-(4-méthoxyphényl)éthyl]-4-[ 1-(4-méthylbenzyl)-1 H-J-imidazo!y!-méthyt]-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'une huile jaune. Spectre de masse : IE m/z = 554 M+
Le 4-[ 1-( 4-méthylbenzyl)- 1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b] [1,4]oxazine-8-carboxylate de sodium pur à 87 %, peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du 4-[I-(4-chlorobenzyl)-
lH-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][l,4]oxazine-8-carboxylate de sodium, à partir de 1,6 g de 4-[ 1-(4-méthylbenzyl)-1 1 H-5-imidazolyl-méthyl]-3,4dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de méthyle, 50 cm de tétrahydrofurane, 8,4 cm3 d'hydroxyde de sodium IN, et 8,4 cm' d'acide chlorhydrique 0,5N, en agitant le mélange réactionnel pendant 20 heures à 20 C puis
au reflux pendant pendant 4 heures. On obtient 1,84 g de 4-[ 1-(4-méthylbenzyl)-1 HS-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium pur à 87 %, sous la forme d'une meringue beige foncé, utilisée telle quelle.
Le 4-[ 1 -(4-méthylbenzyl)- 1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b] [1,4]oxazine-8-carboxylate de méthyle, peut être préparé en opérant comme il est décrit dans l'exemple 1, pour la préparation du 4-[l-(4-chlorobenzyl)-lH-5imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b)[1,4]oxazine-8-carboxylate de méthyle, à partir de 3,2 g de 3-[I-(4-méthylbenzyl)-IH-5-imidazolyl-méthylamino] salicylate de méthyle, 50 cm3 de N,N-diméthylformamide, 0,86 cm3 de dibromo-l,2-éthane, et
<Desc/Clms Page number 48>
2,77 g de carbonate de potassium. On obtient, après purification chromatographique
du produit brut, 1,6 g de 4-[l-(4-méthylbenzyl)-lH-5-imidazoIyI-méthyl]-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de méthyle, sous la forme d'une huile orangée.
du produit brut, 1,6 g de 4-[l-(4-méthylbenzyl)-lH-5-imidazoIyI-méthyl]-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de méthyle, sous la forme d'une huile orangée.
Spectre de masse : IE m/z = 377 M+
Le 3-[ 1-(4-méthylbenzyl)-1 H-5-imidazolyl-méthylamino] salicylate de méthyle peut être préparé en opérant comme il est décrit dans l'exemple 1, pour la préparation du 3-[I-(4-chlorobenzyl)-IH-5-imidazolyl-méthylamino] salicylate de méthyle, à partir de 1,67 g de 3-amino-salicylate de méthyle, 50 cm3 de dichlorométhane, 2,25 g de l-(4-méthylbenzyl)-lH-5-imidazolyl-carboxaldéhyde et de 3,18 g de triacétoxyboro- hydrure de sodium. L'huile marron brute obtenue est chromatographiée sur une colonne de gel de silice (granulométrie 0,04 - 0,06 mm, diamètre 3 cm, hauteur 18 cm), en éluant sous une pression d'argon de 0,5 bar avec du dichlorométhane, puis avec un mélange de dichlorométhane et de méthanol (97 / 3 en volumes) et en recueillant des fractions de 35 cm . Les fractions 9 à 21 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On obtient 3,2 g de 3-[I-(4-méthylbenzyl)-5imidazolyl-méthylamino]-salicylate de méthyle, sous la forme d'une huile orange cristallisant à 20 C.
Le 3-[ 1-(4-méthylbenzyl)-1 H-5-imidazolyl-méthylamino] salicylate de méthyle peut être préparé en opérant comme il est décrit dans l'exemple 1, pour la préparation du 3-[I-(4-chlorobenzyl)-IH-5-imidazolyl-méthylamino] salicylate de méthyle, à partir de 1,67 g de 3-amino-salicylate de méthyle, 50 cm3 de dichlorométhane, 2,25 g de l-(4-méthylbenzyl)-lH-5-imidazolyl-carboxaldéhyde et de 3,18 g de triacétoxyboro- hydrure de sodium. L'huile marron brute obtenue est chromatographiée sur une colonne de gel de silice (granulométrie 0,04 - 0,06 mm, diamètre 3 cm, hauteur 18 cm), en éluant sous une pression d'argon de 0,5 bar avec du dichlorométhane, puis avec un mélange de dichlorométhane et de méthanol (97 / 3 en volumes) et en recueillant des fractions de 35 cm . Les fractions 9 à 21 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On obtient 3,2 g de 3-[I-(4-méthylbenzyl)-5imidazolyl-méthylamino]-salicylate de méthyle, sous la forme d'une huile orange cristallisant à 20 C.
Spectre de masse : IE m/z = 351 M+
Le 1-(4-méthylbenzyl)-1 H-5-imidazolyl-carboxaldéhyde peut être préparé en opérant de la façon suivante : A 5 g de IH-4(5)-imidazole carboxaldéhyde on ajoute 500 cm3 d'acétonitrile, 14,35 g de carbonate de potassium, et 7,55 cm3 d'a chlorométhyl p. xylène. Après 2 heures et 15 minutes de reflux, le mélange réactionnel est refroidi à 20 C, filtré, et le filtrat concentré à sec sous pression déduite (2,7 kPa). Le résidu est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,06 mm, diamètre 5 cm, hauteur 25 cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange de cyclohexane et d'acétate d'éthyle (80 / 20 puis 60 / 40 en volumes) et en recueillant
Le 1-(4-méthylbenzyl)-1 H-5-imidazolyl-carboxaldéhyde peut être préparé en opérant de la façon suivante : A 5 g de IH-4(5)-imidazole carboxaldéhyde on ajoute 500 cm3 d'acétonitrile, 14,35 g de carbonate de potassium, et 7,55 cm3 d'a chlorométhyl p. xylène. Après 2 heures et 15 minutes de reflux, le mélange réactionnel est refroidi à 20 C, filtré, et le filtrat concentré à sec sous pression déduite (2,7 kPa). Le résidu est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,06 mm, diamètre 5 cm, hauteur 25 cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange de cyclohexane et d'acétate d'éthyle (80 / 20 puis 60 / 40 en volumes) et en recueillant
<Desc/Clms Page number 49>
des fractions de 50 cm . Les fractions 40 à 89 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). Le produit obtenu est à nouveau chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,06 mm, diamètre 3 cm, hauteur 30 cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange de dichlorométhane et de méthanol (99 / 1 en volumes) et en recueillant des fractions de 35 cm . Les fractions 7 et 8 sont réunies et concentrées à sec sous pression réduite
(2,7 kPa). On obtient 2,2 g de 1-(4-méthylbenzyl)-1H-5-imidazolyl-carboxaldéhyde, sous la forme de cristaux blancs.
(2,7 kPa). On obtient 2,2 g de 1-(4-méthylbenzyl)-1H-5-imidazolyl-carboxaldéhyde, sous la forme de cristaux blancs.
Exemple 5
Le 8N-[ 1-(S)-carbamoyl-2-(4-méthoxyphényl)éthyl]-4-[ 1-(4-méthylbenzyl)-1 H-5- imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du
8N-[ 1-(S)-carbamoyl-2-( 4-méthoxyphényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1 H -5imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, à partir de 0,73 g de 8N-[ 1-(S)-méthoxycarbonyl-2-(4-méthoxyphényl)éthyl]-4-[ 1-(4méthylbenzyl)-1 H-S-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b] [ 1,4J oxazine-8-carboxamide, et 35 cm de solution saturée d'ammoniac dans le méthanol. Le produit brut est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 2 cm, hauteur 18 cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange de dichlorométhane et de méthanol (98/ 2 puis 95 / 5 en volumes) et en recueillant des fractions de 35 cm . Les fractions 11 à 14 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). Le résidu est repris par 50 cm d'acétate d'éthyle et la solution résultante agitée avec 50 cm d'hydroxyde de sodium 0,1N. La phase organique est décantée, lavée par 50 cm' d'hydroxyde de sodium 0,1N, 50 cm' de saumure puis séchée sur sulfate de magnésium et contrée à sec sous pression réduite (2,7 kPa). On obtient 0,32 g de 8N-[I-(S)-Carbamoyl-2-(4-
méthoxyphényl)éthyl]-4-[ 1-(4-méthylbenzyl)-1 H-S-imidazolyl-méthyl]-3-oxo-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'un solide blanc.
Le 8N-[ 1-(S)-carbamoyl-2-(4-méthoxyphényl)éthyl]-4-[ 1-(4-méthylbenzyl)-1 H-5- imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du
8N-[ 1-(S)-carbamoyl-2-( 4-méthoxyphényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1 H -5imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, à partir de 0,73 g de 8N-[ 1-(S)-méthoxycarbonyl-2-(4-méthoxyphényl)éthyl]-4-[ 1-(4méthylbenzyl)-1 H-S-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b] [ 1,4J oxazine-8-carboxamide, et 35 cm de solution saturée d'ammoniac dans le méthanol. Le produit brut est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 2 cm, hauteur 18 cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange de dichlorométhane et de méthanol (98/ 2 puis 95 / 5 en volumes) et en recueillant des fractions de 35 cm . Les fractions 11 à 14 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). Le résidu est repris par 50 cm d'acétate d'éthyle et la solution résultante agitée avec 50 cm d'hydroxyde de sodium 0,1N. La phase organique est décantée, lavée par 50 cm' d'hydroxyde de sodium 0,1N, 50 cm' de saumure puis séchée sur sulfate de magnésium et contrée à sec sous pression réduite (2,7 kPa). On obtient 0,32 g de 8N-[I-(S)-Carbamoyl-2-(4-
méthoxyphényl)éthyl]-4-[ 1-(4-méthylbenzyl)-1 H-S-imidazolyl-méthyl]-3-oxo-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'un solide blanc.
<Desc/Clms Page number 50>
Spectre de masse : IE m/z = 553 M+ 'H NMR (400 MHz, DMSO-d6) : 8 en ppm : 2,30 (3 H, s), 2,94 (1H, dd, J=8 et 14Hz), 3,09 (1H, dd, J=5 et 14Hz), 3,78 (3H, s), 4,62 (2H, m), 4,71(1 H, d, J=14Hz), 5, Il (2H, s), 5,29 (2H, s), 6,90 (3H, m), 7,01 (2H, d, J=7Hz), 7,05 (1H, t, J=7Hz), 7,17
(4H, m), 7,22 (2H, d, J=7Hz), 7,40 ( 1 H, dd, J=7 et I Hz), 7,55 ( 1 H, s), 7,75 ( 1 H, s), 8,12 (1H, d, J=6Hz).
(4H, m), 7,22 (2H, d, J=7Hz), 7,40 ( 1 H, dd, J=7 et I Hz), 7,55 ( 1 H, s), 7,75 ( 1 H, s), 8,12 (1H, d, J=6Hz).
Le 8N-[ 1-(S)-Méthoxycarbonyl-2-(4-méthoxyphényl)éthyl]-4-[ 1-(4-méthylbenzyl)- 1 H-5-imidazolyl-méthyl]-3 -oxo-3,4-di hydro-2 H-benzo [b] [ 1,4] oxazi ne-8carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 1, pour la préparation du 8N-[1-(S)-Méthoxycarbonyl-2-(4-chlorophényl)éthyl]-4-[1-(4chlorobenzyl)-1 H-S-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[bJ [ 1,4]oxazine-8carboxamide, à partir de 1,0 g de 4-[1-(4-méthylbenzyl)-1H-5-imidazolyl-méthyl]-3- oxo-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium pur à 84 %, 35 cm3 de dichlorométhane, 0,60 g de chlorhydrate de (L)-4-méthoxyphénylalaninate de méthyle, 0,485 g de chlorhydrate de 1-(3-diméthylaminopropyl)-3- éthylcarbodiimide, 0,88 cm3 de N-éthyl diisopropylamine, et de 10 mg d'hydrate d'hydroxybenzotriazole. Le produit brut est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 2 cm, hauteur 18 cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange de dichlorométhane et de méthanol (98,5/ 1,5 en volumes) et en recueillant des fractions de 35 cm . Les fractions 6 à 11sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On
obtient 0,73 g de 8N-[1-(S)-Méthoxycarbonyl-2-(4-méthoxyphényl)éthyl]-4-[1-(4méthylbenzyl)-1 1 H-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][ 1,4] oxazine-8-carboxamide, sous la forme d'une meringue blanche.
obtient 0,73 g de 8N-[1-(S)-Méthoxycarbonyl-2-(4-méthoxyphényl)éthyl]-4-[1-(4méthylbenzyl)-1 1 H-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][ 1,4] oxazine-8-carboxamide, sous la forme d'une meringue blanche.
Le 4-[ 1-( 4-méthylbenzyl)- 1 H-5-imidazolyl-méthyl]-3-oxo-3 ,4-dihydro-2H-benzo[b] [1,4]oxazine-8-carboxylate de sodium pur à 84 %, peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du 4-[1-(4-chlorobenzyl)-
1 H-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxylate de sodium, à partir de 0,83 g de 4-[I-(4-méthylbenzyl)-IH-5-imidazolyl-méthyl]-3-
1 H-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxylate de sodium, à partir de 0,83 g de 4-[I-(4-méthylbenzyl)-IH-5-imidazolyl-méthyl]-3-
<Desc/Clms Page number 51>
oxo-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de méthyle, 10 cm' de tétrahydrofurane, 4,24 cm d'hydroxyde de sodium IN et 20 cm3 d'eau, mais en agitant pendant 3 heures au reflux, puis en ajustant à 20 C le pH à 7 avec 2,12 cm' d'acide chlorhydrique IN. On obtient 1,0g de 4-[I-(4-méthylbenzyl)-IH-5-
imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][ 1 ,4]oxazine-8-carboxylate de sodium pur à 84 %, sous la forme d'un solide crème, qui est utilisé tel quel.
imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][ 1 ,4]oxazine-8-carboxylate de sodium pur à 84 %, sous la forme d'un solide crème, qui est utilisé tel quel.
Le 4-[1-(4-méthylbenzyl)-1H-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b] [l,4]oxazine-8-carboxylate de méthyle, peut être préparé en opérant comme il est
décrit dans l'exemple 3, pour la préparation du 4-[l-(4-chlorobenzyl)-lH-5- imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de méthyle, à partir de 3,0 g de 3-[l-(4-méthylbenzyl)-5-imidazolyl-méthylamino] salicylate de méthyle, 100 cm d'acétonitrile, 0,81 cm' de chlorure de chloroacétyle, et de 2,81 g de carbonate de potassium. Le produit brut est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 2 cm, hauteur 15 cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange de dichlorométhane et de méthanol (98 / 2 en volumes) et en recueillant des fractions de 30 cm . Les fractions 3 à 7 sont réunies et concentrées à sec sous pression réduite
(2,7 kPa). On obtient 0,83 g de 4-[1-(4-méthylbenzyl)-1H-5-imidazolyl-méthyl]-3oxo-3,4-dihydro-2H-benzo[b][1,4)oxazine-8-carboxylate de méthyle, sous la forme d'une huile jaune qui cristallise.
décrit dans l'exemple 3, pour la préparation du 4-[l-(4-chlorobenzyl)-lH-5- imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de méthyle, à partir de 3,0 g de 3-[l-(4-méthylbenzyl)-5-imidazolyl-méthylamino] salicylate de méthyle, 100 cm d'acétonitrile, 0,81 cm' de chlorure de chloroacétyle, et de 2,81 g de carbonate de potassium. Le produit brut est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 2 cm, hauteur 15 cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange de dichlorométhane et de méthanol (98 / 2 en volumes) et en recueillant des fractions de 30 cm . Les fractions 3 à 7 sont réunies et concentrées à sec sous pression réduite
(2,7 kPa). On obtient 0,83 g de 4-[1-(4-méthylbenzyl)-1H-5-imidazolyl-méthyl]-3oxo-3,4-dihydro-2H-benzo[b][1,4)oxazine-8-carboxylate de méthyle, sous la forme d'une huile jaune qui cristallise.
Spectre de masse : IE m/z = 391 M+ Exemple 6
Le 8N-[ 1-(S)-carbamoyl-2-( 4-méthoxyphényl)éthyl]-4-[ 1-( 4-phénylbenzyl)-1 H-5imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[bJ[1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du 8N-[ 1-(S)-carbamoyl-2-(4-méthoxyphényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1 1 H-5imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxamide, à partir de 0,57 g de 8N-[I-(S)-Méthoxycarbonyl-2-(4-méthoxyphényl)éthyl]-4-[I-(4-
Le 8N-[ 1-(S)-carbamoyl-2-( 4-méthoxyphényl)éthyl]-4-[ 1-( 4-phénylbenzyl)-1 H-5imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[bJ[1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du 8N-[ 1-(S)-carbamoyl-2-(4-méthoxyphényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1 1 H-5imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxamide, à partir de 0,57 g de 8N-[I-(S)-Méthoxycarbonyl-2-(4-méthoxyphényl)éthyl]-4-[I-(4-
<Desc/Clms Page number 52>
phénylbenzyl)- 1 H-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][ 1,4] oxazine-8-carboxamide, et 35 cm' de solution saturée d'ammoniac dans le méthanol. Le produit brut est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 2,2 cm, hauteur 14 cm), en éluant sous une pression d'argon de 0,5 bar avec du dichlorométhane puis avec des mélanges de dichlorométhane et de méthanol (99/ 1, 98 / 2, puis 97/ 3 en volumes), et en recueillant des fractions de 15cm3. Les fractions 31à 60 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). Le résidu est repris par 75 cm3 d'acétate d'éthyle et la solution résultante agitée avec 50 cm d'hydroxyde de sodium 0,1N. La phase organique est décantée, lavée par 50 cm' d'hydroxyde de sodium 0,1N, 50 cm de saumure puis séchée sur sulfate de magnésium et contrée à sec sous pression réduite (2,7 kPa). On obtient 0,310 g de 8N-[l-(S)-carbamoyl-2-(4-méthoxyphényl)éthyl]-4-
[ 1-(4-phénylbenzyl)-1 1 H-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][ 1,4] oxazine-8-carboxamide, sous la forme d'une meringue blanche.
[ 1-(4-phénylbenzyl)-1 1 H-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][ 1,4] oxazine-8-carboxamide, sous la forme d'une meringue blanche.
Spectre de masse : IE m/z = 615 M+ 'H NMR (400 MHz, DMSO-d6) : d en ppm : 2,85(1H, dd, J=8 et 14Hz), 3,01 (1H, dd, J=5 et 14Hz), 3,76 (3H, s), 4,60 (1H, m), 4,63 (1H, d, J=14Hz), 4,72 (1H, d, J=14Hz), 5,15 (2H, s), 5,40 (2H, s), 6,89 (2H, d, J=7Hz), 6,93 (1H, s), 7,05 (1H, t, J=7Hz), entre 7,10 et 7,30 (6H, m), 7,40 (2H, m), 7,51 (2H, t, J=7Hz), 7,53 (1H, s), 7,70 (4H, d, J=7Hz), 7,82 (1H, s), 8,12 (1H, d, J=6Hz).
Le 8N-[ 1-(S)-méthoxycarbonyl-2-(4-méthoxyphényl)éthyl]-4-[ 1-(4-phénylbenzyl)lH-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][l,4]oxazine-8carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du 8N-[l-(S)-méthoxycarbonyl-2-(4-méthoxyphényl)éthyI]-4-[l-(4chlorobenzyl)-1 H-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][ 1,4]oxazine- 8-carboxamide, à partir de 0,80 g de 4-[l-(4-phénylbenzyl)-lH-5-imidazolyl-méthylj- 3-oxo-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium pur à 88 %, 35 cm de dichlorométhane, 0,515 g de chlorhydrate de (L)-4-méthoxyphénylalaninate de méthyle, 0,436 g de chlorhydrate de 1-(3-diméthylaminopropyl)-3-
<Desc/Clms Page number 53>
éthylcarbodiimide, 0,785 cm' de N-éthyl diisopropylamine, et de 10 mg d'hydrate d'hydroxybenzotriazole. Le produit brut est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 2 cm, hauteur 13 cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange de dichlorométhane et de méthanol (98 / 2 en volumes) et en recueillant des fractions de 15 cm3. Les fractions 25 à 35 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On obtient
0,57 g de 8N-[1-(S)-méthoxycarbonyl-2-(4-méthoxyphényl)éthyl]-4-[1-(4phénylbenzyl)-1 1 H-5-imidazoIyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][ 1,4J oxazine-8-carboxamide, sous la forme d'une meringue blanche. Spectre de masse : IS m/z = 631MH+ ; m/z = 653 MNa+
Le 4-[l-(4-phénylbenzyI)-lH-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b] [1,4]oxazine-8-carboxylate de sodium pur à 88 %, peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du 4-[I-(4-chlorobenzyl)-
lH-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][l,4]oxazine-8-carboxylate de sodium, à partir de 0,85 g de 4-[I-(4-phénylbenzyl)-IH-5-imidazolyl-méthyl]-3- oxo-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de méthyle, 15 cm' de tétrahydrofurane, 3,8 cm' d'hydroxyde de sodium IN, et 20 cm' d'eau. On obtient
0,80 g de 4-[l-(4-phénylbenzyl)-lH-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H- benzo[b][1,4]oxazine-8-carboxylate de sodium pur à 88 %, sous la forme d'un solide marron clair.
Le 4-[ 1-( 4-phénylbenzyl)-1 H -5-imidazolyl-méthyl]-3 -oxo- 3 ,4-dihydro-2H -benzo[b] [1,4]oxazine-8-carboxylate de méthyle, peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du 4-[I-(4-chlorobenzyl)-IH-5-
imidazolyl-méthylJ-3-oxo-3,4-dihydro-2H-benzo[bJ[1,4]oxazine-8-carboxylate de méthyle, à partir de 2 g de 3-[I-(4-phénylbenzyl)-IH-5-imidazolyl-méthylamino] salicylate de méthyle, 50 cm3d'acétonitrile, 0,46 cm de chlorure de chloroacétyle, et de 1,6 g de carbonate de potassium. Le produit brut est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 2 cm, hauteur
0,57 g de 8N-[1-(S)-méthoxycarbonyl-2-(4-méthoxyphényl)éthyl]-4-[1-(4phénylbenzyl)-1 1 H-5-imidazoIyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][ 1,4J oxazine-8-carboxamide, sous la forme d'une meringue blanche. Spectre de masse : IS m/z = 631MH+ ; m/z = 653 MNa+
Le 4-[l-(4-phénylbenzyI)-lH-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b] [1,4]oxazine-8-carboxylate de sodium pur à 88 %, peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du 4-[I-(4-chlorobenzyl)-
lH-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][l,4]oxazine-8-carboxylate de sodium, à partir de 0,85 g de 4-[I-(4-phénylbenzyl)-IH-5-imidazolyl-méthyl]-3- oxo-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de méthyle, 15 cm' de tétrahydrofurane, 3,8 cm' d'hydroxyde de sodium IN, et 20 cm' d'eau. On obtient
0,80 g de 4-[l-(4-phénylbenzyl)-lH-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H- benzo[b][1,4]oxazine-8-carboxylate de sodium pur à 88 %, sous la forme d'un solide marron clair.
Le 4-[ 1-( 4-phénylbenzyl)-1 H -5-imidazolyl-méthyl]-3 -oxo- 3 ,4-dihydro-2H -benzo[b] [1,4]oxazine-8-carboxylate de méthyle, peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du 4-[I-(4-chlorobenzyl)-IH-5-
imidazolyl-méthylJ-3-oxo-3,4-dihydro-2H-benzo[bJ[1,4]oxazine-8-carboxylate de méthyle, à partir de 2 g de 3-[I-(4-phénylbenzyl)-IH-5-imidazolyl-méthylamino] salicylate de méthyle, 50 cm3d'acétonitrile, 0,46 cm de chlorure de chloroacétyle, et de 1,6 g de carbonate de potassium. Le produit brut est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 2 cm, hauteur
<Desc/Clms Page number 54>
28 cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange de dichlorométhane et de méthanol (98,5/ 1,5 en volumes) et en recueillant des fractions de 35 cm3. Les fractions 3 à 6 sont réunies et concentrées à sec sous pression réduite
(2,7 kPa). On obtient 0,87 g de 4-[I-(4-phénylbenzyl)-IH-5-imidazolyl-méthyl]-3oxo-3,4-dihydro-2H-benzo[bJ[l,4Joxazine-8-carboxylate de méthyle, sous la forme d'une huile jaune qui cristallise.
(2,7 kPa). On obtient 0,87 g de 4-[I-(4-phénylbenzyl)-IH-5-imidazolyl-méthyl]-3oxo-3,4-dihydro-2H-benzo[bJ[l,4Joxazine-8-carboxylate de méthyle, sous la forme d'une huile jaune qui cristallise.
Spectre de masse : IE m/z = 453 M+
Le 3-[l-(4-phénylbenzyl)-lH-5-imidazolyl-méthylamino] salicylate de méthyle peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du 3-[l-(4-chlorobenzyl)-IH-5-imidazolyl-méthylamino] salicylate de méthyle, à partir de 1,85 g de 3-amino-salicylate de méthyle, 75 cm3 de dichlorométhane, 3,3 g de 1-(4-phénylbenzyl)-1H-5-imidazolyl-carboxaldéhyde et de 3,53 g de triacétoxy- borohydrure de sodium. On obtient, après recristallisation dans l'acétate d'éthyle, puis
séchage sous pression réduite (0,7 kPa), 3,5 g de 3-[ 1-(4-phénylbenzyl)-1 H-5- imidazolyl-méthylamino] salicylate de méthyle, sous la forme de cristaux beige. Spectre de masse : IE m/z = 413 M+
Le 1-(4-phénylbenzyl)-1H-5-imidazolyl-carboxaldéhyde peut être préparé en opérant comme il est décrit dans l'exemple 4, pour la préparation du 1-(4-méthylbenzyl)-1H- 5-imidazolyl-carboxaldéhyde, à partir de 4,32 g de 1H-4(5)-imidazolylcarboxaldéhyde, 500 cm' d'acétonitrile, 13,66 g de carbonate de potassium, et de 10 g de chlorure de 4-phénylbenzyle. Le produit brut est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,06 mm, diamètre 5 cm, hauteur 26 cm), en éluant avec un mélange du dichlorométhane, en recueillant des fractions de 70 cm .
Le 3-[l-(4-phénylbenzyl)-lH-5-imidazolyl-méthylamino] salicylate de méthyle peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du 3-[l-(4-chlorobenzyl)-IH-5-imidazolyl-méthylamino] salicylate de méthyle, à partir de 1,85 g de 3-amino-salicylate de méthyle, 75 cm3 de dichlorométhane, 3,3 g de 1-(4-phénylbenzyl)-1H-5-imidazolyl-carboxaldéhyde et de 3,53 g de triacétoxy- borohydrure de sodium. On obtient, après recristallisation dans l'acétate d'éthyle, puis
séchage sous pression réduite (0,7 kPa), 3,5 g de 3-[ 1-(4-phénylbenzyl)-1 H-5- imidazolyl-méthylamino] salicylate de méthyle, sous la forme de cristaux beige. Spectre de masse : IE m/z = 413 M+
Le 1-(4-phénylbenzyl)-1H-5-imidazolyl-carboxaldéhyde peut être préparé en opérant comme il est décrit dans l'exemple 4, pour la préparation du 1-(4-méthylbenzyl)-1H- 5-imidazolyl-carboxaldéhyde, à partir de 4,32 g de 1H-4(5)-imidazolylcarboxaldéhyde, 500 cm' d'acétonitrile, 13,66 g de carbonate de potassium, et de 10 g de chlorure de 4-phénylbenzyle. Le produit brut est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,06 mm, diamètre 5 cm, hauteur 26 cm), en éluant avec un mélange du dichlorométhane, en recueillant des fractions de 70 cm .
Les fractions 20 à 32 sont réunies et concentrées à sec sous pression réduite (2,7 kPa).
On obtient 3,3 g de 1-(4-phénylbenzyl)-IH-5-imidazolyl-carboxaldéhyde, sous la forme d'une huile jaune qui cristallise.
<Desc/Clms Page number 55>
Exemple 7
Le 8N-[ 1 -(S)-carbamoyl-2-(4-méthoxyphényI)éthyl]-4-[ 1 -(4-phénylbenzyl)- 1 H-5- imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du 8N-
[ 1-(S)-carbamoyl-2-(4-méthoxyphényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1 1 H-5-imidazolylméthyl]-3-oxo-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, à partir de 0,78 g de 8N-[I-(S)-méthoxycarbonyl-2-(4-méthoxyphényl)éthyl]-4-[I-(4phénylbenzyl)-1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8- carboxamide, et 35 cm3 de solution saturée d'ammoniac dans le méthanol. Le produit brut est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 2 cm, hauteur 17 cm), en éluant sous une pression d'argon de 0,5 bar avec du dichlorométhane puis successivement avec des mélanges de dichlorométhane et de méthanol (98 / 2, puis 95 / 5 en volumes), et en recueillant des fractions de 35 cm . Les fractions 10 à 17 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). Le résidu est repris par 75 cm' d'acétate d'éthyle et la solution résultante agitée avec 50 cm3d'hydroxyde de sodium 0,1N. La phase organique est décantée, lavée par 50 cm3 d'hydroxyde de sodium 0,1N, 50 cm' de saumure puis séchée sur sulfate de magnésium et contrée à sec sous pression réduite (2,7 kPa). On obtient 0,60 g de 8N-[I-(S)-carbamoyl-2-(4-méthoxyphényl)éthyl]-4-
[ 1-(4-phénylbenzyl)-1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine- 8-carboxamide, sous la forme d'une meringue blanche.
Le 8N-[ 1 -(S)-carbamoyl-2-(4-méthoxyphényI)éthyl]-4-[ 1 -(4-phénylbenzyl)- 1 H-5- imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du 8N-
[ 1-(S)-carbamoyl-2-(4-méthoxyphényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1 1 H-5-imidazolylméthyl]-3-oxo-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, à partir de 0,78 g de 8N-[I-(S)-méthoxycarbonyl-2-(4-méthoxyphényl)éthyl]-4-[I-(4phénylbenzyl)-1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8- carboxamide, et 35 cm3 de solution saturée d'ammoniac dans le méthanol. Le produit brut est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 2 cm, hauteur 17 cm), en éluant sous une pression d'argon de 0,5 bar avec du dichlorométhane puis successivement avec des mélanges de dichlorométhane et de méthanol (98 / 2, puis 95 / 5 en volumes), et en recueillant des fractions de 35 cm . Les fractions 10 à 17 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). Le résidu est repris par 75 cm' d'acétate d'éthyle et la solution résultante agitée avec 50 cm3d'hydroxyde de sodium 0,1N. La phase organique est décantée, lavée par 50 cm3 d'hydroxyde de sodium 0,1N, 50 cm' de saumure puis séchée sur sulfate de magnésium et contrée à sec sous pression réduite (2,7 kPa). On obtient 0,60 g de 8N-[I-(S)-carbamoyl-2-(4-méthoxyphényl)éthyl]-4-
[ 1-(4-phénylbenzyl)-1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine- 8-carboxamide, sous la forme d'une meringue blanche.
Spectre de masse : IE m/z = 601 M+ 'H NMR (400 MHz, DMSO-d6) : d en ppm : 2,93 (1H, dd, J=8 et 14Hz), 3,05 (1H, dd, J=5 et 14Hz), 3,20 (2H, m), 3,75 (3H, s), 4,12 (1H, m), 4,20 ( 1 H, m), 4,39 (2H, s), 4,63 ( 1 H, m), 5,33 (2H, s), 6,81 (2H, m), 6,88 (2H, d, J=7Hz), 6,90 ( 1 H, s), 7,11(1H, dd, J=7 et 2Hz), 7,13 (1H, s), 7,17 (2H, d, J=7Hz), 7,23 (2H, d, J=7Hz), 7,42 (1H, t, J=7Hz), 7,50 (3H, m), 7,70 (4H, d, J=7Hz), 7,87 (1H, s), 8,20 (1H, d, J=6Hz).
<Desc/Clms Page number 56>
Le 8N-[ 1-(S)-méthoxycarbonyl-2-(4-méthoxyphényl)éthyl]-4-[ 1-(4-phénylbenzyl)lH-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][l,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du 8N-[ 1-(S)-méthoxycarbonyl-2-(4-chlorophényl)éthylJ-4-[ 1-(4-chlorobenzyl)-1 H-5- imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxamide, à partir de 0,81 g de 4-[I-(4-phénylbenzyl)-IH-5-imidazolyl-méthyl]-3,4-dihydro-2H- benzo[b][1,4]oxazine-8-carboxylate de sodium pur à 88 %, 35 cm' de dichlorométhane, 0,435 g de chlorhydrate de (L)-4-méthoxyphénylalaninate de méthyle, 0,367 g de chlorhydrate de 1-(3-diméthylaminopropyl)-3-éthylcarbodiimide, et de 0,66 cm3 de N-éthyl diisopropylamine. Le produit brut est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 2 cm, hauteur 12 cm), en éluant sous une pression d'argon de 0,5 bar avec du dichlorométhane puis avec un mélange de dichlorométhane et de méthanol (97/ 3 en volumes), et en recueillant des fractions de 35 cm . Les fractions 8 à 12 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On obtient 0,780 g de 8N-[1-(S)- méthoxycarbonyl-2-(4-méthoxyphényl)éthyl]-4-[ 1-(4-phénylbenzyl)-1H-5-
imidazolyl-méthyl)-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'une meringue blanche.
imidazolyl-méthyl)-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'une meringue blanche.
Spectre de masse : IE m/z = 616 M+
Le 4-[I-(4-phénylbenzyl)- IH-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4] oxazine-8-carboxylate de sodium pur à 88 % peut être préparé en opérant comme il
est décrit dans l'exemple 3, pour la préparation du 4-[1-(4-chlorobenzyl)-1H-5imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][1,4)oxazine-8-carboxylate de sodium, à partir de 0,70 g de 4-[1-(4-phénylbenzyl)-1H-S-imidazolyl-méthyl]-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de méthyle, 10 cm3 de tétrahydrofurane, 3,2 cm' d'hydroxyde de sodium IN, 1,6 cm3 d'acide chlorhydrique IN et 20 cm' d'eau, en agitant le mélange réactionnel au reflux pendant 4 heures. On
obtient 0,81 g de 4-[1-(4-phénylbenzyl)-1H-5-imidazolyl-méthyl]-3,4-dihydro-2H-
Le 4-[I-(4-phénylbenzyl)- IH-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4] oxazine-8-carboxylate de sodium pur à 88 % peut être préparé en opérant comme il
est décrit dans l'exemple 3, pour la préparation du 4-[1-(4-chlorobenzyl)-1H-5imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][1,4)oxazine-8-carboxylate de sodium, à partir de 0,70 g de 4-[1-(4-phénylbenzyl)-1H-S-imidazolyl-méthyl]-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de méthyle, 10 cm3 de tétrahydrofurane, 3,2 cm' d'hydroxyde de sodium IN, 1,6 cm3 d'acide chlorhydrique IN et 20 cm' d'eau, en agitant le mélange réactionnel au reflux pendant 4 heures. On
obtient 0,81 g de 4-[1-(4-phénylbenzyl)-1H-5-imidazolyl-méthyl]-3,4-dihydro-2H-
<Desc/Clms Page number 57>
Le 4-[ ! -(4-phényibenzy!)- ! H-J-imidazo!y!-méthy!]-3,4-dihydro-2H-benzo[b][ ! 1,4] oxazine-8-carboxylate de méthyle, peut être préparé en opérant comme il est décrit dans l'exemple 1, pour la préparation du 4-[I-(4-chlorobenzyl)-IH-5-imidazotyl- méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de méthyle, à partir de 1,5 g de 3-[I-(4-phénylbenzyl)-IH-5-imidazolyl-méthylamino] salicylate de méthyle, 50 cm' d'acétonitrile, 0,40 cm3 de dibromo-l,2-éthane et de 1,1 g de carbonate de potassium. Après traitement, l'huile obtenue est chromatographiée sur une colonne de gel de silice (granulométrie 0,04 - 0,06 mm, diamètre 3 cm, hauteur 18 cm), en éluant sous une pression d'argon de 0,5 bar avec du dichlorométhane, puis avec un mélange de dichlorométhane et de méthanol (99 / 1 en volumes), et en recueillant des fractions de 35 cm . Les fractions 16 à 30 sont réunies et concentrées à sec sous pression
réduite (2,7 kPa). On obtient 0,72 g de 4-[l -(4-phénylbenzyl)- lH-5-imidazoIyl- méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de méthyle, sous la forme d'une huile jaune.
réduite (2,7 kPa). On obtient 0,72 g de 4-[l -(4-phénylbenzyl)- lH-5-imidazoIyl- méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de méthyle, sous la forme d'une huile jaune.
Spectre de masse : IE m/z = 439 M+ Exemple 8
Le 8N-[2-( 4-chIorophényI)éthyl]-4-[I-( 4-phénylbenzyl)-1 1 H-5-imidazolyl-méthyl]- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du 8N-[1-(S)- méthoxycarbonyl-2-(4-méthoxyphényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1H-5-
imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxamide, à partir de 1,16 g de 4-[ 1-(4-phénylbenzyl)-1 H-5-imidazolyl-méthyl]-3,4-dihydro-2 H- benzo[b][1,4]oxazine-8-carboxylate de sodium pur à 88 %, 25 cm3 de dichlorométhane, 0,353 cm' de 4-chlorophényléthylamine, 0,528 g de chlorhydrate de
1-(3 -diméthylaminopropyl) -3 -éthylcarbodiim ide, et de 0,50 cm de N-éthyl diisopropylamine. Après traitement du mélange réactionnel, le produit brut obtenu est
Le 8N-[2-( 4-chIorophényI)éthyl]-4-[I-( 4-phénylbenzyl)-1 1 H-5-imidazolyl-méthyl]- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du 8N-[1-(S)- méthoxycarbonyl-2-(4-méthoxyphényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1H-5-
imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxamide, à partir de 1,16 g de 4-[ 1-(4-phénylbenzyl)-1 H-5-imidazolyl-méthyl]-3,4-dihydro-2 H- benzo[b][1,4]oxazine-8-carboxylate de sodium pur à 88 %, 25 cm3 de dichlorométhane, 0,353 cm' de 4-chlorophényléthylamine, 0,528 g de chlorhydrate de
1-(3 -diméthylaminopropyl) -3 -éthylcarbodiim ide, et de 0,50 cm de N-éthyl diisopropylamine. Après traitement du mélange réactionnel, le produit brut obtenu est
<Desc/Clms Page number 58>
chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 2,0 cm, hauteur 22 cm), en éluant sous une pression d'argon de 0,5 bar avec du dichlorométhane, et en recueillant des fractions de 35 cm . Les fractions 4 à 13 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On obtient 0,80 g de
8N-[2-(4-chlorophényl)éthyl]-4-[ 1-(4-phénylbenzyl)-1 H-5-imidazolyl-méthyl]-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'une meringue blanche.
8N-[2-(4-chlorophényl)éthyl]-4-[ 1-(4-phénylbenzyl)-1 H-5-imidazolyl-méthyl]-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'une meringue blanche.
Spectre de masse : IE m/z = 562 M+ 'H NMR (400 MHz, DMSO-d6) : d en ppm : 2,78 (2H, t, J=6Hz), 3,10 (2H, t, J=4Hz), 3,43 (2H, q, J=6Hz), 4,03 (2H, t, J=4Hz), 4,34 (2H, s), 5,28 (2H, s), 6,75 (2H, m), 6,87 (1 H, s), 6,98 (1 H, dd, J=7 et 1Hz), 7,17 (2H, d, J=7Hz), 7,26 (2H, d, J=7Hz), 7,34 (2H, d, J=7Hz), 7,38 (1H, t, J=7Hz), 7,45 (2H, t, J=7Hz), 7,65 (4H, m), 7,82(lH,s),8,03(lH,t,J=5Hz).
Exemple 9
Le 8N-[ 1-(S)-carbamoyl-2-(4-chlorophényl)éthyl]-2,2-diméthyl-4-[ 1-(4méthylbenzyl)-1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 1, pour la préparation du 8N-[ 1-(S)-Carbamoyl-2-(4-chlorophényl)éthyl]-4-[ 1-(4chlorobenzyl)- 1 H-5-imidazolyl-méthyl]-3 ,4-dihydro-2H-benzo[b][ 1,4]oxazine-8carboxamide, à partir de 0,60 g de 8N-[ 1-(S)-méthoxycarbonyl-2-(4chlorophényl)éthyl]-2,2-diméthyl-4-[ 1-(4-méthylbenzyl)-1 1 H-5-imidazolyl-méthyl]- 3,4-dihydro-2H-benzo[b][l,4Joxazine-8-carboxamide, et de 35 cm de solution saturée d'ammoniac dans le méthanol. Le produit brut est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 2 cm, hauteur 20 cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange de dichlorométhane et de méthanol (97,5/ 2,5 en volumes) et en recueillant des fractions de 35 cm3. Les fractions 7 à 13 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On
obtient 0,30 g de 8N-[1-(S)-Carbamoyl-2-(4-chlorophényl)éthyl]-2,2-diméthyl-4-[1-
Le 8N-[ 1-(S)-carbamoyl-2-(4-chlorophényl)éthyl]-2,2-diméthyl-4-[ 1-(4méthylbenzyl)-1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 1, pour la préparation du 8N-[ 1-(S)-Carbamoyl-2-(4-chlorophényl)éthyl]-4-[ 1-(4chlorobenzyl)- 1 H-5-imidazolyl-méthyl]-3 ,4-dihydro-2H-benzo[b][ 1,4]oxazine-8carboxamide, à partir de 0,60 g de 8N-[ 1-(S)-méthoxycarbonyl-2-(4chlorophényl)éthyl]-2,2-diméthyl-4-[ 1-(4-méthylbenzyl)-1 1 H-5-imidazolyl-méthyl]- 3,4-dihydro-2H-benzo[b][l,4Joxazine-8-carboxamide, et de 35 cm de solution saturée d'ammoniac dans le méthanol. Le produit brut est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 2 cm, hauteur 20 cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange de dichlorométhane et de méthanol (97,5/ 2,5 en volumes) et en recueillant des fractions de 35 cm3. Les fractions 7 à 13 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On
obtient 0,30 g de 8N-[1-(S)-Carbamoyl-2-(4-chlorophényl)éthyl]-2,2-diméthyl-4-[1-
<Desc/Clms Page number 59>
(4-méthylbenzyl)- 1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8- carboxamide, sous la forme d'une meringue blanche.
Spectre de masse : IE m/z = 571 M' 'H NMR (400 MHz, DMSO-d6) : d en ppm : 1,18 (3H, s), 1. 24 (3H, s), 2,35(3H, s), 2,98 (2H, s), 3,03 (1H, dd, J=8 et 14Hz), 3,20 (1H, dd, J=5 et 14Hz), 4,38 (2H, s), 4,78 (1H, q, J=6Hz), 5,22 (2H, s), 6,73 (1H, dd, J=7 et 2Hz), 6,79 (1H, t, J=7Hz), 6,82 (1H, s), 7,09 (2H, d, J=7Hz), entre 7,15 et 7,30 (6H, m), 7,35 (2H, d, J=7Hz), 7,65 (H1, s), 7,80 (H1, s), 8,61 (1H, d, J=6Hz).
Le 8N-[ 1 -(S)-méthoxycarbonyl-2-(4-chlorophényl)éthyl]-2,2-diméthyl-4-[ 1 -(4-
méthylbenzyl)-1 H-S-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du 8N-[1-(S)-méthoxycarbonyl-2-(4-méthoxyphényl)éthyl]-4-[1-(4chlorobenzyl)-1 H-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-
8-carboxamide, à partir de 0,76 g de 2,2-diméthyl-4-[I-(4-méthylbenzyl)-IH-5- imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium pur à 88 %, 30 cm' de dichlorométhane, 0,44 g de chlorhydrate de 4-chlorophénylalaninate de méthyle, 0,368 g de chlorhydrate de 1-(3diméthylaminopropyl)-3-éthylcarbodiimide, et de 0,66 cm3 de N-éthyl diisopropylamine. Après traitement du mélange réactionnel, le produit brut obtenu est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 1,0 cm, hauteur 24 cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange de dichlorométhane et de méthanol (99/ 1 en volumes), et en recueillant des fractions de 35 cm . Les fractions 8 à 17 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On obtient 0,61 g de 8N-[I-(S)-méthoxycarbonyl-2-(4- chlorophényl)éthyl]-2,2-diméthyl-4- [ 1-(4-méthylbenzyl)-1H-5-imidazolyl-méthyl]- 3,4-dihydro-2H-benzo[b][l,4]oxazine-8-carboxamide, sous la forme d'une huile jaune.
méthylbenzyl)-1 H-S-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du 8N-[1-(S)-méthoxycarbonyl-2-(4-méthoxyphényl)éthyl]-4-[1-(4chlorobenzyl)-1 H-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-
8-carboxamide, à partir de 0,76 g de 2,2-diméthyl-4-[I-(4-méthylbenzyl)-IH-5- imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium pur à 88 %, 30 cm' de dichlorométhane, 0,44 g de chlorhydrate de 4-chlorophénylalaninate de méthyle, 0,368 g de chlorhydrate de 1-(3diméthylaminopropyl)-3-éthylcarbodiimide, et de 0,66 cm3 de N-éthyl diisopropylamine. Après traitement du mélange réactionnel, le produit brut obtenu est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 1,0 cm, hauteur 24 cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange de dichlorométhane et de méthanol (99/ 1 en volumes), et en recueillant des fractions de 35 cm . Les fractions 8 à 17 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On obtient 0,61 g de 8N-[I-(S)-méthoxycarbonyl-2-(4- chlorophényl)éthyl]-2,2-diméthyl-4- [ 1-(4-méthylbenzyl)-1H-5-imidazolyl-méthyl]- 3,4-dihydro-2H-benzo[b][l,4]oxazine-8-carboxamide, sous la forme d'une huile jaune.
Spectre de masse : IE m/z = 586 M+
<Desc/Clms Page number 60>
Le 2,2-diméthyl-4-[I-(4-méthylbenzyl)- 1 H-5-imidazolyl-méthyl]-3,4-dihydro-2Hbenzo[b][ l ,4]oxazine-8-carboxylate de sodium pur à 88 %, peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du 4-[ l -(4chlorobenzyl)-lH-5-imidazolyI-méthyI]-3-oxo-3,4-dihydro-2H-benzo[b][l,4]oxazine- 8-carboxylate de sodium, à partir de 0,64 g de 2,2-diméthyl-4-[1-(4-méthylbenzyl)lH-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][l,4]oxazine-8-carboxylate de méthyle, 10 cm de tétrahydrofurane, 3,2 cm d'hydroxyde de sodium 1N et de 20 cm d'eau, en agitant le mélange pendant 4 heures à la température du reflux. On obtient
0,76 g de 2,2-diméthyl-4-[I-(4-méthylbenzyl)-IH-5-imidazolyl-méthyl]-3,4-dihydro- 2H-benzo[b][1,4]oxazine-8-carboxylate de sodium pur à 88 %, sous la forme d'un solide crème.
Le 2,2-diméthyl-4-[l-(4-méthylbenzyl)-lH-5-imidazolyl-méthyl]-3,4-dihydro-2H- benzo[b][1,4]oxazine-8-carboxylate de méthyle peut être préparé en opérant comme il
est décrit dans l'exemple 1, pour la préparation du 3-[I-(4-chlorobenzyl)-IH-5imidazolyl-méthylamino] salicylate de méthyle, à partir de 0,600 g de 2,2-diméthyl- 3,4-dihydro-2H-benzo[b][l,4Joxazine-8-carboxylate de méthyle, 15 cm de dichlorométhane, 0,62 g de 1-(4-méthylbenzyl)-1H-5-imidazolyl-carboxaldéhyde et de 0,86 g de triacétoxyborohydrure de sodium. L'huile orangée brute obtenue est chromatographiée sur une colonne de gel de silice (granulométrie 0,04 - 0,06 mm, diamètre 3 cm, hauteur 27 cm), en éluant sous une pression d'argon de 0,5 bar avec du dichlorométhane, puis avec des mélanges de dichlorométhane et de méthanol (99/ 1 puis 98 / 2 en volumes) et en recueillant des fractions de 15 cm . Les fractions 50 à 54 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On obtient 0,64 g
de 2,2-diméthyl-4-[I-(4-méthylbenzyl)- 1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H- benzo[b][1,4]oxazine-8-carboxylate de méthyle, sous la forme d'une huile jaune.
Spectre de masse : IE m/z = 405 M+ Le 2,2-diméthyl-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de méthyle peut être préparé en opérant de la façon suivante :
<Desc/Clms Page number 61>
A une solution de 1,17 g de 2,2-diméthyl-3-oxo-3,4-dihydro-2H-benzo[b][1,4] oxazine-8-carboxylate de méthyle dans 15 cm' de tétrahydrofurane, on ajoute 3 cm' d'une solution de complexe borane-diméthylsulfure 2M dans le tétrahydrofurane.
Après 20 heures d'agitation à 20 C, le mélange réactionnel est chauffé au reflux pendant 3 heures, refroidi à 20 C puis additionné de 25 cm3 d'hydroxyde de sodium
0,1N, et 50 cm' d'acétate d'éthyle. Après agitation, la phase organique est décantée, lavée par 50 cm3 d'eau et 50 cm3 de saumure, séchée puis concentrée à sec sous pression réduite (2,7 kPa). Le résidu est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,06 mm, diamètre 2 cm, hauteur 19 cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange de dichlorométhane et de méthanol (99 / 1 en volumes) et en recueillant des fractions de 35 cm . Les fractions 3 à 6 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On obtient 0,62 g de 2,2diméthyl-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de méthyle, sous la forme d'une huile orange qui cristallise.
0,1N, et 50 cm' d'acétate d'éthyle. Après agitation, la phase organique est décantée, lavée par 50 cm3 d'eau et 50 cm3 de saumure, séchée puis concentrée à sec sous pression réduite (2,7 kPa). Le résidu est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,06 mm, diamètre 2 cm, hauteur 19 cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange de dichlorométhane et de méthanol (99 / 1 en volumes) et en recueillant des fractions de 35 cm . Les fractions 3 à 6 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On obtient 0,62 g de 2,2diméthyl-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de méthyle, sous la forme d'une huile orange qui cristallise.
Spectre de masse : IE m/z = 221M+ Le 2,2-diméthyl-3-oxo-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de méthyle peut être préparé en opérant de la façon suivante : A un mélange fortement agité et refroidi à 5 C de 4,17 g de 3-amino salicylate de méthyle, 150 cmde chloroforme, et de 150 cm d'une solution aqueuse saturée d'hydrogénocarbonate de sodium, on ajoute 4,63 cmde bromure d'a-bromoisobutyryle. Après 40 minutes d'agitation à température ambiante, le mélange est décanté, la phase organique séchée sur sulfate de magnésium est concentrée à sec sous pression réduite (2,7 kPa). L'huile jaune obtenue, est reprise par 100 cm3 d'acétonitrile, puis additionnée de 7,76 g de carbonate de potassium. Le mélange, chauffé au reflux pendant 1 heure et 30 minutes est filtré, et le filtrat est concentré à sec sous pression réduite (2,7 kPa). Le résidu est repris par 150 cm3 d'acétate d'éthyle, la solution obtenue est lavée par 3 fois 50 cm' d'eau, puis séchée sur sulfate de magnésium et concentrée à sec sous pression réduite (2,7 kPa). Le résidu est
<Desc/Clms Page number 62>
chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,06 mm, diamètre 3,5 cm, hauteur 18cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange de dichlorométhane et de méthanol (99 / 1 en volumes) et en recueillant des fractions de 50 cm . Les fractions 7 à 12 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On obtient 3,4 g de 2,2-diméthyl-3-oxo-3,4-dihydro-2Hbenzo[b][1,4]oxazine-8-carboxylate de méthyle, sous la forme de cristaux blancs.
Spectre de masse : IE m/z = 235 M* Exemple 10
Le 8N-[1 1-(S)-carbamoyl-2-(4-chlorophényl)éthyl]-2,2-diméthyl-4-[ 1-(4chlorobenzyl)-lH-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][l,4]oxazine-8carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 1, pour la préparation du 8N-[l-(S)-carbamoyl-2-(4-chlorophényl)éthyl]-4-[l-(4chlorobenzyl)-lH-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][l,4]oxazine-8carboxamide, à partir de 1,0 g de 8N-[1-(S)-méthoxycarbonyl-2-(4chlorophényl)éthyl]-2,2-diméthyl-4-[ 1 -(4-chlorobenzyl)- H-5-imidazolyl-méthyIJ- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, et de 35 cm de solution saturée d'ammoniac dans le méthanol. Le produit brut est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 3 cm, hauteur 21 cm), en éluant sous une pression d'argon de 0,5 bar avec des mélanges de dichlorométhane et de méthanol (99 / 1 puis 97,5 / 2,5 puis 95 / 5 en volumes) et en recueillant des fractions de 35 cm3. Les fractions 21 à 30 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). Le résidu est repris par 50 cm' d'acétate d'éthyle et la solution résultante agitée avec 50 cm' d'hydroxyde de sodium IN. La phase organique est décantée, lavée par 50 cm' d'eau, par 50 cm de saumure puis séchée sur sulfate de magnésium et contrée à sec sous pression réduite (2,7 kPa). On obtient
0,64 g de 8N-[ 1-(S)-carbamoyl-2-(4-chlorophényl)éthyl]-2,2-diméthyl-4-[ 1-(4chlorobenzyl)- H-S-imidazolyl-méthylJ-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8- carboxamide, sous la forme d'une meringue blanche.
Le 8N-[1 1-(S)-carbamoyl-2-(4-chlorophényl)éthyl]-2,2-diméthyl-4-[ 1-(4chlorobenzyl)-lH-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][l,4]oxazine-8carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 1, pour la préparation du 8N-[l-(S)-carbamoyl-2-(4-chlorophényl)éthyl]-4-[l-(4chlorobenzyl)-lH-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][l,4]oxazine-8carboxamide, à partir de 1,0 g de 8N-[1-(S)-méthoxycarbonyl-2-(4chlorophényl)éthyl]-2,2-diméthyl-4-[ 1 -(4-chlorobenzyl)- H-5-imidazolyl-méthyIJ- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, et de 35 cm de solution saturée d'ammoniac dans le méthanol. Le produit brut est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 3 cm, hauteur 21 cm), en éluant sous une pression d'argon de 0,5 bar avec des mélanges de dichlorométhane et de méthanol (99 / 1 puis 97,5 / 2,5 puis 95 / 5 en volumes) et en recueillant des fractions de 35 cm3. Les fractions 21 à 30 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). Le résidu est repris par 50 cm' d'acétate d'éthyle et la solution résultante agitée avec 50 cm' d'hydroxyde de sodium IN. La phase organique est décantée, lavée par 50 cm' d'eau, par 50 cm de saumure puis séchée sur sulfate de magnésium et contrée à sec sous pression réduite (2,7 kPa). On obtient
0,64 g de 8N-[ 1-(S)-carbamoyl-2-(4-chlorophényl)éthyl]-2,2-diméthyl-4-[ 1-(4chlorobenzyl)- H-S-imidazolyl-méthylJ-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8- carboxamide, sous la forme d'une meringue blanche.
<Desc/Clms Page number 63>
Spectre de masse : IE m/z = 591 M* 'H NMR (400 MHz, DMSO-d6) : d en ppm : 1,17 (3H, s), 1.23 (3H, s), 2,98 (2H, s), 3,03 (1H, dd, J=8 et 14Hz), 3,20 (1H, dd, J=5 et 14Hz), 4,38 (2H, s), 4,79 (1H, q, J=6Hz), 5,30 (2H, s), 6,76 (1H, dd, J=7 et 2Hz), 6,82 (1H, t, J=7Hz), 6,85 (1H, s), 7,20 (4H, d, J=7Hz), 7,25 (2H, m), 7,35 (2H, d, J=7Hz), 7,48 (2H, d, J=7Hz), 7,66 (1H, s), 7,83 (1H, s), 8,61 (IH, d, J=6Hz).
Le 8N-[ I -(S)-méthoxycarbonyl-2-(4-chlorophényl)éthyl]-2,2-diméthyl-4-[ 1 -(4chlorobenzyl)- 1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du 8N-[ 1-(S)-méthoxycarbonyl-2-(4-méthoxyphényl)éthyl]-4-[ 1-(4chlorobenzyl)-1 H-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][ 1,4]oxazine- 8-carboxamide, à partir de 1,16 g de 2,2-diméthyl-4-[ 1-(4-chlorobenzyl)-1 H-5- imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium pur à 88 %, 50 cm3 de dichlorométhane, 0,65 g de chlorhydrate de 4-chlorophénylalaninate de méthyle, 0,54 g de chlorhydrate de 1-(3- diméthylaminopropyl)-3-éthylcarbodiimide, et de 0,57 cm3 de N-éthyl diisopropylamine. Après traitement du mélange réactionnel, le produit brut obtenu est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 3 cm, hauteur 16 cm), en éluant sous une pression d'argon de 0,5 bar avec du dichlorométhane puis avec un mélange de dichlorométhane et de méthanol (99 / 1 en volumes), et en recueillant des fractions de 35 cm . Les fractions 13 à 30 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On obtient 1,0 g de
8N-[ 1-(S)-méthoxycarbonyl-2-(4-chlorophényl)éthyl]-2,2-diméthyl-4-[ l-(4chlorobenzyl)-1 1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8- carboxamide, sous la forme d'une huile jaune. Spectre de masse : IE m/z = 606 M+
Le 2,2-diméthyl-4-[ 1-( 4-chlorobenzyl)-1 1 H-5-imidazolyl-méthyl]-3,4-dihydro-2Hbenzo[b][l,4Joxazine-8-carboxylate de sodium pur à 88 % peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du 4-[1-(4-
8N-[ 1-(S)-méthoxycarbonyl-2-(4-chlorophényl)éthyl]-2,2-diméthyl-4-[ l-(4chlorobenzyl)-1 1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8- carboxamide, sous la forme d'une huile jaune. Spectre de masse : IE m/z = 606 M+
Le 2,2-diméthyl-4-[ 1-( 4-chlorobenzyl)-1 1 H-5-imidazolyl-méthyl]-3,4-dihydro-2Hbenzo[b][l,4Joxazine-8-carboxylate de sodium pur à 88 % peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du 4-[1-(4-
<Desc/Clms Page number 64>
chlorobenzyl)-1 H-5-imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][1,4]oxazine-
8-carboxylate de sodium, à partir de 1,0 g de 2,2-diméthyl-4-[1-(4-chlorobenzyl)-(H- 5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[bJ[I,4]oxazine-8-carboxylate de méthyle, 10 cm de tétrahydrofurane, 4,7 cm' d'hydroxyde de sodium 1N, 2,35 cm3 d'acide chlorhydrique 1N et de 20 cm3 d'eau, en agitant le mélange pendant 4 heures
à la température du reflux. On obtient 1,16g de 2,2-diméthyl-4-[1-(4-chlorobenzyl)- 1H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium pur à 88 %, sous la forme d'un solide blanc cassé, utilisé tel quel.
8-carboxylate de sodium, à partir de 1,0 g de 2,2-diméthyl-4-[1-(4-chlorobenzyl)-(H- 5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[bJ[I,4]oxazine-8-carboxylate de méthyle, 10 cm de tétrahydrofurane, 4,7 cm' d'hydroxyde de sodium 1N, 2,35 cm3 d'acide chlorhydrique 1N et de 20 cm3 d'eau, en agitant le mélange pendant 4 heures
à la température du reflux. On obtient 1,16g de 2,2-diméthyl-4-[1-(4-chlorobenzyl)- 1H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium pur à 88 %, sous la forme d'un solide blanc cassé, utilisé tel quel.
Le 2,2-diméthyl-4-[I-( 4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H- benzo[b][1,4]oxazine-8-carboxylate de méthyle peut être préparé en opérant comme il est décrit dans l'exemple 1, pour la préparation du 3-[1-(4-chlorobenzyl)-5imidazolyl-méthylamino] salicylate de méthyle, à partir de 1,3 g de 2,2-diméthyl-3,4-
dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de méthyle, 35 cm de dichlorométhane, 1,5 g de 1-(4-chlorobenzyl)-imidazol-5-carboxaldéhyde et de 1,9 g de triacétoxyborohydrure de sodium. L'huile orangée brute obtenue est chromatographiée sur une colonne de gel de silice (granulométrie 0,04 - 0,06 mm, diamètre 3 cm, hauteur 17 cm), en éluant sous une pression d'argon de 0,5 bar avec des mélanges de dichlorométhane et de méthanol (99 / 1 puis 98 / 2 en volumes) et en recueillant des fractions de 35 cm'. Les fractions 14 à 31 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On obtient 1,0 g de 2,2-diméthyl-4-[l-(4-
chlorobenzyl)-lH-5-imidazoIyl-méthyl]-3,4-dihydro-2H-benzo[b][l,4]oxazine-8- carboxylate de méthyle, sous la forme d'une huile jaune. Spectre de masse : IE m/z = 425 M+ Exemple 11
Le 8N-[2-(4-chlorophényl)éthyl]-4-[ 1-(4-chlorobenzyl)- I H-S-imidazolyl-méthyl]-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du 8N-[1-(S)-Méthoxycarbonyl-2-
(4-méthoxyphényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-3-oxo-3,4-
dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de méthyle, 35 cm de dichlorométhane, 1,5 g de 1-(4-chlorobenzyl)-imidazol-5-carboxaldéhyde et de 1,9 g de triacétoxyborohydrure de sodium. L'huile orangée brute obtenue est chromatographiée sur une colonne de gel de silice (granulométrie 0,04 - 0,06 mm, diamètre 3 cm, hauteur 17 cm), en éluant sous une pression d'argon de 0,5 bar avec des mélanges de dichlorométhane et de méthanol (99 / 1 puis 98 / 2 en volumes) et en recueillant des fractions de 35 cm'. Les fractions 14 à 31 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On obtient 1,0 g de 2,2-diméthyl-4-[l-(4-
chlorobenzyl)-lH-5-imidazoIyl-méthyl]-3,4-dihydro-2H-benzo[b][l,4]oxazine-8- carboxylate de méthyle, sous la forme d'une huile jaune. Spectre de masse : IE m/z = 425 M+ Exemple 11
Le 8N-[2-(4-chlorophényl)éthyl]-4-[ 1-(4-chlorobenzyl)- I H-S-imidazolyl-méthyl]-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du 8N-[1-(S)-Méthoxycarbonyl-2-
(4-méthoxyphényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-3-oxo-3,4-
<Desc/Clms Page number 65>
dihydro-2H-benzo[b][l,4]oxazine-8-carboxamide, à partir de 0,643 g de 4-[1-(4chlorobenzyl)-1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8- carboxylate de sodium pur à 86,25 % , 25 cm' de dichlorométhane, 0,23 cm' de 2-(4chlorophényl)éthylamine, 0,316 g de chlorhydrate de 1-(3-diméthylaminopropyl)-3- éthylcarbodiimide, et de 0,25 cm' de triéthylamine. Après traitement du mélange réactionnel, le produit brut obtenu est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 2,0 cm, hauteur 13 cm), en éluant sous une pression d'argon de 0,5 bar avec du dichlorométhane ouis avec un mélange de dichlorométhane et de méthanol (99 / 1 en volumes), et en recueillant des fractions de 15 cm . Les fractions 15 à 20 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On obtient 0,40 g de 8N-[2-(4-chlorophényl)éthyl]-4-[I-(4-
chlorobenzyl)-IH-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8- carboxamide, sous la forme d'une meringue blanche.
Spectre de masse : IE m/z = 520 M+ 'H NMR (400 MHz, DMSO-d6) : d en ppm : 2,85 (2H, t, J=6Hz), 3,13 (2H, t, J=4Hz), 3,51 (2H, q, J=6Hz), 4,10 (2H, t, J=4Hz), 4,33 (2H, s), 5,29 (2H, s), 6,79 (2H, m), 6,90 (1H, s), 7,02 (1H, m), 7,15 (2H, d, J=7Hz), 7,33 (2H, d, J=7Hz), 7,41 (2H, d, J=7Hz), 7,45 (2H, d, J=7Hz), 7,85 (1H, s), 8,10 (1H, t, J=5Hz).
Le 4-[ 1-(4-chlorobenzyl)-1 H-S-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[bJ [ 1,4] oxazine-8-carboxylate de sodium pur à 86,25 % peut être préparé en opérant comme
il est décrit dans l'exemple 3, pour la préparation du 4-[1-(4-chlorobenzyl)-1H-5imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][l,4Joxazine-8-carboxylate de sodium, à partir de 4,0 g de 4-[I-(4-chlorobenzyl)-IH-5-imidazolyl-méthyl]-3,4dihydro-2H-benzo[b][l,4Joxazine-8-carboxylate de méthyle, 40 cm' de tétrahydrofurane, 20 cm3 d'hydroxyde de sodium IN, 10 cm d'acide chlorhydrique IN et 80 cm3d'eau, en agitant le mélange réactionnel au reflux pendant 4 heures puis pendant 20 heures à 20 C. On obtient 4,4 g de 4-[I-(4-chlorobenzyl)-IH-5-
imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b)[l,4Joxazine-8-carboxylate de sodium, sous la forme d'un solide marron clair.
il est décrit dans l'exemple 3, pour la préparation du 4-[1-(4-chlorobenzyl)-1H-5imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][l,4Joxazine-8-carboxylate de sodium, à partir de 4,0 g de 4-[I-(4-chlorobenzyl)-IH-5-imidazolyl-méthyl]-3,4dihydro-2H-benzo[b][l,4Joxazine-8-carboxylate de méthyle, 40 cm' de tétrahydrofurane, 20 cm3 d'hydroxyde de sodium IN, 10 cm d'acide chlorhydrique IN et 80 cm3d'eau, en agitant le mélange réactionnel au reflux pendant 4 heures puis pendant 20 heures à 20 C. On obtient 4,4 g de 4-[I-(4-chlorobenzyl)-IH-5-
imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b)[l,4Joxazine-8-carboxylate de sodium, sous la forme d'un solide marron clair.
<Desc/Clms Page number 66>
Spectre de masse : IE m/z = 384 M* Exemple 12
Le 8N-[ 1-(S)-méthoxycarbonyl-2-( 4-chlorophényl)éthyl]-4-[ 1-(4-méthylbenzyl)-1 H- 5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][ 1 ,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du 8N-
[ 1-(S)-Méthoxycarbonyl-2-(4-chlorophényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1 H-5imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxamide, à partir de 3,0 g de 4-[I-(4-méthylbenzyl)-IH-5-imidazolyl-méthyl]-3,4-dihydro-2H- benzo[b][1,4]oxazine-8-carboxylate de sodium, 50 cm' de dichlorométhane, 2,14 g de chlorhydrate de (L)-4-chlorophénylalaninate de méthyle, 1,79 g de chlorhydrate de 1-(3-diméthylaminopropyl)-3-éthylcarbodiimide, de 2,6 cm' de N-éthyl diisopropylamine, et de 0,13 g d'hydrate d'hydroxybenzotriazole. Après traitement du mélange réactionnel, le produit brut est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 4 cm, hauteur 27 cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange de dichlorométhane et de méthanol (99 1 en volumes), et en recueillant des fractions de 60 cm . Les fractions 20 à 34 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On obtient 2,70 g de
8N-[ 1-(S)-méthoxycarbonyl-2-(4-chlorophényl)éthyl]-4-[ 1-(4-méthylbenzyl)-1 1 H-5- imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'une meringue crème.
Le 8N-[ 1-(S)-méthoxycarbonyl-2-( 4-chlorophényl)éthyl]-4-[ 1-(4-méthylbenzyl)-1 H- 5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][ 1 ,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du 8N-
[ 1-(S)-Méthoxycarbonyl-2-(4-chlorophényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1 H-5imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxamide, à partir de 3,0 g de 4-[I-(4-méthylbenzyl)-IH-5-imidazolyl-méthyl]-3,4-dihydro-2H- benzo[b][1,4]oxazine-8-carboxylate de sodium, 50 cm' de dichlorométhane, 2,14 g de chlorhydrate de (L)-4-chlorophénylalaninate de méthyle, 1,79 g de chlorhydrate de 1-(3-diméthylaminopropyl)-3-éthylcarbodiimide, de 2,6 cm' de N-éthyl diisopropylamine, et de 0,13 g d'hydrate d'hydroxybenzotriazole. Après traitement du mélange réactionnel, le produit brut est chromatographié sur une colonne de gel de silice (granulométrie 0,04 - 0,063 mm, diamètre 4 cm, hauteur 27 cm), en éluant sous une pression d'argon de 0,5 bar avec un mélange de dichlorométhane et de méthanol (99 1 en volumes), et en recueillant des fractions de 60 cm . Les fractions 20 à 34 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On obtient 2,70 g de
8N-[ 1-(S)-méthoxycarbonyl-2-(4-chlorophényl)éthyl]-4-[ 1-(4-méthylbenzyl)-1 1 H-5- imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'une meringue crème.
Spectre de masse : IE m/z = 558 M* 'H NMR (400 MHz, DMSO-d6) : d en ppm : 2,30 (3H, s), entre 3,05 et 3,25 (4H, m), 3,70 (3H, s), 4,10 (1H, m), 4,18 (1H, m), 4,35 (2H, s), 4,72 (IH, m), 5,22 (2H, s), 6,80 (2H, m), 6,88 (1H, s), 7,05 (3H, m), 7,20 (2H, d, J=7Hz), 7,32 (2H, d, J=7Hz), 7,43 (2H, d, J=7Hz), 7,80 (1H, s), 8,38 (1H, d, J=6Hz).
<Desc/Clms Page number 67>
Exemple 13
Le monohydrate de 3-(4-chlorophényl)-2{{4-[l-(4-méthyIbenzyI)-lH-5-imidazoIylméthyl]-3,4-dihydro-2H-benzo[b][ 1 ,4]oxazine-8-carbonyl}-amino }-propionate de sodium peut être préparé en opérant de la façon suivante : A une solution de 1,4 g de 8N-[I-(S)-méthoxycarbonyl-2-(4-chlorophényl)éthyl]-4- [ 1 -(4-méthylbenzyl)- H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b)[ 1 ,4]oxazine- 8-carboxamide dans 25 cm' de tétrahydrofurane, on ajoute 2,5 cm' d'hydroxyde de sodium IN et 12 cm de méthanol. Après 20 heures d'agitation à 20 C, le mélange réactionnel est concentré à sec sous pression réduite (2,7 kPa). Le résidu est additionné de 20 cm3d'oxyde de diéthyle, la suspension résultante est filtrée, le solide essoré, puis séché sous pression réduite à 40 C. On obtient 1,3 g de monohydrate de 3-(4-chlorophényl)-2 { {4-[ 1-(4-méthylbenzyl)-1H-5-imidazolyl-méthyl]-3,4-dihydro-
2H-benzo[b)[1,4)oxazine-8-carbonyl}-amino}-propionate de sodium, sous la forme d'un solide blanc cassé.
Le monohydrate de 3-(4-chlorophényl)-2{{4-[l-(4-méthyIbenzyI)-lH-5-imidazoIylméthyl]-3,4-dihydro-2H-benzo[b][ 1 ,4]oxazine-8-carbonyl}-amino }-propionate de sodium peut être préparé en opérant de la façon suivante : A une solution de 1,4 g de 8N-[I-(S)-méthoxycarbonyl-2-(4-chlorophényl)éthyl]-4- [ 1 -(4-méthylbenzyl)- H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b)[ 1 ,4]oxazine- 8-carboxamide dans 25 cm' de tétrahydrofurane, on ajoute 2,5 cm' d'hydroxyde de sodium IN et 12 cm de méthanol. Après 20 heures d'agitation à 20 C, le mélange réactionnel est concentré à sec sous pression réduite (2,7 kPa). Le résidu est additionné de 20 cm3d'oxyde de diéthyle, la suspension résultante est filtrée, le solide essoré, puis séché sous pression réduite à 40 C. On obtient 1,3 g de monohydrate de 3-(4-chlorophényl)-2 { {4-[ 1-(4-méthylbenzyl)-1H-5-imidazolyl-méthyl]-3,4-dihydro-
2H-benzo[b)[1,4)oxazine-8-carbonyl}-amino}-propionate de sodium, sous la forme d'un solide blanc cassé.
*Spectre de masse : IS m/z = 589 MNa+ 'H NMR (400 MHz, DMSO-d6) : d en ppm : 2,32 (3H, s), entre 3,05 et 3,25 (4H, m), 4,05 (2H, t, J=4Hz), 4,12 (1H, m), 4,31 (2H, s), 5,22 (2H, s), 6,78 (2H, m), 6,88 (IH, s), 7,05 (2H, d, J=7Hz), entre 7,10 et 7,22 (5H, m), 7,25 (2H, d, J=7Hz), 7,80 (1H, s), 8,30(lH,d,J=6Hz).
Exemple 14
Le 4-[ 1-( 4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-[2-( 4-pyridyl)éthyl]-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, peut être préparé en opérant de la façon suivante : A 0,200 g de la résine 4-(tripyrrolidinium-O-phosphonium)-2,3,5,6- tétrafluorobenzamidométhyl-copoly(styrène-1 %-divinylbenzène) à 0,77 mol/mg [nommée résine tétrafluorophénol activée (5)] on ajoute 4 cm3 de N,Ndiméthylfonnamide. Après 2 minutes d'agitation, on ajoute 0,125 g de 4-[1-(4- chlorobenzyl)- H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8-
Le 4-[ 1-( 4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-[2-( 4-pyridyl)éthyl]-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, peut être préparé en opérant de la façon suivante : A 0,200 g de la résine 4-(tripyrrolidinium-O-phosphonium)-2,3,5,6- tétrafluorobenzamidométhyl-copoly(styrène-1 %-divinylbenzène) à 0,77 mol/mg [nommée résine tétrafluorophénol activée (5)] on ajoute 4 cm3 de N,Ndiméthylfonnamide. Après 2 minutes d'agitation, on ajoute 0,125 g de 4-[1-(4- chlorobenzyl)- H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8-
<Desc/Clms Page number 68>
carboxylate de sodium, et 0,134 cm' de N-éthyl di i sopropyl amine. Après 1 heure et 30 minutes d'agitation à 20 C, la suspension est filtrée, la résine lavée, en agitant 2 minutes pour chaque lavage, avec 2 fois 2 cm' de N,N-diméthylformamide, puis avec 2 fois 3 cm de dichlorométhane, puis essorée et ensuite reprise avec 4 cm de dichlorométhane. Après 5 minutes d'agitation, on ajoute 18,6 mm de 4-(2aminoéthyl) pyridine, et 21,6 mm' de triéthylamine. Après 20 heures d'agitation à 20 C, le mélange réactionnel est filtré, la résine lavée par 3 fois 3 cm de dichlorométhane. Les filtrats réunis sont concentrés à sec sous pression réduite (0,7 kPa) à 60 C. On obtient 0,075 g de 8N-[2-(4-pyridyl)éthyl]-4-[I-(4-
chlorobenzyl)-lH-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8- carboxamide, sous la forme d'un solide jaunâtre.
chlorobenzyl)-lH-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8- carboxamide, sous la forme d'un solide jaunâtre.
'H NMR (300 MHz, DMSO-d6) : d en ppm : 2,87 (2H, t, J=6Hz), 3,10 (2H, t, J=4Hz), 3,55 (2H, q, J=6Hz), 4,08 (2H, t, J=4Hz), 4,32 (2H, s), 5,25 (2H, s), 6,76 (2H, m), 6,86 (1H, s), 6,98 (1H, m), 7,12 (2H, d, J=8Hz), 7,30 (2H, d, J=7Hz), 7,42 (2H, d, J=8Hz), 7,81 ( 1 H, s), 8,12 ( 1 H, t, J=5Hz), 8,52 (2H, d, J=7Hz).
La résine 4-(tripyrrolidinium-O-phosphonium)-2,3,5,6-tétrafluorobenzamidométhyl- copoly(styrène-l%-divinylbenzène).à 0,77 umol/mg peut être préparée en opérant de la façon suivante : A une suspension de résine 4-hydroxy-2,3,5,6-tetrafluorobenzamidométhyl- copoly(styrène-1 %-divinylbenzène) (1. 0 g, 0.97 mmol) dans le CH2CI2 (40 ml), on ajoute de l'hexafluorophosphate de bromotripyrrolidinophosphonium (PyBroP) (0. 904 g, 1. 94 mmol) et de la triéthylamine (TEA) (0. 272 ml, 1. 94 mmol) et le mélange est agité pendant 15 heures à température ambiante puis filtré. La résine est lavée avec CH2Cl2 (10 x 10 mL) et séchée in vacuo à 20 C pour donner la résine 4-(tripyrrolidinium-O-phosphonium)-2,3,5,6-tétrafluorobenzamidométhyl-copoly (styrène-1%-divinylbenzène).
'HNMR 8: 2. 00 (s, CH2,12H); 3. 30 (s, NCH2,12H); 4. 50 (NCH2Ar). IR 3082, 2977,1651,1452,1317,1220,1108,991,847,758.
<Desc/Clms Page number 69>
19F NMR d: -75 (3F); -78 (3F); -141 (2F); -156 (2F).
La résine 4-hydroxy-2,3,5,6-tétrafluorobenzamidomethyl-copoly(styrène-l %divinylbenzène) appelée résine tétrafluorophénol (3) peut être préparée de la façon suivante : L'aminométhyl polystyrène (0.39 mmol/ gm) ; 2. 0 gm ; 0. 78 mmol) est trempée dans du DMF (15 ml) pendant 5 minutes dans une cartouche de seringue en polypropylène.
A la suspension de résine est ajouté le diisopropylcarbodiimide (492 mg ; mmol), l'acide 2,3,5,6-tétrafluoro-4-hydroxybenzoïque (819. 35 mg ; 3. 9 mmol) et le 4-diméthylaminopyridine (50 mg). Le mélange réactionnel est agité doucement à température ambiante pendant une nuit. Ensuite, le mélange réactionnel est filtré et lavé avec du DMF (3 x 20 mL), THF (3 x 20 mL), et CH2C12 (3 x 20 mL). La résine est séchée in vacuo pendant une nuit à 40 C.
IR 1764, 1691, 1653 cm-1.
Analyse élémentaire: calcd: N, 0.46 ; 2. 51. Found : 0. 57, 0.56 ; 3. 65 3.68.
La résine est ensuite placée dans une cartouche en polypropylène et traitée avec une solution de pipéridine à 10 % dans le DMF (3 ml) et agitée doucement pendant une nuit. Ensuite, le mélange réactionnel est filtré et lavé avec DMF (3 x 20 mL), THF (3 x 20 ml), etCH2Cl2 (3 x 20 ml). La résine est séchée in vacuo pendant une nuit à 40 C. Le spectre IR de la résine montre la perte du signal du carbonyle à 1764 cm-1, du à la formation de l'ester de phénol.
Exemple 15
Le 4-[1-(4-chlorobenzyl)-1H-5-imidazolyl-méthyl]-8N-[2-phényléthyl]-3,4-dihydro- 2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[I-(4-chlorobenzyl)-IH-5imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm' de N,N-diméthylformamide, 0,125 g de 4-[I-(4-chlorobenzyl)-IH-5-imidazolyl-méthyl]-
3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium, 0,134 cm3 de N-éthyl
Le 4-[1-(4-chlorobenzyl)-1H-5-imidazolyl-méthyl]-8N-[2-phényléthyl]-3,4-dihydro- 2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[I-(4-chlorobenzyl)-IH-5imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm' de N,N-diméthylformamide, 0,125 g de 4-[I-(4-chlorobenzyl)-IH-5-imidazolyl-méthyl]-
3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium, 0,134 cm3 de N-éthyl
<Desc/Clms Page number 70>
diisopropylamine, 4 cm de dichlorométhane, 19,3 mm' de 2-phényléthylamine, et de 21,6 mm' de triéthylamine. On obtient 0,072 g de 8N-[2-(4-chlorophényl)éthyl]-4-[l -
(4-chlorobenzyl)-lH-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][l,4]oxazine-8- carboxamide, sous la forme d'un solide jaunâtre.
(4-chlorobenzyl)-lH-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][l,4]oxazine-8- carboxamide, sous la forme d'un solide jaunâtre.
'H NMR (300 MHz, DMSO-d6) : d en ppm : 2,84 (2H, t, J=6Hz), 3,10 (2H, t, J=4Hz), 3,40 (2H, q, J=6Hz), 4,07 (2H, t, J=4Hz), 4,31 (2H, s), 5,26 (2H, s), 6,78 (2H, m), 6,87 (1H, s), 6,98 (1H, m), 7,03 (1H, t, J=7Hz), 7,12 (2H, d, J=8Hz), entre 7,20 et 7,40 (5H, m), 7,42 (2H, d, J=8Hz), 7,81 (1H, s), 8,08 (1H, t, J=5Hz).
Exemple 16
Le 4-[1-(4-chlorobenzyl)-1H-5-imidazolyl-méthyl]-8N-isopentyl-3,4-dihydro-2H- benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[I-(4-chlorobenzyl)-IH-5-imidazolyl-
méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8- carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm3 de N,N-diméthylformamide, 0,125 g de 4-[I-(4-chlorobenzyl)-IH-5-imidazolyl-méthyl]- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium, 0,134 cm' de N-éthyl diisopropylamine, 4 cm' de dichlorométhane, 17,9 mm' d'isopentylamine, et de 21,6mm de triéthylamine. On obtient 0,065 g de 4-[I-(4-chlorobenzyl)-IH-5-
imidazolyl-méthyl]-8N-isopentyl-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8- carboxamide, sous la forme d'un solide jaunâtre.
Le 4-[1-(4-chlorobenzyl)-1H-5-imidazolyl-méthyl]-8N-isopentyl-3,4-dihydro-2H- benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[I-(4-chlorobenzyl)-IH-5-imidazolyl-
méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8- carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm3 de N,N-diméthylformamide, 0,125 g de 4-[I-(4-chlorobenzyl)-IH-5-imidazolyl-méthyl]- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium, 0,134 cm' de N-éthyl diisopropylamine, 4 cm' de dichlorométhane, 17,9 mm' d'isopentylamine, et de 21,6mm de triéthylamine. On obtient 0,065 g de 4-[I-(4-chlorobenzyl)-IH-5-
imidazolyl-méthyl]-8N-isopentyl-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8- carboxamide, sous la forme d'un solide jaunâtre.
Exemple 17
Le 4-[ 1-(4-chlorobenzyl)-1 H-S-imidazolyl-méthyl]-8N-[2-(2-hydroxyéthoxy)éthyl]- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[1-(4-chlorobenzyl)-
1 H-5-imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H-benzo[b] [ 1,4] oxazine-8-carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm3 de N,N-diméthylformamide, 0,125 g de 4-[I-(4-chlorobenzyl)-IH-5-
Le 4-[ 1-(4-chlorobenzyl)-1 H-S-imidazolyl-méthyl]-8N-[2-(2-hydroxyéthoxy)éthyl]- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[1-(4-chlorobenzyl)-
1 H-5-imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H-benzo[b] [ 1,4] oxazine-8-carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm3 de N,N-diméthylformamide, 0,125 g de 4-[I-(4-chlorobenzyl)-IH-5-
<Desc/Clms Page number 71>
imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium, 0,134 cm' de N-éthyl diisopropylamine, 4 cm' de dichlorométhane, 15,4 cm3 de 2-(2aminoéthoxy) éthanol, et de 21,6 mm' de triéthylamine. On obtient 0,059 g de 4-[1- (4-chlorobenzyl)-l H-5-imidazolyl-méthyl]-8N-[2-(2-hydroxyéthoxy)éthyl]-3,4dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'une huile jaunâtre.
'H NMR (400 MHz, DMSO-d6) : d en ppm : 3,17 (2H, t, J=4Hz), 3,46 (2H, q, J=6Hz), 3,50 (2H, t, J=5Hz), 3,55 (4H, m), 4,20 (2H, t, J=4Hz), 4,35 (2H, s), 4,66 (1H, t, J=6Hz), 5,30 (2H, s), 6,80 (2H, m), 6,90 (1H, s), 7,10 (1H, dd, J=4 et 5Hz), 7,16 (2H, d, J=8Hz), 7,46 (2H, d, J=8Hz), 7,83 (1H, s), 8,19 (1H, t, J=5Hz).
Exemple 18
Le 4-[1-( 4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-( 4-hydroxybutyl)-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[I-(4-chlorobenzyl)-IH-5-
imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8- carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm3 de N,N-diméthylformamide, 0,125 g de 4-[I-(4-chlorobenzyl)-IH-5-imidazolyl-méthyl]- 3,4-dihydro-2H-benzo[b][l,4]oxazine-8-carboxylate de sodium, 0,134 cm de N-éthyl diisopropylamine, 4 cm' de dichlorométhane, 14,2 mm' de 4-aminobutanol, et de 21,6 mm 3 de triéthylamine. On obtient 0,056 g de 4-[I-(4-chlorobenzyl)-IH-5-
imidazolyl-méthyl]-8N-(4-hydroxybutyl)-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8- carboxamide, sous la forme d'une huile jaunâtre.
Le 4-[1-( 4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-( 4-hydroxybutyl)-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[I-(4-chlorobenzyl)-IH-5-
imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8- carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm3 de N,N-diméthylformamide, 0,125 g de 4-[I-(4-chlorobenzyl)-IH-5-imidazolyl-méthyl]- 3,4-dihydro-2H-benzo[b][l,4]oxazine-8-carboxylate de sodium, 0,134 cm de N-éthyl diisopropylamine, 4 cm' de dichlorométhane, 14,2 mm' de 4-aminobutanol, et de 21,6 mm 3 de triéthylamine. On obtient 0,056 g de 4-[I-(4-chlorobenzyl)-IH-5-
imidazolyl-méthyl]-8N-(4-hydroxybutyl)-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8- carboxamide, sous la forme d'une huile jaunâtre.
'H NMR (400 MHz, DMSO-d6) : d en ppm : entre 1,45 et 1,60 (4H, m), 3,16 (2H, t, J=4Hz), 3,28 (2H, q, J=6Hz), 3,46 (2H, q, J=6Hz), 4,17 (2H, t, J=4Hz), 4,34 (2H, s), 4,45 (1H, t, J=6Hz), 5,29 (2H, s), 6,79 (2H, m), 6,90 (1H, s), 7,01 (1H, dd, J=4 et 5Hz), 7,16 (2H, d, J=8Hz), 7,46 (2H, d, J=8Hz), 7,84 (1H, s), 8,07 (1H, t, J=5Hz).
<Desc/Clms Page number 72>
Exemple 19
Le 4-[I-(4-chlorobenzyl)- H-5-imidazolyl-méthyl]-8N-[(2-(2,4-dichlorophényl) éthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[1-(4-
chlorobenzyl)-l H -5-imidazolyl-méthyl] -8N -[2 -( 4-pyridinyl)éthyl] - 3 ,4-dihydro-2H- benzo[b][1,4]oxazine-8-carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm de N,N-diméthylforrnamide, 0,125 g de 4-[I-(4-chlorobenzyl)-IH-
5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b)[1,4]oxazine-8-carboxylate de sodium, 0,134 cm' de N-éthyl diisopropylamine, 4 cm' de dichlorométhane, 23,2 mm de 2-(2,4-dichlorophényl)éthylamine, et de 21,6 mm3de triéthylamine. On obtient
0,069 g de 4-[1-(4-chlorobenzyl)-1H-5-imidazolyl-méthyl]-8N-[(2-(2,4dichlorophényl)éthyl]-3,4-dihydro-2H-benzo[bJ[1,4]oxazine-8-carboxamide, sous la forme d'une huile jaunâtre.
Le 4-[I-(4-chlorobenzyl)- H-5-imidazolyl-méthyl]-8N-[(2-(2,4-dichlorophényl) éthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[1-(4-
chlorobenzyl)-l H -5-imidazolyl-méthyl] -8N -[2 -( 4-pyridinyl)éthyl] - 3 ,4-dihydro-2H- benzo[b][1,4]oxazine-8-carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm de N,N-diméthylforrnamide, 0,125 g de 4-[I-(4-chlorobenzyl)-IH-
5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b)[1,4]oxazine-8-carboxylate de sodium, 0,134 cm' de N-éthyl diisopropylamine, 4 cm' de dichlorométhane, 23,2 mm de 2-(2,4-dichlorophényl)éthylamine, et de 21,6 mm3de triéthylamine. On obtient
0,069 g de 4-[1-(4-chlorobenzyl)-1H-5-imidazolyl-méthyl]-8N-[(2-(2,4dichlorophényl)éthyl]-3,4-dihydro-2H-benzo[bJ[1,4]oxazine-8-carboxamide, sous la forme d'une huile jaunâtre.
'H NMR (300 MHz, DMSO-d6) : d en ppm : 2,95 (2H, t, J=6Hz), 3,10 (2H, t, J=4Hz), 3,50 (2H, q, J=6Hz), 4,08 (2H, t, J=4Hz), 4,30 (2H, s), 5,25 (2H, s), 6,75 (2H, m), 6,87 (1H, s), 6,95 (1H, m), 7,11(2H, d, J=8Hz), 7,40 (4H, m), 7,60 (1H, s),
7,80 ( 1 H, s), 8,10 ( 1 H, t, J=5 Hz).
7,80 ( 1 H, s), 8,10 ( 1 H, t, J=5 Hz).
Exemple 20 Le 4-[ 1-(4-chlorobenzyl)-1 1 H-5-imidazolyl-méthyl]-8N-(6-hydroxyhexyl)-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme
il est décrit dans l'exemple 14, pour la préparation du 4-[1-(4-chlorobenzyl)-IH-5imidazolyl-méthylJ-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm de N,N-diméthylformamide, 0,125 g de 4-[l-(4-chlorobenzyl)-lH-5-imidazolyl-méthyl]- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium, 0,134 cm3 de N-éthyl diisopropylamine, 4 cm de dichlorométhane, 0,018 g de 6-amino-1-hexanol, et de 21,6 mm3 de triéthylamine. On obtient 0,061 g de 4-[I-(4-chlorobenzyl)-IH-5-
il est décrit dans l'exemple 14, pour la préparation du 4-[1-(4-chlorobenzyl)-IH-5imidazolyl-méthylJ-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm de N,N-diméthylformamide, 0,125 g de 4-[l-(4-chlorobenzyl)-lH-5-imidazolyl-méthyl]- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium, 0,134 cm3 de N-éthyl diisopropylamine, 4 cm de dichlorométhane, 0,018 g de 6-amino-1-hexanol, et de 21,6 mm3 de triéthylamine. On obtient 0,061 g de 4-[I-(4-chlorobenzyl)-IH-5-
<Desc/Clms Page number 73>
imidazolyl-méthyl]-8N-(6-hydroxyhexyl)-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8carboxamide, sous la forme d'une huile jaunâtre.
'H NMR (300 MHz, DMSO-d6) : d en ppm : entre 1,25 et 1,60 (8H, m), 3,13(2H, t, J=4Hz), 3,25 (2H, q, J=6Hz), 3,42 (2H, q, J=6Hz), 4,15 (2H, t, J=4Hz), 4,32 (2H, s), 4,37 (1H, t, J=6Hz), 5,27 (2H, s), 6,75 (2H, m), 6,87 (1H, s), 6,98 (1H, dd, J=4 et 5Hz), 7,13 (2H, d, J=8Hz), 7,43 (2H, d, J=8Hz), 7,82 ( 1 H, s), 8,03 ( 1 H, t, J=5Hz).
Exemple 21
Le 4-[ 1-(4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-[ 1-hydroxy-4-méthylsulfanyl- 2(S)-butyl] 3,4-dihydro-2H-benzo[b][l,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[1-(4-
chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H- benzo[b][1,4]oxazine-8-carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm' de N,N-diméthylformamide, 0,125 g de 4-[I-(4-chlorobenzyl)-IH-
5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[bJ[1,4]oxazine-8-carboxylate de sodium, 0,134 cm' de N-éthyl diisopropylamine, 4 cm3 de dichlorométhane, 0,021 g de (L)méthioninol, et de 21,6 mm' de triéthylamine. On obtient 0,064 g de 4-[1-(4-
chlorobenzyl)-lH-5-imidazolyl-méthyl]-8Nl-hydroxy-4-méthylsulfanyl-2(S)-butyl]- 3,4-dihydro-2H-benzo[b][l,4]oxazine-8-carboxamide, sous la forme d'une huile jaunâtre.
Le 4-[ 1-(4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-[ 1-hydroxy-4-méthylsulfanyl- 2(S)-butyl] 3,4-dihydro-2H-benzo[b][l,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[1-(4-
chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H- benzo[b][1,4]oxazine-8-carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm' de N,N-diméthylformamide, 0,125 g de 4-[I-(4-chlorobenzyl)-IH-
5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[bJ[1,4]oxazine-8-carboxylate de sodium, 0,134 cm' de N-éthyl diisopropylamine, 4 cm3 de dichlorométhane, 0,021 g de (L)méthioninol, et de 21,6 mm' de triéthylamine. On obtient 0,064 g de 4-[1-(4-
chlorobenzyl)-lH-5-imidazolyl-méthyl]-8Nl-hydroxy-4-méthylsulfanyl-2(S)-butyl]- 3,4-dihydro-2H-benzo[b][l,4]oxazine-8-carboxamide, sous la forme d'une huile jaunâtre.
'H NMR (300 MHz, DMSO-d6) : d en ppm : 1,72 (2H, m), 1,90 (2H, m), 2,08 (3H, s), 3,15 (2H, t, J=4Hz), 3,40 ( 1 H, m), 3,52 ( 1 H, m), 4,03 (1H, m), 4,15 (2H, m), 4,32 (2H, s), 4,37 (1H, t, J=6Hz), 5,27 (2H, s), 6,75 (2H, m), 6,87 (1H, s), 6,98 (1H, m), 7,13 (2H, d, J=8Hz), 7,43 (2H, d, J=8Hz), 7,82 (1H, s), 7,87 (1H, d, J=8Hz).
Exemple 22
Le 4-[1-(4-chlorobenzyl)-1H-5-imidazolyl-méthyl]-8N-[(RS)-2-tétrahydrofurylméthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[1-(4-
Le 4-[1-(4-chlorobenzyl)-1H-5-imidazolyl-méthyl]-8N-[(RS)-2-tétrahydrofurylméthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[1-(4-
<Desc/Clms Page number 74>
chlorobenzyl)-l H-5-imidazolyl-méthyl]-8N -[2-( 4-pyridyl)éthyl]-3,4-dihydro-2Hbenzo[b](l,4Joxazine-8-carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm' de N,N-diméthylformamide, 0,125 g de 4-[I-(4-chlorobenzyl)-IH- 5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium, 0,134 cm' de N-éthyl diisopropylamine, 4 cm' de dichlorométhane, 15,9 mm' de (RS)-(2-tétrahydrofuryl)méthylamine, et de 21,6 mm3de triéthylamine. On obtient
0,057 g de 4-[1-(4-chlorobenzyl)-1H-5-imidazolyl-méthyl]-8N-[(RS)-2-(tétrahydrofuryl)méthyl]-3,4-dihydro-2H-benzo[bJ[1,4]oxazine-8-carboxamide, sous la forme d'une huile jaunâtre.
'H NMR (300 MHz, DMSO-d6) : d en ppm : 1,62 (1H, m), entre 1,80 et 2,00 (3H, m), 3,15 (2H, t, J=4Hz), 3,35 (2H, m), 3,67 (1H, q, J=6Hz), 3,80 (1H, q, J=6Hz), 3,98 (1H, m), 4,15 (2H, m), 4,32 (2H, s), 5,26 (2H, s), 6,78 (2H, m), 6,87 (1H, s), 7,08 (1H, m), 7,12 (2H, d, J=8Hz), 7,43 (2H, d, J=8Hz), 7,81 (1H, s), 8,09 (1H, t, J=5Hz).
Exemple 23
Le 4-[l-(4-chlorobenzyl)-lH-5-imidazolyl-méthyl]-8N-[2-(2-pyridyl)éthyl]-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme
il est décrit dans l'exemple 14, pour la préparation du 4-[l-(4-chlorobenzyl)-lH-5imidazolyl-méthylJ-8N-[2-(4-pyridyl)éthylJ-3,4-dihydro-2H-benzo[bJ[ 1,4]oxazine-8carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm de N,N-diméthylformamide, 0,125 g de 4-[l-(4-chlorobenzyl)-lH-5-imidazolyl-méthyl]- 3,4-dihydro-2H-benzo[b][l,4]oxazine-8-carboxylate de sodium, 0,134 cl de N-éthyl diisopropylamine, 4 cm' de dichlorométhane, 18,4 mm de 2-(2-aminoéthyl)pyridine, et de 21,6 mm' de triéthylamine. On obtient 0,061 g de 4-[l-(4-chlorobenzyl)-lH-5imidazolyl-méthylJ-8N-[2-(2-pyridyl)éthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8- carboxamide, sous la forme d'une huile jaunâtre.
Le 4-[l-(4-chlorobenzyl)-lH-5-imidazolyl-méthyl]-8N-[2-(2-pyridyl)éthyl]-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme
il est décrit dans l'exemple 14, pour la préparation du 4-[l-(4-chlorobenzyl)-lH-5imidazolyl-méthylJ-8N-[2-(4-pyridyl)éthylJ-3,4-dihydro-2H-benzo[bJ[ 1,4]oxazine-8carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm de N,N-diméthylformamide, 0,125 g de 4-[l-(4-chlorobenzyl)-lH-5-imidazolyl-méthyl]- 3,4-dihydro-2H-benzo[b][l,4]oxazine-8-carboxylate de sodium, 0,134 cl de N-éthyl diisopropylamine, 4 cm' de dichlorométhane, 18,4 mm de 2-(2-aminoéthyl)pyridine, et de 21,6 mm' de triéthylamine. On obtient 0,061 g de 4-[l-(4-chlorobenzyl)-lH-5imidazolyl-méthylJ-8N-[2-(2-pyridyl)éthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8- carboxamide, sous la forme d'une huile jaunâtre.
'H NMR (300 MHz, DMSO-d6) : d en ppm : 3,00 (2H, t, J=6Hz), 3,12 (2H, t, J=4Hz), 3,65 (2H, q, J=6Hz), 4,10 (2H, t, J=4Hz), 4,31 (2H, s), 5,26 (2H, s), 6,78 (2H, m), 6,87 (IH, s), 7,07 (1H, m), 7,12 (2H, d, J=8Hz), 7,27 (1H, dd, J=5 et 8Hz),
<Desc/Clms Page number 75>
7,32 (1H, d, J=8Hz), 7,43 (2H, d, J=8Hz), 7,75 (1H, t, J=8Hz), 7,81(1H, s), 8,29 (1H, t, J=5Hz), 8,56 (1H, d, J=5Hz).
Exemple 24
Le 4-[ 1 -(4-chlorobenzyl)- 1 H-5-imidazoIyl-méthyl]-8N-(3 -pyridylméthyl)-3 ,4dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[ 1-( 4-chlorobenzyl)-1 H -5imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm' de N,N-diméthylformamide, 0,125 g de 4-[1-(4-chlorobenzyl)-1H-5-imidazolyl-méthyl]- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium, 0,134 cm' de N-éthyl diisopropylamine, 4 cm' de dichlorométhane, 15,7 mm3 de 3-aminométhylpyridine, et de 21,6 mm3 de triéthylamine. On obtient 0,058 g de 4-[I-(4-chlorobenzyl)-IH-5-
imidazolyl-méthyl]-8N-(3-pyridylméthyl)-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8- carboxamide, sous la forme d'une huile jaunâtre.
Le 4-[ 1 -(4-chlorobenzyl)- 1 H-5-imidazoIyl-méthyl]-8N-(3 -pyridylméthyl)-3 ,4dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[ 1-( 4-chlorobenzyl)-1 H -5imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm' de N,N-diméthylformamide, 0,125 g de 4-[1-(4-chlorobenzyl)-1H-5-imidazolyl-méthyl]- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium, 0,134 cm' de N-éthyl diisopropylamine, 4 cm' de dichlorométhane, 15,7 mm3 de 3-aminométhylpyridine, et de 21,6 mm3 de triéthylamine. On obtient 0,058 g de 4-[I-(4-chlorobenzyl)-IH-5-
imidazolyl-méthyl]-8N-(3-pyridylméthyl)-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8- carboxamide, sous la forme d'une huile jaunâtre.
'H NMR (300 MHz, DMSO-d6) : d en ppm : 3,15 (2H, t, J=4Hz), 4,16 (2H, t, J=4Hz), 4,33 (2H, s), 4,50 (2H, d, J=6Hz), 5,26 (2H, s), 6,78 (2H, m), 6,87 (1H, s), 7,02 (1H, m), 7,13 (2H, d, J=8Hz), 7,38 (1H, dd, J=5 et 8Hz), 7,43 (2H, d, J=8Hz), 7,75 (IH, d, J=8Hz), 7,81 (1H, s), 8,48 (IH, dd, J=l et 5Hz), 8,57 (1H, d, J=lHz), 8,68 (1H, t, J=6Hz).
Exemple 25
Le 4-[1-(4-chlorobenzyl)-1H-S-imidazolyl-méthyl]-8N-(2-méthoxy-éthyl)-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[I-(4-chlorobenzyl)-IH-5-
imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl)-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8- carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm' de N,N-diméthylformamide, 0,125 g de 4-[I-(4-chlorobenzyl)-IH-5-imidazolyl-méthyl]-
3,4-dihydro-2H-benzofb][1,4]oxazine-8-carboxylate de sodium, 0,134 cm3 de N-éthyl
Le 4-[1-(4-chlorobenzyl)-1H-S-imidazolyl-méthyl]-8N-(2-méthoxy-éthyl)-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[I-(4-chlorobenzyl)-IH-5-
imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl)-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8- carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm' de N,N-diméthylformamide, 0,125 g de 4-[I-(4-chlorobenzyl)-IH-5-imidazolyl-méthyl]-
3,4-dihydro-2H-benzofb][1,4]oxazine-8-carboxylate de sodium, 0,134 cm3 de N-éthyl
<Desc/Clms Page number 76>
diisopropylamine, 4 cm' de dichlorométhane, 13,4 mm' de 2-méthoxyéthylamine, et
de 21,6 mm' de triéthylamine. On obtient 0,052 g de 4-[ 1-(4-chlorobenzyl)-1 H-5imidazolyl-méthyl]-8N-(2-méthoxy-éthyl)-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8- carboxamide, sous la forme d'une meringue jaunâtre.
de 21,6 mm' de triéthylamine. On obtient 0,052 g de 4-[ 1-(4-chlorobenzyl)-1 H-5imidazolyl-méthyl]-8N-(2-méthoxy-éthyl)-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8- carboxamide, sous la forme d'une meringue jaunâtre.
'H NMR (300 MHz, DMSO-d6) : d en ppm : 3,14 (2H, t, J=4Hz), 3,30 (3H, s), 3,45 (4H, m), 4,16 (2H, t, J=4Hz), 4,32 (2H, s), 5,27 (2H, s), 6,78 (2H, m), 6,87 (1H, s), 7,08 ( 1 H, m), 7,13 (2H, d, J=8Hz), 7,43 (2H, d, J=8Hz), 7,81 (1H, s), 8,12 ( 1 H, t, J=6Hz).
Exemple 26
Le 4-[ 1-( 4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-[(2-(2-méthoxyphényl)éthyl]- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[l-(4-chlorobenzyl)-
1 H-S-imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H-benzo[b] [ 1,4] oxazine-8-carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm3 de N,N-diméthylformamide, 0,125 g de 4-[I-(4-chlorobenzyl)-IH-5- imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium, 0,134 cm3 de N-éthyl diisopropylamine, 4 cm de dichlorométhane, 22,5 mm de 2-(2méthoxyphényl)éthylamine, et de 21,6 mm de triéthylamine. On obtient 0,068 g de
4-[ 1-(4-chlorobenzyl)-1 H-S-imidazolyl-méthyl]-8N-[(2-(2-méthoxyphényl)éthyl]-3,4- dihydro-2H-benzo[b][l,4]oxazine-8-carboxamide, sous la forme d'une huile jaunâtre. 'H NMR (300 MHz, DMSO-d6): d en ppm: 2,83 (2H, t, J=6Hz), 3,11 (2H, t, J=4Hz), 3,47 (2H, q, J=6Hz), 3,80 (3H, s), 4,08 (2H, t, J=4Hz), 4,31 (2H, s), 5,27 (2H, s), 6,78 (2H, m), 6,88 (1H, s), 6,92 ( 1 H, t, J=7Hz), 7,00 ( 1 H, d, J=7Hz), 7,03 ( 1 H, m), 7,13 (2H, d, J=8Hz), 7,20 ( 1 H, d, J=7Hz), 7,25 ( 1 H, t, J=7Hz), 7,43 (2H, d, J=8Hz), 7,81 ( 1 H, s), 8,00 ( 1 H, t, J=6Hz).
Le 4-[ 1-( 4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-[(2-(2-méthoxyphényl)éthyl]- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[l-(4-chlorobenzyl)-
1 H-S-imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H-benzo[b] [ 1,4] oxazine-8-carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm3 de N,N-diméthylformamide, 0,125 g de 4-[I-(4-chlorobenzyl)-IH-5- imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium, 0,134 cm3 de N-éthyl diisopropylamine, 4 cm de dichlorométhane, 22,5 mm de 2-(2méthoxyphényl)éthylamine, et de 21,6 mm de triéthylamine. On obtient 0,068 g de
4-[ 1-(4-chlorobenzyl)-1 H-S-imidazolyl-méthyl]-8N-[(2-(2-méthoxyphényl)éthyl]-3,4- dihydro-2H-benzo[b][l,4]oxazine-8-carboxamide, sous la forme d'une huile jaunâtre. 'H NMR (300 MHz, DMSO-d6): d en ppm: 2,83 (2H, t, J=6Hz), 3,11 (2H, t, J=4Hz), 3,47 (2H, q, J=6Hz), 3,80 (3H, s), 4,08 (2H, t, J=4Hz), 4,31 (2H, s), 5,27 (2H, s), 6,78 (2H, m), 6,88 (1H, s), 6,92 ( 1 H, t, J=7Hz), 7,00 ( 1 H, d, J=7Hz), 7,03 ( 1 H, m), 7,13 (2H, d, J=8Hz), 7,20 ( 1 H, d, J=7Hz), 7,25 ( 1 H, t, J=7Hz), 7,43 (2H, d, J=8Hz), 7,81 ( 1 H, s), 8,00 ( 1 H, t, J=6Hz).
<Desc/Clms Page number 77>
Exemple 27
Le 4-[ 1-( 4-chlorobenzyl)-1 H-J-imidazo)y)-méthy[]-8N-[(2-(2-ch)orophényt)éthyt]- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[1-(4-chlorobenzyl)- 1 H-5-imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H-benzo[b] [ 1,4] oxazine-8-carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5),
4 cm' de N,N-diméthylformamide, 0,125 g de 4-[ 1-(4-chlorobenzyl)-1 H-5- imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium, 0,134 cm' de N-éthyl diisopropylamine, 4 cm3de dichlorométhane, 21,7 mm3de 2-(2chlorophényl)éthylamine, et de 21,6 mm de triéthylamine. On obtient 0,080 g de 4-[ 1-(4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-[(2-(2-chlorophényl)éthyl]-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'une huile jaunâtre.
Le 4-[ 1-( 4-chlorobenzyl)-1 H-J-imidazo)y)-méthy[]-8N-[(2-(2-ch)orophényt)éthyt]- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[1-(4-chlorobenzyl)- 1 H-5-imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H-benzo[b] [ 1,4] oxazine-8-carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5),
4 cm' de N,N-diméthylformamide, 0,125 g de 4-[ 1-(4-chlorobenzyl)-1 H-5- imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium, 0,134 cm' de N-éthyl diisopropylamine, 4 cm3de dichlorométhane, 21,7 mm3de 2-(2chlorophényl)éthylamine, et de 21,6 mm de triéthylamine. On obtient 0,080 g de 4-[ 1-(4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-[(2-(2-chlorophényl)éthyl]-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'une huile jaunâtre.
'H NMR (300 MHz, DMSO-d6) : d en ppm : 2,95 (2H, t, J=6Hz), 3,11 (2H, t, J=4Hz), 3,53 (2H, q, J=6Hz), 4,08 (2H, t, J=4Hz), 4,31 (2H, s), 5,26 (2H, s), 6,77 (2H, m), 6,88 (1H, s), 7,01 (1H, m), 7,13 (2H, d, J=8Hz), entre 7,37 et 7,50 (6H, m),
7,81 (1 H, s), 8,12 ( 1 H, t, J=6Hz).
7,81 (1 H, s), 8,12 ( 1 H, t, J=6Hz).
Exemple 28 Le 4-[ 1-(4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-[(2-(3-méthoxyphényl)éthyl]- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[1-(4-chlorobenzyl)-
lH-5-imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H-benzo[b][l,4] oxazine-8-carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm 3 de N,N-diméthylformamide, 0,125 g de 4-[I-(4-chlorobenzyl)-IH-5- imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium, 0,134 cm3 de N-éthyl diisopropylamine, 4 cm3de dichlorométhane, 22,4 mm3 de 2-(3méthoxyphényl)éthylamine, et de 21,6 mm' de triéthylamine. On obtient 0,063 g de
lH-5-imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H-benzo[b][l,4] oxazine-8-carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm 3 de N,N-diméthylformamide, 0,125 g de 4-[I-(4-chlorobenzyl)-IH-5- imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium, 0,134 cm3 de N-éthyl diisopropylamine, 4 cm3de dichlorométhane, 22,4 mm3 de 2-(3méthoxyphényl)éthylamine, et de 21,6 mm' de triéthylamine. On obtient 0,063 g de
<Desc/Clms Page number 78>
4-[ 1-(4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-[(2-(3-méthoxyphényl)éthyl]-3,4dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'une huile jaunâtre. 'H NMR (300 MHz, DMSO-d6): d en ppm : 2,83 (2H, t, J=6Hz), 3,11 (2H, t, J=4Hz), 3,51 (2H, q, J=6Hz), 3,77 (3H, s), 4,08 (2H, t, J=4Hz), 4,31 (2H, s), 5,25 (2H, s), 6,78 (2H, m), entre 6,79 et 6,87 (3H, m), 6,88 (1H, s), 7,03 (1H, m), 7,13 (2H, d, J=8Hz), 7,25 (1H, t, J=7Hz), 7,43 (2H, d, J=8Hz), 7,81 (1H, s), 8,07 ( 1 H, t, J=6Hz).
Exemple 29
Le 4-[1-(4-chlorobenzyl)-1H-5-imidazolyl-méthyl]-8N-[(2-(4-fluorophényl)éthyl]- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[I-(4-chlorobenzyl)-
1 H-S-imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H-benzo[b] [ 1,4] oxazine-8-carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm de N,N-diméthylformamide, 0,125 g de 4-[I-(4-chlorobenzyl)-IH-5-imidazolyl- méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium, 0,134 cm de N-éthyl diisopropylamine, 4 cm de dichlorométhane, 20,2 mm3 de 2-(4fluorophényl) éthylamine, et de 21,6 mm de triéthylamine. On obtient 0,059 g de
4-[ 1-(4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-[(2-(4-fluorophényl)éthyl]-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'une huile jaunâtre. 'H NMR (300 MHz, DMSO-d6) : d en ppm : 2,83 (2H, t, J=6Hz), 3,11 (2H, t, J=4Hz), 3,48 (2H, q, J=6Hz), 4,09 (2H, t, J=4Hz), 4,31 (2H, s), 5,27 (2H, s), 6,78 (2H, m), 6,88 (1H, s), 7,03 (1H, m), 7,13 (2H, d, J=8Hz), 7,15 (2H, t, J=8Hz), 7,32 (2H, dd, J=6 et 8Hz), 7,43 (2H, d, J=8Hz), 7,81 (1H, s), 8,07 (1H, t, J=6Hz).
Le 4-[1-(4-chlorobenzyl)-1H-5-imidazolyl-méthyl]-8N-[(2-(4-fluorophényl)éthyl]- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[I-(4-chlorobenzyl)-
1 H-S-imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H-benzo[b] [ 1,4] oxazine-8-carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm de N,N-diméthylformamide, 0,125 g de 4-[I-(4-chlorobenzyl)-IH-5-imidazolyl- méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium, 0,134 cm de N-éthyl diisopropylamine, 4 cm de dichlorométhane, 20,2 mm3 de 2-(4fluorophényl) éthylamine, et de 21,6 mm de triéthylamine. On obtient 0,059 g de
4-[ 1-(4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-[(2-(4-fluorophényl)éthyl]-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'une huile jaunâtre. 'H NMR (300 MHz, DMSO-d6) : d en ppm : 2,83 (2H, t, J=6Hz), 3,11 (2H, t, J=4Hz), 3,48 (2H, q, J=6Hz), 4,09 (2H, t, J=4Hz), 4,31 (2H, s), 5,27 (2H, s), 6,78 (2H, m), 6,88 (1H, s), 7,03 (1H, m), 7,13 (2H, d, J=8Hz), 7,15 (2H, t, J=8Hz), 7,32 (2H, dd, J=6 et 8Hz), 7,43 (2H, d, J=8Hz), 7,81 (1H, s), 8,07 (1H, t, J=6Hz).
Exemple 30
Le 8N-[(2-(4-bromophényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1 1 H-5-imidazolyl-méthyl]- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[1-(4-chlorobenzyl)-
Le 8N-[(2-(4-bromophényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1 1 H-5-imidazolyl-méthyl]- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[1-(4-chlorobenzyl)-
<Desc/Clms Page number 79>
1 H-5-imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H-benzo[b)[ 1,4] oxazine-8-carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm 3 de N,N-diméthylformamide, 0,125 g de 4-[I-(4-chlorobenzyl)-IH-5-
imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium, 0,134 cm' de N-éthyl diisopropylamine, 4 cm' de dichlorométhane, 23,9 mm3 de 2-(4bromophényl)éthylamine, et de 21,6 mm' de triéthylamine. On obtient 0,073 g de 8N-
[(2-(4-bromophényl)éthyl]-4-[l-(4-chlorobenzyl)-lH-5-imidazolyl-méthyl]-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'une huile jaunâtre. 'H NMR (300 MHz, DMSO-d6) : d en ppm : 2,82 (2H, t, J=6Hz), 3,11 (2H, t, J=4Hz), 3,48 (2H, q, J=6Hz), 4,09 (2H, t, J=4Hz), 4,31 (2H, s), 5,27 (2H, s), 6,78 (2H, m), 6,88 (1H, s), 6,99 (1H, m), 7,13 (2H, d, J=8Hz), 7,25 (2H, d, J=8Hz), 7,42 (2H, d, J=8Hz), 7,52 (2H, d, J=8Hz), 7,81 (1H, s), 8,07 (1H, t, J=6Hz).
Exemple 31
Le 4-[1-(4-chlorobenzyl)-1H-5-imidazolyl-méthyl]-8N-[(2-(4-méthoxyphényl)éthyl]- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[l-(4-chlorobenzyl)-
lH-5-imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H-benzo[b][l,4] oxazine-8-carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5),
4 cm3 de N,N-diméthylformamide, 0,125 g de 4-[ 1-(4-chlorobenzyl)-1 H-5- imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium, 0,134 cm' de N-éthyl diisopropylamine, 4 cm' de dichlorométhane, 22,5 mm' de 2-(4méthoxyphényl) éthylamine, et de 21,6 mm' de triéthylamine. On obtient 0,063 g de
4-[I-(4-chlorobenzyl)- 1 H-5-imidazolyl-méthyll-8N-[(2-(4-méthoxyphényl)éthyl]-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'une huile jaunâtre.
Le 4-[1-(4-chlorobenzyl)-1H-5-imidazolyl-méthyl]-8N-[(2-(4-méthoxyphényl)éthyl]- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[l-(4-chlorobenzyl)-
lH-5-imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H-benzo[b][l,4] oxazine-8-carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5),
4 cm3 de N,N-diméthylformamide, 0,125 g de 4-[ 1-(4-chlorobenzyl)-1 H-5- imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium, 0,134 cm' de N-éthyl diisopropylamine, 4 cm' de dichlorométhane, 22,5 mm' de 2-(4méthoxyphényl) éthylamine, et de 21,6 mm' de triéthylamine. On obtient 0,063 g de
4-[I-(4-chlorobenzyl)- 1 H-5-imidazolyl-méthyll-8N-[(2-(4-méthoxyphényl)éthyl]-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'une huile jaunâtre.
'H NMR (300 MHz, DMSO-d6) : d en ppm : 2,77 (2H, t, J=6Hz), 3,11 (2H, t, J=4Hz), 3,46 (2H, q, J=6Hz), 3,76 (3H, s), 4,09 (2H, t, J=4Hz), 4,31 (2H, s), 5,27 (2H, s), 6,77 (2H, m), 6,88 (1H, s), 6,90 (2H, d, J=8Hz), 7,05 (1H, m), 7,12 (2H, d, J=8Hz), 7,20 (2H, d, J=8Hz), 7,43 (2H, d, J=8Hz), 7,81 (1H, s), 8,06 (1H, t, J=6Hz).
<Desc/Clms Page number 80>
Exemple 32
Le 4-[ 1-( 4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-[(2-(3,4-diméthoxyphényl) éthyl ] -3,4-di hydro-2 H-benzo[b] [ 1, 4] oxazine-8-carboxam ide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[1-(4chlorobenzyl)-lH-5-imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H- benzo[b][1,4]oxazine-8-carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm de N,N-diméthylformamide, 0,125 g de 4-[I-(4-chlorobenzyl)-IH-
5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[bJ[1,4]oxazine-8-carboxylate de sodium, 0,134 cm' de N-éthyl diisopropylamine, 4 cm3 de dichlorométhane, 26,0 mm de 2-(3,4-diméthoxyphényl)éthylamine, et de 21,6 mm3de triéthylamine. On obtient
0,063 g de 4-[I-(4-chlorobenzyl)-IH-5-imidazolyl-méthyl]-8N-[(2-(3,4-diméthoxy phényl)éthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'une meringue jaunâtre.
Le 4-[ 1-( 4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-[(2-(3,4-diméthoxyphényl) éthyl ] -3,4-di hydro-2 H-benzo[b] [ 1, 4] oxazine-8-carboxam ide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[1-(4chlorobenzyl)-lH-5-imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H- benzo[b][1,4]oxazine-8-carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm de N,N-diméthylformamide, 0,125 g de 4-[I-(4-chlorobenzyl)-IH-
5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[bJ[1,4]oxazine-8-carboxylate de sodium, 0,134 cm' de N-éthyl diisopropylamine, 4 cm3 de dichlorométhane, 26,0 mm de 2-(3,4-diméthoxyphényl)éthylamine, et de 21,6 mm3de triéthylamine. On obtient
0,063 g de 4-[I-(4-chlorobenzyl)-IH-5-imidazolyl-méthyl]-8N-[(2-(3,4-diméthoxy phényl)éthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'une meringue jaunâtre.
'H NMR (300 MHz, DMSO-d6) : d en ppm : 2,76 (2H, t, J=6Hz), 3,11 (2H, t, J=4Hz), 3,49 (2H, q, J=6Hz), 3,75 (3H, s), 3,77 (3H, s), 4,08 (2H, t, J=4Hz), 4,31 (2H, s), 5,27 (2H, s), 6,78 (2H, m), 6,79 (1H, dd, J=2 et 7Hz), 6,88 (2H, m), 6,91 (1H, d, J=7Hz), 7,05 (1H, m), 7,12 (2H, d, J=8Hz), 7,43 (2H, d, J=8Hz), 7,81 (1H, s), 8,07 (1H, t, J=6Hz).
Exemple 33
Le 4-[ 1 -(4-chlorobenzyl)- 1 H-5-imidazolyl-méthyl]-8N-[Y2-(4-suIfamoyI-phényl') éthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[1-(4-
chloroben2yl)-lH-J-imidazolyI-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H- benzo[b][1,4]oxazine-8-carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm' de N,N-diméthylformamide, 0,125 g de 4-[I-(4-chlorobenzyl)-IH-
5-imidazolyl-méthyl]-3,4-dihydro-2H -benzo[b][ 1 A]oxazine-8-carboxylate de sodium, 0,134 cm3 de N-éthyl diisopropylamine, 4 cm3 de dichlorométhane, 0,031 g de 4-(2-
Le 4-[ 1 -(4-chlorobenzyl)- 1 H-5-imidazolyl-méthyl]-8N-[Y2-(4-suIfamoyI-phényl') éthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[1-(4-
chloroben2yl)-lH-J-imidazolyI-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H- benzo[b][1,4]oxazine-8-carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm' de N,N-diméthylformamide, 0,125 g de 4-[I-(4-chlorobenzyl)-IH-
5-imidazolyl-méthyl]-3,4-dihydro-2H -benzo[b][ 1 A]oxazine-8-carboxylate de sodium, 0,134 cm3 de N-éthyl diisopropylamine, 4 cm3 de dichlorométhane, 0,031 g de 4-(2-
<Desc/Clms Page number 81>
aminoéthyl)benzènesulfonamide, et de 21,6 mm' de triéthylamine. On obtient
0,012 g de 4-[1-(4-chlorobenzyl)-IH-5-imidazolyl-méthyl]-8N-[(2-(4-sulfamoylphényl)éthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxamide, sous la forme d'une meringue blanche.
0,012 g de 4-[1-(4-chlorobenzyl)-IH-5-imidazolyl-méthyl]-8N-[(2-(4-sulfamoylphényl)éthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxamide, sous la forme d'une meringue blanche.
'H NMR (300 MHz, DMSO-d6): d en ppm : 2,92 (2H, t, J=6Hz), 3,11 (2H, t, J=4Hz), 3,53 (2H, q, J=6Hz), 4,08 (2H, t, J=4Hz), 4,31 (2H, s), 5,27 (2H, s), 6,77 (2H, m), 6,87 (1H, s), 7,00 (1H, m), 7,12 (2H, d, J=8Hz), 7,33 (2H, s large), 7,43 (2H, d, J=8Hz), 7,48 (2H, d, J=8Hz), 7,79 (2H, d, J=8Hz), 7,81 (1 H, s), 8,10 (1H, t, J=6Hz).
Exemple 34
Le 4-[ 1-( 4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-[(2-(3-fluorophényl)éthyl]- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[I-(4-chlorobenzyl)-
1 H-5-imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H-benzo[b] [ 1,4J oxazine-8-carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm 3 de N,N-diméthylformamide, 0,125 g de 4-[I-(4-chlorobenzyl)-IH-5-
imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b] [ ,4]oxazine-8-carboxylate de sodium, 0,134 cm 3 de N-éthyl diisopropylamine, 4 cm3 de dichlorométhane, 20,1 mm3 de 2-(3fluorophényl)éthylamine, et de 21,6 mm' de triéthylamine. On obtient 0,059 g de
4 [1 -(4-chlorobenzyl)- lH-5-imidazolyl-méthyl]-8N-[(2-(3-fluorophényl)éthyl]-3 ,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'une huile jaunâtre.
Le 4-[ 1-( 4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-[(2-(3-fluorophényl)éthyl]- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[I-(4-chlorobenzyl)-
1 H-5-imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H-benzo[b] [ 1,4J oxazine-8-carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm 3 de N,N-diméthylformamide, 0,125 g de 4-[I-(4-chlorobenzyl)-IH-5-
imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b] [ ,4]oxazine-8-carboxylate de sodium, 0,134 cm 3 de N-éthyl diisopropylamine, 4 cm3 de dichlorométhane, 20,1 mm3 de 2-(3fluorophényl)éthylamine, et de 21,6 mm' de triéthylamine. On obtient 0,059 g de
4 [1 -(4-chlorobenzyl)- lH-5-imidazolyl-méthyl]-8N-[(2-(3-fluorophényl)éthyl]-3 ,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'une huile jaunâtre.
'H NMR (300 MHz, DMSO-d6) : d en ppm : 2,87 (2H, t, J=6Hz), 3,11 (2H, t, J=4Hz), 3,52 (2H, q, J=6Hz), 4,08 (2H, t, J=4Hz), 4,31 (2H, s), 5,27 (2H, s), 6,77 (2H, m), 6,87 ( 1 H, s), 7,00 ( 1 H, m), entre 7,03 et 7,15 (5H, m), 7,37 ( 1 H, m), 7,43 (2H, d, J=8Hz), 7,81 ( 1 H, s), 8,09 ( 1 H, t, J=6Hz).
<Desc/Clms Page number 82>
Exemple 35
Le 4-[l-(4-chlorobenzyl)-lH-J-imidazolyl-méthyl]-8N-[(2-(2-fluorophényl)éthyl]- 3,4-dihydro-2H-benzo[b][l,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[l-(4-chlorobenzyl)-
1 H-5-imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H-benzo[b] [[1,4] oxazine-8-carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm' de N,N-diméthylformamide, 0,125 g de 4-[l-(4-chlorobenzyI)-IH-5- imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium, 0,134 cm' de N-éthyl diisopropylamine, 4 cm3 de dichlorométhane, 20,1 mm3 de 2-(2fluorophényl)éthylamine, et de 21,6 mm' de triéthylamine. On obtient 0,059 g de
4 [1-(4-chlorobenzyl)-1H-S-imidazolyl-méthyl]-8N-[(2-(2-fluorophényl)éthyl]-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'une huile jaunâtre.
Le 4-[l-(4-chlorobenzyl)-lH-J-imidazolyl-méthyl]-8N-[(2-(2-fluorophényl)éthyl]- 3,4-dihydro-2H-benzo[b][l,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 14, pour la préparation du 4-[l-(4-chlorobenzyl)-
1 H-5-imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro-2H-benzo[b] [[1,4] oxazine-8-carboxamide, à partir de 0,200 g de résine tétrafluorophénol activée (5), 4 cm' de N,N-diméthylformamide, 0,125 g de 4-[l-(4-chlorobenzyI)-IH-5- imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxylate de sodium, 0,134 cm' de N-éthyl diisopropylamine, 4 cm3 de dichlorométhane, 20,1 mm3 de 2-(2fluorophényl)éthylamine, et de 21,6 mm' de triéthylamine. On obtient 0,059 g de
4 [1-(4-chlorobenzyl)-1H-S-imidazolyl-méthyl]-8N-[(2-(2-fluorophényl)éthyl]-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'une huile jaunâtre.
'H NMR (300 MHz, DMSO-d6) : d en ppm : 2,87 (2H, t, J=6Hz), 3,11 (2H, t, J=4Hz), 3,52 (2H, q, J=6Hz), 4,08 (2H, t, J=4Hz), 4,31 (2H, s), 5,27 (2H, s), 6,77 (2H, m), 6,87 (1H, s), 7,00 ( 1 H, m), entre 7,03 et 7,15 (5H, m), 7,37 (1H, m), 7,43 (2H, d, J=8Hz), 7,81 (1H, s), 8,09 (1H, t, J=6Hz).
Exemple 36
Le 8N-( 4-pyridylméthyl]-4-[ 1-(4-phénylbenzyl)-1 1 H-5-imidazolyl-méthyl]-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du 8N-[1-(S)-méthoxycarbonyl-2-
(4-méthoxyphényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-3-oxo-3,4dihydro-2H-benzo[b][l,4]oxazine-8-carboxamide, à partir de 0,63 g de 4-[1-(4phénytbenzyl)-1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8- carboxylate de sodium pur à 88 %, 15 cm' de dichlorométhane, 0,200 cm' de 4- (aminométhyl)pyridine, 0,380 g de chlorhydrate de 1-(3-diméthylaminopropyl)-3- éthylcarbodiimide, et de 0,50 cm de N-éthyl diisopropylamine et de 0,04 g d'hydrate d'hydroxybenzotriazole. Après traitement du mélange réactionnel, le produit brut obtenu est chromatographié sur une colonne de gel de silice (granulométrie 0,04 -
Le 8N-( 4-pyridylméthyl]-4-[ 1-(4-phénylbenzyl)-1 1 H-5-imidazolyl-méthyl]-3,4- dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide peut être préparé en opérant comme il est décrit dans l'exemple 3, pour la préparation du 8N-[1-(S)-méthoxycarbonyl-2-
(4-méthoxyphényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-3-oxo-3,4dihydro-2H-benzo[b][l,4]oxazine-8-carboxamide, à partir de 0,63 g de 4-[1-(4phénytbenzyl)-1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8- carboxylate de sodium pur à 88 %, 15 cm' de dichlorométhane, 0,200 cm' de 4- (aminométhyl)pyridine, 0,380 g de chlorhydrate de 1-(3-diméthylaminopropyl)-3- éthylcarbodiimide, et de 0,50 cm de N-éthyl diisopropylamine et de 0,04 g d'hydrate d'hydroxybenzotriazole. Après traitement du mélange réactionnel, le produit brut obtenu est chromatographié sur une colonne de gel de silice (granulométrie 0,04 -
<Desc/Clms Page number 83>
0,063 mm, diamètre 2,0 cm, hauteur 16 cm), en éluant sous une pression d'argon de 0,5 bar avec du dichlorométhane, puis avec un mélange de dichlorométhane et de méthanol (98 / 2 en volumes), et en recueillant des fractions de 30 cm . Les fractions 39 à 48 sont réunies et concentrées à sec sous pression réduite (2,7 kPa). On obtient
0,370 g de 8N-(4-pyridinylméthyl]-4-[l-(4-phénylbenzyl)-lH-5-imidazolyl-méthyl]- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'une meringue jaune.
0,370 g de 8N-(4-pyridinylméthyl]-4-[l-(4-phénylbenzyl)-lH-5-imidazolyl-méthyl]- 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'une meringue jaune.
Spectre de masse :DCI m/z=516 MH+ 'H NMR (300 MHz, DMSO-d6) : d en ppm : 3,18 (2H, t, J=6Hz), 4,18 (2H, t, J=6Hz), 4,39 (2H, s), 4,49 (2H, d, J=6Hz), 5,32 (2H, s), 6,81 (2H, m), 6,89 (1H, s), 7,02 (1H, dd, J=3 et 7Hz), 7,21 (2H, d, J=8Hz), 7,31 (2H, d, J=7Hz), 7,39 (1H, t, J=7Hz), 7,49 (2H, t, J=7Hz), 7,67 (4H, d, J=8Hz), 7,85 (1H, s), 8,52 (2H, d, J=7Hz), 8,68 (1H, t, J=6Hz).
Exemple 37 En opérant comme dans l'exemple 1, mais à partir de 0,42 g d'acide 4-[1-(4-
chlorobenzyl)-1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8- carboxylique, 0,222 g de (RS)-4-chlorophénylalaninol, 0,01 g de 1-hydroxybenzotriazole, 0,45 ml de triéthylamine et 0,230 g de chlorhydrate de 1-(3- diméthylaminopropyl)-3-éthylcarbodiimide, on obtient 0,36 g (65 %) de 8N-[1hydroxy-3(4-chlorophényl)-2(RS)propyl]-4-[ 1-(4-chlorobenzyl)-1H-5-imidazolyl-
méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'une meringue crème.
chlorobenzyl)-1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8- carboxylique, 0,222 g de (RS)-4-chlorophénylalaninol, 0,01 g de 1-hydroxybenzotriazole, 0,45 ml de triéthylamine et 0,230 g de chlorhydrate de 1-(3- diméthylaminopropyl)-3-éthylcarbodiimide, on obtient 0,36 g (65 %) de 8N-[1hydroxy-3(4-chlorophényl)-2(RS)propyl]-4-[ 1-(4-chlorobenzyl)-1H-5-imidazolyl-
méthyl]-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, sous la forme d'une meringue crème.
Analyse élémentaire : C29H28Cl2N4O3, 0,1 CH2CI2
Calculé (%) : C = 63,16 ; H = 5,12 ; CI = 12 ,86 ; N = 10,16
Trouvé (%) : C = 62,87 ; H = 5,25 ; CI = 12,74 ; N = 10,15
Calculé (%) : C = 63,16 ; H = 5,12 ; CI = 12 ,86 ; N = 10,16
Trouvé (%) : C = 62,87 ; H = 5,25 ; CI = 12,74 ; N = 10,15
<Desc/Clms Page number 84>
EXEMPLE 38A
Evaluation de l'activité farnésyle transférase de composés selon l'invention
L'activité farnésyle transférase est mesurée par la quantité farnésylée de substrat K-ras ou de substrat dérivé du peptide correspondant à sa partie C-terminale, le groupement farnésyl étant apporté par le pyrophosphate de famésyle (FPP).
Evaluation de l'activité farnésyle transférase de composés selon l'invention
L'activité farnésyle transférase est mesurée par la quantité farnésylée de substrat K-ras ou de substrat dérivé du peptide correspondant à sa partie C-terminale, le groupement farnésyl étant apporté par le pyrophosphate de famésyle (FPP).
Précisément, le substrat biotinylé utilisé, représentatif de K-ras : BIOT-(PA)3 -S-K-D-G- (K)6 -S-K-T-K-C-V-I-M, est [3H] farnésylé sur sa cystéine C, par la farnésyl transférase en présence de [3H]FPP. Il est ensuite mis en contact de billes
PVT*-streptavidine (AMERSHAM), et est quantifié par scintillation de proximité (dosage SPA) entre le tritium et les billes PVT, grâce à l'interaction streptavidine/biotine.
PVT*-streptavidine (AMERSHAM), et est quantifié par scintillation de proximité (dosage SPA) entre le tritium et les billes PVT, grâce à l'interaction streptavidine/biotine.
Expérimentalement, la famésyl transférase purifiée selon le protocole ci-joint, est diluée pour ce dosage à une concentration telle qu'on obtienne une consommation en substrats inférieure à 30 %. Les concentrations molaires finales de chaque substrat sont ajustées à leur Km respectif : 50 nM pour le peptide K ras biotinylé et 120 nM pour le FPP, amenés sous 20 l dans un volume final de 100 l du mélange réactionnel à base de tampon HEPES 50 mM pH 7.5, MgCl2 5 mM, KCl
40 mM, dithiothréitol 5 mM, Triton X 100 0. 01 %.
40 mM, dithiothréitol 5 mM, Triton X 100 0. 01 %.
Les inhibiteurs à tester, dissous initialement à 1 mM dans un solvant adéquat (DMF ou DMSO) sont dilués dans le tampon de dosage et sont ajoutés sous forme de
10 l, en triplicate, dans le mélange réactionnel à une concentration 10 fois supérieure à leur concentration finale.
10 l, en triplicate, dans le mélange réactionnel à une concentration 10 fois supérieure à leur concentration finale.
La réaction, effectuée dans des plaques de microtitrations OPTIPLATES 96, est initiée par l'enzyme et dure soixante minutes à 37 C. Elle est stoppée par addition de 150 l de mélange d'un tampon d'arrêt à pH 4 constitué de H3PO4 0,2 M, MgCl2 1. 5 mM, BSA 0. 5 % (p/v), azoture de sodium 0,05 % (p/v) contenant 200 ug de billes PVT-streptavidine.
Après agitation lente de trente minutes (pour éliminer de la chemiluminescence), les plaques sont lues en [3H]CPM dans un compteur à
<Desc/Clms Page number 85>
scintillation pour microplaques TOP COUNT@ (PACKARD) où elles sont transformées en [3H]DPM à partir d'une gamme d'agent coloré atténuant la scintillation (" quenching ").
Les pourcentages d'inhibition sont calculés par rapport à un témoin sans inhibiteur après soustraction de toutes les valeurs de celle d'un blanc ne contenant que les substrats et le tampon.
Les CI50 sont calculées ou mesurées à partir des inhibitions obtenues à neuf concentrations différentes avec les logiciels Enzfitter ou Grafit. Les produits selon l'invention présentent des CIso comprises entre 0,1nM et 100 M.
EXEMPLE 38B
L'activité des composés selon l'invention peut également être évaluée par la capacité desdits composés à inhiber la croissance en agar de clones issus de lignées tumorales humaines. Par exemple des cellules de la lignée de carcinome colique humain HCT116, fournies par l'ATCC, sont mises à pousser en monocouche dans un milieu de culture, Dubelcco modifié Eagle, contenant 2 mM de L-glutamine, 200 U/ml de pénicilline, 200 ug/ml de streptomycine complémenté par 10 % en volumes de sérum de veau foetal inactivé à la chaleur. Les cellules en croissance exponentielle sont trypsinisées, lavées au PBS et diluées à une concentration finale de 5000 cellules/ml dans du milieu de culture complet. Les inhibiteurs à tester, ou le solvant de contrôle sont alors ajoutés, sous un volume de 50 l, à 2,5 ml de suspension de cellules, préparée précédemment, on ajoute ensuite 0,4 ml d'une solution d'agar, Noble Difco, maintenue à 45 C puis on mélange. Le milieu ainsi obtenu est immédiatement jeté dans des boites de Pétri, maintenu cinq minutes à 4 C puis mis à incuber à 37 C sous une atmosphère de 5 % de CO2. Les nombre de clones cellulaires (> 50 cellules) est compté après douze jours d'incubation à 37 C sous une atmosphère de 5 % de CO2. Chaque inhibiteur est testé en duplicate aux concentrations finales en agar de 10, 1, 0,1 0,01 et 0,001 ug/ml. Les résultats sont exprimés en pourcentage d'inhibition de clonogénicité par rapport aux contrôles non
L'activité des composés selon l'invention peut également être évaluée par la capacité desdits composés à inhiber la croissance en agar de clones issus de lignées tumorales humaines. Par exemple des cellules de la lignée de carcinome colique humain HCT116, fournies par l'ATCC, sont mises à pousser en monocouche dans un milieu de culture, Dubelcco modifié Eagle, contenant 2 mM de L-glutamine, 200 U/ml de pénicilline, 200 ug/ml de streptomycine complémenté par 10 % en volumes de sérum de veau foetal inactivé à la chaleur. Les cellules en croissance exponentielle sont trypsinisées, lavées au PBS et diluées à une concentration finale de 5000 cellules/ml dans du milieu de culture complet. Les inhibiteurs à tester, ou le solvant de contrôle sont alors ajoutés, sous un volume de 50 l, à 2,5 ml de suspension de cellules, préparée précédemment, on ajoute ensuite 0,4 ml d'une solution d'agar, Noble Difco, maintenue à 45 C puis on mélange. Le milieu ainsi obtenu est immédiatement jeté dans des boites de Pétri, maintenu cinq minutes à 4 C puis mis à incuber à 37 C sous une atmosphère de 5 % de CO2. Les nombre de clones cellulaires (> 50 cellules) est compté après douze jours d'incubation à 37 C sous une atmosphère de 5 % de CO2. Chaque inhibiteur est testé en duplicate aux concentrations finales en agar de 10, 1, 0,1 0,01 et 0,001 ug/ml. Les résultats sont exprimés en pourcentage d'inhibition de clonogénicité par rapport aux contrôles non
<Desc/Clms Page number 86>
traités. Les doses inhibitrices ICso sont déterminées graphiquement à partir des moyennes semi-logarithmiques des valeurs obtenues pour chaque concentration.
Les produits selon l'invention inhibent de 50 % la formation de clones à des concentrations comprises entre 0,1nM et 100 M.
EXEMPLE 39
EXEMPLE 39A On prépare, selon la technique habituelle, des gélules dosées à 50 mg de produit actif ayant la composition suivante : - Produit actif........................................................................ 50 mg - Cellulose............................................................................... 18 mg - Lactose.................................................................................. 55 mg - Silice colloïdale...................................................................... 1 mg - Carboxyméthylamidon sodique............................................. 10 mg - Talc ....................................................................................... 10 mg - Stéarate de magnésium........................................................ 1 mg
EXEMPLE 39B On prépare selon la technique habituelle des comprimés dosés à 50 mg de produit actif ayant la composition suivante : - Produit actif ....................................................................... 50 mg - Lactose.................................................................................. 104 mg - Cellulose ............................................................................... 40 mg - Polyvidone............................................................................. 10 mg - Carboxyméthylamidon sodique............................................. 22 mg - Talc...................................................................................... 10 mg - Stéarate de magnésium........................................................ 2 mg - Silice colloïdale...................................................................... 2 mg - Mélange d'hydroxyméthylcellulose, glycérine, oxyde de titane (72-3,5-24,5) q.s.p. 1 comprimé pelliculé terminé à 245 mg
EXEMPLE 39A On prépare, selon la technique habituelle, des gélules dosées à 50 mg de produit actif ayant la composition suivante : - Produit actif........................................................................ 50 mg - Cellulose............................................................................... 18 mg - Lactose.................................................................................. 55 mg - Silice colloïdale...................................................................... 1 mg - Carboxyméthylamidon sodique............................................. 10 mg - Talc ....................................................................................... 10 mg - Stéarate de magnésium........................................................ 1 mg
EXEMPLE 39B On prépare selon la technique habituelle des comprimés dosés à 50 mg de produit actif ayant la composition suivante : - Produit actif ....................................................................... 50 mg - Lactose.................................................................................. 104 mg - Cellulose ............................................................................... 40 mg - Polyvidone............................................................................. 10 mg - Carboxyméthylamidon sodique............................................. 22 mg - Talc...................................................................................... 10 mg - Stéarate de magnésium........................................................ 2 mg - Silice colloïdale...................................................................... 2 mg - Mélange d'hydroxyméthylcellulose, glycérine, oxyde de titane (72-3,5-24,5) q.s.p. 1 comprimé pelliculé terminé à 245 mg
<Desc/Clms Page number 87>
EXEMPLE 39C On prépare une solution injectable contenant 50 mg de produit actif ayant la composition suivante : - Produit actif........................................................................ 50 mg - Acide benzoïque.................................................................... 80 mg - Alcool benzylique.................................................................. 0,06 ml - Benzoate de sodium............................................................. 80 mg - Ethanol à 95 %...................................................................... 0,4 ml - Hydroxyde de sodium............................................................ 24 mg - Propylène glycol.................................................................... 1,6 ml
- Eau..........................................................................q.s.p. 4 ml
- Eau..........................................................................q.s.p. 4 ml
Claims (25)
- dans laquelle : R1 représente # un radical alkyle, # un radical -ORi1 dans lequel Ri1 représente un atome d'hydrogène, un radical alkyle ou un radical hydroxyalkyle, # un radical aryle ou hétéroaryle, éventuellement substitués par un ou plusieurs atomes ou radicaux choisis parmi les atomes d'halogène, et les radicaux alkoxy, alkyle, hydroxy, nitro, amino, aralkoxy, sulfamoyle, polyfluoroalkyle, polyfluoroalkoxy, aryle, aralkyle; # un radical hétérocyclyle; R2 représente un atome d'hydrogène, un radical -C(O)-Ri2 , ou un radical -(CH2)mRi3 , dans lesquels : # Ri2 représente un radical choisi parmi les radicaux hydroxy, amino, alkoxy, alkylamino, étant entendu que lorsque Ri2 représente un radical hydroxy, la fonction acide correspondante peut éventuellement être sous forme de sel; # Ri3 représente, un atome d'halogène, un radical alkylthio, ou hydroxy ; # m représente un chiffre entier égal à 1, 2 ; R3 représente un atome d'hydrogène ou un radical alkyle, -(CH2)pRi4 dans lequelREVENDICATIONS 1 - Composés de formule générale (I)<Desc/Clms Page number 89>R9 représente un atome ou radical choisi parmi les atomes d'hydrogène, d'halogène et - les radicaux alkyle, - aryle, ou hétéroaryle, éventuellement substitués par un ou plusieurs atomes ou radicaux choisis parmi les atomes d'halogène ou les radicaux alkoxy, alkyle ; - cycloalkyle, alkoxy, cyano, nitro, - polyfluoroalkyle, polyfluoroalkoxy, polyfluoroalkylthio, - aralkyle, aryloxy; - un radical -Ri6-CO-Ri7, pour lequel : Ri6 représente un radical alkylène, alkènylène; Ri7 représente un radical hydroxy, alkoxy, amino ; X représente un radical -(CH2-)n dans lequel n représente un chiffre entier égal à 0, 1, 2,3; Y représente un radical alkylène ; Z représente un radical alkylène ; Het # représente un radical imidazolyle ou pyridyl pour lequel Y et Z peuvent être attachés sur 2 quelconques des atomes de carbone ou d'azote qui le constituent ; # représente un radical phényle pour lequel Z et R9 peuvent être attachés sur 2 quelconques des atomes de carbone qui le constituent ;R8 représente un atome d'hydrogène ou un atome d'halogèneR6, R7 représentent chacun un atome d'hydrogène ou forment ensemble avec l'atome de carbone auquel ils sont attachés le radical carbonyle ;R4, R5 représentent indépendamment un atome d'hydrogène ou un radical alkyle ;Ri4 représente un radical hydroxy, -CORis où Ri5 représente un radical hydroxy, alkoxy, amino p représente un chiffre entier égal à 1, 2,3;<Desc/Clms Page number 90>sous forme racémique ou leurs stéréoisomères ainsi que leurs sels.
- 2 - Composés selon la revendication 1 pour lesquels :R1 représente # un radical alkyle, # un radical -ORi1 dans lequel Ri1 représente un atome d'hydrogène, un radical alkyle ou un radical hydroxyalkyle, ou # un radical phényle, 2- ou 3- ou 4- pyridyle, éventuellement substitués par un ou 2 atomes ou radicaux choisis parmi les atomes d'halogène, ou les radicaux alkoxy, alkyle, sulfamoyle, polyfluoroalkoxy R2 représente un atome d'hydrogène, ou un radical -C(O)-Ri2, ou un radical - (CH2)mRi3 ; Ri2 représente un radical choisi parmi les radicaux hydroxy, alkoxy, amino ; Ri3 représente un radical alkylthio, hydroxy, un atome d'halogène ; m est égal à 1, 2 ; R3 représente représente un atome d'hydrogène ; R4, R5 représentent un atome d'hydrogène ou un radical alkyle ; R6, R7 représentent chacun un atome d'hydrogène ou forment ensemble avec l'atome de carbone auquel ils sont attachés le radical carbonyle ; Rg représente un atome d'hydrogène ; R9 représente un atome ou radical choisi parmi les atomes d'halogène et les radicaux alkyle, cyano, polyfluoroalkoxy, polyfluoroalkylthio, aryle éventuellement substitué par un ou plusieurs atomes ou radicaux choisis parmi les atomes d'halogène ou les radicaux alkoxy ou alkyle, hétéroaryle, un radical-Ri6-CORi7, pour lequel : Ri6 représente un radical alkylène, alkènylène;<Desc/Clms Page number 91>Ri7 représente un radical hydroxy, alkoxy, amino ; X représente un radical -(CH2-)n dans lequel n est égal à 0, 1, 2, 3 Y représente un radical alkylène ; Z représente un radical alkylène ; Het représente un radical imidazolyle ; # représente un radical phényle ; sous forme racémique ou leurs stéréoisomères ainsi que leurs sels.
- 3 - Composés selon l'une quelconque des revendications précédentes choisis individuellement parmi :8N-[ 1-(S)-Carbamoyl-2-(4-chlorophényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1 1 H-5imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8-carboxamide, 8N-[ 1-(S)-Carbamoyl-2-(4-méthoxyphényl)éthyl]-4-[3-(4-chlorobenzyl)-4pyridylméthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxamide, 8N-[ 1-(S)-Carbamoyl-2-(4-méthoxyphényl)éthyl]-4-[ 1-(4-chlorobenzyl)-1 1 H-5imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxamide, 8N-[ 1-(S)-Carbamoyl-2-(4-méthoxyphényl)éthyl]-4-[ 1-(4-méthylbenzyl)-1 1 H-5imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8-carboxamide, 8N-[ 1-(S)-Carbamoyl-2-(4-méthoxyphényl)éthyl]-4-[ 1-(4-méthylbenzyl)-1 1 H-5imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8-carboxamide, 8N-[ 1-(S)-Carbamoyl-2-(4-méthoxyphényl)éthyl]-4-[ 1-(4-phénylbenzyl)-1 1 H-5imidazolyl-méthyl]-3-oxo-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8-carboxamide, 8N-[ 1-(S)-Carbamoyl-2-(4-méthoxyphényl)éthyl]-4-[ 1-(4-phénylbenzyl)-1 1 H-5imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b)[1,4]oxazine-8-carboxamide, 8N-[2-(4-chlorophényl)éthyl]-4-[l -(4-phénylbenzyl)- 1 H-5-imidazolyl-méthyl]-3,4dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxamide, 8N-[ 1-(S)-Carbamoyl-2-(4-chlorophényl)éthyl]-2,2-diméthyl-4-[ 1-(4-méthylbenzyl)- 1 H-5-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxamide,<Desc/Clms Page number 92>méthylJ-3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carbonyl}-amino}-propionate de sodium, 4-[ 1-(4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-[2-(4-pyridyl)éthyl]-3,4-dihydro- 2H-benzo[b][ 1,4]oxazine-8-carboxamide, 4-[ 1-(4-chlorobenzyl)-1 H-S-imidazolyl-méthyl]-8N-[2-phényléthyl]-3,4-dihydro-2Hbenzo[b][ 1 ,4]oxazine-8-carboxamide, 4-[ 1-(4-chlorobenzyl)-1 1 H-5-imidazolyl-méthyl]-8N-isopentyl-3 ,4-dihydro-2H- benzo[b][l,4]oxazine-8-carboxamide, 4-[1-(4-chlorobenzyl)- H-5-imidazolyl-méthyl]-8N-[2-(2-hydroxyéthoxy)éthyl]-3,4- dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxamide,8N-[ 1-(S)-Carbamoyl-2-(4-chlorophényl)éthyl]-2,?-diméthyl-4-[ 1-(4-chlorobenzyl)IHo-imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][l,4]oxazine-8-carboxamide, 8N-[2-(4-chlorophényI)éthyl]-4-[l-(4-chlorobenzyl)-lH-5-imidazoIyl-méthyl]-3,4dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxamide, 8N-[ 1-(S)-Méthoxycarbonyl-2-(4-chlorophényl)éthyl]-4-[ 1-(4-méthylbenzyl)-1 1 H-5- imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxamide, monohydrate de 3-(4-chlorophényl)-2 { {4-[ 1-(4-méthylbenzyl)-1H-5-imidazolyl-4-[l-(4-chlorobenzyl)-lH-5-imidazolyl-méthyl]-8N-(4-hydroxybutyl)-3,4-dihydro- 2H-benzo[b] [ 1,4]oxazine-8-carboxamide, 4-[ 1-(4-chlorobenzyl)-1 1 H-5-imidazolyl-méthyl]-8N-[(2-(2,4-dichlorophényl)éthyl]- 3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8-carboxamide, 4-[ 1-(4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-(6-hydroxyhexyl)-3,4-dihydro- 2H-benzo[b][ [ 1,4]oxazine-8-carboxamide,4-[ 1-( 4-chlorobenzyI)-1 H-5-imidazolyI-méthyl]-8N-[ 1-hydroxy-4-méthylsulfanyl- 2(S)-butyl] 3,4-dihydro-2H-benzo[b][1,4]oxazine-8-carboxamide, 4-[ 1-(4-chlorobenzyl)-1 H-S-imidazolyl-méthyl]-8N-[(RS)-2-tétrahydrofurylméthyl]- 3,4-dihydro-2H-benzo[b][ 1 ,4]oxazine-8-carboxamide, 4-[ 1-(4-chlorobenzyl)-1 H-5- imidazolyl-méthyl]-8N -[2-(2-pyridyl)éthyl]-3,4-dihydro- 2H-benzo[b][ l,4Joxazine-8-carboxamide,<Desc/Clms Page number 93>4-[1-(4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-(3-pyridylméthyl)-3,4-dihydro- 2H-benzo[b][ 1,4]oxazine-8-carboxamide,4-[ 1-(4-chlorobenzyl)-1 lH-5-imidazolyI-méthyl]-8N-(2-méthoxy-éthyl)-3,4-dihydro- 2H-benzo[b][ 1,4]oxazine-8-carboxamide, 4-[ 1-(4-chlorobenzyl)-1 1 H-5-imidazolyl-méthyl]-8N-[(2-(2-méthoxyphényl)éthyl]-3,4- dihydro-2H-benzo[b][l,4]oxazine-8-carboxamide, 4-[1-(4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-[(2-(2-chlorophényl)éthyl]-3,4- dihydro-2H-benzo[b] [ 1,4]oxazine-8-carboxamide,4-[l-(4-chlorobenzyl)-lH-5-imidazolyl-méthyl]-8N-[(2-(3-méthoxyphényl)éthyl]-3,4dihydro-2H-benzo[b] [ 1,4]oxazine-8-carboxamide, 4-[ 1-( 4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-[(2-( 4-fluorophényl)éthyl]-3,4dihydro-2H-benzo[b] 1 1,4]oxazine-8-carboxamide, 8N-[(2-(4-bromophényl)éthyl]-4-[I-(4-chlorobenzyl)- H-5-imidazolyl-méthyl]-3,4dihydro-2H-benzo[b][ 1 ,4]oxazine-8-carboxamide, 4-[ 1-(4-chlorobenzyl)-1 H-5-imidazolyl-méthyl]-8N-[(2-(4-méthoxyphényl)éthyl]-3,4dihydro-2H-benzo[b] [ 1 ,4]oxazine-8-carboxamide, 4-[l-(4-chlorobenzyl)-lH-5-imidazolyl-méthyl]-8N-[(2-(3,4-diméthoxyphényl)éthyl]- 3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8-carboxamide, 4-[ 1-(4-chlorobenzyl)-1 H-S-imidazolyl-méthyl]-8N-[(2-(4-sulfamoyl-phényl)éthylJ- 3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8-carboxamide, 4-[l-(4-chlorobenzyl)-lH-5-imidazolyl-méthyl]-8N-[(2-(3-fluorophényl)éthyl]-3,4dihydro-2H-benzo[b][ 1,4]oxazine-8-carboxamide, 4-[ 1-(4-chlorobenzyl)-1 1 H-5-imidazolyl-méthyl]-8N-[(2-(2-fluorophényl)éthyl]-3,4dihydro-2H-benzo[b] [ 1,4]oxazine-8-carboxamide, 8N-(4-pyridylméthyl]-4-[l-(4-phénylbenzyl)-lH-5-imidazolyl-méthyl]-3,4-dihydro- 2H-benzo[b][ 1 ,4]oxazine-8-carboxamide, 8N[ 1-hydroxy-3 (4-chlorophényl)-2(RS)-propyl]-4-[ 1-(4-chlorobenzyl)- 1 H-5imidazolyl-méthyl]-3,4-dihydro-2H-benzo[b] [ 1,4]oxazine-8-carboxamide, ou leurs stéréoisomères, ou sous forme racémique ainsi que leurs sels.<Desc/Clms Page number 94>
- 4 - Composé selon l'une quelconque des revendications précédentes pour lesquels Y et Z représentent un radical méthylène.
- 5 - Procédé de préparation des composés de formule générale (I) selon l'une quelconque des revendications précédentes dans laquelle R1, R2, R3, R4, R5, R6, R7, Rg , R9, X, Y, Z, Het et Ar sont définis comme en revendication 1 caractérisé en ce que on procède à partir du composé de formule générale (II)dans laquelle R4, R5, R6, R7, R8 , R9, Y, Z, Het et Ar sont définis comme précédemment, par action d'un composé de formule générale (nI)dans laquelle X, RI, R2, R3 sont tels que définis précédemment, en opérant selon les méthodes d'amidification.
- 6 - Procédé selon la revendication 5 des composés de formule générale (I) pour lesquels RI, R3, R4, R5, R6, R7, Rs , R9, X, Y, Z, Het et Ar sont définis comme en revendication 1 et R2 représente un radical -CORi2, où Ri2 représente un radical amino, caractérisé en ce qu'on procède à partir des produits de formule générale (II) par action d'un composé de formule générale (III)<Desc/Clms Page number 95>dans laquelle R1, R3, X sont tels que définis en formule générale (I) et R2 représente le radical -CORi2 pour lequel Ri2 représente un radical alkoxy, dans les conditions d'amidification, puis soit suivie de l'action de l'ammoniac, ou soit suivie, après hydrolyse du radical -CORi2 en radical carboxy, de l'action de l'ammoniac.
- 7 - Procédé selon les revendications 5 ou 6 caractérisé en ce que la réaction d'amidification est mise en oeuvre à partir des composés de formule générale (II) greffés sur une résine.
- 11 - Procédé de préparation des composés de formule générale (II) tels que définis en revendication 10 caractérisé en ce que on procède à partir des esters correspondants de formule générale (IV) :<Desc/Clms Page number 97>dans laquelle R4, R5, R6, R7, Rs, R9, Y, Z, Het et Ar sont définis comme précédemment et R représente un radical alkyle, par saponification.
- 12 - Procédé selon la revendication 11caractérisé en ce que les composés de formule générale (IV) dans laquelle R, R4, R5, R6, R7, R8, R9, Y, Z, Het et Ar sont définis comme en revendication 11sont obtenus à partir de composés de formule générale (V)dans laquelle R, R8, R9, Y, Z, Het et Ar sont définis comme précédemment, par action d'un dihalogénure de formule générale (VI) :dans laquelle R4, R5, R6, R7 sont définis comme précédemment et Hal représente un atome d'halogène, par alkylation ou acylation.<Desc/Clms Page number 98>
- 13 - Procédé de préparation des composés de formule générale (V) selon la revendication 12 dans laquelle R, R8, R9, Y, Z, Het et Ar sont définis comme précédemment caractérisés en ce que l'on procède à partir de composés de formule générale (VII) :dans laquelle R, R8 sont définis comme précédemment, par action d'un réactif de formule générale (VIII)dans laquelle R9, Z, Het et Ar sont définis comme précédemment et Y' représente un radical alkylène tel que Y' et l'atome de carbone du groupe carbonyle auquel il est attaché forment le radical Y tel que défini précédemment, en opérant dans des conditions d'amination réductrice.
- 14 - Procédé de préparation des composés de formule générale (IV) selon la revendication 12 dans laquelle R4, R5, R6, R7, R8, R9, R, Y, Z, Het et Ar sont définis comme précédemment peuvent être obtenus à partir des composés (IX) :<Desc/Clms Page number 99>dans laquelle R4, R5, R6, R7 sont définis comme précédemment et Hal représente un atome d'halogène, par alkylation ou acylation.dans laquelle R, R8 sont définis comme précédemment, par action d'un dihalogénure de formule (VI)dans laquelle R9, Z, Het et Ar sont définis comme précédemment et Y' représente un radical alkylène tel que Y' et l'atome de carbone du groupe carbonyle auquel il est attaché forment le radical Y tel que défini précédemment, en opérant dans des conditions d'amination réductrice, les composés de formule (IX) étants obtenus à partir des produits de formule (VII)dans laquelle R4, R5, R6, R7, R8, R sont définis comme précédemment par réaction sur un aldéhyde de formule (VIII)
- 15 - Procédé selon les revendications 5,6, 7,14 caractérisé en ce que la réaction d'amidification est effectuée en opérant en présence d'un agent de condensation et éventuellement en présence d'un agent d'activation.<Desc/Clms Page number 100>
- 16 - Procédé selon la revendication 15 caractérisé en ce que l'agent de condensation est choisi parmi le chlorhydrate de l-éthyl-3-[3-(diméthylamino) propyl] carbodiimide, le 1,1-dicyclohexylcarbodiimide ou l'hexafluorophosphate de benzotriazol-1-oxy tris(diméthylamino)phosphonium.
- 17 - Procédé selon la revendication 15 caractérisé en ce que l'agent d'activation est choisi parmi l'hydroxybenzotriazole.
- 18 - Procédé selon les revendications 13,14 caractérisé en ce que la réaction d'amination réductrice est effectuée en opérant dans un solvant organique en présence d'acide puis par action d'un composé réducteur.
- 19 - Procédé selon la revendication 18 caractérisé en ce que le composé réducteur est le cyanoborohydrure de sodium (NaBH3CN) ou le triacétoxy-borohydrure de sodium (NaBH(OCOCH3) 3) ou le complexe BH3.pyridine.
- 20 - Composition pharmaceutique contenant au moins un composé des revendications1 à 4 en association avec un ou plusieurs diluants ou adjuvants pharmaceutiquement acceptables qu'ils soient inertes ou biologiquement actifs.
- 21 - Utilisation des composés des revendications 1 à 4 pour la préparation de compositions pharmaceutiques utiles pour le traitement et/ou la prévention des conditions pathologiques liées aux voies de signalisations cellulaires, associées à la famésyle transférase, ou à leurs conséquences ou symptômes.
- 22 - Utilisation des composés des revendications 1 à 4 pour la préparation de compositions pharmaceutiques utiles pour inhiber la farnésyle transférase.
- 23 - Utilisation des composés des revendications 1 à 4 pour la préparation de compositions pharmaceutiques utiles pour le traitement des maladies liées à des proliférations cellulaires.
- 24 - Utilisation des composés des revendications 1 à 4 pour la préparation de compositions pharmaceutiques utiles pour le traitement des cancers.<Desc/Clms Page number 101>
- 25 - Association d'un composé des revendications 1 à 4 avec un ou plusieurs composés compatibles et pharmacologiquement actifs et/ou un traitement radiothérapique.
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR9909894A FR2796943A1 (fr) | 1999-07-30 | 1999-07-30 | Derives de benzoxazinnes, leur procede de preparation et leur utilisation en therapeutique |
| PCT/FR2000/002190 WO2001009127A1 (fr) | 1999-07-30 | 2000-07-28 | Derives de benzoxazines, leur procede de preparation et leur utilisation en therapeutique |
| AU68467/00A AU6846700A (en) | 1999-07-30 | 2000-07-28 | Benzoxazine derivatives and their therapeutic use |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR9909894A FR2796943A1 (fr) | 1999-07-30 | 1999-07-30 | Derives de benzoxazinnes, leur procede de preparation et leur utilisation en therapeutique |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| FR2796943A1 true FR2796943A1 (fr) | 2001-02-02 |
Family
ID=9548696
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| FR9909894A Pending FR2796943A1 (fr) | 1999-07-30 | 1999-07-30 | Derives de benzoxazinnes, leur procede de preparation et leur utilisation en therapeutique |
Country Status (3)
| Country | Link |
|---|---|
| AU (1) | AU6846700A (fr) |
| FR (1) | FR2796943A1 (fr) |
| WO (1) | WO2001009127A1 (fr) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BRPI0609879A2 (pt) | 2005-04-28 | 2010-05-11 | Pfizer Ltd | derivados de aminoácidos |
Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1993016702A1 (fr) * | 1992-02-27 | 1993-09-02 | Abbott Laboratories | Agents antineoplasiques de quinobenzoxazine, quinobenzothiazine et pyrido-acridine |
| EP0618221A2 (fr) * | 1993-04-02 | 1994-10-05 | Bristol-Myers Squibb Company | Inhibiteurs hétérocycliques de la farnesyl-protein-transferase |
| WO1996022278A1 (fr) * | 1995-01-18 | 1996-07-25 | Rhone-Poulenc Rorer S.A. | Nouveaux inhibiteurs de farnesyl transferase, leur preparation et les compositions pharmaceutiques qui les contiennent |
| WO1996024612A1 (fr) * | 1995-02-09 | 1996-08-15 | Rhone-Poulenc Rorer S.A. | Inhibiteurs de farnesyl transferase, leur preparation et les compositions pharmaceutiques qui les contiennent |
| WO1997021701A1 (fr) * | 1995-12-08 | 1997-06-19 | Janssen Pharmaceutica N.V. | Derives de la (imidazol-5-yl)methyl-2-quinoleinone comme inhibiteur de la proteine farnesyle-transferase |
| WO1997030992A1 (fr) * | 1996-02-26 | 1997-08-28 | Bristol-Myers Squibb Company | Inhibiteurs de la farnesyl-transferase |
| WO1999018951A1 (fr) * | 1997-09-29 | 1999-04-22 | Bristol-Myers Squibb Company | Inhibiteurs de la transferase farnesyle proteine |
| WO1999028315A1 (fr) * | 1997-11-28 | 1999-06-10 | Lg Chemical Ltd. | Derives d'imidazole a activite inhibitrice de farnesyle transferase et leur procede de preparation |
-
1999
- 1999-07-30 FR FR9909894A patent/FR2796943A1/fr active Pending
-
2000
- 2000-07-28 AU AU68467/00A patent/AU6846700A/en not_active Abandoned
- 2000-07-28 WO PCT/FR2000/002190 patent/WO2001009127A1/fr active Application Filing
Patent Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1993016702A1 (fr) * | 1992-02-27 | 1993-09-02 | Abbott Laboratories | Agents antineoplasiques de quinobenzoxazine, quinobenzothiazine et pyrido-acridine |
| EP0618221A2 (fr) * | 1993-04-02 | 1994-10-05 | Bristol-Myers Squibb Company | Inhibiteurs hétérocycliques de la farnesyl-protein-transferase |
| WO1996022278A1 (fr) * | 1995-01-18 | 1996-07-25 | Rhone-Poulenc Rorer S.A. | Nouveaux inhibiteurs de farnesyl transferase, leur preparation et les compositions pharmaceutiques qui les contiennent |
| WO1996024612A1 (fr) * | 1995-02-09 | 1996-08-15 | Rhone-Poulenc Rorer S.A. | Inhibiteurs de farnesyl transferase, leur preparation et les compositions pharmaceutiques qui les contiennent |
| WO1997021701A1 (fr) * | 1995-12-08 | 1997-06-19 | Janssen Pharmaceutica N.V. | Derives de la (imidazol-5-yl)methyl-2-quinoleinone comme inhibiteur de la proteine farnesyle-transferase |
| WO1997030992A1 (fr) * | 1996-02-26 | 1997-08-28 | Bristol-Myers Squibb Company | Inhibiteurs de la farnesyl-transferase |
| WO1999018951A1 (fr) * | 1997-09-29 | 1999-04-22 | Bristol-Myers Squibb Company | Inhibiteurs de la transferase farnesyle proteine |
| WO1999028315A1 (fr) * | 1997-11-28 | 1999-06-10 | Lg Chemical Ltd. | Derives d'imidazole a activite inhibitrice de farnesyle transferase et leur procede de preparation |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2001009127A1 (fr) | 2001-02-08 |
| AU6846700A (en) | 2001-02-19 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7034941B2 (ja) | Lsd1/hdac二重阻害剤としてのシクロプロピル-アミド化合物 | |
| EP1499589B1 (fr) | Derives de n-¬phenyl(piperidin-2-yl)methyl|benzamide, leur preparation et leur application en therapeutique | |
| AU723374B2 (en) | N-oxides of heterocyclic esters, amides, thioesters, and ketones | |
| CZ292942B6 (cs) | Derivát (N-hydroxykarbamoyl)-1-(4-fenoxy)benzensulfonylu | |
| CA2565293C (fr) | Derives de tetrahydroisoquinolilsulfonamides, leur preparation et leur utilisation en therapeutique | |
| JP2004532274A (ja) | 新規なベンゾチエニルまたはインドール誘導体、その製造およびタンパク質プレニルトランスフェラーゼ阻害剤としてのその使用 | |
| EA001280B1 (ru) | Замещенные n-[(аминоиминометил или аминометил)фенил] пропиламиды | |
| FR2786482A1 (fr) | Nouveaux derives de 2-pyridone, leur preparation et leur application en therapeutique | |
| CN104936960A (zh) | 作为n型钙通道阻滞剂的吡咯并吡唑 | |
| CA2527192C (fr) | Nouveaux derives d'imidazoles, leur preparation et leur utilisation en tant que medicament | |
| JP7428833B2 (ja) | ヒストン脱アセチル化酵素6阻害剤としての1,3,4-オキサジアゾール誘導体化合物、およびそれを含む医薬組成物 | |
| CA2321218A1 (fr) | Derives de systemes heterocycliques condenses, leur preparation, les compositions pharmaceutiques qui les contiennent | |
| FR2796947A1 (fr) | Nouveaux derives 8-carbonyl chromanes, leur preparation et leur utilisation en therapeutique | |
| FR2837201A1 (fr) | Nouveaux composes derives de la quinazoline, leur procede de preparation et les compositions pharmaceutiques qui les contiennent | |
| FR2796943A1 (fr) | Derives de benzoxazinnes, leur procede de preparation et leur utilisation en therapeutique | |
| EP0948483B1 (fr) | Inhibiteurs de farnesyle transferase | |
| WO2001009124A1 (fr) | Derives 8-carbonyl chromanes, leur preparation et leur utilisation en therapique | |
| FR2796948A1 (fr) | Nouveaux derives 8-carbonyl chromannes, leur preparation et leur utilisation en therapeutique | |
| CA2315144A1 (fr) | Nouveaux inhibiteurs de farnesyle transferase, leur preparation, les compositions pharmaceutiques qui les contiennent et leur utilisation pour la preparation de medicaments | |
| US20030216441A1 (en) | Farnesyltransferase inhibitors | |
| WO2007082666A1 (fr) | Acylaminoimidazoles | |
| FR2774985A1 (fr) | Nouveaux derives de naphthyl disubstitues, leur preparation, les compositions pharmaceutiques qui les contiennent et leur utilisation pour la preparation de medicaments | |
| WO1999041242A1 (fr) | Derives de naphtyl disubstitues, leur preparation, les compositions pharmaceutiques qui les contiennent | |
| US20090036480A1 (en) | 5-Ht7 Receptor Antagonists | |
| JP4749710B2 (ja) | イミダゾール化合物およびα−2−アドレナリン作動性受容体としてのその使用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| CD | Change of name or company name |