-
Elektrochemische Zellen werden zum Speichern elektrischer Energie für stationäre und mobile Anwendungen eingesetzt. Dabei werden hohe Anforderungen an die Sicherheit, Umweltverträglichkeit, Zuverlässigkeit und Haltbarkeit der elektrochemischen Zelle gestellt.
-
Aufgabe der Erfindung ist es daher, eine elektrochemische Zelle mit verbesserter Sicherheit, Umweltverträglichkeit und Haltbarkeit bereitzustellen.
-
Diese Aufgabe wird durch eine elektrochemische Zelle gemäß Anspruch 1 gelöst. Weitere Ausgestaltungen der elektrochemischen Zelle, ein Elektrolyt geeignet zum Befüllen der elektrochemischen Zelle, ein Verfahren zum Herstellen der elektrochemischen Zelle, sowie ein Verfahren zum Betreiben der elektrochemischen Zelle, sind Gegenstand weiterer Ansprüche. Weitere abhängige Ansprüche beziehen sich auf bevorzugte Ausführungsformen der elektrochemischen Zelle, sowie des Elektrolyten geeignet zum Befüllen der elektrochemischen Zelle.
-
Gegenstand der Erfindung ist eine elektrochemische Zelle (1), umfassend eine negative Elektrode (2b) und eine positive Elektrode (2a).
-
Die negative Elektrode der erfindungsgemäßen elektrochemischen Zelle fungiert im Entladebetrieb als Anode, die positive Elektrode fungiert im Entladebetrieb als Kathode. Mit Entladebetrieb ist dabei die Umwandlung der in der elektrochemischen Zelle gespeicherten chemischen Energie in elektrische Energie gemeint, die dann einem Verbraucher zugeführt werden kann.
-
Die erfindungsgemäße elektrochemische Zelle (1) umfasst außerdem einen Aluminium-Stromkollektor (3a), welcher elektrisch leitend mit der positiven Elektrode (2a) verbunden ist, sowie einen Elektrolyten (4).
-
Der Elektrolyt weist einen Anteil an nicht-ionischen organischen Verbindungen von weniger als 1,0 Gewichtsprozent am gesamten Elektrolyten auf. Mit nicht-ionischen organischen Verbindungen sind dabei insbesondere organische Verbindungen bestehend aus ungeladenen Molekülen gemeint. Nicht-ionische organische Verbindungen umfassen also insbesondere keine Kationen oder Anionen. Typische Beispiele für nicht-ionische organische Verbindungen, die in herkömmlichen elektrochemischen Zellen als Lösungsmittel oder als Zusatzstoff im Elektrolyt vorliegen, sind beispielsweise Karbonate etwa Dimethylkarbonat, Diethylkarbonat oder Vinylenkarbonat, aber auch andere gängige organische Verbindungen, die nicht der Gruppe der ionischen Flüssigkeiten angehören. Derartige Verbindungen sind in elektrochemischen Zellen oft nur aufgrund von Schutzschichten sowohl auf der negativen wie auch der positiven Elektrode einsetzbar ohne welche sie sich unter Betriebsbedingungen zersetzen würden. Eine mangelnde Stabilität des Elektrolyten kann jedoch zu Kapazitätsverlusten in der elektrochemischen Zelle führen.
-
Der Elektrolyt der erfindungsgemäßen elektrochemischen Zelle umfasst dagegen eine ionische Flüssigkeit als Lösungsmittel mit einem Anteil von mindestens 80 Gewichtsprozent am gesamten Elektrolyten.
-
Ionische Flüssigkeiten sind im Gegensatz zu nicht-ionischen organischen Verbindungen durch eine deutlich geringere Entflammbarkeit, deutlich geringere Dampfdrücke und eine deutlich höhere thermische Stabilität gekennzeichnet. Die Erfinder haben erkannt, dass die Betriebssicherheit der erfindungsgemäßen elektrochemischen Zelle gegenüber herkömmlichen elektrochemischen Zellen deutlich erhöht werden kann, wenn der Anteil der ionischen Flüssigkeit am gesamten Elektrolyt bei mindestens 80 Gewichtsprozent liegt und zugleich der Anteil an nicht-ionischen organischen Verbindungen bei weniger als 1,0 Gewichtsprozent am gesamten Elektrolyten liegt.
-
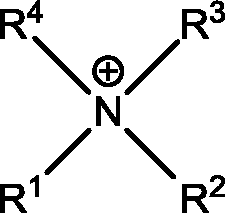
Die besagte ionische Flüssigkeit der erfindungsgemäßen elektrochemischen Zelle umfasst ein Kation der allgemeinen Formel
wobei die Reste R
1 bis R
4 unabhängig voneinander Substituenten umfassend 1 bis 15 Kohlenstoffatome sein können, wobei die Reste linear oder verzweigt sein können, und wobei die Reste R
3 und R
4 außerdem gemeinsam mit dem zentralen N-Atom des Kations einen gesättigten, Ring formen können, wobei der Ring insbesondere fünf- bis siebengliedrig sein kann, und wobei dessen periphere H-Atome substituiert sein können.
-
Besagte ionische Flüssigkeit umfasst zudem ein Anion der allgemeinen Formel
wobei für X und Y die Kombinationen
- – X ist -CF3 und Y ist -CF3,
- – X ist -C2F5 und Y ist -C2F5,
- – X ist -CF3 und Y ist -F,
- – X ist -C2F5 und Y ist -F
möglich sind.
-
Bei den entsprechenden Anionen handelt es sich also um Bis(trifluoromethansulfonyl)imid (abgekürzt TFSI), um Bis(pentafluoroethansulfonyl)imid (abgekürzt BETI), um Fluorosulfonyl-(trifluoromethansulfonyl)imid (abgekürzt FTFSI) und um Fluorosulfonyl-(pentafluoroethansulfonyl)imid (abgekürzt FPFSI).
-
Der Elektrolyt weist weiterhin ein Leitsalz auf das
-
Das Leitsalz umfasst also das Anion Bis(fluorosulfonyl)imid (abgekürzt FSI). Letzteres wird im Folgenden zuweilen mit der Bezeichnung LiFSI (für Lithium-Bis(fluorosulfonyl)imid) abgekürzt. Beispielsweise kann der Elektrolyt LiFSI als einziges Leitsalz aufweisen.
-
Der Elektrolyt weist außerdem einen Anteil von weniger als 0,5 Gewichtsprozent PF6 – (Hexafluorophosphat) am gesamten Elektrolyten auf.
-
Herkömmliche elektrochemische Zellen weisen dagegen häufig einen höheren Anteil an Hexafluorophosphat-Anionen am Elektrolyten auf, beispielsweise als Bestandteil des Leitsalzes (z.B. LiPF6). Die Erfinder der vorliegenden Erfindung haben jedoch festgestellt, dass Hexafluorophosphat unter Betriebsbedingungen für unerwünschte Zersetzungs- oder Nebenreaktionen verantwortlich ist, die zur Freisetzung korrosiver, umweltschädlicher und toxischer Substanzen führen können. Dies führt bei herkömmlichen elektrochemischen Zellen zur Korrosion von Zellkomponenten sowie zu zusätzlichen Risiken für die Umwelt und die Sicherheit. Durch das Vorliegen eines besonders niedrigen Anteils an PF6 – am gesamten Elektrolyt in der erfindungsgemäßen elektrochemischen Zelle wird also die Umweltverträglichkeit, Sicherheit und Haltbarkeit gegenüber herkömmlichen elektrochemischen Zellen erhöht.
-
Neben dem Elektrolyten sind auch die Stromkollektoren von elektrochemischen Zellen hohen Anforderungen ausgesetzt. Stromkollektoren kontaktieren die Elektrodenmaterialien und ermöglichen so das Abgreifen und Weiterleiten des elektrischen Stromes. Insbesondere auf der Seite der positiven Elektrode können Stromkollektoren sehr hohen positiven und damit stark oxidierenden Potentialen ausgesetzt sein. Dies führt sogar bei Aluminium-Stromkollektoren zu Korrosion und Auflösung, was sich negativ auf die Zuverlässigkeit und Haltbarkeit herkömmlicher elektrochemischer Zellen auswirkt.
-
Der Aluminium-Stromkollektor der erfindungsgemäßen elektrochemischen Zelle weist eine Schutzschicht umfassend AlF3 auf. Die Erfinder der vorliegenden elektrochemischen Zelle haben festgestellt, dass eine Schutzschicht umfassend AlF3 einen besonders effektiven Schutz des Stromkollektors gegen Auflösung und Korrosion bietet und damit die Zuverlässigkeit und Haltbarkeit der elektrochemischen Zelle erhöht. Die Erfinder haben beispielsweise herausgefunden, dass AlF3 nicht in der ionischen Flüssigkeit, welche in der erfindungsgemäßen elektrochemischen Zelle als Lösungsmittel fungiert, löslich ist.
-
AlF3 wird beispielsweise nicht durch die genannten Anionen der ionischen Flüssigkeit oder des Leitsalzes angegriffen.
-
Die Schutzschicht umfassend AlF3 kann beispielsweise durch eine Reaktion des Aluminium-Stromkollektors mit PF6 – erzeugt werden. Da PF6 – sowohl eine unzulängliche chemische Stabilität gegenüber von Wasser wie auch eine geringe thermische Stabilität (thermische Zersetzung schon ab 60°C) besitzt, führt die Gegenwart von PF6 – unter Betriebsbedingungen in herkömmlichen elektrochemischen Zellen zur Bildung unerwünschter toxischer und korrosiver Neben- und Zersetzungsprodukte (z.B. HF und PF5). Die Erfinder der vorliegenden elektrochemischen Zelle haben herausgefunden, dass es nicht erforderlich ist dauerhaft PF6 – in der elektrochemischen Zelle vorzuhalten um eine Schutzschicht umfassend AlF3 zu erhalten, etwa durch das Vorhandensein von PF6 – im Leitsalz. Die erfindungsgemäße elektrochemische Zelle zeichnet sich vielmehr dadurch aus, dass sie eine Schutzschicht auf dem Aluminium-Stromkollektor umfassend AlF3 aufweist und gleichzeitig keine hohen Mengen an PF6 – enthält. Der Anteil an PF6 – am gesamten Elektrolyt ist niedriger als 0,5 Gewichtsprozent, wobei es weiter bevorzugt ist wenn der Elektrolyt frei von PF6 – ist. Damit weist die erfindungsgemäße elektrochemische Zelle weit geringere Mengen an PF6 – auf, als herkömmliche elektrochemische Zellen bei denen PF6 – Teil des Leitsalzes ist, beispielsweise als Anion des häufig genutzten Leitsalzes LiPF6. Die erfindungsgemäße elektrochemische Zelle ist damit nicht nur durch einen geschützten Aluminium-Stromkollektor sondern zugleich durch eine besonders hohe Sicherheit gekennzeichnet.
-
Der Elektrolyt der erfindungsgemäßen elektrochemischen Zelle umfasst eine ionische Flüssigkeit als Lösungsmittel mit einem Anteil von mindestens 80 Gewichtsprozent am gesamten Elektrolyt. Die quaternären Ammonium-Kationen der ionischen Flüssigkeit ermöglichen in Verbindung mit den im Folgenden genannten Anionen einen hinreichend niedrigen Schmelzpunkt und eine hinreichend niedrige Viskosität auch bei Temperaturen deutlich unter dem Gefrierpunkt, was eine gute Ionen-Mobilität und damit hohe Leitfähigkeiten auch bei niedrigen Temperaturen deutlich unter dem Gefrierpunkt oftmals weit unter –40°C ermöglicht. Das Anion der ionischen Flüssigkeit ist ausgewählt aus der Gruppe der folgenden Anionen:
- – Bis(trifluoromethansulfonyl)imid (abgekürzt TFSI):
- – Bis(pentafluoroethansulfonyl)imid (abgekürzt BETI):
- – Fluorosulfonyl-(trifluoromethansulfonyl)imid (abgekürzt FTFSI):
- – Fluorosulfonyl-(pentafluoroethansulfonyl)imid (abgekürzt FPFSI):
-
Während TFSI und BETI symmetrischen Charakter besitzen, sind die beiden anderen Anionen asymmetrische Anionen.
-
Die ionischen Flüssigkeiten der genannten Anionen mit quaternären Ammonium-Kationen sind mit geringem Aufwand herstellbar und zu vertretbaren Preisen erhältlich. Sie verfügen über eine sehr hohe chemische und elektrochemische Stabilität. Auch sind sie thermisch bis zu Temperaturen von über 300°C stabil, während nicht-ionische organische Verbindungen unter vergleichbaren elektrochemischen Bedingungen oftmals schon ab 60°C unerwünschte Zersetzungsreaktionen eingehen.
-
Der Elektrolyt der erfindungsgemäßen elektrochemischen Zelle weist insbesondere einen Anteil von weniger als 1,0 Gewichtsprozent an nicht-ionischen organischen Verbindungen am gesamten Elektrolyten auf, wobei es weiter bevorzugt ist, wenn der Elektrolyt frei ist von nicht-ionischen organischen Verbindungen. Herkömmliche Zellen enthalten dagegen zumeist nicht-ionische organische Verbindungen mit einem Anteil der 1,0 Gewichtsprozent deutlich übersteigt. Oft dienen in herkömmlichen elektrochemischen Zellen nicht-ionische organische Verbindungen als Zusatz zu einer ionischen Flüssigkeit, die als Lösungsmittel fungiert, oder sie werden selbst als Lösungsmittel eingesetzt. Da der Elektrolyt der erfindungsgemäßen elektrochemischen Zelle weniger als 1,0 Gewichtsprozent an nicht-ionischen organischen Verbindungen am gesamten Elektrolyt aufweist, besitzt der Elektrolyt sowie die elektrochemische Zelle eine deutlich höhere Stabilität als elektrochemische Zellen mit einem höheren Anteil an nicht-ionischen organischen Verbindungen. Insbesondere zeichnet sich der Elektrolyt der erfindungsgemäßen elektrochemischen Zelle durch eine geringere Flüchtigkeit, und somit einen geringeren Dampfdruck aus. Daher kommt es bei der erfindungsgemäßen elektrochemischen Zelle auch bei Temperaturen über 60°C nicht zur Entstehung hoher Drücke in der Zelle, die zu einem Bruch der elektrochemischen Zelle und der Freisetzung von korrosiven, toxischen sowie leicht entflammbaren Stoffen führen können. Auch ist der Elektrolyt selbst deutlich weniger entflammbar als vergleichbare Elektrolyten herkömmlicher Zellen, welche einen höheren Gehalt an nicht-ionischen organischen Verbindungen aufweisen. In ähnlicher Weise verfügt der Elektrolyt der erfindungsgemäßen Zelle aufgrund des geringen Anteils an nicht-ionischen organischen Verbindungen von weniger als 1,0 Gewichtsprozent auch über eine höhere chemische Stabilität gegenüber Wasser und zeichnet sich durch eine hohe elektrochemische Stabilität in einem breiten Potentialbereich aus. Aufgrund der höheren Stabilität des Elektrolyten der erfindungsgemäßen elektrochemischen Zelle werden deutlich weniger toxische und korrosive Nebenprodukte gebildet, welche die Sicherheit gefährden oder die Haltbarkeit der Zelle verringern.
-
Neben der ionischen Flüssigkeit ist das Leitsalz ein weiterer zentraler Bestandteil des Elektrolyten der erfindungsgemäßen elektrochemischen Zelle. Das LiFSI Leitsalz dient insbesondere als Lithium-Ionen-Quelle.
-
Die Verwendung von LiFSI hat außerdem den Effekt, dass ein weiteres Anion in den Elektrolyten eingeführt wird, das sich vom Anion des ionischen Lösungsmittels unterscheidet. Durch die Anwesenheit von zumindest zwei verschiedenen Anionen wird eine Erniedrigung der Schmelztemperatur des Elektrolyten erreicht. Auch wird durch die gleichzeitige Anwesenheit zweier verschiedener Anionen eine vergleichsweise niedrige Viskosität auch bei Temperaturen weit unter dem Gefrierpunkt ermöglicht. Dies führt wiederum zu einer guten Ladungsträger-Mobilität und damit guten Leitfähigkeiten auch bei niedrigen Temperaturen.
-
Außerdem ermöglicht der Einsatz von LiFSI den Verzicht auf LiPF6, welches bei herkömmlichen elektrochemischen Zellen häufig als Leitsalz fungiert. Der Ersatz von LiPF6 durch LiFSI als Leitsalz erlaubt eine Entkopplung des Anteils an PF6 – am Elektrolyt vom Anteil des Leitsalzes am Elektrolyt, wobei letzterer vom Bedarf an Lithium-Ionen vorgegeben wird.
-
Da LiPF6 bei Temperaturen über 60°C nicht stabil ist und toxische Neben- oder Zersetzungsprodukte wie etwa Fluorwasserstoff (HF) oder hoch toxisches Phosphorpentafluorid (PF5) bilden kann, erlaubt es der Einsatz von LiFSI die Sicherheit der elektrochemischen Zelle deutlich zu erhöhen.
-
Eine Reihe von herkömmlichen elektrochemischen Zellen nutzen ionische Lösungsmittel mit FSI als Anion des ionischen Lösungsmittels. Die Erfinder der vorliegenden elektrochemischen Zelle haben jedoch festgestellt, dass die oben genannten Anionen, nämlich TFSI, BETI, FTFSI und FPFSI gegenüber FSI als Anionen des Lösungsmittels vorzuziehen sind. Diese Anionen haben nicht nur eine höhere chemische, elektrochemische und thermische Stabilität als FSI, sondern sie sind beispielsweise auch besser kompatibel mit gängigen Elektrodenmaterialien, die für die negative Elektrode Verwendung finden. Beispielsweise sind sie hervorragend kompatibel mit Kohlenstoff basierten, etwa Graphit basierten Elektroden, während ionische Lösungsmittel auf FSI Basis weniger gut kompatibel mit derartigen Elektroden sind. Aus diesen Gründen umfasst der Elektrolyt der erfindungsgemäßen elektrochemischen Zelle eine ionische Flüssigkeit mit einem Anteil von 80 Gewichtsprozent am gesamten Elektrolyten, wobei das Anion der ionischen Flüssigkeit ausgewählt ist aus TFSI, BETI, FTFSI und FPFSI. FSI liegt dagegen lediglich als Anion des Leitsalzes in deutlich geringeren Mengen vor. So wird insgesamt eine höhere Stabilität des Elektrolyten und der elektrochemischen Zelle erreicht.
-
Im Folgenden werden bevorzugte Ausführungsformen der erfindungsgemäßen elektrochemischen Zelle vorgestellt.
-
Eine bevorzugte Ausführungsform der Erfindung betrifft eine erfindungsgemäße elektrochemische Zelle, wobei die negative Elektrode Kohlenstoff, Silizium-Kohlenstoff Komposite, Zinn-Kohlenstoff Komposite oder Kombinationen davon umfasst. Die negative Elektrode kann zudem jeweils aus Kohlenstoff, Silizium-Kohlenstoff Kompositen, Zinn-Kohlenstoff Kompositen oder Kombinationen davon bestehen. Kohlenstoff aufweisende Elektrodenmaterialien zeichnen sich durch eine hohe Versatilität, gute Stabilität und gute Elektronentransfereigenschaften aus.
-
Die negative Elektrode kann weiterhin Graphit umfassen oder aus Graphit bestehen. Graphit umfassende Elektrodenmaterialien sind aufgrund der hohen kinetischen Hemmung der elektrochemischen Kohlenstoffoxidation vergleichsweise stabile Elektrodenmaterialien, die zudem kostengünstig sind.
-
Eine weitere Ausführungsform der Erfindung betrifft eine erfindungsgemäße elektrochemische Zelle, wobei die negative Elektrode mit einem Kupfer-Stromkollektor verbunden ist. Kupfer-Stromkollektoren sind aufgrund der hervorragenden Leitfähigkeit von Kupfer von Vorteil, welche die bereits sehr gute Leitfähigkeit von Aluminium noch übersteigt.
-
Weiterhin kann eine erfindungsgemäße elektrochemische Zelle einen Anteil von PF6 – am gesamten Elektrolyten von weniger als 0,1 Gewichtsprozent, insbesondere weniger als 0,05 Gewichtsprozent, weiter bevorzugt weniger als 0,01 Gewichtsprozent aufweisen. Es ist besonders bevorzugt, wenn der Anteil von PF6 – am gesamten Elektrolyt weniger als 0,005 und weiter bevorzug weniger als 0,001 Gewichtsprozent aufweist. Am meisten bevorzugt ist es, wenn der Elektrolyt ganz frei von PF6 – ist. Je geringer die Menge an PF6 – am Elektrolyten, umso weniger korrosive, umweltschädliche oder toxische Neben- oder Zersetzungsprodukte von unerwünschten Reaktionen des PF6 – können gebildet werden. Daher führen besonders geringe Anteile von PF6 – am gesamten Elektrolyten zu einer weiteren Verbesserung der Sicherheit, Umweltverträglichkeit und Stabilität der Zelle.
-
Eine weitere bevorzugte Ausführungsform der Erfindung betrifft eine erfindungsgemäße elektrochemische Zelle, wobei der Anteil an nicht-ionischen organischen Verbindungen am gesamten Elektrolyten weniger als 0,5 Gewichtsprozent, insbesondere weniger als 0,1 Gewichtsprozent, bevorzugt weniger als 0,01 Gewichtsprozent umfasst. Der Elektrolyt kann weiterhin auch ganz frei von nicht-ionischen organischen Verbindungen sein. Aufgrund der im Vergleich zu ionischen Flüssigkeiten deutlich höheren Flüchtigkeit, Entflammbarkeit und der geringeren thermischen Stabilität ist es vorteilhaft für die Stabilität und Sicherheit der elektrochemischen Zelle, wenn der Anteil der nicht-ionischen organischen Verbindungen begrenzt wird.
-
Eine weitere bevorzugte Ausführungsform der Erfindung betrifft eine erfindungsgemäße elektrochemische Zelle, wobei die negative Elektrode eine Schutzschicht umfassend ein Polymer, erhältlich durch Reaktion der negativen Elektrode mit
-
Der Aufbau der Schutzschicht kann beispielsweise durch eine elektrochemische Reaktion erfolgen. Insbesondere kann die Schutzschicht während der ersten Lade-Entlade-Vorgänge gebildet werden.
-
Die Schutzschicht auf der negativen Elektrode kann dabei die Elemente Stickstoff, Schwefel, Sauerstoff und Fluor umfassen. Beispielsweise kann die Schutzschicht ein Polymer der Formel FSO2(NSOF)nN–SO2F umfassen. Das Polymer ist stabil, isolierend gegenüber Elektronen und leitend gegenüber Lithium-Ionen. Die Schutzschicht auf der negativen Elektrode der erfindungsgemäßen elektrochemischen Zelle schützt die Elektrodenmaterialien der negative Elektrode vor einer Zerstörung der Elektrodenstruktur im Rahmen der Einlagerung (Interkallation) von solvatisierten Ionen. Beispielsweise werden Elektrodenmaterialien die Kohlenstoff, Silizium-Kohlenstoff Komposite oder Zinn-Kohlenstoff Komposite, sowie Mischungen davon umfassen, vor einer im Zuge der Einlagerung von solvatisierten Lithium-Ionen auftretenden Alterung und Zerstörung der Schichtstruktur geschützt.
-
Gleichzeitig hat die Schicht auf der negativen Elektrode die durch Reaktion mit FSI entsteht, den Effekt, dass sie den Elektrolyten vor Reduktion schützt. Ohne die Bildung der Schutzschicht auf der negativen Elektrode wird fortwährend Elektrolyt reduziert und somit verbraucht. Die schützende Wirkung ist also sowohl auf die negative Elektrode wie auch auf den Elektrolyten gerichtet.
-
Eine bevorzugte Ausführungsform der Erfindung betrifft eine erfindungsgemäße elektrochemische Zelle, umfassend einen Elektrolyt, wobei das Kation der ionischen Flüssigkeit, welche als Lösungsmittel fungiert, dadurch gekennzeichnet ist, dass mehrere der vier Substituenten voneinander verschiedene Substituenten sind. Durch die Verschiedenartigkeit der Substituenten wird ein niedrigerer Schmelzpunkt der ionischen Flüssigkeit als bei gleichartigen Substituenten erreicht. Dies führt vor allem bei sehr niedrigen Temperaturen zu einer verbesserten Viskosität. Auf diese Weise wird eine hohe Mobilität der Ladungsträger beispielsweise der Lithium-Ionen erreicht, so dass auch bei niedrigen Temperaturen hohe Leitfähigkeiten erreicht werden können.
-
Es ist außerdem möglich, dass die Substituenten am zentralen Stickstoffatom des Kations der ionischen Flüssigkeit, welche als Lösungsmittel des Elektrolyten fungiert, jeweils 1 bis 10 Kohlenstoffatome umfassen. Dies hat den Vorteil, dass so eine niedrigere Viskosität auch bei niedrigeren Temperaturen erreicht werden kann als bei Substituenten, welche mehr Kohlenstoffatome umfassen. Häufig weisen die Substituenten zudem deutlich unterschiedlich viele Kohlenstoffatome, also deutlich unterschiedliche Kettenlängen auf. Auch dies begünstigt eine besonders gute Viskosität und damit gute Leitfähigkeitswerte des Elektrolyten bei niedrigen Temperaturen.
-
Eine andere Ausführungsform der Erfindung betrifft eine erfindungsgemäße elektrochemische Zelle, wobei die Substituenten am zentralen Stickstoffatom des Kations der ionischen Flüssigkeit, welche als Lösungsmittel des Elektrolyten fungiert, neben Kohlenstoff und Wasserstoff auch weitere Elemente aufweisen. Insbesondere können die Substituenten auch Sauerstoff umfassen. Dabei ist es besonders vorteilhaft, wenn einzelne oder mehrere Substituenten Sauerstoff in Form von einer oder mehrerer Ether-Gruppen umfassen. Beispielsweise ist es besonders vorteilhaft, wenn einer der Substituenten eine oder mehrere Ether-Gruppen aufweist, während alle anderen Substituenten Alkylreste sind. Durch die Einführung von Ether-Gruppen und die damit einhergehende verminderte Wechselwirkung zwischen den Substituenten der Kationen wird die Viskosität und damit die Ionen-Mobilität besonders bei sehr niedrigen Temperaturen verbessert. Es ist also beispielsweise auch möglich, dass es sich bei den Substituenten R1 bis R4 um Alkyl- oder Alkoxy-Gruppen handelt.
-
Es ist also auch möglich, dass mindestens einer der Substituenten des Ammonium-Kations ein Alkylrest ist. Auch ist es möglich, dass alle Substituenten am Ammonium-Kation Alkylsubstituenten sind. Die Alykl-Substituenten können in jedem dieser Fälle jeweils unabhängig voneinander verzweigt oder linear sein. Bevorzugte Alkyl-Substituenten sind beispielsweise Methyl-, Ethyl-, Propyl-, Butyl-, Pentyl-, Hexyl-, Heptyl-, Octyl-, Nonyl- und Decyl-Substituenten.
-
Eine weitere bevorzugte Ausführungsform der Erfindung betrifft eine erfindungsgemäße elektrochemische Zelle, wobei zwei der Substituenten am zentralen Stickstoffatom des Kations der ionischen Flüssigkeit, welche als Lösungsmittel des Elektrolyten fungiert, einen gesättigten Ring bilden. Beispielsweise können fünf-, sechs- und siebengliedrige Ringe gebildet werden. Diese Ringe können Sauerstoff in Form einer Ether-Gruppe umfassen, können aber auch frei von Sauerstoff sein. Besonders vorteilhaft ist es wenn es sich bei den Ringen um fünf- oder sechsgliedrige gesättigte Ringe handelt, da selbige häufig eine bessere Viskosität und Leifähigkeit ermöglichen als größere Ringe. Es ist zudem möglich, dass periphere Wasserstoffatome der besagten Ringe substituiert sind. Beispielsweise ist es möglich, dass Wasserstoffatome mit Alkyl-Gruppen substituiert sind. Es ist aber auch möglich, dass keines der peripheren Wasserstoffatome substituiert ist. Die Substitution von peripheren Wasserstoffen des Ringes kann beispielsweise genutzt werden um Asymmetrie im Kation zu erzeugen. Dies führt zu dem Effekt, dass der Schmelzpunkt und die Viskosität des Lösungsmittels vermindert und Leitfähigkeitswerte auch bei niedrigen Temperaturen verbessert werden können.
-
Eine Weiterbildung der Erfindung betrifft eine elektrochemische Zelle, wobei es sich bei dem Kation des Lösungsmittels um Kationen der Formeln,
-
Derartige Kationen sind besonders gut als Kationen für die ionische Flüssigkeit geeignet, die das Lösungsmittel des Elektrolyten bildet, weil sie sich durch eine hervorragende elektrochemische und thermische Stabilität auszeichnen. Auch besitzen ionische Flüssigkeiten dieser Kationen zumeist sehr niedrige Schmelzpunkte und eine hinreichend geringe Viskosität und ermöglichen damit auch bei Temperaturen weit unter dem Gefrierpunkt, häufig weit unter –40°C, noch hohe Ionen-Mobilität und damit sehr gute Leitfähigkeiten.
-
Weiterhin können die Reste R1 und R2 des Kations des Lösungsmittels voneinander verschieden sein und ansonsten unabhängig voneinander ausgewählt sein aus,
-(CH2)n-CH3 mit n = 0 bis 9, insbesondere n = 1 bis 5 und
-(CH2CH2O)m-CH3 mit m = 1 bis 4, insbesondere m = 1 oder 2 und
-(CH2OCH2)p-CH3 mit p = 1 bis 4, insbesondere p = 1 oder 2.
Gerade Kationen dieser Formeln ermöglichen eine besonders gute Leitfähigkeit des Elektrolyten.
-
Eine andere Ausführungsform der Erfindung betrifft eine erfindungsgemäße elektrochemische Zelle, wobei das Kation des Lösungsmittels asymmetrisch ist, insbesondere ein asymmetrisch substituiertes Stickstoffatom aufweist. In diesem Fall ist mit asymmetrisch gemeint, dass das zentrale Stickstoffatom vier verschiedene Substituenten aufweist. Die Verwendung von asymmetrischen Kationen hat den Effekt, dass sie einen besonders niedrigen Schmelzpunkt sowie eine sehr niedrige Viskosität und damit sehr hohe Leitfähigkeiten der ionischen Flüssigkeit ermöglicht.
-
Ferner ist es möglich, dass genau einer der beiden Reste R1 und R2 des Kations des Lösungsmittels -(CH2CH2O)m-CH3 mit m = 1 oder 2 ist, insbesondere -CH2CH2-O-CH3 ist. Ionische Flüssigkeiten dieser Kationen mit den oben genannten Anionen besitzen besonders gute Leitfähigkeiten auch bei Temperaturen weit unter –40°C, oftmals sogar bei Temperaturen unter –100°C.
-
Beispiele für Kationen des ionischen Lösungsmittels, die lediglich zur Veranschaulichung dienen, sind im Folgenden genannt:
-
Die Erfindung ist jedoch nicht auf Elektrolyten umfassend die genannten Kationen als Kationen der ionischen Flüssigkeit, welche als Lösungsmittel der elektrochemischen Zelle fungiert, beschränkt.
-
Weiterhin kann das Anion des Lösungsmittels ungleiche Substituenten für X und Y aufweisen. Das Anion hat somit asymmetrischen Charakter. Derartige ionische Flüssigkeiten mit asymmetrischen Anionen wie etwa
ermöglichen in Kombination mit den zuvor genannten Kationen die Bildung ionischer Flüssigkeiten mit weit niedrigeren Schmelzpunkten als dies mit symmetrischen Anionen möglich ist. Derartige ionische Flüssigkeiten zeichnen sich durch besonders hervorragende Leitfähigkeiten auch bei Temperaturen von unter –100°C aus. Leitfähigkeiten deutlich höher als 10
–4 Scm
–1 bei –40°C werden mit derartigen ionischen Flüssigkeiten erreicht.
-
Eine andere Ausführungsform der Erfindung betrifft eine elektrochemische Zelle, wobei das Anion des Lösungsmittels identische Substituenten für X und Y aufweist. Derartige ionische Flüssigkeiten mit symmetrischen Anionen wie etwa
besitzen den Vorteil, dass sie häufig deutlich weniger aufwendig und preiswerter herstellbar sind als ionische Flüssigkeiten umfassend asymmetrische Anionen.
-
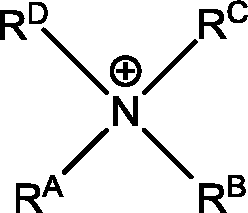
Eine weitere Weiterbildung der Erfindung betrifft eine elektrochemische Zelle, umfassend ein zusätzliches Kation im Elektrolyt, wobei das Kation die allgemeine Formel
aufweist, wobei die Reste R
A bis R
D unabhängig voneinander Substituenten umfassend 1 bis 15 Kohlenstoffatome sein können, wobei die Reste linear oder verzweigt sein können, und wobei die Reste R
C und R
D außerdem gemeinsam mit dem zentralen N-Atom des Kations einen gesättigten, Ring formen können, wobei der Ring insbesondere fünf- bis siebengliedrig sein kann, und wobei dessen periphere H-Atome substituiert sein können, wobei das zusätzliche Kation verschieden ist von dem Kation des Lösungsmittels.
-
Für das besagte zusätzliche Kation gelten ansonsten alle oben bereits für das Kation des ionischen Lösungsmittels angeführten Merkmale, Eigenschaften und bevorzugte Ausführungsformen.
-
Die Gegenwart des zusätzlichen Kations ermöglicht eine Herabsetzung des Schmelzpunktes und eine Verringerung der Viskosität und somit eine Erhöhung der Ionen-Mobilität und Leitfähigkeit v.a. bei niedrigen Temperaturen. In dieser speziellen Ausführungsform der Erfindung weist der Elektrolyt somit neben den Lithium-Kationen noch zumindest zwei weitere Kationen sowie zumindest zwei Anionen auf. Die Vielzahl verschiedener Kationen und Anionen dieser Ausführungsform führt zu einer Verringerung der Viskosität bei tiefen Temperaturen.
-
Eine weitere bevorzugte Ausführungsform der Erfindung betrifft eine erfindungsgemäße elektrochemische Zelle, wobei es sich bei der elektrochemischen Zelle um einen Lithium-Ionen-Akkumulator bzw. um eine Lithium-Ionen-Batterie handelt. Lithium-Ionen-Akkumulatoren erlauben hohe Zellspannungen, sind wieder aufladbar und zeichnen sich durch besonders hohe Energiedichten aus. Lithium-Ionen-Akkumulatoren gelten deshalb als besonders breit einsetzbar sowohl für mobile wie auch stationäre Anwendungen. Beispielsweise kann der Lithium-Ionen-Akkumulator als Materialien für die positive Elektrode LiCoO2, LiNiO2, LiMn2O4 und LiFePO4 oder Mischungen davon umfassen. Die positive Elektrode des Lithium-Ionen-Akkumulators kann auch aus LiCoO2, LiNiO2, LiMn2O4 und LiFePO4 oder Mischungen davon bestehen.
-
Der für die erfindungsgemäße elektrochemische Zelle beschriebene Elektrolyt ist beispielsweise besonders gut geeignet, um den hohen Potentialen in Lithium-Ionen-Akkumulatoren standzuhalten.
-
Die Erfindung betrifft weiterhin einen Elektrolyt, welcher einen Anteil an nicht-ionischen organischen Verbindungen von weniger als 1,0 Gewichtsprozent am gesamten Elektrolyten aufweist und geeignet ist zum Befüllen einer elektrochemischen Zelle. Der besagte Elektrolyt umfasst
-
- – eine ionische Flüssigkeit als Lösungsmittel mit einem Anteil von 80 bis 94,9 Gewichtsprozent am gesamten Elektrolyten,
• umfassend ein Kation der allgemeinen Form wobei die Reste R1 bis R4 unabhängig voneinander Substituenten umfassend 1 bis 15 Kohlenstoffatome sein können, wobei die Reste linear oder verzweigt sein können, und wobei die Reste R3 und R4 außerdem gemeinsam mit dem zentralen N-Atom des Kations einen gesättigten, Ring formen können, wobei der Ring insbesondere fünf- bis siebengliedrig sein kann, und wobei dessen periphere H-Atome substituiert sein können, und
• und ein Anion der Form wobei für X und Y die Kombinationen
– X ist -CF3 und Y ist -CF3
– X ist -C2F5 und Y ist -C2F5
– X ist -CF3 und Y ist -F
– X ist -C2F5 und Y ist -F
möglich sind,
und
- – ein Leitsalz mit einem Anteil von 5 bis 15 Gewichtsprozent am gesamten Elektrolyten umfassend
und
- – ein Additiv mit einem Anteil von 0,1 bis 5 Gewichtsprozent, am gesamten Elektrolyten umfassend
• ein Kation der allgemeinen Form wobei die Reste RA bis RD unabhängig voneinander Substituenten umfassend 1 bis 15 Kohlenstoffatome sein können, wobei die Reste linear oder verzweigt sein können, und wobei die Reste RC und RD außerdem gemeinsam mit dem zentralen N-Atom des Kations einen gesättigten, Ring formen können, wobei der Ring insbesondere fünf- bis siebengliedrig sein kann, und wobei dessen periphere H-Atome substituiert sein können,
und
• PF6 – als Anion.
-
Der Elektrolyt der zuvor beschriebenen erfindungsgemäßen elektrochemischen Zelle geht aus diesem Elektrolyten nach dem Befüllen der elektrochemischen Zelle durch wenige Lade-Entlade-Zyklen der elektrochemischen Zelle hervor. Unter einem Lade-Entlade-Zyklus ist dabei zu verstehen, dass die elektrochemische Zelle einmal aufgeladen und daraufhin entladen wird.
-
Der zum Befüllen der elektrochemischen Zelle geeignete Elektrolyt und der nach einem oder einigen wenigen Lade-Entlade-Zyklen resultierende Elektrolyt unterscheiden sich dadurch voneinander, dass der zum Befüllen der Zelle geeignete Elektrolyt ein Additiv umfasst, welches im Zuge der ersten Lade-Entlade-Zyklen, insbesondere im Zuge der ersten drei Lade-Entlade-Zyklen eine chemische Reaktion mit dem Aluminium-Stromkollektor eingeht. PF6 – Anionen des Additivs reagieren mit dem Aluminium-Stromkollektor unter Bildung einer Schutzschicht umfassend AlF3. Dadurch werden die PF6 – Anionen weit- gehend verbraucht, was zu dem geringen Anteil an PF6 – Anionen am finalen Elektrolyten von weniger als 0,5 Gewichtsprozent führt. Weiterhin können sich der Elektrolyt zum Befüllen der elektrochemischen Zelle und der resultierende Elektrolyt auch dadurch unterscheiden, dass ein Teil der FSI Anionen (also den Anionen des Leitsalzes) mit der negativen Elektrode eine Reaktion eingehen können, wobei eine Schutzschicht auf der negativen Elektrode gebildet werden kann. Der Anteil an FSI Anionen am resultierenden Elektrolyt kann also geringer sein als der Anteil am Elektrolyt geeignet zum Befüllen der Zelle.
-
Alle weiteren zuvor bereits beschriebenen Eigenschaften und Merkmale des Elektrolyten der erfindungsgemäßen elektrochemischen Zelle treffen auch auf den Elektrolyten geeignet zum Befüllen der elektrochemischen Zelle zu. Darüber hinaus sind auch alle bevorzugten Ausführungsformen der elektrochemischen Zelle, soweit sie den Elektrolyten betreffen, auf den Elektrolyten, der zum Befüllen der elektrochemischen Zelle geeignet ist, übertragbar.
-
Im Hinblick auf das Additiv des Elektrolyten gelten für das Kation des Additivs, bei dem es sich um ein ionisches Additiv handelt, die gleichen Eigenschaften und bevorzugten Ausführungsformen wie für das zuvor beschriebene Kation der ionischen Flüssigkeit die das Lösungsmittel der erfindungsgemäßen elektrochemischen Zelle bildet.
-
Das Additiv umfassend ein Kation der allgemeinen Form
und des Anions PF
6 –,
dient als PF
6 – Quelle für die Reaktion mit dem Aluminium-Stromkollektor unter Bildung einer Schutzschicht umfassend AlF
3. Die Einbringung von PF
6 – in Form eines derartigen Salzes erlaubt es auf eine Verwendung von LiPF
6 als PF
6 – Quelle zu verzichten. Dies erlaubt eine Einführung von PF
6 – durch ein vom Leitsalz verschiedenes Salz. Die erforderliche Menge an Leitsalz im Elektrolyt wird vor allem durch den Bedarf an Lithium-Ionen bestimmt. Bei einer Zugabe von PF
6 – über das Leitsalz werden daher unnötig große Mengen an PF
6 – in den Elektrolyt eingeführt, die aufgrund der negativen Eigenschaften des PF
6 – zu Problemen der Sicherheit und Umweltverträglichkeit etwa durch die Bildung unerwünschter Nebenprodukte (z.B. HF, PF
5) führen. Dadurch dass PF
6 – in der Form eines vom Leitsalz verschiedenen Additivs eingeführt wird, wird es möglich eine Entkopplung von der Menge an zugegebenem Leitsalz zu erreichen und so deutlich geringere Mengen an PF
6 – einzusetzen, so dass PF
6 –während der ersten Lade-Entlade-Zyklen nahezu vollständig abgebaut werden kann.
-
Ein Anteil von 80 bis 94,9 Gewichtsprozent der ionischen Flüssigkeit am Elektrolyten ist vorteilhaft, da selbige durch eine besonders hohe chemische, elektrochemische und thermische Stabilität gekennzeichnet ist. Die hohe Stabilität dieser Hauptkomponente des Elektrolyten führt zu einer hohen Gesamtstabilität des Elektrolyten.
-
Der Anteil von 5 bis 15 Gewichtsprozent des Leitsalzes LiFSI am gesamten Elektrolyten stellt eine ausreichende Lithium-Ionen-Konzentration sicher. Zudem sind somit hinreichend viele FSI-Anionen für die Ausbildung der Schutzschicht auf der negativen Elektrode bereitgestellt. Aus dem gleichen Grunde ist es weiterhin bevorzugt, wenn der Anteil des Leitsalzes 5 bis 12 Gewichtsprozent am gesamten Elektrolyten und noch weiter bevorzugt 6 bis 10 Gewichtsprozent am gesamten Elektrolyten umfasst.
-
Ein Anteil von 0,1 bis 5 Gewichtsprozent des Additivs am gesamten Elektrolyt sorgt für einen hinreichend hohen Anfangsgehalt von PF6 – im Elektrolyt, um eine funktionsfähige Schutzschicht umfassend AlF3 auf dem Aluminium-Stromkollektor im Zuge der ersten Lade-Entlade-Zyklen zu erzeugen. Gleichzeitig ist der Anteil an PF6 –, welches im Vergleich zum Kation des Additivs ein deutlich geringeres Molekulargewicht aufweist, hinreichend gering, sodass PF6 – nach wenigen Lade-Entladezyklen weitgehend abgebaut ist. Aus dem gleichen Grunde ist es besonders bevorzugt, wenn der Anteil des Additivs am Elektrolyten 0,1 bis 2 Gewichtsprozent beträgt. In einer anderen bevorzugten Ausführungsform beträgt der Anteil des Additivs am Elektrolyten 1 bis 5 Gewichtsprozent, insbesondere 1 bis 2 Gewichtsprozent. Neben dem Schutz des Aluminium-Stromkollektors hat das Additiv zudem den Effekt den Elektrolyten vor einer unerwünschten Oxidation zu schützen.
-
Eine weitere Ausführungsform der Erfindung betrifft einen Elektrolyt geeignet zum Befüllen einer elektrochemischen Zelle, wobei das Kation des Additivs identisch ist mit dem Kation des Lösungsmittels. Ein derartiger Elektrolyt ist weniger komplex und meist auch einfacher und preiswerter herzustellen als ein Elektrolyt mit verschiedenartigen Kationen des Additivs und des Lösungsmittels.
-
Eine weitere Ausführungsform der Erfindung betrifft einen Elektrolyt geeignet zum Befüllen einer elektrochemischen Zelle, wobei das Kation des Additivs verschieden ist vom Kation des Lösungsmittels. Ein derartiger Elektrolyt besitzt im Vergleich zu einem Elektrolyt mit nur einem Kation abgesehen von den Lithium-Kationen eine vergleichsweise niedrigere Schmelztemperatur und auch eine geringere Viskosität bei niedrigeren Temperaturen. Dies führt zu einer besonders hohen Ionen-Mobilität und verbesserten Leitfähigkeiten auch bei tiefen Temperaturen.
-
Das im Zusammenhang mit der erfindungsgemäßen elektrochemischen Zelle bereits beschriebene zusätzliche Kation geht aus dem Additiv hervor, wenn das Additiv ein Kation umfasst, welches nicht gleich dem Kation der ionischen Flüssigkeit, die das Lösungsmittel bildet, ist.
-
Weiterhin betrifft die Erfindung ein Verfahren zum Herstellen einer elektrochemischen Zelle. Das Verfahren umfasst die Schritte:
- A) Bereitstellen einer elektrochemischen Zelle ohne Elektrolyt, umfassend zwei Elektroden und einen Aluminium-Stromkollektor,
- B) Befüllen der elektrochemischen Zelle mit dem oben beschriebenen Elektrolyten geeignet zum Befüllen der elektrochemischen Zelle,
- C) Laden und Entladen der befüllten elektrochemischen Zelle, wobei Schritt C) mindestens einmal, bevorzugt mindestens dreimal durchgeführt wird, und
wobei im Verfahrensschritt C) aufgrund einer Reaktion des PF6 – mit dem Aluminium-Stromkollektor eine Schutzschicht umfassend AlF3 auf dem Aluminium Stromkollektor gebildet wird, und aufgrund einer Reaktion desmit der negativen Elektrode eine Schutzschicht auf der negativen Elektrode gebildet wird.
-
Das geschilderte Verfahren beschreibt die Herstellung einer erfindungsgemäßen elektrochemischen Zelle unter Nutzung des erfindungsgemäßen Elektrolyten geeignet zum Befüllen einer elektrochemischen Zelle. Im Rahmen des Verfahrens kommt kein LiPF6 zum Einsatz. PF6 – wird ausschließlich in Form des zuvor beschriebenen Additivs in den Elektrolyten eingeführt. Auf diese Weise ist auch die Sicherheit des Verfahrens zur Herstellung der elektrochemischen Zelle deutlich höher als bei Verfahren mit LiPF6, da das Additiv eine höhere Stabilität als LiPF6 aufweist und unerwünschte Nebenreaktionen unter Freisetzung toxischer oder ätzender Substanzen vermieden werden können.
-
In einer weiteren Ausführungsform des Verfahrens zum Herstellen der elektrochemischen Zelle wird Schritt C) höchstens fünfmal, weiter bevorzugt höchstens dreimal durchgeführt. Es ist auch möglich, das Schritt C) nur einmal durchgeführt wird.
-
Weiterhin betrifft die Erfindung ein Verfahren zum Betreiben einer elektrochemischen Zelle, umfassend zwei Elektroden und einen Aluminium-Stromkollektor sowie einen Elektrolyten geeignet zum Befüllen der elektrochemischen Zelle, wobei während der ersten Lade-Entlade-Zyklen, insbesondere während der ersten drei Lade-Entlade-Zyklen aufgrund einer Reaktion des PF
6 – mit dem Aluminium-Stromkollektor eine Schutzschicht umfassend AlF
3 auf dem Aluminium Stromkollektor gebildet wird, und aufgrund einer Reaktion des
mit der negativen Elektrode eine Schutzschicht auf der negativen Elektrode gebildet wird.
-
Schließlich gestattet das erfindungsgemäße Verfahren den Aufbau der beschriebenen Schutzschichten sowohl auf der negativen Elektrode wie auch auf dem Aluminium-Stromkollektor unter gleichzeitigem Verbrauch von für den dauerhaften Betrieb unerwünschten PF6 –. Der resultierende Elektrolyt umfasst überwiegend die thermisch, chemisch und elektrochemisch äußerst stabile ionische Flüssigkeit, die als Lösungsmittel fungiert, sowie die essentiellen Lithium-Kationen. Der resultierende Elektrolyt kann FSI-Anionen in einem geringeren Maß umfassen, während PF6 – Ionen kaum mehr vorhanden sind. Diese Kombination erlaubt die Herstellung der gewünschten Schutzschichten auf der negativen Elektrode und auf dem Aluminium-Stromkollektor wobei zugleich der resultierende Elektrolyt nahezu frei ist von unerwünschten Komponenten, während allein hoch stabile und sichere Komponenten im Elektrolyt verbleiben.
-
Im Folgenden soll kurz auf die Synthese des Additivs des erfindungsgemäßen Elektrolyten, der zum Befüllen der elektrochemischen Zelle geeignet ist, eingegangen werden. Außerdem soll die Erfindung anhand einer Figur sowie eines Ausführungsbeispiels näher erläutert werden.
-
Die Herstellung des Additivs erfolgt mittels Ionenaustauschreaktionen.
-
Eine mögliche Synthese wird im Folgenden beispielhaft für das Additiv N-Methyl-N-Butyl-Pyrrolidinium-Hexafluorophosphat (abgekürzt PYR14PF6) aufgezeigt.
-
Als Startmaterial fungiert käuflich erhältliches PYR14Br, welches in Wasser oder alternativ einem organischen Lösungsmittel, beispielsweise Acetonitril, mit AgPF6 umgesetzt wird.
-
Dabei bildet sich mittels Ionenaustausch PYR14PF6, welches ebenso wie die beiden Edukte in Wasser (bzw. Acetonitril) löslich ist. Als weiteres Produkt entsteht AgBr, welches einen Niederschlag bildet. Das Fällungsprodukt AgBr kann dann beispielsweise mittels Filtration oder Zentrifugation abgetrennt werden. Die resultierende Lösung enthält das gewünschte Produkt PYR14PF6, welches mittels Verdampfen des Lösungsmittels erhalten werden kann.
-
Bevorzugte Lösungsmittel bei der Umsetzung sind Wasser, Acetonitril oder Mischungen davon. Um Kontaminationen des Produkts mit Silber zu vermeiden kann der Ionenaustausch beispielsweise auch mittels potentiometrischer Titration durchgeführt werden. Eine Reinigung des erhaltenen Produkts ist beispielsweise durch Umkristallisieren, falls gewünscht auch durch mehrfaches Umkristallisieren, möglich.
-
Eine alternative Syntheseroute vollzieht den Ionenaustausch nicht mit AgPF6 sondern mit LiPF6. Hierbei reagiert PYR14Br mit LiPF6 zu PYR14PF6. Als Lösungsmittel dient eine ethanolische Lösung (wasserfreies Ethanol). Das Produkt kann mittels Extraktion z.B. mit Dichlormethan erhalten werden.
-
Allgemein ist eine Synthese der genannten Additive aus den Halogeniden, bevorzugt den Bromiden, des quaternären vierfachsubstituierten Ammonium-Kations möglich durch Umsetzung mit AgPF6 oder LiPF6 oder vergleichbaren Salzen von Hexafluorophosphat.
-
1 zeigt eine schematische Darstellung der elektrochemischen Zelle (1).
-
Die Zelle (1) weist eine positive Elektrode (2a) und eine negative Elektrode (2b) auf. Die positive Elektrode (2a) ist elektrisch leitend mit einem Aluminium-Stromkollektor (3a) verbunden, welcher eine Schutzschicht umfassend AlF3 aufweist. Auch die negative Elektrode kann mit einem Stromkollektor (3b) verbunden sein. Zudem umfasst die elektrochemische Zelle (1) einen Elektrolyten (4) der beschriebenen Zusammensetzung.
-
Im Folgenden werden zur Veranschaulichung zwei Beispiele für Zusammensetzungen des Elektrolyten, geeignet zum Befüllen der elektrochemischen Zelle, angegeben.
-
Beispiel 1:
-
Der Elektrolyt gemäß Ausführungsbeispiel 1 umfasst mit einem Anteil von 92 Gewichtsprozent am gesamten Elektrolyten als Lösungsmittel die ionische Flüssigkeit der Formel:
-
Der Elektrolyt geeignet zum Befüllen der Zelle umfasst gemäß Ausführungsbeispiel 1 weiterhin 7 Gewichtsprozent des Leitsalzes LiFSI am gesamten Elektrolyten:
-
Ferner umfasst der Elektrolyt zum Befüllen der Zelle einen Anteil von 1 Gewichtsprozent des Additivs am gesamten Elektrolyten:
-
Beispiel 2:
-
Der Elektrolyt gemäß Ausführungsbeispiel 2 umfasst mit einem Anteil von 90 Gewichtsprozent am gesamten Elektrolyten als Lösungsmittel die ionische Flüssigkeit der Formel:
-
Der Elektrolyt geeignet zum Befüllen der Zelle umfasst gemäß Ausführungsbeispiel 2 weiterhin 8 Gewichtsprozent des Leitsalzes LiFSI am gesamten Elektrolyten:
-
Ferner umfasst der Elektrolyt zum Befüllen der Zelle einen Anteil von 2 Gewichtsprozent des Additivs am gesamten Elektrolyten:
-
Die hier beschriebene Erfindung ist nicht durch die Beschreibung anhand der Ausführungsbeispiele beschränkt. Vielmehr umfasst die Erfindung jedes neue Merkmal sowie jede Kombination von Merkmalen, was insbesondere jede Kombination von Merkmalen in den Patentansprüchen beinhaltet, auch wenn dieses Merkmal oder diese Kombination selbst nicht explizit in den Patentansprüchen oder Ausführungsbeispielen angegeben ist.