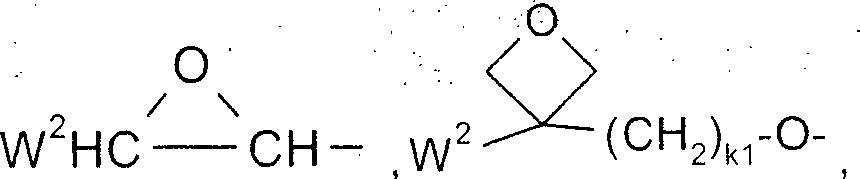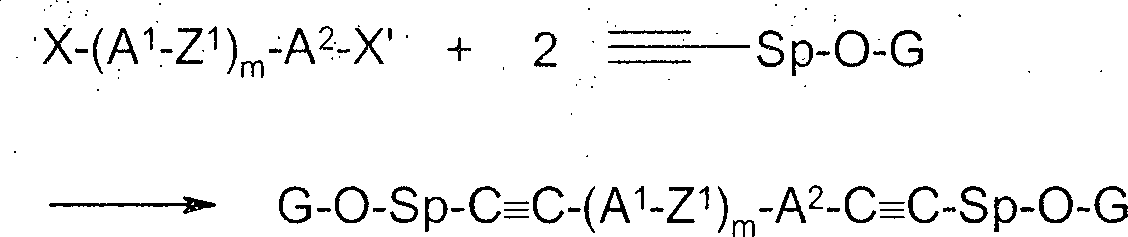-
Die vorliegende Erfindung betrifft polymerisierbare Verbindungen, Verfahren und Zwischenprodukte zu ihrer Herstellung, und ihre Verwendung für optische, elektrooptische und elektronische Zwecke, insbesondere in Flüssigkristall(FK)-Medien und FK-Anzeigen, vor allem in FK-Anzeigen des PS- oder PSA-Typs (”polymer sustained” bzw. ”polymer sustained alignment”).
-
Die derzeit verwendeten Flüssigkristallanzeigen (FK-Anzeigen) sind meist solche des TN-Typs (”twisted nematic”). Diese weisen allerdings den Nachteil einer starken Blickwinkelabhängigkeit des Kontrastes auf. Daneben sind sogenannte VA-Anzeigen (”vertically aligned”) bekannt, die einen breiteren Blickwinkel aufweisen. Die FK-Zelle einer VA-Anzeige enthält eine Schicht eines FK-Mediums zwischen zwei transparenten Elektroden, wobei das FK-Medium üblicherweise einen negativen Wert der dielektrischen (DK-)Anisotropie aufweist. Die Moleküle der FK-Schicht sind im ausgeschalteten Zustand senkrecht zu den Elektrodenflächen (homöotrop) oder gekippt homöotrop (”tilted”) orientiert. Bei Anlegen einer elektrischen Spannung an die beiden Elektroden findet eine Umorientierung der FK-Moleküle parallel zu den Elektrodenflächen statt.
-
Weiterhin sind OCB-Anzeigen (”optically compensated bend”) bekannt, die auf einem Doppelbrechungseffekt beruhen und eine FK-Schicht mit einer sogenannten ”bend”-Orientierung und üblicherweise positiver (DK-)Anisotropie aufweisen. Bei Anlegen einer elektrischen Spannung findet eine Umorientierung der FK-Moleküle senkrecht zu den Elektrodenflächen statt. Darüber hinaus enthalten OCB-Anzeigen normalerweise einen oder mehrere doppelbrechende optische Retardationsfilme, um unerwünschte Lichtdurchlässigkeit der ”bend”-Zelle im dunklen Zustand zu vermeiden. OCB-Anzeigen besitzen gegenüber TN-Anzeigen einen weiteren Blickwinkel und kürzere Schaltzeiten.
-
Weiterhin sind sogenannte IPS-Anzeigen (”In-Plane Switching”) bekannt, die eine FK-Schicht zwischen zwei Substraten enthalten, wobei die beiden Elektroden nur auf einem der beiden Substrate angeordnet sind, und vorzugsweise ineinander verzahnte, kammförmige Strukturen aufweisen. Dadurch wird bei Anlegen einer Spannung an die Elektroden ein elektrisches Feld zwischen ihnen erzeugt, welches eine signifikante Komponente parallel zur FK-Schicht aufweist. Dies bewirkt eine Umorientierung der FK-Moleküle in der Schichtebene.
-
Des weiteren wurden sogenannte FFS-Anzeigen (”Fringe-Field-Switching”) vorgeschlagen (siehe u. a. S. H. Jung et al., Jpn. J. Appl. Phys., Band 43, No. 3, 2004, 1028), die ebenfalls zwei Elektroden auf dem gleichen Substrat beinhalten, wovon jedoch im Gegensatz zu IPS-Anzeigen nur eine als kammförmig strukturierte Elektrode ausgebildet ist, und die andere Elektrode unstrukturiert ist. Dadurch wird ein starkes sogenanntes „fringe field” erzeugt, also ein starkes elektrisches Feld nahe am Rand der Elektroden und in der gesamten Zelle ein elektrisches Feld, welches sowohl eine starke vertikale als auch eine starke horizontale Komponente aufweist. Sowohl IPS-Anzeigen als auch FFS-Anzeigen weisen eine geringe Blickwinkelabhängigkeit des Kontrastes auf.
-
In VA-Anzeigen des neueren Typs ist die einheitliche Ausrichtung der FK-Moleküle auf mehrere kleinere Domänen innerhalb der FK-Zelle beschränkt. Zwischen diesen Domänen, auch als Tilt-Domänen (engl. ”tilt domains”) bezeichnet, können Disklinationen existieren. VA-Anzeigen mit Tilt-Domänen weisen, verglichen mit herkömmlichen VA-Anzeigen, eine größere Blickwinkelunabhängigkeit des Kontrastes und der Graustufen auf. Außerdem sind solche Anzeigen einfacher herzustellen, da eine zusätzliche Behandlung der Elektrodenoberfläche zur einheitlichen Orientierung der Moleküle im eingeschalteten Zustand, wie z. B. durch Reiben, nicht mehr notwendig ist. Stattdessen wird die Vorzugsrichtung des Kipp- oder Tiltwinkels (engl. ”pretilt”) durch eine spezielle Ausgestaltung der Elektroden kontrolliert.
-
In den sogenannten MVA-Anzeigen (”multidomain vertical alignment”) wird dies üblicherweise dadurch erreicht, dass die Elektroden Erhebungen oder Vorsprünge (engl. ”protrusions”) aufweisen, die einen lokalen pretilt verursachen. Als Folge werden die FK-Moleküle beim Anlegen einer Spannung in verschiedenen, definierten Regionen der Zelle in unterschiedliche Richtungen parallel zu den Elektrodenflächen orientiert. Dadurch wird ein ”kontrolliertes” Schalten erreicht und das Entstehen störender Disklinationslinien vermieden. Diese Anordnung verbessert zwar den Blickwinkel der Anzeige, führt aber zu einer Verringerung ihrer Lichtdurchlässigkeit.
-
Eine Weiterentwicklung von MVA verwendet Protrusions nur auf einer Elektroden-Seite, die gegenüberliegende Elektrode weist hingegen Schlitze (engl. ”slits”) auf, was die Lichtdurchlässigkeit verbessert. Die geschlitzten Elektroden erzeugen beim Anlegen einer Spannung ein inhomogenes elektrisches Feld in der FK-Zelle, so dass weiterhin ein kontrolliertes Schalten erreicht wird. Zur weiteren Verbesserung der Lichtdurchlässigkeit können die Abstände zwischen den slits und protrusions vergrößert werden, was jedoch wiederum zu einer Verlängerung der Schaltzeiten führt. Beim sogenannten PVA (Patterned VA) kommt man ganz ohne Protrusions aus, indem man beide Elektroden auf den gegenüberliegenden Seiten durch Schlitze strukturiert, was zu einem erhöhten Kontrast und verbesserter Lichtdurchlässigkeit führt, aber technologisch schwierig ist und das Display empfindlicher gegen mechanische Einflüsse macht (Klopfen, engl. „tapping”, etc.). Für viele Anwendungen, wie beispielsweise Monitore und vor allem TV-Bildschirme, ist jedoch eine Verkürzung der Schaltzeiten sowie eine Verbesserung des Kontrastes und der Luminanz (Transmission) der Anzeige gefragt.
-
Eine Weiterentwicklung stellen die sogenannten PS- bzw. PSA-Anzeigen (”polymer sustained” bzw. ”polymer sustained alignment”) dar, für die auch gelegentlich der Begriff ”polymer stabilized” verwendet wird. Darin wird dem FK-Medium eine geringe Menge (zum Beispiel 0.3 Gew.-%, typischerweise < 1 Gew.-%) einer oder mehrerer polymerisierbaren Verbindung(en) zugesetzt, welche nach Einfüllen in die FK-Zelle mit oder ohne angelegte elektrische Spannung zwischen den Elektroden in situ polymerisiert bzw. vernetzt wird, üblicherweise durch UV-Photopolymerisation. Als besonders geeignet hat sich der Zusatz von polymerisierbaren mesogenen oder flüssigkristallinen Verbindungen, auch als reaktive Mesogene oder ”RM”s bezeichnet, zur FK-Mischung erwiesen.
-
Nachfolgend wir der Begriff ”PSA”, falls nicht anders angegeben, stellvertretend für PS-Anzeigen und PSA-Anzeigen verwendet.
-
Mittlerweile wird das PS(A)-Prinzip in diversen klassischen FK-Anzeigen angewendet. So sind beispielsweise PSA-VA-, PSA-OCB-, PSA-IPS-, PSA-FFS- und PSA-TN-Anzeigen bekannt. Die Polymerisation der polymerisierbaren Verbindung(en) erfolgt bei PSA-VA- und PSA-OCB-Anzeigen vorzugsweise bei angelegter elektrischer Spannung, bei PSA-IPS-Anzeigen mit oder ohne, vorzugsweise ohne, angelegte elektrische Spannung. Wie man in Testzellen nachweisen kann, führt das PS(A) Verfahren zu einem pretilt in der Zelle. Bei PSA-OCB-Anzeigen beispielsweise kann man erreichen, dass die Bend-Struktur stabilisiert wird, so dass man ohne Offset-Spannung auskommt oder diese reduzieren kann. Im Falle von PSA-VA-Anzeigen wirkt sich der pretilt positiv auf die Schaltzeiten aus. Für PSA-VA-Anzeigen kann ein Standard-MVA- bzw. -PVA Pixel- und Elektroden-Layout verwendet werden. Darüber hinaus kann man aber beispielsweise auch mit nur einer strukturierten Elektrodenseite und ohne Protrusions auskommen, was die Herstellung wesentlich vereinfacht und gleichzeitig zu einem sehr guten Kontrast bei sehr guter Lichtdurchlässigkeit führt.
-
Außerdem haben sich sogenannte Posi-VA-Anzeigen (”Positiv-VA”) als besonders günstige Ausführungsform erwiesen. Ebenso wie bei klassischen VA-Anzeigen, ist bei Posi-VA-Anzeigen die Ausgangsorientierung der Flüssigkristalle im spannungsfreien Ausgangszustand, homöotrop, also im wesentlichen senkrecht zu den Substraten. Im Gegensatz zu klassischen VA-Anzeigen werden in Posi-VA-Anzeigen jedoch FK-Medien mit positiver dielektrischer Anisotropie verwendet. Die beiden Elektroden in Posi-VA-Anzeigen sind, wie in den üblicherweise verwendeten IPS-Anzeigen, nur auf einem der beiden Substrate angeordnet, und weisen vorzugsweise ineinander verzahnte, kammförmige (interdigitale) Strukturen auf. Durch Anlegen einer elektrischen Spannung an die interdigitale Elektroden, die ein im wesentlichen zur Schicht des FK-Mediums paralleles Feld erzeugen, werden die FK-Moleküle in eine im wesentlichen zu den Substraten parallele Orientierung überführt. Auch bei Posi-VA-Anzeigen hat sich eine Polymerstabilisierung (PSA) als vorteilhaft erwiesen, d. h. die Zugabe von RMs zum FK-Medium, welche in der Zelle polymerisiert werden, wodurch eine erhebliche Reduzierung der Schaltzeiten realisiert werden konnte.
-
PSA-VA-Anzeigen sind beispielsweise in
JP 10-036847 A ,
EP 1 170 626 A2 ,
US 6,861,107 ,
US 7,169,449 ,
US 2004/0191428 A1 ,
US 2006/0066793 A1 und
US 2006/0103804 A1 beschrieben. PSA-OCB-Anzeigen sind beispielsweise in
T.-J. Chen et al., Jpn. J. Appl. Phys. 45, 2006, 2702–2704 und
S. H. Kim, L.-C. Chien, Jpn. J. Appl. Phys. 43, 2004, 7643–7647 beschrieben. PSA-IPS-Anzeigen sind zum Beispiel in
US 6,177,972 und
Appl. Phys. Lett. 1999, 75(21), 3264 beschrieben. PSA-TN-Anzeigen sind zum Beispiel in
Optics Express 2004, 12(7), 1221 beschrieben.
-
PSA-Anzeigen können ebenso wie die oben beschriebenen konventionallen FK-Anzeigen als Aktivmatrix- oder Passivmatrix-Anzeigen betrieben werden. Bei Aktivmatrix-Anzeigen erfolgt die Ansteuerung einzelner Bildpunkte üblicherweise durch integrierte, nicht-lineare aktive Elemente wie beispielsweise Transistoren (z. B. Dünnfilmtransistoren, engl. ”thin film transistor” bzw. ”TFT”), bei Passivmatrix-Anzeigen üblicherweise nach dem Multiplex-Verfahren, wie aus dem Stand der Technik bekannt.
-
Insbesondere für Monitor- und vor allem TV-Anwendungen ist nach wie vor die Optimierung der Schaltzeiten, wie aber auch des Kontrastes und der Luminanz (also auch Transmission) der FK-Anzeige gefragt. Hier kann das PSA-Verfahren entscheidende Vorteile bringen. Insbesondere bei PSA-VA-, PSA-IPS-, PSA-FFS- und PSA-Posi-VA-Anzeigen kann man ohne nennenswerte Einbußen sonstiger Parameter eine Verkürzung der Schaltzeiten erreichen, die mit einem in Testzellen messbaren pretilt korrelieren.
-
Im Stand der Technik werden beispielsweise polymerisierbare Verbindungen der folgenden Formel verwendet
worin P eine polymerisierbare Gruppe, üblicherweise eine Acrylat- oder Methacrylategruppe bedeutet, wie beispielsweise in
US 7,169,449 beschrieben.
-
Es ergibt sich jedoch das Problem, dass nicht alle Kombinationen bestehend aus FK-Mischung (nachfolgend auch als ”FK-Hostmischung” bezeichnet) + polymerisierbarer Komponente (typischerweise RMs) für PSA-Anzeigen geeignet sind, weil sich zum Beispiel kein oder kein ausreichender Tilt einstellt, oder weil zum Beispiel die sogenannte „Voltage Holding Ratio” (VHR oder HR) für TFT-Displayanwendungen unzureichend ist. Zudem hat sich gezeigt, dass bei Verwendung in PSA-Anzeigen die aus dem Stand der Technik bekannten FK-Mischungen und RMs noch einige Nachteile aufweisen. So eignet sich nicht jedes bekannte, in FK-Mischungen lösliche RM zur Verwendung in PSA-Anzeigen. Ausserdem ist es oft schwierig, neben der direkten Messung des pretilts in der PSA-Anzeige ein geeignetes Auswahlkriterium für das RM zu finden. Noch kleiner wird die Auswahl geeigneter RMs, wenn eine Polymerisation mittels UV-Licht ohne den Zusatz von Photoinitiatoren gewünscht ist, was für bestimmte Anwendungen von Vorteil sein kann.
-
Darüber hinaus sollte die gewählte Kombination FK-Hostmischung/RM eine möglichst geringe Rotationsviskosität sowie möglichst gute elektrische Eigenschaften aufweisen, insbesondere sollte sie eine möglichst hohe VHR besitzen. Bei PSA-Anzeigen ist vor allem eine hohe VHR nach Bestrahlung mit UV-Licht erforderlich, da die UV-Belichtung ein notwendiger Teil des Herstellungsprozesses der Anzeige ist, aber auch als normale Belastung im Betrieb der fertigen Anzeige auftritt.
-
Insbesondere wäre es wünschenswert, neue Materialien für PSA-Anzeigen zur Verfügung zu haben, die einen besonders kleinen pretilt-Winkel erzeugen. Hierbei sind Materialien bevorzugt, die während der Polymerisation bei gleicher Belichtungszeit einen niedrigeren pretilt-Winkel erzeugen als die bisher bekannten Materialien, und/oder durch deren Verwendung der mit den bekannten Materialien erzielbare (höhere) pretilt-Winkel bereits nach kürzerer Belichtungszeit erreicht werden kann.
-
Dadurch könnten die Produktionszeit (engl. ”tact time”) der Anzeige verkürzt und die Kosten des Produktionsprozesses verringert werden.
-
Ein weiteres Problem bei der Herstellung von PSA-Anzeigen ist das Vorhandensein bzw. die Entfernung von Restmengen unpolymerisierter RMs insbesondere nach dem Polymerisationsschritt zur Erzeugung des pretilt-Winkels in der Anzeige. Beispielsweise können solche nicht abreagierten RMs die Eigenschaften der Anzeige nachteilig beeinflussen, indem sie z. B. nach Fertigstellung der. Anzeige während des Betriebes unkontrolliert polymerisieren.
-
So zeigen die aus dem Stand der Technik bekannten PSA-Anzeigen oft den unerwünschten Effekt des sogenannten ”image sticking” oder ”image burn”, d. h. dass das in der FK-Anzeige durch vorübergehende Ansteuerung einzelner Bildpunkte (pixel) erzeugte Bild auch nach Abschalten des elektrischen Feldes in diesen Bildpunkten, oder nach Ansteuerung anderer Bildpunkte, noch sichtbar bleibt.
-
Dieses ”image sticking” kann einerseits auftreten, wenn FK-Hostmischungen mit einem geringen VHR verwendet wird. In diesen kann die UV-Komponente des Tageslichtes oder der Hintergrundbeleuchtung unerwünschte Zerfallsreaktionen der FK-Moleküle und dadurch die Erzeugung von ionischen oder radikalischen Verunreinigungen auslösen. Diese können sich insbesondere an den Elektroden bzw. den Orientierungsschichten anreichern und dort die effektive angelegte Spannung reduzieren. Dieser Effekt ist auch bei herkömmlichen FK-Anzeigen ohne Polymerkomponente zu beobachten.
-
In PSA-Anzeigen wird darüber hinaus oft ein zusätzlicher ”image sticking”-Effekt beobachtet, der durch die Gegenwart von unpolymerisierten RMs hervorgerufen wird. Dabei wird durch UV-Licht aus der Umgebung oder von der Hintergrundbeleuchtung eine unkontrollierte Polymerisation der Rest-RMs ausgelöst. In den geschalteten Displaybereichen wird dadurch nach mehreren Ansteuerungszyklen der Tiltwinkel verändert. Als Resultat kann eine Transmissionsänderung in den geschalteten Bereichen auftreten, während sie in den ungeschalteten Bereichen unverändert bleibt.
-
Es ist deshalb wünschenswert, dass die Polymerisation der RMs bei der Herstellung der PSA-Anzeige möglichst vollständig abläuft und die Anwesenheit von unpolymerisierten RMs in der Anzeige möglichst ausgeschlossen oder auf ein Minimum reduziert wird. Hierzu werden Materialien benötigt, die eine möglichst effektive und vollständige Polymerisation ermöglichen. Zudem wäre ein kontrolliertes Abreagieren dieser Restmengen wünschenswert. Dies wäre einfacher, wenn das RM schneller und effektiver polymerisiert als die bisher bekannten Materialien.
-
Es besteht somit immer noch ein großer Bedarf an PSA-Anzeigen, insbesondere vom VA- und OCB-Typ, sowie FK-Medien und polymerisierbaren Verbindungen zur Verwendung in solchen Anzeigen, welche die oben beschriebenen Nachteile nicht oder nur in geringem Maße zeigen und verbesserte Eigenschaften besitzen. Insbesondere besteht ein großer Bedarf nach PSA-Anzeigen, sowie Materialien zur Verwendung in PSA-Anzeigen, die einen hohen spezifischen Widerstand bei gleichzeitig großem Arbeitstemperaturbereich, kurze Schaltzeiten auch bei tiefen Temperaturen und niedriger Schwellenspannung, einen niedrigen pretilt-Winkel, eine Vielzahl von Graustufen, einen hohen Kontrast und einen weiten Blickwinkel ermöglichen, sowie hohe Werte der ”voltage holding ratio” (VHR) nach UV-Belastung aufweisen.
-
Der Erfindung liegt die Aufgabe zugrunde, neue geeignete Materialien, insbesondere RMs und diese enthaltende FK-Medien, für die Verwendung in PSA-Anzeigen bereitzustellen, die die oben angegebenen Nachteile nicht oder in geringerem Maße aufweisen, möglichst schnell und vollständig polymerisieren, eine möglichst schnelle Einstellung eines niedrigen pretilt-Winkels ermöglichen, das Auftreten von ”image sticking” in der Anzeige verringern oder vermeiden, und vorzugsweise gleichzeitig sehr hohe spezifische Widerstände, niedrige Schwellenspannungen und niedrige Schaltzeiten ermöglichen.
-
Weitere Aufgabe der Erfindung ist die Bereitstellung von neuen RMs, insbesondere für optische, elektrooptische und elektronische Anwendungen, sowie von geeigneten Verfahren und Zwischenprodukten zu ihrer Herstellung.
-
Insbesondere liegt der Erfindung die Aufgabe zugrunde, polymerisierbare Verbindungen bereitzustellen, die nach Photopolymerisation einen größeren maximalen Pretilt erzeugen, was zu einem schnelleren Erreichen des gewünschten Pretilts und so zu deutlich verkürzten Zeiten bei der Herstellung der FK-Anzeige führt.
-
Diese Aufgabe wurde erfindungsgemäß gelöst durch die Bereitstellung von Materialien, Verfahren und FK-Anzeigen wie in der vorliegenden Anmeldung beschrieben. Insbesondere wurde überraschend gefunden, dass die oben beschriebenen Aufgaben teilweise oder vollständig gelöst werden können, indem man PSA-Anzeigen bereitstellt, die eine oder mehrere polymerisierte erfindungsgemäße Verbindungen enthalten, bzw. indem man zur Herstellung solcher PSA-Anzeigen FK-Medien verwendet, welche eine oder mehrere erfindungsgemäße polymerisierbare Verbindungen enthalten. Die erfindungsgemäßen polymerisierbaren Verbindungen enthalten eine mesogene Gruppe und eine oder mehrere polymerisierbare Gruppen, wobei mindestens eine dieser polymerisierbaren Gruppen über eine Abstandsgruppe mit der mesogenen Gruppe verbunden ist, und wobei mindestens eine dieser Abstandsgruppen eine C-C-Dreifachbindung enthält.
-
Die Verwendung solcher polymerisierbarer Verbindungen in erfindungsgemäßen FK-Medien und PSA-Anzeigen führt zu einem besonders schnellen Erreichen des gewünschten Pretilts und zu deutlich verkürzten Zeiten bei der Herstellung der Anzeige. Dies konnte in Verbindung mit einem FK-Medium mittels belichtungszeitabhängiger Pretilt-Messungen in VA-Tilt-Messzellen nachgewiesen werden. Insbesondere konnte ein Pretilt ohne den Zusatz von Photoinitiator erreicht werden.
-
Da die erfindungsgemäßen polymerisierbaren Verbindungen in den PSA-Anzeigen eine deutlich höhere Polymerisationsgeschwindigkeit zeigen, verbleiben auch weniger unreagierte Restmengen in der FK-Zelle, wodurch deren elektrooptische Eigenschaften verbessert werden, und das kontrollierte Abreagieren dieser Restmengen einfacher wird.
-
Polymerisierbare Verbindungen mit einer Abstandsgruppe enthaltend eine C-C-Dreifachbindung wurden im Stand der Technik für andere Zwecke beschrieben. So offenbart
US 6,369,262 mesogene Diacrylatmonomere mit einer C-C-Dreifachbindung in der Abstandsgruppe zur Herstellung von anisotropen hochvernetzten Polymeren mit hohen Glastemperaturen für stereolithographischen Anwendungen insbesondere bei hohen Temperaturen. Die Verwendung solcher Monomere in PSA-Anzeigen zur schnellen Einstellung eines Tiltwinkels durch in situ-Polymerisation im elektrischen Feld wird jedoch weder beschrieben noch vorgeschlagen.
-
Gegenstand der Erfindung ist somit die Verwendung von polymerisierbaren Verbindungen enthaltend eine mesogene Gruppe und eine oder mehrere polymerisierbare Gruppen, wobei mindestens eine dieser polymerisierbaren Gruppen über eine Abstandsgruppe mit der mesogenen Gruppe verbunden ist, und wobei mindestens eine dieser Abstandsgruppen eine C-C-Dreifachbindung enthält (nachfolgend auch als ”erfindungsgemäße polymerisierbare Verbindungen” bezeichnet), in Flüssigkristall-(FK-)medien und FK-Anzeigen des PS- oder PSA-(polymer sustained alignment)Typs.
-
Ein weiterer Gegenstand der Erfindung ist ein FK-Medium enthaltend eine oder mehrere erfindungsgemäße polymerisierbare Verbindungen und eine oder mehrere zusätzliche Verbindungen, welche auch mesogen, flüssigkristallin und/oder polymerisierbar sein können.
-
Ein weiterer Gegenstand der Erfindung ist ein FK-Medium enthaltend ein Polymer erhältlich durch Polymerisation einer oder mehrerer erfindungsgemäßer polymerisierbarer Verbindungen und eine oder mehrere zusätzliche Verbindungen, welche auch mesogen, flüssigkristallin und/oder polymerisierbar sein können.
-
Ein weiterer Gegenstand der Erfindung ist ein FK-Medium enthaltend
- – eine polymerisierbare Komponente A), enthaltend eine oder mehrere erfindungsgemäße polymerisierbare Verbindungen, sowie
- – eine flüssigkristalline Komponente B), im Folgenden auch als ”FK-Hostmischung” bezeichnet, enthaltend eine oder mehrere, vorzugsweise zwei oder mehr niedermolekulare (monomere und unpolymerisierbare) Verbindungen wie vor- und nachstehend beschrieben.
-
Ein weiterer Gegenstand der Erfindung ist ein Verfahren zur Herstellung eines FK-Mediums wie vor- und nachstehend beschrieben, indem man eine oder mehrere niedermolekulare flüssigkristalline Verbindungen, oder eine FK-Hostmischung wie vor- und nachstehend beschrieben, mit einer oder mehreren erfindungsgemäßen polymerisierbaren Verbindungen und gegebenenfalls mit weiteren flüssigkristallinen Verbindungen und/oder Additiven, mischt.
-
Ein weiterer Gegenstand der Erfindung ist die Verwendung von erfindungsgemäßen polymerisierbaren Verbindungen und erfindungsgemäßen FK-Medien in PS- und PSA-Anzeigen, insbesondere die Verwendung in PS- und PSA-Anzeigen enthaltend ein FK-Medium, zur Erzeugung eines Tiltwinkels im FK-Medium durch in situ-Polymerisation der Verbindung(en) der Formel I in der PSA-Anzeige, vorzugsweise unter Anlegen eines elektrischen oder magnetischen Feldes.
-
Ein weiterer Gegenstand der Erfindung ist eine FK-Anzeige enthaltend eine oder mehrere erfindungsgemäße polymerisierbare Verbindungen oder ein erfindungsgemäßes FK-Medium, insbesondere eine PS- oder PSA-Anzeige, besonders bevorzugt eine PSA-VA-, PSA-OCB-, PSA-IPS-, PSA-FFS-, PSA-Posi-VA- oder PSA-TN-Anzeige.
-
Ein weiterer Gegenstand der Erfindung ist eine FK-Anzeige des PS- oder PSA-Typs, enthaltend eine FK-Zelle mit zwei Substraten und zwei Elektroden, wobei mindestens ein Substrat lichtdurchlässig ist und mindestens ein Substrat eine oder zwei Elektroden aufweist, sowie einer zwischen den Substraten befindlichen Schicht eines FK-Mediums enthaltend eine polymerisierte Komponente und eine niedermolekulare Komponente, wobei die polymerisierte Komponente erhältlich ist durch Polymerisation einer oder mehrerer polymerisierbarer Verbindungen zwischen den Substraten der FK-Zelle im FK-Medium, vorzugsweise unter Anlegen einer elektrischen Spannung an die Elektroden, wobei mindestens eine der polymerisierbaren Verbindungen aus erfindungsgemäßen polymerisierbaren Verbindungen ausgewählt ist.
-
Ein weiterer Gegenstand der Erfindung ist ein Verfahren zur Herstellung einer FK-Anzeige wie vor- und nachstehend beschrieben, indem man ein FK-Medium, enthaltend eine oder mehrere niedermolekulare flüssigkristalline Verbindungen oder eine FK-Hostmischung wie vor- und nachstehend beschrieben sowie eine oder mehrere erfindungsgemäße. polymerisierbare Verbindungen, in eine FK-Zelle mit zwei Substraten und zwei Elektroden wie vor- und nachstehend beschrieben füllt, und die polymerisierbaren Verbindungen, vorzugsweise unter Anlegen einer elektrischen Spannung an die Elektroden, polymerisiert.
-
Die erfindungsgemäßen PS- und PSA-Anzeigen weisen zwei Elektroden, vorzugsweise in Form von transparenten Schichten, auf, wobei diese auf einem oder beiden der Substrate aufgebracht sind, die die FK-Zelle bilden. Dabei ist entweder jeweils eine Elektrode auf je einem der beiden Substrate aufgebracht, wie zum Beispiel in erfindungsgemäßen PSA-VA-, PSA-OCB- oder PSA-TN-Anzeigen, oder beide Elektroden sind auf nur einem der beiden Substrate aufgebracht, während das andere Substrat keine Elektrode aufweist, wie zum Beispiel in erfindungsgemäßen PSA-Posi-VA-, PSA-IPS- oder PSA-FFS-Anzeigen.
-
Weiterer Gegenstand der Erfindung sind neue erfindungsgemäße polymerisierbare Verbindungen, Verfahren zu ihrer Herstellung, sowie in diesen Verfahren verwendete oder daraus erhaltene neue Zwischenprodukte.
-
Vor- und nachstehend gelten folgende Bedeutungen:
Die Begriffe ”Tilt” und ”Tiltwinkel” beziehen sich auf eine gekippte oder geneigte Orientierung der FK-Moleküle eines FK-Mediums relativ zu den Oberflächen der Zelle in einer FK-Anzeige (hier vorzugsweise einer PS- oder PSA-Anzeige). Der Tiltwinkel bezeichnet dabei den durchschnittlichen Winkel (< 90°) zwischen den Moleküllängsachsen der FK-Moleküle (FK-Direktor) und der Oberfläche der planparallelen Trägerplatten, welche die FK-Zelle bilden. Ein niedriger Wert des Tiltwinkels (d. h. eine große Abweichung vom 90°-Winkel) entspricht dabei einem großen Tilt. Eine geeignete Methode zur Messung des Tiltwinkels findet sich in den Beispielen. Soweit nicht anders angegeben, beziehen sich vor- und nachstehend offenbarte Werte des Tiltwinkels auf diese Messmethode.
Der Begriff ”mesogene Gruppe” ist dem Fachmann bekannt und in der Literatur beschrieben, und bedeutet eine Gruppe, die durch die Anisotropie ihrer anziehenden und abstoßenden Wechselwirkungen wesentlich dazu beiträgt, in niedermolekularen oder polymeren Substanzen eine Flüssigkristall(FK-)Phase hervorzurufen. Verbindungen enthaltend mesogene Gruppen (mesogene Verbindungen) müssen nicht unbedingt selbst eine FK-Phase aufweisen. Es ist auch möglich, dass mesogene Verbindungen FK-Phasenverhalten nur nach Vermischung mit anderen Verbindungen und/oder nach Polymerisation zeigen. Typische mesogene Gruppen sind beispielsweise starre stäbchen- oder scheibchenförmige Einheiten. Ein Überblick über die im Zusammenhang mit mesogenen bzw. FK-Verbindungen verwendeten Begriffe und Definitionen findet sich in Pure Appl. Chem. 73(5), 888 (2001) und C. Tschierske, G. Pelzl, S. Diele, Angew. Chem. 2004, 116, 6340–6368.
Der Begriff ”Abstandsgruppe” (engl. ”spacer” oder ”spacer group”), vor- und nachstehend auch als ”Sp” bezeichnet, ist dem Fachmann bekannt und in der Literatur beschrieben, siehe beispielsweise Pure Appl. Chem. 73(5), 888 (2001) und C. Tschierske, G. Pelzl, S. Diele, Angew. Chem. 2004, 116, 6340–6368. Falls nicht anders angegeben, bezeichnet der Begriff ”Abstandsgruppe” bzw. ”Spacer” vor- und nachstehend eine flexible Gruppe, die in einer polymerisierbaren mesogenen Verbindung die mesogene Gruppe und die polymerisierbare(n) Gruppe(n) miteinander verbindet.
Der Begriff ”reaktives Mesogen” oder ”RM” bezeichnet eine Verbindung enthaltend eine mesogene Gruppe und eine oder mehrere funktionelle Gruppen, die zur Polymerisation geeignet sind (auch als polymerisierbare Gruppe oder Gruppe P bezeichnet).
Die Begriffe ”niedermolekulare Verbindung” und ”unpolymerisierbare Verbindung” bezeichnen, üblicherweise monomere, Verbindungen, die keine funktionelle Gruppe aufweisen, welche zur Polymerisation unter den üblichen dem Fachmann bekannten Bedingungen, insbesondere unter den zur Polymerisation der RMs verwendeten Bedingungen, geeignet ist.
Der Begriff ”organische Gruppe” bedeutet eine Kohlenstoff- oder Kohlenwasserstoffgruppe.
Der Begriff ”Kohlenstoffgruppe” bedeutet eine ein- oder mehrbindige organische Gruppe enthaltend mindestens ein Kohlenstoffatom, wobei diese entweder keine weiteren Atome enthält (wie z. B. -C≡C-), oder gegebenenfalls ein oder mehrere weitere Atome wie beispielsweise N, O, S, P, Si, Se, As, Te oder Ge enthält (z. B. Carbonyl etc.). Der Begriff ”Kohlenwasserstoffgruppe” bedeutet eine Kohlenstoffgruppe, die zusätzlich ein oder mehrere H-Atome und gegebenenfalls ein oder mehrere Heteroatome wie beispielsweise N, O, S, P, Si, Se, As, Te oder Ge enthält.
”Halogen” bedeutet F, Cl, Br oder I.
”Konjugierter Rest” und ”konjugierte Gruppe” bedeuten einen Rest bzw. eine Gruppe, welche hauptsächlich sp2-hybridisierte (bzw. gegebenenfalls auch sp-hybridisierte) Kohlenstoffatome, die auch durch entsprechende Heteroatome ersetzt sein können, enthalten. Dies bedeutet im einfachsten Fall abwechselndes Vorliegen von Doppel- und Einfachbindungen. ”Hauptsächlich” bedeutet in diesem Zusammenhang, dass natürlich (unwillkürlich) auftretende Defekte, die zu Konjugationsunterbrechungen führen, den Begriff ”konjugiert” nicht entwerten. Des Weiteren wird in diesem Anmeldetext ebenfalls als ”konjugiert” bezeichnet, wenn sich in dem Rest oder der Gruppe beispielsweise Arylamineinheiten oder bestimmte Heterocyclen (d. h. Konjugation über N-, O-, P- oder S-Atome) befinden.
-
Eine Kohlenstoff- oder Kohlenwasserstoffgruppe kann eine gesättigte oder ungesättigte Gruppe sein. Ungesättigte Gruppen sind beispielsweise Aryl-, Alkenyl- oder Alkinylgruppen. Ein Kohlenstoff- oder Kohlenwasserstoffrest mit mehr als 3 C-Atomen kann geradkettig, verzweigt und/oder cyclisch sein, und kann auch Spiroverknüpfungen oder kondensierte Ringe aufweisen.
-
Die Begriffe ”Alkyl”, ”Aryl”, ”Heteroaryl” etc. umfassen auch mehrbindige Gruppen, beispielsweise Alkylen, Arylen, Heteroarylen etc.
-
Der Begriff ”Aryl” bedeutet eine aromatische Kohlenstoffgruppe oder eine davon abgeleitete Gruppe. Der Begriff ”Heteroaryl” bedeutet ”Aryl” gemäß vorstehender Definition, enthaltend ein oder mehrere Heteroatome.
-
Bevorzugte Kohlenstoff- und Kohlenwasserstoffgruppen sind gegebenenfalls substituiertes Alkyl, Alkenyl, Alkinyl, Alkoxy, Alkylcarbonyl, Alkoxycarbonyl, Alkylcarbonyloxy und Alkoxycarbonyloxy mit 1 bis 40, vorzugsweise 1 bis 25, besonders bevorzugt 1 bis 18 C-Atomen, gegebenenfalls substituiertes Aryl oder Aryloxy mit 6 bis 40, vorzugsweise 6 bis 25 C-Atomen, oder gegebenenfalls substituiertes Alkylaryl, Arylalkyl, Alkylaryloxy, Arylalkyloxy, Arylcarbonyl, Aryloxycarbonyl, Arylcarbonyloxy und Aryloxycarbonyloxy mit 6 bis 40, vorzugsweise 6 bis 25 C-Atomen.
-
Weitere bevorzugte Kohlenstoff- und Kohlenwasserstoffgruppen sind C1-C40 Alkyl, C2-C40 Alkenyl, C2-C40 Alkinyl, C3-C40 Allyl, C4-C40 Alkyldienyl, C4-C40 Polyenyl, C6-C40 Aryl, C6-C40 Alkylaryl, C6-C40 Arylalkyl, C6-C40 Alkylaryloxy, C6-C40 Arylalkyloxy, C2-C40 Heteroaryl, C4-C40 Cycloalkyl, C4-C40 Cycloalkenyl, etc. Besonders bevorzugt sind C1-C22 Alkyl, C2-C22 Alkenyl, C2-C22 Alkinyl, C3-C22 Allyl, C4-C22 Alkyldienyl, C6-C12 Aryl, C6-C20 Arylalkyl und C2-C20 Heteroaryl.
-
Weitere bevorzugte Kohlenstoff- und Kohlenwasserstoffgruppen sind geradkettige, verzweigte oder cyclische Alkylreste mit 1 bis 40, vorzugsweise 1 bis 25 C-Atomen, welche unsubstituiert oder durch F, Cl, Br, I oder CN ein- oder mehrfach substituiert sind, und worin ein mehrere nicht benachbarte CH2-Gruppen jeweils unabhängig voneinander durch -C(Rx)=C(Rx)-, -C≡C-, -N(Rx)-, -O-, -S-, -CO-, -CO-O-, -O-CO-, -O-CO-O- so ersetzt sein können, dass O- und/oder S-Atome nicht direkt miteinander verknüpft sind.
-
Rx bedeutet vorzugsweise H, Halogen, eine geradkettige, verzweigte oder cyclische Alkylkette mit 1 bis 25 C-Atomen, in der auch ein oder mehrere nicht benachbarte C-Atome durch -O-, -S-, -CO-, -CO-O-, -O-CO-, -O-CO-O- ersetzt sein können, wobei auch ein oder mehrere H-Atome durch Fluor ersetzt sein können, eine optional substituierte Aryl- oder Aryloxygruppe mit 6 bis 40 C-Atomen, oder eine optional substituierte Heteroaryl- oder Heteroaryloxygruppe mit 2 bis 40 C-Atomen.
-
Bevorzugte Alkoxygruppen sind beispielsweise Methoxy, Ethoxy, 2-Methoxyethoxy, n-Propoxy, i-Propoxy, n-Butoxy, i-Butoxy, s-Butoxy, t-Butoxy, 2-Methylbutoxy, n-Pentoxy, n-Hexoxy, n-Heptoxy, n-Octoxy, n-Nonoxy, n-Decoxy, n-Undecoxy, n-Dodecoxy, etc.
-
Bevorzugte Alkylgruppen sind beispielsweise Methyl, Ethyl, n-Propyl, Isopropyl, n-Butyl, Isobutyl, s-Butyl, t-Butyl, 2-Methylbutyl, n-Pentyl, s-Pentyl, Cyclopentyl, n-Hexyl, Cyclohexyl, 2-Ethylhexyl, n-Heptyl, Cycloheptyl, n-Octyl, Cyclooctyl, n-Nonyl, n-Decyl, n-Undecyl, n-Dodecyl, Dodecanyl, Trifluoromethyl, Perfluoro-n-butyl, 2,2,2-Trifluoroethyl, Perfluorooctyl, Perfluorohexyl etc.
-
Bevorzugte Alkenylgruppen sind beispielsweise Ethenyl, Propenyl, Butenyl, Pentenyl, Cyclopentenyl, Hexenyl, Cyclohexenyl, Heptenyl, Cycloheptenyl, Octenyl, Cyclooctenyl etc.
-
Bevorzugte Alkinylgruppen sind beispielsweise Ethinyl, Propinyl, Butinyl, Pentinyl, Hexinyl, Octinyl etc.
-
Bevorzugte Alkoxygruppen sind beispielsweise Methoxy, Ethoxy, 2-Methoxyethoxy, n-Propoxy, i-Propoxy, n-Butoxy, i-Butoxy, s-Butoxy, t-Butoxy, 2-Methylbutoxy, n-Pentoxy, n-Hexoxy, n-Heptoxy, n-Octoxy, n-Nonoxy, n-Decoxy, n-Undecoxy, n-Dodecoxy, etc.
-
Bevorzugte Aminogruppen sind beispielsweise Dimethylamino, Methylamino, Methylphenylamino, Phenylamino, etc.
-
Aryl- und Heteroarylgruppen können einkernig oder mehrkernig sein, d. h. sie können einen Ring (wie z. B. Phenyl) oder zwei oder mehr Ringe aufweisen, welche auch anelliert (wie z. B. Naphthyl) oder kovalent verknüpft sein können (wie z. B. Biphenyl), oder eine Kombination von anellierten und verknüpften Ringen beinhalten. Heteroarylgruppen enthalten ein oder mehrere Heteroatome, vorzugsweise ausgewählt aus O, N, S und Se.
-
Besonders bevorzugt sind ein-, zwei- oder dreikernige Arylgruppen mit 6 bis 25 C-Atomen sowie ein-, zwei- oder dreikernige Heteroarylgruppen mit 5 bis 25 Ringatomen, welche optional anellierte Ringe enthalten und optional substituiert sind. Ferner bevorzugt sind 5-, 6- oder 7-gliedrige Aryl- und Heteroarylgruppen, worin auch eine oder mehrere CH-Gruppen durch N, S oder O so ersetzt sein können, dass O-Atome und/oder S-Atome nicht direkt miteinander verknüpft sind.
-
Bevorzugte Arylgruppen sind beispielsweise Phenyl, Biphenyl, Terphenyl, [1,1':3',1'']Terphenyl-2'-yl, Naphthyl, Anthracen, Binaphthyl, Phenanthren, Pyren, Dihydropyren, Chrysen, Perylen, Tetracen, Pentacen, Benzpyren, Fluoren, Inden, Indenofluoren, Spirobifluoren, etc.
-
Bevorzugte Heteroarylgruppen sind beispielsweise 5-gliedrige Ringe wie Pyrrol, Pyrazol, Imidazol, 1,2,3-Triazol, 1,2,4-Triazol, Tetrazol, Furan, Thiophen, Selenophen, Oxazol, Isoxazol, 1,2-Thiazol, 1,3-Thiazol, 1,2,3-Oxadiazol, 1,2,4-Oxadiazol, 1,2,5-Oxadiazol, 1,3,4-Oxadiazol, 1,2,3-Thiadiazol, 1,2,4-Thiadiazol, 1,2,5-Thiadiazol, 1,3,4-Thiadiazol, 6-gliedrige Ringe wie Pyridin, Pyridazin, Pyrimidin, Pyrazin, 1,3,5-Triazin, 1,2,4-Triazin, 1,2,3-Triazin, 1,2,4,5-Tetrazin, 1,2,3,4-Tetrazin, 1,2,3,5-Tetrazin, oder kondensierte Gruppen wie Indol, Isoindol, Indolizin, Indazol, Benzimidazol, Benzotriazol, Purin, Naphthimidazol, Phenanthrimidazol, Pyridimidazol, Pyrazinimidazol, Chinoxalinimidazol, Benzoxazol, Naphthoxazol, Anthroxazol, Phenanthroxazol, Isoxazol, Benzothiazol, Benzofuran, Isobenzofuran, Dibenzofuran, Chinolin, Isochinolin, Pteridin, Benzo-5,6-chinolin, Benzo-6,7-chinolin, Benzo-7,8-chinolin, Benzoisochinolin, Acridin, Phenothiazin, Phenoxazin, Benzopyridazin, Benzopyrimidin, Chinoxalin, Phenazin, Naphthyridin, Azacarbazol, Benzocarbolin, Phenanthridin, Phenanthrolin, Thieno[2,3b]thiophen, Thieno[3,2b]thiophen, Dithienothiophen, Isobenzothiophen, Dibenzothiophen, Benzothiadiazothiophen, oder Kombinationen dieser Gruppen.
-
Die vor- und nachstehend genannten Aryl- und Heteroarylgruppen können auch mit Alkyl, Alkoxy, Thioalkyl, Fluor, Fluoralkyl oder weiteren Aryl- oder Heteroarylgruppen substituiert sein.
-
Die (nicht-aromatischen) alicyclischen und heterocyclischen Gruppen umfassen sowohl gesättigte Ringe, d. h. solche die ausschließlich Einfachbindungen enthalten, als auch teilweise ungesättigte Ringe, d. h. solche die auch Mehrfachbindungen enthalten können. Heterocyclische Ringe enthalten ein oder mehrere Heteroatome, vorzugsweise ausgewählt aus Si, O, N, S und Se.
-
Die (nicht-aromatischen) alicyclischen und heterocyclischen Gruppen können einkernig sein, d. h. nur einen Ring enthalten (wie z. B. Cyclohexan), oder mehrkernig sein, d. h. mehrere Ringe enthalten (wie z. B. Decahydronaphthalin oder Bicyclooctan). Besonders bevorzugt sind gesättigte Gruppen. Ferner bevorzugt sind ein-, zwei- oder dreikernige Gruppen mit 5 bis 25 Ringatomen, welche optional anellierte Ringe enthalten und optional substituiert sind. Ferner bevorzugt sind 5-, 6-, 7- oder 8-gliedrige carbocyclische Gruppen worin auch ein oder mehrere C-Atome durch Si ersetzt sein können und/oder eine oder mehrere CH-Gruppen durch N ersetzt sein können und/oder eine oder mehrere nicht-benachbarte CH2-Gruppen durch -O- und/oder -S- ersetzt sein können.
-
Bevorzugte alicyclische und heterocyclische Gruppen sind beispielsweise 5-gliedrige Gruppen wie Cyclopentan, Tetrahydrofuran, Tetrahydrothiofuran, Pyrrolidin, 6-gliedrige Gruppen wie Cyclohexan, Silinan, Cyclohexen, Tetrahydropyran, Tetrahydrothiopyran, 1,3-Dioxan, 1,3-Dithian, Piperidin, 7-gliedrige Gruppen wie Cycloheptan, und anellierte Gruppen wie Tetrahydronaphthalin, Decahydronaphthalin, Indan, Bicyclo[1.1.1]pentan-1,3-diyl, Bicyclo[2.2.2]octan-1,4-diyl, Spiro[3.3]heptan-2,6-diyl, Octahydro-4,7-methano-indan-2,5-diyl.
-
Bevorzugte Substituenten sind beispielsweise löslichkeitsfördernde Gruppen wie Alkyl oder Alkoxy, elektronenziehende Gruppen wie Fluor, Nitro oder Nitril, oder Substituenten zur Erhöhung der Glastemperatur (Tg) im Polymer, insbesondere voluminöse Gruppen wie z. B. t-Butyl oder gegebenenfalls substituierte Arylgruppen.
-
Bevorzugte Substituenten, vor- und nachstehend auch als ”L” bezeichnet, sind beispielsweise F, Cl, Br, I, -CN, -NO2, -NCO, -NCS, -OCN, -SCN, -C(=O)N(Rx)2, -C(=O)Y1, -C(=O)Rx, -N(Rx)2, worin Rx die oben angegebene Bedeutung hat und Y1 Halogen bedeutet, optional substituiertes Silyl oder Aryl mit 6 bis 40, vorzugsweise 6 bis 20 C Atomen, und geradkettiges oder verzweigtes Alkyl, Alkoxy, Alkylcarbonyl, Alkoxycarbonyl, Alkylcarbonyloxy oder Alkoxycarbonyloxy mit 1 bis 25 C-Atomen, worin ein oder mehrere H-Atome gegebenenfalls durch F oder Cl ersetzt sein können.
-
”Substituiertes Silyl oder Aryl” bedeutet vorzugsweise durch Halogen, -CN, R0, -OR0, -CO-R0, -CO-O-R0, -O-CO-R0 oder -O-CO-O-R0 substituiert, worin R0 die oben angegebene Bedeutung hat.
-
Besonders bevorzugte Substituenten L sind beispielsweise F, Cl, CN, NO
2, CH
3, C
2H
5, OCH
3, OC
2H
5, COCH
3, COC
2H
5, COOCH
3, COOC
2H
5, CF
3, OCF
3, OCHF
2, OC
2F
5, ferner Phenyl.
ist vorzugsweise
worin L eine der oben angegebenen Bedeutungen hat.
-
Die polymerisierbare Gruppe P ist eine Gruppe, die für eine Polymerisationsreaktion, wie beispielsweise die radikalische oder ionische Kettenpolymerisation, Polyaddition oder Polykondensation, oder für eine polymeranaloge Umsetzung, beispielsweise die Addition oder Kondensation an eine Polymerhauptkette, geeignet ist. Besonders bevorzugt sind Gruppen für die Kettenpolymerisation, insbesondere solche enthaltend eine C=C-Doppelbindung oder -C≡C-Dreifachbindung, sowie zur Polymerisation unter Ringöffnung geeignete Gruppen wie beispielsweise Oxetan- oder Epoxygruppen
-
Bevorzugte Gruppen P sind ausgewählt aus der Gruppe bestehend aus CH
2=CW
1-CO-O-, CH
2=CW
1-CO-,
CH
2=CW
2-(O)
k3-, CW
1=CH-CO=(O)
k3-, CW
1=CH-CO-NH-, CH
2=CW
1-CO-NH-, CH
3-CH=CH-O-, (CH
2=CH)
2CH-OCO-, (CH
2=CH-CH
2)
2CH-OCO-, (CH
2=CH)
2CH-O-, (CH
2=CH-CH
2)
2N-, (CH
2=CH-CH
2)
2N-CO-, HO-CW
2W
3-, HS-CW
2W
3-, HW
2N-, HO-CW
2W
3-NH-, CH
2=CW
1-CO-NH-, CH
2=CH-(COO)
k1-Phe-(O)
k2-, CH
2=CH-(CO)
k1-Phe-(O)
k2-, Phe-CH=CH-, HOOC-, OCN-, und W
4W
5W
6Si-, worin W
1 H, F, Cl, CN, CF
3, Phenyl oder Alkyl mit 1 bis 5 C-Atomen, insbesondere H, F, Cl oder CH
3 bedeutet, W
2 und W
3 jeweils unabhängig voneinander H oder Alkyl mit 1 bis 5 C-Atomen, insbesondere H, Methyl, Ethyl oder n-Propyl bedeuten, W
4, W
5 und W
6 jeweils unabhängig voneinander Cl, Oxaalkyl oder Oxacarbonylalkyl mit 1 bis 5 C-Atomen bedeuten, W
7 und W
8 jeweils unabhängig voneinander H, Cl oder Alkyl mit 1 bis 5 C-Atomen bedeuten, Phe 1,4-Phenylen bedeutet, welches optional mit einem oder mehreren, von P-Sp- verschiedenen Resten L wie oben definiert substituiert ist, k
1, k
2 und k
3 jeweils unabhängig voneinander 0 oder 1 bedeuten, k
3 vorzugsweise 1 bedeutet, und k
4 eine ganze Zahl von 1 bis 10 bedeutet.
-
Besonders bevorzugte Gruppen P sind ausgewählt aus der Gruppe bestehend aus CH
2=CW
1-CO-O-, CH
2=CW
1-CO-,
CH
2=CW
2-O-, CW
1=CH-CO-(O)
k3-, CW
1=CH-CO-NH-, CH
2=CW
1-CO-NH-, (CH
2=CH)
2CH-OCO-, (CH
2=CH-CH
2)
2CH-OCO-, (CH
2=CH)
2CH-O-, (CH
2=CH-CH
2)
2N-, (CH
2=CH-CH
2)
2N-CO-, CH
2=CW
1-CO-NH-, CH
2=CH-(COO)
k1-Phe-(O)
k2-, CH
2=CH-(CO)
k1-Phe-(O)
k2-, Phe-CH=CH- und W
4W
5W
6Si-, worin W
1 H, F, Cl, CN, CF
3, Phenyl oder Alkyl mit 1 bis 5 C-Atomen, insbesondere H, F, Cl oder CH
3 bedeutet, W
2 und W
3 jeweils unabhängig voneinander H oder Alkyl mit 1 bis 5 C-Atomen, insbesondere H, Methyl, Ethyl oder n-Propyl bedeuten, W
4, W
5 und W
6 jeweils unabhängig voneinander Cl, Oxaalkyl oder Oxacarbonylalkyl mit 1 bis 5 C-Atomen bedeuten, W
7 und W
8 jeweils unabhängig voneinander H, Cl oder Alkyl mit 1 bis 5 C-Atomen bedeuten, Phe 1,4-Phenylen bedeutet, k
1, k
2 und k
3 jeweils unabhängig voneinander 0 oder 1 bedeuten, k
3 vorzugsweise 1 bedeutet, und k
4 eine ganze Zahl von 1 bis 10 bedeutet.
-
Ganz besonders bevorzugte Gruppen P sind sind ausgewählt aus der Gruppe bestehend aus CH
2=CW
1-CO-O-, insbesondere CH
2=CH-CO-O-, CH
2=C(CH
3)-CO-O- und CH
2=CF-CO-O-, ferner CH
2=CH-O-, (CH
2=CH)
2CH-O-CO-, (CH
2=CH)
2CH-O-,
-
Weitere ganz besonders bevorzugte Gruppen P sind sind ausgewählt aus der Gruppe bestehend aus Vinyloxy-, Acrylat-, Methacrylat-, Fluoracrylat-, Chloracrylat-, Oxetan- und Epoxygruppen, und bedeuten besonders bevorzugt eine Acrylat- oder Methacrylatgruppe.
-
Bevorzugte, von einer Einfachbindung verschiedene Abstandsgruppen Sp sind ausgewählt aus der Formel Sp''-X'', so dass der Rest P-Sp- der Formel P-Sp''-X''- entspricht, wobei
Sp'' Alkylen mit 1 bis 20, vorzugsweise 1 bis 12 C-Atomen bedeutet, welches optional durch F, Cl, Br, I oder CN ein- oder mehrfach substituiert ist, und worin auch eine oder mehrere nicht benachbarte CH2-Gruppen jeweils unabhängig voneinander so durch -O-, -S-, -NH-, -N(R0)-, -Si(R00R000)-, -CO-, -CO-O-, -O-CO-, -O-CO-O-, -S-CO-, -CO-S-, -N(R00)-CO-O-, -O-CO-N(R00)-, -N(R00)-CO-N(R00)-, -CH=CH- oder -C≡C- ersetzt sein können, dass O- und/oder S-Atome nicht direkt miteinander verknüpft sind,
X'' -O-, -S-, -CO-, -CO-O-, -O-CO-, -O-CO-O-, -CO-N(R00)-, -N(R00)-CO-, -N(R00)-CO-N(R00)-, -OCH2-, -CH2O-, -SCH2-, -CH2S-, -CF2O-, -OCF2-, -CF2S-, -SCF2-, -CF2CH2-, -CH2CF2-, -CF2CF2-, -CH=N-, -N=CH-, -N=N-, -CH=CR0-, -CY2=CY3-, -C≡C-, -CH=CH-CO-O-, -O-CO-CH=CH- oder eine Einfachbindung bedeutet,
R00 und R000 jeweils unabhängig voneinander H oder Alkyl mit 1 bis 12 C-Atomen bedeuten, und
Y2 und Y3 jeweils unabhängig voneinander H, F, Cl oder CN bedeuten.
-
X' ist vorzugsweise -O-, -S-CO-, -COO-, -OCO-, -O-COO-, -CO-NR0-, -NR0-CO-, -NR0-CO-NR0- oder eine Einfachbindung.
-
Typische Abstandsgruppen Sp'' sind beispielsweise -(CH2)p1-, -(CH2CH2O)q1-CH2CH2-, -CH2CH2-S-CH2CH2-, -CH2CH2-NH-CH2CH2- oder -(SiR00R000-O)p1-, worin p1 eine ganze Zahl von 1 bis 12 ist, q1 eine ganze Zahl von 1 bis 3 ist, und R00 und R000 die oben angegebenen Bedeutungen besitzen.
-
Besonders bevorzugte Gruppen -Sp''-X''- sind -(CH2)p1-, -(CH2)p1-O-, -(CH2)p1-O-CO-, -(CH2)p1-O-CO-O-, worin p1 und q1 die oben angegebene Bedeutung haben.
-
Besonders bevorzugte Gruppen Sp'' sind beispielsweise jeweils geradkettiges Ethylen, Propylen, Butylen, Pentylen, Hexylen, Heptylen, Octylen, Nonylen, Decylen, Undecylen, Dodecylen, Octadecylen, Ethylenoxyethylen, Methylenoxybutylen, Ethylenthioethylen, Ethylen-N-methyl-iminoethylen, 1-Methylalkylen, Ethenylen, Propenylen und Butenylen.
-
In einer weiteren bevorzugten Ausführungsform der Erfindung bedeuten R
a und/oder R
b in Formel I einen Rest mit zwei oder mehreren polymerisierbaren Gruppen (multifunktionelle polymerisierbare Reste). Geeignete Reste dieses Typs, sowie diese enthaltende polymerisierbare Verbindungen und ihre Herstellung sind beispielsweise in
US 7,060,200 B1 oder
US 2006/0172090 A1 beschrieben. Besonders bevorzugt sind multifunktionelle polymerisierbare Reste ausgewählt aus folgenden Formeln
-X-alkyl-CHP1-CH2-CH2P2 I*a -X-alkyl-C(CH2P1)(CH2P2)-CH2P3 I*b -X-alkyl-CHP1CHP2-CH2P3 I*c -X-alkyl-C(CH2P1)(CH2P2)-CaaH2aa+1 I*d -X-alkyl-CHP1-CH2P2 I*e -X-alkyl-CHP1P2 I*f -X-alkyl-CP1P2-CaaH2aa+1 I*g -X-alkyl-C(CH2P1)(CH2P2)-CH2OCH2-C(CH2P3)(CH2P4)CH2P5 I*h -X-alkyl-CH((CH2)aaP1)((OH2)bbP2) I*i -X-alkyl-CHP1CHP2-CaaH2aa+1 I*k -X'-alkyl-C(CH3)(CH2P1)(CH2P2) I*m worin
alkyl eine Einfachbindung oder geradkettiges oder verzweigtes Alkylen mit 1 bis 12 C-Atomen bedeutet, worin eine oder mehrere nicht benachbarte CH
2-Gruppen jeweils unabhängig voneinander durch -C(R
00)=C(R
000)- -C≡C-, -N(R
00)-, -O-, -S-, -CO-, -CO-O-, -O-CO-, -O-CO-O- so ersetzt sein können, dass O- und/oder S-Atome nicht direkt miteinander verknüpft sind, und worin auch ein oder mehrere H-Atome durch F, Cl oder CN ersetzt sein können, wobei R
00 und R
000 die oben angegebene Bedeutung haben,
aa und bb jeweils unabhängig voneinander 0, 1, 2, 3, 4, 5 oder 6 bedeuten,
X eine der für X' angegebenen Bedeutungen besitzt, und
P
1-5 jeweils unabhängig voneinander eine der für P angegebenen Bedeutungen besitzen.
-
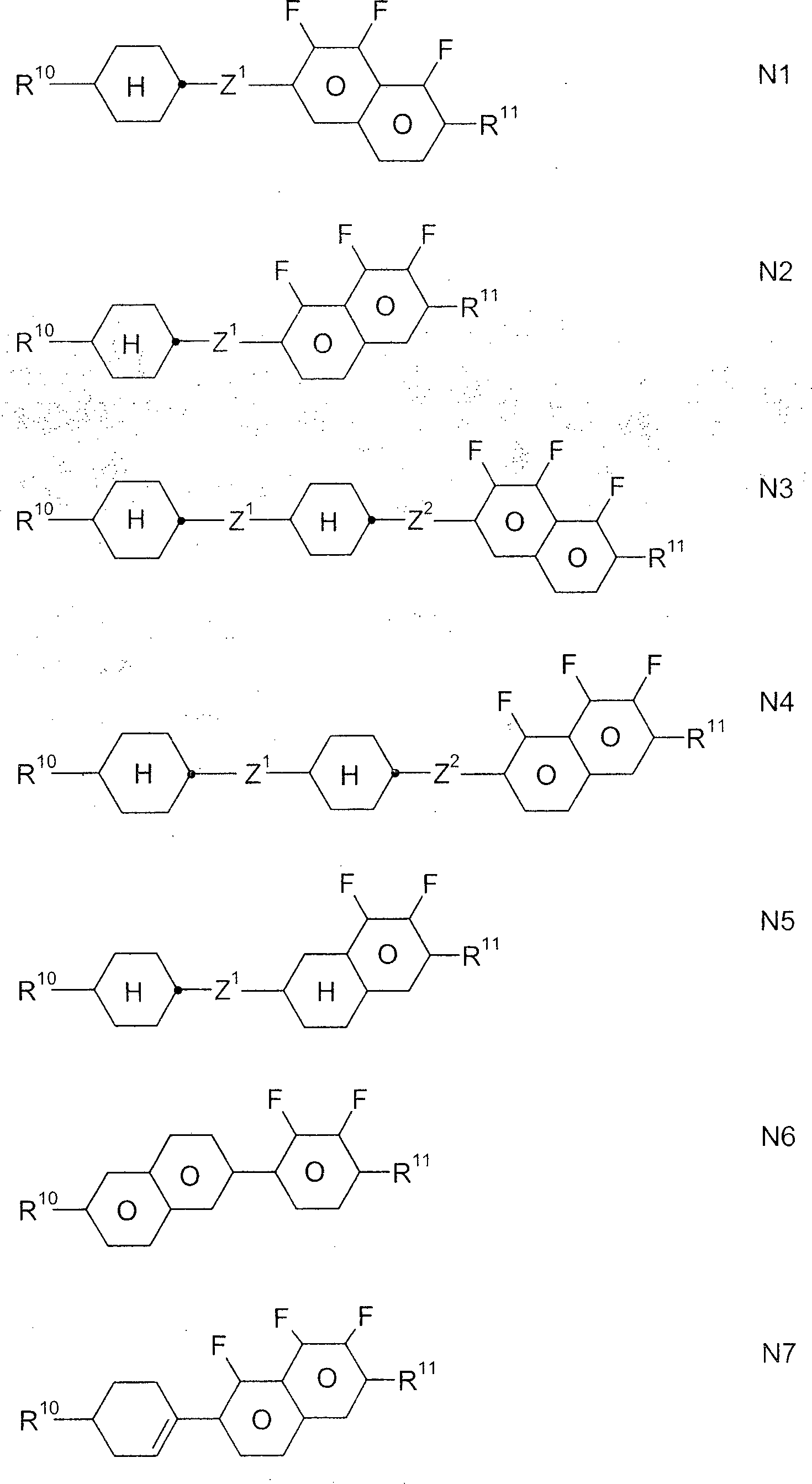
Besonders bevorzugte erfindungsgemäße polymerisierbare Verbindungen sind solche der Formel I: Ra-(C≡C)p-(A1-Z1)m-A2-(C≡C)q-Rb I worin die einzelnen Reste folgende Bedeutung besitzen
Ra, Rb jeweils unabhängig voneinander P-Sp-, H, F, Cl, Br, I, -CN, -NO2, -NCO, -NCS, -OCN, -SCN, SF5, geradkettiges oder verzweigtes Alkyl mit 1 bis 25 C-Atomen, worin auch eine oder mehrere nicht benachbarte CH2-Gruppen jeweils unabhängig voneinander durch Arylen, -C(R0)=C(R00)-, -C≡C-, -N(R0)-, -O-, -S-, -CO-, -CO-O-, -O-CO-, -O-CO-O- so ersetzt sein können, dass O- und/oder S-Atome nicht direkt miteinander verknüpft sind, und worin auch ein oder mehrere H-Atome durch F, Cl, Br, I, CN oder P-Sp- ersetzt sein können, oder Aryl oder Heteroaryl, vorzugsweise mit 2 bis 25 C-Atomen, welches auch zwei oder mehr anellierte Ringe enthalten kann und welches optional durch L ein- oder mehrfach substituiert ist, wobei mindestens einer der Reste Ra und Rb eine Gruppe P-Sp- bedeutet oder enthält,
P bei jedem Auftreten gleich oder verschieden eine polymerisierbare Gruppe,
Sp bei jedem Auftreten gleich oder verschieden eine Abstandsgruppe oder eine Einfachbindung,
A1, A2 jeweils unabhängig voneinander eine aromatische, heteroaromatische, alicyclische oder heterocyclische Gruppe, vorzugsweise mit 4 bis 25 C-Atomen, welche auch anellierte Ringe enthalten kann, und welche optional durch L ein- oder mehrfach substituiert ist,
L bei jedem Auftreten gleich oder verschieden P-Sp-, H, OH, CH2OH, Halogen, SF5, NO2, eine Kohlenstoffgruppe oder Kohlenwasserstoffgruppe,
Z1 jeweils unabhängig voneinander -O-, -S-, -CO-, -CO-O-, -OCO-, -O-CO-O-, -OCH2-, -CH2O-, -SCH2-, -CH2S-, -CF2O-, -OCF2-, -CF2S-, -SCF2-, -(CH2)n-, -CF2CH2-, -CH2CF2-, -(CF2)n-, -CH=CH-, -CF=CF-, -CH=CF-, -CF=CH-, -C≡C-, -CH=CH-COO-, -OCO-CH=CH-, -CH2-CH2-COO-, -OCO-CH2-CH2-, -C(R0R00)-, -O(RyRz), oder eine Einfachbindung,
R0, R00 jeweils unabhängig voneinander und bei jedem Auftreten gleich oder verschieden H oder Alkyl mit 1 bis 12 C-Atomen,
Ry, Rz jeweils unabhängig voneinander H, F, CH3 oder CF3,
m 0, 1, 2, 3 oder 4,
n bei jedem Auftreten gleich oder verschieden 1, 2, 3 oder 4,
p, q jeweils unabhängig voneinander 0 oder 1, wobei p + q ≥ 1.
-
Besonders bevorzugte Verbindungen der Formel I sind solche, worin
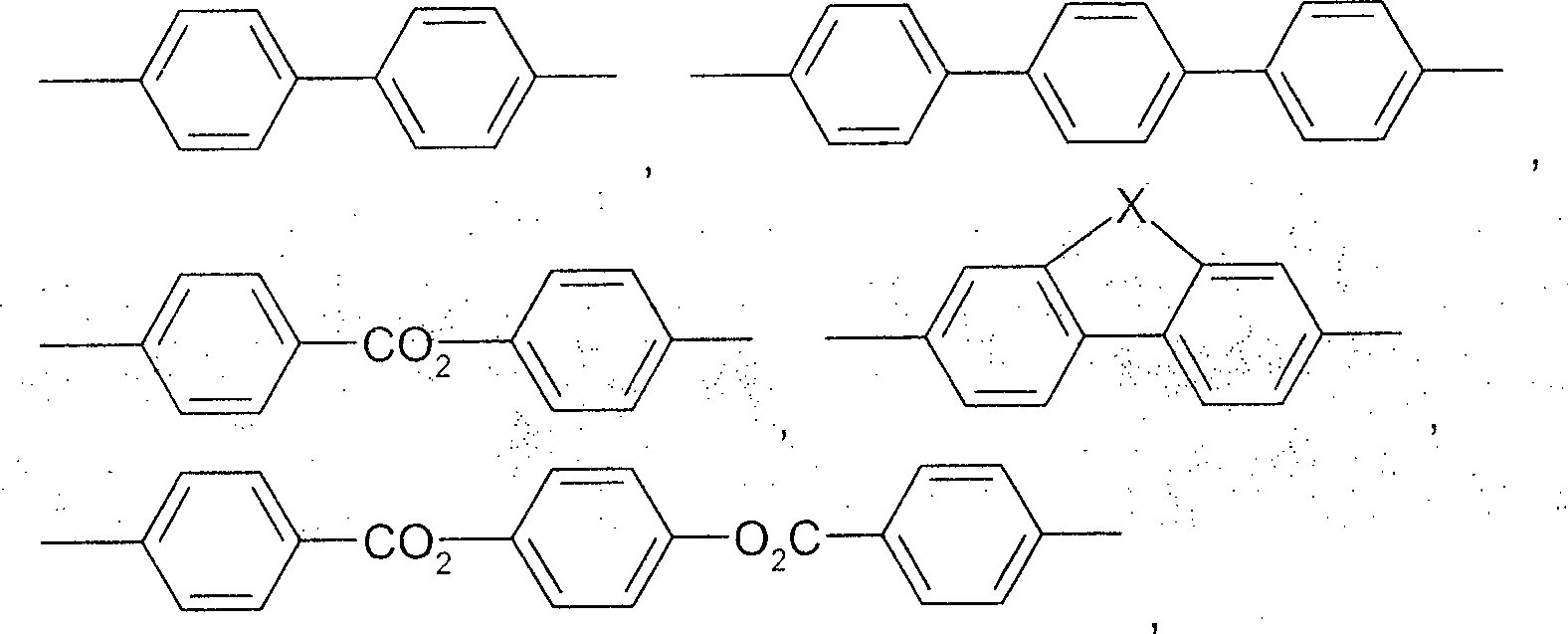
A1 und A2 jeweils unabhängig voneinander 1,4-Phenylen, Naphthalin-1,4-diyl oder Naphthalin-2,6-diyl, wobei in diesen Gruppen auch eine oder mehrere CH-Gruppen durch N ersetzt sein können, Cyclohexan-1,4-diyl, worin auch eine oder mehrere nicht-benachbarte CH2-Gruppen durch O und/oder S ersetzt sein können, 1,4-Cyclohexenylen, Bicyclo[1.1.1]pentan-1,3-diyl, Bicyclo[2.2.2]octan-1,4-diyl, Spiro[3.3]heptan-2,6-diyl, Piperidin-1,4-diyl, Decahydronaphthalin-2,6-diyl, 1,2,3,4-Tetrahydronaphthalin-2,6-diyl, Indan-2,5-diyl, Octahydro-4,7-methano-indan-2,5-diyl, Phenanthren-2,7-diyl, Anthracen-2,7-diyl, Phenanthren-2,7-diyl, 9,10-Dihydrophenanthren-2,7-diyl, 6H-Benzo[c]chromen-3,8-diyl, 9H-Fluoren,2,7-diyl, 9,9-Dimethyl-9H-Fluoren,2,7-diyl, Dibenzofuran-3,7-diyl, 2-Oxo-2H-chromen-7-yl, 4-Phenyl-2-oxo-2H-chromen-7-yl, 4-Oxo-4H-chromen-6-yl, 4-Phenyl-4-oxo-4H-chromen-6-yl, wobei alle diese Gruppen unsubstituiert oder durch L ein- oder mehrfach substituiert sein können, und wobei von allen diesen Gruppen Cyclohexan und aromatische Gruppen ganz besonders bevorzugt sind,
L P, P-Sp-, OH, CH2OH, F, Cl, Br, I, -CN, -NO2, -NCO, -NCS, -OCN, -SCN, -C(=O)N(Rx)2, -C(=O)Y1, -C(=O)Rx, -N(Rx)2, optional substituiertes Silyl, optional substituiertes Aryl mit 6 bis 20 C Atomen, geradkettiges oder verzweigtes Alkyl oder Alkoxy 1 bis 25, vorzugsweise 1 bis 12, C-Atomen, oder geradkettiges oder verzweigtes Alkenyl, Alkinyl, Alkylcarbonyl, Alkoxycarbonyl, Alkylcarbonyloxy oder Alkoxycarbonyloxy mit 2 bis 25, vorzugsweise 2 bis 12, C-Atomen, worin in allen diesen Gruppen auch ein oder mehrere H-Atome durch F, Cl, P oder P-Sp- ersetzt sein können,
Y1 Halogen, und
Rx P, P-Sp-, H, Halogen, geradkettiges, verzweigtes oder cyclisches Alkyl mit 1 bis 25, vorzugsweise 1 bis 12 C-Atomen, worin auch eine oder mehrere nicht benachbarte CH2-Gruppen durch -O-, -S-, -CO-, -CO-O-, -O-CO-, -O-CO-O- so ersetzt sein können, dass O- und/oder S-Atome nicht direkt miteinander verknüpft sind, und worin auch ein oder mehrere H-Atome durch F, Cl oder P-Sp- ersetzt sein können,
bedeuten.
-
In den Verbindungen der Formel I und deren Unterformeln bedeuten die mesogene Gruppe -(A1-Z1)m-A2- sowie -(C≡C)p-(A1-Z1)m-A2-(C≡C)q- vorzugsweise einen konjugierten Rest. Es hat sich gezeigt, dass erfindungsgemäße polymerisierbare Verbindungen enthaltend konjugierte mesogene Reste besonders hohe Absorption im Wellenlängenbereich der für die Polymerisation üblicherweise verwendeten UV-Strahlung aufweisen, und eine schnelle und vollständige Polymerisation ermöglichen, insbesondere auch ohne die Verwendung von Photoinitiatoren. Sie sind deshalb für die Verwendung in PSA-Anzeigen besonders gut geeignet.
-
Weitere bevorzugte Verbindungen der Formel I sowie deren vor- und nachstehend angegebenen Unterformeln sind solche worin
- – einer der Reste Ra und Rb P-Sp- bedeutet und der andere von P-Sp- verschieden ist,
- – Ra und Rb gleiche oder verschiedene Reste P-Sp- bedeuten,
- – Ra und Rb P-Sp- bedeuten, wobei in einem der Reste Ra und Rb Sp eine Einfachbindung bedeutet und in dem anderen der Reste Ra und Rb Sp von einer Einfachbindung verschieden ist und vorzugsweise eine Gruppe der Formel Sp''-X''- bedeutet, so dass dieser Rest P-Sp- der Formel P-Sp''-X''- entspricht,
- – Ra und Rb gleiche oder verschiedene Reste P-Sp- bedeuten, worin beide Reste Sp eine Einfachbindung bedeuten,
- – einer der Reste Ra und Rb eine Gruppe P-Sp- bedeutet oder enthält, und der andere eine unpolymerisierbare Gruppe bedeutet, vorzugsweise ausgewählt aus geradkettigem oder verzweigtem Alkyl mit 1 bis 25 C-Atomen, worin auch eine oder mehrere nicht benachbarte CH2-Gruppen jeweils unabhängig voneinander durch C(R00)=C(R000)-, -C≡C-, -N(R00)-, -O-, -S-, -CO-, -CO-O-, -O-CO-, -O-CO-O- so ersetzt sein können, dass O- und/oder S-Atome nicht direkt miteinander verknüpft sind, und worin auch ein oder mehrere H-Atome durch F, Cl, Br, I oder CN ersetzt sein können,
- – Ra und Rb von H verschieden sind,
- – einer der Reste Ra und Rb P-Sp- bedeutet und der andere von H verschieden ist,
- – der von P-Sp- verschiedenene Rest Ra oder Rb Alkyl mit 1 bis 12, vorzugsweise 5 bis 12 C-Atomen, Alkoxy mit 1 bis 12 C-Atomen oder Alkenyl mit 2 bis 11 C-Atomen bedeuten, wobei in allen diesen Resten auch ein oder mehrere H-Atome durch F ersetzt sein können,
- – Ra oder Rb geradkettiges oder verzweigtes Alkyl mit 1 bis 25, vorzugsweise 1 bis 12, C-Atomen, worin auch eine oder mehrere nicht benachbarte CH2-Gruppen jeweils unabhängig voneinander durch -C(R00)=C(R000)-, -C≡C-, -N(R00)-, -O-, -S-, -CO-, -CO-O-, -O-CO-, -O-CO-O- so ersetzt sein können, dass O- und/oder S-Atome nicht direkt miteinander verknüpft sind, und worin auch ein oder mehrere H-Atome durch F, Cl, Br, I oder CN ersetzt sein können, bedeutet,
- – Sp eine Einfachbindung bedeutet,
- – Sp -(CH2)p1-, -(CH2)p1-O-, -(CH2)p1-O-CO-, -(CH2)p1-O-CO-O-, vorzugsweise -(CH2)p1- oder -(CH2)p1-O- bedeutet, worin p1 eine ganze Zahl von 1 bis 12, vorzugsweise von 1 bis 5, besonders bevorzugt von 1 bis 3 bedeutet,
- – Sp oder Sp'' ein Rest mit 1 bis 5, vorzugsweise 1 bis 3 C-Atomen ist,
- – A1 und A2 ausgewählt sind aus der Gruppe bestehend aus Phenylen-1,4-diyl, Naphthalin-2,6-diyl, Phenanthren-2,7-diyl, Anthracen-2,7-diyl, 9,10-Dihydrophenanthren-2,7-diyl, 6H-Benzo[c]chromen-3,8-diyl, welches optional in 6-Position durch Ra mono- oder disubstituiert ist, 9H-Fluoren,2,7-diyl welches optional in 9-Position durch Ra mono- oder disubstituiert ist, Dibenzofuran-3,7-diyl, welches optional in 6-Position durch Ra mono- oder disubstituiert ist, wobei in allen vorstehend beschriebenen Ringen bzw. Ringsystemen auch eine oder zwei CH-Gruppen durch N ersetzt sein können, und wobei die einzelnen Ringe ein- oder mehrfach durch L wie vor- und nachstehend beschrieben substituiert sein können, wobei Ra vorzugsweise eine der vor- und nachstehend angebenenen bevorzugten Bedeutungen hat,
- – L keine polymerisierbare Gruppe bedeutet oder enthält,
- – L eine unpolymerisierbare Gruppe ist, vorzugsweise ausgewählt aus F, Cl, -CN und geradkettigem oder verzweigtem Alkyl mit 1 bis 25, besonders bevorzugt 1 bis 10 C-Atomen, worin auch eine oder mehrere nicht benachbarte CH2-Gruppen jeweils unabhängig voneinander durch -C(R00)=C(R000)- -C≡C-, -N(R00)-, -O-, -S-, -CO-, -CO-O-, -O-CO-, -O-CO-O- so ersetzt sein können, dass O- und/oder S-Atome nicht direkt miteinander verknüpft sind, und worin auch ein oder mehrere H-Atome durch F, Cl, Br, I oder CN ersetzt sein können,
- – L F, Cl, Br, I, -CN, -NO2, -NCO, -NCS, -OCN oder -SCN, vorzugsweise F, bedeutet,
- – L geradkettiges oder verzweigtes Alkyl oder Alkoxy mit 1 bis 12 C-Atomen, oder geradkettiges oder verzweigtes Alkenyl, Alkinyl, Alkylcarbonyl, Alkoxycarbonyl, Alkylcarbonyloxy oder Alkoxycarbonyloxy mit 2 bis 12 C-Atomen, worin in allen diesen Gruppen auch ein oder mehrere H-Atome durch F, Cl, P oder P-Sp- ersetzt sein können, bedeutet,
- – L P- oder P-Sp bedeutet,
- – Z1 ausgewählt ist aus der Gruppe bestehend aus -O-, -CO-O-, -OCO-, -OCH2-, -CH2O-, -CF2O-, -OCF2-, -CH2CH2-, -CH=CH-, -CF=CF-, -CH=CF-, -CF=CH-, -C≡C-, Einfachbindung,
- – Z1 eine Einfachbindung bedeutet,
- – m 0, 1 oder 2, vorzusgweise 0 oder 1, bedeutet,
- – p und q 1 bedeuten,
- – einer von p und q 0 und der andere 1 bedeutet.
-
Besonders bevorzugte Verbindungen der Formel I sind ausgewählt aus der Gruppe bestehend aus den folgenden Unterformeln
worin P, Sp und L eine der vor- und nachstehend angegebenen Bedeutungen haben, die Reste R jeweils unabhängig voneinander eine der für R
a vor- und nachstehend angegebenen Bedeutungen haben, P' eine der für P und Sp' eine der für Sp vor- und nachstehend angegebenen Bedeutungen haben, r 0, 1, 2, 3 oder 4, s 0, 1, 2 oder 3 und t 0, 1 oder 2 bedeuten.
-
Besonders bevorzugt sind solche Verbindungen der Formeln I1 bis I11, worin einer der Reste Sp und Sp' eine Einfachbindung bedeutet und der andere von einer Einfachbindung verschieden ist.
-
Ganz besonders bevorzugte Verbindungen der Formel I sind ausgewählt aus der Gruppe bestehend aus den folgenden Unterformeln
worin P, P', Sp, R, L und r die oben angegebenen Bedeutungen haben.
-
P und P' bedeuten in den Verbindungen der Formel I sowie deren Unterformeln vorzugsweise eine Acrylat-, Fluoracrylat- oder Methacrylatgruppe.
-
Sp und Sp' bedeuten Verbindungen der Formeln I sowie deren Unterformeln vorzugsweise -(CH2)p1-, -O-(CH2)p1-, -(CH2)p1-O-, -O-CO-(CH2)p1-, -(CH2)p1-O-CO-, -O-CO-O-(CH2)p1-, -(CH2)p1-O-CO-O- oder eine Einfachbindung, worin p1 eine ganze Zahl von 1 bis 12, vorzugsweise von 1 bis 6, ganz besonders bevorzugt 1, 2 oder 3 bedeutet, wobei diese Gruppen so mit P oder P' verknüpft sind, dass O-Atome nicht direkt miteinander verknüpft sind.
-
Ein weiterer Gegenstand der Erfindung sind neue Verbindungen der Formeln I sowie deren Unterformeln, worin die einzelnen Reste die vor- und nachstehend angegebenen Bedeutungen oder bevorzugten Bedeutungen haben, mit der Massgabe, dass im Falle p = q = 1 und R
a = R
b = P-Sp-, insbesondere falls P eine Acrylat-, Glycidyl- oder Epoxygruppe ist und Sp Alkyloxy oder Oxaalkyl mit 1 bis 20 C-Atomen oder eine Einfachbindung bedeutet, -(A
1-Z
1)
m-A
2- einen von folgenden Gruppen verschiedenen Rest bedeutet
worin X CH
2, NH, O, S oder SO
2 bedeutet.
-
Besonders bevorzugt sind neue Verbindungen der Formel I sowie deren Unterformeln, worin Z1 eine Einfachbindung bedeutet, insbesondere solche worin m 0 oder 1 ist, und solche worin, vorzugsweise im Falle p = q = 1, der Rest -(A1-Z1)m-A2- von Biphenyl, Terphenyl, Fluoren (vorzugsweise einschließlich substituiertem Fluoren) und Dibenzofuran verschieden ist.
-
Ein weiterer Gegenstand der Erfindung sind neue Zwischenprodukte zur Herstellung von Verbindungen der Formel I, ausgewählt aus Formel II G-O-Sp-(C≡C)p-(A1-Z1)m-A2-(C≡C)q-Sp'-O-G' II worin A1,2, Z1, Sp, Sp', p, q und m die in Formel I oder vor- und nachstehend angegebene Bedeutung besitzen, und G und G' jeweils unabhängig voneinander ein H-Atom oder eine Schutzgruppe bedeuten.
-
Geeignete Schutzgruppen G sind dem Fachmann bekannt. Bevorzugte Schutzgruppen sind Alkyl, Acyl und Alkylsilyl- oder Arylsilylgruppen, 2-Tetrahydropyranyl oder Methoxymethyl.
-
Besonders bevorzugte Zwischenprodukte der Formel II sind ausgewählt aus der Gruppe bestehend aus den oben genannten Unterformeln I1–I15 und I1a–I15a, worin P jeweils G-O und P' jeweils O-G' bedeutet, wobei G und G' vorzugsweise H bedeuten.
-
Vorzugsweise bedeutet in diesen bevorzugten Zwischenprodukten in einer der Reste Sp und Sp', vorzugsweise Sp, eine Einfachbindung und der andere, vorzugsweise Sp', eine von einer Einfachbindung verschiedene Gruppe.
-
Unter diesen bevorzugten Verbindungen sind solche besonders bevorzugt, worin einer der Reste Sp und Sp', vorzugsweise Sp, eine Einfachbindung und der andere, vorzugsweise Sp', -(CH2)p1- bedeuten, wobei p1 wie oben definiert ist.
-
In einer weiteren bevorzugten Ausführungsform der Erfindung enthalten die erfindungsgemäßen polymerisierbaren Verbindungen keine Gruppe der Formel III, bzw. A
1 und A
2 in Formel I und II bedeuten eine von der Formel III verschiedene Gruppe:
worin W -C(R
cR
d)-, -CH
2CH
2-, -CH
2-O-, -O-, -CO-, -CO-O-, -S- oder -N(R
c)- bedeutet, und R
c und R
d jeweils unabhängig voneinander eine der für R
a in Formel I angegebenen, von P-Sp verschiedenen Bedeutungen besitzen oder P-Sp- bedeuten.
-
Besonders geeignete und bevorzugte Verfahren zur Herstellung von Verbindungen und Zwischenprodukten der Formeln I und II sowie deren Unterformeln sind in folgenden Schemata beispielhaft dargestellt und enthalten vorzugsweise einen oder mehrere der nachfolgend beschriebenen Schritte.
-
Die Verbindungen und Zwischenprodukte der Formel I und II sowie deren Unterformeln können in Analogie zu dem Fachmann bekannten und in Standardwerken der organischen Chemie beschriebenen Verfahren, wie beispielsweise in Houben-Weyl, Methoden der organischen Chemie, Thieme-Verlag, Stuttgart, hergestellt werden.
-
Beispielsweise erfolgt die Synthese von Verbindungen der Formel I durch Veresterung oder Veretherung der Zwischenprodukte der Formel II mit entsprechenden Säuren, Säurederivaten, oder halogenierten Verbindungen enthaltend eine Gruppe P. Wie in Schema 1 beispielhaft dargestellt (worin R H oder CH
3 bedeutet), können Verbindungen der Formel I, worin R
a und R
b R-Sp- und die Reste P eine Acrylat- oder Methacrylatgruppe bedeuten, durch Veresterung der entsprechenden Alkohole der Formel II, worin G = G' = H mit Säurederivaten wie zum Beispiel (Meth)acrylsäurechlorid oder (Meth)acrylsäureanhydrid in Gegenwart einer Base und ggf. 4-(N,N-Dimethylamino)pyridin (DMAP) erhalten werden. Weiterhin können die Alkohole auch mit (Meth)acrylsäure in Gegenwart eines wasserentziehenden Mittels verestert werden, beispielsweise nach Steglich mit Dicyclohexylcarbodiimid (DCC). Schema 1
-
Die Einführung der Alkingruppen kann beispielsweise durch Sonogashira-Reaktion, wie sie z. B. in
E. Negishi, L. Anastasia, Chem. Rev. 2003, 103, 1979 beschrieben ist, erfolgen (Schema 2). Dabei können die Verbindungen II erhalten werden, indem geeignete Arylhalogenide mit terminalen Alkinolen wie in Schema 2 gezeigt umgesetzt werden (X = Halogen, Triflat). Entsprechendes gilt für den symmetrisch substituierten Fall (Schema 3). Schema 2
Schema 3
-
Dialkine mit unterschiedlichen Spacergruppen lassen sich in ähnlicher Weise erhalten, indem man dihalogenierte Bausteine mit verschiedenen Halogensubstituenten unterschiedlicher Reaktivität verwendet, z. B. X gleich Brom und X' gleich Iod (Schema 3), wodurch sich zwei verschiedene Alkine schrittweise einführen lassen. Alternativ kann man von monohalogenierten Hydroxyverbindungen ausgehen, die nach Umsetzung zu Alkinen anschließend zu Triflaten abgewandelt werden können, welche ihrerseits in einer Sonogashira-Reaktion umsetzbar sind (Schema 4). Schema 4
-
Zur Herstellung von PSA-Anzeigen werden die polymerisierbaren Verbindungen im FK-Medium zwischen den Substraten der FK-Anzeige unter Anlegen einer Spannung durch in-situ-Polymerisation polymerisiert oder vernetzt (falls eine Verbindung zwei oder mehr polymerisierbare Gruppen enthält). Die Polymerisation kann in einem Schritt durchgeführt werden. Es ist auch möglich, zunächst in einem ersten Schritt die Polymerisation unter Anlegen einer Spannung durchzuführen, um einen pretilt-Winkel zu erzeugen, und anschließend in einem zweiten Polymerisationsschritt ohne anliegende Spannung die im ersten Schritt nicht abreagierten Verbindungen zu polymerisieren bzw. zu vernetzen (”end curing”).
-
Geeignete und bevorzugte Polymerisationsmethoden sind beispielsweise die thermische oder Photopolymerisation, vorzugsweise Photopolymerisation, insbesondere UV-Photopolymerisation. Dabei können gegebenfalls auch ein oder mehrere Initiatoren zugesetzt werden. Geeignete Bedingungen für die Polymerisation, sowie geeignete Arten und Mengen der Initiatoren, sind dem Fachmann bekannt und in der Literatur beschrieben. Für die radikalische Polymerisation eignen sich zum Beispiel die kommerziell erhältlichen Photoinitiatoren Irgacure651®, Irgacure184®, Irgacure907®, Irgacure369®, oder Darocure1173® (Ciba AG). Falls ein Initiator eingesetzt wird, beträgt dessen Anteil vorzugsweise 0,001 bis 5 Gew.-%, besonders bevorzugt 0,001 bis 1 Gew.-%.
-
Die erfindungsgemäßen polymerisierbaren Verbindungen eignen sich auch für die Polymerisation ohne Initiator, was erhebliche Vorteile mit sich bringt, wie beispielsweise geringere Materialkosten und insbesondere eine geringere Verunreinigung des FK-Mediums durch mögliche Restmengen des Initiators oder dessen Abbauprodukte. Die Polymerisation kann somit auch ohne Zusatz eines Initiators erfolgen. Somit enthält das FK-Medium in einer bevorzugten Ausführungsform keinen Polymerisationsinitiator.
-
Die polymerisierbare Komponente A) oder das FK-Medium können auch einen oder mehrere Stabilisatoren enthalten, um eine unerwünschte spontane Polymerisation der RMs, beispielsweise während der Lagerung oder des Transports, zu verhindern. Geeignete Arten und Mengen der Stabilisatoren sind dem Fachmann bekannt und in der Literatur beschrieben. Besonders geeignet sind zum Beispiel die kommerziell erhältlichen Stabilisatoren der Serie Irganox® (Ciba AG), wie beispielsweise Irganox® 1076. Falls Stabilisatoren eingesetzt werden, beträgt deren Anteil, bezogen auf die Gesamtmenge der RMs beziehungsweise der polymerisierbaren Komponente A), vorzugsweise 10–10,000 ppm, besonders bevorzugt 50–500 ppm.
-
Die erfindungsgemäßen FK-Medien zur Verwendung in PSA-Anzeigen enthalten vorzugsweise < 5 Gew.-%, besonders bevorzugt < 1 Gew.-%, ganz besonders bevorzugt < 0.5 Gew.-% an polymerisierbaren Verbindungen, insbesondere polymerisierbaren Verbindungen der oben genannten Formeln.
-
Besonders bevorzugt sind FK-Medien enthaltend eine, zwei oder drei erfindungsgemäße polymerisierbare Verbindungen.
-
Ferner bevorzugt sind FK-Medien, worin die polymerisierbare Komponente (Komponente A) ausschließlich erfindungsgemäße polymerisierbare Verbindungen enthält.
-
Ferner bevorzugt sind FK-Medien, worin Komponente B) eine FK-Verbindung oder eine FK-Mischung ist, die eine nematische Flüssigkristallphase aufweist.
-
Ferner bevorzugt sind achirale erfindungsgemäße polymerisierbare Verbindungen, sowie FK-Medien worin die Verbindungen der Komponente A) und/oder B) ausschließlich aus der Gruppe bestehend aus achiralen Verbindungen ausgewählt sind.
-
Ferner bevorzugt sind FK-Medien, worin die polymerisierbare Komponente bzw. Komponente A) eine oder mehrere erfindungsgemäße polymerisierbare Verbindungen mit einer polymerisierbaren Gruppe (monoreaktiv) und eine oder mehrere erfindungsgemäße polymerisierbare Verbindungen mit zwei oder mehr, vorzugsweise zwei polymerisierbaren Gruppen (di- oder multireaktiv) enthält.
-
Ferner bevorzugt sind PSA-Anzeigen und FK-Medien, worin die polymerisierbare Komponente bzw. Komponente A) ausschließlich erfindungsgemäße polymerisierbare Verbindungen mit zwei polymerisierbaren Gruppen (direaktiv) enthält.
-
Der Anteil der polymerisierbaren Komponente bzw. Komponente A) in den erfindungsgemäßen FK-Medien ist vorzugsweise < 5%, besonders bevorzugt < 1%, ganz besonders bevorzugt < 0.5%.
-
Der Anteil der flüssigkristallinen Komponente bzw. Komponente B) in den erfindungsgemäßen FK-Medien ist vorzugsweise > 95%, besonders bevorzugt > 99%.
-
Die erfindungsgemäßen polymerisierbaren Verbindungen können einzeln polymerisiert werden, es können aber auch Mischungen polymerisiert werden, welche zwei oder mehr erfindungsgemäße polymerisierbare Verbindungen enthalten, oder Mischungen enthaltend eine oder mehrere erfindungsgemäße polymerisierbare Verbindungen und eine oder mehrere weitere polymerisierbare Verbindungen (Comonomere), welche vorzugsweise mesogen oder flüssigkristallin sind. Bei Polymerisation solcher Mischungen entstehen Copolymere. Die vor- und nachstehend genannten polymerisierbaren Mischungen sind ein weiterer Gegenstand der Erfindung. Die polymerisierbaren Verbindungen und Comonomere sind mesogen oder nicht-mesogen, vorzugsweise mesogen oder flüssigkristallin.
-
Geeignete und bevorzugte mesogene Comonomere, besonders für die Verwendung in PSA-Anzeigen, sind beispielsweise ausgewählt aus den folgenden Formeln:
worin die einzelnen Reste folgende Bedeutung besitzen:
P
1 und P
2 jeweils unabhängig voneinander eine polymerisierbare Gruppe, vorzugsweise mit einer der vor- und nachstehend für P angegebenen Bedeutungen, besonders bevorzugt eine Acrylat-, Methacrylat-, Fluoracrylat-, Oxetan-, Vinyloxy- oder Epoxygruppe,
Sp
1 und Sp
2 jeweils unabhängig voneinander eine Einfachbindung oder eine Abstandsgruppe, vorzugsweise mit einer der vor- und nachstehend für Sp angegebenen Bedeutungen, und besonders bevorzugt -(CH
2)
p1-, -(CH
2)
p1-O-, -(CH
2)
p1-CO-O- oder -(CH
2)
p1-O-CO-O- bedeuten, worin p1 eine ganze Zahl von 1 bis 12 ist, und wobei in den letztgenannten Gruppen die Verknüpfung zur benachbarten Ring über das O-Atom erfolgt,
wobei auch einer oder mehrere der Reste P
1-Sp
1- und P
2-Sp
2- R
aa bedeuten können, mit der Maßgabe dass mindestens einer der vorhandenen Reste P
1-Sp
1- und P
2-Sp
2- nicht R
aa bedeutet,
R
aa H, F, Cl, CN oder geradkettiges oder verzweigtes Alkyl mit 1 bis 25 C-Atomen, worin auch eine oder mehrere nicht benachbarte CH
2-Gruppen jeweils unabhängig voneinander durch C(R
0)=C(R
00)-, -C≡C-, -N(R
0)-, -O-, -S-, -CO-, -CO-O-, -O-CO-, -O-CO-O- so ersetzt sein können, dass O- und/oder S-Atome nicht direkt miteinander verknüpft sind, und worin auch ein oder mehrere H-Atome durch F, Cl, CN oder P
1-Sp
1- ersetzt sein können, besonders bevorzugt geradkettiges oder verzweigtes, optional ein- oder mehrfach fluoriertes, Alkyl, Alkoxy, Alkenyl, Alkinyl, Alkylcarbonyl, Alkoxycarbonyl, Alkylcarbonyloxy oder Alkoxycarbonyloxy mit 1 bis 12 C-Atomen (wobei die Alkenyl- und Alkinylreste mindestens zwei und die verzweigten Reste mindestens drei C-Atome aufweisen),
R
0, R
00 jeweils unabhängig voneinander und bei jedem Auftreten gleich oder verschieden H oder Alkyl mit 1 bis 12 C-Atomen,
R
y und R
z jeweils unabhängig voneinander H, F, CH
3 oder CF
3,
Z
1 -O-, -CO-, -C(R
yR
z)-, oder -CF
2CF
2-,
Z
2 und Z
3 jeweils unabhängig voneinander -CO-O-, -O-CO-, -CH
2O-, -OCH
2-, -CF
2O-, -OCF
2-, oder -(CH
2)
n-, wobei n 2, 3 oder 4 ist,
L bei jedem Auftreten gleich oder verschieden F, Cl, CN, oder geradkettiges oder verzweigtes, optional ein- oder mehrfach fluoriertes, Alkyl, Alkoxy, Alkenyl, Alkinyl, Alkylcarbonyl, Alkoxycarbonyl, Alkylcarbonyloxy oder Alkoxycarbonyloxy mit 1 bis 12 C-Atomen vorzugsweise F,
L' und L'' jeweils unabhängig voneinander H, F oder Cl,
r 0, 1, 2, 3 oder 4,
s 0, 1, 2 oder 3,
t 0, 1 oder 2,
x 0 oder 1.
-
In den Verbindungen der Formeln M1 bis M29 bedeutet
worin L bei jedem Auftreten gleich oder verschieden eine der vor- und nachstehend angegebenen Bedeutungen hat, und vorzugsweise F, Cl, CN, NO
2, CH
3, C
2H
5, C(CH
3)
3, CH(CH
3)
2, CH
2CH(CH
3)C
2H
5, OCH
3, OC
2H
5, COCH
3, COC
2H
5, COOCH
3, COOC
2H
5, CF
3, OCF
3, OCHF
2, OC
2F
5 oder P-Sp-, besonders bevorzugt F, Cl, CN, CH
3, C
2H
5, OCH
3, COCH
3, OCF
3 oder P-Sp-, ganz besonders bevorzugt F, Cl, CH
3, OCH
3, COCH
3 oder OCF
3, insbesondere F oder CH
3 bedeutet.
-
Die FK-Medien zur Verwendung in den erfindungsgemäßen FK-Anzeigen enthalten, neben den oben beschriebenen polymerisierbaren Verbindungen, eine FK-Mischung (”Host-Mischung”) enthaltend eine oder mehr, vorzugsweise zwei oder mehr niedermolekulare (d. h. monomere bzw. unpolymerisierte) Verbindungen. Letztere sind stabil bzw. unreaktiv gegenüber einer Polymerisationsreaktion unter den zur Polymerisation der polymerisierbaren Verbindungen verwendeten Bedingungen. Prinzipiell eignet sich als Host-Mischung jede zur Verwendung in herkömmlichen VA- und OCB-Anzeigen geeignete FK-Mischung. Geeignete FK-Mischungen sind dem Fachmann bekannt und in der Literatur beschrieben, beispielsweise Mischungen in VA-Anzeigen in
EP 1 378 557 A1 , und Mischungen für OCB-Anzeigen in
EP 1 306 418 A1 und
DE 102 24 046 A1 .
-
Besonders bevorzugte FK-Anzeigen, FK-Host-Mischungen und FK-Medien werden im Folgenden genannt:
In einer ersten bevorzugten Ausführungsform enthält das FK-Medium eine FK-Host-Mischung basierend auf Verbindungen mit negativer dielektrischer Anisotropie. Solche FK-Medien eignen sich besonders für PSA-VA-Anzeigen. Besonders bevorzugte Ausführungsformen eines solchen FK-Mediums werden in den folgenden Abschnitten a)–x) genannt:
- a) FK-Medium, welches eine oder mehrere Verbindungen der Formel CY und/oder PY enthält: worin die einzelnen Reste folgende Bedeutung besitzen
a 1 oder 2,
b 0 oder 1, R1 und R2 jeweils unabhängig voneinander Alkyl mit 1 bis 12 C-Atomen, wobei auch eine oder zwei nicht benachbarte CH2-Gruppen durch -O-, -CH=CH-, -CO-, -OCO- oder -COO- so ersetzt sein können, dass O-Atome nicht direkt miteinander verknüpft sind, vorzugsweise Alkyl oder Alkoxy mit 1 bis 6 C-Atomen,
Zx und Zy jeweils unabhängig voneinander -CH2CH2-, -CH=CH-, -CF2O-, -OCF2-, -CH2O-, -OCH2-, -CO-O-, -O-CO-, -C2F4-, -CF=CF-, -CH=CH-CH2O-, oder eine Einfachbindung, vorzugsweise eine Einfachbindung,
L1-4 jeweils unabhängig voneinander F, Cl, OCF3, CF3, CH3, CH2F, CHF2.
Vorzugsweise bedeuten beide Reste L1 und L2 F, oder einer der Reste L1 und L2 F und der andere Cl, bzw. beide Reste L3 und L4 F, oder einer der Reste L3 und L4 F und der andere Cl.
Die Verbindungen der Formel CY sind vorzugsweise ausgewählt aus der Gruppe bestehend aus folgenden Unterformeln worin a 1 oder 2, Alkyl und Alkyl* jeweils unabhängig voneinander einen geradkettigen Alkylrest mit 1-6 C-Atomen, und Alkenyl einen geradkettigen Alkenylrest mit 2-6 C-Atomen, und (O) ein Sauerstoffatom oder eine Einfachbindung bedeuten. Alkenyl bedeutet vorzugsweise CH2=CH-, CH2=CHCH2CH2-, CH3-CH=CH-, CH3-CH2-CH=CH-, CH3-(CH2)2-CH=CH-, CH3-(CH2)3-CH=CH- oder CH3-CH=CH-(CH2)2-.
Die Verbindungen der Formel PY sind vorzugsweise ausgewählt aus der Gruppe bestehend aus folgenden Unterformeln: worin Alkyl und Alkyl* jeweils unabhängig voneinander einen geradkettigen Alkylrest mit 1-6 C-Atomen und Alkenyl einen geradkettigen Alkenylrest mit 2-6 C-Atomen, und (O) ein Sauerstoffatom oder eine Einfachbindung bedeuten. Alkenyl bedeutet vorzugsweise CH2=CH-, CH2=CHCH2CH2-, CH3-CH=CH-, CH3-CH2-CH=CH-, CH3-(CH2)2-CH=CH-, CH3-(CH2)3-CH=CH- oder CH3-CH=CH-(CH2)2-.
- b) FK-Medium, welches zusätzlich eine oder mehrere Verbindungen der folgenden Formel enthält: worin die einzelnen Reste folgende Bedeutung besitzen R3 und R4 jeweils unabhängig voneinander Alkyl mit 1 bis 12 C-Atomen, worin auch eine oder zwei nicht benachbarte CH2-Gruppen durch -O-, -CH=CH-, -CO-, -O-CO- oder -CO-O- so ersetzt sein können, dass O-Atome nicht direkt miteinander verknüpft sind,
Zy -CH2CH2-, -CH=CH-, -CF2O-, -OCF2-, -CH2O-, -OCH2-, -CO-O-, -O-CO-, -C2F4-, -CF=CF-, -CH=CH-CH2O-, oder eine Einfachbindung, vorzugsweise eine Einfachbindung.
Die Verbindungen der Formel ZK sind vorzugsweise ausgewählt aus der Gruppe bestehend aus folgenden Unterformeln: worin Alkyl und Alkyl* jeweils unabhängig voneinander einen geradkettigen Alkylrest mit 1-6 C-Atomen bedeuten, und Alkenyl einen geradkettigen Alkenylrest mit 2-6 C-Atomen bedeuten. Alkenyl bedeutet vorzugsweise CH2=CH-, CH2=CHCH2CH2-, CH3-CH=CH-, CH3-CH2-CH=CH-, CH3-(CH2)2-CH=CH-, CH3-(CH2)3-CH=CH- oder CH3-CH=CH-(CH2)2-.
- c) FK-Medium, welches zusätzlich eine oder mehrere Verbindungen der folgenden Formel enthält: worin die einzelnen Reste bei jedem Auftreten gleich oder verschieden folgende Bedeutung haben: R5 und R6 jeweils unabhängig voneinander eine der oben für R1 angegebenen Bedeutungen, und
e 1 oder 2.
Die Verbindungen der Formel DK sind vorzugsweise ausgewählt aus der Gruppe bestehend aus folgenden Unterformeln: worin Alkyl und Alkyl* jeweils unabhängig voneinander einen geradkettigen Alkylrest mit 1-6 C-Atomen, und Alkenyl und Alkenyl* jeweils unabhängig voneinander einen geradkettigen Alkenylrest mit 2-6 C-Atomen bedeuten. Alkenyl und Alkenyl* bedeuten vorzugsweise CH2=CH-, CH2=CHCH2CH2-, CH3-CH=CH-, CH3-CH2-CH=CH-, CH3-(CH2)2-CH=CH-, CH3-(CH2)3-CH=CH- oder CH3-CH=CH-(CH2)2-.
- d) FK-Medium, welches zusätzlich eine oder mehrere Verbindungen der folgenden Formel enthält: worin die einzelnen Reste folgende Bedeutung besitzen f 0 oder 1,
R1 und R2 jeweils unabhängig voneinander Alkyl mit 1 bis 12 C-Atomen, wobei auch eine oder zwei nicht benachbarte CH2-Gruppen durch -O-, -CH=CH-, -CO-, -OCO- oder -COO- so ersetzt sein können, dass O-Atome nicht direkt miteinander verknüpft sind,
Zx und Zy jeweils unabhängig voneinander -CH2CH2-, -CH=CH-, -CF2O-, -OCF2-, -CH2O-, -OCH2-, -CO-O-, -O-CO-, -C2F4-, -CF=CF-, -CH=CH-CH2O-, oder eine Einfachbindung, vorzugsweise eine Einfachbindung,
L1 und L2 jeweils unabhängig voneinander F, Cl, OCF3, CF3, CH3, CH2F, CHF2.
Vorzugsweise bedeuten beide Reste L1 und L2 F oder einer der Reste L1 und L2 F und der andere Cl.
Die Verbindungen der Formel LY sind vorzugsweise ausgewählt aus der Gruppe bestehend aus folgenden Unterformeln worin R1 die oben angegebene Bedeutung hat, Alkyl einen geradkettigen Alkylrest mit 1-6 C-Atomen, (O) ein Sauerstoffatom oder eine Einfachbindung und v eine ganze Zahl von 1 bis 6 bedeuten. R1 bedeutet vorzugsweise geradkettiges Alkyl mit 1 bis 6 C-Atomen oder geradkettiges Alkenyl mit 2 bis 6 C-Atomen, insbesondere CH3, C2H5, n-C3H7, n-C4H9, n-C5H11, CH2=CH-, CH2=CHCH2CH2-, CH3-CH=CH-, CH3-CH2-CH=CH-, CH3-(CH2)2-CH=CH-, CH3-(CH2)3-CH=CH- oder CH3-CH=CH-(CH2)2-.
- e) FK-Medium, welches zusätzlich eine oder mehrere Verbindungen ausgewählt aus der Gruppe bestehend aus folgenden Formeln enthält: worin alkyl C1-6-alkyl, Lx H oder F und X F, Cl, OCF3, OCHF2 oder OCH=CF2 bedeutet. Besonders bevorzugt sind Verbindungen der Formel G1, worin X F bedeutet.
- f) FK-Medium, welches zusätzlich eine oder mehrere Verbindungen ausgewählt aus der Gruppe bestehend aus folgenden Formeln enthält: worin R5 eine der oben für R1 angegebenen Bedeutungen besitzt, alkyl C1-6-alkyl, d 0 oder 1, und z und m jeweils unabhängig voneinander eine ganze Zahl von 1 bis 6 bedeuten. R5 ist in diesen Verbindungen besonders bevorzugt C1-6-alkyl oder -alkoxy oder C2-6-alkenyl, d ist vorzugsweise 1. Vorzugsweise enthält das erfindungsgemäße FK-Medium eine oder mehrere Verbindungen der oben genannten Formeln in Mengen von ≥ 5 Gew.-%.
- g) FK-Medium, welches zusätzlich eine oder mehrere Biphenylverbindungen ausgewählt aus der Gruppe bestehend aus folgenden Formeln enthält: worin Alkyl und Alkyl* jeweils unabhängig voneinander einen geradkettigen Alkylrest mit 1-6 C-Atomen, und Alkenyl und Alkenyl* jeweils unabhängig voneinander einen geradkettigen Alkenylrest mit 2-6 C-Atomen bedeuten. Alkenyl und Alkenyl* bedeuten vorzugsweise CH2=CH-, CH2=CHCH2CH2-, CH3-CH=CH-, CH3-CH2-CH=CH-, CH3-(CH2)2-CH=CH-, CH3-(CH2)3-CH=CH- oder CH3-CH=CH-(CH2)2-.
Der Anteil der Biphenyle der Formeln B1 bis B3 in der FK-Mischung beträgt vorzugsweise mindestens 3 Gew.-%, insbesondere ≥ 5 Gew.-%.
Die Verbindungen der Formel B2 sind besonders bevorzugt.
Die Verbindungen der Formel B1 bis B3 sind vorzugsweise ausgewählt aus der Gruppe bestehend aus folgenden Unterformeln worin Alkyl* einen Alkylrest mit 1-6 C-Atomen bedeutet. Insbesondere bevorzugt enthält das erfindungsgemäße Medium eine oder mehrere Verbindungen der Formeln B1a und/oder B2c.
- h) FK-Medium, welches zusätzlich eine oder mehrere Terphenylverbindungen der folgenden Formel enthält: worin R5 und R6 jeweils unabhängig voneinander eine der oben für R1 angegebenen Bedeutungen besitzen und jeweils unabhängig voneinander bedeuten, worin L5 F oder Cl, vorzugsweise F, und L6 F, Cl, OCF3, CF3, CH3, CH2F oder CHF2, vorzugsweise F, bedeuten.
Die Verbindungen der Formel T sind vorzugsweise ausgewählt aus der Gruppe bestehend aus folgenden Unterformeln worin R einen geradkettigen Alkyl- oder Alkoxyrest mit 1-7 C-Atomen, R* einen geradkettigen Alkenylrest mit 2-7 C-Atomen, (O) ein Sauerstoffatom oder eine Einfachbindung, und m eine ganze Zahl von 1 bis 6 bedeutet. R* bedeutet vorzugsweise CH2=CH-, CH2=CHCH2CH2-, CH3-CH=CH-, CH3-CH2-CH=CH-, CH3-(CH2)2-CH=CH-, CH3-(CH2)3-CH=CH- oder CH3-CH=CH-(CH2)2-.
Vorzugsweise bedeutet R Methyl, Ethyl, Propyl, Butyl, Pentyl, Hexyl Methoxy, Ethoxy, Propoxy, Butoxy oder Pentoxy.
Das erfindungsgemäße FK-Medium enthält die Terphenylle der Formeln T und deren bevorzugte Unterformeln vorzugsweise in einer Menge von 0,5–30 Gew.-%, insbesondere von 1–20 Gew.-%.
Besonders bevorzugt sind Verbindungen der Formeln T1, T2, T3 und T21. In diesen Verbindungen bedeutet R vorzugsweise Alkyl, ferner Alkoxy jeweils mit 1-5 C-Atomen.
Vorzugsweise werden die Terphenyle in erfindungsgemässen Mischungen eingesetzt, wenn der Δn-Wert der Mischung ≥ 0,1 sein soll. Bevorzugte Mischungen enthalten 2–20 Gew.-% einer oder mehrerer Terphenyl-Verbindungen der Formel T, vorzugsweise ausgewählt aus der Gruppe der Verbindungen T1 bis T22.
- i) FK-Medium, welches zusätzlich eine oder mehrere Verbindungen ausgewählt aus der Gruppe bestehend aus folgenden Formeln enthält: worin R1 und R2 die oben angegebenen Bedeutungen haben, und vorzugsweise jeweils unabhängig voneinander geradkettiges Alkyl mit 1 bis 6 C-Atomen oder geradkettiges Alkenyl mit 2 bis 6 C-Atomen bedeuten.
Bevorzugte Medien enthalten eine oder mehrere Verbindungen ausgewählt aus den Formeln O1, O3 und O4.
- k) FK-Medium, welches zusätzlich eine oder mehrere Verbindungen der folgenden Formel enthält: R9 H, CH3, C2H5 oder n-C3H7, (F) einen optionalen Fluorsubstituenten und q 1, 2 oder 3 bedeutet, und R7 eine der für R1 angegebenen Bedeutungen hat, vorzugsweise in Mengen von > 3 Gew.-%, insbesondere ≥ 5 Gew.-%, und ganz besonders bevorzugt von 5–30 Gew.-%.
Besonders bevorzugte Verbindungen der Formel IF sind ausgewählt aus der Gruppe bestehend aus folgenden Unterformeln: worin R7 vorzugsweise geradkettiges Alkyl bedeutet und R9 CH3, C2H5 oder n-C3H7 bedeutet. Besonders bevorzugt sind die Verbindungen der Formel FI1, FI2 und FI3.
- m) FK-Medium, welches zusätzlich eine oder mehrere Verbindungen ausgewählt aus der Gruppe bestehend aus folgenden Formeln enthält: worin R8 die für R1 angegebene Bedeutung hat und Alkyl einen geradkettigen Alkylrest mit 1-6 C-Atomen bedeutet.
- n) FK-Medium, welches zusätzlich eine oder mehrere Verbindungen enthält, die eine Tetrahydronaphthyl- oder Naphthyl-Einheit aufweisen, wie z. B. die Verbindungen ausgewählt aus der Gruppe bestehend aus folgenden Formeln: worin R10 und R11 jeweils unabhängig voneinander eine der für R1 angegebenen Bedeutungen haben, vorzugsweise geradkettiges Alkyl oder Alkoxy mit 1 bis 6 C-Atomen oder geradkettiges Alkenyl mit 2 bis 6 C-Atomen bedeuten, und Z1 und Z2 jeweils unabhängig voneinander -C2H4-, -CH=CH-, -(CH2)4-, -(CH2)3O-, -O(CH2)3-, -CH=CH-CH2CH2-, -CH2CH2CH=CH-, -CH2O-, -OCH2-, -CO-O-, -O-CO-, -C2F4-, -CF=CF-, -CF=CH-, -CH=CF-, -CH2- oder eine Einfachbindung bedeuten.
- o) FK-Medium, welches zusätzlich eine oder mehrere eine oder mehrere Difluordibenzochromane und/oder Chromane der folgenden Formeln enthält: worin
R11 und R12 jeweils unabhängig voneinander die oben angegebene Bedeutung aufweisen,
Ring M trans-1,4-Cyclohexylen oder 1,4-Phenylen bedeutet,
Zm -C2H4-, -CH2O-, -OCH2-, -CO-O- oder -O-CO-,
c 0 oder 1 bedeutet,
vorzugsweise in Mengen von 3 bis 20 Gew.-%, insbesondere in Mengen von 3 bis 15 Gew.-%.
Besonders bevorzugte Verbindungen der Formeln BC, CR und RC sind ausgewählt aus der Gruppe bestehend aus folgenden Unterformeln: worin Alkyl und Alkyl* jeweils unabhängig voneinander einen geradkettigen Alkylrest mit 1-6 C-Atomen, (O) ein Sauerstoffatom oder eine Einfachbindung, c 1 oder 2, und Alkenyl und Alkenyl* jeweils unabhängig voneinander einen geradkettigen Alkenylrest mit 2-6 C-Atomen bedeuten. Alkenyl und Alkenyl* bedeuten vorzugsweise CH2=CH-, CH2=CHCH2CH2-, CH3-CH=CH-, CH3-CH2-CH=CH-, CH3-(CH2)2-CH=CH-, CH3-(CH2)3-CH=CH- oder CH3-CH=CH-(CH2)2-.
Ganz besonders bevorzugt sind Mischungen enthaltend eine, zwei oder drei Verbindungen der Formel BC-2.
- p) FK-Medium, welches zusätzlich eine oder mehrere fluorierte Phenanthrene und/oder Dibenzofurane der folgenden Formeln enthält: worin R11 und R12 jeweils unabhängig voneinander die oben angegebenen Bedeutungen besitzen, b 0 oder 1, L F und r 1, 2 oder 3 bedeutet.
Besonders bevorzugte Verbindungen der Formeln PH und BF sind ausgewählt aus der Gruppe bestehend aus folgenden Unterformeln: worin R und R' jeweils unabhängig voneinander einen geradkettigen Alkyl- oder Alkoxyrest mit 1-7 C-Atomen bedeuten.
- q) FK-Medium, welches außer den erfindungsgemäßen polymerisierbaren Verbindungen, insbesondere der Formel I oder deren Unterformeln, sowie den Comonomeren, keine Verbindungen enthält, die eine endständige Vinyloxygruppe (-O-CH=CH2) aufweisen.
- r) FK-Medium, welches 1 bis 5, vorzugsweise 1, 2 oder 3 polymerisierbare Verbindungen, vorzugsweise ausgewählt aus erfindungsgemäßen polymerisierbare Verbindungen, insbesondere der Formel I oder deren Unterformeln, enthält:
- s) FK-Medium, worin der Anteil an polymerisierbaren Verbindungen, insbesondere der Formel I oder deren Unterformeln, im Gesamtgemisch 0,05 bis 5%, vorzugsweise 0,1 bis 1% beträgt.
- t) FK-Medium, welches 1 bis 8, vorzugsweise 1 bis 5 Verbindungen der Formel CY1, CY2, PY1 und/oder PY2 enthält. Der Anteil dieser Verbindungen im Gesamtgemisch beträgt vorzugsweise 5 bis 60%, besonders bevorzugt 10 bis 35%. Der Gehalt dieser einzelnen Verbindungen beträgt vorzugsweise jeweils 2 bis 20%.
- u) FK-Medium, welches 1 bis 8, vorzugsweise 1 bis 5 Verbindungen der Formel CY9, CY10, PY9 und/oder PY10 enthält. Der Anteil dieser Verbindungen im Gesamtgemisch beträgt vorzugsweise 5 bis 60%, besonders bevorzugt 10 bis 35%. Der Gehalt dieser einzelnen Verbindungen beträgt vorzugsweise jeweils 2 bis 20%.
- v) FK-Medium, welches 1 bis 10, vorzugsweise 1 bis 8 Verbindungen der Formel ZK enthält, insbesondere Verbindungen der Formel ZK1, ZK2 und/oder ZK6. Der Anteil dieser Verbindungen im Gesamtgemisch beträgt vorzugsweise 3 bis 25%, besonders bevorzugt 5 bis 45%. Der Gehalt dieser einzelnen Verbindungen beträgt vorzugsweise jeweils 2 bis 20%.
- w) FK-Medium, worin der Anteil an Verbindungen der Formel CY, PY und ZK im Gesamtgemisch mehr als 70%, vorzugsweise mehr als 80% beträgt,
- x) PSA-VA-Anzeige, worin der pretilt-Winkel vorzugsweise ≤ 85°, besonderes bevorzugt ≤ 80° beträgt.
-
In einer zweiten bevorzugten Ausführungsform enthält das FK-Medium eine FK-Host-Mischung basierend auf Verbindungen mit positiver dielektrischer Anisotropie. Solche FK-Medien eignen sich besonders zur Verwendung in PSA-OCB-, PSA-TN-, PSA-Posi-VA-, PSA-IPS- oder PSA-FFS-Anzeigen.
-
Besonders bevorzugt ist ein FK-Medium dieser zweiten bevorzugten Ausführungsform, welches eine oder mehrere Verbindungen ausgewählt aus der Gruppe bestehend aus den Verbindungen der Formeln AA und BB enthält
und gegebenenfalls zusätzlich zu den Verbindungen der Formel AA und/oder BB eine oder mehrere Verbindungen der Formel CC enthält
worin die einzelnen Reste folgende Bedeutung besitzen:
jeweils unabhängig voneinander, und bei jedem Auftreten gleich oder verschieden
jeweils unabhängig voneinander, und bei jedem Auftreten gleich oder verschieden
R
21, R
31, R
41, R
42 jeweils unabhängig voneinander Alkyl, Alkoxy, Oxaalkyl oder Fluoralkyl mit 1 bis 9 C-Atomen oder Alkenyl mit 2 bis 9 C-Atomen,
X
0 F, Cl, halogeniertes Alkyl oder Alkoxy mit 1 bis 6 C-Atomen oder halogeniertes Alkenyl oder Alkenyloxy mit 2 bis 6 C-Atomen,
Z
31 -CH
2CH
2-, -CF
2CF
2-, -COO-, trans- -CH=CH-, trans- -CF=CF-, -CH
2O- oder eine Einfachbindung, vorzugsweise -CH
2CH
2-, -COO-, trans- -CH=CH- oder eine Einfachbindung, besonders bevorzugt -COO-, trans- -CH=CH- oder eine Einfachbindung,
Z
41, Z
42 -CH
2CH
2-, -COO-, trans- -CH=CH-, trans- -CF=CF-, -CH
2O-, -CF
2O-, -C≡C- oder eine Einfachbindung, vorzugsweise eine Einfachbindung,
L
21, L
22, L
31, L
32 H oder F,
g 1, 2 oder 3,
h 0, 1, 2 oder 3.
-
X0 ist vorzugsweise F, Cl, CF3, CHF2, OCF3, OCHF2, OCFHCF3, OCFHCHF2, OCFHCHF2, OCF2CH3, OCF2CHF2, OCF2CHF2, OCF2CF2CHF2, OCF2CF2CHF2, OCFHCF2CF3, OCFHCF2CHF2, OCF2CF2CF3, OCF2CF2CClF2, OCClFCF2CF3 oder CH=CF2, besonders bevorzugt F oder OCF3.
-
X0 is preferably F, Cl, CF3, CHF2, OCF3, OCHF2, OCFHCF3, OCFHCHF2, OCFHCHF2, OCF2CH3, OCF2CHF2, OCF2CHF2, OCF2CF2CHF2, OCF2CF2CHF2, OCFHCF2CF3, OCFHCF2CHF2, OCF2CF2CF3, OCF2CF2CClF2, OCClFCF2CF3 or CH=CF2, very preferably F or OCF3.
-
Die Verbindungen der Formel AA sind vorzugsweise ausgewählt aus der Gruppe bestehend aus folgenden Formeln:
worin A
21, R
21, X
0, L
21 und L
22 die in Formel AA angegebene Bedeutung besitzen, L
23 und L
24 jeweils unabhängig voneinander H oder F bedeuten, und X
0 vorzugsweise F bedeutet. Besonders bevorzugt sind Verbindungen der Formeln AA1 und AA2.
-
Besonders bevorzugte Verbindungen der Formel AA1 sind ausgewählt aus der Gruppe bestehend aus den folgenden Unterformeln:
worin R
0 die für R
21 in Formel AA1 angegebene Bedeutung besitzt, X
0, L
21 und L
22 die in Formel AA1 angegebene Bedeutung besitzen, L
23, L
24, L
25 und L
26 jeweils unabhängig voneinander H oder F bedeuten, und X
0 vorzugsweise F bedeutet.
-
Ganz besonders bevorzugte Verbindungen der Formel AA1 sind ausgewählt aus der Gruppe bestehend aus den folgenden Unterformeln:
worin R
0 die für R
21 in Formel AA1 angegebene Bedeutung besitzt.
-
Besonders bevorzugte Verbindungen der Formel AA2 sind ausgewählt aus der Gruppe bestehend aus den folgenden Unterformeln:
worin R
0 die für R
21 in Formel AA1 angegebene Bedeutung besitzt, X
0, L
21 und L
22 die in Formel AA angegebene Bedeutung besitzen, L
23, L
24, L
25 und L
26 jeweils unabhängig voneinander H oder F bedeuten und X
0 vorzugsweise F bedeutet.
-
Ganz besonders bevorzugte Verbindungen der Formel AA2 sind ausgewählt aus der Gruppe bestehend aus den folgenden Unterformeln:
worin R
0 die für R
21 in Formel AA1 angegebene Bedeutung besitzt.
-
Besonders bevorzugte Verbindungen der Formel AA3 sind ausgewählt aus der Gruppe bestehend aus den folgenden Unterformeln:
worin R
0 die für R
21 in Formel AA1 angegebene Bedeutung besitzt, X
0, L
21 und L
22 die in Formel AA3 angegebene Bedeutung besitzen, und X
0 vorzugsweise F bedeutet.
-
Besonders bevorzugte Verbindungen der Formel AA4 sind solche der folgenden Unterformel:
worin R
0 die für R
21 in Formel AA1 angegebene Bedeutung besitzt.
-
Die Verbindungen der Formel BB sind vorzugsweise ausgewählt aus der Gruppe bestehend aus folgenden Formeln:
worin A
31, A
32, R
31, X
0, L
31, L
32 und g die in Formel BB angegebene Bedeutung besitzen, und X
0 vorzugsweise F bedeutet. Besonders bevorzugt sind Verbindungen der Formeln BB1 und BB2.
-
Besonders bevorzugte Verbindungen der Formel BB1 sind ausgewählt aus der Gruppe bestehend aus den folgenden Unterformeln:
worin R
3 die für R
31 in Formel BB1 angegebene Bedeutung besitzt, X
0, L
31 und L
32 die in Formel BB1 angegebene Bedeutung besitzen, und X
0 vorzugsweise F bedeutet.
-
Ganz besonders bevorzugte Verbindungen der Formel BB1a sind ausgewählt aus der Gruppe bestehend aus den folgenden Unterformeln:
worin R
3 die für R
31 in Formel BB1 angegebene Bedeutung besitzt.
-
Ganz besonders bevorzugte Verbindungen der Formel BB1b sind ausgewählt aus der Gruppe bestehend aus den folgenden Unterformeln:
worin R
3 die für R
31 in Formel BB1 angegebene Bedeutung besitzt.
-
Besonders bevorzugte Verbindungen der Formel BB2 sind ausgewählt aus der Gruppe bestehend aus den folgenden Unterformeln:
worin R
0 die für R
31 in Formel BB2 angegebene Bedeutung besitzt, X
0, L
31 und L
32 die in Formel BB2 angegebene Bedeutung besitzen, L
33, L
34, L
35 und L
36 jeweils unabhängig voneinander H oder F bedeuten, und X
0 vorzugsweise F bedeutet.
-
Ganz besonders bevorzugte Verbindungen der Formel BB2a sind ausgewählt aus der Gruppe bestehend aus den folgenden Unterformeln:
worin R
3 die für R
31 in Formel BB2 angegebene Bedeutung besitzt.
-
Ganz besonders bevorzugte Verbindungen der Formel BB2b sind ausgewählt aus der Gruppe bestehend aus den folgenden Unterformeln:
worin R
3 die für R
31 in Formel BB2 angegebene Bedeutung besitzt.
-
Ganz besonders bevorzugte Verbindungen der Formel BB2c sind ausgewählt aus der Gruppe bestehend aus den folgenden Unterformeln:
worin R
3 die für R
31 in Formel BB2 angegebene Bedeutung besitzt.
-
Ganz besonders bevorzugte Verbindungen der Formel BB2d und BB2e sind ausgewählt aus der Gruppe bestehend aus den folgenden Unterformeln:
worin R
3 die für R
31 in Formel BB2 angegebene Bedeutung besitzt.
-
Ganz besonders bevorzugte Verbindungen der Formel BB2f sind ausgewählt aus der Gruppe bestehend aus den folgenden Unterformeln:
worin R
3 die für R
31 in Formel BB2 angegebene Bedeutung besitzt.
-
Ganz besonders bevorzugte Verbindungen der Formel BB2g sind ausgewählt aus der Gruppe bestehend aus den folgenden Unterformeln:
worin R
3 die für R
31 in Formel BB2 angegebene Bedeutung besitzt.
-
Ganz besonders bevorzugte Verbindungen der Formel BB2h sind ausgewählt aus der Gruppe bestehend aus den folgenden Unterformeln:
worin R
3 die für R
31 in Formel BB2 angegebene Bedeutung besitzt.
-
Ganz besonders bevorzugte Verbindungen der Formel BB2i sind ausgewählt aus der Gruppe bestehend aus den folgenden Unterformeln:
worin R
3 die für R
31 in Formel BB2 angegebene Bedeutung besitzt.
-
Ganz besonders bevorzugte Verbindungen der Formel BB2k sind ausgewählt aus der Gruppe bestehend aus den folgenden Unterformeln:
worin R
3 die für R
31 in Formel BB2 angegebene Bedeutung besitzt.
-
Alternativ oder zusätzlich zu den Verbindungen der Formeln BB1 und/oder BB2 können die FK-Medien eine oder mehrere Verbindungen der Formel BB3 wie oben definiert enthalten.
-
Besonders bevorzugte Verbindungen der Formel BB3 sind ausgewählt aus der Gruppe bestehend aus den folgenden Unterformeln:
worin R
3 die für R
31 in Formel BB3 angegebene Bedeutung besitzt.
-
Vorzugsweise enthalten die FK-Medien dieser zweiten bevorzugten Ausführungsform zusätzlich zu den Verbindungen der Formel AA und/oder BB eine oder mehrere dielektrisch neutrale Verbindungen mit einer dielektrischen Anisotropie im Bereich von –1,5 bis +3, bevorzugt ausgewählt aus der Gruppe der Verbindungen der Formel CC wie oben definiert.
-
Besonders bevorzugte Verbindungen der Formel CC sind ausgewählt aus der Gruppe bestehend aus den folgenden Unterformeln:
worin R
41 und R
42 die in Formel CC angegebenen Bedeutungen besitzen, und vorzugsweise jeweils unabhängig voneinander Alkyl, Alkoxy, fluoriertes Alkyl oder fluoriertes Alkoxy mit 1 bis 7 C-Atomen, Alkenyl, Alkenyloxy, Alkoxyalkyl oder fluoriertes Alkenyl mit 2 bis 7 C-Atomen bedeuten und L
4 H oder F bedeutet.
-
Vorzugsweise enthalten die FK-Medien dieser zweiten bevorzugten Ausführungsform, zusätzlich oder alternativ zu den dielektrisch neutralen Verbindungen der Formel CC, eine oder mehrere dielektrisch neutrale Verbindungen mit einer dielektrischen Anisotropie im Bereich von –1,5 bis +3, ausgewählt aus der Gruppe der Verbindungen der Formel DD
worin A
41, A
42, Z
41, Z
42, R
41, R
42 und h die in Formel CC angegebene Bedeutung besitzen.
-
Besonders bevorzugte Verbindungen der Formel DD sind ausgewählt aus der Gruppe bestehend aus den folgenden Unterformeln:
worin R
41 und R
42 die in Formel DD angegebenen Bedeutungen besitzen und R
41 vorzugsweise Alkyl bedeutet, und in Formel DD1 R
42 vorzugsweise Alkenyl, besonders bevorzugt -(CH
2)
2-CH=CH-CH
3, und in Formel DD2 R
42 vorzugsweise Alkyl, -(CH
2)
2-CH=CH
2 oder -(CH
2)
2-CH=CH-CH
3 bedeutet.
-
Die Verbindungen der Formeln AA und BB werden im erfindungsgemäßen FK-Medium vorzugsweise in einer Konzentration von 2% bis 60%, stärker bevorzugt von 3% bis 35% und ganz besonders bevorzugt von 4% bis 30% der Gesamtmischung verwendet.
-
Die Verbindungen der Formeln CC und DD werden im erfindungsgemäßen FK-Medium vorzugsweise in einer Konzentration von 2% bis 70%, stärker bevorzugt von 5% bis 65%, noch stärker bevorzugt von 10% bis 60% und ganz besonders bevorzugt von 10%, bevorzugt von 15%, bis 55% der Gesamtmischung verwendet.
-
Die Kombination von Verbindungen der oben genannten bevorzugten Ausführungsformen a)–y) mit den oben beschriebenen polymerisierten Verbindungen bewirkt in den erfindungsgemäßen FK-Medien niedrige Schwellenspannungen, niedrige Rotationsviskositäten und sehr gute Tieftemperaturstabilitäten bei gleichbleibend hohen Klärpunkten und hohen HR-Werten, und erlaubt die schnelle Einstellung eines besonders niedrigen pretilt-Winkels in PSA-Anzeigen. Insbesondere zeigen die FK-Medien in PSA-Anzeigen im Vergleich zu den Medien aus dem Stand der Technik deutlich verringerte Schaltzeiten, insbesondere auch der Graustufenschaltzeiten.
-
Vorzugsweise weist die Flüssigkristallmischung einen nematischen Phasenbereich von mindestens 80 K, besonders bevorzugt von mindestens 100 K, und eine Rotationsviskosität von nicht mehr als 250, vorzugsweise nicht mehr als 200 mPa·s, bei 20°C auf.
-
In den erfindungsgemäßen Anzeigen des VA-Typs sind die Moleküle in der Schicht des FK-Mediums im ausgeschalteten Zustand senkrecht zu den Elektrodenflächen (homöotrop) oder gekippt homöotrop (engl. ”tilted”) orientiert. Bei Anlegen einer elektrischen Spannung an die Elektroden findet eine Umorientierung der FK-Moleküle mit den Moleküllängsachsen parallel zu den Elektrodenflächen statt.
-
Erfindungsgemäße FK-Medien basierend auf Verbindungen mit negativer dielektrischer Anisotropie gemäß der ersten bevorzugten Ausführungsform, insbesondere zur Verwendung in Anzeigen des PSA-VA-Typs, weisen eine negative dielektrische Anisotropie Δε auf, vorzugsweise von –0,5 bis –10, insbesondere von –2,5 bis –7,5 bei 20°C und 1 kHz.
-
Die Doppelbrechung Δn in erfindungsgemäßen FK-Medien zur Verwendung in Anzeigen des PSA-VA-Typs ist vorzugsweise unter 0,16, besonders bevorzugt von 0,06 bis 0,14, ganz besonders bevorzugt von 0,07 bis 0,12.
-
In den erfindungsgemäßen Anzeigen des OCB-Typs sind die Moleküle in der Schicht des FK-Mediums eine ”bend”-Orientierung auf. Bei Anlegen einer elektrischen Spannung findet eine Umorientierung der FK-Moleküle mit den Moleküllängsachsen senkrecht zu den Elektrodenflächen statt.
-
Erfindungsgemäße FK-Medien zur Verwendung in Anzeigen des PSA-OCB-Typs sind vorzugsweise solche basierend auf Verbindungen mit positiver dielektrischer Anisotropie gemäß der zweiten bevorzugten Ausführungsform, und weisen vorzugsweise eine positive dielektrische Anisotropie Δε von +4 bis +17 bei 20°C und 1 kHz auf.
-
Die Doppelbrechung Δn in erfindungsgemäßen FK-Medien zur Verwendung in Anzeigen des PSA-OCB-Typs beträgt vorzugsweise von 0,14 bis 0,22, besonders bevorzugt von 0,16 bis 0,22.
-
Erfindungsgemäße FK-Medien, basierend auf Verbindungen mit positiver dielektrischer Anisotropie gemäß der zweiten bevorzugten Ausführungsform, zur Verwendung in Anzeigen des PSA-TN-, PSA-Posi-VA-, PSA-IPS- oder PSA-FFS-Typs haben vorzugsweise eine positive dielektrische Anisotropie von +2 bis +30, insbesondere von +3 bis +20 bei 20°C und 1 kHz.
-
Die Doppelbrechung Δn in erfindungsgemäßen FK-Medien zur Verwendung in Anzeigendes PSA-TN-, PSA-Posi-VA-, PSA-IPS- oder PSA-FFS-Typs beträgt vorzugsweise von 0,07 bis 0,15, insbesondere von 0,08 bis 0,13.
-
Die erfindungsgemäßen FK-Medien können auch weitere, dem Fachmann bekannte und in der Literatur beschriebene Zusätze oder Additive enthalten, bei beispielsweise Polymerisationsinitiatoren, Inhibitoren Stabilisatoren, oberflächenaktive Substanzen oder chirale Dotierstoffe. Diese können polymerisierbar oder unpolymerisierbar sein. Polymerisierbare Additive werden dementsprechend der polymerisierbaren Komponente oder Komponente A) zugerechnet. Unpolymerisierbare Additive werden dementsprechend der unpolymerisierbaren Komponente oder Komponente B) zugerechnet.
-
Die FK-Medien können beispielsweise einen oder mehrere chirale Dotierstoffe enthalten, vorzugsweise solche ausgewählt aus der Gruppe bestehend aus Verbindungen der nachfolgenden Tabelle B.
-
Ferner können den FK-Medien beispielsweise 0 bis 15 Gew.-% pleochroitische Farbstoffe zugesetzt werden, ferner Nanopartikel, Leitsalze, vorzugsweise Ethyl-dimethyldodecylammonium-4-hexoxybenzoat, Tetrabutylammoniumtetraphenylborat oder Komplexsalze von Kronenethern (vgl. z. B.
Haller et al., Mol. Cryst. Liq. Cryst. 24, 249–258 (1973)) zur Verbesserung der Leitfähigkeit, oder Substanzen zur Veränderung der dielektrischen Anisotropie, der Viskosität und/oder der Orientierung der nematischen Phasen. Derartige Substanzen sind z. B. in
DE-A 22 09 127 ,
22 40 864 ,
23 21 632 ,
23 38 281 ,
24 50 088 ,
26 37 430 und
28 53 728 beschrieben.
-
Die einzelnen Komponenten der bevorzugten Ausführungsformen a)–z) der erfindungsgemäßen FK-Medien sind entweder bekannt, oder ihre Herstellungsweisen sind für den einschlägigen Fachmann aus dem Stand der Technik ohne weiteres abzuleiten, da sie auf in der Literatur beschriebenen Standardverfahren basieren. Entsprechende Verbindungen der Formel CY werden beispielsweise in
EP-A-0 364 538 beschrieben. Entsprechende Verbindungen der Formel ZK werden beispielsweise in
DE-A-26 36 684 und
DE-A-33 21 373 beschrieben.
-
Die Herstellung der erfindungsgemäß verwendbaren FK-Medien erfolgt in an sich üblicher Weise, beispielsweise indem man eine oder mehrere der oben genannten Verbindungen mit einer oder mehreren polymerisierbaren Verbindungen wie oben definiert, und ggf. mit weiteren flüssigkrisallinen wie oben definiert, und ggf. mit weiteren flüssigkristallinen Verbindungen und/oder Additiven mischt. In der Regel wird die gewünschte Menge der in geringerer Menge verwendeten Komponenten in der den Hauptbestandteil ausmachenden Komponenten gelöst, zweckmäßig bei erhöhter Temperatur. Es ist auch möglich Lösungen der Komponenten in einem organischen Lösungsmittel, z. B. in Aceton, Chloroform oder Methanol, zu mischen und das Lösungsmittel nach Durchmischung wieder zu entfernen, beispielsweise durch Destillation. Das Verfahren zur Herstellung der erfindungsgemäßen FK-Medien ist ein weiterer Gegenstand der Erfindung.
-
Es versteht sich für den Fachmann von selbst, daß die erfindungsgemäßen FK-Medien auch Verbindungen enthalten können, worin beispielsweise H, N, O, Cl, F durch die entsprechenden Isotope ersetzt sind.
-
Der Aufbau der erfindungsgemäßen FK-Anzeigen entspricht der für PSA-Anzeigen üblichen Geometrie, wie er im eingangs zitierten Stand der Technik beschrieben ist. Es sind Geometrien ohne Protrusions bevorzugt, insbesondere diejenigen, bei denen darüber hinaus die Elektrode auf der Colour Filter-Seite unstrukturiert ist und lediglich die Elektrode auf der TFT-Seite Schlitze aufweist. Besonders geeignete und bevorzugte Elektrodenstrukturen für PSA-VA-Anzeigen sind beispielsweise in
US 2006/0066793 A1 beschrieben.
-
Die folgenden Beispiele erläutern die vorliegende Erfindung ohne sie zu begrenzen. Sie zeigen dem Fachmann jedoch bevorzugte Mischungskonzepte mit bevorzugt einzusetzenden Verbindungen und deren jeweiligen Konzentrationen sowie deren Kombinationen miteinander. Außerdem illustrieren die Beispiele, welche Eigenschaften und Eigenschftskombinationen zugänglich sind.
-
Folgende Abkürzungen werden verwendet:
(n, m, z: jeweils unabhängig voneinander 1, 2, 3, 4, 5 oder 6) Tabelle A
-
In einer bevorzugten Ausführungsform der vorliegenden Erfindung enthalten die erfindungsgemäßen FK-Medien eine oder mehrere Verbindungen ausgewählt aus der Gruppe bestehend aus Verbindungen der Tabelle A.
-
Tabelle B
-
In der Tabelle B werden mögliche chirale Dotierstoffe angegeben, die den erfindungsgemäßen FK-Medien zugesetzt werden können.
-
-
-
Vorzugsweise enthalten die FK-Medien 0 bis 10 Gew.-%, insbesondere 0,01 bis 5 Gew.-%, besonders bevorzugt 0,1 bis 3 Gew.-% an Dotierstoffen. Vorzugsweise enthalten die FK-Medien einen oder mehrere Dotierstoffe ausgewählt aus der Gruppe bestehend aus Verbindungen der Tabelle B.
-
Tabelle C
-
In der Tabelle C werden mögliche Stabilisatoren angegeben, die den erfindungsgemäßen FK-Medien zugesetzt werden können. (n bedeutet hier eine ganze Zahl von 1 bis 12, vorzugsweise 1, 2, 3, 4, 5, 6, 7 oder 8, endständige Methylgruppen sind nicht gezeigt).
-
-
-
-
-
-
Vorzugsweise enthalten die FK-Medien 0 bis 10 Gew.-%, insbesondere 1 ppm bis 5 Gew.-%, besonders bevorzugt 1 ppm bis 1 Gew.-% an Stabilisatoren. Vorzugsweise enthalten die FK-Medien einen oder mehrere Stabilisatoren ausgewählt aus der Gruppe bestehend aus Verbindungen der Tabelle C.
-
Tabelle D
-
In der Tabelle D sind Beispielverbindungen zusammengestellt, die in den FK-Medien gemäß der vorliegenden Erfindung vorzugsweise als reaktive mesogene Verbindungen verwendet werden können.
-
-
-
-
-
-
-
-
In einer bevorzugten Ausführungsform der vorliegenden Erfindung enthalten die mesogenen Medien eine oder mehrere Verbindungen ausgewählt aus der Gruppe der Verbindungen der Tabelle D.
-
Außerdem werden folgende Abkürzungen und Symbole verwendet:
- Vo
- Schwellenspannung, kapazitiv [V] bei 20°C,
- ne
- außerordentlicher Brechungsindex bei 20°C und 589 nm,
- no
- ordentlicher Brechungsindex bei 20°C und 589 nm,
- Δn
- optische Anisotropie bei 20°C und 589 nm,
- ε⊥
- dielektrische Permittivität senkrecht zum Direktor bei 20°C und 1 kHz,
- ε||
- dielektrische Permittivität parallel zum Direktor bei 20°C und 1 kHz,
- Δε
- dielektrische Anisotropie bei 20°C und 1 kHz,
- Kp., T(N, I)
- Klärpunkt [°C],
- γ1
- Rotationsviskosität bei 20°C [mPa·s],
- K1
- elastische Konstante, ”splay”-Deformation bei 20°C [pN],
- K2
- elastische Konstante, ”twist”-Deformation bei 20°C [pN],
- K3
- elastische Konstante, ”bend”-Deformation bei 20°C [pN].
-
Soweit nicht explizit anders vermerkt, sind in der vorliegenden Anmeldung alle Konzentrationen in Gewichtsprozent angegeben und beziehen sich auf die entsprechende Gesamtmischung, enthaltend alle festen oder flüssigkristallinen Komponenten, ohne Lösungsmittel.
-
Soweit nicht explizit anders vermerkt, sind in der vorliegenden Anmeldung alle angegebenen Werte für Temperaturen, wie z. B. der Schmelzpunkt T(C, N), der Übergang von der smektischen (S) zur nematischen (N) Phase T(S, N) und der Klärpunkt T(N, I), in Grad Celsius (°C) angegeben. Fp. bedeutet Schmelzpunkt, Kp. = Klärpunkt. Ferner bedeuten K kristalliner Zustand, N = nematische Phase, S = smektische Phase und I = isotrope Phase. Die Angaben zwischen diesen Symbolen stellen die Übergangstemperaturen dar.
-
Alle physikalischen Eigenschaften werden und wurden nach
"Merck Liquid Crystals, Physical Properties of Liquid Crystals", Status Nov. 1997, Merck KGaA, Deutschland bestimmt und gelten für eine Temperatur von 20°C und Δn wird bei 589 nm und Δε bei 1 kHz bestimmt, sofern nicht jeweils explizit anders angegeben.
-
Der Begriff „Schwellenspannung” bezieht sich für die vorliegende Erfindung auf die kapazitive Schwelle (V0), auch Freedericksz-Schwelle genannt, sofern nicht explizit anders angegeben. In den Beispielen kann auch, wie allgemein üblich, die optische Schwelle für 10% relativen Kontrast (V10) angegeben werden.
-
Die zur Messung der kapazitiven Schwellenspannung verwendete Anzeige besteht aus zwei planparallelen Glasträgerplatten im Abstand von 20 μm, welche auf den Innenseiten jeweils ein Elektrodenschicht sowie eine darüberliegende, ungeriebene Orientierungsschicht aus Polyimid aufweisen, die eine homöotrope Randorientierung der Flüssigkristallmoleküle bewirken.
-
Die zur Messung der Tiltwinkel verwendete Anzeige bzw. Testzelle besteht aus zwei planparallelen Glasträgerplatten im Abstand von 4 μm, welche auf den Innenseiten jeweils eine Elektrodenschicht sowie eine darüberliegende Orientierungsschicht aus Polyimid aufweisen, wobei die beiden Polyimidschichten antiparallel zueinander gerieben werden und eine homöotrope Randorientierung der Flüssigkristallmoleküle bewirken.
-
Die polymerisierbaren Verbindungen werden in der Anzeige bzw. Testzelle durch Bestrahlung mit UVA-Licht (üblicherweise 365 nm) einer definierten Intensität für eine vorgegebene Zeit polymerisiert, wobei gleichzeitig eine Spannung an die Anzeige angelegt wird (üblicherweise 10 V bis 30 V Wechselstrom, 1 kHz). In den Beispielen wird, falls nicht anders angegeben, eine Quecksilberdampflampe mit 28 mW/cm2 verwendet, die Intensität wird mit einem Standard-UV-Meter (Fabrikat Ushio UNI meter) gemessen, der mit einem Bandpassfilter bei 365 nm ausgerüstet ist.
-
Der Tiltwinkel wird per Drehkristall-Experiment (Autronic-Melchers TBA-105) bestimmt. Ein niedriger Wert (d. h. eine große Abweichung vom 90°-Winkel) entspricht dabei einem großen Tilt.
-
Der VHR-Wert wird wie folgt gemessen: Zur FK-Host-Mischung werden 0.3% einer polymerisierbaren monomeren Verbindung zugesetzt, und die dadurch entstandene Mischung in TN-VHR-Testzellen gefüllt (90° gerieben, Orientierungsschicht TN-Polyimid, Schichtdicke d ≈ 4 μm). Der HR-Wert wird nach 5 min bei 100°C vor und nach 2 h UV-Belastung (suntest) bei 1 V, 60 Hz, 64 μs pulse bestimmt (Messgerät: Autronic-Melchers VHRM-105).
-
Beispiel 1
-
2-Methylacrylsäure-4'-[4-(2-methyl-acryloyloxy)-but-1-inyl]-biphenyl-4-ylester (1)
-
1.1 4'-(4-Hydroxy-but-1-inyl)-biphenyl-4-ol
-
17,2 g (69,0 mmol) 4-Brom-4'-hydroxybiphenyl, 10,0 g (143 mmol) But-3-in-1-ol, 2,00 g (2,85 mmol) Bis(triphenylphosphin)palladium(II)chlorid, 0,7 g Kupfer(I)iodid und 25 ml (178 mmol) Diisopropylamin werden in 150 ml THF über Nacht unter Rückfluß erhitzt. Anschließend wird der Ansatz auf 200 ml MTB-Ether gegeben, mit 400 ml Wasser versetzt und mit Salzsäure angesäuert. Die wäßrige Phase wird abgetrennt und dreimal mit Essigester extrahiert. Die vereinigten org. Phasen werden i. Vak. eingeengt und der Rückstand mit Dichlormethan/Essigester (3:1) über Kieselgel filtriert. Kristallisation des Rohproduktes aus Toluol liefert 4'-(4-Hydroxy-but-1-inyl)-biphenyl-4-ol als farblosen Feststoff.
-
1.2 2-Methylacrylsäure-4'-[4-(2-methyl-acryloyloxy)-but-1-inyl]-biphenyl-4-ylester (1)
-
13,2 g (55,4 mmol) 4'-(4-Hydroxy-but-1-inyl)-biphenyl-4-ol werden in 100 ml Dichlormethan gelöst und nach Zugabe von 22 ml (159 mmol) Triethylamin unter Eiskühlung mit einer Lösung von 14,0 g (134 mmol) Acryloylchlorid in 10 ml Dichlormethan versetzt. Nach 1 h wird der Ansatz über bas. Aluminiumoxid und Kieselgel filtriert und eingeengt. Kristallisation aus Ethanol liefert den 2-Methylacrylsäure-4'-[4-(2-methyl-acryloyloxy)-but-1-inyl]-biphenyl-4-ylester 1 als farblose Kristalle vom Schmp. 86°C
1H-NMR (400 MHz, CDCl3):
δ = 1,98 ppm (mc, 3H, Me), 2.08 (mc, 3H, Me), 2.82 (t, J = 6,9 Hz, 2H, CH2CH2O-), 4.35 (t, J = 6,9 Hz, 2H, CH2CH2O-), 5.60 (quint., J = 1,6 Hz, 1H, C=CHAHB), 5.78 (quint., J = 1,6 Hz, 1H, C = CHAHB), 6.18 (mc, 1H, C=CHAHB), 6.37 (mc, 1H, C=CHAHB), 7,20 (AB-mc, darin: J = 8,7 Hz, 2H, Ar-H), 7,46 (AB-mc, darin: J = 8,5 Hz, 2H, Ar-H), 7,51 (AB-mc, darin: J = 8,5 Hz, 2H, Ar-H), 7,59 (AB-mc, darin: J = 8,7 Hz, 2H, Ar-H).
-
Beispiel 2
-
2-Methyl-acrylsäure-4-{4'-[4-(2-methyl-acryloyloxy)-but-1-inyl]-biphenyl-4-yl}-but-3-inylester (2)
-
Analog zu Beispiel 1 erhielt man aus 4,4'-Dibrombiphenyl den 2-Methylacrylsäure-4-{4'-[4-(2-methyl-acryloyloxy)-but-1-inyl]-biphenyl-4-yl}-but-3-inylester 2 als farblosen Feststoff vom Schmp. 86°C.
1H-NMR (400 MHz, CDCl3):
δ = 1,98 ppm (mc, 6H, Me), 2,82 (t, J = 6,9 Hz, 4H, -C≡CCH2-), 4,35 (t, J = 6,9 Hz, 4H, -CH2O-), 5,60 (quint., J = 1,6 Hz, 2H, -C=CHAHB-), 6,18 (mc, 2H, C=CHAHB), 7,48 (AB-mc, darin: J = 8,4 Hz, 8H, Ar-H).
-
Beispiel 3
-
2-Methyl-acrylsäure-4-{6-[4-(2-methyl-acryloyloxy)-but-1-inyl]-naphthalin-2-yl}-but-3-inylester (3)
-
Analog zu Beispiel 2 erhielt man aus 2,5-Dibromnaphthalin den 2-Methylacrylsäure-4-{6-[4-(2-methyl-acryloyloxy)-but-1-inyl]-naphthalin-2-yl}-but-3-inylester 3 als farblosen Feststoff vom Schmp. 93°C.
-
Beispiel 4
-
2-Methylacrylsäure-4'-[4-(2-methyl-acryloyloxy)-prop-1-inyl]-biphenyl-4-ylester (4)
-
Analog zu Beispiel 1 wird der 2-Methylacrylsäure-4'-[4-(2-methyl-acryloyloxy)-but-1-inyl]-biphenyl-4-ylester 4 hergestellt. Man erhält farblose Kristalle vom Schmp. 80°C.
1H-NMR (400 MHz, CDCl3):
δ = 2,00 ppm (mc, 3H, Me), 2.08 (mc, 3H, Me), 5,01 (s, 2H, CH2O-), 5.64 (quint., J = 1,5 Hz, 1H, C=CHAHB), 5.78 (quint., J = 1,5 Hz, 1H, C=CHAHB), 6.22 (mc, 1H, C=CHAHB), 6.37 (mc, 1H, C=CHAHB), 7,20 (AB-mc, darin: J = 8,7 Hz, 2H, Ar-H), 7,53 (s, 4H, Ar-H), 7,59 (AB-mc, darin: J = 8,7 Hz, 2H, Ar-H).
-
Beispiel 5
-
2-Methyl-acrylsäure-6-[3-(2-methyl-acryloyloxy)-prop-1-inyl]-naphthalin-2-ylester (5)
-
5.1 6-(3-Hydroxy-prop-1-inyl)-naphthalin-2-ol
-
9,00 g (40,3 mmol) 6-Bromnaphthalin-2-ol, 3,5 g (62,4 mmol) prop-2-in-1-ol, 1,00 g (1,43 mmol) Bis(triphenylphosphin)palladium(II)chlorid, 0,5 g (2,63 mmol) Kupfer(I)iodid und 10 ml Diisopropylamin werden in 60 ml DMF über Nacht bei 80°C rühren gelassen. Anschließend wird der Ansatz auf 200 ml Essigester gegeben, mit 400 ml Wasser versetzt und mit Salzsäure angesäuert. Die wäßrige Phase wird abgetrennt und dreimal mit Essigester extrahiert. Die vereinigte org. Phasen werden i. Vak. eingeengt und der Rückstand mit Toluol/Essigester (2:1) über Kieselgel filtriert. Kristallisation des Rohproduktes aus Toluol/Heptan liefert 6-(3-Hydroxy-prop-1-inyl)-naphthalin-2-ol als farblosen Feststoff.
1H-NMR (400 MHz, CDCl3):
δ = 1,67 ppm (t, J = 6,2 Hz, 1H, OH), 4,54 (d, J = 6,2 Hz, 2H, -CH2OH), 5,10 (s, 1H, OH), 7,12 (s, br., 2H, Ar-H), 7,43 (dd, J = 1,6 Hz, J = 8,5 Hz, 1H, Ar-H), 7,61 (d, J = 8,5 Hz, 1H, Ar-H), 7,71 (dd, J = 1,4 Hz, J = 8,4 Hz, 1H, Ar-H), 7,89 (s, 1H, Ar-H).
-
5.2 2-Methyl-acrylsäure-6-[3-(2-methyl-acryloyloxy)-prop-1-inyl]-naphthalin-2-ylester (5)
-
In Analogie zu Beispiel 1.2 liefert 6-(3-Hydroxy-prop-1-inyl)-naphthalin-2-ol den 2-Methyl-acrylsäure-6-[3-(2-methyl-acryloyloxy)-prop-1-inyl]-naphthalin-2-ylester 5 als farblose Kristalle vom Schmp. 60°C.
1H-NMR (400 MHz, CDCl3):
δ = 2,00 ppm (mc, 3H, Me), 2.10 (mc, 3H, Me), 5,03 (s, 2H, CH2O-), 5.65 (quint., J = 1,5 Hz, 1H, C=CHAHB), 5.80 (quint., J = 1,5 Hz, 1H, C=CHAHB), 6.23 (mc, 1H, C=CHAHB), 6.40 (mc, 1H, C=CHAHB), 7,28 (dd, J = 2,3 Hz, J = 8,9 Hz, 1H, Ar-H), 7,51 (dd, J = 1,6 Hz, J = 8,5 Hz, 1H, Ar-H), 7,58 (d, J = 2,2 Hz, 1H, Ar-H), 7,74 (d, J = 9,0 Hz, Ar-H), 7,82 (Ar-H), 8,00 (s, 1H, Ar-H).
-
Beispiel 6
-
2-Methyl-acrylsäure-4-[7-(2-methyl-acryloyloxy)-9,10-dihydrophenanthren-2-yl]-but-3-inylester (6)
-
6.1 7-Iod-9,10-dihydrophenanthren-2-ol
-
8,8 g (20,4 mmol) 2,7-Diiod-9,10-dihydrophenanthren werden in 250 ml THF gelöst und nach Zugabe von 7,0 ml (30,5 mmol) Triisopropylborat bei –70°C mit 16,5 ml einer 15proz. Lsg. von n-Butyllithium in Hexan versetzt. Nach 1 h wird der Ansatz mit 2 N Salzsäure hydrolysiert und auf Raumtemp. erwärmt. Die Lösung wird zweimal mit MTB-Ether extrahiert, über Natriumsulfat getrocknet, das Lösungsmittel i. Vak. entfernt das erhaltene Rohprodukt in 80 ml Toluol und 30 ml 2 N Natronlauge unter kräftigem Rühren suspendiert. Nach Zugabe von 8 ml 30proz. Wasserstoffperoxid wird der Ansatz unter Kühlung bei 30–40°C 30 min gerührt, mit 200 ml Wasser versetzt und mit 2 N Salzsäure angesäuert. Die wäßr. Phase wird abgetrennt und dreimal mit Essigester extrahiert. Die vereinigten org. Phasen werden mit verd. Ammoniumeisen(II)sulfatlsg. gewaschen und über Natriumsulfat getrocknet. Das Lösungsmittel wird. i. Vak. entfernt und der Rückstand mit Dichlormethan über Kieselgel filtriert. Man erhält 7-Iod-9,10-dihydro-phenanthren-2-ol als farblosen Feststoff.
1H-NMR (400 MHz, DMSO-d6):
δ = 2,72 ppm (mc, 4H, -CH2CH2-), 6.66 (6, J = 2.4 Hz, 1H, Ar-H), 6.70 (dd, J = 2.4 Hz, J = 8.5 Hz, 1H, Ar-H), 7.47 (d, J = 8.0 Hz, 1H, Ar-H), 7.60 (mc, 2H, Ar-H), 9.57 (s, br., 1H, OH).
-
6.2 7-(4-Hydroxybut-1-inyl)-9,10-dihydrophenanthren-2-ol
-
9,0 g (24,6 mmol) 7-Iod-9,10-dihydrophenanthren-2-ol werden in 100 ml THF vorgelegt, 1,0 g (1,43 mmol) Bis(triphenylphosphin)palladium(II)chlorid, 0,3 g (1,58 mmol) Kupfer(I)Iodid und 11 ml Diisopropylamin hinzugegeben und anschließend unter Kühlung bei max. 30°C eine Lösung von 3,0 g (42,8 mmol) 1-Butin in 20 ml THF zutropfen gelassen. Der Ansatz wird 1,5 h bei Raumtemp. rühren gelassen, auf Wasser gegeben und mit 2 N Salzsäure angesäuert. Die wäßr. Phase wird abgetrennt und dreimal mit Essigester extrahiert. Die vereinigten org. Phasen werden mit Wasser gewaschen, über Natriumsulfat getrocknet und das Lösungsmittel i. Vak. entfernt. Das Rohprodukt wird mit Dichlormethan/Essigester (3:1) über Kieselgel filtriert und aus Toluol umkristallisiert. Man erhält 7-(4-Hydroxy-but-1-ynyl)-9,10-dihydrophenanthren-2-ol als farblosen Feststoff.
-
6.3 2-Methyl-acrylsäure-4-[7-(2-methyl-acryloyloxy)-9,10-dihydrophenanthren-2-yl]-but-3-inylester (6)
-
In Analogie zu Beispiel 1.2 liefert 7-(4-Hydroxy-but-1-ynyl)-9,10-dihydrophenanthren-2-ol den 2-Methyl-acrylsäure-4-[7-(2-methyl-acryloyloxy)-9,10-dihydrophenanthren-2-yl]-but-3-inylester 6 als farblosen Feststoff vom Schmp. 72°C.
1H-NMR (400 MHz, CDCl3):
δ = 1,98 ppm (s, 3H, CH3) 2,07 (s, 3H, CH3), 2,77–2,88 (mc, 6H, -CH2CH2- und CH2CH2-O-), 4,35 (t, J = 6,9 Hz, 2H, -CH2CH2O-), 5,60 (mc, 1H, CH2=C(Me)-C(O)O-), 5,76 (mc, 1H, CH2=C(Me)-C(O)O-), 6,17 (mc, 1H, CH2=C(Me)-C(O)O-), 6,35 (mc, 1H, CH2=C(Me)-C(O)O-), 6.99–7,09 (m, 2H, Ar-H), 7,26–7,35 (m, 2H, Ar-H), 7,63 (d, J = 8.0 Hz, 1H, Ar-H), 7,72 (d, J = 8,4 Hz, 1H, Ar-H).
-
Beispiel 7
-
2-Methyl-acrylsäure-4-[7-(2-methyl-acryloyloxy)-9,10-dihydrophenanthren-2-yl]-prop-1-inylester (7)
-
Entsprechend dem Beispiel 6 wird der 2-Methyl-acrylsäure-4-[7-(2-methyl-acryloyloxy)-9,10-dihydrophenanthren-2-yl]-prop-1-inylester 7 hergestellt. Man erhält farblose Kristalle vom Schmp. 103°C.
-
Beispiel 8
-
2-Methyl-acrylsäure-7-[3-(2-methyl-acryloyloxy)-prop-1-inyl]-phenanthren-2-ylester (8)
-
8.1 2-Brom-7-hydroxyphenanthren
-
25,0 g (74,4 mmol) 2,7-Dibromphenanthren (CAS-Nr. 62325-30-8) und 24,0 ml (104 mmol) Triisopropylborat werden in 750 ml THF vorgelegt und bei –70°C tropfenweise mit 61 ml (97 mmol) einer 15proz. Lösung von n-Butyllithium in Hexan versetzt. Nach beendeter Zugabe wird noch 1 h rühren gelassen, der Ansatz mit 2 N Salzsäure hydrolysiert und die Kühlung entfernt. Nach Zugabe von MTB-Ether wird die wäßr. Phase entfernt und mit MTB-Ether extrahiert. Die vereinigten org. Phasen werden über Natriumsulfat getrocknet, eingeengt und der Rückstand aus Heptan umkristallisiert. Die so erhaltene Boronsäure wird in 350 ml Toluol und 150 ml 2 N Natronlauge unter kräftigem Rühren mit 30 ml 30proz. Wasserstoffperoxid so versetzt, daß die Temp. 45°C nicht übersteigt. Nach beendeter Zugabe wird der Ansatz noch 30 min rühren gelassen, auf 200 ml Wasser gegeben und mit 2 N Salzsäure angesäuert. Die wäßrige Phase wird abgetrennt und dreimal mit Essigester extrahiert. Die vereinigten org. Phasen werden mit verd. Ammoniumeisen(II)sulfatlösung und Wasser gewaschen und über Natriumsulfat getrocknet. Das Lösungsmittel wird i. Vak. entfernt, der Rückstand mit Dichlormethan über Kieselgel filtriert und aus Toluol umkristallisiert. Man erhält 2-Brom-7-hydroxyphenanthren als farblose Kristalle.
1H-NMR (400 MHz, DMSO-d6):
δ = 7,20–7,27 ppm (m, 2H), 7,73 (mc, 3H), 8,17 (d, J = 2,2 Hz, 1H), 8,63 (t, J = 9,2 Hz, 2H), 9,95 (s, br., austauschbar, OH).
-
8.2 7-(3-Hydroxyprop-1-inyl)-phenanthren-2-ol
-
37,2 g (133 mmol) 7-(3-Hydroxyprop-1-inyl)-phenanthren-2-ol und 10,0 g (178 mmol) 2-Propin-1-ol werden in 400 ml DMF und 40 ml Triethylamin vorgelegt und nach Zugabe von 7,0 g (10,0 mmol) Bis(triphenylphosphin)palladium(II)chlorid und 2,0 g (10,5 mmol) Kupfer(I)iodid über Nacht bei 80°C rühren gelassen. Anschließend wird der Ansatz auf Wasser gegeben, mit 2 N Salzsäure angesäuert und dreimal mit Essigester extrahiert. Die vereinigten org. Phasen werden mit ges. Natriumchloridlsg. gewaschen und über Natriumsulfat getrocknet. Das Lösungsmittel wird i. Vak. entfernt und der Rückstand durch Chromatographie mit Dichlormethan/Essigester (9:1) an Kieselgel gereinigt. Kristallisation aus Toluol liefert 7-(3-Hydroxyprop-1-inyl)-phenanthren-2-ol als farblose Kristalle.
1H-NMR (400 MHz, DMSO-d6):
δ = 4,36 ppm (s, 2H, CH2O), 5,39 (s, br., 1H, CH2OH), 7,20 (dd, J = 2,6 Hz, J = 8,9 Hz, 1H, Ar-H), 7,24 (d, J = 2,6 Hz, 1H, Ar-H), 7,60 (dd, J = 1,6 Hz, J = 8,6 Hz, 1H, Ar-H), 7,70 (AB-d, J = 9,1 Hz, 1H, Ar-H), 7,74 (AB-d, J = 9,1 Hz, 1H, Ar-H), 8,01 (d, J = 1,6 Hz, 1H, Ar-H), 8,62 (d, J = 5,8 Hz, 1H, Ar-H), 8,64 (d, J = 5,5 Hz, 1H, Ar-H) 10,0 (s, br., 1H, OH).
-
8.3 2-Methyl-acrylsäure-7-[3-(2-methyl-acryloyloxy)-prop-1-inyl]-phenanthren-2-ylester (8)
-
In Analogie zu Bsp. 1.2 liefert 7-(3-Hydroxyprop-1-inyl)-phenanthren-2-ol den 2-Methyl-acrylsäure-7-[3-(2-methyl-acryloyloxy)-prop-1-inyl]-phenanthren-2-ylester 8 als farblose Kristalle vom Schmp. 105°C.
1H-NMR (400 MHz, CDCl3):
δ = 2,01 ppm (mc, 3H, Me), 2,12 (mc, 3H, Me), 5,06 (s, 2H, CH2O-), 5.66 (quint., J = 1,6 Hz, 1H, C=CHAHB), 5.82 (quint., J = 1,6 Hz, 1H, C=CHAHB), 6,24 (mc, 1H, C=CHAHB), 6.43 (mc, 1H, C=CHAHB), 7,45 (dd, J = 2,5 Hz, J = 9,0 Hz, 1H, Ar-H), 7,66 (d, J = 2,4 Hz, 1H, Ar-H), 7,70 (mc, 3H, Ar-H), 8,02 (d, J = 1,5 Hz, 1H, Ar-H), 8,57 (d, J = 8,6 Hz, 1H, Ar-H), 8,65 (d, J = 9,1 Hz, 1H, Ar-H).
-
Beispiel 9
-
2-Methyl-acrylsäure-7-[4-(2-methyl-acryloyloxy)-but-1-inyl]-phenanthren-2-ylester (9)
-
In Analogie zu Beispiel 8 wird der 2-Methyl-acrylsäure-7-[4-(2-methyl-acryloyloxy)-but-1-inyl]-phenanthren-2-ylester 9 hergestellt. Man erhält farblose Kristalle vom Schmp. 91°C.
-
Beispiel 10
-
(2-Methacrylsäure-3-[3-(4-methoxy-phenyl)-2-oxo-2H-chromen-7-yl]-prop-2-inylester) (10)
-
10.1 Trifluormethansulfonsäure-3-(4-methoxy-phenyl)-2-oxo-2H-chromen-7-ylester
-
7,0 g (26,1 mmol) 7-Hydroxy-3-(4-methoxy-phenyl)-chromen-2-on werden in 200 ml Dichlormethan suspendiert und nach Zugabe von 5 ml (36 mmol) Triethylamin und 100 mg (0,819 mmol) DMAP unter Eiskühlung tropfenweise mit 5,3 ml (32,3 mmol) Trifluormethansulfonsäureanhydrid versetzt. Nach 2 h wird die Lösung mit Eiswasser gewaschen und das Lösungsmittel i. Vak. entfernt. Chromatographie des Rohproduktes mit Toluol/Essigester an Kieselgel liefert den Trifluormethansulfonsäure-3-(4-methoxy-phenyl)-2-oxo-2H-chromen-7-ylester als gelben Feststoff.
1H-NMR (400 MHz, CDCl3):
δ = 3,86 (s, 3H, OCH3), 6,99 (mc, 2H, Ar-H), 7,23 (dd, J = 2,4 Hz, J = 8,6 Hz, 1H, Ar-H), 7,30 (d, J = 2,4 Hz, 1H, Ar-H), 7,62 (d, J = 8,6 Hz, 1H, Ar-H), 7,67 (mc, 2H, Ar-H), 7,76 (s, 1H, -C=CH-).
-
10.2 7-(3-Hydroxyprop-1-inyl)-3-(4-methoxy-phenyl)-chromen-2-on
-
6,90 g (17,2 mmol) Trifluormethansulfonsäure-3-(4-methoxy-phenyl)-2-oxo-2H-chromen-7-ylester, 1,5 ml (25,4 mmol) Propin-1-ol, 12,0 g (36,8 mmol) Caesiumcarbonat, 150 mg (0,578 mmol) Bis(acetonitril)palladium(II)chlorid und 800 mg (1,68 mmol) 2-Dicyclohexylphosphino-2'-4'-6'-triisopropylbiphenyl werden in 100 ml Dioxan bei 60°C 3 h rühren gelassen, auf 400 ml Wasser gegeben und mit 2 N Salzsäure angesäuert. Die wäßrige Phase wird dreimal mit Essigester extrahiert und die vereinigten org. Phasen mit Wasser gewaschen und über Natriumsulfat getrocknet. Das Lösungsmittel wird i. Vak. entfernt und der Rückstand wird mit Toluol/Essigester (4:1) über Kieselgel filtriert. Kristallisation des Rohproduktes aus Toluol/Essigester (10:1) liefert 7-(3-Hydroxyprop-1-inyl)-3-(4-methoxy-phenyl)-chromen-2-on als gelbe Kristalle.
1H-NMR (400 MHz, CDCl3):
δ = 1,74 ppm (t, br., OH), 3,86 (s, 3H, OCH3), 4,45 (d, br., J = 4,0 Hz, 2H, CH2OH), 6,98 (mc, 2H, Ar-H), 7,33 (dd, J = 1,5 Hz, J = 8,0 Hz, 1H, Ar-H), 7,40 (s, br., 1H), 7,46 (d, J = 8,0 Hz, 1H, Ar-H), 7,68 (mc, 2H, Ar-H), 7,73 (s, 1H, -C=CH-).
-
10.3 2-Methacrylsäure-3-[3-(4-methoxy-phenyl)-2-oxo-2H-chromen-7-yl]-prop-2-inylester (10)
-
-
700 mg (2,29 mmol) 7-(3-Hydroxyprop-1-inyl)-3-(4-methoxy-phenyl)-chromen-2-on werden in 15 ml Dichlormethan suspendiert, mit 0,3 ml (3,7 mmol) Pyridin und 10 mg DMAP versetzt und unter Eiskühlung eine Lösung von 450 mg (2,9 mmol) Methacrylsäureanhydrid in 5 ml Dichlormethan zutropfen gelassen. Nach 30 min wird die Kühlung entfernt und der Ansatz 3,5 h bei Raumtemp. rühren gelassen. Das Lösungsmittel wird i. Vak entfernt, der Rückstand mit Dichlormethan/Essigester (95:5) über Kieselgel filtriert und das Rohprodukt aus Diethylether/Essigester (2:3) umkristallisiert. Man erhält 2-Methacrylsäure-3-[3-(4-methoxy-phenyl)-2-oxo-2H-chromen-7-yl]-prop-2-inylester als gelbe Kristalle vom Schmp. 143°C.
-
Beispiel 11
-
2-Methylacrylsäure-3-{4-[6-(2-methyl-acryloyloxy)-naphthalin-2-yl]-phenyl}-prop-2-inylester (11)
-
11.1 6-[4-(3-Hydroxy-prop-1-inyl)-phenyl]-naphthalin-2-ol
-
13,0 g (0,047 mol) Natriummetaborat-octahydrat werden in 100 ml Wasser vorgelegt und eine Lösung von 7,00 g (33,1 mmol) 3-(4-Bromphenyl)-prop-2-in-1-ol (CAS-Nr. 37614-58-7) und 9,00 g (33,3 mmol) 6-(4,4,5,5-Tetramethyl-[1,3,2]dioxaborolan-2-yl)-naphthalin-2-ol (CAS-Nr. 269410-21-1) in 200 ml THF hinzugefügt. Nach Zugabe von 1,00 g (1,40 mmol) Bis(triphenylphosphin)palladium(II)chlorid wird der Ansatz 5 h unter Rückfluß erhitzt und anschließend mit 100 ml Essigester versetzt und mit 2 M Salzsäure angesäuert. Die org. Phase wird abgetrennt, über Natriumsulfat getrocknet und eingeengt. Der Rückstand wird mit Toluol/Essigester (3:2) über Kieselgel filtriert und das Rohprodukt aus Toluol/Essigester umkristallisiert. Man erhält 6-[4-(3-Hydroxy-prop-1-inyl)-phenyl]-naphthalin-2-ol als farblosen Feststoff.
-
11.2 2-Methylacrylsäure-3-{4-[6-(2-methyl-acryloyloxy)-naphthalin-2-yl]-phenyl}-prop-2-inylester
-
In Analogie zu Beispiel 1 erhält man aus 6-[4-(3-Hydroxy-prop-1-inyl)-phenyl]-naphthalin-2-ol den 2-Methylacrylsäure-3-{4-[6-(2-methyl-acryloyloxy)-naphthalin-2-yl]-phenyl}-prop-2-inylester als farblose Kristalle.
Phasenverhalten Tg –23 K 110 SmE 110 SmA 159 I (Zers.).
-
Beispiel 12
-
In Analogie zu Beispiel 11 wird 2-Methylacrylsäure-6-{4-[4-(2-methyl-acryloyloxy)-but-1-inyl]-phenyl}-naphthalin-2-yl-ester (12) hergestellt
Phasenverhalten K 108 Sm (89) SmE (107) SmA 170 I (Zers.)
-
Beispiel 13
-
2-Methylacrylsäure-3-[2',3'-difluor-4-(2-methylacryloyloxy)-[1,1';4',1'']terphenyl-4''-yl]-prop-2-inylester (13)
-
13.1 4'-Benzyloxy-2,3-difluorbiphenyl-4-boronsäure
-
32,0 g (106 mmol) 4'-Benzyloxy-2,3-difluorbiphenyl (CAS-Nr. 305366-70-5) werden in 250 ml THF gelöst und bei –70°C tropfenweise mit 75,0 ml (119 mmol) einer 15% Lösung von n-Butyllithium in Hexan versetzt. Nach beendeter Zugabe wird noch 1 h gerührt und eine Lösung von 13,5 ml (119 mmol) Trimethylborat in 50 ml THF zutropfen gelassen. Nach 1 h wird der Ansatz auftauen gelassen, mit MTB-Ether versetzt und mit 2 M Salzsäure angesäuert. Die org. Phase wird abgetrennt, mit ges. Kochsalzlösung gewaschen und über Natriumsulfat getrocknet. Das Lösungsmittel wird im Vak. entfernt, der Rückstand in 200 ml Heptan/Toluol (1:1) unter Rühren auf 70°C erhitzt und nach dem Erkalten abgesaugt. Man erhält 4'-Benzyloxy-2,3-difluorbiphenyl-4-boronsäure als farblosen Feststoff, der ohne weitere Aufreinigung in der nächsten Stufe eingesetzt wird.
-
13.2 4'-Hydroxy-2,3-difluorbiphenyl-4-boronsäure
-
27,0 g (79,4 mmol) 4'-Benzyloxy-2,3-difluorbiphenyl-4-boronsäure werden in THF an Palladium-Aktivkohlekatalysator bis zum Stillstand hydriert. Der Katalysator wird abfiltriert und das Lösungsmittel i. Vak. entfernt. Das Rohprodukt wird mit 110 ml Toluol/Essigester (10:1) unter Rühren auf 80°C erhitzt und nach dem Erkalten abgesaugt. Man erhält 4'-Hydroxy-2,3-difluorbiphenyl-4-boronsäure als farblosen Feststoff, der ohne weitere Aufreinigung in der nächsten Stufe eingesetzt wird.
-
13.3 2',3'-Difluor-4''-(3-hydroxy-prop-1-inyl)-[1,1';4',1'']terphenyl-4-ol
-
In Analogie zu Beispiel 11.2 erhält man aus 4'-Hydroxy-2,3-difluorbiphenyl-4-boronsäure und 3-(4-Brom-phenyl)-prop-2-in-1-ol das 2',3'-Difluor-4''-(3-hydroxy-prop-1-inyl)-[1,1';4',1'']terphenyl-4-ol als farblosen Feststoff.
-
13.4 2-Methylacrylsäure-3-[2',3'-difluor-4-(2-methyl-acryloyloxy)-[1,1';4',1'']terphenyl-4''-yl]-prop-2-inylester
-
In Analogie zu Beispiel 1 erhält man aus 2',3'-Difluor-4''-(3-hydroxy-prop-1-inyl)-[1,1';4',1'']terphenyl-4-ol den 2-Methylacrylsäure-3-[2',3'-difluor-4-(2-methyl-acryloyloxy)-[1,1';4',1'']terphenyl-4''-yl]-prop-2-inylester als farblosen Feststoff.
Phasenverhalten K 122 N 133 I.
-
-
In Analogie zu Beispiel 13 wird der 2-Methylacrylsäure-4-(2',3'-difluor-4-(2-methyl-acryloyloxy)-[1,1';4',1'']terphenyl-4''-yl]-but-3-inylester (14) hergestellt.
Phasenverhalten K 112 N 150 (Zers.)
-
Mischungsbeispiel A
-
Die nematische FK-Mischung N1 wird wie folgt formuliert
| CCH-501 | 9,00% | Kp. | +70,0 |
| CCH-35 | 14,00% | Δn | 0,0825 |
| PCH-53 | 8,00% | Δε | –3,5 |
| CY-3-O4 | 14,00% | ε|| | 3,5 |
| CY-5-O4 | 13,00% | K3/K1 | 1,00 |
| CCY-3-O2 | 8,00% | γ1 | 141 |
| CCY-5-O2 | 8,00% | V0 | 2,06 |
| CCY-2-1 | 9,00% | | |
| CCY-3-1 | 9,00% | | |
| CPY-2-O2 | 8,00% | | |
-
Zur FK-Mischung N1 werden jeweils 0.3% einer polymerisierbaren monomeren Verbindung der unten gezeigten Formeln M1–M10 aus den Beispielen 1–10 zugesetzt und die dadurch entstandenen Mischungen (siehe Tabelle 1, 2) in VA-e/o-Testzellen gefüllt (antiparallel gerieben, Orientierungsschicht VA-Polyimid, Schichtdicke d ≈ 4 μm). Unter Anlegen einer Spannung von 24 V (Wechselstrom) werden die Zellen in der angegebenen Zeit mit UV-Licht der Intensität 50 mW/cm2 bestrahlt, dadurch erfolgt Polymerisation der monomeren Verbindung. Vor und nach der UV-Bestrahlung wird per Drehkristall-Experiment (Autronic-Melchers TBA-105) der Tiltwinkel bestimmt.
-
Zur Bestimmung der Polymerisationsgeschwindigkeit wird der Restgehalt an unpolymerisiertem RM (in Gew.-%) in den Testzellen nach verschiedenen Belichtungszeiten mit der HPLC-Methode gemessen. Dazu wird jede Mischung jeweils unter den angegebenen Bedingungen in der polymerisiert. Danach wird die Mischung mit MEK (Methylethylketon) aus der Testzelle gespült und vermessen.
-
Zu Vergleichszwecken werden die oben beschriebenen Versuche mit aus dem Stand der Technik (z. B.
WO 2009/030329 A1 ) bekannten strukturanalogen polymerisierbaren Verbindung V1–V10 durchgeführt.
-
-
-
-
-
Die vergleichenden Tiltwinkelergebnisse für die Monomere M1–M10 und V1–V10 sind in den Tabellen 1 und 2 aufgeführt. Die RM-Konzentrationen nach verschiedenen Belichtunsgzeiten sind in den Tabellen 3 und 4 zusammengefasst. Tabelle 1 (t = Belichtungszeit)
| | V1 | M1 | V4 | M4 | V7 | M7 | M2 |
| t/s | Tiltwinkel/° |
| 0 | 89,8 | 88,7 | 87,0 | 89,4 | 89,1 | 88,5 | 89,4 |
| 30 | 89,7 | 89,1 | 86,3 | 88,9 | 88,0 | 85,9 | 88,6 |
| 60 | 89,0 | 86,2 | 87,6 | 87,1 | 86,8 | 80,5 | 88,2 |
| 120 | 87,7 | 81,4 | 85,9 | 83,7 | 80,7 | 76,9 | 87,7 |
| 240 | 84,8 | 76,4 | 82,6 | 79,9 | 72,3 | 70,4 | 84,3 |
| 360 | 81,9 | 73,7 | - | 77,4 | 67,7 | 65,9 | 82,1 |
Tabelle 2 (t = Belichtungszeit)
| | V8 | M8 | V9 | M9 | V10 | M10 | M5 |
| t/s | Tiltwinkel/° |
| 0 | 88,9 | 89,5 | 88,9 | 88,4 | 88,7 | 89,7 | 88,8 |
| 30 | 88,8 | 87,6 | 89,3 | 87,4 | 90,0 | 86,6 | 89,0 |
| 60 | 85,9 | 83,0 | 86,9 | 82,0 | 89,6 | 84,3 | 87,0 |
| 120 | 81,6 | 76,6 | 82,1 | 77,9 | 88,1 | 80,7 | 82,8 |
| 240 | 77,2 | 71,0 | 78,7 | 73,8 | 85,2 | 77,6 | 74,7 |
| 360 | 75,6 | 68,5 | 76,0 | 72,8 | 82,5 | 75,2 | 66,4 |
Tabelle 3 (t = Belichtungszeit)
| | V1 | M1 | V4 | M4 | V7 | M7 | M5 |
| t/s | RM-Konzentration/% |
| 0 | 0,300 | 0,300 | 0,300 | 0,300 | 0,300 | 0,300 | 0,300 |
| 120 | 0,280 | 0,232 | 0,271 | 0,257 | 0,202 | 0,054 | 0,188 |
| 240 | 0,256 | 0,161 | 0,277 | 0,167 | 0,112 | 0,000 | 0,106 |
| 360 | 0,225 | 0,083 | 0,241 | 0,104 | 0,050 | 0,000 | 0,080 |
Tabelle 4 (t = Belichtungszeit)
| | V8 | M8 | V9 | M9 |
| t/s | RM-Konzentration/% |
| 0 | 0,300 | 0,300 | 0,300 | 0,300 |
| 120 | 0,170 | 0,110 | 0,179 | 0,081 |
| 240 | 0,100 | 0,026 | 0,099 | 0,011 |
| 360 | 0,070 | 0,018 | 0,065 | 0,000 |
-
Wie aus den Tabellen 1 und 2 ersichtlich ist, wird in PSA-Anzeigen mit den erfindungsgemäßen Monomeren M1–M10 schneller ein kleiner Tiltwinkel nach Polymerisation erreicht als in PSA-Anzeigen mit den entsprechenden strukturanalogen, gesättigten Monomeren V1–V10 aus dem Stand der Technik.
-
Wie aus den Tabellen 3 und 4 ersichtlich ist, wird in PSA-Anzeigen mit den erfindungsgemäßen Monomeren M1–M9 eine deutlich schnellere und vollständigere Polymerisation erzielt als in PSA-Anzeigen mit den entsprechenden strukturanalogen, gesättigten Monomeren V1–V9 aus dem Stand der Technik.
-
Mischungsbeispiel B
-
Unter Verwendung der Monomere 11–14 aus den Beispielen 11–14 und der nematischen FK-Mischung N1 aus Beispiel A werden Testzellen wie in Beispiel A beschrieben hergestellt und der Tiltwinkel sowie der Gehalt an Rest-RM bestimmt. Die Ergebnisse sind in den Tabellen 5 und 6 zusammengefasst. Tabelle 5 (t = Belichtungszeit)
| | Bsp. 11 | Bsp. 12 | Bsp. 13 | Bsp. 14 |
| t/s | Tiltwinkel/° |
| 0 | 87,8 | 87,6 | 89,0 | 89,0 |
| 30 | 82,8 | 83,6 | 87,7 | 86,3 |
| 60 | 77,5 | 79,6 | 83,6 | 81,4 |
| 120 | 73,5 | 74,8 | 81,2 | 78,6 |
| 240 | 71,2 | 70,9 | 78,6 | 76,3 |
| 360 | 66,4 | 69,4 | 77,0 | 76,3 |
Tabelle 6 (t = Belichtungszeit)
| | Bsp. 11 | Bsp. 12 | Bsp. 13 | Bsp. 14 |
| t/s | RM-Konzentration/% |
| 0 | N/A | N/A | 0,300 | 0,300 |
| 120 | | | 0,128 | 0,130 |
| 240 | | | 0,030 | 0,030 |
| 360 | | | 0,000 | 0,000 |
-
Wie aus den Tabellen 5 und 6 ersichtlich ist, wird mit den Monomeren aus Beispiel 11–14 eine schnelle und vollständige Polymerisation sowie ein kleiner Tiltwinkel nach Polymerisation erreicht.
-
ZITATE ENTHALTEN IN DER BESCHREIBUNG
-
Diese Liste der vom Anmelder aufgeführten Dokumente wurde automatisiert erzeugt und ist ausschließlich zur besseren Information des Lesers aufgenommen. Die Liste ist nicht Bestandteil der deutschen Patent- bzw. Gebrauchsmusteranmeldung. Das DPMA übernimmt keinerlei Haftung für etwaige Fehler oder Auslassungen.
-
Zitierte Patentliteratur
-
- JP 10-036847 A [0013]
- EP 1170626 A2 [0013]
- US 6861107 [0013]
- US 7169449 [0013, 0016]
- US 2004/0191428 A1 [0013]
- US 2006/0066793 A1 [0013, 0171]
- US 2006/0103804 A1 [0013]
- US 6177972 [0013]
- US 6369262 [0033]
- US 7060200 B1 [0081]
- US 2006/0172090 A1 [0081]
- EP 1378557 A1 [0120]
- EP 1306418 A1 [0120]
- DE 10224046 A1 [0120]
- DE 2209127 A [0167]
- DE 2240864 A [0167]
- DE 2321632 A [0167]
- DE 2338281 A [0167]
- DE 2450088 A [0167]
- DE 2637430 A [0167]
- DE 2853728 A [0167]
- EP 0364538 A [0168]
- DE 2636684 A [0168]
- DE 3321373 A [0168]
- WO 2009/030329 A1 [0220]
-
Zitierte Nicht-Patentliteratur
-
- S. H. Jung et al., Jpn. J. Appl. Phys., Band 43, No. 3, 2004, 1028 [0005]
- T.-J. Chen et al., Jpn. J. Appl. Phys. 45, 2006, 2702–2704 [0013]
- S. H. Kim, L.-C. Chien, Jpn. J. Appl. Phys. 43, 2004, 7643–7647 [0013]
- Appl. Phys. Lett. 1999, 75(21), 3264 [0013]
- Optics Express 2004, 12(7), 1221 [0013]
- Pure Appl. Chem. 73(5), 888 (2001) [0045]
- C. Tschierske, G. Pelzl, S. Diele, Angew. Chem. 2004, 116, 6340–6368 [0045]
- Pure Appl. Chem. 73(5), 888 (2001) [0045]
- C. Tschierske, G. Pelzl, S. Diele, Angew. Chem. 2004, 116, 6340–6368 [0045]
- Houben-Weyl, Methoden der organischen Chemie, Thieme-Verlag, Stuttgart [0100]
- E. Negishi, L. Anastasia, Chem. Rev. 2003, 103, 1979 [0102]
- Haller et al., Mol. Cryst. Liq. Cryst. 24, 249–258 (1973) [0167]
- ”Merck Liquid Crystals, Physical Properties of Liquid Crystals”, Status Nov. 1997, Merck KGaA, Deutschland [0184]